Профилактическое/терапевтическое средство против рака
Формула / Реферат
1. Профилактическое/терапевтическое средство против андроген-независимого рака простаты, содержащее производное метастина, которое представляет собой Ac-D-Tyr-D-Trp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение № 550) или Ac-D-Tyr-Hyp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение № 723) или соль указанных соединений.
2. Средство по п.1, где производное метастина представляет собой Ac-D-Tyr-Hyp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение № 723) или его соль.
3. Средство по п.1, где производное метастина представляет собой Ac-D-Tyr-D-Trp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение № 550) или его соль.
4. Применение производного метастина для получения профилактического/терапевтического средства против андроген-независимого рака простаты, где производное метастина представляет собой Ac-D-Tyr-D-Trp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение № 550) или Ac-D-Tyr-Hyp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение № 723) или соль указанных соединений.
5. Применение по п.4, где производное метастина представляет собой Ac-D-Tyr-D-Trp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение № 550) или его соль.
6. Применение по п.4, где производное метастина представляет собой Ac-D-Tyr-Hyp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение № 723) или его соль.
Текст
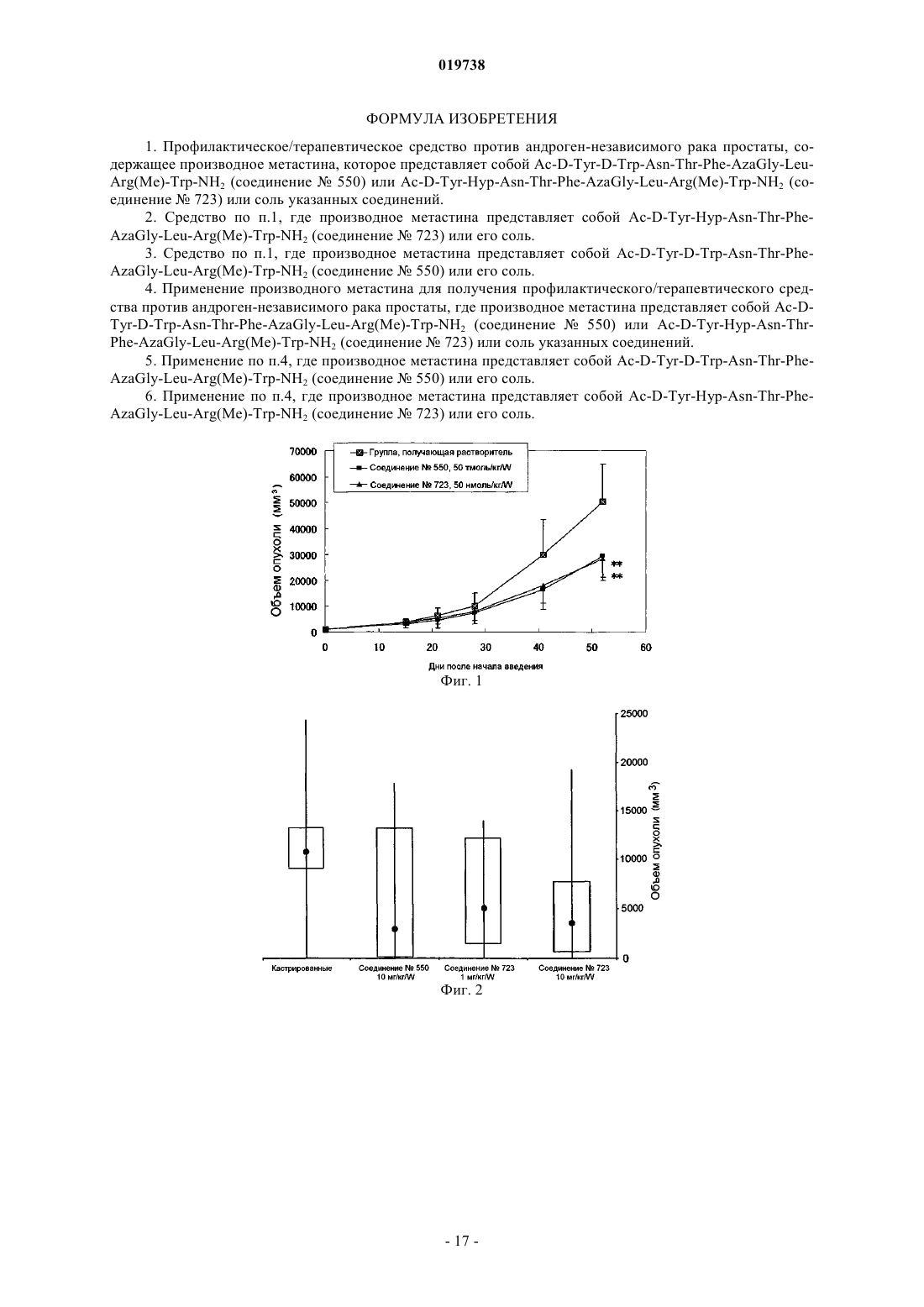
Изобретение предлагает профилактическое/терапевтическое средство против андрогеннезависимого рака простаты, содержащее производное метастина, которое представляет собой AcD-Tyr-D-Trp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 или Ac-D-Tyr-Hyp-Asn-Thr-Phe-AzaGlyLeu-Arg(Me)-Trp-NH2 или соль указанных соединений. Кроме того, изобретение относится к применению указанных производных метастатина для получения профилактического/ терапевтического средства против андроген-независимого рака простаты.(71)(73) Заявитель и патентовладелец: ТАКЕДА ФАРМАСЬЮТИКАЛ КОМПАНИ ЛИМИТЕД (JP) 019738 1. Область техники. Настоящее изобретение относится к профилактическому/терапевтическому средству против андроген-независимого рака простаты. 2. Уровень техники. Рак простаты встречается преимущественно у пожилых мужчин. Андрогены тесно связаны с развитием данного заболевания. Следовательно, рост опухоли можно ограничить путем ингибирования продукции или функции андрогенов. Способы лечения рака простаты путем ингибирования продукции или функции андрогенов включают хирургическую кастрацию путем орхиэктомии, химическую кастрацию агонистами GnRH, блокирование сигналов андрогенов антагонистами андрогенов и ингибирование продукции андрогенов эстрогенами. Известные терапевтические средства против рака простаты включают диэтилстильбэстрол, хлормадинона ацетат, ципротерона ацетат, гозерелина ацетат, бусерелина ацетат, лейпрорелина ацетат, ганиреликс, флутамид, бикалутамид, нилутамид, финастерид, дексаметазон, преднизолон, кетоконазол и ингибиторы лиазы (см., например, WO 2004/063221). В частности, хирургическая кастрация, такая как орхиэктомия, химическая кастрация агонистами GnRH и блокирование сигналов андрогенов антагонистами андрогенов обладают высокой эффективностью и низкими побочными эффектами и, следовательно, являются очень успешными способами лечения. В условиях лечения рака, если пациент приобретает толерантность к терапевтическому средству,эффективность лекарственного средства ослабевает, приводя, например, к рецидиву рака или метастазированию. Соответственно, существует потребность в разработке лекарственных средств для введения раковым пациентам, у которых развилась толерантность к терапевтическим средствам. Даже среди пациентов с раком простаты, которые получают терапию для подавления продукции или функции андрогенов, существуют случаи возобновления роста опухоли. Рак простаты, развитие которого возобновляется после подавления роста опухоли путем ингибирования продукции или функции андрогенов с использованием такого способа лечения, как орхиэктомия или гормональная терапия, называют андрогеннезависимый рак простаты (AIPC), гормоно-устойчивый рак простаты (HRPC) или устойчивый к кастрации рак простаты (CRPC). Возможные механизмы возобновления рака простаты включают: (1) стимуляцию роста опухоли в результате снижения уровней андрогенов, (2) уменьшение селективности в отношении лигандов вследствие изменений рецепторов андрогенов (см., например, "Novel mutations of androgen receptor: A possible mechanism of bicalutamide withdrawal syndrome", Т. Hara et al., Cancer Research 63,149-153 (2003, и (3) увеличение экспрессии ферментов, конвертирующих андрогены с низкой активностью (например, DHEA, DHEA-S), которые продуцируются надпочечниками и не подавляются путем хирургической кастрации, такой как орхиэктомия, кастрации агонистами GnRH или ингибирования продукции андрогенов под действием эстрогенов, в высокоактивные андрогены (например, тестостерон,дигидротестостерон) (см., например, "Increased expression of genes converting adrenal androgens to testosterone in androgen-independent prostate cancer", M. Stanbrough et al., Cancer Research 66, 2815-2825 (2006. Однако лекарственные средства, эффективные против андроген-независимого рака простаты, еще не обнаружены. Из вышесказанного видно, что существует потребность в лекарственных средствах, эффективных против андроген-независимого рака простаты в клинической ситуации. В данной области описаны производные метастина, которые представляют собой соединения, способные ингибировать раковые метастазы или рост раковой опухоли, и которые, в качестве ингибиторов раковых метастаз или ингибиторов роста раковой опухоли, являются эффективными средствами для профилактики или лечения рака (WO 2004/063221, WO 2006/001499 и WO 2007/072997). Сущность изобретения Следовательно, целью данного изобретения является разработка профилактического/терапевтического средства против андроген-независимого рака простаты, которое обладает высокой эффективностью как лекарственное средство. В процессе экстенсивных исследований, направленных на выявление подходящих профилактических/терапевтических средств против андроген-независимого рака простаты, авторы данного изобретения обнаружили, что производное метастатина, описанное ниже (называемое далее "соединение данного изобретения"), можно использовать для профилактики и лечения андроген-независимого рака простаты. Соответственно, настоящее изобретение предлагает:[1] Профилактическое/терапевтическое средство против андроген-независимого рака простаты, содержащее производное метастина, которое представляет собой Ac-D-Tyr-D-Trp-Asn-Thr-Phe-AzaGly-LeuArg(Me)-Trp-NH2 (соединение 550) или Ac-D-Tyr-Hyp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 723) или соль указанных соединений;[2] где производное метастина представляет собой Ac-D-Tyr-Hyp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)Trp-NH2 (соединение 723) или его соль;[3] средство по приведенному выше пункту [1], где производное метастина представляет собой AcD-Tyr-D-Trp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 550) или его соль;[4] применение производного метастина для получения профилактического/терапевтического сред-1 019738 ства против андроген-независимого рака простаты, где производное метастина представляет собой Ac-DTyr-D-Trp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 550) или Ac-D-Tyr-Hyp-Asn-ThrPhe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 723) или соль указанных соединений;[5] применение по приведенному выше пункту [4], где производное метастина представляет собой[6] применение по приведенному выше пункту [4], где производное метастина представляет собойAc-D-Tyr-Hyp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 723) или его соль. Профилактические/терапевтические средства против андроген-независимого рака простаты настоящего изобретения являются полезными, поскольку их можно вводить пациентам с андрогеннезависимым раком (в особенности, раком простаты, у которых возникают проблемы с клинической точки зрения). Кроме того, лекарственное средство настоящего изобретения представляет собой сочетание соединения данного изобретения и сопутствующего лекарственного средства и особенно подходит для применения в качестве профилактического/терапевтического средства против рака простаты и андрогеннезависимого рака простаты. Лекарственное средство данного изобретения также можно использовать для введения раковым пациентам с развившейся толерантностью (устойчивостью) к терапевтическим средствам. Краткое описание фигур На фиг. 1 приведен график, демонстрирующий противоопухолевое действие соединения 550 и соединения 723 в отношении андроген-независимой опухоли R3327-G. Вертикальные отрезки на графике обозначают среднее значение + стандартное отклонение или среднее значение - стандартное отклонение (группа, получающая растворитель, n=6; группа, получающая соединение 550, n=10; группа,получающая соединение 723, n=7).: р 0,01 (тест Даннетта, по сравнению с группой, получающей растворитель). На фиг. 2 показана противоопухолевая активность соединения 550 и соединения 723 в отношении модели, несущей опухоль DU145 (через 74 дня после трансплантации клеток DU145). На графике концы усов диаграммы вида "ящик с усами" указывают максимальное значение и минимальное значение,верхнее основание ящика обозначает третий квантиль, нижнее основание ящика обозначает первый квантиль, аобозначает среднее значение. Описание предпочтительных воплощений В качестве особенно предпочтительного производного метастина можно использовать соединение,имеющее следующий номер:Ac-D-Tyr-Hyp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 723). Производные метастина настоящего изобретения, сокращенно называемые ниже "соединение данного изобретения" или "соединение настоящего изобретения", можно синтезировать по способу, описанному в WO 2004/063221, WO 2006/001499 или WO 2007/072997. Если соединение настоящего изобретения присутствует в виде конфигурационного изомера, диастереомера, конформационного изомера или т.п., при желании каждый из них можно выделить с помощью описанных выше способов разделения и очистки. Кроме того, если соединение настоящего изобретения является рацемическим, его можно разделить на S-изомер и R-изомер с помощью традиционных способов разделения оптических изомеров. Если соединение настоящего изобретения существует в виде стерических изомеров, настоящее изобретение включает такие изомеры как по отдельности, так и в виде смеси. Кроме того, соединение настоящего изобретения может быть гидратированным или не гидратированным. Соединение настоящего изобретения также можно пометить изотопом (таким как 3 Н, 14 С, 35S) и др. Примеры солей соединения настоящего изобретения включают соль металла, соль аммония, соль органического основания, соль неорганической кислоты, соль органической кислоты, соль основной или кислой аминокислоты и т.п. Предпочтительные примеры солей металлов включают соли щелочных металлов, такие как соли натрия, соли калия и др.; соли щелочно-земельных металлов, такие как соли кальция, соли магния, соли бария и др.; соли алюминия; и т.п. Предпочтительные примеры солей органических оснований включают соли триметиламина, триэтиламина, пиридина, пиколина, 2,6-лутидина, этаноламина, диэтаноламина, триэтаноламина, циклогексиламина, дициклогексиламина, N,N'-дибензилэтилендиамина и др. Предпочтительные примеры солей неорганических кислот включают соли хлористо-водородной кислоты, бромисто-водородной кислоты, азотной кислоты, серной кислоты, фосфорной кислоты и др. Предпочтительные примеры солей органических кислот включают соли муравьиной кислоты, уксусной кислоты, трифторуксусной кислоты, фталевой кислоты, фумаровой кислоты, щавелевой кислоты, винной кислоты, малеиновой кислоты, лимонной кислоты, янтарной кислоты, яблочной кислоты, метансульфоновой кислоты, бензолсульфоновой кислоты, п-толуолсульфоновой кислоты и др. Предпочтительные примеры солей основных аминокислот включают соли аргинина, лизина, орнитина и др., и предпочтительные примеры солей кислых аминокислот включают соли аспарагиновой кислоты, глутаминовой ки-2 019738 слоты и др. Среди указанных солей предпочтительными являются фармацевтически приемлемые соли. Например, если соединение содержит кислую функциональную группу, предпочтительно использовать неорганические соли, такие как соли щелочных металлов (например, соли натрия, соли калия и др.), соли щелочно-земельных металлов (например, соли кальция, соли магния, соли бария и др.), соли аммония и т.п. Если соединение содержит основную функциональную группу, предпочтительно использовать соли с неорганическими кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота,азотная кислота, серная кислота, фосфорная кислота, и соли с органическими кислотами, такими как уксусная кислота, фталевая кислота, фумаровая кислота, щавелевая кислота, винная кислота, малеиновая кислота, лимонная кислота, янтарная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и др. Пролекарственная форма соединения настоящего изобретения представляет собой такое производное метастина, которое превращается в соединение настоящего изобретения в результате взаимодействия с ферментом, желудочной кислотой и др. в физиологических условиях in vivo. Другими словами, пролекарство настоящего изобретения представляет собой производное метастина, которое в результате ферментативного окисления, восстановления, гидролиза и др. превращается в соединение настоящего изобретения, или производное метастина, которое в результате гидролиза и др. под действием желудочной кислоты и др. превращается в производное метастина настоящего изобретения. Примеры пролекарственной формы соединения настоящего изобретения включают производные метастина, в которых аминогруппа, присутствующая в соединении настоящего изобретения, замещена ацилом, алкилом, фосфорной кислотой и др. (например, производные метастина, в которых аминогруппа,присутствующая в соединении настоящего изобретения, замещена таким заместителем, как эйкозаноил,аланил, пентиламинокарбонил (5-метил-2-оксо-1,3-диоксолен-4-ил)метоксикарбонил, тетрагидрофуранил, пирролидилметил, пивалоилоксиметил, трет-бутил и др.); производные метастина, в которых гидроксильная группа, присутствующая в соединении настоящего изобретения, замещена ацилом, алкилом,фосфорной кислотой, борной кислотой и др. (например, производные метастина, в которых гидроксильная группа, присутствующая в соединении настоящего изобретения, замещена ацетилом, пальмитоилом,пропаноилом, пивалоилом, сукцинилом, фумарилом, аланилом, диметиламинометилкарбонилом и др.); и производные метастина, в которых карбоксильная группа, присутствующая в соединении настоящего изобретения, замещена сложным эфиром, амидом и др. (например, производные метастина, в которых карбоксильная группа, присутствующая в соединении настоящего изобретения, превращена в этиловый эфир, фениловый эфир, карбоксиметиловый эфир, диметиламинометиловый эфир, пивалоилоксиметиловый эфир, этоксикарбонилоксиэтиловый эфир, фталидиловый эфир, (5-метил-2-оксо-1,3-диоксолен-4 ил)метиловый эфир, циклогексилоксикарбонилэтиловый эфир, метиламид и др.); и т.п. Указанные производные метастина можно получить из соединения настоящего изобретения с помощью известных способов. Пролекарственные формы соединения настоящего изобретения могут представлять собой соединения, которые превращаются в соединение настоящего изобретения в физиологических условиях, как описано в "Pharmaceutical Research и Development", Vol. 7, Drug Design, страницы 163-198, опубликованном Hirokawa Publishing Co. в 1990 г. Профилактическое/терапевтическое средство против андроген-независисмого рака простаты Соединение данного изобретения обладает высокой эффективностью, заключающейся в том, что,наряду со способностью подавлять рост опухоли у пациентов с андроген-независимым раком простаты,указанное соединение обладает низкой токсичностью и имеет незначительные побочные эффекты. Следовательно, соединение данного изобретения можно использовать в качестве профилактического/терапевтического средства против андроген-независимого рака простаты у млекопитающих (например, у людей, обезьян, шимпанзе, овец, собак, мышей и крыс; в особенности, у людей) . В настоящем изобретении термин "андроген-независимый рак простаты" относится к раку простаты, который заново приобретает способность расти после временного подавления способности опухоли к росту в результате ингибирования продукции или функции андрогенов с помощью некоторых видов терапии, таких как орхиэктомия или гормональная терапия. Термин "подавление способности опухоли к росту" относится к состоянию ракового пациента с раком простаты, получающего лечение, заключающееся в ингибировании продукции или функции андрогенов с помощью некоторых видов терапии, таких как орхиэктомия или гормональная терапия, где указанное состояние характеризуется подавлением роста опухоли или улучшением остеодинии и диагностируется по снижению концентрации простатоспецифического антигена (ПСА) в крови или с помощью такого метода, как компьютерная томография (КТ), магнитно-резонансная томография (МРТ) или ультразвуковая томография. Пониженная концентрация ПСА в крови здесь представляет собой концентрацию, составляющую, например, менее 5 нг/мл. В данном описании термин "заново приобретенная способность к росту" относится к состоянию ракового пациента с раком простаты, у которого временно подавлена способность опухоли к росту в результате лечения, включающего ингибирование продукции или функции андрогенов, где состояние характеризуется ростом опухоли, появлением или обострением остеодинии, или возникновением новых-3 019738 участков метастазирования, и диагностируется по стабильному повышению концентрации ПСА в крови,или с помощью такого метода, как КТ, МРТ или ультразвуковая томография. Термин "стабильное повышение концентрации ПСА в крови" относится к состоянию, при котором концентрация ПСА в крови составляет, например, 5 нг/мл или более, причем стабильное повышение концентрации ПСА в крови наблюдается в ряде анализов. В настоящем изобретении "андроген-независимый рак простаты" включает устойчивый к кастрации рак простаты. Профилактическое средство против андроген-независимого рака простаты настоящего изобретения также может замедлять развитие андроген-зависимого рака простаты в андрогеннезависимый рак простаты. Лекарственный препарат Если профилактическое/терапевтическое средство настоящего изобретения против андрогеннезависимого рака простаты вводят пациенту в виде лекарственного препарата, препарат может быть получен только из соединения данного изобретения, или он может быть получен путем смешивания соединения данного изобретения с сопутствующим лекарственным средством и фармацевтически приемлемым носителем. Содержание соединения данного изобретения в лекарственном средстве обычно составляет от 0,1 до 100% (мас./мас.). Если в состав лекарственного препарата входит сопутствующее лекарственное средство, его содержание обычно составляет от 0,1 до 100% (мас./мас.). Подходящие примеры лекарственной формы средства настоящего изобретения для перорального введения включают твердые препараты, такие как таблетки, капсулы, гранулы и порошки. Подходящие лекарственные формы для парентерального введения, такого как внутривенное, подкожное или внутримышечное, включают препараты для инъекций, свечи и подъязычные таблетки. Предпочтительные препараты для инъекций включают препараты с замедленным высвобождением,такие как микрокапсулы. Лекарственные формы для подъязычного, подкожного или внутримышечного введения включают подъязычные таблетки и препараты с замедленным высвобождением, такие как микрокапсулы. В качестве фармацевтически приемлемых носителей можно использовать разные виды органических и неорганических веществ-носителей, традиционно используемых в качестве ингредиентов лекарственных препаратов. Твердые препараты обычно содержат подходящие количества наполнителей, смазывающих средств, связующих средств, дезинтегрирующих средств и загустителей. Жидкие препараты обычно содержат подходящие количества растворителей, диспергирующих средств, средств, облегчающих растворение, суспендирующих средств, средств, обеспечивающих изотоничность, буферов и смягчающих средств. При необходимости можно использовать традиционные добавки, такие как консерванты, антиоксиданты, красители и подсластители. Примерами предпочтительных наполнителей являются лактоза, сахароза, D-маннит, крахмал, кристаллическая целлюлоза, легкая безводная кремневая кислота и др. Предпочтительные примеры смазывающих средств включают стеарат магния, стеарат кальция, тальк, коллоидный оксид кремния и др. Примеры предпочтительных связующих средств включают кристаллическую целлюлозу, сахарозу,D-маннит, декстрин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон и др. Примеры предпочтительных дезинтегрирующих средств включают крахмал, карбоксиметилцеллюлозу, карбоксиметилцеллюлозу кальция, кроскармелозу натрия, карбоксиметилкрахмал натрия и др. Примеры предпочтительных загустителей включают природную камедь, производные целлюлозы,полимеры на основе полиакриловой кислоты и др. Примеры предпочтительных растворителей включают воду для инъекций, спирт, пропиленгликоль,полиэтиленгликоль, макрогол, кунжутное масло, кукурузное масло, оливковое масло и др. Примеры предпочтительных диспергирующих средств включают твин 80, НСО 60, полиэтиленгликоль, карбоксиметилцеллюлозу, альгинат натрия и др. Примеры предпочтительных средств, облегчающих растворение, включают полиэтиленгликоль,пропиленгилколь, D-маннит, бензил бензоат, этанол, трисаминометан, холестерин, триэтаноламин, карбонат натрия, цитрат натрия и др. Примеры предпочтительных суспендирующих средств включают поверхностно-активные вещества,такие как стеарил триэтаноламин, лаурилсульфат натрия, лауриламинопропионат, лецитин, бензалкония хлорид, бензетония хлорид, глицерина моностеарат и др.; гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и др. Примеры предпочтительных средств, обеспечивающих изотоничность, включают глюкозу, Dсорбит, хлорид натрия, глицерин, D-маннит и др. Примеры предпочтительных буферов включают забуферивающие растворы фосфатов, ацетатов,карбонатов, цитратов и др. Примеры предпочтительных смягчающих средств включают бензиловый спирт и др. Примеры предпочтительных консервантов включают п-гидроксибензоаты, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроуксусную кислоту, сорбиновую кислоту и др.-4 019738 Примеры предпочтительных антиоксидантов включают сульфит, аскорбиновую кислоту и др. Лекарственный препарат можно получить с помощью традиционных способов. Ниже приведены примеры способов получения.(1) Таблетки, порошки, гранулы. Способ получения может включать добавление к соединению настоящего изобретения таких ингредиентов, как наполнители, дезинтегрирующие средства, связующие средства и смазывающие средства, с последующим формованием путем прессования. После прессования можно нанести покрытие, маскирующее вкус, улучшающее растворимость в кишечнике или увеличивающее продолжительность действия препарата.(2) Капсулы. Способ получения может включать заполнение капсул соединением данного изобретения, или заключение соединения данного изобретения в оболочку и формование с использованием основы для капсулы, где соединение данного изобретения находится в виде порошка, гранул или жидкости. Примеры исходных веществ для получения капсулы и основы для капсул включают желатин и гидроксипропилметилцеллюлозу.(3) Препараты для инъекций. Способ получения может включать добавление соединения данного изобретения в водный раствор для инъекций, например, вместе с диспергирующими средствами, консервантами и средствами, обеспечивающими изотоничность, или путем растворения, суспендирования или эмульгирования соединения данного изобретения в растительном масле (таком как оливковое масло, кунжутное масло, хлопковое масло, кукурузное масло), пропиленгликоле или т.п.(4) Свечи. Способ получения может включать добавление соединения данного изобретения в масляную или водную твердую, полутвердую или жидкую композицию. Примеры масляной основы, которую можно использовать в таких композициях, включают глицериды высших жирных кислот (например, масло какао, Witepsols), средние жирные кислоты (например, Migliols) и растительные масла (например, кунжутное масло, соевое масло, хлопковое масло). Примеры водных гелей включают природные камеди, производные целлюлозы, виниловые полимеры и полимеры акриловой кислоты. Способ введения Способ введения лекарственного препарата, полученного по способу, описанному в приведенном выше разделе "Лекарственный препарат", может варьировать в зависимости от используемого соединения настоящего изобретения, типа сопутствующего лекарственного средства, вида животного, которому вводят препарат, симптомов, лекарственной формы и числа введений препарата. Например, при пероральном введении суточная доза лекарственного препарата для взрослого пациента с андрогеннезависимым раком простаты, выраженная в виде эффективного количества соединения данного изобретения, обычно составляет примерно от 0,001 до 500 мг/кг массы тела, предпочтительно примерно от 0,1 до 40 мг/кг массы тела, и еще более предпочтительно примерно от 0,5 до 20 мг/кг массы тела. Если лекарственный препарат вводят парентерально, или соединение данного изобретения и сопутствующее лекарственное средство используют в сочетнии, суточная доза обычно бывает ниже указанного интервала. Например, при парентеральном введении суточная доза лекарственного препарата для взрослого пациента с андроген-независимым раком простаты, выраженная в виде эффективного количества соединения данного изобретения, предпочтительно составляет примерно от 0,01 до 4 мг/кг массы тела, и более предпочтительно примерно от 0,03 до 0,6 мг/кг массы тела. Однако фактически водимое количество соединения данного изобретения определяют с учетом таких факторов, как выбранное соединение, лекарственная форма, возраст, масса и пол пациента, тяжесть заболевания, способ введения, а также период и интервалы введения, причем лечащий врач может в любое время изменить указанное количество по собственному усмотрению. Способ введения вышеуказанного лекарственного препарата специально не ограничивается. Например, введение можно осуществлять пероральным или парентеральным способом. В данном описании термин "парентеральный" включает внутривенное, внутримышечное, подкожное, назальное, внутрикожное, глазное, внутрицеребральное, ректальное, вагинальное и внутрибрюшинное введение. Хотя период и интервал введения вышеуказанного лекарственного препарата варьирует в зависимости от условий и во всех случаях устанавливается лечащим врачем, можно использовать любой из ряда способов введения, включающих фракционированное введение, ежедневное введение, дробное введение, кратковременное введение высокой дозы и повторное введение. Например, в случае перорального введения желательно использовать разделенные дозы, которые вводят ежедневно в один или несколько приемов (предпочтительно два или три раза в день). Альтернативно можно использовать введение в виде препарата с замедленным высвобождением, или введение по каплям в течение продолжительного периода времени (например, один раз в месяц). Для профилактики и лечения андроген-независимого рака простаты также можно использовать, наряду с химиотерапией, включающей введение средства настоящего изобретения, способ лечения, отличный от химиотерапии, такой как хирургическое лечение, включающее орхиэктомию, термотерапию или-5 019738 лучевую терапию. Лекарственное средство настоящего изобретения Соединения настоящего изобретения применяются также для получения профилактического/терапевтического средства, то есть лекарственного средства, которое отличается тем, что оно содержит сочетание соединения данного изобретения и сопутствующего лекарственного средства. Сопутствующее лекарственное средство предпочтительно представляет собой одно или несколько средств, выбранных из группы, включающей гормональные средства (предпочтительно половые гормоны), алкилирующие средства, метаболические антагонисты, противораковые антибиотики, растительные алкалоиды,иммунотерапевтические средства, а также средства, которые ингибируют действие факторов роста клеток и рецепторов факторов роста клеток. Сопутствующее лекарственное средство предпочтительно представляет собой модулятор LHRH, такой как агонист рецептора LHRH (например, гозерелин ацетат,бусерелина ацетат, лейпрорелина ацетат) или антагонист рецептора LHRH (например, ганиреликс, цетрореликс, абареликс); наиболее предпочтительно агонист рецептора LHRH (предпочтительно лейпрорелина ацетат). Предпочтительные примеры лекарственного средства настоящего изобретения включают лекарственные средства для профилактики или лечения рака простаты или андроген-независимого рака простаты, которые содержат сопутствующее лекарственное средство, представляющее собой агонист рецептораLHRH или антагонист рецептора LHRH. Лекарственное средство настоящего изобретения представляет собой сочетание соединения данного изобретения, или его соль или пролекарственную форму, в качестве первого активного ингредиента и сопутствующее лекарственное средство (агонист рецептора LHRH или антагонист рецептора LHRH) в качестве второго активного ингредиента. Лекарственное средство настоящего изобретения можно получить путем объединения соединения данного изобретения и сопутствующего лекарственного средства с помощью традиционного способа. Соединение данного изобретения и сопутствующее лекарственное средство, используемые в качестве активных ингредиентов, могут быть включены в состав препарата по отдельности, или они могут быть смешаны с получением сочетанного лекарственного средства. Примеры лекарственных форм, подходящих для перорального введения средства настоящего изобретения, включают твердые препараты, такие как таблетки, капсулы, гранулы и порошки. Лекарственные формы, подходящие для парентерального введения, такого как внутривенное, подкожное или внутримышечное, включают препараты для инъекций, свечи и подъязычные таблетки. Предпочтительные препараты для инъекций включают препараты с замедленным высвобождением, такие как микрокапсулы. Лекарственные формы для подъязычного, подкожного или внутримышечного введения включают подъязычные таблетки и препараты с замедленным высвобождением, такие как микрокапсулы. В качестве способов получения можно использовать способы, включающие описанные выше в разделе "3. Получение лекарственного средства", а также аналогичные им способы. Способ введения пациенту лекарственного средства настоящего изобретения может варьировать в зависимости от типа используемого соединения настоящего изобретения, типа сопутствующего лекарственного средства, вида животного, которому вводят препарат, симптомов, лекарственной формы и числа введений препарата. Конкретные способы введения включают способы, описанные выше в разделе "4. Способ введения", а также аналогичные им способы. Лекарственное средство настоящего изобретения, которое представляет собой сочетание соединения данного изобретения, или его соль или пролекарственную форму, с сопутствующим лекарственным средством, можно использовать в качестве средства для профилактики и лечения андроген-независимого рака простаты. Лекарственное средство для введения раковым пациентам с толерантностью (устойчивостью) к терапевтическим средствам Средство настоящего изобретения для введения раковым пациентам, у которых развилась толерантность (устойчивость) к терапевтическим средствам, отличается тем, что оно содержит сочетание соединения данного изобретения и сопутствующего лекарственного средства. Терапевтическое средство, к которому у пациента развилась толерантность, специально не ограничивается и может представлять собой, например, одно или несколько средств, выбранных из группы,включающей гормональные средства (предпочтительно половые гормоны), алкилирующие средства, метаболические антагонисты, противораковые антитела, растительные алкалоиды, иммунотерапевтические средства, а также средства, которые ингибируют активность факторов роста клеток и рецепторов факторов роста клеток. В частности, терапевтическое средство может представлять собой модулятор LHRH,такой как агонист рецептора LHRH (например, гозерелина ацетат, бусерелина ацетат, лейпрорелина ацетат) или антагонист рецептора LHRH (например, ганиреликс, цетрореликс, абареликс); предпочтительно агонист рецептора LHRH (предпочтительно лейпрорелина ацетат). Рак представляет собой андроген-независимый рак простаты."Толерантность к терапевтическому средству" означает, что эффективность терапевтического средства уменьшается при его повторном применении, что приводит к необходимости увеличения дозы для достижения эффектов, наблюдаемых в начале применения указанного средства. Раковые пациенты, у-6 019738 которых развилась толерантность к терапевтическому средству, включают, например, пациентов, у которых наблюдается рецидив или метастазирование рака вследствие развития толерантности опухоли к терапевтическому средству, пациентов, у которых лечение рака включает только введение терапевтического средства, а также пациентов, у которых лечение рака включает как введение терапевтического средства, так и другие способы лечения (такие как хирургическое лечение, лучевая терапия, криотерапия). Если рак представляет собой андроген-независимый рак простаты, термин "раковые пациенты, у которых развилась толерантность к терапевтическому средству," относится к состоянию, при котором, после временного подавления способности опухоли к росту путем ингибировании продукции или функции андрогенов с помощью некоторых видов терапии, наблюдается рост опухоли или появление или ухудшение остеодинии, или появление новых участков метастазирования, что детектируют по стабильному повышению концентрации ПСА в крови или с помощью такого метода, как КТ, МРТ или ультразвуковая томография. Термин "стабильное повышение концентрации ПСА в крови" относится к состоянию, при котором концентрация ПСА в крови составляет, например, 5 нг/мл или более, причем стабильное повышение концентрации ПСА в крови наблюдается в ряде анализов. Примеры сопутствующих лекарственных средств включают одно или несколько средств, выбранных из группы, включающей гормональные средства (предпочтительно половые гормоны), алкилирующие средства, метаболические антагонисты, противораковые антибиотики, растительные алкалоиды,иммунотерапевтические средства, и средства, которые ингибируют действие факторов роста клеток и рецепторов факторов роста клеток. Сопутствующее лекарственное средство предпочтительно представляет собой модулятор LHRH, такой как агонист рецептора LHRH (например, гозерелина ацетат, бусерелина ацетат, лейпрорелина ацетат) или антагонист рецептора LHRH (например, ганиреликс, цетрореликс,абареликс); наиболее предпочтительно агонист рецептора LHRH. Лекарственные средства для введения раковым пациентам с развившейся толерантностью к терапевтическому средству можно получить путем объединения соединения данного изобретения и сопутствующего лекарственного средства с помощью традиционного способа. Соединение данного изобретения и сопутствующее лекарственное средство, используемые в качестве активных ингредиентов, могут быть включены в состав препарата по отдельности, или они могут быть смешаны с получением сочетанного лекарственного средства. Примеры лекарственных форм, подходящих для перорального введения средства настоящего изобретения, включают твердые препараты, такие как таблетки, капсулы, гранулы и порошки. Лекарственные формы, подходящие для парентерального введения, такого как внутривенное,подкожное или внутримышечное, включают препараты для инъекций, свечи и подъязычные таблетки. Лекарственные формы для подъязычного, подкожного или внутримышечного введения включают препараты с замедленным высвобождением, такие как подъязычные таблетки или микрокапсулы. В качестве способов получения можно использовать способы, включающие описанные выше в разделе "3. Получение лекарственного средства", а также аналогичные им способы. Способ введения пациенту лекарственного средства настоящего изобретения может варьировать в зависимости от используемого соединения настоящего изобретения, типа сопутствующего лекарственного средства, вида животного, которому вводят препарат, симптомов, лекарственной формы и числа введений препарата. Конкретные способы введения включают способы, описанные выше в разделе "Способ введения", а также аналогичные им способы. Лекарственное средство настоящего изобретения для введения раковым пациентам с развившейся толерантностью к терапевтическому средству представляет собой сочетание соединения данного изобретения и сопутствующего лекарственного средства, указанное лекарственное средство можно использовать для введения пациентам с андроген-независимым раком простаты. Примеры Настоящее изобретение далее иллюстрируется с помощью нижеследующих примеров способов получения и тестовых примеров. Следует понимать, что настоящее изобретение не ограничивается указанными примерами и что можно осуществить разные изменения и модификации без отступления от сущности и объема изобретения. В нижеследующих примерах термин "комнатная температура" обычно относится к температуре в интервале примерно от 10 до 35 С. Используемый ниже символ "%" обозначает мол./мол.% в случае выхода, об.% в случае растворителя, используемого для хроматографии, и мас.% в остальных случаях. В спектрах протонного ЯМР не указываются сигналы протонов ОН и NH, поскольку они являются широкими и не могут быть подтверждены. Сокращенные названия оснований и аминокислот, приведенные в описании и фигурах, соответствуют названиям, принятым комиссией IUPAC-IUB по биохимической номенклатуре, или названиям, традиционно используемым в данной области, примеры которых приведены ниже. Если не указано иначе,аминокислоты, которые могут иметь оптические изомеры, представлены в виде L-формы. Идентификационные номера последовательностей, присутствующих в списке последовательностей данного описания, обозначают нижеследующие последовательности, соответственно.[SEQ ID NO: 1] Обозначает аминокислотную последовательность человеческого метастина (Метастин).[SEQ ID NO: 2] Обозначает последовательность оснований ДНК, кодирующей человеческий метастин.[SEQ ID NO: 3] Обозначает аминокислотную последовательность предшественника мышиного метастина (А).[SEQ ID NO: 4] Обозначает последовательность оснований ДНК, кодирующей предшественник мышиного мета- 11019738 стина (А), которая соответствует последовательности оснований в плазмиде pCMV-mKiSS-1, присутствующей в трансформанте Escherichia coli DH10B/pCMV-mKiSS-1.[SEQ ID NO: 5] Обозначает аминокислотную последовательность предшественника мышиного метастина (В).[SEQ ID NO: 6] Обозначает последовательность оснований ДНК, кодирующей предшественник мышиного метастина (А), которая соответствует последовательности оснований в плазмиде pCR2.1-mKiSS-1.4A, присутствующей в трансформанте Escherichia coli DH5/pCR2.1-mKiSS-1.4A.[SEQ ID NO: 7] Обозначает аминокислотную последовательность предшественника крысиного метастина.[SEQ ID NO: 8] Обозначает последовательность оснований ДНК, кодирующей предшественник крысиного метастина. [SEQ ID NO: 9] Обозначает аминокислотную последовательность человеческого ОТ 7 Т 175 (рецептор метастина).[SEQ ID NO: 10] Обозначает последовательность оснований ДНК, кодирующей человеческий ОТ 7 Т 175 (рецептор метастина).[SEQ ID NO: 11] Обозначает аминокислотную последовательность крысиного ОТ 7 Т 175 (рецептор метастина).[SEQ ID NO: 12] Обозначает последовательность оснований ДНК, кодирующей крысиный ОТ 7 Т 175 (рецептор метастина).[SEQ ID NO: 13] Обозначает аминокислотную последовательность мышиного ОТ 7 Т 175 (рецептор метастина).[SEQ ID NO: 14] Обозначает последовательность оснований ДНК, кодирующей мышиный ОТ 7 Т 175 (рецептор метастина).[SEQ ID NO: 15] Обозначает аминокислотную последовательность человеческого метастина 15 (40-54).[SEQ ID NO: 16] Обозначает аминокислотную последовательность человеческого метастина 10 (45-54) (MS10).[SEQ ID NO: 17] Обозначает аминокислотную последовательность человеческого метастина 9 (46-54).[SEQ ID NO: 18] Обозначает аминокислотную последовательность человеческого метастина 8 (47-54).[SEQ ID NO: 19] Обозначает последовательность оснований ДНК, кодирующей человеческий метастин 15 (40-54).[SEQ ID NO: 20] Обозначает последовательность оснований ДНК, кодирующей человеческий метастин 10 (45-54).[SEQ ID NO: 21] Обозначает последовательность оснований ДНК, кодирующей человеческий метастин 9 (46-54).[SEQ ID NO: 22] Обозначает последовательность оснований ДНК, кодирующей человеческий метастин 8 (47-54). В настоящем изобретении Tyr-Asn-Trp-Asn-Ser-Phe-Gly-Leu-Arg-Phe-NH2 (SEQ ID NO: 16) представляет собой метастин 10, или MS10. В последующих примерах положение Tyr на N-конце MS10 обозначают как положение 1, а положение Phe на С-конце обозначают как положение 10. Обозначение соединения 79 (пример 1) как [Hph10]MS10 означает, что оно представляет собой пептид, в котором Phe на С-конце (положение 10) MS10 замещен Hph. Обозначение соединения 4 как des(1)-MS10 означает, что оно представляет собой пептид, в котором Tyr на N-конце (положение 1) удален. Обозначение соединения 53 как des(1-3)-Fmoc-MS10 означает, что оно представляет собой пептид, в котором Tyr-Asn-Trp на N-конце (положения 1-3) удалены, а аминогруппа Asn в положении 4 модифицирована Fmoc. Пример способа получения 1. Смесь, содержащую 10,0 мг соединения 550, 60,0 мг лактозы и 35,0 мг кукурузного крахмала,гранулируют путем пропускания через сито с размером меш 1 мм, используя 0,03 мл 10% водного раствора желатина (содержащего 3,0 мг желатина), затем сушат при 40 С и снова пропускают через сито. Полученные гранулы смешивают с 2,0 мг стеарата магния и прессуют. На полученные таблетки наносят сахарное покрытие, используя водную суспензию сахарозы, диоксида титана, талька и гуммиарабика. После нанесения покрытия таблетки полируют пчелиным воском и получают таблетки, покрытые оболочкой. Пример способа получения 2. Соединение 550 (10,0 мг) и стеарат магния (3,0 мг) гранулируют, используя 0,07 мл водного раствора растворимого крахмала (содержащего 7,0 мг растворимого крахмала). Затем гранулы сушат и смешивают с 70,0 мг лактозы и 50,0 мг кукурузного крахмала. Смесь прессуют, формируя таблетки. Пример способа получения 3. Соединение 550 (5,0 мг) и таблеточную соль (20,0 мг) растворяют в дистиллированной воде и добавляют воду до общего объема 2,0 мл. Раствор фильтруют и вносят в ампулы объемом 2 мл в стерильных условиях. После стерилизации ампулы запаивают, получая раствор для инъекции. Пример способа получения 4. Смесь, содержащую 10,0 мг соединения 723, 60,0 мг лактозы и 35,0 мг кукурузного крахмала,гранулируют путем пропускания через сито с размером меш 1 мм, используя 0,03 мл 10% водного раствора желатина (содержащего 3,0 мг желатина), затем сушат при 40 С и снова пропускают через сито. Полученные гранулы смешивают с 2,0 мг стеарата магния и прессуют. На полученные таблетки наносят сахарное покрытие, используя водную суспензию сахарозы, диоксида титана, талька и гуммиарабика. После нанесения покрытия таблетки полируют пчелиным воском и получают таблетки, покрытые оболочкой. Пример способа получения 5. Соединение 723 (10,0 мг) и стеарат магния (3,0 мг) гранулируют, используя 0,07 мл водного раствора растворимого крахмала (содержащего 7,0 мг растворимого крахмала). Затем гранулы сушат и смешивают с 70,0 мг лактозы и 50,0 мг кукурузного крахмала. Смесь прессуют, формируя таблетки. Пример способа получения 6. Соединение 723 (5,0 мг) и таблеточную соль (20,0 мг) растворяют в дистиллированной воде и добавляют воду до общего объема 2,0 мл. Раствор фильтруют и вносят в ампулы объемом 2 мл в сте- 13019738 рильных условиях. После стерилизации ампулы запаивают, получая раствор для инъекции. Пример способа получения 7. 409,80 г сополимера молочной кислоты и гликолевой кислоты (соотношение молочная кислота/гликолевая кислота: 75/25; средневзвешенная молекулярная масса (Mw): 7800; среднечисленная молекулярная масса (Mn): 3400; отношение Mw/Mn: 2,3) (Wako Pure Chemical Industries, Ltd.) растворяют в 757,76 г дихлорметана. Отвешивают 795,45 г раствора, смешивают с водным раствором, который получают путем растворения 35,10 г соединения 723 в 30,60 г дистиллированной воды, и эмульгируют,используя ROBOMIX (произведенный Tokushukika) с получением эмульсии вода/масло (скорость вращения: примерно 10000 об/мин, одна минута). Затем полученную эмульсию вода/масло охлаждают примерно до 10 С, выливают примерно в 50 л 0,1% (мас./мас.) водного раствора поливинилового спирта(EG-40, произведенного Nippon Synthetic Chemical Industry Co., Ltd), заранее нагретого примерно до 18 С, и эмульгируют, используя HOMOMIC LINE FLOW (произведенный Tokushukika) с получением эмульсии вода/масло/вода (скорость вращения турбины: примерно 7000 об/мин; скорость вращения циркуляционного насоса: примерно 2000 об/мин). Полученную эмульсию вода/масло/вода перемешивают в течение примерно 3 часов (процесс удаления воды), фильтруют через сито с размером отверстий 75 мкм,полученные микросферы непрерывно центрифугируют, используя центрифугу (H-600S, произведеннуюKokusan Co Ltd.) (скорость вращения: примерно 2000 об/мин; величина потока: примерно 550 мл/мин) и собирают. Собранные микросферы снова диспергируют в небольшом количестве дистиллированной воды, фильтруют через сито с размером отверстий 90 мкм, добавляют 42,436 г маннита и лиофилизируют с помощью лиофилизатора (DFM-05A-S, ULVAC), получая микрокапсульные порошки. Содержание соединения 723 в полученном микрокапсульном порошке составляет 8,2%. Пример способа получения 8. 1263,2 г сополимера молочной кислоты и гликолевой кислоты (соотношение молочная кислота/гликолевая кислота: 75/25; средневзвешенная молекулярная масса (Mw): 10300) (Wako Pure ChemicalIndustries, Ltd.) растворяют в 2184,0 г дихлорметана. Отвешивают 2525,6 г раствора и смешивают с раствором, который получают путем растворения 273,34 г соединения 550 в смеси 840,0 г уксусной кислоты и 280,0 г метанола, с получением масляной фазы. Затем масляную фазу охлаждают примерно до 10 С, выливают в 200 л 0,1% (мас./мас.) водного раствора поливинилового спирта (EG-40, произведенного Nippon Synthetic Chemical Industry Co., Ltd), заранее нагретого примерно до 18 С, и эмульгируют, используя HOMOMIC LINE FLOW (произведенный Tokushukika) с получением эмульсии масло/вода (скорость вращения турбины: примерно 7000 об/мин; скорость вращения циркуляционного насоса: примерно 2500 об/мин). Полученную эмульсию масло/вода перемешивают в течение примерно 3 ч (процесс удаления воды), фильтруют через сито с размером отверстий 75 мкм, полученные микросферы непрерывно центрифугируют, используя центрифугу (Н-1002, произведенную Kokusan Co Ltd.) (скорость вращения: примерно 2000 об/мин; величина потока: примерно 600 мл/мин) и собирают. Собранные микросферы снова диспергируют в небольшом количестве дистиллированной воды, фильтруют через сито с размером отверстий 90 мкм, добавляют 168,51 г маннита и лиофилизируют с помощью лиофилизатора (RL-402BS,произведенного Kyowa Vacuum Engineering, Ltd.), получая микрокапсульные порошки. Содержание соединения 550 в полученном микрокапсульном порошке составляет 16,7%. Тестовый пример 1. Клетки Dunning R3327-G, клеточную линию андроген-чувствительного рака простаты крысы, имплантируют орхиэктомизированным крысам Copenhagen и анализируют андроген-независимые противоопухолевые эффекты соединения 550 и соединения 723. Клетки R3327-G (7106) имплантируют подкожно орхиэктомизированным самцам крыс Copenhagen возрастом 10 недель. Через пятьдесят дней после имплантации крыс распределяют по группам в зависимости от объема опухоли и затем приписывают к группе, получающей соединениие 550 - 50 нмоль/кг/W, группе, получающей соединение 723 - 50 нмоль/кг/W, и группе, получающей раствор(каждая группа состоит из 10 животных). Дозу рассчитывают на основе средней массы животных в день начала введения препарата. Введение осуществляют путем подкожной имплантации в участок спины с помощью насоса ALZET. Диаметр опухоли измерят через 50, 65, 71, 78, 91 и 102 дней после имплантации клеток (через 0, 15, 21, 28, 41 и 52 дней после начала введения препарата). Объем опухоли (мм 3) рассчитывают по следующей формуле: большая осьмалая ось 2/2. Вследствие гибели и эвтаназии животных в процессе тестирования через 52 дня после начала введения препарата (через 102 дня после трансплантации) в группе, получающей раствор, остается только шесть животных, а в группе, получающей соединение 723, остается только семь животных. Результаты приведены на фиг. 1. Через 52 дня после начала введения 50 нмоль/кг/W как соединение 550, так и соединение 723 оказывают значительные противоопухолевые эффекты. Полученные результаты демонстрируют, что соединение 550 и соединение 723 можно использовать для лечения гормон-независимого рака простаты. Тестовый пример 2. Анализ ингибиторной активности пептидного производного метастина в отношении роста опухоли с использованием клеточной линии рака простаты человека VСaP.- 14019738 В случае соединение 723 анализируют ингибиторную активность в отношении андрогеннезависимого роста клеточной линии рака простаты человека VCaP (CRL-2876, Американская коллекция типовых культур). В данном анализе используют VCaP в состоянии трехмерной культуры (сфероидальной). А именно, клетки VCaP суспендируют в среде DMEM ( 11995, Invitrogen), содержащей 10% FCS( по каталогу 171012, Cell Culture Bioscience), с получением концентрации 1,5106 клеток/мл. Данную суспензию наносят пятнами на крышку чашки для культивирования тканей ( по каталогу 353003,FALCON) (20 мкл на каждое пятно) с получением культуры в висячей капле (3104 клеток в капле). Чтобы предотвратить высыхание, в чашку для культивирования добавляют 10 мл DPBS ( по каталогу 14190, Invitrogen). Культивирование проводят при 37 С, во влажной атмосфере, содержащей 5% СО 2, в течение 10 дней, после чего сфероиды, образовавшиеся в каждой капле, переносят последовательно с помощью микродозатора с отрезанным кончиком в 96-луночный планшет с U-образным дном, обеспечивающий низкую степень прилипания (MS-0096S, SUMITOMO BAKELITE), и культивирование продолжают в течение еще 3 дней. Через 3 дня среду заменяют на среду DMEM, не содержащую феноловый красный ( по каталогу 21063, Invitrogen), но содержащую 10% DCC-FCS (FCS, обработанная нагруженной декстраном угольной пылью; далее аналогично). Следует отметить, что вышеуказанную DCC-FCS получают следующим образом: 25 г угольной пыли (С-3345, SIGMA) и 250 мг декстрана Т 70 (17-0280-2, Pharmacia) добавляют к 500 мл DPBS и полученную смесь стерилизуют автоклавированием; 25 мл полученной суспензии добавляют к 500 мл FCS и смесь встряхивают в течение 30 минут при 45 С; затем смесь центрифугируют при 1700g в течение 30 мин при 4 С, полученный супернатант стерилизуют фильтрацией и получают DCC-FCS. Сразу после замены среды начинают обработку соединением 723. Вначале соединение 723 растворяют в среде DMEM, не содержащей фенолового красного, с получением 1 мМ раствора соединения 723. Раствор соединения 723 разбавляют средой DMEM, не содержащей феноловый красный,но содержащей 10% DCC-FCS, и вносят в культуральную среду каждые 12 ч в течение 8 последовательных дней так, чтобы конечная концентрация соединения 723 составляла 1 мкМ. В контрольной группе среду DMEM, не содержащую феноловый красный, разбавляют средой DMEM, не содержащей феноловый красный, но содержащей 10% DCC-FCS, таким же способом, как и в случае раствора соединения 723, и затем ее вносят в культуральную среду. Количественный анализ роста клеток через 9 дней после начала обработки соединением 723 проводят путем измерения химической люминесценции, вызванной клеточным АТР, с использованием люминесцентного анализа жизнеспособности клеток CellTiter-Glo (Promega). Для измерения интенсивности люминесценции используют Wallac 1420 ARVO MX/Light (Parkin Elmer). Результаты показаны ниже.: p=0,00653 (n=18, критерий Стьюдента). Как видно из приведенной выше таблицы, соединение 723 значительно уменьшает андрогеннезависимый рост клеток рака простаты человека. Тестовый пример 3. Анализ ингибиторной активности пептидного производного метастина в отношении роста опухоли с использованием клеточной линии рака простаты человека 22Rv1. В случае соединение 723 анализируют ингибиторную активность в отношении роста клеточной линии андроген-независимого рака простаты человека 22Rv1 (CRL-2505, Американская коллекция типовых культур). В данном анализе используют VCaP в состоянии трехмерной культуры (сфероидальной). А именно, клетки 22Rv1 суспендируют в среде RPMI1640 ( по каталогу 22400, Invitrogen), содержащей 10% FCS ( по каталогу 171012, Cell Culture Bioscience), с получением концентрации 1,5106 клеток/мл. Данную суспензию наносят пятнами на крышку чашки для культивирования тканей ( по каталогу 353003, FALCON) (20 мкл на каждое пятно) с получением культуры в висячей капле (3103 клеток в капле). Чтобы предотвратить высыхание, в чашку для культивирования добавляют 10 мл DPBS ( по каталогу 14190, Invitrogen). Культивирование проводят при 37 С, во влажной атмосфере, содержащей 5% СО 2, в течение 10 дней, после чего сфероиды, образовавшиеся в каждой капле, переносят последовательно с помощью микродозатора с отрезанным кончиком в 96-луночный планшет с U-образным дном, обеспечивающий низкую степень прилипания (MS-0096S, SUMITOMO BAKELITE), и культивирование продолжают в течение еще 3 дней. Через 3 дня среду заменяют на среду RPMI1640, не содержащую феноловый красный ( по каталогу 11835, Invitrogen), но содержащую 10% DCC-FCS (FCS, обработанная нагруженной декстраном угольной пылью). Следует отметить, что вышеуказанную DCC-FCS получают следующим образом: 25 г угольной пыли (С-3345, SIGMA) и 250 мг декстрана Т 70 (17-0280-2, Pharmacia) добавляют к 500 мл DPBS и полученную смесь стерилизуют автоклавированием; 25 мл полученной суспензии добавляют к 500 мл FCS и смесь встряхивают в течение 30 мин при 45 С; затем смесь центрифугируют при 1700g в течение 30 мин при 4 С, полученный супернатант стерилизуют фильтрацией и получают DCC-FCS.- 15019738 Сразу после замены среды начинают обработку соединением 723. Вначале соединение 723 растворяют в среде DMEM, не содержащей фенолового красного ( по каталогу 21063, Invitrogen), с получением 1 мМ раствора соединения 723. Раствор соединения 723 разбавляют средой RPMI1640,не содержащей феноловый красный, но содержащей 10% DCC-FCS, и вносят в культуральную среду каждые 12 ч в течение 8 последовательных дней так, чтобы конечная концентрация соединения 723 составляла 1 мкМ. В контрольной группе среду DMEM, не содержащую феноловый красный, разбавляют средой DMEM, не содержащей феноловый красный, но содержащей 10% DCC-FCS, таким же способом,как и в случае раствора соединения 723, и затем ее вносят в культуральную среду. Количественный анализ роста клеток через 9 дней после начала обработки соединением 723 проводят путем измерения химической люминесценции, вызванной клеточным АТР, с использованием люминесцентного анализа жизнеспособности клеток CellTiter-Glo (Promega). Для измерения интенсивности люминесценции используют Wallac 1420 ARVO MX/Light (Parkin Elmer). Результаты показаны ниже.: р=0,00003 (n=18, критерий Стьюдента). Как видно из приведенной выше таблицы, соединение 723 значительно уменьшает рост клеток андроген-независимого рака простаты человека в отсутствие андрогенов. Тестовый пример 4. Анализ противоопухолевой активности пептидного производного метастина у моделей самцов крыс, несущих опухоль DU145. Анализируют противоопухолевую активность соединения 550 и соединения 723 в отношении моделей самцов крыс, несущих опухоль DU145. А именно, 100 мкл суспензии DU145 (андрогеннезависимая клеточная линия, клеточная линия с высокой экспрессией GPR54, АТСС), 1106 клеток/100 мкл, смешивают со 100 мкл матрикса базальной мембраны: Matrigel (торговое наименование, BD Biosciences), и полученную смесь трансплантируют усыпленным эфиром самцам крыс F344/NJcl-rnu/rnu возрастом 7 недель под кожу в брюшной области (CLEA Japan, Inc.). Через 10 дней после трансплантации крыс, у которых объем подкожной опухоли достигает 200 мм 3, делят на 4 группы (группы A-D, по 10 крыс в каждой группе). В каждой группе крыс усыпляют эфиром и затем подкожно вводят следующие суспензии: группа А: примерно 2 мл суспензии микрокапсульного порошка, полученного в примере способа получения 8, в диспергирующей среде (1 мл диспергирующей среды содержит 10 мг микрокапсульного порошка) (доза соединения 550: 10 мг/кг массы тела); группа В: примерно 0,2 мл суспензии микрокапсульного порошка, полученного в примере способа получения 7, в диспергирующей среде (1 мл диспергирующей среды содержит 1 мг микрокапсульного порошка) (доза соединения 723: 1 мг/кг массы тела); и группа С: примерно 2 мл суспензии микрокапсульного порошка, полученного в примере способа получения 7, в диспергирующей среде (1 мл диспергирующей среды содержит 1 мг микрокапсульного порошка) (доза соединения 723: 10 мг/кг массы тела). В данном контексте диспергирующая среда представляет собой суспензию, полученную путем суспендирования D-маннита, кармелозы натрия и полисорбата 80 в воде для инъекций, где 1 мл суспензии содержит 50 мг D-маннита, 5 мг кармелозы натрия и 1 мг полисорбата 80. Крыс группы D подвергают хирургической кастрации и используют в качестве группы отрицательного контроля. Крыс из групп A-D выращивают в обычных условиях. Через 74 дня после трансплантации клеток DU145 измеряют объем опухоли (длинный диаметркороткий диаметркороткий диаметр/2). Кроме того, через 30 и 60 дней после трансплантации клеток DU145 крысам групп А-С вводят соединение 550 или соединение 723 с помощью описанного выше способа. Результаты показаны на фиг. 2. Данный анализ однозначно показывает, что противоопухолевые эффекты соединения 550 и соединения 723 превышают эффекты хирургической кастрации. Промышленная применимость Профилактические/терапевтические средства против андроген-независимого рака (в особенности,рака простаты) настоящего изобретения являются полезными, поскольку их можно вводить пациентам с андроген-независимым раком (в особенности, раком простаты), которые несут проблемы с клинической точки зрения. Кроме того, лекарственное средство настоящего изобретения представляет собой сочетание соединения данного изобретения и сопутствующего лекарственного средства и особенно подходит для применения в качестве профилактического/терапевтического средства против рака простаты и андроген-независимого рака простаты. Лекарственное средство данного изобретения также можно использовать для введения раковым пациентам с развившейся толерантностью к терапевтическим средствам. Характеристика последовательностей- 16019738 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Профилактическое/терапевтическое средство против андроген-независимого рака простаты, содержащее производное метастина, которое представляет собой Ac-D-Tyr-D-Trp-Asn-Thr-Phe-AzaGly-LeuArg(Me)-Trp-NH2 (соединение 550) или Ac-D-Tyr-Hyp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 723) или соль указанных соединений. 2. Средство по п.1, где производное метастина представляет собой Ac-D-Tyr-Hyp-Asn-Thr-PheAzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 723) или его соль. 3. Средство по п.1, где производное метастина представляет собой Ac-D-Tyr-D-Trp-Asn-Thr-PheAzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 550) или его соль. 4. Применение производного метастина для получения профилактического/терапевтического средства против андроген-независимого рака простаты, где производное метастина представляет собой Ac-DTyr-D-Trp-Asn-Thr-Phe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 550) или Ac-D-Tyr-Hyp-Asn-ThrPhe-AzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 723) или соль указанных соединений. 5. Применение по п.4, где производное метастина представляет собой Ac-D-Tyr-D-Trp-Asn-Thr-PheAzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 550) или его соль. 6. Применение по п.4, где производное метастина представляет собой Ac-D-Tyr-Hyp-Asn-Thr-PheAzaGly-Leu-Arg(Me)-Trp-NH2 (соединение 723) или его соль.
МПК / Метки
МПК: A61K 38/00, A61P 35/00, A61K 9/00, A61K 38/08, A61K 38/17
Код ссылки
<a href="https://eas.patents.su/30-19738-profilakticheskoe-terapevticheskoe-sredstvo-protiv-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Профилактическое/терапевтическое средство против рака</a>
Предыдущий патент: Способ и устройство для производства синтез-газа из газообразных углеводородов
Следующий патент: Фармацевтическая композиция и способ увеличения роста волос
Случайный патент: Способ изготовления анода для катодной защиты