Макроциклические ингибиторы интегразы
Номер патента: 19558
Опубликовано: 30.04.2014
Авторы: Бонфанти Жан-Франсуа, Тюринг Йоханнес Вильхельмус Й., Фортэн Жером Мишель Клод
Формула / Реферат
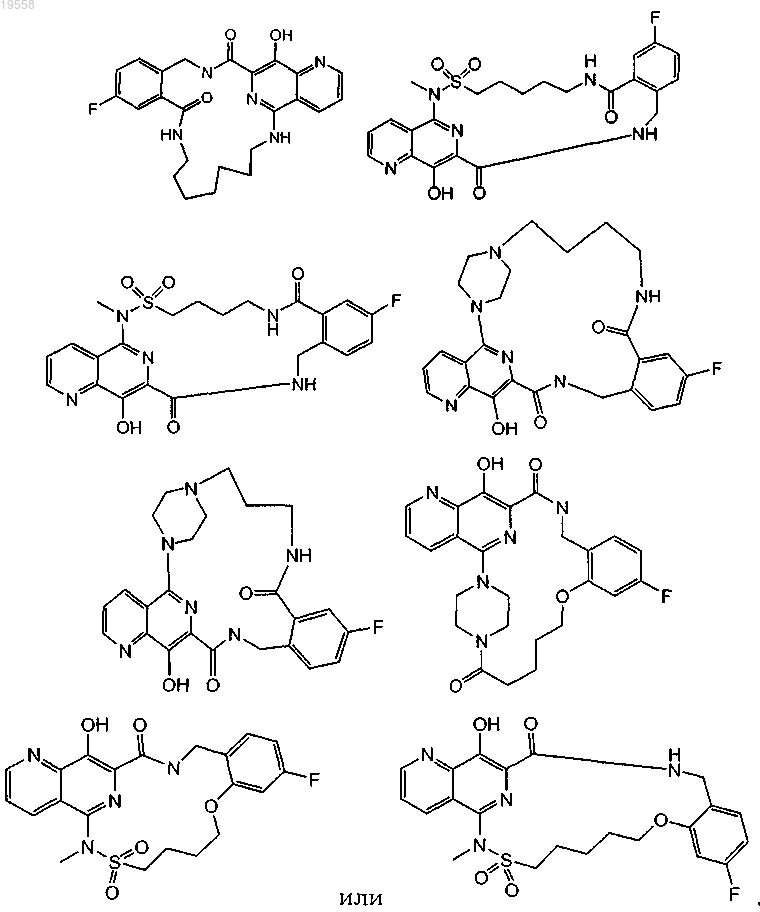
1. Соединение, имеющее формулу (I)
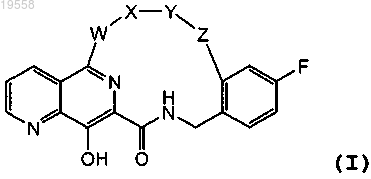
и его фармацевтически приемлемые соли, где
W представляет собой -NH-, -N(CH3)- или пиперазин-1,4-диил,
X представляет собой связь, -С(=O)- или -S(=O)2-,
Y представляет собой С3-7алкилен,
Z представляет собой -NH-C(=O)- или -О-.
2. Соединение по п.1, где W представляет собой -NH- или -N(CH3)-.
3. Соединение по п.1 или 2, где X представляет собой связь или -S(=O)2-.
4. Соединение по любому из пп.1-3, где Y представляет собой С4-5алкилен.
5. Соединение по п.1, где X представляет собой -С(=O)- и Y представляет собой С3-4алкилен, когда W представляет собой пиперазин-1,4-диил.
6. Соединение по любому из пп.1-5, где Z представляет собой -О-.
7. Соединение по любому из пп.1-5, где Z представляет собой -NH-C(=O)-, в частности, когда азот группы
-NH-C(=O)- связан с Y.
8. Соединение по любому из пп.1-7, где длина линкера -W-X-Y-Z- составляет 8 или 9 атомов.
9. Соединение по п.1, где -W-X-Y-Z- выбран из
---NH-С5-7алкилен-NH-C(=О)---,
---N(CH3)-S(=О)2-С4-5алкилен-NH-С(=О)---,
---N(CH3)-S(=О)2-С4-5алкилен-О---,
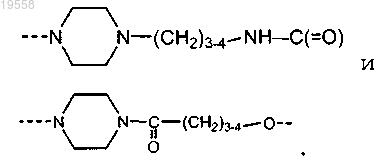
10. Соединение по п.1 и его фармацевтически приемлемые соли, имеющие формулу
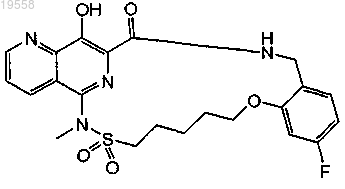
11. Соединение по п.1 и его фармацевтически приемлемые соли, имеющие формулу

12. Соединение по п.1 или его фармацевтически приемлемая соль, имеющее формулу
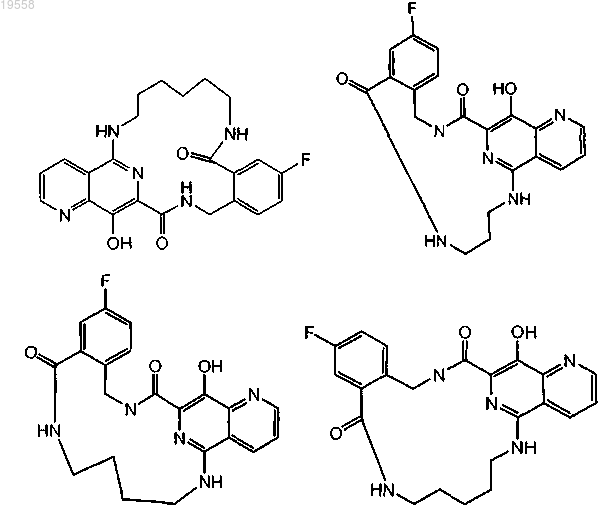
13. Применение соединения по любому из пп.1-12 в качестве ингибитора репликации ВИЧ.
Текст
(BE), Бонфанти Жан-Франсуа, Фортэн Жером Мишель Клод (FR) Медведев В.Н. (RU)-O-, и его фармацевтически приемлемые соли, фармацевтические композиции и их применение в качестве ингибиторов ВИЧ.(71)(73) Заявитель и патентовладелец: ЭЛАНКО ЭНИМАЛ ХЭЛС АИЭЛЭНД ЛИМИТЕД (IE) 019558 Настоящее изобретение относится к производным нафтиридина, обладающим способностью ингибировать репликацию ВИЧ (вируса иммунодефицита человека), их получению и фармацевтическим композициям, содержащим указанные соединения. Первоначально лечение инфекции ВИЧ представляло собой монотерапию производными нуклеозидов; несмотря на то, что указанные лекарственные средства были эффективными в отношении подавления репликации вирусов, они быстро теряли свою эффективность из-за появления штаммов с лекарственной устойчивостью. Стало очевидно, что из-за высокой частоты мутаций в комбинации с быстрой репликацией ВИЧ стал особо сложной мишенью для противовирусной терапии. Появление комбинированной терапии, включающей несколько агентов, направленных против ВИЧ, привело к улучшению терапевтического эффекта. Современным стандартом лечения является так называемая высокоактивная антиретровирусная терапия (HAART), обеспечивающая эффективное и стойкое подавление вируса.HAART, как правило, включает комбинацию нуклеозидных или нуклеотидных ингибиторов обратной транскриптазы (NRTI или NtRTI соответственно) с ненуклеозидным ингибитором обратной транскриптазы (NNRTI), ингибитором протеазы (PI) и ингибитором интегразы или ингибитором проникновения. Согласно действующей директиве для антиретровирусной терапии рекомендована схема по меньшей мере тройной комбинированной терапии даже для начального лечения. Несмотря на то, что HAART может приводить к подавлению ВИЧ до не поддающегося обнаружению уровня, может возникать устойчивость из-за проблем соблюдения больными режима лечения. Также было показано, что резистентный вирус передается свежеинфицированным субъектам, что приводит к сильным ограничениям в вариантах лечения указанных пациентов, еще не получавших медикаментозного лечения. Следовательно, сохраняется необходимость в новых и эффективных соединениях, которые могут применяться в качестве лекарственных средств, направленных против ВИЧ. В частности, существует необходимость в новых ингибиторах интегразы ВИЧ, которые являются более эффективными с точки зрения активности в отношении вируса дикого типа, а также в отношении мутировавших штаммов, в частности в отношении мутировавших штаммов, отобранных при использовании одобренных или практически одобренных на сегодняшний день ингибиторов интегразы, таких как ралтегравир и элвитегравир. Первичные мутации, наиболее часто возникающие в ходе проведения лечения ралтегравиром,включают N155H и Q148K/R/H и в редких случаях Y143R/C. Приобретение мутации N155 или Q148, как было обнаружено, приводит к возникновению перекрестной устойчивости к структурно различным ингибиторам интегразы. Существует необходимость в ингибиторах интегразы, обеспечивающих преимущества с точки зрения их фармакокинетических и/или фармакодинамических свойств, в частности, не обладающих способностью связываться с широким спектром белков. Другие аспекты, которые должны учитываться при разработке новых ингибиторов интегразы, включают благоприятный профиль безопасности, дозировки и/или отсутствие необходимости в усиливающих средствах. Другие ингибиторы интегразы ВИЧ известны в данной области техники. Например, в WO 0255079,WO 0230931, WO 0230930 и WO 0230426 (MerckCo., Inc., для всех из указанных публикаций) описаны аза- и полиазанафталенилкарбоксамиды, подходящие в качестве ингибиторов интегразы ВИЧ. В WO 0236734 (MerckCo., Inc.) дополнительно описаны аза- и полиазанафталенилкетоны, подходящие в качестве ингибиторов интегразы ВИЧ. В Roggo et al., Journal of antibiotics (1996) описаны спиродигидробензофуранлактамы в качестве антагонистов эндотелина и в качестве ингибиторов протеазы ВИЧ-1. В ЕР 0459449 ShionogiCo. описаны фурано[2,3-F]изоиндолы в качестве ингибиторов альдозоредуктазы. В CS 225002 (Krepelka Jiri, Vlckova Drahuse) описаны производные 9-фенил-1 Н-бензо[f]изоиндол-1,3-диона, способные подавлять опухоли у мышей и крыс. Подобным образом, в CS 210880(Krepelka Jiri, Vancurova Iva, Roubik Jiri) описаны определенные имиды 4-арилнафталин-2,3 дикарбоновой кислоты в качестве активных противоопухолевых соединений. В статье Krepelka et al.,Collect. Czech. Chem. Commun. (1982), 47(1), рр. 304-14, описан синтез и противоопухолевое действие некоторых N-замещенных имидов 1-замещенных-4-арилнафталин-2,3-дикарбоновых кислот. Полициклические карбамоилпиридоны также были описаны в качестве ингибиторов интегразы ВИЧ в ЕР 1874117 (Smithkline Beecham Corp., Shionogi). В WO 2005118593 (Bristol Myers Squibb) описан ряд бициклических гетероциклов в качестве ингибиторов интегразы, а в WO 2004103278 описан ряд ацилсульфонамидов в качестве ингибиторов интегразы ВИЧ. В WO 2005028478 (Gilead Sciences Inc.) описан ряд азахинолинонфосфонатных соединений в качестве ингибиторов интегразы, и в WO 2004035577 (Gilead Sciences Inc.) описан ряд предварительно структурированных трициклических ингибиторов интегразы. Более того, ряд пиридопиразиновых и пиримидопиразиндионовых соединений был описан в WO 2005087766 (Instituto di Ricerche di Biologia Moleculare p Angeletti Spa). Кроме того, тетрагидро-4 Н-пиридо(1,2-a)пиримидины и родственные им соединения были описаны в WO 2004058757 (Instituto di Ricerche di Biologia Moleculare p Angeletti Spa). В WO 2004046115 (Japan Tobacco Inc.) описаны 4-оксихинолиновые соединения в качестве ингибиторов интегразы ВИЧ и в US 20080207618 описано 6(гетероциклзамещенный бензил)-4-оксохинолиновое соединение в качестве ингибитора ВИЧ. Настоящее изобретение направлено на обеспечение нового конкретного ряда производных нафтиридина, обладающих способностью ингибировать интегразу ВИЧ и репликацию ВИЧ.-1 019558 Соединения настоящего изобретения отличаются от соединений, известных из уровня техники, по своей структуре, противовирусной активности и/или фармакологической активности. Было обнаружено,что указанные соединения обладают сильной активностью в отношении не только вируса дикого типа,но также в отношении мутантных штаммов, в частности в отношении штаммов, обладающих устойчивостью к одному или более известным ингибиторам интегразы, при этом указанные штаммы называют штаммами ВИЧ с лекарственной устойчивостью или множественной лекарственной устойчивостью. Таким образом, согласно одному аспекту настоящее изобретение относится к соединениям формулы I, включая их стереохимические изомерные формы, которые могут быть представлены формулой I и где W представляет собой -NH-, -N(CH3)- или пиперазин-1,4-диил,X представляет собой связь, -C(=O)- или -S(=O)2-,Y представляет собой С 3-7 алкилен,Z представляет собой -NH-C(=O)- или -O-,и к их фармацевтически приемлемым солям. Во всех случаях использования в обозначении фрагмента или группы молекулы пунктирная линияпредставляет собой связь, связывающую указанный фрагмент или группу с оставшейся частью молекулы. В данном описании С 3-7 алкилен в качестве группы или части группы означает радикал с прямой или разветвленной бивалентной насыщенной углеводородной цепью, содержащей от 3 до 7 атомов углерода,такой как пропилен, 2-пропил, 1-бутилен, пропилен, гексилен или гептилен. Представляющим интерес С 3-7 алкиленом является С 4-5 алкилен или С 3-4 алкилен; причем С 4-5 алкилен означает радикал с прямой или разветвленной бивалентной насыщенной углеводородной цепью, содержащей от 4 или 5 атомов углерода; С 3-4 алкилен означает радикал с прямой или разветвленной бивалентной насыщенной углеводородной цепью, содержащей от 3 или 4 атомов углерода. Предпочтительными являются алкиленовые радикалы с прямой цепью. Во всех случаях, когда радикал встречается в определении соединений формулы (I) или в любой из подгрупп, описанных в данном описании, указанный радикал независимо является таким, как указано выше, согласно определению соединений формулы (I) или согласно более узким определениям, приведенным ниже в данном описании. Следует отметить, что радикал на какой-либо группе молекулы, используемый в определениях, может находиться в любом положении на указанной группе при условии ее химической стабильности. Например, бутил включает 1-бутил и 2-бутил. Некоторые из соединений формулы (I) могут также существовать в их таутомерной форме. Несмотря на то, что указанные формы специально не обозначены в вышеприведенной формуле, они включены в объем настоящего изобретения. Настоящее изобретение также включает любые изотопы атомов, присутствующих в соединениях настоящего изобретения. Например, изотопы водорода включают тритий и дейтерий, и изотопы углерода включают С-13 и С-14. Во всех случаях использования выше или ниже в данном описании термины "соединения формулы(I)", "настоящие соединения", "соединения настоящего изобретения" или любые эквивалентные термины и, подобным образом, термины "подгруппы соединений формулы (I)", "подгруппы настоящих соединений", "подгруппы соединений настоящего изобретения" или любые эквивалентные термины включают соединения общей формулы (I) или подгруппы соединений общей формулы (I), а также их соли, сольваты и стереоизомеры. Когда какая-либо переменная встречается более одного раза в какой-либо группе, каждое определение является независимым. Любые более узкие определения радикалов, указанных в данном описании,применимы к группе соединений формулы (I), а также к любой подгруппе, определенной или указанной в данном описании. Подгруппы соединений формулы I представляют собой такие соединения формулы I или подгруппы соединений формулы I, как определено в данном описании,где W представляет собой -NH- или -N(CH3)-, или где X представляет собой связь или -S(=O)2-, или где Y представляет собой С 4-5 алкилен, или где X представляет собой -C(=O)- и Y представляет собой С 3-4 алкил, когда W представляет собой пиперазин-1,4-диил, или где Z представляет собой -O-, или где Z представляет собой -NH-C(=O)-, в частности, где азот группы -NH-C(=O)- связан с Y, илиNH-С 5-7 алкилен-NH-С(=O),N(СН 3)-S(=О)2-С 4-5 алкилен-NH-C(=О),N(CH3)-S(=O)2-С 4-5 алкилен-О, Фармацевтически приемлемые формы аддитивных солей, которые соединения настоящего изобретения способны образовывать, могут быть легко получены с использованием соответствующих кислот,таких как, например, неорганические кислоты, такие как галогенводородные кислоты, например хлористо-водородная или бромисто-водородная кислота, серная, гемисерная, азотная, фосфорная кислота и т.д.; или органических кислот, таких как, например, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая кислота и т.д. Наоборот, указанная кислотно-аддитивная соль может быть преобразована в форму свободного основания путем обработки соответствующим основанием. Соединения формулы (I), содержащие кислые протоны, могут быть преобразованы в форму их фармацевтически приемлемых солей присоединения металла или амина путем обработки соответствующими органическими и неорганическими основаниями. Соответствующие формы щелочных солей включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и т.д., соли с органическими основаниями, например первичными,вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, бензатин, N-метилD-глюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол, соли гидрабамина и соли с аминокислотами,такими как, например, аргинин, лизин и подобными аминокислотами. Наоборот, соль может быть преобразована обработкой кислотой в форму свободной кислоты. Получение соединений Соединение настоящего изобретения, как правило, может быть получено последовательностью стадий, каждая из которых известна специалистам в данной области техники. В частности, соединения настоящего изобретения могут быть получены в соответствии с одним или более из следующих способов получения. В следующих схемах, если не указано иное, все используемые переменные являются такими,как определено для соединений формулы (I). Макроциклы, имеющие общую формулу (I) настоящего изобретения, могут быть получены посредством реакции циклизации, включающей "открытый" предшественник формулы (II), в которой 8 гидроксильная функциональная группа 1,6-нафтиридина защищена с помощью защитной группы (PG) или, альтернативно, не имеет защитной группы и используется в виде свободной гидроксильной функциональной группы. Примеры подходящих защитных групп для указанной гидроксильной функциональной группы представляют собой С 1-4 алкил, бензил, арилсульфонил и бензоил. Указанная реакция циклизации может быть осуществлена посредством образования амидной связи, вовлекающей карбоксильную функциональную группу в положении 7 на молекуле нафтиридина, как показано на схеме 1, и требует присутствия дегидратирующего реагента. Примеры обычно используемых реагентов включают HBTU(пентафторфенилдифенилфосфинат). В конкретном варианте осуществления указанный дегидратирующий реагент представляет собой HBTU или FDPP. Реакцию, как правило, осуществляют путем медленного добавления "открытого" предшественника общей формулы (II) к смеси, содержащей указанный дегидратирующий агент и избыточное количество третичного амина, такого как диизопропилэтиламин или подобный амин. Подходящий растворитель представляет собой апротонный растворитель, такой какCH2Cl2, или более предпочтительно полярный апротонный растворитель, такой как ДМФА. При определенных обстоятельствах применение НОВТ (гидроксибензотриазола) в качестве вспомогательного вещества является предпочтительным. В предпочтительном варианте осуществления изобретения реакцию циклизации осуществляют при низкой концентрации "открытого" предшественника (II), например, в диапазоне от 1 до 10 мМ, в частности при 4 мМ. Согласно другому варианту осуществления изобретения реакция макроциклизации может быть осуществлена в области линкера -W-X-Y-Z-, например, при получении соединений формулы I, где Z представляет собой амидную связь формулы -NH-C(=O)-, где промежуточное соединение формулы IIa циклизуют с использованием способа, описанного выше в данном описании, с образованием макроциклической амидной связи.-3 019558 Удаление защитной группы из 8-гидроксильной группы соединения формулы III, как показано на схеме 1, может быть осуществлено с использованием различных условий и зависит от конкретной защитной группы PG. Согласно одному варианту осуществления изобретения, когда PG представляет собой бензил, макроцикл общей формулы (III) можно обрабатывать трифторуксусной кислотой при температуре от 0 до 80 С. Необязательно можно использовать апротонный сорастворитель, такой как дихлорметан. Также предпочтительно использовать агент, захватывающий полученные в результате бензильные карбокатионы, например триизопропилсилан или подобный агент. Согласно второму варианту осуществления изобретения, когда PG представляет собой Me, макроцикл общей формулы (III) можно обрабатывать йодидом натрия и тетрахлорсиланом в смеси растворителей, состоящей из полярного апротонного растворителя, такого как ацетонитрил или подобный растворитель, и ароматического неполярного растворителя, такого как толуол или подобный растворитель. Указанное преобразование предпочтительно осуществляют в температурном диапазоне от температурой 0 С до комнатной температуры. Альтернативно, указанное удаление защитных групп осуществляют с использованием борсодержащего реагента,такого как трибромид бора (BBr3), в апротонном растворителе, таком как дихлорметан или подобный растворитель, при низкой температуре, например при -78 С. Согласно третьему варианту осуществления изобретения, когда PG представляет собой паратолилсульфонил, макроцикл общей формулы (III) обрабатывают алкоксидом натрия в соответствующем спиртовом растворителе, например метоксиде натрия в метаноле, при комнатной температуре. Необязательно можно использовать полярный апротонный сорастворитель, такой как ДМФА или подобный растворитель. Соединения формулы II получают из соединений формулы IV, и соединения формулы IIa получают из соединений формулы VI путем использования соответствующих способов удаления защитных групп,описанных и показанных на схемах 2 и 2 а соответственно. Различные способы получения промежуточных соединений (их подгрупп) формул IV или VI при использовании соединения формулы XI в качестве исходного соединения описаны и показаны на схемах 3, 4, 4 а, 4b, 4 с, 5 а, 5b и 5c. Нафтиридин общей формулы (XI) может быть получен с различными защитными группами (PG). Выбор PG зависит от конкретных функциональных групп А, В, С и D, определенных выше в данном описании. PG вводят для гидроксильной группы нафтиридина общей формулы (XIa), как показано на схеме 1. Когда PG представляет собой бензил или С 1-4 алкил, указанный нафтиридин (XIa) обрабатывают неорганическим основанием, таким как карбонат цезия или подобное основание, в полярном апротонном растворителе, таком как ДМФА или подобный растворитель, с последующим добавлением галогенида С 1-4 алкила, такого как метилйодид или бензилбромид, с получением промежуточного соединения общей формулы (XI). Реакцию наиболее предпочтительно осуществляют при комнатной температуре. Альтернативно, когда PG означает паратолилсульфонил, указанный нафтиридин (XIa) обрабатывают паратолуолсульфонилхлоридом в присутствии третичного амина в качестве основания, такого как триэтиламин или подобное основание. Подходящий растворитель представляет собой хлорированный углеводород,такой как хлороформ или подобный растворитель, и температура реакции составляет от 20 до 50 С. Схема 1"Открытые" предшественники общей формулы (II) могут быть получены в две стадии, начиная с предшественника, содержащего защитную группу общей формулы (IV), как показано на схеме 2. Сначала сложный эфир карбоновой кислоты общей формулы (IV) омыляют, с получением соответствующей карбоновой кислоты общей формулы (V). Указанное преобразование может быть осуществлено путем использования гидроксида металла (M-ОН), такого как гидроксид калия, гидроксид натрия или гидроксид лития. Реакцию осуществляют в водных условиях, наиболее предпочтительно в присутствии по меньшей мере одного растворимого в воде органического сорастворителя, такого как метанол, этанол или ТГФ или подобный сорастворитель. На второй стадии защитную Boc-группу амина удаляют с получением предшественника макроцикла общей формулы (II), что может достигаться путем обработки Воссодержащего промежуточного соединения формулы (V) раствором, содержащим трифторуксусную кислоту, необязательно в присутствии триизопропилсилана, в апротонном растворителе, таком как дихлорметан или подобный растворитель. В предпочтительном варианте осуществления изобретения указанное преобразование осуществляют при температуре от 0 С до комнатной температуры. Альтернативно, указанное удаление защитной группы может быть осуществлено путем обработки соединения (V) раствором хлористо-водородной кислоты в полярном апротонном растворителе, таком как диоксан, в частности 4 н. раствор HCl в диоксане. Схема 2"Открытые" предшественники общей формулы (IIa) могут быть получены в две стадии, начиная с содержащего защитную группу предшественника общей формулы (VI), как показано на схеме 2 а. Схема 2 а Сначала сложный эфир карбоновой кислоты общей формулы (VI) омыляют с получением соответствующей карбоновой кислоты общей формулы (VII). Указанное преобразование может быть осуществлено путем использования гидроксида металла (М-ОН), такого как гидроксид калия, гидроксид натрия или гидроксид лития. Реакцию осуществляют в водной среде, наиболее предпочтительно в присутствии по меньшей мере одного растворимого в воде органического сорастворителя, такого как метанол, этанол,ТГФ или подобный сорастворитель. На второй стадии защитную Вос-группу амина удаляют с получением предшественника макроцикла общей формулы (IIa), что может достигаться путем обработки промежуточного соединения формулы (VII), содержащего Вос-группу, раствором, содержащим трифторуксусную кислоту, необязательно в присутствии триизопропилсилана, в апротонном растворителе, таком как дихлорметан или подобный растворитель. В предпочтительном варианте осуществления изобретения указанное преобразование осуществляют при температуре от 0 С до комнатной температуры. Предшественник общей формулы (VI) может быть получен в две стадии из нафтиридина общей формулы (VIII), как показано на схеме 3. Первая стадия включает омыление промежуточного соединения(VIII), которое может быть осуществлено взаимодействием с гидроксидом металла (М-ОН), таким как гидроксид калия или гидроксид натрия. Реакцию осуществляют в водной среде, наиболее предпочтительно в присутствии по меньшей мере одного растворимого в воде органического сорастворителя, такого как метанол или подобный растворитель. Дальнейшее преобразование карбоновой кислоты (IX) в амиды формулы (VI) проводят с использованием известных в данной области техники методов, таких как обработка первичного амина формулы (X) солью хлористо-водородной кислоты, такой как гидрохлорид метил 2-(аминометил)-5-фторбензоата, когда С 1-2 алкил представляет собой метил, в присутствии стандартного амидного агента сочетания, такого как HBTU (гексафторфосфат O-бензотриазол-N,N,N',N'тетраметилурония), EDCI (1-этил-3-(3-диметиламинопропил)карбодиимид) или EDAC (гидрохлорид 1 этил-3-(3-диметиламинопропил)карбодиимида) в апротонном растворителе, подобном CH2Cl2, в присутствии в качестве вспомогательного вещества основания амина, такого как диизопропилэтиламин. При определенных обстоятельствах предпочтительно использование НОВТ (гидроксибензотриазола) в каче-5 019558 стве вспомогательного вещества. Схема 3 Промежуточное соединение общей формулы (VIIIf) может быть получено несколькими способами в зависимости от природы функциональных групп W и X, определенных выше в данном описании. Согласно первому варианту осуществления изобретения, когда W представляет собой -NH- и X представляет собой связь, может быть использована реакция, показанная на схеме 4. Подходящие защитные группы(PG) в указанной реакции представляют собой Me и Bn. Указанное преобразование включает применение содержащего две аминогруппы и одну защитную группу линкера (XII). В частности, указанная защитная группа представляет собой Вос-группу. Указанный линкер можно вводить путем обработки смеси бромида (XI) и третичного амина, такого как диизопропилэтиламин или подобный третичный амин, в полярном апротонном растворителе, таком как DMA (диметилацетамид), амином (XII). Реакцию наиболее предпочтительно осуществляют в температурном диапазоне от 80 до 160 С, в частности при 140 С, с получением эфира карбоновой кислоты общей формулы (VIIIf). Схема 4 Согласно второму варианту осуществления изобретения, когда W представляет собой пиперазинил и X представляет собой связь, может быть осуществлена последовательность реакций, показанная на схеме 4 а. На первой стадии пиперазин вводят в нафтиридин общей формулы (XI). Указанное преобразование может быть осуществлено путем обработки смеси бромида (XI) и третичного амина, такого как диизопропилэтиламин или подобный третичный амин, в полярном апротонном растворителе, таком какDMA, пиперазином. Реакцию наиболее предпочтительно осуществляют в температурном диапазоне от 80 до 140 С, в частности при 110 С, с получением пиперазина общей формулы (XIII). На второй стадии указанный пиперазин (XIII) обрабатывают бромсодержащим линкером общей формулы (XIV). Например, когда Y представляет собой С 4 алкил, указанный линкер представляет собой трет-бутил-4 бромбутилкарбамат. Указанное преобразование требует присутствия неорганического основания, такого как карбонат калия или подобное основание. Реакцию предпочтительно осуществляют в полярном апротонном растворителе, таком как DMA или подобный растворитель, с получением нафтиридина общей формулы (VIIIa). Схема 4 а Согласно третьему варианту осуществления изобретения, когда W представляет собой -N(CH3)-, X представляет собой S(=O)2, Y представляет собой С 3-7 алкилен и Z представляет собой -NH-C(=O)-, можно осуществлять реакцию, показанную на схеме 4b, с использованием содержащего защитную группу бромнафтиридина общей формулы (XI). Подходящие защитные группы представляют собой метил или тозил. Функционализированный нафтиридин общей формулы (VIIIb) получают путем взаимодействия бромнафтиридина (XI) с содержащим защитную группу функционализированным аминогруппой линке-6 019558 ром общей формулы (XV). Использование основания меди(I), такого как оскид меди(I), в присутствии лиганда, такого как 2,2'-бипиридин, обеспечивает преимущества в указанной реакции. Подходящие растворители представляют собой полярные апротонные растворители, такие как DMA, NMP (Nметилпирролидон) или подобные растворители. Для проведения реакции требуется повышенная температура, как правило, в диапазоне от 80 до 140 С, в частности 120 С. Схема 4b В определенных случаях, предпочтительно осуществлять преобразование защитной группы (PG) функциональной 8-гидроксигруппы нафтиридина. Примером указанной стратегии является взаимопреобразование тозильной группы соединения (VIIIc) в бензильную группу соединения (VIIIe), как показано на схеме 4 с. Стадия удаления защитной группы включает обработку тозилата (VIIIc) алкоксидом натрия в соответствующем спиртовом растворителе, например метоксиде натрия в метаноле. Температура реакции составляет от 20 до 60 С. Необязательно может использоваться полярный апротонный сорастворитель, такой как ДМФА или подобный растворитель. Повторное введение защитной группы с получением бензилоксинафтиридина общей формулы (VIIIe) может быть осуществлено путем обработки соединения(VIIId) неорганическим основанием, таким как карбонат цезия или подобное основание, в полярном апротонном растворителе, таком как ДМФА или подобный растворитель, с последующим добавлением бензилгалогенида, такого как бензилбромид. Реакцию наиболее предпочтительно осуществляют при комнатной температуре. Схема 4 с Предшественники макроцикла общей формулы (IV) могут быть получены несколькими способами в зависимости от природы функциональных групп W, X и Z, определенных выше в данном описании. Согласно первому варианту осуществления изобретения, когда W представляет собой пиперазинил,X представляет собой -С(=O)- и Z представляет собой атом кислорода, может быть осуществлена реакция, показанная на схеме 5 а, с получением предшественника макроцикла общей формулы (IVa). Пиперазин общей формулы (XIII) обрабатывают карбоновой кислотой общей формулы (XVI) в присутствии обычного агента сочетания амидов, такого как HBTU (гексафторфосфат О-бензотриазол-N,N,N',N'тетраметилурония), EDCI (1-этил-3-(3-диметиламинопропил)карбодиимид) или EDAC (гидрохлорид 1 этил-3-(3-диметиламинопропил)карбодиимида), в апротонном растворителе, таком как CH2Cl2, в присутствии в качестве вспомогательного вещества основания амина, такого как диизопропилэтиламин. Схема 5 а Согласно второму варианту осуществления изобретения, когда W представляет собой -N(CH3)-, X представляет собой -S(=O)2-, Y представляет собой С 3-7 алкилен и Z представляет собой -NH-С(=O)-, может быть осуществлена последовательность реакций, показанная на схеме 5b, начиная с функционализи-7 019558 рованного Вос-амином нафтиридина общей формулы (VIIIb), с получением предшественника макроцикла общей формулы (IVb). Сначала может быть произведено удаление защитной Вос-группы из аминогруппы соединения (VIIIb) обработкой TFA (трифторуксусной кислотой) с получением амина формулы(XVIII). Необязательно может быть использован галогенированный углеводород в качестве сорастворителя, и температура реакции составляет от 0 до 20 С. Альтернативно, указанное удаление защитной группы может быть осуществлено путем использования HCl в полярном апротонном растворителе, таком как диоксан. На второй стадии амин общей формулы (XVIII) обрабатывают карбоновой кислотой(XVII) в присутствии традиционного реагента сочетания амидов, такого как HBTU (гексафторфосфат Обензотриазол-N,N,N',N'-тетраметилурония), EDCI (1-этил-3-(3-диметиламинопропил)карбодиимида) илиEDAC (гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида), в апротонном растворителе, таком как CH2Cl2, или, альтернативно, в полярном апротонном растворителе, таком как ДМФА или подобный растворитель, в присутствии в качестве вспомогательного вещества основания амина, такого как диизопропилэтиламин. Схема 5b Согласно третьему варианту осуществления изобретения, когда W представляет собой -(NCH3)-, X представляет собой S(=O)2-, Y представляет собой С 3-7 алкилен и Z представляет собой атом кислорода,может быть использована реакция, показанная на схеме 5 с, начиная с бромнафтиридина общей формулы(XI), с получением предшественника макроцикла общей формулы (IVc). Подходящие защитные группы представляют собой метил или тозил. Предшественник макроцикла общей формулы (IVc) получают путем взаимодействия бромнафтиридина (XI) с содержащим сульфонамид линкером общей формулы(XIX). Использование основания меди(I), такого как оксид меди(I), в присутствии лиганда, такого как 2,2'-бипиридин, обеспечивает преимущества в указанной реакции. Подходящие растворители представляют собой полярные апротонные растворители, такие как DMA, NMP (N-метилпирролидон) или подобные растворители. Для проведения реакции требуется повышенная температура, как правило, в диапазоне от 80 до 140 С, в частности 120 С, в целом, реакцию осуществляют в инертной атмосфере. Схема 5 с Для создания улучшенных промежуточных соединений и макроциклов, показанных на схемах 1-5c,предпочтительно могут быть использованы структурные элементы, показанные на схемах 7 а-9. Указанные структурные элементы могут быть получены согласно описаниям, приведенным ниже в данном описании. Функционализированный Boc-аминогруппой линкер общей формулы (XV) может быть получен из аминосульфонамида общей формулы (XV'), как показано на схеме 7 а. Как правило, раствор амина (XV) в хлорированном углеводородном растворителе, таком как дихлорметан или подобный растворитель, обрабатывали Вос-ангидридом при комнатной температуре. Схема 7 а Функционализированный аминогруппой линкер общей формулы (XV') может быть получен из хлорсульфонамида (XVa') различными способами в зависимости от природы Y, определенного выше в-8 019558 данном описании. Например, когда Y представляет собой С 3-4 алкил, что приводит к получению линкера формулы (XVb), может быть осуществлена последовательность реакций, показанная на схеме 7b. Хлорсульфонамид (XVa') сначала обрабатывают йодидом натрия в полярном апротонном растворителе, таком как ДМФА или подобный растворитель, при комнатной температуре. Далее добавляют азид натрия и смеси дают возможность реагировать в температурном диапазоне от 20 до 70 С, в частности при 60 С, с получением азида (XVc). На следующей стадии азид восстанавливают с получением амина (XVd). Указанное преобразование может быть осуществлено путем помещения азида (XVc) в атмосферу водорода,как правило, при 1 атм, в протонном растворителе, таком как метанол или подобный растворитель. Использование катализатора, такого как палладий на углеродном носителе или подобный катализатор, является существенным для осуществления указанной реакции гидрирования. Схема 7b В другом примере, когда Y представляет собой пентилен, что приводит к получению линкера формулы (XVd), может быть осуществлена последовательность реакций, показанная на схеме 7 с. Хлорсульфонамид (XVa) сначала обрабатывают йодидом натрия в полярном апротонном растворителе, таком как ДМФА или подобный растворитель, при комнатной температуре. Далее добавляют цианид натрия и смеси дают возможность реагировать в температурном диапазоне от 20 до 70 С, в частности при 60 С, с получением нитрила (XVe). На следующей стадии нитрил восстанавливают с получением амина (XVd). Указанное преобразование может быть осуществлено путем помещения нитрила (XVe) в атмосфере водорода, как правило, при 1 атм, в протонный растворитель, такой как метанол или подобный растворитель, в присутствии аммиака. Использование катализатора, такого как палладий на углеродном носителе или подобный катализатор, является существенным для осуществления указанной реакции гидрирования. Альтернативно, восстановление нитрильной функциональной группы в соединении (XVe) может быть осуществлено путем обработки боргидриддиметил сульфидным комплексом при комнатной температуре в полярном апротонном растворителе, таком как ТГФ или подобный растворитель, с получением первичного амина (XVd). Схема 7c Нитрил формулы (XVe) также может быть получен из хлорида (XVa) в три стадии, как показано на схеме 7d. Первая стадия включает введение подходящей защитной группы, такой как Boc, для сульфонамидной функциональной группы. Указанное преобразование может быть осуществлено путем обработки хлорида (XVa) BOC2O при комнатной температуре в полярном апротонном растворителе, таком как ДМФА или подобный растворитель, с получением хлорида (XVf), содержащего защитную Boc-группу. Необязательно может быть использован протонный сорастворитель, такой как метанол или подобный сорастворитель. Вторая стадия включает нуклеофильное замещение хлорида в соединении (XVa) цианидом, что может быть осуществлено путем обработки хлорида (XVa) неорганической солью цианида, такой как цианид калия, при температуре от комнатной температуры до 150 С, в частности при 80 С, в полярном апротонном растворителе, таком как ацетонитрил или подобный растворитель. Предпочти-9 019558 тельно использовать краун-эфир в указанном преобразовании, в частности 18-краун-6, с получением нитрила формулы (XVg). На третьей стадии удаление защитной группы из Boc-аминогруппы в соединении (XVg) может достигаться путем обработки TFA с получением цианида формулы (XVe). Необязательно в качестве сорастворителя может быть использован галогенированный углеводород, и температура реакции составляет от 0 до 20 С. Альтернативно, указанное удаление защитной группы может быть осуществлено путем использования HCl в полярном апротонном растворителе, таком как диоксан. Карбоновая кислота общей формулы (XVI) может быть получена в четыре стадии из (2(бензилокси)-4-фторфенил)метанамина (XVIa), как показано на схеме 8. На первой стадии вводят защитную Boc-группу для амина (XVIa). Это может быть осуществлено путем обработки амина (XVIa) в смеси растворителей, состоящей из диоксана и воды, Boc-ангидридом в присутствии карбоната натрия с получением содержащего защитную Вос-группу соединения (XVIb). Указанная реакция может быть осуществлена в температурном диапазоне от 0 до 20 С. На второй стадии бензильную группу в соединении (XVIb) удаляют в ходе восстановительной реакции путем проведения реакции в атмосфере водорода, как правило, при 1 атм, в протонном растворителе, таком как этанол или подобный растворитель, необязательно в присутствии апротонного сорастворителя, такого как этилацетат или подобный сорастворитель. Использование катализатора, такого как палладий на углероде или подобный катализатор, является существенным для проведения указанной реакции гидрирования, которая приводит к получению фенола (XVIc). На третьей стадии фенол (XVIc) подвергают взаимодействию с функционализированным галогеном эфиром карбоновой кислоты, имеющим общую формулу (XX), в присутствии неорганического основания, такого как карбонат калия или подобное основание. Указанное преобразование может быть осуществлено в полярном апротонном растворителе, таком как DMA или подобный растворитель, в температурном диапазоне от 20 до 80 С, в частности при 60 С, с получением эфира карбоновой кислоты общей формулы (XVId). На четвертой стадии эфир карбоновой кислоты общей формулы (XVId) омыляют, с получением карбоновой кислоты общей формулы (XVI). Указанное преобразование может быть осуществлено путем взаимодействия с гидроксидом металла (M-ОН), таким как гидроксид калия или гидроксид натрия. Реакцию осуществляют в водной среде, наиболее предпочтительно в присутствии по меньшей мере одного растворимого в воде органического сорастворителя, такого как метанол или подобный сорастворитель, и необязательно ТГФ. Схема 8 Сульфонамидный структурный элемент общей формулы (XIX) может быть получен из фенола(XVIc) и сульфонамида общей формулы (XV"), как показано на схеме 9 а. Сульфонамид общей формулы(XV") содержит уходящую группу А, которая может представлять собой галоген, в частности йод, или,альтернативно, тозилат. Фенол (XVIc) подвергают взаимодействию с соединением (XV") в присутствии неорганического основания, такого как карбонат калия или подобное основание. Указанное преобразование может быть осуществлено в полярном апротонном растворителе, таком как ДМФА или ДМСО или подобный растворитель, в температурном диапазоне от 20 до 80 С, в частности при 50-60 С, с получением сульфонамида общей формулы (XIX). Схема 9 а Сульфонамидный линкер общей формулы (XV") может быть получен с использованием различных способов в зависимости от природы Y. Например, когда Y представляет собой С 3-4 алкил, йодсульфона- 10019558 мид формулы (XVa) может быть получен взаимодействием соответствующего хлорсульфонамида(XVa') с йодидом натрия, как показано на схеме 9b. Указанное преобразование осуществляют в ацетоне при температуре кипения с обратным холодильником. Схема 9b В другом примере, когда Y представляет собой С 5 алкил (т.е. пентилен), тозилат (XVb") может быть получен в три стадии из нитрила (XVe), как показано на схеме 9 с. На первой стадии нитрил (XVe) гидролизуют до карбоновой кислоты (XVc"). Указанная реакция может быть осуществлена путем нагревания смеси уксусной кислоты и хлористо-водородной кислоты предпочтительно при температуре кипения с обратным холодильником. На второй стадии карбоксильную функциональную группу соединения(XVc") восстанавливают до соответствующего спирта формулы (XVd"). Указанное преобразование может быть осуществлено путем обработки боргидрида в полярном апротонном растворителе, таком как ТГФ или подобный растворитель, при температуре от 0 до 20 С. На третьей стадии гидроксильную функциональную группу соединения (XVd") функционализируют с образованием тозилатной группы с получением соединения (XVb") путем взаимодействия спирта (XVd") и тозилхлорида в присутствии третичного амина, такого как триэтиламин или подобный растворитель, в неполярном растворителе, таком как дихлорметан или подобный растворитель, при комнатной температуре. Схема 9 с Предшественники линкера общей формулы (XVm) и (XVn) могут быть получены, как показано на схеме 9d, начиная с бромного спирта общей формулы (XVh). На первой стадии вводят защитную группу для спирта (XVh) в виде эфира карбоновой кислоты общей формулы (XVi). Указанный спирт (XVh) обрабатывают ацилхлоридом, таким как ацетилхлорид или пивалоилхлорид, или подобный хлорид, в присутствии основания третичного амина, такого как триэтиламин или подобный третичный амин, в галогенированном растворителе, таком как дихлорметан или подобный растворитель. Реакция может быть осуществлена при температуре от 0 С до комнатной температуры. На второй стадии сложный бромэфир общей формулы (XVi) преобразовывают в соответствующий (аминоиминометил)тиоэфир формулы(XVj). Указанное преобразование осуществляют путем нагревания смеси тиомочевины и сложного бромэфира (XVi) в протонном растворителе, таком как этанол или подобный растворитель, при температуре от 70 до 100 С. На третьей стадии сульфонилхлорид общей формулы (XVk) получают путем обработки(аминоиминометил)тиоэфира формулы (XVj) раствором хлора в воде в качестве растворителя при температуре 0 С. На четвертой стадии сульфонилхлорид общей формулы (XVk) преобразовывают в соответствующий метилсульфонамид общей формулы (XVm) путем обработки смеси сульфонилхлорида(XVk) солью HCl метиламина в двухфазной системе растворителей, состоящей из воды и галогенированного углеводорода, такого как дихлорметан или подобный растворитель. Указанное преобразование осуществляют в присутствии неорганического основания, такого как карбонат калия или подобное основание, при температуре от 10 до 20 С. На четвертой стадии защитную группу сложного эфира метилсульфонамида формулы (XVm) удаляют путем обработки гидроксида металла, такого как гидроксид натрия. Реакцию осуществляют в водной среде, наиболее предпочтительно в присутствии по меньшей мере одного растворимого в воде органического сорастворителя, такого как метанол, этанол или ТГФ или подобный сорастворитель, с получением метилсульфонамидного спирта общей формулы (XVn). Соединения формулы (I) обладают антиретровирусными свойствами (способностью подавлять интегразу), в частности, в отношении ВИЧ - этиологитческого агента синдрома приобретенного иммунодефицита (СПИД) у людей. Вирус ВИЧ предпочтительно инфицирует Т 4-клетки человека и разрушает или изменяет их нормальную функцию, в частности нарушает координацию иммунной системы. В результате у инфицированного пациента постоянно снижается число Т 4-клеток, поведение которых, кроме того,является нарушенным. Следовательно, защитная иммунная система неспособна бороться с инфекциями и новообразованиями, и ВИЧ-инфицированные субъекты, как правило, умирают от оппортунистических инфекций, таких как пневмония, или от раковых заболеваний. Соединения настоящего изобретения также проявляют активность в отношении штаммов ВИЧ с лекарственной устойчивостью и множественной лекарственной устойчивостью, в частности в отношении штаммов ВИЧ, которые приобрели устойчивость к одному или более одобренным ингибиторам интегразы, в частности к ралтегравиру и/или элвитегравиру. Основные ассоциированные с устойчивостью к ралтегравиру мутации включают N155H и Q148K/R/H. Благодаря их антиретровирусным свойствам, в частности антиретровирусным свойствам в отношении ВИЧ, соединения формулы (I) или любые подгруппы, фармацевтически приемлемые аддитивные соли и стереоизомерные формы указанных соединений полезны для лечения субъектов, инфицированных ВИЧ, и для профилактики указанных инфекций. Соединения настоящего изобретения могут также находить применение в лечении теплокровных животных, инфицированных вирусами, существование которых опосредовано или зависит от ферментов протеаз. Состояния, которые могут быть подвержены предотвращению или лечению с помощью соединений настоящего изобретения, в частности состояния,ассоциированные с ВИЧ, включают СПИД, СПИД-ассоциированный комплекс (ARC), прогрессирующую генерализованную лимфаденопатию (PGL), наряду с хроническими заболеваниями центральной нервной системы, вызванными ретровирусами, такими как, например, опосредованная ВИЧ деменция и множественный склероз. Таким образом, соединения настоящего изобретения или любые их подгруппы могут применяться в качестве лекарственных средств для лечения перечисленных выше состояний. Указанное применение в качестве лекарственных средств или способа лечения включает введение ВИЧ-инфицированным субъектам количества, эффективного для борьбы с состояниями, ассоциированными с ВИЧ, и другими патогенными ретровирусами, в частности ВИЧ-1. В частности, соединения формулы (I) могут применяться при получении лекарственного средства для лечения или предотвращения ВИЧ-инфекций. Согласно другому аспекту настоящего изобретения предложен способ лечения человека, страдающего вирусными инфекциями, или способ предотвращения у человека вирусных инфекций, в частности ВИЧ-инфекций. Указанный способ включает введение человеку эффективного количества соединения формулы (I), фармацевтически приемлемой аддитивной соли, фармацевтически приемлемого сольвата или возможной стереоизомерной формы указанного соединения. Настоящее изобретение также предоставляет композиции для лечения вирусных инфекций, содержащие терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель или разбавитель. Соединения настоящего изобретения или любые их подгруппы могут быть представлены в виде различных фармацевтических форм для введения. В качестве приемлемых композиций могут быть приведены все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций настоящего изобретения эффективное количество конкретного соединения в качестве активного ингредиента, необязательно в форме аддитивной соли, комбинируется путем плотного перемешивании с фармацевтически приемлемым носителем, причем форма указанного носителя может сильно различаться в зависимости от формы состава, требуемой для введения. Такие фармацевтические композиции желательны в единичной дозированной форме, подходящей, в частности,для перорального, ректального, чрезкожного введения или путем парентеральной инъекции. Например,при получении композиций в дозированной форме для перорального введения могут быть использованы любые из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты и подобные среды, в случае жидких составов для перорального введения, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмал, сахара, каолин, разбавители, лубри- 12019558 канты, связующие вещества, дезинтегрирующие агенты и подобные носители, в случае порошков, пилюлей, капсул и таблеток. Благодаря легкости их введения таблетки и капсулы представляют собой наиболее предпочтительные единичные дозированные формы для перорального введения, причем в данном случае, как очевидно, используются твердые фармацевтические носители. В случае композиций для парентерального введения носитель обычно включает, по меньшей мере, значительное количество стерильной воды, хотя могут быть включены другие ингредиенты, например способствующие растворимости ингредиенты. Могут быть получены, например, растворы для инъекций, в которых носитель включает солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Также могут быть получены суспензии для инъекций, причем в данном случае могут быть использованы соответствующие жидкие носители, суспендирующие агенты и подобные агенты. Также включены твердые составы, которые могут быть превращены в жидкие составы непосредственно перед применением. В композициях,подходящих для чрезкожного введения, носитель необязательно содержит усиливающий проникновение агент и/или подходящий увлажнитель, необязательно в комбинации с подходящими добавками любой природы в малой дозе, причем указанные добавки не оказывают существенного вредного воздействия на кожу. Указанные добавки могут облегчать введение через кожу и/или могут способствовать получению желаемых композиций. Указанные композиции могут вводиться различными способами, например, в виде трансдермального пластыря, посредством точечного нанесения, в виде мази. Соединения настоящего изобретения также можно вводить путем ингаляции или инсуффляции способами и лекарственными формами, используемыми в данной области техники для введения указанным путем. Таким образом, как правило, соединения настоящего изобретения можно вводить в легкие в форме раствора, суспензии или сухого порошка. Любые системы, разработанные для доставки растворов,суспензий или сухих порошков путем ингаляции или инсуффляции через рот или нос, являются подходящими для введения соединений настоящего изобретения. Особо предпочтительно приведенные выше фармацевтические композиции представлены в виде единичных доз для легкости их введения и стабильности дозы. Единичные дозированные формы при использовании в данном описании относятся к физически дискретным единицам, подходящим в качестве однократных доз, где каждая указанная единица содержит заданное количество активного ингредиента,рассчитанное для обеспечения желаемого терапевтического эффекта, в комбинации с необходимым фармацевтическим носителем. Примерами указанных единичных дозированных форм являются таблетки(включая таблетки с риской или таблетки с покрытием), капсулы, пилюли, пакеты с порошкообразным продуктом, вафли, суппозитории, растворы или суспензии для инъекций и подобные формы, и отдельные составляющие указанных форм. Специалисты в области лечения ВИЧ-инфекций могут определить эффективное суточное количество на основании результатов тестов, представленных в данном описании. Как правило, предполагается,что эффективное суточное количество составляет от 0,01 до 50 мг/кг массы тела, более предпочтительно от 0,1 до 10 мг/кг массы тела. Может являться подходящим введение необходимой дозы в виде двух,трех, четырех или более доз с соответствующими интервалами в течение дня. Указанные дозы могут быть представлены в единичных дозированных формах, содержащих, например, от 1 до 1000 мг, в частности от 5 до 200 мг активного ингредиента на единичную дозированную форму. Точная доза и частота введения зависят от конкретного применяемого соединения формулы (I),конкретного состояния, подвергаемого лечению, тяжести указанного состояния, подвергаемого лечению,возраста, массы и общего физического состояния конкретного пациента, а также других лекарственных средств, которые субъект может принимать, как хорошо известно специалистам в данной области техники. Более того, очевидно, что указанное эффективное суточное количество может быть увеличено или уменьшено в зависимости от реакции подвергаемого лечению субъекта и/или в зависимости от оценки врача, назначающего соединения настоящего изобретения. Таким образом, диапазоны эффективного суточного количества, приведенные выше в данном описании, предложены в качестве рекомендаций и никоим образом не ограничивают объем или применение настоящего изобретения. Также в качестве лекарственного средства может использоваться комбинация одного или более дополнительных антиретровирусных соединений и соединений формулы (I). Таким образом, настоящее изобретение также относится к продукту, содержащему (а) соединение формулы (I) и (b) один или более дополнительных антиретровирусных соединений, в виде комбинированного препарата для одновременного, раздельного или последовательного применения при лечении ВИЧ. Различные лекарственные средства могут комбинироваться в виде отдельных препаратов или в пределах одного препарата вместе с фармацевтически приемлемыми носителями. Указанные другие антиретровирусные соединения могут представлять собой известные антиретровирусные соединения, такие как нуклеозидные ингибиторы обратной транскриптазы (NRTI), например зидовудин (AZT), диданозин (ddI), залцитабин (ddC), ламивудин (3 ТС), ставудин (d4T), эмтрицитабин (FTC), абакавир (ABC), амдоксовир (DAPD), элвуцитабин(АСН-126,443), априцитабин (AVX754, (-)-dOTC), фосалвудин тидоксил (FZT, HDP-990003), фосфазид,KP-1461, рацивир (PSI-5004), MIV-210 и GS-9131; ненуклеозидные ингибиторы обратной транскриптазы(NNRTI), такие как делавирдин (DLV), эфавиренц (EFV), невирапин (NVP), дапивирин (ТМС 120), этравирин (ETR, TMC125), рилпивирин (ТМС 278), IDX899, RDEA-806, UK-453601, RDEA-427 и UC-781;- 13019558 нуклеотидные ингибиторы обратной транскриптазы (NtRTI), например, тенофовир и его пролекарство тенофовир дизопроксил фумарат (TDF); ингибиторы протеаз, например, ритонавир (RTV), саквинавир(GW-640385, VX-385), типранавир (PNU-140690), DG-17, SPI256, PPL-100 (MK8122) и ТМС 310911; ингибиторы проникновения, которые включают ингибиторы слияния (например, энфувиртид (Т-20) сифувиртид, HRG-214, альбувиртид, SUC-HAS и maC46/M87o), ингибиторы присоединения, модуляторы внутриклеточного биосинтеза холестерина и кортикостероидов (например, SP-01A) и корецепторные антагонисты, где указанные корецепторные антагонисты включают антагонисты рецептора CCR5 (например, CCR5mAb004, маравирок (UK-427,857), PRO-140, TAK-220, TAK-652, PF232798, викривирок(SCH-D, SCH-417,690), GSK-706769, нифевирок и SCH-532706) и антагонисты рецептора CXR4 (например, AMD-070), другие примеры ингибиторов проникновения включают TNX-355, INCB 9471, BMS488043, нонакин и VGV-1; ингибиторы созревания, например, бевиримат (РА-457) и вивекон; и ингибиторы интегразы вируса, например, ралтегравир (MK-0518), элвитегравир (JTK-303, GS-9137), BMS538158, S-349572, JTK-656, S-247303 и GS-265744. Следующие примеры приведены в качестве иллюстрации и не ограничивают объем настоящего изобретения. Примеры Химический синтез соединений формулы (I)i Пример 1. Метил 8-(бензилокси)-5-бром-1,6-нафтиридин-7-карбоксилат Бензилбромид (2,53 мл, 21,2 ммоль) добавляли к смеси метил 5-бром-8-гидрокси-1,6-нафтиридин-7 карбоксилата (3,0 г; 10,6 ммоль) и карбоната цезия (6,9 г; 21,2 ммоль) в ДМФА (30 мл) при перемешивании при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Добавляли воду и этилацетат. Органическую фазу отделяли, промывали водой и насыщенным раствором NaCl. Органическую фазу сушили, фильтровали и концентрировали досуха. Неочищенное вещество очищали колоночной флэш-хроматографией на силикагеле (градиентное элюирование: гексанэтилацетат от 10:1 до 2:1). Фракции продукта собирали и растворитель выпаривали. Выход: 3,3 г (83%). Пример 2. Этил-2-циано-5-фторбензоат Цианид цинка (26,5 г; 0,225 моль) и Pd2(dba)3 (1,9 г; 3,4 ммоль) добавляли к раствору этил-2-бром-5 фторбензоата (27,9 г; 0,112 моль) в ДМФА (71 мл). Добавляли трифенилфосфин (2,9 г; 11 ммоль) и затем реакционную смесь перемешивали при температуре 130 С в атмосфере азота в течение 4 ч. Смесь выливали в Н 2 О (300 мл) и затем экстрагировали EtOAc (200 мл). Органический слой отделяли, промывали Н 2 О (2100 мл), насыщенным раствором соли (100 мл), сушили (MgSO4), фильтровали и растворитель выпаривали. Осадок очищали колоночной хроматографией на силикагеле (элюент: гексаны/EtOAc (5/1, по объему. Фракции продукта собирали и растворитель выпаривали. Выход: 20 г (93%; оранжевое твердое вещество). Пример 3. Этил-2-трет-бутоксикарбониламино)метил)-5-фторбензоат Смесь этил-2-циано-5-фторбензоата (пример 2; 20 г; 0,10 моль), Boc2O (24 мл; 0,11 моль), бикарбоната натрия (9,4 г; 0,11 моль) и никеля Ренея (2 г) в ТГФ (414 мл) гидрировали при давлении Н 2 (3 бар) при температуре 50 С в течение 24 ч. После удаления Н 2 катализатор удаляли фильтрованием через целит и целит промывали ТГФ. Фильтрат выпаривали. Осадок очищали колоночной хроматографией на силикагеле (элюент: гексаны/EtOAc (5/1, об./об.). Фракции продукта собирали и растворитель выпаривали. Выход: 15,9 г (52%). Концентрированную HCl (37%; 16 мл) добавляли по каплям к раствору этил-2-третбутоксикарбониламино)метил)-5-фторбензоата (пример 3; 15,9 г; 53,6 ммоль) в ТГФ (96 мл). Смесь нагревали при 50 С в течение 2 ч. Смесь концентрировали досуха. Осадок забирали в этанол (200 мл) и снова концентрировали. Твердое вещество растирали с эфиром (100 мл). Осадок отфильтровывали и промывали диэтиловым эфиром (250 мл). Выход: 8,5 г (81%; в виде бесцветного твердого вещества). Пример 5. 4-Хлор-N-метилбутан-1-сульфонамид К раствору 4-хлорбутан-1-сульфонилхлорида (117 ммоль) и триэтиламина (117 ммоль) в дихлорметане (250 мл) при 0 С добавляли по каплям 2 М раствор метиламина в ТГФ (117 ммоль). Смеси давали нагреться до комнатной температуры при перемешивании в течение ночи. Органический раствор промывали H2O и экстрагировали CH2Cl2, сушили над MgSO4 и фильтровали. Раствор концентрировали. Продукт использовали без дополнительной очистки. Пример 6. 4-Азидо-N-метилбутан-1-сульфонамид Раствор 4-хлор-N-метилбутан-1-сульфонамида (пример 5; 180 ммоль) и йодида натрия (198 ммоль) в ДМФА (180 мл) перемешивали в течение 10 мин при комнатной температуре. Добавляли азид натрия(397 ммоль) и реакционную смесь перемешивали в течение ночи при 60 С. Смесь фильтровали. Органическую фазу экстрагировали смесью AcOEt/вода. Неочищенную смесь концентрировали и использовали без дополнительной очистки на следующей стадии. Пример 7. 4-Амино-N-метилбутан-1-сульфонамид К раствору 4-азидо-N-метилбутан-1-сульфонамида (пример 6; 202 ммоль) в метаноле (200 мл) добавляли Pd/C (20 ммоль Pd). Смесь помещали в атмосферу водорода и перемешивали в течение ночи при комнатной температуре. Смесь фильтровали и концентрировали. Неочищенный продукт использовали на следующей стадии без дополнительной очистки. Пример 8. трет-Бутил 4-(N-метилсульфамоил)бутилкарбамат К раствору 4-амино-N-метилбутан-1-сульфонамида (пример 7; 183 ммоль) в дихлорметане (350 мл) порциями добавляли Boc2O (183 ммоль). Смесь перемешивали в течение ночи при комнатной температуре. Неочищенный продукт концентрировали и очищали колоночной хроматографией (CH2Cl2:MeOH 100:1) с получением требуемого соединения с выходом 62%. Пример 9. 4-Циано-N-метилбутан-1-сульфонамид Раствор 4-хлор-N-метилбутан-1-сульфонамида (пример 5; 86,7 ммоль) и йодида натрия (95,4 ммоль) в ДМФА (175 мл) перемешивали в течение 10 мин при комнатной температуре. Добавляли цианид натрия (191 ммоль) и смесь перемешивали в течение ночи при 60 С. Смесь фильтровали и фильтрат экстрагировали смесью AcOEt/вода. Неочищенный продукт концентрировали и использовали без дополнительной очистки на следующей стадии (примеры 10 и 20). Пример 10. 5-Амино-N-метилпентан-1-сульфонамид Смесь 4-циано-N-метилбутан-1-сульфонамида (пример 9; 91,2 ммоль) и Pd/C (10% моль, 1 г) в смеси метанол/7 н. NH3 (180 мл) помещали в атмосферу водорода. Смесь перемешивали в течение ночи при комнатной температуре. Смесь фильтровали и концентрировали. Неочищенный продукт использовали на- 15019558 следующей стадии без дополнительной очистки. Пример 11. трет-Бутил 5-(N-метилсульфамоил)пентилкарбамат К раствору 5-амино-N-метилпентан-1-сульфонамида (пример 10; 42,6 ммоль) в дихлорметане (92 мл) порциями добавляли Вос 2 О (42,6 ммоль). Смесь перемешивали в течение ночи при комнатной температуре. Неочищенный продукт концентрировали и очищали колоночной хроматографией(CH2Cl2:MeOH 100:1) с получением требуемого соединения с выходом 50%. Пример 12. Метил 5-бром-8-(тозилокси)-1,6-нафтиридин-7-карбоксилат Триэтиламин (15,9 ммоль) добавляли к суспензии метил 5-бром-8-гидрокси-1,6-нафтиридин-7 карбоксилата (10,6 ммоль) в хлороформе (22 мл) в течение 5 мин при температуре 20-50 С. Тозилхлорид(12,7 ммоль) добавляли в течение 5 мин при поддержании температуры при 40 С в течение 2 ч. Смесь охлаждали до 20 С в течение 15 мин. МеОН добавляли в течение 30 мин, затем смесь MeOH:вода добавляли в течение 30 мин. Полученное в результате кристаллическое не совсем белое твердое вещество отделяли фильтрованием и сушили с получением требуемого соединения с выходом 50%. Пример 13. Метил 8-(бензилокси)-5-(пиперазин-1-ил)-1,6-нафтиридин-7- карбоксилат Диизопропилэтиламин (42,9 ммоль) добавляли к раствору метил 8-(бензилокси)-5-бром-1,6 нафтиридин-7-карбоксилата (пример 1; 10,7 ммоль) в DMA (270 мл) при комнатной температуре. Реакцию перемешивали в течение 5 мин. Добавляли пиперазин (16,1 ммоль) и реакционную смесь нагревали при 110 С в течение 12 ч. Реакцию охлаждали, добавляли воду и этилацетат. Органический слой отделяли и промывали водой(2) и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и выпаривали. Осадок очищали флэш-хроматографией на SiO2 (гексаны/AcOEt 10:1-1:1) с получением указанного в заголовке соединения (1,5 г) в виде бледно-желтого твердого вещества. Пример 14. трет-Бутил 2-(бензилокси)-4-фторбензилкарбамат(2-(Бензилокси)-4-фторфенил)метанамин растворяли в 1,4-диоксане (22 мл). Добавляли воду (6 мл) и 1 М раствор Na2CO3 (55 мл). Реакционную смесь охлаждали до температуры 0 С. Добавляли по каплямBoc2O. Полученной в результате смеси давали нагреться до комнатной температуры и перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь фильтровали и промывали CH2Cl2 и водой (2). Фазы разделяли и органический слой сушили над MgSO4, фильтровали и концентрировали с получением неочищенного требуемого соединения в виде желтого твердого вещества (5,75 г). Указанное вещество объединяли с порциями из отдельных экспериментов и затем очищали колоночной хроматографией на SiO2 (гексаны/AcOEt, 8/1, по объему) с получением требуемого соединения (чистота 97%) в виде бесцветного твердого вещества. Пример 15. трет-Бутил 4-фтор-2-гидроксибензилкарбамат Раствор трет-бутил-2-(бензилокси)-4-фторбензилкарбамата (пример 14; 9 ммоль) в EtOH (80 мл) и этилацетате (240 мл) обрабатывали в атмосфере водорода (1 атм) при 25 С 10% Pd/C (0,4 г) в течение 24 ч. Катализатор удаляли фильтрованием через целит, промывали EtOH и фильтрат концентрировали с получением указанного в заголовке соединения (2,2 г) в виде желтого твердого вещества. Пример 16. Этил-5-(2-трет-бутоксикарбониламино)метил)-5-фторфенокси)пентаноат Этил-5-бромпентаноат (14,9 ммоль) добавляли по каплям в течение 15 мин к смеси трет-бутил-4 фтор-2-гидроксибензилкарбамата (пример 15; 12,4 ммоль) и карбоната калия (16,1 ммоль) в DMA (37 мл). Реакцию нагревали при 60 С в течение 4 ч с последующим добавлением дополнительного количества этил-5-бромпентаноата (4,5 ммоль) и карбоната калия (4,8 ммоль) и нагревали при температуре 60 С в течение 2 ч. Растворитель выпаривали. Осадок забирали в AcOEt и фильтровали. Фильтрат промывалиAcOEt (3) и концентрировали в вакууме. Осадок очищали колоночной хроматографией на SiO2 (гексаны/AcOEt, 8/1, по объему) с получением требуемого соединения (4,1 г, чистота 96%). Пример 17. 5-(2-трет-Бутоксикарбониламино)метил)-5-фторфенокси)пентановая кислота Этил-5-(2-трет-бутоксикарбониламино)метил)-5-фторфенокси)пентаноат (пример 16; 1,6 ммоль) растворяли в смеси ТГФ (6 мл), метанола (6 мл) и воды (6 мл). Добавляли гидроксид натрия (5,0 ммоль) и перемешивали в течение 2 ч. Органический растворитель удаляли в вакууме и водный остаток подкисляли 1 н. HCl до достижения рН 3. Смесь экстрагировали этилацетатом и органическую фазу удаляли в вакууме с получением указанного в заголовке соединения (0,55 г), которое использовали без дополнительной обработки на следующей стадии (пример 5.1). Пример 18. 4-Йод-N-метилбутан-1-сульфонамид Соединение в ацетоне (600 мл) перемешивали при кипячении с обратным холодильником в течение ночи. Смеси давали охлаждаться до комнатной температуры и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения (40 г), которое использовали без дополнительной обработки на следующей стадии (пример 19). Пример 19. трет-Бутил 4-фтор-2-(4-(N-метилсульфамоил)бутокси)бензилкарбамат Смесь трет-бутил-4-фтор-2-гидроксибензилкарбамата (пример 15; 12,2 ммоль), 4-йод-Nметилбутан-1-сульфонамида (пример 18; 18,3 ммоль) и карбоната калия (61 ммоль) в ДМФА (60 мл) перемешивали при температуре 80 С в течение 10 ч. Реакционную смесь фильтровали и осадок промывали этилацетатом. Фильтрат концентрировали и добавляли воду. Смесь экстрагировали простым эфиром и органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали с получением неочищенного продукта. Неочищенный продукт объединяли с другой порцией из отдельного эксперимента и затем очищали препаративной высокоэффективной жидкостной хроматографией с обращенно-фазовой(элюент: МеОН/Н 2 О от 50/50 до 80/20, 0,1% CF3COOH). Собирали очищенные фракции и добавляли на- 17019558 сыщенный раствор NaHCO3. Растворитель концентрировали в вакууме и затем экстрагировали дихлорметаном. Органический слой сушили над MgSO4, фильтровали и концентрировали с получением требуемого соединения (1,1 г, выход 13%). Пример 20. 5-(N-Метилсульфамоил)пентановая кислота Смесь 4-циано-N-метилбутан-1-сульфонамида (пример 9; 100 ммоль), уксусной кислоты (100 мл) и концентрированной хлористо-водородной кислоты (100 мл) кипятили с обратным холодильником в течение 5 ч и затем концентрировали в вакууме. Осадок забирали в ТГФ и затем отфильтровывали. Фильтрат концентрировали и осадок промывали дихлорметаном с получением очищенного продукта (11 г; выход 58%). Пример 21. 5-Гидрокси-N-метилпентан-1-сульфонамид К охлажденному раствору 5-(N-метилсульфамоил)пентановой кислоты (пример 20; 26 ммоль) в ТГФ (50 мл) добавляли раствор боргидрида в ТГФ (77 ммоль) при 0 С. Реакционной смеси давали нагреться до комнатной температуры и кипятили с обратным холодильником в течение 3 ч. Добавляли метанол и смесь концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали колоночной флэш-хроматографией (SiO2; элюент: петролейный эфир/этилацетат от 100/0 до 20/80) с получением очищенного указанного в заголовке соединения (1,2 г; выход 26%). Пример 22. 5-(N-Метилсульфамоил)пентил-4-метилбензолсульфонат(19,2 ммоль) в ТГФ (15 мл) добавляли паратолуолсульфонилхлорид (5,9 ммоль) в ТГФ (5 мл) при комнатной температуре и реакционную смесь перемешивали в течение 10 ч. Реакционную смесь промывали насыщенным раствором NaHCO3 и затем насыщенным раствором соли. Органический слой сушили надMgSO4, фильтровали и концентрировали. Осадок очищали колоночной флэш-хроматографией (SiO2; элюент: петролейный эфир/этилацетат от 100/0 до 50/50) с получением очищенного указанного в заголовке соединения (0,9 г; выход 41%). Пример 23. трет-Бутил-4-фтор-2-(5-(N-метилсульфамоил)пентилокси)бензилкарбамат(20 мл) перемешивали при температуре 50 С в атмосфере азота в течение 2 ч. Реакционную смесь забирали в дихлорметан и фильтровали. Фильтрат промывали насыщенным раствором NaHCO3 и насыщенным раствором соли. Органический слой концентрировали в вакууме и затем добавляли метил-третбутиловый эфир. Смесь промывали насыщенным раствором соли и органический слой сушили надMgSO4, фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали колоночной флэш-хроматографией (SiO2; элюент: петролейный эфир/этилацетат, от 100/0 до 50/50) с получением очищенного указанного в заголовке соединения (0,7 г; выход 82%). Пример 1.1. Метил 8-(бензилокси)-5-(6-(трет-бутоксикарбониламино)гексиламино)-1,6-нафтиридин-7-карбоксилат Метил 8-(бензилокси)-5-бром-1,6-нафтиридин-7-карбоксилат (пример 1; 5,50 г; 14,7 ммоль) растворяли в DMA (300 мл). Добавляли DIPEA (5,14 мл; 29,5 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 5 мин при комнатной температуре. Добавляли трет-бутил 6 аминогексилкарбамат (4,95 мл; 22,1 ммоль) и реакционную смесь перемешивали при температуре 100 С в течение 12 ч. Реакционную смесь охлаждали. Добавляли воду и этилацетат. Органический слой отделяли и промывали водой (2) и насыщенным раствором соли. Органический слой сушили (MgSO4),фильтровали и растворитель выпаривали. Осадок очищали колоночной флэш-хроматографией на силикагеле (элюент: гексан/EtOAc, от 10:1 до 1:1). Фракции продукта собирали и растворитель выпаривали. Выход: 33%; бледно-желтое твердое вещество. Пример 1.2. 8-(Бензилокси)-5-(6-(трет-бутоксикарбониламино)гексиламино)-1,6-нафтиридин-7 карбоновая кислота(100 мг; 2,7 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Добавляли Н 2 О и 2 н. HCl до достижения рН 4-5. Смесь экстрагировали EtOAc 8-(Бензилокси)-5-(6-(трет-бутоксикарбониламино)гексиламино)-1,6-нафтиридин-7-карбоновую кислоту (пример 1.2; 0,42 г; 0,85 ммоль) растворяли в дихлорметане (9 мл). Добавляли DIPEA (0,58 мл; 3,42 ммоль) и HBTU (0,39 г; 1,03 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 мин. Гидрохлорид этил-2-(аминометил)-5-фторбензоата (пример 4; 0,24 г; 1,03 ммоль) добавляли порциями при комнатной температуре. Смесь перемешивали в течение ночи при комнатной температуре. Смесь разбавляли CH2Cl2 и промывали насыщенном водным раствором Na2CO3 (2) и H2O. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали. Осадок очищали колоночной флэш-хроматографией на силикагеле (элюент: гексан/EtOAc, от 10:1 до 1:1). Фракции собирали и растворитель выпаривали. Выход: 0,643 г. Пример 1.4. 2-8-(Бензилокси)-5-(6-(трет-бутоксикарбониламино)гексиламино)-1,6-нафтиридин-7 карбоксамидо)метил)-5-фторбензойная кислота Этил-2-8-(бензилокси)-5-(6-(трет-бутоксикарбониламино)гексиламино)-1,6-нафтиридин-7- 19019558 карбоксамидо)метил)-5-фторбензоат (пример 1.3; 0,64 г; 0,96 ммоль) растворяли в этаноле (4 мл). 1 н. Раствор NaOH (1,5 мл) добавляли при комнатной температуре. После завершения реакции добавляли 1 н.HCl до достижения рН 2-3. Растворитель выпаривали при пониженном давлении. Осадок забирали вEtOAc и промывали Н 2 О и насыщенным раствором соли. Органический слой отделяли, сушили (MgSO4),фильтровали и растворитель выпаривали при пониженном давлении. Выход: 0,592 г (96%; использовали на следующей стадии реакции без дополнительной очистки). Пример 1.5. 2-5-(6-Аминогексиламино)-8-(бензилокси)-1,6-нафтиридин-7-карбоксамидо)метил)-5 фторбензойная кислота в виде соли TFA 2-8-(Бензилокси)-5-(6-(трет-бутоксикарбониламино)гексиламино)-1,6-нафтиридин-7-карбоксамидо)метил)-5-фторбензойную кислоту (пример 1.4; 0,48 г; 0,74 ммоль) растворяли в дихлорметане (4 мл) и охлаждали до 0 С. Полученный ранее раствор добавляли к указанному холодному раствору и реакционную смесь перемешивали и постепенно нагревали от 0 С до комнатной температуры в течение 1 ч. Растворитель выпаривали при пониженном давлении и осадок отгоняли азеотропно с толуолом (2). Полученный осадок сушили в высоком вакууме и использовали на следующей стадии без дополнительной очистки. Выход: 0,420 г (96%). Пример 1.6. Макроциклизация Раствор 2-5-(6-аминогексиламино)-8-(бензилокси)-1,6-нафтиридин-7-карбоксамидо)метил)-5 фторбензойной кислоты в виде соли TFA (пример 1,5; 0,42 г; 0,74 ммоль) в ДМФА (40 мл) медленно добавляли к раствору HBTU (0,84 г; 2,22 ммоль) и DIPEA (3,77 мл; 22,2 ммоль) в ДМФА (150 мл) при комнатной температуре в течение 4 ч. Реакционную смесь концентрировали. Добавляли NH4OH (3 мл) и смесь перемешивали в течение 30 мин при комнатной температуре. Растворитель выпаривали досуха. Осадок распределяли между дихлорметаном и насыщенным водным раствором NaHCO3 (2). Слои разделяли. Органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Неочищенное вещество очищали колоночной флэш-хроматографией на силикагеле (элюент: CH2Cl2/MeOH, от 80:1 до 20:1). Фракции продукта собирали и растворитель выпаривали. Осадок растирали с ацетонитрилом, продукт отделяли фильтрованием и сушили. Выход: 0,080 г (бесцветные кристаллы). Пример 2.1. Метил 5-(5-(трет-бутоксикарбониламино)-N-метилпентилсульфонамидо)-8(тозилокси)-1,6-нафтиридин-7-карбоксилат Смесь метил 5-бром-8-(тозилокси)-1,6-нафтиридин-7-карбоксилата (пример 12; 10,3 ммоль), трет- 20019558 бутил 5-(N-метилсульфамоил)пентилкарбамата (пример 11; 12,4 ммоль), 2,2'-бипиридина (12,4 ммоль) и оксида меди(I) (12,4 ммоль) в ДМФА (22 мл) дегазировали путем перемешивания в токе азота в течение 1 мин и нагревали при 120 С в течение 4 ч. Суспензия коричневого цвета превращалась в темно-красный раствор с малым количеством нерастворенного оксида меди(I). Смесь разбавляли хлороформом, добавляли целит и полученную смесь фильтровали через плотный слой целита. Плотный слой промывали хлороформом и объединенные фильтраты энергично перемешивали с раствором EDTA в воде при медленном барботировании азота в течение 30 мин. Верхняя водная фаза приобретала зеленую окраску по мере того, как нижняя органическая фаза приобретала желтую окраску. Органическую фазу промывали раствором EDTA в воде. Органические фазы сушили над MgSO4 и концентрировали. Осадок очищали колоночной хроматографией на SiO2 (гексаны:этилацетат, от 5:1 до 1:1) с получением целевого продукта с выходом 70%. Пример 2.2. Метил 5-(5-(трет-бутоксикарбониламино)-N-метилпентилсульфонамидо)-8-гидрокси 1,6-нафтиридин-7-карбоксилат Метил 5-(5-(трет-бутоксикарбониламино)-N-метилпентилсульфонамидо)-8-(тозилокси)-1,6-нафтиридин-7-карбоксилат (пример 2.1; 8,68 ммоль) растворяли в ДМФА (17 мл) при температуре 40 С и переносили в 33% раствор NaOMe в МеОН (4,1 мл; 21,7 ммоль) в течение 1-2 мин при 25 С. Полученную в результате желтую гомогенную смесь нагревали до 50 С. Смесь охлаждали до 25 С в течение 15 мин и выдерживали при 25 С в течение 15 мин. Добавляли уксусную кислоту (1 мл) в течение 1 мин, затем добавляли воду. Суспензию выдерживали в течение 30 мин и фильтровали. Отфильтрованный осадок промывали водой и сушили с получением требуемого соединения с выходом 61%. Пример 2.3. Метил 8-(бензилокси)-5-(5-(трет-бутоксикарбониламино)-N-метилпентилсульфонамидо)-1,6-нафтиридин-7-карбоксилат К суспензии метил 5-(5-(трет-бутоксикарбониламино)-N-метилпентилсульфонамидо)-8-гидрокси 1,6-нафтиридин-7-карбоксилата (пример 2.2; 5,44 ммоль) и Cs2CO3 (10,9 ммоль) в ДМФА (11 мл) добавляли бензилбромид (10,9 ммоль). Смесь перемешивали в течение ночи. Неочищенную смесь экстрагировали смесью AcOEt/вода, сушили над MgSO4 и концентрировали. Продукт очищали колоночной хроматографией на SiO2 (AcOEt:гексаны, 1:1) с получением требуемого соединения с выходом 75%. Пример 2.4. 8-(Бензилокси)-5-(5-(трет-бутоксикарбониламино)-N-метилпентилсульфонамидо)-1,6 нафтиридин-7-карбоновая кислота К раствору метил 8-(бензилокси)-5-(5-(трет-бутоксикарбониламино)-N-метилпентилсульфонамидо)-1,6-нафтиридин-7-карбоксилата (пример 2.3; 4,05ммоль) в метаноле (8 мл) и воде (8 мл) при комнатной температуре добавляли гидроксид натрия (16,2 ммоль). Реакцию нагревали при 50 С. Добавляли этилацетат и водную фазу обрабатывали 1 н. HCl до достижения рН 6-7. Снова добавляли этилацетат, слои разделяли и органическую фазу сушили над MgSO4 и концентрировали. Получали неочищенный продукт с выходом 94%, который использовали на следующей стадии без дополнительной очистки.(4,58 ммоль) и DIPEA (15,8 ммоль). Смесь перемешивали в течение 5 мин при комнатной температуре. Гидрохлорид этил-2-(аминометил)-5-фторбензоата (пример 4; 4,58 ммоль) добавляли порциями при комнатной температуре. Смесь перемешивали в течение ночи при комнатной температуре. Продукт экстрагировали CH2Cl2, сушили над MgSO4 и концентрировали. Неочищенный продукт очищали колоночной хроматографией на SiO2 (AcOEt:гексаны, 1:1) с получением требуемого соединения с выходом 71%. Пример 2.6. 2-5-(5-Амино-N-метилпентилсульфонамидо)-8-гидрокси-1,6-нафтиридин-7-карбоксамидо)метил)-5-фторбензойная кислота в виде соли HCl К раствору этил 2-8-(бензилокси)-5-(5-(трет-бутоксикарбониламино)-N-метилпентилсульфонамидо)-1,6-нафтиридин-7-карбоксамидо)метил)-5-фторбензоата (пример 2.5; 2,71 ммоль) в этаноле добавляли концентрированную HCl (37%; 1,1 мл) при комнатной температуре. Реакционную смесь нагревали при 100 С в течение 3 дней. Растворитель выпаривали и неочищенный продукт использовали на следующей стадии без дополнительной очистки. Пример 3.1. Метил 5-(4-(трет-бутоксикарбониламино)-N-метилбутилсульфонамидо)-8-(тозилокси)1,6-нафтиридин-7-карбоксилат Указанное в заголовке соединение получали аналогично способу, описанному в примере 2,1, начиная с метил 5-бром-8-(тозилокси)-1,6-нафтиридин-7-карбоксилата (пример 12; 10,3 ммоль) и трет-бутил 4-(N-метилсульфамоил)бутилкарбамата (пример 8), с получением требуемого соединения (3,43 г). Пример 3.2. Метил 5-(4-амино-N-метилбутилсульфонамидо)-8-(тозилокси)-1,6-нафтиридин-7 карбоксилат- 22019558 К раствору метил 5-(4-(трет-бутоксикарбониламино)-N-метилбутилсульфонамидо)-8-(тозилокси)1,6-нафтиридин-7-карбоксилата (пример 3,1; 5,52 ммоль) в дихлорметане (5 мл) добавляли трифторуксусную кислоту (5 мл) при 0 С. После добавления реакционную смесь нагревали до комнатной температуры. Растворитель выпаривали и осадок забирали в толуол (3). Полученный в результате осадок сушили в вакууме и использовали на следующей стадии (пример 3.3) без дополнительной очистки. Пример 3.3. Метил 5-(4-(2-трет-бутоксикарбониламино)метил)-5-фторбензамидо)-N-метилбутилсульфонамидо)-8-(тозилокси)-1,6-нафтиридин-7-карбоксилат(5,63 ммоль). Смесь перемешивали в течение 5 мин при комнатной температуре. 2-третБутоксикарбониламино)метил)-5-фторбензойную кислоту (4,69 ммоль) добавляли порциями при комнатной температуре. Смесь перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали. Осадок промывали 1M раствором Na2CO3. Водную фазу экстрагировали дихлорметаном, сушили и концентрировали. Неочищенный продукт очищали колоночной хроматографией на SiO2 (гексаны:этилацетат от 5:1 до 1:1) с получением требуемого соединения с выходом 49%. Пример 3.4. 5-(4-(2-трет-Бутоксикарбониламино)метил)-5-фторбензамидо)-N-метилбутилсульфонамидо)-8-(тозилокси)-1,6-нафтиридин-7-карбоновая кислота К раствору метил 5-(4-(2-трет-бутоксикарбониламино)метил)-5-фторбензамидо)-N-метилбутилсульфонамидо)-8-(тозилокси)-1,6-нафтиридин-7-карбоксилата (пример 3.3; 2,75 ммоль) в смеси ТГФ и воды (5,5 мл) (1:1) добавляли гидроксид лития (4,13 ммоль) при комнатной температуре. После завершения реакции добавляли этилацетат и воду. Водный слой обрабатывали 1 н. HCl до достижения рН 5-6. Водный слой экстрагировали этилацетатом. Органический слой сушили над MgSO4 и концентрировали с получением требуемого соединения с выходом 41%. Пример 3.5. 5-(4-(2-(Аминометил)-5-фторбензамидо)-N-метилбутилсульфонамидо)-8-(тозилокси)1,6-нафтиридин-7-карбоновая кислота в виде соли TFA- 23019558 Указанное в заголовке соединение получали аналогично способу, описанному в примере 3.2, начиная с 5-(4-(2-трет-бутоксикарбониламино)метил)-5-фторбензамидо)-N-метилбутилсульфонамидо)-8(тозилокси)-1,6-нафтиридин-7-карбоновой кислоты (пример 3.4; 1,1 ммоль). Пример 3.6. Макроциклизация Целевое соединение получали аналогично способу, описанному в примере 1.6, начиная с 5-(4-(2(аминометил)-5-фторбензамидо)-N-метилбутилсульфонамидо)-8-(тозилокси)-1,6-нафтиридин-7 карбоновой кислоты в виде соли TFA (пример 3.5; 1,57 ммоль). Неочищенный продукт не подвергали очистке и непосредственно использовали на стадии удаления защитной группы (соединение 7). Пример 4.1. Метил 8-(бензилокси)-5-(4-(4-(трет-бутоксикарбониламино)бутил)пиперазин-1-ил)-1,6 нафтиридин-7-карбоксилат К раствору метил 8-(бензилокси)-5-(пиперазин-1-ил)-1,6-нафтиридин-7-карбоксилата (пример 13; 1,3 ммоль) в DMA (10 мл) добавляли карбонат калия (2,6 ммоль) с последующим добавлением третбутил-4-бромбутилкарбамата (1,3 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Добавляли воду и этилацетат. Объединенный органический слой промывали водой,сушили над MgSO4, фильтровали и концентрировали с получением неочищенного требуемого соединения (0,89 г). Пример 4.2. 8-(Бензилокси)-5-(4-(4-(трет-бутоксикарбониламино)бутил)пиперазин-1-ил)-1,6 нафтиридин-7-карбоновая кислота К раствору метил 8-(бензилокси)-5-(4-(4-(трет-бутоксикарбониламино)бутил)пиперазин-1-ил)-1,6 нафтиридин-7-карбоксилата (пример 4.1; 1,2 ммоль) в смеси метанола (2,5 мл) и воды (2,5 мл) добавляли гидроксид натрия (2,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакцию гасили водой и 2 н. HCl до достижения рН 6. Смесь экстрагировали AcOEt (2). Органический слой сушили (MgSO4) и фильтровали с получением твердого вещества (400 мг), которое использовали без дополнительной обработки на следующей стадии. Пример 4.3. Этил 2-8-(бензилокси)-5-(4-(4-(трет-бутоксикарбониламино)бутил)пиперазин-1-ил)1,6-нафтиридин-7-карбоксамидо)метил)-5-фторбензоат- 24019558 8-(Бензилокси)-5-(4-(4-(трет-бутоксикарбониламино)бутил)пиперазин-1-ил)-1,6-нафтиридин-7 карбоновую кислоту (пример 4.2; 1,4 ммоль) растворяли в дихлорметане (14 мл). Добавляли DIPEA (5,4 ммоль) и HBTU (1,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 мин. Гидрохлорид этил-2-(аминометил)-5-фторбензоата (пример 4; 1,6 ммоль) добавляли порциями при комнатной температуре. Смесь перемешивали в течение ночи при комнатной температуре. Смесь разбавляли CH2Cl2 и промывали насыщенным водным раствором Na2CO3 (2) и H2O. Органический слой отделяли, сушили (MgSO4), фильтровали и выпаривали. Осадок очищали колоночной флэшхроматографией на силикагеле (элюент: гексан/EtOAc от 10:1 до 1:1), с получением 0,97 г указанного в заголовке соединения. Пример 4.4. 2-8-(Бензилокси)-5-(4-(4-(трет-бутоксикарбониламино)бутил)пиперазин-1-ил)-1,6 нафтиридин-7-карбоксамидо)метил)-5-фторбензойная кислота(4,5 мл). Твердый гидрат LiOH (1,6 ммоль) добавляли при комнатной температуре. Реакционную смесь перемешивали в течение 24 ч, затем добавляли 2 н. HCl до достижения рН 6-7. Смесь экстрагировали дважды EtOAc и объединенные органические фракции сушили над сульфатом магния. Неочищенное вещество, содержащее указанное в заголовке соединение (0,27 г), использовали без дополнительной обработки на следующей стадии. Пример 4.5. 2-5-(4-(4-Аминобутил)пиперазин-1-ил)-8-гидрокси-1,6-нафтиридин-7-карбоксамидо) метил)-5-фторбензойная кислота в виде соли TFA(1,6 мл) и охлаждали до температуры 0 С. Смесь TFA (1,6 мл) и дихлорметана (1,6 мл) добавляли к указанному холодному раствору, реакционную смесь перемешивали и постепенно нагревали от 0 С до комнатной температурой в течение 1 ч. Растворитель выпаривали при пониженном давлении и осадок азеотропно отгоняли с толуолом (2). Полученный в результате осадок (0,42 г) сушили при высоком вакууме и использовали на следующей стадии (соединение 8) без дополнительной очистки. Пример 5.1. Метил 8-(бензилокси)-5-(4-(5-(2-трет-бутоксикарбониламино)метил)-5-фторфенокси) пентаноил)пиперазин-1-ил)-1,6-нафтиридин-7-карбоксилат К раствору метил 8-(бензилокси)-5-(пиперазин-1-ил)-1,6-нафтиридин-7-карбоксилата (пример 13; 1,3 ммоль), 5-(2-трет-бутоксикарбониламино)метил)-5-фторфенокси)пентановой кислоты (пример 17; 1,6 ммоль) и диизопропилэтиламина (3,9 ммоль) в дихлорметане (10 мл) добавляли HBTU (2,0 ммоль). Смесь перемешивали в течение ночи. Смесь промывали насыщенным раствором NaHCO3, 10% лимонной кислотой и насыщенным раствором соли и сушили над Na2SO4. Растворитель удаляли в вакууме. Осадок очищали колоночной флэш-хроматографией на SiO2 (элюент: метанол/CH2Cl2, 1:100) с получением ука- 25019558 занного в заголовке соединения (800 мг). Пример 5.2. 8-(Бензилокси)-5-(4-(5-(2-трет-бутоксикарбониламино)метил)-5-фторфенокси)пентаноил)пиперазин-1-ил)-1,6-нафтиридин-7-карбоновая кислота Метил 8-(бензилокси)-5-(4-(5-(2-трет-бутоксикарбониламино)метил)-5-фторфенокси)пентаноил) пиперазин-1-ил)-1,6-нафтиридин-7-карбоксилат (пример 5.1; 1,1 ммоль) растворяли в смеси ТГФ (6 мл),метанола (6 мл) и воды (6 мл). Гидроксид натрия (7,5 ммоль) добавляли и перемешивали в течение 2 дней. Органический растворитель удаляли в вакууме и осадок промывали диэтиловым эфиром. Водный остаток подкисляли 1 н. HCl до рН 8-9. Смесь промывали этилацетатом. Водную фазу подкисляли 1 н.HCl до рН 3-4. Смесь экстрагировали этилацетатом и органический слой промывали насыщенным раствором соли и сушили над Na2SO4. Растворитель удаляли в вакууме с получением указанного в заголовке соединения (0,4 г), которое использовали без дополнительной обработки на следующей стадии. Пример 5.3. 5-(4-(5-(2-(Аминометил)-5-фторфенокси)пентаноил)пиперазин-1-ил)-8-(бензилокси)1,6-нафтиридин-7-карбоновая кислота в виде соли TFA Указанное в заголовке соединение получали аналогично способу, описанному в примере 1.5, из 8(бензилокси)-5-(4-(5-(2-трет-бутоксикарбониламино)метил)-5-фторфенокси)пентаноил)пиперазин-1 ил)-1,6-нафтиридин-7-карбоновой кислоты (пример 5.2). Пример 5.4. Макроциклизация 5-(4-(5-(2-(аминометил)-5-фторфенокси)пентаноил)пиперазин-1-ил)8-(бензилокси)-1,6-нафтиридин-7-карбоновой кислоты в виде соли TFA(1,8 ммоль) в ДМФА (20 мл) добавляли по каплям к смеси пентафторфенилдифенилфосфината (0,71 ммоль) и диизопропилэтиламина (0,4 мл) в диизопропилэтиламине (1,8 ммоль) в ДМФА (140 мл) в течение 30 мин. Смесь перемешивали в течение 36 ч при комнатной температуре. Растворитель удаляли в вакууме и осадок растворяли в CH2Cl2, промывали насыщенным раствором NaHCO3, 10% лимонной кислотой, насыщенным раствором NaHCO3 и насыщенным раствором соли и сушили над Na2SO4. Растворитель удаляли в вакууме и твердый осадок промывали простым эфиром с получением 300 мг порошка,который использовали без дополнительной обработки на следующей стадии (соединение 10). Пример 6.1. Метил 5-(4-(2-трет-бутоксикарбониламино)метил)-5-фторфенокси)-N-метилбутилсульфонамидо)-8-метокси-1,6-нафтиридин-7-карбоксилат Смесь метил 5-бром-8-метокси-1,6-нафтиридин-7-карбоксилата (2,4 ммоль), трет-бутил 4-фтор-2(4-(N-метилсульфамоил)бутокси)бензилкарбамата (пример 19; 2,6 ммоль), 2,2'-бипиридина (3,1 ммоль) и оксида меди(I) (3,1 ммоль) в NMP (30 мл) перемешивали при температуре 120 С в атмосфере азота в течение 10 ч. Реакционную смесь разбавляли дихлорметаном и фильтровали. Фильтрат промывали 10% раствором динатриевой соли 2-[2-(бис(карбоксилатометил)амино)этил(карбоксилатометил)амино]ацетата (EDTA), насыщенным раствором NaHCO3 и насыщенным раствором соли. Органический слой концентрировали в вакууме и затем добавляли метил-трет-бутиловый эфир. Смесь промывали насыщенным раствором соли и органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали колоночной флэш-хроматографией на SiO2 (элюент: петролейный эфир/этилацетат от 100/0 до 60/40) с получением указанного в заголовке соединения (0,48 г, выход 30%). Пример 6.2 Указанное в заголовке соединение получали в 3 стадии из метил 5-(4-(2-третбутоксикарбониламино)метил)-5-фторфенокси)-N-метилбутилсульфонамидо)-8-метокси-1,6-нафтиридин-7-карбоксилата (пример 6.1), аналогично способам, описанным в примерах 5.2; 5.3 и 5.4. Пример 7.1. Метил 5-(5-(2-трет-бутоксикарбониламино)метил)-5-фторфенокси)-N-метилпентилсульфонамидо)-8-метокси-1,6-нафтиридин-7-карбоксилат Указанное в заголовке соединение получали аналогично способу, описанному в примере 6.1, с использованием трет-бутил-4-фтор-2-(5-(N-метилсульфамоил)пентилокси)бензилкарбамата (пример 23) и 5-бром-8-метокси-1,6-нафтиридин-7-карбоксилата. Пример 7.2 Указанное в заголовке соединение получали в 3 стадии из метил 5-(5-(2-третбутоксикарбониламино)метил)-5-фторфенокси)-N-метилпентилсульфонамидо)-8-метокси-1,6-нафтиридин-7-карбоксилата (пример 7.1) аналогично способам, описанным в примерах 5.2; 5.3 и 5.4. Соединение 1- 27019558 Макроцикл из примера 1.6 (80 мг; 0,15 ммоль) растворяли в 4 н. HCl в 1,4-диоксане (5 мл) и смесь нагревали при 40 С в течение 1 ч. Реакционную смесь концентрировали в вакууме. Осадок растирали с метанолом и твердый продукт отфильтровывали и сушили. Выход: 0,055 г (99%; чистота по результатам ВЭЖХ: 96%), выделен в виде соли HCl. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,25-1,65 (м, 8 Н), 3,44 (ушир.с, 4 Н), 4,70 (д, J=5,3 Гц, 2 Н), 7,58 Содержащий O-бензильную группу в качестве защитной группы предшественник соединения 2 получали аналогично способу, описанному для примеров 1.1-1.6, начиная с метил 8-(бензилокси)-5-бром 1,6-нафтиридин-7-карбоксилата (пример 1) и N-трет-бутоксикарбонил-1,3-диаминопропана. Удаление бензильной группы с получением соединения 2 осуществляли, как следует далее. Предшественник макроцикл, содержащий O-бензильную группу, растворяли в дихлорметане (3,6 мл) и охлаждали до 0 С. К указанной смеси добавляли свежеприготовленный раствор, состоящий из трифторуксусной кислоты (3,6 мл), триизопропилсилана (0,075 мл) и дихлорметана (3,6 мл). Полученной в результате смеси давали нагреться до комнатной температуры в течение 1 ч. Реакционную смесь концентрировали в вакууме. Осадок растворяли в дихлорметане и промывали насыщенным раствором NaHCO3. Водную фазу экстрагировали дихлорметаном (2). Объединенные органические слои сушили (MgSO4), фильтровали и растворитель выпаривали. Неочищенное вещество очищали колоночной флэш-хроматографией на силикагеле(элюент: CH2Cl2/MeOH, от 50:1 до 10:1). Фракции продукта собирали и растворитель выпаривали. Осадок растирали с диэтиловым эфиром, продукт отделяли фильтрованием и сушили. Выход: 0,023 г в виде твердого вещества (32%; чистота по результатам ВЭЖХ: 97%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,98 (ушир.с, 2H), 3,34 (ушир.с, 2 Н), 3,40 (ушир.с, 2 Н), 4,78 (д,J=4,5 Гц, 2 Н), 7,31 (т, J=7,5 Гц, 1 Н), 7,39 (д, J=8,6 Гц, 1 Н), 7,55 (т, J=6,3 Гц, 1 Н), 7,69 (дд, J=7,2, 3,7 Гц,1 Н), 7,73 (ушир.с, 1 Н), 8,56-8,72 (м, 2 Н), 9,03 (д, J=3,7 Гц, 1 Н), 9,10 (т, J=5,5 Гц, 1 Н), 11,69 (ушир.с, 1 Н). Соединение 3 Указанное соединение получали аналогично способу, описанному для примеров 1.1-1.6 и соединения 2, начиная с метил 8-(бензилокси)-5-бром-1,6-нафтиридин-7-карбоксилата (пример 1) и N-третбутоксикарбонил-1,3-диаминобутана. Полученное в результате соединение характеризовали ВЭЖХ с обращенной фазой с использованием серийной системы для жидкостной хроматографии Agilent 1100,включающей бинарный насос с дегазатором, автодозатор, термостат колонки и УФ-детектор, с колонкойYMC-Pack ODS-AQ C18 (4,650 мм). Температура колонки составляла 35 С. Скорость потока подвижной фазы поддерживали при 2,6 мл/мин при градиенте от 95% воды и 5% ацетонитрила до 95% ацетонитрила в течение 4,80 мин и выдерживанием в 95% ацетонитриле в течение 1,20 мин. Поток из колонки направляли в MC-спектрометр. MC-детектор был оснащен источником электрораспыления. Напряжение на капилляре составляло 3 кВ, температуру квадруполя поддерживали при 100 С, и температура десольватации составляла 300 С. Азот использовали в качестве распыляющего газа. Масс-спектры получали путем сканирования от 100 до 1400. Объем вводимой пробы составлял 10 мкл. Регистрацию данных осуществляли с помощью системы для сбора данных Agilent Chemstation. Rt (время удерживания): 2,6 мин.; MH+: 410. Указанное соединение получали аналогично способу, описанному для примеров 1.1-1.6 и соединения 1, и выделяли в виде соли HCl, начиная с метил 8-(бензилокси)-5-бром-1,6-нафтиридин-7 карбоксилата (пример 1) и N-трет-бутоксикарбонил-1,3-диаминопентана. 1 Указанное соединение получали аналогично способу, описанному для примеров 1.1-1.6 и соединения 1, начиная с метил 8-(бензилокси)-5-бром-1,6-нафтиридин-7-карбоксилата (пример 1) и N-третбутоксикарбонил-1,3-диаминогептана. Соединение 5 выделяли в виде соли HCl. Полученное в результате соединение описывали по результатам ВЭЖХ с обращенной фазой с использованием способа, описанного для соединения 3. Rt: 3,3 мин. MH+: 452. Соединение 6 К раствору 2-5-(5-амино-N-метилпентилсульфонамидо)-8-гидрокси-1,6-нафтиридин-7-карбоксамидо)метил)-5-фторбензойной кислоты в виде соли HCl (пример 2.6; 1,94 ммоль) в ДМФА (70 мл) медленно добавляли по каплям раствор HBTU (5,77 ммоль) и триэтиламина (58 ммоль) в ДМФА (250 мл) при комнатной температуре. По результатам ВЭЖХ наблюдали полное преобразование. Добавляли раствор NH3 в метаноле. Смесь перемешивали в течение 30 мин при комнатной температуре. Растворитель выпаривали. Осадок очищали хроматографией с обращенной фазой с получением требуемого соединения с выходом 4%. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,38 (квт, J=6,7 Гц, 2 Н), 1,61 (квт, J=6,5 Гц, 2 Н), 1,89 (квт, J=7,2 Гц, 2 Н), 3,31-3,39 (м, 4 Н), 3,41 (с, 3 Н), 4,74 (д, J=6,1 Гц, 2 Н), 7,36 (тд, J=8,6, 2,4 Гц, 1 Н), 7,48 (дд, J=9,7,2,1 Гц, 1 Н), 7,68 (дд, J=8,2, 6,1 Гц, 1 Н), 7,87 (дд, J=8,4, 4,3 Гц, 1 Н), 8,58 (д, J=8,4 Гц, 1 Н), 8,70 (т, J=5,5 Гц,1 Н), 9,17 (д, J=2,7 Гц, 1 Н), 9,64 (т, J=6,0 Гц, 1 Н), 13,65 (ушир.с, 1 Н). Соединение 7 Неочищенный макроцикл, полученный в примере 3.6 (1,6 ммоль), растворяли в ДМФА (8 мл) и переносили в 30% раствор NaOMe в метаноле в течение 1-2 мин при комнатной температуре. Реакцию гасили уксусной кислотой (3 мл), растворитель выпаривали в вакууме и осадок очищали ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения с выходом 14% за последние две стадии. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,70 (квин, J=6,5 Гц, 2 Н), 1,80 (квин, J=7,5 Гц, 2 Н), 3,30-3,35 (м,- 29
МПК / Метки
МПК: C07D 498/22, C07D 471/18, A61P 31/18, C07D 515/18, C07D 498/18, A61K 31/547, C07D 513/18
Метки: макроциклические, ингибиторы, интегразы
Код ссылки
<a href="https://eas.patents.su/30-19558-makrociklicheskie-ingibitory-integrazy.html" rel="bookmark" title="База патентов Евразийского Союза">Макроциклические ингибиторы интегразы</a>
Предыдущий патент: Устройство и способ для обработки табака
Следующий патент: Антивирусное соединение, в частности ингибирующее вич, фармацевтическая композиция на его основе и способ ингибирования с его помощью
Случайный патент: Пульпа, покрытая хитозаном, бумага, полученная с использованием такой пульпы, и способ их получения