Модуляторы ampk (амф-активируемой протеинкиназы)
Номер патента: 19309
Опубликовано: 28.02.2014
Авторы: Раджур Шаранаппа Б., Шан Хайбо, Инь Пан, Пит Нортон П., Салгаонкар Пареш Д., Бернберг Нил С., Вэн Цин Пин, Ким Хва-Ок, Лю Хун
Формула / Реферат
1. Соединение формулы (I)
или его соль, в котором
Х1-Х4 независимо один от другого представляют собой С, CR1 или N, где R1 независимо выбирают из группы, состоящей из водорода, гидрокси, галогена, амино, С1-C10-алкокси, C1-С10-алкилтио, CF3, CN, NO2, N3, CHNOH, C1-C10-алкилсульфонила, ацила, алифатической группы, имеющей от 4 до 12 атомов, фенила, гетероарила или гетероцикла; и
представляет собой гетероарил, где Z представляет собой О, N или NH; и
является фенилом;
и
является фенилом, замещенным по меньшей мере одним гидроксилом; где
каждый гетероарил представляет собой независимо ненасыщенную от 3- до 6-членную гетероциклическую группу, содержащую от 1 до 4 атомов азота; ненасыщенную конденсированную гетероциклическую группу, содержащую от 1 до 5 атомов азота; ненасыщенную 3-6-членную гетеромоноциклическую группу, содержащую атом кислорода; ненасыщенную 3-6-членную гетеромоноциклическую группу, содержащую атом серы; ненасыщенную 3-6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов кислорода и от 1 до 3 атомов азота; ненасыщенную конденсированную гетероциклическую группу, содержащую от 1 до 2 атомов кислорода и от 1 до 3 атомов азота; ненасыщенную 3-6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов серы и от 1 до 3 атомов азота; или ненасыщенную конденсированную гетероциклическую группу, содержащую от 1 до 2 атомов серы и от 1 до 3 атомов азота;
каждый гетероцикл представляет собой независимо насыщенную от 3- до 6-членную гетеромоноциклическую группу, содержащую от 1 до 4 атомов азота; насыщенную от 3- до 6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов кислорода и от 1 до 3 атомов азота; насыщенную от 3- до 6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов серы и от 1 до 3 атомов азота; дигидротиофен; дигидропиран; дигидрофуран или дигидротиазол;
каждый ацил представляет собой (C1-C6)алканоил, (C3-C6)циклоалкилкарбонил, гетероциклический карбонил, бензоил или гетероарилкарбонил; и
каждый алкокси, алкилтио, алкилсульфонил, ацил, алифатическая группа, амино, фенил, гетероарил и гетероциклическая группа является необязательно независимо замещенным одним или более заместителем, выбранным из галогена, C1-C10-алкила, C2-C10-алкенила, C2-C10-алкинила, фенила, гетероциклила, тиола, C1-C10-алкилтио, фенилтио, C1-C10-алкилтио-C1-C10-алкила, фенилтио-C1-C10-алкила, C1-C10-алкилсульфонила, C1-C10-алкилсульфонил-C1-C10-алкила, фенилсульфонил-C1-C10-алкила, C1-C10-алкокси, фенилокси, фенил-C1-C10-алкокси, аминокарбонила, аминокарбонил-C3-C8-циклоалкила, аминокарбонилгетероциклила, С1-С10-алкиламинокарбонила, фениламинокарбонила, С1-C10-алкоксикарбонила, фенилоксикарбонила, гало-C1-C10-алкила, амино, трифторметила, циано, нитро, C1-C10-алкиламино, фениламино, C1-C10-алкиламино-C1-C10-алкила, фениламино-C1-C10-алкила, амино-C1-C10-алкиламино, гидрокси, C1-C10-алкокси-C1-C10-алкила, карбокси-C1-C10-алкила, C1-C10-алкоксикарбонил C1-C10-алкила, аминокарбонил-C1-C10-алкила, ацила, фенил-C1-C10-алкоксикарбонила, карбоновой кислоты, сульфокислоты, сульфонила, фосфоновой кислоты, фенила, гетероарила, гетероциклила и алифатической группы, имеющей от 4 до 12 атомов.
2. Соединение по п.1 формулы
или его соль, в котором R1, R2, R4 и R5 независимо представляют собой водород или одну или более электронодонорных групп; R3 представляет собой водород, -CN, -CHNOH, -CONH2 или -СНО; R6 независимо представляет собой водород, гидрокси, галоген, амино, C1-C10-алкокси, C1-C10-алкилтио, CF3, CN, NO2, N3, CHNOH, C1-C10-алкилсульфонил, фенил, гетероарил или гетероцикл; и каждый R выбирают из Н или гидроксила, где по меньшей мере один R представляет собой гидроксил и где каждый алкокси, алкилтио, алкилсульфонил, амино, фенил, гетероарил и гетероциклическая группа является необязательно независимо замещенным, как определено в п.1.
3. Соединение по п.1, в котором Ar2 представляет собой 2-гидроксифенил или 2,6-дигидроксифенил или его соль.
4. Соединение по п.1 или его соль, в котором Х1-Х4 независимо представляют собой С, CR1 или N, где R1 независимо выбирают из группы, состоящей из водорода, гидрокси, галогена, амино, C1-C10-алкокси, C1-C10-алкилтио, CF3, CN, NO2, N3, C1-C10-алкилсульфонила, ацила, алифатической группы, фенила, гетероарила или гетероцикла; и где каждый алкокси, алкилтио, алкилсульфонил, ацил, алифатическая группа, амино, фенил, гетероарил и гетероциклическая группа является необязательно независимо замещенным, как определено в п.1.
5. Соединение по п.1 формулы (III)
или его соль, в котором Х5-Х16 независимо представляют собой С или CR1, где каждый R1 независимо выбирают из группы, состоящей из водорода, гидрокси, галогена, амино C1-C10-алкокси, C1-C10-алкилтио, CF3, CN, NO2, N3, C1-C10-алкилсульфонила, ацила, алифатической группы, фенила, гетероарила или гетероцикла; при условии, что по меньшей мере один из X11-X16 представляет собой С-ОН; и
выбирают из группы, состоящей из
ив котором Х17-Х21 независимо представляют собой С, CR1 или N; Y4 представляет собой О, N или NH; Y5-Y6 независимо выбирают из группы, состоящей из С, CR1, О, S, N и NH; X1-X4 являются такими, как определено в п.1;
и каждый алкокси, алкилтио, алкилсульфонил, ацил, алифатическая группа, амино, фенил, гетероарил и гетероциклическая группа является необязательно независимо замещенным, как определено в п.1.
6. Соединение по п.1 формулы (IV)
или его соль, в котором
выбирают из группы, состоящей из
ив котором Х17-Х21 независимо представляют собой С, CR1 или N, где каждый R1 представляет собой независимо водород, гидрокси, галоген, амино, C1-C10-алкокси, C1-C10-алкилтио, CF3, CN, NO2, N3, C1-C10-алкилсульфонил, ацил, алифатическую группу, фенил, гетероарил или гетероцикл; Y4 представляет собой О, N или NH; Y5-Y6 независимо выбирают из группы, состоящей из С, CR1, О, S, N или NH; n равняется 1-3; Х1-Х4 являются такими, как определено в п.1;
и где каждый алкокси, алкилтио, алкилсульфонил, ацил, алифатическая группа, амино, фенил, гетероарил и гетероциклическая группа является необязательно независимо замещенным, как определено в п.1.
7. Соединение по п.6 или его соль, в котором один из Х1-Х4 представляет собой С и остальные представляют собой СН.
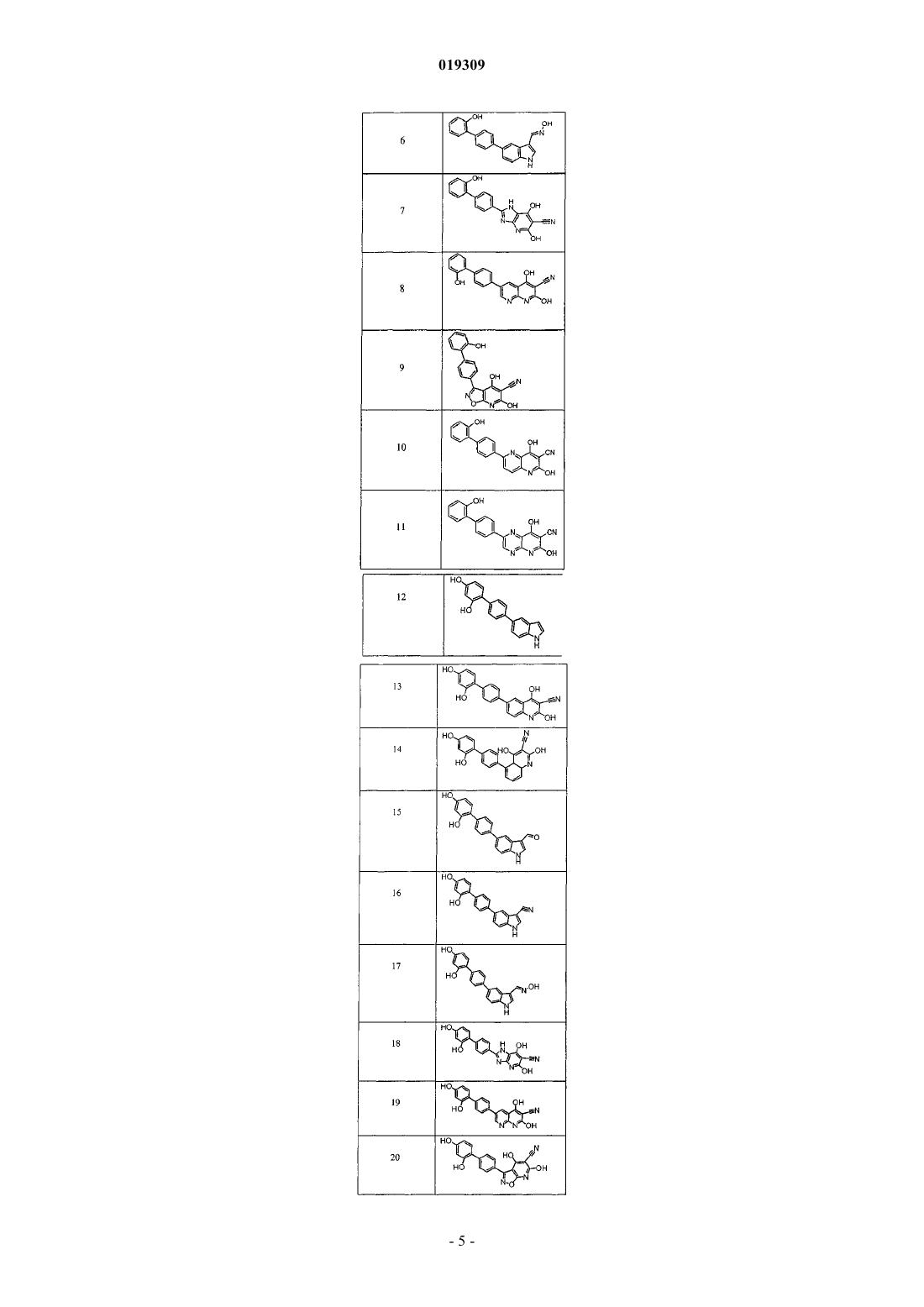
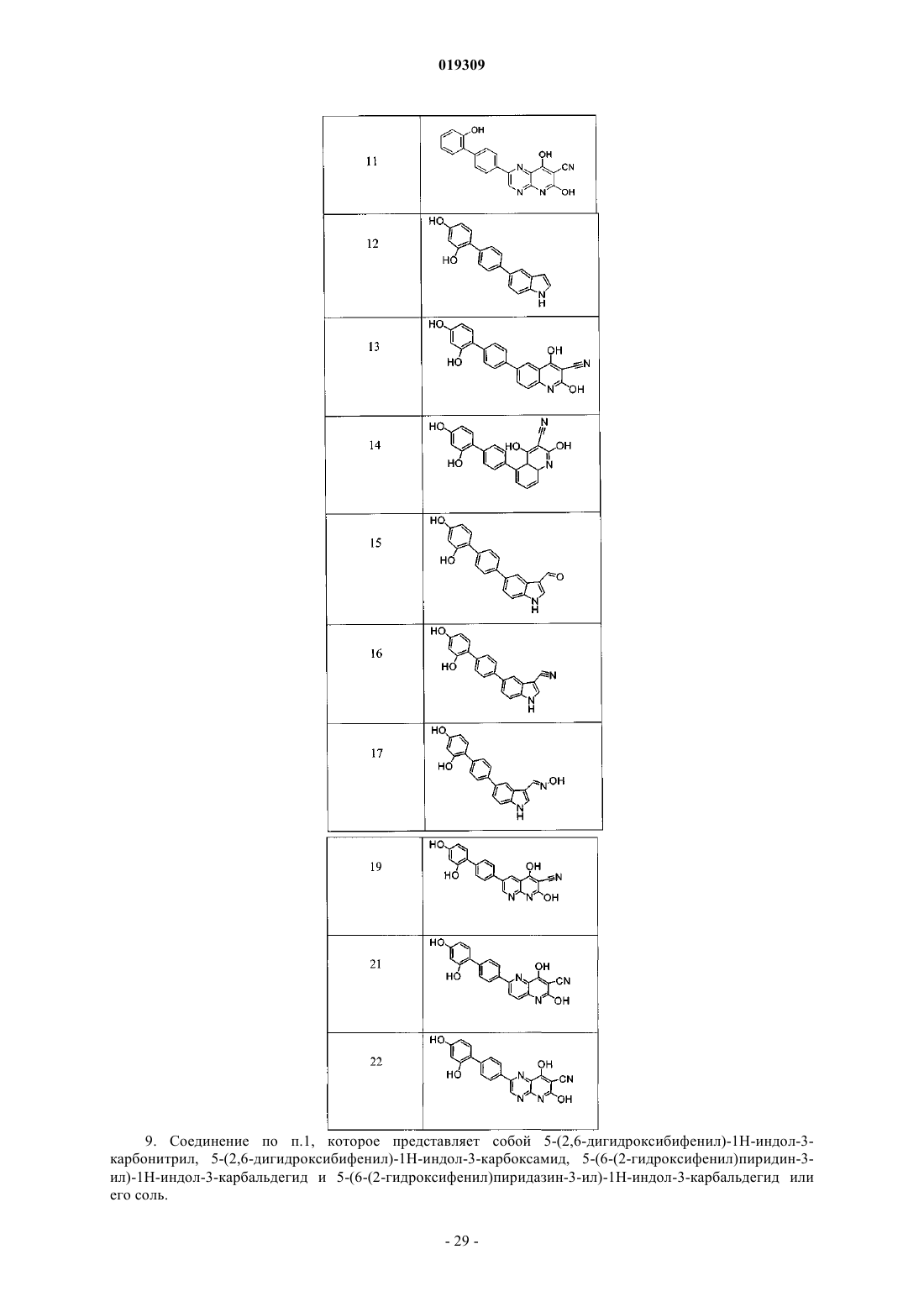
8. Соединение по п.1, выбранное из соединений, представленных в табл. А, или его соль
9. Соединение по п.1, которое представляет собой 5-(2,6-дигидроксибифенил)-1H-индол-3-карбонитрил, 5-(2,6-дигидроксибифенил)-1H-индол-3-карбоксамид, 5-(6-(2-гидроксифенил)пиридин-3-ил)-1Н-индол-3-карбальдегид и 5-(6-(2-гидроксифенил)пиридазин-3-ил)-1Н-индол-3-карбальдегид или его соль.
10. Фармацевтическая композиция, включающая терапевтически эффективное количество соединения по любому из пп.1-9 или его соли, в комбинации с фармацевтически приемлемым носителем.
11. Способ регуляции АМРК у субъекта, включающий введение указанному субъекту, нуждающемуся в лечении, терапевтически эффективного количества соединения по п.1 или его соли.
12. Способ лечения сахарного диабета у субъекта, включающий введение указанному субъекту, нуждающемуся в лечении, терапевтически эффективного количества соединения по п.1 или его соли.
13. Способ лечения ожирения у субъекта, включающий введение указанному субъекту, нуждающемуся в лечении, терапевтически эффективного количества соединения по п.1 или его соли.
14. Способ лечения рака у субъекта, включающий введение указанному субъекту, нуждающемуся в лечении, терапевтически эффективного количества соединения по п.1 или его соли.
Текст
Изобретение относится к соединениям и фармацевтически приемлемым солям, эфирам и пролекарствам формулы (I) или (II), которые полезны в качестве эффективных модуляторов АМРК при лечении диабета, ожирения и рака. Область техники, к которой относится изобретение Изобретение относится к соединениям и фармацевтически приемлемым солям, эфирам и пролекарствам формулы (I) или (II), которые полезны в качестве эффективных модуляторов АМРК при лечении диабета, ожирения и рака. Предшествующий уровень техники АМФ-активируемая протеинкиназа (АМРК) в разных клетках выполняет роль внутриклеточного метаболического сенсора, где она отслеживает соотношение АМФ и АТФ и реагирует на его изменения(Hardie et al., Annu. Rev. Biochem. 67:821-855, 1998). При активации АМРК этот фермент фосфорилирует большое число белковых субстратов для того, чтобы снизить дальнейшее использование АТФ клеткой. АМРК представляет собой гетеротримерный комплекс, состоящий из каталитической субъединицыи двух вспомогательных субъединиц ( и ). Обе субъединицыинеобходимы для оптимальной активности каталитической субъединицы . Комплекс АМРК является эволюционно консервативным и также может быть найден в дрожжах и растениях. АМРК млекопитающих состоит из различных изоформ субъединиц: 1, 2, 1, 2, 1, 2 и 3 (Hardie and Hawley, BioEssays 23:1112 1119, 2001). Разные комбинации изоформ субъединиц по разному активируются in vivo, и вероятнее всего различаются также в использовании субстратов. Активность АМРК обнаружена во всех тканях, включая печень, почки, мышцы, легкие и мозг (Cheung et al., Biochem. J. 346:659-669, 2000). АМРК рассматривается как главный регулятор путей биосинтеза липидов из-за е роли в фосфорилировании и инактивации ключевых ферментов, таких как ацетил-КоА-карбоксилаза и синтаза жирных кислот (Hardie and Carling, Eur. J. Biochem. 246:259 273, 1997). Более недавняя работа позволяет предполагать, что АМРК играет более широкую роль в регуляции метаболизма (Winder and Hardie, Am. J.Physiol. 277:E1 10, 1999); это включает окисление жирных кислот, поглощение глюкозы мышцами, экспрессию цАМФ-стимулируемых генов глюконеогенеза, таких как РЕРСК (фосфоенолпируваткарбоксикиназа) и Г 6 Фаза (глюкозо-6-фосфатаза), и экспрессию стимулируемых глюкозой генов, ассоциированных с липогенезом в печени, включая синтазу жирных кислот, Spot-14 и пируваткиназу L-типа. Хроническая активация АМРК может также индуцировать экспрессию мышечной гексокиназы и переносчиков глюкозы (Glut4), что напоминает эффекты интенсивной тренировки (Holmes et al. J. Appl. Phiysiol. 87:1990 1995,1999). АМРК фосфорилирует и модулирует активность ключевых ферментов метаболизма углеводов. Действительно, АМРК играет важную роль в липогенезе, поскольку она ингибирует синтез жирных кислот и холестерина за счет инактивации ацетил-КоА-карбоксилазы и HMG-коредуктазы. АМРК снижает экспрессию синтазы жирных кислот (FAS), которая контролирует синтез триглицеридов. Кроме того,АМРК снижает также экспрессию одного из ключевых ферментов глюконеогенеза (РЕРСК), что проявляется в ингибировании продукции глюкозы в печени. АМРК увеличивает клиренс глюкозы в крови за счет облегчения транспорта глюкозы в скелетные мышцы. Все эти свойства в совокупности позволяют выбрать АМРК в качестве мишени при лечении диабета и ассоциированных с ним метаболических заболеваний, в соответствии с чем поиск фармакологических активаторов АМРК имеет фундаментальное значение для лечения таких патологий (Winder andresistance syndrome. Diabetes 51: 2199 (2002. Метформин увеличивает активность АМФ-активируемой протеинкиназы в скелетных мышцах субъектов с диабетом 2 типа (Diabetes, 51: 2074 (2002), хотя необходимо выяснить, в какой степени его антидиабетическое действие связано с этой активацией. Как и в случае с лептином и адипонектином, стимулирующий эффект метформина является непрямым и реализуется через активацию расположенной выше в сигнальном пути киназы (Zhou, G. et.al. Role of AMPactivated protein kinase in mechanism of metformin action. The J. of Clin. Inves.t, 108: 1167 (2001. Несмотря на последние достижения в этой области, все еще существует потребность в более эффективных модуляторах АМРК. Сущность изобретения В соответствии с этим настоящее изобретение предоставляет соединение, имеющее общую формулу I или II: или его геометрические изомеры, энантиомеры, диастереомеры, рацематы, фармацевтически приемлемые соли, пролекарства и их сольваты, где Х 1-Х 4 независимо выбираются из группы, состоящей из С, CR1 или N, где R1 независимо выбирается из группы, состоящей из водорода, гидрокси, галогена, замещенного или незамещенного амино, замещенного или незамещенного алкокси, замещенного или незамещенного алкилтио, CF3, CN, NO2, N3, замещенного или незамещенного алкилсульфонила, ацила, алифатической группы, замещенной алифатической группы, арила, гетероарила и гетероцикла;Y2-Y3 независимо выбираются из группы, состоящей из С, CR1, О, S, N или NH; независимо выбирается из группы, состоящей из гетероарила, замещенного гетероарила,гетероцикла, замещенного гетероцикла, где Z представляет собой О, N или NH; и и независимо выбираются из группы, состоящей из арила, замещенного арила, гетероарила, замещенного гетероарила, гетероцикла, замещенного гетероцикла, циклоалкила, замещенного циклоалкила, циклоалкенила и замещенного циклоалкенила. Необходимо отметить, что все соединения всегда включают геометрические изомеры, энантиомеры, диастереомеры, рацематы, фармацевтически приемлемые соли и сольваты соединений. Необходимо понимать, что формула содержит хиральные центры, и где хиральный центр не нарисован для указания на определенный изомер, подразумеваются активные изомеры и рацематы. Подобно этому, соли и сольваты определяются здесь как "включенные" в само соединение. Осуществление изобретения В первом воплощении соединения настоящего изобретения представляют собой соединения, представленные формулой (I) или (II), как показано выше, или их геометрические изомеры, энантиомеры,диастереомеры, рацематы, фармацевтически приемлемые соли, пролекарства и их сольваты. В одном воплощении соединения настоящего изобретения представляют собой соединения, представленные формулой (III), как показано ниже, или их геометрические изомеры, энантиомеры, диастереомеры, рацематы, фармацевтически приемлемые соли, пролекарства и их сольваты: где Х 5-Х 16 независимо выбираются из группы, состоящей из С, CR1 или N, где R1 представляет собой водород или электронодонорную группу, такую как электроноакцепторную группу, и предпочтительно независимо выбирается из группы, состоящей из водорода, гидрокси, галогена, замещенного или незамещенного амино, замещенного или незамещенного алкокси, замещенного или незамещенного алкилтио, CF3, CN, NO2, N3, замещенного или незамещенного алкилсульфонила, ацила, алифатической группы, замещенной алифатической группы, арила, гетероарила и гетероцикла; и выбирается из группы, состоящей из и где Х 17-Х 21 независимо выбираются из группы, состоящей из С, CR1 или N, где R1 независимо выбирается из группы, состоящей из водорода, гидрокси, галогена, замещенного или незамещенного амино,замещенного или незамещенного алкокси, замещенного или незамещенного алкилтио, CF3, CN, NO2, N3,замещенного или незамещенного алкилсульфонила, ацила, алифатической группы, замещенной алифатической группы, арила, гетероарила и гетероцикла; Y4 представляет собой О, N или NH; Y5-Y6 независимо выбираются из группы, состоящей из С, CR1, О, S, N или NH; и X1-Х 4 являются такими, как определено в первом воплощении.R1 также может выбираться из группы, состоящей из водорода, гидрокси, галогена, замещенного или незамещенного амино, замещенного или незамещенного алкокси, замещенного или незамещенного алкилтио, CF3, CN, NO2, N3, CHNOH, CONH2, СНО, замещенного или незамещенного алкилсульфонила,ацила, алифатической группы, замещенной алифатической группы, арила, гетероарила и гетероцикла. Соединения предпочтительно представляют собой биарилзамещенные индолы, такие как и их соли, где R1, R2, R3, R4, R5 и R6 независимо представляют собой водород или одну или более электронодонорных групп, и каждый R выбирается из Н или гидроксила, где по меньшей мере один R представляет собой гидроксил. Центральная арильная группа может быть фенилом или она может быть замещена пиридином или пиридазином, например: В одном воплощении соединения настоящего изобретения представляют собой соединения, представленные формулой (IV), как показано ниже, или их геометрические изомеры, энантиомеры, диастереомеры, рацематы, фармацевтически приемлемые соли, пролекарства и их сольваты: и где Х 17-Х 21 независимо выбираются из группы, состоящей из С, CR1 или N, где R1 независимо выбирается из группы, состоящей из водорода, гидрокси, галогена, замещенного или незамещенного амино,замещенного или незамещенного алкокси, замещенного или незамещенного алкилтио, CF3, CN, NO2, N3,замещенного или незамещенного алкилсульфонила, ацила, алифатической группы, замещенной алифатической группы, арила, гетероарила и гетероцикла; Y4 представляет собой О, N или NH; Y5-Y6 независимо выбираются из группы, состоящей из С, CR1, О, S, N или NH; n равняется 1-3, предпочтительно 1 или 2, и Х 1-Х 4 являются такими, как определено в первом воплощении. В одном воплощении соединения настоящего изобретения представляют собой соединения, представленные формулой (V), как показано ниже, или их геометрические изомеры, энантиомеры, диастереомеры, рацематы, фармацевтически приемлемые соли, пролекарства и их сольваты: где X5-X16 независимо выбираются из группы, состоящей из С, CR1 или N, где R1 независимо выбирается из группы, состоящей из водорода, гидрокси, галогена, замещенного или незамещенного амино,замещенного или незамещенного алкокси, замещенного или незамещенного алкилтио, CF3, CN, NO2, N3,замещенного или незамещенного алкилсульфонила, ацила, алифатической группы, замещенной алифатической группы, арила, гетероарила и гетероцикла; и выбирается из группы, состоящей из и где Х 17-Х 21 независимо выбираются из группы, состоящей из С, CR1 или N, где R1 независимо выбирается из группы, состоящей из водорода, гидрокси, галогена, замещенного или незамещенного амино,замещенного или незамещенного алкокси, замещенного или незамещенного алкилтио, CF3, CN, NO2, N3,замещенного или незамещенного алкилсульфонила, ацила, алифатической группы, замещенной алифатической группы, арила, гетероарила и гетероцикла; Y4 представляет собой О, N или NH; Y5-Y6 независимо выбираются из группы, состоящей из С, CR1, О, S, N или NH; и Y1-Y3 являются такими, как определено в первом воплощении. В одном воплощении соединения настоящего изобретения представляют собой соединения, представленные формулой (VI), как показано ниже, или их геометрические изомеры, энантиомеры, диастереомеры, рацематы, фармацевтически приемлемые соли, пролекарства и их сольваты: и где Х 17-Х 21 независимо выбираются из группы, состоящей из С, CR1 или N, где R1 независимо выбирается из группы, состоящей из водорода, гидрокси, галогена, замещенного или незамещенного амино,замещенного или незамещенного алкокси, замещенного или незамещенного алкилтио, CF3, CN, NO2, N3,замещенного или незамещенного алкилсульфонила, ацила, алифатической группы, замещенной алифатической группы, арила, гетероарила и гетероцикла; Y4 представляет собой О, N или NH; Y5-Y6 независимо выбираются из группы, состоящей из С, CR1, О, S, N или NH; n равняется 1, 2 или 3, предпочтительно 1 или 2; и Y1-Y3 являются такими, как определено в первом воплощении. Репрезентативными соединениями согласно настоящему изобретению являются соединения, выбираемые из представленной ниже табл. А, или их геометрические изомеры, энантиомеры, диастереомеры,рацематы, фармацевтически приемлемые соли, пролекарства и их сольваты: Таблица А Таким образом, соединения настоящего изобретения могут применяться для профилактики или лечения устойчивости к инсулину, связанной с ожирением, непереносимостью глюкозы, сахарным диабетом, гипертонией и ишемической болезнью больших и малых кровеносных сосудов. Соединения настоящего изобретения могут также применяться для лечения, профилактики или контроля множества состояний, которые сопровождают диабет 2 типа, включая гиперлипидемию, гипертириглицеридемию,атеросклероз, рестеноз кровеносных сосудов, синдром раздраженного кишечника (слизистый колит),панкреатит, опухоли жировых клеток и карциномы, такие как липосаркома, дислипидемию и другие заболевания, при которых наблюдается устойчивость к инсулину, а также метаболический синдром и входящие в него состояния (включая гипертриглицеридемию, гиперхолестеринемию и низкий уровень ЛВП), и другие заболевания, такие как несердечная ишемия, инфекция и рак. Кроме того, соединения настоящего изобретения применимы в онкологии и в лечении раковых заболеваний. Сообщалось, что снижение кровяного давления является следствием активации АМРК (Buhl, E. S.et.al. Long-term AICAR administration reduces metabolic disturbances and lowers blood pressure in rats displaying feature of the insulin resistance syndrome. Diabetes, 51: 2199 (2002, то есть активация АМРК может иметь положительные эффекты в случае гипертонии. Таким образом, комбинация некоторых или всех упомянутых выше эффектов стимуляции АМРК, как ожидается, будет снижать проявление сердечнососудистых заболеваний (например, MI, инфаркт). Увеличенный синтез жирных кислот является характерным для многих опухолевых клеток, следовательно, снижение синтеза жирных кислот посредством активации АМРК может быть полезно в терапии рака. Было показано, что стимуляция АМРК стимулирует продукцию кетоновых тел астроцитами (Blazqucz, С. et.al. The AMP-activated protein kinase is involved in the regulation of ketone body production by astrocytes. J. Neurochem., 73: 1674 (1999, и, таким образом, может использоваться в качестве стратегии в лечении ишемических повреждений в мозге. Было показано, что стимуляция АМРК стимулирует экспрессию разобщающего белка 3 (uncoupling protein 3,UCP3) в скелетных мышцах (Zhou, M. et.al. UCP-3 expression in skeletal muscle: effects of exercise, hypoxia,and AMP-activated protein kinase. Am. J. Physiol. Endocrinol. Metab., 279: E622 (2000, и, таким образом,может быть способом для профилактики повреждений, вызываемых активными формами кислорода. Было показано, что эндотелиальная NO-синтаза (eNOS) активируется через опосредованное АМРК фосфорилирование (Chen, Z.-Р., et.al. AMP-activated protein kinase phosphorylation of endothelial NO synthase.FEBS Letters, 443: 285 (1999, таким образом, активация АМРК может применяться для улучшения локальных систем циркуляции крови. Настоящие соединения также являются пригодными при лечении рака в качестве антинеопластического агента. Раковые заболевания включают твердые раковые опухоли, включая рак прямой кишки, рак молочной железы, рак легких и рак простаты, опухолевую инвазию, опухолевый рост и метастазы опухоли, раки ротовой полости и глотки (губ, языка, рта и глотки), пищевода, желудка, тонкого кишечника, толстого кишечника, прямой кишки, печени и желчных протоков, поджелудочной железы,гортани, легких, костей, соединительной ткани, кожи, шейки матки, эндометрия, яичников, семенников,мочевого пузыря, почек и других мочевыводящих тканей, сетчатки (eye brain) и центральной нервной системы, щитовидной железы и других эндокринных желез, болезнь Ходжкина (лимфогранулематоз), не связанные с болезнью Ходжкина лимфомы, множественную миеломную болезнь (болезнь РустицкогоКалера) и злокачественные заболевания кроветворных тканей, включая лейкемии и лимфомы, включая лимфоцитные, гранулоцитные и моноцитные. Заболевания, которые могут регулироваться путем активации АМРК, лечатся или предотвращаются у пациента путем введения пациенту терапевтически эффективного количества соединения настоящего изобретения в таком количестве и в течение такого времени, которые необходимы для достижения желаемого результата. Термин "терапевтически эффективное количество" обозначает достаточное количество соединения для улучшения состояния при заболеваниях, регулируемых грелином (ghrelin), при разумном соотношении выгода/риск, пригодном для любого медицинского лечения. Специфический терапевтически эффективный уровень дозировки для каждого конкретного пациента будет зависеть от множества факторов, включая заболевание, лечение которого проводится, и тяжесть заболевания, активность применяемого соединения, применяемую специфическую композицию, возраст, массу тела, общее состояние здоровья, пол и диету пациента, время введения, путь введения, скорость выведения, длительность лечения и применяемые в комбинации лекарства или одновременно применяемую терапию. Настоящее изобретение включает фармацевтические композиции, включающие фармацевтически приемлемые соли соединений настоящего изобретения как описано выше. Настоящее изобретение также включает фармацевтические композиции, включающие гидраты соединений настоящего изобретения. Термин "гидрат" включает, но ими не ограничивается, полугидрат, моногидрат, дигидрат, тригидрат и тому подобное. Настоящее изобретение дополнительно включает фармацевтические композиции, включающие любые твердые или жидкие формы соединения настоящего изобретения. Например, соединения могут находиться в кристаллической форме, в аморфном состоянии и иметь любой размер частиц. Частицы могут быть микронизированы, или могут быть агломеризованы, быть в виде гранул, порошков, масел, масляных суспензий или в любой другой твердой или жидкой физической форме. Соединения настоящего изобретения и производные, фрагменты, аналоги, гомологи, их фармацевтически приемлемые соли или гидраты могут быть включены в состав фармацевтических композиций,подходящих для введения, вместе с фармацевтически приемлемым носителем или эксципиентом. Такие композиции обычно включают терапевтически эффективное количество любого из упомянутых выше соединений и фармацевтически приемлемый носитель. Предпочтительно эффективное количество при лечении диабета и/или ожирения представляет собой количество, эффективное для того, чтобы селективно индуцировать терминальную дифференцировку подходящих неопластических клеток, и более низкое, чем количество, которое оказывает токсическое действие на пациента. Соединения настоящего изобретения могут вводиться любым подходящим способом, включая, но ими не ограничиваясь, парентеральный, внутривенный, внутримышечный, подкожный, в виде импланта,пероральный, подъязычный, буккальный, назальный, легочный, трансдермальный, топический (местный), вагинальный, ректальный и введение через слизистые или тому подобное. Топическое введение может также включать применение трансдермального введения, такого как трансдермальные повязки(пластыри) или устройства для ионофореза. Фармацевтические препараты включают твердые, полужидкие или жидкие препараты (таблетки, пилюли, пастилки, капсулы, суппозитории, кремы, мази, аэрозоли,порошки, жидкости, эмульсии, суспензии, сиропы, инъекции и т.д.), содержащие соединение настоящего изобретения в качестве активного ингредиента, которые являются пригодными для выбранного способа введения. В одном воплощении, фармацевтические композиции вводятся перорально, и они готовятся,соответственно, в форме, пригодной для перорального введения, то есть в виде твердого или жидкого препарата. Подходящие твердые формы для перорального применения включают таблетки, капсулы, шарики, гранулы, пилюли, саше и шипучие композиции, порошки и тому подобное. Подходящие жидкие формы для перорального применения включают растворы, суспензии, дисперсии, эмульсии, масла и тому подобное. В одном воплощении настоящего изобретения композиция готовится в виде капсул. В соответствии с этим воплощением композиции настоящего изобретения включают в дополнение к активному соединению и инертному носителю или разжижителю, твердую желатиновую капсулу. Любой инертный эксципиент, который обычно используется в качестве носителя или разбавителя,может применяться в композициях настоящего изобретения, например, такой как камедь, крахмал, сахар,целлюлозный материал, акрилат или их смеси. Предпочтительным разбавителем является микрокристаллическая целлюлоза. Композиции могут дополнительно включать диспергирующий агент (например,кроскармеллозу натрия) и любрикант (например, стеарат магния) и могут дополнительно включать одну или более добавок, выбираемых из связывающего вещества, буфера, ингибитора протеаз, сурфактанта,солюбилизирующего агента, пластификатора, эмульгирующего агента, стабилизирующего агента, увеличивающего вязкость агента, подсластителя, образующего пленку агента или любую их комбинацию. Кроме того, композиции настоящего изобретения могут готовиться в форме композиций с контролируемым высвобождением или с немедленным высвобождением. Для жидких композиций фармацевтически приемлемые носители могут представлять собой водные и неводные растворы, суспензии, эмульсии или масла. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль и органические эфиры для инъекций, такие как этилолеат. Водные носители включают воду, растворы спирт/вода, эмульсии или суспензии, включая физиологический раствор и буферные среды. Примерами масел являются масла нефтяного, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло, минеральное масло, оливковое масло, подсолнечное масло и масло печени рыб. Растворы или суспензии также могут включать следующие компоненты: стерильный растворитель, такой как вода для инъекций, физиологический раствор,нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота (ЭДТА); буферы, такие как ацетаты, цитраты или фосфаты, и агенты для обеспечения тоничности растворов, такие как хлорид натрия или декстроза. Величину pH можно регулировать с помощью кислот или оснований, таких как соляная кислота или гидроксид натрия. Кроме того, композиции могут дополнительно включать связывающие агенты (например, гуммиарабик, кукурузный крахмал, желатин, карбомер, этилцеллюлозу, гуаровую камедь, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, повидон), дезинтегрирующие агенты (например, кукурузный крахмал, картофельный крахмал, альгиновую кислоту, диоксид кремния, кроскармеллозу натрия, кросповидон, гуаровую камедь, гликолат натрия крахмала, Примогель (Primogel), буферы (например, трисHCl, ацетат, фосфат) с различным значением pH и ионной силы, добавки, такие как альбумин или желатин для предотвращения абсорбции к поверхностям, детергенты (например, Твин 20, Твин 80, ПлюроникF68, соли желчных кислот), ингибиторы протеаз, сурфактанты (например, лаурилсульфат натрия), усилители проницаемости, солюбилизирующие агенты (например, глицерин, полиэтиленглицерин, циклодекстрины), глидант (например, коллоидный диоксид кремния), антиоксиданты (например, аскорбиновую кислоту, метабисульфит натрия, гидроксианизолбутилат), стабилизаторы (например, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу), увеличивающие вязкость агенты (например, карбомер,коллоидный диоксид кремния, этилцеллюлозу, гуаровую камедь), подсластители (например, сахарозу,аспартам, лимонную кислоту), ароматизирующие агенты (например, перечную мяту, метилсалицилат или апельсиновый ароматизатор), консерванты (например, тимеросал, бензиловый спирт, парабены),любриканты (например, стеариновую кислоту, стеарат магния, полиэтиленгликоль, лаурилсульфат натрия), вещества, облегчающие сыпучесть (например, коллоидный диоксид кремния), пластификаторы(например, диэтилфталат, триэтилцитрат), эмульгаторы (например, карбомер, гидроксипропилцеллюлоза, лаурилсульфат натрия), полимерные покрытия (например, полоксамеры или полоксамины), покрывающие и образующие пленку агенты (например, этилцеллюлозу, акрилаты, полиметакрилаты) и/или адъюванты. В одном воплощении активные соединения готовятся с носителями, которые будут защищать соединение от быстрого выведения из организма, такими как композиции для контролируемого высвобождения, включая импланты и микроинкапсулированные системы доставки. Могут применяться биодеградируемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы для получения таких композиций хорошо известны специалистам в данной области техники. Материалы могут также быть получены коммерчески доступным путем от Alza Corporation и Nova Pharmaceuticals, Inc. Липосомальные суспензии(включая липосомы, направленные против инфицированных клеток за счет моноклональных антител к вирусным антигенам) также могут применяться в качестве фармацевтически приемлемых носителей. Они могут быть получены согласно способам, известным специалистам в данной области техники, например, как это описано в U.S. Pat No. 4522811. Особенно предпочтительно готовить пероральные композиции в форме единиц дозирования для легкого введения и однородности дозировки. Единица дозирования в используемом здесь значении относится к физически дискретным единицам, подходящим в качестве однократной дозировки для проходящего лечения субъекта, где каждая единица содержит заранее определенное количество активного соединения, рассчитанное таким образом, чтобы обеспечить желаемый терапевтический эффект, в комбинации с необходимым фармацевтическим носителем. Конкретная спецификация для форм единицы дозировки настоящего изобретения определяется и прямо зависит от уникальных характеристик активного соединения и от определенного терапевтического эффекта, который должен быть достигнут, и тех ограничений, которые свойственны соединениям в данной области техники, таким как активное соединение для лечения индивидуумов. Фармацевтические композиции могут быть помещены в контейнер, пакет или диспенсер (раздаточное устройство) вместе с инструкцией по применению. Ежедневное введение может повторяться непрерывно в течение периода от нескольких дней до нескольких лет. Пероральное лечение может продолжаться в течение от одной недели до всей жизни пациента. Предпочтительно введение может длиться в течение пяти последовательных дней, после чего пациент может быть обследован для определения того, требуется ли дальнейшее введение. Введение может быть постоянным или периодическим, например, лечение в течение определенного количества последовательных дней с последующим периодом отдыха. Соединения настоящего изобретения могут вводиться внутривенно в первый день лечения, путем перорального введения во второй день и во все последующие дни. Получение фармацевтических композиций, которые содержат активный компонент, хорошо известно в данной области техники и может проводиться, например, путем смешивания, гранулирования или формирования таблеток. Активный терапевтический ингредиент часто смешивается с эксципиентами, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом. Для перорального введения активные агенты смешиваются с обычными для этой цели добавками, такими как наполнители, стабилизаторы или инертные разбавители, и превращаются обычными способами в пригодные для введения формы, такие как таблетки, таблетки с покрытием, твердые или мягкие желатиновые капсулы, водные, спиртовые или масляные растворы и тому подобное, как детально описано выше. Количество соединения, вводимое пациенту, меньше, чем количество, которое будет оказывать токсическое действие на пациента. В определенных воплощениях количество соединения, которое вводится пациенту, меньше, чем количество, которое обеспечивает концентрацию соединения в плазме крови пациента, равную или превышающую уровень токсичности данного соединения. Предпочтительно,чтобы концентрация соединения в плазме крови пациента поддерживалась на уровне примерно 10 нМ. В одном воплощении концентрация соединения в плазме крови пациента поддерживается на уровне примерно 25 нМ. В одном воплощении концентрация соединения в плазме крови пациента поддерживается на уровне примерно 50 нМ. В одном воплощении концентрация соединения в плазме крови пациента поддерживается на уровне примерно 100 нМ. В одном воплощении концентрация соединения в плазме крови пациента поддерживается на уровне примерно 500 нМ. В одном воплощении концентрация соединения в плазме крови пациента поддерживается на уровне примерно 1000 нМ. В одном воплощении концентрация соединения в плазме крови пациента поддерживается на уровне примерно 2500 нМ. В одном воплощении концентрация соединения в плазме крови пациента поддерживается на уровне примерно 5000 нМ. В одном воплощении концентрация соединения в плазме крови пациента поддерживается на уровне примерно 25000 нМ. В одном воплощении концентрация соединения в плазме крови пациента поддерживается на уровне между примерно 5000 нМ и примерно 25000 нМ. Оптимальное количество соединения, которое должно вводиться пациенту при практическом применении настоящего изобретения, будет зависеть от того, какое конкретное соединение применяется. Определения Ниже приводятся определения различных терминов, применяемых в описании настоящего изобретения. Эти определения относятся к терминам, применяемым во всем тексте настоящей заявки на изобретение и в формуле изобретения, если нет других ограничений в особых случаях, или в индивидуальном порядке, или в случае составной части более крупной группы."Алифатическая группа" или "алифатический(кая)" представляет собой неароматический остаток,который может быть насыщенным (например, с одинарными связями) или может содержать одну или более единиц ненасыщенности (например, двойные и/или тройные связи). Алифатическая группа может быть линейной, разветвленной или циклической, содержать углерод, водород или, не обязательно, один или более гетероатомов и может быть замещенной или незамещенной. Алифатическая группа предпочтительно содержит от примерно 1 до примерно 24 атомов, более предпочтительно от примерно 4 до примерно 24 атомов, более предпочтительно от примерно 4 до примерно 12 атомов, более обычно от примерно 4 до примерно 8 атомов. Термин "ацил" обозначает водород, алкил, частично насыщенный или полностью насыщенный циклоалкил, частично насыщенный или полностью насыщенный гетероцикл, арил и гетероарил, замещенный карбонильными группами. Например, ацил включает группы, такие как (C1-C6)алканоил (например,формил, ацетил, пропионил, бутирил, валерил, капроил, t-бутилацетил, и т.д.), (C3-C6)циклоалкилкарбонил (например, циклопропилкарбонил, циклобутилкарбонил, циклопентилкарбонил, циклогексилкарбонил и т.д.), гетероциклический карбонил (например, пирролидинилкарбонил, пирролид-2-он-5-карбонил,пиперидинилкарбонил, пиперазинилкарбонил, тетрагидрофуранилкарбонил и т.д.), ароил (например,бензоил) и гетероароил (например, тиофенил-2-карбонил, тиофенил-3-карбонил, фуранил-2-карбонил,фуранил-3-карбонил 1H-пирроил-2-карбонил, 1H-пирроил-3-карбонил, бензо[b]тиофенил-2-карбонил и т.д.). Кроме того, алкильная, циклоалкильная, гетероцикличекая, арильная и гетероарильная часть ацильной группы может быть любой одной из групп, описанных в соответствующих определениях. Когда указано, что группа является "не обязательно замещенной", ацильная группа может быть незамещенной или не обязательно замещенной одним или более заместителями (обычно от одного до трех заместителей), независимо выбираемыми из группы заместителей, перечисленных ниже в определении термина"замещенный", или алкильная, циклоалкильная, гетероцикличекая, арильная и гетероарильная часть ацильной группы может быть замещена, как описано выше в списке предпочтительных и более предпочтительных заместителей, соответственно. Термин "алкил" включает линейные или разветвленные радикалы, имеющие от одного до примерно двадцати атомов углерода, или, предпочтительно, от одного до примерно двенадцати атомов углерода. Более предпочтительно алкильные радикалы представляют собой "низшие алкильные" радикалы, имеющие от одного до примерно десяти атомов углерода. Наиболее предпочтительно они представляют собой низшие алкильные радикалы, имеющие от одного до примерно восьми атомов углерода. Примеры таких радикалов включают метил, этил, и-пропил, изопропил, "-бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, гексил и тому подобное. Термин "алкенил" включает линейные или разветвленные радикалы, имеющие по меньшей мере одну двойную связь углерод-углерод и содержащие от двух до примерно двадцати атомов углерода или,предпочтительно, от двух до примерно двенадцати атомов углерода. Более предпочтительно алкенильные радикалы представляют собой "низшие алкенильные" радикалы, содержащие от двух до примерно десяти атомов углерода и более предпочтительно от двух до примерно восьми атомов углерода. Примеры алкенильных радикалов включают этенил, аллил, пропенил, бутенил и 4-метилбутенил. Термины "алкенил" и "низший алкенил" включают радикалы, имеющие "цис" и "транс" ориентации, или альтернативно этому "Е" и "Z" ориентации. Термин "алкинил" включает линейные или разветвленные радикалы, имеющие по меньшей мере одну тройную связь углерод-углерод и содержащие от двух до примерно двадцати атомов углерода или,предпочтительно, от двух до примерно двенадцати атомов углерода. Более предпочтительно алкинильные радикалы представляют собой "низшие алкинильные" радикалы, содержащие от двух до примерно десяти атомов углерода и более предпочтительно от двух до примерно восьми атомов углерода. Примеры алкинильных радикалов включают пропаргил, 1-пропинил, 2-пропинил, 1-бутин, 2-бутинил и 1 пентинил. Термин "циклоалкил" включает насыщенные карбоциклические радикалы, имеющие от трех до примерно двенадцати атомов углерода. Термин "циклоалкил" включает насыщенные карбоциклические радикалы, имеющие от трех до примерно двенадцати атомов углерода. Более предпочтительно циклоалкильные радикалы представляют собой "низшие циклоалкильные" радикалы, имеющие от трех до примерно восьми атомов углерода. Примеры таких радикалов включают циклопропил, циклобутил, циклопентил и циклогексил. Термин "циклоалкенил" включает частично ненасыщенные карбоциклические радикалы, имеющие от трех до примерно двенадцати атомов углерода. Циклоалкенильные радикалы, которые представляют собой частично ненасыщенные карбоциклические радикалы, которые содержат две двойные связи (которые могут быть или не быть сопряженными) могут называться "циклоалкилдиенилы". Более предпочтительно циклоалкенильные радикалы представляют собой "низшие циклоалкенильные" радикалы, имеющие от четырех до примерно восьми атомов углерода. Примеры таких радикалов включают циклобутенил, циклопентенил и циклогексенил. Термин "алкокси" включает линейные или разветвленные содержащие окси-группу радикалы, каждый из которых имеет алкильную часть из от одного до примерно двадцати атомов углерода или, предпочтительно, от одного до примерно двенадцати атомов углерода. Более предпочтительно алкокси радикалы представляют собой "низшие алкокси" радикалы, имеющие от одного до примерно десяти атомов углерода и, более предпочтительно, имеющие от одного до примерно восьми атомов углерода. Примеры таких радикалов включают метокси, этокси, пропокси, бутокси и трет-бутокси. Термин "алкоксиалкил" включает алкильные радикалы, имеющие один или более алкокси радикалов, присоединенных к алкильному радикалу, образуя, таким образом, моноалкоксиалкильные и диалкоксиалкильные радикалы. Термин "арил" сам по себе или в комбинации обозначает карбоциклическую ароматическую систему, содержащую одно, два или три кольца, где такие кольца могут быть соединены вместе углами или могут быть слиты. Термин "арил" включает ароматические радикалы, такие как фенил, нафтил, тетрагидронафтил, индан и бифенил. Термин "карбонил" при использовании как сам по себе, так и в комбинации с другими терминами,такими как "алкоксикарбонил", обозначает (С=О). Термин "карбамоил" при использовании как сам по себе, так и в комбинации с другими терминами,такими как "арилкарбамоилалкил", обозначает C(O)NH. Термины "гетероциклил", "гетероцикл" "гетероциклический" или "гетероцикло" включают насыщенные, частично ненасыщенные и ненасыщенные содержащие гетероатомы циклические радикалы,которые также могут называться "гетероциклил", "гетероциклоалкенил" и "гетероарил" соответственно,где гетероатомы могут выбираться из азота, серы и кислорода. Примеры насыщенных гетероциклических радикалов включают насыщенную от 3- до 6-членную гетеромоноциклическую группу, содержащую от 1 до 4 атомов азота (например, пирролидинил, имидазолидинил, пиперидино, пиперазинил и т.д.); насыщенную от 3- до 6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов кислорода и от 1 до 3 атомов азота (например, морфолинил); насыщенную от 3- до 6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов серы и от 1 до 3 атомов азота (например, тиазолидинил и т.д.). Примеры частично ненасыщенных гетероциклических радикалов включают дигидротиофен, дигидропиран, дигидрофуран и дигидротиазол. Гетероциклические радикалы могут включать пятивалентный азот, такой как в радикалах тетразолия и пиридиния. Термин "гетероцикл" также включает радикалы, в которых гетероциклические радикалы являются конденсированными с арильными или циклоалкильными радикалами. Примеры таких конденсированных бициклических радикалов включают бензофуран, бензотиофен и тому подобное. Термин "гетероарил" включает ненасыщенные гетероциклические радикалы. Примеры гетероарильных радикалов включают ненасыщенную от 3- до 6-членную гетероциклическую группу, содержащую от 1 до 4 атомов азота, например пирролил, пирролинил, имидазолил, пиразолил, пиридил, пиримидил, пиразинил, пиридазинил, триазолил (например, 4 Н-1,2,4-триазолил, 1 Н-1,2,3-триазолил, 2 Н-1,2,3 триазолил и т.д.), татразолил (например, 1 Н-татразолил, 2 Н-татразолил, и т.д.) и т.д.; ненасыщенную конденсированную гетероциклическую группу, содержащую от 1 до 5 атомов азота, например индолил,изоиндолил, индолизинил, бензимидазолил, хинолил, изохинолил, мндазолил, бензотриазолил, тетразолопиридазинил (например, тетразоло[1,5-b]пиридазинил и т.д.) и т.д.; ненасыщенную 3-6-членную гетеромоноциклическую группу, содержащую атом кислорода, например пиранил, фурил и т.д.; ненасыщенную 3-6-членную гетеромоноциклическую группу, содержащую атом серы, например тиенил и т.д.; ненасыщенную 3-6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов кислорода и от 1 до 3 атомов азота, например оксазолил, изоксазолил, оксадиазолил (например, 1,2,4-оксадиазолил,1,3,4-оксадиазолил, 1,2,5-оксадиазолил и т.д.) и т.д.; ненасыщенную конденсированную гетероциклическую группу, содержащую от 1 до 2 атомов кислорода и от 1 до 3 атомов азота (например, бензоксазолил, бензоксадиазолил и т.д.); ненасыщенную 3-6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов серы и от 1 до 3 атомов азота, например тиазолил, тиадиазолил (например, 1,2,4 тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил и т.д.) и т.д.; ненасыщенную конденсированную гетероциклическую группу, содержащую от 1 до 2 атомов серы и от 1 до 3 атомов азота (например, бензотиа- 10019309 золил, бензотиадиазолил и т.д.) и тому подобное. Термин "гетероциклоалкил" включает гетероциклозамещенные алкильные радикалы. Более предпочтительными гетероциклоалкильными радикалами являются "низшие гетероциклоалкильные" радикалы, имеющие от одного до шести атомов углерода в гетероциклических радикалах. Термин "алкилтио" включает радикалы, содержащие линейные или разветвленные алкильные радикалы, имеющие от одного до примерно десяти атомов углерода, присоединенных к атому двухвалентной серы. Предпочтительные алкилтио радикалы имеют алкильные радикалы, содержащие от одного до примерно двадцати атомов углерода или, предпочтительно, от одного до примерно двенадцати атомов углерода. Более предпочтительными алкилтио радикалами, имеющими алкильные радикалы, являются "низшие алкилтио" радикалы, имеющие от одного до примерно десяти атомов углерода. Наиболее предпочтительными являются алкилтио радикалы, имеющие низшие алкильные радикалы, содержащие от одного до примерно восьми атомов углерода. Примерами таких низших алкилтио радикалов являются метилтио,этилтио, пропилтио, бутилтио и гексилтио. Термины "аралкил" или "арилалкил" включают арилзамещенные алкильные радикалы, такие как бензил, дифенилметил, трифенилметил, фенилэтил и дифенилэтил. Термин "арилокси" включает арильные радикалы, присоединение через атом кислорода к другим радикалам. Термины "аралкокси" или "арилалкокси" включают аралкильные радикалы, присоединенные через атом кислорода к другим радикалам. Термин "аминоалкил" включает алкильные радикалы, замещенные амино радикалами. Предпочтительные аминоалкильные радикалы имеют алкильные радикалы, содержащие от одного до примерно двадцати атомов углерода или, предпочтительно, от одного до примерно двенадцати атомов углерода. Более предпочтительно аминоалкильные радикалы представляют собой "низшие аминоалкильные" радикалы, которые имеют алкильные радикалы, содержащие от одного до примерно десяти атомов углерода. Наиболее предпочтительными являются аминоалкильные радикалы, имеющие низшие алкильные радикалы, содержащие от одного до восьми атомов углерода. Примеры таких радикалов включают аминометил, аминоэтил и тому подобное. Термин "алкиламино" обозначает аминогруппы, которые замещены одним или двумя алкильными радикалами. Предпочтительные алкиламино радикалы имеют алкильные радикалы, содержащие от одного до примерно двадцати атомов углерода или, предпочтительно, от одного до примерно двенадцати атомов углерода. Более предпочтительно алкиламино радикалы представляют собой "низшие алкиламино" радикалы, которые имеют алкильные радикалы, содержащие от одного до примерно десяти атомов углерода. Наиболее предпочтительными являются алкиламино радикалы, содержащие от одного до примерно восьми атомов углерода. Подходящими низшими алкиламинами могут быть однозамещенные Nалкиламино или двухзамещенные N,N-алкиламино, такие как N-метиламино, N-этиламино, N,Nдиметиламино, N,N-диэтиламино или тому подобное. Термин "замещенный" указывает на замену одного или более водородных радикалов в данной структуре на радикал специфического заместителя, включая, но ими не ограничиваясь: галоген, алкил,алкенил, алкинил, арил, гетероциклил, тио, алкилтио, арилтио, алкилтиоалкил, арилтиоалкил, алкилсульфонил, алкилсульфонилалкил, арилсульфонилалкил, алкокси, арилокси, аралкокси, аминокарбонил,аминокарбонилциклоалкил, аминокарбонилгетероциклил, алкиламинокарбонил, ариламинокарбонил,алкоксикарбонил, арилоксикарбонил, галоалкил, амин, трифторметил, циано, нитро, алкиламино, ариламино, алкиламиноалкил, ариламиноалкил, аминоалкиламино, гидрокси, алкоксиалкил, карбоксиалкил,алкоксикарбонилалкил, аминокарбонилалкил, ацил, аралкоксикарбонил, карбоновую кислоту, сульфокислоту, сульфонил, фосфоновую кислоту, арил, гетероарил, гетероциклические и алифатические радикалы. Необходимо понимать, что заместители могут быть дополнительно замещенными. Для простоты химические компоненты, которые определены и упоминаются в тексте, могут быть унивалентными химическими компонентами (например, алкил, арил и т.д.) или мультивалентными компонентами в определенных структурных обстоятельствах, которые понятны специалисту в данной области техники. Например, "алкильный" компонент может обозначать моновалентный радикал (например,СН 3-СН 2-), или в других случаях бивалентный связующий компонент может быть "алкилом", в таком случае специалист в данной области техники будет понимать, что алкил представляет собой дивалентный радикал (например, -СН 2-СН 2-), который эквивалентен термину "алкилен". Подобным образом в условиях, когда требуются дивалентные компоненты, указанные как "алкокси", "алкиламино", "арилокси", "алкилтио", "арил", "гетероарил", "гетероциклический", "алкил", "алкенил", "алкинил", "алифатический" или "циклоалкил", специалист в данной области техники будет понимать, что термины "алкокси","алкиламино", "арилокси", "алкилтио", "арил", "гетероарил", "гетероциклический", "алкил", "алкенил","алкинил", "алифатический" или "циклоалкил" относятся к соответствующему дивалентному компоненту. Термины "галоген" или "гало" в используемом здесь значении относятся к атому, выбираемому из фтора, хлора, брома и йода. Термин "соединение" в используемом здесь значении включает фармацевтически приемлемые соли,- 11019309 сольваты, гидраты, полиморфы, энантиомеры, диастереоизомеры, рацематы и тому подобное соединений, имеющих указанную формулу. Термин "лечение" относится к любому процессу, действию, применению, терапии или тому подобному, когда млекопитающее, включая человека, является объектом медицинской помощи с целью улучшения состояния данного млекопитающего, непосредственно или косвенно. В используемом здесь значении термин "фармацевтически приемлемая соль" относится к таким солям, которые в рамках существующего в медицине мнения являются приемлемыми для применения в контакте с тканями человека и низших животных без повышенной токсичности, раздражения, аллергического ответа и тому подобного, и могут обеспечивать разумное соотношение выгода/риск. Фармацевтически приемлемые соли хорошо известны в данной области техники. Например, S. M. Berge, et al. детально описывает фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 66: 1-19 (1977). Соли могут быть получены in situ во время завершающего выделения и очистки соединений настоящего изобретения, или получены отдельно путем реакции свободного основания с подходящей органической кислотой или неорганической кислотой. Примеры фармацевтически приемлемых дополнительных солей нетоксичных кислот включают, но ими не ограничиваются, соли аминогрупп, образуемые с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, фосфорная кислота, серная кислота и хлорная кислота, или с органическими кислотами, такими как уксусная кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота, лактобионовая кислота или малоновая кислота, или с помощью других методов, известных в данной области техники, таких как ионный обмен. Другие фармацевтически приемлемые соли включают, но ими не ограничиваются, адипаты, альгинаты,аскорбаты, аспартаты, бензосульфонаты, бензоаты, бисульфаты, бораты, бутираты, камфораты, камфоросульфонаты, цитраты, циклопентанпропионаты, диглюконаты, додецилсульфаты, этансульфонаты,форматы, фумараты, глюкогептонаты, глицерофосфаты, глюконаты, хемисульфаты, гептаноаты, гексаноаты, гидройодиды, 2-гидроксиэтансульфонаты, лактобионаты, лактаты, лаураты, лаурилсульфаты, малаты, малеаты, малонаты, метансульфонаты, 2-нафталинсульфонаты, никотинаты, нитраты, олеаты, оксалаты, пальмитаты, памоаты, пектинаты, персульфаты, 3-фенилпропионаты, фосфаты, пикраты, пивалаты, пропионаты, стеараты, сукцинаты, сульфаты, тартраты, тиоцианаты, р-толуолсульфонаты, андеканоаты, валераты и тому подобное. Типичные соли щелочных или щелочно-земельных металлов включают соли натрия, лития, калия, кальция, магния и тому подобное. Дополнительные фармацевтически приемлемые соли включают, когда это приемлемо, катионы нетоксичного аммония, четвертичного аммония и амина, образованные с применением противоионов, таких как галид, гидроксид, карбоксилат, сульфат,фосфат, нитрат, алкил, имеющий от 1 до 6 атомов углерода, сульфонат и арилсульфонат. В используемом здесь значении термин "фармацевтически приемлемый эфир" относится к сложным эфирам, которые гидролизуются in vivo, и включают такие эфиры, которые быстро распадаются в организме человека с освобождением родительского соединения или его соли. Подходящие эфирные группы включают, например, такие группы, которые являются производными фармацевтически приемлемых алифатических карбоновых кислот, в частности алкановой, алкеновой, циклоалкановой и алкандионовой кислот, в которых каждый алкильный или алкенильный остаток предпочтительно имеет не более чем 6 атомов углерода. Примеры конкретных эфиров включают, но ими не ограничиваются, форматы, ацетаты, пропионаты, бутираты, акрилаты и этилсукцинаты. Термин "фармацевтически приемлемые пролекарства" в используемом здесь значении относится к таким пролекарствам соединений настоящего изобретения, которые в рамках существующего в медицине мнения, являются приемлемыми для применения в контакте с тканями человека и низших животных без повышенной токсичности, раздражения, аллергического ответа и тому подобное, могут обеспечивать разумное соотношение выгода/риск, являются эффективными при их направленном применении, а также к цвиттерионным формам соединений настоящего изобретения, где это возможно. В используемом здесь значении термин "пролекарство" означает соединение, которое может in vivo превращаться метаболическим путем (например, путем гидролиза) в соединение настоящего изобретения. В данной области техники известны многие формы пролекарств, например, как это обсуждается в работах Bundgaard, (ed.),Design of Prodrugs, Elsevier (1985); Widder, et al., (ed.), Methods in Enzymology, vol. 4, Academic PressDrug And Prodrug Metabolism: Chemistry, Biochemistry And Enzymology," John Wiley and Sons, Ltd. (2002). В используемом здесь значении термин "фармацевтически приемлемый носитель" включает любой из всех растворителей, дисперсионных сред, покрытий, антибактериальных и противогрибковых агентов,изотонических и замедляющих абсорбцию агентов и тому подобное, совместимых с фармацевтическим введением, такой, как стерильная свободная от пирогенов вода. Подходящие носители описаны в последнем издании Remington's Pharmaceutical Sciences, стандартном справочнике в данной области техники, который включается в настоящее изобретение путем отсылки. Предпочтительные примеры таких носителей и разбавителей включают, но ими не ограничиваются, воду, физиологический раствор, рас- 12019309 творы Рингера, раствор декстрозы и 5% сывороточный альбумин человека. Липосомы и не-водные носители, такие как нелетучие масла, также могут применяться. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области техники. За исключением тех случаев,когда какая-либо обычная среда или агент является несовместимым с активным соединением, предполагается их применение в композициях. В композиции также могут быть включены дополнительные активные соединения. В используемом здесь значении, термин "субъект" означает животное. Предпочтительно животное является млекопитающим. Более предпочтительно млекопитающее представляет собой человека. Субъектом также являются, например, собаки, кошки, лошади, коровы, свиньи, морские свинки, рыбы, птицы и тому подобное. Соединения настоящего изобретения могут быть модифицированы путем присоединения подходящих функциональных групп для усиления избирательных биологических свойств. Такие модификации известны в данной области техники и могут включать такие модификации, которые усиливают биологическую проницаемость в данную биологическую систему (например, в кровь, лимфатическую систему,центральную нервную систему), увеличивают пероральную доступность, увеличивают растворимость для возможности введения путем инъекции, изменяют метаболизм и изменяют скорость выведения. Синтезированные соединения могут быть отделены от реакционной среды и дополнительно очищены методами, такими как колоночная хроматография, жидкостная хроматография высокого давления или перекристаллизация. Как должно быть понятно специалисту в данной области техники, дополнительные методы синтеза соединений с приведенной здесь формулой будут очевидны специалисту среднего уровня в данной области техники. Кроме того, различные стадии синтеза могут быть проведены в другой последовательности или в другом порядке для получения желаемых соединений. Трансформации при химическом синтезе и способы защиты групп (защиты и снятия защиты), применимые при синтезе описанных здесь соединений, известны в данной области техники и включают, например, такие способы, которые описаны в R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene andFieser, Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); и L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis. John Wiley and Sons (1995), и в их последующих изданиях. Описанные здесь соединения содержат один или более асимметрических центров, что следовательно приводит к возникновению энантиомеров, диастереомеров и других стереоизомерных форм, которые могут быть определены в терминах абсолютной стереохимии как (R)- или (S)-, или как (D)- или (L)- для аминокислот. Настоящее изобретение включает все такие возможные изомеры, а также их рацематные и оптически чистые формы. Оптические изомеры могут быть получены из их соответствующих оптически активных предшественников способами, описанными выше, или путем разделения рацематных смесей. Разделение может быть проведено в присутствии разделяющего агента, путем хроматографии или путем повторной перекристаллизации, или с помощью определенных комбинаций этих способов, которые известны специалистам в данной области техники. Дополнительные детали относительно разделения можно найти в Jacques, et al., Enantiomers, Racemates, and Resolutions (John WileySons, 1981). Когда описанные здесь соединения содержат олефиновые двойные связи, другие ненасыщенные компоненты или центры геометрической асимметрии, если это не указано по-другому, предполагается, что соединения включают оба Е и Z геометрических изомера и/или цис- и транс-изомеры. Аналогично этому в настоящее изобретение включены все таутомерные формы. Конфигурация любой двойной связи углерод-углерод,приведенная здесь, выбрана исключительно для удобства и не предназначена для обозначения какойлибо определенной конфигурации, если в тексте не указано по-другому, то есть двойная связь углеродуглерод или углерод-гетероатом показана здесь произвольно, так что транс может быть цис, транс или смесью этих двух форм в любом соотношении. Фармацевтические композиции Фармацевтические композиции настоящего изобретения включают терапевтически эффективное количество соединения настоящего изобретения, смешанного с одним или более фармацевтически приемлемыми носителями или эксципиентами. В используемом здесь значении термин "фармацевтически приемлемый носитель или эксципиент" означает нетоксичный, инертный твердый, полутвердый или жидкий наполнитель, разбавитель, инкапсулирующий материал или вспомогательную смесь любого типа. Некоторые примеры материалов, которые могут выступать в роли фармацевтически приемлемых носителей, представляют собой сахара, такие как лактоза, глюкоза и сахароза; циклодекстрины, такие как альфа-, бета- и гамма- циклодекстрины; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и целлюлозоацетат; порошкообразный трагакант; солод; желатин; тальк; наполнители, такие как кокосовое масло и воска для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное и соевое масло; гликоли, такие как полипропиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; свободную от пирогенов воду; изотонический физиологический раствор; раствор Рингера; этило- 13019309 вый спирт и фосфатные буферные растворы, а также другие нетоксичные совместимые любриканты, такие как лаурилсульфат натрия и стеарат магния, а также красящие агенты, высвобождающие агенты, покрывающие агенты, подсластители, ароматизаторы и отдушки, консерванты и антиоксиданты также могут присутствовать в композиции согласно решению изготовителя данной композиции. Фармацевтические композиции настоящего изобретения могут вводиться перорально, парентерально, в виде спрея для ингаляций, топически (местно), ректально, назально, буккально, вагинально или через устройство для имплантации, предпочтительно путем перорального введения или введения путем инъекции. Фармацевтические композиции настоящего изобретения могут содержать любые обычные нетоксичные фармацевтически приемлемые носители, адъюванты или наполнители. В некоторых случаях значение pH композиции может быть доведено до нужного значения с помощью фармацевтически приемлемых кислот, оснований или буферов для повышения стабильности соединения в композиции или его формы доставки. В используемом здесь значении термин "парентерально" включает подкожное,внутрикожное, внутривенное, внутримышечное, внутрисуставное, внутриартериальное, внутрисиновиальное, внутригрудинное, подоболочечное введение, введение в пораженный участок и внутричерепную инъекцию или способы инфузии. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных соединений,жидкие лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности,хлопковое, арахисовое, кукурузное, зародышевое, оливковое, касторовое и кунжутное масла), глицерин,тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси. Помимо инертных разбавителей пероральные композиции могут также включать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подсластители, ароматизирующие агенты и отдушки. Препараты для инъекций, например стерильные водные или масляные суспензии для инъекций, могут готовиться согласно способам, известным в данной области техники, с применением подходящих диспергирующих и смачивающих агентов и суспендирующих агентов. Стерильные препараты для инъекций могут также представлять собой стерильные растворы, суспензии или эмульсии для инъекций в нетоксичных пригодных для парентерального введения разбавителях или растворителях, например, такие как раствор в 1,3-бутандиоле. Среди пригодных наполнителей и растворителей, которые могут применяться, присутствуют вода, раствор Рингера, U.S.P. и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или среды для суспендирования обычно применяются стерильные нелетучие масла. Для этой цели может применяться любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, при приготовлении препаратов для инъекций применяются жирные кислоты, такие как олеиновая кислота. Композиции для инъекций могут стерилизоваться, например, путем фильтрации через бактериальные (задерживающие бактерии) фильтры или с помощью включения стерилизующих агентов в лекарственные формы стерильных твердых композиций, которые могут растворяться или диспергироваться в стерильной воде или другой стерильной среде для инъекций перед применением. Для того чтобы пролонгировать эффект лекарства, часто желательным является замедление абсорбции лекарства после подкожной или внутримышечной инъекции. Этого можно достичь при применении жидкой суспензии кристаллического или аморфного материала с плохой растворимостью в воде. В этом случае скорость абсорбции лекарства зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно этому, замедленная абсорбция лекарства при введении парентеральной лекарственной формы достигается путем растворения или суспендирования лекарства в масляном носителе. Лекарственные формы для инъекций с длительным высвобождением готовятся путем создания микроинкапсулированных матриц лекарства в биодеградируемых полимерах, таких как полиактид-полигликолид. В зависимости от соотношения лекарства и полимера и природы конкретного применяемого полимера скорость высвобождения лекарства может контролироваться. Примеры других биодеградируемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Лекарственные формы для инъекций с длительным высвобождением также готовятся путем включения лекарства в липосомы или микроэмульсии, которые совместимы с тканями организма. Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые могут быть приготовлены путем смешивания соединений настоящего изобретения с подходящими не вызывающими раздражения эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при комнатной температуре и соответственно расплавляются в прямой кишке или полости влагалища с высвобождением активного соединения. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли,порошки и гранулы. В таких твердых лекарственных формах активное соединение смешивается по меньшей мере с одним инертным, фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальцийфосфат и/или: а) с наполнителями или разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннитол и кремниевая кислота, б) связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик, в) увлажнителями, такими как глицерин, г) дезинтегрирующими агентами, такими как агарагар, карбонат кальция, картофельный крахмал и крахмал из тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия, д) агентами, замедляющими растворение, такими как парафин, е) ускорителями абсорбции, такими как соединения четвертичного аммония, ж) смачивающими агентами, такими как, например, цетиловый спирт и глицеролмоностеарат, з) абсорбентами, такими как каолин и бентонитовая глина, и) любрикантами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смесями. В случае капсул, таблеток и пилюль лекарственные формы могут также включать буферные агенты. Твердые композиции подобного типа могут также применяться в качестве наполнителей в мягких или твердых желатиновых капсулах с применением таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и тому подобное. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут изготавливаться с покрытиями и оболочками, такими как покрытия для растворения в кишечнике и другие покрытия, хорошо известные в фармацевтическом производстве. Они не обязательно могут содержать придающие матовость агенты, а также могут быть композицией, которая высвобождает активный(ые) ингредиент(ы) только, или предпочтительно, в определенном участке желудочно-кишечного тракта, не обязательно с замедленным высвобождением. Примеры таких связанных композиций, которые могут применяться, включают полимерные вещества и воски. Лекарственные формы для местного или трансдермального введения соединения настоящего изобретения включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, препараты для ингаляций или пластыри. Активный компонент смешивается в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, которые могут потребоваться. Глазные композиции, глазные капли, глазные мази, порошки и растворы также рассматриваются,как входящие в рамки настоящего изобретения. Мази, пасты, кремы и гели в дополнение к активному соединению настоящего изобретения могут содержать эксципиенты, такие как животные и растительные жиры, масла, воски, парафины, крахмал,трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту,тальк и окись цинка или их смеси. Порошки и спреи могут содержать в дополнение к активному соединению настоящего изобретения эксципиенты, такие как лактоза, тальк, кремниевая кислота, гидроокись алюминия, силикаты кальция и полиамидный порошок, или смеси этих веществ. Спреи могут дополнительно содержать обычные пропелленты, такие как хлорфторуглеводороды. Трансдермальные пластыри имеют дополнительное преимущество, поскольку обеспечивают контролируемую доставку соединения в организм. Такие лекарственные формы могут быть приготовлены путем растворения или диспергирования соединения в подходящей среде. Могут также применяться усилители абсорбции для увеличения потока соединения через кожу. Скорость поступления можно контролировать либо с помощью контролирующей скорость мембраны, либо путем диспергирования соединения в полимерной матрице или в геле. Для доставки через легкие терапевтическая композиция настоящего изобретения приготавливается и вводится пациенту в твердой или жидкой измельченной форме путем прямого введения, например,ингаляцией в дыхательную систему. Твердые или жидкие измельченные формы активного соединения,приготовляемые для практического применения настоящего изобретения, включают частицы пригодного для вдыхания размера: то есть частицы, размер которых достаточно мал для прохождения через рот и гортань в процессе ингаляции и поступления в бронхи и альвеолы легких. Доставка терапевтических веществ в виде аэрозолей, в частности антибиотиков в виде аэрозолей, известна в данной области техники(см., например, U.S. Pat. No. 5767068, принадлежащий VanDevanter et al, U.S. Pat. No. 5508269, принадлежащий Smith et al, и WO 98/43650, принадлежащий Montgomery, все эти Патенты включены в настоящее изобретение путем отсылки). Обсуждение доставки антибиотиков через легкие можно также найти вU.S. Pat. No. 6014969, который включается в настоящее изобретение путем отсылки. Под "терапевтически эффективным количеством" соединения настоящего изобретения понимается такое количество соединения, которое обеспечивает терапевтический эффект у получающего лечение субъекта, при разумном соотношении польза/риск, применимом к любому виду медицинского лечения. Терапевтический эффект может быть объективным (то есть измеряемым с помощью определенного теста или маркера), или субъективным (то есть объект лечения демонстрирует признаки или чувствует эффект лекарства). Эффективное количество соединения, описанное выше, может находиться в диапазоне от примерно 0,1 мг/кг до примерно 500 мг/кг, предпочтительно от примерно 1 мг/кг до примерно 50 мг/кг. Эффективные дозировки будут также варьировать в зависимости от пути введения, а также от возможности совместного применения других агентов. Однако необходимо понимать, что общее суточное приме- 15019309 нение соединений и композиций настоящего изобретения будет определяться лечащим врачом в рамках существующей медицинской практики. Специфический терапевтически эффективный уровень дозировки для любого конкретного пациента будет зависеть от множества факторов, включая заболевание, которое лечится, и тяжесть этого заболевания, активность применяемого специфического соединения, специфическую композицию, которая применяется, возраст, массу тела, общее состояние здоровья, пол и диету пациента, время введение, путь введения и скорость выведения применяемого специфического соединения, длительность лечения, лекарства, применяемые в комбинации или в одно и то же время с применяемым специфическим соединением, и подобные факторы, хорошо известные в медицинской практике. Общая суточная дозировка соединений настоящего изобретения, вводимая человеку или другому животному однократно или в виде нескольких доз, может составлять, например, от 0,01 до 50 мг/кг массы тела или более обычно от 0,1 до 30 мг/кг массы тела. Такие количества может содержать однократная доза композиций, или несколько более мелких доз могут составлять суточную дозу. Обычно схема лечения согласно настоящему изобретению включает введение пациенту, нуждающемуся в таком лечении, от примерно 10 мг до примерно 1000 мг соединения(ий) настоящего изобретения в день в виде однократной дозы или в виде нескольких доз. Соединения формулы, описанной здесь, могут, например, вводиться путем инъекции, внутривенно,внутриартериально, подкожно, внутрибрюшинно, внутримышечно или подкожно; или перорально, буккально, назально, через слизистые, местно (топически), в виде глазных препаратов или путем ингаляции в дозировке от примерно 0,1 до примерно 500 мг/кг массы тела, альтернативно этому в дозировках между 1 мг и 1000 мг/дозу, каждые 4-120 ч или в соответствии с требованиями для данного конкретного лекарства. Описанные здесь способы подразумевают введение эффективного количества соединения или содержащей соединение композиции для достижения желаемого или заданного эффекта. Обычно фармацевтические композиции настоящего изобретения будут вводиться от примерно 1 до примерно 6 раз в сутки или, альтернативно этому, в виде непрерывной инфузии. Такое введение может применяться в качестве хронической или острой терапии. Количество активного ингредиента, который может комбинироваться с фармацевтическими наполнителями или носителями для получения однократной дозированной формы, будет варьировать в зависимости от объекта лечения и от определенного способа введения. Типичные препараты будут содержать от примерно 5 до примерно 95% активного соединения (по массе). Альтернативно этому, такие препараты могут содержать от примерно 20% до примерно 80% активного соединения. Могут потребоваться более низкие или более высокие дозировки, чем те, которые указаны выше. Специфические дозировки и схемы лечения для каждого конкретного пациента будут зависеть от множества факторов, включая активность применяемого специфического соединения, возраст, масса тела, общее состояние здоровья, пол, диету, время введения, скорость выведения, комбинацию лекарств, тяжесть и течение болезни, состояния или симптомов, отношение пациента к болезни, состоянию или симптомам,и решение лечащего врача. При улучшении состояния пациента, если это необходимо, может вводиться поддерживающая доза соединения настоящего изобретения, композиции настоящего изобретения или их комбинации. Впоследствии дозировка или частота введения или и то и другое, могут быть снижены, в зависимости от симптомов, до уровня, при котором сохраняется улучшенное состояние, когда симптомы снизились до желаемого уровня. Однако пациенты могут нуждаться в периодическом повторном лечении на долговременной основе при любом рецидиве симптомов болезни. Способы синтеза и примеры Соединения и способы настоящего изобретения будут лучше понятны при знакомстве со следующими примерами, которые предназначены исключительно для иллюстрации и не ограничивают рамок настоящего изобретения. Квалифицированному специалисту в данной области техники будут очевидны различные изменения и модификации, которые можно внести в раскрываемые воплощения, и такие изменения и модификации, включая, но ими не ограничиваясь, те, которые касаются химических структур,заместителей, производных, композиций и/или способов настоящего изобретения могут быть сделаны без отступления от духа настоящего изобретения и выхода из рамок прилагаемой формулы изобретения. Схема 1b. BBr3, CH2Cl. 5-(2-Метоксибифенил)-1H-индол (2). К раствору вещества 1 (0,052 мг, 0,26 ммоль) в 3,5 мл диметоксиэтана и воды (3:0,5) были добавлены 2-метоксибифенилборная кислота (0,09 г, 0,39 ммоль), гидроокись бария (0,12 г, 0,39 ммоль) и 2 мол.% Pd(PPh3)4 в инертной атмосфере. Реакционную смесь нагревали при 85C. Через 6 ч раствор был охлажден до комнатной температуры и профильтрован. Осадок промывали этилацетатом и объединенный фильтрат концентрировали при пониженном давлении. Неочищенный осадок был очищен колоночной хроматографией на силикагеле с выходом 45 мг вещества 2: 1 Н ЯМР (CDCl3, 400 МГц)8,19 (br s,1H), 7,90 (s, 1H), 7,70 (m, 2 Н), 7,62 (m, 2 Н), 7,49 (m, 2 Н), 7,39 (m, 2 Н), 7,05 (m, 2 Н), 6,61 (s, 1H), 3,84 (s,3H). 5-(2-Гидроксибифенил)-1H-индол (3) [соединение 1]. К раствору вещества 2 (0,025 г, 0,084 ммоль) в 4 мл дихлорметана было добавлено 0,25 мл 1,0 М раствора трибромида бора в дихлорметане при 0C. Реакционная смесь была оставлена для нагревания до комнатной температуры и оставалась при этой температуре при перемешивании в течение ночи. После завершения реакции реакционная смесь была разведена добавлением 20 мл дихлорметана и промыта насыщенным раствором бикарбоната натрия (215 мл), водой (215 мл), солевым раствором (брином)(110 мл), высушена (Na2SO4) и сконцентрирована in vacuo. Неочищенный осадок был очищен колоночной хроматографией на силикагеле с выходом 10 мг вещества 3. MS (ES +ve) m/z 286. Схема 2(10:1:3:6) Метил-2-(2-цианацетамидо)-5-бромбензоат (5). Титульное соединение может быть получено двумя альтернативными способами. А) К раствору вещества 4 (1,00 г, 4,35 ммоль) в 16 мл дихлорметана был добавлен триэтиламин(1,32 г, 13,05 ммоль), и реакционная смесь была охлаждена до 0C. К вышеназванному раствору был добавлен цианацетилхлорид (10,87 ммоль) (свежеприготовленный из цианоуксусной кислоты (0,92 г, 10,87 ммоль) и оксалилхлорида (10,87 ммоль) в 16 мл дихлорметана и каталитических количеств DMF). Реакционная смесь была оставлена нагреваться при комнатной температуре. После завершения реакции дихлорметан удаляли in vacuo и неочищенный осадок экстрагировали этилацетатом (50 мл), далее органический слой был промыт насыщенным бикарбонатом натрия (225 мл), водой (225 мл), солевым раствором (115 мл), высушен (Na2SO4) и сконцентрирован in vacuo. Неочищенный осадок был очищен колоночной хроматографией на силикагеле с почти количественным выходом вещества 5. 1H ЯМР (CDCl3,400 МГц)8,41 (d, J = 9,2 Гц, 1H), 8,08 (d, J= 2,4 Гц, 1H), 7,58 (dd, J= 2,4 Гц, 9,2 Гц, 1H), 3,58 (s, 2 Н). Б) К раствору цианоуксусной кислоты (0,92 г, 10,87 ммоль) в 20 мл дихлорметана и диметилацетамида (4:1) был добавлен HATU (4,13 г, 10,87 ммоль) и диизопропилэтиламин (1,75 г, 13,49 ммоль), после чего реакционная смесь перемешивалась в течение 15 мин. К вышеназванному раствору был добавлен 4(1,00 г, 4,35 ммоль) в 10 мл дихлорметана и реакционная смесь нагревалась при 60C. После завершения реакции реакционная смесь была охлаждена до комнатной температуры и промыта насыщенным бикарбонатом натрия (225 мл), водой (225 мл), солевым раствором (115 мл), высушена (Na2SO4) и сконцентрирована in vacuo. Неочищенный осадок был очищен колоночной хроматографией на силикагеле с получением почти количественного выхода вещества 5. 1H ЯМР (CDCl3 + CD3OD, 400 МГц)8,41 (d, J = 9,2 Гц, 1 Н), 8,08 (d, J=2,4 Гц, 1H), 7,58 (dd, J= 2,4 Гц, 9,2 Гц, 1 Н), 3,58 (s, 2H). 6-Бром-2,4-дигидроксихинолин-3-карбонитрил (6). Перемешиваемый раствор вещества 5 (0,15 г, 0,48 ммоль) в 7 мл THF был охлажден до -78C. К охлажденному раствору было добавлено 2,41 мл раствора KHMDS (0,5 М). Реакционную смесь оставляли нагреваться до комнатной температуры. После завершения реакции реакционная смесь была сконцентрирована in vacuo. К осадку было добавлены 10 мл воды. Водный слой промывали диэтиловым эфиром(215 мл) и затем подкисляли 1 М HCl. Твердый осадок отфильтровывали и промывали водой и эфиром с получением 60 мг вещества 6. 1H ЯМР (CD3OD, 400 МГц)8,13 (d, J = 2,4 Гц, 1H), 7,71 (dd, J = 2,4 Гц,9,2 Гц, 1H), 7,21 (d, J = 9,2 Гц, 1H); MS (Es +ve) m/z 265, (Es -ve) m/z 263. 6-(2-Гидроксибифенил)-2,4-дигидроксихинолин-3-карбонитрил (7) [соединение 2]. К раствору вещества 6 (0,037 г, 0,140 ммоль) в 4,3 мл смеси диметоксиэтан : толуол : этанол : вода(0,091 г, 0,28 ммоль) и 2 мол.% тетракиспалладия в инертной атмосфере. Реакционная смесь нагревалась при 100C в течение ночи. После завершения реакции реакционная смесь охлаждалась до комнатной температуры и была сконцентрирована in vacuo. Полученный осадок растворяли в 10 мл воды, водный слой был промыт этилацетатом (215 мл) и водный слой был подкислен добавлением 1 М HCl. Твердый осадок отфильтровывали и промывали водой и эфиром с получением 18 мг вещества 7. 1H ЯМР (CD3OD,- 17019309(10:1:3:6). Этил-2-амино-6-хлорбензоат (9). К раствору вещества 8 (0,50 г, 2,91 ммоль) в 7 мл THF был добавлен 1,1'-карбонилдиимидазол (0,52 г, 3,20 ммоль) и реакционная смесь перемешивалась 4 ч. После завершения реакционная смесь была сконцентрирована in vacuo, и твердый осадок был растворен в 50 мл дихлорметана, промыт насыщенным бикарбонатом натрия (225 мл), водой (225 мл), солевым раствором (115 мл), высушен (Na2SO4) и сконцентрирован in vacuo с получением 0,48 г твердого вещества. Твердое вещество растворяли в 1 мл этанола и 5 мл THF, после чего был добавлен этоксид натрия (0,18 г) и реакционная смесь нагревалась при 70C в течение 1 ч. После завершения реакции растворитель удаляли in vacuo, и осадок был растворен в этилацетате, промыт водой (2 х 15 мл), солевым раствором (115 мл), высушен (Na2SO4) и сконцентрирован in vacuo с получением 0,29 г практически чистого вещества 9. Аналитический образец вещества 9 был приготовлен путем очистки с применением колоночной хроматографии на силикагеле 1 Н ЯМР (CDCl3, 400 МГц)7,07 (m, 1 Н), 6,74 (d, J=8,0 Гц, 1 Н), 6,57 (d, J= 8,0 Гц, 1 Н). Этил-2-(2-цианацетамидо)-4-хлорбензоат (10). Титульное соединение было получено аналогичным способом, как описано для вещества 5. Таким образом, начиная с вещества 9 (0,05 г, 0,35 ммоль) и следуя описанной выше процедуре, было получено 25 мг чистого вещества 10. 1 Н ЯМР (CDCl3, 400 МГц)9,71 (br s, 1H), 8,19 (d, J = 8,4 Гц, 1 Н), 7,40 (m,1H), 7,26 (m, 1H), 4,51 (q, J = 7,2 Гц, 2 Н), 3,54 (s,2H), 1,45 (t,J = 7,2 Гц, 3H). 5-Хлор-2,4-дигидроксихинолин-3-карбонитрил (11). Титульное соединение было получено аналогичным способом, как описано для вещества 6. Таким образом, начиная с вещества 10 (0,30 г, 1,12 ммоль) и следуя описанной выше процедуре, было получено 125 мг чистого вещества 11. MS (Es +ve) m/z 221, (Es -ve) m/z 219. 5-(2-Гидроксибифенил)-2,4-дигидроксихинолин-3-карбонитрил (12) [соединение 3]. Титульное соединение было получено аналогичным способом, как описано для вещества 7. Таким образом, начиная с вещества 11 (0,043 г, 0,195 ммол.%) и следуя описанной выше процедуре, 2 мол.%Pd(OAc)2, S-phos (4 мол.%) и 1,0 М K3PO4 (3 эквивалента) применялись вместо Pd(PPh3)4 и карбоната цезия, было получено 10 мг чистого вещества 12. 1 Н ЯМР (DMSO-d6, 400 МГц)10,01 (s, 1H), 9,49 (s,1H), 7,41 (d, J= 8,0 Гц, 2 Н), 7,28 (m, 2 Н), 7,13 (m, 4 Н), 6,93 (m, 2 Н), 6,61 (d, J= 7,2 Гц, 1 Н); MS (Es +ve),m/z 354 (Es -ve) m/z 353. Схема 4 К перемешиваемому раствору гидроксиламингидрохлорида (0,47 г, 6,76 ммоль) в 10 мл метанола был добавлен ацетат натрия (0,56 г, 6,76 ммоль), и реакционная смесь перемешивалась в течение 15 мин. После этого было добавлено вещество 13 (1,00 г, 5,41 ммоль) и реакционная смесь нагревалась при 70C в течение 4 ч. После завершения реакционная смесь была сконцентрирована in vacuo. Твердый осадок был растворен в дихлорметане (25 мл) и воде (20 мл). Органический слой отделяли и промывали последовательно водой (220 мл), солевым раствором (115 мл), высушивали (Na2SO4) и концентрировали с получением 0,75 г вещества 14 (смесь геометрических изомеров). 1H ЯМР (CDCl3, 400 МГц)8,06 (s,1H), 7,51 (d, J=8,4 Гц, 2 Н), 7,43 (d, J=8,4 Гц, 2H). 4-Бромбензальдегид-2-хлороксим (15). К перемешиваемому раствору вещества 14 (0.75 г, 3,75 ммоль) в 16 мл DMF был добавлен Nхлорсукцинимид (0,50 г, 3,75 ммоль) медленно при 0C. Реакционную смесь нагревали при 50C в течение 1 ч и выливали в размельченный лед. Разведенное водой выпавшее в осадок твердое вещество промывали водой и высушивали с получением 0,9 г практически чистого вещества 15. 1 Н ЯМР (CDCl3, 400 МГц)7,56 (d, J= 8,4 Гц, 2 Н), 7,37 (d, J=8,4 Гц, 2H). Этил-5-амино-3-(4-бромфенил)изоксазол-4-карбоксилат(16). К раствору этилцианацетата (0,11 мл, 1,1 ммоль) в 4 мл этанола, охлажденному до 0C, был добавлен этоксид натрия (0,07 г, 1,1 ммоль), и реакционная смесь перемешивалась при этой температуре в течение 15 мин. К вышеназванному раствору было добавлено вещество 15 (0,24 г, 1,00 ммоль) в 3 мл этанола при 0C, и реакционная смесь была оставлена для нагревания до комнатной температуры. Реакционная смесь перемешивалась при комнатной температуре в течение ночи и была сконцентрирована invacuo. Неочищенная смесь была растворена в этилацетате (25 мл) и воде (20 мл). Органический слой был отделен и промыт водой (220 мл), насыщенным NH4Cl (215 мл), солевым раствором (115 мл), высушен (Na2SO4) с получением 0,3 г практически чистого вещества 16. Если необходимо, твердое вещество может быть дополнительно очищено путем поршкования со смесью 15-20% этилацетатхексан. Аналитический образец был приготовлен путем очистки с применением колоночной хроматографии на силикагеле 1H ЯМР (CDCl3, 400 МГц)7,55 (m, 4H), 6,10 (br s, 2H), 4,22 (q, J = 7,2 Гц, 2 Н), 1,20 (t, J = 7,2 Гц, 3H);MS (Es +ve) m/z 311 (Es -ve) m/z 309. Этил-5-(2-цианацетамидо)-3-(4-бромфенил)изоксазол-4-карбоксилат (17). Титульное соединение было получено аналогичным способом, как описано для вещества 5. Таким образом, начиная с вещества 16 (0,10 г, 0,323 ммоль) и следуя описанной выше процедуре, было получено 90 мг чистого вещества 17. 1 Н ЯМР (CDCl3, 400 МГц)7,35 (d, J = 7,2 Гц, 2 Н), 7,31 (d, J = 7,2 Гц, 2 Н),4,05 (q, J = 7,2 Гц, 2 Н), 3,39 (s, 1 Н), 1,20(t, J= 7,2 Гц, 3H). 3-(4-Бромфенил)-4,6-дигидроксиизоксазоло[5,4-b]пиридин-5-карбонитрил (18). Титульное соединение было получено аналогичным способом, как описано для вещества 6. Таким образом, начиная с вещества 17 (0,06 г, 0,159 ммоль) и следуя описанной выше процедуре, было получено 25 мг чистого вещества 18. 1 Н ЯМР (CD3OD, 400 МГц)7,69 (d, J = 7,2 Гц, 2 Н), 7,63 (d, J=7,2 Гц, 2 Н). 3-(2-Гидроксибифенил)-4,6-дигидроксиизоксазоло[5,4-6]пиридин-5-карбонитрил (19) [соединение 9]. Титульное соединение было получено аналогичным способом, как описано для вещества 7. Таким образом, начиная с вещества 18 (0,022 г) и следуя описанной выше процедуре, 2-гидроксибензолборная кислота использовалась вместо 2-гидроксибифенилборной кислоты, было получено 10 мг чистого вещества 19. 1H ЯМР (CD3OD, 400 МГц)7,84 (d, J = 8,0 Гц, 2H), 7,76 (d, J = 8,0 Гц, 2H), 7,30 (d, J= 9,2 Гц,1H), 7,16-7,2 (m, 1H), 6,88-6,92 (m, 2H). Схема 5(10:1:3:6). Метил 2-амино-5-бромпиридин-3-карбоксилат (21). Титульное соединение было получено аналогичным способом, как описано для вещества 5. Таким образом, начиная с вещества 20 (0,30 г, 1,3 ммоль) и следуя описанной выше процедуре, было получено 313 мг чистого вещества 21. 6-Бром-2,4-дигидрокси-1,8-нафтиридин-3-карбонитрил (22). Титульное соединение было получено аналогичным способом, как описано для вещества 6. Таким образом, начиная с вещества 21 (0,313 г, 1,05 ммоль) и следуя описанной выше процедуре, было получено 106 мг чистого вещества 22. 1H ЯМР (CDCl3, 400 МГц)8,51 (s, 1H), 8,29 (s, 1H); MS (Es +ve) m/z 267,- 19019309(Es -ve) m/z 265. 6-(2-Гидроксибифенил)-2,4-дигидрокси-1,8-нафтиридин-3-карбонитрил (23) [соединение 8]. Титульное соединение было получено аналогичным способом, как описано для вещества 7. Таким образом, начиная с вещества 22 (0,106 г, 0,398 ммоль) и следуя описанной выше процедуре, было получено 56 мг чистого вещества 23. 1H ЯМР (CDCl3, 400 МГц)11,02 (s, 1H), 9,62 (br s, 1H), 8,92 (s, 1H),8,75 (s, 1 Н), 8,56 (s, 1H), 8,19 (s, 1H), 7,77 (m, 1 Н), 7,65 (m, 1H), 7,25 (m, 1H), 7,19 (m, 1H), 6,95 (m, 2 Н);(10:1:3:6). Этил 5-амино-2-(4-бромфенил)-1 Н-имидазол-4-карбоксилат (27). К веществу 24 (1,82 г, 10,0 ммоль) в 16 мл воды была добавлена диэтилдитиофосфорная кислота(2,24 г, 12,0 ммоль), и смесь нагревалась при 80C в микроволновой печи в течение 15 мин. После завершения реакционная смесь была проэкстрагирована диэтиловым эфиром и после этого промывалась насыщенным NaHCO3 (220 мл), солевым раствором (120 мл), высушивалась (Na2SO4), концентрировалась in vacuo и очищалась колоночной хроматографией на силикагеле с получением 1,2 г 25 в виде белого твердого вещества. К раствору тиоамида 25 (1,40 г, 6,5 ммоль) в 15 мл безводного хлороформа был добавлен бензилбромид (4,45 г, 26 ммоль), и реакционная смесь нагревалась при 80C в микроволновой печи в течение 15 мин. Реакционная смесь была выпарена досуха, и затем в большом избытке был добавлен диэтиловый эфир, чтобы высадить 1,6 г гидробромида тиоиминоэфира 26. Этот продукт высушивали под вакуумом и использовали в следующей стадии. К раствору вещества 26 (1,00 г, 2,6 ммоль) в 10 мл безводного дихлорметана был добавлен пиридин(0,205 мл, 2,6 ммоль). В другую колбу, содержащую вещество 26 а (получено способом, описанным в литературе) (476 мг, 3,1 ммоль) в 10 мл безводного дихлорметана, был добавлен NH3 в метаноле (6,2 ммоль). Обе реакционные смеси были профильтрованы в сосуд для микроволновой печи, куда был добавлен безводный хлороформ (10 мл). Реакционная смесь нагревалась до 60C в микроволновой печи. За ходом реакции следили с помощью тонкослойной хроматографии (TLC), реакция заканчивалась через 10 мин. Реакционную смесь выпаривали досуха и добавляли диэтиловый эфир для осаждения 600 мг вещества 27. Продукт отфильтровывали, промывали эфиром и высушивали под вакуумом. MS (Es +ve) m/z 310. Этил 5-(2-цианацетамидо)-2-(4-бромфенил)-1H-имидазол-4-карбоксилат (28). Титульное соединение было получено аналогичным способом, как описано для вещества 5. Таким образом, начиная с вещества 27 (0,3 г, 0,97 ммоль) было получено 160 мг чистого вещества 28. 1 Н ЯМР(Es +ve) m/z 377. 2-(4-Бромфенил)-5,7-дигидрокси-3H-имидазо[4,5-b]пиридин-6-карбонитрил (29). Титульное соединение было получено аналогичным способом, как описано для вещества 6. Таким образом, начиная с вещества 28 (0,071 г, 0,189 ммоль) и следуя описанной выше процедуре, было получено 25 мг вещества 29. MS (Es +ve) m/z 331. 3-(2-Гидроксибифенил)-4,6-дигидроксиимидазо[5,4-b]пиридин-5-карбонитрил (30) [соединение 7]. Титульное соединение было получено аналогичным способом, как описано для вещества 7. Таким образом, начиная с вещества 29 (0,022 г, 0,066 ммоль), используя 2-гидроксибензолборную кислоту вместо 2-гидроксибифенилборной кислоты, и следуя описанной выше процедуре, было получено 5 мг вещества 30. MS (Es +ve) m/z 345, (Es -ve) 343.e. гидроксиламингидрохлорид, CH3COONa, МеОН. 5-(4-Бромфенил)-1H-индол (32). К раствору вещества 31 (3,093 г, 10,93 ммоль) в 30 мл смеси диметоксиэтан : толуол : этанол : вода(10:1:3:6) был добавлен 4-бромйодбензол (1,60 г, 9,94 ммоль), октагидрат гидроокиси бария (6,312 г,20,01 ммоль) и 5 мол.% Pd(PPh3)4 в инертной атмосфере. Реакционная смесь нагревалась при 90C в течение 3 ч. После завершения реакции реакционная смесь была охлаждена до комнатной температуры и сконцентрирована in vacuo. Осадок был проэкстрагирован 10 мл воды, и водный слой был промыт этилацетатом (225 мл). Органические слои были собраны, промыты солевым раствором (215 мл), высушены (Na2SO4), профильтрованы и сконцентрированы для получения неочищенного вещества в виде красного масла. Материал был дополнительно очищен колоночной хроматографией (10% - 35% EtOAc в гексане) с получением 1,7 г 32 в виде твердого белого вещества. 5-(4-Бромфенил)-1H-индол-3-карбальдегид (33). В 100-мл круглодонную колбу поместили 2,8 мл диметилформамида (2,74 г, 3,74 ммоль). Колбу и е содержимое охлаждали в бане со льдом и солью в течение примерно 0,5 ч, после чего к диметилформамиду при перемешивании по каплям было добавлено 0,86 мл (1,44 г, 94 ммоль) свежеперегнанного фосфороксихлорида. После этого к вышеназванному раствору медленно был добавлен раствор 1,0 г вещества 32 (85 ммоль) в 1 мл диметилформамида. После добавления температура раствора была поднята до 40C, и раствор был оставлен при перемешивании на час. В это время к реакционной смеси по каплям был добавлен 1 N NaOH (10 мл). Полученная смесь была быстро нагрета до точки кипения и оставлена остывать до комнатной температуры. Полученный осадок был собран на фильтре и дополнительно промыт водой. Вещество 33, полученное этим способом, было достаточно чистым для следующей реакции.MS (Es +ve) m/z 300, (Es -ve) m/z 298. 5-(4-Бромфенил)-1H-индол-3-карбонитрил (34). Смесь вещества 33 (1,35 г 4,50 ммоль), двузамещенного фосфата аммония (3,19 г, 23,8 ммоль), 1 нитропропана (13,61 г, 152,9 ммоль) и ледяной уксусной кислоты (10 мл) нагревалась с дефлегматором в течение ночи. В процессе нагревания бледно-желтая смесь приобрела темно-красный цвет. Летучие реагенты и растворители были удалены при пониженном давлении, после чего к темному осадку был добавлен избыток воды. Через короткое время неочищенное вещество 34 быстро выпало в осадок. Его отделили фильтрацией, промыли гексаном и высушили при пониженном давлении. Вещество 34 было получено в виде бледно-желтого твердого вещества в количестве 1,19 г. MS (Es -ve) m/z 295. 5-(2-Гидроксибифенил)-1H-индол-3-карбальдегид (35) [соединение 4]. Титульное соединение было получено аналогичным способом, как описано для вещества 7. Таким образом, начиная с вещества 33 (1,6 г, 5,3 ммоль), используя 2-гидроксибензолборную кислоту вместо 2 гидроксибифенилборной кислоты, и следуя описанной выше процедуре, был получен 1 г чистого вещества 35. 1H ЯМР (CDCl3, 400 МГц)9,80 (s, 1H), 8,39 (s, 1 Н), 7,79 (s, 1 Н), 7,61 (d, J= 8,4 Гц, 2 Н), 7,51 (d,J= 8,4 Гц, 2 Н), 7,45 (m, 1H), 7,38 (m, 1 Н), 7,18 (m, 2 Н), 7,02 (m, 1H), 6,78 (m, 1 Н); MS (Es +ve) m/z 312, (Es-ve) m/z 314. 5-(2-Гидроксибифенил)-1H-индол-3-карбонитрил (36) [соединение 5]. Титульное соединение было получено аналогичным способом, как описано для вещества 7. Таким образом, начиная с вещества 34 (1,19 г, 4,00 ммоль), используя 2-гидроксибензолборную кислоту вместо 2-гидроксибифенилборной кислоты, и следуя описанной выше процедуре, было получено 710 мг чистого вещества 36. 1 Н ЯМР (CDCl3, 400 МГц)8,76 (br s, 1 Н), 8,00 (s, 1H), 7,75 (m, 3H), 7,57 (m, 4 Н), 7,29 (m,2 Н), 7,05 (m, 2 Н); MS (Es -ve) m/z 309. 5-(2-Гидроксибифенил)-1H-индол-3-карбальдегидоксим (37) [соединение 6]. К гидроксиламингидрохлориду (0,014 г, 0,20 ммоль) в 3 мл метанола был добавлен ацетат натрия(0,016 мг, 0,20 ммоль), и реакционная смесь перемешивалась при комнатной температуре в течение 15 мин. К этой смеси было добавлено вещество 35 (0,05 г, 0,16 ммоль) в 2 мл метанола, и реакционная смесь нагревалась с дефлегматором в течение ночи. Реакционная смесь была сконцентрирована in vacuo и осадок был растворен в дихлорметане, промыт водой (215 мл), солевым раствором (115 мл), высушен(Na2SO4) с получением 30 мг вещества 37 в виде бледно-желтого твердого вещества, состоящего из смеси геометрических изомеров (1:1) MS (Es +ve) m/z 329, MS (Es -ve) m/z 327. Схема 8(10:1:3:6) был добавлен 4-бромйодбензол (1,60 г, 9,94 ммоль), октагидрат гидроокиси бария (6,312 г,20,01 ммоль) и 5 мол.% Pd(PPh3)4 в инертной атмосфере. Реакционная смесь нагревалась при 90C в течение 3 ч. После завершения реакции реакционная смесь была охлаждена до комнатной температуры и сконцентрирована in vacuo. Осадок экстрагировали в 10 мл воды и водный слой промывали этилацетатом(225 мл). Органические слои были собраны, промыты солевым раствором (215 мл), высушены(Na2SO4), профильтрованы и сконцентрированы с получением неочищенного вещества в виде красного масла. Полученный материал был дополнительно очищен колоночной хроматографией (10% - 35%EtOAc в гексане) с получением 1,7 г вещества 2 в виде белого твердого вещества. 5-(4-Бромфенил)-1H-индол-3-карбальдегид (3). В 100-мл круглодонную колбу поместили 2,8 мл диметилформамида (2,74 г, 3,74 ммоль). Колбу и е содержимое охлаждали в бане со льдом и солью в течение примерно 0,5 ч, после чего к диметилформамиду при перемешивании по каплям было добавлено 0,86 мл (1,44 г, 94 ммоль) свежеперегнанного фосфороксихлорида. После этого к вышеназванному раствору медленно был добавлен раствор 1,0 г вещества 2 (85 ммоль) в 1 мл диметилформамида. После добавления температура раствора была поднята до 40C, и раствор был оставлен при перемешивании на час. В это время к реакционной смеси по каплям был добавлен 1 N NaOH (10 мл). Полученная смесь была быстро нагрета до точки кипения и оставлена остывать до комнатной температуры. Полученный осадок был собран на фильтре и дополнительно промыт водой. Вещество 3, полученное этим способом, было достаточно чистым для следующей реакции.MS (Es +ve) m/z 300, (Es -ve) m/z 298. 5-(4-Бромфенил)-1H-индол-3-карбонитрил (4). Смесь вещества 3 (1,35 г 4,50 ммоль), двузамещенного фосфата аммония (3,19 г, 23,8 ммоль), 1 нитропропана (13,61 г, 152,9 ммоль) и ледяной уксусной кислоты (10 мл) нагревалась с дефлегматором в течение ночи. В процессе нагревания бледно-желтая смесь приобрела темно-красный цвет. Летучие реагенты и растворители были удалены при пониженном давлении, после чего к темному осадку был добавлен избыток воды. Через короткое время неочищенное вещество 4 быстро выпало в осадок. Его отделили фильтрацией, промыли гексаном и высушили при пониженном давлении. Вещество 4 было получено в виде бледно-желтого твердого вещества в количестве 1,19 г. MS (Es -ve) m/z 295. 5-(2,6-Диметоксибифенил)-1H-индол-3-карбонитрил (5). К раствору вещества 4 (1,00 г, 3,38 ммоль) в 10 мл смеси диметоксиэтан:толуол:этанол:вода(10:1:3:6) были добавлены 2,6-диметоксибромбензол (1,14 г, 4,39 ммоль), карбонат цезия (2,75 г, 8,45 ммоль) и 5 мол.% Pd(PPh3)4 в инертной атмосфере. Реакционная смесь нагревалась при 90C в течение ночи. После завершения реакции реакционная смесь была охлаждена до комнатной температуры и сконцентрирована in vacuo. Осадок экстрагировали в 10 мл воды и водный слой промывали этилацетатом(225 мл). Органические слои собирали, промывали солевым раствором (215 мл), высушивали(Na2SO4), фильтровали и концентрировали для получения неочищенного вещества в виде красного масла. Полученный материал был дополнительно очищен колоночной хроматографией (10% - 35% EtOAc в гексане) с получением 0,65 г 5 в виде твердого вещества бежевого цвета. 5-(2,6-Дигидроксибифенил)-1H-индол-3-карбонитрил (6). К перемешиваемому раствору вещества 4 (1,3 г, 3,7 ммоль) в CH2Cl2 (20 мл) при 0C был добавленBBr3 (1,0 мл, 12,1 ммоль). Реакционная смесь была оставлена для нагревания до комнатной температуры и перемешивалась в течение 1 ч. После этого реакция была остановлена добавлением воды (10 мл). Из смеси выпал осадок, который собрали фильтрацией и очистили с помощью хроматографии (30% - 70%100% этилацетат:гексан) с получением 451 мг конечного продукта 6. Схема 9(10:1:3:6) был добавлен 4-бромйодбензол (1,60 г, 9,94 ммоль), октагидрат гидроокиси бария (6,312 г,20,01 ммоль) и 5 мол.% Pd(PPh3)4 в инертной атмосфере. Реакционная смесь нагревалась при 90C в течение 3 ч. После завершения реакции, реакционная смесь была охлаждена до комнатной температуры и сконцентрирована in vacuo. Осадок экстрагировали в 10 мл воды и водный слой промывали этилацетатом(225 мл). Органические слои собирали, промывали солевым раствором (215 мл), высушивали(Na2SO4), фильтровали и концентрировали с получением неочищенного вещества в виде красного масла. Полученный материал был дополнительно очищен колоночной хроматографией (10% - 35% EtOAc в Гексане) с получением 1,7 г 2 в виде белого твердого вещества. 5-(4-Бромфенил)-1H-индол-3-карбальдегид (3). В 100-мл круглодонную колбу поместили 2,8 мл диметилформамида (2,74 г, 3,74 ммоль). Колбу и е содержимое охлаждали в бане со льдом и солью в течение примерно 0,5 ч, после чего к диметилформамиду при перемешивании по каплям было добавлено 0,86 мл (1,44 г, 94 ммоль) свежеперегнанного фосфороксихлорида. После этого к вышеназванному раствору медленно был добавлен раствор 1,0 г вещества 2 (85 ммоль) в 1 мл диметилформамида. После добавления температура раствора была поднята до 40C, и раствор был оставлен при перемешивании на час. В это время к реакционной смеси по каплям был добавлен 1 N NaOH (10 мл). Полученная смесь была быстро нагрета до точки кипения и оставлена остывать до комнатной температуры. Полученный осадок был собран на фильтре и дополнительно промыт водой. Вещество 3, полученное этим способом, было достаточно чистым для следующей реакции.MS (Es +ve) m/z 300, (Es -ve) m/z 298. 5-(4-Бромфенил)-1H-индол-3-карбонитрил (4). Смесь вещества 3 (1,35 г 4,50 ммоль), двузамещенного фосфата аммония (3,19 г, 23,8 ммоль), 1 нитропропана (13,61 г, 152,9 ммоль) и ледяной уксусной кислоты (10 мл) нагревалась с дефлегматором в течение ночи. В процессе нагревания бледно-желтая смесь приобрела темно-красный цвет. Летучие реагенты и растворители были удалены при пониженном давлении, после чего к темному осадку был добавлен избыток воды. Через короткое время неочищенное вещество 4 быстро выпало в осадок. Его отделили фильтрацией, промыли гексаном и высушили при пониженном давлении. Вещество 4 было получено в виде бледно-желтого твердого вещества в количестве 1,19 г. MS (Es -ve) m/z 295. 5-(4-Бромфенил)-1H-индол-3-карбоксамид (5). Раствор вещества 4 (1,00 г, 3,38 ммоль) в этаноле был обработан перекисью водорода (30%) и 1 NNaOH. После завершения реакции растворитель был удален, и полученный осадок был промыт органическими растворителями для получения 5 в виде твердого вещества бежевого цвета. 5-(2,6-Диметоксибифенил)-1H-индол-3-карбоксамид (6). К раствору вещества 5 (1,00 г, 3,18 ммоль) в 10 мл смеси диметоксиэтан:толуол:этанол:вода(10:1:3:6) были добавлены 2,6-диметоксибромбензол (1,10 г, 4,14 ммоль), карбонат цезия (2,59 г, 7,95 ммоль) и 5 мол.% Pd(PPh3)4 в инертной атмосфере. Реакционная смесь нагревалась при 90C в течение ночи. После завершения реакции реакционная смесь была охлаждена до комнатной температуры и сконцентрирована in vacuo. Осадок экстрагировали в 10 мл воды и водный слой промывали этилацетатом(225 мл). Органические слои были собраны, промыты солевым раствором (215 мл), высушены(Na2SO4), профильтрованы и сконцентрированы с получением неочищенного вещества в виде красного масла. Полученный материал был дополнительно очищен колоночной хроматографией (10% - 35%EtOAc в гексане) с получением 0,60 г 6 в виде твердого вещества бежевого цвета. 5-(2,6-Дигидроксибифенил)-1H-индол-3-карбоксамид (7). К перемешиваемому раствору вещества 6 (1,0 г, 2,69 ммоль) в CH2Cl2 (20 мл) при 0C был добавленBBr3 (1,12 мл, 13,44 ммоль). Реакционная смесь была оставлена для нагревания до комнатной температуры и перемешивалась в течение 1 ч. После этого реакция была остановлена добавлением воды (10 мл). Из смеси выпал осадок, который собрали фильтрацией и очистили с помощью хроматографии (30% - 70%100% этилацетат : гексан) с получением 400 мг конечного продукта 7. Схема 10b. ДМФА, POCl3; с. 2-Гидроксибензолборная кислота, тетракис-Pd, карбонат цезия, DME:H2O. 5-(4-Бромпиридин-3-ил)-1H-индол (2). К раствору вещества 1 (3,093 г, 10,93 ммоль) в 30 мл смеси диметоксиэтан : толуол : этанол : вода(10:1:3:6) были добавлены 6-бром-3-йодпиридин (3,10 г, 10,93 ммоль), карбонат цезия (8,90 г, 27,33 ммоль) и 5 мол.% Pd(PPh3)4 в инертной атмосфере. Реакционная смесь нагревалась при 90C в течение 3 ч. После завершения реакции реакционная смесь была охлаждена до комнатной температуры и сконцентрирована in vacuo. Осадок экстрагировали в 10 мл воды и водный слой промывали этилацетатом (225 мл). Органические слои были собраны, промыты солевым раствором (215 мл), высушены (Na2SO4),профильтрованы и сконцентрированы с получением неочищенного вещества в виде красного масла. Полученный материал был дополнительно очищен колоночной хроматографией (10% - 35% EtOAc в гексане) с получением 1,8 г 2 в виде белого твердого вещества. 5-(4-Бромпиридин-3-ил)-1H-индол-3-карбальдегид (3). В 100-мл круглодонную колбу поместили 2,8 мл диметилформамида (2,74 г, 3,74 ммоль). Колбу и е содержимое охлаждали в бане со льдом и солью в течение примерно 0,5 ч, после чего к диметилформамиду при перемешивании по каплям было добавлено 0,86 мл (1,44 г, 94 ммоль) свежеперегнанного фосфороксихлорида. После этого к вышеназванному раствору медленно был добавлен раствор вещества 2 (1,0 г, 3,66 ммоль) в 1 мл диметилформамида. После добавления температура раствора была поднята до 40C, и раствор был оставлен при перемешивании на час. В это время к реакционной смеси по каплям был добавлен 1 N NaOH (10 мл). Полученная смесь была быстро нагрета до точки кипения и оставлена остывать до комнатной температуры. Полученный осадок был собран на фильтре и дополнительно промыт водой. Вещество 3, полученное этим способом, было достаточно чистым для следующей реакции. 5-(6-(2-Гидроксифенил)пиридин-3-ил)-1 Н-индол-3-карбальдегид (4). Титульное соединение было получено аналогичным способом, как описано для вещества 2. Таким образом, начиная с вещества 3 (0,1 г, 0,33 ммоль), используя 2-гидроксибензолборную кислоту вместо 6 бром-3-йодпиридинборной кислоты, и следуя описанной выше процедуре, было получено 50 мг чистого вещества 4. Схема 11(10:1:3:6) были добавлены 3,6-дихлорпиридазин (1,63 г, 10,93 ммоль), карбонат цезия (8,90 г, 27,33 ммоль) и 5 мол.% Pd(PPh3)4 в инертной атмосфере. Реакционная смесь нагревалась при 90C в течение 3 ч. После завершения реакции реакционная смесь была охлаждена до комнатной температуры и сконцентрирована in vacuo. Осадок экстрагировали в 10 мл воды и водный слой промывали этилацетатом (225 мл). Органические слои были собраны, промыты солевым раствором (215 мл), высушены (Na2SO4),профильтрованы и сконцентрированы с получением неочищенного вещества в виде красного масла. Полученный материал был дополнительно очищен колоночной хроматографией (10% - 35% EtOAc в гексане) с получением 1,8 г 2 в виде белого твердого вещества. 5-(4-Бромпиридазин-3-ил)-1 Н-индол-3-карбальдегид (3). В 100-мл круглодонную колбу поместили 2,8 мл диметилформамида (2,74 г, 3,74 ммоль). Колбу и е содержимое охлаждали в бане со льдом и солью в течение примерно 0,5 ч, после чего к диметилформамиду при перемешивании по каплям было добавлено 0,86 мл (1,44 г, 94 ммоль) свежеперегнанного фосфороксихлорида. После этого к вышеназванному раствору медленно был добавлен раствор вещества 2 (1 г, 3,65 ммоль) в 1 мл диметилформамида. После добавления температура раствора была поднята до 40C, и раствор был оставлен при перемешивании на час. В это время к реакционной смеси по каплям был добавлен 1 N NaOH (10 мл). Полученная смесь была быстро нагрета до точки кипения и оставлена остывать до комнатной температуры. Полученный осадок был собран на фильтре и дополнительно промыт водой. Вещество 3, полученное этим способом, было достаточно чистым для следующей реакции. 5-(6-(2-Гидроксифенил)пиридазин-3-ил)-1 Н-индол-3-карбальдегид (4). Титульное соединение было получено аналогичным способом, как описано для вещества 2. Таким образом, начиная с вещества 3 (0,1 г, 0,33 ммоль), используя 2-гидроксибензолборную кислоту вместо 6 бром-3-йодпиридинборной кислоты и следуя описанной выше процедуре, было получено 50 мг чистого вещества 4. Соединения настоящего изобретения могут быть получены любым способом, который известен и применим для получения химически родственных соединений. Необходимые исходные материалы могут быть получены стандартными способами органической химии. Получение таких исходных материалов описано в прилагаемых нелимитирующих примерах. Альтернативно этому, необходимые исходные материалы могут быть получены способами, аналогичными показанным, которые доступны химику средней квалификации. Биологические исследования. Как говорилось выше, описанные в настоящем изобретении производные обладают антипролиферативной активностью. Эти свойства могут быть исследованы, например, с применением одного или более способов, описанных ниже. Определение активности АМРК in vitro. Активность АМРК была измерена по фосфорилированию амино-концевого фрагмента ацетил-КоАкарбоксилазы человека типа 1, аминокислоты 1-120. Фрагмент экспрессировали в виде биотинилированного слитого белка в E.coli. Измерение ферментативной активности проводили в 5 мкл реакционной смеси, содержащей 60 мМ HEPES, pH 7,0, 50 мМ NaCl, 1 мМ ДТТ, 5 мМ MgCl2, 0,05% Твин-20, 100 мкМ АТФ и в присутствии 25 мкМ АМФ в качестве положительного контроля. Реакцию проводили при комнатной температуре в течение 60 мин и останавливали добавлением 5 мкл стоп-раствора, состоящего из 20 мМ ЭДТА, 0,1% БСА, 1% Тритона Х-100, 0,01% Твина 20, 100 мМ Трис pH 8,0, очищенных поликлональных антител кролика анти-pS79 (антифофсосерин 79) (ацетил-КоА-карбоксилазы 1), полученных в лаборатории, в разведении 1:5000, 40 мкг/мл AlphaScreen (Perkin Elmer) Acceptor beads и 40 мкг/мл AlphaScreen (Perkin Elmer) donor beads. Реакционная смесь дополнительно инкубировалась 2 ч при комнатной температуре и анализировалась на анализаторе Fusion-Alpha microplate analyzer. Вестерн-блот анализ активности АМРК in vitro. Измерение активности АМРК проводили в объеме 25 мкл того же реакционного буфера, как и для измерения альфа АМРК, при 30C в течение 30 мин. Реакцию останавливали буфером для образцов дляSDS-ПААГ электрофореза. Фосфорилированный GST-ACC определяли Вестерн-блот анализом с антителами анти-фосфосерин 79-АСС 1 (Cell Signaling Technologies). Применяемая в описанных выше анализах АМРК была частично очищена (Blazquez, С. et.al. The AMP-activated protein kinase is involved in the regulation of ketone body production by astrocytes. J. Neurochem. 73: 1674 (1999 из HEKs (линия эмбриональных клеток почек человека), и если не указано иначе, используемые в описанных выше измерениях реактивы были получены от Sigma. В приведенной ниже табл. В показаны репрезентативные соединения настоящего изобретения и их активность при определении АМРК in vitro. В этих измерениях использовалась следующая шкала для значений ED50:I50 мкМ, 50 мкМII10 мкМ, и III10 мкМ. Таблица В Настоящая заявка на патент и указанная в нем научная литература предоставляет информацию,доступную специалисту в данной области техники. Все патенты Соединенных Штатов и опубликованные или неопубликованные заявки на патент Соединенных Штатов, цитируемые здесь, включены в на- 25019309 стоящее изобретение путем отсылки. Все опубликованные иностранные патенты и заявки на патент, цитируемые здесь, включены в настоящее изобретение путем отсылки. Все другие опубликованные ссылки,документы, рукописи и научная литература, цитируемые здесь, включены в настоящее изобретение путем отсылки. Хотя настоящее изобретение раскрыто в деталях и описано со ссылками на его предпочтительные воплощения, специалист в данной области техники должен понимать, что могут быть сделаны различные изменения в форме и деталях без выхода за рамки настоящего изобретения, которые указаны в прилагаемой формуле изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его соль, в котором Х 1-Х 4 независимо один от другого представляют собой С, CR1 или N, где R1 независимо выбирают из группы, состоящей из водорода, гидрокси, галогена, амино, С 1-C10-алкокси, C1-С 10-алкилтио, CF3, CN,NO2, N3, CHNOH, C1-C10-алкилсульфонила, ацила, алифатической группы, имеющей от 4 до 12 атомов,фенила, гетероарила или гетероцикла; и представляет собой гетероарил, где Z представляет собой О, N или NH; и является фенилом; и является фенилом, замещенным по меньшей мере одним гидроксилом; где каждый гетероарил представляет собой независимо ненасыщенную от 3- до 6-членную гетероциклическую группу, содержащую от 1 до 4 атомов азота; ненасыщенную конденсированную гетероциклическую группу, содержащую от 1 до 5 атомов азота; ненасыщенную 3-6-членную гетеромоноциклическую группу, содержащую атом кислорода; ненасыщенную 3-6-членную гетеромоноциклическую группу, содержащую атом серы; ненасыщенную 3-6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов кислорода и от 1 до 3 атомов азота; ненасыщенную конденсированную гетероциклическую группу, содержащую от 1 до 2 атомов кислорода и от 1 до 3 атомов азота; ненасыщенную 3-6 членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов серы и от 1 до 3 атомов азота; или ненасыщенную конденсированную гетероциклическую группу, содержащую от 1 до 2 атомов серы и от 1 до 3 атомов азота; каждый гетероцикл представляет собой независимо насыщенную от 3- до 6-членную гетеромоноциклическую группу, содержащую от 1 до 4 атомов азота; насыщенную от 3- до 6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов кислорода и от 1 до 3 атомов азота; насыщенную от 3- до 6-членную гетеромоноциклическую группу, содержащую от 1 до 2 атомов серы и от 1 до 3 атомов азота; дигидротиофен; дигидропиран; дигидрофуран или дигидротиазол; каждый ацил представляет собой (C1-C6)алканоил, (C3-C6)циклоалкилкарбонил, гетероциклический карбонил, бензоил или гетероарилкарбонил; и каждый алкокси, алкилтио, алкилсульфонил, ацил, алифатическая группа, амино, фенил, гетероарил и гетероциклическая группа является необязательно независимо замещенным одним или более заместителем, выбранным из галогена, C1-C10-алкила, C2-C10-алкенила, C2-C10-алкинила, фенила, гетероциклила,тиола, C1-C10-алкилтио, фенилтио, C1-C10-алкилтио-C1-C10-алкила, фенилтио-C1-C10-алкила, C1-C10 алкилсульфонила, C1-C10-алкилсульфонил-C1-C10-алкила, фенилсульфонил-C1-C10-алкила, C1-C10 алкокси, фенилокси, фенил-C1-C10-алкокси, аминокарбонила, аминокарбонил-C3-C8-циклоалкила, аминокарбонилгетероциклила, С 1-С 10-алкиламинокарбонила, фениламинокарбонила, С 1-C10-алкоксикарбонила,фенилоксикарбонила, гало-C1-C10-алкила, амино, трифторметила, циано, нитро, C1-C10-алкиламино, фениламино, C1-C10-алкиламино-C1-C10-алкила, фениламино-C1-C10-алкила, амино-C1-C10-алкиламино, гидрокси, C1-C10-алкокси-C1-C10-алкила, карбокси-C1-C10-алкила, C1-C10-алкоксикарбонил C1-C10-алкила,аминокарбонил-C1-C10-алкила, ацила, фенил-C1-C10-алкоксикарбонила, карбоновой кислоты, сульфокислоты, сульфонила, фосфоновой кислоты, фенила, гетероарила, гетероциклила и алифатической группы,имеющей от 4 до 12 атомов. 2. Соединение по п.1 формулы или его соль, в котором R1, R2, R4 и R5 независимо представляют собой водород или одну или более электронодонорных групп; R3 представляет собой водород, -CN, -CHNOH, -CONH2 или -СНО; R6 независимо представляет собой водород, гидрокси, галоген, амино, C1-C10-алкокси, C1-C10-алкилтио, CF3, CN,NO2, N3, CHNOH, C1-C10-алкилсульфонил, фенил, гетероарил или гетероцикл; и каждый R выбирают из Н или гидроксила, где по меньшей мере один R представляет собой гидроксил и где каждый алкокси,алкилтио, алкилсульфонил, амино, фенил, гетероарил и гетероциклическая группа является необязательно независимо замещенным, как определено в п.1. 3. Соединение по п.1, в котором Ar2 представляет собой 2-гидроксифенил или 2,6-дигидроксифенил или его соль. 4. Соединение по п.1 или его соль, в котором Х 1-Х 4 независимо представляют собой С, CR1 или N,где R1 независимо выбирают из группы, состоящей из водорода, гидрокси, галогена, амино, C1-C10 алкокси, C1-C10-алкилтио, CF3, CN, NO2, N3, C1-C10-алкилсульфонила, ацила, алифатической группы, фенила, гетероарила или гетероцикла; и где каждый алкокси, алкилтио, алкилсульфонил, ацил, алифатическая группа, амино, фенил, гетероарил и гетероциклическая группа является необязательно независимо замещенным, как определено в п.1. 5. Соединение по п.1 формулы (III) или его соль, в котором Х 5-Х 16 независимо представляют собой С или CR1, где каждый R1 независимо выбирают из группы, состоящей из водорода, гидрокси, галогена, амино C1-C10-алкокси, C1-C10 алкилтио, CF3, CN, NO2, N3, C1-C10-алкилсульфонила, ацила, алифатической группы, фенила, гетероарила или гетероцикла; при условии, что по меньшей мере один из X11-X16 представляет собой С-ОН; и выбирают из группы, состоящей из и в котором Х 17-Х 21 независимо представляют собой С, CR1 или N; Y4 представляет собой О, N илиNH; Y5-Y6 независимо выбирают из группы, состоящей из С, CR1, О, S, N и NH; X1-X4 являются такими,как определено в п.1; и каждый алкокси, алкилтио, алкилсульфонил, ацил, алифатическая группа, амино, фенил, гетероарил и гетероциклическая группа является необязательно независимо замещенным, как определено в п.1. 6. Соединение по п.1 формулы (IV) и в котором Х 17-Х 21 независимо представляют собой С, CR1 или N, где каждый R1 представляет собой независимо водород, гидрокси, галоген, амино, C1-C10-алкокси, C1-C10-алкилтио, CF3, CN, NO2, N3,C1-C10-алкилсульфонил, ацил, алифатическую группу, фенил, гетероарил или гетероцикл; Y4 представляет собой О, N или NH; Y5-Y6 независимо выбирают из группы, состоящей из С, CR1, О, S, N или NH; n равняется 1-3; Х 1-Х 4 являются такими, как определено в п.1; и где каждый алкокси, алкилтио, алкилсульфонил, ацил, алифатическая группа, амино, фенил, гетероарил и гетероциклическая группа является необязательно независимо замещенным, как определено в п.1. 7. Соединение по п.6 или его соль, в котором один из Х 1-Х 4 представляет собой С и остальные представляют собой СН. 8. Соединение по п.1, выбранное из соединений, представленных в табл. А, или его соль 9. Соединение по п.1, которое представляет собой 5-(2,6-дигидроксибифенил)-1H-индол-3 карбонитрил, 5-(2,6-дигидроксибифенил)-1H-индол-3-карбоксамид, 5-(6-(2-гидроксифенил)пиридин-3 ил)-1 Н-индол-3-карбальдегид и 5-(6-(2-гидроксифенил)пиридазин-3-ил)-1 Н-индол-3-карбальдегид или его соль.
МПК / Метки
МПК: A01N 31/04
Метки: протеинкиназы, модуляторы, амф-активируемой
Код ссылки
<a href="https://eas.patents.su/30-19309-modulyatory-ampk-amf-aktiviruemojj-proteinkinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы ampk (амф-активируемой протеинкиназы)</a>
Предыдущий патент: Установка и способ для удаления твердых частиц из фильтра, предназначенного для отфильтровывания твердых частиц из выхлопных газов двигателя
Следующий патент: Фиксирующее устройство для катализаторных частиц
Случайный патент: Имидазопиразиновые ингибиторы syk, фармацевтическая композиция, содержащая имидазопиразиновые ингибиторы syk, и способы их применения