Соединения для лечения гепатита с
Номер патента: 19185
Опубликовано: 30.01.2014
Авторы: Хан Ин, Грант-Янг Кэтерин А., Кэдоу Джон Ф., Йен Кап-Сун, Бено Бретт Р., Хевавасам Пиясена, Бендер Джон А., Парселла Кайл Е., Никель Эндрю
Формула / Реферат
1. Соединение формулы I
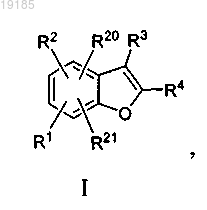
где R1 представляет собой фенил, где указанный фенил замещен 1-2 заместителями, выбранными из группы, состоящей из галогена, циано, (C1-C6)алкила, галоген(C1-C6)алкила, гидрокси(C1-C6)алкила, (карбокси)(С1-C6)алкила, (С1-C6)алкокси, гидрокси(С1-C6)алкилокси, тетрагидропиранилокси, карбокси, (С1-C6)алкоксикарбонила, (карбокси)(С2-C6)алкенила, (C1-C6)алкилкарбоксамидо, (C1-C6)алкоксикарбоксамидо, ((С1-С6)алкилсульфамидо)(С1-С6)алкила, Ar5, SO2NR15R16 и CONR7R8; и где указанный фенил также замещен 0-2 заместителями, выбранными из группы, состоящей из галогена; нитро; (С1-C6)алкила; (C3-С7)циклоалкила; галоген(С1-C6)алкила; амино(С1-C6)алкила; гидрокси; (C1-C6)алкокси; OR17; (C3-С7)циклоалкокси; амино; (C1-C6)алкоксикарбоксамидо; фуранила, тиенила или пиразолила, замещенного 0-2 (C1-C6)алкильными заместителями; пиридинила, замещенного 0-2 галогена, циано, (C1-C6)алкила, гидрокси, (C1-C6)алкокси, амино или (С1-C6)алкиламинокарбонильными заместителями; пиримидинила; пиримидинедионила; аминопиримидинила; индолила; изохинолинила и фенила, замещенного 0-2 заместителями, выбранными из галогена, циано(C1-C6)алкила, гидрокси(C1-C6)алкила, (С1-C6)алкокси(С1-C6)алкила, (C1-C6)алкокси, амино, карбокси, аминокарбонила, (С1-C6)алкиламинокарбонила, (C1-C6)алкилкарбоксамидо и карбокси(C2-C6)алкенила;
R2 представляет собой водород, галоген, нитро, амино, фенил или R5R6N;
R3 представляет собой CONR11R12;
R4 представляет собой фенил, замещенный 0-2 галогеновыми заместителями;
R5 представляет собой водород или (С1-C6)алкилсульфонил;
R6 представляет собой водород, (С1-C6)алкил, гидрокси(С1-C6)алкил или (C1-C6)алкилсульфонил;
R7 представляет собой водород, (C1-C6)алкил, алкинил, циано(C1-C6)алкил, галоген(С1-C6)алкил, гидрокси(С1-C6)алкил, дигидрокси(С1-C6)алкил, (С1-C6)алкокси(С1-C6)алкил, оксо(С1-C6)алкил, (ди(C1-C6)алкиламино)(С1-C6)алкил, ((C3-С7)циклоалкил)(C1-C6)алкил, (C3-С7)циклоалкил, ((C1-C6)алкил)(C3-С7)циклоалкил, (гидрокси(С1-C6)алкил)(C3-С7)циклоалкил, (тетрагидрофуранил)(C1-C6)алкил, (тетрагидропиранил)(C1-C6)алкил, (карбокси)(C1-C6)алкил, ((С1-C6)алкоксикарбонил)(C1-C6)алкил, ((С2-C6)алкенилоксикарбонил)(С1-C6)алкил, ((C1-C6)алкоксикарбонил)гидрокси(С1-C6)алкил, (CONR13R14)(C1-C6)алкил, (CONR13R14)(гидрокси(С1-С6)алкил)(С1-С6)алкил, (CONR13R14)(С3-С7)циклоалкил, ((С1-C6)алкилкарбонил)амино(C1-C6)алкил, (фенил)(C1-C6)алкил, (C1-C6)алкилсульфонил, фенилсульфонил, Ar2, Ar3,
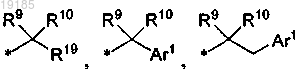 или
или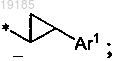
R8 представляет собой водород, (С1-C6)алкил или (С1-C6)алкокси(С1-C6)алкил;
или R7R8N, взятые вместе, представляют собой азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, дигидроиндолил или изоиндолинил и замещены 0-2 заместителями, выбранными из (C1-C6)алкила, гидрокси(С1-C6)алкила, (C1-C6)алкокси(C1-C6)алкила, гидрокси, (С1-C6)алкоксикарбонила, ди(С1-C6)алкилкарбоксамидо, (С1-C6)алкилкарбониламино, пиридинила и фенила, где указанный фенил замещен 0-2 галоген или (С1-C6)алкильными заместителями;
или где R7R8N, взятые вместе, представляют собой (хинуклидинил)амино, (хинуклидинил)((C1-C6)алкил)амино, (метилпирролидинил)((С1-C6)алкил)амино, ((имидазолил)(C1-C6)алкил)(гидрокси(C1-C6)алкил)амино, ((С1-C6)алкилтиазолил)амино, ((карбоксамидо)циклопентанил)амино, ((галогенфенил)циклопентанил)амино, 3H-спиро(изобензофуранил)пиперидинил, (гидроксиинданил)амино или
(хинуклидинил)амино, (хинуклидинил)((C1-C6)алкил)амино, (метилпирролидинил)((С1-C6)алкил)амино, ((имидазолил)(C1-C6)алкил)(гидрокси(C1-C6)алкил)амино, ((С1-C6)алкилтиазолил)амино, ((карбоксамидо)циклопентанил)амино, ((галогенфенил)циклопентанил)амино, 3H-спиро(изобензофуранил)пиперидинил, (гидроксиинданил)амино или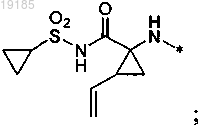
R9 представляет собой водород, (C1-C6)алкил или гидрокси(С1-C6)алкил;
R10 представляет собой водород или (С1-C6)алкил;
или R9 и R10, взятые вместе, представляют собой этилен или пропилен;
R11 представляет собой (C1-C6)алкил;
R12 представляет собой водород;
R13 представляет собой водород, (C1-C6)алкил, циано(С1-C6)алкил, галоген(С1-C6)алкил, (C2-C6)алкенил или тиазолил;
R14 представляет собой водород или (С1-C6)алкил;
R15 представляет собой (C1-C6)алкил, гидрокси(С1-C6)алкил, (C3-С7)циклоалкил или бензил;
R16 представляет собой водород;
или R15 и R16, взятые вместе с атомом азота, к которому они присоединены, представляют собой азетидинил, пирролидинил, пиперидинил, пиперазинил или морфолинил;
R17 представляет собой галоген(С1-C6)алкил, циано(С1-C6)алкил, ((C3-С7)циклоалкил)(C1-C6)алкил, гидрокси(C1-C6)алкил, (C1-C6)алкокси(C1-C6)алкил, амино(С1-C6)алкил, (R18)(С1-C6)алкил, (Ar4)(С1-C6)алкил, алкинил или амино(C3-С7)циклоалкил;
R18 представляет собой CONH2, H2NCONH, дибензиламино, фталимидо, амино, ди(С1-C6)алкиламино, пирролидинил, пиперидинил, пиперазинил или морфолинил, где азетидинил, пирролидинил, пиперидинил, пиперазинил или морфолинил замещены 0-3 (С1-C6)алкил или (С1-C6)алкоксикарбонил заместителями;
R19 представляет собой циано, гидрокси(С1-C6)алкил, морфолинил(C1-C6)алкил, карбокси, (C1-C6)алкоксикарбонил, (C3-С7)циклоалкилсульфоксамидо, (((C1-C6)алкил)пиразолил)амино, (((C1-C6)алкил)изоксазолил)амино, (тиадиазолил)амино, (триазинил)амино или алкиниламинокарбонил;
R20 представляет собой водород;
R21 представляет собой водород;
Ar1 представляет собой фенил, нафталенил, пиридинил, фуранил, пиразолил, изоксазолил, имидазолил, оксазолил, тиазолил, оксадиазолил, триазолил, тетразолил, пиразинил, пиримидинил или бензотиазолил и замещен 0-2 заместителями, выбранными из галогена, (С1-C6)алкила, (C3-С7)циклоалкила, галоген(С1-C6)алкила, (C1-C6)алкокси(С1-C6)алкила, гидрокси, (C1-C6)алкокси, амино, аминокарбонила, пиридинила, фенила, галогенфенила, (С1-C6)алкилфенила и (С1-C6)алкоксифенила;
Ar2 представляет собой фенил, бифенил или пиридинил и замещен 0-2 заместителями, выбранными из галогена, (С1-C6)алкила, циано, гидрокси, (C1-C6)алкокси и карбокси;
Ar3 представляет собой пиразолил, изоксазолил, тиазолил, триазолил, пиримидинил или пиризинил и замещен 0-2 заместителями, выбранными из гидрокси, (С1-C6)алкила и CONR13R14;
Ar4 представляет собой фуранил, пирролил, пиразолил, изоксазолил, имидазолил, оксадиазолил, триазолил, пиридинил, индолил или фенил и замещен 0-2 заместителями, выбранными из галогена, (C1-C6)алкила, галоген(С1-C6)алкила и гидрокси; и
Ar5 представляет собой пиразолил, имидазолил или оксадиазолил и замещен 0-2 заместителями, выбранными из (С1-C6)алкила, (C1-C6)алкоксикарбонила, бензила и фенила;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой фенил, замещенный 1 CONR7R8 заместителем и также замещенный 0-2 галоген, (С1-C6)алкил или (C1-C6)алкокси заместителями; R2 представляет собой водород, галоген или R5R6N; R3 представляет собой CONR11R12; R4 представляет собой монофторфенил; R5 представляет собой алкилсульфонил; R6 представляет собой гидрокси(С1-C6)алкил; R7 представляет собой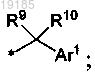
R8 представляет собой водород; R9 представляет собой (С1-C6)алкил; R10 представляет собой (С1-C6)алкил или R9 и R10, взятые вместе, представляют собой этилен или пропилен; R11 представляет собой (С1-C6)алкил; R12 представляет собой водород и Ar1 представляет собой фенил, пиридинил, пиримидинил, изоксазолил, оксазолил или оксадиазолил и замещен 0-1 галоген или (С1-C6)алкильными заместителями; или его фармацевтически приемлемая соль.
3. Соединение по п.1, где R1 представляет собой фенил, замещенный 1 CONR7R8 заместителем и также замещенный 0-2 галоген, (С1-C6)алкил или (C1-C6)алкокси заместителями.
4. Соединение по п.3, где R7 представляет собой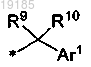
и по меньшей мере один из R9 и R10 не представляет собой водород.
5. Соединение по п.1, представляющее собой 4-фтор-2-(4-фторфенил)-N-метил-5-(2-метил-5-(1-(пиримидин-2-ил)циклопропилкарбамоил)фенил)бензофуран-3-карбоксамид формулы
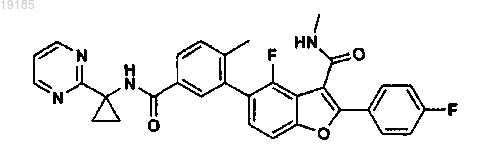
или его фармацевтически приемлемую соль.
6. Фармацевтическая композиция, содержащая соединение 4-фтор-2-(4-фторфенил)-N-метил-5-(2-метил-5-(1-(пиримидин-2-ил)циклопропилкарбамоил)фенил)бензофуран-3-карбоксамид или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
7. Способ лечения вирусного гепатита С, включающий введение пациенту терапевтически эффективного количества соединения 4-фтор-2-(4-фторфенил)-N-метил-5-(2-метил-5-(1-(пиримидин-2-ил)циклопропилкарбамоил)фенил)бензофуран-3-карбоксамида или его фармацевтически приемлемой соли.
Текст
СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ГЕПАТИТА С Описание раскрывает соединения формулы I, включая их соли, так же как композиции и способы применения соединений. Соединения обладают активностью против вирусного гепатита С (HCV) и могут быть полезными для лечения пациентов, инфицированных HCV. Предшествующий уровень техники Изобретение главным образом относится к новым соединениям формулы I, включая их соли, которые проявляют активность против вируса гепатита С (HCV) и являются полезными для лечения пациентов с заболеванием HCV. Изобретение также относится к композициям и способам применения указанных соединений. Вирус гепатита С (HCV) является основным патогеном человека, инфицировавшим предположительно 170 млн человек по всему миру - грубо в пять раз больше, чем инфицированных вирусом иммунодефицита человека 1 типа. У значительного числа инфицированных HCV индивидуумов развивается серьезное прогрессирующее заболевание печени, включая цирроз и печеночно-клеточный рак (Lauer,G.M. et al., N Engl. J. Med, 345:41-52 (2001.HCV является положительно закрученным РНК вирусом. Основываясь на сравнении вычисленной последовательности аминокислот и значительном сходстве в 5'-нетранслируемой области, HCV классифицируется как отдельный род в семействе Flaviviridae. Все представители семейства Flaviviridae имеют оболочечные вирионы, которые содержат положительно закрученный РНК геном, кодирующий все известные вирус-специфические белки с помощью трансляции единичной непрерывной открытой рамки считывания. Существенная гетерогенность найдена в нуклеотидной и кодированной аминокислотной последовательности по всему геному HCV. Были описаны по меньшей мере шесть основных генотипов и более чем 50 подтипов. Основные генотипы HCV отличаются по распространенности в мире, и клиническое значение генетической гетерогенности HCV остается неясным, несмотря на множество исследований возможного действия генотипов на патогенез и терапию. Геном одноцепочечной РНК HCV составляет приблизительно 9500 нуклеотидов в длину и имеет одну открытую рамку считывания (ORF), кодирующую один большой полипротеин из примерно 3000 аминокислот. В инфицированных клетках указанный полипротеин расщепляется по многим сайтам клеточными и вирусными протеазами до получения структурных и неструктурных (NS) белков. В случаеHCV поколение зрелых неструктурных белков (NS2, NS3, NS4A, NS4B, NS5A и NS5B) подвергается воздействию двух вирусных протеаз. Первая, как предполагают, является металлопротеазой и расщепляетNS2-NS3 связь; вторая является сериновой протеазой, содержащей на N-конце NS3 (также обозначаемая как NS3 протеаза), и опосредует все последующие расщепления ниже по каскаду NS3 как в цисположении в сайте расщепления NS3-NS4A, так и в транс-положении для остальных сайтов NS4A-NS4B,NS4B-NS5A, NS5A-NS5B. NS4A белок, как представляется, выполняет множество функций, действуя как кофактор для NS3 протеазы и возможно способствует расположению в мембране NS3 и других компонентов вирусной репликазы. Образование комплекса NS3 белка и NS4A представляется необходимым для этапов процесса, повышая эффективность протеолиза во всех сайтах. Белок NS3 также проявляет активность нуклеозидной трифосфатазы и РНК хеликазы. NS5B (также обозначаемая как HCV полимераза) является РНК-зависимой РНК полимеразой, которая вовлечена в репликацию HCV. HCV NS5B белок описан в "Structural Analysis of the Hepatitis С Virus RNA Polymerase в Complex with Ribonucleotides(2003. Обычно наиболее эффективная HCV терапия использует комбинацию -интерферона и рибавирина, приводя к успеху у 40% пациентов (Poynard, Т. et al., Lancet, 352:1426-1432 (1998. Последние клинические результаты демонстрируют то, что пегилированный -интерферон является более активным по сравнению с не модифицированным -интерфероном в случае использования монотерапии (Zeuzem, S. etal., N Engl. J. Med, 343:1666-1672 (2000. Однако даже при условии использования экспериментальных терапевтических режимов, включающих комбинации пегилированного -интерферона и рибавирина, у значительной части пациентов не наблюдается стабильного снижения вирусного воздействия. Таким образом, ясной и важной потребностью является необходимость развития эффективной терапии для лечения HCV инфекции.HCV-796, HCV NS5B ингибитор, демонстрирует способность снижать уровни HCV РНК у пациентов. Уровни вирусной РНК снижаются временно и затем подавляются во время дозирования лекарства,когда лечение проводят с помощью соединения как единственного агента, но уровни падают более сильно в случае, когда происходит комбинирование со стандартным воздействием в виде интерферона и рибавирина. Развитие этого соединения было приостановлено из-за гепатотоксичности, которую наблюдали во время продолжительных периодов дозирования режимов комбинирования. U.S. Patent7265152 и соответствующая заявка РСТ WO 2004/041201 А 2 раскрывают соединения HCV-796 класса. Изобретение обеспечивает технические преимущества, например, за счет новых соединений, которые проявляют активность против гепатита С. Кроме того, соединения обеспечивают преимущество с точки зрения фармакологического использования, например, благодаря одному или более механизмам их действия, связывания, ингибирования, селективности выбора цели, растворимости, профилей безопасности или биодоступности. Описание изобретения Один из аспектов изобретения представляет собой соединение формулы I где R1 представляет собой R5R6N; алкокси; (алкоксикарбониламино)алкокси; (алкилфенил)алкокси; (карбокси)алкенил; (алкоксикарбонил)алкенил; (бензилоксикарбонил)алкенил; N-диметилбензил)аминокарбонил)алкенил или фенил, где указанный фенил замещен 1-2 заместителями, выбранными из группы,состоящей из галогена, циано, алкила, галогеналкила, гидроксиалкила, алкоксиалкила, (карбокси)алкила,алкокси, гидроксиалкилокси, алкоксиалкилокси, бензилокси, тетрагидропиранилокси, карбокси, алкоксикарбонила, алкилсульфонила, (карбокси)алкенила, (алкоксикарбонил)алкенила, алкилкарбоксамидо,алкоксикарбоксамидо, алкилсульфамидо, (алкилсульфамидо)алкила, Ar5, SO2NRI5R16 и CONR7R8; и где указанный фенил также замещен 0-2 заместителями, выбранными из группы, состоящей из галогена; нитро; алкила; циклоалкила; галогеналкила; аминоалкила; гидроксиалкила; алкоксиалкила; гидрокси; алкокси; OR17; циклоалкокси; амино; алкиламино; диалкиламино; алкилкарбоксамидо; алкоксикарбоксамидо; алкоксиалкилкарбоксамидо; фуранила, тиенила или пиразолила, замещенного 0-2 алкильными заместителями; пиридинила, замещенного 0-2 галогеном, циано, алкилом, гидрокси, алкокси, амином или алкиламинокарбонильными заместителями; пиримидинил; пиримидинедоинил; аминопиримидинил; индолил; изохинолинил; или фенила, замещенного 0-2 заместителями, выбранными из галогена, алкила,цианоалкила, гидроксиалкила, алкоксиалкила, гидрокси, алкокси, амино, карбокси, алкоксикарбонила,аминокарбонила, алкиламинокарбонила, диалкиламинокарбонила, алкилкарбоксамидо, карбоксиалкенила и фенила;R8 представляет собой водород, алкил, гидроксиалкил или алкоксиалкил; или R7R8N, взятые вместе, представляют собой азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, дигидроиндолил или изоиндолинил и замещены 0-2 заместителями, выбранными из алкила, гидроксиалкила, алкоксиалкила, гидрокси, алкокси, карбокси, алкоксикарбонила, диалкилкарбоксамидо, алкилкарбониламино, алкоксикарбониламино, пиридинила и фенила, где указанный фенил замещен 0-2 галогеновыми или алкильными заместителями; или где R7R8N, взятые вместе, представляют собойR14 представляет собой водород или алкил;R16 представляет собой водород или алкил; или R15 и R16, взятые вместе с атомом азота, к которому они присоединены, представляют собой азетидинил, пирролидинил, пиперидинил, пиперазинил или морфолинил;R18 представляет собой CONH2, H2NCONH, дибензиламино, фталимидо, амино, алкиламино, диалкиламино, азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, где азетидинил, пирролидинил, пиперидинил, пиперазинил или морфолинил, замещенные 0-3 алкильным или алкоксикарбонильным заместителями;Ar1 представляет собой фенил, нафталенил, пиридинил, фуранил, тиенил, пирролил, пиразолил,изоксазолил, изотиазолил, имидазолил, оксазолил, тиазолил, оксадиазолил, оксадиатиазолил, триазолил,тетразолил, пиразинил, пиримидинил или бензотиазолил и замещен 0-2 заместителями, выбранными из галогена, алкила, циклоалкила, галогеналкила, алкоксиалкила, гидрокси, алкокси, амино, алкиламино,диалкиламино, аминокарбонила, пиридинила, фенила, галогенфенила, алкилфенила и алкоксифенила;Ar2 представляет собой фенил, бифенил или пиридинил и замещен 0-2 заместителями, выбранными из галогена, алкила, циано, гидрокси, алкокси и карбокси;Ar3 представляет собой пиразолил, изоксазолил, изотиазолил, имидазолил, оксазолил, тиазолил,триазолил, оксадиазолил, оксатиадиазолил, пиримидинил или пиризинил и замещен 0-2 заместителями,выбранными из гидрокси, алкила, гидроксиалкила и CONR13R14;Ar4 представляет собой фуранил, тиенил, пирролил, пиразолил, изоксазолил, изотиазолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, пиридинил, индолил или фенил и замещен 0-2 заместителями, выбранными из галогена, алкила, галогеналкила, гидроксила и алкокси; иAr5 представляет собой пиррозолил, имидазолил или оксадиазолил и замещен 0-2 заместителями,выбранными из алкила, карбокси, алкоксикарбонила, бензила и фенила; или их фармацевтически приемлемые соли. Другой аспект изобретения представляет собой соединение формулы I, где R20 и R21 представляют собой водород. Другой аспект изобретения представляет собой соединение формулы I, гдеR1 представляет собой R5R6N; (карбокси)алкенил; (алкоксикарбонил)алкенил; (бензилоксикарбонил)алкенил или фенил, где указанный фенил замещен 1-2 заместителями, выбранными из группы, состоящей из циано, алкила, алкокси, гидроксиалкила, алкоксиалкила, гидроксиалкилокси, алкоксиалкилокси, галогеналкила, бензилокси, карбокси, алкоксикарбонила, алкилсульфонила, (карбокси)алкенила,(алкоксикарбонил)алкенила, алкилкарбоксамидо, алкоксикарбоксамидо, алкилсульфамидо, (алкилсульфамидо)алкила, тетрагидропиранилокси, Ar5, SO2NR15R16 и CONR7R8; и где указанный фенил также замещен 0-1 заместителями, выбранными из группы, состоящей из галогена; алкила; гидроксиалкила; алкоксиалкила; гидроксила; алкокси; OR17; циклоалкокси; амино; алкиламино; диалкиламино; алкилкарбоксамидо; алкоксиалкилкарбоксамидо; фуранила; индолила; изохинолинила; пиридинил, замещенный 0-2 галогеном, алкилом, гидроксилом или алкоксильными заместителями; пиразолил, замещенный 0-2 алкильными заместителями; и фенил, замещенный 0-2 галогеном, алкилом, цианоалкилом, гидроксиалкилом, алкоксиалкилом, гидроксилом, алкоксилом, карбоксилом, алкоксикарбонилом, аминокарбонилом,алкиламинокарбонилом, диалкиламинокарбонилом, алкилкарбоксамидом, карбоксиалкенилом или фенильными заместителями;R8 представляет собой водород, алкил, гидроксиалкил или алкоксиалкил; или R7R8N, взятые вместе, представляют собой азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил или дигидроиндолил и замещены 0-2 заместителями, выбранными из алкила, гидроксиалкила, алкоксиалкила, гидроксила, алкокси, карбокси, алкоксикарбонила, диметилкарбоксамидо,алкилкарбониламино, алкоксикарбониламино, пиридинила и фенила, где фенил замещен 0-2 заместителями, выбранными из галогена и алкила; или где R7R8N, взятые вместе, представляют собойR14 представляет собой водород или алкил;R15 представляет собой водород или алкил;R16 представляет собой водород или алкил;R18 представляет собой CONH2, дибензиламино, амино, алкиламино, диалкиламино, азетидинил,пирролидинил, пиперидинил, пиперазинил, морфолинил, где азетидинил, пирролидинил, пиперидинил,пиперазинил или морфолинил замещен 0-3 заместителями, выбранными из алкила и алкоксикарбонила;Ar1 представляет собой фенил, нафталенил, пиридинил, тиенил, тиазолил или пиразинил и замещен 0-2 заместителями, выбранными из алкила, галогена, гидрокси, алкокси, амино, алкиламино и диалкиламино;Ar2 представляет собой фенил, бифенил или пиридинил и замещен 0-2 заместителями, выбранными из галогена, алкила, циано, гидрокси и алкокси;Ar3 представляет собой пиразолил, изоксазолил, тиазолил, пиримидинил или пиризинил и замещен 0-2 заместителями, выбранными из алкила и гидроксиалкила;Ar4 представляет собой пирролил, имидазолил, пиридинил, индолил или фенил и замещен 0-2 заместителями, выбранными из галогена, алкила, гидроксила и алкокси;Ar5 представляет собой пиррозолил, имидазолил или оксадиазолил и замещен 0-2 заместителями,выбранными из алкила, карбокси, алкоксикарбонила, бензила и фенила; или их фармацевтически приемлемые соли. Другой аспект изобретения представляет собой соединение формулы I, гдеR1 представляет собой алкокси; (алкоксикарбониламино)апкокси; (алкилфенил)алкокси; (карбокси)алкенил; N-диметилбензил)аминокарбонил)алкенил или фенил, где указанный фенил замещен 1-2 заместителями, выбранными из группы, состоящей из галогена, циано, алкила, галогеналкила, гидроксиалкила, (карбокси)алкила, алкокси, гидроксиалкилокси, тетрагидропиранилокси, карбокси, алкоксикарбонила, (карбокси)алкенила, алкилкарбоксамидо, алкоксикарбоксамидо, (алкилсульфамидо)алкила, Ar5,SO2NR15R16 и CONR7R8; и где указанный фенил также замещен 0-2 заместителями, выбранными из группы, состоящей из галогена; нитро; алкила; циклоалкила; галогеналкила; аминоалкила; гидрокси; алкокси;OR17; циклоалкокси; амино; алкоксикарбоксамидо; фуранила, тиенила или пиразолила, замещенного 0-2 алкильными заместителями; пиридинила, замещенного 0-2 галогеном, циано, алкилом, гидрокси, алкокси, амино или алкиламинокарбонильными заместителями; пиримидинил; пиримидидионил; аминопиримидинил; индолил; изохинолинил и фенил, замещенный 0-2 заместителями, выбранными из галогена,цианоалкила, гидроксиалкила, алкоксиалкила, алкокси, амино, карбокси, аминокарбонила, алкиламинокарбонила, алкилкарбоксамидо, и карбоксиалкенил;R5 представляет собой водород или алкилсульфонил;R8 представляет собой водород, алкил или алкоксиалкил; или R7R8N, взятые вместе, представляют собой азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, дигидроиндолил или изоиндолинил и замещены 0-2 заместителями, выбранными из алкила, гидроксиалкила, алкоксиалкила, гидрокси, алкоксикарбонила, диалкилкарбоксамидо, алкилкарбониламино, пиридинила и фенила, где указанный фенил замещен 0-2 галоген или алкильными заместителями; или где R7R8N, взятые вместе, представляет собойR10 представляет собой водород или алкил; или R9 и R10, взятые вместе, представляет собой этилен или пропилен;R14 представляет собой водород или алкил;R18 представляет собой CONH2, H2NCONH, дибензиламино, фталимидо, амино, диалкиламино,пирролидинил, пиперидинил, пиперазинил, морфолинил, где азетидинил, пирролидинил, пиперидинил,пиперазинил или морфолинил, замещенный 0-3 алкильным или алкоксикарбонильным заместителями;Ar1 представляет собой фенил, нафталенил, пиридинил, фуранил, пиразолил, изоксазолил, имидазолил, оксазолил, тиазолил, оксадиазолил, триазолил, тетразолил, пиразинил, пиримидинил или бензотиазолил и замещен 0-2 заместителями, выбранными из галогена, алкила, циклоалкила, галогеналкила, алкоксиалкила, гидрокси, алкокси, амино, аминокарбонила, пиридинила, фенила, галогенфенила, алкилфенила и алкоксифенила;Ar2 представляет собой фенил, бифенил или пиридинил и замещен 0-2 заместителями, выбранными из галогена, алкила, циано, гидрокси, алкокси и карбокси;Ar3 представляет собой пиразолил, изоксазолил, тиазолил, триазолил, пиримидинил или пиразинил и замещен 0-2 заместителями, выбранными из гидрокси, алкила и CONR13R14;Ar4 представляет собой фуранил, пирролил, пиразолил, изоксазолил, имидазолил, оксадиазолил,триазолил, пиридинил, индолил или фенил и замещен 0-2 заместителями, выбранными из галогена, алкила, галогеналкила и гидрокси;Ar5 представляет собой пиррозолил, имидазолил или оксадиазолил и замещен 0-2 заместителями,выбранными из алкила, алкоксикарбонила, бензила и фенила; или их фармацевтически приемлемые соли. Другой аспект изобретения представляет собой соединение формулы I, где R1 представляет собой фенил, замещенный 1 CONR7R8 заместителем и также замещенный 0-2 галогеновыми, алкильными или алкоксизаместителями; R2 представляет собой водород, галоген или R5R6N; R3 - CONR11R12; R4 представляет собой монофторфенил; R5 представляет собой алкилсульфонил; R6 представляет собой гидроксиал-5 019185R8 представляет собой водород; R9 представляет собой алкил; R10 9 представляет собой алкил или R и R10, взятые вместе, представляют собой этилен или пропилен; R11 представляет собой алкил; R12 представляет собой водород; R20 и R21 представляют собой водород; Ar1 представляет собой фенил, пиридинил, пиримидинил, изоксазолил, оксазолил или оксадиазолил и замещен 0-1 галогеновыми или алкильными заместителями; или их фармацевтически приемлемые соли. Другой аспект изобретения представляет собой соединение формулы I, где R1 является фенилом,замещенным 1-2 заместителями, выбранными из группы, состоящей из галогена, циано, алкила, галогеналкила, гидроксиалкила, (карбокси)алкила, алкокси, гидроксиалкилокси, тетрагидропиранилокси, карбокси, алкоксикарбонила, (карбокси)алкенила, алкилкарбоксамидо, алкоксикарбоксамидо, (алкилсульфамидо)алкила, Ar5, SO2NR15R16 и CONR7R8; и где указанный фенил также замещен 0-2 заместителями,выбранными из группы, состоящей из галогена, нитро; алкила; циклоалкила; галогеналкила; аминоалкила; гидрокси; алкокси; OR17; циклоалкокси; амино; алкоксикарбоксамидо; фуранила, тиенила или пиразолила, замещенного 0-2 алкильными заместителями; пиридинил, замещенный 0-2 галогеном, циано,алкилом, гидрокси, алкокси, амино или алкиламинокарбонильными заместителями; пиримидинил; пиримидидионил; аминопиримидинил; индолил; изохинолинил; и фенил, замещенный 0-2 заместителями,выбранными из галогена, цианоалкила, гидроксиалкила, алкоксиалкила, алкокси, амино, карбокси, аминокарбонила, алкиламинокарбонила, алкилкарбоксамидо и карбоксиалкенила. Другой аспект изобретения представляет собой соединение формулы I, где R1 представляет собой фенил, замещенный 1 CONR7R8 заместителем и также замещенный 0-2 галогеном, алкилом или алкоксильными заместителями. Другой аспект изобретения представляет собой соединение формулы I, где R7 представляет собой и по крайней мере один из R9 и R10 не представляет собой водород. Другой аспект изобретения представляет собой соединение формулы I, где R2 представляет собой 5 6R R N. Другой аспект изобретения представляет собой соединение формулы I, где R3 представляет собойCONR11R12. Другой аспект изобретения представляет собой соединение формулы I, где R4 представляет собой фенил или монофторфенил. Если не указано иное, эти термины имеют следующие значения. "Алкил" означает прямую или разветвленную алкильную группу, состоящую из от 1 до 6 атомов углерода. "Алкенил" означает прямую или разветвленную алкильную группу, состоящую из от 2 до 6 атомов углерода по крайней мере с одной двойной связью. "Циклоалкил" означает моноциклическую кольцевую систему, состоящую из от 3 до 7 атомов углерода. "Гидроксиалкил", "алкокси" и другие термины с замещенной алкильной частью включают прямые и разветвленные изомеры, состоящие из от 1 до 6 атомов углерода в алкильной части. "Галогеналкил" и "галогеналкокси" включают все галогенпроизводные от моногалогензамещенного алкила до пергалогензамещенного алкила. "Арил включает карбоциклические и гетероциклические ароматические заместители. Заключенные в скобки или в множественные скобки термины предназначены для уточнения связей для специалиста в данной области. Например, термин, такой как R)алкил) означает алкильный заместитель, дополнительно замещенный заместителем R. Заместители, которые проиллюстрированы в химичеких формулах как связанные с различными положениями мультикольцевой системы (например, бициклической системы), представляются связанными с кольцом, как указано на рисунке. Например, заместители R1 и R2 в формуле I предназначены для того,чтобы быть связанными с бензольным кольцом в формуле I, а не с фурановым кольцом. Этилен означает этандиил или -CH2CH2-; пропилен означает пропандиил или -CH2CH2CH2-; бутилен означает бутандиил или -CH2CH2CH2CH2-; пентилен означает пентандиил или -CH2CH2CH2CH2CH2-. Диоксотиазинил означает Любые значения любого радикала, включая R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14,15R , R16, R17, R18, R19, R20, R21, Ar1, Ar2, Ar3, Ar4 или Ar5 могут быть использованы независимо от значения любого другого переменного. Изобретение включает все формы фармацевтически приемлемых солей соединений. Фармацевтически приемлемые соли представляют собой те, в которых противоионы не вносят существенного вклада в физиологическую активность или токсичность соединений и как с точки зрения фармакологической аналогии, так и с точки зрения фармакологической биоэквивалентности. Такие соли могут быть получены в соответствии с общими органическими методиками, с использованием коммерчески доступных реагентов. Некоторые анионные формы солей включают ацетат, ацистрат, бесилат, бромид, хлорид, цитрат,фумарат, глюкоронат, гидробромид, гидрохлорид, гидроиодид, иодид, лактат, малеат, мезилат, нитрат,памоат, фосфат, сукцинат, сульфат, тартрат, тозилат и ксинофоат. Некоторые катионные формы солей включают аммоний, алюминий, бензатин, висмут, кальций, холин, диэтиламин, диэтаноламин, литий,магний, меглюмин, 4-фенилциклогексиламин, пиперазин, калий, натрий, трометамин и цинк. Некоторые из соединений изобретения содержат асимметрические атомы углерода. Изобретение включает все стереоизомерные формы, включая энантиомеры и диастереомеры, а также смеси стереоизомеров, такие как рацематы. Некоторые стереоизомеры могут быть получены методами, известными из уровня техники. Стереомерные смеси соединений и родственных промежуточных соединений могут быть разделены на индивидуальные изомеры с помощью методов, известных из уровня техники. Изобретение обязательно должно включать все изотопы атомов, встречающихся в настоящих соединениях. Изотопы включают те атомы, которые имеют тот же атомный номер, но разные массовые числа. В качестве общего примера и без ограничения изотопы водорода включают дейтерий и тритий. Изотопы углерода включают 13C и 14C. Изотопно-меченые соединения изобретения могут быть в большинстве случаев получены общепринятыми методами, известными специалисту в данной области или с помощью процессов, аналогичных тем, что описаны здесь, используя соответствующие изотопномеченые реагенты, в том месте, где в ином случае применяются немеченые реагенты. Такие соединения могут иметь различное потенциальное использование, например в качестве стандартов и реагентов при определении биологической активности. В случае стабильных изотопов такие соединения могут иметь потенциал для положительного изменения биологических, фармакологических или фармакокинетических свойств. Методы синтеза Соединения могут быть получены методами, известными в данной области, включая те, которые описаны ниже, и включая варианты, известные среднему специалисту, а также включая варианты, известные из уровня техники. Некоторые реагенты и промежуточные соединения известны из уровня техники. Другие реагенты и промежуточные соединения могут быть получены с помощью методов, известных среднему специалисту, с использованием легко доступных материалов. Переменные (например, перечисленные "R" заместители), используемые для описания синтеза соединений, предназначены только для иллюстрации способа получения соединения и не должны смешиваться с переменными, используемыми в формуле изобретения или в других частях описания. Следующие методы являются иллюстративными и они не ограничивают объем изобретения. Сокращения, используемые в схемах, и последующие примеры хорошо известны среднему специалисту. Аббревиатуры, используемые на схемах, как правило, следуют условностям, известным из уровня техники. Химические аббревиатуры в описании и в примерах определяются следующим образом:"BOC", "DMSO" - диметилсульфоксид; "h" - часы; "rt" - комнатная температура или время удерживания"EDTA" - этилендиаминтетрауксусная кислота; "Et2O" - диэтиловой эфир; "DMAP" - 4-диметиламинопиридин; "DCE" - 1,2-дихлорэтан; "ACN" - ацетонитрил; "DME" - 1,2-диметоксиэтан; "HOBt" - 1 гидроксибензотриазол гидрата; "DIEA" - диизопропилэтиламин, "Nf" - CF3(CF2)3SO2- и "TMOF" - триметилортоформиат. Как показано на схеме 1, некоторые соединения изобретения могут быть получены путем связывания трифлата или галоида бензофурана с замещенной фенилбороновой кислотой, которая в некоторых примерах содержит карбоновую кислоту или эфир карбоновой кислоты. Другие методики и условия связывания известны из уровня техники как иные реакции образования связи углерод-углерод. Кислоты и эфиры могут быть преобразованы в амиды методами, известными из уровня техники. Схема 2 изображает один конкретный пример схемы 1. Как показано на схеме 2, нитрогруппа в бензофурановом кольце может быть восстановлена, и полученная аминогруппа может быть функционализирована, используя известные в химии методы. Например, амин может быть преобразован в моносульфонамид по реакции с сульфонилхлоридом или путем приготовления бис-сульфонамида с последующим его селективным гидролизом. Моносульфонамид может быть снова проалкилирован с помощью как простого, так и функционализированного алкила. На схеме 3 гидроксилэтильная группа появляется после кислотного удаления защитной силильной группы. Схема 2 Схема 3 раскрывает получение двух промежуточных соединений, обазначенных в общем виде, как интермедиат 1 и 2, которые могут быть использованы для получения некоторых соединений данного изобретения. Изопропильная группа используется для временной защиты С 5 гидроксигруппы для того,чтобы из этилового эфира мог быть получен этилметиламид. Более реакционноспособный обычный интермедиат 2 дает возможность функционализации сульфонамида, кислотному снятию защиты и образованию ряда амидных соединений после связывания аминов с кислотой, как описано ранее. Схема 4 раскрывает некоторые условия получения ряда описанных соединений и подхода к альтернативному общему интермедиату 3, который позволяет образование амида до восстановления нитрогруппы и функционализации аминогруппы. Схема 5 иллюстрирует метод получения некоторых соединений путем приготовления 2-(4 фторфенил)-N-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензофуран-3-карбоксамида, в котором бор присоединяется к бензофурану, с последующим связыванием с трифлатами или галогенидами,содержащими арильные фрагменты. Схема 5 Схема 6 раскрывает получение функционализированного бензофурана, и схема 7 раскрывает один из методов введения азотосодержащей функциональной группировки, которую в дальнейшем можно модифицировать, как описано на предыдущих схемах. Схема 8 иллюстрирует, что свободная фенольная OH-группа может быть использована для того,чтобы получать различные эфирные соединения. Схема 9 раскрывает способ алкилирования для образования эфиров в мягких или более жестких условиях, зависящих от реакционной способности алкилирующего реагента. Схема 8 Схема 10 раскрывает, каким образом могут быть присоединены эфиры с защищенной аминогруппой, а затем после удаления защитной группы с фталимида высвобождается свободный амин, который может быть либо включен в соединения изобретения, либо путем стандартных химических методик превращен дополнительно в производные с получением вторичных или третичных аминов, или амидов, или сульфонамидов. Схема 10 Биологические способы Соединения демонстрируют активность в отношении HCV NS5B, как было определено в нижеприведенных исследованиях HCV RdRp. Клонирование, экспрессия, очистка HCV NS5B RdRp. кДНК, кодирующую NS5B белок HCV, генотип 1b, клонировали в векторе экспрессии рЕТ 21a. Белок экспрессировали с укорочением на 18 аминокислот с С-конца для улучшения растворимости. Компетентная в отношении Е. coli клеточная линия BL21(DE3) была использована для экспрессирования белка. Культуры выращивали при 37C в течение 4 ч до того, как они достигали оптической плотности 2,0 при 600 нм. Культуры охлаждали до 20C и индуцировали с помощью 1 мМ IPTG. Свежий ампициллин добавляли до конечной концентрации 50 мкг/мл и клетки выращивали в течение ночи при 20C. Клеточный осадок (3L) лизировали для очистки, чтобы получить 15-24 мг очищенного NS5B. Литический буфер содержал 20 мМ Tris-HCl, pH 7,4, 500 мМ NaCl, 0,5% тритон Х-100, 1 мМ DTT, 1 мМEDTA, 20% глицерин, 0,5 мг/мл лизоцима, 10 мМ мг Cl2, 15 мкг/мл дезоксирибонуклеазы I и таблетки ингибитора протеазы Complete TM (Roche). После добавления литического буфера замороженный клеточный осадок ресуспендировали, используя тканевой гомогенизатор. Для уменьшения вязкости образца аликвоты лизата обрабатывали ультразвуком на льду, используя микронаконечник, прикрепленный к ультразвуковому генератору Branson. Обработанный ультразвуком лизат центрифугировали при 100,000 г в течение 1 ч при 4C и фильтровали через 0,2 мкм фильтр (CORNING). Белок очищали, используя три последовательных этапа хроматографии: гепариновая сефароза CL- 12019185 6B, поли-U сефароза 4 В и HITRAP SP сефароза (Pharmacia). Хроматографические буферы были идентичны литическому буферу, но не содержали лизоцим, дезоксирибонуклеазу I, мг Cl2 или ингибитор протеазы и концентрацию NaCl буфера корректировали в соответствии с потребностями загрузки белка на колонке. Каждую колонку элюировали с градиентом NaCl, который варьировался по длине от 5 до 50 объемов колонки в зависимости от типа колонки. После завершающего этапа хроматографии полученная чистота фермента была 90% по данным SDS-PAGE анализа. Фермент аликвотировали и хранили при-80C. Стандартное исследование фермента HCV NS5B RdRp. Исследования HCV RdRp генотипа 1b проводили в конечном объеме 60 мкл в 96-луночных планшетах (COSTAR 3912). Буфер исследования состоял из 20 мМ Hepes, pH 7,5, 2,5 мМ KCl, 2,5 мМ мгCl2, 1 мМ DTT, 1,6 U ингибитора РНКазы (Promega N2515), 0,1 мг/мл BSA (Promega R3961) и 2% глицерина. Все соединения последовательно разводили (3-кратно) в DMSO и далее разбавляли водой, так что конечная концентрация DMSO в исследовании была равна 2%. Фермент HCV RdRp генотипа 1b использовали в конечной концентрации 28 нМ. Поли-А шаблон использовали при 6 нМ и биотинилированный олиго-dT12 праймер использовали при 180 нМ конечной концентрации. Шаблон приобретали коммерческим путем (Amersham 27-4110). Биотинилированный праймер был изготовлен с помощью Сигма Генолиза (Sigma Genosys). 3H-UTP использовали при 0,6 мкКи (0,29 мМ общего UTP). Реакции запускали путем добавления фермента, инкубированного при 30C в течение 60 мин, и останавливали путем добавления 25 мкл 50 мм EDTA-содержащих SPA гранул (4 мг/мл, Amersham RPNQ 0007). Планшеты считывали на устройстве Packard Top Count NXT после более 1 ч инкубации при комнатной температуре. Модифицированное ферментное исследование HCV NS5B RdRp. Модифицированное ферментное исследование проводили практически так, как это описано для стандартного ферментного исследования, за исключением следующего: биотинилированный олиго-dT12 праймер был предварительно нанесен на покрытые стрептавидином SPA гранулы путем смешивания праймера и гранул в буфере исследования и инкубирования при комнатной температуре в течение 1 ч. Несвязанный праймер удаляли после центрифугирования. Связанные с праймером гранулы ресуспендировали в 20 мМ буфере Hepes, pH 7,5 и использовали в исследовании в конечных концентрациях 20 нМ праймера и 0,67 мг/мл гранул. Порядок добавления реактивов в исследовании: фермент (14 нМ) добавляли к разведенному соединению, после чего добавляли смесь шаблона (0,2 нМ), 3H-UTP (0,6 мкКи, 0,29 мкМ) и связанных с праймером гранул для запуска реакции; приведенные концентрации являются конечными. Реакции проводили в течение 4 ч при 30C. Значения IC50 для соединений определяли, используя семь разных [I]. Значения IC50 подсчитывали по ингибированию с помощью формулыy = A+B-A)/(1+C/x)D. Подготовка исследования FRET (флуоресцентного резонансного переноса энергии). Для выполнения скринингового HCV FRET исследования были использованы 96-луночные планшеты с клеточными культурами. Пептид FRET (Anaspec, Inc.) (Taliani et al., Anal. Biochem., 240:60-67(1996 содержит флуоресцентный донор, EDANS рядом с одним концом пептида и акцептор DABCYL рядом с другим концом. Флуоресценцию пептида гасят с помощью межмолекулярного резонансного переноса энергии (RET) между донором и акцептором, и по мере того как NS3 протеаза расщепляет пептид, продукты высвобождаются из RET гашения, и флуоресценция донора становится заметной. Реактив исследования получают следующим образом: 5 Х литический реактив люциферазы клеточной культуры от Promega (E153A) разбавляют до 1X (dH2O, NaCl добавляют до конечной концентрации 150 мм, FRET пептид разбавляют до конечной концентрации 20 мкМ из 2 мМ исходного раствора. Для приготовления планшетов клетки с HCV репликоном с или без репортерного гена люциферазыRenilla трипсинизируют и помещают в каждую лунку 96-луночного планшета с титрованными тестируемыми соединениями, добавленными в колонки с 3 по 12; колонки 1 и 2, содержащие контрольное соединение (ингибитор HCV протеазы), и нижний ряд, содержащий клетки без соединения. Планшеты затем помещают в CO2 инкубатор при 37 С. Исследования. После добавления тестируемых соединений, описанных выше (приготовление исследования FRET),в различное время планшеты удаляют и раствор Alamar синий (Trek Diagnostics, 00-100) добавляют в каждую лунку в качестве меры клеточной токсичности. После считывания в приборе CYTOFLUOR 4000 (РЕ Биосистемы), планшеты отмывают с помощью PBS и затем используют для FRET исследования путем добавления 30 мкл реактива исследования FRET пептида, описанного выше (приготовление исследования FRET) на лунку. Планшет затем помещают в прибор CYTOFLUOR 4000, который устанавливают на 340 возбуждение/490 эмиссия, автоматический режим на 20 циклов и планшет считывают в кинетическом режиме. Обычно отношение сигнал/шум при использовании анализа конечных точек после считывания составляет по меньшей мере три единицы. Альтернативно, после считывания Alamar синего планшеты отмывают PBS, добавляют 50 мкл DMEM (с высоким содержанием глюкозы) без фенолового красного и планшеты затем используют для исследования люциферазы, применяя систему иссле- 13019185 дования люциферазы Promega DUAL-GLO Luciferase Assay System. Анализ соединения проводят путем количественного определения относительного ингибированияHCV репликона и значений относительной цитотоксичности. Для расчета уровней цитотоксичности среднее значение флуоресцентных сигналов Alamar синего из контрольных лунок принимают за 100% нетоксичности. Отдельные сигналы в каждой из лунок с тестируемым соединением затем делят на средний контрольный сигнал и умножают на 100% для определения процента цитотоксичности. Для подсчета значений ингибирования HCV репликона средний фоновый уровень получают из двух лунок, содержащих наибольшее количество ингибитора HCV протеазы в конце периода исследования. Эти числа были схожими с теми, что получены в интактных клетках Huh-7. Фоновые числа затем вычитают из среднего сигнала, полученного в контрольных лунках, и это число используют как 100% активность. Конкретные сигналы в каждой из лунок с тестируемым соединением затем делят на средние контрольные значения после вычитания фона и умножают на 100%, чтобы определить процент активности. Значения EC50 для титрования ингибитора протеазы подсчитывают как концентрацию, которая вызывает 50% снижение FRET или люциферазной активности. Два числа,полученные для планшета с соединением, процент цитотоксичности и процент активности, используют для оценки соединений, представляющих интерес для дальнейшего анализа. Репортерный анализ люциферазы HCV репликона. Исследование люциферазы HCV репликона было разработано для отслеживания ингибиторных эффектов соединений, описанных в работах по репликации вируса HCV. Применение репортерного анализа люциферазы репликона было впервые описано Krieger et al. (Krieger, N. et al., J. Virol., 75(10):4614-4624(2001. HUH-7 клетки, стабильно экпрессирующие HCV репликон, выращивали в среде Игла в модификации Дульбекко (DMEM) (Gibco-BRL), содержащей 10% фетальную телячью сыворотку (FCS) (Sigma) и 1 мг/мл G418 (Gibco-BRL). Соединения серийно разбавляли в 3 раза в DMSO для титрования и затем переносили в стерильные 384-луночные обработанные планшеты для тканевых культур (CORNING cat3571). Планшеты затем засевали 50 мкл клеток с плотностью 3,0103 клеток/лунка в DMEM, содержащей 4% FCS (конечная концентрация DMSO0,5%). После 3 дней инкубации при 37C клетки были проанализированы на активность люциферазы Renilla с помощью EnduRen в качестве субстрата (Promega catE6485). Субстрат EnduRen разбавляли в DMEM и затем добавляли в планшеты до конечной концентрации 75 мкМ. Планшеты инкубировали в течение 2 ч при 37C и затем незамедлительно считывали в течение 30 мин с помощью VIEWLUX Imager (PerkinElmer), используя программу люминесценции. Чтобы оценить цитотоксичность соединений, были определены уровни CC50 путем уплотнения EnduRenсодержащих планшетов CELLTITER-BLUE (Promega, catG8082). 3 мкл CellTiter Blue добавляли в каждую лунку и инкубировали в течение 8 ч при 37C. Сигнал флуоресценции из каждой лунки считывали с длиной волны возбуждения 525/10 нм и длиной волны эмиссии 598/10 нм, используя VIEWLUXImager. Репрезентативные данные для соединений представлены в табл. 1a, 1b и 1c. Таблица 1a
МПК / Метки
МПК: A61K 31/14, C07D 453/00, C07D 417/12, C07D 417/10, C07D 405/12, C07D 413/10, C07D 307/84, C07D 405/10, C07D 407/12, C07D 405/04, C07D 491/10, A61P 31/14, C07D 413/12, C07D 409/12
Метки: соединения, гепатита, лечения
Код ссылки
<a href="https://eas.patents.su/30-19185-soedineniya-dlya-lecheniya-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения для лечения гепатита с</a>
Предыдущий патент: Биологически активная добавка к пище
Следующий патент: Соединительный узел и защитное кольцо для него
Случайный патент: Пролекарства возбуждающих аминокислот












