Соединения для лечения гепатита с
Номер патента: 16614
Опубликовано: 30.06.2012
Авторы: Грант-Янг Катарин А., Кадов Джон Ф., Чжэн Сяофань, Хевавасам Пиясена, Худайма Томас В., Ту Юн, Хан Ин, Бендер Джон А., Дин Минь, Еюн Кап-Сун, Джентлс Роберт Г.
Формула / Реферат
1. Соединение формулы I
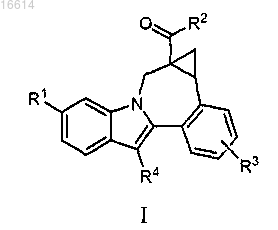
где R1 представляет собой CO2R5 или CONR6R7;
R2 представляет собой
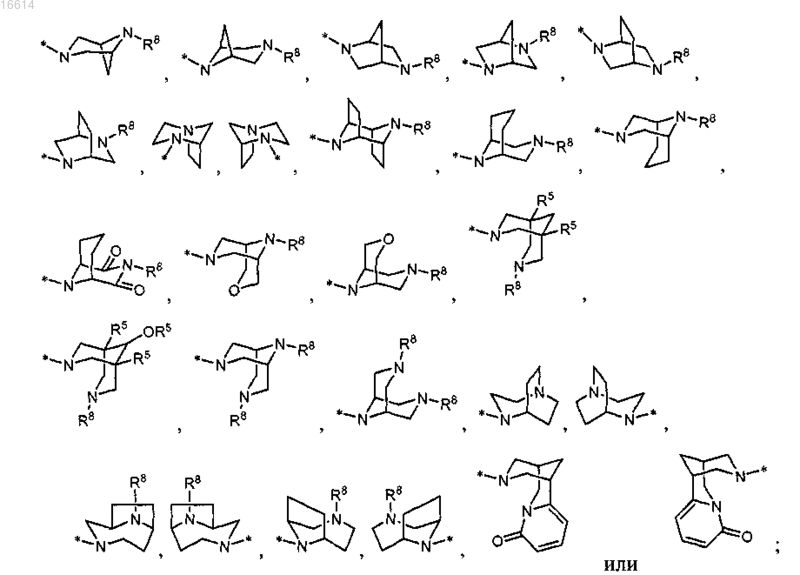
R3 представляет собой водород, галоген, С1-С6алкил, С2-С6алкенил, гидрокси, бензилокси или C1-С6алкокси;
R4 представляет собой С3-С7циклоалкил;
R5 представляет собой водород или С1-С6алкил;
R6 представляет собой водород, С1-С6алкил, C1-C6алкилSO2, C2-C6алкенилSO2, C3-C7циклоалкилSO2, (C3-C7циклоалкил)C1-C6алкилSO2, галогенC1-C6алкилSO2, (R9)(R10)NSO2 или (R11)SO2;
R7 представляет собой водород или C1-C6алкил;
R8 представляет собой водород, C1-C6алкил, C3-C7циклоалкил, (C3-C7циклоалкил)C1-C6алкил, гидроксиC1-C6алкил, C1-C6алкоксиC1-C6алкил, C1-C6алкилкарбонил, C3-C7циклоалкилкарбонил, галогенC1-C6алкилкарбонил, C1-C6алкоксикарбонил, C1-C6алкилSO2, C3-C7циклоалкилSO2, галогенC1-C6алкилSO2, аминокарбонил, (C1-C6алкиламино)карбонил, (диC1-C6алкиламино)карбонил, бензил, бензилоксикарбонил или пиридинил;
R9 представляет собой водород или C1-C6алкил;
R10 представляет собой водород или C1-C6алкил;
R11 представляет собой азетидинил, пирролидинил, пиперидинил, N-(R12)пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил, гомоморфолинил, тетрагидрофуранил, тетрагидропиранил, (тетрагидрофуранил)С1-С6алкил или (тетрагидропиранил)С1-С6алкил и
R12 представляет собой водород или С1-С6алкил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где
R1 представляет собой CO2R5 или CONR6R7;
R2 представляет собой
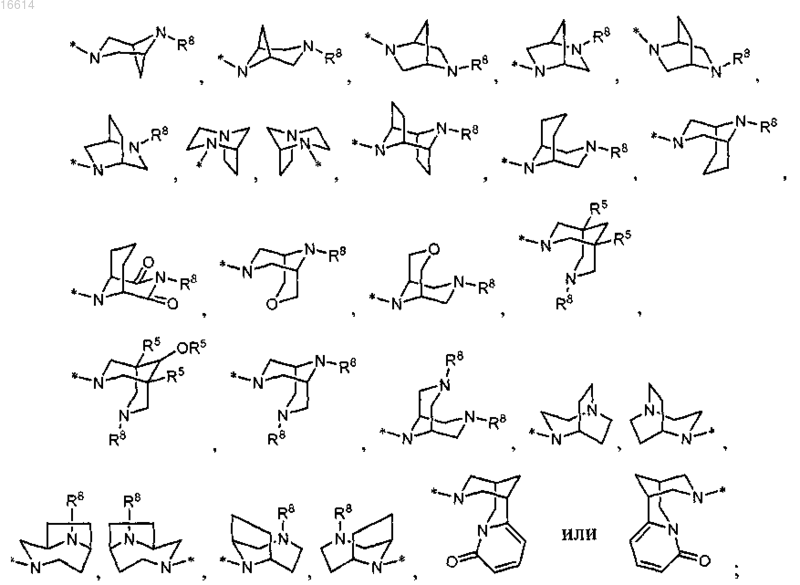
R3 представляет собой водород, галоген, С1-С6алкил, С2-С6алкенил, гидрокси, бензилокси или C1-С6алкокси; R4 представляет собой С3-С7циклоалкил;
R5 представляет собой водород или С1-С6алкил;
R6 представляет собой водород, С1-С6алкил, C1-C6алкилSO2, C2-C6алкенилSO2, C3-C7циклоалкилSO2, (C3-C7циклоалкил)C1-C6алкилSO2, галогенC1-C6алкилSO2, (R9)(R10)NSO2 или (R11)SO2;
R7 представляет собой водород или С1-С6алкил;
R8 представляет собой водород, С1-С6алкил, С3-С7циклоалкил, (С3-С7циклоалкил)С1-С6алкил, C1-С6алкилкарбонил, С3-С7циклоалкилкарбонил, галогенС1-С6алкилкарбонил, С1-С6алкоксикарбонил, C1-C6алкилSO2, C3-C7циклоалкилSO2, галогенC1-C6алкилSO2, аминокарбонил, (C1-C6алкиламино)карбонил, (диС1-С6алкиламино)карбонил, бензил, бензилоксикарбонил или пиридинил;
R9 представляет собой водород или С1-С6алкил;
R10 представляет собой водород или С1-С6алкил;
R11 представляет собой азетидинил, пирролидинил, пиперидинил, N-(R12)пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил, гомоморфолинил, тетрагидрофуранил, тетрагидропиранил, (тетрагидрофуранил)С1-С6алкил или (тетрагидропиранил)С1-С6алкил и
R12 представляет собой водород или С1-С6алкил;
или его фармацевтически приемлемая соль.
3. Соединение по п.1, где
R1 представляет собой CO2R5 или CONR6R7;
R2 представляет собой
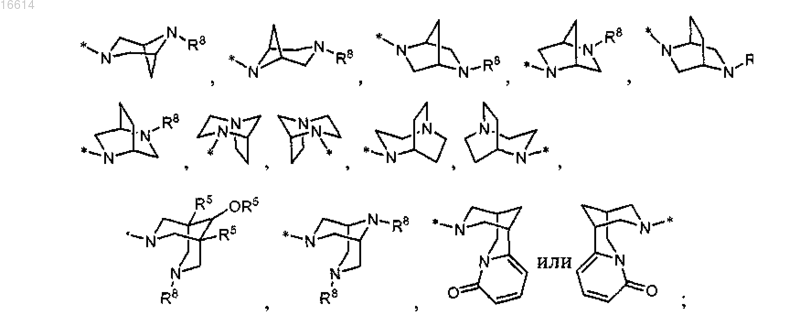
R3 представляет собой водород, галоген, С1-С6алкил, С2-С6алкенил, гидрокси, бензилокси или C1-С6алкокси;
R4 представляет собой С3-С7циклоалкил;
R5 представляет собой водород или С1-С6алкил;
R6 представляет собой водород, С1-С6алкил, C1-C6алкилSO2, C3-C7циклоалкилSO2, галогенC1-С6алкилSO2, (R9)(R10)NSO2 или (R11)SO2;
R7 представляет собой водород или С1-С6алкил;
R8 представляет собой водород, С1-С6алкил, С3-С7циклоалкил, (С3-С7циклоалкил)С1-С6алкил, C1-С6алкилкарбонил, С3-С7циклоалкилкарбонил, галогенС1-С6алкилкарбонил, С1-С6алкоксикарбонил, C1-C6алкилSO2, C3-C7циклоалкилSO2, галогенC1-C6алкилSO2, аминокарбонил, (C1-C6алкиламино)карбонил, (диС1-С6алкиламино)карбонил, бензил, бензилоксикарбонил или пиридинил;
R9 представляет собой водород или С1-С6алкил;
R10 представляет собой водород или С1-С6алкил;
R11 представляет собой азетидинил, пирролидинил, пиперидинил, N-(R12)пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил или гомоморфолинил и
R12 представляет собой водород или С1-С6алкил;
или его фармацевтически приемлемая соль.
4. Соединение по п.1, где R1 представляет собой CONR6R7; R6 представляет собой C1-C6алкилSO2, C3-C7циклоалкилSO2, галогенC1-C6алкилSO2, (R9)2NSO2 или (R10)SO2 и R7 представляет собой водород.
5. Соединение по п.1, где
R2 представляет собой
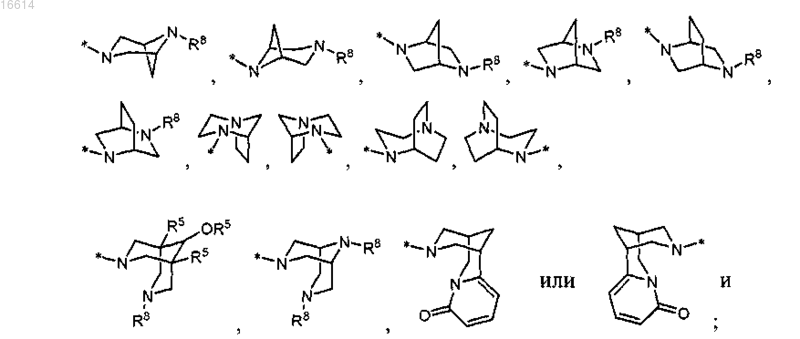
R11 представляет собой азетидинил, пирролидинил, пиперидинил, N-(R12)пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил или гомоморфолинил.
6. Соединение по п.1, где R3 представляет собой водород.
7. Соединение по п.1, где R3 представляет собой метокси.
8. Соединение по п.1, где R4 представляет собой циклогексил.
9. Соединение по п.1, где R6 представляет собой (R9)(R10)NSO2 или (R11)SO2.
10. Соединение по п.1, где R8 представляет собой С1-С6алкил или С1-С6алкоксиС1-С6алкил.
11. Соединение по п.1, выбранное из группы, состоящей из
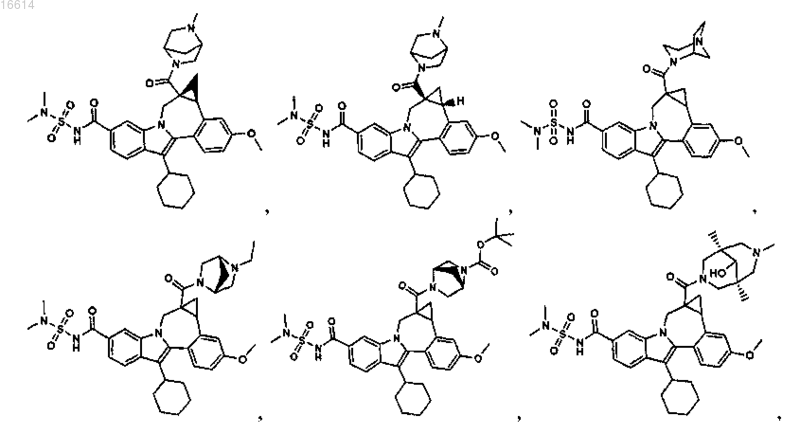
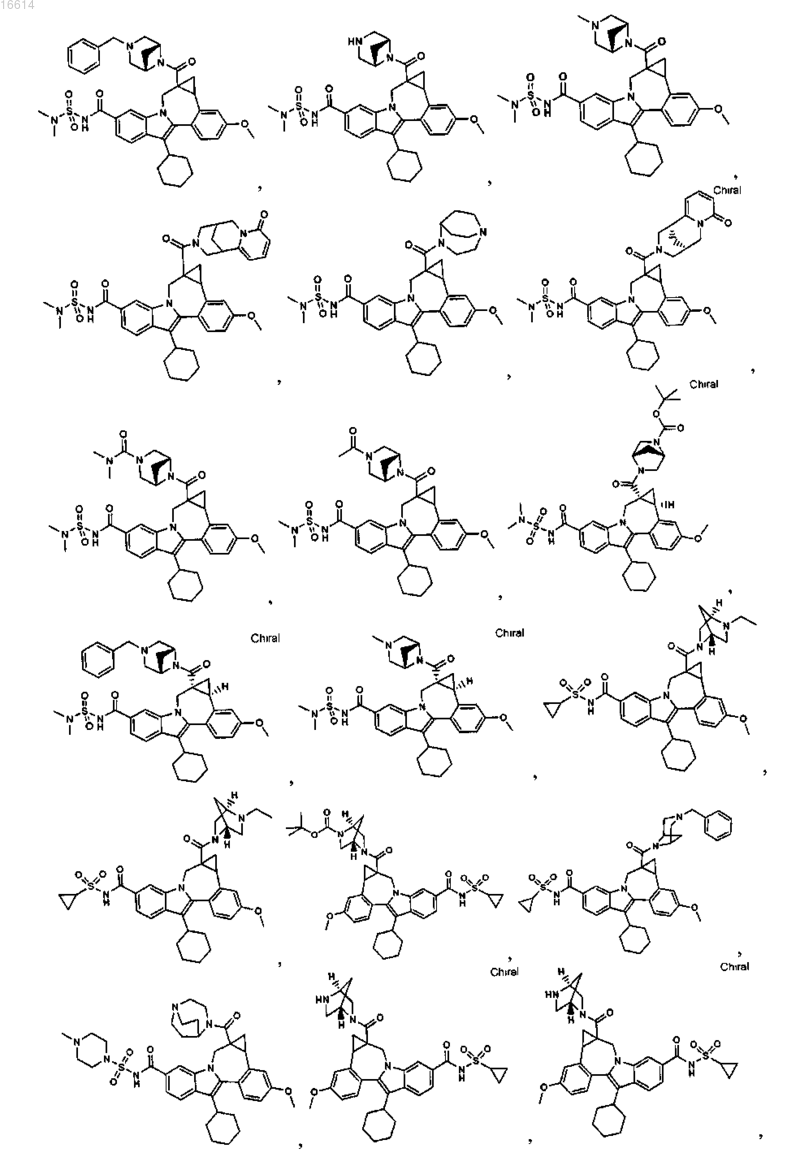
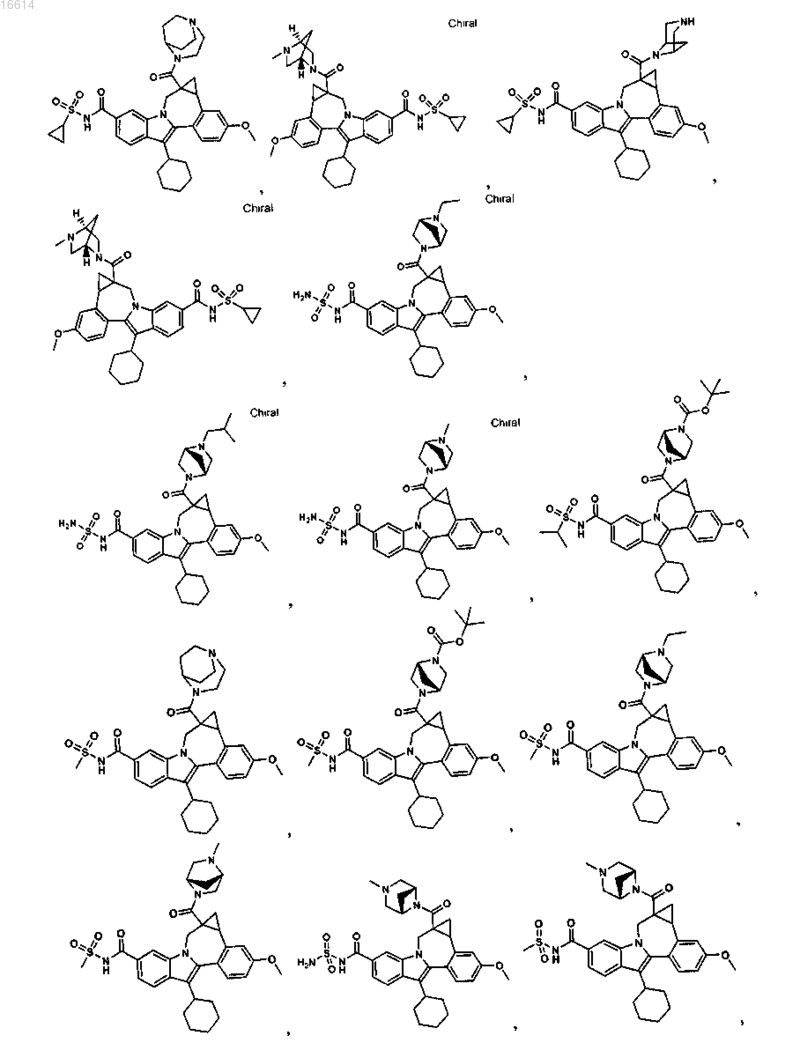
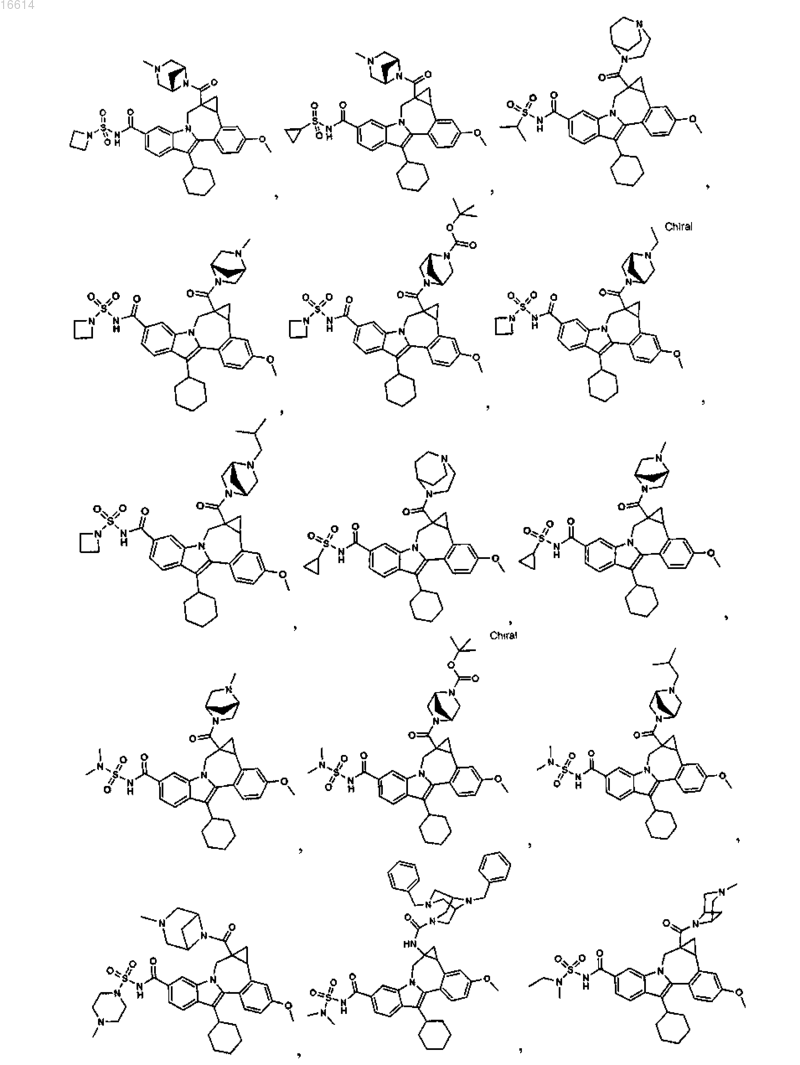
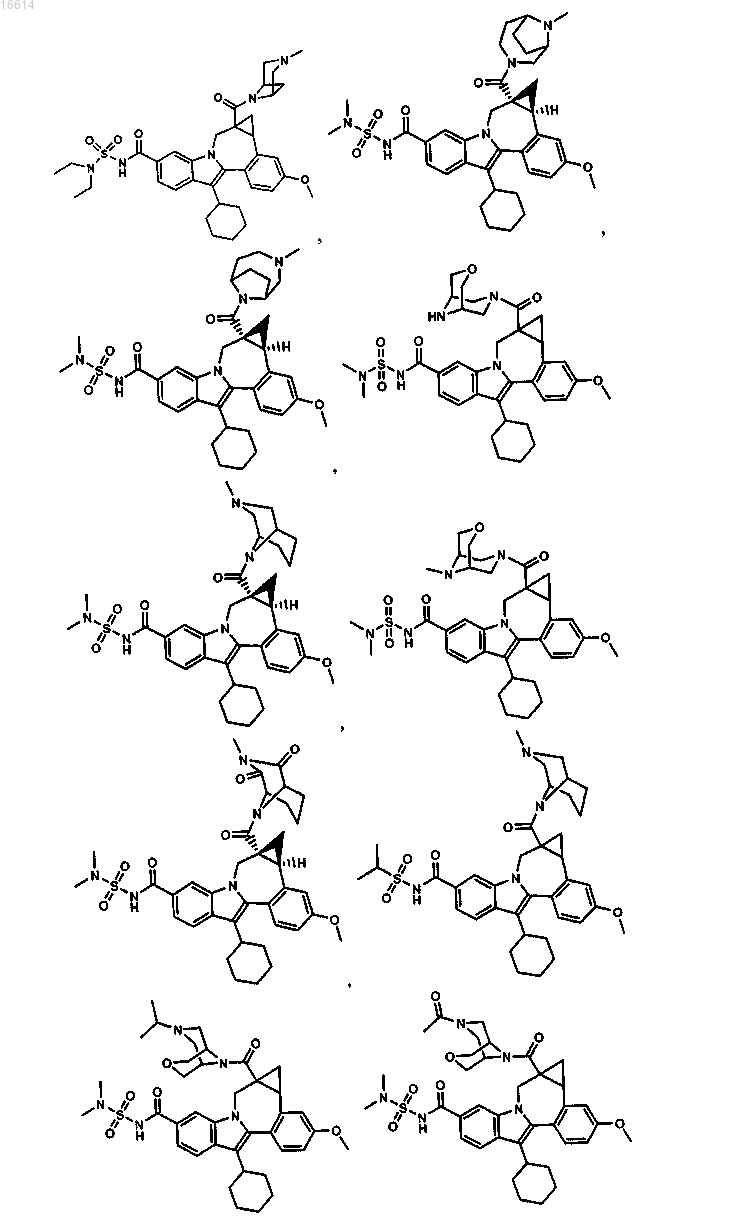
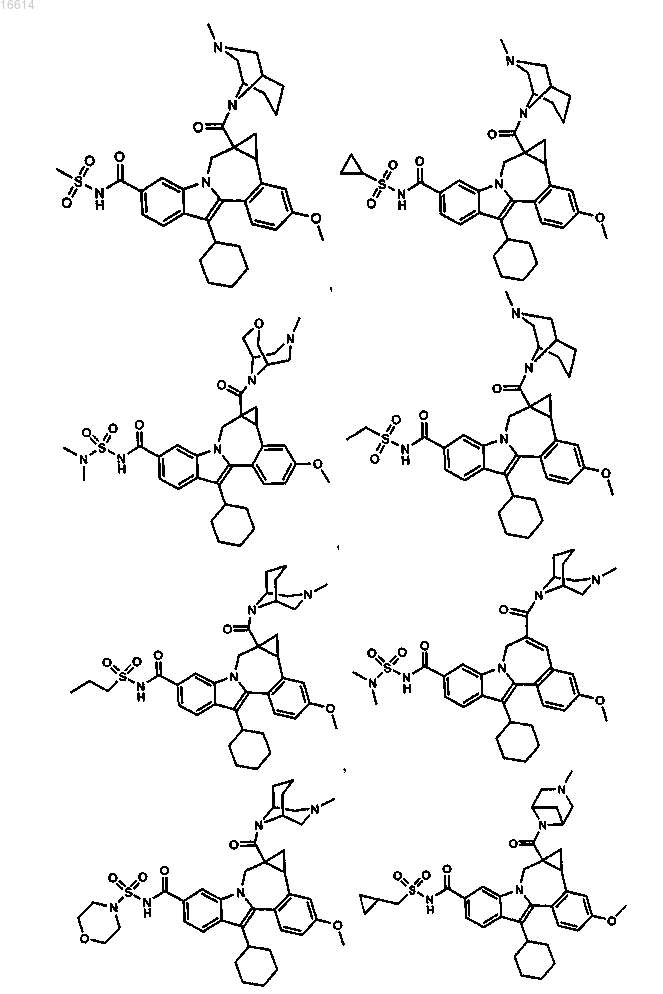
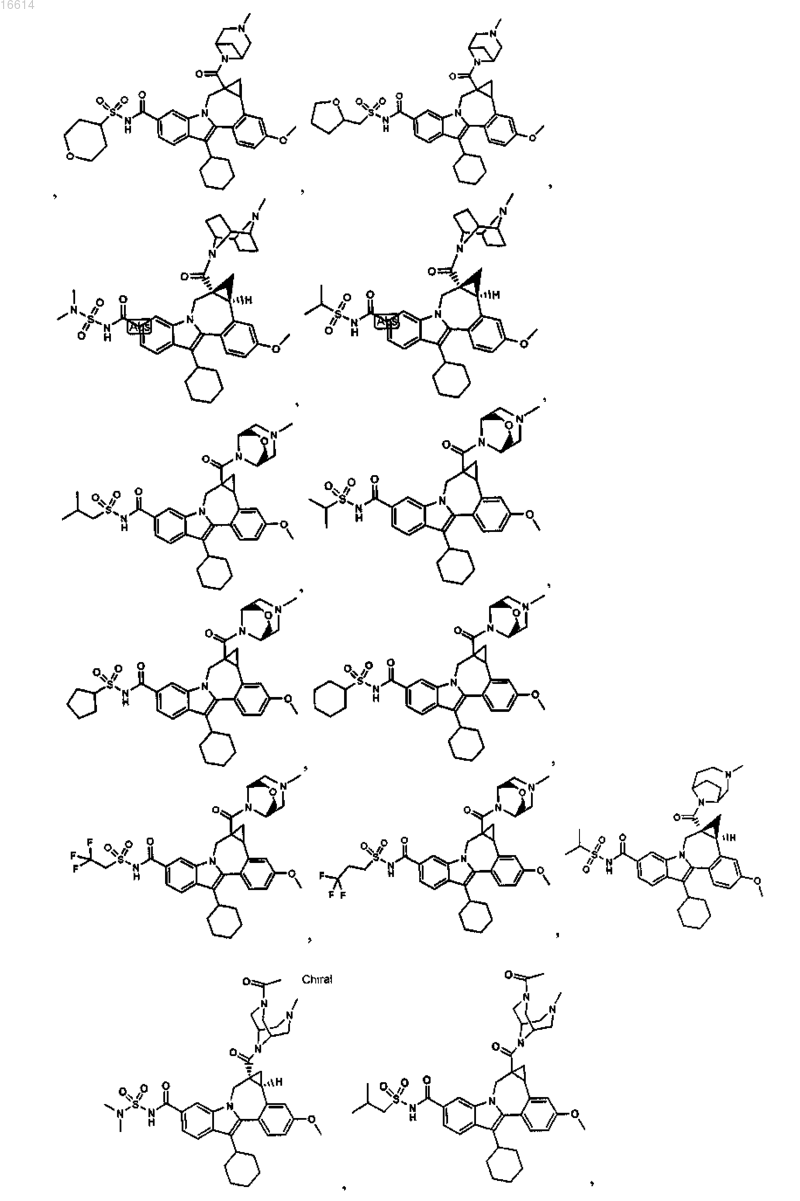
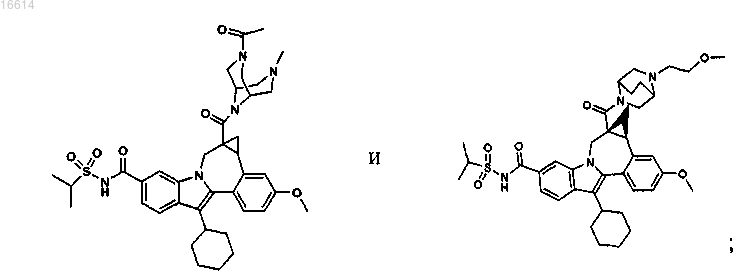
или его фармацевтически приемлемая соль.
12. Фармацевтическая композиция для лечения гепатита C, включающая соединение по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
13. Способ лечения гепатита C, включающий введение пациенту терапевтически эффективного количества соединения по п.1.
14. Способ по п.13, включающий введение по крайней мере одного дополнительного соединения, имеющего терапевтическое действие против HCV инфекции, выбранное из группы, состоящей из интерферонов, циклоспоринов, интерлейкинов, ингибиторов HCV металлопротеазы, ингибиторов HCV сериновой протеазы, ингибиторов HCV полимеразы, ингибиторов HCV хеликазы, ингибиторов HCV NS4B белка, ингибиторов HCV входа, ингибиторов HCV сборки, ингибиторов HCV выхода, ингибиторов HCV NS5A белка, ингибиторов HCV NS5B белка и ингибиторов HCV репликона.
Текст
СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ГЕПАТИТА С Изобретение охватывает соединения формулы I, включая фармацевтически приемлемые соли,так же как композиции и способы использования указанных соединений. Соединения имеют активность против вируса гепатита C (HCV) и являются пригодными при лечении тех инфекций,которые связаны с HCV. 016614 Уровень техники Вирус гепатита C (HCV) является основным патогеном человека, инфицировавшим предположительно 170 млн человек по всему миру - грубо в пять раз больше, чем инфицированных вирусом иммунодефицита человека 1 типа. У значительного числа инфицированных HCV индивидуумов развивается серьезное прогрессирующее заболевание печени, включая цирроз и печеночно-клеточный рак (Lauer,G.M.; Walker, В.D. N. Engl. J. Med. 2001, 345, 41-52).HCV является положительно закрученным РНК вирусом. Основываясь на сравнении вычисленной последовательности аминокислот и значительном сходстве в 5'-нетранслируемой области, HCV классифицируется как отдельный род в семействе Flaviviridae. Все представители семейства Flaviviridae имеют оболочечные вирионы, которые содержат положительно закрученный РНК геном, кодирующий все известные вирус-специфические белки с помощью трансляции единичной непрерывной открытой рамки считывания. Существенная гетерогенность найдена в нуклеотидной и кодированной аминокислотной последовательности по всему геному HCV. По крайней мере есть шесть основных генотипов и более чем 50 подтипов были описаны. Основные генотипы HCV отличаются по распространенности в мире, и клиническое значение генетической гетерогенности HCV остается неясным, несмотря на множество исследований возможного действия генотипов на патогенез и терапию. Геном одноцепочечной РНК HCV составляет приблизительно 9500 нуклеотидов в длину и имеет одну открытую рамку считывания (ORF), кодирующую один большой полипротеин из примерно 3000 аминокислот. В инфицированных клетках этот полипротеин расщепляется по многим сайтам клеточными и вирусными протеазами до получения структурных и неструктурных (NS) белков. В случае HCV генерированное поколение зрелых неструктурных белков (NS2, NS3, NS4A, NS4B, NS5A и NS5B) подвергается воздействию двух вирусных протеаз. Первая из них, как полагают, является металлопротеазой и расщепляет NS2-NS3 связь; вторая является сериновой протеазой, содержащей на N-конце NS3 (также обозначаемая как NS3 протеаза) и опосредует все последующие расщепления ниже по каскаду NS3 как в цис-положении в сайте расщепления NS3-NS4A, так и в транс-положении для остальных сайтов NS4ANS4B, NS4B-NS5A, NS5A-NS5B. NS4A белок, как представляется, выполняет множество функций, действуя как кофактор для NS3 протеазы и возможно способствует расположению в мембране NS3 и других компонентов вирусной репликазы. Образование комплекса NS3 белка и NS4A представляется необходимым для эффективного полибелкового процессинга, повышая протеолитическое расщепление во всех сайтах. Белок NS3 также проявляет активность нуклеозидной трифосфатазы и РНК хеликазы. NS5Band Rice, Clinics in Liver Disease 2003, 7, 211-242. В настоящее время самая эффективная HCV терапия использует комбинацию -интерферона и рибавирина, приводя к поддержанию эффективности у 40% пациентов (Poynard, T. et al., Lancet 1998, 352,1426-1432). Недавние клинические результаты демонстрируют, что управляемый -интерферон превосходит неизменяемый -интерферон как монотерапию (Zeuzem, S. et al., N. Engl. J. Med. 2000, 343, 16661672). Однако даже с экспериментальными терапевтическими режимами, вовлекающими комбинации управляемого -интерферона и рибавирина, у существенной части пациентов нет продолжительного сокращения вирусного бремени. Таким образом, есть очевидная и важная потребность развития эффективной терапии для лечения HCV инфекции. Сущность изобретения Одним из аспектов изобретения является соединение формулы IR5 представляет собой водород или алкил;R7 представляет собой водород или алкил;R9 представляет собой водород или алкил;R10 представляет собой водород или алкил;R12 представляет собой водород или алкил; или его фармацевтически приемлемая соль. Другим аспектом изобретения является соединение формулы I, гдеR5 представляет собой водород или алкил;R7 представляет собой водород или алкил;R9 представляет собой водород или алкил;R10 представляет собой водород или алкил;R12 представляет собой водород или алкил; или его фармацевтически приемлемая соль. Другим аспектом изобретения является соединение формулы I, гдеR5 представляет собой водород или алкил;R7 представляет собой водород или алкил;R9 представляет собой водород или алкил;R10 представляет собой водород или алкил;R11 представляет собой азетидинил, пирролидинил, пиперидинил, N-(R12)пиперазинил, морфолинил, тиоморфолинил, гомопиперидинил или гомоморфолинил иR12 представляет собой водород или алкил. Другим аспектом изобретения является соединение формулы I, гдеR7 представляет собой водород. Другим аспектом изобретения является соединение формулы I, где R3 представляет собой водород. Другим аспектом изобретения является соединение формулы I, где R3 представляет собой метокси. Другим аспектом изобретения является соединение формулы I, где R4 представляет собой циклогексил. Другим аспектом изобретения является соединение формулы I, где R6 представляет собой 9(R )(R10)NSO2 или (R11)SO2. Другим аспектом изобретения является соединение формулы I в соответствии с следующей стереохимией. Другим аспектом изобретения является соединение формулы I в соответствии с следующей стереохимией. Любое значение любого переменного, включая R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11 или R12, может быть использовано независимо от значения любого другого переменного. Если иным образом точно не определено, данные термины имеют следующие значения. Термин "алкил" обозначает прямую или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода. Термин "алкенил" обозначает прямую или разветвленную алкильную группу, содержащую от 2 до 6 атомов углерода, содержащих, по крайней мере, двойную связь. Термин "циклоалкил" обозначает моноциклическую кольцевую систему, содержащую от 3 до 7 атомов углерода. Термины"гидроксиалкил", "алкокси" и другие термины, содержащие замещенный алкильный остаток, включают прямые и разветвленные изомеры, содержащие от 1 до 6 атомов углерода алкильного остатка. Термины"галогеналкил" и "галогеналкокси" включают все галогенированные изомеры от моногалогензамещенного алкила до пергалогензамещенного алкила. Термин "арил" включает карбоциклические и гетероциклические ароматические заместители. Побочные и мультипобочные термины предназначены для пояснения среднему специалисту связанных зависимостей. Например, термин, такой как R)алкил), обозначает алкильный заместитель, дополнительно замещенный заместителем R. Изобретение включает все фармацевтически приемлемые формы солей соединений. Фармацевтически приемлемыми солями являются те, в которых противоположные ионы не делают значительного вклада в физиологическую активность или токсичность соединений и, по существу, функционируют как фармакологические эквиваленты. Такие соли могут быть получены в соответствии с общими методиками органической химии, применяя коммерчески доступные реагенты. Некоторые анионные формы солей включают ацетат, ацистрат, безилат, бромид, хлорид, цитрат, фумарат, глюкоуронат, гидробромид, гидрохлорид, гидроиодид, иодид, лактат, малеат, мезилат, нитрат, памоат, фосфат, сукцинат, сульфат, тартрат, тозилат и хинофоат. Некоторые канионные формы солей включают аммоний, алюминий, бензатин,висмут, кальций, холин, диэтиламин, диэтаноламин, литий, магний, меглумин, 4-фенилциклогексиламин,пиперазин, калий, натрий, трометамин и цинк. Некоторые из соединений по изобретению имеют асимметричные атомы углерода (см., например,соединения, представленные ниже). Изобретение включает все стереомерные формы, включая энантио-4 016614 меры и диастереоизомеры, так же как смеси стереоизомеров, таких как рацематы. Некоторые стереоизомеры могут быть получены, используя способы, известные среднему специалисту. Стереомерные смеси соединений и связанных промежуточных соединений могут быть разделены на индивидуальные изомеры в соответствии с общими способами, известными среднему специалисту. Способы синтеза. Соединения могут быть получены с помощью способов, известных среднему специалисту, включая те, которые описаны ниже. Некоторые реагенты и промежуточные соединения известны среднему специалисту. Другие реагенты и промежуточные соединения могут быть получены с помощью способов,известных среднему специалисту, используя легко доступные продукты. Радикалы (например, нумерованные "R" заместители), используемые для описания синтеза соединений, предназначены только для демонстрации получения и не должны быть смешаны с переменными, используемыми в формуле изобретения или в других разделах описания. Сокращения, используемые на схемах, в целом следуют правилам, используемым в технологии. Метил-2-бром-3-циклогексил-1H-индол-6-карбоксилат может быть гидролизован до 2-бром-3 циклогексил-1H-индол-6-карбоновой кислоты (см. схему 1). Указанное соединение может быть конденсировано с различными сульфонилмочевинами, используя, например, 1,1'-карбонилдиимидазол в комбинации с 1,8-диазабицикло[5.4.0]ундек-7-еном в безводном ТГФ. Полученные ацилсульфамиды могут быть подвергнуты известным реакциям связывания с разнообразными 2-формилбороновыми кислотами или сложными эфирами, используя, например, условия связывания по Сузуки, чтобы обеспечить циклические гемиаминальные промежуточные соединения описанного типа. Указанные соединения могут быть превращены в индолбензазепиновые производные путем обработки метил-2(диметоксифосфорил)акрилатом при воздействии карбоната цезия в ДМФА через консекутивные реакции Михаэля и Хорнер Эммонса. Родственные конденсированные циклопропильные эфирные производные могут быть получены с помощью способов, известных в технологии, включая обработку индолбензазепиновых сложных эфиров иодидом триметилсульфоксиния в строго основных условиях в DMSO. Оставшийся эфирный алифатический остаток в полученных конденсированных циклопропанах может быть гидролизован и кислотные продукты могут быть конденсированы с различными алкил-мостиковыми диаминами. Например, тетрафторборат O-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония и диизопропилэтиламин в DMSO могут дать алкил-мостиковые диаминкарбоксамиды.N-защищенные диамины, например, где W представляет собой защищенный диамин, могут также быть связаными с промежуточными индолбензазепиновыми кислотами, и с полученных диаминкарбоксамидов может быть снята защита, используя способы, известные среднему специалисту, и получены производные, используя различные методики синтеза, некоторые из иллюстративных примеров которых показаны ниже (см. схему 2). Промежуточное соединение, пригодное для синтеза некоторых соединений по изобретению, включает получение трет-бутилового эфира индолбензазепина и представлено на схеме 3. Схема 3 Данная методика включает гидролиз индолметилового эфира в присутствии основания как катализатора с последующей реакцией или с тионилхлоридом и третичным бутоксидом калия, или алкилирова-7 016614 ние с помощью карбоната серебра и третичных бутилбромидов. Полученное соединение может быть преобразовано, используя химические аналогии, которые были ранее описаны, чтобы обеспечить смешанный эфир индолбензазепинов, представленных выше. Указанные промежуточные соединения являются пригодными в альтернативной методике, которая может быть применена для получения ацилсульфамида и ацилсульфонамидных алкил-мостиковых диаминов, как представлено на схеме 4. Циклопропаннирование промежуточного трет-бутилового эфира индолбензазепина и последующее отщепление трет-бутиловой эфирной группы может привести к получению кислоты, которая может быть связана с разнообразными сульфонамидами и сульфонилмочевинами. Последующий гидролиз дает соответствующую алифатическую кислоту, которая может быть связана с разнообразными алкил-мостиковыми диаминами. Например, тетрафторборат O-(1 Н-бензотриазол-1 ил)-N,N,N',N'-тетраметилурония и диизопропилэтиламин в DMSO могут дать алкил-мостиковые диаминкарбоксамиды. Схема 4 Реакции, представленные на схеме 4, могут быть осуществлены в альтернативном порядке, чтобы обеспечить аналогичные продукты. Схемы 4a и 4b демонстрируют две альтернативы. Кроме того, диамин с двумя вторичными аминами может быть применен в любых представленных местах на схемах, где приведено связывание с кислотой на кольце, содержащем семь членов, и свободный NH подвергают функционизации до завершения оставшихся стадий на схеме. Схема 4a Некоторые соединения по примерам существуют в виде стереомерных смесей. Изобретение охватывает все стереоизомеры соединений. Способы фракционирования стереоизомерных смесей хорошо известны среднему специалисту и включают, но без ограничения, препаративную хиральную хроматографию со сверхкритической подвижной фазой (SFC) и хиральную высокоэффективную жидкостную хроматографию (HPLC). Пример использования указанного подхода представлен на схеме 5. Схема 5 Дополнительный способ выполнения таких разделений включает получение смесей диастереоизомеров, которые могут быть разделены, используя различные способы, известные в технологии. Один из примеров указанного подхода показан ниже (схема 6). Некоторые диастереоизомерные амиды могут быть разделены, используя HPLC с обращенной фазой. После гидролиза полученные оптически активные кислоты могут быть связаны с мостиковыми диаминовыми производными (схема 7). Например, тетрафторборат O-(1H-бензотриазол-1-ил)-N,N,N',N'тетраметилурония и диизопропилэтиламин в DMSO могут быть использованы для получения алкилмостиковых карбоксамидов. Другие обычные способы аминового связывания кислоты могут также быть использованы, чтобы получить оптически активные карбоксамиды. Схема 7 Соединения продемонстрировали активность в отношении HCV NS5B, что было определено в следующих HCV RdRp исследованиях. Клонирование, экспрессия и очистка HCVNS5B RdRp. кДНК, кодирующая NS5B белок HCV, генотип 1b, клонирована в векторе экспрессии pET21a. Белок экспрессирован с укорочением на 18 аминокислот с С-конца для повышения растворимости. E. coli компетентная линия клеток BL21(DE3) используется для экспрессии белка. Культуры выращивают при 37C в течение примерно 4 ч до того, как культуры достигают оптической плотности 2,0 при 600 нм. Культуры охлаждают до 20C и индуцируют 1 мМ IPTG. Свежий ампициллин добавляют до конечной концентрации 50 мкг/мл и клетки выращивают в течение ночи при 20C. Клеточный дебрис (3L) лизируют для очистки так, чтобы получить 15-24 мг очищенного NS5B. Литический буфер состоит из 20 мМ Tris-HCl, pH 7,4, 500 мМ NaCl, 0,5% тритон X-100, 1 мМ DTT, 1 мМEDTA, 20% глицерин, 0,5 мг/мл лизоцима, 10 мМ MgCl2, 15 мкг/мл дезоксирибонуклеазы I и таблетки ингибитора протеаз Complete TM (Roche). После добавления литического буфера замороженный клеточный дебрис ресуспендируют, используя гомогенизатор тканей. Для уменьшения вязкости образца, аликвоты лизата разрушают ультразвуком на льду, используя микронаконечник, прикрепленный к ультразвуковому аппарату Branson. Разрушенный ультразвуком лизат центрифугируют при 100,000 g в течение 1 ч при 4C и фильтруют через 0,2 мкм фильтр (Corning). Белок очищают, используя два последовательных этапа хроматографии: гепарин сефароза CL-6B,поли-U сефароза 4B (Pharmacia). Хроматографические буферы были идентичны литическому буферу, но не содержали лизоцима, дезоксирибонуклеазы I, MgCl2 или ингибитор протеаз и концентрация NaCl в- 10016614 буфере была откорректирована в соответствии с потребностью загрузки белка в колонку. Каждая колонка была элюирована с градиентом NaCl, который варьировал по длине от 5 до 50 объемов колонки в зависимости от типа колонки. После заключительного этапа хроматографии итоговая чистота фермента составляет более 90%, по данным SDS-PAGE анализа. Фермент аликвотируют и хранят при -80C. Стандартное исследование фермента HCVNS5B RdRp. Исследования HCV RdRp генотипа 1b проводят в конечном объеме 60 мкл в 96-луночных планшетах (Corning 3600). Буфер исследования состоит из 20 мМ Hepes, pH 7,5, 2,5 мМ KCl, 2.5 мМ MgCl2, 1 мМ DTT, 1,6 U ингибитора РНКазы (PromegaN2515), 0,01 мг/мл BSA (Sigma B6917) и 2% глицерина. Все соединения последовательно разводят (3-кратно) в ДМСО и разводят далее в воде так, что конечная концентрация ДМСО в исследовании составляет 2%. Фермент HCV RdRp генотипа 1b используют в конечной концентрации 28 нМ. Шаблон поли-A используют при 6 нМ и биотинилированный праймер олигоdT12 используют при конечной концентрации 180 нМ. Шаблон приобретают (Amersham 27-4110). Биотинилированный праймер изготовляет Sigma Genosys. 3H-UTP используют при 0,6 мкКи (0,29 мкМ общей UTP). Реакции запускают путем добавления фермента, инкубируют при 30C в течение 60 мин и останавливают путем добавления 25 мкл 50 мМ EDTA, содержащей SPA гранулы (4 мкг/мкл, AmershamRPNQ 0007). Планшеты считывают с помощью Packard Top Count NXT после инкубации при комнатной температуре более 1 ч. Модифицированное исследование фермента HCVNS5B RdRp. Модифицированное исследование фермента выполняют преимущественно, как это описано для стандартного исследования фермента за исключением следующего: биотинилированный олиго dT12 праймер предварительно захватывается на покрытые стрептавидином SPA гранулы путем смешивания праймера и гранул в буфере исследования и инкубирования при комнатной температуре в течение одного часа. Несвязанный праймер удаляют после центрифугирования. Связанные с праймером гранулы ресуспендируют в 20 мМ HEPES буфере, pH 7,5 и используют в исследовании в конечной концентрации праймера 20 нМ и гранул 0,67 мкг/мкл. Порядок добавления реактивов в исследовании: фермент (1,75 нМ) добавляют к разбавленному соединению, после чего добавляют смесь шаблона (0,36 нМ), 3H-UTP(0,6 мкКи, 0,29 мкМ) и связанные с праймером гранулы, чтобы запустить реакцию; приведенные концентрации являются конечными. Реакции проводят в течение 4 ч при 30C. Значения IC50 для соединений определяют, используя семь разных [I]. Значения IC50 подсчитывают исходя из ингибирования, используя формулуy = A+B-A)/(1+C/x)D. Подготовка исследования FRET. Скрининговое HCV FRET исследование проводят в 96-луночных планшетах с клеточными культурами. Пептид FRET (Anaspec, Inc.) (Taliani et al., Anal. Biochem. 1996, 240, 60-67) содержит флуоресцентный донор EDANS рядом с одним концом пептида и акцептор DABCYL рядом с другим концом. Флуоресценцию пептида гасят с помощью межмолекулярного резонансного переноса энергии (RET) между донором и акцептором, и по мере того, как NS3 протеаза расщепляет пептид, продукты высвобождаются из RET гашения и флуоресценция донора становится заметной. Реактив исследования получают следующим образом: 5X литический реактив люциферазы клеточной культуры от Promega (E153A) разбавляют до 1X dH2O, добавляют NaCl до конечной концентрации 150 мМ, FRET пептид разбавляют до конечной концентрации 20 мкМ из 2 мМ исходного раствора. Для приготовления планшетов клетки с HCV репликоном с или без репортерного гена люциферазыRenilla трипсинизируют и помещают в каждую лунку 96-луночного планшета с титрованными тестируемыми соединениями, добавленными в колонки с 3 по 12; колонки 1 и 2 содержат контрольное соединение (ингибитор HCV протеазы), нижний ряд содержит клетки без соединения. Планшеты затем помещают в CO2 инкубатор при 37C. Исследования. После добавления тестируемых соединений, описанных выше (подготовка исследования FRET), в различное время планшеты удаляют и раствор Alamar синий (Trek Diagnostics, 00-100) добавляют в каждую лунку для измерения клеточной токсичности. После считывания в приборе Cytoflour 4000 (PE Biosystems), планшеты отмывают PBS и затем используют для FRET исследования путем добавления 30 мкл реактива исследования FRET пептида, описанного выше (подготовка исследования FRET), в каждую лунку. Затем планшет помещают в прибор Cytoflour 4000, который устанавливают на 340 возбуждение/490 эмиссия, автоматический режим на 20 циклов и планшет считывают в кинетическом режиме. Обычно отношение сигнал/шум при использовании анализа конечных точек после считывания составляет по меньшей мере три. Альтернативно, после считывания Alamar синего, планшеты отмывают PBS,затем используют для исследования люциферазы, применяя систему исследования люциферазы PromegaDual-Glo Luciferase Assay System или Promega EnduRen Live Cell Substrate. Анализ соединения проводят путем количественного определения значений относительного ингибирования HCV репликона и относительной цитотоксичности. Для расчета уровней цитотоксичности среднее значение флуоресцентных сигналов Alamar синего из контрольных лунок принимают за 100%- 11016614 нетоксичное. Отдельные сигналы в каждой из лунок с тестируемым соединением затем делят на средний контрольный сигнал и умножают на 100% для определения процента цитотоксичности. Для подсчета значений ингибирования HCV репликона средний фоновый уровень получают из двух лунок, содержащих наибольшее количество контрольного ингибитора HCV в конце периода исследования. Эти числа были схожими с теми, что получены в интактных клетках Huh-7. Фоновые числа затем вычитают из среднего сигнала, полученного в контрольных лунках, и это число используют как 100% активность. Конкретные сигналы в каждой из лунок с тестируемым соединением, затем делят на средние контрольные значения после вычитания фона и умножают на 100%, чтобы определить процент активности. Значения EC50 для титрования ингибитора протеазы подсчитывают, как концентрацию, которая вызывает 50% снижение FRET или люциферазной активности. Два числа, полученные для планшета с соединением, процент цитотоксичности и процент активности используют для определения соединений, представляющих интерес для дальнейшего анализа. Репрезентативные данные для соединений приведены в табл. 1. Таблица 1A 0,5 мкМ; B 0,0024-0,5 мкМ; C 0,02 мкМ, но точное значение не определено; D 0,04 мкМ, но точное значение не определено; E 0,07 мкМ, но точное значение не определено; G 0,5 мкМ до 5,0 мкМ; H 1,0 мкМ, но точное значение не определено. Фармацевтические композиции и способы лечения Соединения демонстрируют активность в отношении HCV NS5B и могут быть полезными в лечении HCV и HCV инфекции. Следовательно, другой аспект изобретения является композицией, содержащей соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Другой аспект изобретения является композицией, которая дополнительно содержит соединение,обладающее анти-HCV активностью. Другой аспект изобретения является композицией, где соединение, обладающее анти-HCV активностью, является интерфероном. В другом аспекте изобретения интерферон выбран из интерферона 2B,пегилированного интерферона , консенсусного интерферона, интерферона 2A и лимфобластоидного интерферона . Другой аспект изобретения является композицией, где соединение, обладающее анти-HCV активностью, является циклоспорином. В другом аспекте изобретения циклоспорин является циклоспорином A. Другой аспект изобретения является композицией, где соединение, обладающее анти-HCV активностью, выбрано из группы, состоящей из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, которое усиливает развитие ответа T-хелперов 1 типа, интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина, ингибитора инозина 5'-монофосфат дегидрогеназы, амантадина и римантадина. Другой аспект изобретения является композицией, где соединение, обладающее анти-HCV активностью, эффективно ингибирует функцию мишени, выбранной из следующих: HCV металлопротеаза,HCV сериновая протеаза, HCV полимераза, HCV хеликаза, HCV NS4B белок, вход HCV, сборка HCV,выход HCV, HCV NS5A белок, IMPDH и нуклеозидный аналог, для лечения HCV инфекции. Другой аспект изобретения является композицией, содержащей соединение или его фармацевтически приемлемую соль, фармацевтически приемлемый носитель, интерферон и рибавирин. Другой аспект изобретения является способом ингибирования функции HCV репликона, включающий контактирование HCV репликона с соединением или его фармацевтически приемлемой солью. Другой аспект изобретения является способом ингибирования функции HCV NS5B белка, включающий контактирование HCV NS5B белка с соединением или его фармацевтически приемлемой солью. Другой аспект изобретения является способом лечения HCV инфекции у пациента, включающий- 25016614 введение этому пациенту терапевтически эффективного количества соединения или его фармацевтически приемлемой соли. В другом воплощении это соединение эффективно ингибирует функцию HCV репликона. В другом воплощении это соединение эффективно ингибирует функцию HCV NS5B белка. Другой аспект изобретения является способом лечения HCV инфекции у пациента, включающий введение этому пациенту терапевтически эффективного количества соединения или его фармацевтически приемлемой соли в сочетании (перед, после или одновременно) с другим соединением, обладающим анти-HCV активностью. Другой аспект изобретения является способом, в котором другое соединение, обладающее антиHCV активностью, является интерфероном. Другой аспект изобретения является способом, в котором интерферон выбран из интерферона 2B,пегилированного интерферона , консенсусного интерферона, интерферона 2A и лимфобластоидного интерферона . Другой аспект изобретения является способом, в котором другое соединение, обладающее антиHCV активностью, является циклоспорином. Другой аспект изобретения является способом, в котором циклоспорин является циклоспорином А. Другой аспект изобретения является способом, в котором другое соединение, обладающее антиHCV активностью, является выбранным из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, которое усиливает развитие ответа T-хелперов 1 типа, интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина, ингибитора инозина 5'-монофосфат дегидрогеназы, амантадина и римантадина. Другой аспект изобретения является способом, в котором другое соединение, обладающее антиHCV активностью, эффективно ингибирует функцию мишени, выбранной из следующих: HCV металлопротеаза, HCV сериновая протеаза, HCV полимераза, HCV хеликаза, HCV NS4B белок, вход HCV, сборка HCV, выход HCV, HCV NS5A белок, IMPDH и нуклеозидный аналог, для лечения HCV инфекции. Другой аспект изобретения является способом, в котором другое соединение, обладающее антиHCV активностью эффективно ингибирует функцию мишени в жизненном цикле HCV, другую нежели белок HCV NS5B."Терапевтически эффективный" означает количество агента, требуемого для обеспечения убедительной пользы для пациента в понимании врачей, лечащих гепатит и HCV инфекцию."Пациент" означает человека, инфицированного вирусом HCV и подходящего для терапии в понимании врачей, лечащих гепатит и HCV инфекцию."Лечение", "терапия", "режим", "HCV инфекция" и сходные термины используются в значениях,принятых врачами, которые лечат гепатит и HCV инфекцию. Соединения данного изобретения, как правило, вводятся в виде фармацевтических композиций, содержащих терапевтически эффективное количество соединения или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя и могут содержать традиционные наполнители. Терапевтически эффективным является количество, которое необходимо для обеспечения существенной пользы для пациента. Фармацевтически приемлемыми носителями являются такие традиционно известные носители, обладающие приемлемыми профилями безопасности. Композиции охватывают все обычные твердые и жидкие формы, включая капсулы, таблетки, пастилки и порошки, так же как и жидкие суспензии,сиропы, эликсиры и растворы. Композиции получают, используя обычные методики приготовления и традиционные наполнители (такие как связывающие и смачивающие агенты) и носители (такие как вода и спирты) обычно применяются в композициях. Твердые композиции, как правило, готовят в дозированных формах и композиции, содержащие от около 1 до 1000 мг активного ингредиента на дозу, являются предпочтительными. Некоторыми примерами доз являются 1, 10, 100, 250, 500 и 1000 мг. Обычно другие агенты будут представлены в единице дозирования в диапазоне, сходном с агентами того класса, который применяется клинически. Обычно это 0,25-1000 мг/единицу. Жидкие композиции обычно представлены в дозированных лекарственных формах. Как правило,жидкая композиция будет в диапазоне дозированных лекарственных форм 1-100 мг/мл. Некоторыми примерами дозировок являются 1, 10, 25, 50 и 100 мг/мл. Как правило, другие агенты будут представлены в единице дозирования в диапазоне, сходном с агентами того класса, который применяется клинически. Обычно это составляет 1-100 мг/мл. Это изобретение охватывает все традиционные способы введения; пероральный и парентеральный способы являются предпочтительными. Обычно режим дозирования будет сходным с другими агентами,применяемыми клинически. Как правило, суточная доза будет 1-100 мг/кг массы тела ежедневно. Обычно больше соединения требуется при пероральном приеме и меньше при парентеральном. Конкретный режим дозирования, тем не менее, будет определен лечащим врачом с использованием обоснованного медицинского суждения. Это изобретение также охватывает способы, в которых соединение вводится в комбинированной терапии. Это означает, что соединение может быть использовано в сочетании, но отдельно от других- 26016614 агентов, применяемых в лечении гепатита и HCV инфекции. В этих комбинированных способах соединение будет обычно вводиться в суточной дозе 1-100 мг/кг массы тела ежедневно в сочетании с другими агентами. Другие агенты обычно будут вводиться в количествах, используемых терапевтически. Конкретный режим дозирования, тем не менее, будет определен лечащим врачом с использованием обоснованного медицинского суждения. Некоторые примеры соединений, подходящих для композиций и способов, перечислены в табл. 2. Таблица 2
МПК / Метки
МПК: A61P 31/12, C07D 487/04, A61K 31/55
Метки: лечения, гепатита, соединения
Код ссылки
<a href="https://eas.patents.su/30-16614-soedineniya-dlya-lecheniya-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения для лечения гепатита с</a>
Предыдущий патент: Селективные модуляторы рецепторов эстрогена для лечения вазомоторных симптомов
Следующий патент: Способ получения n-замещенных (3-дигалометил-1-метилпиразол-4-ил)карбоксамидов
Случайный патент: Несущий узел