Замещенные производные 2,3-дигидроимидазо[1,2-c]хиназолина, полезные для лечения гиперпролиферативных нарушений и болезней, связанных с ангиогенезом
Номер патента: 18839
Опубликовано: 29.11.2013
Авторы: Вуд Джайли, Михельс Мартин, Роули Р.Брюс, Скотт Уилльям, Редман Анико, Хентеманн Мартин, Кампбелл Анн-Мари, Баллион Анн-Мари
Формула / Реферат
1. Соединение, имеющее формулу
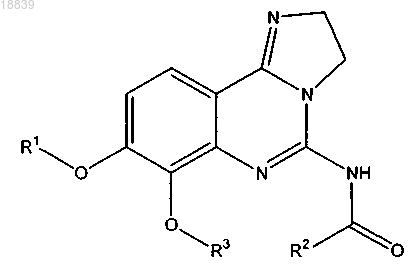
или его физиологически приемлемая соль, сольват, гидрат или стереоизомер, в которой
R1 - (CH2)n-(CHR4)-(CH2)m-N(R5)(R5');
R2 - 5-6-членный гетероарил, содержащий 1 или 2 гетероатома, выбранных из N, О и S, необязательно замещенный 1, 2 или 3 группами R6;
R3 - С1-С8-алкил или С3-С12-циклоалкил;
R4 - водород, гидрокси и R5 и R5' могут быть одинаковыми или различными и представляют собой независимо друг от друга водород, C1-С8-алкил, С3-С8-циклоалкил-С1-С8-алкил, или R5 и R5' могут быть взяты вместе с атомом азота, с которым они связаны, для образования 3-7-членного азотсодержащего гетероциклического кольца, необязательно содержащего по крайней мере один дополнительный гетероатом, выбранный из кислорода, азота или серы, и которое может быть необязательно замещено 1 или несколькими R6' группами, или R4 и R5 могут вместе с атомами, с которыми они связаны, образовать 5-6-членное азотсодержащее гетероциклическое кольцо, необязательно содержащее 1 или несколько атомов азота, кислорода или серы, и которое может быть необязательно замещено 1 или несколькими R6' группами;
R6 может быть одинаковым или различным и представляет собой независимо галоген, С1-С8-алкил, С3-С8-циклоалкил, С3-С8-циклоалкил-С1-С8-алкил, 5-членный гетероарил, содержащий 1 атом N в качестве гетероатома, гетероарил-С1-С8-алкил, насыщенное 5-6-членное гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранных из N и О, гетероциклил-С1-С8-алкил, С1-С8-алкил-OR7, -OR7, -SR7, -N(R7)(R7') или -NR7COR7, каждый из которых может быть необязательно замещен 1 или несколькими группами R8;
R6' может быть одинаковым или различным и представляет собой независимо С1-С8-алкил, С3-С8-циклоалкил-С1-С8-алкил или C1-C8-алкил-OR7;
R7 и R7' могут быть одинаковыми или различными и представляют собой независимо водород, С1-С8-алкил, С3-С8-циклоалкил, С3-С8-циклоалкил-С1-С8-алкил, арил, арил-С1-С8-алкил, 5-членный гетероарил, содержащий 1 атом N в качестве гетероатома, 5-6-членное гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранных из N и О, гетероциклил-С1-С8-алкил или гетероарил-С1-С8-алкил;
R8 представляет собой независимо гидрокси, галоген, амино, С1-С8-алкил, С1-С8-алкокси;
n - целое число от 1 до 4 и
m является целым числом от 0 до 4 с условием, что, когда R4 и R5 вместе с атомами, с которыми они связаны, образовывают 3-7-членное азотсодержащее кольцо, n+m ≤ 4.
2. Соединение по п.1, в котором R2 - азотсодержащий гетероарил, необязательно замещенный 1, 2 или 3 группами R6.
3. Соединение по п.1, в котором R5 и R5' представляют собой независимо С1-С8-алкил.
4. Соединение по п.1, в котором R5 и R5' вместе с атомом азота, с которым они связаны, образуют 5-6-членное азотсодержащее гетероциклическое кольцо, содержащее по крайней мере один дополнительный гетероатом, выбранный из кислорода, азота или серы, и которое может быть необязательно замещено 1 или несколькими R6' группами.
5. Соединение по п.1, в котором R4 представляет собой гидроксигруппу.
6. Соединение по п.1, в котором R4 и R5 вместе с атомами, с которыми они связаны, могут образовать 5-6-членное азотсодержащее гетероциклическое кольцо, необязательно содержащее 1 или несколько атомов азота, кислорода или серы, и которое может быть необязательно замещено 1 или несколькими группами R6'.
7. Соединение по п.1, в котором R3 представляет собой метил.
8. Соединение по п.1, в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол, тиазол, фуран или тиофен, необязательно замещенный 1, 2 или 3 группами R6.
9. Соединение по п.2, в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол или тиазол, необязательно замещенный 1, 2 или 3 группами R6.
10. Соединение по п.1, имеющее формулу

11. Соединение по п.10, в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол, тиазол, фуран или тиофен, необязательно замещенный 1, 2 или 3 группами R6.
12. Соединение по п.11, в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол или тиазол, необязательно замещенный 1, 2 или 3 группами R6.
13. Соединение по п.1, имеющее формулу
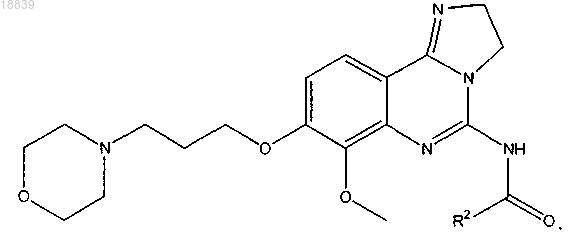
14. Соединение по п.13, в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол, тиазол, фуран или тиофен, необязательно замещенный 1, 2 или 3 группами R6.
15. Соединение по п.14, в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол или тиазол, необязательно замещенный 1, 2 или 3 группами R6.
16. Соединение по п.1, имеющее формулу
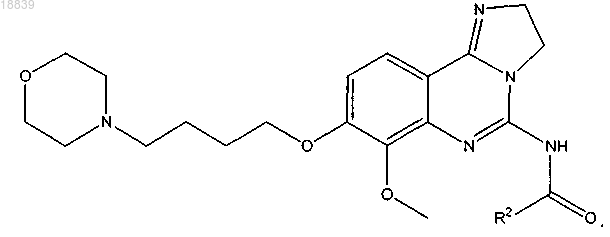
17. Соединение по п.16, в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол, тиазол, фуран или тиофен, необязательно замещенный 1, 2 или 3 группами R6.
18. Соединение по п.17, в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол или тиазол, необязательно замещенный 1, 2 или 3 группами R6.
19. Соединение по п.1, имеющее формулу
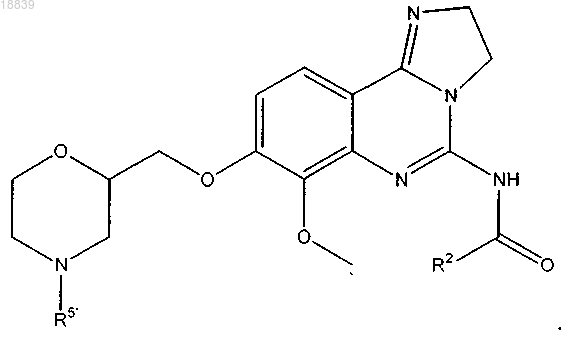
20. Соединение по п.19, в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол, тиазол, фуран или тиофен, необязательно замещенный 1, 2 или 3 группами R6.
21. Соединение по п.20, в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол или тиазол, необязательно замещенный 1, 2 или 3 группами R6.
22. Соединение по п.19, в котором R5' представляет собой С1-С8-алкил.
23. Соединение по п.1, имеющее формулу

24. Соединение по п.23, в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол, тиазол, фуран или тиофен, необязательно замещенный 1, 2 или 3 группами R6.
25. Соединение по п.24, в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол или тиазол, необязательно замещенный 1, 2 или 3 группами R6.
26. Соединение по п.23, в котором R5' представляет собой С1-С8-алкил.
27. Соединение по любому из предыдущих пунктов, представляющее собой
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамид;
N-{8-(3-[(2R,6S)-2,6-диметилморфолин-4-ил]пропокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамид;
N-(8-{3-[(2R,6S)-2,6-диметилморфолин-4-ил]пропокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-2,4-диметил-1,3-тиазол-5-карбоксамид;
2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-1,3-тиазол-5-карбоксамид;
2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]изоникотинамид;
2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-4-метил-1,3-тиазол-5-карбоксамид;
2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-4-пропилпиримидин-5-карбоксамид;
N-{8-[2-(4-этилморфолин-2-ил)этокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
N-{8-[2-(диметиламино)этокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}пиримидин-5-карбоксамид;
N-(8-{3-[2-(гидроксиметил)морфолин-4-ил]пропокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамид;
N-(8-{3-[2-(гидроксиметил)морфолин-4-ил]пропокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамид;
N-{8-[3-(диметиламино)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид 1-оксид;
2-амино-[7-метокси-8-(3-морфолин-4-илпропокси)-23-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-6-(2-пирролидин-1-илэтил)никотинамид;
6-(циклопентиламино)-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-[8-(2-гидрокси-3-морфолин-4-илпропокси)-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-{7-метокси-8-[3-(3-метилморфолин-4-ил)пропокси]-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
N-(8-{3-[2-(гидроксиметил)морфолин-4-ил]пропокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамид;
N-(8-{2-[4-(циклобутилметил)морфолин-2-ил]этокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамид;
N-(7-метокси-8-{2-[4-(2-метоксиэтил)морфолин-2-ил]этокси}-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамид;
N-{8-[(4-этилморфолин-2-ил)метокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
N-(7-метокси-8-{[4-(2-метоксиэтил)морфолин-2-ил]метокси}-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамид;
N-{7-метокси-8-[(4-метилморфолин-2-ил)метокси]-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-4-карбоксамид;
2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-4-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-1-метил-1H-имидазол-4-карбоксамид;
рел-N-(8-{3-[(2R,6S)-2,6-диметилморфолин-4-ил]пропокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиримидин-5-карбоксамид;
рел-N-(8-{3-[(2R,6S)-2,6-диметилморфолин-4-ил]пропокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)-6-метилникотинамид;
рел-6-ацетамидо-N-(8-{3-[(2R,6S)-2,6-диметилморфолин-4-ил]пропокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-1-метил-1H-имидазол-5-карбоксамид;
6-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2-метилникотинамид;
2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-4-метилпиримидин-5-карбоксамид;
6-амино-5-бромо-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-1,3-оксазол-5-карбоксамид;
N-[7-метокси-8-(морфолин-2-илметокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
2-{[2-(диметиламино)этил]амино}-N-{8-[3-(диметиламино)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}пиримидин-5-карбоксамид;
2-амино-N-{8-[3-(диметиламино)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}-1,3-тиазол-5-карбоксамид;
рел-2-амино-N-(8-{3-[(2R,6S)-2,6-диметилморфолин-4-ил]пропокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиримидин-5-карбоксамид;
рел-6-амино-N-(8-{3-[(2R,6S)-2,6-диметилморфолин-4-ил]пропокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамид;
2-[(2-гидроксиэтил)амино]-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназо-лин-5-ил]пиримидин-5-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2-[(3-метоксипропил)амино]пиримидин-5-карбоксамид;
2-амино-N-{8-[3-(диметиламино)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}пиримидин-5-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2-[(3-морфолин-4-илпропил)амино]пиримидин-5-карбоксамид;
2-[(2-метоксиэтил)амино]-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамид;
2-{[2-(диметиламино)этил]амино}-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамид;
6-амино-N-{8-[3-(диметиламино)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2-пирролидин-1-илпиримидин-5-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2-(4-метилпиеразин-1-ил)пиримидин-5-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2-морфолин-4-илпиримидин-5-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-6-пиперазин-1-илникотинамида гидрохлорид;
6-[(3S)-3-аминопирролидин-1-ил]-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамида гидрохлорида гидрат;
6-[(3R)-3-аминопирролидин-1-ил]-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамида гидрохлорид;
6-[(4-фторобензил)амино]-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
6-[(2-фурилметил)амино]-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
6-[(2-метоксиэтил)амино]-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-6-(1H-пиррол-1-ил)никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-6-морфолин-4-илникотинамид;
N-{7-метокси-8-[3-(метиламино)пропокси]-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
6-[(2,2-диметилпропаноил)амино]-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
6-[(циклопропилкарбонил)амино]-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-6-(2,2,2-трифтороэтокси)никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-6-(трифторометил)никотинамид;
6-(изобутириламино)-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-{7-метокси-8-[3-(4-метилпиперазин-1-ил)пропокси]-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2-{[(метиламино)карбонил]амино}-1,3-тиазол-4-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-6-{[(метиламино)карбонил]амино}никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2-(метиламино)-1,3-тиазол-4-карбоксамид;
N-[7-метокси-8-(2-морфолин-4-илэтокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-{8-[2-(диметиламино)этокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}-2,4-диметил-1,3-тиазол-5-карбоксамид;
N-{8-[2-(диметиламино)этокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}-6-метилникотинамид;
6-{[(изопропиламино)карбонил]амино}-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-6-пирролидин-1-илникотинамид;
6-(диметиламино)-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-[7-метокси-8-(3-пиперидин-1-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-[7-метокси-8-(2-пирролидин-1-илэтокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-[7-метокси-8-(2-пиперидин-1-илэтокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
6-{[(этиламино)карбонил]амино}-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
6-фтор-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-1,3-оксазол-4-карбоксамид;
2-(этиламино)-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-1,3-тиазол-4-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиразин-2-карбоксамид;
N-[8-(2-аминоэтокси)-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
6-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]изоникотинамид;
N-{8-[3-(диэтиламино)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
N-{8-[2-(диизопропиламино)этокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
N-{8-[2-(диэтиламино)этокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
N-{8-[3-(диметиламино)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
N-{8-[2-(диметиламино)этокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2-(метиламино)пиримидин-5-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2-(метилтио)пиримидин-5-карбоксамид;
N-[8-(3-аминопропокси)-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамида трифтороацетат;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]тиофен-2-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2,4-диметил-1,3-тиазол-5-карбоксамид;
2-метокси-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-3-фурамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]тиофен-3-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2-метил-1,3-тиазол-4-карбоксамид;
6-метокси-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
5-метокси-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-6-метилникотинамид;
6-(ацетиламино)-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
или его физиологически приемлемая соль, сольват, гидрат или стереоизомер.
28. Соединение по любому из пп.1-26, представляющее собой
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-6-метилникотинамид;
5-метокси-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]-2,4-диметил-1,3-тиазол-5-карбоксамид;
N-{8-[2-(диметиламино)этокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
N-{8-[3-(диметиламино)пропокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}никотинамид;
6-{[(изопропиламино)карбонил]амино}-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
N-{8-[2-(диметиламино)этокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}-2,4-диметил-1,3-тиазол-5-карбоксамид;
N-[7-метокси-8-(2-морфолин-4-илэтокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид;
рел-6-амино-N-(8-{3-[(2R,6S)-2,6-диметилморфолин-4-ил]пропокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)никотинамид;
рел-2-амино-N-(8-{3-[(2R,6S)-2,6-диметилморфолин-4-ил]пропокси}-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил)пиримидин-5-карбоксамид;
2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамид;
N-{8-[2-(диметиламино)этокси]-7-метокси-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил}пиримидин-5-карбоксамид;
N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамид;
или его физиологически приемлемая соль, сольват, гидрат или стереоизомер.
29. Фармацевтическая композиция, включающая соединение по п.1 или его физиологически приемлемую соль, сольват, гидрат или стереоизомер и фармацевтически приемлемый разбавитель или носитель.
30. Фармацевтическая композиция по п.29, в которой соединение присутствует в терапевтически эффективном количестве.
31. Фармацевтическая композиция по п.29, дополнительно включающая по крайней мере одно дополнительное активное соединение.
32. Фармацевтическая композиция по п.29, в которой дополнительное активное соединение представляет собой антигиперпролиферативное, антивоспалительное, болеутоляющее, иммунорегуляторное, диуретическое, антиаритмическое, антигиперхолеристенимическое, антидиабетическое, антидислипидемическое или противовирусное средство.
33. Фармацевтическая композиция по п.32, в которой дополнительное активное соединение представляет собой гемцитабин, паклитаксель, цисплатин, карбоплатин, бутират натрия, доксирубицин, тамоксифен, этопозид, трастумазаб, гефитиниб, интрон А, рапамицин, 17-AAG, U0126, инсулин или производное инсулина, лиганд PPAR, препарат сульфонилмочевины, ингибитор α-гликозидазы, бигуанид, ингибитор РТР-1В, ингибитор DPP-IV, ингибитор 11-бета-HSD, GLP-1, производное GLP-1, GIP, производное GIP, РАСАР, производное РАСАР, секретин или производное секретина, альдеслейкин, алендроновую кислоту, альфаферон, алитретион, алопуринол, алоприм, алокси, альтретамин, аминоглутетимид, амифостин, амрубицин, амсакрин, анастрозол, анзмет, аранесп, арглабин, триоксид мышьяка, аромасин, 5-азацитидин, имуран, БЦЖ или tice БЦЖ, бестатин, бетаметазона ацетат, бетаметазона фосфат натрия, бексаротен, блеомицина сульфат, броксуридин, бортезомиб, бусульфан, кальцитонин, кампат, капецитабин, карбоплатин, казодекс, цефезон, целмолейкин, церубидин, хлорамбуцил, кладрибин, клодроновую кислоту, циклофосфамид, цитарабин, дакарбазин, дактиномицин, ДауноКсом, декадрон, декадрона фосфат, делестроген, денилейкин дифтитокс, депо-медрол, деслорелин, дексразоксан, диэтилстилбестрол, дифлюкан, доцетаксель, доксифторидин, доксорубицин, дронабинол, DW-166HC, элигард, элитек, элленце, эменд, эпирубицин, эпоетин альфа, эпоген, эптаплатин, эргамизол, эстраке, эстрадиол, эстрамустин фосфат натрия, этинилэстрадиол, этиол, этидроновую кислоту, этопофос, этопозид, фадрозол, фарстон, филграстим, финастерид, флиграстим, флоксуридин, флуконазол, флударабин, 5-фтордеоксиуридин монофосфат, 5-фтороурацил (5-FU), фтороксиместерон, флутамид, форместан, фостеабин, фотемустин, фульвестрант, гаммагард, гемцитабин, гемтузумаб, глеевек, глиадел, госерелин, гранисетрон HCl, гистрелин, гикамтин, гидрокортон, эритро-гидроксинониладенин, гидроксимочевину, ибритумомаб тиуксетан, идарубицин, ифосфамид, интерферон-альфа, интерферон-альфа-2, интерферон-альфа-2А, интерферон-альфа-2В, интерферон-альфа-n1, интерферон-альфа-n3, интерферон-бета, интерферон-гамма-1а, интерлейкин-2, интрон А, иресса, иринотекан, китрил, лентинан сульфат, летрозол, лейковорин, лейпролид, лейпролид ацетат, левамизол, кальциевую соль левофолиевой кислоты, левотроид, левоксил, ломустин, лонидамин, маринол, мехлоретамин, мекобаламин, медроксипрогистерона ацетат, мегистрол ацетат, мелфалан, менест, 6-меркаптопурин, месну, метотрексат, метвикс, милтефосин, миноциклин, митомицин С, митотан, митоксантрон, модренал, миоцет, недаплатин, нойласту, ноймегу, нойпоген, нилутамид, нолвадекс, NSC-631570, ОСТ-43, остреотид, ондансетрон HCl, орапред, оксалиплатин, паклитаксел, педиапред, пегаспаргаз, пегасис, пентостатин, пицибанил, пилокарпин HCl, пирарубицин, пликамицин, натрия порфимер, преднимустин, преднизолон, преднизон, премарин, прокарбазин, прокрит, ралтитрексед, ребиф, рений-186 этидронат, ритуксимаб, роферон-А, ромуртид, салаген, сандостатин, сарграмостим, семустин, сизофиран, собузоксан, солу-медрол, спарфозовую кислоту, терапию стволовыми клетками, стрептозоцин, стронций-89 хлорид, синтроид, тамоксифен, тамсулозин, тасонермин, тастолактон, таксотеру, тецелейкин, темозоломид, тенипосид, тестостерона пропионат, тестред, тиогуанин, тиотепу, тиротропин, тилудроновую кислоту, топотекан, торемифен, тоситумомаб, трастузумаб, треосульфан, третиноин, трексалл, триметилмеламин, триметрексат, трипторелин ацетат, трипторелин памоат, UFT, уридин, валрубицин, веснаринон, винбластин, винкристин, виндезин, винорелбин, вирулицин, зинегард, зиностатин, стималамер, зофран, ABI-007, аколбифен, актиммун, аффинитак, аминоптерин, арзоксифен, азоприснил, атаместан, атрасентан, BAY43-9006 (сорафениб), авастин, CCI-779, CDC-501, целебрекс, цетуксимаб, криснатол, ципротерона ацетат, децитабин, DN-101, доксорубицин-МТС, dSLIM, дутастерид, едотекарин, эфлорнитин, эксатекан, фенретинид, гистамина дигидрохлорид, гистрелиновый гидрогель, гольмий 166 DOTMP, ибадроновую кислоту, интерферон-гамма, интрон-PEG, иксабепилон, гемоцианин, L-651582, ланреотид, лазофоксифен, либру, лонафарниб, мипроксифен, минодронат, MS 209, липосомат МТР-РЕ, МХ-6, нафарелин, неморубицин, неовастат, нолатрексед, облимерсен, онко-TCS, осидем, пакситаксель полиглутамат, памидронат динатрий, PN-401, QS-21, квазепам, R-1549, ралоксифен, ранпирнас, 13 цис-ретиноевую кислоту, сатраплатин, сеокальцитол, Т-138067, тарцеву, таксопрексин, тимосин-альфа-1, тиазофурин, типифарниб, тирапазамин, TLK-286, торемифен, TransMID-107R, валсподар, вапреотид, ваталаниб, ветрепорфин, винфлунин, Z-100, золедроновую кислоту или их комбинации.
34. Упакованная фармацевтическая композиция, включающая контейнер, фармацевтическое соединение по п.29 и инструкцию для применения фармацевтической композиции для лечения болезни или состояния у млекопитающего.
35. Способ ингибирования фосфотидилинозитол-3-киназы в клетках, включающий контакт клетки с одним или несколькими соединениями по п.1.
36. Способ лечения нарушения, опосредуемого ингибированием фосфотидилинозитол-3-киназы у млекопитающего, включающий введение млекопитающему, которое в этом нуждается, терапевтически эффективного количества одного или нескольких соединений по п.1.
37. Способ по п.36, в котором нарушение, опосредуемое фосфотидилинозитол-3-киназой, представляет собой ангиогенное нарушение, воспалительное нарушение, аутоиммунное нарушение, сердечно-сосудистое нарушение, нейродегенеративное нарушение, метаболическое нарушение, ноцицептивное нарушение, глазное нарушение, легочное нарушение или почечное нарушение.
38. Способ по п.37, в котором сердечно-сосудистое нарушение представляет собой тромбоз, легочную гипертензию, сердечную гипертрофию, атеросклероз или сердечную недостаточность.
39. Способ по п.37, в котором воспалительное нарушение представляет собой COPD.
40. Способ по п.37, в котором ангиогенное нарушение представляет собой диабетическую ретинопатию, ишемическую окклюзию вен сетчатки, ювенильную ретинопатию, неоваскулярную глаукому, псориаз, ретролентальные фиброплазии, ангиофиброму, воспаление, ревматоидный артрит, рестеноз, рестеноз в стенте или рестеноз сосудистого трансплантата.
41. Способ лечения гиперпролиферативного нарушения у млекопитающего, включающий введение млекопитающему, которое в этом нуждается, терапевтически эффективного количества одного или нескольких соединений по п.1.
42. Способ по п.41, в котором гиперпролиферативное нарушение представляет собой рак.
43. Способ по п.42, в котором рак представляет собой рак молочной железы, дыхательных путей, головного мозга, репродуктивных органов, пищеварительного тракта, мочевых путей, глаза, печени, кожи, головы и шеи, щитовидной железы, паращитовидной железы и отдаленные метастазы солидной опухоли.
44. Способ по п.42, в котором рак представляет собой лимфому, саркому или лейкемию.
Текст
ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 2,3-ДИГИДРОИМИДАЗО[1,2-С]ХИНАЗОЛИНА,ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ ГИПЕРПРОЛИФЕРАТИВНЫХ НАРУШЕНИЙ И БОЛЕЗНЕЙ, СВЯЗАННЫХ С АНГИОГЕНЕЗОМ Изобретение касается новых соединений 2,3-дигидроимидазо[1,2-с]хиназолина формулы фармацевтических композиций, содержащих такие соединения, применения этих соединений или композиций для ингибирования фосфотидилинозитол-3-киназы (PI3K) и лечения болезней,связанных с активностью фосфотидилинозитол-3-киназы (PI3K), при определенном лечении гиперпролиферативных нарушений и/или нарушений ангиогенеза, в качестве отдельного агента или в комбинации с другими активными компонентами.(71)(73) Заявитель и патентовладелец: БАЙЕР ИНТЕЛЛЕКЧУАЛ ПРОПЕРТИ ГМБХ (DE) Область изобретения Настоящее изобретение касается новых соединений 2,3-дигидроимидазо[1,2-с]хиназолина, фармацевтических композиций, содержащих такие соединения, применения этих соединений или композиций для ингибирования фосфотидилинозитол-3-киназы (PI3K) и лечения болезней, связанных с активностью фосфотидилинозитол-3-киназы (PI3K), при определенном лечении гиперпролиферативных нарушений и/или нарушений ангиогенеза, в качестве отдельного агента или в комбинации с другими активными компонентами. Предпосылки создания изобретения В прошлое десятилетие понятие разработки противораковых лекарственных средств, мишенями которых являются патологически активные протеинкиназы, привело к ряду успехов. В дополнение к действиям протеинкиназ липидкиназы также играют важную роль в генерации критических регулирующих вторичных мессенджеров. Семейство PI3K липидкиназ производит 3'-фосфоинозитиды, которые связываются с множеством клеточных мишеней и активируют их, начиная широкий диапазон каскадов трансдукции сигнала (Vanhaesebroeck et al., 2001; Toker, 2002; Pendaries et al., 2003; Downes et al., 2005). Эти каскады в конечном счете вызывают изменения во многих клеточных процессах, включая пролиферацию клеток, выживание клеток, дифференцирование, транспорт в везикулах, миграцию и хемотаксис.PI3K могут быть разделены на три различных класса на основании различий и в структуре, и в предпочтении к субстрату. В то время как члены семейства класса II PI3K были вовлечены в регулирование роста опухоли (Brown and Shepard, 2001; Traer et al., 2006), большая часть исследования сосредоточилась на ферментах класса I и их роли при раке (Vivanco And Sawyers, 2002; Workman, 2004, Chen et al.,2005; Hennessey et al., 2005; Stauffer et al., 2005; Stephens et al., 2005; Cully et al., 2006).PI3K класса I были традиционно разделены на два различных подкласса на основании различий в составе белковой субъединицы. PI3K класса IA состоят из каталитической р 110 каталитической субъединицы (p110,или ), гетеродимеризированной с членом семейства р 85 регулирующих субъединиц. Напротив, каталитическая субъединица РБК класса IB (р 110) гетеродимеризируется с другой р 101 регулирующей субъединицей (рассмотрено Vanhaesebroeck and Waterfield, 1999; Funaki et al., 2000; Katso etal., 2001). С-терминальный участок этих белков содержит каталитический домен, который обладает отдаленной гомологией к протеинкиназам. Структура PI3K подобна р 110 класса IA, но не содержит Nтерминального р 85 связывающего участка (Domin и Waterfield, 1997). Хотя они подобны по общей структуре, гомология между каталитическими р 110 субъединицами является низкой или средней. Самая высокая гомология между PI3K изоформами находится в кармане киназы киназного домена.PI3K изоформы класса IA связываются с активированными рецепторными тирозинкиназами (RTK)(включая PDGFR, EGFR, VEGFR, IGF1-R, c-KIT, CSF-R и Met) или с тирозин фосфорилированными адаптерными белками (такими как Grb2, Cbl, IRS-1 или Gab1), через их р 85 регулирующие субъединицы,что приводит к стимуляции липидкиназной активности. Активация липидкиназной активности p110 и р 110 изоформ, как показано, происходит в ответ на связывание с активированными формами ras онкогена (Kodaki et al., 1994). Фактически, онкогенная активность этих изоформ может потребовать связывания с ras (Kang et al., 2006). Напротив, p110 и p110 изоформы показывают онкогенную активность независимо от связывания ras, через конститутивную активацию Akt.PI3K класса I катализируют преобразование PI(4,5)P2 [PIP2] в PI(3,4,5)P3 [PIP3]. Выработка PIP3 с помощью PI3K затрагивает множественные сигнальные процессы, которые регулируют и координируют биологические конечные точки клеточной пролиферации, клеточного выживания, дифференцирования и клеточной миграции. PIP3 связывается содержащими домен Pleckstrin-гомологии (РН) белками, включая фосфоинозитид-зависимую киназу, PDK1 и Akt прото-онкогенный продукт, ограничивая эти белки в участках активной трансдукции сигнала и также непосредственно способствуя их активации (Klippel etal., 1997; Fleming et al., 2000; Itoh and Takenawa, 2002; Lemmon, 2003). Эта совместная локализация PDK1 с Akt облегчает фосфорилирование и активацию Akt. Карбокситерминальное фосфорилирование Akt наSer473 способствует фосфорилированию Thr308 в петле активации Akt (Chan and Tsichlis, 2001; Hodgekinson et al., 2002; Scheid et al., 2002; Hresko et al., 2003). При активации Akt фосфорилирует и регулирует множественные регулирующие киназы путей, которые непосредственно влияют на прогрессию клеточного цикла и клеточное выживание. Многие из эффектов активации Akt опосредуются через ее отрицательное регулирование путей, которые воздействуют на выживание клетки и которые обычно дисрегулированы при раке. Akt способствует выживанию опухолевых клеток путем регулирования компонентов апоптозных механизмов и механизмов клеточного цикла. Akt - одна из нескольких киназ, которая фосфорилирует и инактивирует проапоптические белки BAD (del Paso et al., 1997; Pastorino et al., 1999). Akt может также способствовать клеточному выживанию через блокирование цитохром С-зависимой каспазной активации путем фосфорилирования каспазы 9 на Ser196 (Cardone et al., 1998).Akt воздействует на генную транскрипцию на нескольких уровнях. Akt-опосредованное фосфорилирование MDM2 Е 3 убиквитинлигазы на Ser166 и Ser186 облегчает ядерный импорт MDM2 и формирование и активацию комплекса убиквитинлигазы. Ядерный MDM2 нацеливается на р 53 опухолевый супрес-1 018839 сор для деградации процесса, который может быть заблокирован LY294002 (Yap et al., 2000; Ogarawa etal., 2002). Нисходящее регулирование р 53 с помощью MDM2 отрицательно воздействует на транскрипцию р 53-регулирируемых про-апоптических генов (например, Вах, Fas, PUMA и DR5), ингибитор клеточного цикла, р 21Cip1 и PTEN опухолевый супрессор (Momand et al., 2000; Hupp et al., 2000; Mayo et al.,2002; Su et al., 2003). Подобным образом, Akt-опосредованное фосфорилирование факторов транскрипции Forkhead FKHR, FKHRL и AFX (Kops et al., 1999; Tang et al., 1999) облегчает их связывание с белками 14-3-3 и экспорт из клеточного ядра в цитозоль (Brunet et al., 1999). Эта функциональная инактивация активности Forkhead также воздействует на транскрипцию про-апоптических и про-ангиогенных генов,включая транскрипцию лиганда Fas (Ciechomska et al., 2003) Bim, члена про-апоптического Bcl-2 семейства (Dijkers et al., 2000), и антагониста ангиопоэтина-1 (Ang-1), Ang-2 (Daly et al., 2004). Факторы транскрипции Forkhead регулируют экспрессию ингибитора циклин-зависимой киназы (Cdk) p27Kip1. Действительно, ингибиторы PI3K, как было продемонстрировано, индуцируют экспрессию р 27Kip1, что приводит к ингибированию Cdk1, остановке клеточного цикла и апоптозу (Dijkers et al., 2000). Также сообщают,что Akt фосфорилирует р 21Cip1 на Thr145 и р 27Kip1 на Thr157, облегчая их ассоциацию с белками 14-3-3, что приводит к ядерному экспорту и удерживанию в цитоплазме, предотвращая их ингибирование Cdks ядра(Zhou et al., 2001; Motti et al., 2004; Sekimoto et al., 2004). В дополнение к этим эффектам Akt фосфорилирует IKK (Romashkova and Makarov, 1999), что приводит к фосфорилированию и деградации IВ и последующей ядерной транслокации NFB, что приводит к экспрессии генов выживания, таких как IAP иBcl-XL. Путь PI3K/Akt также связан с супрессией апоптоза через JNK и р 38MAPK MAP киназы, которые связаны с индукцией апоптоза. Akt, как постулируется, подавляет сигнальный путь JNK и р 38MAPK через фосфорилирование и ингибирование двух JNK/p38 регулирующих киназ, регулирующей сигнал апоптоза киназы 1 (ASK1) (Kim et al., 2001: Liao and Hung, 2003; Yuan et al., 2003) и киназы смешанного происхождения 3 (MLK3) (Lopez-Ilasaca et al., 1997; Barthwal et al., 2003; Figueroa et al., 2003). Индукция р 38MAPK активности наблюдается в опухолях, леченных с помощью цитотоксических агентов, и требуется для этих агентов для индукции смерти клетки (рассмотрено Olson и Hallahan, 2004). Таким образом, ингибиторы пути PI3K могут способствовать активностям совместно вводимых цитотоксических препаратов. Дополнительная роль для передачи сигналов PI3K/Akt вовлекает регулирование прогрессии клеточного цикла через модуляцию активности гликоген синтаз киназы 3 (GSK3). Активность GSK3 повышена в неподвижных клетках, где она фосфорилирует циклин D1 на Ser286, нацеливая белок для убиквитинации и деградации (Diehl et al., 1998) и блокируя вход в S-фазу. Akt ингибирует активность GSK3 через фосфорилирование на Ser9 (Cross et al., 1995). Это приводит к повышению уровней Циклина D1, что способствует прогрессии клеточного цикла. Ингибирование активности GSK3 также воздействует на пролиферацию клеток через активацию wnt/бета-катенинового сигнального пути (Abbosh and Nephew,2005; Naito et al., 2005; Wilker et al., 2005; Kim et al., 2006; Segrelles et al., 2006). Akt-опосредованное фосфорилирование GSK3 приводит к стабилизации и ядерной локализации бета-катенинового белка, что в свою очередь приводит к увеличению экспрессии с-myc и циклина D1, мишеней бета-катенинового/Tcf пути. Хотя передача сигналов PI3K используется многими сетями трансдукции сигнала, связанными с онкогенами и опухолевыми супрессорами, PI3K и ее активность были непосредственно связаны с раком. Сверхэкспрессия обеих изоформ р 110 и р 110 наблюдалась в опухолях мочевого пузыря и толстой кишки и в клеточных линиях, и сверхэкспрессия вообще коррелирует с увеличенной активностью PI3K(Benistant et al., 2000). Также сообщалось об сверхэкспрессии p110 в опухолях яичника и шейки матки и опухолевых клеточных линиях так же, как в чешуйчатоклеточных карциномах легкого. Сверхэкспрессия р 110 в линиях опухоли шейки матки и яичника связана с увеличением активности PI3K (Shayesteh et al.,1999; Ma et al., 2000). Повышенная активность PI3K наблюдалась при колоректальных карциномах (Phillips et al., 1998), и увеличенная экспрессия наблюдалось при карциномах молочной железы (Gershtein etal., 1999). За прошлые несколько лет соматические мутации в гене, кодирующем р 110 (PIK3CA), были идентифицированы во многих раковых образованиях. Данные, собранные до настоящего времени, свидетельствуют, что PIK3CA мутирована приблизительно в 32% случаев колоректального рака (Samuels et al.,2004; Ikenoue et al., 2005), 18-40% - рака молочной железы (Bachman et al., 2004; Campbell et al., 2004;et al., 2005). Сообщалось о мутациях PIK3CA при олигодендроме, астроцитоме, медуллобластоме и также опухолях щитовидной железы (Broderick et al., 2004; Garcia-Rostan et al., 2005). На основании наблюдаемой высокой частоте мутации PIK3CA - один из двух наиболее часто мутируемых генов, связанных с раком, другим является K-ras. Больше чем 80% группы мутаций PIK3CA в пределах двух участков белка,спирального (Е 545K) и каталитического доменов (H1047R). Биохимический анализ и исследования экс-2 018839 прессии белка продемонстрировали, что обе мутации приводят к увеличению конститутивной p110 каталитической активности и фактически являются онкогенными (Bader et al., 2006; Kang et al., 2005;Samuels et al., 2005; Samuels and Ericson, 2006). Недавно сообщалось, что фибробласты эмбриона мыши"knockout PIK3CA" не имели нисходящей передачи сигналов от различных рецепторов фактора ростаRTK (IGFR, EGFR дикого типа и соматические активирующие мутанты EGFR, Her2/Neu) (Zhao et al.,2006). Функциональные исследования PI3K in vivo продемонстрировали, что si-РНК-опосредованная нисходящая регуляция р 110 ингибирует и фосфорилирование Akt и рост опухоли клеток HeLa у голых мышей (Czauderna et al., 2003). В подобных экспериментах si-РНК-опосредованная нисходящая регуляция р 110, как также показано, ингибировала рост клеток злокачественной глиомы in vitro и in vivo (Pu etal., 2006). Ингибирование функции PI3K доминант-отрицательными р 85 регулирующими субъединицами может блокировать митогенез и клеточную трансформацию (Huang et al., 1996; Rahimi et al., 1996). Несколько соматических мутаций в генах, кодирующих р 85 и р 85 регулирующие субъединицы PI3K,которые приводят к повышенной липидкиназной активности, были также идентифицированы во многих раковых клетках (Janssen et al., 1998; Jimenez et al., 1998; Philp et al., 2001; Jucker et al., 2002; Shekar et al.,2005). Нейтрализация антител PI3K также блокирует митогенез и может вызвать апоптоз in vitro (Rocheet al., 1994; Roche et al., 1998; Benistant et al., 2000). Исследования доказательства принципа in vivo с использованием ингибиторов PI3K LY294002 и вортманнина демонстрируют, что ингибирование передачи сигналов PI3K замедляет рост опухоли in vivo (Powis et al., 1994; Shultz et al., 1995; Semba et al., 2002; Ihleet al., 2004). Сверхэкспрессия активности PI3K класса I или стимуляция их липидкиназных активностей связана с резистентностью как к нацеленным (таким как иматиниб и тратсузумаб), так и цитотоксическим химиотерапевтических подходам, а также лучевой терапии (West et al., 2002; Gupta et al., 2003; Osaki et al.,2004; Nagata et al., 2004; Gottschalk et al., 2005; Kim et al., 2005). Активация PI3K, как также было показано, приводит к экспрессии белка-1 с множественной медикаментозной резистентностью (MRP-1) в клетках рака простаты и последующей индукции резистентности к химиотерапии (Lee et al., 2004). Важность передачи сигналов PI3K при канцерогенезе дополнительно подчеркнута результатами о том, что опухолевый супрессор PTEN, PI(3)Р фосфатаза принадлежит к обычно инактивированным генам при человеческих раковых образованиях (Li et al., 1997, Steck et al., 1997; Ali et al., 1999; Ishii et al., 1999).PTEN дефосфорилирует PI(3,4,5)Р 3 до PI(4,5)Р 2, таким образом антагонизируя PI3K-зависимую передачу сигналов. Клетки, содержащие функционально неактивный PTEN, имеют повышенные уровни PIP3, высокие уровни активности передачи сигналов PI3K (Haas-Kogan et al., 1998; Myers et al., 1998; Taylor et al.,2000), увеличенный пролиферативный потенциал и уменьшенную чувствительность к про-апоптическим стимулам (Stambolic et al., 1998). Восстановление функционального PTEN подавляет передачу сигналовPI3K (Taylor et al., 2000), ингибирует клеточный рост и повторно сенсибилизирует клетки к проапоптическим стимулам (Myers et al., 1998; Zhao et al., 2004). Подобным образом, восстановление функции PTEN в опухолях, не имеющих функционального PTEN, ингибирует рост опухоли in vivo (Stahl etal., 2003; Su et al., 2003; Tanaka and Grossman, 2003) и сенсибилизирует клетки к цитотоксическим агентам (Tanaka и Grossman, 2003). Семейство PI3K класса I четко играет важную роль в регулировании множественных путей трансдукции сигнала, которые способствуют клеточному выживанию и клеточной пролиферации, и активация их липидкиназной активности значительно способствует развитию злокачественных новообразований человека. Кроме того, ингибирование PI3K может потенциально обойти клеточные механизмы, которые лежат в основе резистентности к химиотерапевтическим агентам. Поэтому у мощного ингибитора активностей PI3K класса I был бы потенциал не только для ингибирования роста опухоли, но и также для сенсибилизации опухолевых клеток к про-апоптическим стимулам in vivo. Пути трансдукции сигнала, происходящие из хемоаттрактантных рецепторов, как полагают, являются важными мишенями в контроле подвижности лейкоцитов при воспалительных болезнях. Передвижение лейкоцитов контролируется хемоаттрактантными факторами, которые активируют гетеротримерные GPCR и, таким образом, вызывают множество нисходящих внутриклеточных явлений. Трансдукция сигнала вдоль одного из этих путей, которая приводит к мобилизации свободных Са 2+, перестройке цитоскелета и направленному движению, зависит от липидных вторичных мессенджеров, которые продуцируются активностью PI3K (Wymann et al., 2000; Stein and Waterfield, 2000).PI3K модулирует исходные уровни сАМР и контролирует сокращаемость в клетках. Недавнее исследование указывает на то, что изменения в исходных уровнях сАМР способствуют увеличению сокращаемости у мышей-мутантов. Поэтому это исследование показывает, что PI3K ингибиторы представляли бы потенциальные терапии для застойной сердечной недостаточности, ишемии, легочной гипертензии, почечной недостаточности, сердечной гипертрофии, атеросклероза, тромбоэмболии и диабета. Ингибиторы PI3K, как ожидается, блокировали бы трансдукцию сигнала от GPCR и блокировали бы активацию различных иммунных клеток, приводя к широкому противововоспалительному профилю с-3 018839 потенциалом для лечения воспалительных и иммунорегулирующих болезней, включая астму, атопический дерматит, ринит, аллергические болезни, хроническую обструктивную легочную болезнь (COPD),септический шок, болезни суставов, аутоиммунные патологии, такие как ревматический артрит и болезнь Грейва, диабет, рак, нарушения сокращаемости миокарда, тромбоэмболия и атеросклероз. Композиции и соединения ингибитора PI3K, описанные авторами, включая их соли, метаболиты,сольваты, сольваты солей, гидраты и стереоизомерные формы, показывают антипролиферативную активность и, таким образом, полезны для профилактики или лечения нарушений, связанных с гиперпролиферацией. Описание изобретения Один вариант осуществления этого изобретения охватывает соединение, имеющее формулу (I) или его физиологически приемлемую соль, сольват, гидрат или стереоизомер, в которойR4 - водород, гидрокси и R5 и R5' могут быть одинаковыми или различными и представляют собой,независимо друг от друга, водород, С 1-С 8-алкил, С 3-С 8-циклоалкил-С 1-С 8-алкил, или R5 и R5' могут быть взяты вместе с атомом азота, с которым они связаны, для образования 3-7-членного азотсодержащего гетероциклического кольца, необязательно содержащего по крайней мере один дополнительный гетероатом, выбранный из кислорода, азота или серы, которое может быть необязательно замещено 1 или несколькими R6' группами, или R4 и R5 могут вместе с атомами, с которыми они связаны, образовать 5-6 членное азотсодержащее гетероциклическое кольцо, необязательно содержащее 1 или несколько атомов азота, кислорода или серы, которое может быть необязательно замещено 1 или несколькими R6' группами;R6 может быть одинаковым или различным и представляет собой независимо галоген, C1-C8-алкил,С 3-С 8-циклоалкил, С 3-С 8-циклоалкил-С 1-С 8-алкил, 5-членный гетероарил, содержащий 1 атом N в качестве гетероатома, гетероарил-С 1-С 8-алкил, насыщенное 5-6-членное гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранных из N и О, гетероциклил-С 1-С 8-алкил, С 1-С 8-алкил-OR7, -OR7,-SR7, -N(R7)(R7') или -NR7COR7, каждый из которых может быть необязательно замещен 1 или несколькими группами R8;R6' может быть одинаковым или различным и представляет собой независимо С 1-С 8-алкил, С 3-С 8 циклоалкил-С 1-С 8-алкил или С 1-С 8-алкил-OR7;R7 и R7' могут быть одинаковыми или различными и представляют собой независимо водород, С 1 С 8-алкил, С 3-С 8-циклоалкил, С 3-С 8-циклоалкил-С 1-С 8-алкил, арил, арил-С 1-С 8-алкил, 5-членный гетероарил, содержащий 1 атом N в качестве гетероатома, 5-6-членное гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранных из N и О, гетероциклил-С 1-С 8-алкил или гетероарил-С 1-С 8-алкил;R8 представляет собой независимо гидрокси, галоген, амино, С 1-С 8-алкил, C1-С 8-алкокси;n - целое число от 1 до 4 иm является целым числом от 0 до 4 с условием, что, когда R4 и R5 вместе с атомами, с которыми они связаны, образовывают 3-7-членное азотсодержащее кольцо, n+m4. В предпочтительном варианте осуществления изобретение охватывает соединение формулы (I), в котором R2 - азотсодержащий гетероарил, необязательно замещенный 1, 2 или 3 группами R6. В другом предпочтительном варианте осуществления изобретение охватывает соединение формулы(I), в котором R5 и R5' представляют собой независимо C1-С 8-алкил. В еще одном предпочтительном варианте осуществления изобретение охватывает соединение формулы (I), в котором R5 и R5' вместе с атомом азота, с которым они связаны, образуют 5-6-членное азотсодержащее гетероциклическое кольцо, содержащее по крайней мере один дополнительный гетероатом,выбранный из кислорода, азота или серы, и которое может быть необязательно замещено 1 или несколькими R6 группами. В еще одном предпочтительном варианте осуществления изобретение охватывает соединение формулы (I), в котором R4 представляет собой гидроксигруппу. В другом предпочтительном варианте осуществления изобретение охватывает соединение формулы(I), в котором R4 и R5 вместе с атомами, с которыми они связаны, могут образовать 5-6-членное азотсодержащее гетероциклическое кольцо, необязательно содержащее 1 или несколько атомов азота, кислорода или серы, и которое может быть необязательно замещено 1 или несколькими группами R6'. В еще одном предпочтительном варианте осуществления изобретение охватывает соединение формулы (I), в котором R3 - метил. В еще одном предпочтительном варианте осуществления изобретение охватывает соединение формулы (I), в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол,тиазол, фуран или тиофен, необязательно замещенный 1, 2 или 3 группами R6; более предпочтительно пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол или тиазол, необязательно замещенный 1, 2 или 3 группами R6. В отличном варианте осуществления изобретение охватывает соединение формулы (Ia) или его физиологически приемлемую соль, сольват, гидрат или стереоизомер, в котором R2 принимает значения, определенные выше. В другом отличном варианте осуществления изобретение охватывает соединение формулы (Ib) или его физиологически приемлемую соль, сольват, гидрат или стереоизомер, в котором R2 принимает значения, определенные выше. В еще одном отличном варианте осуществления изобретение охватывает соединение формулы (Ic) или его физиологически приемлемую соль, сольват, гидрат или стереоизомер, в котором R2 принимает значения, определенные выше. В еще одном отличном варианте осуществления изобретение охватывает соединение формулы (Id) или его физиологически приемлемую соль, сольват, гидрат или стереоизомер, в котором R2 и R5' принимают значения, определенные выше. В еще одном отличном варианте осуществления изобретение охватывает соединение формулы (Ie)-5 018839 или его физиологически приемлемую соль, сольват, гидрат или стереоизомер, в котором R2 и R5' принимают значения, определенные выше. В предпочтительном варианте осуществления изобретение охватывает соединение формул (I)-(V), в котором R2 представляет собой пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол, тиазол, фуран или тиофен, необязательно замещенный 1, 2 или 3 группами R6; более предпочтительно в котором R2- пиридин, пиридазин, пиримидин, пиразин, пиррол, оксазол или тиазол, необязательно замещенный 1, 2 или 3 группами R6. В еще одном предпочтительном варианте осуществления изобретение охватывает соединение,имеющее формулуN-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]никотинамид; или его физиологически приемлемая соль, сольват, гидрат или стереоизомер. В предпочтительном варианте осуществления изобретение охватывает соединение, имеющее формулуN-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин 5-карбоксамид; или его физиологически приемлемую соль, сольват, гидрат или стереоизомер. В случае если существует несоответствие между химическим названием и изображенной химической структурой, изображенная химическая структура имеет приоритет перед данным химическим названием. Не ограничиваясь теорией или механизмом, соединения существующего изобретения демонстрируют удивительную активность для ингибирования фосфатидилинозитол-3-киназы и химическую и структурную стабильность в сравнении с такими соединениями из предшествующего уровня техники. Считается, что эта удивительная активность основана на химической структуре соединений, в особенности основности соединений в результате того, что R1 является амином, необязательно замещенным R5 иR5'. Далее, соответствующий выбор R3 и R2 обеспечивает необходимую активность против соответствующих изоформ, чтобы предоставить активность in vivo. Определения Термин "алкил" касается радикала неразветвленной или разветвленной углеводородной цепи, состоящего исключительно из углеродных и водородных атомов, содержащего исключительно углеродные и водородные атомы, не содержащего ненасыщенности, имеющего от одного до восьми углеродных атомов, и который присоединен к остальной части молекулы одинарной связью, такого как иллюстративно,метил, этил, N-пропил, 1-метилэтил (изопропил), N-бутил, N-пентил и 1,1-диметилэтил (т-бутил). Термин "алкенил" касается алифатической углеводородной группы, содержащей двойную связь углеродуглерод и которая может представлять собой неразветвленную или разветвленную цепь, имеющую приблизительно от 2 приблизительно до 10 углеродных атомов, например этенил, 1-пропенил, 2-пропенил(аллил), изопропенил, 2-метил-1-пропенил, 1-бутенил и 2-бутенил. Термин "алкинил" касается гидрокарбонильных радикалов с неразветвленной или разветвленной цепью, имеющих по крайней мере одну тройную связь углерод-углерод и имеющих в диапазоне приблизительно от 2 до 12 углеродных атомов (при этом на данный момент предпочтительны радикалы, имеющие в диапазоне приблизительно от 2 до 10 углеродных атомов), например этинил. Термин "алкокси" обозначает алкильную группу, определенную авторами, присоединенную через кислородную связь к остальной части молекулы. Характерные примеры этих групп - метокси и этокси. Термин "алкоксиалкил" обозначает алкоксигруппу, определенную авторами, присоединенную через кислородную связь к алкильной группе, которая затем присоединяется к главной структуре на любом углероде из алкильной группы, что приводит к созданию устойчивой остальной части структуры молекулы. Характерные примеры таких групп -СН 2 ОСН 3, -CH2OC2H5. Термин "циклоалкил" обозначает неароматическую моно- или многоциклическую кольцевую систему приблизительно из 3-12 углеродных атомов, такую как циклопропил, циклобутил, циклопентил,циклогексил, и примеры многоциклических циклоалкильных групп включают пергидронафтиловую,адамантиловую и норборниловую группы, соединенные мостиками циклическую группу или спиробициклические группы, например спиро(4,4)нон-2-ил. Термин "циклоалкилалкил" касается циклических содержащих кольцо радикалов, содержащих в диапазоне приблизительно от 3 до 8 углеродных атомов, непосредственно присоединенных к алкильной группе, которая затем также присоединяется к главной структуре на любом углероде из алкильной группы, что приводит к созданию устойчивой структуры, такой как циклопропилметил, циклобутилэтил,циклопентилэтил. Термин "арил" касается ароматических радикалов, имеющих в диапазоне от 6 до 14 углеродных атомов, таких как фенил, нафтил, тетрагидронафтил, инданил, бифенил. Термин "арилалкил" касается арильной группы, определенной авторами, непосредственно связанной с алкильной группой, определенной авторами, которая затем присоединяется к главной структуре на любом углероде из алкильной группы, что приводит к созданию устойчивой остальной части структуры молекулы, например -СН 2 С 6 Н 5, -С 2 Н 5 С 6 Н 5. Термин "гетероциклическое кольцо" касается радикала из устойчивого 3-15-членного кольца, которое состоит из углеродных атомов и от одного до пяти гетероатомов, выбранных из группы, состоящей из азота, фосфора, кислорода и серы. В целях этого изобретения радикал гетероциклического кольца может представлять собой моноциклическую, бициклическую или трициклическую кольцевую систему,которая может включать слитые, соединенные мостиками или спирокольцевые системы, и атомы азота,фосфора, углерода, кислорода или серы в радикале гетероциклического кольца могут быть необязательно окислены до различных состояний окисления. Кроме того, атом азота может быть необязательно четвертичным; и кольцевой радикал может быть частично или полностью насыщенным (то есть гетероароматическим или гетероарильным ароматическим). Примеры таких радикалов гетероциклического кольца включают, кроме прочих, азетидинил, акридинил, бензодиоксолил, бензодиоксанил, бензофурнил, карбазолил циннолинил диоксоланил, индолизинил, нафтиридинил, пергидроазеринил, феназинил, фенотиазинил, феноксазинил, фталазил, пиридил, птеридинил, пуринил, хиназолинил, хиноксалинил, хинолинил,изохинолинил, тетразоил, имидазолил тетрагидроизоуинолил, пиперидинил, пиперазинил, 2 оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 2-оксоазеринил, азеринил, пирролил, 4 пиперидонил, пирролидинил, пиразинил, пиримидинил пиридазинил, оксазолил оксазолинил оксазолидинил, триазолил, инданил, изоксазолил, изоксазолидинил, морфолинил, тиазолил, тиазолинил, тиазолидинил, изотиазолил, хинуклидинил, изотиазолидинил, индолил, изоиндолил, индолинил, изоиндолинил,октагидроиндолил, октагидроизоиндолил хинолил, изохинолил, декагидроизохинолил, бензимидазолил,тиадиазолил, бензопиранил, бензотиазолил, бензооксазолил, фурил, тетрагидрофуртил, тетрагидропиранил, тиенил, бензотиенил, тиаморфолинил, тиаморфолинил сульфоксид тиаморфолинил сульфон, диоксафосфоланил, оксадиазолил, хроманил, изохроманил. Термин "гетероарил" касается радикала гетероциклического кольца, определенного авторами, который является ароматическим. Радикал гетероарильного кольца может быть присоединен к главной структуре на любом гетероатоме или углеродном атоме, что приводит к созданию устойчивой структуры. Радикал гетероциклического кольца может быть присоединен к главной структуре на любом гете- 10018839 роатоме или углеродном атоме, что приводит к созданию устойчивой структуры. Термин "гетероарилалкил" касается радикала гетероарильного кольца, определенного авторами,непосредственно связанного с алкильной группой. Гетероарилалкильный радикал может быть присоединен к главной структуре на любом углеродном атоме из алкильной группы, что приводит к созданию устойчивой структуры. Термин "гетероциклил" касается радикала гетероциклического кольца, определенного авторами. Радикал гетероциклического кольца может быть присоединен к главной структуре на любом гетероатоме или углеродном атоме, что приводит к созданию устойчивой структуры. Термин "гетероциклилалкил" касается радикала гетероциклического кольца, определенного авторами, непосредственно связанного с алкильной группой. Гетероциклилалкильный радикал может быть присоединен к главной структуре на углеродном атоме в алкильной группе, что приводит к созданию устойчивой структуры. Термин "карбонил" касается кислородного атома связанного с углеродным атомом молекулы двойной связью. Термин "галоген" касается радикалов фтора, хлора, брома и йода. При использовании авторами множественной формы слов соединения, соли, полиморфы, гидраты,сольваты и т.п., это также означает отдельное соединение, соль, полиморф, изомер, гидрат, сольват или подобное. Соединения этого изобретения могут содержать один или несколько асимметричных центров, в зависимости от положения и природы различных желательных заместителей. Асимметричные углеродные атомы могут присутствовать в (R)- или (S)-конфигурации, что приводит к образованию рацемических смесей в случае единственного асимметричного центра и диастереомерных смесей в случае множественных асимметричных центров. В определенных случаях асимметрия может также присутствовать из-за ограниченного вращения вокруг данной связи, например центральной связи, примыкающей к двум замещенным ароматическим кольцам указанных соединений. Заместители на кольце могут также присутствовать или в цис- или в транс-форме. Считается, что все такие конфигурации (включая энантиомеры и диастереомеры), включены в рамки существующего изобретения. Предпочтительные соединения - те,которые демонстрируют более желательную биологическую активность. Отделенные, чистые или частично очищенные изомеры и стереоизомеры или рацемические или диастереомерные смеси соединений этого изобретения также включены в рамки существующего изобретения. Очистка и разделение таких материалов могут быть достигнуты стандартными методами, известными в данной области. Существующее изобретение также касается полезных форм соединений, раскрытых авторами, таких как фармацевтически приемлемые соли, ко-преципитаты, метаболиты, гидраты, сольваты и пролекарства всех соединений из примеров. Термин "фармацевтически приемлемая соль" касается относительно нетоксичной аддитивной соли неорганической или органической кислоты и соединения существующего изобретения. Например, см. S.M. Berge, et al. "Pharmaceutical Salts," J. Pharm. Sci. 1977, 66, 1-19. Фармацевтически приемлемые соли включают полученные путем реакции главного соединения, функционирующего как основание, с неорганической или органической кислотой для образования соли, например соли соляной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, камфорсульфоновой кислоты, щавелевой кислоты, малеиновой кислоты, янтарной кислоты и лимонной кислоты. Фармацевтически приемлемые соли также включают те, в которых главное соединение функционирует как кислота и реагирует с соответствующим основанием для образования, например, соли натрия,калия, кальция, магния, аммония и хлорина. Квалифицированные специалисты в данной области далее признают, что кислотные аддитивные соли указанных в формуле соединений могут быть получены путем реакции соединений с соответствующей неорганической или органической кислотой с помощью любого из многих известных методов. Альтернативно, соли щелочных и щелочно-земельных металлов кислотных соединений изобретения получают путем реакции соединений изобретения с соответствующим основанием с помощью многих известных методов. Характерные соли соединений этого изобретения включают обычные нетоксичные соли и соли четвертичного аммония, которые образованы, например, из неорганических или органических кислот или оснований способами, известными в данной области. Например, такие кислотные аддитивные соли включают ацетат, адипат, альгинат, аскорбат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират,цитрат, камфорат, камфорсульфонат, циннамат, циклопентанпропионат, диглюконат, додецилсульфат,этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, хлорид,бромид, йодид, 2-гидроксиэтансульфонат, итаконат, лактат, малеат, манделат, метансульфонат, 2 нафталенсульфонат, никотинат, нитрат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, сульфонат, сульфат, тартрат, тиоцианат, тозилат и ундеканоат. Основные соли включают соли щелочных металлов, такие как соли калия и натрия, соли щелочноземельных металлов, такие как соли кальция и магния, и соли аммония с органическими основаниями,такими как дициклогексиламин и N-метил-D-глюкамин. Кроме того, основные азотсодержащие группы могут быть превращены в четвертичные с помощью таких агентов, как низшие алкилгалиды, такие как метил-, этил-, пропил- или бутилхлориды, бромиды и йодиды; диалкилсульфаты, такие как диметил-,- 11018839 диэтил-, дибутилсульфат или диамилсульфаты, длинноцепочечные галиды, такие как децил-, лаурил-,миристил- и стеарилхлориды, бромиды и йодиды, аралкилгалиды, такие как бензил- и фенэтилбромиды и другие. Сольват с целью этого изобретения представляет собой комплекс растворителя и соединения изобретения в твердом состоянии. Характерные сольваты включали бы, кроме прочих, комплексы соединения изобретения с этанолом или метанолом. Гидраты - определенная форма сольвата, в котором растворитель - вода. Фармацевтические композиции соединений изобретения Это изобретение также касается фармацевтических композиций, содержащих одно или несколько соединений существующего изобретения. Эти композиции могут быть использованы для достижения желательного фармакологического эффекта путем введения пациенту, который нуждается в этом. Пациент для целей этого изобретения является млекопитающим, включая человека, который нуждается в лечении специфического состояния или болезни. Поэтому существующее изобретение включает фармацевтические композиции, которые состоят из фармацевтически приемлемого носителя и фармацевтически эффективного количества соединения или его соли существующего изобретения. Фармацевтически приемлемый носитель - предпочтительно носитель, который относительно нетоксичен и безвреден для пациента при концентрациях, совместимых с эффективной активностью активного компонента таким образом, чтобы любые побочные эффекты, приписываемые носителю, не искажали благоприятные воздействия активного компонента. Фармацевтически эффективное количество соединения предпочтительно представляет собой то количество, которое приводит к результату или оказывает влияние на специфическое состояние, которое подвергается лечению. Соединения существующего изобретения можно вводить с фармацевтически приемлемыми носителями, известными в данной области, используя любые эффективные обычные формы дозирования, включая препараты с немедленным, замедленным и отсроченным высвобождением, перорально, парентерально, местно, назально, офтальмично, оптически, сублингвально, ректально, вагинально и т.п. Для перорального введения соединения могут быть сформулированы в твердые или жидкие препараты, такие как капсулы, пилюли, таблетки, леденцы, пастилки, порошки, растворы, суспензии или эмульсии, и могут быть подготовлены согласно методам, известным в данной области для получения фармацевтических композиций. Твердые дозированные формы могут представлять собой капсулу, которая может быть стандартного желатинового типа с твердой или мягкой оболочкой, содержащую, например, сурфактанты, любриканты и инертные наполнители, такие как лактоза, сахароза, фосфат кальция и кукурузный крахмал. В другом варианте осуществления соединения этого изобретения могут быть таблетированы с обычными таблеточными основаниями, такими как лактоза, сахароза и кукурузный крахмал в комбинации со связывающими веществами, такими как акация, кукурузный крахмал или желатин, дезинтегрирующими агентами, предназначенными для того, чтобы способствовать распаду и растворению таблетки после введения, такими как картофельный крахмал, альгиновая кислота, кукурузный крахмал и гуаровая смола, трагакантовая камедь, акация, любрикантами, предназначенными для улучшения текучести при гранулировании таблеток и для предотвращения прилипания таблеточного материала на поверхность таблеточного пресса и пуансонов, например тальк, стеариновая кислота или магния, кальция или цинка стеарат, красителями, красящими агентами и ароматизирующими агентами, такими как мята, масло гаультерии или ароматизатор "вишня", предназначенными для повышения эстетических качеств таблеток и чтобы сделать их более приемлемыми для пациента. Подходящие вспомогательные вещества для использования в пероральных жидких дозированных формах включают дикальция фосфат и разбавители,такие как вода и спирты, например этанол, бензиловый спирт и полиэтиленспирты, или с добавлением фармацевтически приемлемого сурфактанта, суспендирующего агента или эмульгирующего агента или без них. Различные другие материалы могут присутствовать в качестве оболочек или для модификации иным образом физической формы единицы дозирования. Например, таблетки, пилюли или капсулы могут быть покрыты шеллаком, сахаром или и тем, и другим. Диспергируемые порошки и гранулы подходят для подготовки водной суспензии. Они обеспечивают активный компонент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или несколькими консервантами. Подходящие диспергирующие или смачивающие агенты и суспендирующие агентов иллюстрируются уже упомянутыми выше. Могут также присутствовать дополнительные вспомогательные вещества, например подслащающие, ароматизирующие и красящие агенты,описанные выше. Фармацевтические композиции этого изобретения могут также быть в виде эмульсий масло-в-воде. Масляная фаза может представлять собой растительное масло, такое как жидкий парафин или смесь растительных масел. Подходящие эмульгирующие агенты могут представлять собой (1) природные смолы,такие как смола акации и трагакантовая камедь, (2) природные фосфатиды, такие как соевые бобы и лецитин, (3) эстеры или частичные эстеры, полученные из жирных кислот и гекситол ангидридов, например сорбитан моноолеат, (4) продукты конденсации указанных частичных эстеров с этиленоксидом, например полиоксиэтиленсорбитан моноолеат. Эмульсии могут также содержать подслащивающие и аро- 12018839 матизирующие агенты. Масляные суспензии могут быть сформулированы путем суспендирования активного компонента в растительном масле, таком как, например, арахисовое масло, оливковое масло, сезамовое масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, такой как, например, воск, твердый парафин или цетиловый спирт. Суспензии могут также содержать один или несколько консервантов, например этил или N-пропил п-гидроксибензоат; один или несколько красящих агентов; один или несколько ароматических агентов и один или несколько подслащивающих агентов, таких как сахароза или сахарин. Сиропы и эликсиры могут быть сформулированы с помощью подслащивающих агентов, таких как,например, глицерин, пропиленгликоль, сорбит или сахароза. Такие формулировки могут также содержать успокоительное средство и консервант, такой как метил- и пропилпарабены и ароматизирующие и красящие агенты. Соединения этого изобретения можно также вводить парентерально, то есть подкожно, внутривенно, интраокулярно, интрасиновиально, внутримышечно или интраперитонеально, в виде инъекционных дозировок соединения в предпочтительно физиологически приемлемом разбавителе с фармацевтическим носителем, который может представлять собой стерильную жидкость или смесь жидкостей, таких как вода, физиологический раствор, водные растворы декстрозы и родственных сахаров, спирт, такой как этанол, изопропиловый спирт или гексадециловый спирт, гликоли, такие как пропиленгликоль или полиэтиленгликоль, глицеринкетали, такие как 2,2-диметил-1,1-диоксолан-4-метанол, эстеры, такие как поли(этиленгликоль) 400, масло, жирная кислота, эстер жирной кислоты или глицерид жирной кислоты,или ацетилированный глицерид жирной кислоты с добавлением фармацевтически приемлемого сурфактанта, такого как мыло или детергент, суспендирующего агента, такого как пектин, карбомеры, метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза, или эмульгирующий агент и другие фармацевтические адьюванты или без них. Примеры масел, которые могут использоваться в парентеральных формулировках этого изобретения, включают таковые из нефти, животного, растительного или синтетического происхождения, например арахисовое масло, соевое масло, сезамовое масло, хлопковое масло, кукурузное масло, оливковое масло, вазелин и минеральное масло. Подходящие жирные кислоты включают олеиновую кислоту, стеариновую кислоту, изостеариновую кислоту и миристиновую кислоту. Подходящие эстеры жирной кислоты включают, например, этилолеат и изопропилмиристат. Подходящие мыла включают соли жирной кислоты и щелочного металла, аммония и триэтаноламина и подходящие детергенты включают катионоактивные детергенты, например диметилдиалкиламмония галиды, алкилпиридиния галиды и алкиламинацетаты; анионные детергенты, например алкил-, арил- и олефинсульфонаты, алкил-, олефин-, эстер- и моноглицеридсульфаты и сульфосукцинаты; неионные детергенты, например оксиды жирных аминов,алканоламиды жирных кислот, и поли(оксиэтилен-оксипропилен)ы или сополимеры этиленоксида или пропиленоксида; и амфотерные детергенты, например алкил-бета-аминопропионаты и четвертичные аммониевые соли 2-алкилимидазолина, а также смеси. Парентеральные композиции этого изобретения будут типично содержать приблизительно от 0,5 приблизительно до 25 вес.% активного компонента в растворе. Консерванты и буферы могут также полезно использоваться. Чтобы минимизировать или устранить раздражение в участке инъекции, такие композиции могут содержать неионный сурфактант, имеющий гидрофильно-липофильное равновесие(HLB) предпочтительно от приблизительно 12 до приблизительно 17. Количество сурфактанта в такой формулировке предпочтительно колеблется приблизительно от 5 приблизительно до 15 вес.%. Сурфактант может быть одним компонентом, имеющим вышеупомянутое HLB, или может представлять смесь двух или больше компонентов, имеющих желательное HLB. Пример сурфактантов, используемых в парентеральных формулировках, включает класс эстеров полиэтиленсорбитана и жирной кислоты, например сорбитанмоноолеат и высокомолекулярные аддукты этиленооксида с гидрофобным основанием, сформированные конденсацией пропиленоксида с пропиленгликолем. Фармацевтические композиции могут быть в виде стерильных инъекционных водных суспензий. Такие суспензии могут быть сформулированы согласно известным методам с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, таких как, например, натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий альгинат, поливинилпирролидон, трагакантовая камедь и акациевая смола; диспергирующих или смачивающих агентов, которые могут представлять собой природный фосфатид, такой как лецитин, продукт конденсации алкиленоксида с жирной кислотой, например полиоксиэтиленстеарат, продукт конденсации этиленоксида с длинноцепочечным алифатическим спиртом, например гептадека-этиленоксицетанол, продукт конденсации этиленоксида с частичным эстером, полученным из жирной кислоты и гекситола, такой как полиоксиэтиленсорбитолмоноолеат, или продукт конденсации этиленоксида с частичным эстером, полученным из жирной кислоты и гекситолангидрида, например полиоксиэтиленсорбитанмоноолеат. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе. Разба- 13018839 вители и растворители, которые могут использоваться, включают, например, воду, раствор Рингера, изотонические растворы натрия хлорида и изотонические растворы глюкозы. Кроме того, стерильные фиксированные масла традиционно используются в качестве суспендирующих сред или растворителей. С этой целью может использоваться любое мягкое, жирное масло, включая синтетические моно- или диглицериды. Кроме того, в подготовке инъекций могут использоваться жирные кислоты, такие как олеиновая кислота. Композицию изобретения можно также вводить в виде суппозиториев для ректального введения активного вещества. Эти композиции могут быть подготовлены путем смешивания активного вещества с подходящим нераздражающим вспомогательным веществом, которое является твердым при обычных температурах, но становится жидким при ректальной температуре и будет поэтому таять в прямой кишке для высвобождения активного вещества. Такие материалы включают, например, масло какао и полиэтиленгликоль. Другая формулировка, используемая в методах существующего изобретения, использует устройства трансдермальной доставки ("пластыри"). Такие трансдермальные пластыри могут использоваться для обеспечения непрерывной или прерывистой инфузии соединений существующего изобретения в контролируемом количестве. Конструкция и использование трансдермальных пластырей для доставки фармацевтических агентов известны в данной области (см., например, патент США 5023252, опубликованный 11 июня 1991 г., включенный авторами путем ссылки). Такие пластыри могут быть сконструированы для непрерывной, периодической доставки или доставки по требованию фармацевтических агентов. Формулировки с контролируемым высвобождением для парентерального введения включают липосомальную, полимерную микросферу и полимерные гелевые формулировки, которые известны в данной области. Может быть желательно или необходимо вводить фармацевтическую композицию пациенту через механическое устройство доставки. Конструкция и использование механических устройств доставки для доставки фармацевтических агентов известны в данной области. Прямые методы для, например, введения активного вещества непосредственно в головной мозг обычно вовлекают размещение катетера для доставки препарата в систему желудочков пациента, чтобы обойти гемоэнцефалический барьер. Одна такая имплантируемая система доставки, используемая для транспорта агентов в определенные анатомические участки организма, описана в патенте США 5011472, опубликованном 30 апреля 1991 г. Композиции изобретения могут также содержать другие обычные фармацевтически приемлемые компоненты, в общем обозначаемые как носители или разбавители, по мере необходимости или по желанию. Могут использоваться обычные процедуры для подготовки таких композиций в соответствующих дозируемых формах. Такие компоненты и процедуры включают описанные в следующих ссылках,каждая из которых включена авторами путем ссылки: Powell, M.F. et al., "Compendium of Excipients forand Their Use in Injectable Products" PDA Journal of Pharmaceutical ScienceTechnology 1997, 51(4), 166171. Обычно используемые фармацевтические компоненты, которые могут использоваться как соответствующие для формулировки композиции для ее намеченного пути введения, включают подкисляющие агенты (примеры включают, кроме прочих, уксусную кислоту, лимонную кислоту,фумаровую кислоту, соляную кислоту, азотную кислоту); подщелачивающие агенты (примеры включают, кроме прочих, раствор аммония, карбонат аммония, диэтаноламин, моноэтаноламин, гидрооксид калия, борат натрия, карбонат натрия, гидроксид натрия, триэтаноламин, троламин); адсорбенты (примеры включают, кроме прочих, порошкообразную целлюлозу и активированный древесный уголь); аэрозольные пропелленты (примеры включают, кроме прочих, углекислый газ, CCl2F2, F2ClC-CClF2 и CClF3),агенты для вытеснения воздуха (примеры включают, кроме прочих, азот и аргон); противогрибковые консерванты (примеры включают, кроме прочих, бензойную кислоту, бутилпарабен, этилпарабен, метилпарабен, пропилпарабен, бензоат натрия); антибактериальные консерванты (примеры включают, кроме прочих, бензалкония хлорид, бензэтония хлорид, спирт бензиловый, цетилпиридиния хлорид, хлоробутанол, фенол, фенилэтиловый спирт,фенилмеркурия нитрат и тимерозал); антиоксиданты (примеры включают, кроме прочих, аскорбиновую кислоту, аскорбил пальмитат,бутилированный гидроксианизол, бутилированный гидрокситолуол, гипофосфорную кислоту, монотиоглицерин, пропилгаллат, аскорбат натрия, бисульфит натрия, сульфоксилат формальдегид натрия, метабисульфит натрия); связывающие материалы (примеры включают, кроме прочих, блок-сополимеры, природный и синтетический каучук, полиакрилаты, полиуретаны, силиконы, полисилоксаны и сополимеры бутадиенсти- 14018839 рола); буферные агенты (примеры включают, кроме прочих, калия метафосфат, дикалия фосфат, натрия ацетат, безводный натрия цитрат и дигидрат натрия цитрата),агент-N-носители (примеры включают, кроме прочих, акациевый сироп, ароматический сироп, ароматический эликсир, вишневый сироп, сироп какао, апельсиновый сироп, сироп, кукурузное масло, минеральное масло, арахисовое масло, сезамовое масло, бактериостатический натрия хлорид для инъекций и бактериостатическую воду для инъекции), хелатирующие агенты (примеры включают, кроме прочих,динатрия эдетат и эдетовую кислоту), красители (примеры включают, кроме прочих, FDC Красный 3, FDC Красный 20, FDC Желтый 6, FDC Синий 2, DC Зеленый 5, DC Оранжевый 5, DC Красный 8, карамель и железа оксид красный); просветляющие агенты (примеры включают, кроме прочих, бентонит); эмульгирующие агенты (примеры включают, кроме прочих, акацию, цетомакрогол, цетиловый спирт, глицерилмоностеарат, лецитин, сорбитанмоноолеат, полиоксиэтилен 50 моностеарат); инкапсулирующие агенты (примеры включают, кроме прочих, желатин и целлюлозы ацетат фталат), ароматизаторы (примеры включают, кроме прочих, анисовое масло, коричное масло, какао, ментол,апельсиновое масло, масло мяты и ванилин); гигроскопические вещества (примеры включают, кроме прочих, глицерин, пропиленгликоль и сорбит); отмучивающие агенты (примеры включают, кроме прочих, минеральное масло и глицерин); масла (примеры включают, кроме прочих, арахисовое масло, минеральное масло, оливковое масло,арахисовое масло, сезамовое масло и растительное масло); основания мазей (примеры включают, кроме прочих, ланолин, гидрофильную мазь, полиэтиленгликолевую мазь, ванилин, мягкий гидрофильный ванилин, белую мазь, желтую мазь и мазь с розовой водой); усиливающие проницаемость агенты (трансдермальная доставка) (примеры включают, кроме прочих, моногидрокси- или полигидроксиспирты, моно- или поливалентные спирты, насыщенные или ненасыщенные жирные спирты, насыщенные или ненасыщенные жирные эстеры, насыщенные или ненасыщенные дикарбоновые кислоты, эфирные масла, фосфатидил производные, цефалин, терпены, амиды,эфиры, кетоны и мочевины), пластификаторы (примеры включают, кроме прочих, диэтилфталат и глицерин); растворители (примеры включают, кроме прочих, этанол, кукурузное масло, хлопковое масло, глицерин, изопропиловый спирт, минеральное масло, олеиновую кислоту, арахисовое масло, очищенную воду, воду для инъекций, стерильную воду для инъекций и стерильную воду для ирригаций); усиливающие жесткость агенты (примеры включают, кроме прочих, цетиловый спирт, цетиловые эстеры, воск, микрокристаллический воск, парафин, стеариловый спирт, белый воск и желтый воск); основания суппозиториев (примеры включают, кроме прочих, масло какао и полиэтиленгликоли(смеси; сурфактанты (примеры включают, кроме прочих, бензалкония хлорид, ноноксинол 10, октоксинол 9, полисорбат 80, натрия лаурилсульфат и сорбитанмонопальмитат); суспендирующие агенты (примеры включают, кроме прочих, агар, бентонит, карбомеры, натрий карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, каолин, метилцеллюлозу, трагакант и вигум); подслащивающие агенты (примеры включают, кроме прочих, аспартам, декстрозу, глицерин, маннит, пропиленгликоль, натрий сахарин, сорбит и сахарозу); таблеточные антиадгезивные вещества (примеры включают, кроме прочих, стеарат магния и тальк); таблеточные связывающие вещества (примеры включают, кроме прочих, акацию, альгиновую кислоту, натрий карбоксиметилцеллюлозу, компрессируемый сахар, этилцеллюлозу, желатин, жидкую глюкозу, метилцеллюлозу, несшитый поливинилпирролидон и крахмал прежелатинизированный); разбавители таблеток и капсул (примеры включают, кроме прочих, двухосновный кальция фосфат,каолин, лактозу, маннит, микрокристаллическую целлюлозу, порошкообразную целлюлозу, осажденный карбонат кальция, карбонат натрия, фосфат натрия, сорбит и крахмал); агенты для таблеточной оболочки (примеры включают, кроме прочих, жидкую глюкозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу, этилцеллюлозу, ацетат фталат целлюлозы и шеллак); вспомогательные вещества для прямого прессования таблеток (примеры включают, кроме прочих,двухосновный кальция фосфат); таблеточные дезинтегранты (примеры включают, кроме прочих, альгиновую кислоту, кальций карбоксиметилцеллюлозу, микрокристаллическую целлюлозу, полакриллин калия, поперечно сшитый поливинилпирролидон, натрия альгинат, натрия крахмалгликолят и крахмал); таблеточные скользящие вещества (примеры включают, кроме прочих, коллоидный кремния диоксид, кукурузный крахмал и тальк); таблеточные любриканты (примеры включают, кроме прочих, стеарат кальция, стеарат магния, ми- 15018839 неральное масло, стеариновую кислоту и цинка стеарат); пигменты таблеток/капсул (примеры включают, кроме прочих, диоксид титана); таблеточные полирующие агенты (примеры включают, кроме прочих, карнаубский воск и белый воск); загустители (примеры включают, кроме прочих, пчелиный воск, цетиловый спирт и парафин); агенты тоничности (примеры включают, кроме прочих, декстрозу и натрия хлорид); увеличивающие вязкость агенты (примеры включают, кроме прочих, альгиновую кислоту, бентонит, карбомеры, натрий карбоксиметилцеллюлозу, метилцеллюлозу, поливинилпирролидон, альгинат натрия и трагакант); смачивающие агенты (примеры включают, кроме прочих, гептадекаэтиленоксицетанол, лецитин,сорбитмоноолеат, полиоксиэтиленсорбитмоноолеат и полиоксиэтиленстеарат). Фармацевтические композиции согласно существующему изобретению могут быть иллюстрированы следующим образом. Стерильный в/в раствор: 5 мг/мл раствор желательного соединения этого изобретения можно приготовить с использованием стерильной инъекционной воды, и, в случае необходимости, проводят коррекцию рН. Раствор разводят для введения до 1-2 мг/мл с помощью стерильной 5% декстрозы и вводят как в/в инфузию приблизительно в течение 60 мин. Лиофилизированный порошок для в/в введения: может быть приготовлен стерильный препарат с использованием (i) 100-1000 мг желательного соединения этого изобретения в виде лиофилизированного порошка, (ii) 32-327 мг/мл цитрата натрия и (iii) 300-3000 мг Декстрана 40. Формулировку растворяют с помощью стерильного, инъекционного физиологического раствора или 5% декстрозы до концентрации 10-20 мг/мл, которую дополнительно разбавляют с помощью физиологического раствора или 5% декстрозы до 0,2-0,4 мг/мл, и вводят или в/в болюсом или в/в инфузиями в течение 15-60 мин. Внутримышечная суспензия: для внутримышечной инъекции могут быть приготовлены следующий раствор или суспензия: 50 мг/мл желательного, водонерастворимого соединения этого изобретения; 5 мг/мл натрий карбоксиметилцеллюлоза; 4 мг/мл ТВИН 80; 9 мг/мл натрия хлорид; 9 мг/мл бензиловый спирт. Капсулы с твердой оболочкой: большое количество капсул готовят путем заполнения в стандартные двойные твердые желатиновые капсулы по 100 мг порошкообразного активного компонента, 150 мг лактозы, 50 мг целлюлозы и 6 мг стеарата магния. Мягкие желатиновые капсулы: готовят смесь активного компонента в перевариваемом масле, таком как соевое масло, хлопковое масло или оливковое масло, и вводят с помощью насоса положительного вытеснения в размягченный желатин для образования мягких желатиновых капсул, содержащих 100 мг активного компонента. Капсулы промывают и высушивают. Активный компонент может быть растворен в смеси полиэтиленгликоля, глицерина и сорбита для получения смешивающейся с водой смеси препарата. Таблетки: большое количество таблеток готовят в соответствии с обычными процедурами так, чтобы единица дозировки составила 100 мг активного компонента, 0,2 мг коллоидного кремния диоксида, 5 мг стеарата магния, 275 мг микрокристаллической целлюлозы, 11 мг крахмала и 98,8 мг лактозы. Могут наноситься соответствующие водные и неводные покрытия для увеличения вкусовой привлекательности,улучшения элегантности и стабильности или задержки всасывания. Таблетки/капсулы с немедленным высвобождением: они представляют собой твердые пероральные дозированные формы, полученные с помощью стандартных и новых процессов. Эти единицы принимают перорально без воды для немедленного высвобождения и доставки препарата. Активный компонент смешивают в жидкости, содержащей компонент, такой как сахар, желатин, пектин и подсластители. Эти жидкости отверждают в твердые таблетки или каплеты путем высушивания вымораживанием и методами экстракции из твердого состояния. Соединения препарата могут быть сжаты с вязкоупругим и термоэластичным сахаром и полимерами или шипучими компонентами для получения пористых матриц,предназначенных для немедленного высвобождения без необходимости запивать водой. Способ лечения гиперпролиферативных нарушений. Существующее изобретение касается способов для использования соединений существующего изобретения и их композиций для лечения гиперпролиферативных нарушений млекопитающих. Соединения могут быть использованы для ингибирования, блокирования, уменьшения, снижения и т.д., пролиферации клеток и/или деления клеток и/или продуцирования апоптоза. Этот метод включает введение млекопитающему, которое в этом нуждается, включая человека, количества соединения этого изобретения или его фармацевтически приемлемой соли, изомера, полиморфа, метаболита, гидрата, сольвата или эстера и т.д., которое является эффективным для лечения нарушения. Гиперпролиферативные нарушения включают, кроме прочих, например, псориаз, келоиды и другие гиперплазии, поражающие кожу, доброкачественную гиперплазию простаты (ВРН), солидные опухоли, такие как раковые образования молочной- 16018839 железы, дыхательных путей, головного мозга, репродуктивных органов, пищеварительного тракта, мочевых путей, глаза, печени, кожи, головы и шеи, щитовидной железы, паращитовидной железы и их отдаленные метастазы. Такие нарушения также включают лимфомы, саркомы и лейкемии. Примеры рака молочной железы включают, кроме прочих, инвазивную дуктальную карциному, инвазивную лобулярную карциному, дуктальную карциному in situ и лобулярную карциному in situ. Примеры раковых образований дыхательных путей включают, кроме прочих, мелкоклеточную и"немелкоклеточную" карциному легкого, а также аденому бронха и плевропульмонарную бластому. Примеры раковых образований головного мозга включают, кроме прочих, глиому ствола головного мозга и гипофтальмичную глиому, астроцитому мозжечка и мозга, медуллобластому, эпендимому, а также нейроэктодермальную и шишковидную опухоль. Опухоли мужских репродуктивных органов включают, кроме прочих, рак простаты и яичка. Опухоли женских репродуктивных органов включают, кроме прочих, рак эндометрия, шейки матки, яичника,влагалища и вульвы, а также саркому матки. Опухоли пищеварительного тракта включают, кроме прочих, анальный рак, рак толстой кишки, колоректальный рак, рак пищевода, желчного пузыря, желудка, поджелудочной железы, ректальный рак,рак тонкой кишки и слюнной железы. Опухоли мочевых путей включают, кроме прочих, рак мочевого пузыря, рак мужского полового члена, рак почки, почечной лоханки, мочеточника, уретры и человеческий папиллярный почечный рак. Глазные раковые образования включают, кроме прочих, внутриглазную меланому и ретинобластому. Примеры раковых образований печени включают, кроме прочих, гепатоцеллюлярную карциному(карциному клеток печени с фиброламеллярным вариантом или без него), холангиокарциному (внутрипеченочная карцинома желчных протоков) и смешанную гепатоцеллюлярную холангиокарциному. Раковые образования кожи включают, кроме прочих, чешуйчатоклеточную карциному, саркому Капоши, злокачественную меланому, рак кожи клеток Меркеля и немеланомный рак кожи. Раковые образования головы и шеи включают, кроме прочих, гортанный, гипофаренгиальный, носоглоточный, орофарингеальный рак, рак губ и ротовой полости и чешуйчатоклеточный. Лимфомы включают, кроме прочих, связанную со СПИДом лимфому, неходжкинскую лимфому, кожную Тклеточную лимфому, лимфому Burkitt, болезнь Ходжкина и лимфому центральной нервной системы. Саркомы включают, кроме прочих, саркому мягких тканей, остеосаркому, злокачественную волокнистую гистиоцитому, лимфосаркому и рабдомиосаркому. Лейкемии включают, кроме прочих, острую миелоидную лейкемию, острую лимфообластную лейкемию, хроническую лимфоцитарную лейкемию, хроническую миелогенную лейкемию и волосатоклеточную лейкемию. Эти нарушения были хорошо охарактеризованы у людей, но также и существуют с подобной этиологией у других млекопитающих, и могут лечиться путем введения фармацевтических композиций существующего изобретения. Термин "лечение" или "лечить", заявленный везде по этому документу, использован традиционно,например ведение пациента или уход за пациентом с целью борьбы с состоянием, облегчения, снижения,освобождения, улучшения состояния и т.д., болезни или нарушения, такого как карцинома. Способы лечения киназных нарушений. Существующее изобретение также предлагает способы для лечения нарушений, связанных с аберрантной киназной активностью (такой как тирозинкиназная активность), включая фосфотидилинозитол 3-киназу. Эффективное количество соединений существующего изобретения может использоваться для лечения нарушений, включая ангиогенные нарушения, такие как рак; воспалительные нарушения (включая,кроме прочих, хроническое обструктивное легочное расстройство (COPD, аутоиммунные нарушения,сердечно-сосудистые нарушения (включая, кроме прочих, тромбоз, легочную гипертензию, сердечную гипертрофию, атеросклероз или сердечную недостаточность), нейродегенеративные нарушения, метаболические нарушения, ноцицептивные нарушения, глазные нарушения, легочные нарушения или почечные нарушения. Тем не менее, такие раковые образования и другие болезни можно лечить с помощью соединений существующего изобретения, независимо от механизма действия и/или взаимосвязи между киназой и нарушением. Фраза "аберрантная киназная активность или "аберрантная тирозинкиназная активность" включает любую патологичную экспрессию или активность гена, кодирующего киназу, или полипептида, который он кодирует. Примеры такой аберрантной активности включают, кроме прочих, сверхэкспрессию гена или полипептида; генную амплификацию; мутации, которые производят конститутивно-активную или гиперактивную киназную активность; генные мутации, делеции, замены, дополнения и т.д. Существующее изобретение также предусматривает способы ингибирования активности киназы,особенно фосфотидилинозитол-3-киназы, включая введение эффективного количества соединения существующего изобретения, включая его соли, полиморфы, метаболиты, гидраты, сольваты, пролекарства(например, эстеры) и его диастереоизомерные формы. Активность киназы может быть ингибирована в- 17018839 клетках (например, in vitro) или в клетках млекопитающего субъекта, особенно человеческого пациента,который нуждается в лечении. Способы лечения ангиогенного нарушения. Существующее изобретение также предлагает способы лечения нарушений и болезней, связанных с чрезмерным и/или патологичным ангиогенезом. Несоответствующая и смещенная экспрессия ангиогенеза может быть вредной для организма. Многие патологические состояния связаны с ростом посторонних кровеносных сосудов. Они включают, например, диабетическую ретинопатию, ишемическую окклюзию вен сетчатки и ювенильную ретинопатию (Aiello et al. New Engl. J. Med. 1994, 331, 1480; Peer et al. Lab. Invest. 1995, 72, 638), возрастную макулярную дегенерацию (AMD; см., Lopez et al. Invest. Opththalmol. Vis. Sci. 1996, 37, 855), неоваскулярную глаукому, псориаз, ретролентальные фиброплазии, ангиофиброму, воспаление, ревматоидный артрит (РА), рестеноз, рестеноз в стенте, рестеноз сосудистого трансплантата и т.д. Кроме того, увеличенное кровоснабжение, связанное со злокачественной и неопластической тканью, способствует росту, что приводит к быстрому распространению опухоли и метастазам. Кроме того, рост новых кровеносных и лимфатических сосудов в опухоли обеспечивает запасной выход для клеток-изменниц, способствуя метастазам и последующему распространению рака. Таким образом, соединения существующего изобретения могут быть использованы для лечения и/или профилактики любого из вышеупомянутых нарушений ангиогенеза, например, путем ингибирования и/или уменьшения формирования кровеносных сосудов; путем ингибирования, блокирования, уменьшения, снижения и т.д. пролиферации эндотелиальных клеток или других типов, вовлеченных в ангиогенез, также вызывая смерть клеток или апоптоз таких типов клеток. Доза и введение. На основании стандартных лабораторных методов, известных для оценки соединений, полезных для лечения гиперпролиферативных нарушений и ангиогенных нарушений, с помощью стандартных тестов на токсичность и стандартных фармакологических испытаний для определения лечения состояний,идентифицированных выше у млекопитающих, и путем сравнения этих результатов с результатами известных лекарств, которые используются для лечения этих состояний, может быть легко определена эффективная дозировка соединений этого изобретения для лечения каждого желательного показания. Количество активного компонента, которое будет вводиться при лечении одного из этих состояний, может широко варьировать согласно таким рассматриваемым факторам, как конкретное соединение и используемая единица дозировки, способ введения, период лечения, возраст и пол пациента, подвергающегося лечению, и природы и степени состояния, подвергающегося лечению. Общее количество активного компонента, которое будет вводиться, вообще колеблется приблизительно от 0,001 до приблизительно 200 мг/кг массы тела в сутки и предпочтительно приблизительно от 0,01 до приблизительно 20 мг/кг массы тела в сутки. Клинически полезные схемы дозирования будут колебаться от дозирования один-три раза в сутки до дозирования один раз каждые четыре недели. Кроме того, "перерывы в приеме препарата", в течение которых пациент не принимает препарат на протяжении определенного промежутка времени, могут быть выгодными для общего равновесия между фармакологическим эффектом и переносимостью. Единица дозировки может содержать приблизительно от 0,5 приблизительно до 1500 мг активного компонента и может вводиться один или несколько раз в сутки или меньше одного раза в сутки. Средняя суточная дозировка для введения путем инъекции, включая внутривенные, внутримышечные, подкожные и парентеральные инъекции, и использование методик инфузии предпочтительно будет составлять от 0,01 до 200 мг/кг общей массы тела. Режим среднего суточного ректального дозирования предпочтительно будет составлять от 0,01 до 200 мг/кг общей массы тела. Режим среднего суточного влагалищного дозирования предпочтительно будет составлять от 0,01 до 200 мг/кг общей массы тела. Режим среднего суточного местного дозирования предпочтительно будет составлять от 0,1 до 200 мг, которые применяют один-четыре раза в сутки. Трансдермальная концентрация будет предпочтительно такой, которая необходима для поддержания суточной дозы от 0,01 до 200 мг/кг. Режим среднего суточного дозирования ингаляцией предпочтительно будет составлять от 0,01 до 100 мг/кг общей массы тела. Конечно, определенный начальный и продолжающийся режим дозирования для каждого пациента будут варьировать в зависимости от природы и тяжести состояния, определенного лечащим диагностом,активности определенного используемого соединения, возраста и общего состояния пациента, времени введения, пути введения, скорости выведения препарата из организма, комбинаций веществ и т.п. Желательный способ лечения и количество доз соединения существующего изобретения или его фармацевтически приемлемой соли либо эстера или их комбинации могут быть установлены квалифицированными специалистами в данной области, использующими обычные тесты лечения. Комбинированные терапии. Соединения этого изобретения можно вводить в виде отдельного фармацевтического агента или в комбинации с одним или несколькими другими фармацевтическими агентами, если комбинация не вызывает недопустимых отрицательных эффектов. Например, соединения этого изобретения могут быть комбинированы с известными антигиперпролиферативными, антивоспалительными, болеутоляющими,- 18018839 иммунорегуляторными, диуретичними, антиаритмичными, антигиперхолеристенимичными, антидислипидемичными, антидиабетическими или противовирусными средствами и т.п., а также с их смесями и комбинациями. Дополнительный фармацевтический агент может представлять собой алдеслейкин, алендроновую кислоту, альфаферон, алитретиноин, алопуринол, алоприм, алокси, альтретамин, аминоглутетимид, амифостин, амрубицин, амсакрин, анастрозол, анзмет, аранесп, арглабин, триоксид мышьяка, аромасин, 5 азацитидин, имуран, БЦЖ или tice БЦЖ, бестатин, бетаметазона ацетат, бетаметазона фосфат натрия,бексаротен, блеомицина сульфат, броксуридин, бортезомиб, бусульфан, кальцитонин, кампат, капецитабин, карбоплатин, казодекс, цефезон, целмолейкин, церубидин, хлорамбуцил, цисплатин, кладрибин,кладрибин, клодроновая кислота, циклофосфамид, цитарабин, дакарбазин, дактиномицин, ДауноКсом,декадрон, декадрона фосфат, делестроген, денилейкин дифтитокс, депо-медрол, деслорелин, дексразоксан, диэтилстилбестрол, дифлюкан, доцетаксель, доксифторидин, доксорубицин, дронабинол, DW166HC, элигард, элитек, элленце, эменд, эпирубицин, эпоетин альфа, эпоген, эптаплатин, эргамизол, эстраке, эстрадиол, эстрамустин фосфат натрия, этинилэстрадиол, этиол, этидроновая кислота, этопофос,этопозид, фадрозол, фарстон, филграстим, финастерид, флиграстим, флоксуридин, флуконазол, флударабин, 5-фтордеоксиуридин монофосфат, 5-фтороурацил (5-FU), фтороксиместерон, флутамид, форместан,фостеабин, фотемустин, фульвестрант, гаммагард, гемцитабин, гемтузумаб, глеевек, глиадел, госерелин,гранисетрон HCl, гистрелин, гикамтин, гидрокортон, эритро-гидроксинониладенин, гидроксимочевину,ибритумомаб тиуксетан, идарубицин, ифосфамид, интерферон альфа, интерферон-альфа-2, интерферональфа-2 А, интерферон-альфа-2 В, интерферон-альфа-n1, интерферон-альфа-n3, интерферон бета, интерферон гамма-1 а, интерлейкин-2, интрон А, иресса, иринотекан, китрил, лентинан сульфат, летрозол, лейковорин, лейпролид, лейпролид ацетат, левамизол, кальциевую соль левофолиевой кислоты, левотроид,левоксил, ломустин, лонидамин, маринол, мехлоретамин, мекобаламин, медроксипрогистерона ацетат,мегистрол ацетат, мелфалан, менест, 6-меркаптопурин, Месну, метотрексат, метвикс, милтефосин, миноциклин, митомицин С, митотан, митоксантрон, модренал, миоцет, недаплатин, нойласту, ноймегу, нойпоген, нилутамид, нолвадекс, NSC-631570, ОСТ-43, остреотид, ондансетрон HCl, орапред, оксалиплатин,паклитаксел, педиапред, пегаспаргаз, пегасис, пентостатин, пицибанил, пилокарпин HCl, пирарубицин,пликамицин, натрия порфимер, преднимустин, преднизолон, преднизон, премарин, прокарбазин, прокрит, ралтитрексед, ребиф, рений-186 этидронат, ритуксимаб, роферон-А, ромуртид, салаген, сандостатин, сарграмостим, семустин, сизофиран, собузоксан, солу-медрол, спарфозовую кислоту, терапию стволовыми клетками, стрептозоцин, стронций-89 хлорид, синтроид, тамоксифен, тамсулозин, тасонермин,тастолактон, таксотеру, тецелейкин, темозоломид, тенипосид, тестостерона пропионат, тестред, тиогуанин, тиотепу, тиротропин, тилудроновую кислоту, топотекан, торемифен, тоситумомаб, трастузумаб,треосульфан, третиноин, трексалл, триметилмеламин, триметрексат, трипторелин ацетат, трипторелин памоат, UFT, уридин, валрубицин, веснаринон, винбластин, винкристин, виндезин, винорелбин, вирулицин, зинегард, зиностатин, стималамер, зофран, ABI-007, аколбифен, актиммун, аффинитак, аминоптерин, арзоксифен, азоприснил, атаместан, атрасентан, BAY43-9006 (сорафениб), авастин, CCI-779, CDC501, целебрекс, цетуксимаб, криснатол, ципротерона ацетат, децитабин, DN-101, доксорубицин-МТС,dSLIM, дутастерид, едотекарин, эфлорнитин, эксатекан, фенретинид, гистамина дигидрохлорид, гистрелиновый гидрогель, гольмий 166 DOTMP, ибадроновую кислоту, интерферон гамма, интрон-PEG, иксабепилон, гемоцианин, L-651582, ланреотид, лазофоксифен, либру, лонафарниб, мипроксифен, минодронат, MS 209, липосомал МТР-РЕ, МХ-6, нафарелин, неморубицин, неовастат, нолатрексед, облимерсен,онко-TCS, осидем, паклитаксель полиглутамат, памидронат динатрий, PN-401, QS-21, квазепам, R-1549,ралоксифен, ранпирнас, 13 цис-ретиноевую кислоту, сатраплатин, сеокальцитол, Т-138067, тарцеву, таксопрексин, тимосин альфа 1, тиазофурин, типифарниб, тирапазамин, TLK-286, торемифен, TransMID107R, валсподар, вапреотид, ваталаниб, ветрепорфин, винфлунин, Z-100, золедроновую кислоту или их комбинации. Дополнительный фармацевтический агент может также представлять собой гемцитабин, паклитаксель, цисплатин, карбоплатин, бутират натрия, 5-FU, доксирубицин, тамоксифен, этопозид, трастумазаб,гефитиниб, интрон А, рапамицин, 17-AAG, U0126, инсулин или производное инсулина, лиганд PPAR,препарат сульфонилмочевины, ингибитор -гликозидазы, бигуанид, ингибитор РТР-1 В, ингибитор DPPIV, ингибитор 11-бета-HSD, GLP-1, производное GLP-1, GIP, производное GIP, PACAP, производное РАСАР, секретин или производное секретина. Дополнительные антигиперпролиферативные агенты, которые могут быть добавлены в композицию, включают, кроме прочих, соединения, перечисленные в режимах противораковой химиотерапии в 11-м изд. Merck Index, (1996), который включен авторами путем ссылки, такие как аспарагиназа, блеомицин, карбоплатин, кармустин, хлорамбуцил, цисплатин, коласпаза, циклофосфамид, цитарабин, дакарбазин, дактиномицин, даунорубицин, доксорубицин (адриамицин), эпирубицин, этопозид, 5 фтороурацил, гексаметилмеламин, гидроксимочевина, ифосфамид, иринотекан, лейковорин, ломустин,мехлоретамин, 6-меркаптопурин, месну, метотрексат, митомицин С, митоксантрон, преднизолон, преднизон, прокарбазин, ралоксифен, стрептозоцин, тамоксифен, тиогуанин, топотекан, винбластин, винкристин и виндезин.- 19018839 Другие антигиперпролиферативные агенты, подходящие для использования с композицией изобретения, включают, кроме прочих, такие соединения, которые признаны для использования в лечении неопластических болезней в Goodman and Gilman's The Pharmacological Basis of Therapeutics (9-е изд.), редактор Molinoff et al., опубл. McGraw-Hill, с. 1225-1287, (1996), который включен авторами путем ссылки, такие как аминоглутетимид, L-аспарагиназа, имуран, 5-азацитидин кладрибин, бусульфан, диэтилстилбестрол, 2',2'-дифтордезоксицитидин, доцетаксель, эритрогидроксинонил аденин, этинилэстрадиол,5-фтордезоксиуридин, 5-фтордезоксиуридина монофосфат, флударабина фосфат, фтороксиместерон,флутамид, гидроксипрогестерона капроат, идарубицин, интерферон, медоксипрогестерона ацетат, мегестрола ацетат, мелфалан, митотан, паклитаксель, пентостатин, N-фосфонацетил-L-аспартат (PALA), пликамицин, семустин, тенипозид, пропионат тестостерона, тиотепа, триметилмеламин, уридин и винорелбин. Другие антигиперпролиферативные агенты, подходящие для использования с композицией изобретения, включают, кроме прочих, другие антираковые агенты, такие как эпотилон и его производные,иринотекан, ралоксифен и топотекан. Вообще, использование цитотоксических и/или цитостатических агентов в комбинации с соединением или комбинацией существующего изобретения будет служить для:(1) получения лучшей эффективности в снижении роста опухоли или даже устранения опухоли по сравнению с введением только одного агента,(2) обеспечения введения меньшего количества вводимых химиотерапевтических агентов,(3) обеспечения химиотерапевтического лечения, которое хорошо переносится пациентом с меньшим количеством вредных фармакологических осложнений, чем наблюдаются при монохимиотерапиях и определенных других комбинированных терапиях,(4) обеспечения лечения более широкого спектра различных типов рака у млекопитающих, особенно людей,(5) обеспечения более высокого показателя ответа среди леченых пациентов,(6) обеспечения более длительного времени выживания среди леченых пациентов по сравнению со стандартными химиотерапевтическими лечениями,(7) обеспечения более длительного времени до прогрессии опухоли и/или(8) получения результатов эффективности и переносимости, по крайней мере, столь же хороших,как результаты для агентов, используемых по отдельности, по сравнению с известными случаями, когда комбинации других противораковых агентов оказывают антагонистические эффекты. Эксперимент. Сокращения и акронимы. Всесторонний список сокращений, используемых органическими химиками с обычными навыками в данной области, находится в ACS Style Guide (3-е изд.) или Руководстве для Авторов Journal of OrganicChemistry. Сокращения, содержащиеся в указанных списках, и все сокращения, используемые органическими химиками с обычными навыками в данной области, включены авторами путем ссылки. Для целей этого изобретения химические элементы идентифицированы в соответствии с Периодической таблицей элементов, версии CAS, Руководства по химии и физике, 67-е изд., 1986-87.- 20018839 Более определенно, при использовании следующих сокращений в течение этого раскрытия они имеют следующие значения: Процентные выходы, о которых сообщают в следующих примерах, основаны на исходном компоненте, который использовался в самом низком молярном количестве. Чувствительные к воздуху и влажности жидкости и растворы переносились через шприц или канюлю и вводились в реакционные сосуды через резиновые перегородки. Реактивы и растворители коммерческого класса использовались без дальнейшей очистки. Термин "сконцентрированный под сниженным давлением" касается использования ротационного испарителя Buchi при приблизительно 15 мм Hg. Все температуры регистрируются нескоригированными в градусах Цельсия (С). Тонкослойная хроматография (ТСХ) проводилась на предварительно покрытых стеклянных силикагелевых 60 F-254 250-мкм пластинах. Структуры соединений этого изобретения были подтверждены с использованием одной или нескольких следующих процедур. ЯМР. Спектры ЯМР были получены для каждого соединения и были совместимы с показанными структурами. Обычная одномерная ЯМР спектроскопия была выполнена на 300 или 400 МГц спектрометрах Var- 24018839ian Mercury-plus. Образцы растворили в дейтерированных растворителях. Химические сдвиги были зарегистрированы на шкале ppm и были отнесены к соответствующим сигналам растворителей, таких как 2,49 ppm для DMSO-d6, 1,93 ppm для CD3CN, 3,30 ppm для CD3OD, 5,32 ppm для CD2Cl2 и 7,26 ppm для CDCl3 для 1 Н спектров. ГХ/МС. Масс-спектры электронного воздействия (EI-MC) были получены с помощью масс-спектрометраHewlett Packard, 5973, снабженного газовым хроматографом Hewlett Packard 6890 с колонкой JW HP-5(0,25-мМ покрытие; 30 м 0,32 мм). Источник ионов поддерживали при 250 С и спектры сканировали от 50-550 amu при 0,34 с на сканирование. ЖХ/МС. Если не указано иначе, все времена удерживания получены из ЖХ/МС и соответствуют молекулярному иону. Спектры жидкостной хроматографии высокого давления-электрораспылительные массспектры (ЖХ/МС) были получены, используя один из следующих. Метод (LCQ). ВЭЖХ Hewlett Packard 1100, оборудованная четвертичным насосом, детектором с переменной длиной волны, установленным на 254 нм, колонкой Waters Sunfire C18 (2,130 мм, 3,5 мкм), автосамплеромGilson и масс-спектрометром с уловителем ионов с электрораспылительной ионизацией Finnigan LCQ. Спектры сканировали от 120-1200 amu, используя переменное ионное время согласно числу ионов в источнике. Элюентами были А: 2% ацетонитрил в воде с 0,02% TFA и В: 2% вода в ацетонитриле с 0,018%TFA. Элюирование градиента от 10 к 95% В в течение 3,5 мин при скорости потока 1,0 мл/мин использовалось с начальным задержанием 0,5 мин и конечным задержанием при 95% В 0,5 мин. Общее время хроматографирования составляло 6,5 мин. Метод В (LCQ5). Система ВЭЖХ Agilent 1100. Система ВЭЖХ 1100 Agilent была оборудована автосамплером 1100Agilent, четвертичным насосом, детектором с переменной длиной волны, установленным на 254 нм. Используемая колонка ВЭЖХ - колонка Waters Sunfire C18 (2,130 мм, 3,5 мкм). ВЭЖХ элюент был непосредственно соединен без расщепления с масс-спектрометром с уловителем ионов с электрораспылительной ионизацией Finnigan LCQ DECA. Спектры сканировали от 140-1200 amu, используя переменное ионное время согласно числу ионов в источнике при применении положительного режима ионов. Элюентами были А: 2% ацетонитрил в воде с 0,02% TFA и В: 2% вода в ацетонитриле с 0,02% TFA. Элюирование градиента от 10 к 90% В в течение 3,0 мин при скорости потока 1,0 мл/мин использовалось с начальным задержанием 1,0 мин и конечным задержанием при 95% В 1,0 мин. Общее время хроматографирования составляло 7,0 мин. Метод С (LTQ). Система ВЭЖХ Agilent 1100. Система ВЭЖХ 1100 Agilent была оборудована автосамплером 1100Agilent, четвертичным насосом и диодной матрицей. Используемая колонка ВЭЖХ - колонка Waters Sunfire C18 (2,130 мм, 3,5 мкм). ВЭЖХ элюент был непосредственно соединен с расщеплением 1:4 с массспектрометром с уловителем ионов с электрораспылительной ионизацией Finnigan LTQ. Спектры сканировали от 50-800 amu, используя переменное ионное время согласно числу ионов в источнике при применении положительного или отрицательного ионного режима. Элюентами были А: вода с 0,1 муравьиной кислотой и В: ацетонитрил с 0,1% муравьиной кислотой. Элюирование градиента от 10 к 90% В в течение 3,0 мин при скорости потока 1,0 мл/мин использовалось с начальным задержанием 2,0 мин и конечным задержанием при 95% В 1,0 мин. Общее время хроматографирования составляло 8,0 мин. Метод D. Система ВЭЖХ Gilson, оборудованная детектором с переменной длиной волны, установленным на 254 нм, колонка YMC pro С-18 (223 мм, 120 А), и масс-спектрометром с уловителем ионов с электрораспылительной ионизацией Finnigan LCQ. Спектры сканировали от 120-1200 amu, используя переменное ионное время согласно числу ионов в источнике. Элюентами были А: 2% ацетонитрил в воде с 0,02%TFA и В: 2% вода в ацетонитриле с 0,018% TFA. Элюирование градиента от 10 к 95% В в течение 3,5 мин при скорости потока 1,0 мл/мин использовалось с начальным задержанием 0,5 мин и конечным задержанием при 95% В 0,5 мин. Общее время хроматографирования составляло 6,5 мин. Метод Е. Система ВЭЖХ Agilent 1100. Система ВЭЖХ 1100 Agilent был оборудована автосамплером 1100Agilent, четвертичным насосом и диодной матрицей. Используемая колонка ВЭЖХ - колонка Waters Sunfire C18 (2,130 мм, 3,5 мкм). ВЭЖХ элюент был непосредственно соединен с расщеплением 1:4 с массспектрометром с уловителем ионов с электрораспылительной ионизацией Finnigan LTQ. Спектры сканировали от 50-1000 amu, используя переменное ионное время согласно числу ионов в источнике или в положительном или в отрицательном ионном режиме. Элюентами были А: вода с 0,1 муравьиной кислотой и В: ацетонитрил с 0,1% муравьиной кислотой. Элюирование градиента от 10 к 90% В в течение 3,0 мин при скорости потока 1,0 мл/мин использовалось с начальным задержанием 2,0 мин и конечным задержанием при 95% В 1,0 мин. Общее время хроматографирования составляло 8,0 мин.- 25018839 Препаративная ВЭЖХ. Препаративная ВЭЖХ была выполнена в режиме обращенной фазы, типично используя систему ВЭЖХ Gilson, оборудованную двумя насосами Gilson 322, автосамплером Gilson 215, детектором диодной матрицы Gilson и колонкой С-18 (например, YMC Pro 20150 мм, 120 А). Элюирование градиента использовалось с растворителем А - вода с 0,1% TFA и растворителем В - ацетонитрил с 0,1% TFA. После инжекции в колонку в виде раствора соединение типично элюировалось с градиентом смешанных растворителей, таким как 10-90% растворитель В в растворителе в течение 15 мин при скорости потока 25 мл/мин. Фракция(и), содержащая желательный продукт, была собрана УФ-контролем при 254 или 220 нм. Препаративная MPLC. Препаративная жидкостная хроматография среднего давления (MPLC) была выполнена стандартными методами "флэш" хроматографии на силикагеле (например, Still, W.С. et al. J. Org. Chem. 1978, 43,2923-5) или при силикагелевых картриджах и устройствах, таких как системы Biotage Flash. Использовалось множество растворителей для элюирования, как описано в экспериментальных протоколах. Общие препаративные методы. Определенный процесс, который будет использован в получении соединений, используемых в этом варианте осуществления изобретения, зависит от определенного желательного соединения. Такие факторы, как выбор определенных заместителей играют роль в пути, которому будут следовать в получении определенных соединений этого изобретения. Эти факторы легко распознаются специалистом с обычными навыками в данной области. Соединения изобретения могут быть получены при помощи известных химических реакций и процедур. Однако представлены следующие общие препаративные методики, чтобы помочь читателю в синтезе соединений существующего изобретения, с более детальными специфическими примерами, представляемыми ниже в экспериментальном разделе, описывающем рабочие примеры. Соединения изобретения могут быть получены согласно обычным химическим методам и/или, как раскрыто ниже, из исходных материалов, которые или коммерчески доступны или производятся согласно обычным, стандартным химическим методам. Общие методы для получения соединений приведены ниже, и получение характерных соединений определенно иллюстрируется в примерах. Синтетические преобразования, которые могут использоваться в синтезе соединений этого изобретения и в синтезе промежуточных продуктов, вовлеченных в синтез соединений этого изобретения, известны или доступны для специалиста, квалифицированного в данной области. Коллекции синтетических преобразований могут быть найдены в компиляциях, таких какC. Hansch; P.G. Sammes; J.B. Taylor, Eds. Comprehensive Medicinal Chemistry: Pergamon Press: Oxford, UK (1990). Кроме того, обзоры синтетической методологии и связанных вопросов включают Organic Reactions;Drug Synthesis; John Wiley: New York; Annual Reports in Organic Synthesis; Academic Press: San Diego CA и Methoden der Organischen Chemie (Houben-Weyl); Thieme: Штутгарт, Германия. Кроме того, базы данных синтетических преобразований включают Chemical Abstracts, которые можно найти, используя CAS В схеме реакции 1 ванилина ацетат может быть преобразован в промежуточный продукт (III) в условиях нитрования, таких как неразбавленная дымящая азотная кислота или азотная кислота в присутствии другой сильной кислоты, такой как серная кислота. Гидролиз ацетата в промежуточном продукте(III) ожидался бы в присутствии оснований, таких как гидроксид натрия, гидрооксид лития или гидрооксид калия в протонном растворителе, таком как метанол. Защиты промежуточного продукта (IV) для получения соединений формулы (V) можно достигнуть стандартными методами (Greene, T.W.; Wuts,P.G.M.; Protective Groups in Organic Synthesis; WileySons: New York, 1999). Преобразования соединений формулы (V) в соединения формулы (VI) можно достичь, используя аммиак в присутствии йода в апротонном растворителе, таком как THF или диоксан. Восстановление нитрогруппы в формуле (VI) могло быть достигнуто с использованием железа в уксусной кислоте или водородного газа в присутствии подходящего катализатора из палладия, платины или никеля. Преобразование соединений формулы (VII) в имидазолин формулы (VIII) лучше всего достигают с использованием этилендиамина в присутствии катализатора, такого как элементная сера при нагревании. Циклизации соединений формулы (VIII) в соединения формулы (IX) достигают, используя цианогена бромид в присутствии аминного основания,такого как триэтиламин, диизопропилэтиламин или пиридин в галогенированном растворителе, таком как DCM или дихлорэтан. Удаление защитной группы в формуле (IX) будет зависеть от выбранной группы и может быть достигнуто стандартными методами (Greene, T.W.; Wuts, P.G.M.; Protective Groupsin Organic Synthesis; WileySons: New York, 1999). Алкилирование фенола в формуле (X) может быть достигнуто с использованием основания, такого как карбонат цезия, гидрид натрия, или т-бутоксид калия в полярном апротонном растворителе, таком как DMF или DMSO с введением боковой цепи, имеющей соответствующую уходящую группу, такую как галид или сульфонатная группа. Наконец, амиды формулы (I) могут быть образованы с использованием активированных эстеров, таких как кислотные хлориды и ангидриды, или альтернативно сформированы с использованием карбоновых кислот и соответствующих агентов спаривания, таких как PYBOP, DCC или EDCI в полярных апротонных растворителях. В схеме реакции 2 соединение формулы (IV), подготовленное, как описано выше, может быть преобразовано в структуру формулы (XII), используя аммиак в присутствии йода в апротонном растворителе, таком как THF или диоксан. Алкилирование фенола в формуле (XII) может быть достигнуто с использованием основания, такого как карбонат цезия, гидрид натрия, или т-бутоксид калия в полярном апротонном растворителе, таком как DMF или DMSO, с введением боковой цепи, имеющей соответствующую уходящую группу, такую как галид или сульфонатная группа. Восстановление нитрогруппы в формуле (XIII) могло быть достигнуто с использованием железа в уксусной кислоте или водородного газа в присутствии подходящего катализатора из палладия, платины или никеля. Преобразование соединений формулы (XIV) в имидазолин формулы (XV) лучше всего достигают с использованием этилендиамина в присутствии катализатора, такого как элементная сера при нагревании. Циклизации соединений формулы (XV) в соединения формулы (XVI) достигают, используя цианогена бромид в присутствии аминного основания, такого как триэтиламин, диизопропилэтиламин или пиридин в галогенированном растворителе, таком как DCM или дихлорэтан. Наконец, амиды формулы (I) могут быть образованы, используя активированные эстеры, такие как кислотные хлориды и ангидриды, или альтернативно сформированы с использованием карбоновых кислот и соответствующих агентов спаривания, таких как PYBOP,DCC или EDCI в полярных апротонных растворителях. Схема реакции 3 В схеме реакции 3 соединение формулы (X), полученное, как описано выше, может быть преобразовано в амид (XVI) с использованием активированных эстеров, таких как кислотные хлориды и ангидриды, или альтернативно сформированы с использованием карбоновых кислот и соответствующих агентов спаривания, таких как PYBOP, DCC или EDCI в полярных апротонных растворителях. Оно могло затем быть преобразовано в соединение формулы (I) с использованием основания, такого как карбонат цезия, гидрид натрия, или т-бутоксид калия в полярном апротонном растворителе, таком как DMF илиDMSO, с введением боковой цепи, имеющей соответствующую уходящую группу, такую как галид или сульфонатная группа. В схеме реакции 4 соединение формулы (IX), полученное как описано выше, может быть преобразовано в амид (XVII) с использованием активированных эстеров, таких как кислотные хлориды и ангидриды или альтернативно сформированы с использованием карбоновых кислот и соответствующих агентов спаривания, таких как PYBOP, DCC или EDCI в полярных апротонных растворителях. Удаление защитной группы в формуле (XVII) будет зависеть от выбранной группы и может быть достигнуто стандартными методами (Greene, T.W.; Wuts, P.G.M.; Protective Groups in Organic Synthesis; WileySons:New York, 1999). Алкилирование фенола в формуле (XVI) может быть достигнуто с использованием основания, такого как карбонат цезия, гидрид натрия, или т-бутоксид калия в полярном апротонном растворителе, таком как DMF или DMSO, с введением боковой цепи, имеющей соответствующую уходящую группу, такую как галид или сульфонатная группа. Схема реакции 5 В схеме реакции 5 соединение формулы (XVIII) может быть преобразовано в бис-хлоридное соединение формулы (XIX) с использованием хлорирующих агентов, таких как POCl3 или COCl2 в апротонных растворителях. Полученный таким образом хлорид может быть преобразован в имидазолины формулы(XXI) через реакцию с соответствующими количествами этаноламина или соответственно защищенного заместителя, что сопровождается активацией с помощью подходящего активирующего агента, такого как сульфонилхлорид, PPh3 или галогенизирующего агента, такого как SOCl2. Хлорид (XXI) может быть преобразован в амин (XXII) с помощью любого источника нуклеофильного амина, такого как аммиак, фталимид или защищенные амины, такие как бензил амин в полярном растворителе, такого как DMF илиDMSO. Образование фенола, изображенного в формуле (X), может быть достигнуто путем снятия защиты метилового эфира, используя любое из условий, указанных в литературе (Greene, T.W.; Wuts, P.G.M.;Protective Groups in Organic Synthesis; WileySons: New York, 1999). Для лучшего понимания этого изобретения приведены следующие примеры. Эти примеры служат только для иллюстративных целей и не должны никоим образом рассматриваться как ограничение области применения изобретения. Все публикации, упомянутые авторами, включены путем ссылки в их полном объеме.
МПК / Метки
МПК: A01N 43/54, A61K 31/517
Метки: замещенные, лечения, полезные, нарушений, связанных, ангиогенезом, болезней, 2,3-дигидроимидазо[1,2-c]хиназолина, производные, гиперпролиферативных
Код ссылки
<a href="https://eas.patents.su/30-18839-zameshhennye-proizvodnye-23-digidroimidazo12-chinazolina-poleznye-dlya-lecheniya-giperproliferativnyh-narushenijj-i-boleznejj-svyazannyh-s-angiogenezom.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные 2,3-дигидроимидазо[1,2-c]хиназолина, полезные для лечения гиперпролиферативных нарушений и болезней, связанных с ангиогенезом</a>
Предыдущий патент: Способ идентификации сектора, мобильная станция и система мобильной связи
Следующий патент: Рекомбинантная клетка-хозяин для получения соединения, представляющего интерес
Случайный патент: Огнезащитная полимерная композиция, содержащая тонкодисперсные включения


































