Кристаллические сольваты и комплексы производных (1s)-1,5-ангидро-1-c-(3-((фенил)метил)фенил)-d-глюцитола с аминокислотами в качестве ингибиторов sglt2 для лечения диабета
Номер патента: 18229
Опубликовано: 28.06.2013
Авторы: Димарко Джон Д., Гроссо Джон Энтони, Рибель Петер, Сингх Джанак, Ванг Ченьчи, Бйн Джеффри Т., Нёршль Александра А., Гугутас Джек З., Лобингер Хильдегард, Лай Чиаджень, Дешпанде Прашант П., Рамакришнан Шривидья
Формула / Реферат
1. Кристаллическая форма SC-3 соединения (S)-PG формулы (Ia)
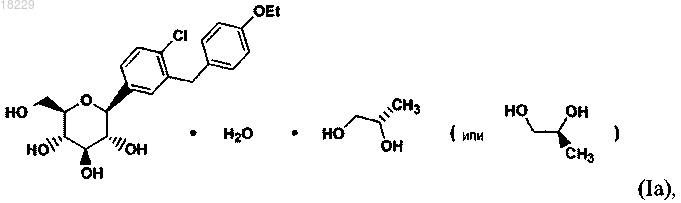
охарактеризованная одним или большим количеством следующих характеристик:
a) параметры элементарной ячейки:
а=11.2688(8) Å,
b=4.8093(3) Å,
с=46.723(3) Å,
пространственная группа = P212121,
молекулы/асимметричная ячейка = 1,
где измерение указанной кристаллической структуры осуществляют при комнатной температуре и которая охарактеризована фракционными атомными координатами, по существу, являющимися такими, как приведено в табл. 4;
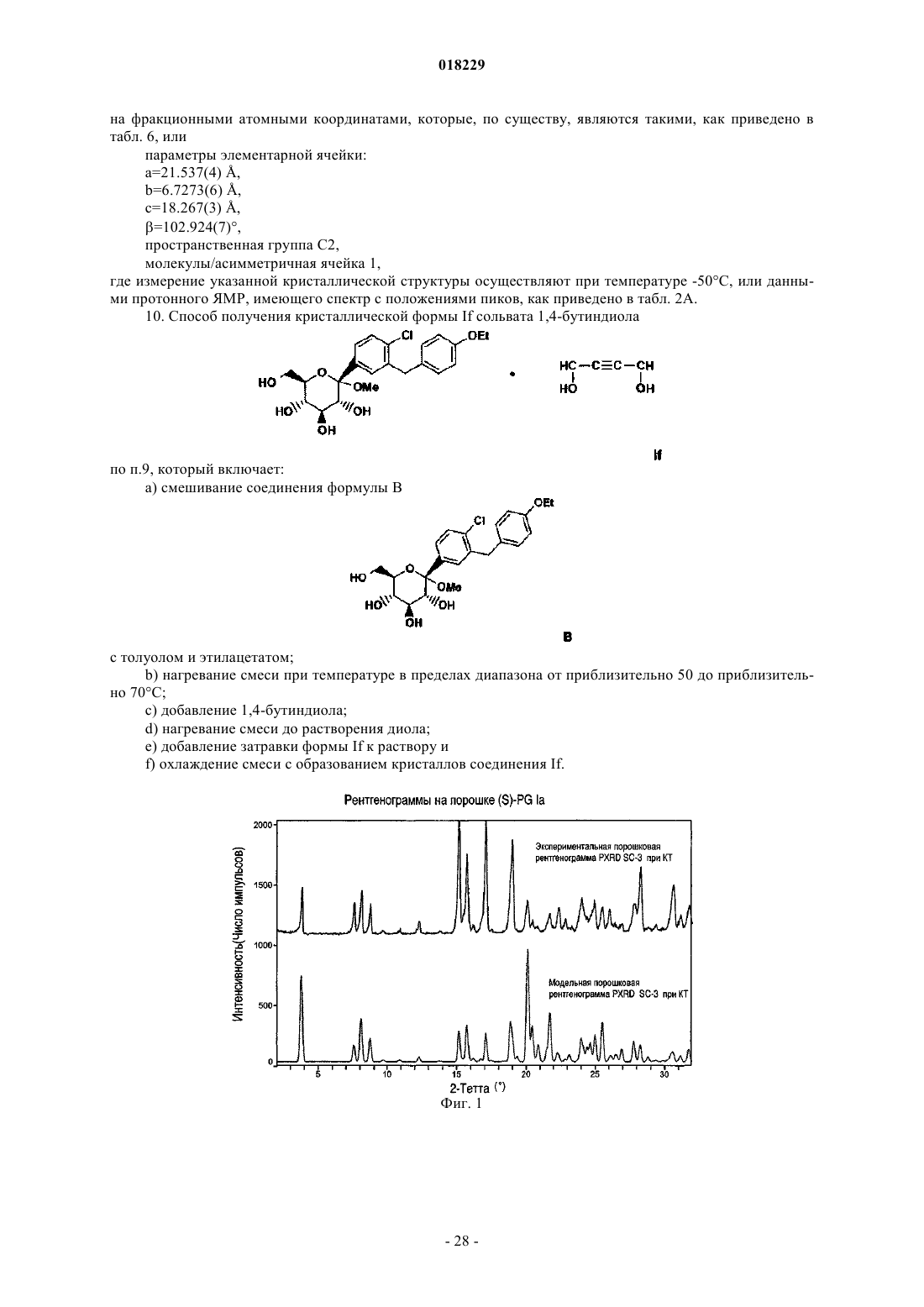
b) рентгенограмма на порошке, включающая 2θ значений (CuKα l=1.5418 Å), выбранных из группы, состоящей из 3,8±0,1, 7,6±0,1, 8,1±0,1, 8,7±0,1, 15,2±0,1, 15,7±0,1, 17,1±0,1, 18,9±0,1 и 20,1±0,1, при комнатной температуре;
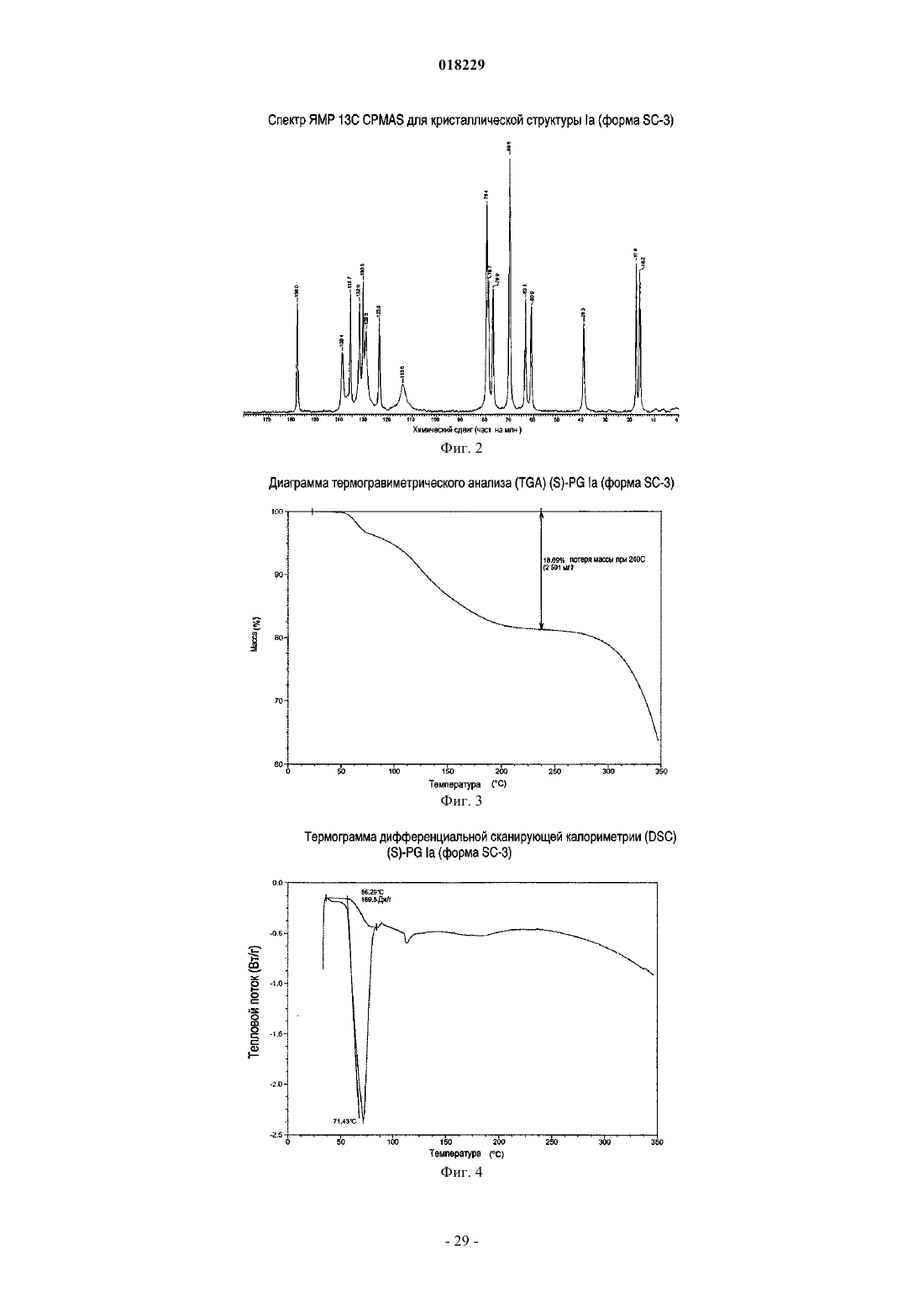
c) спектр ЯМР 13С в твердой фазе, имеющий аналогичные положения пиков при 16.2, 17.6, 39.3, 60.9, 63.3, 69.8, 76.9, 78.7, 79.4, 113.8, 123.6, 129.3, 130.5, 132.0, 135.7, 139.1 и 158.0 ч./млн, как определено на спектрометре 400 МГц относительно TMS;
d) термограмма дифференциальной сканирующей калориметрии, имеющая эндотерму в диапазоне от приблизительно 50 до 78°С или как показано на фиг. 4;
e) диаграмма термогравиметрического анализа с потерей веса приблизительно 18,7% от приблизительно комнатной температуры до приблизительно 240°С или как показано на фиг. 3; или
f) наличие протонного ЯМР, имеющего аналогичные положения пиков, как приведено в табл. 1А.
2. Кристаллическая форма по п.1, которая находится, по существу, в чистой форме.
3. Фармацевтическая композиция, содержащая эффективное количество кристаллической формы соединения по п.1 и фармацевтически приемлемый носитель или разбавитель.
4. Способ получения кристаллической формы SC-3 соединения (S)-PG формулы (Ia) по п.1

включающий реакцию соединения формулы А

в органическом растворителе с основанием и (S)-пропиленгликолем, необязательно, с добавлением кристаллической затравки (S)-PG (формы SC-3).
5. Способ получения кристаллической формы SC-3 соединения (S)-PG формулы (Ia) по п.1, который включает взаимодействие соединения формулы В
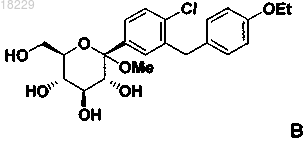
с восстанавливающим агентом, таким как алкилсилилгидрид, в присутствии активирующей группы, такой как кислота Льюиса, для образования соединения формулы (I)
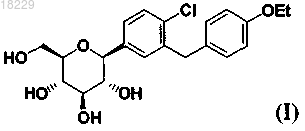
реакцию соединения I с (S)-пропиленгликолем, необязательно, с добавлением кристаллической затравки формы SC-3 к реакционной смеси.
6. Способ по п.5, отличающийся тем, что восстанавливающий агент представляет собой триэтилсилан и активирующая группа представляет собой BF3OEt2 или BF3×2CH3COOH.
7. Способ получения кристаллической формы SC-3 соединения (S)-PG формулы (Ia) по п.1
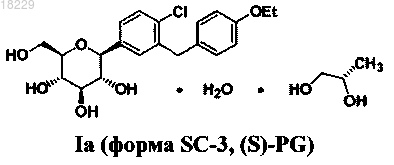
включающий
взаимодействие соединения формулы (If)
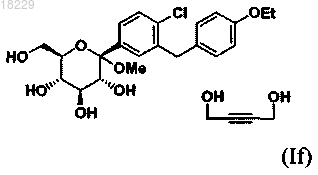
с уксусным ангидридом в присутствии диметиламинопиридина и CH3CN, с получением соединения В'2
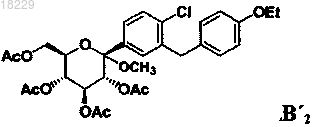
взаимодействие вышеупомянутого соединения с восстанавливающим агентом, таким как алкилсилилгидрид, в присутствии активирующей группы, такой как кислота Льюиса, и CH3CN, с образованием соединения формулы А
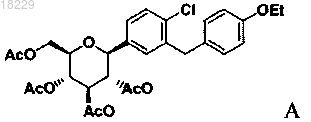
взаимодействие вышеупомянутого соединения с основанием и затем с (S)-пропиленгликолем, необязательно, с добавлением кристаллической затравки формы SC-3 к реакционной смеси.
8. Способ по п.7, отличающийся тем, что восстанавливающий агент представляет собой триэтилсилан и активирующая группа представляет собой BF3OEt2 или BF3×2CH3COOH.
9. Кристаллическая форма If сольвата 1,4-бутиндиола формулы

охарактеризованная одним или большим количеством следующих характеристик:
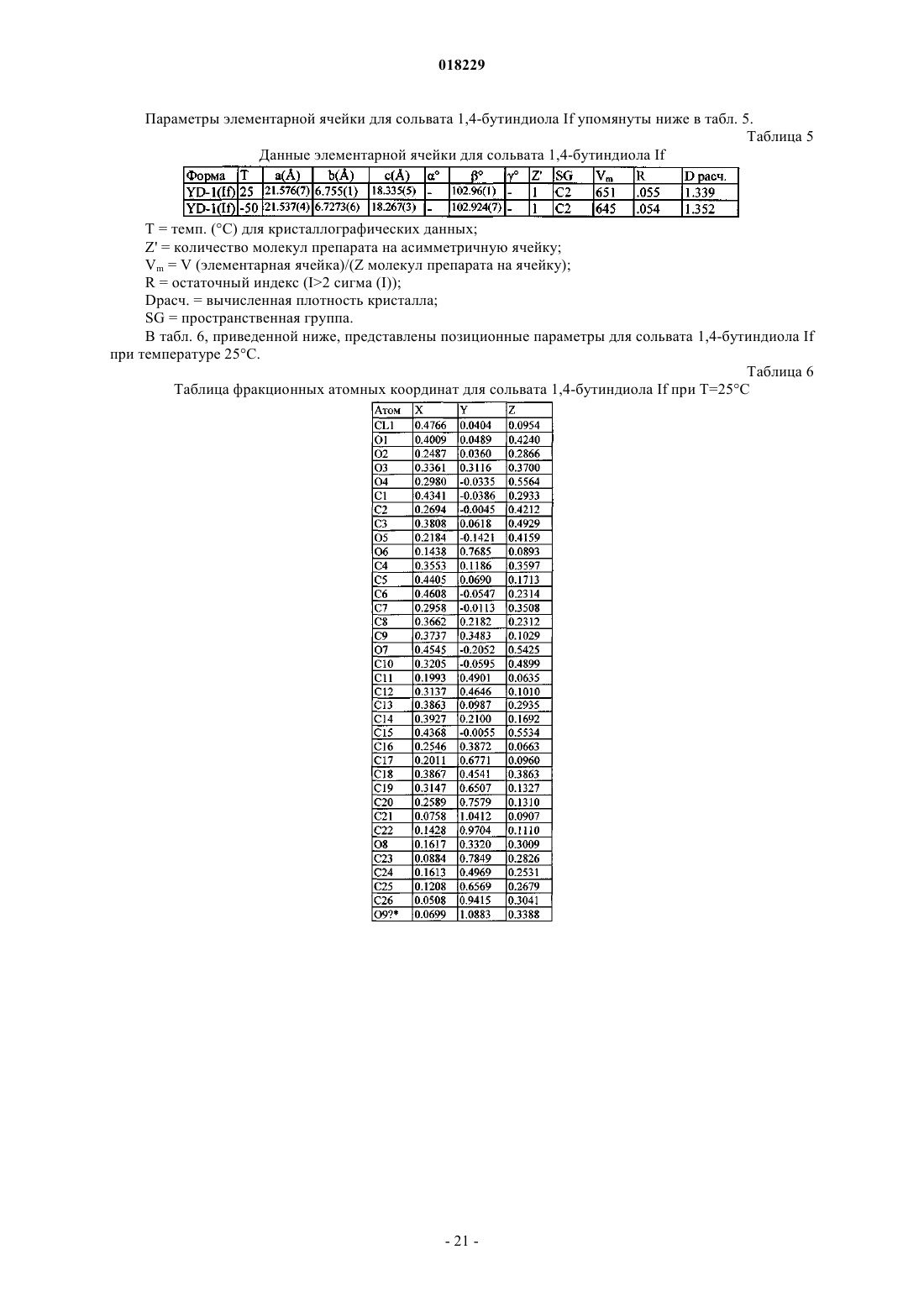
параметры элементарной ячейки:
а=21.576(7) Å,
b=6.755(1) Å,
с=18.335(5) Å,
β=102.96(1)°,
пространственная группа С2,
молекулы/асимметричная ячейка 1,
где измерение указанной кристаллической структуры осуществляют при 25°С и которая охарактеризована фракционными атомными координатами, которые, по существу, являются такими, как приведено в табл. 6, или
параметры элементарной ячейки:
а=21.537(4) Å,
b=6.7273(6) Å,
с=18.267(3) Å,
β=102.924(7)°,
пространственная группа С2,
молекулы/асимметричная ячейка 1,
где измерение указанной кристаллической структуры осуществляют при температуре -50°С, или данными протонного ЯМР, имеющего спектр с положениями пиков, как приведено в табл. 2А.
10. Способ получения кристаллической формы If сольвата 1,4-бутиндиола
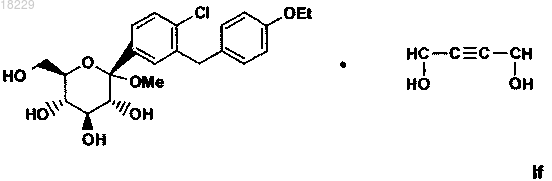
по п.9, который включает:
а) смешивание соединения формулы В
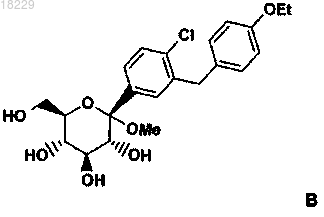
с толуолом и этилацетатом;
b) нагревание смеси при температуре в пределах диапазона от приблизительно 50 до приблизительно 70°С;
c) добавление 1,4-бутиндиола;
d) нагревание смеси до растворения диола;
e) добавление затравки формы If к раствору и
f) охлаждение смеси с образованием кристаллов соединения If.
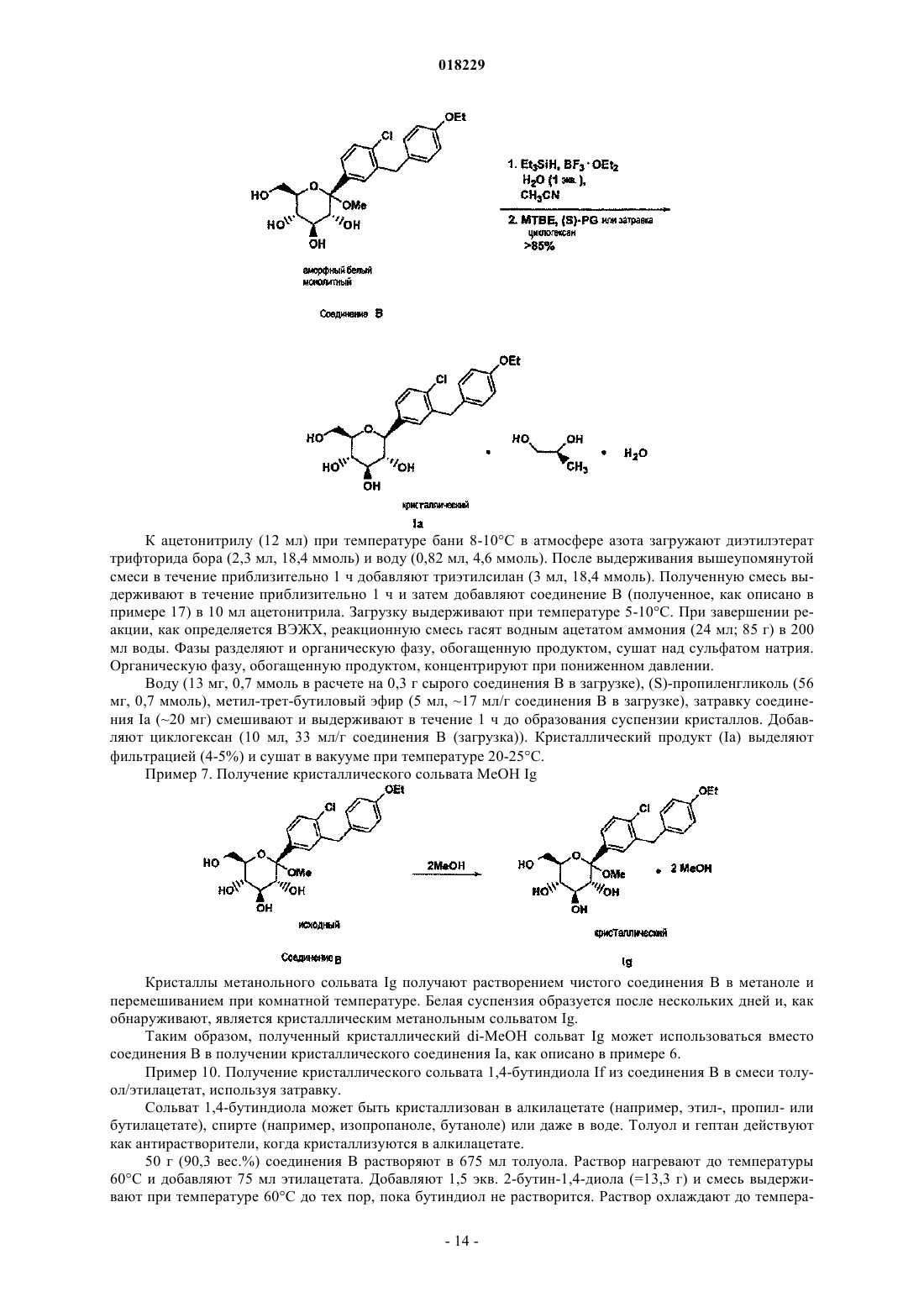
Текст
Изобретение относится к кристаллическим структурам соединений формул Ia и If, к способам их получения и к фармацевтическим композициям, содержащим указанную структуру соединения Ia Область изобретения Настоящее изобретение относится к полиморфным кристаллическим структурам свободной кислоты ингибиторов SGLT2, к их фармацевтическим композициям, к способу для получения таких кристаллических структур и также к способам лечения заболеваний, таких как диабет. Уровень техники Приблизительно 100 миллионов человек во всем мире страдают от диабета типа II (NIDDM), который характеризуется гипергликемией из-за чрезмерной продукции глюкозы в печени и периферической резистентности к инсулину, первопричины для которых пока еще неизвестны. Постоянный контроль уровней глюкозы в плазме у пациентов с диабетом может уменьшить развитие диабетических осложнений и декоменсации -клеток, отмечаемых в данном заболевании. Глюкоза плазмы обычно фильтруется в клубочках почек и активно реабсорбируется в проксимальном канальце. 90% обратного захвата глюкозы в почке происходит в эпителиальных клетках начального сегмента Sl ренальных кортикальных проксимальных канальцев. SGLT2, 672 аминокислот белка, содержащих 14 перекрывающих мембрану сегментов, которые преобладающе экспрессируются в начальном сегменте Sl ренальных проксимальных канальцев, который, вероятно, будет главным транспортером,ответственным за этот обратный захват. Субстратная специфичность, зависимость от натрия и локализация SGLT2 находятся в соответствии со свойствами высокой мкости, низкого сродства, зависимого от натрия переносчика глюкозы, предварительно охарактеризованного в человеческих кортикальных почечных проксимальных канальцах. Кроме того, исследования гибридного истощения выявили SGLT2 в качестве преобладающего сотранспортера Na+/глюкозы в сегменте Sl проксимального канальца, так как фактически вся активность переноса Na-зависимой глюкозы, закодированная в mRNA коры почки крысы, ингибируется антисмысловым олигонуклеотидом, характерным для крысы SGLT2. У людей мутации в SGLT2 были связаны с семейными формами почечной глюкозурии, обеспечивая дальнейшую очевидность первичной роли SGLT2 в почечной реабсорбции глюкозы. У таких пациентов морфология почек и функция почек отлична от нормальной. Ингибирование SGLT2 прогнозирует уменьшение уровней глюкозы в плазме посредством улучшенного выведения глюкозы из организма у пациентов с диабетом. Селективное ингибирование SGLT2 у пациентов с диабетом могло бы нормализовать уровень глюкозы в плазме, увеличивая выделение глюкозы с мочой, таким образом, улучшая чувствительность к инсулину и задерживая развитие диабетических осложнений, в отсутствие существенных побочных эффектов со стороны желудочно-кишечного тракта. Сущность изобретения Изобретение относится к кристаллическим структурам соединения формулы Ia, a именно кристаллической форме SC-3 соединения (S)-PG формулы Ia которая охарактеризована одним или большим количеством следующих характеристик:a) параметры элементарной ячейки а=11,2688(8)b=4,8093(3)с=46,723(3)пространственная группа=P212121 молекулы/асимметричная ячейка=1,где измерение указанной кристаллической структуры осуществляют при комнатной температуре и которая охарактеризована фракционными атомными координатами, по существу, являющимися такими, как приведено в табл. 4;c) спектр ЯМР 13 С в твердой фазе, имеющий аналогичные положения пиков при 16.2, 17.6, 39.3,60.9, 63.3, 69.8, 76.9, 78.7, 79.4, 113.8, 123.6, 129.3, 130.5, 132.0, 135.7, 139.1 и 158.0 ч./млн, как определено на спектрометре 400 МГц относительно TMS;d) термограмма дифференциальной сканирующей калориметрии, имеющая эндотерму в диапазоне от приблизительно 50 до 78 С, или как показано на фиг. 4;e) диаграмма термогравиметрического анализа с потерей веса приблизительно 18,7% от приблизительно комнатной температуры до приблизительно 240 С или, как показано на фиг. 3; илиf) наличие протонного ЯМР, имеющего аналогичные положения пиков, как приведено в табл. 1 А. В одном из аспектов изобретения кристаллическая форма находится, по существу, в чистой форме. Изобретение также относится к фармацевтической композиции, содержащей эффективное количество кристаллической формы SC-3 соединения (S)-PG формулы Ia, которое имеет вышеуказанные характеристики, и фармацевтически приемлемый носитель или разбавитель. В другом аспекте изобретение относится к способу получения кристаллической формы SC-3 соединения (S)-PG формулы Ia с вышеуказанными характеристиками включающему реакцию соединения формулы А (которая включает стадии получения соединения А (полученного, как описано в US10/745075, поданной 23 декабря 2003 г., примеры 17-20), структуры) в органическом растворителе с основанием и (S)-пропиленгликолем, необязательно с добавлением кристаллической затравки (S)-PG (формы SC-3). В следующем аспекте изобретение относится к способу получения кристаллической формы получения кристаллической формы SC-3 соединения (S)-PG формулы Ia, который включает взаимодействие соединения формулы В с восстанавливающим агентом, таким как алкилсилилгидрид, в присутствии активирующей группы, такой как кислота Льюиса, для образования соединения формулы I реакцию соединения I с (S)-пропиленгликолем, необязательно с добавлением кристаллической затравки формы SC-3 к реакционной смеси. В указанном способе восстанавливающий агент может представлять собой триэтилсилан, и активирующая группа может представлять собой BF3OEt2 или BF32CH3COOH. Изобретение также относится к способу получения кристаллической формы SC-3 соединения (S)PG формулы Ia по п.1 включающий взаимодействие соединения формулы If взаимодействие вышеупомянутого соединения с восстанавливающим агентом, таким как алкилсилилгидрид, в присутствии активирующей группы, такой как кислота Льюиса, и CH3CN, с образованием соединения формулы А взаимодействие вышеупомянутого соединения с основанием и затем с (S)-пропиленгликолем, необязательно с добавлением кристаллической затравки формы SC-3 к реакционной смеси. В этом способе восстанавливающий агент может представлять собой триэтилсилан, и активирующая группа может представлять собой BF3OEt2 или BF32CH3COOH. В другом аспекте изобретение относится к кристаллической форме If сольвата 1,4-бутиндиола формулы которая охарактеризована одним или большим количеством следующих характеристик. Параметры элементарной ячейки: а=21.576(7)=102.96(1) пространственная группа С 2 молекулы/асимметричная ячейка 1,где измерение указанной кристаллической структуры осуществляют при 25 С и которая характеризована фракционными атомными координатами, которые, по существу, являются такими, как приведено в табл. 6, или параметры элементарной ячейки а=21.537(4)=102.924(7) пространственная группа С 2 молекулы/асимметричная ячейка 1,где измерение указанной кристаллической структуры осуществляют при температуре -50 С или данными протонного ЯМР, имеющего спектр с положениями пиков, как приведено в табл. 2 А. Предложен также способ получения кристаллической формы If сольвата 1,4-бутиндиола, имеющего вышеуказанные параметры который включает а) смешивание соединения формулы Вb) нагревание смеси при температуре в пределах диапазона от приблизительно 50 до приблизительно 70 С;d) нагревание смеси до растворения диола;e) добавление затравки формы If к раствору иf) охлаждение смеси с образованием кристаллов соединения If. Далее указанные выше способы раскрыты более подробно. Как указано выше, способ получения кристаллического соединения структуры (S)-PG структуры Ia(форма SC-3) включает стадии получения соединения А, которое может быть получено, как описано вUS10/745075, поданной 23 декабря 2003 г., примеры 17-20, структуры с последующей обработкой соединения А спиртовым растворителем, таким как метанол или этанол, и водным основанием, таким как гидроксид натрия, и водой, в случае необходимости, в инертной атмосфере и при повышенной температуре, в случае необходимости, добавлением кислоты, такой как соляная кислота, для нейтрализации реакционной смеси для получения соединения I структуры, и обработкой реакционной смеси, содержащей соединение I, органическим растворителем, таким как метилтретбутиловый эфир, алкилацетат, такой как этилацетат, метилацетат, изопропилацетат или бутилацетат и (S)-пропиленгликоль, необязательно, добавлением затравки (S)-PG соединения Ia (SC-3) к смеси, для получения (S)-PG соединения Ia(форма SC-3). Способ получения соединения Ia который включает стадию восстановления соединения В структуры для удаления метоксигруппы посредством обработки соединения В, которое может быть получено, как описано в US10/745,075, поданной 3 декабря 2003 г., пример 17, или кристаллического сольвата, такого как сольват 1,4-бутиндиола (If), агентом восстановления, таким как триэтилсилилгидрид, и активирующей группой, которая является кислотой Льюиса, такой как BF3Et2O или BF32CH3COOH, предпочтительно BF32CH3COOH, и органическим растворителем, таким как CH3CN, и добавлением воды, отде-4 018229 лением соединения структуры I, и обработкой соединения I (S)-пропиленгликолем в присутствии растворителя, такого как метилтретбутиловый эфир, необязательно с затравкой соединения Ia S)-PG), чтобы получить кристаллическую суспензию соединения Ia S)-PG) и выделить соединение Ia S)-PG). Вышеупомянутый способ по изобретению представляет собой однореакторную операцию, которая минимизирует получение промежуточных соединений, приводя к улучшенному выходу и свойству конечного кристаллического соединения Ia. Кристаллическое соединение Ia, которое также упоминается как сольват (S)-пропиленгликоля соединения I, является новой кристаллической структурой и представляет собой объем объектов настоящего изобретения. Соединение формулы В (аморфная форма) раскрыто в US10/745,075, поданной 23 декабря 2003 г.,содержание которой полностью включено в настоящую заявку в качестве ссылки. Способ получения кристаллического сольвата 1,4-бутиндиола If включает стадии растворения основного соединения В в алкилацетате, таком как этилацетат, пропилацетат или бутилацетат, или в спирте, таком как изопропиловый спирт или бутанол, или воде, добавлением 2-бутин-1,4-диола к раствору соединения В, нагревание полученной смеси до тех пор, пока диол не растворится, охлаждение смеси и выделение кристаллов сольвата 1,4-бутиндиола If. Толуол или гептан могут использоваться как антирастворители, когда сольват If кристаллизуется в алкилацетате. Сольват 1,4-бутиндиола If может быть выделен и может использоваться для получения соединенияI или соединения Ia в непрерывном процессе или периодическом процессе, как описано в дальнейшем. Сольват 1,4-бутиндиола If может использоваться для получения кристаллического соединения Ia,как описано в настоящей заявке. Краткое описание фигур Изобретение проиллюстрировано ссылкой на прилагаемые чертежи, описанные ниже. Фиг. 1 иллюстрирует вычисленную (модельную при температуре 25 С) и наблюдаемую (экспериментальную при комнатной температуре) порошковую рентгенограмму (S)-PG кристаллической структуры Ia, форма SC-3; фиг. 2 - 13 С ЯМР спектр CPMAS для (S)-PG кристаллической структуры Ia формы SC-3; фиг. 3 - диаграмму термогравиметрического анализа (TGA) (S)-PG кристаллической структуры Ia,форма SC-3; фиг. 4 - термограмму дифференциальной сканирующей калориметрии (DSC) (S)-PG кристаллической структуры соединения формы Ia, форма SC-3; фиг. 5 - наблюдаемую (экспериментальную при комнатной температуре) порошковую рентгенограмму кристаллической структуры сольвата 1,4-бутиндиола If; фиг. 6 - термограмму дифференциальной сканирующей калориметрии (DSC) кристаллической структуры сольвата 1,4-бутиндиола If; фиг. 7 - схематическое представление непрерывного реакционного процесса. Подробное описание изобретения Настоящее изобретение обеспечивает, по крайней мере в части, кристаллические структуры соединения I в качестве новых веществ. Термин "фармацевтически приемлемый", как используется в настоящей заявке, относится к тем соединениям, веществам, композициям и/или дозированным формам, которые находятся в области традиционной медицинской практики, которые являются пригодными для контакта с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или других осложнений, сораз-5 018229 мерных с разумным соотношением польза/риск. В определенных предпочтительных воплощениях кристаллические структуры соединения I изобретения находятся, по существу, в чистой форме. Термин "по существу чистый", как используется в настоящей заявке, означает соединение, имеющее чистоту больше чем приблизительно 90%, включая, например, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%,приблизительно 98%, приблизительно 99% и приблизительно 100%. Свойство соединения находится в виде различных кристаллических структур, известно как полиморфизм. Как используется в настоящей заявке, термин "полиморф" относится к кристаллическим формам, имеющим тот же самый химический состав, но различные пространственные расположения молекул, атомов и/или ионов, формирующих кристалл. В то время как полиморфы имеют тот же самый химический состав, они отличаются по упаковке и геометрическому расположению и могут показывать различные физические свойства, такие как температура плавления, форма, цвет, плотность, твердость,деформируемость, стабильность, растворимость и т.п. В зависимости от соотношения температурастабильность два полиморфа могут быть или монотроными, или энантиотропными. Для монотропной системы относительная стабильность между двумя твердыми фазами остается неизменной, когда изменяется температура. Напротив, в энантиотропной системе существует температура перехода, при которой стабильность этих двух фаз полностью изменяется (Theory and Origin of Polymorphism in "Polymorphism in Pharmaceutical Solids" (1999) ISBN: 8247-0237). Образцам кристаллических структур по изобретению можно обеспечить, по существу, чистую фазовую однородность, идентифицируемую наличием доминирующего количества единственной кристаллической структуры и, необязательно, незначительных количеств одной или более других кристаллических структур. Присутствие больше чем одной кристаллической структуры по изобретению в образце может быть определено методами, такими как порошковая дифракция рентгеновских лучей (PXRD) или твердофазная ядерная магнитно-резонансная спектроскопия (SSNMR). Например, присутствие экстрапиков при сравнении экспериментально измеренной рентгенограммы PXRD (наблюдаемой) с модельной рентгенограммой PXRD (вычисленной) может указывать на больше чем одну кристаллическую структуру в образце. Модельная рентгенограмма PXRD может быть вычислена на основе данных рентгеновского анализа монокристалла (см. Smith, D.K., "А FORTRAN Program for Calculating X-Ray Powder DiffractionPatterns" Lawrence Radiation Laboratory, Livermore, California, UCRL-7196 (April 1963); см. также Yin, S.,Scaringe, R.P., DiMarco, J., Galella, M. and Gougoutas, J.Z., American Pharmaceutical Review, 2003, 6, 2, 80). Предпочтительно кристаллическая структура имеет, по существу, чистую фазовую однородность, как обозначено посредством меньше чем 10%, предпочтительно меньше чем 5% и более предпочтительно меньше чем 2% общей площади пика в экспериментальной рентгенограмме PXRD, являющейся результатом дополнительных пиков, которые отсутствуют на модельной рентгенограмме PXRD. Наиболее предпочтительна кристаллическая структура по изобретению, имеющая, по существу, чистую фазовую однородность с меньше чем 1% от общей площади пика в экспериментальной рентгенограмме PXRD,являющейся результатом дополнительных пиков, которые отсутствуют на модельной рентгенограммеPXRD. Различные кристаллические структуры по изобретению, описанному в настоящей заявке, могут быть различимы друг от друга с помощью различных аналитических методов, известных специалисту в данной области. Такие методы включают, но не ограничиваясь, твердофазную ядерную магнитнорезонансную спектроскопию (SSNMR), порошковую дифракцию рентгеновских лучей (PXRD), дифференциальную сканирующую калориметрию (DSC) и/или термогравиметрический анализ (TGA). Получение кристаллических структур Кристаллические структуры по изобретению могут быть получены разнообразными методами,включая, например, кристаллизацию или перекристаллизацию из подходящего растворителя, сублимацию, рост из расплава, переход в твердую фазу из другой фазы, кристаллизацию из суперкритической жидкости и реактивное распыление. Методы для кристаллизации или перекристаллизации кристаллических форм из растворяющей смеси включают, например, выпаривание растворителя, уменьшение температуры растворяющей смеси, использование кристаллической затравки в пересыщенной растворяющей смеси молекулы и/или соли, замораживание, высушивающее растворяющую смесь, и добавление антирастворителей (противорастворителей) к растворяющей смеси. Могут использоваться высокопроизводительные методы кристаллизации для получения кристаллических форм, включая полиморфы. Кристаллические лекарства, включая полиморфы, способы получения и характеристики кристаллов лекарства обсуждаются в Solid-State Chemistry of Drugs, S.R. Byrn, R.R. Pfeiffer, и J.G. Stowell, 2nd Edition,SSCI, West Lafayette, Indiana, 1999. Кристаллические затравки могут быть добавлены к любой смеси для кристаллизации для ускорения кристаллизации. Как будет понятно квалифицированному специалисту, применение затравки используется для управления ростом конкретной кристаллической структуры или для управления распределением размера частиц кристаллического продукта. Соответственно, вычисление количества необходимых затравок зависит от размера доступной затравки и желательного размера средней частицы продукта, как описано, например, в "Programmed Cooling of Batch Crystallizers," J.W. Mullin и J. Nyvlt, Chemical Engi-6 018229neering Science, 1971, 26, 369-377. Вообще, затравки небольшого размера необходимы для эффективного управления ростом кристаллов в партии. Затравка небольшого размера может быть получена просеиванием, помолом или тонким измельчением больших кристаллов или микрокристаллизацией растворов. Должна быть предпринята осторожность, чтобы размалывание или тонкое измельчение кристаллов не привели ни к какому изменению в кристалличности формы заданной кристаллической структуры (т.е. изменения на аморфную форму или на другой полиморф). Как используется в настоящей заявке, термин "комнатная температура" или "RT" обозначает температуру окружающей среды от 20 до 25 С (68-77F). Вообще, в получении кристаллического соединения Ia, как описано ниже, растворитель(и) будет использоваться для образования кристаллического соединения Ia, предпочтительно имеющего объемную плотность, как описано ниже. Кристаллическое соединение структуры Ia (S-PG) SC-3 по изобретению получено согласно следующей сокращенной реакции, как показано на схеме I.(Кристаллическое) соединение (Ia S)-PG) формы SC-3 Как отмечено на схеме I, соединение В или If (все вместе относятся к соединению В), где соединение В в форме аморфного или кристаллического твердого вещества (If) обрабатывают агентом восстановления, таким как силилгидрид, предпочтительно алкилсилилгидрид, более предпочтительно триэтилсилан (или триэтилсилилгидрид), в присутствии активирующей группы, которая является кислотой Льюиса, такой как BCl3Me2S, BBr3, BF3OEt2, BCl3 или BF32CH3COOH, предпочтительно BF3OEt2 илиCH3CN/дихлорметан, метиленхлорид или вода, при температуре в пределах диапазона от приблизительно -15 до приблизительно 25 С, предпочтительно от приблизительно 5 до приблизительно 10 С, для восстановления соединения В и образования соответствующего основного соединения I которое отделяют от реакционной смеси и обрабатывают (S)-пропиленгликолем S)-PG) и органическим растворителем, таким как алкилацетат, как изложено выше, предпочтительно изопропилацетат или метилтретбутиловый эфир (МТВЕ), и, необязательно, затравкой соединенияS)-PG) Ia (молярное отношение затравка Ia:соединение В в пределах диапазона от приблизительно 0,1 приблизительно до 10%,предпочтительно приблизительно от 0,5 приблизительно до 3%), с образованием кристаллической суспензии соединения S)-PG) Ia, и выделяют кристаллическое соединение S)-PG) Ia из кристаллической суспензии. При выполнении вышеупомянутой сокращенной реакции схемы I силильный восстанавливающий агент будет использоваться в молярном соотношении к соединению В в пределах диапазона от приблизительно 1,2:1 до приблизительно 4,5:1, предпочтительно от приблизительно 2:1 до приблизительно 4:1,в то время как активирующая группа (кислота Льюиса) будет использоваться в молярном соотношении к силильному восстанавливающему агенту в пределах диапазона от приблизительно 1,2:1 до приблизительно 4,5:1, предпочтительно от приблизительно 2:1 до приблизительно 4:1. (S)-пропиленгликоль S)PG) будет использоваться в молярном соотношении к соединению В в пределах диапазона от приблизительно 0,9:1 до приблизительно 1,5:1, предпочтительно от приблизительно 0,98:1 до приблизительно 1,2:1; вода будет использоваться в молярном соотношении к (S)-PG в пределах диапазона от приблизительно 0,95:1 до приблизительно 5:1, предпочтительно от приблизительно 0,99:1 до приблизительно 2:1. Кристаллическое соединение структуры Ia S)-PG) формы SC-3 по изобретению может также быть получено согласно реакционной схеме II, изложенной ниже. Схема II где соединение А обрабатывают спиртовым растворителем, таким как метанол, этанол или изопропиловый спирт, предпочтительно метанол, водой и водным основанием, таким как гидроксид щелочного металла, таким как NaOH, KOH или LiOH, предпочтительно NaOH, предпочтительно в инертной атмосфере, такой как азот, при повышенной температуре в пределах диапазона от приблизительно 50 до приблизительно 85 С, предпочтительно от приблизительно 60 до приблизительно 80 С, чтобы получить соединение I. Водное основание будет использоваться в молярном соотношении к соединению в пределах диапазона от приблизительно 3,5:1 до приблизительно 5,5:1, предпочтительно от приблизительно 3:1 до приблизительно 5:1. Реакционную смесь, содержащую соединение I, обрабатывают органическим растворителем, таким как метилтретбутиловый эфир (МТВЕ) или алкилацетат, как описано выше, предпочтительно изопропилацетат или МТВЕ, выделяют соединение I, которое обрабатывают с (S)-пропиленгликолем, чтобы получить сгущенную суспензию, содержащую кристаллический продукт Ia (S)-PG, форма SC-3. Необязательно, добавляют затравку соединения S)-PG) Ia к реакционной смеси. Кристаллическое соединение Ia отделяют от суспензии с использованием традиционных процедур, например, суспензию соединения Ia обрабатывают органическим растворителем, таким как циклогексан, изооктан или метилциклогексан,предпочтительно циклогексан, и выделяют кристаллическое соединение Ia. В процессе образования соединения Ia (S)-PG используется в молярном соотношении к соединениюI в диапазоне от приблизительно 0,9:1 до приблизительно 1,5:1, предпочтительно от приблизительно 0,98:1 до приблизительно 1,2:1. Способ согласно изобретению для получения кристаллической формы соединения В, которая является формой If, осуществляют в соответствии со схемой III, изложенной ниже. Кристаллический сольват 1,4-бутиндиола If по изобретению получают согласно следующей реакционной схеме IV. где некристаллическое соединение В (которое может быть получено, как описано в US10/745075, поданной 23 декабря 2003 г., или в US 6515117) предпочтительно, по существу, в чистой форме (например,с чистотой от 50 до 100%) смешивают со смесью толуол/алкилацет (такой как этилацетат) и смесь нагревают до температуры в пределах диапазона от приблизительно 50 до приблизительно 70 С, предпочтительно от приблизительно 55 до приблизительно 65 С, добавляют 2-бутин-1,4 диол и нагревают, как указано выше, пока диол не растворится, добавляют затравку соединения If и смесь охлаждают до получения кристаллов соединения If. В альтернативном способе получения кристаллического соединения If соединение В растворяют в алкилацетате (таком как бутилацетат) или в смеси алкилацетат/гептан (от 0,5:1 до 1,5:1), при повышенной температуре в пределах диапазона от приблизительно 50 до приблизительно 70 С, предпочтительно от приблизительно 55 до приблизительно 65 С, добавляют 1,4-бутиндиол и смесь охлаждают до комнатной температуры до образования кристаллов соединения If. В предпочтительном воплощении соединение If кристаллизуют из смеси соединения В и толуол/алкилацетата (предпочтительно этилацетата), содержащей объемное отношение толуола к алкилацетату в пределах диапазона от приблизительно 1:1 до приблизительно 19:1, предпочтительно от приблизительно 4:1 до приблизительно 9:1. Смесь толуол/алкилацетат будет включать достаточное количество толуола, чтобы получить молярное соотношение к соединению В в пределах диапазона от приблизительно 40:1 до приблизительно 90:1, предпочтительно от приблизительно 60:1 до приблизительно 80:1 до образования сольвата 1,4-бутиндиола If. Кристаллизация для образования сольвата 1,4-бутиндиола If может быть более легко осуществлена с использованием кристаллов затравки соединения If в количестве от приблизительно 0,1 до приблизительно 10%, предпочтительно от приблизительно 0,5 до приблизительно 3% в расчете на вес исходного соединения В. В другом предпочтительном воплощении соединение If (которое может быть или может не быть очищено) кристаллизуют из смеси соединения В и алкилацетат/гептан (предпочтительно бутилацетат/толуол) необязательно с использованием затравки кристаллического соединения If, использующегося от приблизительно 0,1 до приблизительно 10%, предпочтительно от приблизительно 0,5 до приблизительно 3% затравки If в расчете на вес исходного соединения В. Алкилацетат будет использоваться при объемном соотношении с гептаном в пределах диапазона от приблизительно 0,5:1 до приблизительно 2:1, предпочтительно от приблизительно 1:1 до приблизительно 1:1,5. Кристаллический сольват 1,4-бутиндиола If может также быть получен в непрерывном процессе,как показано на схеме IVA. Синтез сольвата If включает две последовательные стадии с соединением Е и соединением D: (1) литирование соединения Е, чтобы получить литерованное промежуточное соединение G, и (2) связывание литированного промежуточного соединения G с соединением D. Со ссылкой на фиг. 7 показана блок-схема процесса (подобного раскрытому в US 7164015, который включен в настоящую заявку в качестве ссылки). В этом воплощении весь способ получения соединенияIf, как показано на схеме IVA, выполняют при некриогенных условиях. Ароматический реагент Е,имеющий группу, подходящую для лития и галогенового обмена, хранят в первом сосуде 1 при комнатной температуре. Литиевый реактив Q подают во второй сосуд 2 также при комнатной температуре. Ароматический реагент Е и литиевый реактив Q перемещают из сосудов 1 и 2 с помощью насосов 3 и 4,соответственно, к первому накрытому кожухом статическому миксеру 5. Температура реакции для получения литированных анионных частиц регулируется в диапазоне от приблизительно -30 до приблизительно 20 С в первом миксере 5 с помощью холодильника 6. Литированные анионные частицы G, таким образом образованные, подаются непосредственно из первого миксера 5 во второй статический миксер 22 по обычной линии подачи 19. Карбонилом замещенный реагент D подается в третий сосуд 20 при комнатной температуре и перемещается насосом 21 через холодильник 26, где он охлаждается до температуры в пределах диапазона от приблизительно -10 до приблизительно -30 С, и затем перемещается во второй покрытый кожухом статический миксер 22. Реакция для получения продукт гликозида Н регулируется во втором миксере 22 с помощью второго холодильника 23. Затем обработка в условиях гликозидирования происходит, где Н подается в обычный реактор 25,где его обрабатывают кислотой в спиртовом растворителе, предпочтительно MSA/MeOH или HCl/МеОН,с образованием Н' (десилилированного гемикеталя), который затем преобразовывают в гликозид В. Затем дополнительное выделение продукта и обратная экстракция и кристаллизация с 2-бутин-1,4-диолом(J) в смеси толуол/EtOAc позволяют получить кристаллический продукт If. Реактор 25 может поддерживаться при комнатной или другой некриогенной температуре в течение любых последующих реакций. Используемый литиевый реагент представляет собой по желанию органолитиевый реагент. Подходящие органолитиевые реагенты включают n-BuLi, S-BuLi и t-BuLi. Другие будут очевидны квалифицированным в данной области специалистам. После завершения реакции желаемый продукт If может быть выделен и очищен согласно методам,широко известным в данной области органической химии (например, осаждением, экстракцией растворителем, перекристаллизацией и хроматографией). Соединение If со снятием защитной группы само по себе может быть полезным в качестве промежуточного продукта или конечного продукта. Соединение If может реагировать далее с получением фармацевтически приемлемых кислотно-аддитивных или основных солей, с использованием методов, которые будут известны квалифицированным в данной области специалистам. Температура и время реакции - два важных параметра в непрерывном способе, показанном на схемеIVA: литированием можно управлять непрерывно от -30 (или ниже) до 20 С (или выше), предпочтительно приблизительно от -17 до приблизительно -10 С, от минут до секунд времени реакции. Для после- 10018229 дующей реакции связывания поток литированного производного G затем смешивают с потоком соединения D (третий поток подачи) в миксере. Смешанный поток можно затем направить в проточный реактор, если дополнительное время реакции необходимо для завершения. Реакцией связывания можно управлять непрерывно при более высоких температурах от -30 до -10 С (или выше), предпочтительно от приблизительно -30 до приблизительно -20 С, от минут до секунд времени реакции. Поток реакции связывания затем направляют в реактор периодического действия для дальнейших реакций, как описано в настоящей заявке. При непрерывном процессе и реакция литирования, и реакция связывания могут быть объединены и могут управляться при более высоких температурах, использующих меньшие проточные реакторы с эффективным температурным контролем, по сравнению с криогенными периодическими реакторами в масштабе. Рабочая температура непрерывного литирования в вышеупомянутом процессе может быть до 20 С(не ограничиваясь), предпочтительно от -17 до -10 С, производя 95 RAP желательного литированного промежуточного продукта G. В реакции связывания продукт связывания вышеупомянутого процесса при от -20 до -30 С предпочтительно находится в диапазоне 70-79 RAP. Соединение If может использоваться для получения кристаллического промежуточного продукта,как показано на схеме IVB. Схема IVB Получения промежуточного продукта А Со ссылкой на схему IVB соединение If, твердый DMAP, жидкий ацетонитрил и жидкий уксусный ангидрид нагревают до температуры в пределах диапазона от приблизительно 70 до приблизительно 85 С и выдерживают до тех пор, пока реакция не завершится. Загрузку охлаждают (например, 5 С). Триэтилсилан и комплекс трифторида бора с уксусной кислотой или другую кислоту Льюиса (как описано в отношении схемы I) добавляют к реакционной смеси. После того как реакция завершена, добавляют ацетон или другой растворитель. Загрузку нагревают (например, от приблизительно 20 до приблизительно 30 С) и выдерживают до тех пор, пока не израсходован триэтилсилан. Добавляют водный раствор NH4OAc и загрузку перемешивают и позволяют ей расслоиться на верхнюю и более нижнюю формы фаз. Восстанавливают загрузочный объем продукта в обогащенной верхней фазе, отгоняя ацетонитрил при минимальном перемешивании. SDA3A этанол добавляют при повышенной температуре (60 С). Продукт А кристаллизуют охлаждением или охлаждением с добавлением затравки (5 вес.% в расчете на соединение If влажного измельчения, измельченного в азотной струе, или предыдущую загрузку). Продукт перекристаллизовывают в виде или влажного, или сухого осадка из этанола SDA3A. Кристаллический сольват диметанола Ig по изобретению получают согласно следующей схеме реакции V. Схема V где некристаллическое соединение В (которое может быть получено, как описано в US10/745075, поданной 23 декабря 2003 г., или в US 6515117) предпочтительно, по существу, в чистой форме (чистота от 50 до 100%) растворяют в метаноле, смеси метанол/толуол или смеси метанол/толуол/гептан, смеси метанол/метилтретбутиловый эфир (МТВЕ)/гептан или смеси метанол/толуол/этилацетат или другой алкилацетат, при перемешивании, с образованием белой суспензии, содержащей кристаллический сольват диметанола Ig. Кристаллический сольват диметанола Ig можно выделить из суспензии с использованием обычных методик, таких как фильтрация. Вышеупомянутый процесс может быть выполнен при комнатной температуре, хотя могут использоваться повышенные температуры до приблизительно 20-25 С, чтобы усилить кристаллизацию. В предпочтительном воплощении соединение Ig кристаллизуют из смеси метанол/толуол, содержащей объемное соотношение метанола к толуолу в пределах диапазона от приблизительно 6:1 до приблизительно 1:1, предпочтительно от приблизительно 3:1 до приблизительно 5:1. Смесь метанол/толуол будет включать достаточное количество метанола, чтобы получить мольное соотношение к соединению В в пределах диапазона от приблизительно 80:1 до приблизительно 10:1, предпочтительно от приблизительно 40:1 до приблизительно 20:1, чтобы способствовать образованию сольвата диметанола Ig. Кристаллизация для образования сольвата диметанола Ig может быть более легко выполнена с использованием затравочных кристаллов соединения Ig в количестве от приблизительно 0,1 до приблизительно 10%, предпочтительно от приблизительно 0,5 до приблизительно 3% в расчете на вес исходного соединения В. В другом предпочтительном воплощении соединение Ig (которое может быть или, возможно, может не быть очищено) кристаллизуют из смеси метанол/толуол/гептан с добавлением затравки кристаллического соединения Ig, использующего в диапазоне от приблизительно 0,1 до приблизительно 10%, предпочтительно от приблизительно 0,5 до приблизительно 3% в расчете на вес исходного соединения В. Метанол будет использоваться при объемном соотношении к толуолу в пределах диапазона от приблизительно 1:0,5 до приблизительно 1:6, предпочтительно от приблизительно 1:1,5 до приблизительно 1:2,5 и при объемном соотношении гептан:толуол в пределах диапазона от приблизительно 2:1 до приблизительно 0,5:1, предпочтительно от приблизительно 1,3:1 до приблизительно 0,5:1. Следующие примеры обеспечиваются для описания изобретения в дальнейших деталях. Указанные примеры, которые формулируют лучший способ осуществления, рассматриваются для осуществления изобретения, предназначены для иллюстрации, а не для ограничения изобретения. Получение соединений формулы I, главным образом, описано в US 6414126 и особенно раскрыто на схеме 1 и в примере 1 US 5515117. US 6414126 и US 5515117 полностью включены в настоящую заявку в качестве ссылки. Стабильные формы соединений формулы (I) могут быть кристаллизованы в виде сольватов (например, гидратов). Примеры получения кристаллических структур Пример 1. Получение (S)-пропиленгликоля S)-PG) структуры - формы SC-3 - формулы Ia Соединение А может быть получено, как описано в примере 1, части Е US 6515117. Стеклянный реактор на 10 л, оборудованный термопарой и вводом для азота, промывают МеОН (1,25 л), деминерализованной водой (3,6 л) и затем 50%-м водным раствором NaOH (205,9 мл, 3,899 моль). Остаточный раствор NaOH в градуированном цилиндре помещают с водой (94 мл) в реактор. Добавляют соединение А (503,11 г, 0,872 моль) и смесь размешивают и нагревают до температуры 68 С в течение более чем 1,5 ч. Через 1 ч температуру бани с циркуляцией понижают от 80 до 70 С; внутренняя температура стала 65 С. После в общей сложности 3 ч ВЭЖХ (колонка: YMC ODS-A (С-18) S3, 4,650 мм,растворитель А: 0,2% вод. раствор Н 3 РО 4, растворитель В: 90% CH3CN/10% Н 2 О, исходное %В=0, конечное %В=100, градиент времени 8 мин; время удерживания 3 мин, интегрированное время остановки 11,0 мин, расход 2,5 мл/мин, длина волны УФ 220 нм) обозначает завершение реакции, соединение I АР 99,5. После того как смесь была охлаждена до температуры 25 С, добавляют изопропилацетат (2,5 л). Смесь размешивают в течение 10 мин и затем водный слой отделяют (рН 12,5) и органический слой промывают водой (1 л). В течение этой промывки рН двухфазной системы регулируют до 6,0 конц. HCl (5,0 мл) и затем водный слой отделяют. (Была осуществлена нейтрализация перед фазовым разделением, чтобы предотвратить загрязнение продукта с NaOH. (S)-PG структура, полученная без нейтрализации, была немного основной [рН 8,3 суспензии, диспергированной с помощью ультразвука в воде (20 мг/мл)]). Органический слой собирают в отдельном сосуде. Реактор промывают водой (2 л), МеОН (2 л) и продувают азотом. Влажный раствор соединения В добавляют в реактор и вводят (S)-пропиленгликоль S)PG) (67,03 г, 0,872 моль). Необязательно, на данной стадии могут быть добавлены затравочные кристаллы (S)-PG Ia. Мгновенная кристаллизация позволяет получить сгущенную суспензию. После перемеши- 12018229 вания в течение 1 ч быстро добавляют циклогексан (2,5 л) в течение 10 мин и перемешивание продолжают в течение 21 ч. Продукт фильтруют через фильтровальную бумагу (Whatman 5, воронка Бюхнера с диаметром 24"). Фильтрация осуществляется быстро и занимает приблизительно 15 мин. Отфильтрованный осадок промывают смесью (1:1) МТВЕ/циклогексан (21 л) и сушат под вакуумом в течение 0,5 ч. Твердое вещество помещают на тарелку из пирекса и сушат под вакуумом (25 мм рт.ст.) в сушильном шкафу при температуре 25-30 С в течение двух дней, пока водный анализ KF не будет соответствовать моногидрату (3,6 вес.%). Получают продукт (S)-PG Ia (0,425 кг, выход 97%) в виде белоснежного твердого вещества, ВЭЖХ метод (мобильная фаза А: 0,05% TFA в Н 2 О, мобильная фаза В: TFA: 0,05% в CAN. Колонка: YMC Hydrosphere 4,6150 (3 мкм). Градиент: 30-90% В в течение 45 мин, удерживание 5 мин; обратно к 30% В и повторное уравновешивание в течение 10 мин. Длина волны: 220 нм. Объем инъекции: 10 мкл. Температура: окружающей среды). АР 99,7. Затравочные кристаллы могут быть получены растворением соединения I в растворителе, таком как МТВЕ, и обработкой получающегося раствора с (S)-пропиленгликолем и осуществлением процесса, как описано выше, без использования затравки. Пример 1A. (S)-пропиленгликоль S)-PG) структураформа SC3 - формула Ia Процедура. 20 г соединения А загружают в реактор при температуре и давлении окружающей среды. В реактор добавляют 30 мл метанола и 49,75 мл 3 Н NaOH и реакционную смесь нагревают до температуры 80 С или кипятят с обратным холодильником и выдерживают приблизительно 2-3 ч для завершения реакции 0,5 АР. Загрузку охлаждают до температуры 20 С и нейтрализуют до рН 6,0-7,5 с использованием конц.HCl или 1 Н уксусной кислоты (требуется 1 мл/гм загрузки). Экстракция. Продукт экстрагируют из реакционной смеси 100 мл изопропилацетата, водную фазу отделяют и органическую фазу промывают водой до удельной электропроводности 10 мС (4 мл/г загрузки). Водную фазу отделяют. Кристаллизация. 2.8 г (1,05 экв.) (S)-(+)-1,2-пропандиола добавляют к реакционной смеси. В загрузку добавляют затравочные кристаллы 0,1 г соединения I. Добавляют 160 мл циклогексана и загрузку охлаждают от комнатной температуры до температуры 5 С. Загрузку перемешивают от комнатной температуры до температуры 5 С по крайней мере в течение 1 ч до выделения. Выделение и сушка. Каждый образец выделенного осадка промывают смесью 50/50 по объему изопропилацетат/циклогексан. Осадок сушат при температуре 30 С в вакуумном сушильном шкафу под глубоким вакуумом (осадок высушен, когда KF=3,6-4,1%). Выход=84% (без учета погрешностей). Характерная чистота=99,81 АР. Характерное содержание PG=15,1-15,8% посредством ГХ. Пример 6. Получение сольвата (S)-PG формы SC-3 Ia К ацетонитрилу (12 мл) при температуре бани 8-10 С в атмосфере азота загружают диэтилэтерат трифторида бора (2,3 мл, 18,4 ммоль) и воду (0,82 мл, 4,6 ммоль). После выдерживания вышеупомянутой смеси в течение приблизительно 1 ч добавляют триэтилсилан (3 мл, 18,4 ммоль). Полученную смесь выдерживают в течение приблизительно 1 ч и затем добавляют соединение В (полученное, как описано в примере 17) в 10 мл ацетонитрила. Загрузку выдерживают при температуре 5-10 С. При завершении реакции, как определяется ВЭЖХ, реакционную смесь гасят водным ацетатом аммония (24 мл; 85 г) в 200 мл воды. Фазы разделяют и органическую фазу, обогащенную продуктом, сушат над сульфатом натрия. Органическую фазу, обогащенную продуктом, концентрируют при пониженном давлении. Воду (13 мг, 0,7 ммоль в расчете на 0,3 г сырого соединения В в загрузке), (S)-пропиленгликоль (56 мг, 0,7 ммоль), метил-трет-бутиловый эфир (5 мл, 17 мл/г соединения В в загрузке), затравку соединения Ia (20 мг) смешивают и выдерживают в течение 1 ч до образования суспензии кристаллов. Добавляют циклогексан (10 мл, 33 мл/г соединения В (загрузка. Кристаллический продукт (Ia) выделяют фильтрацией (4-5%) и сушат в вакууме при температуре 20-25 С. Пример 7. Получение кристаллического сольвата МеОН Ig Кристаллы метанольного сольвата Ig получают растворением чистого соединения В в метаноле и перемешиванием при комнатной температуре. Белая суспензия образуется после нескольких дней и, как обнаруживают, является кристаллическим метанольным сольватом Ig. Таким образом, полученный кристаллический di-MeOH сольват Ig может использоваться вместо соединения В в получении кристаллического соединения Ia, как описано в примере 6. Пример 10. Получение кристаллического сольвата 1,4-бутиндиола If из соединения В в смеси толуол/этилацетат, используя затравку. Сольват 1,4-бутиндиола может быть кристаллизован в алкилацетате (например, этил-, пропил- или бутилацетате), спирте (например, изопропаноле, бутаноле) или даже в воде. Толуол и гептан действуют как антирастворители, когда кристаллизуются в алкилацетате. 50 г (90,3 вес.%) соединения В растворяют в 675 мл толуола. Раствор нагревают до температуры 60 С и добавляют 75 мл этилацетата. Добавляют 1,5 экв. 2-бутин-1,4-диола (=13,3 г) и смесь выдерживают при температуре 60 С до тех пор, пока бутиндиол не растворится. Раствор охлаждают до темпера- 14018229 туры 55 С и добавляют 0,1% затравки (50 мг) соединения 1,4-бутиндиола If. Смесь выдерживают в течение 1 ч при температуре 55 С. Соединение If начинает кристаллизоваться. Смесь охлаждают до температуры 25 С в течение 6 ч. Полученную суспензию размешивают в течение 3 ч перед выделением (концентрация маточного раствора составляет 3 мг/мл), отфильтровывают и промывают 180 мл толуола + 20 мл этилацетата и сушат под вакуумом при температуре 45 С, чтобы получить кристаллы сольвата 1,4 бутиндиола If. ВЭЖХ АР=99,5%. Активность=80,7 вес.% (рассчитанная активность=83,6% для сольвата 1:1). Выход=95%. Пример 11. Получение кристаллического сольвата 1,4-бутиндиола If из соединения В в смеси бутилацетат/гептан. 0,5 г соединения В (91 вес.%) растворяют в 3,5 мл бутилацетата + 3,5 мл гептана при температуре 60 С. Добавляют 1,5 экв. 2-бутин-1,4-диола и смесь охлаждают до комнатной температуры. Полученную суспензию размешивают в течение 12 ч, фильтруют и промывают 1 мл смеси 1:1 бутилацетат:гептан и сушат под вакуумом при температуре 50 С, чтобы получить кристаллы сольвата 1,4-бутиндиола If. Активность=85,1%. Выход=90%. Сольват 1,4-бутиндиола If может использоваться вместо соединения В при использовании кислоты Льюиса BF32 СН 3 СООН вместо BF3OEt2, чтобы получить кристаллическое соединение Ia. Пример 16. Получение соединения If с помощью непрерывных реакций литирования и связывания Используется схема реакции, подобная той, которая показана на схеме IVA и фиг. 7. Устанавливают холодильник (-30 С) для реактора литирования 5 (снабженный рубашкой статический смеситель 5). Устанавливают холодильник (-30 С) для реактора связывания 22 (снабженный рубашкой статический смеситель 22) и теплообменник предварительного охлаждения (не показан на фиг. 7) для смеси подачи соединение D/толуол. Непрерывное литирование. Два потока подачи смесь E/THF/толуол (2,74 мл/мин) и Q, а именно n-BuLi в гексане (0,41 мл/мин) смешивают и объединяют с помощью снабженного рубашкой статического смесителя 5 (-30 С). Перед перекачкой потока подачи D/толуол, толуол (2,96 мл/мин) направляют в систему в виде свежего потока для поддержания расхода общего потока постоянным при 6,1 мл/мин. Образцы на выходе статического смесителя литирования 5 собирают для анализа ВЭЖХ. Образцы берут прежде (а) начала реакции связывания и (b) после сбора реакционной смеси в реакторе MSAMeOH. Непрерывная реакция связывания. Поток подачи D/толуол (2,96 мл/мин) предварительно охлаждают с помощью теплообменника перед смешиванием с потоком литирования. Эти два потока, а именно G и D, смешивают и объединяют в снабженном рубашкой статическом смесителе 22 (между-24 и -30 С). Поток реакции является желтоватым по цвету. Образцы собирают на выходе смесителя 22 для анализа ВЭЖХ. Образцы берут до и после сбора в реакторе MSA-MeOH 25. Метилгликозидирование. Поток реакции связывания 24 направляют в реактор 25 на 500 мл, содержащий MSA и метанол или смесь HCl/MeOH при температуре -10 С при перемешивании. После окончания сбора реакционную смесь хранят при температуре -10 С при перемешивании в течение следующего часа. Реакционную смесь нагревают до температуры 35 С. Реакцию считают завершенной (приблизительно 6 ч) тогда, когда анализ ВЭЖХ покажет, что RAP десилилированного гемикеталя Н'0,3%. Реакционную смесь охлаждают до комнатной температуры (20 С) и реакционную смесь выдерживают в течение 16 ч, чтобы получить соединение В. Образование кристаллов If. Соединение В кристаллизуют с 2-бутин-1,4-диолом (J) в смеси толуол/EtOAc, чтобы получить кристаллы If. Пример 17. Получение промежуточного продукта А Твердое соединение If (50,0 г), твердый DMAP (1,2 г), жидкий ацетонитрил (450 мл) и жидкий уксусный ангидрид (63 мл) загружают в реактор в виде сосуда на 250 мл. Загрузку (77 С) нагревают и выдерживают до завершения реакции. Загрузку охлаждают (5 С). Триэтилсилан (72 мл) и комплекс уксусной кислоты и трифторида бора (63 мл) загружают в реактор. После завершения реакции добавляют ацетон (36 мл). Загрузку (21 С) нагревают и выдерживают, пока не израсходуется триэтилсилан. Водный раствор NH4OAc (33 вес.%, 450 мл) добавляют и загрузку перемешивают, позволяя расслоиться на верхнюю и нижнюю фазы, которые образуются. Загрузочный объем продукта в богатой верхней фазе восстанавливают отгонкой ацетонитрила при минимальном перемешивании. Этанол SDA3A (1 л) загружают при повышенной температуре (60 С). Продукт кристаллизуют охлаждением или охлаждением с добавлением затравки (5 вес.%, в расчете на соединение If влажного измельчения, измельчения в струе азота или предыдущей загрузки). Продукт обычно выделяют с выходом 75%. Продукт перекристаллизовывают или в виде влажного, или сухого осадка из этанола SDA3A. Исследование кристаллических структур Кристаллические структуры, эквивалентные кристаллическим структурам, описанным ниже и заявленным в настоящей заявке, могут демонстрировать подобные, но все же неидентичные, аналитические характеристики в пределах приемлемого диапазона погрешности в зависимости от испытательных условий, чистоты, оборудования и других обычных переменных, известных квалифицированным в данной области специалистам. Соответственно, будет очевидно квалифицированным в данной технологии специалистам, что могут быть сделаны различные модификации и изменения в настоящем изобретении, не отступая от объема и сущности изобретения. Другие воплощения изобретения будут очевидны квалифицированным в технологии специалистам из соображения описания и практики изобретения, раскрытого в настоящей заявке. Указано, что описание и примеры необходимо рассматривать в качестве образца, но не ограничивая объем изобретения. Дифракция рентгеновских лучей на порошке. Квалифицированный в данной области специалист оценит, что дифракционная рентгенограмма может быть получена с погрешностью измерения, которая зависит от используемых условий измерения. В частности, общеизвестно, что интенсивность на дифракционной рентгенограмме на порошке может колебаться в зависимости от используемых условий измерения. Должно далее быть понятно, что относительные интенсивности могут также изменяться в зависимости от экспериментальных условий и, соответственно, точный порядок интенсивности не должен быть принят во внимание. Дополнительно погрешность измерения угла дифракции для обычной дифракционной рентгенограммы на порошке составляет обычно приблизительно 5% или меньше и такая степень погрешности измерения должна быть принята во внимание как имеющая отношение к вышеупомянутым углам дифракции. Следовательно, долж- 16018229 но быть понятно, что кристаллические структуры настоящего изобретения не ограничиваются кристаллическими структурами, которые обеспечиваются дифракционными рентгенограммами на порошке,полностью идентичными дифракционным рентгенограммам на порошке, изображенным в приложенных фигурах, раскрытых в настоящей заявке. Любые кристаллические структуры, которые обеспечиваются дифракционными рентгенограммами на порошке, в основном идентичными раскрытым в приложенных фигурах, находятся в объеме настоящего изобретения. Способность устанавливать реальные тождества дифракционных рентгенограмм на порошке находится в пределах навыков квалифицированных в данной области специалистов.(PXRD). Образец был перемещен в ячейку Philips MPD (45 KB, 40 мА, Cu K1). Данные собирают при комнатной температуре при 2-32 2 (способ непрерывного сканирования, частота сканирования 0,03/с,щели автодивергенции и антирассеяния, приемная получая щель 0,2 мм, вращатель образца ON). Рентгенограмма на порошке для структур (S)-PG (Ia) проиллюстрирована на фиг. 1. Рентгенограмма на порошке для сольвата 1,4-бутиндиола If проиллюстрирована на фиг. 5 соответственно. Выбранные положения дифракционных пиков (градусы 20,2) для (S)-PG (Ia) показаны в табл. 1, приведенной ниже. Характерные положения дифракционного пика (градусы 20,1) при КТ являются основанными на рентгенограмме высокого качества, снятой с помощью дифрактометра (CuK) с вращающимся капилляром с 2, калиброванным Национальным институтом стандартов и методологии технологии и других пригодных стандартов, известных квалифицированным в данной области специалистам. Относительные интенсивности, однако, могут изменяться в зависимости от размера и морфологии кристалла. Таблица 1 Выбранные пики PXRD (20,2) Ядерный магнитный резонанс в твердой фазе. Структура (S)-PG (Ia) сольвата 1,4-бутиндиола If охарактеризована методами ЯМР в твердой фазе. Все измерения ЯМР С-13 в твердой фазе были сделаны на приборе Bruker DSX-400, спектрометром ЯМР 400 МГц. Спектры с высоким разрешением получают, используя мощное протонное расщепление импульсного режима ТРРМ и поперечную поляризацию линейно нарастающей амплитуды (RAMP-CP) с магическим углом вращения (MAS) при приблизительно 12 кГц А.Е. Bennett et al., J. Chem. Phys., 1995,103, 6951; G. Metz, X. Wu и S.O. Smith, J. Magn. Reson. A, 1994, 110, 219-227). Приблизительно 70 мг образца, помещенного в контейнер с ротором из двуокиси циркония, использовалось для каждого эксперимента. Химические сдвигибыли отнесены к внешнему адамантану с высокочастотным резонансом,установленным до 38,56 ч./млн (W.L. Earl и D.L. VanderHart, J. Magn. Reson., 1982, 48, 35-54). Полученный 13 С ЯМР CPMAS спектр для структуры (S)-PG показан на фиг. 2. Основные резонансные пики для спектра углерода в твердой фазе (S)-PG упомянуты ниже в табл. 1A и 2 и для сольвата 1,4-бутиндиола If упомянуты ниже в табл. 2 А соответственно. Кристаллические структуры, демонстрирующие в основном аналогичные положения пиков 13 С ЯМР, где "в основном аналогичный" означает от 10 до 15% безразмерного значения, как считается, находятся в рамках настоящего изобретения (т.е. эквиваленты к структурам, проиллюстрированным ниже). Таблица 1 А Положения пика протонного ЯМР для сольвата (S)-пропиленгликоля Ia 1 Указанные данные точно действительны для спектрофотометра на 400 МГц. Таблица 2 А Положения пика протонного ЯМР для сольвата 1,4-бутиндиола If 1 Н ЯМР (400 МГц, CDCl3)1.33 (т, 3 Н, J=7.1 Гц, -СН 3), 2.90 (с, 2 Н, -СН 2), 3.39 (с, 9 Н, -ОСН 3), 3.43.65 (м, 3 Н), 3.81 (уш.м, 2 Н), 3.91 (q, 2 Н, J=7.1 Гц, -СН 2), 3.97 (м, 1 Н), 6.73 (д, 1H, J=8.6 Гц, Ar-Н), 7.02 (д,2 Н, J=8.4 Гц, Ar-Н), 7.25 (с, 2 Н, Ar-Н), 7.34 (с, 1H, Ar-Н); 13 С (CDCl3)14,78, 38.43, 49.14, 50.57, 61.84, 63.34, 69.98, 72.53, 74.63, 100.95, 114.36, (2), 126.64,129.19, 129.59, 129.71, 131.38, 134.30, 136.61, 138.50, 157.27. Т.пл. 103,08 С. Термогравиметрический анализ. Эксперименты термогравиметрического анализа (TGA) были выполнены на приборе ТАInstruments модели Q500. Образец (приблизительно 10-30 мг) помещают в платиновый резервуар,предварительно измеренный. Вес образца измеряют точно и регистрируют до тысячной миллиграмма с помощью прибора. Печь продувают азотом при 100 мл/мин. Данные собирают между комнатной температурой и 300 С при скорости нагревания 10 С/мин. Диаграмма TGA для структуры (S)-PG Ia показана на фиг. 3. Потери веса соответствуют 1 моль воды и 1 моль пропиленгликоля на 1 моль проанализированной структуры. Дифференциальная сканирующая калориметрия. Температурный режим твердого состояния структур (S)-PG Ia и сольвата 1,4-бутиндиола If был исследован с помощью дифференциальной сканирующей калориметрии (DSC). Диаграмма DSC для структур (S)-PG Ia показана на фиг. 4. Диаграмма DSC для структуры сольвата 1,4-бутиндиола If показана на фиг. 6. Эксперименты дифференциальной сканирующей калориметрии (DSC) были выполнены на приборе ТА Instruments модели Q1000. Образец (приблизительно 2-6 мг) взвешивают в алюминиевом резервуаре и взвешивают точно до одной сотой миллиграмма и направляют на DSC. Прибор продувают азотом при 50 мл/мин. Данные собирают между комнатной температурой и 300 С при скорости нагревания 10 С/мин. График сделан с эндотермическими пиками, направленными вниз. Специалисту, квалифицированному в данной области, будет понятно, что при измерении DSC есть определенная термодинамическая степень изменчивости в фактическом действительном масштабе измерений и пиковых температурах в зависимости от скорости нагревания, кристаллической формы и чистоты и других параметров измерения. Рентгенографический анализ монокристалла. Монокристалл для структуры (S)-PG Ia и для структуры сольвата 1,4-бутиндиола If получают и исследуют посредством дифракции рентгеновских лучей. Данные собирают на дифрактометре серии Bruker-Nonius CAD4 (BRUKER AXS, Inc., 5465 EastCheryl Parkway Madison, WI 53711 USA). Параметры элементарной ячейки получают посредством анализа методом наименьших квадратов экспериментальных значений параметров дифрактометра при 25 отражениях под большими углами. Интенсивности были измерены, используя CuK излучение (=1,5418) при постоянной температуре с -2 различными методиками сканирования, и были скорректированы только для факторов поляризации Лоренца. Фоновые индексы собирают при крайних наблюдаемых значениях в течение половины времени сканирования. Поочередно данные монокристалла собирают на приборе Bruker-Nonius Kappa CCD 2000 system, используя CuK излучение (=1,5418 ). Индексирование и проведение измерений данных интенсивности были выполнены с программным обеспечениемSweet, R.M. (Academic, NY), Vol. 276, pp. 307-326) с пакетом программ (Collect Data collection and processing user interface: Collect: Data collection software, R. Hooft, Nonius B.V., 1998). Если указано, то кристаллы охлаждают в холодном потоке криосистемы Oxford cryo system во время сбора данных (Oxford Cryosystems Cryostream cooler: J. Cosier и A.M. Glazer, J. Appl. Cryst, 1986, 19,105). Структуры решены прямыми методами и уточнялись на основе наблюдаемых отражений, используя или пакет программ SDP (SDP, Structure Determination Packge, Enraf-Nonius, Bohemia NY 11716 Scatteringfactors, including/' and/", in the SDP software were taken from the "International Tables for Crystallography",Kynoch Press, Birmingham, England, 1974; Vol. IV, Tables 2.2A and 2.3.1) с незначительными изменениями, или пакет программ по кристаллографии MAXUS (maXus solution and refinement softwaresuite: S. Mackay, C.J. Gilmore, С. Edwards, M. Tremayne, N. Stewart, K. Shankland. maXus: a computer program for the solution and refinement of crystal structures from diffraction data). Полученные атомные параметры (координаты и температурные коэффициенты) уточнены с помощью метода наименьших квадратов с полной матрицей. Функция, минимизированная при уточнении,былаw(F0 - Fc)2, R определен как F0 - Fc/F0, где Rw = w(F0 - Fc)2/wF02]1/2, где w - соответствующая весовая функция, основанная на погрешностях в наблюдаемых интенсивностях. Различные диаграммы исследованы на всех стадиях уточнения. Водороды введены в теоретических положениях с изотропными температурными коэффициентами, но водородные параметры не были изменены. Параметры элементарной ячейки для структуры (S)-PG формы Ia, SC-3 упомянуты ниже в табл. 3. Как используется в настоящей заявке, параметр элементарной ячейки "молекулы/на ячейку" относится к количеству молекул соединения в элементарной ячейке. Таблица 3 Данные элементарной ячейки для (S)-PG (Ia)Z' = количество молекул препарата на асимметричную ячейку;Vm = V (элементарная ячейка)/(Z молекул препарата на ячейку);SG = пространственная группа. Табл. 4, приведенная ниже, формулирует позиционные параметры для структуры (S)-PG Ia при температуре 25 С. Таблица 4 Позиционные параметры для (S)-PG при Т=25 С Параметры элементарной ячейки для сольвата 1,4-бутиндиола If упомянуты ниже в табл. 5. Таблица 5 Данные элементарной ячейки для сольвата 1,4-бутиндиола IfZ' = количество молекул препарата на асимметричную ячейку;Vm = V (элементарная ячейка)/(Z молекул препарата на ячейку);SG = пространственная группа. В табл. 6, приведенной ниже, представлены позиционные параметры для сольвата 1,4-бутиндиола If при температуре 25 С. Таблица 6 Таблица фракционных атомных координат для сольвата 1,4-бутиндиола If при Т=25 С Атомный фактор заполнения обусловлен неупорядоченностью растворителя 2-бутин-1,4-диола в кристаллической структуре. Полезность и комбинации А. Полезность. Соединение настоящего изобретения обладает активностью ингибиторов натрийзависимых переносчиков глюкозы, найденных в кишечнике и почке млекопитающих. Предпочтительно соединение по изобретению является селективным ингибитором ренальной активности SGLT2 и поэтому может использоваться при лечении заболеваний или расстройств, связанных с активностью SGLT2. Соответственно, соединение настоящего изобретения можно вводить млекопитающим, предпочтительно людям, для лечения разновидности состояний и расстройств, включая, но не ограничиваясь, лечение или задержку прогрессирования или начала диабета (включая тип I и тип II, сниженную толерантность к глюкозе, инсулинрезистентность и осложнения диабета, такие как нефропатия, ретинопатия, невропатия и катаракта), гипергликемию, гиперинсулинемию, гиперхолестеринемию, дислипидемию, повышенные уровни жирных кислот или глицерина в крови, гиперлипидемию, гипертриглицеридемию,ожирение, лечение ран, ишемию тканей, атеросклероз и гипертонию. Соединение настоящего изобретения может также использоваться, чтобы увеличить в крови уровни липопротеина высокой плотности(HDL). Кроме того, состояния, заболевания и расстройства, все вместе, на которые ссылаются как на "синдром X" или метаболический синдром, как детально описано в Johannsson, J. Clin. Endocrinol. Metab., 82,727-34 (1997), можно лечить, используя соединение настоящего изобретения. Кристаллические соединения (S)-PG (SC-3) (Ia) можно вводить в дозированных формах и в дозировках, как раскрыто в US 6515117, раскрытие которого полностью включено в настоящую заявку в качестве ссылки. В. Комбинации. Настоящее изобретение включает в пределах его объема фармацевтические композиции, включающие активный компонент, терапевтически эффективное количество соединения формулы I, включая (S)PG (форма SC-3, Ia), одно или в комбинации с фармацевтическим носителем или разбавителем. Необязательно, соединение настоящего изобретения может использоваться в виде индивидуального лечения или использоваться в комбинации с одним или несколькими другими терапевтическим(и) агентом(ами). Другие "терапевтические агент(ы)", подходящие для комбинации с соединением настоящего изобретения, включают, но не ограничиваясь, известные терапевтические агенты, полезные в лечении вышеупомянутых расстройств, включая антидиабетические агенты; антигиперглицемические агенты; гиполипидемические/липидпонижающие агенты; агенты против ожирения; противогипертонические агенты и супрессивные средства аппетита. Примеры подходящих антидиабетических агентов для использования в комбинации с соединением настоящего изобретения включают бигуаниды (например, метформин или фенформин), ингибиторы глюкозидазы (например, акарбоза или миглитол), инсулины (включая средства, усиливающие секрецию инсулина, или сенсибилизаторы инсулина), меглитинид (например, репаглинид), сульфонилмочевины(например, глимепирид, глибурид, гликлазид, хлорпропамид и глипизид), комбинации бигуанид/глибурид (например, Glucovance (глюкованс, тиазолидиндионы (например, троглитазон, росиглитазон и пиоглитазон), агонисты PPAR-, агонисты PPAR-, двойные агонисты PPAR /, ингибиторы гликогенфосфорилазы, ингибиторы связывающего белка жирной кислоты (аР 2), глюкагонподобного пептида-1 (GLP-1) или другие агонисты рецептора GLP-1 и ингибиторы дипептидилпептидазы IV(DPP4). Полагается, что использование соединения формулы I в комбинации по крайней мере с одним или несколькими другими антидиабетическим(и) агентом(ами) обеспечивает антигиперглицемический эффект больше, чем это возможно от каждого в отдельности из этих лекарств, одних и больше, чем объединенные аддитивные антигиперглицемические эффекты, произведенные этими лекарствами. Другие подходящие тиазолидиндионы включают Mitsubishi's MCC-555 (раскрытый в US 5594016),фараглитазар фирмы GIaxo-Wellcome (GI-262570), энглитазон (СР-68722, фирмы Pfizer) или дарглитазонgamma. Effect on PPAR alpha Activation on Abnormal Lipid Metabolism in Liver of Zucker Fatty Rats", Diabetes, 47, 1841-1847 (1998), WO 01/21602 и в US 6653314, раскрытие которых полностью включено в настоящую заявку в качестве ссылки, используя дозы, такие же, как там изложено, где соединения, определяемые как предпочтительные, предпочтительны для использования в настоящей заявке. Подходящие ингибиторы аР 2 включают раскрытые в американской заявке 09/391053, поданной 7 сентября 1999 г., и в американской заявке 09/519079, поданной 6 марта 2000 г., используя дозы, как в них указано. Подходящие ингибиторы DPP4 включают раскрытые в WO 99/38501, WO 99/46272, WO 99/67279Lett., Vol. 6, No. 22, pp. 1163-1166 and 2745-2748 (1996), соединения, раскрытые в US10/899641, WO 01/68603 и в US 6395767, используя дозировки, как изложено в вышеупомянутых ссылках. Другие подходящие меглитиниды включают натеглинид (Novartis) или KAD1229 (PF/Kissei). Примеры подходящих антигиперглицемических агентов для использования в комбинации с соединением настоящего изобретения включают глюкагонподобный пептид-1 (GLP-1), такой как GLP-1(136)амид, GLP-1(7-36)амид, GLP-1(7-37) (как раскрыто в US 5614492), а также такой как эксенатид(Amylin/Lilly), LY-315902 (Lilly), MK-0431 (Merck), лираглутид (NovoNordisk), ZP-10 (Zealand Pharmaceuticals A/S), CJC-1131 (Conjuchem Inc) и соединения, раскрытые в WO 03/033671. Примеры подходящих гиполипидемических/липидпонижающих агентов для использования в комбинации с соединением настоящего изобретения включают один или более ингибиторов МТР, ингибиторов редуктазы HMG СоА, ингибиторов скваленсинтазы, производных фиброевой кислоты, ингибиторов АСАТ, ингибиторов липоксигеназы, ингибиторов абсорбции холестерина, ингибиторов сотранспортераNa+/желчная кислота, активаторов активности рецептора LDL, секвестрантов желчных кислот, белковпереносчиков эфиров холестерина (например, ингибиторы СЕТР, такие как торцетрапиб (СР-529414,Pfizer) и JTT-705 (Akros Pharma, агонистов PPAR (как описано выше) и/или никотиновой кислоты и е производных. Ингибиторы МТР, которые могут использоваться, как описано выше, включают раскрытые в US 5595872, US 5739135, US 5712279, US 5760246, US 5827875, US 5885983 и US 5962440. Ингибиторы HMG СоА редуктазы, которые могут использоваться в комбинации с одним или более соединениями формулы I, включают мевастатин и соответствующие соединения, как раскрыто в US 3983140, ловастатин (мевинолин) и соответствующие соединения, как раскрыто в US 4231938, правастатин и соответствующие соединения, такие как раскрытые в US 4346227, симвастатин и соответствующие соединения, как раскрыто в US 4448784 и 4450171. Другие ингибиторы HMG СоА редуктазы, которые могут использоваться в настоящей заявке, включают, но не ограничиваясь, флувастатин, раскрыты в US 5354772, церивастатин, как раскрыто в US 5006530 и 5177080, аторвастатин, как раскрыто в US 4681893,- 23018229US 5011930, висастатин (фирмы Shionogi-Astra/Zeneca (ZD-4522, как раскрыто в US 5260440 и соответствующие соединения статина, раскрытые в US 5753675, аналоги пиразола производных мевалонолактона, как раскрыто в US 4613610, аналоги индена производных мевалонолактона, как раскрыто в заявкеWO 86/03488, 6-[2-(замещенный пиррол-1-ил)алкил)пиран-2-оны и их производные, как раскрыто в US 4647576, SC-45355 фирмы Searle (производное 3-замещенной пентандиовой кислоты) дихлорацетат, аналоги имидазола мевалонолактона, как раскрыто в заявке WO 86/07054, производные 3-карбокси-2 гидроксипропанфосфоновой кислоты, как раскрыто во французском патенте FR 2596393, 2,3 дизамещенные производные пиррола, фурана и тиофена, как раскрыто в ЕР 0221025, нафтильные аналоги мевалонолактона, как раскрыто в US 4686237, октагидронафталины, такие как раскрыты в US 4499289, кетоаналоги мевинолина (ловастатин), как раскрыто в ЕР 0142146 А 2, и хинолиновые и пиридиновые производные, как раскрыто в US 5506219 и 5691322. Предпочтительные гиполипидемические агенты представляют собой правастатин, ловастатин, симвастатин, аторвастатин, флувастатин, церивастатин, атавастатин и ZD-4522. Кроме того, соединения фосфиновой кислоты, полезные в ингибировании HMG СоА редуктазы, такие как раскрыты в GB 2205837, являются подходящими для использования в комбинации с соединением настоящего изобретения. Ингибиторы скваленсинтазы, подходящие для использования в настоящей заявке, включают, но не ограничиваясь, -фосфоносульфонаты, раскрытые в US 5712396, раскрытые в Biller et al., J. Med. Chem.,1988, Vol. 31, No. 10, pp. 1869-1871, включая изопреноид(фосфинилметил)фосфонаты, а также другие известные ингибиторы скваленсинтазы, например, как раскрыто в US 4871721 и 4924024 и в Biller, S.A.,Neuenschwander, K., Ponpipom, M.M. и Poulter, CD., Current Pharmaceutical Design, 2, 1-40 (1996). Кроме того, другие ингибиторы скваленсинтазы, подходящие для использования в настоящей заявке, включают терпеноидпирофосфаты, раскрытые в Ortiz de MontelIano et al., J. Med. Chem., 1977, 20,243-249, фарнезилдифосфатный аналог А и прескваленпирофосфатные аналоги (PSQ-PP), как раскрыто вCorey and VoIante, J. Am. Chem. Soc, 1976, 98, 1291-1293, фосфинилфосфонаты, раскрытые в McClard,R.W. et al., J.A.C.S., 1987, 109, 5544, и циклопропаны, раскрытые в Capson, T.L., PhD dissertation, June,1987, Dept. Med. Chem. U of Utah, Abstract, Table of Contents, pp. 16, 17, 40-43, 48-51, Summary. Производные фиброевой кислоты, которые могут использоваться в комбинации с соединением формулы I, включают фенофибрат, гемфиброзил, клофибрат, безафибрат, ципрофибрат, клинофибрат и т.п., пробукол и соответствующие соединения, как раскрыто в US 3674836, пробукол и гемфиброзил предпочтительны, секвестранты желчной кислоты, такие как холестирамин, холестипол и DEAESephadex (Secholex, Policexide), а также липостабил (Rhone-Poulenc), Eisai E-5050 (производное Nзамещенного этаноламина), иманиксил (НОЕ-402), тетрагидролипстатин (THL), истигмастанилфосфорилхолин (SPC, Roche), аминоциклодекстрин (Tanabe Seiyoku), Ajinomoto AJ-814 (производное азулена),мелинамид (Sumitomo), Sandoz 58-035, American Cyanamid CL-277,082 и CL-283,546 (дизамещенные производные мочевины), никотиновая кислота, аципимокс, ацифран, неомицин, п-аминосалициловая кислота, аспирин, производные поли(диаллилметиламина) такие, как раскрыто в US 4759923, четвертичный амин поли(диаллилдиметиламмония хлорид) и ионены, такие как раскрыты в US 4027009 и другие известные понижающие сывороточный холестерин агенты. Ингибитор АСАТ, который может использоваться в комбинации с соединением формулы I, включает раскрытые в Drugs of the Future 24, 9-15 (1999), (Avasimibe); "The ACAT inhibitor, Cl-1011 is effectiveetal, Chemtracts: Org. Chem. (1995), 8(6), 359-62, или TS-962 (Taisho Pharmaceutical Co. Ltd.). Гиполипидемический агент может быть активатором активности рецептора LD2, такой как 1(3 Н)изобензофуранон, 3-(13-гидрокси-10-оксотетрадецил)-5,7-диметокси-(MD-700, Taisho Pharmaceutical Co.Ltd.) и холестан-3-ол, 4-(2-пропенил)-(3 а,4 а,5a)-(LY295427, Eli Lilly). Примеры подходящего ингибитора абсорбции холестерина для использования в комбинации с соединением изобретения включают SCH48461 (Schering-Plough), а также раскрытые в Atherosclerosis 115,45-63 (1995) и J. Med. Chem. 41, 973 (1998). Примеры подходящих ингибиторов сотранспортера Na+/желчная кислота для использования в ком- 24018229 бинации с соединением изобретения включают соединения, как раскрыто в Drugs of the Future, 24, 425430 (1999). Ингибиторы липоксигеназы, которые могут использоваться в комбинации с соединением формулыI, включают ингибиторы 15-липоксигеназы (15-LO), такие как производные бензимидазола, как раскрыто в WO 97/12615, ингибиторы 15-LO, как раскрыто в WO 97/12613, изотиазолоны, как раскрыто в WO 96/38144, и ингибиторы 15-LO, как раскрыто Sendobry et al. "Attenuation of diet-induced atherosclerosis inPharmacology (1997) 120, 1199-1206 и Cornicelli et al., "15-Lipoxygenase and its Inhibition: A Novel Therapeutic Target for Vascular Disease", Current Pharmaceutical Design, 1999, 5, 11-20. Примеры подходящих противогипертонических агентов для использования в комбинации с соединением настоящего изобретения включают -адренергические блокаторы, блокаторы кальциевых каналов (L-тип и Т-тип; например дилтиазем, верапамил, нифедипин, амлодипин и мибефрадил), мочегонные средства (например, хлоротиазид, гидрохлоротиазид, флуметиазид, гидрофлуметиазид, бендрофлуметиазид, метилхлоротиазид, трихлорометиазид, политиазид, бензтиазид, этакриновая кислота, трикринафен,хлорталидон, фуросемид, мусолимин, буметанид, триамтрен, амилорид, спиронолактон), ингибиторы ренина, ингибиторы АСЕ (например, каптоприл, зофеноприл, фозиноприл, эналаприл, цераноприл, цилазоприл, делаприл, пентоприл, хинаприл, рамиприл, лизиноприл), антагонисты рецептора АТ-1 (например, лозартан, ирбезартан, валзартан), антагонисты рецептора ЕТ (например, ситакссентан, атрсентан и соединения, раскрытые в US 5612359 и 6043265), двойной антагонист ЕТ/АII (например, соединения,раскрытые в WO 00/01389), ингибиторы нейтральной эндопептидазы (NEP), ингибиторы вазопептидазы,(двойные ингибиторы NEP-ACE) (например, омапатрилат и гемопатрилат) и нитраты. Примеры подходящих агентов против ожирения для использования в комбинации с соединением настоящего изобретения включают -3-адренергический агонист, ингибитор липазы, ингибитор обратного захвата серотонина (и допамина), -препарат тироидного рецептора, агонисты 5 НТ 2 С (такие как ArenaAPD-356); антагонисты MCHR1, такие как Synaptic SNAP-7941 и Takeda Т-226926, агонисты рецептора меланокортина (MC4R), антагонисты рецептора меланинконцентрирующего гормона (MCHR) (такого как Synaptic SNAP-7941 и Takeda Т-226926), модуляторы рецептора галанина, антагонисты орексина,агонисты CCK, антагонист NPY1 или NPY5, модуляторы NPY2 и NPY4, агонисты фактора высвобождения кортикотропина, модуляторы гистаминового рецептора-3 (Н 3), ингибиторы 11HSD-l, модуляторы рецептора адинопектина, ингибиторы обратного захвата моноамина или агенты высвобождения, модуляторы цилиарного нейротрофического фактора (CNTF, такой как AXOKINE Regeneron), BDNF (нейротрофический фактор головного мозга), модуляторы лептина и рецептора лептина, антагонисты рецептора каннабиноида-1 (такой как SR-141716 (Sanofi) или SLV-319 (Solvay, и/или аноректический агент.-3-адренергические агонисты, которые могут необязательно использоваться в комбинации с соединением настоящего изобретения, включают AJ9677 (Takeda/Dainippon), L750355 (Merck), или СР 331648 (Pfizer), или другие известные -3-адренергические агонисты, как раскрыто в US 5541204,5770615, 5491134, 5776983 и 5488064. Примеры ингибиторов липазы, которые могут необязательно использоваться в комбинации с соединением настоящего изобретения, включают орлистат или ATL-962 (Alizyme). Ингибитор обратного захвата серотонина (и допамина) (или агонисты рецептора серотонина), который может необязательно использоваться в комбинации с соединением настоящего изобретения, может быть BVT-933 (Biovitrum), сибутрамин, топирамат (JohnsonJohnson) или аксокин (Regeneron). Примеры соединений -тироидных рецепторов, которые могут необязательно использоваться в комбинации с соединением настоящего изобретения, включают лиганды тироидного рецептора, такие как раскрытые в WO 97/21993 (U. CaI SF), WO 99/00353 (KaroBio) и WO 00/039077 (KaroBio). Ингибиторы обратного захвата моноамина, которые могут необязательно использоваться в комбинации с соединением настоящего изобретения, включают фенфлурамин, дексфенфлурамин, флувоксамин, флуоксетин, пароксетин, сертралин, хлорфентермин, клофорекс, клортермин, пицилорекс, сибутрамин, дексамфетамин, фентермин, фенилпропаноламин или мазиндол. Аноректический агент, который может необязательно использоваться в комбинации с соединением настоящего изобретения, включает топирамат (JohnsonJohnson), дексамфетамин, фентермин, фенилпропаноламин или мазиндол. Вышеупомянутые патенты и патентные заявки включены в настоящую заявку в качестве ссылки. Вышеуказанные другие терапевтические агенты, когда используются в комбинации с соединением настоящего изобретения, могут использоваться, например, в тех количествах, указанных в Physicians'Desk Reference, а также в патентах, приведенных выше, или как определено специалистом в данной области. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма SC-3 соединения (S)-PG формулы (Ia) охарактеризованная одним или большим количеством следующих характеристик:a) параметры элементарной ячейки: а=11.2688(8) ,b=4.8093(3) ,с=46.723(3) ,пространственная группа = P212121,молекулы/асимметричная ячейка = 1,где измерение указанной кристаллической структуры осуществляют при комнатной температуре и которая охарактеризована фракционными атомными координатами, по существу, являющимися такими, как приведено в табл. 4;c) спектр ЯМР 13 С в твердой фазе, имеющий аналогичные положения пиков при 16.2, 17.6, 39.3,60.9, 63.3, 69.8, 76.9, 78.7, 79.4, 113.8, 123.6, 129.3, 130.5, 132.0, 135.7, 139.1 и 158.0 ч./млн, как определено на спектрометре 400 МГц относительно TMS;d) термограмма дифференциальной сканирующей калориметрии, имеющая эндотерму в диапазоне от приблизительно 50 до 78 С или как показано на фиг. 4;e) диаграмма термогравиметрического анализа с потерей веса приблизительно 18,7% от приблизительно комнатной температуры до приблизительно 240 С или как показано на фиг. 3; илиf) наличие протонного ЯМР, имеющего аналогичные положения пиков, как приведено в табл. 1 А. 2. Кристаллическая форма по п.1, которая находится, по существу, в чистой форме. 3. Фармацевтическая композиция, содержащая эффективное количество кристаллической формы соединения по п.1 и фармацевтически приемлемый носитель или разбавитель. 4. Способ получения кристаллической формы SC-3 соединения (S)-PG формулы (Ia) по п.1 включающий реакцию соединения формулы А в органическом растворителе с основанием и (S)-пропиленгликолем, необязательно, с добавлением кристаллической затравки (S)-PG (формы SC-3). 5. Способ получения кристаллической формы SC-3 соединения (S)-PG формулы (Ia) по п.1, который включает взаимодействие соединения формулы В с восстанавливающим агентом, таким как алкилсилилгидрид, в присутствии активирующей группы, такой как кислота Льюиса, для образования соединения формулы (I) реакцию соединения (I) с (S)-пропиленгликолем, необязательно, с добавлением кристаллической затравки формы SC-3 к реакционной смеси. 6. Способ по п.5, отличающийся тем, что восстанавливающий агент представляет собой триэтилсилан и активирующая группа представляет собой BF3OEt2 или BF32CH3COOH. 7. Способ получения кристаллической формы SC-3 соединения (S)-PG формулы Ia по п.1 включающий взаимодействие соединения формулы (If) взаимодействие вышеупомянутого соединения с восстанавливающим агентом, таким как алкилсилилгидрид, в присутствии активирующей группы, такой как кислота Льюиса, и CH3CN, с образованием соединения формулы А взаимодействие вышеупомянутого соединения с основанием и затем с (S)-пропиленгликолем, необязательно, с добавлением кристаллической затравки формы SC-3 к реакционной смеси. 8. Способ по п.7, отличающийся тем, что восстанавливающий агент представляет собой триэтилсилан и активирующая группа представляет собой BF3OEt2 или BF32CH3COOH. 9. Кристаллическая форма If сольвата 1,4-бутиндиола формулы охарактеризованная одним или большим количеством следующих характеристик: параметры элементарной ячейки: а=21.576(7) ,b=6.755(1) ,с=18.335(5) ,=102.96(1),пространственная группа С 2,молекулы/асимметричная ячейка 1,где измерение указанной кристаллической структуры осуществляют при 25 С и которая охарактеризова- 27018229 на фракционными атомными координатами, которые, по существу, являются такими, как приведено в табл. 6, или параметры элементарной ячейки: а=21.537(4) ,b=6.7273(6) ,с=18.267(3) ,=102.924(7),пространственная группа С 2,молекулы/асимметричная ячейка 1,где измерение указанной кристаллической структуры осуществляют при температуре -50 С, или данными протонного ЯМР, имеющего спектр с положениями пиков, как приведено в табл. 2 А. 10. Способ получения кристаллической формы If сольвата 1,4-бутиндиола по п.9, который включает: а) смешивание соединения формулы Вb) нагревание смеси при температуре в пределах диапазона от приблизительно 50 до приблизительно 70 С;d) нагревание смеси до растворения диола;e) добавление затравки формы If к раствору иf) охлаждение смеси с образованием кристаллов соединения If.
МПК / Метки
МПК: A61P 3/10, A61K 31/70, C07H 7/04
Метки: кристаллические, производных, сольваты, ингибиторов, sglt2, аминокислотами, комплексы, качестве, лечения, диабета, 1s)-1,5-ангидро-1-c-(3-((фенил)метил)фенил)-d-глюцитола
Код ссылки
<a href="https://eas.patents.su/30-18229-kristallicheskie-solvaty-i-kompleksy-proizvodnyh-1s-15-angidro-1-c-3-fenilmetilfenil-d-glyucitola-s-aminokislotami-v-kachestve-ingibitorov-sglt2-dlya-lecheniya-diabeta.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллические сольваты и комплексы производных (1s)-1,5-ангидро-1-c-(3-((фенил)метил)фенил)-d-глюцитола с аминокислотами в качестве ингибиторов sglt2 для лечения диабета</a>
Предыдущий патент: Устройство для сепарации магнитных частиц из жидкости
Следующий патент: Способ гидроразрыва пласта
Случайный патент: Линейный пружинный привод клапана