Кристаллические формы 4-[2-(4-метилфенилсульфанил)фенил]пиперидина с объединенным ингибированием повторного поглощения серотонина и норадреналина для лечения невропатической боли
Номер патента: 16054
Опубликовано: 30.01.2012
Авторы: Лопес Де Диего Хейди, Миллер Зилке, Банг-Андерсен Бенни, Фальд Андре, Стенсбёль Тине Брайан
Формула / Реферат
1. Аддитивная соль HBr и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина
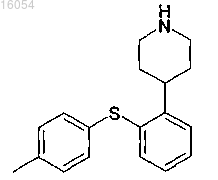
в кристаллической форме.
2. Соединение по п.1, где соединение характеризуется пиками на рентгеновской порошковой дифрактограмме (XRPD) в области приблизительно 6,08, 14,81, 19,26 и 25,38°2θ.
3. Соединение по п.1, где соединение характеризуется рентгеновской порошковой дифрактограммой (XRPD), представленной на фиг. 1.
4. Аддитивная соль DL-молочной кислоты и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина
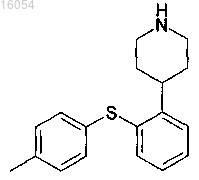
в кристаллической форме.
5. Аддитивная соль глутаровой кислоты и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина (1:1)

в кристаллической форме.
6. Аддитивная соль малоновой кислоты и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина (1:1)
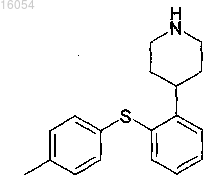
в кристаллической форме.
7. Аддитивная соль L-аспарагиновой кислоты и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина (1:1) или гидрат аддитивной соли L-аспарагиновой кислоты и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина (1:1)

в кристаллической форме.
8. Аддитивная соль глутаминовой кислоты и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина (1:1) или моногидрат аддитивной соли глутаминовой кислоты и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина
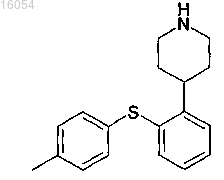
в кристаллической форме.
9. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 вместе с фармацевтически приемлемым наполнителем, для применения в лечении заболевания, выбранного из хронической боли, депрессии у частично отвечающих пациентов, устойчивой к лечению депрессии, болезни Альцгеймера, когнитивного нарушения, ADHD, меланхолии, PTSD, приливов крови, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, наркотической зависимости и токсикомании, зависимости от алкоголя или лекарственных средств, рвоты, расстройств пищевого поведения, IBS, аффективных расстройств, депрессии, основного депрессивного расстройства, послеродовой депрессии, депрессии, связанной с биполярным расстройством, болезни Альцгеймера, психоза или болезни Паркинсона, тревожности, генерализированного тревожного расстройства, социального тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, приступов паники, фобии, социальной фобии, агорафобии или стрессового недержания мочи.
10. Способ лечения заболевания, выбранного из хронической боли, депрессии у частично отвечающих пациентов, устойчивой к лечению депрессии, болезни Альцгеймера, когнитивного нарушения, ADHD, меланхолии, PTSD, приливов крови, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, наркотической зависимости и токсикомании, зависимости от алкоголя или лекарственных средств, рвоты, расстройств пищевого поведения, IBS, аффективных расстройств, депрессии, основного депрессивного расстройства, послеродовой депрессии, депрессии, связанной с биполярным расстройством, болезни Альцгеймера, психоза или болезни Паркинсона, тревожности, генерализированного тревожного расстройства, социального тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, приступов паники, фобии, социальной фобии, агорафобии или стрессового недержания мочи, где способ включает в себя введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения по любому из пп.1-8.
11. Способ по п.10, где указанное заболевание представляет собой хроническую боль.
12. Способ по п.11, где указанная хроническая боль выбрана из фантомной боли в конечности, невропатической боли, диабетической невропатии, постгерпетической невралгии (PHN), туннельного синдрома запястья (CTS), вызванной HIV невропатии, комплексного местного болевого синдрома (CPRS), тригеминальной невралгии/невралгии тройничного нерва/болезненного тика, хирургического вмешательства (например, послеоперационные аналгетические средства), диабетической васкулопатии, резистентности капилляров или диабетических симптомов, связанных с инсулитом, ангиозной боли, менструальной боли, связанной с раком боли, зубной боли, головной боли, мигрени, головной боли напряжения, тригеминальной невралгии, синдрома височно-нижнечелюстного сустава, миофасциальной боли при повреждении мышц, синдрома фибромиалгии, боли в костях и суставах (остеоартрита), ревматоидного артрита, ревматоидного артрита и отека, происходящего из-за травмы, связанной с ожогами, боли при растяжениях или трещинах в кости из-за остеоартрита, остеопороза, метастазов в кости или неизвестных причин, подагры, фиброзита, миофасциальной боли, компрессионных синдромов верхней апертуры грудной клетки, боли в верхней части спины или боли в нижней части спины (где боль в спине происходит из-за системного, местного или первичного заболевания позвоночника (радикулопатия)), тазовой боли, кардиальной боли в груди, не относящейся к кардиальной боли в груди, боли, связанной с повреждением спинного мозга (SCI), центральной постинсультной боли, невропатии при раке, боли при СПИД, боли при серповидно-клеточной анемии и гериатрической боли.
13. Способ по п.12, где указанная хроническая боль представляет собой невропатическую боль.
14. Способ по п.13, где указанная невропатическая боль выбрана из гиперпатии, гипералгезии, невропатии, диабетической невропатии, неврита, невралгии, гиперестезии, каузалгии и аллодинии.
15. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства для лечения заболевания, выбранного из хронической боли, депрессии у частично отвечающих пациентов, устойчивой к лечению депрессии, болезни Альцгеймера, когнитивного нарушения, ADHD, меланхолии, PTSD, приливов крови, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, наркотической зависимости и токсикомании, зависимости от алкоголя или лекарственных средств, рвоты, расстройств пищевого поведения, IBS, аффективных расстройств, депрессии, основного депрессивного расстройства, послеродовой депрессии, депрессии, связанной с биполярным расстройством, болезни Альцгеймера, психоза или болезни Паркинсона, тревожности, генерализированного тревожного расстройства, социального тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, приступов паники, фобии, социальной фобии, агорафобии или стрессового недержания мочи.
16. Применение по п.15, где указанное заболевание представляет собой хроническую боль.
17. Применение по п.16, где указанная хроническая боль выбрана из фантомной боли в конечности, невропатической боли, диабетической невропатии, постгерпетической невралгии (PHN), туннельного синдрома запястья (CTS), вызванной HIV невропатии, комплексного местного болевого синдрома (CPRS), тригеминальной невралгии/невралгии тройничного нерва/болезненного тика, хирургического вмешательства (например, послеоперационные аналгетические средства), диабетической васкулопатии, резистентности капилляров или диабетических симптомов, связанных с инсулитом, ангиозной боли, менструальной боли, связанной с раком боли, зубной боли, головной боли, мигрени, головной боли напряжения, тригеминальной невралгии, синдрома височно-нижнечелюстного сустава, миофасциальной боли при повреждении мышц, синдрома фибромиалгии, боли в костях и суставах (остеоартрита), ревматоидного артрита, ревматоидного артрита и отека, происходящего из-за травмы, связанной с ожогами, боли при растяжениях или трещинах в кости из-за остеоартрита, остеопороза, метастазов в кости или неизвестных причин, подагры, фиброзита, миофасциальной боли, компрессионных синдромов верхней апертуры грудной клетки, боли в верхней части спины или боли в нижней части спины (где боль в спине происходит из-за системного, местного или первичного заболевания позвоночника (радикулопатия)), тазовой боли, кардиальной боли в груди, не относящейся к кардиальной боли в груди, боли, связанной с повреждением спинного мозга (SCI), центральной постинсультной боли, невропатии при раке, боли при СПИД, боли при серповидно-клеточной анемии и гериатрической боли.
18. Применение по п.17, где указанная хроническая боль представляет собой невропатическую боль.
19. Применение по п.18, где указанная невропатическая боль выбрана из гиперпатии, гипералгезии, невропатии, диабетической невропатии, неврита, невралгии, гиперестезии, каузалгии и аллодинии.
Текст
Дата публикации и выдачи патента Номер заявки КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 4-[2-(4-МЕТИЛФЕНИЛСУЛЬФАНИЛ)ФЕНИЛ] ПИПЕРИДИНА С ОБЪЕДИНЕННЫМ ИНГИБИРОВАНИЕМ ПОВТОРНОГО ПОГЛОЩЕНИЯ СЕРОТОНИНА И НОРАДРЕНАЛИНА ДЛЯ ЛЕЧЕНИЯ НЕВРОПАТИЧЕСКОЙ БОЛИ Представлены кристаллические формы 4-[2-(4-метилфенилсульфанил)фенил]пиперидина и его солей, например, для лечения невропатической боли. Банг-Андерсен Бенни, Фальд Андре,Стенсбль Тине Брайан (DK), Миллер Зилке (US), Лопес Де Диего Хейди 016054 Восприятие боли является более сложным, чем прямая передача сигналов от поврежденного участка организма к специфическим рецепторам в мозге, где воспринятая боль пропорциональна повреждению. Скорее, разрушение периферической ткани и повреждение нервов может вызывать изменения в структурах центральной нервной системы, вовлеченных в восприятие боли, влияющее на последующую чувствительность к боли. Эта нейропластичность может служить причиной центральной сенсибилизации в ответ на долговременные вредные стимулы, которая может проявляться, например, как хроническая боль, т.е., где восприятие боли остается даже после прекращения вредного стимула, или как гипералгезия, т.е. усиленный ответ на стимул, который в норме не является болезненным. Одним из наиболее таинственных и ярких примеров этого является синдром фантома конечности, т.е. сохранение боли, которая существовала в конечности до ее ампутации. Недавний обзор центральной нейропластичности и боли см. в Melzack et al in Ann. N. Y. Acad. Sci., 933, 157-174, 2001. Хроническая боль, такая как невропатическая боль, проявляется по-другому, чем другие типы боли,например соматическая или висцеральная боль. Боль часто описывают как внезапную острую, жгучую,покалывание, онемение или колющую. Общераспространенные причины невропатической боли включают в себя алкоголизм, ампутацию, проблемы спины, ног и бедер, химиотерапию, диабет, HIV, рассеянный склероз, хирургическую операцию на позвоночнике и инфекцию вирусом опоясывающего лишая. Центральный компонент хронической боли может объяснить, почему хроническая боль, например,такая как невропатическая боль, часто плохо отвечает на классические аналгетические средства, такие как нестероидные противовоспалительные лекарственные средства (NSAIDS) и опиоидные аналгетические средства. Трициклические антидепрессанты (ТСА), типичным примером которых является амитрилин, стали общепринятыми для лечения невропатической боли, и считают, что эффект является опосредованным объединенным ингибирующим эффектом переносчика серотонина и переносчика норадреналина [Clin Ther., 26, 951-979, 2004]. Совсем недавно, так называемые антидепрессанты двойного действия, обладающие ингибирующим эффектом для повторного поглощения как серотонина, так и норадреналина, использовали в клинике для лечения невропатической боли [Human Psychopharm., 19, S21-S25,2004]. Примерами антидепрессантов двойного действия являются венлафаксин и дулоксетин, и этот класс антидепрессантов часто обозначают как SNRI. Данные об использовании избирательных ингибиторов повторного поглощения серотонина (SSRI) против невропатической боли являются немногочисленными, однако, в основном, позволяют предполагать ограниченный эффект [Bas. Clin. Pharmacol, 96, 399-409, 2005]. Фактически, выдвинули гипотезу,что SSRT являются только слабо антиноцицептивными сами по себе, но что ингибирование переносчика серотонина увеличивает антиноцицептивный эффект ингибирования повторного поглощения норадреналина. Это представление поддерживает обзор 22 исследований на животных и пяти исследований на людях, показывающий, что SNRT обладают превосходящим антиноцицептивным эффектом по сравнению с ингибиторами повторного поглощения норадреналина, что снова превосходит SSRI [Pain Med. 4, 310316, 2000]. Недавние данные относительно антагониста 5-НТ 3 одансетрона означают, что антагонисты 5-НТ 3 могут обладать аналгетическим эффектом и, таким образом, являться применимыми для лечения невропатической боли [Anesth. Analg., 97, 1474-1478, 2003]. Использование трициклических антидепрессантов связано, однако, с известными, антихолинергическими побочными эффектами, например, такими как сонливость, тревожность, беспокойство и затруднения когнитивных функций и памяти. Таким образом, в данной области существует необходимость нахождения альтернативных путей для лечения невропатической боли. В международной патентной заявке, опубликованной как WO 2003/029232, описано, например, соединение 4-[2-(4-метилфенилсульфанил)фенил]пиперидин в виде свободного основания и соответствующей соли HCl. Сообщается, что соединение является ингибитором переносчика серотонина и рецептора серотонина 2 С(5-НТ 2C) и считают, что оно является применимым для лечения аффективных нарушений, например депрессии и тревожности. Сущность изобретения Авторы настоящего изобретения неожиданно обнаружили, что в дополнение к уже известному фармакологическому профилю, 4-[2-(4-метилфенилсульфанил)фенил]пиперидин является сильным ингибитором повторного поглощения серотонина и повторного поглощения норадреналина антагонистом рецептора серотонина 3 (5-НТ 3), антагонистом рецептора серотонина 2 А(5-НТ 2A) и ингибитором 1 адренергического рецептора, и соединение как таковое можно использовать для лечения, например, хронической боли. Соответственно, изобретение относится к соединению I, которое представляет собой 4[2-(4-метилфенилсульфанил)фенил]пиперидин, и его фармацевтически приемлемым солям в кристаллической форме, при условии, что указанное соединение не является аддитивной солью, представляющей собой гидрохлорид 4-[2-(4-метилфенилсульфанил)фенил]пиперидина. В одном варианте осуществления изобретение относится к соединению I для использования в терапии. В одном варианте осуществления изобретение относится к способу лечения, включающему в себя-1 016054 введение терапевтически эффективного количества соединения I нуждающемуся в этом пациенту. В одном варианте осуществления изобретение относится к фармацевтической композиции, содержащей соединение I. В одном варианте осуществления изобретение относится к применению соединения I для изготовления лекарственного средства. Фигуры Фиг. 1 - картина рентгенодиффракции аддитивной соли HBr соединения I; фиг. 2 - картина рентгенодиффракции сольвата аддитивной соли HBr соединения I; фиг. 3 - картина рентгенодиффракции аддитивной соли пальмитиновой кислоты соединения I; фиг. 4 - картина рентгенодифракции аддитивной соли DL-молочной кислоты соединения I; фиг. 5 - картина рентгенодиффракции аддитивной соли адипиновой кислоты (1:1) соединения I(+ форма); фиг. 6 - картина рентгенодиффракции аддитивной соли адипиновой кислоты (2:1) соединения I; фиг. 7 - картина рентгенодиффракции аддитивной соли фумаровой кислоты (1:1) соединения I; фиг. 8 - картина рентгенодиффракции аддитивной соли глутаровой кислоты (1:1) соединения I; фиг. 9 - картина рентгенодиффракции аддитивной соли малоновой кислоты (1:1) соединения I, форма; фиг. 10 - картина рентгенодиффракции аддитивной соли малоновой кислоты соединения I, -форма; фиг. 11 - картина рентгенодиффракции аддитивной соли щавелевой кислоты (1:1) соединения I; фиг. 12 - картина рентгенодиффракции аддитивной соли себациновой кислоты (2:1) соединения I; фиг. 13- картина рентгенодиффракции аддитивной соли янтарной кислоты (2:1) соединения I; фиг. 14 - картина рентгенодиффракции аддитивной соли L-яблочной кислоты (1:1) соединения I, форма; фиг. 15 - картина рентгенодиффракции аддитивной соли L-яблочной кислоты (1:1) соединения I, форма; фиг. 16 - картина рентгенодиффракции аддитивной соли D-виннокаменной кислоты (1:1) соединения I; фиг. 17 - картина рентгенодиффракции аддитивной соли L-аспарагиновой кислоты (1:1) соединенияI в смеси с L-аспарагиновой кислотой; фиг. 18 - картина рентгенодиффракции гидрата аддитивной соли L-аспарагиновой кислоты (1:1) соединения I в смеси с L-аспарагиновой кислотой; фиг. 19 - картина рентгенодиффракции аддитивной соли глутаминовой кислоты (1:1) соединения I в смеси с моногидратом глутаминовой кислоты; фиг. 20 - картина рентгенодиффракции аддитивной соли лимонной кислоты (2:1) соединения I; фиг. 21 - картина рентгенодиффракции аддитивной соли НС 1 соединения I; фиг. 22 - картина рентгенодиффракции аддитивной соли фосфорной кислоты (1:1) соединения I; фиг. 23 - уровни дофамина в префронтальном кортексе после введения соединения по настоящему изобретению; фиг. 24 - уровни ацетилхолина в префронтальном кортексе после введения соединения по настоящему изобретению; фиг. 25 а+b - уровни ацетилхолина в префронтальном кортексе и вентральном гиппокампе после введения соединения по настоящему изобретению. Подробное описание изобретения Настоящее изобретение относится к соединению I, которое представляет собой 4-[2-(4 метилфенилсульфанил)фенил]пиперидин, и его фармацевтически приемлемым солям в кристаллической форме при условии, что указанное соединение не является аддитивной солью, представляющей собой гидрохлорид. Структура 4-[2-(4-метилфенилсульфанил)фенил]пиперидина представляет собой Фармакологический профиль соединений по настоящему изобретению проиллюстрирован в примерах, но его можно суммировать следующим образом. Соединения являются ингибиторами повторного поглощения серотонина и норадреналина; они ингибируют рецепторы серотонина 2 А, 2 С и 3; и они ингибируют адренергический рецептор -1. В одном варианте осуществления указанные фармацевтически приемлемые соли представляют собой кислотно-аддитивные соли кислот, которые являются нетоксичными. Указанные соли включают в себя соли, полученные из органических кислот, таких как малеиновая, фумаровая, бензойная, аскорбиновая, янтарная, щавелевая, бис-метиленсалициловая, метансульфоновая, этандисульфоновая, уксусная,-2 016054 пропионовая, виннокаменная, салициловая, лимонная, глюконовая, молочная, яблочная, малоновая, миндальная, коричная, цитраконовая, аспарагиновая, стеариновая, пальмитиновая, итаконовая, гликолевая,п-аминобензойная, глютаминовая, бензолсульфоновая, теофиллинуксусные кислоты, так же как 8 галотеофиллины, например 8-бромтеофиллин. Указанные соли можно также получать из неорганических солей, таких как соли бромисто-водородной, серной, сульфаминовой, фосфорной и азотной кислот. Дополнительные применимые соли перечислены в таблице в примере 1d (табл. 1). В одном варианте осуществления соединение по настоящему изобретению, т.е. соединение формулы I, представляет собой аддитивную соль HBr. В одном варианте осуществления соединение по настоящему изобретению представляет собой аддитивную соль DL-молочной кислоты, и в частности соль 1:1. В одном варианте осуществления соединение по настоящему изобретению представляет собой аддитивную соль L-аспарагиновой кислоты, и в частности соль 1:1. В одном варианте осуществления соединение по настоящему изобретению представляет собой аддитивную соль глутаминовой кислоты, и в частности соль 1:1. В одном варианте осуществления соединение по настоящему изобретению представляет собой аддитивную соль глутаровой кислоты, и в частности соль 1:1. В одном варианте осуществления соединение по настоящему изобретению представляет собой аддитивную соль малоновой кислоты, и в частности соль 1:1, которая, как обнаружили, существует в двух полиморфных модификацияхи , из которых -форму считают наиболее стабильной на основании более низкой растворимости. В одном варианте осуществления соединения по настоящему изобретению существуют в очищенной форме. Термин очищенная форма предназначен для обозначения того, что соединение является, по существу, свободным от других соединений или других форм, т.е. полиморфов указанного соединения, в зависимости от конкретного случая. Пероральные лекарственные формы, и в частности таблетки и капсулы, часто предпочитают пациенты и врач-терапевт из-за простоты введения и, в результате, лучшей комплаентности. Для таблеток и капсул является предпочтительным, чтобы активные ингредиенты являлись кристаллическими. Кристаллические формы по настоящему изобретению могут существовать в виде сольватов, т.е. кристаллических форм, где молекулы растворителя формируют часть кристаллической структуры. Сольваты могут быть образованы из воды, в этом случае сольваты часто обозначают гидратами. Альтернативно, сольваты могут быть образованы из других растворителей, например, таких как этанол, ацетон или этилацетат. Точное количество сольвата часто зависит от условий. Например, гидраты будут, как правило, терять воду при увеличении температуры или при уменьшении относительной влажности. Соединения, которые не изменяются или которые изменяются только немного, когда условия, например,такие как влажность, изменяются, как правило, рассматривают как более подходящие для фармацевтических составов. Обнаружили, что аддитивная соль HBr не образует гидраты при осаждении из воды, тогда как такие соединения, как кислотно-аддитивные соли сукцинат, малат и тартрат, образуют. Некоторые соединения являются гигроскопическими, т.е. они поглощают воду при воздействии влажности. Гигроскопичность, как правило, рассматривают как нежелательное свойство для соединений,которые должны присутствовать в фармацевтическом составе, в частности в сухом составе, таком как таблетки или капсулы. В одном варианте осуществления изобретение относится к кристаллам с низкой гигроскопичностью. Для пероральных лекарственных форм с использованием кристаллических активных ингредиентов также является благоприятным, если указанные кристаллы являются строго определенными. В настоящем контексте термин строго определенный, в частности, означает, что стехиометрия является строго определенной, т.е. что соотношение между ионами, формирующими соль, представляет собой соотношение между малыми целыми числами, такое как 1:1, 1:2, 2:1, 1:1:1 и т.д. В одном варианте осуществления соединения по настоящему изобретению представляют собой строго определенные кристаллы. Растворимость активного ингредиента также является важной для выбора лекарственной формы,так как она может вносить непосредственный вклад в биодоступность. Как правило, считают, что для пероральных лекарственных форм более высокая растворимость активного ингредиента является благоприятной, так как она увеличивает биодоступность. Некоторые пациенты, например пожилые пациенты,могут испытывать трудности с глотанием таблеток, и растворы пероральных капель могут являться подходящей альтернативой, исключающей необходимость глотания таблеток. Для ограничения объема раствора пероральных капель необходимо обладать высокой концентрацией активного ингредиента в растворе, для чего снова требуется высокая растворимость соединения. Как показано в табл. 3, аддитивные соли DL-молочной кислоты, L-аспарагиновой кислоты, глутаминовой кислоты, глутаровой кислоты и малоновой кислоты обладают исключительно высокой растворимостью. Кристаллические формы вносят вклад в свойства фильтрации и переработки соединения. Иглообразные кристаллы проявляют тенденцию являться более сложными для манипуляций в производственной среде, так как фильтрация становится более трудной и требующей больше времени. Точная форма-3 016054 кристалла данной соли может зависеть, например, от условий, при которых осаждается соль. Из кислотно-аддитивной соли HBr по настоящему изобретению вырастают иглообразные, сольватированные кристаллы при осаждении из этанола, уксусной кислоты и пропанола, однако кристаллы негидратированной формы, которые не являются иглообразными, вырастают при осаждении аддитивной соли HBr из воды,обеспечивая превосходные фильтрационные свойства. В табл. 3 представлен также результирующий рН, т.е. рН насыщенного раствора соли. Это свойство является важным, поскольку увлажнения никогда нельзя полностью избежать во время хранения, и накопление влажности будет приводить к уменьшению рН в или на таблетке, содержащей соль с низким результирующим рН, что может приводить к уменьшению срока годности. Более того, соль с низким результирующим рН может приводить к коррозии производственного оборудования, если таблетки получают влажной грануляцией. Данные в табл. 3 позволяют предполагать, что аддитивные соли HBr, HCl и адипиновой кислоты могут являться превосходными в этом отношении. В одном варианте осуществления соединение по настоящему изобретению представляет собой аддитивную соль HBr в кристаллической форме, в частности в очищенной форме. В следующем варианте осуществления указанная соль HBr характеризуется пиками на рентгеновской порошковой дифрактограмме (XRPD) в области приблизительно 6,08, 14,81, 19,26 и 25,382, и в частности указанная сольHBr обладает XRPD, как показано на фиг. 1. В одном варианте осуществления соединение по настоящему изобретению представляет собой аддитивную соль DL-молочной кислоты (1:1) в кристаллической форме, в частности, в очищенной форме. В следующем варианте осуществления указанная аддитивная соль DL-молочной кислоты характеризуется пиками на XRPD в области приблизительно 5,30, 8,81, 9,44 и 17,242, и в частности, указанная аддитивная соль DL-молочной кислоты обладает XRPD, как показано на фиг. 4. В одном варианте осуществления соединение по настоящему изобретению представляет собой аддитивную соль L-аспарагиновой кислоты (1:1) в кристаллической форме, в частности, в очищенной форме. В следующем варианте осуществления указанная аддитивная соль L-аспарагиновой кислоты является несольватированной и характеризуется пиками на XRPD в области приблизительно 11,05, 20,16, 20,60,25,002, и в частности указанная соль L-аспарагиновой кислоты, при смешивании с L-аспарагиновой кислотой, обладает XRPD, как показано на фиг. 17. В одном варианте осуществления, указанная аддитивная соль L-аспарагиновой кислоты представляет собой гидрат, в частности, в очищенной форме. В следующем варианте осуществления указанный гидрат аддитивной соли L-аспарагиновой кислоты характеризуется пиками на XRPD в области приблизительно 7,80, 13,80, 14,10, 19,632, и в частности указанный гидрат аддитивной соли L-аспарагиновой кислоты, при смешивании с L-аспарагиновой кислотой, обладает XRPD, как показано на фиг. 18. В одном варианте осуществления соединение по настоящему изобретению представляет собой аддитивную соль глутаминовой кислоты (1:1) в кристаллической форме, в частности, в очищенной форме. В следующем варианте осуществления указанная аддитивная соль глутаминовой кислоты характеризуется пиками на XRPD в области приблизительно 7,71, 14,01, 19,26, 22,572, и в частности указанная соль глутаминовой кислоты, при смешивании с моногидратом глутаминовой кислоты, обладает XRPD,как показано на фиг. 19. В одном варианте осуществления соединение по настоящему изобретению представляет собой аддитивную соль малоновой кислоты (1:1) в кристаллической форме, в частности, в очищенной форме. В следующем варианте осуществления указанная аддитивная соль малоновой кислоты представляет собой-форму и характеризуется пиками на XRPD в области приблизительно 10,77, 16,70, 19,93, 24,012,или указанная аддитивная соль малоновой кислоты представляет собой -форму и характеризуется пиками на XRPD в области приблизительно 6,08, 10,11, 18,25, 20,262, и в частности, указанная аддитивная соль малоновой кислоты обладает XRPD, как показано на фиг. 9 или 10. В одном варианте осуществления соединение по настоящему изобретению представляет собой аддитивную соль глутаровой кислоты (1:1) в кристаллической форме, в частности, в очищенной форме. В следующем варианте осуществления указанная аддитивная соль глутаровой кислоты характеризуется пиками на XRPD в области приблизительно 9,39, 11,70, 14,05 и 14,582, и в частности указанная аддитивная соль глутаровой кислоты обладает XRPD, как показано на фиг. 8. Как указано выше, соединения по настоящему изобретению особенно хорошо подходят для лечения хронической боли. Хроническая боль включает в себя такие показания, как фантомная боль в конечности, невропатическая боль, диабетическая невропатия, постгерпетическая невралгия (PHN), туннельный синдром запястья (CTS), вызванная HIV невропатия, комплексный местный болевой синдром (CPRS),тригеминальная невралгия/невралгия тройничного нерва/болезненного тика, хирургическое вмешательство (например, послеоперационные аналгетические средства), диабетическая васкулопатия, резистентность капилляров или диабетические симптомы, связанные с инсулитом, ангинозная боль, менструальная боль, связанная с раком боль, зубная боль, головная боль, мигрень, головная боль напряжения, тригеминальная невралгия, синдром височно-нижнечелюстного сустава, миофасциальная боль при повреждении мышц, синдром фибромиалгии, боль в костях и суставах (остеоартрит), ревматоидный артрит, ревмато-4 016054 идный артрит и отек, происходящий из-за травмы, связанной с ожогами, боль при растяжениях или трещинах в кости из-за остеоартрита, остеопороза, метастазов в кости или неизвестных причин, подагра,фиброзит, миофасциальная боль, компрессионный синдром верхней апертуры грудной клетки, боль в верхней части спины или боль в нижней части спины (где боль в спине происходит из-за системного,местного, или первичного заболевания позвоночника (радикулопатия, тазовая боль, кардиальная боль в груди, не относящаяся к кардиальной боли в груди, боль, связанная с повреждением спинного мозга(SCI), центральная постинсультная боль, невропатия при раке, боль при СПИД, боль при серповидноклеточной анемии или гериатрическая боль. В частности, соединения по настоящему изобретению являются применимыми для лечения расстройств настроения, таких как депрессия, связанных с перечисленными выше признаками хронической боли. Боль определена Международной ассоциацией по изучению боли (IASP) как неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения (IASP Classification of chronic pain, 2nd Edition, IASP Press(2002), 210). Даже несмотря на то, что боль всегда является субъективной, ее причины или синдромы можно классифицировать. Невропатическая боль как подтип определена IASP как боль, инициированная или вызванная первичным поражением или дисфункцией нервной системы.IASP признает различные подтипы невропатической боли, и примерами являются Аллодиния, которую определяют как боль из-за стимула, который в норме не вызывает боль. Каузалгия, которую определяют как синдром длительной жгучей боли, аллодинию и гиперпатию после травматического повреждения нерва, часто сочетающиеся с вазомоторной и судомоторной дисфункцией и последующими трофическими изменениями. Гиперестезия, которую определяют как повышенную чувствительность к стимуляции, исключая ощущения. Невралгия, которую определяют как боль при раздражении нерва или нервов. Неврит, который определяют как воспаление нерва или нервов. Невропатия, которую определяют как расстройство функции или патологическое изменение нерва: если одного нерва - мононевропатия, если нескольких нервов - множественная мононевропатия, если диффузная и билатеральная полиневропатия. Невропатия может являться связанной, например, с диабетом, в этом случае ее называют диабетической невропатией. Гипералгезия, которую определяют как увеличенный ответ на стимул, который в норме является болезненным. Гиперпатия, которую определяют как болевой синдром, характеризующийся аномально болезненной реакцией на стимул, особенно повторяющийся стимул, так же как повышенный болевой порог. Стимулы, вызывающие невропатическую боль, могут являться механическими или термическими. Уникальный фармакологический профиль соединений по настоящему изобретению делает их подходящими для лечения других заболеваний, которые не связаны напрямую с хронической болью. Рецепторы 5-HT2C локализованы, например, на дофаминергических нейронах, где активация оказывает тоническое ингибирующее влияние на высвобождение дофамина, и антагонисты 5-HT2C будут оказывать эффект увеличения уровня дофамина. Данные, представленные в примере 2 Е, показывают, что соединения по настоящему изобретению, действительно вызывают зависимое от дозы увеличение внеклеточных уровней дофамина в мозге. На этом основании можно выдвинуть гипотезу, что антагонисты 5-HT2C особенно хорошо подходят для лечения депрессии, которая является устойчивой к лечению избирательными ингибиторами повторного поглощения серотонина [Psychopharmacol. Bull., 39, 147-166, 2006]. Эта гипотеза находит подтверждение в нескольких клинических исследованиях, где показали, что сочетание миртазапина и SSRI превосходит один SSRI для лечения пациентов с депрессией с неадекватным клиническим ответом (устойчивая к лечению депрессия, TRD, или не поддающаяся лечению депрессия) [Psychother. Psychosom., 75, 139-153, 2006]. Миртазапин является также антагонистом 5-НТ 2 и 5-НТ 3, что указывает на то, что соединения, вызывающие ингибирование повторного поглощения серотонина в сочетании с антагонизмом 5-НТ 2 и 5-НТ 3, такие как соединения по настоящему изобретению, являются применимыми для лечения TRD, т.е. будут увеличивать частоту ремиссий для пациентов, страдающих от устойчивой к лечению депрессии. Данные, представленные в примере 2F и 2G, показывают, что соединения по настоящему изобретению вызывают увеличение внеклеточного уровня ацетилхолина в префронтальном кортексе и вентральном гиппокампе. Существует давнее клиническое доказательство того, что увеличение уровней ацетилхолина в мозге представляет собой способ лечения болезни Альцгеймера и когнитивных нарушений в общем, ср. с применением ингибиторов ацетилхолинэстеразы в лечении болезни Альцгеймера. На этом основании считают, что соединения по настоящему изобретению являются применимыми для лечения болезни Альцгеймера и когнитивного нарушения, а также расстройств настроения, таких как депрессия,связанная с болезнью Альцгеймера и когнитивным нарушением.-5 016054 Часть пациентов с депрессией будет отвечать на лечение, например, с помощью SSRI, в том смысле, что они будут обладать улучшением по клинически релевантным шкалам депрессии, таким какMADRD и HAMD, но с оставшимися другими симптомами, такими как нарушения сна и когнитивные нарушения. В настоящем контексте этих пациентов обозначают как частично отвечающих. Из-за обсуждаемых выше эффектов на уровни ацетилхолина ожидают, что соединения по настоящему изобретению будут являться применимыми для лечения когнитивных нарушений в дополнение к депрессии. Клинические исследования показали, что соединение празосин, которое является антагонистом -1 адренергического рецептора, уменьшает нарушения сна [Biol. Psychiatry, 61, 928-934, 2007]. Более того, считают также, что антагонизм 5-HT2A и 5-HT2C соединений по настоящему изобретению обладает седативным,улучшающим сон эффектом [Neuropharmacol, 33, 467-471, 1994], поэтому соединения по настоящему изобретению являются применимыми для лечения частично отвечающих пациентов или, если перефразировать, что лечение пациентов с депрессией с помощью соединений по настоящему изобретению будет уменьшать долю частично отвечающих пациентов. Синдром дефицита внимания и гиперактивности (ADHD) является одним из наиболее распространенных нейроповеденческих расстройств. ADHD характеризуют по присутствию триады социальных и коммуникативных нарушений с ограниченным, повторяющимся или стереотипным поведением. ADHD обычно начинается в детстве или подростковом возрасте, однако симптомы могут продолжаться во взрослом состоянии. В настоящее время атомоксетин является единственным нестимулирующим средством, одобренным FDA для лечения ADHD [Drugs, 64, 205-222, 2004]. Атомоксетин является ингибитором повторного поглощения норадреналина, и это позволяет предполагать, что соединения по настоящему изобретению можно использовать для лечения ADHD. Кроме того, соединения по настоящему изобретению могут обладать седативным эффектом из-за антагонизма -1 адренергического рецептора и антагонизма 5-НТ 2, обсуждаемого выше, который является благоприятным для лечения ADHD. Меланхолия является конкретным подтипом депрессии, часто связанным с тяжелой депрессией; этот тип депрессии обозначают также меланхолической депрессией. Меланхолия связана с тревожностью, страхом перед будущим, бессонницей и потерей аппетита. Показали, что соединения, которые ингибируют повторное поглощение как серотонина, так и норадреналина, например, такие как венлафаксин, являются особенно эффективными для лечения пациентов с тяжелой депрессией и меланхолией[Depres. Anxiety, 12, 50-54, 2000]. Как обсуждают выше, соединения, проявляющие антагонизм 5-HT2C,увеличивают уровень дофамина, поэтому ожидают, что такие соединения будут эффективными для лечения меланхолии [Psychpharm. Bull, 39, 147-166, 2006]. Кроме того, ожидают, что антагонизм -1 адренергического рецептора и 5-НТ 2 соединений по настоящему изобретению будет помогать нормализовать сон, поэтому указанные соединения являются применимыми для лечения меланхолии.FDA недавно одобрены сертралин и пароксетин, два SSRT, для лечения посттравматического стрессового расстройства (PTSD). Более того, соединения, обладающие 5-HT2A антагонистической активностью, являются применимыми, так как ожидают, что они способны подавлять возбуждение, бессонницу и вспыльчивость у пациентов с PTSD [Curr opinion Invest. Drug, 4, 37-41, 2003]. Соответственно,ожидают, что соединения по настоящему изобретению будут применимыми для лечения PTSD. Приливы крови представляют собой симптом, связанный с переходом к менопаузе. Некоторые женщины могут страдать от этого до такой степени, когда это мешает сну или общей активности, и когда необходимо лечение. Гормонозаместительная терапия с помощью эстрогена являлась общепринятой практикой в течение десятилетий, однако, недавно высказали опасения побочных эффектов, таких как рак молочной железы и кардиальные события. Клинические испытания с SSRI и SNRI показали, что эти соединения оказывают эффект на приливы крови, хотя и меньший, чем эстроген [J. Am. Med. Ass., 295,2057-2071, 2006]. Лечение приливов крови соединениями, ингибирующими повторное поглощение серотонина и/или норадреналина, например, соединениями по настоящему изобретению, может, однако, являться альтернативным лечением для женщин, которые не могут или не хотят принимать эстроген. Апноэ во сне или обструктивный синдром апноэ-гипапноэ во сне, или обструктивное нарушенное во сне дыхание является нарушением, для которого эффективная фармакотерапия остается неидентифицированной. Однако несколько исследований на животных позволяют предполагать, что антагонисты 5 НТ 3, например, соединения по настоящему изобретению, могут являться эффективными при терапевтическом вмешательстве [Sleep, 21, 131-136, 1998; Sleep, 8, 871, 878, 2001]. Недавно показано, что антагонист 5-НТ 3 одансетрон является эффективным для лечения пристрастия к алкоголю и лекарственным средствам и зависимости от них [Drug Alc. Depend., 84, 256-263, 2006;Pharmacol Therapeut., 111, 855-876, 2006]. Это, по-видимому, поддерживает представление, что антагонисты 5-НТ 3, например, соединения по настоящему изобретению, могут являться применимыми для лечения пристрастия, такого как пристрастие к алкоголю, никотину или углеводам; и зависимости от алкоголя и лекарственных средств. Другие предполагаемые применения антагонистов 5-НТ 3 включают в себя применения при рвоте, в частности вызванной химиотерапией рвоте, расстройствах пищевого поведения, таких как булимия, и синдроме раздраженной кишки (IBS) [Exp. Opin. Ther. Targets, 11, 527-540, 2007].-6 016054 Кроме того, ожидают, что соединения по настоящему изобретению, как обладающие уникальным фармакологическим профилем, являются применимыми для лечения аффективных расстройств, депрессии, основных депрессивных расстройств, послеродовой депрессии, депрессии, связанной с биполярным расстройством, болезни Альцгеймера, психоза или болезни Паркинсона, тревожности, генерализированного тревожного расстройства, социального тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, приступов паники, фобии, социальной фобии, агорафобии и стрессового недержания мочи. В одном варианте осуществления изобретение относится к способу лечения хронической боли, депрессии у частично отвечающих пациентов, устойчивой к лечению депрессии, болезни Альцгеймера,когнитивного нарушения, ADHD, меланхолии, PTSD, приливов крови, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, наркотической зависимости и токсикомании, зависимости от алкоголя или лекарственных средств, рвоты, расстройств пищевого поведения, IBS, аффективных расстройств,депрессии, основного депрессивного расстройства, послеродовой депрессии, депрессии, связанной с биполярным расстройством, болезни Альцгеймера, психоза или болезни Паркинсона, тревожности, генерализированного тревожного расстройства, социального тревожного расстройства, обсессивнокомпульсивного расстройства, панического расстройства, приступов паники, фобии, социальной фобии,агорафобии или стрессового недержания мочи, где способ включает в себя введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения I. В одном варианте осуществления у указанного пациента, которого лечат от любого из вышеперечисленных заболеваний, сначала диагностируют указанное заболевание. В одном варианте осуществления изобретение относится к способу лечения хронической боли, где способ включает в себя введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения I. В одном варианте осуществления указанная хроническая боль выбрана из фантомной боли в конечности, невропатической боли, диабетической невропатии, постгерпетической невралгии(PHN) , туннельного синдрома запястья (CTS), вызванной HIV невропатии, комплексного местного болевого синдрома (CPRS), тригеминальной невралгии/невралгии тройничного нерва/болезненного тика, хирургического вмешательства (например, послеоперационные аналгетические средства), диабетической васкулопатии, резистентности капилляров или диабетических симптомов, связанных с инсулитом, ангинозной боли, менструальной боли, связанной с раком боли, зубной боли, головной боли, мигрени, головной боли напряжения, тригеминальной невралгии, синдрома височно-нижнечелюстного сустава, миофасциальной боли при повреждении мышц, синдрома фибромиалгии, боли в костях и суставах (остеоартрита), ревматоидного артрита, ревматоидного артрита и отека, происходящего из-за травмы, связанной с ожогами, боли при растяжениях или трещинах в кости из-за остеоартрита, остеопороза, метастазов в кости или неизвестных причин, подагры, фиброзита, миофасциальной боли, компрессионных синдромов верхней апертуры грудной клетки, боли в верхней части спины или боли в нижней части спины (где боль в спине происходит из-за системного, местного, или первичного заболевания позвоночника (радикулопатия, тазовой боли, кардиальной боли в груди, не относящейся к кардиальной боли в груди, боли,связанной с повреждением спинного мозга (SCI), центральной постинсультной боли, невропатии при раке, боли при СПИД, боли при серповидно-клеточной анемии или гериатрической боли. В одном варианте осуществления указанная хроническая боль представляет собой невропатическую боль. В одном варианте осуществления указанная невропатическая боль выбрана из гиперпатии, гипералгезии, невропатии, диабетической невропатии, неврита, невралгии, гиперестезии, каузалгии и аллодинии. В одном варианте осуществления соединение по изобретению вводят в количестве от приблизительно 0,001 до приблизительно 100 мг/кг массы тела в сутки. Типичная пероральная доза лежит в диапазоне от приблизительно 0,001 до приблизительно 100 мг/кг массы тела в сутки, предпочтительно от приблизительно 0,01 до приблизительно 50 мг/кг массы тела в сутки, введенных в одной или нескольких дозах, например, от 1 до 3 доз. Точная доза будет зависеть от частоты и способа введения, пола, возраста, массы и общего состояния здоровья субъекта, которого лечат, природы и тяжести состояния, которое лечат, и любых сопутствующих заболеваний, подлежащих лечению, и других факторов, очевидных специалистам в данной области. Типичная пероральная доза для взрослых лежит в диапазоне 1-100 мг/сутки соединения по настоящему изобретению, например 1-30 мг/сутки или 5-25 мг/сутки. Этого, как правило, можно достигать введением 0,1-50 мг, например 1-25 мг, например 1, 5, 10, 15, 20 или 25 мг соединения по настоящему изобретению один или два раза в сутки. Терапевтически эффективное количество соединения, как применяют здесь, означает количество,достаточное для излечения, смягчения или частичной остановки клинических проявлений данного заболевания и его осложнений при терапевтическом вмешательстве, включающем в себя введение указанного соединения. Количество, достаточное для достижения этого, определяют как терапевтически эффективное количество. Термин также включает в себя количества, достаточные для излечения, смягчения или частичной остановки клинических проявлений данного заболевания и его осложнений при лечении,-7 016054 включающем в себя введение указанного соединения. Эффективные количества для каждой цели будут зависеть от тяжести заболевания или повреждения, так же как от массы и общего состояния здоровья субъекта. Будет понятно, что определение подходящей дозы можно проводить с использованием общепринятых экспериментов, посредством конструирования матрицы значений и тестирования различных точек в матрице, где все это находится в компетенции подготовленного терапевта. Термин лечение и проведение лечения, как применяют здесь, означает управление течением и уход за пациентом в целях борьбы с состоянием, таким как заболевание или нарушение. Термин предназначен, чтобы включать в себя полный спектр способов лечения данного состояния, от которого страдает пациент, таких как введение активного соединения для смягчения симптомов или осложнений, для замедления прогрессирования заболевания, нарушения или состояния, для смягчения или облегчения симптомов и осложнений, и/или для излечения или устранения заболевания, нарушения или состояния, так же как для предупреждения состояния, где предупреждение следует понимать как управление течением и уход за пациентом в целях борьбы с заболеванием, состоянием или нарушением, и оно включает в себя введение активных соединений для предотвращения возникновения симптомов или осложнений. Тем не менее, профилактическое (превентивное) и терапевтическое (лечебное) лечение являются двумя отдельными аспектами изобретения. Пациент, подлежащий лечению, предпочтительно представляет собой млекопитающее, в частности человека. В одном варианте осуществления изобретение относится к применению настоящего изобретения для изготовления лекарственного средства для лечения хронической боли, депрессии у частично отвечающих пациентов, устойчивой к лечению депрессии, болезни Альцгеймера, когнитивного нарушения,ADHD, меланхолии, PTSD, приливов крови, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, наркотической зависимости и токсикомании, зависимости от алкоголя или лекарственных средств, рвоты, расстройств пищевого поведения, IBS, аффективных расстройств, депрессии, основных депрессивных расстройств, послеродовой депрессии, депрессии, связанной с биполярным расстройством,болезни Альцгеймера, психоза или болезни Паркинсона, тревожности, генерализированного тревожного расстройства, социального тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, приступов паники, фобии, социальной фобии, агорафобии или стрессового недержания мочи. В одном варианте осуществления изобретение относится к применению настоящего изобретения для изготовления лекарственного средства для лечения хронической боли, такой как невропатическая боль. В одном варианте осуществления изобретение относится к соединению по настоящему изобретению для применения в качестве лекарственного средства для лечения хронической боли, депрессии у частично отвечающих пациентов, устойчивой к лечению депрессии, болезни Альцгеймера, когнитивного нарушения, ADHD, меланхолии, PTSD, приливов крови, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, наркотической зависимости и токсикомании, зависимости от алкоголя или лекарственных средств, рвоты, расстройств пищевого поведения, IBS, аффективных расстройств, депрессии, основных депрессивных расстройств, послеродовой депрессии, депрессии, связанной с биполярным расстройством, болезни Альцгеймера, психоза или болезни Паркинсона, тревожности, генерализированного тревожного расстройства, социального тревожного расстройства, обсессивно-компульсивного расстройства,панического расстройства, приступов паники, фобии, социальной фобии, агорафобии или стрессового недержания мочи. В одном варианте осуществления изобретение относится к соединениям по настоящему изобретению для применения в качестве лекарственного средства для лечения хронической боли, такой как невропатическая боль. Соединения по настоящему изобретению можно вводить самостоятельно в виде чистого соединения или в сочетании с фармацевтически приемлемыми носителями или наполнителями, либо в однократной, либо во множественных дозах. Фармацевтические композиции по изобретению можно составлять с фармацевтически приемлемыми носителями или разбавителями, так же как с любыми другими известными адъювантами и наполнителями согласно общепринятым способам, таким как способы, описанные в Remington: The Science and Practice of Pharmacy, 19 Edition, Gennaro, Ed., Mack Publishing Co.,Easton, PA, 1995. Фармацевтические композиции можно специально составлять для введения любым подходящим способом, таким как пероральный, ректальный, назальный, пульмональный, местный (включая буккальный и подъязычный), чрескожный, интрацистернальный, внутрибрюшинный, вагинальный и парентеральный (включая подкожный, внутримышечный, интратекальный, внутривенный и внутрикожный) способ, где пероральный способ является предпочтительным. Следует учитывать, что предпочтительный способ будет зависеть от общего состояния здоровья и возраста субъекта, подлежащего лечению, природы состояния, подлежащего лечению, и выбранного активного ингредиента. Фармацевтические композиции для перорального введения включают в себя твердые лекарственные формы, такие как капсулы, таблетки, драже, пилюли, пастилки, порошки и гранулы. Когда это целесообразно, их можно получать с покрытиями.-8 016054 Жидкие лекарственные формы для перорального введения включают в себя растворы, эмульсии,суспензии, сиропы и эликсиры. Фармацевтические композиции для парентерального введения включают в себя стерильные водные и неводные подходящие для инъекции растворы, дисперсии, суспензии или эмульсии, так же как стерильные порошки для разведения в стерильных подходящих для инъекции растворах или дисперсиях перед использованием. Другие подходящие для введения формы включают в себя суппозитории, спреи, мази, кремы, гели,средства для ингаляции, кожные пластыри, имплантаты и т.д. Удобно вводить соединения по изобретению в единичной дозированной форме, содержащей указанные соединения в количестве приблизительно 0,1-50 мг, например 1, 5, 10, 15, 20 или 25 мг соединения по настоящему изобретению. Для парентеральных способов, таких как внутривенное, интратекальное, внутримышечное и подобное введение, как правило, дозы составляют порядка приблизительно половины дозы, применяемой для перорального введения. Для парентерального введения можно применять растворы соединения по изобретению в стерильном водном растворе, водном пропиленгликоле, водном витамине Е или кунжутном или арахисовом масле. Такие водные растворы следует подходящим образом забуферивать, если необходимо, и сначала сделать жидкий разбавитель изотоническим с помощью достаточного количества солевого раствора или глюкозы. Водные растворы являются, в частности, подходящими для внутривенного, внутримышечного,подкожного и внутрибрюшинного введения. Все применяемые стерильные водные среды легко получить общепринятыми способами, известными специалистам в данной области. Подходящие фармацевтические носители включают в себя инертные твердые разбавители или наполнители, стерильный водный раствор и различные органические растворители. Примерами твердых носителей являются лактоза, магнезия, сахароза, циклодекстрин, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния, стеариновая кислота и эфиры низших алкилов и целлюлозы. Примерами жидких носителей являются сироп, арахисовое масло, оливковое масло, фосфолипиды, жирные кислоты, амины жирных кислот, полиоксиэтилен и вода. Фармацевтические композиции, полученные объединением соединений по изобретению и фармацевтически приемлемых носителей, затем легко вводят во множестве лекарственных форм, подходящих для описанных способов введения. Составы по настоящему изобретению, подходящие для перорального введения, могут присутствовать в виде отдельных единиц, таких как капсулы или таблетки, каждая из которых содержит предопределенное количество активного ингредиента, и которые могут включать подходящий наполнитель. Более того, подходящие для перорального введения составы могут присутствовать в форме порошка или гранул, раствора или суспензии в водной или неводной жидкости, или жидкой эмульсии масло в воде или вода в масле. Если твердый носитель используют для перорального введения, препарат может представлять собой таблетку, например, помещенную в твердую желатиновую капсулу в форме порошка или осадка, или в форме пастилки или таблетки для рассасывания. Количество твердого носителя может меняться, но обычно будет составлять от приблизительно 25 мг до приблизительно 1 г. Если используют жидкий носитель, препарат может присутствовать в форме сиропа, эмульсии,мягкой желатиновой капсулы или стерильной пригодной для инъекции жидкости, такой как водные или неводные жидкие суспензия или раствор. Таблетки можно получать смешиванием активного ингредиента с обычными адъювантами и/или разбавителями с последующим прессованием смеси в общепринятом аппарате для изготовления таблеток. Примеры адъювантов или разбавителей включают в себя кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камедь и т.п. Любые другие адъюванты или добавки,обычно применяемые для таких целей, такие как окрашивающие вещества, ароматизирующие вещества,консерванты и т.д., можно использовать при условии, что они являются совместимыми с активными ингредиентами. Капсулы, содержащие соединение по настоящему изобретению, можно получить смешиванием порошка, содержащего указанное соединение, с микрокристаллической целлюлозой и стеаратом магния и помещением указанного порошка в твердую желатиновую капсулу. Необязательно, указанную капсулу можно окрашивать посредством подходящего пигмента. Как правило, капсулы будут содержать 0,2520% соединения по настоящему изобретению, например 0,5-1,0%, 3,0-4,0%, 14,0-16,0% соединения по настоящему изобретению. Эти концентрации можно использовать для удобной доставки 1, 5, 10, 15, 20 и 25 мг соединения по настоящему изобретению в единичной дозированной форме. Растворы для инъекций можно получить растворением активного ингредиента и возможных добавок в части растворителя для инъекции, предпочтительно, стерильной воды, доведением раствора до желаемого объема, стерилизации раствора и заполнения им подходящих ампул или флаконов. Можно добавлять любые подходящие добавки, общепринятые в данной области, такие как средства для тоничности, консерванты, антиоксиданты и т.д. Соединение I можно получать, как описано в WO 2003/029232.-9 016054 Соли соединения I можно получать добавлением подходящей кислоты с последующим осаждением. Осаждение можно вызывать, например, охлаждением, удалением растворителя, добавлением другого растворителя или их смеси. Все ссылки, включая публикации, патентные заявки и патенты, процитированные в настоящем документе, включены в настоящий документ в качестве ссылок в полном объеме и в той степени, как если бы было указано, что каждая ссылка отдельно и конкретно включена в качестве ссылки и приведена в ее полном объеме в настоящем документе (до максимальной степени, допускаемой законом), независимо от какого-либо отдельно предоставленного включения конкретных документов, сделанного в другой части настоящего документа. Применение форм единственного числа и сходных объектов ссылки в контексте описания изобретения следует истолковывать как охватывающее как единственное, так и множественное число, если в настоящем документе нет иных указаний, или если контекст явно этому не противоречит. Например,выражение соединениеследует понимать как указание на различные соединения по этому изобретению или конкретный описанный аспект, если нет иных указаний. Если нет иных указаний, все точные значения, представленные в настоящем документе, являются репрезентативными для соответствующих приблизительных значений (например, можно считать, что все примеры точных значений, представленные в отношении конкретного фактора или измерения, также относятся к соответствующему приблизительному значению, модифицированному посредством приблизительно, когда это целесообразно). Описание в настоящем документе любого аспекта или аспекта изобретения с использованием таких терминов, как содержащий, обладающий, включающий, или охватывающий по отношению к элементу или элементам, предназначено для предоставления основания для сходного аспекта или аспекта этого изобретения, который состоит из, по существу состоит из этого конкретного элемента или элементов или по существу содержит их, если нет иных указаний, или если контекст явно этому не противоречит (например, композицию, описанную в настоящем документе как содержащую конкретный элемент, следует также понимать как описание композиции, состоящей из этого элемента, если нет иных указаний, или если контекст явно этому не противоречит). Примеры Аналитические способы Измерения рентгеновских порошковых дифрактограмм (XRPD) проводили на дифрактометреPANalytical X'Pert PRO X-Ray с использованием радиоактивного излучения CuK1. Образцы измеряли в режиме отражения в диапазоне 2 5-40 с использованием детектора X'celerator. Элементарный состав (CHN) измеряли на аппарате Elementar Vario EL от Elementar. Приблизительно 4 мг образца использовали для каждого измерения, и результаты даны как средние значения двух измерений. Пример 1 а. Соль НВr соединения I К 442 г перемешиваемого и слабо нагреваемого (приблизительно 45 С) этилового эфира 4-(2-птолилсульфанилфенил)пиперидин-1-карбоновой кислоты в виде масла добавляли 545 мл 33 мас.% HBr в АсОН (5,7 М, 2,5 экв.). Это перемешивание давало экзотермический эффект 10 С. После окончания добавления реакционную смесь нагревали до 80 С и оставляли на 18 ч. Отбирали образец и анализировали посредством HPLC и, если не происходило завершения реакции, являлось необходимым добавлять больше 33 мас.% HBr в АсОН. В другом случае смесь охлаждали до 25 С, заставляя оседать продукт гидробромид 4-(2-п-толилсульфанилфенил)пиперидина. Спустя один час при 25 С к густой суспензии добавляли 800 мл диэтилэфира. Перемешивание продолжали еще час перед тем, как продукт выделяли фильтрацией, промывали 400 мл диэтилэфира и высушивали под вакуумом при 40 С в течение ночи. Гидробромид соединения I выделяли в виде белого твердого вещества. Пример 1b. Соль HBr соединения I. 2-(4-толилсульфанил)фенилбромид В реакторе при перемешивании в атмосфере азота N-метилпирролидон, NMP (4,5 л) продували азотом в течение 20 мин. Добавляли 4-метилбензолтиол (900 г, 7,25 моль) и затем 1,2-дибромбензол (1709 г,7,25 моль). Наконец, добавляли трет-бутоксид калия (813 г, 7,25 моль) в качестве последнего реагента. Реакция являлась экзотермической, приводя к повышению температуры реакционной смеси до 70 С. Затем реакционную смесь нагревали до 120 С в течение 2-3 ч. Реакционную смесь охлаждали до комнатной температуры. Добавляли этилацетат (4 л) и водный раствор хлорида натрия (15%, 2,5 л). Смесь перемешивали в течение 20 мин. Водную фазу отделяли и проводили экстракцию другой порцией этилацетата (2 л). Водную фазу отделяли и органические фазы объединяли и промывали раствором хлорида натрия (15%, 2,5 л). Органическую фазу отделяли, высушивали с помощью сульфата натрия и выпаривали при пониженном давлении до красного масла, содержащего 20-30% NMP. Масло разводили до удваивания объема метанолом и смесь кипятили с обратным холодильником. Добавляли больше метанола, пока не получали прозрачный красный раствор. Во время осаждения раствор медленно охлаждали до комнатной температуры. Продукт кристаллизовался в виде грязно-белых кристаллов, их выделяли фильтрацией,- 10016054 промывали метанолом и высушивали при 40 С в вакуумной печи до постоянной массы. Этил-4-гидрокси-4-(2-(4-толилсульфанил)фенил)пиперидин-1-карбоксилат В реакторе при перемешивании в атмосфере азота 2-(4-толилсульфанил)фенил бромид (600 г, 2,15 моль) суспендировали в гептане (4,5 л). При комнатной температуре 10 М BuLi в гексане (235 мл, 2,36 моль) добавляли в течение 10 мин. Обнаружили только небольшой экзотермический эффект. Суспензию перемешивали в течение 1 ч при температуре окружающей среды и затем охлаждали до -40 С. 1 карбэтокси-4-пиперидон (368 г, 2,15 моль), растворенный в THF (1,5 л), добавляли при скорости не быстрее такой, чтобы поддерживать температуру реакции ниже -40 С. Когда реакция проходила до завершения, реакционную смесь нагревали до 0 С и добавляли 1 М HCl (1 л), поддерживая температуру ниже 10 С. Отделяли кислую водную фазу и проводили экстракцию этилацетатом (1 л). Органические фазы объединяли и проводили экстракцию раствором хлорида натрия (15%, 1 л). Органическую фазу сушили над сульфатом натрия и выпаривали до полукристаллической массы. Ее суспендировали в этиловом эфире (250 мл) и отфильтровывали. Высушивали в вакуумной печи при 40 С до постоянной массы. Этил-4-(2-(4-толилсульфанил)фенил)пиперидин-1-карбоксилат Трифторуксусную кислоту (2,8 кг, 24,9 моль) и триэтилсилан (362 г, 3,1 моль) загружали в реактор с эффективной мешалкой. Этил-4-гидрокси-4-(2-(4-толилсульфанил)фенил)пиперидин-1-карбоксилат(462 г, 1,24 моль) добавляли по частям через насыпную воронку. Реакция являлась слабо экзотермической. Температура поднималась до 50 С. После окончания добавления реакционную смесь нагревали до 60 С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры. Добавляли толуол (750 мл) и воду (750 мл). Выделяли органическую фазу, и проводили экстракцию водной фазы другой порцией толуола (750 мл). Органические фазы объединяли, промывали раствором хлорида натрия (15%, 500 мл) и высушивали над сульфатом натрия. Сульфат натрия отфильтровывали, фильтрат выпаривали при пониженном давлении до красного масла, которое перерабатывали далее на следующей стадии. Гидробромид 4-(2-(4-толилсульфанил)фенил)пиперидина Неочищенный этил-4-(2-(4-толилсульфанил)фенил)пиперидин-1-карбоксилат в виде красного масла из примера 3 смешивали в реакторе с мешалкой с бромисто-водородной кислотой в уксусной кислоте(40%, 545 мл, 3,11 моль). Смесь нагревали при 80 С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры. Во время охлаждения продукт выкристаллизовывался. Спустя 1 ч при комнатной температуре к реакционной смеси добавляли этиловый эфир (800 мл), и смесь перемешивали в течение еще одного часа. Продукт отфильтровывали, промывали этиловым эфиром и высушивали в вакуумной печи при 50 С до постоянной массы. Пример 1 с. Перекристаллизация соли HBr соединения I Смесь из 10,0 г соли НВr соединения I, например, полученной как выше, нагревали для кипячения с обратным холодильником в 100 мл Н 2 О. Смесь становилась прозрачной и полностью растворялась при 80-90 С. К прозрачному раствору добавляли 1 г активированного угля и продолжали кипячение с обратным холодильником в течение 15 мин, перед тем как профильтровать и оставить для самопроизвольного охлаждения до комнатной температуры. Во время охлаждения происходило осаждение белого твердого вещества, и суспензию перемешивали в течение 1 ч при комнатной температуре. Фильтрацией и высушиванием в вакууме при 40 С в течение ночи получали 6,9 г (69%) кислотно-аддитивной соли HBr соединения I. См. XRPD на фиг. 1. Элементарный анализ: 3,92% N, 59,3 6% С, 6,16% Н (теоретически: 3,85% N, 59,34% С, 6,09% Н) . Пример 1d. Получение маточных растворов свободного основания К смеси из 500 мл этилацетата и 200 мл Н 2 О добавляли 50 г соли HBr соединения I, получая двухфазную суспензию. К этой суспензии добавляли приблизительно 25 мл конц. NaOH, что приводило к образованию прозрачного двухфазного раствора (рН измеряли как 13-14). Раствор энергично перемешивали в течение 15 мин и отделяли органическую фазу. Органическую фазу промывали с помощью 200 мл Н 2 О, сушили над Na2SO4, фильтровали и выпаривали в вакууме при 60 С, получая выход свободного основания 38 г (99%) в виде почти бесцветного масла. Растворением 10 г масла и доведением объема до 150 мл с использованием этилацетата получали 0,235 М маточный раствор в этилацетате, из которого использовали аликвоты по 1,5 мл (100 мг свободного основания). Растворением 10 г масла и доведением объема до 100 мл с использованием 96% об. EtOH получали маточный раствор 0,353 M в EtOH, из которого использовали аликвоты по 1,0 мл (100 мг свободного основания). Пример 1e. Образование солей с использованием маточных растворов свободного основания Данные аликвоты помещали в пробирки и при перемешивании добавляли соответствующее количество кислоты, как указано в табл. 1. Если кислота являлась жидкой, ее добавляли чистой, в других случаях ее растворяли в данном растворителе перед добавлением. После смешивания и осаждения перемешивание продолжали в течение ночи, и осадок собирали фильтрацией. Перед высушиванием в вакууме при 30 С отбирали небольшой контрольный образец и высушивали при комнатной температуре без вакуума. Эту процедуру включали для тестирования сольватов. Некоторые результаты представлены в табл. 1. Дифрактограммы XRPD показаны на фиг. 1-22, и избранные положения пиков приведены в табл. 2. В- 11016054 табл. 3 показаны растворимости соединений по настоящему изобретению в воде вместе с рН полученного насыщенного раствора. В колонке осадок показано, является ли осадок, выделенный после определения растворимости, идентичным растворенному соединению, что является показателем формирования гидратов. Таблица 1- 12016054 Таблица 2. Избранные положения рентгеновских пиков (2), 2:1 означает 2 основания на 1 кислоту. Все значения +- 0,1 Пример 2 А. Ингибирование повторного поглощения серотонина (5-НТ) и норадреналина (NE) Аликвоты тестируемого соединения и препарат синаптосомы коры головного мозга крысы предварительно инкубировали в течение 10 мин/37 С, и затем добавляли [3H]NE или [3 Н]5-НТ (конечная концентрация 10 нМ). Неспецифическое поглощение определяли в присутствии 10 мкМ талсупрама или циталопрама, а общее поглощение определяли в присутствии буфера. Аликвоты инкубировали в течение 15 мин при 37 С. После инкубации [3H]NE или [3 Н]5-НТ, поглощенные синаптосомами, отделяли фильтрацией через Unifilter GF/C, предварительно смоченный в 0,1% PEI, в течение 30 мин, с использованием программы Tomtec Cell Harvester. Фильтры промывали и считали в счетчике Wallac MicroBeta. В NET для соединений по настоящему изобретению показали значение IC50 23 нМ. В SERT для соединений по настоящему изобретению показали значение IC50 8 нМ. Пример 2 В. Антагонизм 5-HT2A Соединения по настоящему изобретению тестировали по аффинностям к рецепторам серотонина и обнаружили, что для них выявили антагонистический профиль с аффинностью к рецепторам 5-HT2A (Ki 54 нМ). Аффинность вычисляли из Y = 100/(1 + 10(x-logIC50, где Y обозначает процент связывания, и X обозначает концентрацию соединения. 5 концентраций соединений (1, 10, 30, 100, 1000 нМ) использовали для вычисления значения IC50. Ki вычисляли из уравнения Чена и Прусоффа Ki = (IC50/(1+([L]/Kd. Аффинность определяли на MDL Pharmaservices каталожный номер 271650. В клетках млекопитающих, экспрессирующих рецепторы 5-HT2A человека, для соединений по настоящему изобретению показали конкурентные антагонистические свойства. Соединения связываются с рецепторами 5-HT2A с Ki100 нМ и в функциональном анализе соединения, являющиеся антагонистами 5-НТ, вызывают высвобождение Са 2+ из внутриклеточных запасов с Kb 67 нМ. Анализ Шилда выявил конкурентный антагонизм с Kb 100 нМ. Эксперимент проводили следующим образом. За 2 или 3 суток перед экспериментом клетки СНО,экспрессирующие 250 фмоль/мг рецепторов 5-HT2A человека, рассевали при плотности, достаточной для получения моноконфлюэентного слоя на сутки эксперимента. Клетки нагружали красителем (Са+-набор от Molecular Devices) в течение 60 мин при 37 С в инкубаторе с 5% СО 2 при 95% влажности. Исходную флуоресценцию мониторировали на считывателе флуоресцентного изображения планшетов или FLIPR384 от Molecular Devices (Sunnyvale, CA) с длиной волны возбуждения 488 нм и диапазоном испускания 500560 нм. Интенсивность лазера устанавливали на подходящий уровень для получения исходных значений приблизительно 8000-10000 единиц флуоресценции. Изменения исходной флуоресценции должны составлять менее 10%. Значения ЕС 50 оценивали с использованием увеличивающихся концентраций тестируемого соединения, покрывающих по меньшей мере 3 порядка. Значения рА 2 оценивали, проверяя полные кривые зависимости от дозы 5-НТ с четырьмя различными концентрациями соединения (150, 400,1500 и 4000 нМ). Значения Kb также оценивали, проверяя 2 порядка концентраций тестируемых веществ с ЕС 85 5-НТ. Тестируемые вещества добавляли к клеткам за 5 мин перед 5-НТ. Значения Ki рассчитывали с использованием уравнения Чена и Прусоффа. Пример 2 С. Антагонизм рецептора 5-HT3A В ооцитах, экспрессирующих гомомерные рецепторы 5-HT3A, 5-НТ человека активирует токи с ЕС 50 2600 нМ. К этому току могут проявлять антагонизм классические антагонисты 5-НТ 3, такие как ондансе- 14016054 трон. Для ондансетрона в этой системе наблюдают значение Ki ниже 1 нМ. Соединения по настоящему изобретению обладают активным антагонизмом в низких концентрациях (0,1-100 нМ) (IC5010 нМ/Kb2 нМ) и агонистическими свойствами при применении в более высоких концентрациях (100-100000 нМ)(ЕС 502600 нМ) с достижением максимального тока приблизительно 70-80% от максимального тока,вызываемого собственно 5-НТ. В ооцитах, экспрессирующих гомомерные рецепторы 5-HT3A, 5-НТ активирует токи с ЕС 50 3,3 мкМ. Эксперименты проводили следующим образом. Ооциты удаляли хирургически у половозрелой самки Xenepus laevis после анестезии в 0,4% MS-222 в течение 10-15 мин. Затем ооциты расщепляли при комнатной температуре в течение 2-3 ч с помощью 0,5 мг/мл коллагеназы (типаIA Sigma-Aldrich) в буфере OR2 (82,5 мН NaCl, 2,0 мМ KCl, 1,0 мМ MgCl2 и 5,0 мМ HEPES, рН 7,6). Ооциты, освобожденные от фолликулярного слоя, отбирали и инкубировали в течение 24 ч в модифицированном солевом растворе Барта [88 мМ NaCl, 1 мМ KCl, 15 мМ HEPES, 2,4 мМ NaHCO3, 0,41 мМCaCl2, 0,82 мМ MgSO4, 0,3 мМ Ca(NO3)2], дополненном 2 мМ пируватом натрия, 0,1 ед./л пенициллина и 0,1 мкг/л стрептомицина. Идентифицировали ооциты на стадии IV-IV и инъецировали в них 12-48 нл свободной от нуклеазы воды, содержащей 14-50 пг кРНК, кодирующей рецепторы 5-НТ 3 А человека, и инкубировали при 18 С до их использования для снятия электрофизиологических показаний (1-7 суток после инъекции). Ооциты с экспрессией рецепторов 5-НТ 3 человека помещали в баню 1 мл и проводили перфузию буфером Рингера (115 мМ NaCl, 2,5 мМ KCl, 10 мМ HEPES, 1,8 мМ CaCl2, 0,1 мМ MgCl2, pH 7,5). Клетки объединяли с агаром, в который помещены электроды 0,5-1 M, содержащие 3 М KC1, и напряжение фиксировали на -90 мВ посредством усилителя GeneClamp 500B. Проводили непрерывную перфузию ооцитов с помощью буфера Рингера, и лекарственные средства добавляли в перфузат. Растворы агониста 5-НТ вводили в течение 10-30 с. Эффективности антагонистов рецептора 5-НТ 3 исследовали посредством измерения концентрации-ответа по отношению к стимуляции 10 мкм 5-НТ. Пример 2D. Антагонизм рецептора 1A Соединения по настоящему изобретению тестировали по аффинностям по отношению к рецептору 1A и обнаружили, что они обладают антагонистическим профилем со средней аффинностью для рецепторов 1A (K1=34 нМ). На сутки экспериментов мембраны (см. ниже описание препарата мембраны) оттаивали, гомогенизировали в буфере с использованием ultra turrax и разводили до желательной концентрации (5 мкг/лунку 5 мкг/900 мкл, хранили на льду до использования). Эксперимент начинают смешиванием 50 мкл тестируемого соединения, 50 мкл [3 Н]-празосина, и 900 мкл мембран и смесь инкубируют в течение 20 мин при 25 С. Неспецифическое связывание определяют в присутствии 10 мкм WB-4101 и общее связывание определяют в присутствии буфера. После инкубации связанный лиганд отделяют от несвязанного фильтрацией через Unifilter GF/B, предварительно смоченный в 0,1 % PEI в течение 30 мин, с использованием программы Tomtec Cell Harvester (D4, 24). 96 лунок. Фильтры промывают 3 раза 1 мл ледяного буфера, высушивают при 50 С и добавляют к фильтрам 35 мкл сцинтилляционной жидкости/лунку. Связанную радиооактивность подсчитывают в Wallac 0Y 1450MicroBeta. Аффинность вычисляют из Y = 100/ (1 + 10(x-logIC50, где Y обозначает процент связывания, и X обозначает концентрацию соединения. Концентрации соединений, перекрывающие 2 порядка, использовали для вычисления значения IC50. Ki вычисляли из уравнения Чена и Прусоффа Ki = (IC50/(1+( [L]/Kd. В функциональном анализе соединения по настоящему изобретению являются антагонистами вызванного адреналином высвобождения Са 2+ из внутриклеточных запасов, и функциональный анализ выявил, что соединения являлись антагонистами. Эти эксперименты, по существу, проводили так, как описано ниже. Все клетки культивировали в среде DMEM, дополненной 10% BCS, 4 мМ L-глутамином (или 2 мМ в случае COS-7), и 100 единиц/мл пенициллина плюс 100 мкг/мл стрептомицина, при 37 С, в 5% СО 2. За 24 ч перед анализами клетки СНО, экспрессирующие рецепторы альфа 1A-7 человека, высевали в 384-луночные микропланшеты для титрования с черными стенками, покрытые поли-D-лизином. Отбирали культуральную среду и клетки нагружали красителем с помощью 1,5 мкм Fluo-4 в буфере для анализа, составленном из сбалансированного солевого раствора Хэнка (138 мМ NaCl, 5 мМ KCl, 1,3 мМ CaCl2,0,5 мМ MgCl2, 0,4 мМ MgSO4, 0,3 мМ KH2PO4, 0,3 мМ Na2HPO4, 5,6 мМ глюкоза) плюс 20 мМ HEPES рН 7,4, 0,05% BSA и 2,5 мМ пробеницид (50 мкл/лунку) в течение 1 ч в 5% CO2 при 37 С. После удаления избытка красителя клетки промывали в буфере для анализа и покрывали конечным объемом, равным 45 мкл/лунку (или 30 мкл/лунку для анализа антагонистов). В случае оценки антагониста, антагонист или носитель добавляли в этой точке в виде аликвоты 15 мкл в 4% DMSO-содержащем буфере с 4 х конечной концентрацией (конечный DMSO = 1%), с последующей инкубацией 20 мин. Исходную флуоресценцию мониторировали на считывателе флуоресцентного изображения планшетов или FLIPR от MolecularDevices (Sunnyvale, CA) с длиной волны возбуждения 488 нм и диапазоном испускания 500-560 нм. Энергию возбуждения лазера регулировали так, что считывания исходной флуоресценции составляли приблизительно 8000 относительных единиц флуоресценции (RFU). Затем клетки стимулировали при комнатной температуре агонистами, разведенными в буфере для анализа (15 мкл), и измеряли RFU с интервалами в 1,5 с в течение периода 2,5 мин. Для каждой лунки вычисляли максимальное изменение- 15016054 флуоресценции. Кривые концентрация-ответ, полученные из максимального изменения флуоресценции,анализировали по нелинейной регрессии (уравнение Хилла). Для антагонистических определений после 20 мин инкубации соединений (как выше) добавляли фиксированные концентрации стандартного агониста серотонина. Пример 2 Е. Увеличение уровня дофамина Однократная инъекция соединений по настоящему изобретению зависимым от дозы образом увеличивала внеклеточные уровни DA во фронтальном кортексе крысы. Соединение по настоящему изобретению при 8,9 мг/кг и 18 мг/кг s.c. увеличивало уровни DA приблизительно на 100 и 150%, соответственно, выше исходных уровней, как изображено на фиг. 23. Количества вычисляли как свободное основание. Метод Использовали самцов крыс Sprague-Dawley с первоначальной массой 275-300 г. Животных содержали при цикле 12 ч свет/темнота в контролируемых условиях при постоянной температуре окружающей среды (212 С) и влажности (555%) с пищей и водопроводной водой, доступной по желанию. Для экспериментов с обработкой в течение трех суток использовали осмотические мининасосы (Alzet, 2 ML 1). Насосы заполняли в асептических условиях и имплантировали подкожно с анестезией севофлурансом. Эксперименты проводили с установленными мининасосами. Образцы крови для измерения уровней тестируемого соединения в плазме после 3 суток обработки собирали в конце экспериментов. Эксперименты хирургической операции и микродиализа Проводили анестезию животных с помощью гипнорма/дормикума (2 мл/кг), и внутримозговые направляемые канюли (СМА/12) стереотаксически имлантировали в гиппокамп, направляя диализный наконечник в вентральный гиппокамп (координаты: 5,6 мм спереди брегмы, латерально -5,0 мм, 7,0 мм вентрально от твердой оболочки или во фронтальном кортексе (координаты: 3,2 мм спереди брегмы; латерально, 3,0 мм; 4,0 мм вентрально от твердой оболочки). Анкерные винты и акриловый цемент служили для фиксации направляющих канюль. Температуру тела животных мониторировали посредством ректального зонда и поддерживали при 37 С. Крысам позволяли восстановиться после хирургической операции в течение 2 суток, при одиночном содержании в клетках. На сутки эксперимента зонд для микродиализа (СМА/12, диаметр 0,5 мм, длина 3 мм) вставляли через направляющую канюлю. Зонды соединяли через двухканальное поворотное соединение с насосом для микроинъекций. Перфузию зонда для микродиализа с помощью фильтрованного раствора Рингера (145 мм NaCl, 3 мМ KCl, 1 мМ MgCl2, 1,2 мМ CaCl2) начинали незадолго до вставки зонда в мозг и продолжали в течение продолжительности эксперимента при постоянной скорости потока 1 (1,3) мкл/мин. После 180 мин стабилизации начинали эксперименты. Диализаты собирали каждые 20 (30) мин. После экспериментов крыс умерщвляли декапитацией, их мозг удаляли, замораживали и нарезали для верификации расположения зонда. Анализ диализатов Концентрацию дофамина в диализатах анализировали посредством HPLC с электрохимической детекцией. Моноамины разделяли обращенно-фазовой жидкостной хроматографией (ODS 1503 мм, 3 мкМ). Дофамин: подвижная фаза, состоящая из 90 мМ NaH2PO4, 50 мМ цитрата натрия, 367 мг/л натриевой соли 1-октансульфоновой кислоты, 50 мкм ЭДТА и 8% ацетонитрила (рН 4,0) при скорости потока 0,5 мл/мин. Электрохимическую детекцию осуществляли с использованием кулонометрического детектора; напряжение устанавливали на 250 мВ (замыкающая ячейка при 350 мВ) (Coulochem II, ESA). Пример 2F. Увеличение уровня ацетилхолина Эксперимент разработали для оценки эффектов соединений по настоящему изобретению на внеклеточные уровни ацетилхолина в префронтальном кортексе свободно двигающихся крыс. Для экспериментов использовали самцов крыс Wistar (280-350 г; Harlan, Zeist, The Netherlands). Крыс содержали индивидуально в пластиковых клетках (303040 см), и они имели доступ к пище и воде по желанию. Проводили анестезию крыс с использованием изофлурана (2%, 400 мл/мин N2O, 400 мл/мин О 2). Лидокаин (10% мас./об.) использовали для местной анестезии. Каждое животное помещали в стереотаксическую рамку (Kopf instruments, USA), и I-образные зонды собственного изготовления (мембрана Hospal AN 69, 4 мм открытой поверхности) вставляли в срединный префронтальный кортекс (mPFC) с использованием атласа мозга крысы Paxinos and Watson (1982). Координаты наконечника зонда представляли собой mPFC [AP=3,4 мм, L=-0,8 мм, V=5,0 мм]. Затем зонд фиксировали на черепе с помощью зубного цемента и винта. Флуниксин (1 мг/кг s.c.) вводили в качестве послеоперационного аналгетического средства. Эксперименты проводили через 24-48 ч после хирургической операции. На сутки эксперимента крыс соединяли с помощью гибких трубок РЕЕК с насосами для микроперфузии (СМА 102) и проводили перфузию зондов для диализа с помощью буфера Рингера, содержащего 147 мМ NaCl, 3,0 мМ KCl, 1,2 мМ CaCl2 и 1,2 мМ MgCl2, при скорости потока 1,5 мкл/мин. Образцы после микродиализа собирали с интервалами 30 мин в минифлаконы, содержащие 55 мкл 0,02 М муравьиной кислоты, для определения- 16016054 уровня ацетилхолина. Образцы собирали посредством автоматического коллектора фракций (СМА 142),и хранили при -80 С до анализа. После завершения экспериментов крыс умерщвляли. Мозг удаляли и выдерживали в растворе параформальдегида (4% мас./об.). Положение каждого зонда верифицировали гистологически согласно Paxinos and Watson (1982), посредством получения коронарных срезов мозга. Тестируемое соединение растворяли в 10% 2-ОН-пропил-бета-циклодекстрине, и введение осуществляли посредством подкожных инъекций объемов 5 мл/кг в различных дозах. Концентрации ацетилхолина определяли посредством HPLC с детекцией тандемной массспектрометрией (MS/MS). Аликвоты (25 мкл) инъецировали в колонку для HPLC посредством автоматического инжектора для образцов (PerkinElmer Instruments, серия 200). Хроматографическое разделение проводили на аналитической колонке с обращенной фазой 1502,00 мм (4 мкм) (Phenomenex Synergy MAX-RP, Bester), защищенной защитной колонкой 42,0 мм (Phenomenex Synergy MAX-RP AJO-6073, Bester), где обе поддерживали при температуре 30 С. Подвижная фаза (изократическая) состояла из ультраочищенной воды(UP), ацетонитрила (ACN) и трифторуксусной кислоты (TFA) (UP:ACN:TFA = 95,0:0,5:0,1 об./об./об.%). Подвижную фазу пропускали через систему со скоростью потока 0,300 мл/мин насосом HPLC (PerkinElmer Instruments, микронасос серии 200). Анализы LC/MS проводили с использованием системы API 4000 MS/MS, состоящей из детектораAPI 4000 MS/MS и сопряженного устройства для ионораспыления Turbo Ion Spray (оба из Applied Biosystems, the Netherlands). Сбор данных проводили в режиме положительной ионизации, с напряжением ионораспыления, установленном на 5,5 кВ, давлением газа в распылителе 50 фунтов на кв. дюйм (на шкалеSCIEX 0-90) с температурой пробы 600 С. Прибором управляли в режиме мониторинга множественных реакций (MRM) для детекции ацетилхолина (предшественник 146,1 Да, продукт 86,8 Да). Энергия столкновения составляла 21,0 эВ, и давление газа (азота) при столкновении поддерживали при 7 (на шкалеSCIEX 0-12). Данные калибровали и оценивали количество с использованием системы данных Analysttm(Applied Biosystem, версия 1,2). Два последовательных образца после микродиализа с изменениями менее 50% брали в качестве исходных уровней и устанавливали на 100%. Изменения концентрации ацетилхолина выражали в процентах от исходного у того же самого субъекта. Данные показаны на фиг. 24. Пример 2G. Увеличение уровня ацетилхолина Эксперимент разработали для оценки эффектов соединений по настоящему изобретению на внеклеточные уровни ацетилхолина в префронтальном кортексе и вентральном гиппокампе свободно двигающихся крыс. Использовали самцов крыс Sprague-Dawley с первоначальной массой 275-300 г. Животных содержали при цикле 12 ч свет/темнота в контролируемых условиях при постоянной температуре внутри помещения (212 С) и влажности (555%) с пищей и водопроводной водой, доступной по желанию. Эксперименты хирургической операции и микродиализа Проводили анестезию крыс с помощью гипнорма/дормикума (2 мл/кг), и внутримозговые направляемые канюли (СМА/12) стереотаксически имлантировали в гиппокамп с целью достижения положения наконечника диализного зонда в вентральном гиппокампе (координаты: 5,6 мм спереди брегмы, латерально -5,0 мм, 7,0 мм вентрально от твердой оболочки или во фронтальном кортексе (координаты: 3,2 мм спереди брегмы; латерально, 0,8 мм; 4,0 мм вентрально от твердой оболочки). Анкерные винты и акриловый цемент использовали для фиксации направляющих канюль. Температуру тела животных мониторировали посредством ректального зонда и поддерживали при 37 С. Крысам позволяли восстановиться после хирургической операции в течение 2 суток, при одиночном содержании в клетках. На сутки эксперимента зонд для микродиализа (СМА/12, диаметр 0,5 мм, длина 3 мм) вставляли через направляющую канюлю. Зонды соединяли через двухканальное поворотное соединение с насосом для микроинъекций. Перфузию зонда для микродиализа с помощью фильтрованного раствора Рингера (145 мм NaCl, 3 мМ KCl, 1 мМ MgCl2, 1,2 мМ CaCl2, содержащего 0,5 мкм неостигмин) начинали незадолго до вставки зонда в мозг и продолжали в течение продолжительности эксперимента при постоянной скорости потока 1 мкл/мин. После 180 мин стабилизации начинали эксперименты. Диализаты собирали каждые 20 мин. После экспериментов крыс умерщвляли, их мозг удаляли, замораживали и нарезали для верификации расположения зонда. Анализ диализата ацетилхолина Концентрацию ацетилхолина (ACh) в диализатах анализировали посредством HPLC с электрохимической детекцией с использованием подвижной фазы, состоящей из 100 мМ водородфосфата динатрия, 2,0 мМ октансульфоновой кислоты, 0,5 мМ хлорида тетраметиламмония и 0,005% MB (ESA), рН 8,0. Предколоночный ферментативный реактор (ESA), содержащий иммобилизованную холиноксидазу, исключал холин из инъецируемого образца (10 мкл) перед разделением ACh на аналитической колонке(ESA ACH-250); скорость потока 0,35 мл/мин, температура: 35 С. После аналитической колонки образец пропускали через постколоночный твердофазный реактор (ESA), содержащий иммобилизованную аце- 17016054 тилхолинэстеразу и холиноксидазу. В последнем реакторе ACh переводили в холин, а затем холин в бетаин и Н 2 О 2. Последний детектировали электрохимически с использованием платинового электрода(Analytical cell: ESA, модель 5040). Представление данных В экспериментах с однократной инъекцией среднее значение из 3 последовательных образцов Ach,непосредственно предшествующих введению соединения, служило исходным уровнем для каждого эксперимента, и данные переводили в проценты от исходных (средних исходных значений до инъекции,нормализованных до 100%). Данные представлены на фиг. 25 а и 25b. Данные, представленные на фиг. 24, показывают неожиданные падения уровней ацетилхолина (см.,например, 8 мг/кг), которые трудно объяснить, и которые приписали погрешности эксперимента. В общем, оба набора данных из примера 2F и 2G показывают одно и то же, т.е. зависимое от дозы увеличение внеклеточных уровней ацетилхолина в мозге. Ожидают, что преклинические обнаружения переведут в улучшение когнитивных функций при клинически условиях, применяемых, например, для лечения заболеваний, характеризующихся нарушением когнитивных функций, например, таких как у пациентов с болезнью Альцгеймера, частично отвечающих пациентов, пациентов с нарушением когнитивных функций и т.д. Пример 3. Эффект на невропатическую боль Чтобы продемонстрировать эффективность против невропатической боли, соединение по настоящему изобретению тестировали на формалиновой модели невропатической боли [Neuropharm., 48, 252263, 2005; Pain, 51, 5-17, 1992]. В этой модели мышам вводили инъекцию формалина (4,5%, 20 мкл) в подошвенную поверхность левой задней лапы, и затем их помещали в отдельные аналитические стаканы(емкостью 2 л) для обследования. Раздражение, вызванное инъекцией формалина, вызывает характерную двухфазную поведенческую реакцию, как количественно оценивают по количеству времени, потраченного на зализывание поврежденной лапы. Первая фаза (0-10 мин) представляет собой непосредственное химическое раздражение и ноцицепцию, тогда как вторая (20-30 мин), как считают, представляет собой боль невропатического происхождения. Две фазы разделены периодом покоя, в котором поведение возвращается к нормальному. Измерением количества времени, потраченного на зализывание поврежденной лапы в двух фазах, оценивают эффективность тестируемых соединений для уменьшения болезненных стимулов. Тестировали восемь мышей С 57/В 6 (приблизительно 25 г) на группу. В табл. 4 ниже показано количество времени, потраченного на зализывание поврежденной лапы в двух фазах, т.е. через 0-5 мин и 20-30 мин после инъекции формалина. Количество введенного соединения рассчитывали как свободное основание. Таблица 4 Данные в табл. 4 показывают, что соединение по настоящему изобретению оказывает небольшой эффект на первую фазу, представляющую собой непосредственное химическое раздражение и ноцицепцию. Более заметно, что данные показывают также явное и зависимое от дозы уменьшение времени, потраченного на зализывание лап во второй фазе, показывая эффект соединения по настоящему изобретению для лечения невропатической боли. Пример 4. Капсулы Гидробромид 4-[2-(4-метилфенилсульфанил)фенил]пиперидина смешивали с микрокристаллической целлюлозой на первой стадии. На второй стадии подмешивали стеарат магния. Получали капсулы с четырьмя концентрациями - активный ингредиент составляли в форме свободного основания. Из каждой партии получали 10000 капсул. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Аддитивная соль HBr и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина- 18016054 в кристаллической форме. 2. Соединение по п.1, где соединение характеризуется пиками на рентгеновской порошковой дифрактограмме (XRPD) в области приблизительно 6,08, 14,81, 19,26 и 25,382. 3. Соединение по п.1, где соединение характеризуется рентгеновской порошковой дифрактограммой (XRPD), представленной на фиг. 1. 4. Аддитивная соль DL-молочной кислоты и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина в кристаллической форме. 5. Аддитивная соль глутаровой кислоты и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина (1:1) в кристаллической форме. 6. Аддитивная соль малоновой кислоты и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина (1:1)(1:1) или гидрат аддитивной соли в кристаллической форме. 8. Аддитивная соль глутаминовой кислоты и 4-[2-(4-метилфенилсульфанил)фенил]пиперидина (1:1) или моногидрат аддитивной соли глутаминовой кислоты и 4-[2-(4 метилфенилсульфанил)фенил]пиперидина в кристаллической форме. 9. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 вместе с фармацевтически приемлемым наполнителем, для применения в лечении заболевания, выбранного из хронической боли, депрессии у частично отвечающих пациентов, устойчивой к лечению депрессии, болезни Альцгеймера, когнитивного нарушения, ADHD, меланхолии, PTSD, приливов крови, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, наркотической зависимости и токсикомании, зависимости от алкоголя или лекарственных средств, рвоты, расстройств пищевого поведения, IBS, аффективных расстройств, депрессии, основного депрессивного расстройства, послеродовой депрессии, депрессии, связанной с биполярным расстройством, болезни Альцгеймера, психоза или болезни Паркинсона, тревожности, генерализированного тревожного расстройства, социального тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, приступов паники, фобии, социальной фобии, агорафобии или стрессового недержания мочи. 10. Способ лечения заболевания, выбранного из хронической боли, депрессии у частично отвечающих пациентов, устойчивой к лечению депрессии, болезни Альцгеймера, когнитивного нарушения,ADHD, меланхолии, PTSD, приливов крови, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, наркотической зависимости и токсикомании, зависимости от алкоголя или лекарственных средств, рвоты, расстройств пищевого поведения, IBS, аффективных расстройств, депрессии, основного- 19016054 депрессивного расстройства, послеродовой депрессии, депрессии, связанной с биполярным расстройством, болезни Альцгеймера, психоза или болезни Паркинсона, тревожности, генерализированного тревожного расстройства, социального тревожного расстройства, обсессивно-компульсивного расстройства,панического расстройства, приступов паники, фобии, социальной фобии, агорафобии или стрессового недержания мочи, где способ включает в себя введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения по любому из пп.1-8. 11. Способ по п.10, где указанное заболевание представляет собой хроническую боль. 12. Способ по п.11, где указанная хроническая боль выбрана из фантомной боли в конечности, невропатической боли, диабетической невропатии, постгерпетической невралгии (PHN), туннельного синдрома запястья (CTS), вызванной HIV невропатии, комплексного местного болевого синдрома (CPRS),тригеминальной невралгии/невралгии тройничного нерва/болезненного тика, хирургического вмешательства (например, послеоперационные аналгетические средства), диабетической васкулопатии, резистентности капилляров или диабетических симптомов, связанных с инсулитом, ангиозной боли, менструальной боли, связанной с раком боли, зубной боли, головной боли, мигрени, головной боли напряжения, тригеминальной невралгии, синдрома височно-нижнечелюстного сустава, миофасциальной боли при повреждении мышц, синдрома фибромиалгии, боли в костях и суставах (остеоартрита), ревматоидного артрита, ревматоидного артрита и отека, происходящего из-за травмы, связанной с ожогами, боли при растяжениях или трещинах в кости из-за остеоартрита, остеопороза, метастазов в кости или неизвестных причин, подагры, фиброзита, миофасциальной боли, компрессионных синдромов верхней апертуры грудной клетки, боли в верхней части спины или боли в нижней части спины (где боль в спине происходит из-за системного, местного или первичного заболевания позвоночника (радикулопатия,тазовой боли, кардиальной боли в груди, не относящейся к кардиальной боли в груди, боли, связанной с повреждением спинного мозга (SCI), центральной постинсультной боли, невропатии при раке, боли при СПИД, боли при серповидно-клеточной анемии и гериатрической боли. 13. Способ по п.12, где указанная хроническая боль представляет собой невропатическую боль. 14. Способ по п.13, где указанная невропатическая боль выбрана из гиперпатии, гипералгезии, невропатии, диабетической невропатии, неврита, невралгии, гиперестезии, каузалгии и аллодинии. 15. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства для лечения заболевания, выбранного из хронической боли, депрессии у частично отвечающих пациентов, устойчивой к лечению депрессии, болезни Альцгеймера, когнитивного нарушения, ADHD, меланхолии,PTSD, приливов крови, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, наркотической зависимости и токсикомании, зависимости от алкоголя или лекарственных средств, рвоты, расстройств пищевого поведения, IBS, аффективных расстройств, депрессии, основного депрессивного расстройства,послеродовой депрессии, депрессии, связанной с биполярным расстройством, болезни Альцгеймера,психоза или болезни Паркинсона, тревожности, генерализированного тревожного расстройства, социального тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства,приступов паники, фобии, социальной фобии, агорафобии или стрессового недержания мочи. 16. Применение по п.15, где указанное заболевание представляет собой хроническую боль. 17. Применение по п.16, где указанная хроническая боль выбрана из фантомной боли в конечности,невропатической боли, диабетической невропатии, постгерпетической невралгии (PHN), туннельного синдрома запястья (CTS), вызванной HIV невропатии, комплексного местного болевого синдрома(CPRS), тригеминальной невралгии/невралгии тройничного нерва/болезненного тика, хирургического вмешательства (например, послеоперационные аналгетические средства), диабетической васкулопатии,резистентности капилляров или диабетических симптомов, связанных с инсулитом, ангиозной боли,менструальной боли, связанной с раком боли, зубной боли, головной боли, мигрени, головной боли напряжения, тригеминальной невралгии, синдрома височно-нижнечелюстного сустава, миофасциальной боли при повреждении мышц, синдрома фибромиалгии, боли в костях и суставах (остеоартрита), ревматоидного артрита, ревматоидного артрита и отека, происходящего из-за травмы, связанной с ожогами,боли при растяжениях или трещинах в кости из-за остеоартрита, остеопороза, метастазов в кости или неизвестных причин, подагры, фиброзита, миофасциальной боли, компрессионных синдромов верхней апертуры грудной клетки, боли в верхней части спины или боли в нижней части спины (где боль в спине происходит из-за системного, местного или первичного заболевания позвоночника (радикулопатия,тазовой боли, кардиальной боли в груди, не относящейся к кардиальной боли в груди, боли, связанной с повреждением спинного мозга (SCI), центральной постинсультной боли, невропатии при раке, боли при СПИД, боли при серповидно-клеточной анемии и гериатрической боли. 18. Применение по п.17, где указанная хроническая боль представляет собой невропатическую боль. 19. Применение по п.18, где указанная невропатическая боль выбрана из гиперпатии, гипералгезии,невропатии, диабетической невропатии, неврита, невралгии, гиперестезии, каузалгии и аллодинии.
МПК / Метки
МПК: A61P 25/32, A61P 25/24, A61P 25/04, A61P 25/28, C07D 211/20, A61P 25/22, A61K 31/451, A61P 25/34, A61P 25/36
Метки: ингибированием, 4-[2-(4-метилфенилсульфанил)фенил]пиперидина, объединенным, боли, повторного, формы, невропатической, лечения, поглощения, серотонина, кристаллические, норадреналина
Код ссылки
<a href="https://eas.patents.su/30-16054-kristallicheskie-formy-4-2-4-metilfenilsulfanilfenilpiperidina-s-obedinennym-ingibirovaniem-povtornogo-pogloshheniya-serotonina-i-noradrenalina-dlya-lecheniya-nevropaticheskojj-bol.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллические формы 4-[2-(4-метилфенилсульфанил)фенил]пиперидина с объединенным ингибированием повторного поглощения серотонина и норадреналина для лечения невропатической боли</a>
Предыдущий патент: Применение молекулы нуклеиновой кислоты, содержащей двухцепочечную область, для лечения пролиферативного нарушения
Следующий патент: Соединения, ингибирующие киназы, и фармацевтическая композиция на их основе
Случайный патент: Игровой автомат












