Кристаллические безводные формы лактата n-гидрокси-3-[4-[[[2-(2-метил-1h-индол-3-ил)этил]амино]метил]фенил]-2e-2-акриламида
Номер патента: 17984
Опубликовано: 30.04.2013
Авторы: Папоутсакис Димитрис, Штовассер Франк, Ацемоглы Мурат, Байва Джоджиндер С., Слейд Джоел, Карпински Пьотр
Формула / Реферат
1. Кристаллическая безводная форма (форма А) лактата N-гидрокси-3-[4-[[[2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида, где кристаллическая безводная форма выбрана из
DL-лактата, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из 9,9, 11,4, 13,8, 15,7, 18,2, 19,7, 20,3, 21,5, 25,3, 27,4 и 30,0 (градусов 2θ);
L-лактата, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из 9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6, 25,2 и 29,9 (градусов 2θ);
D-лактата, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из группы, включающей 9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6 и 25,2 (градусов 2θ).
2. Кристаллическая безводная форма DL-лактата по п.1, где в основном чистая кристаллическая форма характеризуется порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из 9,9, 11,4, 13,8, 15,7, 18,2, 19,7, 20,3, 21,5, 25,3, 27,4 и 30,0 (градусов 2θ).
3. Кристаллическая безводная форма L-лактата по п.1, где в основном чистая кристаллическая форма характеризуется порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из 9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6, 25,2 и 29,9 (градусов 2θ).
4. Кристаллическая безводная форма D-лактата по п.1, где в основном чистая кристаллическая форма характеризуется порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из 9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6 и 25,2 (градусов 2θ).
Текст
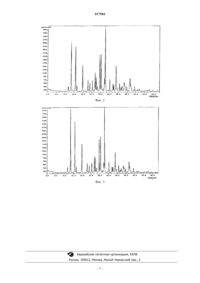
КРИСТАЛЛИЧЕСКИЕ БЕЗВОДНЫЕ ФОРМЫ ЛАКТАТА N-ГИДРОКСИ-3-[4-2-(2 МЕТИЛ-1H-ИНДОЛ-3-ИЛ)ЭТИЛ]АМИНО]МЕТИЛ]ФЕНИЛ]-2E-2-АКРИЛАМИДА Настоящее изобретение относится к кристаллическим безводным формам лактата N-гидрокси-3[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Область техники, к которой относится изобретение Настоящее изобретение относится к кристаллическим безводным формам лактата N-гидрокси-3-[42-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида. Уровень техники Полиморфизм означает существование более одной кристаллической структуры соединения. Эта способность химического соединения кристаллизоваться более чем в одной кристаллической модификации может оказывать значительное влияние на срок годности, растворимость, характеристики при составлении композиций и характеристики переработки лекарственного средства. Кроме того, полиморфизм молекулы лекарственного средства может влиять на действие лекарственного средства. Разные полиморфные формы могут обладать разными скоростями поступления в организм, что приводит к большей или меньшей биологической активности, чем необходимо. В предельных случаях нежелательная полиморфная форма даже может быть токсичной. Образование неизвестной полиморфной формы во время приготовления может приводить к нежелательным последствиям. Исследование и регулирование полиморфизма обеспечивает определенные преимущества при выведении новых лекарственных средств на рынок. Во-первых и в первую очередь, прогнозирование существования возможных полиморфных форм лекарственного средства можно использовать для сведения к минимуму возможности загрязнения лекарственного средства другими полиморфными формами во время изготовления или хранения. В некоторых случаях невозможность удаления примесей может привести к угрожающим для жизни последствиям. Кристаллизация непредусмотренной полиморфной формы во время изготовления может привести к тому, что потребуются недели или даже месяцы простоя технологической линии, пока исследователи обнаружат и устранят причину образования новой кристаллической формы или проведут дополнительный цикл исследований, чтобы получить разрешение для применения новой формы. Во-вторых, установление того, какие кристаллические структуры возможны, в ряде случаев позволяет исследователям добиться максимальных желательных характеристик соединения, таких как растворимость, характеристики при составлении композиций, характеристики переработки и срок годности. Изучение этих факторов на ранней стадии разработки нового лекарственного средства может привести к более активному, более стабильному или более дешевому в производстве лекарственному средству. Соединение которая описана в документе WO 02/22577. Этому соединению приписаны ценные фармакологические характеристики; в частности, его можно использовать, например, в качестве ингибитора гистондезацетилазы, который используется для лечения заболеваний, реагирующих на ингибирование активности гистондезацетилазы. Информация о возможных полиморфных формах N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида применима для разработки подходящей дозированной формы, поскольку невозможность использования одной полиморфной формы при клинических исследованиях и исследованиях стабильности может привести к тому, что использованные или исследованные дозированные формы окажутся разными при переходе от одной партии к другой. После выбора полиморфной формы важно, чтобы ее можно было получать воспроизводимым образом и чтобы в разработанной дозированной форме она в течение длительного времени оставалась неизмененной. Также желательно разработать способ полученияN-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-акриламида высокой чистоты, поскольку наличие примесей может привести к нежелательным токсикологическим эффектам. В документе WO 02/22577 отсутствует информация о всех возможных кристаллических модификациях N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида. Согласно изобретению неожиданно было установлено, что разные кристаллические модификации (новые полиморфные формыN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2 акриламида), охарактеризованные ниже, можно получить с использованием специально подобранных условий осуществления способа, например путем выбора системы растворителей, длительности кристаллизации и т.п. Краткое изложение сущности изобретения Настоящее изобретение относится к кристаллической безводной форме (форма А) лактата Nгидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, где кристаллическая безводная форма выбрана из:DL-лактата, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из 9,9, 11,4, 13,8, 15,7, 18,2, 19,7, 20,3, 21,5, 25,3, 27,4 и 30,0 (градусов 2);L-лактата, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из 9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6, 25,2 и 29,9 (градусов 2);D-лактата, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из группы, включающей 9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6 и 25,2 (градусов 2). Указанная кристаллическая безводная форма (форма А) лактата N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида может входить в состав фармацевтической композиции, также включающей по меньшей мере один фармацевтически приемлемый носитель, разбавитель, растворитель или инертный наполнитель. Указанная кристаллическая безводная форма (форма А) лактата N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида может быть использована для лечения заболевания, которое реагирует на ингибирование активности гистондезацетилазы, которое включает стадию введения субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества в основном чистой кристаллической безводной формы А лактата N-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]-метил]фенил]-2 Е-2-пропенамида, предлагаемой в настоящем изобретении. Краткое описание чертежей На фиг. 1 приведена порошковая рентгенограмма формы А DL-лактата N-гидрокси-3-[4-2-(2 метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида, предлагаемого в настоящем изобретении. На фиг. 2 и 3 приведены порошковые рентгенограммы безводных L-лактата и D-лактата соответственно N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предлагаемого в настоящем изобретении. Подробное описание изобретения Свободное основание N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е 2-акриламида можно получить в новых полиморфных формах А, В, С, HA и HB. Эти "кристаллические модификации" (или "полиморфные формы") различаются по порошковым рентгенограммам, физикохимическим и фармакокинетическим характеристикам и термодинамической стабильности. Настоящее изобретение относится к кристаллической безводной форме А лактата N-гидрокси-3-[4-2-(2-метил-1Hиндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, которая является очень стабильной, причем даже в отсутствие воды, а также имеет превосходный профиль растворения. Эти свойства безводного монолактата указанного соединения обеспечивают изобретательное решение целого комплекса проблем,касающихся стабильности лекарственного вещества, постоянства его состава и характеристик доставки. При использовании в настоящем изобретении термины "выделенный" и/или "в основном чистый" означают,что более 50% кристаллическогоN-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-акриламида или его соли находится в одной из форм, описанных в настоящем изобретении, и предпочтительно если содержится не менее 70%, более предпочтительно не менее 80% и наиболее предпочтительно не менее 90% одной из кристаллических форм, описанных в настоящем изобретении. Форма А DL-лактата (безводный DL-лактат) плавится и разлагается примерно при 183-186 С и является немного гигроскопичной и имеет потери при сушке (LOD), равные 0,2%, до 120 С. В воде и в большинстве органических растворителей форма А стабильнее других форм DL-лактата. При большинстве условий форма А не превращается в какую-либо другую форму, однако после установления равновесия при рН 1 и 2 образуется хлорид и при 0 и 10 С и в смеси ацетон/вода форма А обнаруживается вместе с формой HA. Ее порошковая рентгенограмма содержит не менее двух, более предпочтительно не менее четырех и наиболее предпочтительно все максимумы, выбранные из расположенных при 9,9, 11,4,13,8, 15,7, 18,2, 19,7, 20,3, 21,5, 25,3, 27,4 и 30,0 (градусов 2). Особенно предпочтительный вариант осуществления относится к в основном чистой полиморфной форме А DL-лактата N-гидрокси-3-[4-2-(2 метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида, представленной на фиг. 1. Особенно предпочтительный вариант осуществления относится к в основном чистой полиморфной безводной форме L-(+)-лактата N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]2 Е-2-акриламида. Порошковая рентгенограмма L-(+)-лактата N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-акриламида приведена на фиг. 2. Эта порошковая рентгенограмма содержит не менее двух, более предпочтительно не менее четырех и наиболее предпочтительно все максимумы, выбранные из расположенных при 9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6, 25,2 и 29,9 (градусов 2). И плавление, и разложение безводной формы L-(+)-лактата N-гидрокси-3-[4-2-(2-метил-1H-2 017984 индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида происходят примерно при 184,7 С. Другой особенно предпочтительный вариант осуществления относится в основном к чистой полиморфной безводной формеN-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-акриламида. Порошковая рентгенограмма D-(-)-лактата N-гидрокси-3[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида приведена на фиг. 3. Эта порошковая рентгенограмма содержит не менее двух, более предпочтительно не менее четырех и наиболее предпочтительно все максимумы, выбранные из расположенных при 9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2,21,6, и 25,2 (градусов 2). И плавление, и разложение безводной формы D-(-)-лактата N-гидрокси-3-[42-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида происходят примерно при 184,1 С. Различные методики можно использовать для получения полиморфных форм каждой указанной выше соли N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида. Такими методиками являются представленные выше и представленные в приведенных ниже примерах. Также предполагается фармацевтическая композиция, включающая:(а) терапевтически эффективное количество в основном чистой кристаллической безводной формы А лактата N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида,предлагаемой в одном из предыдущих вариантов осуществления настоящего изобретения и(b) по меньшей мере один фармацевтически приемлемый носитель, разбавитель, растворитель или инертный наполнитель. Предпочтительно, если более 50%, более предпочтительно не менее 70%, еще более предпочтительно не менее 80% и наиболее предпочтительно не менее 90% кристаллической формы, содержащейся в композиции, представляет собой одну из форм, предлагаемых в настоящем изобретении."Терапевтически эффективное количество" означает количество полиморфной формы, предлагаемой в настоящем изобретении, которое при введении нуждающемуся в нем субъекту достаточно для лечения патологических состояний, протекание которых облегчается путем ингибирования активности гистондезацетилазы. Количество конкретного соединения, предлагаемого в настоящем изобретении, которое будет терапевтически эффективным, меняется в зависимости от таких факторов, как патологическое состояние и его тяжесть, индивидуальность нуждающегося в нем субъекта и т.п., и это количество без труда могут определить специалисты с общей подготовкой в данной области техники. По меньшей мере один фармацевтически приемлемый носитель, разбавитель, растворитель или инертный наполнитель может без труда определить специалист с общей подготовкой в данной области техники, и оно будет зависеть от выбранного пути введения. Иллюстративные примеры подходящих путей введения включают пероральное, назальное, парентеральное, местное, чрескожное и ректальное. Фармацевтические композиции могут находиться в любой фармацевтической форме, которую специалист в данной области техники считает подходящей. Подходящие фармацевтические формы включают твердые, полужидкие, жидкие и лиофилизированные препараты, такие как таблетки, порошки, капсулы,суппозитории, суспензии, липосомы и аэрозоли. Также предполагается способ лечения заболевания, которое реагирует на ингибирование активности гистондезацетилазы, включающий стадию введения субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества в основном чистой кристаллической безводной формы А лактатаN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида, предлагаемой в одном из предыдущих вариантов осуществления настоящего изобретения. Предпочтительно, если более 50%, более предпочтительно не менее 70%, еще более предпочтительно не менее 80% и наиболее предпочтительно не менее 90% вводимой кристаллической формы представляет собой одну из форм,предлагаемых в настоящем изобретении. Как отмечено выше, иллюстративные примеры путей введения включают пероральное, назальное, парентеральное, местное, чрескожное и ректальное. Введение кристаллической формы можно выполнять путем введения фармацевтической композиции или путем введения других эффективных средств. Ниже с помощью примеров будут описаны предпочтительные варианты осуществления настоящего изобретения. Следует понимать, что эти примеры приведены только для иллюстрации настоящего изобретения и их не следует рассматривать в качестве каким-либо образом ограничивающих объем настоящего изобретения. В приведенных ниже примерах при указании степени кристалличности "превосходная" указывает на материал, обладающий основными пиками на порошковой рентгенограмме (XRPD), которые являются узкими и обладают интенсивностями, превышающими примерно 70 импульсов; "хорошая" указывает на материал, обладающий основными пиками на XRPD, которые являются узкими и обладают интенсивностями в диапазоне 30-70 импульсов; и "плохая" указывает на материал, обладающий основными пиками на XRPD, которые являются широкими и обладают интенсивностями менее 30 импульсов. Кроме того, LOD означает потерю массы, определенную при температуре между температурой окружающей среды и температурой разложения. Последняя примерно означает точку начала роста на зависимости первой производной от температуры на термогравиметрической кривой. Это не является точным началом разложения, поскольку потеря массы для разных солей происходит с разной скоростью. Поэтому реальная температура разложения может быть ниже указанной. Образование соли, стехиометрический состав и наличие или отсутствие растворителей подтверждается с помощью химических сдвигов 1 Н-ЯМР (ядерный магнитный резонанс) для соответствующих солеобразующих реагентов и растворителей, использованных в реакции (в таблицах приведен только один характеристический химический сдвиг для солеобразующих реагентов или растворителей). По данным ЯМР невозможно определить содержание воды,поскольку пики воды являются широкими. Степень протонирования свободного основания оценивают по изменению химического сдвига бензильных (Hbz) протонов. Кроме того, соли, предлагаемые в настоящем изобретении, осаждаются в виде сыпучих порошков (СПП), клейких аморфных веществ (КАВ)(которые обладают смолообразной консистенцией и склонны к агломерации с образованием единой сферической массы или прилипают к стенкам емкости, в которой проводят реакцию) или аморфных гелей(АГ). Кроме того, "-" указывает, что измерения не проводились. Пример 1. Получение безводного DL-лактата.DL-молочную кислоту (4,0 г, 85% раствор в воде, что соответствует 3,4 г чистой DL-молочной кислоты) разбавляли водой (27,2 г) и раствор нагревали при 90 С (внутренняя температура) в течение 15 ч. Раствор охлаждали до комнатной температуры и использовали в качестве раствора молочной кислоты на следующей стадии получения соли. Свободное основание N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е 2-акриламида формы HA (10,0 г) помещали в четырехгорлую колбу для проведения реакции с механической мешалкой. Прибавляли деминерализованную воду (110,5 г) и суспензию нагревали при 65 С (внутренняя температура) в течение 30 мин. К этой суспензии в течение 30 мин при 65 С прибавляли растворDL-молочной кислоты. Во время прибавления раствора лактата суспензия превращалась в раствор. Капельную воронку промывали деминерализованной водой (9,1 г) и раствор перемешивали при 65 С еще в течение 30 мин. Раствор охлаждали до 45 С (внутренняя температура) и при этой температуре прибавляли затравочные кристаллы (10 мг моногидрата DL-лактата N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-акриламида). Суспензию охлаждали до 33 С и перемешивали при этой температуре в течение еще 20 ч. Суспензию еще раз нагревали до 65 С, перемешивали в течение 1 ч при этой температуре и охлаждали до 33 С в течение 1 ч. После дополнительного перемешивания при 33 С в течение 3 ч продукт отделяли фильтрованием и отфильтрованный осадок промывали деминерализованной водой (220 г). Влажный отфильтрованный осадок сушили в вакууме при 50 С и получали безводныйN-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2 акриламида в виде кристаллического продукта. По данным ВЭЖХ и 1 Н-ЯМР продукт соответствовал моногидрату соли (форма HA), однако в спектрах 1 Н-ЯМР наблюдались широкие сигналы воды. XRPD указывала на присутствие безводной формы. Дополнительные эксперименты по получению соли проводили по методике, описанной выше, раствор продукта фильтровали при 65 С, а затем охлаждали до 45 С, вносили затравку и кристаллизовали. Во всех случаях в качестве продукта получали форму А (безводная форма). Пример 2. Получение безводного DL-лактата.DL-молочную кислоту (2,0 г, 85% раствор в воде, что соответствует 1,7 г чистой DL-молочной кислоты) разбавляли водой (13,6 г) и раствор нагревали при 90 С (внутренняя температура) в течение 15 ч. Раствор охлаждали до комнатной температуры и использовали в качестве раствора молочной кислоты на последующей стадии получения соли. Свободное основание N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е 2-акриламида формы Hg (5,0 г) помещали в четырехгорлую реакционную колбу с магнитной мешалкой. Прибавляли деминерализованную воду (54,85 г) и суспензия нагревали до 48 С (внутренняя температура) в течение 30 мин. К этой суспензии в течение 30 мин при 48 С прибавляли раствор DL-молочной кислоты. Прибавляли затравочные кристаллы (в виде суспензии 5 мг DL-лактата N-гидрокси-3-[4-2-(2 метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида, безводная форма А, в 0,25 г воды) и перемешивание продолжали в течение еще 2 ч при 48 С. Температуру повышали до 65 С (внутренняя температура) в течение 30 мин и суспензию перемешивали в течение еще 2,5 ч при этой температуре. Затем температуру понижали до 48 С в течение 2 ч и продолжали перемешивание при этой температуре в течение еще 22 ч. Продукт отделяли фильтрованием и отфильтрованный осадок промывали деминерализованной водой (210 г). Влажный отфильтрованный осадок сушили в вакууме при 50 С и получали безводный DL-лактатN-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида (форма А) в виде кристаллического продукта. Плавление и разложение происходили одновременно при 183,3 С. Пример 3. Превращение моногидрата DL-лактата в безводный DL-лактат.DL-молочную кислоту (0,59 г, 85% раствор в воде, что соответствует 0,5 г чистой DL-молочной кислоты) разбавляли водой (4,1 г) и раствор нагревали при 90 С (внутренняя температура) в течение 15 ч. Раствор охлаждали до комнатной температуры и использовали в качестве раствора молочной кислоты на последующей стадии получения соли. 10 г моногидрата DL-лактата N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида формы Hg помещали в четырехгорлую реакционную колбу. Прибавляли воду(110,9 г), затем прибавляли раствор молочной кислоты. Капельную воронку, через которую прибавляли молочную кислоту, промывали водой (15,65 г). Суспензию нагревали до 82 С (внутренняя температура) и получали раствор. Раствор перемешивали в течение 15 мин при 82 С и в горячем виде фильтровали в другую колбу для проведения реакции и получали прозрачный раствор. Температуру понижали до 50 С и прибавляли затравочные кристаллы (в виде суспензии 10 мг DL-лактата N-гидрокси-3-[4-2-(2-метил 1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида, безводная форма, в 0,5 г воды). Температуру понижали до 33 С и перемешивание продолжали в течение еще 19 ч при этой температуре. Полученную суспензию повторно нагревали при 65 С (внутренняя температура) в течение 45 мин, перемешивали при 65 С в течение 1 ч и охлаждали до 33 С в течение 1 ч. После перемешивания при 33 С в течение еще 3 ч продукт отделяли фильтрованием и влажный отфильтрованный осадок промывали водой (50 г). Продукт сушили в вакууме при 50 С и получали кристаллический безводный DL-лактат N-гидрокси-3-[4-2-(2 метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида (форма А). Пример 4. Получение безводного DL-лактата.DL-молочную кислоту (8,0 г, 85% раствор в воде, что соответствует 6,8 г чистой DL-молочной кислоты) разбавляли водой (54,4 г) и раствор нагревали при 90 С (внутренняя температура) в течение 15 ч. Раствор охлаждали до комнатной температуры и использовали в качестве раствора молочной кислоты на последующей стадии получения соли. Свободное основание N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е 2-акриламида формы Hg (20 г) помещали в стеклянный реактор объемом 1 л и прибавляли смесь этанол/вода (209,4 г смеси 1:1 мас./мас). Светло-желтую суспензию нагревали при 60 С (внутренняя температура) в течение 30 мин и в течение 30 мин при этой температуре прибавляли раствор молочной кислоты. Капельную воронку промывали водой (10 г). Раствор охлаждали до 38 С в течение 2 ч и при 38 С прибавляли затравочные кристаллы (20 мг DL-лактата N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-акриламида, безводная форма). После перемешивания при 38 С в течение еще 2 ч смесь охлаждали до 25 С в течение 6 ч. Охлаждение продолжали от 25 до 10 С в течение 5 ч, от 10 до 5 С в течение 4 ч и от 5 до 2 С в течение 1 ч. Суспензию перемешивали в течение еще 2 ч при 2 С и продукт отделяли фильтрованием. Влажный отфильтрованный осадок промывали водой(230 г) и продукт сушили в вакууме при 45 С и получали кристаллический безводный DL-лактат Nгидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида (форма А). Пример 5. Получение моногидрата DL-лактата. 3,67 г (10 ммоль) свободного основания (N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-акриламида) формы Hg и 75 мл ацетона помещали в трехгорлую колбу объемом 250 мл с магнитной мешалкой и капельной воронкой. К суспензии при перемешивании по каплям прибавляли 10 мл 1 М молочной кислоты в воде (10 ммоль) в 20 мл ацетона и получали прозрачный раствор. Перемешивание продолжали при температуре окружающей среды и примерно через 1 ч белое твердое вещество выпадало в осадок. Смесь охлаждали в бане со льдом и перемешивали в течение еще 1 ч. Белое твердое вещество собирали фильтрованием и один раз промывали холодным ацетоном(15 мл). Затем вещество сушили в вакууме и получали 3,94 г моногидрата DL-лактата N-гидрокси-3-[42-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-акриламида (86,2%). Пример 6. Получение безводного L-(+)-лактата. Свободное основание N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е 2-акриламида (20,0 г) обрабатывали L-(+)-молочной кислотой (6,8 г) по методике, описанной в примере 5,и получали кристаллическийN-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-акриламида, безводную форму. Плавление и разложение происходили одновременно при 184,7 С. XRPD приведена на фиг. 2 (2=9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6, 25,2,29,9). Пример 7. Получение безводного D-(-)-лактата. Свободное основание N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е 2-акриламида (20,0 г) обрабатывали D-(-)-молочной кислотой (6,8 г) по методике, описанной в примере 5,и получали кристаллическийN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-акриламида, безводную форму. Плавление и разложение происходили одновременно при 184,1 С. XRPD приведена на фиг. 3 (2=9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6,25,2). Хотя настоящее изобретение описано выше с помощью предпочтительных вариантов осуществления, понятно, что без отклонения от основных положений, раскрытых в настоящем изобретении, в него можно внести многочисленные изменения и модификации. В соответствии с этим предполагается, что все такие изменения и модификации входят в сущность и в широком смысле в объем прилагаемой формулы изобретения. Все заявки на патенты, патенты и другие публикации, цитированные в настоящем изобретении, во всей своей полноте включены в настоящее изобретение в качестве ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая безводная форма (форма А) лактата N-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, где кристаллическая безводная форма выбрана изDL-лактата, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из 9,9, 11,4, 13,8, 15,7, 18,2, 19,7, 20,3, 21,5, 25,3, 27,4 и 30,0 (градусов 2);L-лактата, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из 9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6, 25,2 и 29,9 (градусов 2);D-лактата, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из группы, включающей 9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6 и 25,2 (градусов 2). 2. Кристаллическая безводная форма DL-лактата по п.1, где в основном чистая кристаллическая форма характеризуется порошковой рентгенограммой, содержащей по меньшей мере два максимума,выбранных из 9,9, 11,4, 13,8, 15,7, 18,2, 19,7, 20,3, 21,5, 25,3, 27,4 и 30,0 (градусов 2). 3. Кристаллическая безводная форма L-лактата по п.1, где в основном чистая кристаллическая форма характеризуется порошковой рентгенограммой, содержащей по меньшей мере два максимума, выбранных из 9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6, 25,2 и 29,9 (градусов 2). 4. Кристаллическая безводная форма D-лактата по п.1, где в основном чистая кристаллическая форма характеризуется порошковой рентгенограммой, содержащей по меньшей мере два максимума,выбранных из 9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6 и 25,2 (градусов 2).
МПК / Метки
МПК: A61K 31/404, C07D 209/00, A61P 35/00
Метки: лактата, n-гидрокси-3-[4-[[[2-(2-метил-1h-индол-3-ил)этил]амино]метил]фенил]-2e-2-акриламида, кристаллические, формы, безводные
Код ссылки
<a href="https://eas.patents.su/8-17984-kristallicheskie-bezvodnye-formy-laktata-n-gidroksi-3-4-2-2-metil-1h-indol-3-iletilaminometilfenil-2e-2-akrilamida.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллические безводные формы лактата n-гидрокси-3-[4-[[[2-(2-метил-1h-индол-3-ил)этил]амино]метил]фенил]-2e-2-акриламида</a>
Предыдущий патент: Дейтерированные производные катехоламина и лекарственные средства, содержащие указанные соединения
Следующий патент: Способы определения устойчивости рака к ингибиторам гистондеацетилазы
Случайный патент: Способ испытания на баропрочность резьбового компонента