Производные азетидина и их применение
Номер патента: 17842
Опубликовано: 29.03.2013
Авторы: Грэм Кристофер, Браф Пол, Парсонс Рэйчел, Рафли Стивен, Масиас Альба, Харт Терренс, Уоллс Стивен
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
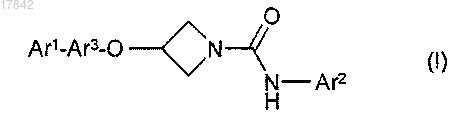
где Ar1 представляет собой возможно замещенный фенил;
Ar2 представляет собой фенил, пиридил, пиримидинил, пиразинил, пиридазинил или оксадиазолил, каждый из которых является возможно замещенным; и
Ar3 представляет собой возможно замещенный бивалентный фенилен или пиридинильный радикал;
где любые возможные заместители в Ar1, Ar2 и Ar3 независимо выбраны из хлора, фтора, брома, циклопропила, метила, моно-, ди- или триметила, трифторметила, дифторметила, монофторметила, метокси, этокси, пропокси, бутокси, пентокси, 2-метоксиэтокси, 2-бензилоксиэтокси, 2-гидроксиэтокси, моно-, ди- или трифторметокси, циано, гидрокси, -CO2R1 и -SO2R1, где R1 представляет собой водород, метил или этил; тетразолил; -NR2R3, -CH2NR2R3 и -C(=O)NR2R3, где R2 и R3 независимо представляют собой водород, метил или этил.
2. Соединение по п.1, где Ar2 представляет собой 3-пиридил, пиримидин-4-ил, пиразин-2-ил или пиридазин-3-ил, каждый из которых является возможно замещенным.
3. Соединение по п.1 или 2, где Ar3 представляет собой замещенный бивалентный 1,4-фенилен или 2,5-пиридиниленовый радикал формулы
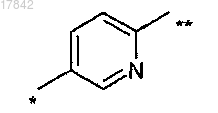
где связь, помеченная одной звездочкой, присоединена к Ar1 и связь, помеченная двойной звездочкой, присоединена к кислороду.
4. Соединение по п.1, где
Ar2 представляет собой 3-пиридил, пиримидин-4-ил, пиразин-2-ил или пиридазин-3-ил;
Ar3 представляет собой возможно замещенный бивалентный 1,4-фенилен или 2,5-пиридинильный радикал формулы
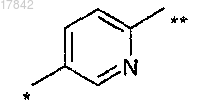
где связь, помеченная одной звездочкой, присоединена к Ar1 и связь, помеченная двойной звездочкой, присоединена к кислороду; и
Ar1 представляет собой возможно замещенный фенил.
5. Соединение по п.4, у которого Ar1 представляет собой фенил, 2-фторфенил, 3-(2-метоксиэтокси)фенил или 2-метокси-5-(2-метоксиэтокси)фенил.
6. Соединение по п.4 или 5, у которого Ar2 представляет собой пиридазин-3-ил.
7. Фармацевтическая композиция, включающая соединение по любому из пп.1-6, вместе с одним или более фармацевтически приемлемыми носителями и/или вспомогательными веществами.
8. Применение соединения по любому из пп.1-6 для изготовления лекарственного средства для лечения заболевания или состояния, выбранного из острой или хронической боли, головокружения, рвоты, тошноты, расстройства питания, неврологических и психических патологий, острых или хронических нейродегенеративных заболеваний, эпилепсии, нарушений сна, сердечно-сосудистых заболеваний, почечной ишемии, рака, нарушений иммунной системы, аллергических заболеваний, паразитических, вирусных или бактериальных инфекционных заболеваний, воспалительных заболеваний, остеопороза, заболеваний глаз, легочных заболеваний, заболеваний органов ЖКТ, глаукомы, связанной с повышенным внутриглазным давлением, и недержания мочи.
9. Применение по п.8, при котором заболеванием или состоянием является страх, депрессия, боль, воспаление, зуд, нарушение сна или расстройство движения.
Текст
Соединения формулы (I) являются ингибиторами гидролазы амида жирной кислоты (FAAH) и являются эффективными для лечения заболеваний или состояний, на которые ингибирование активности FAAH оказывает благоприятное воздействие, таких как страх, депрессия, боль,воспаление, нарушения питания, сна, нейродегенеративные нарушения и расстройства движения где Ar1 представляет собой замещенный фенил, Ar2 представляет собой фенил, пиридил,пиримидинил, пиразинил, пиридазинил или оксадиазолил, каждый из которых является возможно заменимым; и Ar3 представляет собой возможно замещенный бивалентный фенилен или пиридинильный радикал. Данное изобретение относится к классу производных азетидина, которые являются ингибиторами гидролазы амида жирных кислот (FAAH) и являются эффективными при лечении заболеваний или состояний, на которые ингибирование активности FAAH оказывает благоприятное воздействие, таких как страх, депрессия, боль, воспаление, а также нарушения питания и сна, нейродегенеративные заболевания и расстройства движений. Предпосылки создания изобретения Эндогенные агонисты каннабиноидных СВ 1- и СВ 2-рецепторов включают амид жирных кислот анандамид (AEA). AEA гидролизуется с образованием арахидоновой кислоты посредством мембраносвязанной гидролазы амида жирных кислот (FAAH). Фермент FAAH был охарактеризован в 1996 г. Cravatt и др. (Cravatt, Nature 1996, 384, 83). В дальнейшем было установлено, что фермент FAAH, кроме того,отвечает за катаболизм большого числа важных амидов жирных кислот сигнальных липидов, включающих другой важный эндогенный каннабиноид, 2-арахидоноилглицерин (2-AG) (Science 1992, 258, 19461949); индуцирующее сон вещество олеамид (Science 1995, 268, 1606); подавляющее аппетит средство Nолеоилэтаноламин (OEA) (Rodriguez de Fonesca, Nature 2001, 414, 209) и противовоспалительный агент палмитоилэтаноламид (PEA) (Lambert, Curr. Med. Chem. 2002, 9(6), 663). Ингибиторы FAAH являются востребованными, поскольку такие ингибиторы повышают концентрации эндогенных сигнальных липидов и, следовательно, вызывают соответствующие благоприятные фармакологические эффекты. Имеются некоторые данные о действиях разных ингибиторов FAAH в доклинических моделях. Такие действия включают аналгезирующие свойства (см. WO 02/087569, WO 04/033652); страх (Kathuria, Nat. Med. 2003, 9(1), 76); спастичность (Baker, FASEB J. 2001, 15(2), 300). Результаты исследования действий некоторых экзогенных каннабиноидов предполагают, что ингибитор FAAH может быть полезным при лечении разных состояний, заболеваний, нарушений или симптомов. Такие состояния включают боль, тошноту/рвоту, анорексию, спастичность, расстройства движений, эпилепсию и глаукому. В настоящее время одобренное применение каннабиноидов в терапии включает их применение для облегчения тошноты, вызванной химиотерапией, а также рвоты у больных раком пациентов, улучшение аппетита у пациентов с ВИЧ/СПИДом, которые страдают анорексией в результате синдрома истощения. Помимо одобренных показаний к применению, областью терапии, в которой большое внимание уделяется применению каннабиноида, является аналгезия, т.е. лечение боли. Пять небольших рандомизированных контролируемых испытаний показали, что тетрагидроканнабинол ТНС превосходит плацебо, вызывая дозозависимую аналгезию (Robson, Br. J. Psychiatry 2001, 178, 107-115). Ряд индивидов со множественным склерозом заявили о благоприятном действии каннабиса на боль,связанную с заболеванием, и на спастичность, что подтверждалось небольшими контролируемыми испытаниями (Svendsen, Br. Med. J. 2004, 329, 253). Также разные пострадавшие от травм спинного мозга,таких как параплегия, сообщали, что приступы боли смягчались после курения марихуаны. В отчете,демонстрирующем способность каннабиноидов контролировать спастичность и дрожание в модели множественного склероза, хронического рецидивирующего экспериментального аутоиммунного энцефаломиелита CREAE, было доказано, что такие эффекты вызваны СВ 1- и СВ 2-рецепторами (Baker, Nature 2000, 404, 84-87). Фазу 3 клинических испытаний проводили на пациентах со множественным склерозом и повреждением спинного мозга с использованием смеси с небольшим соотношением компонентов смеси тетрагидроканнабинол/каннабидиол (THC/CBD). Каннабиноиды вызывают дозозависимое понижение внутриглазного давления (IOP) и, следовательно, могут смягчать симптомы глаукомы. Офтальмологи предписывают каннабис для пациентов с глаукомой, у которых другие лекарства не могут в достаточной мере контролировать внутриглазное давление (Robson, 2001 supra). Дополнительно к действиям ингибитора FAAH на AEA и другие эндоканнабиноиды, ингибиторыFAAH катаболизма других липидных медиаторов могут применяться при лечении других терапевтических симптомов. Например, PEA продемонстрировал биологические эффекты на животных моделях воспаления, иммунодепрессии, аналгезии и нейрозащиты (Ueda, J. Biol. Chem. 2001, 276(38), 35552). Олеамид, другой субстрат FAAH, индуцирует сон (Boger, Proc. Natl. Acad. Sci. USA 2000, 97(10), 5044; Mendelson, Neuropsychopharmacology 2001, 25, S36). Ингибиторы FAAH считаются потенциально полезными при лечении болезни Альцгеймера, шизофрении, депрессии, алкоголизма, наркотической зависимости, суицида, болезни Паркинсона, болезни Гентингтона, инсульта, рвоты, выкидышей, имплантации эмбриона, эндотоксинового шока, цирроза печени, атеросклероза, рака, травмы головы, глаукомы и синдрома имплантации костного цемента. Другие заболевания или состояния, на которые ингибирование активности FAAH потенциально может оказывать благоприятное воздействие, включают, например, множественный склероз, ретинит,боковой амиотрофический склероз, энцефалит, вызванный вирусом иммунодефицита, синдром гиперактивности с дефицитом внимания, боль, ноцицептивную боль, невропатическую боль, невоспалительную боль, болезненный геморрагический цистит, ожирение, гиперлипидемию, нарушения обмена веществ,питание и лечебное голодание, изменение аппетита, стресс, память, старение, гипертинию, септический шок, кардиогенный шок, флегмону и моторику кишечника, синдром раздраженного кишечника, колит,-1 017842 диарею, илеит, ишемию, ишемию головного мозга, ишемию печени, инфаркт миокарда, церебральную эксайтотоксичность, приступы, приступы лихорадки, нейротоксичность, невропатию, сон, индуцирование сна, продление сна, асомнию и воспалительные заболевания. Неврологические и психические заболевания или состояния, на которые ингибирование активностиFAAH потенциально может оказывать благоприятное воздействие, включают, например, боль, депрессию, страх, глаукому, тошноту, рвоту, потерю аппетита, нарушения сна, респираторные нарушения, аллергии, травматическое повреждение мозга, инсульт, генерализованное тревожное расстройство (GAD),синдром навязчивых состояний, шизофрению, психоз, болезнь Паркинсона, мышечную спастичность,эпилепсию, дискинезию, пароксизм, нарушение суточного ритма организма и асомнию. Другие заболевания или состояния, на которые ингибирование активности FAAH потенциально может оказывать благоприятное действие, включают, например, разные метаболические синдромы, заболевания, нарушения и/или состояния, включающие, но не ограничивающиеся этим, синдром инсулинорезистентности, диабет, гиперлипидемию, жировую дистрофию печени, ожирение, атеросклероз и артериосклероз. Ингибиторы FAAH являются потенциально полезными при лечении разных болевых синдромов,заболеваний, нарушений и/или состояний, включающих, но не ограничивающихся такими, которые характеризуются невоспалительной болью, воспалительной болью, периферической невропатической болью, центральной болью, диафферентационной болью, хронической ноцицептивной болью, раздражением ноцицептивных рецепторов, фантомной и проходящей острой болью. Ингибирование активности FAAH потенциально также может применяться при лечении разных состояний при наличии воспаления. Эти состояния включают, но не ограничиваются этим, артрит (такой как ревматоидный артрит, тендинит плечевого сустава или бурсит, подагрический артрит и полимиалгия ревматическая), органоспецифические воспалительные заболевания (такие как тиреоидит, гепатит, воспалительные заболевания кишечника), астму, другие аутоиммунные заболевания (такие как множественный склероз), хроническое обструктивное заболевание легких (COPD) и сердечно-сосудистые заболевания. Ингибиторы FAAH являются потенциально полезными для предупреждения нейродегенерации или для обеспечения нейрозащиты. Кроме того, отмечалось, что когда активность фермента FAAH снижена или отсутствует, один из его субстратов, анандамид, действует как субстрат для СОХ-2 (циклооксигеназы-2), превращающий анандамид в простамиды (Weber et al. J. Lipid. Res. 2004; 45:757). Концентрации некоторых простамидов могут быть повышены в присутствии ингибитора FAAH. Некоторые простамиды связаны с пониженным внутриглазным давлением и гипотензией глаза. Таким образом, ингибиторы FAAH могут быть полезными для лечения глаукомы. Сущность изобретения Данное изобретение обеспечивает класс производных азетидина, обладающих FAAH ингибирующей активностью, полная характеристика и описание которых представлены далее. Соединения изобретения являются эффективными для лечения заболеваний или состояний, на которые ингибирование активности FAAH оказывает благоприятное воздействие. Такие заболевания или состояния описаны выше. В частности, соединения изобретения могут использоваться при лечении страха, депрессии, боли, воспаления, нарушения сна или расстройствах движений. Подробное описание изобретения В одном аспекте настоящее изобретение обеспечивает соединение формулы (I) или его фармацевтически приемлемую соль где Ar1 представляет собой факультативно замещенный фенил или факультативно замещенный моноциклический гетероарил, содержащий 5 или 6 атомов в кольце;Ar2 представляет собой факультативно замещенный фенил, факультативно замещенный моноциклический гетероарил, содержащий 5 или 6 атомов, или факультативно замещенный конденсированный бициклический гетероарил, содержащий 5 или 6 кольцевых атомов в каждом конденсированном кольце; иAr3 представляет собой бивалентный радикал, выбранный из группы, состоящей из факультативно замещенного фениленового и факультативно замещенного моноциклического гетероариленового радикалов, содержащих 5 или 6 атомов в кольце. В других аспектах изобретение обеспечивает:(a) фармацевтическую композицию, включающую представленное выше соединение формулы (I) или его фармацевтически приемлемую соль вместе с одним или более фармацевтически приемлемыми носителями и/или вспомогательными веществами,(b) применение представленного выше соединения формулы (I) или его фармацевтически приемле-2 017842 мой соли для лечения заболевания или состояния, на которое ингибирование активности FAAH оказывает благоприятное воздействие;(c) способ лечения заболевания или состояния, на которое ингибирование активности FAAH оказывает благоприятное воздействие, включающий введение пациенту, страдающему таким заболеванием или состоянием, эффективного количества представленного выше соединения формулы (I) или его фармацевтически приемлемой соли. Заболевания или состояния, на которые ингибирование активности FAAH оказывает благоприятное воздействие, включают упомянутые выше и, в частности, включают страх, депрессию, боль (особенно ноцицептическую, нейропатическую, висцеральную, послеоперационную боль, а также боль, вызванную раком), зуд, воспаление, нарушения сна и расстройства движений. Терминология Использующийся здесь термин "(Ca-Cb)алкил", где a и b являются целыми числами, относится к алкильному радикалу с прямой или разветвленной цепью, содержащему от a до b атомов углерода. Таким образом, например, при а, равном 1, и b, равном 6, термин включает метил, этил, n-пропил, изопропил, nбутил, изобутил, сек-бутил, t-бутил, n-пентил и n-гексил. Использующийся здесь термин "(Ca-Cb)фторалкил", где a и b являются целыми числами, относится к алкильному радикалу с прямой или разветвленной цепью, содержащему от a до b атомов углерода, в котором один или более атомов водорода заменены атомами фтора. Моно-, ди- и трифторметил охвачены данным термином. Использующийся здесь неуточненный термин "гетероарил" относится к моноциклическому или конденсированному бициклическому ароматическому радикалу, содержащему один или более гетероатомов, выбранных из S, N и O. Моноциклический гетероарильный радикал, в частности, может содержать 5 или 6 атомов в кольце. В конденсированном бициклическом гетероарильном радикале каждое конденсированное кольцо содержит 5 или 6 кольцевых атомов. Примерами гетероарильных радикалов являются тиенил, бензтиенил, фурил, бензфурил, пирролил, имидазолил, бензимидазолил, тиазолил, бензтиазолил, изотиазолил, бензизотиазолил, пиразолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, изотиазолил, триазолил, бензтриазолил, тиадиазолил, оксадиазолил, пиридинил, пиридазинил,пиримидинил, пиразинил, триазинил, индолил и индазолил."Бивалентный фениленовый радикал" представляет собой бензольное кольцо с двумя ненасыщенными валентностями и включает 1,3-фенилен и 1,4-фенилен."Бивалентный гетероариленовый радикал" представляет собой гетероарильное кольцо, в котором два атома углерода кольца имеют ненасыщенные валентности. Например, моноциклические дивалентные гетероариленовые радикалы, содержащие шесть атомов в кольце, включают следующие далее пиридиниленовый, пиримидиниленовый и пиразиниленовый радикалы Моноциклические дивалентные гетероариленовые радикалы, содержащие пять атомов в кольце,включают радикалы следующей формулы:Y представляет собой =C- или =NH-. Если иное не указано в контексте, в котором он встречается, термин "замещенный" применительно к любой фенильной или гетероарильной группе означает замещенный по меньшей мере одним заместителем, выбранным, например, из (С 1-С 6)алкила, (С 1-С 6)фторалкила, (C1-C6)алкокси (включая метилендиокси и этилендиокси замещение на смежные атомы углерода ароматического кольца), (C1-C6)фторалкокси, (С 1-С 6)алкокси-(С 1-С 6)алкила, бензилокси-(С 1-С 6)алкила, (C1-C6)алкокси-(С 1-С 6)алкокси, бензилокси-(С 1-С 6)алкокси, гидрокси, гидрокси(С 1-С 6)алкила, гидрокси(C1-C6)алкокси, меркапто, меркапто(C1C6)алкила, (C1-C6)алкилтио, циклопропила, гало (включая фтор и хлор), нитро, нитрила (циано), -COOH,тетразолила, -COORA, -CORA, SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB,-NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA,-NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или-NRACONRARB, где RA и RB независимо представляют собой (C1-C6)алкильную группу, или RA и RB при присоединении к одному и тому же атому азота могут образовывать вместе с атомом азота циклическую аминогруппу, такую как морфолинильную, пиперидинильную или пиперазинильную группу. "Факультативный заместитель" может быть одним из групп заместителей, описанных выше. Использующийся здесь термин "соль" включает соли присоединения основания, соли присоединения кислоты и четвертичные соли. Соединения изобретения, которые являются кислыми, могут образовывать соли, включающие фармацевтически или ветеринарно приемлемые соли, с основаниями, такими как гидроксиды щелочных металлов, например гидроксиды натрия и калия; гидроксиды щелочноземельных металлов, например гидроксиды кальция, бария и магния; с органическими основаниями, например N-этилпиперидин, дибензиламин и т.п. Такие соединения (I), которые являются основными, могут образовывать соли, включающие фармацевтически или ветеринарно приемлемые соли, с неорганическими кислотами, например с галогенводородными кислотами, такими как соляная или бромистоводородная кислота, серная кислота, азотная кислота или фосфорная кислота и т.п., а также с органическими кислотами, например с уксусной, винной, янтарной, фумаровой, малеиновой, яблочной, салициловой, лимонной, метансульфоновой и p-толуолсульфоновой кислотами и т.п. Любая не уточненная ссылка на соединение, подпадающее под формулу (I), должна рассматриваться как ссылка на это соединение,независимо от того, находится оно в форме соли или нет. Обзор пригодных солей представлен в Handbook of Pharmaceutical Salts: Properties, Selection and Useby Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Предполагается, что наряду со многими органическими соединениями, применяющимися в медицине, по меньшей мере, некоторые из соединений изобретения могут быть получены в виде кристаллогидратов и кристаллосольватов. Такие гидраты и сольваты, как известно, являются лишь специфическими физико-химическими формами активных соединений изобретения и, следовательно, составляют часть изобретения. Любая не уточненная здесь ссылка на соединение, подпадающее под формулу (I), должна рассматриваться как ссылка на это соединение, независимо от того, находится оно в форме гидрата или сольвата или нет. Термин "сольват" используется здесь для описания молекулярного комплекса, включающего соединение изобретения и стехиометрическое количество одной или более фармацевтически приемлемых молекул растворителя, например этанола. Термин "гидрат" используется в том случае, если указанным растворителем является вода. Структурные особенности В соединениях изобретенияAr1 может являться факультативно замещенным фенилом или быть выбранным из группы моноциклических гетероарильных групп, состоящих, например, из пиридила, тиенила, фурила, пирролила,имидазолила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиразолила, триазолила, оксадиазолила, тиадиазолила, пиридазинила, пиримидинила, пиразинила, тетразолила и триазинила, любой из которых является факультативно замещенным. В особых случаях Ar1 представляет собой фенил, 2-, 4- или 5 оксазолил, 2-, 4- или 5-тиазолил, [1,3,4]тиадиазол-2-ил, [1,3,4]оксадиазол-2-ил, [1,2,3]оксадиазол-4-ил, 1-,4-пиразолил или [1,2,4]триазол-3-ил, любой из которых является факультативно замещенным. В отдельных случаях Ar1 может являться, например, фенилом, 2-фторфенилом, 3-(2-метоксиэтокси)фенилом или 2-метокси-5-(2-метоксиэтокси)фенилом.Ar2 может являться факультативно замещенным фенилом или может быть выбран из группы моноциклических гетероарильных групп, состоящих, например, из пиридила, тиенила, фурила, пирролила,имидазолила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиразолила, триазолила, оксадиазолила, тиадиазолила, пиридазинила, пиримидинила, пиразинила и триазинила, любой из которых является факультативно замещенным; или может быть выбран из группы конденсированных бициклических гетероарильных групп, состоящих, например, из бензтиенила, бензфурила, бензимидазолила, бензтиазолила,бензизотиазолила, пиразолила, бензоксазолила, бензизоксазолила, бензтриазолила, индолила и индазолила, любой из которых является факультативно замещенным. В определенных случаях, Ar2 представляет собой фенил, 2-, 3- или 4-пиридил, 2-, 4- или 5-пиримидинил, пиразин-2-ил, пиридазин-3-ил, 2 тиазолил, 2-оксазолил, бенз[d]изоксазол-3-ил, индазол-3-ил, 5-оксадиазолил или 5-тиадиазолил, любой из которых является факультативно замещенным. Предпочтительные Ar2 группы включают фенил, пиридил, пиримидинил, пиразинил или пиридазинил, любой из которых является факультативно замещенным. Например, Ar2 может являться 3 пиридилом, пиримидин-4-илом, пиразин-2-илом или пиридазин-3-илом.Ar3 может представлять собой факультативно замещенный фениленовый радикал, такой как, например, 1,4-фениленовый радикал; или может быть выбран из группы, состоящей, например, из бивалентного пиридиниленового, тиениленового, фуриленового, пирролиленового, имидазолиленового, оксазолиленового, изоксазолиленового, тиазолиленового, изотиазолиленового, пиразолиленового, триазолиленового, пиридазиниленового, пиримидиниленового, пиразиниленового, триазиниленового, тиадиазолиленового радикалов, любой из которых является факультативно замещенным. Предпочтительные Ar3 радикалы включают фениленовый или пиридиниленовый радикал, такой как факультативно замещенный дивалентный 1,4-фениленовый или 2,5-пиридиниленовый радикал следую-4 017842 где связь, помеченная одной звездочкой, присоединена к Ar1, и связь, помеченная двойной звездочкой,присоединена к кислороду, показанному в формуле (I). Другие определенные примеры гетероариленовых Ar3 радикалов включают следующую группу дивалентных радикалов, любой из которых является факультативно замещенным: где связь, помеченная одной звездочкой, присоединена к Ar1, и связь, помеченная двойной звездочкой,присоединена к кислороду. Обычно не более двух факультативно замещенных заместителей на одно кольцо присутствует в Ar1,2Ar и Ar3. Любые факультативные заместители в Ar1, Ar2 и Ar3 могут быть независимо выбраны, например, из хлора, фтора, брома, циклопропила, метила, моно-, ди- или триметила, трифторметила, дифторметила, монофторметила, метокси, этокси, пропкси, бутокси, пентокси, 2-метоксиэтокси, 2-бензилоксиэтокси, 2-гидроксиэтокси, моно-, ди- или трифторметокси, циано, гидрокси, -CO2R или -SO2R1, где R1 представляет собой водород, метил или этил, тетразолил, -NR2R3, -CH2NR2R3 и -C(=O)NR2R3, где R2 и R3 независимо представляют собой водород, метил или этил. В некоторых соединениях изобретения радикал Ar1-Ar3 представляет собой 4-фенилфенил, например бифенил-4-иловый радикал. В других соединениях изобретения Ar2 представляет собой 2- или 3-фторфенил или 3-пиридил. В предпочтительном подклассе соединений изобретенияAr3 представляет собой факультативно замещенный бивалентный 1,4-фениленовый или 2,5 пиридиниленовый радикал следующей формулы:Ar1 является факультативно замещенным фенилом. В данном предпочтительном подклассе Ar1 может представлять собой, например, 2-фторфенил, 3(2-метоксиэтокси)фенил или 2-метокси-5-(2-метоксиэтокси)фенил, и предпочтительно, чтобы Ar2 являлся пиридазин-3-илом. Особые примеры соединений изобретения включают соединения, приведенные в представленных здесь примерах. Соединения изобретения, которые являются предпочтительными благодаря сочетанию хорошего внутреннего ингибирующего потенциала в отношении FAAH, а также высоких и пролонгированных плазменных концентраций после орального введения, подтвержденных тестами на лабораторных крысах,представляют собой пиридин-3-иламид 3-(бифенил-4-илокси)азетидин-1-карбоновой кислоты; пиридазин-3-иламид 3-[5-(2-фторфенил)пиридин-2-илокси]азетидин-1-карбоновой кислоты; пиридазин-3-иламид 3-5-[3-(2-метоксиэтокси)фенил]пиридин-2-илоксиазетидин-1-карбоновой кислоты; пиридазин-3-иламид 3-(5-фенилпиридин-2-илокси)азетидин-1-карбоновой кислоты; пиридазин-3-иламид 3-[5-(2-метоксифенил)пиридин-2-илокси]азетидин-1-карбоновой кислоты и их фармацевтически приемлемые соли. Синтез Существует множество стратегий синтеза соединений (I), имеющих отношение к настоящему изобретению, но все они основаны на общепризнанной химии, известной для специалиста в области синтетической органической химии. Таким образом, соединения формулы (I) можно синтезировать согласно методикам, описанным в стандартной литературе и хорошо известным опытным в данной области специалистам. Типичными источниками литературы являются "Advanced organic chemistry", 4th EditionHeterocyclic Chemistry", 2nd Edition (Pergamon), A.R. Katritzky), обзорные статьи, такие как размещенные в "Synthesis", "Acc. Chem. Res", "Chem. Rev" или литературные первоисточники, найденные стандартным поиском литературы в режиме on-line, или вторичные источники, такие как "Chemical Abstracts" или"Beilstein". Для приготовления представленных здесь примеров использовали способы, указанные в литературе, а также аналогичные им способы. Например, азетидин формулы (II) или его соль могут взаимодействовать с изоцианатом формулы(III) для получения соединений изобретения. Любые реакционноспособные факультативные заместители в Ar1, Ar2 или Ar3 можно защитить в течение реакции и в дальнейшем снять защиту Другие подходы к синтезу соединений изобретения обобщены в схемах 1, 2 и 3 представленных ниже примеров. Как утверждалось выше, соединения изобретения являются эффективными при лечении заболеваний или состояний, на которые ингибирование активности FAAH оказывает благоприятное воздействие,и примеры таких заболеваний и состояний упомянуты выше. Будет понятно, что конкретный уровень дозы для каждого пациента будет зависеть от разных факторов, включающих активность использующихся конкретных соединений, возраст, вес тела, общее состояние здоровья, пол, диету, время введения, режим введения, скорость выведения из организма, комбинацию лекарственных препаратов, а также причинный механизм и тяжесть конкретного заболевания,подвергающегося терапии. В целом, пригодная доза для орально вводимых составов обычно находится в диапазоне от 0,1 до 3000 мг один, два или три раза в день, или эквивалентное ежедневное количество для введения в виде инъекции, ингаляции, вливания или других режимов. Однако оптимальные уровни доз и частота введения определяются клиническими испытаниями, признанными в данной области. Соединения изобретения могут быть приготовлены для любого режима введения, согласующегося с их фармакокинетическими свойствами. Орально вводимые композиции могут быть в форме таблеток,капсул, порошков, гранул, таблеток для рассасывания, жидких или гелевых составов. Таблетки и капсулы для орального введения могут быть представлены в форме однократной дозы и могут содержать традиционные вспомогательные вещества, такие как связующие, например, сироп, камедь, желатин, сорбит,трагант или поливинилпирролидон; наполнители, например лактозу, сахар, маисовый крахмал, фосфат кальция, сорбит или глицин; лубриканты, например стеарат магния, тальк, полиэтиленгликоль или кремний; разрыхлители, например картофельный крахмал или приемлемые смачивающие агенты, такие как лаурил сульфат натрия. Таблетки могут быть покрыты согласно способам, хорошо известным в обычной фармацевтической практике. Оральные жидкие составы могут быть в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в виде сухого продукта для растворения в воде или другом пригодном носителе перед использованием. Такие жидкие составы могут содержать традиционные добавки, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлозу, сироп глюкозы, желатин гидрогенизированные пищевые жиры; эмульгаторы, например лецитин, сорбитмоноолеат или камедь; безводные носители (которые могут включать пищевые масла), например миндальное масло, фракционированное кокосовое масло, масляные эфиры,такие как глицерин, пропиленгликоль или этиловый спирт; консерванты, например метил или пропил ргидроксибензоат или сорбиновую кислоту, и при желании традиционные ароматизаторы или красители. Другие определенные составы для орального введения включают жевательную резинку, таблетки для рассасывания и леденцы, содержащие соединение изобретения. Для местного применения на кожу лекарство может быть приготовлено в виде крема, лосьона или мази. Кремовые или мазевые составы, которые могут применяться в лекарственных препаратах, являются традиционными составами, хорошо известными в данной области, например описанными в стандартных учебниках по фармацевтике, таких как Британская Фармакопея. Также в данной области известны способы доставки через пластыри с замедленным высвобождением. Активные компоненты могут также вводиться парентерально в стерильной среде. В зависимости от используемого носителя и концентрации лекарственный препарат может быть суспендирован или растворен в носителе. Предпочтительно, чтобы вспомогательные вещества, такие как обезболивающие, консервирующие и буферные агенты, могли растворяться в носителе. Также активные компоненты могут быть составлены для ингаляции, например, в виде назального спрея, или сухого порошка, или аэрозольных ингаляторов. Предпочтительно, чтобы в случае доставки в виде ингаляции активное соединение находилось в форме микрочастиц. Данные микрочастицы можно приготовить разными способами, включающими сушку распылением, лиофилизацию и микронизацию. Доставку аэрозолей можно выполнить введением микронизированных активных соединений, например,из капсул для ингаляции или других систем доставки "сухих порошков" с помощью, например, пневматических струйных распылителей или ультразвуковых распылителей, предпочтительно с использованием дозированных аэрозолей с газом-вытеснителем или без него. Соединения изобретения можно вводить вместе с другими классами фармацевтически активных лекарственных препаратов. Следующие примеры иллюстрируют приготовление и активности конкретных соединений изобретения и не предполагают ограничивать полный масштаб изобретения. Часть А. Примеры 1-4. Анализ спектров ядерного магнитного резонанса (ЯМР) 1H (400 МГц) и 13C (100 МГц) выполняли на спектрометре ЯМР Bruker DPX-400 МГц. В качестве эталонного спектра использовали известный химический сдвиг образца растворителя. Данные 1H ЯМР представлены с указанием химического сдвига, множественности спектральных линий (s, синглет; d, дублет; t, триплет; q, квартет; m, мультиплет;dd, дублет дублетов; br, широкий; видимый и т.д.), интеграции (например, 1H), константа(ы) взаимодействия (J) в Гц. Представленные данные 13C указывают на химический сдвиг . Дейтерированные растворители получали от компании Sigma-Aldrich Chemical Company или Fluorochem. Анализ LCMS проводили на приборе HP 1100 с использованием колонки Luna 3 мкм, C 18(2),304,6 мм ID компании Phenomenex при температуре 22C при скорости потока 2 мл/мин с использованием следующих систем растворителей: растворитель A: вода (степень чистоты для ВЭЖХ) + 10 мМ ацетата аммония + 0,08% об./об. муравьиной кислоты; растворитель B: 95% об./об. ацетонитрила (степень чистоты для ВЭЖХ) + 5% об./об. растворителя А + 0,08 об./об. муравьиной кислоты. Градиент: 95:5 растворитель A:растворитель B, от 0,00 до 0,25 мин; от 95:5 до 5:95 растворитель A: растворитель B, от 0,25 до 2,50 мин; 5:95 растворитель A:растворитель B, от 2,50 до 3,75 мин. УФ-детектирование проводили при 230, 254 и 270 нм. Использовали масс-спектрометрHP1100MSD, Series А в режиме положительной или отрицательной ионизации в электроспрее. Диапазон определяемой молекулярной массы от 120 до 1000. Образцы поставлялись в виде 1 мМ раствора в DMSO при 5 мкл неполного заполнения петли инжектора. Очистки препаративной ВЭЖХ выполняли на Waters FractionLynx MS Autopurification system с использованием колонки Gemini 5 мкМ С 18(2), 10020 мм ID компании Phenomenex, работающей при скорости потока 20 мл/мин с УФ-детектированием на диодной матрице (210-400 нм) и сбором отдельных фракций. Градиенты, использующиеся для каждого соединения, показаны в табл. 1. Растворители A и B аналогичны указанным выше для аналитических условий. Использовали масс-спектрометр Waters Micromass ZQ2000 в режиме положительной или отрицательной ионизации в электроспрее с диапазоном определяемой молекулярной массы от 150 до 1000. Схема A(13,11 г, 50 ммоль) перемешивали в ацетонитриле (250 мл) в течение 20 мин при комнатной температуре до полного растворения реагентов. Диизопропил азодикарбоксилат (9,84 мл, 10,11 г, 50 ммоль) добавляли по каплям. Происходило образование белого осадка, и начальная реакция была умеренно экзотермической. Продукт желтого цвета немедленно отделяли. Через 5 мин реакционную смесь нагревали до температуры кипения, при которой происходило растворение осадка, и перемешивали при этой температуре в течение 3,25 ч. Смесь охлаждали до комнатной температуры и собирали с помощью шпателя для вызывания кристаллизации. Смесь охлаждали на льду и твердую фазу собирали фильтрацией. Твердую фазу отмывали дополнительным количеством холодного ацетонитрила и тщательно высушивали для получения простого эфира (15,42 г, 79%) в виде белого порошка; точка плавления при 141-142C; Rf 0,68 (2:1 гексан:EtOAc); LCMS время удерживания 2,57 мин, m/z 392,2 [M+H]+; 1 1-Бензгидрил-3-(бифенил-4-илокси)азетидин (15,40 г, 39,34 ммоль) растворяли в дихлорметане (400 мл), перемешивали и охлаждали в ледяной ванне. 1-Хлорэтилхлорформат (8,49 мл, 11,25 г, 78,69 ммоль) добавляли порциями по 1 мл в течение 10 мин и смесь перемешивали еще в течение 30 мин при 0C, затем при комнатной температуре в течение 25,5 ч. Добавляли дополнительное количество 1 хлорэтилхлорформата (4,25 мл, 5,63 г, 39,35 ммоль) и смесь перемешивали в течение 3 дней. Растворители выпаривали в вакууме и в полученное белое твердое вещество добавляли метанол (300 мл). Смесь осторожно нагревали до растворения, после чего оставляли охлаждаться при энергичном перемешивании, вследствие чего происходило образование белого осадка. После дальнейшего перемешивания в течение 2 ч при комнатной температуре твердую фазу собирали фильтрацией для получения амина (7,41 г,72%) в виде белого твердого вещества; точка плавления при температуре 195C; LCMS время удерживания 1,64 мин, m/z 226,1 [M+H]+; 1H ЯМР (400 МГц; DMSO-d6)9.26 (br s, 2H), 7.64-7.60 (m, 4H), 7.47-7.41 (m, 2H), 7.33 (tt, 1H, J=7.3 и 1.2 Гц), 6.96 (d, 2H, J=8.8 Гц), 5.13 (tt, 1H, J=6.8 и 4.8 Гц), 4.46 (dd, 2H, J=12.4 и 6.8 Гц), 4.01 (dd, 2H,J=12.4 и 4.8 Гц). Стадия 3. Фениламид 3-(бифенил-4-илокси)азетидин-1-карбоновой кислоты. В перемешанную суспензию гидрохлорида 3-(1,1'-бифенил-4-илокси)азетидина (100 мг, 382 мкмоль) в дихлорметане (2,5 мл) добавляли триэтиламин (63 мкл, 48 мг, 478 мкмоль) с последующим фенилизоцианатом (35 мкл, 38 мг, 320 мкмоль) и реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч. Смесь наносили на 2 г предварительно упакованного картриджа SCX-2 и продукт элюировали смесью дихлорметан:метанол 1:1 (15 мл). Растворители выпаривали для получения мочевины (113 мг, 100%) в виде белого порошка; LCMS время удерживания 2,57 мин, m/z 345,2 [M+H]+; 1 Н ЯМР (400 МГц; DMSO-d6)8.54 (s, 1H), 7.62 (d, 4H, J=7.6 Гц), 7.50 (d, 2H, J=8.0 Гц), 7.44 (t, 2 Н,J=7.6 Гц), 7.32 (t, 1H, J=7.2 Гц), 7.23 (t, 2 Н, J=7.8 Гц), 7.98-7.91 (m, 3H), 5.09 (m, 1H), 4.46-4.42 (m, 2 Н) и 3.95-3.91 (m, 2H). Пример 2. (3-Фторфенил)амид 3-(бифенил-4-илокси)азетидин-1-карбоновой кислоты. Указанное соединение было приготовлено аналогично примеру 1 с использованием 3-фторфенилизоцианата вместо фенилизоцианата. Продукт получали в виде белого порошка; LCMS время удерживания 2,61 мин, m/z 363,1 [M+H]+; 1 Указанное соединение было приготовлено аналогично примеру 1 с использованием 2-фторфенилизоцианата вместо фенилизоцианата. Продукт очищали растиранием с диэтиловым эфиром для получения указанного соединения в виде грязно-белого твердого вещества; LCMS время удерживания 2,60 мин,m/z 363,1 [M+H]+; 1 Гидрохлорид 3-(бифенил-4-илокси)азетидина (3 г, 11,47 ммоль) суспендировали в дихлорметане (45 мл) в атмосфере азота, обрабатывали триэтиламином (4,0 мл, 28,68 ммоль) и перемешивали в течение 10 мин при комнатной температуре. Смесь охлаждали до 0C и обрабатывали добавлением порциями пиридин-3-изоцианата (1,15 г, 9,56 ммоль). Перемешивали при 0C в течение 10 мин, затем при комнатной температуре в течение 16 ч. Раствор разбавляли дополнительным количеством дихлорметана (200 мл),промывали водой (2100 мл) с последующим солевым раствором (50 мл), высушивали (над MgSO4) и растворитель выпаривали в вакууме для получения грязно-белого твердого вещества. Твердую фазу растирали с диэтиловым эфиром, после чего перемешивали в течение 3 дней с MP-изоцианатной смолой в смеси дихлорметан/метанол/ацетонитрил. Смесь фильтровали и доводили до сухого состояния в вакууме. Полученную твердую фазу последовательно растирали с диэтиловым эфиром, затем ацетонитрилом и фильтровали для получения мочевины (1,2 г, 36%) в виде белого твердого вещества; Rf 0,10 (5% MeOHDCM); LCMS время удерживания 2,08 мин, m/z 346,2 [M+H]+; 1(CH2). Часть В. Примеры 5-19. Общая методика. Все реагенты, полученные от коммерческих поставщиков, использовали без дополнительной очистки. Безводные растворители получали от коммерческих поставщиков и использовали без дополнительной сушки. Флэш-хроматографию выполняли с использованием предварительно упакованных силикагелем картриджей (Strata SI-1; 61 , Phenomenex, Cheshire UK или IST Flash II, 54 , Argonaut, Hengoed, UK). Тонкослойную хроматографию (TLC) выполняли с использованием 510 см пластинок, покрытых силикагелем Merck Type 60 F254. После того как вещества становятся видимыми в УФ-свете, величину фактора удерживания (Rf) каждой зоны можно определить при необходимости как отношение расстояния, которое прошел продукт, к общему расстоянию, которое прошел растворитель (фронту растворителя). Некоторые соединения настоящего изобретения были охарактеризованы методом LC/MS (метод А) с использованием жидкостного хроматографа с масс-селективным детектором Hewlett Packard серии 1100 LC/MSD, сопряженным с квадрупольным детектором (режим ионизации: в режиме положительных или отрицательных ионов в электроспрее; колонка: Phenomenex Luna 3 мкМ C18(2) 304.6 мм при 22C. Буфер А готовили растворением 1,93 г ацетата аммония в 2,5 л воды (степени чистоты для ВЭЖХ) и добавлением 2 мл муравьиной кислоты. Буфер В готовили добавлением 132 мл буфера А в 2,5 л ацетонитрила (степень чистоты для ВЭЖХ) и 2 мл муравьиной кислоты; градиент элюирования от 95:5 до 5:95 буфер А:буфер В в течение 3,75 мин. (Объем введения: 2 мкл). Скорость потока = 2,0 мл/мин. УФдетектирование проводили с помощью детектора на диодной матрице при 230, 254 и 270 нм. Времена удерживания (RT) выражены в минутах. Ионизация является положительной, если не указано иное. Некоторые соединения настоящего изобретения были охарактеризованы альтернативным методомLC/MS (Метод В) с использованием жидкостного хроматографа серии Agilent 1200 SL, сопряженного с одноквадруполным масс-спектрометром Agilent MSD 6140 с многорежимным источником; колонка: Phenomenex Luna 2,5 мкМ C18, 502 мм, HST при температуре колонки 55C. Буфер А: вода/10 мМ формиата аммония/0,04% (об./об.) муравьиной кислоты, pH 3.5. Буфер В: ацетонитрил/5,3% (об./об.) А/0,04%(об./об.) формиата. Градиенты и скорости потока для метода В приведены в табл. 1 (объем введения: 2 мкл). УФ-детектирование проводили с использованием детектора на диодной матрице при 230, 254 и 270 нм. Времена удерживания (RT) выражены в минутах. Ионизация является положительной, если не указано иное. Таблица 1 Градиенты растворителя и скорости потока для LC/MS метода В Анализ спектров ядерного магнитного резонанса (ЯМР) выполняли на спектрометре ЯМР BrukerDPX-400 МГц. В качестве эталонного спектра был известный химический сдвиг растворителя. Данные протонного ЯМР указаны в следующей последовательности: химический сдвигв ppm, мультиплетность (s = синглет, d = дублет, t = триплет, q = квартет, m = мультиплет, dd = дублет дублетов, br = широкий), интегрирование, константа взаимодействия. Некоторые соединения изобретения очищали препаративной ВЭЖХ. Очистки препаративной ВЭЖХ выполняли на системе Waters FractionLynx MS Autopurification system с колонкой Gemini 5 мкмC18(2), 10020 мм ID компании Phenomenex, при скорости потока 20 мл/мин с УФ-детектированием на диодной матрице (210-400 нм) и сбором масс-спектральных данных. Соответствующие градиенты растворителей для элюирования соединения определяли для каждого конкретного соединения. При pH 4: растворитель A: вода (степень очистки для ВЭЖХ) + 10 мМ ацетата аммония + 0,08% об./об. муравьиной кислоты; растворитель B: 95% об./об. ацетонитрила (степень очистки для ВЭЖХ) + 5% об./об. растворителя А + 0,08% об./об. муравьиной кислоты. При pH 9: растворитель A: вода (степень очистки для ВЭЖХ) + 10 мМ ацетата аммония + 0,08% об./об. раствора аммиака; растворитель B: 95% об./об. ацетонитрила (степень очистки для ВЭЖХ) + 5% об./об. растворителя А + 0,08% об./об. раствора аммиака. Анализ спектров ядерного магнитного резонанса (ЯМР) 1H (400 МГц) и 13C (100 МГц) выполняли на спектрометре ЯМР Bruker DPX-400 МГц. Эталонным спектром был известный химический сдвиг образца растворителя. Данные 1 Н ЯМР представлены с указанием химического сдвига , мультиплетности (s, синглет; d, дублет; t, триплет; q, квартет; m, мультиплет; dd, дублет дублетов; br, широкий; арр,очевидный и т.д.), интегрирование (например, 1H), константа(ы) взаимодействия (J) в Гц. Данные 13 С представлены с указанием химического сдвига . Дейтерированные растворители получали от компании Sigma-Aldrich Chemical Company или компании Fluorochem. Масс-спектрометром являлся спектрометр Micromass ZQ2000 компании Waters в режиме положительной или отрицательной ионизации в электроспрее со сканированием молекулярной массы в диапазоне от 150 до 1000. Химические наименования по номенклатуре IUPAC получали с помощью программы AutoNomStandard. Некоторые соединения примеров были получены согласно режиму, показанному на схеме 1. Некоторые соединения примеров были получены согласно режиму, показанному на схеме 2. Схема 2 Некоторые соединения примеров получали с использованием режима, показанного на схеме 3. Экспериментальные методы, реагенты и способы выделения продукта известны опытным специалистам в области органического синтеза. Следует понимать, что другие способы также могут использоваться. Схема 3 Гидрид натрия (дисперсия 60 мас.% в минеральном масле, 6,36 г, 0,156 моль) добавляли порциями в раствор 1-бензгидрилазетидин-3-ола (25,38 г, 0,106 моль) в безводном диметилформамиде (400 мл) в атмосфере азота. Это вызвало образование осадка и вспенивание. После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 15 мин. Раствор 2-хлор-5-иодпиридина(25,40 г, 0,105 моль) в диметилформамиде (100 мл) добавляли в реакционную смесь через капельную воронку в течение 15 мин. После завершения добавления реакционную смесь нагревали до 70C и перемешивали в атмосфере азота в течение 4,5 ч. Затем реакционную смесь оставляли охлаждаться до ком- 11017842 натной температуры и добавляли насыщенный водный раствор хлорида аммония (30 мл). Растворители удаляли в вакууме и остаточную твердую фазу разделяли между этилацетатом (600 мл) и насыщенным водным раствором бикарбоната натрия (500 мл). Фазы разделяли и органическую фазу промывали насыщенным водным раствором хлорида натрия (3300 мл), высушивали над сульфатом натрия и фильтровали, после чего растворители фильтрата удаляли в вакууме для получения желто-коричневого твердого вещества, которое растирали с диэтиловым эфиром, фильтровали и высушивали в вакууме для получения указанного соединения в виде бежевого твердого вещества (33,41 г, 71%). LCMS (метод A) RT = 2,19 мин; m/z = 443 [M+H]+. Стадия 2. Гидрохлорид 2-(азетидин-3-илокси)-5-иодпиридина. 1-Хлорэтилхлорформат (128 мл, 0,104 моль) добавляли по каплям через шприц в перемешанный раствор 2-(1-бензгидрилазетидин-3-илокси)-5-иодпиридина (23,03 г, 0,052 моль) в дихлорметане (250 мл) при комнатной температуре. Полученный раствор перемешивали при комнатной температуре в течение 3,5 ч, затем добавляли метанол (250 мл) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Растворители удаляли в вакууме и полученный твердый остаток растирали с диэтиловым эфиром, фильтровали и затем высушивали в вакууме для получения указанного продукта в виде кремового твердого вещества (17,8 г,колич. выход). Сырой продукт использовали без дальнейшей очистки. 4-Нитрофенилхлорформат (692 мг, 3,44 ммоль) добавляли в перемешанный раствор 2-(1 бензгидрилазетидин-3-илокси)-5-иодпиридина (1,01 г, 2,29 моль) в дихлорметане (40 мл) при комнатной температуре. Полученный раствор перемешивали при комнатной температуре в течение 18 ч. Растворитель удаляли в вакууме и продукт очищали флэш-хроматографией на силикагеле (25 г), элюируя дихлорметаном для получения указанного соединения в виде бесцветного твердого вещества (474 мг, 47%). Раствор 4-аминопиримидина (Aldrich, 243 мг, 2,54 ммоль) в безводном DMF (4 мл) добавляли через шприц в суспензию гидрида натрия (60%-ная (мас.%) дисперсия в минеральном масле, 185 мг, 4,62 ммоль) в безводном DMF (4 мл) в атмосфере азота. Смесь перемешивали в течение 5 мин, затем по каплям добавляли раствор 4-нитрофенилового эфира 3-(5-иодопиридин-2-илокси)азетидин-1-карбоновой кислоты (1,02 г, 2,31 ммоль) в безводном DMF (6 мл) и полученную желтую мутную смесь перемешивали при комнатной температуре в течение 1,5 ч. Реакционную смесь заливали в насыщенный водный раствор хлорида аммония (30 мл) и экстрагировали этилацетатом (3100 мл). Объединенные органические фазы промывали насыщенным водным раствором хлорида натрия (100 мл) и высушивали над сульфатом натрия. Смесь фильтровали и растворители фильтрата удаляли в вакууме для получения желтого твердого вещества, которое растирали с диэтиловым эфиром, фильтровали и сушили для получения указанного соединения (594 мг, 65%) в виде бесцветного твердого вещества. LCMS (метод A) RT = 1,89 мин; m/z = 398 [M+H]+. Стадия 5. 2-[3-(2-Метоксиэтокси)фенил]-4,4,5,5-тетраметил[1,3,2]диоксаборолан. Кабонат калия (1,88 г, 13,65 ммоль) добавляли в раствор пинаколового эфира 3-гидроксифенилбороновой кислоты (Apollo, 1,0 г, 4,55 ммоль) в DMF (10 мл). Добавляли 2-бромэтилметиловый эфир (0,41 мл, 5,46 ммоль) и реакционную смесь нагревали до 100C в течение 1 ч. Реакционную смесь оставляли охлаждаться, после чего разделяли между этилацетатом (50 мл) и водой (150 мл). Фазы разделяли и органическую фазу промывали солевым раствором (150 мл), высушивали над безводным сульфатом натрия, фильтровали и растворители фильтрата удаляли в вакууме для получения указанного продукта в виде светло-коричневого масла (1,1 г), которое использовали без дальнейшей очистки. Стадия 6. Пиримидин-4-иламид 3-5-[3-(2-метоксиэтокси)фенил]пиридин-2-илоксиазетидин-1 карбоновой кислоты. Раствор 2-[3-(2-метоксиэтокси)фенил]-4,4,5,5-тетраметил[1,3,2]диоксаборолана (стадия 5, 109 мг,0,39 ммоль) в смеси THF/H2O (10:1; 3 мл) добавляли в сосуд для СВЧ, содержащий пиримидин-4-иламид 3-(5-иодпиридин-2-илокси)азетидин-1-карбоновой кислоты (стадия 4, 104 мг, 0,26 ммоль) и карбонат калия (108 мг, 0,786 ммоль). Через смесь пропускали поток пузырьков азота в течение 5 мин, после чего добавляли комплекс 1,1'-бис[(дифенилфосфино)ферроцен]дихлорпалладия(II) с CH2Cl2 (21 мг, 10 мол.%),сосуд герметично закрывали и нагревали при 100C в синтезаторе СВЧ в течение 30 мин. Охлажденную реакционную смесь разбавляли этилацетатом (20 мл) и промывали через целит (2,5 г IST картридж). Слой целлита промывали дополнительным количеством этилацетата 10 мл и объединенный фильтрат промывали последовательно водой (30 мл), раствором 1N NaOH (30 мл), водой (30 мл), затем насыщенным раствором хлорида натрия (30 мл). Смесь высушивали над сульфатом натрия и фильтровали. Растворители фильтрата удаляли в вакууме для получения коричневой смолы, которую очищали флэшхроматографией, элюируя градиентом от 50 до 100% этилацетата в гексане для получения твердого смолообразного вещества. Продукт растворяли в дихлорметане (25 мл) и добавляли 2N NaOH (водн. 25 мл),после чего смесь энергично перемешивали в течение 1 ч. Фазы разделяли и органический слой высушивали над сульфатом натрия, фильтровали, после чего растворитель фильтрата удаляли в вакууме для получения твердого вещества, которое растирали с диэтиловым эфиром, фильтровали и высушивали для получения указанного соединения в виде бесцветного твердого вещества (50 мг, 45%). Данное соединение было приготовлено способом, представленным для примера 5 стадии 1. Таким образом, 5-бром-2-хлорпиридин (31,31 г, 0,163 моль) и 1-бензгидрилазетидин-3-ол (38,93 г, 0,163 моль) Данное соединение было приготовлено способом, представленным для примера 5 стадии 2. Таким образом, гидрохлорид 2-(азетидин-3-илокси)-5-бромпиридина (13,76 г, 0,035 моль) прореагировал с 1 хлорэтилхлорформатом с получением указанного соединения (10,22 г колич. выход) в виде коричневого твердого вещества. Данное соединение было приготовлено способом, представленным для примера 5 стадии 3. Таким образом, гидрохлорид 2-(азетидин-3-илокси)-5-бромпиридина (2,0 г, 7,53 моль) прореагировал с 4 нитрофенилхлорформатом с образованием указанного соединения (1,11 г, 37%) в виде бледно-желтого твердого вещества. Данное соединение было приготовлено способом, представленным для примера 5 стадии 4. Таким образом, 4-нитро-фениловый эфир 3-(5-бромпиридин-2-илокси)азетидин-1-карбоновой кислоты (905 мг,2,30 ммоль) прореагировал с 2-аминопиразином (243 мг, 2,53 ммоль) с образованием указанного соединения (454 мг, 56%) в виде грязно-белого твердого вещества. Данное соединение было приготовлено способом, представленным для примера 5 стадии 4. Таким образом, пиразин-2-иламид 3-(5-бромпиридин-2-илокси)азетидин-1-карбоновой кислоты (100 мг, 0,285 ммоль) прореагировал с 2-[3-(2-метоксиэтокси)фенил]-4,4,5,5-тетраметил[1,3,2]диоксабороланом (пример 5, стадия 5, 118 мг, 0,855 ммоль) с образованием указанного соединения (70 мг, 58%) в виде бесцветного порошка. В охлажденный в ледяной ванне раствор гидрида натрия (60 мас.% в минеральном масле, 2,1 г, 52,4 ммоль) в DMF (50 мл) в атмосфере азота добавляли (по каплям) раствор 3-аминопиридазина (2,74 г, 28,79 ммоль) в DMF (50 мл). Через несколько минут добавляли раствор 4-нитрофенилового эфира 3-(5-йодпиридин-2-илокси)азетидин-1-карбоновой кислоты (пример 5, стадия 3); 11,54 г, 26,18 ммоль) в DMF (40 мл). Через 5 мин охлаждающую ванну удаляли и реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1,5 ч. Добавляли насыщенный раствор бикарбоната натрия(500 мл) и смесь экстрагировали EtOAc (4400 мл). Объединенные органические фазы промывали насыщенным раствором хлорида натрия (500 мл), высушивали над сульфатом натрия и фильтровали. Растворители фильтрата удаляли в вакууме для получения сырого продукта, который растирали с диэтиловым эфиром для получения указанного соединения (752 г, 72%) в виде бесцветного твердого вещества. Данное соединение было приготовлено аналогично способу, представленному для примера 5 стадии 6. Таким образом, пиридазин-3-иламид 3-(5-иодпиридин-2-илокси)азетидин-1-карбоновой кислоты ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Растворители суспензии удаляли в вакууме и остаток разделяли между этилацетатом (400 мл) и насыщенным водным раствором бикарбоната натрия (400 мл). Смесь фильтровали через слой целлита и фазы фильтрата разделяли. Органическую фазу промывали насыщенным водным раствором бикарбоната натрия (250 мл), затем насыщенным водным раствором хлорида натрия (250 мл), после чего высушивали над сульфатом натрия и фильтровали. Растворители фильтрата удаляли в вакууме для получения желтого твердого вещества, которое очищали флэш-хроматографией на силикагеле (100 г), элюируя смесью 1:19 7N раствор аммиака в метаноле:дихлорметан. Это позволило получить указанное соединение (2,0 г, 42%) в виде бесцветного твердого вещества. Данное соединение было приготовлено способом, представленным для примера 5 стадии 6. Таким образом, пиридин-3-иламид 3-(5-иодпиридин-2-илокси)азетидин-1-карбоновой кислоты (300 мг, 0,76 ммоль) реагировал с 3-гидроксифенилбороновой кислотой (156 мг, 1,14 ммоль) с образованием сырого продукта, который очищали флэш-хроматографией на силикагеле, элюируя градиентом растворителя от 1:19 до 1:9 смеси 7N раствор аммиака в метаноле:дихлорметан. Это позволило получить указанное соединение (130 мг, 47%) в виде бесцветного порошка. Карбонат калия (23 мг, 165 мкмоль) добавляли в раствор пиридин-3-иламид 3-[5-(3-гидроксифенил)пиридин-2-илокси]азетидин-1-карбоновой кислоты (20 мг, 55 мкмоль) в DMF (0,5 мл). Добавляли 2-бромэтилметиловый эфир (6 мкл, 66 мкмоль) и реакционную смесь нагревали до 100C в синтезаторе СВЧ в течение 1 ч. Реакционную смесь оставляли охлаждаться и растворитель удаляли в вакууме. Сырой продукт очищали препаративной ВЭЖХ для получения указанного продукта в виде бесцветного твердого вещества (6.7 мг, 29%). Данное соединение было приготовлено способом, представленным для примера 5 стадии 5. Таким образом, пинаколиновый эфир 3-гидроксифенилбороновой кислоты (500 мг, 2,27 ммоль) реагировал с бензил-2-бромэтиловым эфиром (0,54 мл, 3,41 моль) и полученный сырой продукт использовали без дальнейшей очистки. Стадия 2. Пиридазин-3-иламид 3-5-[3-(2-бензилоксиэтокси)фенил]пиридин-2-илоксиазетидин-1 карбоновой кислоты. Данное соединение было приготовлено способом, представленным для примера 5 стадии 6. Таким образом, пиридазин-3-иламид 3-(5-иодпиридин-2-илокси)азетидин-1-карбоновой кислоты (пример 7,стадия 1) (600 мг, 1,15 ммоль) реагировал с 2-[3-(2-бензилоксиэтокси)фенил]-4,4,5,5-тетраметил[1,3,2]диоксабороланом (1,5 экв.). Сырой продукт очищали флэш-хроматографией на силикагеле, элюируя смесью 4:1 этилацетат:гексан для получения указанного соединения (214 мг, 28%) в виде коричневой пены. Пиридазин-3-иламид 3-5-[3-(2-бензилоксиэтокси)фенил]пиридин-2-илоксиазетидин-1-карбоновой кислоты (пример 9, 325 мг, 0,65 ммоль) растворяли в безводном дихлорметане (10 мл) в атмосфере азота. Смесь охлаждали в ледяной ванне и по каплям добавляли трибромид бора в растворе дихлорметана (1 М, 0,98 мл, 0,98 ммоль), вызывая образование осадка. Реакционную смесь перемешивали при 0C в течение 2 ч. Осадок собирали фильтрацией и очищали флэш-хроматографией на силикагеле, элюируя этилацетатом, затем 5-10% метанолом в DCM. Последующая очистка препаративной ВЭЖХ при pH 4 позволила получить указанное соединение (13 мг, 5%) в виде бесцветного твердого вещества. Триэтиламин (14,55 мл, 104,43 ммоль) добавляли в охлажденный в ледяной ванне раствор 4 метоксифенола (5,185 г, 41,77 ммоль) в безводном эфире (200 мл) в атмосфере азота. Добавляли по каплям ацетилхлорид (5,94 мл, 83,53 ммоль) и реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали дополнительно в течение 10 мин. Реакционную смесь разделяли между этилацетатом и насыщенным водным раствором бикарбоната натрия. Фазы разделяли и органическую фазу высушивали над сульфатом натрия, фильтровали и растворители фильтрата удаляли в вакууме для получения указанного соединения (7,45 г, колич.) в виде коричневой жидкости. Уксусную кислоту (2,24 мл, 7,4 ммоль) добавляли в смесь 4-метоксифенилового эфира (1,0 г, 6,02 ммоль) и ацетата натрия (940 мг, 11,46 ммоль). Добавляли по каплям смесь брома (0,37 мл, 6,02 ммоль) в уксусной кислоте (2,1 мл) и смесь перемешивали в течение 18 ч при комнатной температуре. Добавляли еще 0,6 мл уксусной кислоты с последующим 0,1 мл брома. Смесь перемешивали в течение 2 ч, затем разделяли между этилацетатом (100 мл) и водой (100 мл). Фазы разделяли и органический слой промывали последовательно насыщенным водным раствором бикарбоната натрия (2150 мл), насыщенным водным раствором тиосульфата натрия (100 мл) и насыщенным водным раствором хлорида натрия (100 мл). Органическую фазу высушивали над сульфатом натрия, фильтровали и растворители фильтрата удаляли в вакууме для получения масла, которое очищали флэш-хроматографией на силикагеле, элюируя градиентом 0-10% этилацетата в гексане для получения указанного соединения (1,2 г, 81%) в виде светло-коричневого масла. Раствор гидроксида калия (290 мг, 5,19 ммоль) в воде (2,5 мл) добавляли в раствор 3-бром-4 метоксифенилового эфира уксусной кислоты (1,2 г, 4,9 ммоль) в метаноле (18,5 мл). Смесь перемешивали при комнатной температуре в течение 30 мин, после чего растворители удаляли в вакууме и добавляли воду (40 мл). Смесь подкисляли добавлением по каплям 1,2 М водного раствора HCl (4,3 мл) и экстрагировали дихлорметаном (240 мл). Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и растворители фильтрата выпаривали в вакууме для получения указанного соедине- 18017842 2-Бромэтилметиловый эфир (0,07 мл, 0,74 ммоль) добавляли в смесь карбоната калия (136 мг, 0,99 ммоль) и 3-бром-4-метоксифенола (100 мг, 0,49 ммоль) в DMF (2 мл) и смесь нагревали при 100C в течение 1 ч. Реакционную смесь оставляли охлаждаться и разделяли между этилацетатом (20 мл 2) и водой (20 мл). Объединенные органические фазы промывали насыщенным водным раствором хлорида натрия (40 мл) и высушивали над сульфатом натрия. Растворители удаляли в вакууме для получения сырого масла, которое очищали флэш-хроматографией на силикагеле, элюируя градиентом 0-10% этилацетата в гексане для получения указанного соединения (113 мг, 88%) в виде бесцветной жидкости. Раствор 2-бром-1-метокси-4-(2-метоксиэтокси)бензола (110 мг, 0,42 ммоль) в безводном THF (2 мл) охлаждали до -78C с использованием CO2-ацетоновой ванны в атмосфере азота. Добавляли триизопропилборат (0,19 мл, 0,842 ммоль) с последующим раствором n-бутиллития (2,5 М в гексанах, 0,22 мл, 0,55 ммоль). Смесь оставляли нагреваться до комнатной температуры, растворители удаляли в вакууме для получения бесцветного твердого вещества. В неочищенную бороновую кислоту добавляли пиридазин-3 иламид 3-(5-иодпиридин-2-илокси)азетидин-1-карбоновой кислоты (пример 7, стадия 1) (150 мг, 0,38 ммоль), 1N водный раствор бикарбоната натрия (1,26 мл), DMF (7 мл) и комплекс 1,1'-бис[(дифенилфосфино)ферроцен]дихлорпалладия(II) с CH2Cl2 (15 мг). Через смесь в течение 5 мин пропускали поток пузырьков азота и реакционную смесь нагревали при 80C в течение 2 ч. Смесь оставляли охлаждаться,разделяли между этилацетатом (30 мл) и водой (30 мл). Органическую фазу разделяли, затем промывали насыщенным водным раствором хлорида натрия (60 мл) и высушивали над сульфатом натрия. Растворители удаляли в вакууме для получения сырого масла, которое очищали флэш-хроматографией на силикагеле, элюируя градиентом 0-10% этилацетат в гексане для получения указанного соединения (77 мг,41%) в виде бледно-желтой пены. Данное соединение было приготовлено способом, представленным для примера 5 стадии 6. Таким образом, пиразин-2-иламид 3-(5-иодпиридин-2-илокси)азетидин-1-карбоновой кислоты (100 мг, 0,25 ммоль) реагировал с 2,5-диметоксибензолбороновой кислотой (Кат. No 107099-99-0, 69 мг, 0,38 ммоль) для получения указанного соединения (84 мг, 83%) в виде грязно-белого порошка. Данное соединение было приготовлено способом, представленным для примера 5 стадии 6. При этом смешивали пиразин-2-иламид 3-(5-иодпиридин-2-илокси)азетидин-1-карбоновой кислоты (750 мг,1,89 ммоль), бензолбороновую кислоту (345 мг, 2,83 ммоль), карбонат калия (783 мг, 5,67 ммоль), [1,1'бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (комплекс с дихлорметаном; 155 мг, 0,19 ммоль) иTHF-H2O (10:1; 15 мл), герметично закрывали в двух сосудах для СВЧ и нагревали при 100C в течение 2 ч. Сосуды объединяли, выпаривали, наносили на 50 г SiO2 картридж в DCM и тщательно высушивали. Продукт элюировали смесью от 1:1 изогексан:EtOAc до EtOAc и продукт, полученный после выпаривания фракций, содержащих продукт, растирали в смеси 2:1 диэтиловый эфир-изогексан и собирали фильтрацией для получения продукта (702 мг, 54%) в виде белого порошка; точка плавления при температуре 201-202C; Rf=0.17 (EtOAc); LCMS (метод В) RT = 1,19 мин; m/z = 348 ([M+H]+, 100%); 1 Н (399 МГц; DMSO-d6)9.97 (1H, br s), 8.85 (1H, dd, J=4.5 и 1.3 Гц), 8.48 (1H, dd, J=2.5 и 0.5 Гц),8.15 (1H, dd, J=9.1 и 1.5 Гц), 8.08 (1H, dd, J=8.6, 2.5 Гц), 7.68-7.66 (2H, m), 7.59 (1H, dd, J=9.1 и 4.5 Гц),7.49-7.45 (2H, m), 7.39-7.36 (1H, m), 7.01 (1H, dd, J=8.6 и 0.5 Гц), 5.40 (1H, tt, J=6.6 и 4.0 Гц), 4.48 (2H, dd,J=8.6 и 6.6 Гц) и 4.04 (2H, dd, J=9.6 и 3.0 Гц). Пример 14. Пиридазин-3-иламид 3-[5-(2,6-дифторфенил)пиридин-2-илокси]азетидин-1-карбоновой кислоты. Пиримидин-4-иламид 3-(5-иодпиридин-2-илокси)азетидин-1-карбоновой кислоты (50 мг, 0,126 ммоль), 2,6-дифторфенилтрифторборат калия (29 мг, 0,132 ммоль), триэтиламин (0,05 мл, 0,38 ммоль),комплекс 1,1'-бис[(дифенилфосфино)ферроцен]дихлорпалладия(II) с CH2Cl2 (5 мг, 5 мол.%) и EtOH (108 мг, 0,786 ммоль) объединяли и нагревали при 80C в течение 16 ч. Так как реакция не завершилась, добавляли еще 2,6-дифторфенилтрифторборат (29 мг, 0,132 ммоль), комплекс 1,1'-бис[(дифенилфосфино)ферроцен]дихлорпалладия(II) с CH2Cl2 (5 мг, 5 мол.%) и триэтиламин (0,05 мл, 0,38 ммоль),после чего смесь нагревали еще в течение 5 ч. Реакционную смесь оставляли охлаждаться до прохождения через слой целита и отмывали EtOAc и МеОН. Эти органические фазы выпаривали в вакууме для получения сырого масла, которое очищали флэш-хроматографией, элюируя градиентом от 0 до 4% МеОН в CH2Cl2 для получения продукта, все еще содержащего примеси, в виде коричневого масла. Данный продукт очищали ВЭЖХ (pH 4, HCO2NH4/HCO2H/H2O/MeCN) для получения требуемого продукта в виде белого твердого вещества (8 мг, 17%) LCMS (метод В) RT = 1,2 мин; m/z = 384 [M+H]+. 1 2-Хлор-5-гидроксифенилбороновую кислоту (409 мг, 2,37 ммоль), пинакол (336 мг, 2,85 ммоль), толуол (20 мл) и молекулярное сито с диаметром пор 4(400 мг) объединяли и нагревали при 120C в течение 2 ч. Реакционную смесь оставляли охлаждаться и затем разделяли между EtOAc (230 мл) и водой(30 мл). Объединенные органические фазы промывали солевым раствором (20 мл), высушивали (Na2SO4) и выпаривали в вакууме для получения требуемого продукта в виде белого твердого вещества (500 мг,83%). 4-Хлор-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенол (495 мг, 1,95 ммоль), PPh3 (765 мг,2,92 ммоль) и THF (11 мл) объединяли в атмосфере азота при комнатной температуре. Затем добавляли 2-метоксиэтанол (0,18 мл, 2,34 ммоль) и реакционную смесь перемешивали в течение 5 мин. Смесь затем охлаждали до 0C и добавляли по каплям DIAD (0,57 мл, 2,92 ммоль). Смесь оставляли нагреваться до комнатной температуры и перемешивали еще в течение 2 ч. Реакционную смесь разделяли между EtOAc(230 мл) и водой (30 мл). Объединенные органические фазы промывали солевым раствором (30 мл),высушивали (Na2SO4) и выпаривали в вакууме для получения сырого продукта в виде желтого масла,которое очищали флэш-хроматографией, элюируя градиентом от 0 до 50% EtOAc в гексане для получения продукта, все еще содержащего примеси, в виде грязно-белого твердого вещества (316 мг, с примесями). Данный продукт объединяли с пиримидин-4-иламидом 3-(5-иодпиридин-2-илокси)азетидин-1 карбоновой кислоты (64 мг, 0,162 ммоль), 1 М раствором NaHCO3 (0,19 мл, 0,194 ммоль), PdCl2(PPh3)2 (6 мг, 2 мол.%) и DMF (4 мл). Смесь дегазировали пропусканием потока пузырьков азота в течение 5 мин и далее нагревали при 80C в течение 2 ч в атмосфере азота. Реакционную смесь оставляли охлаждаться перед фильтрацией через слой целита перед разделением между EtOAc (220 мл) и водой (25 мл). Объединенные органические фазы высушивали (Na2SO4) и выпаривали в вакууме для получения сырого масла, которое очищали флэш-хроматографией, элюируя градиентом от 0 до 10% МеОН в CH2Cl2 для получения продукта, все еще содержащего примеси, в виде коричневого масла. Данный продукт очищали ВЭЖХ (pH 4, HCO2NH4/HCO2H/H2O/MeCN) для получения требуемого продукта в виде белого твердого вещества (48 мг, 26%).CH2Cl2 (23 мг, 10 мол.%) в сосуде для СВЧ добавляли THF/H2O (10:1, 3 мл). Через смесь пропускали поток пузырьков азота в течение 5 мин, сосуд герметично закрывали и нагревали при 100C в СВЧ синтезаторе в течение 20 мин. Охлажденную реакционную смесь разбавляли этилацетатом (20 мл) и фильтровали через целит (2,5 г IST картридж). Слой целлита промывали еще 10 мл этилацетата и объединенный фильтрат промывали последовательно водой (25 мл), затем насыщенным раствором хлорида натрия (25 мл). Смесь высушивали над сульфатом натрия и фильтровали. Растворители фильтрата удаляли в вакууме для получения сырого продукта, который очищали флэш-хроматографией, элюируя градиентом от 50 до 100% этилацетата в гексане для получения твердого продукта в виде смолы, который растирали с диэтиловым эфиром, фильтровали и высушивали для получения указанного соединения в виде бесцветного твердого вещества (67 мг, 64%). Раствор 2-метоксифенилбороновой кислоты в THF/H2O (10:1, 40 мл) добавляли в сосуд для СВЧ,содержащий пиридазин-3-иламид 3-(5-бромпиридин-2-илокси)азетидин-1-карбоновой кислоты (приготовленный аналогично примеру 19 стадии 1) 1,5 г, 4,28 ммоль) и карбонат калия (1,78 г, 12,86 ммоль). Через смесь пропускали поток пузырьков азота в течение 5 мин, затем добавляли комплекс 1,1'бис[(дифенилфосфино)ферроцен]дихлорпалладия(II) с CH2Cl2 (0,350 г, 10 мол.%), сосуд герметично закрывали и нагревали при 100C в СВЧ-синтезаторе в течение 30 мин. Охлажденную реакционную смесь разбавляли этилацетатом (100 мл) и последовательно промывали насыщенным водным раствором карбоната натрия (100 мл), затем насыщенным раствором хлорида натрия (100 мл). Смесь высушивали над сульфатом магния и фильтровали. Растворители фильтрата удаляли в вакууме для получения коричневого смолянистого вещества, которое очищали флэш-хроматографией, элюируя градиентом от 80 до 100% этилацетата в гексане для получения бледно-желтого твердого вещества. Продукт растирали с диэтиловым эфиром, фильтровали и высушивали для получения указанного соединения в виде белого твердого вещества (1,098 г, 68%). Раствор 4-фторфенилбороновой кислоты (0,254 г, 1,81 ммоль) в THF/H2O (10:1, 10 мл) добавляли в сосуд для СВЧ, содержащий пиридазин-3-иламид 3-(5-йодпиридин-2-илокси)азетидин-1-карбоновой кислоты (пример 7 стадии 1) (0,480 г, 1,21 ммоль) и карбонат калия (0,50 г, 3,63 ммоль). Через смесь пропускали поток пузырьков азота в течение 5 мин, затем добавляли комплекс 1,1'-бис[(дифенилфосфино) ферроцен]дихлорпалладия(II) с CH2Cl2 (0,099 г, 10 мол.%), сосуд герметично закрывали и нагревали при 100C в СВЧ-синтезаторе в течение 30 мин. Охлажденную реакционную смесь разбавляли этилацетатом(20 мл) и последовательно промывали насыщенным водным раствором карбоната натрия (20 мл), затем насыщенным раствором хлорида натрия (20 мл). Смесь высушивали над сульфатом магния и фильтровали. Растворители фильтрата удаляли в вакууме для получения коричневого смолянистого вещества, которое очищали флэш-хроматографией, элюируя градиентом от 50 до 100% этилацетата в гексане для получения белого твердого вещества (0,235 г, 53%). В охлажденный в ледяной ванне раствор гидрида натрия (60 мас.% в минеральном масле (0,946 г,23,6 ммоль) в DMF (21 мл) в атмосфере азота добавляли по каплям раствор 3-аминопиридазина (1,24 г,13,01 ммоль) в DMF (21 мл). Через несколько минут добавляли раствор 4-нитрофенилового эфира 3-(5 бромпиридин-2-илокси)азетидин-1-карбоновой кислоты (пример 10, стадия 3; 4,66 г, 11,83 ммоль) вDMF. Через 5 мин охлаждающую ванну удаляли и реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1,5 ч. Добавляли насыщенный раствор бикарбоната натрия(500 мл) и смесь экстрагировали EtOAc (4400 мл). Объединенные органические фазы промывали насыщенным раствором хлорида натрия (500 мл), высушивали над сульфатом натрия и фильтровали. Растворители фильтрата удаляли в вакууме для получения сырого продукта, который растирали с диэтиловым эфиром для получения указанного соединения (3,32 г, 80%) в виде бесцветного твердого вещества. Раствор 2-фтор-3-метоксифенилбороновой кислоты (0,065 г, 0,38 ммоль) в THF/H2O (10:1; 2 мл) добавляли в сосуд для СВЧ, содержащий пиридазин-3-иламид 3-(5-бромпиридин-2-илокси)азетидин-1 карбоновой кислоты (приготовленный на стадии 1) (0,100 г, 0,25 ммоль) и карбонат калия (0,105 г, 0,76 ммоль). Через смесь пропускали поток пузырьков азота в течение 5 мин, затем добавляли комплекс 1,1'бис[(дифенилфосфино)ферроцен]дихлорпалладия(II) с CH2Cl2 (0,020 г, 10 мол.%), сосуд герметично закрывали и нагревали при 100C в СВЧ-синтезаторе в течение 30 мин. Охлажденную реакционную смесь разбавляли этилацетатом (20 мл) и последовательно промывали насыщенным водным раствором карбоната натрия (20 мл) и затем насыщенным раствором хлорида натрия (20 мл). Смесь высушивали над сульфатом магния и фильтровали. Растворители фильтрата удаляли в вакууме для получения коричневого смолянистого вещества, которое очищали флэш-хроматографией, элюируя градиентом от 80 до 100% этилацетата в гексане для получения грязно-белого твердого вещества (0,079 г, 78%). В раствор 2-фторбороновой кислоты (1,45 г, 10,36 ммоль) и 2-(1-бензгидрилазетидин-3-илокси)-5 йодпиридина (3,53 г, 7,97 ммоль) в DMF (180 мл) добавляли бикарбонат натрия (2,01 г), суспендированного в воде (20 мл). Реакционную смесь перемешивали в потоке азота в течение 1 ч, затем добавляли комплекс 1,1'-бис[(дифенилфосфино)ферроцен]дихлорпалладия(II) с CH2Cl2 (326 мг, 5 мол.%) и перемешивали в течение 18 ч при комнатной температуре. Реакционную смесь концентрировали в вакууме, разбавляли этилацетатом (400 мл), фильтровали через целит и промывали последовательно насыщенным водным раствором бикарбоната натрия (3150 мл), затем насыщенным раствором хлорида натрия (150 мл). Смесь высушивали над сульфатом магния и фильтровали. Растворители фильтрата удаляли в вакууме и остаток очищали флэш-хроматографией (4% метанола в DCM) для получения указанного соединения (2,18 г, 67%). 4-Нитрофенилхлорформат (734 мг, 3,64 ммоль) добавляли в перемешанный раствор 2-(1 бензгидрилазетидин-3-илокси)-5-(2-фторфенил)пиридина (996 мг, 2,43 моль) в дихлорметане (25 мл) при комнатной температуре. Полученный раствор перемешивали при комнатной температуре в течение 18 ч,разбавляли дихлорметаном (150 мл) и промывали последовательно насыщенным водным раствором бикарбоната натрия (3150 мл), затем насыщенным раствором хлорида натрия (150 мл). Органическую фазу высушивали над сульфатом магния и фильтровали. Растворители фильтрата удаляли в вакууме и остаток очищали растиранием с метил-трет-бутиловым эфиром (25 мл) для получения после фильтрации желтого твердого вещества (786 мг, 79%). В раствор 6-метилпиридазин-3-иламина (60 мг, 0,55 ммоль, Кат. [No 18591-82-7]) в DMF (3 мл) при 0C добавляли гидрид натрия (20 мг, 0,5 ммоль, 60%-ная дисперсия в минеральном масле). После перемешивания при 0C в течение 15 мин по каплям добавляли раствор 4-нитрофенилового эфира 3-[5-(2 фторфенил)пиридин-2-илокси]азетидин-1-карбоновой кислоты (102 мг, 0,25 ммоль) в DMF (4 мл). После перемешивания в течение 16 ч при комнатной температуре реакционную смесь концентрировали в вакууме, разбавляли этилацетатом (50 мл) и промывали последовательно насыщенным водным раствором бикарбоната натрия (250 мл), затем насыщенным раствором хлорида натрия (50 мл). Смесь высушивали над сульфатом магния и фильтровали. Растворители фильтрата удаляли в вакууме и остаток очищали флэш-хроматографией (40% этилацетата в DCM) для получения указанного соединения (48 мг, 49%). В раствор 6-метоксипиридазин-3-иламина (39 мг, 0,31 ммоль, Кат. [No 7252-84-8]) в DMF (3 мл) при 0C добавляли гидрид натрия (20 мг, 0,5 ммоль, 60%-ная дисперсия в минеральном масле). После перемешивания при 0C в течение 15 мин по каплям добавляли раствор 4-нитрофенилового эфира 3-[5(2-фторфенил)пиридин-2-илокси]азетидин-1-карбоновой кислоты (102 мг, 0,25 ммоль) в DMF (4 мл). После перемешивания в течение 16 ч при комнатной температуре реакционную смесь концентрировали в вакууме, разбавляли этилацетатом (50 мл) и промывали последовательно насыщенным водным раствором бикарбоната натрия (250 мл), затем насыщенным раствором хлорида натрия (50 мл). Смесь высушивали над сульфатом магния и фильтровали. Растворители фильтрата удаляли в вакууме и остаток очищали флэш-хроматографией (этилацетат) для получения указанного соединения (35 мг, 37%). В раствор 5-метил[1,3,4]оксадиазол-2-иламина (31 мг, 0,31 ммоль, Кат. [No 52838-39-8]) в DMF (3 мл) при 0C добавляли гидрид натрия (20 мг, 0,5 ммоль, 60%-ная дисперсия в минеральном масле). После перемешивания при 0C в течение 15 мин по каплям добавляли раствор 4-нитрофенилового эфира 3[5-(2-фторфенил)пиридин-2-илокси]азетидин-1-карбоновой кислоты (102 мг, 0,25 ммоль) в DMF (4 мл). После перемешивания в течение 16 ч при комнатной температуре реакционную смесь концентрировали в вакууме, разбавляли этилацетатом (50 мл) и промывали последовательно насыщенным водным раствором бикарбоната натрия (250 мл), затем насыщенным раствором хлорида натрия (50 мл). Смесь высушивали над сульфатом магния и фильтровали. Растворители фильтрата удаляли в вакууме и остаток очищали препаративной ВЭЖХ для получения указанного соединения (10 мг, 11%). В раствор пиридазин-4-иламина (30 мг, 0,31 ммоль, [Кат. No 20744-39-2]) в DMF (3 мл) при 0C добавляли гидрид натрия (20 мг, 0,5 ммоль, 60%-ная дисперсия в минеральном масле). После перемешивания при 0C в течение 15 мин по каплям добавляли раствор 4-нитрофенилового эфира 3-[5-(2-фторфенил)пиридин-2-илокси]азетидин-1-карбоновой кислоты (102 мг, 0,25 ммоль) в DMF (4 мл). После перемешивания в течение 16 ч при комнатной температуре реакционную смесь концентрировали в вакууме, разбавляли этилацетатом (50 мл) и промывали последовательно насыщенным водным раствором бикарбоната натрия (250 мл), затем насыщенным раствором хлорида натрия (50 мл). Смесь высушивали над сульфатом магния и фильтровали. Растворители фильтрата удаляли в вакууме и остаток очищали препаративной ВЭЖХ для получения указанного соединения (15 мг, 16%). Раствор 3,6-дихлор-4-метилпиридазина (3,0 г, 18,40 ммоль) в аммиаке (28-30%; 150 мл) нагревали при 130C в реакторе под давлением в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и экстрагировали дихлорметаном (10100 мл). Органические слои объединяли, высушивали(Mg2SO4), фильтровали и концентрировали для получения смеси указанных соединений (853 мг; 32%). В раствор смеси 6-хлор-4-метилпиридазин-3-иламина и 6-хлор-5-метилпиридазин-3-иламина (143 мг, 1,0 ммоль) в DMF (6 мл) при 0C добавляли гидрид натрия (80 мг, 2,0 ммоль, 60%-ная дисперсия в минеральном масле). После перемешивания при 0C в течение 15 мин по каплям добавляли раствор 4- 25017842 нитрофенилового эфира 3-[5-(2-фторфенил)пиридин-2-илокси]азетидин-1-карбоновой кислоты (204 мг,0,5 ммоль) в DMF (6 мл). После перемешивания в течение 16 ч при комнатной температуре реакционную смесь концентрировали в вакууме, разбавляли этилацетатом (50 мл) и промывали последовательно насыщенным водным раствором бикарбоната натрия (250 мл), затем насыщенным раствором хлорида натрия (50 мл). Смесь высушивали над сульфатом магния и фильтровали. Растворители фильтрата удаляли в вакууме и региоизомеры частично разделяли флэш-хроматографией (4% метанол в DCM) и отдельно гидрогенизировали при атмосферном давлении (10% Pd/C, этанол) для получения региоизомеров после очистки препаративной ВЭЖХ.LCMS (метод A) RT = 1.82 мин; m/z = 380 [M+H]+. Результаты биологического анализа Часть А. Анализ ингибирования FAAH y крыс. Активный фермент FAAH крыс (30-579) изолировали, как описано в литературе. Кодируемую последовательность аминокислот 30-579 крысиного FAAH клонировали в экспрессирующий вектор рЕТ 28 а для обеспечения белка His-tag на N-конце. После экспрессии гистидинилированный (His-tagged) ферментFAAH (30-579) изолировали методом, основанным на Patricelli et al., 1998; Biochemistry vol. 37, p. 15177 с комбинацией хелатирующей сефарозы, гепарин-сефарозы и эксклюзионной хроматографии. Активность FAAH определяли путем измерения высвобождения сильно флуоресцирующего 7 амино-4-метилкумарина (АМС), образованного при гидролизе субстрата арахидоноил-7-амино-4-метилкумаринамида (ААМСА) ферментом FAAH. Ингибирование активности FAAH определяли как процент снижения флуоресценции, определяемой в отсутствие соединения. Анализ проводили в 384-луночном планшете с черными стенками и чистым дном. Предварительно инкубировали 27,5 мкл фермента FAAH (в буфере анализа FAAH: 50 мМ Hepes, 0,01% Triton X-100, 1 мМ EDTA, 0,5 мг/мл BSA (свободная жирная кислота), pH 8,2) при концентрации 120 нМ при увеличении концентрации соединений (2,5 мкл в 100% DMSO) в течение 0, 1 или 3 ч при комнатной температуре. Во все контрольные образцы добавляли 2,5 мкл DMSO (100% FAAH активность) и для "неспецифических" контрольных образцов (0% FAAH активности) использовали 2,5 мкл URB-597, известного ингибитора FAAH активности (при конечной концентрации насыщения 10 мкМ). Затем во все лунки добавляли 20 мкл 7,5 мкМ субстрата ААМСА (в буфере анализа FAAH) и инкубировали при комнатной температуре еще в течение 1,5 ч. Флуоресценцию определяли при длине волны возбуждения 355 нм и длине волны излучения 460 нм с использованием планшет-ридера Flexstation (Molecular Devices, UK). Ингибирование FAAH активности соединениями определяли как процентное снижение в относительных единицах флуоресценции (RFU) по сравнению со "всеми" контрольными образцами (при отсутствии соединения) за вычетом "неспецифических" контрольных образцов. Величины IC50 определяли из 10-точечных кривых зависимости от дозы в XL-Fit с использованием 4-Parameter Logistic Model (сигмоидальная модель доза-отклик). Следующая табл. 1 представляет результаты испытаний после 3-часового инкубирования соединений примеров 1-4 в вышеуказанном анализе ингибирования FAAH у крыс. Таблица 1 Часть В. Анализ человеческого фермента FAAH 1. Активность человеческого фермента FAAH 1 определяли измерением высвобождения сильно флуоресцирующего 7-амино-4-метилкумарина (АМС), полученного при гидролизе субстрата арахидоноил-7-амино-4-метилкумаринамида (ААМСА) ферментом FAAH. Ингибирование активности человеческого фермента FAAH определяли как процентное снижение флуоресценции, определенной при отсутствии соединения. Анализ проводили в 384-луночном планшете с черными стенками и чистым дном. Предварительно инкубировали 27,5 мкл человеческого фермента FAAH 1 (буфер в анализе FAAH: 50 мМ Hepes, 0,01%Triton X-100, 1 мМ EDTA, 0,5 мг/мл BSA (свободная жирная кислота), pH 8,2) при концентрации 10 нМ,с увеличением концентраций соединений (2,5 мкл в 100% DMSO) в течение 1 ч при комнатной температуре. Добавляли 2,5 мкл DMSO для "всех" контрольных образцов (100% FAAH активность) и 2,5 мклURB-597, известного ингибитора FAAH активности (при конечной концентрации насыщения 10 мкМ) использовали для "неспецифических" контрольных образцов (0% FAAH активности). Во все лунки добавляли 20 мкл 7,5 мкМ субстрата ААМСА (в буфере анализа FAAH) и инкубировали при комнатной температуре еще в течение 4 ч. Флуоресценцию определяли при длине волны возбуждения 355 нм и длине волны излучения 460 нм с использованием планшет-ридера Flexstation (Molecular Devices, UK). Ингибирование активности человеческого фермента FAAH 1 соединениями определяли как процент снижения относительных единиц флуоресценции (RFU) по сравнению со "всеми" контрольными образцами(при отсутствии соединения) за вычетом "неспецифических" контрольных образцов. Величины IC50 определяли из 10-точечных кривых зависимости от дозы в XL-Fit с использованием 4-Parameter LogisticModel (сигмоидальная модель доза-отклик). Табл. 2 показывает результаты тестирования после 1-часового инкубирования соединений примеров 5-19 в вышеуказанном анализе ингибирования человеческого фермента FAAH. Таблица 2 Часть С. Модель воспалительной боли при каррагинан-индуцированной термической гипералгезии у крыс. Крыс-самцов линии Wistar оценивали на чувствительность к термической боли путем применения фокусированного светового луча на задние лапы и записи времени отдергивания лапы до и после местной внутрипяточной инъекции каррагинана. Через 3 ч чувствительность к термической боли оценивали снова в обработанных и необработанных задних лапах до введения тестируемого соединения или носителя. В качестве положительного контроля вводили индометацин. Методика. Крыс-самцов линии Sparague Dawley с помеченными хвостами акклиматизировали к ящикам с выдвигающимся полом в 3 разных условиях (за 6, 5 и 1 день до тестирования) в течение по меньшей мере 5 мин для каждого условия. За день до тестирования у крыс создавали привыкание к комнате для тестирования в течение по меньшей мере 30 мин перед тестированием. Крыс помещали в ящик для температурной стимуляции Харгривса и оставляли успокоиться в течение 3-5 мин, после чего подавали стимул подвижным источником теплового излучения. Латентность отдергивания как левой, так и правой задних лап от источника тепла определяли 2 раза (через 3 мин). Среднее значение 2 стимулов записывали как базовое для каждого животного. Крыс 18 и 30 не использовали в исследовании, так как они имели очень вы- 27017842 сокие показания базовых значений, и они были заменены на 61 и 63. Крыс затем переводили на лечение лекарственными препаратами, обеспечивая баланс базовых латентностей в группе. В день тестирования крысы получали внутрипяточную инъекцию лямбда-каррагинана (100 мкл в 1% солевом растворе) или солевой раствор в правую заднюю лапу за 3 ч до тестирования. За 4 ч до тестирования крысам вводили перорально (р.о.) VER-158416 (1, 3 или 10 мг/кг) или носитель (5% EtOH: 95% (1% метилцеллюлоза в воде). Затем за 30 мин до тестирования крысы получали вторую инъекцию индометацина 10 мг/кг или носителя (50% 0,1 М Na2CO3:47,5% фосфатно-буферного солевого раствора(PBS): 2,5% 1 М HCl) внутрибрюшинно (i.p.). В запланированное время тестирования после обработки лекарственным препаратом латентность отдергивания лапы от источника теплового излучения заново оценивали единичным снятием показаний. Например, соединение примера 13, представленное выше, тестировали следующим образом. Крысам внутрипяточно вводили каррагинан в момент времени t=0; соединение примера 13 (1, 3 и 10 мг/кг р.о.) или носитель (5% EtOH:95% (1% метилцеллюлоза в воде) в момент времени t=2 ч; индометацин (10 мг/кг i.p.) или носитель в момент времени t=2,5 ч, и термическую чувствительность измеряли в момент времени t=3 ч. Таким образом, все крысы получили дозы как орально, так и внутрибрюшинно. Соединение примера 13 (1, 3, 10 мг/кг, р.о.) вызывало дозозависимое ингибирование каррагинаниндуцированной термической гиперчувствительности, которая достигала статистической важности (носитель/каррагинановая группа; однофакторная ANOVA с последующими пост-хок тестами НьюманаКейла) при дозах 3 и 10 мг/кг. Соединение не снижало болевую чувствительность ниже нормальных уровней и не влияло на чувствительность противоположной лапы к термической боли. Максимальный эффект соединения был аналогичен эффекту положительного контроля, индометацина. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его фармацевтически приемлемая соль где Ar1 представляет собой возможно замещенный фенил;Ar2 представляет собой фенил, пиридил, пиримидинил, пиразинил, пиридазинил или оксадиазолил,каждый из которых является возможно замещенным; иAr3 представляет собой возможно замещенный бивалентный фенилен или пиридинильный радикал; где любые возможные заместители в Ar1, Ar2 и Ar3 независимо выбраны из хлора, фтора, брома,циклопропила, метила, моно-, ди- или триметила, трифторметила, дифторметила, монофторметила, метокси, этокси, пропокси, бутокси, пентокси, 2-метоксиэтокси, 2-бензилоксиэтокси, 2-гидроксиэтокси,моно-, ди- или трифторметокси, циано, гидрокси, -CO2R1 и -SO2R1, где R1 представляет собой водород,метил или этил; тетразолил; -NR2R3, -CH2NR2R3 и -C(=O)NR2R3, где R2 и R3 независимо представляют собой водород, метил или этил. 2. Соединение по п.1, где Ar2 представляет собой 3-пиридил, пиримидин-4-ил, пиразин-2-ил или пиридазин-3-ил, каждый из которых является возможно замещенным. 3. Соединение по п.1 или 2, где Ar3 представляет собой замещенный бивалентный 1,4-фенилен или 2,5-пиридиниленовый радикал формулыAr3 представляет собой возможно замещенный бивалентный 1,4-фенилен или 2,5-пиридинильный радикал формулыAr1 представляет собой возможно замещенный фенил. 5. Соединение по п.4, у которого Ar1 представляет собой фенил, 2-фторфенил, 3-(2-метоксиэтокси)фенил или 2-метокси-5-(2-метоксиэтокси)фенил. 6. Соединение по п.4 или 5, у которого Ar2 представляет собой пиридазин-3-ил. 7. Фармацевтическая композиция, включающая соединение по любому из пп.1-6, вместе с одним или более фармацевтически приемлемыми носителями и/или вспомогательными веществами. 8. Применение соединения по любому из пп.1-6 для изготовления лекарственного средства для лечения заболевания или состояния, выбранного из острой или хронической боли, головокружения, рвоты,тошноты, расстройства питания, неврологических и психических патологий, острых или хронических нейродегенеративных заболеваний, эпилепсии, нарушений сна, сердечно-сосудистых заболеваний, почечной ишемии, рака, нарушений иммунной системы, аллергических заболеваний, паразитических, вирусных или бактериальных инфекционных заболеваний, воспалительных заболеваний, остеопороза, заболеваний глаз, легочных заболеваний, заболеваний органов ЖКТ, глаукомы, связанной с повышенным внутриглазным давлением, и недержания мочи. 9. Применение по п.8, при котором заболеванием или состоянием является страх, депрессия, боль,воспаление, зуд, нарушение сна или расстройство движения.
МПК / Метки
МПК: C07D 413/14, C07D 401/14, C07D 205/04, C07D 401/12
Метки: производные, применение, азетидина
Код ссылки
<a href="https://eas.patents.su/30-17842-proizvodnye-azetidina-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные азетидина и их применение</a>
Предыдущий патент: Дезинфицирующая композиция
Следующий патент: Жидкие эмульгируемые в воде концентраты действующего вещества
Случайный патент: Фильтр и лицевая маска для устранения физических и/или биологических загрязнений из фильтруемой среды












