Производные азетидина и циклобутана как ингибиторы jak-киназ
Номер патента: 17218
Опубликовано: 30.10.2012
Авторы: Шепард Стейси, Ксиа Майкл, Чжоу Цзячэн, Лю Пинли, Роджерс Джеймс Д., Ли Юнь-Лун, Мелони Дэвид
Формула / Реферат
1. Соединение формул I-III или IV
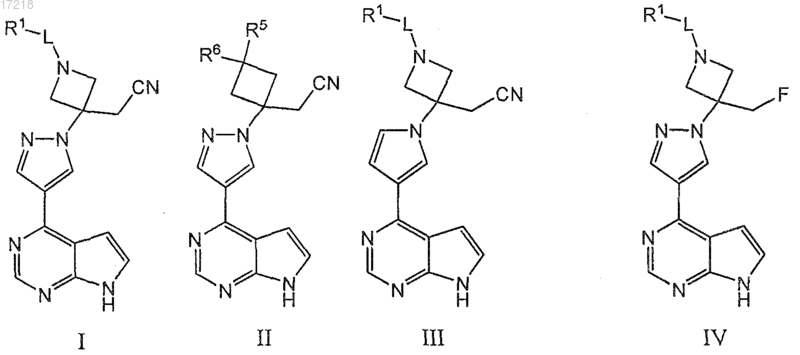
или фармацевтически приемлемая соль указанного соединения,
где L представляет собой SO2 или СО;
R1 представляет собой C1-6алкил, С3-7циклоалкил, фенил, 5- или 6-членный гетероарил, индолил, NR2R3 или OR4, при этом указанный алкил, циклоалкил, фенил или гетероарил возможно содержит 1, 2 или 3 заместителя, независимо выбранных из F, CN и C1-4алкила;
R2 и R3 независимо выбраны из Н, C1-4алкила и фенила;
R4 представляет собой C1-6алкил, фенил или бензил;
R5 и R6 независимо выбраны из Н, F, CN, ОН, C1-4алкила, бензилокси, С2-8диалкиламиносульфонила и 5-членного гетероарила, где указанный алкил возможно содержит 1, 2 или 3 заместителя, независимо выбранных из F, ОН, CN и C1-4алкокси и где указанный 5-членный гетероарил возможно замещен C1-4алкилом;
при этом если L представляет собой SO2, то R1 отличен от OR4, если один из R5 и R6 представляет собой ОН, то другой из R5 и R6 отличен от ОН, CN или F, и если один из R5 и R6 представляет собой С2-8диалкиламиносульфонил, то другой из R5 и R6 отличен от С2-8диалкиламиносульфонила.
2. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что L представляет собой SO2.
3. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что L представляет собой СО.
4. Соединение по любому из пп.1-3 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что R1 представляет собой метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, 2-метилпроп-1-ил, 1-метилпроп-1-ил, каждый из которых возможно содержит в качестве заместителей 1, 2 или 3 F.
5. Соединение по любому из пп.1-3 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что R1 представляет собой C1-4алкил.
6. Соединение по любому из пп.1-3 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что R1 представляет собой этил.
7. Соединение по любому из пп.1-3 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что R1 представляет собой С3-7циклоалкил, возможно содержащий в качестве заместителя C1-4алкил.
8. Соединение по любому из пп.1-3 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что R1 представляет собой фенил, возможно содержащий в качестве заместителя F, метил или CN.
9. Соединение по любому из пп.1-3 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что R1 представляет собой 5-членный гетероарил, выбранный из тиенила, пиразолила, пирролила, 1,2,4-оксадиазолила и изоксазолила, каждый из которых возможно содержит в качестве заместителя C1-4алкил.
10. Соединение по любому из пп.1-3 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что R1 представляет собой пиридинил.
11. Соединение по любому из пп.1-3 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что R1 представляет собой NR2R3 или OR4.
12. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что L представляет собой SO2 и R1 представляет собой C1-6алкил.
13. Соединение по п.1, выбранное из
{1-(этилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
1-(циклопропилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-илацетонитрила;
1-[(1-метилциклопропил)карбонил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-илацетонитрила;
1-[(1-метилциклопропил)сульфонил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-илацетонитрила;
1-(метилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(фенилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(изопропилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(пропилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(бутилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(трет-бутилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
3-(цианометил)-N,N-диметил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-1-сульфонамида;
{1-[(1-метил-1Н-пиразол-3-ил)сульфонил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-1-[(3,3,3-трифторпропил)сульфонил]азетидин-3-ил}ацетонитрила;
{1-(изобутилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(втор-бутилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-[(5-метил-2-тиенил)сульфонил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-[(4-фторфенил)сульфонил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-[(3-фторфенил)сульфонил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-[(2-фторфенил)сульфонил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(пиридин-3-илсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(пиридин-2-илсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(циклопропилкарбонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
1-{(1-метилциклопропил)карбонил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-бензоил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-[(6-метилпиридин-2-ил)карбонил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(пиридин-3-илкарбонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(3-метилбензоил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(4-метилбензоил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
3-({3-(цианометил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-1-ил}карбонил)бензонитрила;
[3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-1-(2-тиенилкарбонил)азетидин-3-ил]ацетонитрила;
[3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-1-(1Н-пиррол-2-илкарбонил)азетидин-3-ил]ацетонитрила;
{1-(1Н-индол-2-илкарбонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(изоксазол-5-илкарбонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
{1-(1Н-пиразол-3-илкарбонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила;
изобутил-3-(цианометил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-1-карбоксилата;
фенил-3-(цианометил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-1-карбоксилата;
бензил-3-(цианометил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-1-карбоксилата;
3-(цианометил)-N-фенил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-1-карбоксамида
или фармацевтически приемлемой соли любого из вышеуказанных соединений.
14. {1-(Этилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрил или фармацевтически приемлемая соль указанного соединения.
15. Соль фосфорной кислоты {1-(этилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила.
16. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, где один из R5 и R6 представляет собой Н, а другой выбран из Н, F, CN, ОН, C1-4алкила, бензилокси, С2-8диалкиламиносульфонила и 5-членного гетероарила, при этом указанный алкил возможно содержит 1, 2 или 3 заместителя, выбранных из F, ОН, CN и С1-4алкокси, и указанный 5-членный гетероарил возможно содержит в качестве заместителя C1-4алкил.
17. Соединение по п.16 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что R5 и R6 независимо выбраны из Н, F, CN, ОН и метила.
18. Соединение по п.16 или фармацевтически приемлемая соль указанного соединения, отличающиеся тем, что R5 и R6 независимо выбраны из Н и CN.
19. Соединение по п.16, выбранное из
3-(цианометил)-N,N-диметил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутансульфонамида;
3-изоксазол-3-ил-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутилацетонитрила;
{3-(3-метил-1,2,4-оксадиазол-5-ил)-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутил}ацетонитрила;
{3-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутил}ацетонитрила;
1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутилацетонитрила;
3-(гидроксиметил)-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутилацетонитрила;
3-(фторметил)-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутилацетонитрила;
3-(дифторметил)-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутилацетонитрила;
2,2'-[1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутан-1,3-диил]диацетонитрила;
3-(цианометил)-1-метил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутанкарбонитрила;
3-(цианометил)-1-(метоксиметил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутанкарбонитрила;
3-(цианометил)-1-(фторметил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутанкарбонитрила;
1,3-бис-(цианометил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутанкарбонитрила;
3-(цианометил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутанкарбонитрила;
3,3-бис-(гидроксиметил)-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутилацетонитрила;
3,3-бис-(фторметил)-1-[4-(7-[2-(триметилсилил)этокси]метил-7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутилацетонитрила;
2,2',2"-[1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутан-1,3,3-триил]триацетонитрила;
3-гидрокси-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутилацетонитрила;
3-фтор-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутилацетонитрила;
3-метил-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутилацетонитрила;
3,3-диметил-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутилацетонитрила;
3-(бензилокси)-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутилацетонитрила
или фармацевтически приемлемой соли любого из вышеуказанных соединений.
20. 3-(Цианометил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутанкарбонитрил или фармацевтически приемлемая соль указанного соединения.
21. цис-3-(Цианометил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутанкарбонитрил или фармацевтически приемлемая соль указанного соединения.
22. транс-3-(Цианометил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутанкарбонитрил или фармацевтически приемлемая соль указанного соединения.
23. Соединение по п.1, которое выбрано из
{1-(этилсульфонил)-3-[3-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиррол-1-ил]азетидин-3-ил}ацетонитрила;
4-{1-[1-(этилсульфонил)-3-(фторметил)азетидин-3-ил]-1Н-пиразол-4-ил}-7Н-пирроло[2,3-d]пиримидина
или фармацевтически приемлемой соли указанных соединений.
24. Фармацевтическая композиция, содержащая соединение по любому из пп.1-23 или фармацевтически приемлемую соль указанного соединения и по меньшей мере один фармацевтически приемлемый носитель.
25. Фармацевтическая композиция по п.24, подходящая для местного применения.
26. Способ лечения аутоиммунного заболевания у пациента, включающий введение указанному пациенту терапевтически эффективного количества соединения по любому из пп.1-23 или фармацевтически приемлемой соли указанного соединения.
27. Способ по п.26, отличающийся тем, что указанное аутоиммунное заболевание представляет собой кожное расстройство, рассеянный склероз, ревматоидный артрит, псориатический артрит, ювенильный артрит, диабет I типа, волчанку, воспалительное заболевание кишечника, болезнь Крона, генерализованную миастению, иммуноглобулиновые нейропатии, миокардит или аутоиммунное расстройство щитовидной железы.
28. Способ по п.27, отличающийся тем, что указанное аутоиммунное заболевание представляет собой ревматоидный артрит.
29. Способ по п.27, отличающийся тем, что указанное аутоиммунное заболевание представляет собой кожное расстройство и проявляется в форме атопического дерматита, псориаза, сенсибилизации кожи, раздражения кожи, кожной сыпи, контактного дерматита или аллергической контактной сенсибилизации.
30. Способ лечения воспалительного заболевания у пациента, включающий введение указанному пациенту терапевтически эффективного количества соединения по любому из пп.1-23 или фармацевтически приемлемой соли указанного соединения.
31. Способ лечения рака у пациента, включающий введение указанному пациенту терапевтически эффективного количества соединения по любому из пп.1-23 или фармацевтически приемлемой соли указанного соединения.
32. Способ по п.31, отличающийся тем, что указанный рак представляет собой солидную опухоль, рак предстательной железы, рак почки, рак печени, рак молочной железы, рак легкого, рак щитовидной железы, саркому Капоши, болезнь Кастлемана, рак поджелудочной железы, лимфому, лейкоз или множественную миелому.
33. Способ лечения ревматоидного артрита у пациента, включающий введение указанному пациенту терапевтически эффективного количества {1-(этилсульфонил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]азетидин-3-ил}ацетонитрила или его фармацевтически приемлемой соли.
34. Способ лечения ревматоидного артрита у пациента, включающий введение указанному пациенту терапевтически эффективного количества 3-(цианометил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклобутанкарбонитрила или его фармацевтически приемлемой соли.
Текст
ПРОИЗВОДНЫЕ АЗЕТИДИНА И ЦИКЛОБУТАНА КАК ИНГИБИТОРЫ JAK-КИНАЗ Изобретение относится к производным азетидина и циклобутана, а также их композициям,способам применения и способам получения, при этом указанные производные представляют собой ингибиторы JAK-киназ, подходящие для лечения JAK-опосредованных заболеваний,включая, например, воспалительные и аутоиммунные расстройства, а также рак. 017218 Область техники Настоящее изобретение относится к производным азетидина и циклобутана, также как к композициям на их основе и способам их применения и получения, которые являются ингибиторами JAK (янускиназ) и могут применяться при лечении заболеваний, опосредованных янус-киназами, включающих,например, воспалительные или аутоиммунные заболевания, также как и раковые заболевания. Уровень техники Протеинкиназы (ПК) представляют собой группу ферментов, которые регулируют различные важные биологические процессы, включающие, среди прочих, клеточный рост, выживание и дифференцировку клеток, образование органов и морфогенез, неоваскуляризацию, заживление и регенерацию тканей. Протеинкиназы выполняют свои физиологические функции путем катализирования фосфорилирования белков (или субстратов) и, таким образом, модулирования клеточных активностей субстратов в различных биологических средах. Помимо участия в нормальных процессах тканей/органов, многие протеинкиназы также играют более специализированные роли в ходе заболеваний человека, включая рак. Подкласс протеинкиназ (которые также называются онкогенными протеинкиназами), в случае их неправильной регуляции, могут вызывать образование и рост опухолей и в дальнейшем способствовать их поддержанию и прогрессированию. На сегодняшний день онкогенные протеинкиназы представляют собой одну из самых больших и наиболее перспективных групп белков-мишеней для борьбы с раковыми заболеваниями и для разработки лекарственных средств. Семейство янус-киназ (JAK) играет роль в зависимой от цитокинов регуляции пролиферации и функционирования клеток, участвующих в иммунном ответе. На сегодняшний день известны четыре представителя семейства JAK у млекопитающих: JAK1 (также известная как янус-киназа-1), JAK2 (также известная как янус-киназа-2), JAK3 (также известная как янус-киназа лейкоцитов; JAKL; L-JAK и янускиназа-3) и TYK2 (также известная как протеинтирозинкиназа 2). JAK белки варьируют в размере от 120 до 140 кДа и содержат семь консервативных доменов гомологии JAK (JH); один из них представляет собой функциональный каталитический киназный домен, а другой является псевдокиназным доменом, вероятно выполняющим регуляторную функцию и/или служащим местом стыковки со STAT белками. Блокировка передачи сигнала на уровне JAK-киназ кажется перспективной для развития методов лечения, например воспалительных заболеваний, аутоиммунных заболеваний, миелопролиферативных заболеваний и раковых заболеваний человека. Также предполагается, что ингибиторы JAK-киназ могут оказывать терапевтически полезное действие на пациентов, страдающих кожными иммунными заболеваниями, такими как псориаз, и сенсибилизацией кожи. Поэтому ингибиторы янус-киназ или родственных им киназ являются необходимыми, и в нескольких публикациях описаны классы эффективных соединений. Например, некоторые ингибиторы JAK-киназ, включая пирролопиридин и пирролопиримидины, описаны в заявке на патент США с серийным номером 11/637545, поданной 12 декабря 2006 г. Таким образом, существует постоянная необходимость в новых или улучшенных агентах, ингибирующих киназы, такие как янус-киназы, для возможности создания новых и более эффективных лекарственных препаратов для лечения рака и других заболеваний. Соединения и способы, описанные в настоящем изобретении, направлены на выполнение этих и других целей. Краткое описание изобретения Настоящее изобретение предлагает, среди прочего, ингибиторы JAK-киназ формул I-IV: или их фармацевтически приемлемые соли, при этом их составляющие определены ниже.-1 017218 Настоящее изобретение дополнительно предлагает фармацевтические композиции, содержащие соединение формул I-IV или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель. Настоящее изобретение дополнительно предлагает методы лечения любого из различных JAKопосредованных заболеваний и нарушений, рассмотренных в настоящем описании, путем введения пациенту терапевтически эффективного количества соединения формул I-III или IV или его фармацевтически приемлемой соли. Настоящее изобретение дополнительно предлагает соединения формул I-IV или их фармацевтически приемлемые соли для применения в терапевтических целях. Настоящее изобретение дополнительно предлагает использование соединений формул I-IV или их фармацевтически приемлемых солей для приготовления лекарственных препаратов для их применения в терапевтических целях. Настоящее изобретение дополнительно предлагает способы приготовления соединений формул I-IV. Подробное описание Настоящее изобретение предлагает, среди прочего, ингибиторы JAK-киназ формулы I или их фармацевтически приемлемые соли,где L представляет собой SO2 или СО;NR R или OR4, при этом указанный алкил, циклоалкил, фенил или гетероарил возможно содержит 1, 2 или 3 заместителя, независимо выбранных из F, CN и C1-4 алкила;R2 и R3 независимо выбраны из Н, С 1-4 алкила и фенила иC1-6 алкил, С 3-7 циклоалкил, фенил, 5- или 6-членный гетероарил или NR2R3, при этом указанный алкил,циклоалкил, фенил или гетероарил возможно содержит 1, 2 или 3 заместителя, независимо выбранных изF и C1-4 алкила. В некоторых вариантах осуществления, если L представляет собой СО, то R1 представляет собой С 3-7 циклоалкил, фенил, 5- или 6-членный гетероарил, индолил, NR2R3 или OR4, при этом указанный циклоалкил, фенил или гетероарил возможно содержит 1, 2 или 3 заместителя, независимо выбранных из CN и С 1-4 алкила. В некоторых вариантах осуществления L представляет собой SO2. В некоторых вариантах осуществления L представляет собой СО. В некоторых вариантах осуществления R1 представляет собой метил, этил, н-пропил, изопропил,н-бутил, трет-бутил, 2-метилпроп-1-ил, 1-метилпроп-1-ил, при этом каждый возможно содержит в качестве заместителя 1, 2 или 3 F. В некоторых вариантах осуществления R1 представляет собой C1-4 алкил. В некоторых вариантах осуществления R1 представляет собой этил. В некоторых вариантах осуществления R1 представляет собой С 3-7 циклоалкил, возможно содержащий в качестве заместителя C1-4 алкил. В некоторых вариантах осуществления R1 представляет собой фенил, возможно содержащий в качестве заместителя F, метил или CN. В некоторых вариантах осуществления R1 представляет собой 5-членный гетероарил, выбранный из тиенила, пиразолила, пирролила, 1,2,4-оксадиазолила и изоксазолила, при этом каждый возможно содержит в качестве заместителя C1-4 алкил. В некоторых вариантах осуществления R1 представляет собой пиридинил. В некоторых вариантах осуществления R1 представляет собой NR2R3 или OR4. В некоторых вариантах осуществления L представляет собой SO2 и R1 представляет собой-2 017218 Настоящее изобретение дополнительно предлагает соединения формулы II или фармацевтически приемлемые соли указанных соединений,где R5 и R6 независимо выбраны из Н, F, CN, ОН, C1-4 алкила, бензилокси,С 2-8 диалкиламиносульфонила и 5-членного гетероарила, при этом указанный алкил возможно содержит 1, 2 или 3 заместителя, выбранных из F, ОН, CN и C1-4 алкокси, и при этом указанный 5-членный гетероарил возможно содержит в качестве заместителя C1-4 алкил. В некоторых вариантах осуществления, если один из R5 и R6 представляет собой ОН, то другой из 5R и R6 отличается от CN и F. В некоторых вариантах осуществления один из R5 и R6 представляет собой Н и другой выбран из Н,F, CN, ОН, C1-4 алкила, бензилокси, С 2-8 диалкиламиносульфонила и 5-членного гетероарила, при этом указанный алкил возможно содержит 1, 2 или 3 заместителя, выбранных из F, ОН, CN и C1-4 алкокси, и где указанный 5-членный гетероарил возможно содержит в качестве заместителя C1-4 алкил. В некоторых вариантах осуществления R5 и R6 независимо выбраны из Н, F, CN, ОН и метила. В некоторых вариантах осуществления R5 и R6 независимо выбраны из Н и CN. Настоящее изобретение дополнительно предлагает соединение формулы III или IV или фармацевтически приемлемую соль указанного соединения,где L представляет собой SO2 или СО;R1 представляет собой C1-6 алкил, С 3-7 циклоалкил, фенил, 5- или 6-членный гетероарил, индолил,NR2R3 или OR4, при этом указанный алкил, циклоалкил, фенил или гетероарил возможно содержит 1, 2 или 3 заместителя, независимо выбранных из F, CN и C1-4 алкила;R2 и R3 независимо выбраны из Н, С 1-4 алкила и фенила иR4 представляет собой C1-6 алкил, фенил или бензил; при этом если L представляет собой SO2, то R1 отличается от OR4. В некоторых вариантах осуществления L представляет собой SO2. В некоторых вариантах осуществления L представляет собой СО. В некоторых вариантах осуществления R1 представляет собой метил, этил, н-пропил, изопропил,н-бутил, трет-бутил, 2-метилпроп-1-ил, 1-метилпроп-1-ил, где каждый возможно содержит в качестве заместителя 1, 2 или 3 F. В некоторых вариантах осуществления R1 представляет собой C1-4 алкил. В некоторых вариантах осуществления R1 представляет собой этил. В некоторых вариантах осуществления R1 представляет собой С 3-7 циклоалкил, возможно содержащий в качестве заместителя C1-4 алкил. В некоторых вариантах осуществления R1 представляет собой фенил, возможно содержащий в качестве заместителя F, метил или CN. В некоторых вариантах осуществления R1 представляет собой 5-членный гетероарил, выбранный из тиенила, пиразолила, пирролила, 1,2,4-оксадиазолила и изоксазолила, где каждый возможно содержит в качестве заместителя C1-4 алкил. В некоторых вариантах осуществления R1 представляет собой пиридинил. В некоторых вариантах осуществления R1 представляет собой NR2R3 или OR4. В некоторых вариантах осуществления L представляет собой SO2 и R1 представляет собой-3 017218 В различных разделах настоящего описания заместители соединений согласно изобретению представлены в виде групп или пределов. Специально предполагается, что изобретение включает каждую и все конкретные комбинации членов таких групп и пределов. Например, термин "C1-6 алкил" в действительности относится к метилу, этилу, С 3-алкилу, С 4-алкилу, С 5-алкилу и С 6-алкилу по отдельности. Следует также понимать, что определенные признаки изобретения, которые для ясности описаны в контексте разных вариантов реализации, могут также быть представлены в комбинации в одном варианте реализации. Напротив, различные признаки изобретения, которые для краткости описаны в контексте одного варианта реализации, могут также быть представлены по отдельности или же в любой подходящей субкомбинации. Термин "алкил", используемый в настоящем описании, относится к насыщенной углеводородной группе с прямой или разветвленной цепью. Примеры алкильных групп включают метил (Me), этил (Et),пропил (например, н-пропил и изопропил), бутил (например, н-бутил, изобутил, втор-бутил, трет-бутил),пентил (например, н-пентил, изопентил, втор-пентил, неопентил) и т.д. Алкильная группа может содержать от 1 до примерно 20, от 2 до примерно 20, от 1 до примерно 10, от 1 до примерно 8, от 1 до примерно 6, от 1 до примерно 4 или от 1 до примерно 3 атомов углерода. Связывающая алкильная группа в настоящем описании называется "алкиленом". Термин "циклоалкил", используемый в настоящем описании, относится к циклическим неароматическим углеводородам, включая циклические алкильные, алкенильные и алкинильные группы. Циклоалкильные группы могут включать моно- и полициклические группы (например, включающие 2, 3 или 4 слитых кольца) и спироциклы. Образующие кольцо атомы углерода циклоалкильной группы могут возможно содержать в качестве заместителя оксо- или сульфогруппы. Циклоалкильные группы также включают циклоалкилидены. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопентенил, циклогексенил, циклогексадиенил, циклогептатриенил, норборнил, норпинил, норкарнил, адамантил и т.д. В некоторых вариантах осуществления циклоалкильная группа представляет собой циклопропил. Также к термину "циклоалкил" относятся группы, которые имеют одно или более ароматических колец, слитых (т.е. имеющих общую связь) с циклоалкильным кольцом, например бензо- или тиенилпроизводные циклопентана, циклопентена, циклогексана и т.д. Циклоалкильная группа, содержащая слитые ароматические кольца, может присоединяться через любой образующий кольцо атом, включая образующий кольцо атом слитого ароматического кольца. Термин "гетероарил", используемый в настоящем описании, относится к ароматическому гетероциклическому соединению, имеющему по меньшей мере один гетероатом в кольце, такой как сера, кислород или азот. Гетероарильные группы включают моноциклические и полициклические (например,имеющие 2, 3 или 4 слитых кольца) системы. Примеры гетероарильных групп включают (но не ограничиваются указанными) пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, фурил, хинолил,изохинолил, тиенил, имидазолил, тиазолил, индолил, пиррил, оксазолил, бензофурил, бензотиенил, бензотиазолил, изоксазолил, пиразолил, триазолил, тетразолил, индазолил, 1,2,4-тиадиазолил, изотиазолил,бензотиенил, пуринил, карбазолил, бензимидазолил, индолинил и т.д. В некоторых вариантах осуществления гетероарил представляет собой пиридинил. В некоторых вариантах осуществления гетероарил представляет собой тиенил, пиразолил, пирролил, 1,2,4-оксадиазолил или изоксазолил. В некоторых вариантах осуществления гетероарил представляет собой индолил. В некоторых вариантах осуществления любой образующий кольцо атом N в гетероарильной группе может быть замещен оксогруппой. В некоторых вариантах осуществления гетероарильная группа имеет от 1 до примерно 20 атомов углерода и в других вариантах осуществления от примерно 3 до примерно 20 атомов углерода. В некоторых вариантах осуществления гетероарильная группа содержит от 3 до примерно 14, от 4 до примерно 14,от 3 до примерно 7 или от 5 до 6 образующих кольцо атомов. В некоторых вариантах осуществления гетероарильная группа имеет от 1 до примерно 4, от 1 до примерно 3 или от 1 до 2 гетероатомов. Термин "бензилокси", используемый в настоящем описании, относится к -О-бензилу. Термин "диалкиламиносульфонил", используемый в настоящем описании, относится к-SO2-N(алкилу)2. Соединения, описанные в настоящем изобретении, могут быть асимметричными (например, иметь один или более стереоцентров). Если иное не указано, то предполагаются все возможные стереоизомеры,такие как энантиомеры и диастереомеры. Соединения согласно настоящему изобретению, которые содержат асимметрично замещенные атомы углерода, могут быть изолированы в оптически активной или рацемической форме. Способы получения оптически активных форм из оптически активного исходного материала, такие как расщепление рацемических смесей или стереоселективный синтез, известны в данной области техники. Многие геометрические изомеры олефинов, изомеры относительно C=N двойной связи и т.д. могут также присутствовать в соединениях, описанных в данном изобретении, и все такие стабильные изомеры рассматриваются в рамках настоящего изобретения. Цис- и транс-геометрические изомеры соединений согласно настоящему изобретению описаны и могут быть изолированы в виде смеси изомеров или в виде отдельных изомерных форм. Там, где соединение, способное к стереоизомерии или геометрической изомерии, обозначено структурно или названо без уточнения специфической R/S или цис/транс конфигурации, подразумеваются все его изомеры.-4 017218 Расщепление рацемических смесей соединений можно проводить с помощью любого из многочисленных способов, известных в данной области техники. Примерный способ включает фракционную перекристаллизацию с использованием хиральной кислоты для расщепления, которая является оптически активной солеобразующей органической кислотой. Подходящими расщепляющими агентами для способов фракционной перекристаллизации являются, например, оптически активные кислоты, такие как D- иL-формы винной кислоты, диацетилвинной кислоты, дибензоилвинной кислоты, миндальной кислоты,яблочной кислоты, молочной кислоты, или различные оптически активные камфорсульфоновые кислоты, такие как -камфорсульфоновая кислота. Другие расщепляющие агенты, подходящие для способов фракционной кристаллизации, включают стереоизомерически чистые формы -метилбензиламина (например, S- и R-формы или диастереомерно чистые формы), 2-фенилглицинола, норэфедрина, эфедрина,N-метилэфедрина, циклогексилэтиламина, 1,2-диаминоциклогексана и т.д. Расщепление рацемических смесей может также проводиться путем элюции на колонке, заполненной оптически активным расщепляющим агентом (например, динитробензоилфенилглицином). Подходящий состав растворителя для элюции может быть определен специалистом в данной области техники. Соединения согласно изобретению также включают таутомерные формы. Таутомерные формы являются результатом перемещения двойной связи на место соседней одинарной связи с сопутствующей миграцией протона. Таутомерные формы включают прототропные таутомеры, которые являются изомерными состояниями протонирования, имеющие одинаковую эмпирическую формулу и общий заряд. Типичные прототропные таутомеры включают пары кетон-енол, амид-имидная кислота, лактам-лактам,амид-имидная кислота, енамин-имин и циклические формы, в которых протон может занимать два или более положений в гетероциклической системе, например 1 Н- и 3 Н-имидазол, 1 Н-, 2 Н- и 4 Н-1,2,4-триазол, 1H- и 2 Н-изоиндол и 1 Н- и 2 Н-пиразол. Таутомерные формы могут находиться в равновесии или могут быть пространственно ограничены одной формой в результате соответствующего замещения. Соединения согласно изобретению также включают гидраты и сольваты, наряду с ангидридными и не сольватированными формами. Термин "соединение", используемый в настоящем описании, включает все стереоизомеры, геометрические изомеры, таутомеры и изотопы представленных структур. Все соединения и их фармацевтически приемлемые соли могут находиться в комплексе с другими веществами, такими как вода и растворители (например гидраты и сольваты), или же могут быть изолированы. Соединения согласно изобретению могут также включать все возможные изотопы атомов, присутствующих в промежуточных или конечных соединениях. К изотопам относятся атомы, имеющие одинаковый атомный номер, но разные массовые числа. Например, изотопы водорода включают тритий и дейтерий. В некоторых вариантах осуществления соединения согласно изобретению и их соли являются по существу изолированными. Под фразой "по существу изолированные" подразумевается, что соединение,по меньшей мере, частично или в значительной степени отделено от окружения, в котором оно было образовано или выявлено. Частичное отделение может относиться, например, к композиции, обогащенной соединением согласно изобретению. Значительное отделение может относиться к композициям, содержащим по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90%, по меньшей мере около 95%, по меньшей мере около 97% или по меньшей мере около 99 вес.% соединения согласно изобретению или его соли. Способы изолирования соединений и их солей являются стандартными и известны в данной области техники. Фраза "фармацевтически приемлемый" используется в данном описании в отношении тех соединений, материалов, композиций и/или дозированных форм, которые согласно обоснованному медицинскому заключению подходят для применения в контакте с тканями человека и животных и не проявляют чрезмерной токсичности, не вызывают раздражения, аллергической реакции и других проблем или осложнений, в соответствии с благоприятным соотношением пользы/риска. Выражения "температура окружающей среды" и "комнатная температура", используемые в настоящем описании, известны в данной области техники и относятся в целом к температуре, например температуре реакции, которая примерно соответствует температуре в комнате, где проводится реакция, например температуре от примерно 20 до примерно 30 С. Настоящее изобретение также включает фармацевтически приемлемые соли соединений, описанных в настоящем изобретении. Термин "фармацевтически приемлемые соли", используемый в настоящем описании, относится к производным предложенных соединений, где исходное соединение модифицировано таким образом, что существующая кислотная или основная группа превращается в форму соли. Примеры фармацевтически приемлемых солей включают (но не ограничиваются указанными) соли неорганических или органических кислот остатков оснований, таких как амины; щелочные или органические соли остатков кислот, таких как карбоновые кислоты; и т.д. Фармацевтически приемлемые соли согласно настоящему изобретению включают стандартные нетоксичные соли исходного соединения,-5 017218 образованные, например, из нетоксичных неорганических или органических кислот. Фармацевтически приемлемые соли согласно настоящему изобретению могут быть получены из исходного соединения,содержащего основную или кислотную группу, с помощью стандартных химических методов. В целом,такие соли могут быть получены при взаимодействии свободной кислотной или основной формы этих соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе или в их смеси; как правило, предпочтительными являются неводные растворы,такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил (АцН, ACN). Списки подходящих солей можно найти в изданиях Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company,Easton, Pa., 1985, p. 1418 и Journal of Pharmaceutical Science, 66, 2 (1977), каждое из которых полностью включено в настоящее описание посредством ссылки. Синтез. Соединения согласно изобретению, включая их соли, могут быть получены с помощью известных методов органического синтеза и согласно любому из многочисленных возможных синтетических путей. Реакции получения соединений согласно изобретению могут проводиться в присутствии подходящих растворителей, которые могут быть с легкостью выбраны специалистом в области органического синтеза. Подходящие растворители могут быть, по существу, нереакционноспособными с исходными веществами (реагентами), промежуточными веществами или продуктами реакции при температурах проведения реакций, например при температурах в пределах от температуры замерзания растворителя до температуры кипения растворителя. Определенная реакция может проводиться в одном растворителе или в смеси более чем одного растворителя. В зависимости от определенной стадии реакции специалистом в данной области техники могут быть выбраны подходящие растворители для конкретной стадии реакции. Процесс получения соединений согласно изобретению может включать введение и удаление защитных агентов для различных химических групп. Необходимость введения и удаления защитных групп и подходящие защитные группы могут быть с легкостью определены специалистом в данной области техники. Химию защитных групп можно найти, например, в издании Т.W. Greene and P.G.M. Wuts,Protective Groups in Organic Synthesis, 3rd Ed., WileySons, Inc., New York (1999), полностью включенном в настоящее описании посредством ссылки. За ходом реакций можно следить с помощью любого подходящего метода, известного в данной области техники. Например, образование продукта можно отслеживать с помощью методов спектроскопии,таких как спектроскопия ядерного магнитного резонанса (например, 1 Н или 13 С), инфракрасная спектроскопия, спектрофотометрия (например, в УФ-области), масс-спектрометрия, или с помощью хроматографических методов, таких как высокоэффективная жидкостная хроматография (ВЭЖХ) или тонкослойная хроматография (ТСХ). Настоящее изобретение предлагает способ получения соединения формулы I, как показано ниже на схемах 1-3. Соответственно, на стадии (i) схемы 1 соединение формулы I получают согласно способу,включающему обработку соединения формулы IaR1 представляет собой C1-6 алкил, С 3-7 циклоалкил, фенил, 5- или 6-членный гетероарил, индолил,NR2R3 или OR4, при этом алкил, циклоалкил, фенил или гетероарил возможно содержит 1, 2 или 3 заместителя, независимо выбранных из F, CN и C1-4 алкила;R2 и R3 независимо выбраны из Н, C1-4 алкила и фенила;R4 представляет собой C1-6 алкил, фенил или бензил иR7 представляет собой защитную группу; при этом если L представляет собой SO2, то R1 отличается от OR4. Подходящие защитные группы R7 включают (но не ограничиваются указанными) защитные группы для аминов, рассмотренные в издании Wuts and Greene, Protective Groups in Organic Synthesis, 4th ed., JohnWileySons: New Jersey, p. 696-887 (в особенности, p. 872-887) (2007), полностью включенном в настоящее описание посредством ссылки. В некоторых вариантах осуществления защитная группа R7 представляет собой группу, устойчивую к условиям для удаления защитной группы R10 на стадии (vi) схемы 2. В некоторых вариантах осуществления защитная группа R7 представляет собой группу, устой-6 017218 чивую к условиям удаления защитной группы R9 на стадии (iv) схемы 1. В некоторых вариантах осуществления R7 представляет собой группу, устойчивую к кислотным условиям при комнатной температуре. В некоторых вариантах осуществления R7 представляет собой группу, которая не удаляется в 1-5 н. соляной кислоте при комнатной температуре, при температуре от примерно 10 до примерно 40 С, при температуре от примерно 15 до примерно 40 С или при температуре от примерно 15 до примерно 30 С. В некоторых вариантах осуществления R7 представляет собой бензилоксикарбонил (КБз, Cbz),2,2,2-трихлорэтоксикарбонил(БОМ, ВОМ) или 2-тетрагидропиранил (ТГП, TGP). В некоторых вариантах осуществления R7 представляет собой 2-(триметилсилил)этоксиметил (СЭМ, SEM). В некоторых вариантах осуществления R7 представляет собой N-пивалоилоксиметил (ПОМ, РОМ). Обработка соединения формулы Ia с удалением группы R7 может быть произведена в соответствии со способами удаления специфических защитных групп для аминов, известными в данной области техники, такими как способы, описанные в издании Wuts and Greene, Protective Groups in Organic Synthesis,4th ed., John WileySons: New Jersey, p. 696-887 (в частности, p. 872-887) (2007), полностью включенном в настоящее описание посредством ссылки. Например, в некоторых вариантах осуществления группа R7 удаляется путем обработки ионом фтора (например, фторидом тетрабутиламмония), соляной кислотой,п-толуолсульфонат пиридиния (PPTS) или кислотой Льюиса (например, тетрафторборатом лития). В некоторых вариантах осуществления обработка заключается в обработке тетрафторборатом лития с последующей обработкой гидроксидом аммония (например, если R7 представляет собой 2-(триметилсилил)этоксиметил). В некоторых вариантах осуществления обработка заключается в обработке основанием (например, если R7 представляет собой N-пивалоилоксиметил). В некоторых вариантах осуществления основание представляет собой гидроксид щелочного металла. В некоторых вариантах осуществления основание представляет собой гидроксид натрия. В некоторых вариантах осуществления обработка заключается в обработке гидроксидом натрия или аммония в растворителе, таком как метанол или вода. В некоторых вариантах осуществления для снятия защитной группы СЭМ проводится мягкая двухстадийная процедура. Субстрат защитной группы СЭМ формулы Ia обрабатывается тетрафторборатом лития (LiBF4) или трифторборат эфиратом в водном ацетонитриле при температуре окружающей среды или при повышенной температуре (в некоторых вариантах осуществления при температуре около 80 С) в течение 10-12 ч. Образующийся в результате соответствующий гидроксиметильный промежуточный продукт затем обрабатывается водным гидроксидом аммония (NH4OH) при комнатной температуре с получением соединения формулы I. В некоторых вариантах осуществления для удаления защитных групп ПОМ используется водный раствор гидроксида натрия (NaOH) или гидроксида лития (LiOH). Таким образом, суспензия защищенного с помощью ПОМ соединения формулы Ia обрабатывается раствором 1 н. водного гидроксида натрия при комнатной температуре в течение 2-3 ч. Желаемый продукт формулы I может быть получен в результате проведения типичной кислотно-основной реакции. Схема 1 На стадии (ii) соединение формулы Ia получают согласно способу, включающему взаимодействие соединения формулы Ib с образованием соединения формулы Ia. Стадия (ii) схемы 1 представляет собой реакцию присоединения по Михаэлю между соединением формулы Ib и соединением формулы Ic. Реакцию присоединения по Михаэлю может стимулировать катализатор реакции Михаэля, такой как основание. В некоторых вариантах осуществления катализатор реакции Михаэля представляет собой галогенид тетраалкиламмония, гидроксид тетраалкиламмония,гуанидин, амидин, гидроксид, алкоксид, силикат, фосфат щелочного металла, оксид, третичный амин,карбонат щелочного металла, бикарбонат щелочного металла, кислый фосфат щелочного металла, фосфин или щелочная соль карбоновой кислоты. В некоторых вариантах осуществления катализатор реакции Михаэля представляет собой тетраметилгуанидин, 1,8-диазабицикло(5,4,0)ундец-7-ен,1,5-диазабицикло(4,3,0)нон-5-ен, 1,4-диазабицикло(2,2,2)октан, гидроксид трет-бутиламмония, гидроксид натрия, гидроксид калия, метоксид натрия, этоксид натрия, трикалийфосфат, силикат натрия, оксид кальция, триэтиламин, карбонат натрия, карбонат калия, бикарбонат натрия, бикарбонат калия, кислый фосфат калия, трифенилфосфин, триэтилфосфин, ацетат калия или акрилат калия. В некоторых вариантах осуществления катализатор реакции Михаэля представляет собой 1,8-диазабицикло(5,4,0)ундец-7-ен(ДБУ). В некоторых вариантах осуществления стехиометрическое или каталитическое количество основания используется для ускорения реакции присоединения по Микаэлю. В некоторых вариантах осуществления реакция проводится в органическом растворителе, таком как ацетонитрил или диметилацетамид, при комнатной температуре в течение 2-6 ч. При оптимальных условиях реакции желаемый продукт присоединения по Микаэлю - соединение формулы Ia - может быть получен с высоким выходом и чистотой. Альтернативно, соединение формулы Ia может быть получено в результате реакции, показанной на стадии (iii) схемы 1. Соответственно, соединение формулы Ia получается согласно способу, включающему взаимодействие соединения формулы Id с соединением формулы R8-L-R1 с образованием соединения формулы Ia; где R8 представляет собой уходящую группу. В некоторых вариантах осуществления R8 представляет собой любую легко уходящую группу, известную в данной области техники. В некоторых вариантах осуществления R8 представляет собой галоген или C1-4 алкокси. В некоторых вариантах осуществления R8 представляет собой хлор.-8 017218 В некоторых вариантах осуществления взаимодействие соединения формулы Id с соединением формулы R8-L-R1 проводится в присутствии основания. В некоторых вариантах осуществления основание представляет собой третичный амин, такой как триэтиламин, диизопропилэтиламин,N-метилморфолин и т.д. В некоторых вариантах осуществления основание представляет собой диизопропилэтиламин. На стадии (iv) схемы 1 соединение формулы Id получается согласно способу, включающему обработку соединения формулы Ie с удалением группы R9 с образованием, таким образом, соединения формулы Id; где R9 представляет собой защитную группу. Подходящие защитные группы R9 включают (но не ограничиваются указанными) защитные группы для аминов, описанные в издании Wuts and Greene, Protective Groups in Organic Synthesis, 4th ed., JohnWileySons: New Jersey, p. 696-887 (в особенности, p. 872-887) (2007), полностью включенном в данное описание посредством ссылки. R9 является защитной группой, которая может быть избирательно удалена в условиях, не затрагивающих защитную группу R7. В некоторых вариантах осуществления R9 представляет собой защитную группу, которая может быть удалена в кислых условиях при комнатной температуре, при температуре от примерно 15 до примерно 40 С или при температуре от примерно 15 до примерно 30 С. В некоторых вариантах осуществления R9 представляет собой C1-6 алкоксикарбонил. В некоторых вариантах осуществления R9 представляет собой трет-бутоксикарбонил. Термин "алкоксикарбонил", используемый в настоящем описании, относится к группе, имеющей формулу -С(=O)О-алкил. Обработка соединения формулы Ie с удалением группы R9 может быть проведена с помощью способов для удаления специфических защитных групп для аминов, известных в данной области техники,таких как способы, описанные в издании Wuts and Greene, Protective Groups in Organic Synthesis, 4th ed.,John WileySons: New Jersey, p. 696-887 (в особенности, p. 872-887) (2007), полностью включенном в настоящее описание посредством ссылки. Подходящие условия обработки не затрагивают защитную группу R7. В некоторых вариантах осуществления обработка включает помещение соединения формулыIe в кислые условия при комнатной температуре, при температуре от примерно 15 до примерно 40 С или при температуре от примерно 15 до примерно 30 С. В некоторых вариантах осуществления обработка соединения формулы Ie включает обработку соляной кислотой в 1,4-диоксане. На стадии (v) схемы 1 соединение формулы Ia получается согласно способу, включающему взаимодействие соединения формулы Ib с образованием соединения формулы Ie. Стадия (v) схемы 1 представляет собой реакцию Михаэля между соединением формулы Ib и соединением формулы If. Реакцию Михаэля может стимулировать катализатор реакции Михаэля, такой как основание. В некоторых вариантах осуществления катализатор реакции Михаэля представляет собой галогенид тетраалкиламмония, гидроксид тетраалкиламмония, гуанидин, амидин, гидроксид, алкоксид,силикат, фосфат щелочного металла, оксид, третичный амин, карбонат щелочного металла, бикарбонат щелочного металла, кислый фосфат щелочного металла, фосфин или соль карбоновой кислоты щелочного металла. В некоторых вариантах осуществления катализатор реакции Михаэля представляет собой тетраметилгуанидин,1,8-диазабицикло(5,4,0)ундец-7-ен,1,5-диазабицикло(4,3,0)нон-5-ен,1,4-диазабицикло(2,2,2)октан, гидроксид трет-бутиламмония, гидроксид натрия, гидроксид калия, метоксид натрия, этоксид натрия, трикалийфосфат, силикат натрия, оксид кальция, триэтиламин, карбонат натрия, карбонат калия, бикарбонат натрия, бикарбонат калия, кислый фосфат калия, трифенилфосфин,-9 017218 триэтилфосфин, ацетат калия или акрилат калия. В некоторых вариантах осуществления катализатор реакции Михаэля представляет собой 1,8-диазабицикло(5,4,0)ундец-7-ен (ДБУ, DBU). В некоторых вариантах осуществления для ускорения реакции Михаэля используется стехиометрическое или каталитическое количество основания. В некоторых вариантах осуществления реакция проводится в органическом растворителе, таком как ацетонитрил или диметилацетамид, при комнатной температуре в течение 2-6 ч. При оптимальных условиях реакции желаемый продукт реакции Михаэля - соединение формулы Ia - может быть получен с высоким выходом и чистотой. На стадии (vi) схемы 2 соединение формулы Ig получается согласно способу, включающему обработку соединения формулы Ig с удалением группы R10 и образованием, таким образом, соединения формулы Ib; где R10 представляет собой защитную группу. Подходящие защитные группы R10 включают (но не ограничиваются указанными) защитные группы для аминов, рассмотренные в издании Wuts and Greene, Protective Groups in Organic Synthesis, 4th ed.,John WileySons: New Jersey, p. 696-887 (в особенности, p. 872-887) (2007), полностью включенном в данное описание посредством ссылки. R10 представляет собой защитную группу, которая может быть избирательно удалена в условиях, не затрагивающих защитную группу R7. В некоторых вариантах осуществления R10 представляет собой защитную группу, которая может быть удалена в кислых условиях при комнатной температуре, при температуре от примерно 15 до примерно 40 С или при температуре от примерно 15 до примерно 30 С. В некоторых вариантах осуществления R10 представляет собой группу,которая удаляется в кислых условиях при комнатной температуре. В некоторых вариантах осуществления R10 представляет собой 1-(этокси)этил, три(С 1-6 алкил)силил (например, трет-бутилдиметилсилил или триизопропилсилил), п-метоксибензил (РМВ), трифенилметил, дифенилметил, гидроксиметил, метоксиметил (MOM), диэтоксиметил или трет-бутилдиметилсилилметил. В некоторых вариантах осуществления R10 представляет собой 1-(этокси)этил. Обработка соединения формулы Ig с удалением группы R10 может быть произведена в соответствии со способами для удаления специфических защитных групп для аминов, известными в данной области техники, такими как способы, описанные в издании Wuts and Greene, Protective Groups in OrganicSynthesis, 4th ed., John WileySons: New Jersey, p. 696-887 (в особенности, p. 872-887) (2007), полностью включенном в данное изобретение посредством ссылки. В некоторых вариантах осуществления обработка заключается в обработке соединения формулы Ig в кислых условиях (например, обработку соляной или трихлоруксусной кислотой) при комнатной температуре, при температуре от примерно 15 до примерно 40 С или при температуре от примерно 15 до примерно 30 С. В некоторых вариантах осуществления обработка заключается в обработке соединения формулы Ig водным раствором от примерно 1 н. до примерно 5 н. соляной кислоты при температуре от примерно 10 до примерно 30 С. На стадии (vii) схемы 2 соединение формулы Ig получают согласно способу, включающему взаимодействие соединения формулы In в присутствии палладиевого катализатора и основания с образованием соединения формулы Ig,где X представляет собой тозилат, трифлат, йод, хлор или бром;Ra и Rb вместе с атомами кислорода, к которым они присоединяются, и атомом бора образуют 5-6-членное гетероциклическое кольцо, возможно содержащее в качестве заместителей 1, 2, 3, или 4- 10017218 Стадия (vii) представляет собой реакцию сочетания Сузуки, которую можно инициировать с помощью ряда палладиевых (Pd(0) и Pd(II катализаторов и проводить в условиях, известных в данной области (см., например, Miyaura and Suzuki, Chem. Rev. 1995, 95, 2457-2483, полностью включенную в данное описание посредством ссылки). В некоторых вариантах осуществления палладиевый катализатор представляет собой Pd(PPh3)4 и Pd(dppf)2Cl2. В некоторых вариантах осуществления палладиевый катализатор представляет собой тетракис-(трифенилфосфин)палладий(0) или тетракис-(три(отолил)фосфин)палладий(0). В некоторых вариантах осуществления палладиевый катализатор представляет собой тетракис-(трифенилфосфин)палладий(0). В некоторых вариантах осуществления количество палладиевого катализатора составляет от примерно 110-4 до примерно 0,1 экв. В некоторых вариантах осуществления количество палладиевого катализатора составляет от примерно 0,0010 до примерно 0,0015 экв. В некоторых вариантах осуществления стехиометрическое отношение соединения формулы Ih к соединению формулы II составляет от примерно 1 до примерно 1,05 или от примерно 1 до примерно 1,35. В некоторых вариантах осуществления растворитель для стадии (vii) включает воду и органический растворитель. В некоторых вариантах осуществления органический растворитель представляет собой 1,4-диоксан, 1-бутанол, 1,2-диметоксиэтан (ДМЭ,DME), 2-пропанол, толуол или этанол или их смесь. В некоторых вариантах осуществления органический растворитель включает смесь 1-бутанола и ДМЭ. В некоторых вариантах осуществления основание представляет собой неорганическое основание. В некоторых вариантах осуществления основание представляет собой органическое основание. В некоторых вариантах осуществления основание представляет собой карбонат щелочного металла или гидрокарбонат щелочного металла. В некоторых вариантах осуществления основание представляет собой карбонат калия (K2CO3). В некоторых вариантах осуществления используют от 2 до 5 экв. основания (например, K2CO3). В некоторых вариантах осуществления используют от 2 до 5 экв. основания (например,NaHCO3). В некоторых вариантах осуществления проводят реакцию сочетания Сузуки при температуре от примерно 80 до примерно 100 С. В некоторых вариантах осуществления реакцию осуществляют в течение 2-12 ч. В некоторых вариантах осуществления Ra и Rb, вместе с атомами кислорода, к которым они присоединяются, и атомом бора, образуют группу В некоторых вариантах осуществления X представляет собой хлор, бром или йод. В некоторых вариантах осуществления X представляет собой хлор. На стадии (viii) схемы 2 соединение формулы Ih получается при введении в соединение формулы It защитной группы R7. Группа R7 выбрана согласно вышеследующему описанию. В некоторых вариантах осуществления 7R представляет собой 2-(триметилсилил)этоксиметил. В некоторых вариантах осуществления R7 представляет собой N-пивалоилоксиметил. Введение защитной группы R7 может осуществляться согласно способам введения защитных групп для аминов, известным в данной области техники (см., например, Wuts and Greene, ссылка приведена выше). Например, азот индола может быть депротонирован основанием (например, гидридом натрияN,N-диметилацетамиде (ДМА при низкой температуре (например, от примерно 0 до примерно 5 С) перед обработкой электрофилом, таким как триметилсилилэтоксиметилхлорид (СЭМ-Cl) или пивалоилоксиметилхлорид (ПОМ-Cl). Защищенный с помощью СЭМ или ПОМ 4-хлор-7H-пирроло[2,3d]пиримидин может далее быть изолирован или же получен in situ как исходный материал для последующей реакции Сузуки с последующей очисткой или без нее. Соединение формулы Ic может быть получено согласно способам, представленным ниже на схеме 3. Соответственно, на стадии (ix) схемы 3 соединение формулы Ic получают способом, включающим взаимодействие соединения или его соли формулы Ik или его соли с соединением формулы R8-L-R1 в присутствии основания с образованием соединения формулы Ic; где R8 представляет собой уходящую группу.- 11017218 Группа R8 может представлять собой любую известную в данной области техники подходящую уходящую группу для введения группы, содержащей сульфонил или карбонил. В некоторых вариантах осуществления R8 представляет собой галоген или C1-4 алкокси. В некоторых вариантах осуществленияR8 представляет собой хлор, бром или йод. В некоторых вариантах осуществления R8 представляет собой хлор. В некоторых вариантах осуществления основание представляет собой третичный амин, такой как триэтиламин, диизопропилэтиламин, N-метилморфолин и т.д. В некоторых вариантах осуществления основание представляет собой диизопропилэтиламин. В некоторых вариантах осуществления соль соединения формулы Ik представляет собой хлористо-водородную соль. Соединение формулы If может быть получено путем введения подходящей защитной группы R9 для аминогруппы соединения формулы Ik в соответствии со способами, известными в данной области техники (см., например, Wuts and Greene, выше). Альтернативно, соединение формулы Im может использоваться вместо соединения формулы If. На стадии (х) схемы 3 соединение формулы Ik получается согласно способу, включающему обработку соединения формулы Im для удаления группы -C(=O)OR11 с образованием, таким образом, соединения формулы Ik; где R11 представляет собой C1-6 алкоксикарбонил. В некоторых вариантах осуществления R11 представляет собой трет-бутоксикарбонил (БОК). В некоторых вариантах осуществления обработка соединения формулы Im включает любой способ, известный в данной области техники, для удаления алкоксикарбонильной группы от амина (например, группы БОК) (см., например, Wuts and Greene, Protective Groups in Organic Synthesis, 4th ed., John WileySons:New Jersey, p. 696-887 (в особенности, p. 872-887) (2007), полностью включенную в настоящее описание посредством ссылки). В некоторых вариантах осуществления обработка соединения формулы Im включает обработку водной соляной кислотой. Схема 3 На стадии (xi) схемы 3 соединение формулы Im получают согласно способу, включающему взаимодействие соединения формулы In с реагентом Виттига, содержащим цианометильную или цианометилилидную группу, с образованием соединения формулы Im. Термин "реагент Виттига", используемый в настоящем описании, относится к реагентам, используемым в реакции Виттига, реакции Уэдсворта-Эммонса и реакции Хорненра-Виттига, как описано в данной области техники (см., например, Carey and Sundberg, Advanced Organic Chemistry, Part B:Reactions and Synthesis, 4th ed., Kluwer Academic/Plenum Publishers: New York, p. 111-119 (2001); March,Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 3rd ed., John WileySons: New York,p. 845-855 (1985), каждая из которых полностью включена в настоящее описание посредством ссылки). Типичные реагенты Виттига, содержащие цианометильную или цианометилилидную группу, включают(но не ограничиваются указанными) соединения общей формулы (R'O)2P(=O)-L-R1, R"3P(+)-L(-)-R1,- 12017218R"2P(=O)-L-R1 и (R'N)2P(=O)-L-R1, где R' представляет собой C1-6 алкокси или возможно замещенный фенил; R" представляет собой возможно замещенный фенил; L представляет собой -СН 2- или -СН- иR1 представляет собой цианогруппу. В некоторых вариантах осуществления реагент Виттига представляет собой диэтилцианометилфосфат. В некоторых вариантах осуществления соединение формулы In реагирует с реагентом Виттига в присутствии основания. В некоторых вариантах осуществления основание является сильным основанием. В некоторых вариантах осуществления основание представляет собой трет-бутоксид калия, третбутоксид натрия, гидрид натрия, этоксид натрия, гидроксид натрия, карбонат калия или карбонат натрия. В некоторых вариантах осуществления основание представляет собой алкоксид щелочного металла. В некоторых вариантах осуществления основание представляет собой трет-бутоксид щелочного металла. В некоторых вариантах осуществления основание представляет собой трет-бутоксид калия. В некоторых вариантах осуществления олефинирование кетона азетидина формулы In с реагентом Виттига проводится в органическом растворителе, таком как ТГФ, в присутствии основания, такого как трет-бутокспд калия, при температуре от примерно 0 до примерно 5 С. Азетидиноны формулы In могут быть получены с помощью модифицированного метода, предложенного Гертнером (Gaertner, J. Org. Chem., 1967, 32, 2972) (см., например, стадии (xii)-(xiv. В одном варианте реализации "частичное" образование азетидинолов формулы Io, защищенных соответствующими карбаматами, из соединений формулы Ip при условиях каталитического гидрогенолиза в присутствии электрофила, такого как ди-трет-бутилдикарбонат, упрощает процесс получения защищенных азетидинолов по сравнению с другими модифицированными способами (Zhengming, Chen et al., WO 00/63168). Катализируемое ТЕМПО окисление защищенных азетидинолов формулы Io до соответствующих кетонов формулы In обеспечивает практически 100% выход при мягких условиях реакции. Как бифункционализированные соединения, N-защищенные азетидиноны формулы Io являются очень полезными синтетическими посредниками для получения сложных органических молекул. Соответственно, на стадии (xii) схемы 3 соединение формулы In получают согласно способу, включающему обработку соединения формулы Io окисляющим агентом с образованием соединения формулы In. Термин "окисляющий агент", используемый в настоящем описании, относится к одному или более окислителям, которые, как известно в данной области, окисляют вторичные спирты до кетонов (см., например, Carey and Sundberg, Advanced. Organic Chemistry, Part B: Reactions and Synthesis, 4th ed., KluwerAcademic/Plenum Publishers: New York, p. 747-757, полностью включенную в настоящее описание посредством ссылки). В некоторых вариантах осуществления окисляющий агент включает окислительпереходный металл, включая (но не ограничиваясь указанными) хромовый (VI) реагент (например, реагент Коллинза, бихромат пиридиния (ПБХ) или хлорхромат пиридиния (РСС, перманганат калия, диоксид марганц а(IV), рутениевый (II) реагент (например, RuCl2(п-цимен)2), тетраоксид рутения или комбинацию диоксида марганца (IV), рутениевого (II) реагента и бензохинона; ДМСО и электрофильный реагент, такой как карбодиимидный реагент (например, дициклогексилкарбодиимид), уксусный ангидрид,ангидрид трифторуксусной кислоты, оксалилхлорид или триоксид серы; диметилсульфид иN-хлорсукцинимид; ДМСО и хлор; или реагент Десс-Мартина. В некоторых вариантах осуществления окисляющий агент включает 2,2,6,6-тетраметилпиперидин-1-оксил (ТЕМПО) и стехиометрический окислитель (например, гипохлорит натрия или N-хлорсукцинимид (NXC. В некоторых вариантах осуществления окисляющий агент включает ТЕМПО и гипохлорит натрия. На стадии (xiii) схемы 3 соединение формулы Io получается способом, включающим взаимодействие соединения формулы Ip в условиях каталитического гидрирования с образованием соединения формулы Io. В некоторых вариантах осуществления условия каталитического гидрирования включают присутствие газообразного водорода и Pd/C катализатора.(а) взаимодействие соединения формулы Ir с образованием галоидной соли соединения формулы Ip;(b) обработка соли соединения формулы Ip основанием с образованием соединения формулы Ip; где X1 представляет собой галоген. В некоторых вариантах осуществления X1 представляет собой хлор. Настоящее изобретение также предлагает способ получения соединения формулы I, включающий следующие стадии:(а) взаимодействие соединения формулы Ih в присутствии тетракис-(трифенилфосфин)палладия(0) и карбоната щелочного металла или гидрокарбонатного основания щелочного металла с образованием соединения формулы Ig(b) обработка соединения формулы Ig с удалением группы R10 с образованием соединения формулы Ib(с) взаимодействие соединения формулы Ib с соединением формулы Ic в присутствии каталитического или стехиометрического количества 1,8-диазабицикло(5,4,0)ундец-7-ена с образованием соединения формулы Ia(d) обработка соединения формулы Ia с удалением группы R7 с образованием соединения формулы IX представляет собой хлор. Настоящее изобретение также предлагает способ получения соединения формулы I, включающий следующие стадии:(а) взаимодействие соединения формулы Ih в присутствии тетракис-(трифенилфосфин)палладия(0) и карбоната щелочного металла с образованием соединения формулы Ig(b) обработка соединения формулы Ig с удалением группы R10 с образованием соединения формулы Ib(с) взаимодействие соединения формулы Ib в присутствии каталитического или стехиометрического количества 1,8-диазабицикло(5,4,0)ундец-7-ена с образованием соединения формулы Ie(d) обработка соединения формулы Ie с удалением группы R9 с образованием, таким образом, соединения формулы Id(е) взаимодействие соединения формулы Id с соединением формулы R8-L-R1 с образованием соединения формулы Ia(f) обработка соединения формулы Ia с удалением группы R7 с образованием соединения формулы IX представляет собой хлор. Способы могут использоваться для получения любого из соединений, описанных в вариантах осуществления в данном изобретении, или их комбинаций, или любого из соединений примеров. Настоящее изобретение предлагает любую комбинацию отдельных способов для получения соединения формулы I,соединения формулы Ia и т.д. Настоящее изобретение также предлагает любые из промежуточных соединений вышеуказанных соединений или их соли. В некоторых вариантах осуществления соединение формулы I, полученное согласно способам или их комбинации, представляет собой 1-(этилсульфонил)-3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Нпиразол-1-ил]азетидин-3-илацетонитрил. Настоящее изобретение также предлагает каждое из соответствующих промежуточных соединений формул Ia, Ib, Ic и т.д. для получения 1-(этилсульфонил)-3-[4(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]азетидин-3-илацетонитрила.- 16017218 В некоторых вариантах осуществления способы также включают взаимодействие соединения формулы I с фосфорной кислотой с образованием фосфорнокислой соли. Соль фосфорной кислоты соединения формулы I может быть получена путем обработки раствора соответствующего свободного основания в органическом растворителе, таком как этанол (EtOH), раствором фосфорной кислоты в органическом растворителе, таком как этанол, при комнатной температуре или при повышенной температуре (например, от примерно 60 до примерно 70 С). Полученная неочищенная фосфорнокислая соль может затем быть также очищена путем вторичной кристаллизации или ресуспендирования в органическом растворителе или смеси органических растворителей. В некоторых вариантах осуществления соединение, полученное согласно способам, представляет собой соль фосфорной кислоты 1-(этилсульфонил)-3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Нпиразол-1-ил]азетидин-3-илацетонитрила. В некоторых вариантах осуществления соединения формул I-IV могут быть получены в соответствии с синтетическими процессами, описанными ниже в разделе "Примеры". Способы. Соединения согласно изобретению могут модулировать активность одной или более янус-киназ(JAK). Термин "модулировать" относится к способности повышать или снижать активность одного или более членов семейства JAK-киназ. Соответственно, соединения согласно изобретению могут использоваться в способах модулирования JAK-киназ путем взаимодействия JAK с одним или более соединениями или композициями, описанными в настоящем изобретении. В некоторых вариантах осуществления соединения согласно настоящему изобретению могут действовать как ингибиторы одной или более JAKкиназ. В других вариантах осуществления соединения согласно изобретению могут использоваться для модулирования активности JAK-киназы у объекта, нуждающегося в модуляции рецептора, путем введения модулирующего количества соединения формул I-III или IV.JAK-киназы, с которыми связываются настоящие соединения и/или активность которых они модулируют, включают любого из членов семейства JAK-киназ. В некоторых вариантах осуществленияJAK-киназа представляет собой JAK1 или JAK2. В некоторых вариантах осуществления JAK-киназа представляет собой JAK2. В некоторых вариантах осуществления JAK-киназа представляет собой JAK3. Другой аспект настоящего изобретения относится к способам лечения JAK-опосредованных заболеваний или нарушений у объекта (например, пациента) путем введения нуждающемуся в таком лечении объекту терапевтически эффективного количества или дозы соединения согласно настоящему изобретению или его фармацевтической композиции. JAK-опосредованное заболевание может включать любое заболевание, нарушение или патологическое состояние, которое непосредственно или косвенно связано с экспрессией или активностью JAK-киназы, включая гиперэкспрессию и/или аномальные уровни активности. JAK-опосредованное заболевание может также заключаться в любом заболевании, нарушении или патологическом состоянии, которое можно предотвратить, облегчить или вылечить путем модулирования активности JAK. Примеры JAK-опосредованных заболеваний включают заболевания, затрагивающие иммунную систему, включая, например, отторжение органного трансплантата (например, отторжение аллотрансплантата и реакцию "трансплантат против хозяина"). Другие примеры JAK-опосредованных заболеваний включают аутоиммунные заболевания, такие как множественный склероз, ревматоидный артрит, хронический полиартрит у детей, псориатический артрит, диабет I типа, волчанка, псориаз, воспалительное заболевание кишечника, язвенный колит, болезнь Крона, тяжелая псевдопаралитическая миастения, иммуноглобулин-нефропатии, аутоиммунные заболевания щитовидной железы и т.д. В некоторых вариантах осуществления аутоиммунное заболевание представляет собой аутоиммунное буллезное кожное заболевание, такое как обыкновенная пузырчатка (ОП) или буллезный пемфигоид (БП). Другие примеры JAK-опосредованных заболеваний включают аллергические реакции, такие как астма, пищевые аллергии, атопический дерматит и ринит. Другие примеры JAK-опосредованных заболеваний включают вирусные заболевания, такие как вирус Эпштейна-Барра (ВЭБ), гепатит В, гепатит С,ВИЧ, ВТЛЧ 1, вирус ветряной оспы (ВВО) и вирус папилломы человека (ВПЧ). Другие примеры JAK-опосредованных заболеваний или патологических состояний включают кожные заболевания, такие как псориаз (например, псориаз обыкновенный), атопический дерматит, кожная сыпь, кожное раздражение, сенсибилизация кожи (например, контактный дерматит или аллергический контактный дерматит). Например, некоторые вещества, включающие некоторые лекарственные препараты, при местном применении могут вызывать сенсибилизацию кожи. В некоторых вариантах осуществления одновременное или последовательное введение по меньшей мере одного ингибитора JAK-киназ согласно изобретению вместе с агентом, вызывающим нежелательную сенсибилизацию, может быть полезным в лечении таких нежелательных сенсибилизаций или дерматитов. В некоторых вариантах осуществления кожное нарушение лечится с помощью местного применения по меньшей мере одного ингибитора JAK-киназ согласно изобретению.- 17017218 В других вариантах JAK-опосредованное заболевание представляет собой рак, включая рак, для которого характерно образование солидных опухолей (например, рак предстательной железы, рак почки,рак печени, рак поджелудочной железы, рак желудка, рак молочной железы, рак легких, рак головы и шеи, рак щитовидной железы, глиобластома, саркома Капоши, болезнь Кастлемана, меланома и т.д.), рак крови (например, лимфома, лейкемия, такая как острая лимфобластная лейкемия, острая миелогенная лейкемия (ОМЛ) или множественная миелома) и рак кожи, такой как кожная Т-клеточная лимфома(КТКЛ) и кожная В-клеточная лимфома. Типичные кожные Т-клеточные лимфомы включают синдром Сезари и грибовидный микоз.JAK-опосредованные заболевания могут также включать заболевания, характеризующиеся экспрессией мутантных форм JAK2, таких как формы, включающие по меньшей мере одну мутацию в псевдокиназном домене (например, JAK2V617F).JAK-опосредованные заболевания могут также включать миелопролиферативные заболевания(МПЗ), такие как истинная полицитемия (ИП), эссенциальная тромбоцитемия (ЭТ), миелофиброз с миелоидной метаплазией (МММ), хроническая миелоидная лейкемия (ХМЛ), хроническая миеломоноцитарная лейкемия (ХММЛ), гиперэозинофильный синдром (ГЭС), системный мастоцитоз (СМ) и т.д. В некоторых вариантах осуществления миелопролиферативное заболевание представляет собой первичный миелофиброз (ПМФ) или миелофиброз на фоне истинной полицитемии/эссенциальной тромбоцитемии(Post-PV/ET MF). Другие JAK-опосредованные заболевания включают воспаление и воспалительные заболевания. Типичные воспалительные заболевания включают воспалительные заболевания глаз (например, ирит,увеит, склерит, конъюнктивит или связанные с ними заболевания), воспалительные заболевания дыхательных путей (например, верхних дыхательных путей, включая заболевания носа и синусов, такие как ринит или синусит, нижних дыхательных путей, включая бронхит, хроническое неспецифическое заболевание легких и т.п.), воспалительная миопатия, такая как миокардит, и другие воспалительные заболевания. Ингибиторы JAK, описанные в настоящем изобретении, могут также применяться для лечения ишемически реперфузионных повреждений или заболеваний или патологических состояний, связанных с воспалительным ишемическим событием, таким как инсульт или остановка сердца. Ингибиторы JAK,описанные в настоящем изобретении, могут также применяться для лечения анорексии, кахексии или утомляемости, вызванной или связанной с раковым заболеваем. Ингибиторы JAK, описанные в настоящем изобретении, могут также применяться для лечения рестеноза, склеродермии или фиброза. Ингибиторы JAK, описанные в настоящем изобретении, могут также применяться для лечения патологических состояний, связанных с гипоксией или астроглиозом, таких как, например, диабетическая ретинопатия,рак или нейродегенерация. См., например, Dudley, А.С. et al. Biochem. J. 2005, 390 (Pt 2):427-36,Sriram, K. et al. J. Biol. Chem. 2004, 279 (19):19936-47. Epub 2004 Mar 2. Ингибиторы JAK, описанные в настоящем изобретении, могут также применяться для лечения болезни Альцгеймера. Ингибиторы JAK, описанные в настоящем изобретении, могут также применяться для лечения других воспалительных заболеваний, таких как синдром системной воспалительной реакции (ССВР) и септический шок. Ингибиторы JAK, описанные в настоящем изобретении, могут также применяться для лечения подагры и увеличения предстательной железы в результате, например, доброкачественной гипертрофии предстательной железы или доброкачественной гиперплазии предстательной железы. Ингибиторы JAK-киназ, описанные в настоящем изобретении, наряду с другими ингибиторамиJAK, способными влиять на IL-6/STAT3 сигналинг, могут также применяться для лечения связанных с воспалением пролиферативных заболеваний. Было показано, что воспаление связано с развитием определенных типов рака. Например, было показано, что пациенты, страдающие воспалительным заболеванием кишечника, таким как язвенный колит, имеют намного более высокий риск развития рака ободочной и прямой кишки. Эти типы связанных с воспалением раковых заболеваний были названы связанным с колитом раком (САС). Некоторые исследования показали, что IL-6/STAT3 сигналинг участвует в развитии связанного с колитом рака. Например, мышиные дефицитные по STAT3 клетки кишечного эпителия имели сниженную частоту возникновения и размер опухоли на животной модели связанного с колитом рака. Bromberg, et al., "Inflammation and cancer: IL-6 and STAT3 complete the link", Cancer Cell, 15:7980 (2009). Похожие результаты были получены на дефицитных по IL-6 мышах, у которых аденомы развивались реже и имели меньший размер по сравнению с диким типом мышей. Grivennikov, et al., "IL-6tumor microenvironment", Cancer Cell, 15:114-123 (2009). Соответственно, в некоторых вариантах осуществления ингибиторы JAK согласно изобретению и другие ингибиторы, которые влияют на IL-6/STAT3 сигналинг, могут применяться для лечения раковых заболеваний, связанных с воспалением. В некоторых вариантах осуществления рак связан с воспали- 18017218 тельным заболеванием кишечника. В некоторых вариантах осуществления воспалительное заболевание кишечника представляет собой язвенный колит. В некоторых вариантах осуществления воспалительное заболевание кишечника представляет собой болезнь Крона. В некоторых вариантах осуществления связанный с воспалением рак представляет собой связанный с колитом рак. В некоторых вариантах осуществления связанный с воспалением рак представляет собой рак толстой кишки или рак ободочной и прямой кишки. В некоторых вариантах осуществления рак представляет собой рак желудка, карциноидную опухоль желудочно-кишечного тракта, стромальную опухоль желудочно-кишечного тракта (СО-ЖКТ,GIST), аденокарциному, рак тонкой кишки или рак прямой кишки. Помимо соединений, предложенных в настоящем описании, для лечения связанных с воспалением раковых заболеваний могут применяться типичные ингибиторы JAK, которые включают ингибиторы, описанные в патентах США 2006/0106020; 2006/0183906; 2007/0149506; 2007/0135461; 2008/0188500; 2008/0312258; 2008/0312259 и заявке на патент США с серийным номером 12/270135. Ингибиторы JAK можно тестировать на животных моделях на предмет их возможной эффективности для лечения связанных с воспалением раковых заболеваний. Например, связанный с колитом рак может быть вызван у получавших лечение мышей (например, с помощью ингибиторов JAK) или не получавших лечение мышей в соответствии со способами, рассмотренными в Grivennikov, et al., "IL-6 andSTAT3 are required for survival of intestinal epithelial cells and the development of colitis-associated cancer",Cancer Cell, 15:103-111 (2009). За прогрессированием заболевания можно следить путем измерения веса тела и отслеживания признаков аноректального кровотечения и диареи. После усыпления животных участки дистальных отделов толстой кишки удаляются для анализа. В некоторых вариантах осуществления ингибиторы JAK, описанные в данном изобретении, могут также использоваться для лечения синдрома "сухого глаза". Термин "синдром "сухого глаза", используемый в настоящем описании, включает болезненные состояния, рассмотренные в недавнем официальном сообщении Рабочей группы по "сухому глазу" (DEWS), которая определила синдром "сухого глаза" как"многофакторное заболевание, связанное с нарушениями слезоотделения и глазной поверхности, которые приводят к симптомам дискомфорта, ухудшения зрения и нестабильности слезной пленки с вероятностью повреждения поверхности глаза. Оно сопровождается повышенной осмолярностью слезной пленки и воспалением поверхности глаза". Lemp, "The Definition and Classification of Dry Eye Disease:Surface, 5(2), 75-92, April 2007, полностью включенная в настоящее описание посредством ссылки. Синдром "сухого глаза" также иногда называют сухим кератоконъюнктивитом. В некоторых вариантах осуществления лечение синдрома "сухого глаза" включает облегчение определенных симптомов синдрома"сухого глаза", таких как дискомфорт, нарушения зрения, нестабильность слезной пленки, гиперосмолярность слезной пленки и воспаление глазной поверхности. Как отмечено в докладе DEWS, синдром "сухого глаза" можно разделить на два разных класса: синдром "сухого глаза" из-за недостатка воды в слезной жидкости и синдром "сухого глаза" из-за испарения, которые, в свою очередь, включают различные подклассы. Соответственно, в некоторых вариантах осуществления синдром "сухого глаза" представляет собой синдром "сухого глаза" из-за недостатка воды в слезной жидкости (ADDE). В других вариантах синдром сухого глаза представляет собой синдром "сухого глаза" из-за испарения. В других вариантах синдром "сухого глаза" выбран из любого из подклассов синдрома "сухого глаза" из-за недостатка воды в слезной жидкости или синдрома "сухого глаза" из-за испарения или подходящей их комбинации. Как отмечено автором доклада DEWS, однако,различные классы и подклассы не являются взаимно исключающими. Следовательно, синдром "сухого глаза" может возникать по разным механизмам в разных подклассах или же синдром "сухого глаза", относящийся к одному подклассу, может приводить к событиям, которые вызывают синдром "сухого глаза" по механизму, характерному для другого подкласса. Первый класс синдрома "сухого глаза", "сухой глаз" из-за недостатка воды в слезной жидкости(ADDE), также известен как "сухой глаз" из-за недостаточности слезной жидкости и недостаточности слезной железы. Считается, что при недостатке воды в слезной жидкости причиной синдрома "сухого глаза" является недостаточность секреции слезной железы. Без ограничения какой-либо теорией, предполагается, что сухость возникает из-за сниженной секреции слезной железы и объема слезной жидкости, что вызывает гиперосмолярность слезной жидкости. Гиперосмолярность слезной пленки может вызывать гиперосмолярность эпителиальных клеток глазной поверхности, стимулируя воспалительные реакции, вовлекающие различные киназы и сигнальные пути. Два подкласса синдрома "сухого глаза" из-за недостатка воды в слезной жидкости - это синдром"сухого глаза" на фоне болезни Шегрена (SSDE), при котором слезные железы являются мишенью аутоиммунного процесса, и синдром "сухого глаза", не связанный с болезнью Шегрена (NSSDE). Соответственно, в некоторых вариантах осуществления глазное нарушение представляет собой синдром "сухого глаза" на фоне болезни Шегрена. В других вариантах осуществления синдром "сухого глаза" представляет собой синдром "сухого глаза", не связанный с болезнью Шегрена. При синдроме "сухого глаза" на фоне болезни Шегрена считается, что активированные Т-клетки могут инфильтрировать слезные железы,вызывая гибель клеток ацинусов и протоков и гипосекрецию слезной жидкости. Эффекты локально вы- 19017218 свобождающихся цитокинов или циркулирующих антител могут умножать эффекты гипосекреции. Две основные формы синдрома "сухого глаза" на фоне болезни Шегрена - это первичная и вторичная форма. Первичный "сухой глаз" может возникать в комбинации с "сухим ртом" (ксеростомией). Вторичный синдром "сухого глаза" на фоне болезни Шегрена возникает с симптомами первичного, вместе с аутоиммунным заболеванием соединительной ткани, таким как ревматоидный артрит (РА), системная красная волчанка, нодозный полиартериит, гранулематоз Вегенера, системный склероз, первичный билиарный склероз или смешанное заболевание соединительной ткани. Диагностические критерии для каждого из заболеваний соединительной ткани известны в данной области. Кроме того, первичный синдром "сухого глаза" на фоне болезни Шегрена может быть связан с системным проявлением заболевания, которое может вовлекать легкие, почки, печень, кровеносные сосуды и суставы. При синдроме "сухого глаза", не связанном с болезнью Шегрена, исключаются системные аутоиммунные характеристики синдрома "сухого глаза" на фоне болезни Шегрена. Формы синдрома "сухого глаза", не связанного с болезнью Шегрена, включают первичную недостаточность слезных желез (включая возрастной синдром "сухого глаза", врожденную алакримию и семейную дисавтономию), вторичную недостаточность слезных желез (включая воспалительную инфильтрацию слезной железы саркоидной гранулемой, лимфоматозными клетками и СПИД-ассоциированными Т-лимфоцитами; недостаточность,связанную с болезнью "трансплантат против хозяина"; и недостаточность, вызванную удалением слезных желез или денервацией слезных желез), закупорку слезных протоков (включая закупорку, вызванную рубцующимися конъюнктивитами, включая трахому, рубцующийся пемфигоид и пемфигоид слизистых оболочек, полиморфную эритему и химические или тепловые ожоги) и рефлекторную гипосекрецию (включая рефлекторную сенсорную блокаду, такую как блокаду, связанную с ношением контактных линз, сахарным диабетом и нейротрофным кератитом, и рефлекторную моторную блокаду, включая блокаду, связанную с повреждением VII черепно-мозгового нерва, множественным нейрофиброматозом и воздействием системных лекарственных препаратов, таких как антигистамины, бета-блокаторы, спазмолитики, диуретики, трициклические антидепрессанты, селективные ингибиторы обратного захвата серотонина и другие психотропные лекарственные препараты). Второй основной класс заболевания "сухого глаза" - это "сухой глаз" из-за испарения, которое возникает при интенсивной потере воды с открытой глазной поверхности при нормальной секреторной функции слезных желез. Внутренние причины синдрома "сухого глаза" из-за испарения включают дисфункцию мейбомиевой железы (ДМЖ) (включая дисфункцию, вызванную сниженным числом желез изза врожденной недостаточности с приобретенной ДМЖ; ДМЖ, связанную с дистихиазом, дистихиазный лимфостаз и метаплазию; гиперсекреторную ДМЖ, связанную с мейбомиевой себореей, гиперсекреторную ДМЖ, связанную с ретиноидной терапией, первичную и вторичную обструктивную ДМЖ, фокальную или диффузную обструктивную ДМЖ, простую или рубцовую обструктивную ДМЖ, атрофическую или воспалительную обструктивную ДМЖ; обычную ДМЖ, первичную или вторичную по отношению к переднему краевому блефариту, розацеа, себорейный дерматит, синдрому ectrodactyly, синдрому Тернера, системной токсичности от 13-цис-ретиноевой кислоты, полихлорированные дифенилы и эпинефрин; и рубцовую ДМЖ, первичную или вторичную по отношению к химическим ожогам, пемфигоиду, розацеа, полиморфной эритеме, ВКК и АКК), изменения глазной щели и нарушение движения век или соответствия век и глазного яблока (например, встречающиеся при краниостенозе, эндокринной и других формах проптоза, миопии и после пластических операций на веках), и низкую частоту моргания (включая вызванную экстрапирамидальным расстройством, таким как болезнь Паркинсона). Внешние причины синдрома "сухого глаза" из-за испарения включают заболевания глазной поверхности (включая ксерофтальмию, вызванную недостаточностью витамина А; и заболевания, ассоциированные с лекарственными препаратами местного действия и антисептиков, таких как местная анестезия и хлорид бензалкония), ношение контактных линз, заболевание глазной поверхности (включая аллергическую болезнь глаз), аллергический конъюнктивит (включая внесезонный аллергический кератоконъюнктивит, весенний кератоконъюнктивит и атопический кератоконъюнктивит) и использование антигистаминных препаратов. Пациенты, нуждающиеся в лечении синдрома "сухого глаза", могут быть выявлены при помощи различных диагностических методов, известных в данной области, включающих диагностические методы, рассмотренные в Bron, et al., "Methodologies to Diagnose and Monitor Dry Eye Disease: Report of theDiagnostic Methodology Subcommittee of the International Dry Eye Workshop (2007)", The Ocular Surface,5(2), 108-152 (April 2007), полностью включенных, таким образом, в данное описание посредством ссылок. Методы включают (но не ограничиваются указанными):(1) опросный лист симптомов (например, Begley, et al., "Use of the dry eye questionnaire to measure(2) окраску поверхности глаза для выявления поверхностных повреждений (например, бенгальским розовым или флуоресцеином или с использованием других методов окраски, таких как методы, рассмотренные в Barr et al., "Corneal scarring in the Collaborative Longitudinal Evaluation of Keratoconus (CLEK)(3) измерение скорости разрушения слезной пленки для проверки стабильности слезной пленки (например, Abelson, et al., "Alternate reference values for tear film break-up time in normal and dry eye(4) тест Ширмера (оценка слезного тока, вызванного рефлекторно, при помещении фильтровальной бумаги в конъюнктивальный мешок) (например, van Bijsterveld, "Diagnostic tests in the sicca syndrome".(5) измерение осмолярности слез (например, Farris, "Tear osmolarity a new gold standard" Adv Exp(6) измерение радиуса слезного мениска, высоты и площади поперечного сечения для выявления недостаточности воды в слезной жидкости (например, Cermak et al., "Is complete androgen insensitivity(7) интерферометрию липидного слоя слезной пленки для выявления синдрома "сухого глаза" из-за недостаточности воды в слезной жидкости или прекорниальной недостаточности липидного компонента слезной жидкости (Danjo et al., "Observation of precorneal tear film in patients with Sjogren's syndrome", Acta(8) систему анализа стабильности слезной пленки (TSAS) для выявления нестабильности слезной пленки (например, Goto et al., "Tear Film Stability Analysis System: Introducing a new application for(9) мейбометрию для выявления дисфункции мейбомиевых желез (например, Chew et al., "An(10) мейбографию или мейбоскопию для оценки дисфункции мейбомиевых желез (например,Kaercher, "Ocular symptoms and signs in patients with ectodermal dysplasia symdromes", Grafes Arch Clin Exp(11) метод щеточной цитологии (например, Fukagawa et al., "Histological evaluation of brush cytology(12) проточную цитометрию в импрессионной цитологии для выявления воспаления конъюнктивы(13) папоротниковый тест для определения качественной композиции слезной жидкости(14) определение индекса защиты глаз (OPI) для оценки защищенности глазной поверхности и риска повреждения глазной поверхности (например, Ousler et al., "Factors that influence the inter-blink interval(15) флуорофотометрию (флуориметрию) тока слезной жидкости для оценки изменений тока слезной жидкости при недостаточности воды в слезной жидкости (ATD) (например, Gobbels et al., "Tear secretion in dry eyes as assessed by objective fluorophotometry. Ger J. Ophthalmol. 1992; 1:350-353; Kuppens etal., "Measurement of basal tear turnover using a standardized protocol", Graefe's Arch Clin Exp Ophthalmol. 1995; 233:1-7; McNamara et al., "Fluorometry in contact lens research: The next step", Optom Vis Sci. 1998; 75:316-322; Pearce, "An improved fluorophotometric method for tear turnover assessment", Optom Vis Sci. 2001; 78:30-36),и комбинации этих диагностических тестов; содержание каждого источника полностью включено в настоящее описание посредством ссылки. Эти методы также могут использоваться для определения клинической эффективности соединений,описанных в настоящем описании, при лечении синдрома "сухого глаза". В другом аспекте настоящее изобретение предлагает способ лечения конъюнктивита, увеита (включая хронический увеит), хориодита, ретинита, циклита, склерита, эписклерита или ирита; лечения воспаления или боли, связанной с трансплантацией роговицы, ЛАСИК (LASIK) (лазерным кератомилезом),фоторефракционной кератэктомией или ЛАСЕК (LASEK) (лазерной эпителиокератэктомией); способ подавления потери остроты зрения, связанной с трансплантацией роговицы, ЛАСИК, фоторефракционной кератэктомией или ЛАСЕК; или способ подавления отторжения трансплантата у пациента, в этом нуждающегося, включающий введение пациенту терапевтически эффективного количества соединения формулы I, или его фармацевтически приемлемой соли, или N-оксида. В некоторых вариантах осуществления соединение, или его фармацевтически приемлемая соль, или N-оксид вводится предоперационно пациенту, подготовленному к процедуре, выбранной из трансплантации роговицы, ЛАСИК, фоторефракционной кератэктомии и ЛАСЕК. В некоторых вариантах осуществления соединение, или его фармацевтически приемлемая соль, или N-оксид подавляет или снижает воспаление или боль во время и после процедуры. В некоторых вариантах осуществления соединение, или его фармацевтически приемлемая соль, или N-оксид вводится в течение от примерно 1 до примерно 2 дней до проведения процедуры. В некоторых вариантах осуществления соединение, или его фармацевтически приемлемая соль, илиN-оксид вводится послеоперационно пациенту, который прошел процедуру, выбранную из трансплантации роговицы, ЛАСИК, фоторефракционной кератэктомии и ЛАСЕК. В некоторых вариантах осуществления подавление потери остроты зрения означает снижение потери остроты зрения. В некоторых вариантах осуществления послеоперационное или предоперационное лечение снижает количество рубцовых или фиброзных отложений после проведения процедуры. В некоторых вариантах осуществления подавление потери остроты зрения означает, что пациент сохраняет остроту зрения. В некоторых вариантах осуществления подавление отторжения трансплантата означает, что соединение, или его фармацевтически приемлемая соль, или N-оксид обладает иммуносупрессорным действием, таким образом предотвращая полное отторжение трансплантата роговицы. Термин "контактирование", используемый в настоящем описании, относится к сближению указанных веществ в условиях in vitro или в условиях in vivo. Например, "контактирование" JAK-киназы с соединением согласно изобретению включает введение соединения согласно настоящему изобретению объекту или пациенту, такому как человек, имеющему JAK-киназы, также как, например, введение соединения согласно изобретению в пробу, содержащую клеточный или очищенный препарат, содержащий- 23017218 Термины "объект" или "пациент", используемые в настоящем описании, используются взаимозаменяемо и относятся к любому животному, включая млекопитающих, предпочтительно мышей, крыс, других грызунов, кроликов, собак, кошек, свиней, крупный рогатый скот, овец, лошадей или приматов, и наиболее предпочтительно человека. Фраза "терапевтически эффективное количество", используемая в настоящем описании, относится к количеству активного соединения или фармацевтического агента, который вызывает биологический или медицинский ответ в ткани, системе, животном, объекте или человеке, ожидаемый исследователем, ветеринаром, врачом или другим клиницистом. Термины "проведение лечения" или "лечение", используемые в настоящем описании, относятся к одному или более из следующего:(1) предотвращение заболевания, например предотвращение заболевания, патологического состояния или нарушения, у объекта, который может быть предрасположен к заболеванию, патологическому состоянию или нарушению, но еще не испытывает на себе или не проявляет признаков патологии или симптомы заболевания;(2) подавление заболевания, например подавление заболевания, патологического состояния или нарушения у объекта, испытывающего или проявляющего признаки патологии или симптомы заболевания,патологического состояние или нарушения;(3) смягчение заболевания, например смягчение заболевания, патологического состояния или нарушения у объекта, испытывающего или проявляющего признаки патологии или симптомы заболевания,патологического состояния или нарушения (т.е. обращение патологии и/или симптомов), такое как снижение тяжести заболевания. Комбинированные терапии. Один или более дополнительных фармацевтических агентов, таких как, например, химиотерапевтические, противовоспалительные агенты, стероиды, иммуносупрессоры, так же как и ингибиторы киназWO 2006/056399 или другие агенты, могут использоваться в комбинации с соединениями согласно настоящему изобретению для лечения JAK-опосредованных заболеваний, нарушений или патологических состояний. Один или более дополнительных фармацевтических агентов могут вводиться пациенту одновременно или последовательно. Типичные химиотерапевтические агенты включают протеосомные ингибиторы (например, бортезомиб), талидомид, ревлимид и ДНК-повреждающие агенты, такие как мелфалан, доксорубицин, циклофосфамид, винкристин, этопозид, кармустин и т.д. Типичные стероиды включают кортикостероиды, такие как дексаметазон или преднизон. Типичные ингибиторы Bcr-Abl включают соединения и их фармацевтически приемлемые соли, относящиеся к типам и семействам, описанным в патенте США 5521184, WO 04/005281 и заявке на патент США с серийным номером 60/578491. Типичные подходящие ингибиторы Flt-3 включают соединения и их фармацевтически приемлемые соли, описанные в WO 03/037347, WO 03/099771 и WO 04/046120. Типичные подходящие ингибиторы RAF включают соединения и их фармацевтически приемлемые соли, описанные в WO 00/09495 и WO 05/028444. Типичные подходящие ингибиторы FAK включают соединения и их фармацевтически приемлемые соли, описанные в WO 04/080980, WO 04/056786, WO 03/024967, WO 01/064655, WO 00/053595 иWO 01/014402. В некоторых вариантах осуществления одно или более соединений согласно изобретению могут применяться в комбинации с одним или более другими ингибиторами киназной активности, включая иматиниб, в особенности для лечения пациентов, невосприимчивых к иматинибу или другим ингибиторам киназ. В некоторых вариантах осуществления один или более ингибиторов JAK согласно изобретению мо'гут применяться в комбинации с химиотерапевтическими агентами при лечении раковых заболеваний, таких как множественная миелома, и могут усиливать ответную реакцию на лечение по сравнению с ответом только на химиотерапевтический агент, без обострения его токсических эффектов. Примеры дополнительных фармацевтических агентов, используемых для лечения множественной миеломы, например, могут включать, без ограничений, мелфалан, мелфалан плюс преднизон [MP], доксорубицин,дексаметазон и Velcade (бортезомиб). Другие дополнительные агенты, используемые для лечения множественной миеломы, включают ингибиторы киназ Bcr-Abl, Flt-3, RAF и FAK. Желаемым результатом комбинирования ингибиторов JAK согласно настоящему изобретению с дополнительным агентом является аддитивный или синергический эффект. Кроме того, невосприимчивость клеток множественной миеломы к агентам, таким как дексаметазон, может быть преодолена при лечении ингибиторами JAK согласно настоящему изобретению. Агенты могут комбинироваться с настоящими соединениями в лекарственной форме для однократного введения или в лекарственной форме для продолжительного введения или же агенты могут вводиться одновременно или после введения соединений в отдельных лекарственных формах.- 24017218 В некоторых вариантах осуществления кортикостероиды, такие как дексаметазон, вводятся пациенту в комбинации по меньшей мере с одним ингибитором JAK, где дексаметазон вводится периодически(в отличие от непрерывного введения). В некоторых других вариантах осуществления комбинация одного или более ингибиторов JAK согласно изобретению с другими терапевтическими агентами может вводиться пациенту до, во время и/или после трансплантации костного мозга или трансплантации стволовых клеток. В некоторых вариантах осуществления по меньшей мере один дополнительный терапевтический агент может применяться для лечения синдрома "сухого глаза" и других заболеваний глаза. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой флуоцинолон ацетонид (Retisert) или римексолон (AL-2178, Vexol, Alcon). В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой циклоспорин (Restasis). В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой кортикостероид. В некоторых вариантах осуществления кортикостероид представляет собой триаминолон, дексаметазон, флуоцинолон, кортизон, преднизолон или флуметолон. В некоторых вариантах осуществления дополнительный терапевтический агент выбран из(Othera), PAI-2 (University of Pennsylvania and Temple University), пилокарпина, такролимуса, пимекролимуса (AMS981, Novartis), этабоната лотепреднола, ритуксимаба, диквафосола тетранатрия (INS365,Inspire), KLS-0611 (Kissei Pharmaceuticals), дегидроандростерона, анакинры, эфализумаба, микофенолата натрия, этанерцепта (Embrel), гидроксихлорохина, NGX267 (TorreyPines Therapeutics) или талидомида. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой антиангиогенный агент, холинергический агонист, модулятор TRP-1 рецептора, блокатор кальциевого канала, стимулятор секреции слизи, стимулятор MUC1, ингибитор кальцинеурина, кортикостероид, агонист P2Y2 рецептора, агонист мускаринового рецептора, другой ингибитор JAK-киназ, ингибитор киназы Bcr-Abl, ингибитор киназы Flt-3, ингибитор киназы RAF и ингибитор киназы FAK, такие как ингибиторы, например, описанные в WO 2006/056399. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой производное тетрациклина (например, миноциклин или доксициклин). В некоторых вариантах осуществления дополнительный терапевтический агент (агенты) представляет собой успокаивающие глазные капли (также известные как "искусственные слезы"), которые включают (но не ограничиваются указанными) композиции, содержащие поливинилспирты, гидроксипропилметилцеллюлозу, глицерин, полиэтиленгликоль (например, PEG400) или карбоксиметилцеллюлозу. Искусственные слезы могут помогать в лечении синдрома "сухого глаза" путем компенсирования недостатка увлажняющей и смазывающей способности слезной пленки. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой муколитическое лекарственное средство, такое как N-ацетилцистеин, который может взаимодействовать с мукопротеинами и, таким образом,снижать вязкость слезной пленки. В некоторых вариантах осуществления дополнительный терапевтический агент включает антибиотики, противовирусные агенты, противогрибковые агенты, анестетики, противовоспалительные агенты,включая стероидные и нестероидные противовоспалительные и противоаллергические агенты. Примеры подходящих лекарственных препаратов включают аминогликозиды, такие как амикацин, гентамицин,тобрамицин, стрептомицин, нетилмицин и канамицин; фторхинолоны, такие как ципрофлоксацин, норфлоксацин, офлоксацин, тровафлоксацин, ломефлоксацин, левофлоксацин, эноксацин; нафтиридин,сульфонамиды; полимиксин; хлорамфеникол; неомицин; парамомицин; колистиметат; бацитрацин; ванкомицин; тетрациклины; рифампицин и его производные ("рифампины"); циклосерин; бета-лактамы; цефалоспорины; амфотерицины; флуконазол; флуцитозин; натамицин; миконазол; кетоконазол; кортикостероиды; диклофенак; флурбипрофен; кеторолак; супрофен; комолин; лодоксамид; левокабастин; нафазолин; антазолин; фенирамиман или азалидный антибиотик. Фармацевтические композиции и дозированные формы При фармацевтическом применении соединения согласно изобретению могут быть представлены в виде фармацевтических композиций. Эти композиции могут быть приготовлены в соответствии с методами, хорошо известными в области фармацевтики, и могут быть получены различными способами в зависимости от того, местное или системное- 25017218 предполагается лечение, и от той области, которую необходимо лечить. Применение может быть местным (включая трансдермальное, эпидермальное, офтальмическое и через слизистые оболочки, включая интраназальную, вагинальную и ректальную доставку), легочным (например, путем ингаляции или инсуффляции порошков или аэрозолей, включая использование небулайзера; интратрахеальным или интраназальным), пероральным или парентеральным. Парентеральное введение включает внутривенное,внутриартериальное, подкожное, внутрибрюшинное, внутримышечное путем инъекции или инфузии или внутричерепное, например интратекальное или внутрижелудочковое, введение. Парентеральное введение может проводиться в форме единичной болюсной дозы или может осуществляться, например, с помощью насоса непрерывной инфузии. Фармацевтические композиции и композиции для местного применения могут включать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории,спреи, жидкости и порошки. При необходимости или при желании могут применяться стандартные фармацевтические носители, жидкие, порошкообразные или маслянистые основы, загустители и т.п. Также могут использоваться кондомы и перчатки с покрытием и т.п. Настоящее изобретение также включает фармацевтические композиции, которые содержат в качестве активного компонента одно или более из вышеуказанных соединений согласно изобретению в комбинации с одним или более фармацевтически приемлемыми носителями (вспомогательными веществами). При создании композиций согласно изобретению активный компонент обычно смешивается со вспомогательным веществом, разбавляется вспомогательным веществом или заключается внутрь такого носителя в форме, например, капсулы, пакета, обертки или другой оболочки. Когда вспомогательное вещество служит в качестве разбавителя, оно может представлять собой твердый, полужидкий или жидкий материал, действующий как основа, носитель или среда для активного компонента. Таким образом, композиции могут быть приготовлены в форме таблеток, драже, порошков, пастилок, пакетов, крахмальных капсул, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (в виде твердого вещества или в жидкой среде), мазей, содержащих, например, вплоть до 10% активного соединения по весу, мягких или твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций и стерильных расфасованных порошков. В ходе приготовления композиции активное соединение может быть измельчено для получения подходящего размера частиц до смешивания его с другими компонентами. Если активное соединение. по существу. является нерастворимым, оно может быть измельчено до частиц размером меньше чем 200 меш. Если активное соединение, по существу, является растворимым в воде, необходимый размер частиц может быть получен путем измельчения с достижением по сути однородного распределения в композиции, например, около 40 меш. Соединения согласно изобретению могут быть измельчены в соответствии с известными методами измельчения, такими как мокрый помол для получения подходящего для образования таблеток и других типов лекарственных форм размера частиц. Мелкодисперсные (в виде наночастиц) препараты соединения согласно изобретению могут быть приготовлены с помощью методов, известных в данной области,например, см. WO 2002/000196. Некоторые примеры подходящих вспомогательных веществ включают лактозу, декстрозу, сахарозу, сорбит, маннит, крахмал, аравийскую камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп и метилцеллюлозу. Композиции могут дополнительно включать смазывающие агенты, такие как тальк, стеарат магния и минеральное масло; увлажняющие агенты; эмульгаторы и суспендирующие вещества; консерванты, такие как метил- и пропилгидроксибензоаты; вкусовые добавки и ароматизаторы. Композиции согласно изобретению могут быть приготовлены таким образом, чтобы обеспечить немедленное, продолжительное или отсроченное высвобождение активного компонента после введения пациенту в соответствии со способами, известными в данной области техники. Композиции могут быть приготовлены в виде дозированной лекарственной формы, каждая доза которой содержит от примерно 5 до примерно 1000 мг (1 г), обычно от около 100 до примерно 500 мг активного компонента. Термин "дозированная лекарственная форма" относится к физически дискретной единице, подходящей для однократного дозирования как человека, так и других млекопитающих, при том, что каждая единица содержит предопределенное количество активного компонента, достаточное для оказания желаемого терапевтического эффекта, в комплексе с растворимым фармацевтическим вспомогательным веществом. Активное соединение может быть эффективным в пределах широкого диапазона доз и, как правило,вводится в фармацевтически эффективном количестве. Необходимо понимать, однако, что количество применяемого соединения в данный момент времени обычно определяется врачом в соответствии со значимыми обстоятельствами, включая патологическо состояние, которое необходимо лечить, выбранный способ введения, вводимое соединение, возраст, вес и реакцию конкретного пациента, тяжесть симптомов пациента и т.д. Для приготовления твердых форм композиций, таких как таблетки, главный активный компонент смешивается с фармацевтическим вспомогательным веществом с образованием твердофазной предварительной композиции, содержащей гомогенную смесь соединения согласно настоящему изобретению. В- 26017218 предварительных композициях, которые называются гомогенными, активный компонент обычно равномерно распределен по составу так, что композиция может быть с легкостью разделена на равные эффективные дозированные лекарственные формы, такие как таблетки, драже и капсулы. Эти твердые предварительные композиции затем разделяются на описанные выше виды дозированных лекарственных форм,содержащие, например, от примерно 0,1 до примерно 1000 мг активного компонента согласно настоящему изобретению. Таблетки или драже согласно настоящему изобретению могут быть покрыты или обработаны другим образом с получением лекарственной формы, позволяющей усилить пролонгированное действие. Например, таблетки или драже могут включать внутренний и наружный компоненты дозы, последний в форме оболочки вокруг основы. Два компонента могут быть разделены энтеросолюбильным слоем, который служит для сопротивления разрушению в желудке и позволяет внутреннему компоненту проходить интактным в двенадцатиперстную кишку или же способствует отсроченному высвобождению. Разнообразные материалы могут использоваться для таких энтеросолюбильных слоев или покрытий, такие материалы включают ряд полимерных кислот и смеси полимерных кислот с такими материалами, как шеллак, цетиловый спирт и ацетатцеллюлоза. Жидкие формы, в которые соединения и композиции согласно настоящему изобретению могут быть включены для перорального введения или инъекции, включают водные растворы, соответствующим образом ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии пищевых масел, таких как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, такие как эликсиры и подобные фармацевтические носители. Композиции для ингаляции или инсуффляции включают растворы и суспензии в фармацевтически приемлемых водных или органических растворителях или их смеси и порошки. Жидкие или твердые композиции могут включать подходящие фармацевтически приемлемые вспомогательные вещества, как описано выше. В некоторых вариантах осуществления композиции вводят пероральным или назальным респираторным путем для местного или системного эффекта. Композиции могут распыляться с использованием инертных газов. Распылительные смеси могут вдыхаться прямо из распыляющего устройства или распыляющее устройство может присоединяться к лицевой маске или дыхательной машине перемежающегося положительного давления. Композиции в виде растворов, суспензий или порошков могут вводиться перорально или назально с помощью устройств для доставки композиций соответствующим образом. Количество вводимого пациенту соединения или композиции будет различаться в зависимости от самого соединения или композиции, цели его введения, такой как профилактика или лечение, состояния пациента, способа введения и т.д. В лечебных целях композиции могут вводиться уже страдающему заболеванием пациенту в количестве, достаточном для того, чтобы вылечить или, по меньшей мере, частично сдержать симптомы заболевания или его осложнения. Эффективные дозы будут зависеть от заболевания, которое необходимо лечить, так же как и от решения лечащего врача в зависимости от факторов, таких как тяжесть заболевания, возраст, вес и общее состояние пациента и т.д. Композиции, вводимые пациенту, могут быть представлены в виде фармацевтических композиций,описанных выше. Эти композиции могут быть стерилизованы с помощью метода конвенционной стерилизации или могут быть стерильно фильтрованы. Водные растворы могут быть упакованы в готовой для использования форме или быть лиофилизованными, при этом лиофилизованный препарат смешивается со стерильным жидким носителем до введения. Значение pH композиций соединения, как правило, составляет между 3 и 11, более предпочтительно от 5 до 9 и наиболее предпочтительно от 7 до 8. Необходимо понимать, что использование определенных из вышеперечисленных вспомогательных веществ,носителей или стабилизаторов приводит к образованию фармацевтических солей. Терапевтическая доза соединения согласно настоящему изобретению может варьировать в соответствии, например, с конкретным предназначением лечения, способом введения соединения, здоровья и общего состояния пациента и решения лечащего врача. Пропорция или концентрация соединения согласно изобретению в фармацевтической композиции может меняться в зависимости от набора факторов, включающих дозу, химические характеристики (например, гидрофобность) и способ введения.Например, соединения согласно изобретению могут вводиться в жидком физиологическом буферном растворе, содержащем от примерно 0,1 до примерно 10% соединения для парентерального введения в соотношении вес к объему. Некоторые типичные диапазоны доз составляют от примерно 1 мкг/кг до примерно 1 г/кг веса тела в сутки. В некоторых вариантах осуществления диапазон доз составляет от примерно 0,01 до примерно 100 мкг/кг веса тела в сутки. Дозировка, вероятно, зависит от таких различий, как тип и интенсивность прогрессирования заболевания или нарушения, общее состояние здоровья конкретного пациента, относительная биологическая эффективность выбранного соединения, наличие в композиции вспомогательных веществ и способ введения. Эффективные значения дозы могут экстраполироваться с кривых зависимости доза-эффект, полученных на in vitro или животных модельных тестовых системах. В некоторых вариантах осуществления соединение согласно изобретению или его фармацевтически приемлемая соль представляет собой офтальмологическую композицию. Соответственно, в некоторых вариантах осуществления способы включают предоставление соединения или его фармацевтически при- 27017218 емлемой соли и офтальмологически приемлемого носителя. В некоторых вариантах осуществления офтальмологическая композиция представляет собой жидкую композицию, полужидкую композицию,вкладку, пленку, микрочастицы или наночастицы. В некоторых вариантах осуществления офтальмологическая композиция представляет собой жидкую композицию. В некоторых вариантах осуществления офтальмологическая композиция представляет собой полужидкую композицию. В некоторых вариантах осуществления офтальмологическая композиция представляет собой композицию для местного применения. Композиции для местного применения включают (но не ограничиваются) жидкие и полужидкие композиции. В некоторых вариантах осуществления офтальмологическая композиция представляет собой композицию для местного применения. В некоторых вариантах осуществления композиции для местного применения включает водный раствор,водную суспензию, мазь или гель. В некоторых вариантах осуществления офтальмологическая композиция имеет местное применение на переднюю часть глаза, под верхнее веко, на нижнее веко и в слепой мешок. В некоторых вариантах осуществления офтальмологическая композиция стерилизована. Стерилизация может быть проведена в соответствии с известными методами, такими как стерильная фильтрация раствора или нагревание раствора в готовой для использования ампуле. Офтальмологические композиции согласно изобретению могут также включать фармацевтические вспомогательные вещества, подходящие для приготовления офтальмологических композиций. Примерами таких вспомогательных веществ являются консерванты, буферные вещества, хелатирующие агенты, антиоксиданты и соли для регуляции осмотического давления. При использовании в данном описании термин "офтальмологически приемлемый носитель" относится к любому материалу, который может содержать и высвобождать соединение, или его фармацевтически приемлемую соль, или его N-оксид, которое является совместимым с тканью глаза. В некоторых вариантах осуществления офтальмологически приемлемый носитель представляет собой воду, или водный раствор, или суспензию, но также включает масла, такие как масла, используемые для создания мазей и полимерных матриксов, таких, какие используются в глазных вкладках. В некоторых вариантах осуществления композиция может представлять собой водную суспензию, содержащую соединение, или его фармацевтически приемлемую соль, или N-оксид. Жидкие офтальмологические композиции, включая как мази, так и суспензии, могут иметь вязкость, которая подходит для выбранного способа применения. В некоторых вариантах осуществления офтальмологическая композиция имеет вязкость в пределах от примерно 1000 до примерно 30000 сП. В некоторых вариантах осуществления жидкая композиция включает также полимер. Эти полимеры могут использоваться для усиления биодоступности, повышения вязкости или снижения оттока из глаза жидкой композиции. В некоторых вариантах осуществления полимеры включают (но не ограничиваются указанными) полимеры, описанные в Wagh, et al., "Polymers used in ocular dosage form and drugdelivery systems", Asian J. Pharm., p. 12-17 (Jan. 2008), полностью включенной в данное описание посредством ссылки. В некоторых вариантах осуществления полимер представляет собой гиалуронат натрия,хитозан, циклодекстрин (например, гидроксипропил -циклодекстрин), полигалактуроновую кислоту,ксилоглюкан, ксантановую смолу, геллановую камедь, тиомер, поли(ортоэфир) (например, как описано вEinmahl, Adv. Drug. Deliv. Rev. 53:45-73 (2001), включенной в данное описание посредством ссылки в полном объеме) или полисахарид из семян тамаринда (например, как описано в Ghelardi, et al., Antimicrob. Agents Chemother. 48:3396-3401 (2004), полностью включенной в настоящее описание посредством ссылки). В некоторых вариантах осуществления офтальмологические композиции могут также включать один или более поверхностно-активных веществ, адъювантов, буферов, антиоксидантов, добавок, регулирующих тонус веществ, консервантов (например, ЭДТА, БАХ (хлорид бензалкония), хлорид натрия,перборат натрия, поликватерний-1), загустителей или модификаторов вязкости (например, карбоксиметилцеллюлозу, гидроксиметилцеллюлозу, поливиниловый спирт, полиэтиленгликоль, гликоль 400, пропиленгликоль, гидроксипропилгуар, гиалуроновую кислоту и гидроксипропилцеллюлозу) и т.д. Дополнительные компоненты композиции могут включать, но не ограничиваются указанными, хлорид натрия,бикарбонат натрия, сорбиновую кислоту, метилпарабен, пропилпарабен, хлоргексидин, касторовое масло и перборат натрия. Водные офтальмологические композиции (растворы или суспензии) в целом не содержат физиологически или офтальмологически вредных составляющих. В некоторых вариантах осуществления в композиции используется очищенная или деионизированная вода. Значение pH можно изменять путем добавления любых физиологически и офтальмологически приемлемых для выравнивая pH кислот, оснований или буферов до значений в пределах от примерно 5,0 до 8,5. Примеры офтальмологически приемлемых кислот включают уксусную, борную, лимонную, молочную, фосфорную, соляную кислоты и т.п., и примеры оснований включают гидроксид натрия, фосфат натрия, борат натрия, цитрат натрия, ацетат натрия, лактат натрия, трометамин, трис-гидроксиметиламинометан и т.д. Соли и буферы включают цитрат/декстрозу, бикарбонат натрия, хлорид аммония и смеси вышеперечисленных кислот и оснований.- 28017218 В некоторых вариантах осуществления осмотическое давление офтальмологической композиции может принимать значение от примерно 10 до примерно 400 мОсм или от 260 до примерно 340 мОсм. В некоторых вариантах осуществления осмотическое давление может корректироваться с помощью подходящих количеств физиологически и офтальмологически приемлемых солей или вспомогательных веществ. В других вариантах осуществления может использоваться хлорид натрия для приближения значений осмотического давления к значениям физиологической жидкости. В других вариантах осуществления композиция включает хлорид натрия в пределах от примерно 0,01 до примерно 1% или от примерно 0,05 до примерно 0,45% от общего веса композиции. Эквивалентные количества одной или более солей,образованных из катионов, таких как калий, аммоний и т.п., и анионов, таких как хлорид, цитрат, аскорбат, борат, фосфат, бикарбонат, сульфат, тиосульфат, бисульфат, бисульфат натрия, сульфат аммония и т.п., могут также использоваться в дополнение или вместо хлорида натрия для достижения значений осмолярности в вышеуказанных пределах. Подобным образом, такие сахара, как маннит, декстроза, сорбит,глюкоза и т.п., могут также использоваться для выравнивания осмолярности. В некоторых вариантах осуществления способы включают образование или обеспечение депо терапевтического агента на внешней поверхности глаза. Депо относится к источнику терапевтического агента, который не быстро удаляется слезной жидкостью или другими механизмами очистки глаза. Это позволяет в течение длительного времени поддерживать высокие концентрации терапевтического агента в жидкости на открытой поверхности глаза при однократном применении. Без ограничений какой-либо теорией, предполагается, что абсорбция и проникновение могут зависеть как от концентрации растворенного лекарственного средства, так и продолжительности контакта наружной ткани с жидкостью, содержащей лекарственное средство. По мере того как лекарственное средство удаляют путем замещения глазной жидкости и/или абсорбции в ткань глаза, поступает больше лекарственного средства (например,растворяется) в пополняющуюся глазную жидкость из депо. Соответственно, применение депо может позволить наносить на глазную поверхность более нерастворимые терапевтические агенты. В некоторых вариантах осуществления депо может сохраняться вплоть до 8 ч или больше. В некоторых вариантах осуществления формы офтальмологического депо включают (но не ограничиваются указанными) водные полимерные суспензии, мази и твердые вкладки. В некоторых вариантах осуществления полужидкая композиция представляет собой жидкую композицию, вязкость которой увеличивается при контакте с глазом, обычно из-за присутствия полимера в жидкой композиции. Повышение вязкости может быть вызвано изменением температуры, pH или концентрации электролитов. В некоторых вариантах осуществления полимер включает (но не ограничивается) полимеры, описанные для полужидких лекарственных форм в Wagh, et al., "Polymers used in oculardosage form and drug delivery systems", Asian J. Pharm., p. 12-17 (Jan. 2008), полностью включенной в данное описание посредством ссылки. В некоторых вариантах осуществления полимер представляет собой целлюлозацетофталат, полиакриловую кислоту, геллановую камедь, гиалуроназу, хитозан, соли альгиновой кислоты (например, альгинат натрия) или блок-сополимер оксида этилена и оксида пропилена (например, Pluronic, BASF; полоксамер). В некоторых вариантах полиакриловая кислота является сшитой акриловой кислотой (например, Carbopol). В некоторых вариантах осуществления полужидкая композиция включает смесь карбопола и блок-сополимер оксида этилена и оксида пропилена; смесь метилцеллюлозы и гидроксиэтилцеллюлозы или смесь полиэтиленгликоля и блок-сополимера оксида этилена и оксида пропилена. В некоторых вариантах осуществления офтальмологическая композиция представляет собой мазь или гель. В некоторых вариантах осуществления офтальмологическая композиция представляет собой систему доставки на масляной основе. В некоторых вариантах осуществления композиция включает нефтяную основу или ланолиновую основу, к которой добавляется активный компонент, обычно 0,1-2%,и вспомогательные вещества. Типичные основы могут включать (но не ограничиваются указанными) минеральное масло, вазелин и их комбинации. В некоторых вариантах осуществления мазь применяется как накладка на нижнее веко. В некоторых вариантах осуществления изобретения офтальмологическая композиция представляет собой офтальмологическую вкладку. В некоторых вариантах осуществления офтальмологическая вкладка является биологически инертной, мягкой, биоразлагаемой, вязкоэластичной, устойчивой к стерилизации после взаимодействия с терапевтическими агентами, устойчивой к инфицированию переносимыми по воздуху бактериями, биоразлагаемой, биосовместимой и/или вязкоэластичной. В некоторых вариантах осуществления вкладка включает офтальмологически приемлемый матрикс, например полимерный матрикс. Матрикс, как правило, представляет собой полимер, и терапевтический агент распределен внутри него или связан с полимерным матриксом. В некоторых вариантах осуществления терапевтический агент может медленно высвобождаться из матрикса путем растворения или гидролиза ковалентной связи. В некоторых вариантах осуществления полимер является биоразлагаемым (растворимым), и скорость его растворения может контролировать скорость высвобождения терапевтического агента, распределенного внутри него. В другой форме полимерный матрикс представляет собой биодеградируемый полимер, который разрушается по типу гидролиза с высвобождением, таким образом, терапевтического
МПК / Метки
МПК: C07D 487/04, A61P 35/00, A61K 31/437
Метки: азетидина, ингибиторы, jak-киназ, производные, циклобутана
Код ссылки
<a href="https://eas.patents.su/30-17218-proizvodnye-azetidina-i-ciklobutana-kak-ingibitory-jak-kinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Производные азетидина и циклобутана как ингибиторы jak-киназ</a>
Предыдущий патент: Способ нагрева в стеклоплавильной печи с низким содержанием nox при высокой теплопередаче
Следующий патент: Способ и устройство для непрерывного контроля внутренних областей оборудования и трубопроводов бензохранилища
Случайный патент: Полиморфная, кристаллическая и мезофазная формы 2-(5-бром-4-(4-циклопропилнафталинил-1-ил)-4н-1,2,4-триазол-3-илтио)ацетата натрия и их применение












