Производные замещенных 3-фенил-1-(фенилтиенил)пропан-1-онов и 3-фенил-1-(фенилфуранил)пропан-1-онов, их получение и применение
Формула / Реферат
1. Соединение общей формулы (I)
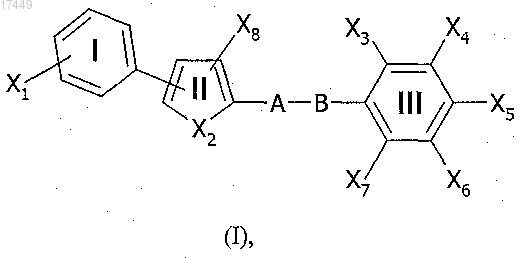
в которой X1 представляет собой галоген, R1, -SR1 или -OR1 группу;
Х2 представляет собой атом серы или кислорода;
Х3 представляет собой галоген, R3, -SR3 или -OR3 группу;
Х4 представляет собой галоген, R4, -SR4 или -OR4 группу;
Х5 представляет собой Y, -S-Y или -O-Y, где Y является группой R5-COOR12 или R5-CONR12R13;
Х6 представляет собой галоген, R6, -SR6 или -OR6 группу;
Х7 представляет собой галоген, R7, -SR7 или -OR7 группу;
R1 представляет собой водород или алкил, имеющий от 1 до 4 атомов углерода, указанный алкил необязательно является галогенированным 1-3 атомами галогена;
R3, R4, R6, R7 и Х8, которые могут быть одинаковыми или разными, выбирают из водорода или алкила, имеющего от 1 до 4 атомов углерода;
R5 представляет собой линейную (С1-С4)алкильную группу, возможно замещенную 1-2 заместителями, выбранными из (С1-С4)алкильной, (С1-С4)алкенильной или фенильной групп;
А представляет собой:
(i) карбонил (СО),
(ii) оксим (C=N-O-H) или оксим эфирную группу (C=N-O-R11), где R11 выбирают из атома водорода, алкила (линейного или разветвленного), имеющего от 1 до 7 атомов углерода, замещенного или не замещенного арилом, указанные алкил и арил необязательно являются галогенированными 1-3 атомами галогена, или
(iii) -CHOR11, где R11 выбирают из атома водорода или алкила (линейного или разветвленного), имеющего от 1 до 7 атомов углерода, указанный алкил не замещен или замещен циклоалкилом, арилом, или гетероарилом, указанные алкил, циклоалкил, арил или гетероарил необязательно являются галогенированными 1-3 атомами галогена;
В представляет собой:
(i) CH2-CH2 группу;
(ii) CH=CH группу,
циклоалкил означает алкильную группу, образующую одно кольцо с 3-8 атомами углерода;
арил означает ароматическую группу, состоящую из 6, 8, 10, 12 или 14 атомов углерода и представляющую собой моно- или бицикл;
гетероарил означает ароматическую группу, состоящую из 3-14 атомов углерода, прерываемых одним или более гетероатомами, выбранными из N, О, S и Р, и
когда группа при необходимости галогенирована, она является замещенной группой 1-3 атомами галогена;
его стереоизомеры (диастереомеры, энантиомеры), чистые или смешанные, рацемические смеси, геометрические изомеры, соли или смеси.
2. Соединение по п.1, где Х5 представляет собой -OR5, где R5 представляет собой алкил, указанная углеродная цепь которого связана с -COOR12 заместителем.
3. Соединение по п.1 или 2, где Х5 выбирают из групп -OC(CH3)2COOR12, -OCH(CH2CH3)COOR12,
-O(CH2)3C(CH3)2COOR12, -OCH(C6H5)COOR12 и -OCH2COOR12.
4. Соединение по любому из пп.1-3, где А представляет собой карбонил С=О.
5. Соединение по любому из пп.1-3, где А представляет собой -CHOR11, где R11 выбирают из атома водорода, метильной, этильной, изопропильной, циклогексилметильной, бензильной, иодобензильной и пиридинилметильной групп.
6. Соединение по любому из пп.1-3, где А представляет собой C=N-O-R11, где R11 выбирают из атома водорода и метильной группы.
7. Соединение по любому из пп.1-6, где кольцо II замещено кольцом I в положении С4.
8. Соединение по любому из пп.1-6, где кольцо II замещено кольцом I в положении С5.
9. Соединение по любому из пп.1-8, где X1 находится в пара-положении относительно положения кольца II.
10. Соединение по любому из пп.1-9, где X1 выбирают из трифторметильной группы, атома брома, метилокси, метилтио и трифторметокси и атома водорода.
11. Соединение по любому из пп.1-10, где по меньшей мере одна из групп Х3, Х4, Х6 и Х7 представляет собой атом галогена.
12. Соединение по любому из пп.1-11, где Х3 и Х4 являются одинаковыми и соответствуют атомам галогена.
13. Соединение по любому из пп.1-12, где Х3 и Х4 являются одинаковыми и соответствуют атомам хлора или фтора.
14. Соединение по любому из пп.1-13, где по меньшей мере одна из групп Х3, Х4, Х6 и Х7 представляет собой атом галогена, оставшаяся группа(ы) среди Х3, Х4, Х6 и Х7 представляет собой атом водорода или атомы водорода.
15. Соединение по любому из пп.1-10, где Х4 и/или Х6 представляют собой алкильную группу.
16. Соединение по любому из пп.1-10, где Х4 и Х6 представляют собой две метильные группы, а Х3, Х7 являются атомами водорода.
17. Соединение по любому из пп.1-16, выбираемое из
трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-(2,3-дихлор-4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(2,3-дихлор-4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-(4-(3-(4-иодобензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,3-дихлорфенокси)-2-метилпропаноата;
2-(4-(3-(4-иодобензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,3-дихлорфенокси)-2-метилпропановой кислоты;
2-(4-(3-(бензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,3-дихлорфенокси)-2-метилпропановой кислоты;
трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутаноата;
2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутановой кислоты;
трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(4-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(2,3-дихлор-4-(3-оксо-3-(4-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановая кислота;
метил 5-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2,2-диметилпентаноата;
5-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2,2-диметилпентановой кислоты;
трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)ацетата;
2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)уксусной кислоты;
этил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-фенилацетата;
2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-фенилуксусной кислоты;
трет-бутил 2-(2-хлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(2-хлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-(3-хлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(3-хлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-(2-фтор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(2-фтор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-(2-фтор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)ацетата;
2-(2-фтор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)уксусной кислоты;
2-(2-фтор-4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)уксусной кислоты;
2-(4-(3-(бензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2-фторфенокси)уксусной кислоты;
трет-бутил 2-(2-фтор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутаноата;
2-(2-фтор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутановой кислоты;
2-(2-фтор-4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутановой кислоты;
трет-бутил 2-(2-бром-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутаноата;
2-(2-бром-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутановой кислоты;
трет-бутил 2-(2-бром-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)ацетата;
2-(2-бром-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)уксусной кислоты;
трет-бутил 2-(2-бром-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропано-ата;
2-(2-бром-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)фур-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)фур-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
2-(2,3-дихлор-4-(3-(пиридин-3-илметокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
2-(2,3-дихлор-4-(3-метокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
2-(2,3-дихлор-4-(3-этокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
2-(2,3-дихлор-4-(3-(циклогексилметокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметокси)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметокси)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-(2,3-дифтор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(2,3-дифтор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-(2,6-диметил-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(2,6-диметил-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
2-(2,3-дихлор-4-(3-(гидроксиимино)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
2-(2,3-дихлор-4-(3-(метоксиимино)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-(4-(3-(5-(4-бромфенил)тиен-2-ил)-3-оксопропил)-2,3-дихлорфенокси)-2-метилпропаноата;
2-(4-(3-(5-(4-бромфенил)тиен-2-ил)-3-оксопропил)-2,3-дихлорфенокси)-2-метилпропановой кислоты;
трет-бутил 2-(2,3-дихлор-4-(3-(5-(4-(метилтио)фенил)тиен-2-ил)-3-оксопропил)фенокси)-2-метилпропаноата;
2-(2,3-дихлор-4-(3-(5-(4-(метилтио)фенил)тиен-2-ил)-3-оксопропил)фенокси)-2-метилпропановой кислоты;
2-(2,3-дихлор-4-(3-изопропокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-фенилтиофен-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(2,3-дихлор-4-(3-оксо-3-(5-фенилтиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-метил-2-(2-метил-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиофен-2-ил)пропил)фенокси)пропаноата;
2-метил-2-(2-метил-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиофен-2-ил)пропил)фенокси)пропановой кислоты;
2-(2,3-дихлор-4-(3-гидрокси-3-(4-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
2-(4-(3-(бензилокси)-3-(4-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,3-дихлорфенокси)-2-метилпропановой кислоты;
2-(2,3-дифтор-4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
2-(4-(3-(бензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,3-дифторфенокси)-2-метилпропановой кислоты;
трет-бутил 2-(4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутаноата;
2-(4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутановой кислоты;
трет-бутил 2-метил-2-(4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)пропаноата;
2-(4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
трет-бутил 2-(4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)ацетата;
2-(4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)уксусной кислоты;
2-(4-(3-(бензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2-фторфенокси)бутановой кислоты;
2-(2,3-дихлор-4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)фуран-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
2-(2,3-дихлор-4-(3-метокси-3-(5-(4-(трифторметил)фенил)фур-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
2-(4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,6-диметилфенокси)-2-метилпропановой кислоты;
2-(4-(3-метокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,6-диметилфенокси)-2-метилпропановой кислоты;
этил 2-(2,3-дихлор-4-(3-оксо-3-(5-(3-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(2,3-дихлор-4-(3-оксо-3-(5-(3-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
этил 2-(2,3-дихлор-4-(3-гидрокси-3-(5-(3-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата;
этил 2-(2,3-дихлор-4-(3-метокси-3-(5-(3-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата;
2-(2,3-дихлор-4-(3-гидрокси-3-(5-(4-(трифторметокси)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты;
2-(2,3-дихлор-4-(3-метокси-3-(5-(4-(трифторметокси)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропановой кислоты.
18. Применение соединения по любому из пп.1-17 в качестве лекарственного средства.
19. Фармацевтическая композиция, содержащая в фармацевтически приемлемом носителе по меньшей мере одно соединение, как определено в пп.1-17, необязательно в комбинации с одним или более другими терапевтическими и/или косметическими действующими началами.
20. Фармацевтическая композиция, содержащая в фармацевтически приемлемом носителе по меньшей мере одно соединение, как определено в пп.1-17, в комбинации с одним или более соединениями, выбранными из следующего перечня:
антидиабетическое средство;
инсулин;
антилипемическое средство и/или молекула, снижающая холестерин;
антигипертензивное средство и гипотензивное средство;
антитромбоцитарное средство;
средство против ожирения;
противовоспалительное средство;
антиоксидант;
средство, применяемое для лечения сердечной недостаточности;
средство, применяемое для лечения коронарной недостаточности;
противораковое средство;
противоастматическое средство;
кортикоид, применяемый при лечении болезней кожи;
сосудорасширяющее и/или противоишемическое средство.
21. Применение фармацевтической композиции по п.19 или 20 для лечения осложнений, связанных с метаболическим синдромом, резистентностью к инсулину, дислипидемией, атеросклерозом, сердечно-сосудистыми болезнями, ожирением, гипертензией, воспалительными заболеваниями, ишемией головного мозга, аутоиммунными заболеваниями, нейродегенеративными патологиями или раком.
22. Применение фармацевтической композиции по п.19 или 20 для лечения факторов риска возникновения сердечно-сосудистых болезней, связанных с нарушениями липидного и/или углеводного обмена.
23. Применение по п.19 или 20 для лечения диабета.
24. Применение по п.19 или 20 для лечения дислипидемии.
Текст
Настоящее изобретение относится к соединениям, полученным из замещенных 3-фенил-1-(тиен-2 ил)пропан-1-онов, характеризующимся общей формулой (I) в которой X1 представляет собой галоген, R1, -SR1 или -OR1 группу; X2 представляет собой атом серы или кислорода; Х 3 представляет собой галоген, R3, -SR3 или -OR3 группу; Х 4 представляет собой галоген, R4,-SR4 или -OR4 группу; X5 представляет собой Y, -S-Y или -O-Y, где Y является группой R5-COOR12 илиR5-CONR12R13; Х 6 представляет собой галоген, R6, -SR6 или -OR6 группу; Х 7 представляет собой галоген, R7,-SR7 или -OR7 группу; R1 представляет собой водород или алкил, имеющий от 1 до 4 атомов углерода,указанный алкил необязательно является галогенированным 1-3 атомами галогена; R3, R4, R6, R7 и X8,которые могут быть одинаковыми или разными, выбирают из водорода или алкила, имеющего от 1 до 4 атомов углерода; R5 представляет собой линейную (С 1-С 4)алкильную группу, возможно замещенную 1-2 заместителями, выбранными из (С 1-С 4)алкильной, (С 1-С 4)алкенильной или фенильной группы; А представляет собой (i) карбонил (СО), (ii) оксим (C=N-O-H) или оксим эфирную группу (C=N-O-R11), гдеR11 выбирают из атома водорода, алкила (линейного или разветвленного), имеющего от 1 до 7 атомов углерода, замещенного или незамещенного арилом, указанные алкил и арил необязательно являются галогенированными 1-3 атомами галогена, или (iii) -CHOR11, где R11 выбирают из атома водорода или алкила (линейного или разветвленного), имеющего от 1 до 7 атомов углерода, указанный алкил не замещен или замещен циклоалкилом, арилом или гетероарилом, указанные алкил, циклоалкил, арил или гетероарил необязательно являются галогенированными 1-3 атомами галогена; В представляет собой (i) CH2-CH2 группу, (ii) CH=CH группу, их стереоизомеры (диастереомеры, энантиомеры), чистые или смешанные,рацемические смеси, геометрические изомеры, соли или смеси этих соединений; где циклоалкил означает алкильную группу, образующую одно кольцо с 3-8 атомами углерода; арил означает ароматическую группу,состоящую из 6-14 атомов углерода и представляющую собой моно- или бицикл; гетероарил означает ароматическую группу, состоящую из 3-14 атомов углерода, прерываемых одним или более гетероатомами,выбранными из N, О, S и Р, и, когда группа при необходимости галогенирована, она является замещенной группой 1-3 атомами галогена; фармацевтическим композициям, содержащим их, а также к их терапевтическому применению, в особенности в области здоровья человека и животных. 017449 Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, полученным из замещенных 3-фенил-1(фенилтиенил)пропан-1-онов и замещенных 3-фенил-1-(фенилфуранил)пропан-1-онов, фармацевтическим композициям, содержащим их, а также к их терапевтическому применению, в особенности в области здоровья человека и животных. Неожиданно изобретатели открыли, что соединения согласно изобретению, по существу, обладают свойствами агонистов PPAR (рецепторов активации пролиферации пероксисом). Следовательно, молекулы, описанные в изобретении, представляют особый интерес для лечения осложнений, связанных с метаболическим синдромом, атеросклерозом, сердечно-сосудистыми болезнями, резистентностью к инсулину, ожирением, гипертонией, диабетом, дислипидемией, воспалительными болезнями (астмой и т.д.), ишемией головного мозга, аутоиммунными болезнями, нейродегенеративными патологиями (болезнь Альцгеймера и т.д.), раком и т.д., а также предоставляют возможность снижения общего риска возникновения сердечно-сосудистых болезней. Предпочтительно соединения согласно изобретению могут быть использованы для лечения дислипидемии и снижения общего сердечнососудистого риска. Уровень техники Диабет, ожирение и дислипидемия (высокие уровни в плазме LDL-холестерина (липопротеинов низкой плотности) и триглицеридов, низкие уровни в плазме HDL-холестерина (липопротеинов высокой плотности относятся к числу точно установленных сердечно-сосудистых факторов риска, которые способствуют развитию сердечно-сосудистой патологии у индивидуума (Mensah M., 2004). Эти факторы риска объединяются с факторами риска, связанными с образом жизни, такими как курение, физическая пассивность и несбалансированная диета. Между этими различными факторами существует синергетический эффект: одновременное наличие нескольких из них ведет к резкому усугублению сердечнососудистого риска и после этого уместно говорить об общем риске сердечно-сосудистых болезней. Распространенность дислипидемии достигла 43,6% популяции в 2004 в основных развитых странах. Распространенность диабета, показывая общее увеличение в настоящее время, находится на пути к тому, чтобы стать еще более существенным фактором в эпидемиологии сердечно-сосудистых болезней: распространенность диабета фактически оценивается на уровне 7,6% популяции к 2010 (Fox-Tucker J., 2005). Согласно данным Международного общества атеросклероза (International Atherosclerosis Society,2003) сердечно-сосудистые болезни являются первичной причиной смертности в индустриально развитых странах и становятся все более и более распространенными в развивающихся странах. В основном эти болезни представляют собой коронарные болезни, ишемию головного мозга и периферические артериальные болезни. Следовательно, эти данные обосновывают принятие энергичных мер для существенного уменьшения заболеваемости и смертности вследствие сердечно-сосудистых патологий, а необходимость поиска эффективных методов лечения (дополнительно к изменению образа жизни на здоровый), действующих на факторы риска сердечно-сосудистых болезней и на их последствия, в настоящее время становится глобальной необходимостью. Вследствие их свойств как агонистов PPAR соединения согласно изобретению представляют особый интерес для лечения патологий, связанных с нарушениями метаболизма липидов и углеводов, таких как диабет, ожирение, дислипидемия или воспаление, а также для снижения общего сердечнососудистого риска. Действительно известно, что PPAR (,и ) вовлечены в патологии этого типа (Kota B.P. et al.,2005): лиганды этих рецепторов предлагаются (продаются) для лечения подобных патологий (Lefebvre P.et al., 2006), а многочисленные модуляторы PPAR, агонисты или антагонисты, селективные или неселективные, находятся в настоящее время на поздней стадии фармацевтической разработки. МодуляторPPAR, имеющий благоприятные эффекты на резистентность к инсулину, ожирение, дислипидемию, гипертензию и/или воспаление, может быть использован при лечении метаболического синдрома (или синдрома X) (Liu Y. и Miller A., 2005). Семейство PPAR включает три изоформы, названные ,и(также называемая ), каждая из которых кодируется разным геном. Эти рецепторы составляют часть суперсемейства ядерных рецепторов и транскрипционных факторов, которые активируются связыванием определенных жирных кислот и/или их липидных метаболитов. Активированные PPAR образуют гетеродимеры с рецепторами 9-цис ретиноевой кислоты (RxR или ретиноид х рецептор) и связываются с чувствительными элементами (PPRE или чувствительный элемент рецептора активации пролиферации пероксисом) на промоторе их геновмишеней, таким образом обеспечивая контроль транскрипции.PPAR преимущественно контролирует липидный метаболизм (печеночный и мышечный) и гомеостаз глюкозы, непосредственно держа под контролем транскрипцию генов, кодирующих протеины, вовлеченные в липидный гомеостаз. Он вызывает противовоспалительные и антипролиферативные эффекты и предотвращает проатерогенные эффекты накопления холестерина в макрофагах, стимулируя выход холестерина (Lefebvre Р., Chinetti G., Fruchart J.C. и Staels В., 2006). Фибраты (фенофибрат, безафибрат,-1 017449 ципрофибрат, гемфиброзил), через посредничество PPAR, таким образом находят клиническое применение при лечении определенных дислипидемий посредством снижения уровней триглицеридов и увеличения уровней в плазме HDL-холестерина (HDL: липопротеин высокой плотности).PPAR участвует в липидном метаболизме зрелых адипоцитов (ключевой регулятор адипогенеза), в гомеостазе глюкозы (особенно в резистентности к инсулину), в воспалении, в накоплении холестерина на уровне макрофагов и в клеточной пролиферации (Lehrke М. и Lazar M.A., 2005). Следовательно,PPAR играет роль в патогенезе ожирения, резистентности к инсулину и диабета. Тиазолидиндионы (росиглитазон, троглитазон и т.д.) представляют собой лиганды рецептора PPAR, применяемые при лечении диабета 2 типа. Теперь существуют лиганды PPAR, находящиеся в клинической разработке (например, GW501516(CAS Регистрационный номер 317318-70-0, но в настоящее время нет лиганда PPAR, применяемого в качестве лекарства. Этот рецептор является привлекательной целью для разработки медикамента для применения в лечении факторов риска, связанных с метаболическим синдромом и с атеросклерозом, таким как дислипидемия, ожирение, воспаление и резистентность к инсулину. Действительно, PPAR вовлечен в контроль липидного и углеводного обменов, в энергетический баланс, в пролиферацию и дифференцировку нейронов и в воспалительный ответ (Gross В. et al., 2005). Кроме непосредственной роли лигандов PPAR в регуляции обмена липидов и углеводов, эти молекулы обладают спектром плейотропного действия вследствие большого разнообразия генов-мишеней из числа (таргентных) генов-мишеней PPAR. Эти разнообразные свойства делают PPAR интересными терапевтическими мишенями для лечения различных патологий, в особенности кардиометаболических патологий (т.е. сердечно-сосудистых и метаболических патологий), так же как и для снижения общего сердечно-сосудистого риска. Лиганды PPAR играют нейронопротекторную роль при болезни Альцгеймера, рассеянном склерозе,болезни Паркинсона и, в более общем смысле, в любой патологии, затрагивающей гибель и дегенерацию нейронов, являются ли они нейронами центральной или периферической нервной системы, гибель и дегенерацию олигодендроцитов, гибель или дегенерацию глиальных клеток, воспаление глиальных клеток(т.е. астроцитов, микроглии или олигодендроцитов) или шванновских клеток. Таким образом, недавно было показано, что агонисты PPAR сохраняют возможность обучения и памяти у крыс с индуцированной болезнью Альцгеймера (de la Monte S.M. et al., 2006). Также было показано, что пероральное применение агонистов PPAR уменьшало клинические симптомы и активацию астроглиального и микроглиального воспаления на модели рассеянного склероза (Polak, 2005). Сущность изобретения Следовательно, вследствие их свойств как агонистов PPAR соединения согласно изобретению представляют собой эффективное терапевтическое средство для улучшения патологий, связанных с нарушениями липидного и/или углеводного метаболизма, для снижения общего сердечно-сосудистого риска, а также для нейропротекторного действия. В частности, соединения согласно изобретению обладают свойствами агонистов PPAR и PPAR и поэтому представляют интерес при лечении метаболических патологий, таких как метаболический синдром (характерными чертами которого являются ожирение (в частности, абдоминальное ожирение), ненормальная концентрация липидов в крови (высокий уровень триглицеридов и/или низкий уровень HDLхолестерина (дислипидемия, повышенная гликемия и/или резистентность к инсулину и гипертензия) и при лечении дислипидемии. Настоящее изобретение относится к соединениям, полученным из замещенных 3-фенил-1(фенилтиенил)пропан-1-онов и 3-фенил-1-(фенилфуранил)пропан-1-онов следующей общей формулы (I) в которой X1 представляет собой галоген, R1, -SR1 или -OR1 группу; Х 2 представляет собой атом серы или кислорода; Х 3 представляет собой галоген, R3, -SR3 или -OR3 группу; Х 4 представляет собой галоген, R4, -SR4 или -OR4 группу; Х 5 представляет собой Y, -S-Y или -O-Y, где Y является группой R5-COOR12 или R5-CONR12R13; Х 6 представляет собой галоген, R6, -SR6 или -OR6 группу; Х 7 представляет собой галоген, R7, -SR7 или -OR7 группу;R1 представляет собой водород или алкил, имеющий от 1 до 4 атомов углерода, указанный алкил необязательно является галогенированным 1-3 атомами галогена;R3, R4, R6, R7 и Х 8, которые могут быть одинаковыми или разными, выбирают из водорода или алкила, имеющего от 1 до 4 атомов углерода;R5 представляет собой линейную (С 1-С 4)алкильную группу, возможно замещенную 1-2 заместителями, выбранными из (С 1-С 4)алкильной, (С 1-С 4)алкенильной или фенильной групп; А представляет собой:(i) карбонил (СО),(ii) оксим (C=N-O-H) или оксим эфирную группу (C=N-O-R11), где R11 выбирают из атома водорода,алкила (линейного или разветвленного), имеющего от 1 до 7 атомов углерода, замещенного или незамещенного арилом, указанные алкил и арил необязательно являются галогенированными 1-3 атомами галогена, или(iii) -CHOR11, где R11 выбирают из атома водорода или алкила (линейного или разветвленного),имеющего от 1 до 7 атомов углерода, указанный алкил не замещен или замещен циклоалкилом, арилом,или гетероарилом, указанные алкил, циклоалкил, арил или гетероарил необязательно являются галогенированными 1-3 атомами галогена; В представляет собой:(i) СН 2-СН 2 группу,(ii) CH=CH группу,циклоалкил означает алкильную группу, образующую одно кольцо с 3-8 атомами углерода; арил означает ароматическую группу, состоящую из 6, 8, 10, 12 или 14 атомов углерода и представляющую собой моно- или бицикл; гетероарил означает ароматическую группу, состоящую из 3-14 атомов углерода, прерываемых одним или более гетероатомами, выбранными из N, О, S и Р, и, когда группа при необходимости галогенирована, она является замещенной группой 1-3 атомами галогена; их стереоизомерам (диастереомерам, энантиомерам), чистым или смешанным, рацемическим смесям, геометрическим изомерам, солям или смесям этих соединений. В рамках настоящего изобретения термин "алкил" обозначает насыщенный, линейный, разветвленный, галогенированный или негалогенированный, углеводородный радикал, имеющий, в частности, от 1 до 24 атомов углерода, предпочтительно от 1 до 10 и имеющий более конкретно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода. В качестве примера можно назвать, например, метил, трифторметил, этил, н-пропил, изопропил, н-бутил, изобутил,трет-бутил, втор-бутил, пентил, неопентил или н-гексил; в частности, алкил или алкенил имеют от 1 до 4 атомов углерода, их предпочтительно выбирают из группы, включающей метил, этил, н-пропил, н-бутил,изопропил, втор-бутил, изобутил, трет-бутил и их ненасыщенные производные, имеющие по меньшей мере одну двойную связь (такую как, в частности, СН=СН); термин "циклоалкил" обозначает алкил, как определено выше, образующий по меньшей мере одно кольцо. В качестве примера можно назвать циклоалкил, имеющий от 3 до 8 атомов углерода, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил; термин "гетероциклоалкил" обозначает насыщенную или ненасыщенную алкильную группу, образующую по меньшей мере одно кольцо, прерванное одним или больше гетероатомами, выбранными из числа N, О, S или Р. Примерами являются гетероциклоалкил, азиридин, пирролидин, тетрагидротиофен,имидазолин, пиперидин, пиперазин и морфолин; термин "арил" относится к ароматическим группам, предпочтительно включающим от 6 до 14 атомов углерода (т.е. 6, 7, 8, 9, 10, 11, 12, 13 или 14 атомов углерода). Они являются в большинстве случаев моно- или бициклическими, как, например, фенил, бензил, -нафтил, -нафтил, антраценил или флуоренил. В рамках настоящего изобретения арил может быть замещенным одним или более заместителями,которые могут быть одинаковыми или разными. Из числа заместителей арильных групп можно указать в качестве примеров галогены, алкильные группы (как определено выше) и алкоксигруппы (определенные как алкил (как определено выше), связанный с молекулой через кислород (эфирная связь, алкилтио группы (определенные как алкил (как определено выше), связанный с молекулой через серу (тиоэфирная связь, такие как метил, трифторметил, метокси и трифторметокси, метилтио и трифторметилтио, амины, нитро группы, гидроксигруппы, арил, гетероарил и гетероциклические группы; термин "гетероарил" относится к ароматическим группам, предпочтительно содержащим от 3 до 14 атомов углерода, преимущественно от 3 до 8 атомов углерода (т.е. 3, 4, 6, 7 или 8 атомов углерода), прерванным одним или более гетероатомами, выбранными из числа N, О, S или Р, например пиррол, имидазол и пиридин. Из числа заместителей гетероарильных групп можно назвать, например, галогены, алкильные группы (как определено выше) и алкоксигруппы (определенные как алкил (как определено выше) связанный с молекулой через кислород (эфирная связь, алкилтио группы (определенные как алкил (как определено выше), связанный с молекулой через серу (тиоэфирная связь. Примерами этих заместителей являются метил, трифторметил, метокси и трифторметокси, метилтио и трифторметилтио, амины, нитро группы,гидроксигруппы, арил, гетероарил и гетероциклические группы. Атомы галогена выбирают из атомов брома, фтора, йода и хлора. В рамках настоящего изобретения в общей формуле (I) атомы кольца II пронумерованы, начиная от атома X2, который имеет номер 1, другие атомы кольца пронумерованы, начиная от углерода кольца II,-3 017449 связанного с группой А-В. Таким образом, углерод кольца II, связанный с группой А-В, является углеродом 2 (или С 2), углерод, смежный с С 2, является углеродом 3 (или С 3) и т.д. Предпочтительно соединения согласно изобретению выбирают из числа трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропаноата; 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропановой кислоты; трет-бутил 2-(2,3-дихлор-4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)2-метилпропаноата; 2-(2,3-дихлор-4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропановой кислоты; трет-бутил 2-(4-(3-(4-иодобензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,3 дихлорфенокси)-2-метилпропаноата; 2-(4-(3-(4-иодобензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,3-дихлорфенокси)-2 метилпропановой кислоты; 2-(4-(3-(бензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,3-дихлорфенокси)-2 метилпропановой кислоты; трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутаноата; 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутановой кислоты; трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(4-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропаноата;-5 017449 трет-бутил 2-(4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)ацетата; 2-(4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)уксусной кислоты; 2-(4-(3-(бензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2-фторфенокси)бутановой кислоты; 2-(2,3-дихлор-4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)фуран-2-ил)пропил)фенокси)-2 метилпропановой кислоты; 2-(2,3-дихлор-4-(3-метокси-3-(5-(4-(трифторметил)фенил)фур-2-ил)пропил)фенокси)-2 метилпропановой кислоты; 2-(4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,6-диметилфенокси)-2 метилпропановой кислоты; 2-(4-(3-метокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,6-диметилфенокси)-2 метилпропановой кислоты; этил 2-(2,3-дихлор-4-(3-оксо-3-(5-(3-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропаноата; 2-(2,3-дихлор-4-(3-оксо-3-(5-(3-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропановой кислоты; этил 2-(2,3-дихлор-4-(3-гидрокси-3-(5-(3-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропаноата; этил 2-(2,3-дихлор-4-(3-метокси-3-(5-(3-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропаноата; 2-(2,3-дихлор-4-(3-гидрокси-3-(5-(4-(трифторметокси)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропановой кислоты; 2-(2,3-дихлор-4-(3-метокси-3-(5-(4-(трифторметокси)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропановой кислоты. Соединения согласно изобретению могут содержать один или больше асимметричных центров. Настоящее изобретение включает стереоизомеры (диастереоизомеры, энантиомеры), чистые или смешанные, а также рацемические смеси и геометрические изомеры. Когда требуется энантиомерно чистая (или обогащенная) смесь, ее можно получить или посредством очищения конечного продукта или хиральных промежуточных соединений, или посредством асимметричного синтеза согласно способам, известным специалисту в данной области техники (например, используя хиральные реагенты и катализаторы). Некоторые соединения согласно изобретению могут иметь различные стабильные таутомерные формы, и все эти формы и смеси включены в данное изобретение. Настоящее изобретение также относится к "фармацевтически приемлемым" солям соединений согласно изобретению. Вообще, этот термин означает низкотоксичные или нетоксичные соли, полученные из оснований или кислот, органических или неорганических. Эти соли могут быть получены во время стадии окончательной очистки соединения согласно изобретению или посредством включения соли в уже очищенное соединение. Некоторые соединения согласно изобретению и их соли могут быть стабильными в некоторых твердых формах. Настоящее изобретение включает все твердые формы соединения согласно изобретению, которые включают аморфные, полиморфные, моно- и поликристаллические формы. Соединения согласно изобретению могут быть в свободной форме или в сольватированной форме,например с фармацевтически приемлемыми растворителями, такими как вода (гидраты) или этанол. Соединения согласно изобретению, меченные изотопом или изотопами, также включаются в изобретение: эти соединения являются структурно идентичными, но отличаются тем, что по меньшей мере один атом структуры заменен изотопом (радиоактивным или нет). Примеры изотопов, которые могут быть включены в структуру соединения согласно изобретению, могут быть выбраны из водорода, углерода, кислорода, серы, таких как 2 Н, 3H, 13C, 14C, 18O, 17O, 35S соответственно. Радиоактивные изотопы 3 Н и 14 С являются особенно предпочтительными, так как их легко получить и определить в исследованиях биодоступности веществ in vivo. Тяжелые изотопы (такие как 2 Н) являются особенно предпочтительными, так как они используются в качестве внутренних стандартов в аналитических исследованиях. Настоящее изобретение раскрывает способ синтеза соединений общей формулы (I), который включает:(1) стадию контактирования в основной среде или кислой среде по меньшей мере одного соединения формулы (С) по меньшей мере с одним соединением формулы (D)(2) необязательно стадию восстановления соединения, полученного на стадии (1);(3) необязательно стадию включения функциональных групп. Условия выполнения стадии (1) в кислой или основной среде и стадии (2) известны специалистам в данной области техники и могут колебаться в широких пределах. В частности, протоколы синтеза могут быть такими, как представленные в разделе "примеры" настоящего изобретения. Контактирование этих двух соединений преимущественно осуществляется стехиометрически. Его выполняют предпочтительно при подходящей температуре (примерно между 18 и 100 С) и предпочтительно при атмосферном давлении. В основной среде реакцию предпочтительно выполняют в присутствии сильного основания, такого как гидроксид щелочного металла, например гидроксида натрия, или алкоголята щелочного металла,такого как этилат натрия. В кислой среде реакцию предпочтительно выполняют в присутствии сильной кислоты, например соляной кислоты. Полученные таким образом соединения можно выделить с помощью обычных способов, известных специалистам в данной области техники. Настоящее изобретение также относится к соединениям, как описано выше, в качестве медикаментов. Настоящее изобретение также относится к соединениям, как описано выше, для лечения осложнений, связанных с метаболическим синдромом, атеросклероза, ишемии головного мозга, аутоиммунных болезней, сердечно-сосудистых болезней, резистентности к инсулину, ожирения, гипертензии, диабета,дислипидемии, воспалительных болезней (например, астмы), нейродегенеративных патологий, в частности рассеянного склероза, болезни Паркинсона, болезни Альцгеймера, таупатий (лобновисочные деменции, болезнь Пика, кортикобазальная дегенерация, прогрессирующий супрануклеарный паралич), корковых деменций, спинальных амиотрофий, умеренного когнитивного нарушения (MCI), синуклеопатий,патологий, связанных с тельцами Леви, хореи Хантингтона, эпилепсии, амиотрофического латерального склероза, прионных болезней (болезни Крейтцфельдта-Якоба), синдрома Дауна, атаксии Фридрейха,спинально-церебеллярной атаксии, мышечной атрофии Шарко-Мари, неврологических осложнений, связанных с AIDS, хронических болей, церебеллярной (мозжечковой) дегенерации, церебеллярной гипоксии, невропатий, связанных с диабетом, рака и т.д., а также для снижения сердечно-сосудистого риска. Предпочтительно изобретение относится к соединению, как описано выше, для лечения сердечнососудистых факторов риска, связанных с нарушениями липидного и/или углеводного обмена, особенно гиперлипидемии и ожирения и, в частности, диабета (диабета II типа). Даже более предпочтительно изобретение относится к соединению, как описано выше, для лечения дислипидемии. Настоящее изобретение также относится к фармацевтическим композициям, содержащим в фармацевтически приемлемом носителе по меньшей мере одно соединение, как описано выше, необязательно в комбинации с одним или более другими терапевтическими и/или косметическими действующими началами. Преимущественно это фармацевтическая композиция для лечения осложнений, связанных с метаболическим синдромом, атеросклерозом, ишемией головного мозга, аутоиммунными болезнями, сердечно-сосудистыми болезнями, резистентностью к инсулину, ожирением, гипертензией, диабетом, дислипидемией, воспалительными болезнями (например, астмой), нейродегенеративными патологиями (в частности, рассеянным склерозом, болезнью Паркинсона, болезнью Альцгеймера, таупатией (лобновисочной деменцией, болезнью Пика, кортикобазальной дегенерацией, прогрессирующим супрануклеарным параличом), корковой деменцией, спинальной амиотрофией, умеренным когнитивным нарушением (MCI),синуклеопатией, патологией, связанной с тельцами Леви, хореей Хантингтона, эпилепсией, амиотрофическим латеральным склерозом, прионными болезнями (болезнь Крейтцфельдта-Якоба), синдромом Дауна, атаксией Фридрейха, спинально-церебеллярной атаксией, мышечной атрофией Шарко-Мари, неврологическими осложнениями, связанными с AIDS, хроническими болями, церебеллярной (мозжечковой) дегенерацией, церебеллярной гипоксией, невропатиями, связанными с диабетом, раком и т.д., а также для снижения сердечно-сосудистого риска. Предпочтительно это относится к фармацевтической композиции для лечения сердечно-сосудистых факторов риска, связанных с нарушениями липидного и/или углеводного обмена, особенно гиперлипидемии и ожирения, и в частности диабета (диабета II типа). Даже более предпочтительно фармацевтическая композиция согласно изобретению предназначена для лечения дислипидемии. Другой объект изобретения относится к применению по меньшей мере одного соединения, как описано выше, для приготовления фармацевтических композиций, предназначенных для лечения различных патологий, как определено выше, особенно связанных с нарушениями липидного и/или углеводного обмена, в числе можно упомянуть дислипидемию. Конкретнее, изобретение относится к применению по меньшей мере одного соединения, как описано выше, для приготовления фармацевтических композиций,-7 017449 предназначенных для лечения факторов риска сердечно-сосудистых болезней, связанных с нарушениями обмена липидов и/или углеводов и предназначенных, таким образом, для снижения сердечнососудистого риска. В качестве неограничивающего примера соединения согласно изобретению преимущественно могут быть введены в комбинации с одним или более другими терапевтическими и/или косметическими средствами, продаваемыми или разрабатываемыми, такими как противодиабетические средства: секретеры инсулина (сульфонилмочевины (глибенкламид, глимепирид, гликлазид и т.д.) и глиниды (репаглинид, натеглинид и т.д., ингибиторы альфа-глюкозидазы,агонисты PPAR (тиазолидиндионы, такие как росиглитазон, пиоглитазон), смешанные PPAR/PPAR агонисты (тесаглитазар, мураглитазар), pan-PPAR (соединения, одновременно активирующие 3 изоформы PPAR), бигуаниды (метформин), ингибиторы дипептидил пептидазы IV (ситаглиптин, вилдаглиптин),агонисты глюкагон-подобного пептида-1 (GLP-1) (экзенатид) и т.д.; инсулин; антилипемические и/или снижающие холестерин средства: фибраты (фенофибрат, гемфиброзил),ингибиторы HMG СоА редуктазы или гидроксиметил глутарил коэнзим А редуктазы (статины, такие как аторвастатин, симвастатин, флувастатин), ингибиторы абсорбции холестерина (эзетимиб, фитостеролы),ингибиторы белка-переносчика эфира холестерина (СЕТР) (торцетрапиб), ингибиторы ацил-коэнзим А холестерин ацилтрансферазы (АСАТ) (авасимиб, эфлуцимиб), ингибиторы микросомального белкапереносчика триглицеридов (МТР), соединения связывающие желчные кислоты (холестирамин), витамин Е, полиненасыщенные жирные кислоты, омега 3 жирные кислоты, производные типа никотиновой кислоты (ниацин) и т.д.; антигипертензивные средства и гипотензивные средства: ингибиторы ангиотензинпревращающего фермента (АСЕ) (каптоприл, эналаприл, рамиприл или квинаприл), антагонисты рецепторов ангиотензина II (лозартан, валсартан, телмисартан, эпосартан, ирбесартан и т.д.), бета-блокаторы (атенолол, метопролол, лабеталол, пропранолол), триазидные и нетриазидные диуретики (фуросемид, индапамид, гидрохлортиазид, антиальдостерон), вазодилататоры (сосудорасширяющие средства), блокаторы кальциевых каналов (нифедипин, фелодипин или амлодипин, дилтиазем или верапамил) и т.д.; антитромбоцитарные средства: аспирин, тиклопидин, дипиридамол, клопидогрел, флурбипрофен и т.д.; средства против ожирения: сибутрамин, ингибиторы липазы (орлистат), агонисты и антагонистыPPAR, антагонисты каннабиоидных рецепторов СВ 1 (римонабант) и т.д.; противовоспалительные средства: например, кортикоиды (преднизон, бетаметазон, дексаметазон,преднизолон, метил преднизолон, гидрокортизон и т.д.), нестероидные противовоспалительные средства(NSAID), полученные из индола (индометацин, сулиндак), NSAIDS арилкарбоксильной группы (тиапрофеновая кислота, диклофенак, этодолак, флурбипрофен, ибупрофен, кетопрофен, напроксен, набуметон,алминопрофен), NSAIDS, полученные из оксикама (мелоксикам, пироксикам, теноксикам), NSAIDS из группы фенаматов, селективные ингибиторы СОХ-2 (целекоксиб, рофекоксиб) и т.д.; антиоксиданты: например, пробукол, и т.д.; средства, применяемые для лечения сердечной недостаточности: тиазидные или нетиазидные диуретики (фуросемид, индапамин, гидрохлортиазид, антиальдостерон), ингибиторы АСЕ (каптоприл, эналаприл, рамиприл или квинаприл), препараты наперстянки (дигоксин, дигитоксин), бета-блокаторы (атенолол, метопролол, лабеталол, пропранолол), ингибиторы фосфодиэстеразы (эноксимон, милринон) и т.д.; средства, применяемые для лечения коронарной недостаточности: бета-блокаторы (атенолол, метопролол, лабеталол, пропранолол), блокаторы кальциевых каналов (нифедипин, фелодипин или амлодипин, бепридил, дилтиазем или верапамил), NO доноры (тринитрин, изосорбид-динитрат, молсидомин),амиодарон и т.д.; противораковые препараты: цитотоксические средства (средства, взаимодействующие с ДНК, алкилирующие вещества, цисплатин и его производные); цитостатические средства (аналоги гонадотропин-высвобождающего гормона (GnRH), аналоги соматостатина, прогестогены, антиэстрогены, ингибиторы ароматазы и т.д.), модуляторы иммунного ответа (интерфероны, IL2 и т.д.) и т.д.; противоастматические средства, такие как бронхорасширяющие средства (агонисты бета 2 рецепторов), кортикоиды, кромогликат, антагонисты лейкотриеновых рецепторов (монтелукаст) и т.д.; кортикоиды, применяемые при лечении болезней кожи, таких как псориаз и дерматиты; сосудорасширяющие и/или противоишемические средства (буфломедил, экстракты Гинко билоба,нафтидрофурил, пентоксифуллин, пирибедил) и т.д. Изобретение также относится к способу лечения различных патологий, как определено выше, особенно связанных с нарушениями липидного и/или углеводного обмена, включающему введение субъекту, особенно человеку, эффективного количества соединения или фармацевтической композиции, как определено выше.-8 017449 В понимании изобретения термин "эффективное количество" относится к количеству соединения,достаточному для получения необходимого биологического результата. Термин "субъект" означает млекопитающее и конкретнее человека. Термин "лечение" означает целебное, симптоматическое и/или профилактическое лечение. Соединения настоящего изобретения таким образом можно применять для субъектов (таких как млекопитающие, в частности человек), которые имеют заявленную болезнь. Соединения настоящего изобретения также могут быть использованы для приостановки или замедления прогрессии или предотвращения дальнейшей прогрессии болезни, таким образом, для улучшения состояния субъектов. Наконец, соединения настоящего изобретения могут быть введены субъектам, которые не больны, но у которых может развиться болезнь или у которых есть значительный риск развития болезни. Фармацевтические композиции согласно изобретению преимущественно включают один или больше фармацевтически приемлемых наполнителей или переносчиков. Например, можно упомянуть солевые, физиологические, изотонические, буферизованные и т.д. растворы, совместимые с фармацевтическим применением, и известные специалистам в данной области техники. Композиции могут содержать одно или более средств или носителей, выбранных из диспергирующих агентов, солюбилизаторов,стабилизаторов, консервантов и т.д. В частности, средствами или переносчиками, которые можно использовать в формулировках (жидких, и/или инжектируемых, и/или твердых), являются метилцеллюлоза, гидроксиметил целлюлоза, карбоксиметил целлюлоза, полисорбат 80, маннитол, желатин, лактоза,растительные масла, гуммиарабик, липосомы и т.д. Композиции могут быть разработаны в виже инжектируемых суспензий, гелей, масел, таблеток, суппозиториев, порошков, твердых желатиновых капсул,капсул, аэрозолей и т.д., необязательно посредством галеновых форм или устройств, которые обеспечивают продолжительное или замедленное высвобождение. Для этого типа формулировок преимущественно применяют такие средства, как целлюлоза, карбонаты или крахмалы. Соединения или композиции согласно изобретению можно вводить различными способами и в различных формах. Таким образом, они могут быть введены системно, оральным или парентеральным путем, посредством ингаляции или инъекции, например внутривенным, внутримышечным, подкожным,чрескожным, внутриартериальным путем и т.д. В большинстве случаев соединения для инъекций разработаны в форме жидких суспензий, которые могут быть введены, например, с помощью шприца, или как инфузии. Понятно, что скорость потока и/или инжектируемая доза может быть установлена специалистом в данной области техники, в зависимости от пациента, патологии, способа введения и т.д. Обычно соединения вводят в дозах, которые могут варьировать между 1 мкг и 2 г на введение, предпочтительно от 0,01 мг до 1 г на введение. Введения могут быть ежедневными или могут повторяться несколько раз в день, если необходимо. Более того, композиции согласно изобретению также могут включать другие средства или действующие начала. Надписи к фигурам. Сокращения, используемые на фигурах и в таблицах: Соед.: соединения;HDL-холестерин: холестерин липопротеинов высокой плотности;LDL-холестерин: холестерин липопротеинов низкой плотности;VLDL-холестерин: холестерин липопротеинов очень низкой плотности; мкд: мг/кг/день. Фиг. с 1-1 по 1-9: оценка in vivo на мыши Е 2/Е 2 антилипемических свойств и свойств, стимулирующих синтез HDL-холестерина, соединений согласно изобретению с помощью анализа липидов и посредством измерения экспрессии генов, вовлеченных в липидный и углеводный обмен и диссипацию энергии. Антилипемический эффект соединений согласно изобретению был оценен in vivo на мыши Е 2/Е 2(гуманизированной по Е 2 изоформе аполипопротеина Е) с помощью анализа распределения холестерина и триглицеридов в разных фракциях липопротеинов в плазме и посредством измерения общего холестерина и уровней HDL-холестерина в плазме после 7 и 13 дней лечения посредством перорального приема; эти уровни сравнимы с уровнями, полученными у контрольных животных (не получавших соединения согласно изобретению). Найденное отличие представляет доказательство антилипемического действия соединения согласно изобретению. Фиг. 1-1: уровень общего холестерина в плазме после 7 и 13 дней лечения соединением 2, введенным в дозе 50 мкд. Фиг. 1-2: уровень HDL-холестерина в плазме после 7 и 13 дней лечения соединением 2, введенным в дозе 50 мкд. Фиг. 1-3: распределение холестерина в разных фракциях липопротеинов в плазме после 13 дней лечения соединением 2, введенным в дозе 50 мкд. Фиг. 1-4: распределение триглицеридов в разных фракциях липопротеинов в плазме после 13 дней лечения соединением 2, введенным в дозе 50 мкд. Эффективность соединений согласно изобретению также оценивали с помощью измерения в пече-9 017449 ночной и (скелетной) мышечной тканях, экспрессии генов, участвующих в липидном и углеводном обмене и диссипации энергии. Уровни экспрессии каждого гена были нормализованы относительно уровня экспрессии эталонных генов - 36 В 4 в печеночной ткани или 18S в икроножной скелетной мышце. Затем был вычислен фактор индукции (показатель индукции), т.е. отношение относительного сигнала (вызванного соединением согласно изобретению) к среднему значению относительных значений контрольной группы. Чем выше этот фактор, тем больше свойство соединения активировать генную экспрессию. Окончательный результат представлен как средняя величина значений индукции в каждой экспериментальной группе. Фиг. 1-5: экспрессия PDK4 (пируватдегидрогеназкиназа, изоформа 4) в ткани печени у мыши Е 2/Е 2 после 13 дней лечения соединением 2 (50 мкд). Фиг. 1-6: экспрессия AcoX1 в ткани печени у мыши Е 2/Е 2 после 13 дней лечения соединением 2(50 мкд). Фиг. 1-7: экспрессия ApoCIII в ткани печени у мыши Е 2/Е 2 после 13 дней лечения соединением 2(50 мкд). Фиг. 1-8: экспрессия PDK4 (пируватдегидрогеназкиназа, изоформа 4) в скелетной мышце у мыши Е 2/Е 2 после 13 дней лечения соединением 2 (50 мкд). Фиг. 1-9: экспрессия UCP2 (разобщающий белок 2) в скелетной мышце у мыши Е 2/Е 2 после 13 дней лечения соединением 2 (50 мкд). Фиг. с 2-1 по 2-6: оценка in vivo на мыши C57B16 антилипемических свойств и свойств, стимулирующих синтез HDL-холестерина, соединений согласно изобретению с помощью анализа липидов и посредством измерения экспрессии генов, вовлеченных в липидный и углеводный обмен и диссипацию энергии. Эффект соединения 2 согласно изобретению, введенного в зависимости доза-эффект, был оценен invivo у мыши С 57 В 16 после 14 дней лечения посредством перорального приема. В конце лечения антилипемический эффект соединения 2 согласно изобретению был оценен посредством измерения уровней в плазме общего холестерина, HDL-холестерина, триглицеридов и свободных жирных кислот. Фиг. 2-1: уровень общего холестерина в плазме после 14 дней лечения соединением 2 согласно изобретению, введенному в дозе 1, 5, 10 и 50 мкд у мыши С 57 В 16. Фиг. 2-2: уровень HDL-холестерина в плазме после 14 дней лечения соединением 2 согласно изобретению, введенному в дозе 1, 5, 10 и 50 мкд у мыши С 57 В 16. Фиг. 2-3: уровень триглицеридов в плазме после 14 дней лечения соединением 2 согласно изобретению, введенному в дозе 1, 5, 10 и 50 мкд у мыши С 57 В 16. Фиг. 2-4: уровень свободных жирных кислот в плазме после 14 дней лечения соединением 2 согласно изобретению, введенному в дозе 1, 5, 10 и 50 мкд у мыши С 57 В 16. Эффективность соединений согласно изобретению также оценивали с помощью измерения в (скелетной) мышечной ткани, экспрессии генов, вовлеченных в углеводный обмен и диссипацию энергии. Уровни экспрессии каждого гена были нормализованы относительно уровня экспрессии эталонного гена 18S. Затем был вычислен фактор индукции. Чем выше этот фактор, тем больше свойство соединения активировать генную экспрессию. Окончательный результат представлен как средняя величина значений индукции в каждой экспериментальной группе. Фиг. 2-5: экспрессия PDK4 в скелетной мышце у мыши С 57 В 16 после 14 дней лечения путем перорального приема соединения 2 (50 мкд). Фиг. 2-6: экспрессия UCP2 в скелетной мышце у мыши С 57 В 16 после 14 дней лечения путем перорального приема соединения 2 (50 мкд). Фиг. с 3-1 по 3-7: оценка in vivo на мыши C57B16 свойств, стимулирующих синтез HDLхолестерина, соединений согласно изобретению с помощью анализа липидов и посредством измерения экспрессии генов, вовлеченных в липидный и углеводный обмен и диссипацию энергии. Эффект соединений согласно изобретению оценивали in vivo на мыши С 57 В 16 после 14 дней лечения путем перорального приема. В конце лечения было определено распределение холестерина в разных фракциях плазмы. Распределение сравнивали с профилем, полученным для контрольных животных (не получавших соединения согласно изобретению). Эффект соединения согласно изобретению также оценивали in vivo на мыши С 57 В 16 посредством измерения уровней общего холестерина в плазме и HDLхолестерина после 14 дней лечения путем перорального приема. Эти уровни сравнивали с уровнями, обнаруженными у контрольных животных (не получавших соединения согласно изобретению). Найденное отличие представляет доказательство антилипемического действия соединения согласно изобретению. Фиг. 3-1: уровень общего холестерина в плазме после 14 дней лечения соединениями 4 и 7 согласно изобретению, введенными в дозе 50 мкд. Фиг. 3-2: уровень HDL-холестерина в плазме после 14 дней лечения соединениями 4 и 7 согласно изобретению, введенными в дозе 50 мкд. Фиг. 3-3: распределение холестерина в разных фракциях липопротеинов в плазме после 14 дней лечения соединениями 4 и 7 согласно изобретению, введенными в дозе 50 мкд. Эффективность соединений согласно изобретению также оценивали с помощью измерения в (ске- 10017449 летной) мышечной ткани, экспрессии генов, вовлеченных в липидный и углеводный обмен и диссипацию энергии. Уровни экспрессии каждого гена были нормализованы относительно уровня экспрессии эталонного гена 18S. Затем был вычислен фактор индукции. Чем выше этот фактор, тем больше свойство соединения активировать генную экспрессию. Окончательный результат представлен как средняя величина значений индукции в каждой экспериментальной группе. Фиг. 3-4: экспрессия PDK4 в мышечной ткани у мыши С 57 В 16 после 14 дней лечения соединением 7 (50 мкд). Фиг. 3-5: экспрессия CPT1b в мышечной ткани у мыши С 57 В 16 С 57 В 16 после 14 дней лечения соединениями 4 и 7 (50 мкд). Фиг. 3-6: экспрессия UCP2 в мышечной ткани у мыши С 57 В 16 С 57 В 16 после 14 дней лечения соединениями 4 и 7 (50 мкд). Фиг. 3-7: экспрессия UCP3 в мышечной ткани у мыши С 57 В 16 С 57 В 16 после 14 дней лечения соединениями 4 и 7 (50 мкд). Фиг. с 4-1 по 4-7: оценка in vivo на мыши db/db антилипемических и антидиабетических свойств иPPAR-активирующих свойств соединений согласно изобретению Эффект соединений согласно изобретению оценивали in vivo на мыши db/db посредством измерения триглицеридов в плазме и инсулинемии после 28 дней лечения соединением 2 путем перорального приема. Эти уровни сравнивали с уровнями, полученными у контрольных животных (не получавшими соединение согласно изобретению). Измеренное различие представляет доказательство антилипемического действия и действия на резистентность к инсулину соединения согласно изобретению. Фиг. 4-1: уровень триглицеридов в плазме после 28 дней лечения соединением 2, введенным в дозе 50 мкд у мыши db/db. Фиг. 4-2: уровень инсулина в плазме после 28 дней лечения соединением 2, введенным в дозе 50 мкд у мыши db/db. Эффективность соединения 2 также оценивали с помощью измерения в ткани печени и мышцы экспрессии генов, участвующих в липидном и углеводном обмене и диссипации энергии. Уровни экспрессии каждого гена были нормализованы относительно уровня экспрессии эталонных генов - 36 В 4 в печени и 18S в скелетной мышце. Затем был вычислен фактор индукции, т.е. отношение относительного сигнала (вызванного соединением согласно изобретению) к среднему значению относительных значений контрольной группы. Чем выше этот фактор, тем больше свойство соединения активировать генную экспрессию. Окончательный результат представлен как средняя величина значений индукции в каждой экспериментальной группе. Фиг. 4-3: экспрессия PDK4 в ткани печени у мыши db/db после 28 дней лечения соединением 2,введенным в дозе 50 мкд. Фиг. 4-4: экспрессия AcoX1 в ткани печени у мыши db/db после 28 дней лечения соединением 2,введенным в дозе 50 мкд. Фиг. 4-5: экспрессия CPT1b в печеночной ткани у мыши db/db после 28 дней лечения соединением 2, введенным в дозе 50 мкд. Фиг. 4-6: экспрессия PDK4 в мышечной ткани у мыши db/db после 28 дней лечения соединением 2,введенным в дозе 50 мкд. Фиг. 4-7: экспрессия UCP3 в мышечной ткани у мыши db/db после 28 дней лечения соединением 2,введенным в дозе 50 мкд. Фиг. 5: оценка in vitro метаболических свойств соединений согласно изобретению с помощью измерения -окисления жирных кислот в миоцитах мыши. Стимулирующие эффекты соединений согласно изобретению оценивали с помощью измерения окисления жирных кислот в миоцитах мыши, предварительно обработанных соединениями согласно изобретению в течение 24 ч. Чем в большей степени индуцировано -окисление жирных кислот, тем больше стимулирующие эффекты соединений согласно изобретению на деградацию жирных кислот в мышечных клетках. Фиг. 6-1 и 6-2: Оценка in vitro свойств соединений согласно изобретению как активаторов обратного транспорта холестерина с помощью измерения экспрессии ABCA1 гена в макрофагах. Эффект соединений согласно изобретению на обратный транспорт холестерина оценивали посредством измерения экспрессии гена АВСА 1 (АТР-связывающая кассета, подсемейство А, член (участник) 1; мембранный транспортер, участвующий в выбросе холестерина) в макрофагах человека. Чем больше увеличена экспрессия АВСА 1, тем больше стимулирующее действие соединений согласно изобретению на обратный транспорт холестерина. Фиг. 6-1: экспрессия АВСА 1 в макрофагах человека после 24 ч обработки соединением 2 в дозе 1 мкМ. Фиг. 6-2: экспрессия АВСА 1 в макрофагах человека после 24 ч обработки соединениями 4 и 7 согласно изобретению в дозе 1 мкМ и 300 нМ соответственно. Фиг. с 7-1 по 7-4: оценка in vitro противовоспалительных свойств соединений согласно изобрете- 11017449 нию с помощью измерения секреции и экспрессия МСР 1 и ММР 9 моноцитами человека, обработанными соединениями согласно изобретению, и стимулированными РМА. Противовоспалительные эффекты соединений согласно изобретению оценивали с помощью измерения секреции и экспрессии моноцитарного хемотаксического протеина-1 (МСР 1), а также посредством измерения экспрессии матриксной металлопротеиназы 9 (ММР 9) моноцитами человека, обработанными соединениями согласно изобретению в течение 24 ч и стимулированными РМА (форбол 12-миристат 13 ацетатом, который вызывает воспалительный ответ клеток). Чем больше сокращается количество секретируемого МСР 1, тем больше ингибирующий эффект соединений согласно изобретению на воспалительный ответ. Подобным образом, чем больше ингибируется экспрессия генов МСР 1 и ММР 9, тем больше соединение согласно изобретению является противовоспалительным. Фиг. 7-1: секреция МСР 1 (моноцитарного хемотаксического протеина-1) в моноцитах человека, обработанных соединениями 7 и 11 согласно изобретению в дозе 1 мкМ. Фиг. 7-2: экспрессия МСР 1 (моноцитарного хемотаксического протеина-1) в моноцитах человека,обработанных соединениями 7 и 11 согласно изобретению в дозе 1 мкМ. Фиг. 7-3: экспрессия ММР 9 (матриксной металлопротеиназы 9) в моноцитах человека, обработанных соединениями 7 и 11 согласно изобретению в дозе 1 мкМ. Фиг. 7-4: экспрессия МСР 1 (моноцитарного хемотаксического протеина-1) в моноцитах человека,обработанных соединением 2 в дозе 0,1 и 0,3 мкМ. Другие преимущества и аспекты изобретения станут понятны при чтении примеров, приведенных ниже, которые следует рассматривать как иллюстративные и неограничивающие. Статистический анализ. Проводили статистический анализ, состоящий из t-теста Стьюдента и/или однофакторного одномерного дисперсионного анализа (ANOVA), а затем теста Тьюки. Результаты сравнивали с контрольной группой согласно значению параметра р:: р 0.05; : р 0.01; : р 0.001. Примеры Обычные реактивы и катализаторы являются коммерчески доступными (Aldrich, Alfa Aesar, Acros,Fluka или Lancaster как требуется). В этих примерах для идентификации соединений применяли различные способы анализа. Точки плавления (Т.п.) представлены в градусах Цельсия. Чистоту продуктов проверяли с помощью тонкослойной хроматографии (TLC) и/или с помощьюHPLC (высокоэффективной жидкостной хроматографии). Масс-спектры получали с помощью ESI-MS (Ионизация методом распыления - Массспектроскопия), Q-TOF (Квадруполь - Время пролета) или MALDI-TOF (Лазерная десорбция-ионизация в присутствии матрицы - Время пролета). Спектры протонного ядерного магнитного резонанса (1 Н ЯМР) регистрировали на спектрометреBruker AC300P. Химические сдвиги выражают в ppm (частиц на миллион) и регистрируют при 300 МГц в дейтерированном растворителе, который установлен для каждого способа анализа: DMSO-d6, MeOD или CDCl3. Для интерпретации спектров использованы следующие аббревиатуры: s - синглет, bs - широкий синглет, d - дублет, dd - двойной дублет, ddd - тройной дуплет, t - триплет, dt - двойной триплет, q - квартет, quint - квинтет, sext - секстет, m - мультиплет. Пример 1. Описание протоколов общего синтеза согласно изобретению. Общий способ А. Бромированное производное (от 0,5 до 75 г; 0,05 до 0,5 моль/мл), карбонат калия (3 экв.) и воду(0,1 экв.), затем по каплям добавляют раствор бороновой кислоты в N,N-диметилформамиде (1,5 экв.; 0,25 г/мл). Смесь перемешивают в инертной атмосфере при комнатной температуре. Общий способ В. Кетон (1 экв.) и альдегид (1 экв.) растворяют в насыщенном спиртовом растворе газообразной соляной кислоты (от 0,2 до 38 г; от 0,2 до 0,5 моль/л). После перемешивания в течение 16 ч при комнатной температуре растворитель удаляли выпариванием под уменьшенным давлением. Общий способ С. Пропенон растворяют в смеси хлороформ/метанол 2:1 (от 0,2 до 14 г; от 0,01 до 0,2 моль/л), затем добавляют каталитическое количество палладия на древесном угле. Все помещают в атмосферу водорода при атмосферном давлении. Общий способ D. Фенол или тиофенол растворяют в N,N-диметилформамиде (от 0,3 до 12 г; от 0,06 до 0,2 моль/л),затем добавляют галогенированное производное (5 экв.) и карбонат калия (5 экв.). Реакционную смесь энергично перемешивают при 70 С.- 12017449 Общий способ Е. трет-Бутил сложный эфир растворяют в дихлорметане (от 0,2 до 15 г; от 0,1 до 1 моль/л), затем добавляют трифторуксусную кислоту (от 10 до 17 экв.). Перемешивают при комнатной температуре. Общий способ F. Сложный эфир растворяют в этаноле (от 0,2 до 0,4 г; от 0,1 до 0,2 моль/л), затем добавляют 2 N раствор гидроксида натрия. Общий способ G. Пропанон растворяют в этаноле (от 0,2 до 4 г; от 0,1 до 0,5 моль/л). Добавляют натрия борогидрид(3 экв.). Все перемешивают при комнатной температуре в течение 3 ч. Растворитель удаляют выпариванием под уменьшенным давлением, осадок после выпаривания переносят в разбавленный водный раствор соляной кислоты и экстрагируют с дихлорметаном. Общий способ Н. Спирт растворяют в N,N-диметилформамиде (от 0,2 до 3 г; от 0,1 до 0,5 моль/л), раствор охлаждают до 0 С, затем добавляют гидрид натрия. После перемешивания в течение 20 мин добавляют подходящий галоидный алкил. Смесь перемешивают при комнатной температуре в течение 4 ч. Растворители удаляют выпариванием под уменьшенным давлением. Общий способ I. Пропанон растворяют в пиридине (0,3 г; 0,1 моль/л). Добавляют О-алкилгидроксиламин гидрохлорид (от 5 до 10 экв.). После 18 ч кипячения с обратным холодильником смесь выпаривали под уменьшенным давлением, переносили в этилацетат и промывали разбавленным раствором соляной кислоты. Органическую фазу концентрировали под уменьшенным давлением. Осадок после выпаривания очищали с помощью флэш-хроматографии на силикагеле. Пример 2. Синтез сырых (первичных) материалов, используемых при синтезе соединений согласно изобретению. 2,3-Дихлор-4-гидроксибензальдегид Карбонат натрия (3,5 экв.), гидроксид кальция (4,5 экв.) и 2,3-дихлорфенол (0,15 г/л) добавляют к воде и суспензию нагревают при 70 С в течение 4 ч. Добавляют по каплям хлороформ (2 экв.) и все перемешивают при 70 С в течение 16 ч. Реакционную смесь охлаждают до 0 С и подкисляют (pH 2) концентрированным раствором соляной кислоты. Все экстрагируют этилацетатом; органические фазы промывают водой, высушивают над сульфатом магния и концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью флэш-хроматографии на силикагеле. Полученное твердое вещество перекристаллизовывают из изопропанола. Элюирование: циклогексан/этилацетат: градиент 9/1 до 7/3. Двуокись кремния 40-63 мкм. 1 2,6-Диметилфенол (0,34 г/мл) и гексаметилентетрамин (2 экв.) растворили в смеси уксусная кислота/вода 2:1. Все нагревают при 100 С в течение 4 ч. Реакционную смесь охлаждают до комнатной температуры и наливают в смесь вода/лед. Осадок высушивают. 1 Н ЯМР (300 МГц, CDCl3,в ppm): 2.33 (s, 6H); 5.90 (s, 1H); 7.55 (s, 2H); 9.81 (s, 1H). 1-(5-(4-(Трифторметил)фенил)тиен-2-ил)этанон 1-(5-(4-(Трифторметил)фенил)тиен-2-ил)этанон получают из 5-ацетил-2-тиофенбориновой кислоты и 4-бромбензотрифторида согласно общему способу А. После перемешивания в течение 2 ч растворители удаляют выпариванием под уменьшенным давлением и осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 8/2. Двуокись кремния 40-63 мкм. 1 1-(4-(4-(Трифторметил)фенил)тиен-2-ил)этанон получают из (4-бромтиен-2-ил)этанона и 4 трифторметилфенилбориновой кислоты согласно общему способу А. После перемешивания в течение 18 ч растворители удаляют выпариванием под уменьшенным давлением и осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 9/1. Двуокись кремния 40-63 мкм. 1 1-(5-(4-(Трифторметокси)фенил)тиен-2-ил)этанон получают из 5-ацетил-2-тиофенбориновой кислоты и 1-бром-4-(трифторметокси)бензола согласно общему способу А. После перемешивания в течение 1 ч реакционную смесь разбавляют водой, фильтруют на целите и затем экстрагируют с этилацетатом. Органическую фазу высушивают над сульфатом магния, фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания перекристаллизовывают из циклогексана. 1 Н ЯМР (300 МГц, DMSO-d6,в ppm): 2.56 (s, 3 Н); 7.47 (d, 2H, J=8.4 Гц); 7.71 (d, 1H, J=3.9 Гц); 7.91 1-(5-(4-Бромфенил)тиен-2-ил)этанон получают из 5-ацетил-2-тиофенбориновой кислоты и 1-бром 4-иодобензола согласно общему способу А. После перемешивания в течение 12 ч реакционную смесь разбавляют водой, фильтруют на целите и затем экстрагируют с этилацетатом. Органическую фазу высушивают над сульфатом магния, фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 9/1 до 8/2. Двуокись кремния 40-63 мкм. 1 Н ЯМР (300 МГц, CDCl3,в ppm): 2.57 (s, 3 Н); 7.31 (d, 1H, J=3.9 Гц); 7.51 (d, 2 Н, J=9.0 Гц); 7.55 (d,2H, J=9.0 Гц); 7.65 (d, 1H, J=3.9 Гц). 5-Бром-2-ацетилфуран 2-Ацетилфуран растворяют в N,N-диметилформамиде (5 г; 1,1 моль/л) и добавляют Nбромсукцинимид (1 экв.). После перемешивания в течение 5 ч при комнатной температуре реакционную смесь наливают в ледяную воду и образованный осадок высушивают. 1 1-(5-(4-(Трифторметил)фенил)фур-2-ил)этанон получают из 4-трифторметил бензолбориновой кислоты и 5-бром-2-ацетилфурана согласно общему способу А. После перемешивания в течение 18 ч реакционную смесь разбавляют водой и затем экстрагируют с этилацетатом. Органическую фазу высушивают над сульфатом магния, фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 95/5 до 8/2. Двуокись кремния 40-63 мкм. 1 1-(5-(4-(Метилтио)фенил)тиен-2-ил)этанон получают из 5-ацетил-2-тиофенбориновой кислоты и 1 бром-4-(метилтио)бензола согласно общему способу А. После перемешивания в течение 18 ч при 100 С реакционную смесь разбавляют водой, фильтруют на целите и затем экстрагируют с этилацетатом. Органическую фазу высушивают над сульфатом магния,фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: от 9/1 до 8/2. Двуокись кремния 40-63 мкм. 1 1-(5-(3-(Трифторметил)фенил)тиен-2-ил)этанон получают из 2-ацетил-5-бромтиофеновой кислоты и 3-трифторметилбензолбориновой кислоты согласно общему способу А. После перемешивания в течение 4 ч растворители удаляют выпариванием под уменьшенным давлением и осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 8/2. Двуокись кремния 40-63 мкм. 1H ЯМР (300 МГц, CDCl3,в ppm): 2.59 (s, 3 Н); 7.39 (d, 1H, J=3.9 Гц); 7.53-7.65 (m, 2H); 7.69 (d, 1H,J=3.9 Гц); 7.83 (d, 1H, J=7.6 Гц); 7.90 (s, 1H). Пример 3. Синтез промежуточных соединений, используемых в синтезе соединений согласно изобретению. Промежуточное соединение 1: 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен 2-ил)проп-2-ен-1-он 3-(2,3-Дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1-(5-(4-(трифторметил)фенил)тиен-2-ил)этанона и 2,3-дихлор-4-гидроксибензальдегида согласно общему способу В. Осадок после выпаривания перекристаллизовывают из ацетонитрила. 1 3-(2,3-Дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)пропан-1-он получают из 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он согласно общему способу С. После перемешивания в течение 1 ч 30 мин при 42 С катализатор удаляют фильтрованием, а растворитель удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 7/3. Двуокись кремния 40-63 мкм. 1- 15017449 3-(2,3-Дихлор-4-гидроксифенил)-1-(4-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1-(4-(4-(трифторметил)фенил)тиен-2-ил)этанона и 2,3-дихлор-4-гидроксибензальдегида согласно общему способу В. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 8/2. Двуокись кремния 40-63 мкм. 1 3-(2,3-Дихлор-4-гидроксифенил)-1-(4-(4-(трифторметил)фенил)тиен-2-ил)пропан-1-он получают из 3-(2,3-дихлор-4-гидроксифенил)-1-(4-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-она согласно общему способу С. Через 6 ч при комнатной температуре катализатор удаляют фильтрованием, а растворитель удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 8/2. Двуокись кремния 40-63 мкм. 1 3-(3-Хлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1-(5-(4-(трифторметил)фенил)тиен-2-ил)этанона и 3-хлор-4-гидроксибензальдегида согласно общему способу В. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 6/4. Двуокись кремния 40-63 мкм. 1 3-(3-Хлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)пропан-1-он получают из 3(3-хлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-она согласно общему способу С. После перемешивания в течение 3 ч при комнатной температуре катализатор удаляют фильтрованием, а растворитель удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: метиленхлорид. Двуокись кремния 40-63 мкм. 1 3-(2-Хлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1-(5-(4-(трифторметил)фенил)тиен-2-ил)этанона и 2-хлор-4-гидроксибензальдегида согласно общему способу В. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. 3-(2-Хлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)пропан-1-он получают из 3(2-хлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-она согласно общему способу С. После перемешивания в течение 3 ч при комнатной температуре катализатор удаляют фильтрованием, а растворитель удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: метиленхлорид. Двуокись кремния 40-63 мкм. 1 Н ЯМР (300 МГц, CDCl3,в ppm): 3.09-3.15 (m, 2 Н); 3.19-3.25 (m, 2 Н); 6.69 (dd, 1, J=2.5 Гц, J=8.2 Гц); 6.9 (d, 1H, J=2.5 Гц); 7.16 (d, 1H); 7.38 (d, 1H, J=3.8 Гц); 7.66-7.71 (m, 3 Н); 7.76 (d, 1H, J=8.5 Гц). Промежуточное соединение 9: 3-(3-фтор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2 ил)проп-2-ен-1-он 3-(3-Фтор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1-(5-(4-(трифторметил)фенил)тиен-2-ил)этанона и 3-фтор-4-гидроксибензальдегида согласно общему способу В. Осадок перекристаллизовывают из ацетонитрила. 1 Н ЯМР (300 МГц, CDCl3,в ppm): 5.51 (s, 1H); 7.08 (d, 1H, J=8.5 Гц); 7.33-7.48 (m, 3 Н); 7.71 (m,1H); 7.77-7.82 (m, 3 Н); 7.86 (d, 2H, J=8.5 Гц). Промежуточное соединение 10: 3-(3-фтор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2 ил)пропан-1-он 3-(3-Фтор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)пропан-1-он получают из 3(3-фтор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-она согласно общему способу С. Через 2 ч 30 мин при 42 С катализатор удаляют фильтрованием, а растворитель удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 7/3. Двуокись кремния 40-63 мкм. 1 Н ЯМР (300 МГц, CDCl3,в ppm): 3.02 (t, 2 Н, J=7.5 Гц); 3.21 (t, 2 Н, J=7.5 Гц); 5.01 (d, 1H, J=3.8 Гц); 6.97 (m, 3 Н); 7.39 (d, 1 Н, J=3.9 Гц); 7.68 (m, 3H); 7.75 (d, 2H, J=8.2 Гц). Промежуточное соединение 11: 3-(3-бром-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2 ил)проп-2-ен-1-он 3-(3-Бром-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1-(5-(4-(трифторметил)фенил)тиен-2-ил)этанона и 3-бром-4-гидроксибензальдегида согласно общему способу В. Осадок после выпаривания кристаллизуют из этанола. 1 Н ЯМР (300 МГц, DMSO-6 в ppm): 7.01 (d, 1H, J=8.2 Гц); 7.65 (d, 1H, J=15.5 Гц); 7.71 (dd, 1H,J=1.9 Гц, J=8.6 Гц); 7.77-7.84 (m, 3 Н); 7.89 (d, 1H, J=4.1 Гц); 8.03 (d, 2H, J=8.2 Гц); 8.19 (d, 1H, J=1.7 Гц); 8.40 (d, 1H, J=4.1 Гц). 3-(3-Бром-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)пропан-1-он получают из 3(3-бром-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-она согласно общему способу С. После перемешивания в течение 4 ч при комнатной температуре катализатор удаляют фильтрованием, а растворитель удаляют выпариванием под уменьшенным давлением и осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 85/15. Двуокись кремния 40-63 мкм. 1 Н ЯМР (300 МГц, CDCl3,в ppm): 2.99-3.05 (m, 2 Н); 3.18-3.23 (m, 2H); 6.96 (d, 1H, J=8.2 Гц); 7.107.14 (m, 1H); 7.36-7.41 (m, 2H); 7.66-7.69 (m, 3 Н); 7.75 (d, 2H, J=8.2 Гц). Промежуточное соединение 13: 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)фур 2-ил)проп-2-ен-1-он 3-(2,3-Дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)фур-2-ил)проп-2-ен-1-он получают из 1-(5-(4-(трифторметил)фенил)фур-2-ил)этанона и 2,3-дихлор-4-гидроксибензальдегида согласно общему способу В. Осадок после выпаривания промывают дихлорметаном. 1 3-(2,3-Дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)фур-2-ил)пропан-1-он получают из 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)фур-2-ил)про-2-ен-1-она согласно общему способу С. После перемешивания в течение 24 ч при 40 С при давлении водорода 5 бар катализатор удаляют фильтрованием, а растворитель удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 8/2. Двуокись кремния 40-63 мкм. 1 Н ЯМР (300 МГц, CDCl3,в ppm): 3.19 (m, 4H); 6.88 (d, 1H, J=4.1 Гц); 6.90 (d, 1H, J=8,9 Гц); 7.17 3-(2,3-Дихлор-4-гидроксифенил)-1-(5-(4-(трифторметокси)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1-(5-(4-(трифторметокси)фенил)тиен-2-ил)этанона и 2,3-дихлор-4-гидроксибензальдегида согласно общему способу В. Осадок после выпаривания выкристаллизовывают из ацетонитрила. 1 Н ЯМР (300 МГц, DMSO-d6,в ppm): 7.07 (d, 1H, J=9.0 Гц); 7.49 (d, 2H, J=8.4 Гц); 7.80-7.86 (m,3 Н); 7.93-7.98 (m, 2H); 8.09 (d, 1H, J=9.0 Гц); 8.36 (d, 1H, J=4.2 Гц). 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(трифтор 3-(2,3-Дихлор-4-гидроксифенил)-1-(5-(4-(трифторметокси)фенил)тиен-2-ил)-пропан-1-он получают из 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(трифторметокси)фенил)тиен-2-ил)проп-2-ен-1-она согласно общему способу С. После перемешивания в течение 24 ч при комнатной температуре под давлением водорода 10 бар катализатор удаляют фильтрованием, а растворители удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 8/2. Двуокись кремния 40-63 мкм. 1 Н ЯМР (300 МГц, CDCl3,в ppm): 3.13-3.23 (m, 4H); 5.61 (s, 1H); 6.90 (d, 1H, J=8.6 Гц); 7.16 (d, 1H,J=8.6 Гц); 7.25-7.29 (m, 3 Н); 7.64-7.69 (m, 3 Н). Промежуточное соединение 17: 3-(2,3-дифтор-4-гидроксифенил)-1-(5-(4(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он 3-(2,3-Дифтор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1-(5-(4-(трифторметил)фенил)тиен-2-ил)этанона и 2,3-дифтор-4-гидроксибензальдегида согласно общему способу В. Осадок после выпаривания выкристаллизовывают из ацетонитрила. 1 3-(2,3-Дифтор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)пропан-1-он получают из 3-(2,3-дифтор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-она согласно общему способу С. После перемешивания в течение 1 ч при 45 С катализатор удаляют фильтрованием, а растворители удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 7/3. Двуокись кремния 40-63 мкм. 1 3-(4-Гидрокси-3,5-диметилфенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1-(5-(4-(трифторметил)фенил)тиен-2-ил)этанона и 4-гидрокси-3,5-диметилбензальдегида согласно общему способу В. Осадок после выпаривания промывают дихлорметаном. 1 3-(4-Гидрокси-3,5-диметилфенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)-пропан-1-он получают из 3-(4-гидрокси-3,5-диметилфенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-она согласно общему способу С. После перемешивания в течение 24 ч при комнатной температуре под давлением водорода 5 бар катализатор удаляют фильтрованием, а растворители удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания используют "как есть" для выполнения следующей стадии. 1 Н ЯМР (300 МГц, DMSO-d6,в ppm): 2.11 (s, 6 Н); 2.71-2.87 (m, 2 Н); 3.18-3.27 (m, 2 Н); 6.80 (s, 2H); 7.75-8.12 (m, 6H). Промежуточное соединение 21: 1-(5-(4-бромфенил)тиен-2-ил)-3-(2,3-дихлор-4 гидроксифенил)проп-2-ен-1-он 1-(5-(4-Бромфенил)тиен-2-ил)-3-(2,3-дихлор-4-гидроксифенил)проп-2-ен-1-он получают из 1-(5-(4 бромфенил)тиен-2-ил)этанона и 2,3-дихлор-4-гидроксибензальдегида согласно общему способу В. Осадок после выпаривания промывают дихлорметаном. 1 1-(5-(4-Бромфенил)тиен-2-ил)-3-(2,3-дихлор-4-гидроксифенил)проп-2-ен-1-он растворяют в дихлорметане (0,7 г; 1,5 моль/л). Последовательно добавляют по каплям триэтилсилан (2,1 экв.) и трифторуксусную кислоту (8 экв.). После перемешивания в течение 16 ч при комнатной температуре реакционную смесь промывают водой, а затем дихлорметан удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 9/1 до 8/2. Двуокись кремния 40-63 мкм. 1 Н ЯМР (300 МГц, CDCl3,в ppm): 3.15-3.20 (m, 4 Н); 6.90 (d, 1H, J=8.6 Гц); 7.16 (d, 1H, J=8.6 Гц); 7.29 (d, 1H, J=4.2 Гц); 7.50 (d, 2H, J=9.0 Гц); 7.55 (d, 2H, J=9.0 Гц); 7.65 (d, 1H, J=4.2 Гц). Промежуточное соединение 23: 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(метилтио)фенил)тиен-2 ил)проп-2-ен-1-он 3-(2,3-Дихлор-4-гидроксифенил)-1-(5-(4-(метилтио)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1(5-(4-(метилтио)фенил)тиен-2-ил)этанона и 2,3-дихлор-4-гидроксибензальдегида согласно общему способу В. Осадок после выпаривания используют "как есть" для выполнения следующей стадии. 1 Н ЯМР (300 МГц, DMSO-d6,в ppm): 2.53 (s, 3H); 7.07 (d, 1H, J=8.8 Гц); 7.35 (d, 2 Н, J=8.7 Гц); 7.32-7.78 (m, 3 Н); 7.83 (d, 1H, J=15.3 Гц); 7.99 (d, 1H, J=15.3 Гц); 8.09 (d, 1H, J=8.8 Гц); 8.33 (d, 1H, J=3.9 Гц). 3-(2,3-Дихлор-4-гидроксифенил)-1-(5-(4-(метилтио)фенил)тиен-2-ил)пропан-1-он получают из 3(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(метилтио)фенил)тиен-2-ил)проп-2-ен-1-она согласно общему способу С в растворе тетрагидрофурана. После перемешивания в течение 24 ч при 50 С под давлением водорода 10 бар катализатор удаляют фильтрованием, а растворитель удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 8/2. Двуокись кремния 40-63 мкм. 1 Н ЯМР (300 МГц, CDCl3,в ppm): 2.52 (s, 3 Н); 3.11-3.24 (m, 4H); 5.61 (bs, 1H); 6.91 (d, 1H, J=8.6 Гц); 7.17 (d, 1H, J=8.6 Гц); 7.23-7.29 (m, 3 Н); 7.56 (d, 2H, J=8.5 Гц); 7.64 (d, 1H, J=4.1 Гц). Промежуточное соединение 25: 3-(2,3-дихлор-4-гидроксифенил)-1-(5-фенилтиен-2-ил)пропан-1-он 3-(2,3-Дихлор-4-гидроксифенил)-1-(5-фенилтиен-2-ил)пропан-1-он получают из 1-(5-(4 бромфенил)тиен-2-ил)-3-(2,3-дихлор-4-гидроксифенил)проп-2-ен-1-она согласно общему способу С. После перемешивания в течение 24 ч при 40 С под давлением водорода 10 бар катализатор удаляют фильтрованием, а растворитель удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: от 9/1 до 8/2. Двуокись кремния 40-63 мкм. 1 3-(4-Гидрокси-3-метилфенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1-(5-(4-(трифторметил)фенил)тиен-2-ил)этанона и 4-гидрокси-3-метил бензальдегида согласно общему способу В. Осадок после выпаривания промывают дихлорметаном. 1 3-(4-Гидрокси-3-метилфенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)пропан-1-он получают из 3(4-гидрокси-3-метилфенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-она согласно общему способу С. После перемешивания в течение 40 ч при 40 С под давлением водорода 5 бар катализатор удаляют фильтрованием, а растворители удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 9/1 до 8/2. Двуокись кремния 40-63 мкм. 1 3-(4-Гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1-(5-(4(трифторметил)фенил)тиен-2-ил)этанона и 4-гидроксибензальдегида согласно общему способу В. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 6/4. Двуокись кремния 40-63 мкм. 1 3-(4-Гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)пропан-1-он получают из 3-(4 гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-она согласно общему способу С. После перемешивания в течение 1,5 ч при комнатной температуре катализатор удаляют фильтрованием, а растворители удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 8/2. Двуокись кремния 40-63 мкм. 1 3-(2,3-Дихлор-4-гидроксифенил)-1-(5-(3-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-он получают из 1-(5-(3-(трифторметил)фенил)тиен-2-ил)этанона и 2,3-дихлор-4-гидроксибензальдегида согласно общему способу В при 50 С в течение 30 ч. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 7/3. Двуокись кремния 40-63 мкм. 1 Н ЯМР (300 МГц, CDCl3,в ppm): 5.95 (s, 1H); 7.06 (d, 1H, J=8.8 Гц); 7.33 (d, 1H, J=15.5 Гц); 7.46 3-(2,3-Дихлор-4-гидроксифенил)-1-(5-(3-(трифторметил)фенил)тиен-2-ил)пропан-1-он получают из 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(3-(трифторметил)фенил)тиен-2-ил)проп-2-ен-1-она согласно общему способу С. После перемешивания в течение 3 ч при 40 С катализатор удаляют фильтрованием, а растворители удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 8/2. Двуокись кремния 40-63 мкм. 1- 22017449 Пример 4. Синтез соединений согласно изобретению. Соединение 1: трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2 ил)пропил)фенокси)-2-метилпропаноат трет-Бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропаноат получают из 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2 ил)пропан-1-она и трет-бутил бромизобутирата согласно общему способу D. После перемешивания в течение 16 ч растворитель удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 95/5. Двуокись кремния 40-63 мкм. 1 2-(2,3-Дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропановую кислоту получают из трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата согласно общему способу Е с использованием 10 экв. трифторуксусной кислоты. Через 16 ч при комнатной температуре реакционную смесь промывают водой, а затем дихлорметан удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания перекристаллизовывают из метиленхлорида. 1 трет-Бутил 2-(2,3-дихлор-4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)2-метилпропаноат получают из трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2 ил)пропил)фенокси)-2-метилпропаноата согласно общему способу G. 1 2-(2,3-Дихлор-4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропановую кислоту получают из 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2 ил)пропил)фенокси)-2-метилпропановой кислоты согласно общему способу G. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: дихлорметан/метанол: 95/5. Двуокись кремния 40-63 мкм. 1 трет-Бутил 2-(4-(3-(4-иодобензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,3 дихлорфенокси)-2-метилпропаноат получают из трет-бутил 2-(2,3-дихлор-4-(3-гидрокси-3-(5-(4(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата с использованием 1,1 экв. гидрида натрия и 1,1 экв. 4-иодобензилбромида согласно общему способу Н. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 95/5. Двуокись кремния 40-63 мкм. 1 2-(4-(3-(4-Иодобензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,3-дихлорфенокси)-2 метилпропановую кислоту получают из трет-бутил 2-(4-(3-(4-иодобензилокси)-3-(5-(4(трифторметил)фенил)тиен-2-ил)пропил)-2,3-дихлорфенокси)-2-метилпропаноата согласно общему способу Е с использованием 10 экв. трифторуксусной кислоты. После перемешивания в течение 16 ч при комнатной температуре реакционную смесь промывают водой, а затем дихлорметан удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: метиленхлорид/метанол: 9/1. Двуокись кремния 40-63 мкм. 1 2-(4-(3-(Бензилокси)-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)-2,3-дихлорфенокси)-2 метилпропановую кислоту получают из 2-(2,3-дихлор-4-(3-гидрокси-3-(5-(4-(трифторметил)фенил)тиен 2-ил)пропил)фенокси)-2-метилпропановой кислоты с использованием 2,2 экв. гидрида натрия и 2,2 экв. бензилбромида согласно общему способу Н. Осадок после выпаривания растворяют в этаноле в присутствии 2 N гидроксида натрия (20 экв.).- 24017449 После перемешивания в течение 16 ч растворители удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания подкисляют с помощью разбавленного раствора соляной кислоты и затем экстрагируют с дихлорметаном. Органическую фазу высушивают над сульфатом магния, фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле (препаративная HPLC, lichrospher (Merck) RP18 12 мкм 100 А, колонка: 25250 мм). Элюирование: градиент воды, метанола + 0,1% трифторуксусной кислоты: от 22/78 до 0/100. 1 Два энантиомера соединения 7 разделяют с помощью хирально-колоночной полупреперативнойHPLC ChiralpakAD-H (25020 мм, 5 мкм, Chiral Technologies Europe) при комнатной температуре. Элюирование выполняют изократически с н-гептан-этанол (95-5) мобильной фазой с 0,1% трифторуксусной кислотой при скорости потока 18 мл/мин. Энантиомерную чистоту каждого из двух полученных таким образом энантиомеров проверяют с помощью HPLC: колонка Chiralpak AD-H (25046 мм, 5 мкм, Daicel Chemical Industries, Ltd.) при 30 С; изократическое элюирование с мобильной фазой н-гептан-этанол (92-8) с добавлением 0,1% трифторуксусной кислоты; скорость потока 1 мл/мин; трет-Бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутаноат получают из 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)пропан 1-она и трет-бутил 2-бромбутаноата согласно общему способу D. После перемешивания в течение 2 ч смесь подкисляют с помощью разбавленного раствора соляной кислоты и затем экстрагируют этилацетатом. Органическую фазу высушивают над сульфатом магния,фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 9/1. Двуокись кремния 40-63 мкм. 1 2-(2,3-Дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутановую кислоту получают из трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)бутаноата согласно общему способу Е с использованием 17 экв. трифторуксусной кислоты. После перемешивания в течение 4 ч при комнатной температуре реакционную смесь промывают- 25017449 водой, а затем дихлорметан удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле (препаративная HPLC, lichrospher (Merck) трет-Бутил 2-(2,3-дихлор-4-(3-оксо-3-(4-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропаноат получают из 3-(2,3-дихлор-4-гидроксифенил)-1-(4-(4-(трифторметил)фенил)тиен-2 ил)пропан-1-она и трет-бутил бромизобутирата согласно общему способу D. После перемешивания в течение 18 ч смесь подкисляют с помощью разбавленного раствора соляной кислоты и затем экстрагируют этилацетатом. Органическую фазу высушивают над сульфатом магния, фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 9/1. Двуокись кремния 40-63 мкм. 1 2-(2,3-Дихлор-4-(3-оксо-3-(4-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропановую кислоту получают из трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(4-(4(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата согласно общему способу Е с использованием 17 экв. трифторуксусной кислоты. После перемешивания в течение 4 ч при комнатной температуре реакционную смесь промывают водой, а затем дихлорметан удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: метиленхлорид/метанол: 9/1. Двуокись кремния 40-63 мкм. 1 Метил 5-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2,2 диметилпентаноат получают из 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2 ил)пропан-1-она и метил 5-иодо-2,2-диметилпентаноата согласно общему способу D. После перемешивания в течение 2 ч смесь подкисляют с помощью разбавленного раствора соляной- 26017449 кислоты и затем экстрагируют этилацетатом. Органическую фазу высушивают над сульфатом магния,фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 8/2. Двуокись кремния 40-63 мкм. 1 Н ЯМР (300 МГц, CDCl3,в ppm): 1.22 (s, 6H); 1.72-1.81 (m, 6H); 3.16-3.25 (m, 4H); 3.67 (s, 3 Н); 6.76 (d, 1H, J=8.5 Гц); 7.18 (d, 1H, J=8.5 Гц); 7.39 (d, 1H, J=4.1 Гц); 7.66-7.69 (m, 3 Н); 7.75 (d, 2H, J=8.5 Гц). Соединение 13: 5-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)2,2-диметилпентановая кислота 5-(2,3-Дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2,2-диметилпентановую кислоту получают из метил 5-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2 ил)пропил)фенокси)-2,2-диметилпентаноата согласно общему способу F с использованием 10 экв. раствора 2 N гидроксида натрия. После перемешивания в течение 18 ч при 50 С растворители удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания переносят в разбавленный раствор соляной кислоты и затем экстрагируют с метиленхлоридом. Органическую фазу высушивают над сульфатом магния, фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: метиленхлорид/метанол: 95/5. Двуокись кремния 40-63 мкм. 1 трет-Бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)ацетат получают из 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2-ил)пропан-1-она и трет-бутилбромацетата согласно общему способу D. После перемешивания в течение 2 ч смесь подкисляют с помощью разбавленного раствора соляной кислоты и затем экстрагируют этилацетатом. Комбинированную органическую фазу высушивают над сульфатом магния, фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 9/1. Оксид кремния 40-63 мкм. 1 2-(2,3-Дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)уксусную кислоту получают из трет-бутил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2 ил)пропил)фенокси)ацетата согласно общему способу Е с использованием 7 экв. трифторуксусной кислоты. После перемешивания в течение 4 ч при комнатной температуре реакционную смесь промывают водой, а затем дихлорметан удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле (препаративная HPLC, lichrospher (Merck) Этил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 фенилэтилацетат получают из 3-(2,3-дихлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2 ил)пропан-1-она и 2-бромфенилэтилацетата согласно общему способу D. После перемешивания в течение 16 ч смесь подкисляют с помощью разбавленного раствора соляной кислоты и затем экстрагируют этилацетатом. Органическую фазу высушивают над сульфатом магния, фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле. Элюирование: циклогексан/этилацетат: 9/1. Двуокись кремния 40-63 мкм. 1 2-(2,3-Дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 фенилуксусную кислоту получают из этил 2-(2,3-дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2 ил)пропил)фенокси)-2-фенилацетата согласно общему способу F с использованием 20 экв. раствора 2 N гидроксида натрия. После перемешивания в течение 16 ч при 40 С смесь подкисляют с помощью разбавленного раствора соляной кислоты и затем экстрагируют этилацетатом. Органическую фазу высушивают над сульфатом магния, фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью хроматографии на силикагеле (препаративная HPLC, lichrospher (Merck) трет-Бутил 2-(2-хлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропаноат получают из 3-(3-хлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2 ил)пропан-1-она и трет-бутилбромизобутирата согласно общему способу D. После перемешивания в течение 2 ч смесь подкисляют с помощью 1 N разбавленного раствора лимонной кислоты и затем экстрагируют этилацетатом. Органическую фазу высушивают над сульфатом магния, фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания 2-(2-Дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропановую кислоту получают из трет-бутил 2-(2-хлор-4-(3-оксо-3-(5-(4(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата согласно общему способу Е с использованием 17 экв. трифторуксусной кислоты. Через 1 ч при комнатной температуре реакционную смесь промывают водой, а затем дихлорметан удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания выкристаллизовывают из смеси метиленхлорид/гептан: 5/5. 1 Н ЯМР (300 МГц, DMSO-d6,в ppm): 1.49 (s, 6H); 2.87 (t, 2H, J=7.7 Гц); 3.32 (t, 2H, J=7.7 Гц); 6.84 трет-Бутил 2-(3-хлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропаноат получают из 3-(2-хлор-4-гидроксифенил)-1-(5-(4-(трифторметил)фенил)тиен-2 ил)пропан-1-она и трет-бутил бромизобутирата согласно общему способу D. После перемешивания в течение 2 ч смесь подкисляют с помощью 1 N разбавленного раствора лимонной кислоты и затем экстрагируют этилацетатом. Органическую фазу высушивают над сульфатом магния, фильтруют и затем концентрируют под уменьшенным давлением. Осадок после выпаривания очищают с помощью флэш-хроматографии на силикагеле. Элюирование: циклогексан/дихлорметан: 5/5. Двуокись кремния 40-63 мкм. 1 2-(3-Дихлор-4-(3-оксо-3-(5-(4-(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2 метилпропановую кислоту получают из трет-бутил 2-(3-хлор-4-(3-оксо-3-(5-(4(трифторметил)фенил)тиен-2-ил)пропил)фенокси)-2-метилпропаноата согласно общему способу Е с использованием 17 экв. трифторуксусной кислоты. Через 1 ч при комнатной температуре реакционную смесь промывают водой, а затем дихлорметан удаляют выпариванием под уменьшенным давлением. Осадок после выпаривания выкристаллизовывают из смеси метиленхлорид/гептан: 5/5. 1
МПК / Метки
МПК: C07D 333/22, A61P 3/00, A61K 31/381
Метки: 3-фенил-1-(фенилфуранил)пропан-1-онов, применение, замещенных, 3-фенил-1-(фенилтиенил)пропан-1-онов, получение, производные
Код ссылки
<a href="https://eas.patents.su/30-17449-proizvodnye-zameshhennyh-3-fenil-1-feniltienilpropan-1-onov-i-3-fenil-1-fenilfuranilpropan-1-onov-ih-poluchenie-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные замещенных 3-фенил-1-(фенилтиенил)пропан-1-онов и 3-фенил-1-(фенилфуранил)пропан-1-онов, их получение и применение</a>
Предыдущий патент: 4-амино-4-оксобутаноиловые пептиды как ингибиторы вирусной репликации
Следующий патент: Подгузник одноразового использования
Случайный патент: Катализатор дегидрирования и способ получения носителя катализатора дегидрирования


































