Бензил- и пиридинилпроизводные в качестве модуляторов пути передачи сигнала hedgehog
Номер патента: 16564
Опубликовано: 30.05.2012
Авторы: Перес Лоренс Блас, Льямас Луис, Макюан Майкл А., Дай Миао, Хэ Фэн, Ли Джон, Юсуфф Наим, Пойкерт Штефан, Миллер-Мослин Карен, Келлехер Джозеф III, Джейн Риши Кумар, Карки Раджеш
Формула / Реферат
1. Соединение формулы I
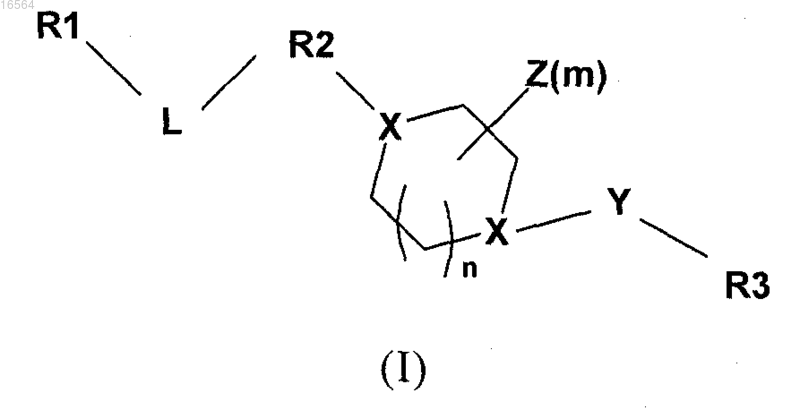
и его фармацевтически приемлемые соли, где
R1 обозначает фенил или het, которые могут быть незамещенными или замещенными;
R2 обозначает het, в котором по меньшей мере одним гетероатомом является N и который может быть незамещенным или замещенным;
L обозначает C1-С6-алкил;
X обозначает N;
Y обозначает связь, СН2;
R3 обозначает арил или het, который является замещенным;
Z обозначает Н, C1-С6-алкил, оксогруппу, C(O)OR6; и
m равно 0, 1 и 2;
заместителями фенила, арила или het в R1, R2 или R3 могут быть один или большее количество из следующих заместителей: C1-С6-алкил, циклоалкил, С1-С6-алкоксигруппа, С3-С10-циклоалкоксигруппа, галоген, -CN, оксогруппа, арил, карбалкоксигруппа, OCF3, CF3, ОН, -C(O)N(R6)2, C(O)R6, -C(O)OR6, -N(R6)2, -NHC(O)R6, -SO2(R6), -SO2N(R6)2, CH2OC(O)N(R6)2, -CH2N(R6)2, -NHC(O)OR6, NHC(O)N(R6)2,
-CH2NHC(O)R6, CH2NHC(O)N(R6)2, CH2NHSO2(R6), CH2NHC(O)OR6, -OC(O)R6, NHC(O)R6, О-арил, het или O-het, в которых алкил, het, циклоалкил, циклоалкоксигруппа, N(R6)2, арил, карбалкоксигруппа и алкоксигруппа могут быть незамещенными или замещенными одним или большим количеством из следующих заместителей: галоген, -ОСН3, -OCF3, -ОН, -NH2, C1-С6-алкил или OR6, оксогруппа, -N(H)0-2-R6,
-CN, -C(O)N(R6)2, C(O)R6, C(O)OR6, -N(R6)2, NHC(O)R6, -SO2(R6), -SO2N(R6)2, OSO2R6, -CH2N(R6)2,
-CH2NHC(O)R6, -OC(O)R6, арил, NHC(O)(R6), О-арил, het, O-het или циклоалкил;
R6 обозначает Н, C1-С6-алкил, С2-С6-алкенил, арил, het, или два R6 у одного атома могут образовать С3-С10-циклоалкил, арил или het; и алкил, алкенил, арил, het, циклоалкил, или het могут быть незамещенными или замещенными с помощью ОН, оксогруппы, C1-С6-алкоксигруппы, NR6, N-C1-С6-алкила, ацила, арила или группы het;
het обозначает 5-7-членное моноциклическое гетероциклическое кольцо, которое может быть ароматическим или неароматическим, содержащим 1-4 кольцевых гетероатома, выбранных из группы, включающей N, О и S; или 8-12-членную конденсированную кольцевую систему, которая включает по меньшей мере одно 5-7-членное гетероциклическое кольцо, которое может быть ароматическим или неароматическим, содержащим 1, 2 или 3 кольцевых гетероатома, выбранных из группы, включающей N, О и S, и этот het является незамещенным или замещенным;
арил обозначает ароматический радикал, содержащий от 6 до 14 кольцевых атомов углерода и не содержащий кольцевых гетероатомов, где указанная арильная группа может быть моноциклической или конденсированной бициклической, которая может быть незамещенной или содержать один или большее количество заместителей; и
n равно 1 или 2.
2. Соединение по п.1, в котором R2 выбран из
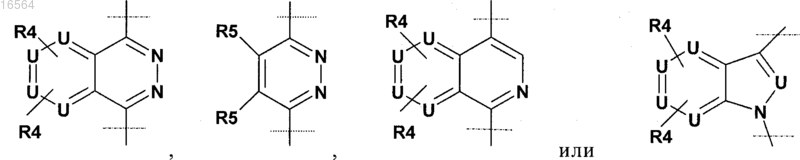
(где N связан с L),
где U обозначает C(H)0-1 или N и не более двух U обозначают N;
R4 независимо обозначает Н, -N(R6)2, -ОН, галоген, -CN, -C(O)OR6, -C(O)N(R6)2, С1-С6-алкил или C1-С6-алкоксигруппу, где алкил и алкоксигруппа могут быть незамещенными или замещенными одним или большим количеством атомов галогена, -ОН, -CN, -NH2, -NO2, -C(O)NH2, -C(O)NH(C1-C6-алкил), -C(O)N(С1-С6-алкил)2, -C(O)(С1-С6-алкил), -NHC(O)(С1-С6-алкил), NH(C1-C6-алкил), -N(С1-С6-алкил)2, -SO2(С1-С6-алкил), -SO2NH2, -SO2NH(С1-С6-алкил);
R5 обозначает Н, арил, het, С1-С6-алкил, C1-С6-алкоксигруппу или С3-С10-циклоалкил, которые могут быть незамещенными или замещенными одним или большим количеством из следующих заместителей: галоген, С3-С10-циклоалкил, арил, het, и где по меньшей мере один R5 не обозначает Н; и
L обозначает C1-С6-алкил.
3. Соединение по п.1, в котором R2 выбран из
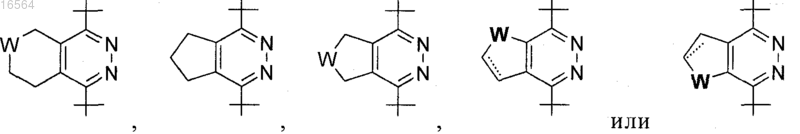
где W обозначает О, NR7 или SO2,
и R7 обозначает Н, связь, C1-С6-алкил или C1-С6-ацил.
4. Соединение по п.1, в котором R2 обозначает
и R3 обозначает het.
5. Соединение по п.2, в котором
R3 обозначает арил или het; и если R3 обозначает het, то по меньшей мере одним кольцевым гетероатомом является N;
U обозначает С(Н)0-1;
R4 обозначает Н, СН3, галоген или -CN;
L обозначает СН2;
X обозначает N;
Y обозначает связь; и
Z обозначает Н или СН3.
6. Соединение по п.5, в котором R2 обозначает
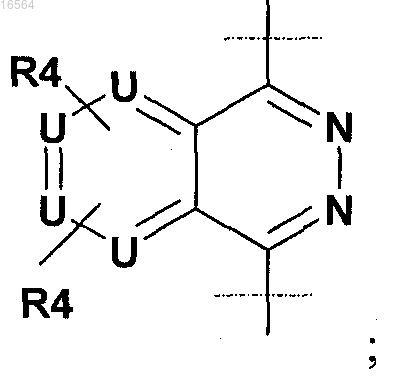
R4 обозначает Н и U обозначает С(Н)0-1,
R3 обозначает фенил, пиридин, пиразин, пиридазин или пиримидин,
Z обозначает Н или СН3 и
n равно 1.
7. Соединение по п.5, в котором R2 выбран из
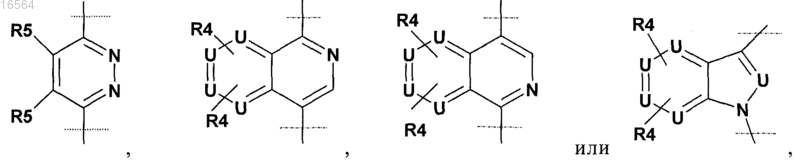
где N связан с L; и
по меньшей мере один R5 обозначает СН3.
8. Фармацевтическая композиция, включающая соединение по п.1 в терапевтически эффективном количестве.
9. Способ лечения млекопитающего, страдающего от патологии, связанной с путем Hedgehog, который включает введение указанному млекопитающему, нуждающемуся в лечении, соединения по п.1 в терапевтически эффективном количестве.
10. Соединение, выбранное из группы, включающей
6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]никотинонитрил;
1-бензил-4-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]фталазин;
1-бензил-4-[4-(5-трифторметилпиридин-2-ил)-[1,4]-диазепан-1-ил]фталазин;
6-[4-(4-пиридин-4-илметилфталазин-1-ил)пиперазин-1-ил]никотинонитрил;
этиловый эфир 4-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]бензойной кислоты;
1-(4-фенилпиперазин-1-ил)-4-пиридин-4-илметилфталазин;
1-бензил-4-[4-(4-трет-бутилфенил)пиперазин-1-ил]фталазин;
1-[4-(4-трет-бутилфенил)пиперазин-1-ил]-4-пиридин-4-илметилфталазин;
1-[4-(4-трет-бутилфенил)пиперазин-1-ил]-4-(3,5-дихлорбензил)фталазин;
4-[4-(4-трет-бутилфенил)пиперазин-1-ил]-6-метил-1-пиридин-4-илметилфталазин;
1-(2-метилпиридин-4-илметил)-4-(4-фенилпиперазин-1-ил)фталазин;
1-бензил-4-(4-фенилпиперидин-1-ил)фталазин;
1-(4-фенилпиперидин-1-ил)-4-пиридин-4-илметилфталазин;
1-(2-метилпиридин-4-илметил)-4-(4-фенилпиперидин-1-ил)фталазин;
1-пиридин-4-илметил-4-[4-(3-трифторметилфенил)пиперазин-1-ил]фталазин;
4-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]бензойная кислота;
1-бензил-4-[4-(3-хлор-5-трифторметилпиридин-2-ил)-[1,4]-диазепан-1-ил]фталазин;
1-бензил-4-(4-хинолин-2-илпиперазин-1-ил)фталазин;
6-[4-(4-бензилфталазин-1-ил)-[1,4]-диазепан-1-ил]никотинонитрил;
4-(4-пиридин-4-илметилфталазин-1-ил)-3,4,5,6-тетрагидро-2Н-[1,2']-бипиразинил;
4-(4-бензилфталазин-1-ил)-3,4,5,6-тетрагидро-2Н-[1,2']-бипиразинил;
1-(2-метилпиридин-4-илметил)-4-(4-пиридин-2-илпиперазин-1-ил)фталазин;
1-пиридин-4-илметил-4-(4-пиридин-2-илпиперазин-1-ил)фталазин;
1-бензил-4-(4-пиридин-2-илпиперазин-1-ил)фталазин;
1-бензил-4-(4-пиримидин-2-илпиперазин-1-ил)фталазин;
1-пиридин-4-илметил-4-(4-пиридин-4-илпиперазин-1-ил)фталазин;
1-бензил-4-(3-метил-4-п-толилпиперазин-1-ил)фталазин;
1-(3-метил-4-п-толилпиперазин-1-ил)-4-пиридин-4-илметилфталазин;
1-(2-метилпиридин-4-илметил)-4-(3-метил-4-п-толилпиперазин-1-ил)фталазин;
1-бензил-4-[4-(3,4-дихлорфенил)пиперазин-1-ил]фталазин;
1-бензил-4-(4-нафталин-2-илпиперазин-1-ил)фталазин;
1-(4-нафталин-2-илпиперазин-1-ил)-4-пиридин-4-илметилфталазин;
1-(2-метилпиридин-4-илметил)-4-(4-нафталин-2-илпиперазин-1-ил)фталазин;
1-бензил-4-(4-нафталин-1-илпиперазин-1-ил)фталазин;
1-(2-метилпиридин-4-илметил)-4-(4-нафталин-1-илпиперазин-1-ил)фталазин;
1-(4-нафталин-1-илпиперазин-1-ил)-4-пиридин-4-илметилфталазин;
1-бензил-4-(4-пиридин-4-илпиперазин-1-ил)фталазин;
1-бензил-4-(4-о-толилпиперазин-1-ил)фталазин;
2-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]пиримидин-5-карбонитрил;
1-бензил-4-(4-пиримидин-2-ил-[1,4]-диазепан-1-ил)фталазин;
1-бензил-4-[4-(4-метилпиримидин-2-ил)-[1,4]-диазепан-1-ил]фталазин;
1-бензил-4-[4-(5-пропилпиримидин-2-ил)пиперазин-1-ил]фталазин;
1-бензил-4-[4-(5-этилпиримидин-2-ил)пиперазин-1-ил]фталазин;
1-бензил-4-[4-(5-пропилпиримидин-2-ил)-[1,4]-диазепан-1-ил]фталазин;
1-бензил-4-[4-(5-этилпиримидин-2-ил)-[1,4]-диазепан-1-ил]фталазин;
2-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]-6-метокси-3Н-пиримидин-4-он;
1-бензил-4-[4-(4-метилпиримидин-2-ил)пиперазин-1-ил]фталазин;
1-бензил-4-[4-(4,6-диметилпиримидин-2-ил)пиперазин-1-ил]фталазин;
1-бензил-4-[4-(5-хлор-3-фторпиридин-2-ил)пиперазин-1-ил]фталазин;
1-бензил-4-[4-(4-трифторметилпиримидин-2-ил)пиперазин-1-ил]фталазин;
1-бензил-4-[4-(2,5-дифторпиридин-3-ил)пиперазин-1-ил]фталазин;
1-бензил-4-[4-(3,5-дифторпиридин-2-ил)пиперазин-1-ил]фталазин;
6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]никотинамид;
этиловый эфир 6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]никотиновой кислоты;
2-{6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]пиридин-3-ил}пропан-2-ол;
6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]никотиновая кислота;
6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]-N-(2-гидроксиэтил)-N-метилникотинамид;
6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]-N-этил-N-(2-гидроксиэтил)никотинамид;
6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]-N-(2-гидроксиэтил)никотинамид;
6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]-N-(2-метоксиэтил)никотинамид;
6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]-N-(2-метоксиэтил)-N-метилникотинамид;
6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]-N-(2-диметиламиноэтил)никотинамид;
{6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]пиридин-3-ил}-(4-метилпиперазин-1-ил)метанон;
{6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]пиридин-3-ил}пиперазин-1-илметанон;
{6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]пиридин-3-ил}морфолин-4-илметанон;
N-бензил-6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]никотинамид;
6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]-N-циклогексилметилникотинамид;
6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]-N-пропилникотинамид;
{6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]пиридин-3-ил}-(3-гидроксипирролидин-1-ил)метанон;
{6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]пиридин-3-ил}тиазолидин-3-илметанон;
{6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]пиридин-3-ил}-(1-оксо-1-l*4*-тиазолидин-3-ил)метанон;
метиловый эфир ({6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]пиридин-3-карбонил}амино)уксусной кислоты;
1-бензил-4-[4-(4-трифторметилфенил)пиперазин-1-ил]фталазин;
6-{4-[4-(3-трифторметилбензил)фталазин-1-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[4-(4-цианобензил)фталазин-1-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[4-(3,4-диметоксибензил)фталазин-1-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[4-(4-хлорбензил)фталазин-1-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[4-(3-хлорбензил)фталазин-1-ил]пиперазин-1-ил}никотинонитрил;
6-[4-(4-фенетилфталазин-1-ил)пиперазин-1-ил]никотинонитрил;
6-[4-(4-нафталин-2-илметилфталазин-1-ил)пиперазин-1-ил]никотинонитрил;
6-{4-[4-(4-трифторметилбензил)фталазин-1-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[4-(4-метоксибензил)фталазин-1-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[4-(3-цианобензил)фталазин-1-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[4-(4-бромбензил)фталазин-1-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[4-(3-бромбензил)фталазин-1-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[4-(1-фенилэтил)фталазин-1-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[4-(4-метилбензил)фталазин-1-ил]пиперазин-1-ил}никотинонитрил;
N-{6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]пиридин-3-илметил}ацетамид;
С-{6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]пиридин-3-ил}метиламин;
4-[4-(4-пиридин-4-илметилфталазин-1-ил)пиперазин-1-ил]бензиламин;
4-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]бензиламин;
4-[5-({6-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]пиридин-3-илметил}карбамоил)пентил]-8-этил-3,8,9,10-тетрагидро-2Н-1,6,11-триокса-8,13-диаза-4-азониапентацен;
N-{4-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]бензил}ацетамид;
N-{4-[4-(4-пиридин-4-илметилфталазин-1-ил)пиперазин-1-ил]бензил}ацетамид;
бензиловый эфир {4-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]бензил}карбаминовой кислоты;
бензиловый эфир {4-[4-(4-пиридин-4-илметилфталазин-1-ил)пиперазин-1-ил]бензил}карбаминовой кислоты;
N-{4-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]бензил}пропионамид;
N-{4-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]бензил}-2-метоксиацетамид;
N-{4-[4-(4-бензилфталазин-1-ил)пиперазин-1-ил]бензил}-3-метилбутирамид;
6-[4-(1-бензилизохинолин-4-ил)пиперазин-1-ил]никотинонитрил;
6-{4-[1-(3-цианобензил)изохинолин-4-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[1-(3-хлорбензил)изохинолин-4-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[1-(3-трифторметилбензил)изохинолин-4-ил]пиперазин-1-ил}никотинонитрил;
6-[4-(4-бензилизохинолин-1-ил)пиперазин-1-ил]никотинонитрил;
4-{4-[6-(4-фторбензил)-4-метилпиридазин-3-ил]пиперазин-1-ил}бензонитрил;
4-{4-[6-(4-фторбензил)-5-метилпиридазин-3-ил]пиперазин-1-ил}бензонитрил;
4-{4-[6-(4-бензил)-4-метилпиридазин-3-ил]пиперазин-1-ил}никотинонитрил;
4-{4-[6-(4-бензил)-5-метилпиридазин-3-ил]пиперазин-1-ил}никотинонитрил;
6-бензил-4-метил-3-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]пиридазин;
6-бензил-5-метил-3-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]пиридазин;
6-(4-фторбензил)-4-метил-3-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]пиридазин;
6-(4-фторбензил)-5-метил-3-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]пиридазин;
4-{4-[6-(4-хлорбензил)-4-метилпиридазин-3-ил]пиперазин-1-ил}никотинонитрил;
4-{4-[6-(4-хлорбензил)-5-метилпиридазин-3-ил]пиперазин-1-ил}никотинонитрил;
4-{4-[6-(4-фторбензил)-4,5-диметилпиридазин-3-ил]пиперазин-1-ил}никотинонитрил;
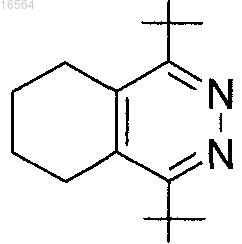
4-{4-[4-(4-фторбензил)-5,6,7,8-тетрагидрофталазин-1-ил]пиперазин-1-ил}никотинонитрил;
6-{4-[4-(4-фторбензил)-6,7-дигидро-5Н-циклопента[d]пиридазин-1-ил]пиперазин-1-ил}никотинонитрил;
3-{4-[1-(4-фторбензил)-1Н-индол-3-ил]пиперидин-1-карбонил}бензонитрил;
4-[1-(4-фторбензил)-1H-индол-3-ил]-5'-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2]-бипиридинил;
4-[3-(5'-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2']-бипиридинил-4-ил)индол-1-илметил]бензонитрил;
4-(1-бензил-1Н-индол-3-ил)-5'-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2]-бипиридинил;
4-[1-(4-фторбензил)-1Н-индол-3-ил]-3,4,5,6-тетрагидро-2Н-[1,2']-бипиридинил-5'-карбонитрил;
4-[1-(4-бромбензил)-1Н-индол-3-ил]-5'-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2]-бипиридинил;
4-(1-бензил-1Н-индол-3-ил)-3,4,5,6-тетрагидро-2Н-[1,2']-бипиридинил-5'-карбонитрил;
{4-[1-(4-фторбензил)-1Н-индол-3-ил]пиперидин-1-ил}-(3-фторфенил)метанон;
4-{4-[1-(4-фторбензил)-1Н-индол-3-ил]пиперидин-1-карбонил}бензонитрил;
3-{4-[1-(4-фторбензил)-1H-индол-3-ил]пиперидин-1-карбонил}бензонитрил;
{4-[1-(4-фторбензил)-1Н-индол-3-ил]пиперидин-1-ил}-(4-трифторметилфенил)метанон или
{4-[1-бензил-1Н-индол-3-ил]пиперидин-1-ил}-(4-трифторметилфенил)метанон.
Текст
В изобретении описаны соединения, применяющиеся при диагностике и лечении патологий,связанных с путем Hedgehog, включая, но не ограничиваясь только ими, образование опухоли,рак, неоплазию и незлокачественные гиперпролиферативные нарушения; точнее, соединения формулы I БЕНЗИЛ- И ПИРИДИНИЛПРОИЗВОДНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ ПУТИ ПЕРЕДАЧИ СИГНАЛА HEDGEHOG 016564 Уровень техники Передача сигнала белком Hedgehog (Hh) впервые обнаружена у дрозофил как важный механизм регуляции формирования структуры эмбриона или процесс, с помощью которого клетки эмбриона образуют упорядоченные пространственные группировки дифференцированных тканей (Nusslein-Volhard et al.(1980) Nature 287, 795-801). В клетках млекопитающих идентифицированы три гена Hedgehog, SonicHedgehog (Shh), Indian Hedgehog (Ihh) и Desert Hedgehog (Dhh). Гены Hedgehog кодируют секретированные белки, которые подвергаются посттрансляционным модификациям, включая аутокаталитическое расщепление, и модификацию липидов (пальмитоилирование) на N-конце и модификацию холестерина на С-конце. Модифицированный липидом N-концевой белок Hedgehog вызывает сигнальную активность на пути белка и коммуникация между клетками возникает вследствие отправки растворимого белка Hedgehog от сигнализирующей клетки и его приема отвечающей клеткой. В отвечающих клетках содержащий 12 трансмембранных спиралей рецептор Patched (Ptch) действует в качестве негативного регулятора передачи сигнала Hh и содержащий 7 трансмембранных спиралей белок Smoothened (Smo) в качестве позитивного регулятора передачи сигнала Hh. В состоянии покоя свободный Ptch (т.е. не связанный с Hh) стехиометрически подавляет активность пути, индуцируемого Smo (Taipale et al. (2002) Nature 418: 892); однако на связывающем лиганд белке Hh репрессия Smo ослабляется и результирующий каскад сигналов приводит к активации и ядерной транслокации факторов транскрипции Gli (Gli1, Gli2 и Gli3). Расположенные в прямом направлении гены-мишени транскрипции передачи сигнала белком Hh включают Wnts, TGF и Ptc и Gli1, которые являются элементами регуляторной петли положительной и отрицательной обратной связи. Генами-мишенями передачи сигнала посредством Hh также являются несколько генов клеточного цикла и генов, регулирующих пролиферацию, такие как c-myc, циклин D и Е. Известно, что передача сигнала белком Hh регулирует самые различные биологические процессы,такие как пролиферацию и дифференциацию клеток и образование органа тканеспецифическим и зависимым от дозы образом. При развитии нервных трубок Shh экспрессируется в вентральной пластинке нервной трубки и направляет дифференциацию специфических подтипов нейронов, включая моторные и допаминергические нейроны. Также известно, что Hh регулирует пролиферацию клетокпредшественников нейронов, таких как невроциты-зерна мозжечка и нервные стволовые клетки. При развитии желудочно-кишечного тракта для развития поджелудочной железы необходим низкий уровень передачи сигнала белком Hh, тогда как высокий уровень передачи сигнала белком Hh блокирует развитие поджелудочной железы. Также известно, что Hh играет важную роль в пролиферации стволовых клеток и органогенезе кожи, предстательной железы, яичек и костного мозга. Обычно передача сигнала белком Hh точно регулируется во время пролиферации, дифференциации клеток и формирования структуры эмбриона. Однако аберрантная активация пути передачи сигналаHedgehog вследствие мутаций, которые конститутивно активируют этот путь, например, может привести к патологическим последствиям. Например, мутации, ведущие к потере функции Patched обнаружены при синдроме Горлина (наследственный синдром, характеризующийся высоким риском раковых заболеваний кожи и головного мозга, также известный, как синдром базально-клеточного невуса (СБКН; и мутации Smo и Gli, ведущие к потере функции, связаны с базально-клеточной карциномой и глиобластомой. Базально-клеточная карцинома (БКК) является самой распространенной формой рака кожи, ежегодно обнаруживающейся более чем у 90000 американцев. Обнаружено, что конститутивная активацияHh стимулирует онкогенез при БКК, медуллобластоме (самая распространенная опухоль головного мозга), рабдомиосаркоме, раке поджелудочной железы, мелкоклеточном раке легких, раке предстательной железы и раке молочной железы. Кроме участия в онкогенезе передача сигнала белком Hh также участвует в метастазировании рака предстательной железы. Передача сигнала белком Hh может участвовать во многих других типах опухолей и такие взаимосвязи, видимо, будут еще обнаруживаться; такие исследования активно проводятся во многих центрах по изучению рака во всем мире. Для пролиферации этих раковых клеток необходима активация пути Hh и блокирование путей передачи сигнала Hh часто подавляет пролиферацию раковых клеток. В действительности, антагонист Hh циклопамин и Gli1 siPHK могут эффективно блокировать пролиферацию этих раковых клеток и могут уменьшить размер опухоли в моделях ксенотрансплантата, указывая на то, что новые антагонисты Hh могут стать новыми химиотерапевтическими средствами лечения этих типов рака. На экспериментальных моделях на животных показано, что антагонист Hh циклопамин подавляет метастазирование рака предстательной железы. Кроме участия в раке передача сигнала белком Hh также играет важную роль в нормальном гомеостазе и регенерации тканей. Путь Hh активируется после повреждения сетчатки, желчного протока, легких, кости и предстательной железы на моделях мышей. Путь Hh также всегда является активным в волосяных фолликулах, костном мозге и некоторых областях центральной нервной системы (ЦНС) и для доброкачественной гиперплазии предстательной железы и образования кровеносных сосудов при экссудативной дегенерации желтого пятна необходима активность пути Hedgehog. Процессы регенерации клеток можно блокировать антителами анти-Shh и циклопамином. Поэтому небольшие молекулыантагонисты пути передачи сигнала Hh могут быть применимы для лечения нейрональных пролифера-1 016564 тивных заболеваний, доброкачественной гиперплазии предстательной железы, при экссудативной дегенерации желтого пятна, псориазе, пролиферативных заболеваниях костного мозга и лейкозах, остеопетрозе и выпадении волос. Данные о том, что конститутивная активация Smo приводит к раку (например, БКК) и что Smo может быть онкогенным при его высвобождении при ингибировании посредством Ptch, указывают на применимость антагонистов Smo в качестве терапевтических средств для лечения таких нарушений (Stone etal. (1996) Nature 384: 129). Поэтому молекулы, которые модулируют активность пути передачи сигналаHedgehog, например которые модулируют активность Smo, являются терапевтически полезными. Краткое изложение сущности изобретения Настоящее изобретение в целом относится к новым соединениям, предназначенным для диагностики и лечения патологий, связанных с путем Hedgehog, включая, но не ограничиваясь только ими, образование опухоли, рак, неоплазию и незлокачественные гиперпролиферативные нарушения. Настоящее изобретение относится к новым соединениям, новым композициям, способам их применения и способам их получения, и такие соединения обычно являются фармакологически полезными в качестве средств для лечения, механизм действия которых включает подавление онкогенеза, роста опухоли и жизнедеятельности опухоли с помощью средств, которые ингибируют путь передачи сигнала Hedgehog и Smo. Соединения и способы, предлагаемые в настоящем изобретении (например, соединение формулы I), относятся к ингибированию активации пути передачи сигнала Hedgehog, например, путем ингибирования аберрантных состояний роста, обусловленных такими фенотипами, как потеря функции Ptc, усиление функции Hedgehog, усиление функции Smoothened или усиление функции Gli, и включает взаимодействие клетки с соединениями, предлагаемыми в настоящем изобретении (например, соединением формулы I), в количестве, достаточном для подавления нормальной активности Ptc, подавления нормальной активности Hedgehog или активности Smoothened (например, для обращения или подавления аберрантного состояния роста). Настоящее изобретение относится к соединениям формулы (I) и его фармацевтически приемлемым солям, гдеR1 обозначает фенил или het, которые могут быть незамещенными или замещенными;R2 обозначает het, в котором по меньшей мере одним гетероатомом является N и который может быть незамещенным или замещенным;R3 обозначает арил или het, который является замещенным;m равно 0, 1 и 2; заместителями фенила, арила или het в R1, R2 или R3 могут быть один или большее количество из следующих заместителей: C1-С 6-алкил, циклоалкил, C1-С 6-алкоксигруппа, С 3-С 10-циклоалкоксигруппа,галоген, -CN, оксогруппа, арил, карбалкоксигруппа, OCF3, CF3, ОН, -C(O)N(R6)2, C(O)R6, -C(O)OR6,-N(R6)2, -NHC(O)R6, -SO2(R6), -SO2N(R6)2; CH2OC(O)N(R6)2, -CH2N(R6)2, -NHC(O)OR6, NHC(O)N(R6)2,-CH2NHC(O)R6, CH2NHC(O)N(R6)2, CH2NHSO2(R6), CH2NHC(O)OR6, -OC(O)R6, NHC(O)R6, О-арил, het или O-het, в которых алкил, het, циклоалкил, циклоалкоксигруппа, N(R6)2, арил, карбалкоксигруппа и алкоксигруппа могут быть незамещенными или замещенными одним или большим количеством из следующих заместителей: галоген, -ОСН 3, -OCF3, -ОН, -NH2, C1-С 6-алкил или OR6, оксогруппа, -N(H)0-2-R6,-CN, -C(O)N(R6)2, C(O)R6, C(O)OR6, -N(R6)2, NHC(O)R6, -SO2(R6), -SO2N(R6)2, OSO2R6, -CH2N(R6)2,-CH2NHC(O)R6, -OC(O)R6, арил, NHC(O)(R6), О-арил, het, O-het или циклоалкил;R6 обозначает Н, C1-С 6-алкил, С 2-С 6-алкенил, арил, het, или два R6 у одного атома могут образовать С 3-С 10-циклоалкил, арил или het; и алкил, алкенил, арил, het, циклоалкил, или het могут быть незамещенными или замещенными с помощью ОН, оксогруппы, C1-С 6-алкоксигруппы, NR6, N-C1-С 6-алкила, ацила,арила или группы het;het обозначает 5-7-членное моноциклическое гетероциклическое кольцо, которое может быть ароматическим или неароматическим, содержащим 1-4 кольцевых гетероатома, выбранных из группы,включающей N, О и S; или 8-12-членную конденсированную кольцевую систему, которая включает по меньшей мере одно 5-7-членное гетероциклическое кольцо, которое может быть ароматическим или неароматическим, содержащим 1, 2 или 3 кольцевых гетероатома, выбранных из группы, включающей N, О и S, и этот het является незамещенным или замещенным;-2 016564 арил обозначает ароматический радикал, содержащий от 6 до 14 кольцевых атомов углерода и не содержащий кольцевых гетероатомов, где указанная арильная группа может быть моноциклической или конденсированной бициклической, которая может быть незамещенной или содержать один или большее количество заместителей; иn равно 1 или 2. Настоящее изобретение также относится к фармацевтическим композициям, включающим терапевтически эффективные количества соединений формулы I, определенных выше в настоящем изобретении,или их фармацевтически приемлемых солей и фармацевтический носитель. Соединения, предлагаемые в настоящем изобретении, как дополнительно описано ниже, включают небольшие молекулы - ингибиторы или антагонисты синтеза, экспрессирования, продуцирования, стабилизации, фосфорилирования, изменения положения в клетке и/или активности Smo. Соединения, предлагаемые в настоящем изобретении, включают, но не ограничиваются только ими, соединения формулы I. Одним объектом настоящего изобретения являются способы применения соединений для ингибирования зависимого от Smo пути активации. Другим объектом настоящего изобретения являются способы применения соединений для ингибирования независимого от Hedgehog (лиганда) пути активации. В некоторых вариантах осуществления способы, предлагаемые в настоящем изобретении, можно использовать для противодействия фенотипическим эффектам нежелательной активации пути Hedgehog, таким как мутации, обусловленные усилением функции Hedgehog, потерей функции Ptc или усилением функции Smoothened. Например, способ, предлагаемый в настоящем изобретении, может включать взаимодействие клетки (in vitro или in vivo) с антагонистом Smo, таким как соединение, предлагаемое в настоящем изобретении (например, соединение формулы I) или другая небольшая молекула в количестве, достаточном для подавления зависимого от Smoothened и/или независимого от Hedgehog пути активации. Соединения и способы, предлагаемые в настоящем изобретении, можно использовать для регулирования пролиферации и/или дифференциации клеток in vitro и/или in vivo, например при образовании тканей из стволовых клеток, или для предупреждения роста гиперпролиферативных клеток. В другом предпочтительном варианте осуществления взаимодействие клетки с соединением, предлагаемым в настоящем изобретении (например, соединением формулы I), или его введение в клетку приводит к подавлению пролиферации клеток, подавлению роста и/или жизнедеятельности опухолевых клеток и/или подавлению онкогенеза. Таким образом, другой предпочтительный вариант осуществления относится к способам торможения и/или подавления пути Hh путем использования соединений, предлагаемых в настоящем изобретении (например, соединения формулы I) в опухолевых клетках. В способах, предлагаемых в настоящем изобретении, можно использовать соединения, предлагаемые в настоящем изобретении (например, соединение формулы I), приготовленные в виде фармацевтических препаратов, включающих фармацевтически приемлемый инертный наполнитель или носитель, и указанные препараты можно вводить пациенту для лечения патологических состояний, включая нежелательную пролиферацию клеток, такую как раковые заболевания и/или опухоли (такие как медуллобластома, базально-клеточная карцинома и т.п.) и незлокачественные гиперпролиферативные нарушения. Один вариант осуществления настоящего изобретения относится к соединению и способу подавления синтеза, экспрессирования, продуцирования, стабилизации, фосфорилирования, изменения положения в клетке и/или активности белка Smo в клетке in vitro или in vivo, включающему взаимодействие указанной клетки с соединением, предлагаемым в настоящем изобретении (например, соединением формулы I), или его введение в указанную клетку. Другим объектом настоящего изобретения являются соединение и способ диагностики, предупреждения и/или лечения ослаблений, нарушений и/или дисфункций клеток; гиперпластических, гиперпролиферативных и/или злокачественных патологических состояний; и/или метастазирования опухолевых клеток у млекопитающего, характеризующихся наличием и/или экспрессированием гена или генного продукта Smo (например, белка Smo), включающий соединения формулы (I) и их введение млекопитающему в терапевтически эффективном количестве. Подробное описание изобретения В одном варианте осуществления соединение формулы (I) дополнительно включает соединение, в котором R2 выбран из(где N связан с L),где U обозначает C(H)0-1 или N и не более двух U обозначают N;R4 независимо обозначает Н, -N(R6)2, -ОН, галоген, -CN, -C(O)OR6, -C(O)N(R6)2, -NH2, низш. алкил или низш. алкоксигруппу, где низш. алкил и низш. алкоксигруппа могут быть незамещенными или за-3 016564 мещенными одним или большим количеством атомов галогенов, -ОН, -CN, -NH2, -NO2, -C(O)NH2,-C(O)NH(С 1-С 6-алкил), -С(O)N(С 1-С 6-алкил)2, -C(O)(С 1-С 6-алкил), -NHC(O)(C1-С 6-алкил), NH(C1-С 6 алкил), -N(С 1-С 6-алкил)2, -SO2(С 1-С 6-алкил), -SO2NH2, -SO2NH(C1-C6-алкил);R5 обозначает Н, арил, het, низш. алкил, низш. алкоксигруппу или циклоалкил, которые могут быть незамещенными или замещенными одним или большим количеством из следующих заместителей: галоген, циклоалкил, арил, het, и где по меньшей мере один R5 не обозначает Н и L обозначает низш. алкил. В другом варианте осуществления R2 может быть выбран из где W обозначает О, NR7 или SO2 и R7 обозначает связь, Н, низш. алкил или низш. ацил. В другом варианте осуществления соединение формулы I включает соединение, в котором R2 обозначает и R3 обозначает het. В другом варианте осуществления соединение формулы (I) включает соединение, в которомR1 обозначает арил или het, который может быть незамещенным или замещенным; и если R1 обозначает het, то по меньшей мере одним кольцевым гетероатомом является N;R3 обозначает арил или het, который может быть незамещенным или замещенным; и если R3 обозначает het, то по меньшей мере одним кольцевым гетероатомом является N;Z обозначает Н или СН 3. Еще один вариант осуществления настоящего изобретения относится к соединению формулы (I), в которойR1 обозначает фенил, пиридин или нафтил, который может быть незамещенным или замещенным;R4 обозначает Н и U обозначает С(Н)0-1,R3 обозначает фенил, пиридин, пиразин, пиридазин или пиримидин, который может быть незамещенным или замещенным;n равно 1. Еще один вариант осуществления настоящего изобретения относится к соединению формулы (I), в которой R1 обозначает фенил, который может быть незамещенным или замещенным и R2 выбран из(где N связан с L); и по меньшей мере один R5 обозначает СН 3. В другом варианте осуществления настоящее изобретение относится к фармацевтический компози-4 016564 ции, включающей терапевтически эффективное количество соединения формулы I. В другом варианте осуществления настоящее изобретение относится к способу лечения млекопитающего, страдающего от патологии, связанной с путем Hedgehog, который включает введение указанному млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I. В настоящем описании термин "лечение" включает профилактическое или предупредительное лечение, а также излечивающее или подавляющее заболевание лечение, включая лечение пациентов, подверженных риску возникновения нарушения, указанного в настоящем изобретении (например, нарушения, связанного с Hedgehog (например, рака, а также заболевших пациентов. Этот термин включает лечение, предназначенное для задержки прогрессирования заболевания."Подавлением и/или обращением", например, связанного с Hedgehog нарушения (например, рака),заявители считают устранение указанного связанного с Hedgehog нарушения (например, диабета) или его приведение в менее тяжелое состояние, чем до лечения или без проведения лечения."Излечивание" при использовании в настоящем изобретении означает обеспечиваемую путем лечения ремиссию связанного с Hedgehog нарушения (например, рака) или его непрерывных приступов у пациента. Термины "профилактика" или "предупреждение" означают блокирование возникновения или рецидива метаболических нарушений, например диабета."Лечение" означает терапию, предупреждение и профилактику и предпочтительно означает введение пациенту лекарственного средства или выполнение лечебных процедур для профилактики (предупреждения) или излечивания, или уменьшения степени проявления или вероятности возникновения нарушения, заболевания или патологического состояния или проявления, если пациент страдает заболеванием."Диагностика" означает постановку диагноза, прогноз, мониторинг, описание, подбор пациентов,включая участников клинических исследований, и выявление пациентов, подверженных риску возникновения нарушения или страдающих от конкретного нарушения или клинического проявления, и тех,которые с наибольшей вероятностью будут реагировать на конкретное лечение, или оценку или мониторинг реакции пациента на конкретное лечение."Соединение (соединения), предлагаемое в настоящем изобретении" при использовании в настоящем изобретении включает, но не ограничивается только ими, соединения формулы I (например, соединения формулы (I), включая все ее варианты). Соединение, предлагаемое в настоящем изобретении,включает соединения, специально перечисленные в настоящем изобретении, включая перечисленные в примерах, приведенных в настоящем изобретении."Задержка прогрессирования" при использовании в настоящем изобретении означает, что введение соединения, предлагаемого в настоящем изобретении (например, соединения формулы I), пациентам на предварительной стадии или ранней стадии связанного с Hedgehog нарушения (например, рака) предупреждает дальнейшее развитие или замедляет развитие заболевания по сравнению с развитием заболевания без введения активного соединения."Усиление функции Hedgehog" означает аберрантную модификацию или мутацию гена Ptc, генаHedgehog или гена Smoothened или изменение (например, уменьшение) степени экспрессирования такого гена, которое приводит к фенотипу, который сходен с взаимодействием клетки с белком Hedgehog, например аберрантную активацию пути Hedgehog. Усиление функции может включать утрату способности генного продукта Ptc регулировать степень экспрессирования генов Gli, например Gli1, Gli2 и Gli3, или утрату способности регулировать процессинг, стабильность, локализацию или активность белков Gli,например Gli1, Gli2 и Gli3. Термин "усиление функции Hedgehog" в настоящем изобретении также используется для указания любого сходного клеточного фенотипа (например, проявление чрезмерной пролиферации), который наблюдается вследствие происходящего где-либо изменения пути передачи сигнала Hedgehog, включая, но не ограничиваясь только ими, модификацию или мутацию самого Hedgehog. Например, опухолевая клетка с аномально высокой скоростью пролиферации вследствие активации пути передачи сигнала Hedgehog будет обладать фенотипом "усиление функции Hedgehog", даже если в этой клетке Hedgehog не подвергся мутации."Потеря функции Patched" означает аберрантную модификацию или мутацию гена Ptc или уменьшение степени экспрессирования такого гена, которое приводит к фенотипу, который сходен с взаимодействием клетки с белком Hedgehog, например аберрантную активацию пути Hedgehog. Потеря функции может включать утрату способности генного продукта Ptc регулировать степень экспрессирования,процессинг, стабильность, локализацию, регуляцию или активность генов и белков Gli, например Gli1,Gli2 и Gli3."Усиление функции Gli" означает аберрантную модификацию или мутацию гена Gli или повышенную степень экспрессирования этого гена, что приводит к фенотипу, который сходен с взаимодействием клетки с белком Hedgehog, например аберрантную активацию пути Hedgehog."Усиление функции Smoothened" означает аберрантную модификацию или мутацию гена Smo или-5 016564 повышенную степень экспрессирования этого гена, что приводит к фенотипу, который сходен с взаимодействием клетки с белком Hedgehog, например аберрантную активацию пути Hedgehog. При использовании в настоящем изобретении "небольшая органическая молекула" означает органическое соединение (или органическое соединение, образовавшее комплекс с неорганическим соединением (например, металлом, которое обладает молекулярной массой, равной менее 3 кДа, и предпочтительно менее 1,5 кДа. При использовании в настоящем изобретении термин "репортерный ген" используется взаимозаменяемым образом с термином "маркерный ген" и означает нуклеиновую кислоту, которая легко обнаруживает и/или кодирует генный продукт, который легко обнаруживается, такой как люцифераза. Транскрипционные и трансляционные контрольные последовательности представляют собой регуляторные последовательности ДНК, такие как промоторы, усилители, терминаторы и т.п., которые обеспечивают экспрессирование кодирующей последовательности в клетке-хозяине. В эукариотных клетках контрольными последовательностями являются сигналы полиаденилирования."Промотирующая последовательность" представляет собой регуляторный участок ДНК, способный связывать РНК-полимеразу в клетке и инициировать транскрипцию кодирующей последовательности в прямом направлении (в направлении 3'). Для определения настоящего изобретения промотирующая последовательность связана по своему 3'-концу сайтом инициации транскрипции и располагается в обратном направлении (в направлении 5') с включением минимального количества оснований или элементов,необходимых для инициирования транскрипции в степени, отличимой от фона. В промотирующей последовательности обнаруживается сайт инициации транскрипции (обычно определяемый, например, путем картирования с нуклеазой S1), а также домены связывания белка (консенсусные последовательности), обеспечивающие связывание РНК-полимеразы. Кодирующая последовательность "находится под контролем" транскрипционной и трансляционной контролирующих последовательностей в клетке, когда РНК-полимераза транскрибирует кодирующую последовательность в мРНК, которая затем подвергается сплайсингу посредством транс-РНК и транслируется в белок, кодируемый кодирующей последовательностью. Выражение "фармацевтически приемлемый" означает соединения и композиции, которые при введении человеку являются физиологически переносимыми и обычно не приводят к аллергическим или аналогичным нежелательным реакциям, таким как расстройства желудка, головокружение и т.п. При использовании в настоящем изобретении термин "фармацевтически приемлемый" предпочтительно означает утвержденный регулятивным органом федерального правительства или правительства штата или указанный в Фармакопее США или другой общепризнанной Фармакопее как применимый для животных и более предпочтительно для человека. Термин "носитель" означает разбавитель, вспомогательное вещество, инертный наполнитель или растворитель, вместе с которым вводят соединение. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода или масла, включая масла, полученные из нефти, и масла животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. В качестве носителей, в особенности для растворов,предназначенных для инъекций, предпочтительно использовать воду или водные физиологические растворы и водные растворы декстрозы и глицерина. Подходящие фармацевтические носители описаны в публикации "Remington's Pharmaceutical Sciences" by E.W. Martin. Выражение "терапевтически эффективное количество" используется в настоящем изобретении для указания количества, достаточного для составляющего по меньшей мере примерно 15%, предпочтительно по меньшей мере примерно 50%, более предпочтительно по меньшей мере примерно 90% ослабления клинически значимого дефицита активности, функции и ответа реципиента и наиболее предпочтительно его предупреждение. Альтернативно, терапевтически эффективное количество достаточно для обеспечения улучшения клинически значимого состояния/симптома у реципиента."Средство" означает все вещества, которые можно использовать для приготовления фармацевтических и диагностических композиций или которыми могут быть соединения, нуклеиновые кислоты, полипептиды, фрагменты, изоформы, варианты или другие вещества, которые независимо можно использовать для таких целей, все в соответствии с настоящим изобретением."Аналог" при использовании в настоящем изобретении означает небольшое органическое соединение, нуклеотид, белок или полипептид, который обладает сходной или такой же активностью или функцией (функциями), как соединение, нуклеотид, белок или полипептид или соединение обладающее необходимой активностью и терапевтическим воздействием в соответствии с настоящим изобретением (например, подавляет рост опухоли), но не обязательно включает последовательность или структуру, которая сходна или идентична с последовательностью или структурой предпочтительного варианта осуществления."Производное" означает соединение, белок или полипептид, который включает аминокислотную последовательность исходного белка или полипептида, которая изменена путем замещений, удалений или прибавлений аминокислотных остатков, или нуклеиновую кислоту или нуклеотид, который модифицирован путем введения или удалений, прибавлений или мутаций нуклеотидных заместителей. Про-6 016564 изводное нуклеиновой кислоты, нуклеотида, белка или полипептида выполняет сходную или такую же функцию, как исходный полипептид."Ингибиторы," или "антагонисты" означают ингибирующие молекулы, идентифицированные с помощью проводимых in vitro и in vivo исследований функции пути Hh, например антагонисты Smo. Ингибиторы и антагонисты предпочтительно означают соединения или средства, которые ослабляют передачу сигналов для пути Hh. Ингибиторы могут представлять собой соединения, которые ослабляют, блокируют или предупреждают передачу сигналов для этого пути."Нарушение(нарушения), связанное с Hedgehog" при использовании в настоящем изобретении включает нарушения, связанные с разрушением или аберрацией пути Hedgehog, а также нарушения, связанные с нормальными, но нежелательными состояниями роста, связанные с активацией пути Hedgehog."Нарушение(нарушения), связанное с Hedgehog" включает, но не ограничивается только ими, образование опухоли, рак, неоплазию, злокачественные гиперпролиферативные нарушения и незлокачественные гиперпролиферативные нарушения. "Нарушение(нарушения), связанное с Hedgehog" также включает доброкачественную гиперплазию предстательной железы, псориаз, экссудативную дегенерацию желтого пятна, остеопетроз и нежелательный рост волос. При использовании в настоящем изобретении термин "рак" включает солидные опухоли млекопитающих, а также злокачественные заболевания крови. "Солидные опухоли млекопитающих" включают раковые заболевания головы и шеи, легких, мезотелиому, заболевания средостения, пищевода, желудка,поджелудочной железы, гепатобилиарной системы, тонкого кишечника, ободочной кишки, ободочной и прямой кишки, прямой кишки, ануса, почек, уретры, мочевого пузыря, предстательной железы, пениса,яичек, половых органов женщин, яичников, молочной железы, эндокринной системы, центральной нервной системы, включая головной мозг; саркомы мягких тканей и костей; и меланому кожного и внутриглазного происхождения. Термин "злокачественные заболевания крови" включает детские лейкозы и лимфомы, болезнь Ходжкина, лимфомы лимфоцитарного и кожного происхождения, острый и хронический лейкоз, плазмоклеточную неоплазию и раковые заболевания, связанные со СПИД (синдром приобретенного иммунодефицита). Кроме того, можно лечить рак на любой стадии прогрессирования, такой как первичный, метастатический и рецидивирующий рак. Информация о многочисленных типах рака приведена, например, в публикациях American Cancer Society или, например, Wilson et al. (1991) Harrison's Principles of Internal Medicine, 12th Edition, McGraw-Hill, Inc. В объем настоящего изобретения входят применение в медицине и ветеринарии. Раковые заболевания, которые особенно хорошо поддаются лечению соединениями и способами,предлагаемыми в настоящем изобретении, включают, но не ограничиваются только ими, глиомы, медуллобластомы, примитивные нейроэктодермальные опухоли (ПНЭДО), базально-клеточную карциному(БКК), мелкоклеточные раковые заболевания легких, крупноклеточные раковые заболевания легких,опухоли желудочно-кишечного тракта, рабдомиосаркомы, саркомы мягких тканей, опухоли поджелудочной железы, опухоли мочевого пузыря и опухоли предстательной железы. При использовании в настоящем изобретении термин "злокачественное гиперпролиферативное нарушение(нарушения)" включает, но не ограничивается только ими, раковые заболевания, нейрональные пролиферативные нарушения, пролиферативные заболевания костного мозга и лейкозы. При использовании в настоящем изобретении термин "незлокачественное гиперпролиферативное нарушение(нарушения)" включает, но не ограничивается только ими, незлокачественные и ненеопластические пролиферативные нарушения, такие как гиперплазию гладких мышц в кровеносных сосудах, образование рубцов на коже и фиброз легких. При использовании в настоящем изобретении термин "арил" определяется, как ароматический радикал, содержащий 6-14 кольцевых атомов углерода и не содержащий кольцевые гетероатомы. Арильная группа может быть моноциклической или конденсированной бициклической или трициклической. Она может быть незамещенной или содержать один или большее количество, предпочтительно 1 или 2 заместителя, где заместители являются такими, как описано в настоящем изобретении. Как определено в настоящем изобретении, арильный фрагмент может быть полностью ароматическим независимо от того,является ли он моноциклическим или бициклическим. Однако, если он содержит более одного кольца,определенного в настоящем изобретении, то термин "арил" включает фрагменты, в которых по меньшей мере одно кольцо является полностью ароматическим, а другое кольцо(кольца) может быть частично ненасыщенным, или насыщенным, или полностью ароматическим."Het" при использовании в настоящем изобретении означает гетероарильные и гетероциклические соединения, содержащие по меньшей мере один кольцевой гетероатом S, О или N. Более предпочтительно, если "het" означает 5-7-членное гетероциклическое кольцо, содержащее 1-4 гетероатома, выбранных из группы, включающей N, О и S, или 8-12-членнную конденсированную кольцевую систему, включая по меньшей мере одно 5-7-членное гетероциклическое кольцо, содержащее 1, 2 или 3 гетероатомов, выбранных из группы, включающей N, О и S. Примеры het при использовании в настоящем изобретении включают, но не ограничиваются только ими, незамещенный и замещенный пирролидил, тетрагидрофурил, тетрагидротиофурил, пиперидил, пиперазил, пуринил, тетрагидропиранил, морфолиновую группу,1,3-диазапанил, 1,4-диазапанил, 1,4-оксазепанил, 1,4-оксатиапанил, фурил, тиенил, пиррил, пирролил,-7 016564 пиразолил, триазолил, тетразолил, индазолил, оксадиазолил, имидазолил, пирролидил, пирролидинил,тиазолил, оксазолил, пиридил, пиразолил, пиразинил, пиримидинил, изоксазолил, пиразинил, хинолил,изохинолил, пиридопиразинил, пирролопиридил, фуропиридил, индолил, бензофурил, бензотиофурил,бензоиндолил, бензотиенил, пиразолил, пиперидил, пиперазинил, индолинил, морфолинил, бензоксазолил, пирролохинолил, пирроло[2,3-b]пиридинил, бензотриазолил, оксобензооксазолил, бензо[1,3]диоксолил, бензоимидазолил, хинолинил, инданил и т.п. Гетероарилы входят в объем определенияhet. Примерами гетероарилов являются пиридил, пиримидинил, хинолил, тиазолил и бензотиазолил. Наиболее предпочтительными het являются пиридил, пиримидинил и тиазолил. het может быть незамещенным или замещенным так, как описано в настоящем изобретении. Предпочтительно, если он является незамещенным или, если он является замещенным, то замещен по атому углерода галогеном, предпочтительно фтором или хлором, гидроксигруппой, С 1-С 4-алкилом, таким как метил или этил, С 1-С 4 алкоксигруппой, предпочтительно метоксигруппой или этоксигруппой, нитрогруппой, -О-С(О)-С 1-С 4 алкилом или -C(O)-O-С 1-С 4-алкилом, SCN или нитрогруппой или по атому азота С 1-С 4-алкилом, предпочтительно метилом или этилом, -O-C(O)-C1-C4-алкилом или -C(O)-O-С 1-С 4-алкилом, такими как карбметоксигруппа или карбэтоксигруппа. Если два заместителя вместе с атомом азота, с которым они связаны, образуют het, следует понимать, что образованное гетероциклическое кольцо представляет собой азотсодержащее кольцо, такое как азиридин, азетидин, азол, пиперидин, пиперазин, морфолин, пиррол, пиразол, тиазол, оксазол, пиридин,пиримидин, изоксазол и т.п., где такой het может быть незамещенным или замещенным, как определено выше в настоящем изобретении. При использовании в настоящем изобретении "галоген" означает фтор, хлор, бром или йод, предпочтительно фтор или хлор. Если не указано иное, то "алкил", по отдельности или в комбинации, включает обладающий линейной или разветвленной цепью алкил, такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил,трет-бутил, н-пентил и разветвленный пентил, н-гексил и разветвленный гексил и т.п."Циклоалкильная" группа означает С 3-С 10-циклоалкил, содержащий 3-10 кольцевых атомов углерода, и может представлять собой, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, циклононил и т.п. Циклоалкильная группа может быть моноциклической или конденсированной бициклической. Кроме того, предпочтительной циклоалкильной группой является циклопентил или циклогексил. Наиболее предпочтительно, если циклоалкил обозначает циклогексил. Циклоалкильная группа может быть полностью насыщенной или частично ненасыщенной, хотя предпочтительно, если она является полностью насыщенной. Как определено в настоящем изобретении, она исключает арильные группы. Циклоалкильные группы могут быть незамещенными или замещенными любым из заместителей, определенных ниже, предпочтительно галогеном, гидроксигруппой или C1-С 6 алкилом, таким как метил. Незамещенный означает, что единственным заместителем является водород. За исключением случаев, описанных в настоящем изобретении, любой определенный выше арил,het, алкил, алкенил, алкинил или циклоалкил может быть незамещенным или независимо содержать до 4,предпочтительно 1, 2 или 3 заместителя, выбранных из группы, включающей галоген (такой как Cl илиBr); гидроксигруппу; низш. алкил (такой как C1-С 3-алкил); низш. алкил, который может быть замещен любым из заместителей, определенных в настоящем изобретении; низш. алкенил; низш. алкинил; низш. алканоил; низш. алкоксигруппу (такую как метоксигруппу); арил (такой как фенил или нафтил); замещенный арил (такой как фторфенил или метоксифенил); арил-низш. алкил, такой как бензил, моно- или диамино-низш. алкил (такой как диметиламиногруппа); низш. алканоиламиногруппу, ацетиламиногруппу; амино-низш. алкоксигруппу (такую как этоксиаминогруппу); нитрогруппу; цианогруппу; цианонизш. алкил; карбоксигруппу; низш. карбалкоксигруппу (такую как метоксикарбонил; нпропоксикарбонил или изопропоксикарбонил), низш. арилоил, такой как бензоил; карбамоил; N-моноили N,N-ди-низш. алкилкарбамоил; сложноэфирную группу низш. алкилкарбаминовой кислоты; амидиновую группу; гуанидиновую группу; уреидную группу; меркаптогруппу; сульфогруппу; низш. алкилтиогруппу; сульфоаминогруппу; сульфонамидную группу; бензосульфонамидную группу; сульфонатную группу; сульфанил-низш. алкил (такой как метилсульфанил); сульфоаминогруппу; арилсульфонамидную группу; галогензамещенную или незамещенную арилсульфонатную группу (такую как хлорфенилсульфонатную группу); низш. алкилсульфинил; арилсульфинил; арил-низш. алкилсульфинил; низш. алкиларилсульфинил; низш. алкансульфинил; арилсульфонил; арил-низш. алкилсульфонил; низш. арилалкил; низш. алкиларилсульфонил; галоген-низш. алкилмеркаптогруппу; галоген-низш. алкилсульфонил, такой как трифторметансульфонил; фосфоно(-Р(=O)(ОН)2); гидрокси-низш. алкоксифосфорил или ди-низш. алкоксифосфорил; мочевину и замещенную мочевину; эфир алкилкарбаминовой кислоты или карбаматы(такие как этил-N-фенил-карбамат); или низш. алкил (например, метил, этил или пропил). В одном варианте осуществления указанные выше алкильные, циклоалкильные и арильные группы независимо являются незамещенными или содержат в качестве заместителей низш. алкил, арил, арилнизш. алкил, карбоксигруппу, низш. карбалкоксигруппу и предпочтительно галоген, -ОН, -SH, -ОСН 3,-SCH3, -CN, -SCN или нитрогруппу.-8 016564 Как определено в настоящем изобретении, термин "низш. алкил" при использовании по отдельности или в комбинации означает алкил, содержащий 1-6 атомов углерода. Алкильная группа может обладать линейной или разветвленной цепью и является такой, как определено выше в настоящем изобретении. Термин "низш. алкенил" означает алкенильную группу, которая содержит 2-6 атомов углерода. Алкенильная группа представляет собой гидрокарбильную группу, содержащую по меньшей мере одну углерод-углеродную двойную связь. Как определено в настоящем изобретении, она может быть незамещенной или замещенной заместителями, описанными в настоящем изобретении. Углерод-углеродные двойные связи могут находиться между любыми двумя атомами углерода алкенильной группы. Предпочтительно, если она содержит 1 или 2 углерод-углеродные двойные связи и более предпочтительно одну углерод-углеродную двойную связь. Алкенильная группа может обладать линейной или разветвленной цепью. Примеры включают, но не ограничиваются только ими, этинил, 1-пропенил, 2-пропенил,1-бутенил, 2-бутенил, 2-метил-1-пропенил, 1,3-бутадиенил и т.п. Термин "низш. алкинил" при использовании в настоящем изобретении означает алкинильную группу, содержащую 2-6 атомов углерода. Алкинильная группа представляет собой гидрокарбильную группу,содержащую по меньшей мере одну углерод-углеродную тройную связь. Углерод-углеродная тройная связь может находиться между любыми двумя атомами углерода алкинильной группы. Предпочтительно, если алкинильная группа содержит 1 или 2 углерод-углеродные тройные связи и более предпочтительно одну углерод-углеродную тройную связь. Алкинильная группа может обладать линейной или разветвленной цепью. Примеры включают этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил и т.п. При использовании в настоящем изобретении термин "арилалкил" означает арильную группу, присоединенную к основной цепи с помощью мостиковой алкиленовой группы. Примеры включают бензил,фенетил, нафтилметил и т.п. Предпочтительным арилалкилом является бензил. Аналогичным образом,цианоалкильная группа означает цианогруппу, присоединенную к основной цепи с помощью мостиковой алкиленовой группы. С другой стороны, термин "алкиларил" означает алкильную группу, присоединенную к основной цепи с помощью мостиковой фениленовой группы. Примеры включают, но не ограничиваются только ими, метилфенил, этилфенил и т.п. При использовании в настоящем изобретении термин "низш. алканоил" означает низш. алкильную цепь, в которой один из атомов углерода заменен группой С=O. Группа С=O может находиться на одном из концов заместителя или в середине фрагмента. Примеры включают, но не ограничиваются только ими, формил, ацетил, 2-пропаноил, 1-пропаноил и т.п. Термин "алкоксигруппа" означает алкильную группу, определенную в настоящем изобретении, связанную с главной цепью с помощью атома кислорода. Примеры включают, но не ограничиваются только ими, метоксигруппу, этоксигруппу и т.п. Термин "карбалкоксигруппа" означает алкоксикарбонильную группу, связанную с главной цепью с помощью карбонильной группы (С(О. Примеры включают, но не ограничиваются только ими, метоксикарбонил, этоксикарбонил и т.п. При использовании в настоящем изобретении "оксо" означает кислород, связанный двойной связью(т.е. =O). Также следует понимать, что обозначение C(O) означает группу -С=O, независимого от того,входит ли она в кетон, альдегид или кислоту, или производное кислоты. Аналогичным образом, S(O) означает группу -S=O. Фармацевтически приемлемые соли любых кислотных соединений, предлагаемых в настоящем изобретении, означают соли, образованные с основаниями, а именно соли катионов, такие как соли щелочных и щелочно-земельных металлов, таких как натрий, литий, калий, кальций, магний, а также соли аммония, такие как соли аммония, триметиламмония, диэтиламмония и трис(гидроксиметил)метиламмония. Аналогичным образом, соли присоединения с кислотами, такие как образованные с неорганическими кислотами, органическими карбоновыми кислотами и органическими сульфоновыми кислотами, например с хлористо-водородной кислотой, малеиновой кислотой и метансульфоновой кислотой, являются возможными, если частью структуры является основная группа, такая как аминогруппа или пиридильная группа. Согласно изобретению было установлено, что пути передачи сигнала, регулируемые с помощью Hh и/или Smo, можно модулировать соединениями, предлагаемыми в настоящем изобретении. В одном варианте осуществления соединения и способы, предлагаемые в настоящем изобретении,включают соединения формулы (I), предназначенные для ингибирования зависимого от Smo пути активации. Другим объектом настоящего изобретения являются соединения и способы, предназначенные для ингибирования независимого от Hedgehog (лиганда) пути активации. В некоторых вариантах осуществления соединения и способы, предлагаемые в настоящем изобретении, можно использовать для противодействия фенотипическим эффектам нежелательной активации пути Hedgehog, таким как мутации, обусловленные усилением функции Hedgehog, потерей функции Ptc или усилением функции Smoothened. Например, соединения, предлагаемые в настоящем изобретении, и способ, предлагаемый в настоящем-9 016564 изобретенни, может включать взаимодействие клетки (in vitro или in vivo) с антагонистом Smo, таким как соединение формулы (I), в количестве, достаточном для подавления зависимого от Smoothened и/или независимого от Hedgehog пути активации. В одном варианте осуществления соединения, предлагаемые в настоящем изобретении (например,соединения формулы I) ингибируют передачу сигнала белком Hh путем блокирования трехмерной структуры белка Smo в неактивной конформации или препятствования образованию активной конформацииSmo. В другом варианте осуществления соединения, предлагаемые в настоящем изобретении (например,соединения формулы I), ингибируют передачу сигнала белком Hh путем предотвращения эндогенно активирующих лигандов Smo от связывания со Smo или от активации Smo (т.е. воздействия путем негативной кооперации с эндогенными агонистами). В другом варианте осуществления соединения, предлагаемые в настоящем изобретении (например, соединения формулы I), ингибируют передачу сигнала белком Hh путем усиления связывания эндогенно инактивирующих лигандов Smo со Smo или инактивацииSmo (т.е. воздействия путем позитивной кооперации с эндогенным антагонистом). В другом варианте осуществления соединения, предлагаемые в настоящем изобретении (например,соединения формулы I), ингибируют передачу сигнала белком Hh путем предотвращения локализацииSmo в плазматической мембране. В другом варианте осуществления соединения, предлагаемые в настоящем изобретении (например, соединения формулы I), ингибируют передачу сигнала белком Hh путем предотвращения передачи сигнала от Ptch к Smo в присутствии или при отсутствии лиганда Hh. В другом варианте осуществления соединения, предлагаемые в настоящем изобретении (например, соединения формулы I), ингибируют передачу сигнала белком Hh путем предотвращения стабилизации Smo. В другом варианте осуществления соединения, предлагаемые в настоящем изобретении (например, соединения формулы I), ингибируют передачу сигнала белком Hh путем предотвращения фосфорилированияSmo по активирующим центрам. В другом варианте осуществления соединения, предлагаемые в настоящем изобретении (например, соединения формулы I), ингибируют передачу сигнала белком Hh путем усиления фосфорилирования Smo по ингибирующим центрам. В еще одном варианте осуществления соединения, предлагаемые в настоящем изобретении (например, соединения формулы I), ингибируют передачу сигнала белком Hh путем предотвращения осуществляющейся с помощью Smo активации расположенных в прямом направлении мишеней, таких как фактор транскрипции Gli. В другом варианте осуществления соединения, предлагаемые в настоящем изобретении (например, соединения формулы I), ингибируют передачу сигнала белком Hh путем осуществления инактивации, секвестрации и/или разрушения Smo. В другом варианте осуществления способы, предлагаемые в настоящем изобретении, можно использовать для регулирования пролиферации и/или дифференциации клеток in vitro и/или in vivo, например, при образовании ткани из стволовых клеток, или для предупреждения роста гиперпролиферативных клеток. В другом предпочтительном варианте осуществления взаимодействие клетки с соединением, предлагаемым в настоящем изобретении (например, соединением формулы I), или его введение в клетку приводит к подавлению пролиферации клеток, подавлению роста и/или жизнедеятельности раковых/опухолевых клеток и/или подавлению онкогенеза. Таким образом, другой предпочтительный вариант осуществления относится к способам торможения и/или подавления пути Hh путем использования соединений, предлагаемых в настоящем изобретении (например, соединения формулы I), в опухолевых клетках. В еще одном варианте осуществления в способах, предлагаемых в настоящем изобретении, используются соединения, предлагаемые в настоящем изобретении (например, соединение формулы I), приготовленные в виде фармацевтического препарата, включающего фармацевтически приемлемый инертный наполнитель или носитель, и указанные препараты можно вводить пациенту для лечения патологических состояний, включая нежелательную пролиферацию клеток, такую как раковые заболевания и/или опухоли (такие как медуллобластома, базально-клеточная карцинома и т.п.) и незлокачественные гиперпролиферативные нарушения. Один вариант осуществления настоящего изобретения относится к способу подавления синтеза,экспрессирования, продуцирования и/или активности белка Smo в клетке in vitro или in vivo, включающему взаимодействие указанной клетки с соединением, предлагаемым в настоящем изобретении (например, соединением формулы I), или его введение в указанную клетку. Другой вариант осуществления настоящего изобретения относится к способу диагностики, предупреждения и/или лечения ослаблений, нарушений и/или дисфункций клеток; гиперпластических, гиперпролиферативных и/или злокачественных патологических состояний; и/или метастазирования опухолевых клеток у млекопитающего, характеризующихся наличием и/или экспрессированием гена или генного продукта Smo (например, белка Smo), включающему введение млекопитающему терапевтически эффективного количества средства, которое ингибирует или подавляет синтез, и/или экспрессирование, и/или активность, т.е. соединения, предлагаемого в настоящем изобретении (например, соединения формулы I). Поэтому в особенности предполагается, что соединения формулы I, которые препятствуют активности передачи сигналов для Hh, Ptc или Smoothened, также будут способны ингибировать пролиферацию (или другие биологические последствия) в нормальных клетках и/или клетках, обладающих фено- 10016564 типом потери функции Patched, фенитопом усиления функции Hedgehog, фенитопом усиления функцииSmoothened или фенитопом усиления функции Gli. Таким образом, предполагается, что в некоторых вариантах осуществления эти соединения могут быть применимы для ингибирования активности Hedgehog в нормальных клетках, например в тех, которые не содержат генетических мутаций, которые активируют путь Hedgehog. В предпочтительных вариантах осуществления соединения способны ингибировать по меньшей мере часть биологических активностей белков Hedgehog, предпочтительно специфично в клетках-мишенях. Таким образом, способы, предлагаемые в настоящем изобретении, включают применение соединений формулы I, которые препятствуют ингибированию пути передачи сигнала Hedgehog с помощью Ptc,например путем ингибирования активации Smoothened или расположенных в прямом направлении компонентов пути передачи сигнала, путем регулирования репарации и/или функциональных характеристик самых различных клеток, тканей и органов, включая нормальные клетки, ткани и органы, а также те, которые обладают фенотипом потери функции Ptc, усиления функции Hedgehog, усиления функцииSmoothened или усиления функции Gli. Например, способ, предлагаемый в настоящем изобретении, применим для терапевтических и косметических целей в диапазоне, включающем регуляцию образования и восстановления нервных тканей, костей и хрящей, регуляцию сперматогенеза, регуляцию доброкачественной гиперплазии предстательной железы, регуляцию образования кровеносных сосудов при экссудативной дегенерации желтого пятна, псориаза, регуляцию гладких мышц, регуляцию легких, печени и других органов, образующихся из первичной кишки, регуляцию гематопоэтической функции, регуляцию роста кожи и волос и т.п. Кроме того, способ, предлагаемый в настоящем изобретении, можно использовать для клеток в культуре (in vitro) или для клеток целого животного (in vivo). В некоторых вариантах осуществления соединение формулы I может ингибировать активацию путиHedgehog путем связывания со Smoothened или с его расположенными в прямом направлении белками. Один вариант осуществления настоящего изобретения относится к применению фармацевтических препаратов, включающих в качестве активного ингредиента модулятор пути передачи сигнала Hedgehog,такой как соединение формулы I, антагонист Smoothened, такой как описанный в настоящем изобретении, приготовленный в количестве, достаточном для ингибирования in vivo пролиферации или других биологических последствий потери функции Ptc, усиления функции Hedgehog, усиления функцииSmoothened или усиления функции Gli. Лечение субъектов путем введения соединений, предлагаемых в настоящем изобретении (например,соединения формулы I), может быть эффективным и для людей, и для животных. Животные, для которых применимо настоящее изобретение, включают и домашних животных, и домашний скот, которых держат в качестве домашних животных или для коммерческих целей. Примерами являются собаки, кошки, крупный рогатый скот, лошади, овцы, свиньи, козы и ламы. Настоящее изобретение также относится к способам и соединениям, предназначенным для ингибирования активации пути передачи сигнала Hedgehog, например для ингибирования нормальных, но нежелательных состояний роста, например, доброкачественной гиперплазии предстательной железы или образования кровеносных сосудов при экссудативной дегенерации желтого пятна, обусловленной физиологической активацией пути передачи сигнала Hedgehog, включающим взаимодействие клетки с соединением формулы I, в количестве, достаточном для подавления активности Smoothened или подавления активности Gli, например для обращения или подавления нормального состояния роста. Настоящее изобретение относится способам и соединениям, предназначенным для ингибирования активации пути передачи сигнала Hedgehog, например для ингибирования аберрантных состояний роста,обусловленным такими фенотипами, как фенотип потери функции Ptc, усиления функции Hedgehog,усиления функции Smoothened или усиления функции Gli, включающим взаимодействие клетки с соединением формулы I в количестве, достаточном для подавления активности Smoothened или подавления активности Gli, например для обращения или подавления аберрантного состояния роста. Представители семейства сигнальных молекул Hedgehog опосредуют многие кратко- и долговременные процессы формирования структурной организации при развитии позвоночных. Формирование структурной организации представляет собой активность, при которой эмбриональные клетки образуют упорядоченные пространственные структуры дифференцированных тканей. Физическая сложность высших организмов возникает во время эмбриогенеза вследствие взаимодействия между внутренней линией дифференцировки клеток и внешними сигналами, идущими к клетке. Индуктивные взаимодействия важны для формирования эмбриональной структурной организации при развитии позвоночных от раннего образования плана организма до образования системы органов и до образования разных типов клеток во время дифференциации ткани. Влияние взаимодействия клеток при развитии меняется: отвечающие клетки переходят от одного пути дифференциации клеток к другому путем индуцирования клеток, которые отличаются от отвечающих клеток и в индуцированных, и в неиндуцированных состояниях (индукции). Иногда клетки приводят к дифференциации соседних клеток, такой как собственная (гомогенетическая индукция); в других случаях клетка подавляет дифференциацию соседних клеток, такую как собственная. Взаимодействия клеток на ранней стадии развития могут быть последовательными, такой что начальная индукция между двумя типами клеток приводит к прогрессивной амплификации разнообра- 11016564 зия. Кроме того, индуктивные взаимодействия происходят не только в эмбрионах, но и в зрелых клетках,и могут приводить к образованию и поддержанию морфологических характеристик, а также индуцировать дифференциацию. Группа генов Hedgehog позвоночных включает трех представителей, которые существуют у млекопитающих, известных как Desert (Dhh), Sonic (Shh) и Indian (Ihh) Hedgehogs, которые все кодируют секретированные белки. Эти разные белки Hedgehog включают сигнальный пептид, высококонсервативныйN-концевой участок и более дивергентный С-концевой домен. Биохимические исследования показали,что аутопротеолитическое расщепление предшественника белка Hh протекает путем первоначального образования сложного тиоэфирного промежуточного продукта, который затем расщепляется при нуклеофильном замещении. Вероятно, что нуклеофильный реагент представляет собой небольшую липофильную молекулу, которая ковалентно связывается с С-концевым концом N-пептида, присоединяя его к поверхности клетки. Биологические проявления являются значительными. В результате присоединения на поверхности клеток, продуцирующих Hedgehog, создается высокая локальная концентрация Nконцевого пептида Hedgehog. Этот N-концевой пептид, который необходим и достаточен для кратко- и долговременный активности пути передачи сигнала Hedgehog.Smoothened (Smo) кодирует содержащий 1024 аминокислоты трансмембранный белок, который действует как приемник сигнала Hedgehog (Hh). Белок Smo содержит 7 гидрофобных входящих в мембрану доменов, внеклеточную область с концевыми аминогруппами и внутриклеточную область с концевыми карбоксигруппами. Smo обладает определенным сходством со связанными с белком G рецепторами и наиболее гомологичен семейству (Fz) серпентиновых белков (Alcedo et al. (1996) Cell 86: 221). Неактивным путь передачи сигнала Hedgehog является тогда, когда трансмембранный белковый рецептор Patched (Ptc) ингибирует стабилизацию, фосфорилирование и активность Smoothened (Smo). Фактор транскрипции Gli, расположенный в прямом направлении компонент пути передачи сигнала Hh,защищается от входа в ядро путем взаимодействия с цитоплазматическими белками, включая Fused (Fu) и Suppressor fused (Sufu). Вследствие этого подавляется транскрипционная активация генов-мишенейHedgehog. Активация пути передачи сигнала инициируется путем связывания любого из трех лигандов млекопитающих (Dhh, Shh или Ihh) с Ptc. Связывание лигандов с помощью Hh меняет взаимодействие Smo и Ptc, обращая подавление Smo,после чего Smo перемещается от внутренних структур клетки к плазматической мембране. ЛокализацияSmo на плазматической мембране инициирует гены-мишени активации пути передачи сигнала Hh независимым от Hh образом (Zhu et al. (2003) Genes Dev. 17(10):1240). Каскад, активированный с помощьюSmo, приводит к перемещению активной формы фактора транскрипции Gli на ядре. Активация Smo с помощью перемещенного ядерного Gli активирует экспрессию гена-мишени пути передачи сигнала Hh,включая Wnts, TGF и Ptc и сам Gli. Повышенные уровни передачи сигнала Hedgehog достаточны для инициирования образования рака и необходимы для жизнеспособности опухоли. Эти раковые заболевания включают, но не ограничиваются только ими, рак предстательной железы (Karhadkar et al. (2004) Nature 431:707; Sanchez et al. (2004)PNAS 101(34):12561), рак молочной железы (Kubo et al. (2004) Cancer Res. 64(17):6071), медуллобластому (Berman et al. (2002) Science 297(5586):1559), базально-клеточную карциному (БКК) (Williams et al.(2003) PNAS 100(8):4616); Xie et al. (1998) Nature 391(6662):90), рак поджелудочной железы (Thayer et al.(Watkins et al. (2003) Nature 422(6929):313), глиому (Kinzler et al. (1988) Nature 332:371), раковые заболевания пищеварительного тракта (Berman et al. (2003) Nature 425(6960):846) и раковые заболевания пищевода (Ma et al. (2006) Int J. Cancer 118(1):139). В соответствии с изложенным выше настоящее изобретение также относится к способу предупреждения или лечения любых заболеваний или нарушений, описанных выше, у субъекта, нуждающегося в таком лечении, который включает введение указанному субъекту терапевтически эффективного количества соединения, предлагаемого в настоящем изобретении (например, соединение формулы I), или его фармацевтически приемлемой соли. Для любого из указанных выше случаев применения необходимая доза меняется в зависимости от пути введения, конкретного подвергающегося лечению патологического состояния и необходимого эффекта. У людей, страдающих синдромом Горлина, наследственным синдромом, характеризующимся высоким риском раковых заболеваний кожи и головного мозга, также известным как синдром базальноклеточного невуса (СБКН), с высокой частотой развивается базально-клеточная карцинома (БКК) и с меньшей частотой другие солидные опухоли (например, медуллобластомы), вследствие потери у зародыша функции мутации в Ptch. Для этих пациентов, а также для других пациентов, страдающих от БКК без синдрома Горлина, у которых наблюдается соматическая потеря функции мутации в Ptch, предполагается отсутствие реакции на лечение, связанное с лигандами Hedgehog. Однако они должны реагировать на ингибиторы пути передачи сигнала Hh, расположенные в прямом направлении от лигандов Hh, такие как соединения, предлагаемые в настоящем изобретении (например, соединение формулы I), которые могут действовать в качестве ингибиторов Smo. Аналогичным образом, другие солидные опухоли вследствие мутации в Patched или Smo не будут реагировать на связанное с лигандом Hh ингибирование, но- 12016564 будут реагировать на блокирование Smo (например, путем введения соединений, предлагаемых в настоящем изобретении). Введение и фармацевтические композиции. Настоящее изобретение относится к применению фармацевтических композиций, включающих соединения формулы (I), при терапевтическом (и, в более широком контексте настоящего изобретения,профилактическом) лечении нарушения(нарушений), связанного с Hedgehog. Обычно соединения, предлагаемые в настоящем изобретении, вводят в терапевтически эффективных количествах по любому из обычных и применимых путей, известных в данной области техники, по отдельности или в комбинации с одним или большим количеством терапевтических средств. Терапевтически эффективное количество может значительно меняться в зависимости от тяжести заболевания, возраста и относительного состояния здоровья субъекта, активности использующегося соединения и других факторов. Обычно указывают, что удовлетворительные результаты наблюдаются при системном введении в суточных дозах, составляющих примерно от 0,03 до 2,5 мг/(кг массы тела). Показанная суточная доза для более крупного млекопитающего, например человека, находится в диапазоне от примерно 0,5 до примерно 100 мг и ее обычно вводят, например, в виде разделенных доз до четырех раз в сутки или в форме пролонгированного действия. Подходящие для перорального введения разовые дозированные формы содержат примерно от 1 до 50 мг активного ингредиента. Соединения, предлагаемые в настоящем изобретении, можно вводить в виде фармацевтических композиций любым обычным путем, в частности энтерально, например перорально, например, в виде таблеток или капсул, или парентерально, например, в виде растворов или суспензий для инъекций, местно, например, в виде лосьонов, гелей, мазей или кремов, или в назальной форме, или в форме суппозитория. К фармацевтическим композициям, включающим соединение, предлагаемое в настоящем изобретении, в свободной форме или в форме фармацевтически приемлемой соли совместно по меньшей мере с одним фармацевтически приемлемым носителем или разбавителем можно изготовить обычным образом по технологиям смешивания, гранулирования или нанесения покрытий. Например, композиции для перорального введения могут представлять собой таблетки или желатиновые капсулы, включающие активный ингредиент совместно с а) разбавителями, например, лактозой, декстрозой, сахарозой, маннитом,сорбитом, целлюлозой и/или глицином; b) смазывающими веществами, например, диоксидом кремния,тальком, стеариновой кислотой, ее магниевой или кальциевой солью и/или полиэтиленгликолем; для таблеток также с с) связующими, например, алюмосиликатом магния, крахмальной пастой, желатином,трагакантовой камедью, метилцеллюлозой, натриевой солью карбоксиметилцеллюлозы и/или поливинилпирролидоном; при необходимости с d) веществами, обеспечивающими распадаемость, например,крахмалами, агаром, альгиновой кислотой или ее натриевой солью, или шипучими смесями; и/или е) абсорбентами, красителями, вкусовыми добавками и подсластителями. Композиции для инъекций могут представлять собой водные изотонические раствор или суспензии, и суппозитории можно приготовить из эмульсий или суспензий жирных веществ. Композиции могут быть стерилизованы и/или могут содержать вспомогательные вещества, такие как консервирующие, стабилизирующие или эмульгирующие агенты, способствующие растворению вещества, соли для регулирования осмотического давления и/или буферы. Кроме того, они также могут содержать другие терапевтически полезные вещества. Композиции, подходящие для чрескожного введения, включают терапевтически эффективное количество соединения, предлагаемого в настоящем изобретении, с носителем. Предпочтительные носители включают впитывающиеся фармакологически приемлемые растворители, предназначенные для содействия прохождению через кожу пациента. Например,чрескожные устройства представляют собой повязку, включающую изнаночный слой, резервуар, содержащий соединение необязательно с носителями, необязательно регулирующий скорость барьерный элемент для доставки соединения в кожу пациента с регулируемой и заранее заданной скоростью в течение продолжительного периода времени и средства для закрепления устройства на коже. Также можно использовать матричные чрескожные препараты. Композиции, подходящие для местного введения, например, на кожу или в глаза, предпочтительно представляют собой водные растворы, мази, кремы или гели,хорошо известные в данной области техники. Они могут содержать солюбилизаторы, стабилизаторы,средства, усиливающие тоничность, буферы и консерванты. Соединения, предлагаемые в настоящем изобретении, можно вводить в терапевтически эффективных количествах в комбинации с одним или большим количеством терапевтических средств (фармацевтические комбинации). Например, синергетический эффект может проявляться при использовании иммуномодулирующих или противовоспалительных или других противоопухолевых терапевтических средств. Когда соединения, предлагаемые в настоящем изобретении, вводят совместно с другими средствами, разумеется, дозы вводимых совместно соединений будут меняться в зависимости от типа используемого совместно лекарственного средства, конкретного используемого лекарственного средства, подвергающегося лечению патологического состояния и т.п. Настоящее изобретение также относится к фармацевтическим комбинациям, например к набору,включающему: а) первое средство, которое является соединением, предлагаемым в настоящем изобретении, описанным в настоящем изобретении, в свободной форме или в форме фармацевтически приемле- 13016564 мой соли, и b) по меньшей мере одно дополнительное средство. Набор может включать инструкции по его введению. Термины "совместное введение" или "комбинированное введение" и т.п. при использовании в настоящем изобретении означает введение выбранных терапевтических средств одному пациенту и включает режимы лечения, при которых средства необязательно вводят по одному и тому же пути введения или в одно и то же время. Термин "фармацевтическая комбинация" при использовании в настоящем изобретении означает препарат, который получен смешиванием или объединением более одного активного ингредиента и включает и фиксированные, и нефиксированные комбинации активных ингредиентов. Термин "фиксированная комбинация" означает, что активные ингредиенты, например соединение формулы I и дополнительное средство, оба вводят пациенту одновременно в виде одного препарата или дозированной формы. Термин "нефиксированная комбинация" означает, что активные ингредиенты, например соединение формулы I и дополнительное средство, оба вводят пациенту в виде отдельных препаратов одновременно,по отдельности или последовательно без наложения специальных ограничений по времени, и при таком введении в организме пациента создаются терапевтически эффективные уровни этих 2 соединений. Последнее также относится к смешанному лечению, например, с введением 3 или большего количества активных ингредиентов. Способы получения соединений, предлагаемых в настоящем изобретении. Типичные примеры синтеза соединений, предлагаемых в настоящем изобретении, например соединений формулы (I), приведены в настоящей заявке в разделе "Примеры". Соединение, предлагаемое в настоящем изобретении, можно получить в виде фармацевтически приемлемой соли присоединения с кислотой по реакции свободного основания соединения с фармацевтически приемлемой неорганической или органической кислотой. Альтернативно, фармацевтически приемлемую соль присоединения с основанием соединения, предлагаемого в настоящем изобретении, можно получить по реакции соединения в форме свободной кислоты с фармацевтически приемлемым неорганическим или органическим основанием. Альтернативно, соли соединений, предлагаемых в настоящем изобретении, можно получить с использованием солей исходных веществ или промежуточных продуктов. Свободные кислоты или свободные основания соединений, предлагаемых в настоящем изобретении, можно получить из соответствующей молекулярной соли с основанием или кислотой соответственно. Например, соединение, предлагаемое в настоящем изобретении, в виде соли присоединения с кислотой можно превратить в соответствующее свободное основание путем обработки подходящим основанием (например, раствором гидроксида аммония, гидроксида натрия и т.п.). Соединение, предлагаемое в настоящем изобретении, в виде соли присоединения с основанием можно превратить в соответствующую свободную кислоту путем обработки подходящей кислотой (например, хлористо-водородной кислотой и т.п.). Пролекарственные производные соединений, предлагаемых в настоящем изобретении, можно получить по методикам, известным специалистам с общей подготовкой в данной области техники (дополнительные подробности см., например, в публикации Saulnier et al., (1994), Bioorganic and MedicinalChemistry Letters, vol. 4, p. 1985). Содержащие защитные группы производные соединений, предлагаемых в настоящем изобретении,можно получить по методикам, известным специалистам с общей подготовкой в данной области техники. Подробное описание методик, применимых для введения защитных групп и их удаления, приведено в публикации Т.W. Greene, "Protecting Groups in Organic Chemistry", 3rd edition, John Wiley and Sons, Inc.,1999. Соединения, предлагаемые в настоящем изобретении, можно легко получить или образовать при осуществлении способа, предлагаемого в настоящем изобретении, в виде сольватов (например, гидратов). Гидраты соединений, предлагаемых в настоящем изобретении, можно легко получить путем перекристаллизации из водной/органической смеси растворителей с использованием таких органических растворителей, как диоксан, тетрагидрофуран или метанол. Соединения, предлагаемые в настоящем изобретении, можно получить в виде своих индивидуальных стереоизомеров по реакции рацемической смеси соединения с оптически активным разделяющим реагентом с образованием пары диастереоизомерных соединений, с последующим разделением диастереоизомеров и выделением оптически чистых энантиомеров. Хотя разделение энантиомеров можно выполнять с использованием ковалентных диастереоизомерных производных соединений, предлагаемых в настоящем изобретении, предпочтительными являются диссоциирующие комплексы (например, кристаллические диастереоизомерные соли). Диастереоизомеры обладают неодинаковыми физическими характеристиками (например, температурами кипения, температурами плавления, растворимостями, реакционной способностью и т.п.) и их можно легко разделить с учетом этих различий. Диастереоизомеры можно разделить с помощью хроматографии или предпочтительно по методикам разделения/выделения,основанным на различии растворимостей. Затем выделяют оптически чистый энантиомер вместе с разделяющим реагентом с помощью любой пригодной методики, не приводящей к рацемизации. Более под- 14016564 робное описание методик, применимых для выделения стереоизомеров соединений из их рацемической смеси, приведено в публикации Jean Jacques, Andre Collet, Samuel H. Wilen, "Enantiomers, Racemates иResolutions", John Wiley And Sons, Inc., 1981. Примеры Настоящее изобретение дополнительно поясняется, но не ограничивается приведенными ниже типичными примерами, которые предназначены для иллюстрации настоящего изобретения, и их не следует рассматривать как ограничивающие. Структуру конечных продуктов, описанных в настоящем изобретении, подтверждают с помощью стандартных аналитических методик, например с помощью спектрометрических и спектроскопических методик (например, МС и ЯМР). Использованные аббревиатуры являются такими, как принято в данной области техники. Очистку соединений проводят с помощью стандартных методик, например с помощью кристаллизации, флэш-хроматографии или ВЭЖХ с обращенной фазой. В примерах используют следующие аббревиатуры: Синтез соединений Фталазины. Как показано на схеме 1, соединения формулы Ia, b, c можно получить или по пути А, т.е. путем замещения хлора в промежуточном продукте типа II на замещенную аминогруппу, или из промежуточного продукта типа III с использованием пути В (прямое нуклеофильное замещение) или пути С (при условиях аминирования Бухвальда). В круглодонной колбе объемом 50 мл 4-(3,5-дихлорбензил)-4-фталазин-1-он (200 мг, 0,655 ммоль, 1 экв.) растворяют в дихлорэтане (5 мл) и добавляют ДИЭА (101 мкл, 0,721 ммоль, 1,1 экв.), затем медленно добавляют POCl3 (67,9 мкл, 0,721 ммоль, 1,1 экв.). Реакционную смесь перемешивают и кипятят с обратным холодильником при 60 С в течение 12 ч, затем раствор охлаждают льдом и обрабатывают насыщенным раствором бикарбоната натрия (5 мл). Добавляют дихлорметан (210 мл) и смесь промывают водой (10 мл). Объединенные органические фракции сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток растирают с этилацетатом и сушат в высоком вакууме и получают продукт в виде белого порошкообразного вещества (222 мг, выход 44%). 1-(5-(Диметилфосфорил)пиридин-2-ил)пиперазин (соединение 2) К раствору трет-бутил-4-(5-бромпиридин-2-ил)пиперазин-1-карбоксилата (250 мг, 0,730 ммоль) в 2,5 мл безводного ТГФ при -78 С в атмосфере аргона добавляют 2,5 М раствор н-бутиллития (320 мкл,0,80 ммоль). После перемешивания в течение 45 мин к реакционной смеси добавляют диметилфосфонийхлорид (164,4 мг, 1,46 ммоль) в 1 мл безводного ТГФ. Реакционную смесь нагревают при -30 С в течение 3 ч. Реакцию останавливают насыщенным водным раствором хлорида аммония и смесь подвергают распределению между ДХМ и рассолом. Органический слой сушат над Na2SO4 и концентрируют и получают неочищенное вещество. Полученное твердое вещество очищают с помощью флэшхроматографии на силикагеле, элюируя смесью 20-100% EtOAc:гептан. Фракции, содержащие искомый продукт, объединяют и концентрируют и получают почти белое твердое вещество (100 мг, выход 40,3%). Искомое соединение с защитной группой Boc растворяют в 2-PrOH (1 мл) и добавляют 4 н. раствор HCl. Реакционную смесь нагревают при 70 С в течение 30 мин и концентрируют и получают искомое соединение в виде гидрохлорида. МС (m/z, MH+): измерено 240,2; рассчитано 240,3. Трифторацетальдегидгидрат (1,7 г, 14,6 ммоль) при 95 С при перемешивании по каплям добавляют к смеси, состоящей из пентаоксида фосфора (1 г, 7,3 ммоль) и 4 мл концентрированной серной кислоты. Свежеполученный газообразный трифторацетальдегид собирают с помощью ловушки, наполненной твердым диоксидом углерода, и при -78 С в атмосфере аргона по каплям добавляют к раствору третбутил-4-(5-бромпиридин-2-ил)пиперазин-1-карбоксилата (1 г, 2,92 ммоль) в ТГФ и 2,5 М раствору нбутиллития в гексанах (1,3 мл, 3,2 ммоль). После добавления реакционную смесь нагревают до комнатной температуры и перемешивают в течение 2 ч. Реакцию останавливают при -78 С насыщенным водным раствором хлорида аммония и смесь подвергают распределению между ДХМ и рассолом. Органический слой сушат над Na2SO4 и концентрируют и получают коричневое твердое вещество. Неочищенное вещество очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью 10-80%EtOAc:гептан. Фракции, содержащие искомый продукт, объединяют и концентрируют и получают желтое липкое твердое вещество (450 мг, выход 42,6%). Искомое соединение с защитной группой Boc (380 мг, 1,1 ммоль) перемешивают в 20% растворе ТФК (трифторуксусная кислота) в ДХМ (5 мл) в течение 10 мин. Реакционную смесь концентрируют и получают искомый продукт в виде его соли с ТФК (260 мг,выход 95%). МС (m/z, MH+): измерено 262,2; рассчитано 262,25. 1,1,1,3,3,3-Гексафтор-2-(6-(пиперазин-1-ил)пиридин-3-ил)пропан-2-ол (соединение 4) Газообразный трифторацетальдегид собирают с помощью ловушки, наполненной твердым диоксидом углерода, и при -78 С в атмосфере аргона по каплям добавляют к раствору трет-бутилового эфира 4-(5-бромпиридин-2-ил)пиперазин-1-карбоновой кислоты (1 г, 2,92 ммоль) в ТГФ и 2,5 М раствору нбутиллития в гексанах (1,29 мл, 3,2 ммоль). После добавления реакционную смесь нагревают до комнатной температуры и перемешивают в течение 1 ч. Реакцию останавливают при -78 С насыщенным водным раствором хлорида аммония и смесь подвергают распределению между ДХМ и рассолом. Органический слой сушат над Na2SO4 и концентрируют и получают светло-желтое твердое вещество. Неочищенное вещество очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью 10-80%EtOAc:гептан. Фракции, содержащие искомый продукт, объединяют и концентрируют и получают бесцветное липкое твердое вещество (450 мг, выход 35,9%). Искомое соединение с защитной группой Boc(200 мг, 0,466 ммоль) перемешивают в течение 10 мин в 50% растворе ТФК в ДХМ (5 мл). Реакционную смесь концентрируют и получают искомый продукт в виде его соли с ТФК (150 мг, выход 98%). МС К раствору трет-бутилового эфира 4-(5-бромпиридин-2-ил)пиперазин-1-карбоновой кислоты (250 мг, 0,73 ммоль) в 3,5 мл безводного ТГФ при -78 С в атмосфере аргона добавляют 1,6 М раствор нбутиллития (500 мкл, 0,80 ммоль). После перемешивания в течение 45 мин к реакционной смеси добавляют оксетан-3-он (131 мг, 1,82 ммоль) в 200 мкл ДХМ. Реакционную смесь перемешивают при -78 С в течение 2 ч и при комнатной температуре в течение 16 ч. Реакцию останавливают насыщенным водным раствором хлорида аммония и смесь подвергают распределению между ДХМ и рассолом. Органический слой сушат над Na2SO4 и концентрируют и получают неочищенное вещество. Полученное твердое вещество очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью 20-100%) EtOAc:гептан. Фракции, содержащие искомый продукт, объединяют и концентрируют и получают почти белое твердое вещество (80 мг, выход 32,7%). Искомое соединение с защитной группой Boc (140 мг, 0,417 ммоль) растворяют в ДХМ и к смеси добавляют лутидин (194 мкл, 1,67 ммоль). Реакционную смесь охлаждают до 0 С, к ней добавляют триметилсилилтрифторметансульфонат (1,25 ммоль, 228 мкл) и перемешивают при 0 С в течение 2 ч. Реакционную смесь выливают на лед и подвергают распределению между ДХМ и водой. Органический слой сушат над Na2SO4 и концентрируют и получают коричневое маслянистое твердое вещество (70 мг, выход 71%). МС (m/z, MH+): измерено 236,4; рассчитано 236,3. 6-S)-3-Метилпиперазин-1-ил)никотинонитрил (соединение 6) Триэтиламин (4,13 г, 3 мл, 40,8 ммоль, 4 экв.) добавляют к раствору 6-хлорникотинонитрила (1,38 г,10 ммоль, 1 экв.) и (S)-2-метилпиперазина (1,00 г, 10 ммоль, 1 экв.) в ДМФ (15 мл) и полученный раствор перемешивают при КТ в течение 14 ч. В ходе реакции образуется белый осадок триэтиламингидрохлорида. Добавляют воду (15 мл) и EtOAc (100 мл), органический слой отделяют, сушат над сульфатом натрия и концентрируют при пониженном давлении и получают белый остаток. Затем твердое вещество сушат в высоком вакууме и получают искомый продукт в виде белого твердого вещества (1,4 г, 69%). 1 Н ЯМР (400 МГц, хлороформ-d)част./млн 8,38 (s, 1H), 7,58 (d, J=9,60 Гц, 1 Н), 6,59 (d, J=9,09 Гц,1H), 4,19-4,31 (m, 2 Н), 3,08-3,15 (m, 1 Н), 2,92-3,04 (m, 1 Н), 2,81-2,91 (m, 2 Н), 2,57-2,65 (m, 1H), 1,15 (d,J=6,32 Гц, 3 Н). 6-R)-3-Метилпиперазин-1-ил)никотинонитрил (соединение 7) Триэтиламин (5,51 г, 4 мл, 54,6 ммоль, 2,7 экв.) добавляют к раствору 6-хлорникотинонитрила (2,76 г, 20 ммоль, 1 экв.) и (R)-2-метилпиперазина (2,00 г, 20 ммоль, 1 экв.) в ДМФ (15 мл) и полученный раствор перемешивают при КТ в течение 36 ч. В ходе реакции образуется белый осадок триэтиламингидрохлорида. Добавляют воду (15 мл) и EtOAc (100 мл), органический слой отделяют, сушат над сульфатом натрия и концентрируют при пониженном давлении и получают белый остаток. Затем твердое вещество сушат в высоком вакууме и получают искомый продукт в виде белого твердого вещества (2,3 г, 59%). 1 Н ЯМР (400 МГц, хлороформ-d)част./млн 8,32 (d, J=2,40 Гц, 1H), 7,52 (dd, J=9,09, 2,27 Гц, 1H),6,52 (d, J=8,97 Гц, 1H), 4,14-4,24 (m, 2H), 3,01-3,07 (m, 1 Н), 2,72-2,94 (m, 3 Н), 2,52 (dd, J=12,76, 10,36 Гц,1 Н), 1,07 (d, J=6,32 Гц, 3 Н). 6-2R,5S)-2,5-Диметилпиперазин-1-ил)никотинонитрил (соединение 8)(2S,5R)-2,5-Диметилпиперазин (200 мг, 1,75 ммоль), 6-хлорникотинонитрил (1,75 ммоль) и триэтиламин (5,25 ммоль) объединяют в 0,875 М растворе 1-метил-2-пирролидинона. Реакционную смесь нагревают с помощью микроволнового излучения при 150 С в течение 30 мин. Смесь подвергают распределению между этилацетатом и водой, органическую фазу собирают. Водный слой повторно промывают этилацетатом и органические фазы объединяют. Сушат над сульфатом натрия, фильтруют и концентрируют. Очистка с помощью препаративной ВЭЖХ дает искомое соединение (выход 9%). 1 В сосуд для микроволнового реактора добавляют 1-бензил-4-хлорфталазин (1,06 г, 4,18 ммоль) и пиперазин (1,82 г, 20,9 ммоль), затем NMP (5 мл) и триэтиламин (6,62 мл, 12,5 ммоль). Сосуд герметично закрывают и облучают в микроволновом реакторе при 180 С (условия высокой мощности) в течение 30 мин. Добавляют дихлорметан (10 мл) и получают осадок, который промывают дополнительным количеством дихлорметана и сушат при пониженном давлении и получают продукт в виде белого порошкообразного вещества (745 мг, выход 58%). 1-Бензил-4-[1,4]-диазепам-1-илфталазин (соединение 10) В сосуд для микроволнового реактора добавляют 1-бензил-4-хлорфталазин (1,11 г, 4,35 ммоль) и гомопиперазин (2,20 г, 21,7 ммоль), затем NMP (5 мл) и триэтиламин (1,84 мл, 13,1 ммоль). Сосуд герметично закрывают и облучают в микроволновом реакторе при 180 С (условия высокой мощности) в тече- 18016564 ние 30 мин. Добавляют дихлорметан и смесь промывают водой. Объединенные органические фракции сушат над сульфатом магния и выпаривают при пониженном давлении и получают искомое соединение в виде желтого масла (640 мг, выход 41,5%). 1-Бензил-4-R)-3-метилпиперазин-1-ил)фталазин (соединение 11) В сосуде для микроволнового реактора твердый Na2CO3 (200 мг, 1,9 ммоль, 1,9 экв.) добавляют к раствору 1-бензил-4-хлорфталазина (250 мг, 0,98 ммоль, 1 экв.) и (R)-2-метилпиперазина (400 мг, 4,0 ммоль, 4,0 экв.) в диоксане (5 мл). Сосуд герметично закрывают и облучают в микроволновом реакторе при 150 С (условия высокой мощности) в течение 30 мин. Реакционную смесь фильтруют и концентрируют, затем разбавляют с помощью EtOAc (50 мл) и водой (15 мл). Органическую фракцию промывают водой и затем рассолом, затем сушат над сульфатом натрия. Растворитель выпаривают при пониженном давлении и получают искомое соединение в виде белого твердого вещества (180 мг, выход 58%). 1 Н ЯМР (400 МГц, хлороформ-d)част./млн 8,08 (d, J=7,07 Гц, 1 Н) 8,00 (d, J=7,71 Гц, 1 Н) 7,69-7,79 Твердый Na2CO3 (400 мг, 3,8 ммоль, 3,8 экв.) добавляют к раствору 1-бензил-4-хлорфталазина (250 мг, 0,98 ммоль, 1 экв.) и (S)-2-метилпиперазина (400 мг, 4,0 ммоль, 4,0 экв.) в диоксане (5 мл). Полученную суспензию нагревают при 100 С в течение 48 ч. Реакционную смесь концентрируют, добавляютEtOAc (50 мл) и воду (15 мл). Органическую фракцию промывают водой и затем рассолом, затем сушат над сульфатом натрия. Растворитель выпаривают при пониженном давлении и получают искомое соединение в виде белого твердого вещества (200 мг, выход 64%). 1 Н ЯМР (400 МГц, хлороформ-d)част./млн 7,97 (d, J=7,07 Гц, 1 Н) 7,89 (d, J=8,21 Гц, 1H) 7,58-7,68(Получают в соответствии с методикой, описанной в публикации Organic Synthesis, vol 4, p. 182). В 3-горлую круглодонную колбу помещают 5,4 мл концентрированной HCl (65 ммоль). Раствор охлаждают до 0 С и порциями добавляют 2-амино-5-цианопиримидин (515 мг, 4,28 ммоль) и перемешивают до получения гомогенного раствора. Затем раствор охлаждают до -15 С. К реакционной колбе присоединяют капельную воронку объемом 100 мл и затем при перемешивании в течение 20 мин по каплям добавляют охлажденный раствор NaNO2 (592 мг, 8,6 ммоль) в 5 мл воды. (Температуру поддерживают равной от -15 до -10 С). Раствор перемешивают в течение еще 1 ч и температуре дают подняться до -5 С. Затем смесь осторожно нейтрализуют 30% раствором NaOH до рН, равного примерно 7, следя за тем, чтобы температура не поднималась выше 0 С. Раствор экстрагируют с помощью EtOAc (320 мл), сушат над MgSO4,фильтруют и выпаривают и получают желтое твердое вещество (159 мг, выход 21,3%). 1-(6-Хлорпиридин-3-ил)пирролидин-2-он (соединение 14) В сосуде с завинчивающейся крышкой емкостью в 2 драхмы к раствору 2-хлор-5-йодпиридина (200 мг, 0,84 ммоль) в 4 мл безводного диоксана добавляют 2-пирролидинон (60,8 мкл, 0,79 ммоль), К 2 СО 3(415,6 мг, 3 ммоль), CuI (15,9 мг, 0,084 ммоль) и N,N'-диметил-1,2-этандиамин (11,8 мкл, 0,083 ммоль). Сосуд вакуумируют и продувают азотом. Реакционную смесь кипятят с обратным холодильником в течение 18 ч. Реакционную смесь фильтруют через целит и фильтрат концентрируют и получают неочищенное вещество. Смесь очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью 50100% EtOAc:гептан. Фракции, содержащие искомый продукт, объединяют и концентрируют и получают- 19016564 искомый продукт в виде белого твердого вещества (160 мг, выход: 97,4%). MC (m/z, MH+): измерено 197,1; рассчитано 197,64. 1-(6-Хлорпиридин-3-ил)циклопропанол (соединение 15) К суспензии метил-6-хлорпиридин-3-карбоксилата (1 г, 5,83 ммоль) в 17 мл безводного эфира добавляют 3 М раствор этилмагнийбромида (8,5 мл, 26 ммоль) в эфире и перемешивают в течение 1 ч, затем к реакционной смеси добавляют изопропоксид титана (1,73 мл, 5,84 ммоль). Смесь перемешивают в атмосфере аргона в течение 16 ч. Реакцию останавливают насыщенным водным раствором хлорида аммония и значение рН водной среды доводят до 3 1 н. раствором HCl. Смесь подвергают распределению между ДХМ и рассолом. Органический слой сушат над Na2SO4 и концентрируют и получают неочищенное вещество. Полученное твердое вещество очищают с помощью флэш-хроматографии на силикагеле,элюируя смесью 10-80% EtOAc:гептан. Фракции, содержащие искомый продукт, объединяют и концентрируют и получают коричневое маслянистое твердое вещество (180 мг, выход: 18,2%). МС (m/z, MH+): измерено 170,1; рассчитано 170,61. 2-(4-трет-Бутоксикарбонилпиперазин-1-ил)пиримидин-5-карбоновая кислота (соединение 16) В сухую 3-горлую круглодонную колбу объемом 250 мл в атмосфере N2 добавляют 5-бром-2-(4 Вос-пиперазин-1-ил)пиримидин (1,00 г, 2,91 ммоль), затем ТГФ (20,0 мл). В колбу вставляют низкотемпературный термометр. Колбу выдерживают в бане с твердым диоксидом углерода в течение 15 мин до достижения внутренней температуры равной -74 С и по каплям добавляют н-BuLi (2,92 мл, 7,29 ммоль). Реакционную смесь перемешивают в течение 1,5 ч и затем через реакционную смесь пропускают СО 2 в течение 45 мин, поддерживая внутреннюю температуру, равной -70 С. Затем колбу извлекают из бани и реакционной смеси дают нагреться до 0 С, затем реакцию останавливают водой. Органическую фазу экстрагируют дихлорметаном. Объединенные органические слои промывают рассолом и сушат надNa2SO4, фильтруют и концентрируют при пониженном давлении. Неочищенное соединение растирают с дихлорметаном и метанолом и получают небольшое количество чистого продукта. Неочищенное вещество очищают с помощью флэш-хроматографии на силикагеле (0-20% метанола в CH2Cl2) и получают искомое соединение (235 мг, выход 27%). Метиловый эфир 2-(4-трет-бутоксикарбонилпиперазин-1-ил)пиримидин-5-карбоновой кислоты (соединение 17) В высушенной в сушильном шкафу круглодонной колбе к 2-(4-трет-бутоксикарбонилпиперазин-1 ил)пиримидин-5-карбоновой кислоте (150 мг, 0,486 ммоль) в атмосфере азота добавляют метанол (1,0 мл) и бензол (3,7 мл) и реакционную смесь перемешивают в течение 10 мин. Добавляют триметилсилилдиазометан (0,34 мл, 0,678 ммоль) и реакционную смесь перемешивают в течение 1 ч. Затем добавляют ледяную уксусную кислоту (0,05 мл) до исчезновения желтой окраски. Реакционную смесь концентрируют при пониженном давлении и выпаривают вместе с бензолом. Остаток сушат в высоком вакууме и получают искомое соединение в виде белого твердого вещества (155 мг, выход 99%). Метиловый эфир 2-пиперазин-1-илпиримидин-5-карбоновой кислоты (соединение 18) Метиловый эфир 2-(4-трет-бутоксикарбонилпиперазин-1-ил)пиримидин-5-карбоновой кислоты (140 мг, 0,434 ммоль) в атмосфере N2 растворяют в дихлорметане (3,0 мл). Добавляют трифторуксусную кислоту (0,83 мл, 10,85 ммоль) и реакционную смесь перемешивают в течение 2 ч. Реакционную смесь концентрируют при пониженном давлении и несколько раз выпаривают вместе с дихлорметаном. Остаток сушат в высоком вакууме и получают искомое соединение в виде его соли с ТФК (130 мг, выход 90%). Метиловый эфир 6-гидроксиметилникотиновой кислоты (соединение 19) В высушенную в сушильном шкафу круглодонную колбу в атмосфере N2 добавляют метил-6(гидроксиметил)никотинат (500 мг, 2,99 ммоль), затем дихлорметан (20,0 мл). Добавляют триэтиламин(2,85 мл, 20,93 ммоль) и затем колбу выдерживают в бане со льдом в течение 50 мин. По каплям добавляют метансульфонилхлорид (0,81 мл, 10,47 ммоль). Реакционную смесь перемешивают при пониженной температуре в течение 45 мин и затем перемешивают при комнатной температуре в течение ночи. Затем реакционную смесь выливают в охлажденную льдом воду. Органические фазы экстрагируют дихлорметаном. Объединенные органические слои промывают рассолом и сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Затем остаток в высоком вакууме и получают искомое соединение (365 мг, выход 50%). Синтез соединений примеров 1-38 по пути А. Общая методика присоединения аминов к 1-хлорфталазинам В сосуд для микроволнового реактора, снабженный мешалкой, добавляют требуемые 1 хлорфталазин (2 ммоль, 1 экв.) и амин (2,6 ммоль, 1,3 экв.). Добавляют NMP (3 мл), затем триэтиламин(3,2 мл, 6 ммоль, 3 экв.). Сосуд герметично закрывают и облучают в микроволновом реакторе при 180 С(условия высокой мощности) в течение 30 мин. Затем к реакционной смеси добавляют воду (50 мл) и получают осадок, который отделяют фильтрованием, промывают дополнительным количеством холодной воды и затем сушат в вакууме. Затем продукты очищают или с помощью флэш-хроматографии на силикагеле, или с помощью ВЭЖХ с обращенной фазой. Пример 1. 6-[4-(4-Бензилфталазин-1-ил)пиперазин-1-ил]никотинонитрил В соответствии с общей методикой реакция 1-бензил-4-хлорфталазина (515 мг, 2,02 ммоль, 1 экв.) и 6-пиперазиноникотинонитрила (495 мг, 2,63 ммоль, 1,3 экв.) дает 430 мг искомого продукта в виде белого твердого вещества (выход 51%). 1 Н ЯМР (400 МГц, CDCl3):3,65 (m, 4H), 3,96 (m, 4H), 4,64 (s, 2H), 6,71 (d, J=9 Гц, 1H), 7,19 (t, J=7 Гц, 1H), 7,27 (t, J=7 Гц, 2 Н), 7,33-7,36 (m, 2H), 7,67 (dd, J=9, 2 Гц, 1H), 7,73-7,82 (m, 2H), 8,02-8,12 (m,2H), 8,45 (d, J=2,53 Гц, 1H). MC-BP (m/z, MH+): измерено 407,1987. Примеры 2-38 и 106-119. В представленной ниже таблице (табл. 1) приведены примеры соединений, полученных по пути А, по методике, аналогичной описанной выше. Превращение соединения примера 1 в соединения приведенных ниже примеров путем присоединения по Гриньяру. Пример 120. 2-(6-(4-(4-Бензилфталазин-1-ил)пиперазин-1-ил)пиридин-3-ил)пропан-2-амин В сосуд объемом 40 мл добавляют гидрат хлорида церия(III) (454,8 мг, 1,84 ммоль) и нагревают в высоком вакууме при 150 С в течение 2 ч. Горячий сосуд заполняют азотом и охлаждают до комнатной температуры, затем добавляют 2 мл ТГФ. Смесь перемешивают в течение 2 ч и затем при -78 С добавляют 3 М раствор метилмагнийбромида в ТГФ (0,62 мл, 1,9 ммоль). Реакционную смесь перемешивают в атмосфере аргона в течение 30 мин. К смеси, содержащей MeCeCl2, добавляют раствор соединения 1(250 мг, 0,62 ммоль) в ТГФ (1 мл). Реакционную смесь осторожно нагревают до комнатной температуры и перемешивание продолжают в течение ночи. Смесь фильтруют через целит, выпаривают и получают- 25016564 неочищенное вещество. Неочищенное вещество очищают с помощью полупрепаративной ВЭЖХ, элюируя смесью 10-100% ацетонитрил:вода (обе подвижные фазы модифицированы с помощью 3% н-PrOH). Фракции, содержащие искомый продукт, объединяют и сушат вымораживанием и получают белое твердое вещество (100 мг, выход: 37,2%). МС-ВР (m/z, MH+): измерено 439,2618; рассчитано 439,2610. Превращение соединения примера 120 в соединения приведенных ниже примеров путем амидирования. Пример 121. N-(2-(6-(4-(4-Бензилфталазин-1-ил)пиперазин-1-ил)пиридин-3-ил)пропан-2-ил)-2 метоксиацетамид К раствору соединения примера 120 (70 мг, 0,16 ммоль) в 2 мл безводного ДХМ добавляют ЭДХHCl (ЭДХ-1-этилен-3-(3-диметиламинопропил)карбодиимид) (31 мг, 0,16 ммоль), каталитическое количество ДМАП (диметиламинопиридин) и ТЭА (триэтиламин) (44 мкл, 0,32 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Смесь концентрируют и неочищенное вещество очищают с помощью полупрепаративной ВЭЖХ, элюируя 10-100% ацетонитрилом в воде (обе подвижные фазы модифицированы с помощью 3% н-PrOH). Фракции, содержащие искомый продукт, объединяют и сушат вымораживанием и получают белое твердое вещество (60 мг, выход: 74,1%). МС-ВР(m/z, MH+): измерено 511,2810; рассчитано 511,2821. Примеры 122-123. В представленной ниже таблице (табл. 1 а) приведены примеры соединений, полученных путем амидирования по методике, аналогичной описанной выше. Таблица 1 а Превращение соединения примера 115 в соединения приведенных ниже примеров путем присоединения по Гриньяру. Пример 124. 2-4-[1-4-Бензилфталазин-1-ил]пиперидин-4-илфенилпропан-2-ол К раствору соединения примера 115 (100 мг, 0,127 ммоль) в ТГФ (5 мл) при -78 С по каплям добавляют MeMgBr (85 мкл, 3,0 М раствор в Et2O, 0,5 ммоль). Реакционную смесь перемешивают при КТ в течение 4 ч и реакцию останавливают насыщенным водным раствором NH4Cl (3 мл). Дополнительно добавляют воду и органический слой экстрагируют с помощью EtOAc. Объединенные органические слои промывают водным раствором NaHCO3 и концентрируют. Очистка неочищенного продукта с помощью ВЭЖХ с детектированием при длине волны, равной 220 нм, с использованием ацетонитрила в воде (от 10 до 100% с 3% 1-пропанола) дает искомый продукт в виде окрашенного в желтый цвет порошкообразного вещества (54 мг, 54%). 1H ЯМР (400 МГц, ДМСО-d6):8,16 (m, 2 Н), 7,89 (m, 2 Н), 7,16-7,44 (m, 9 Н), 4,59 (s, 2 Н), 3,89 (d,J=12,6 Гц, 2 Н), 3,11 (t, J=11,7 Гц, 2 Н), 2,78 (m, 1H), 2,01 (m, 4 Н), 1,42 (s, 6H). МС-ВР (m/z, MH+): измерено 438,2546; рассчитано 438,2545. Превращение соединения примера 116 в соединения приведенных ниже примеров путем восстановления/ацетилирования. Пример 125. 4-[1-(4-Бензилфталазин-1-ил)пиперидин-4-ил]бензиламин К раствору соединения примера 116 (2,5 г, 6,19 ммоль) в МеОН при 0 С добавляют NiCl2 (962 мг,7,42 ммоль) и NaBH4 (1,17 г, 30,9 ммоль). Реакционную смесь нагревают при комнатной температуре в- 26016564 течение еще 10 ч, затем фильтруют и промывают с помощью ДХМ. Органический слой удаляют и получают неочищенный продукт. Очистка неочищенного продукта с помощью ВЭЖХ при использовании ацетонитрила в воде (от 10 до 100% с 3% 1-пропанола) с детектированием при длине волны, равной 220 нм, дает искомое соединение в виде белого твердого вещества (1,5 г, 59%). 1 Н ЯМР (400 МГц, ДМСО-d6):= 8,09 (m, 2 Н ), 7,83 (m, 2 Н), 7,16-7,44 (m, 9 Н), 4,51 (s, 2 Н), 3,83 (d,J=12,6 Гц, 2 Н), 3,63 (s, 2 Н), 3,03 (t, J=10,6 Гц, 2 Н), 2,72 (m, 1H), 1,93 (m, 4 Н). МС (m/z, MH+): измерено 408,55. Пример 126. N-4-[1-(4-Бензилфталазин-1-ил)пиперидин-4-ил)бензилацетамид К раствору соединения примера 125 (60 мг, 0,147 ммоль) в МеОН (4 мл) добавляют избыток уксусного ангидрида и реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Раствор концентрируют и промывают с помощью ДХМ, затем реакцию останавливают водным растворомNaHCO3. Органический слой удаляют и получают неочищенный продукт. Очистка неочищенного продукта с помощью ВЭЖХ с детектированием при длине волны, равной 220 нм, с использованием ацетонитрила в воде (от 10 до 100% с 3% 1-пропанола) дает искомое соединение (40 мг, 60%). 1 Н ЯМР (400 МГц, ДМСО-d6):= 8,22 (s, 1H), 8,12 (m, 2 Н), 7,83 (m, 2 Н), 7,14-7,27 (m, 9 Н), 4,51 (s,2 Н), 4,16 (d, J=5,5 Гц, 2 Н), 4,82 (d, J=12,1 Гц, 2 Н), 3,03 (t, J=11,6 Гц, 2 Н), 2,43 (m, 1H), 1,89 (m, 4 Н), 1,80 К раствору 1-бензил-4-хлорфталазина (1,08 г, 4,04 ммоль) в 8 мл NMP добавляют 4-(4-нитрофенил)пиперидин (1 г, 4,85 ммоль) и ТЭА (1,68 мл, 12,12 ммоль). Реакционную смесь нагревают в микроволновом реакторе при 150 С в течение 45 мин. К реакционной смеси добавляют воду и получают осадок и твердое вещество собирают фильтрованием и сушат в вакууме. Полученное твердое вещество очищают с помощью ВЭЖХ с детектированием при длине волны, равной 220 нм, с использованием ацетонитрила в воде (от 20 до 100% с 3% 1-пропанола) и получают искомое соединение (1,4 г, 78%). 1 Н ЯМР (400 МГц, ДМСО-d6):= 8,21 (m, 4 Н), 7,91 (m, 2 Н), 7,67 (d, J=8,6 Гц, 2 Н), 7,16-7,34 (m, 5 Н),4,59 (s, 2 Н), 3,97 (d, J=12,6 Гц, 2 Н), 3,13 (t, J=10,1 Гц, 2 Н), 3,02 (m, 1H), 2,05 (m, 4 Н). МС (m/z, MH+): измерено 424,50. Пример 128. 4-[1-(4-Бензилфталазин-1-ил)пиперидин-4-ил]фениламин К раствору соединения примера 20 (120 мг, 0,269 ммоль) в МеОН (8 мл) добавляют Pd/C (57 мг) и реакционную смесь перемешивают в атмосфере водорода при комнатной температуре в течение 12 ч. Для удаления Pd/C реакционную смесь фильтруют и органический растворитель удаляют в вакууме и получают неочищенный продукт. Неочищенный продукт очищают с помощью ВЭЖХ с детектированием при длине волны, равной 220 нм, с использованием ацетонитрила в воде (от 30 до 100% с 3% 1 пропанола) и получают искомое соединение (100 мг, 94%). 1 Н ЯМР (400 МГц, ДМСО-d6):= 8,15 (m, 2 Н), 7,87 (m, 2 Н), 7,17-7,34 (m, 5 Н), 7,09 (d, J= 8,6 Гц,2 Н), 6,54 (d, J=11,6 Гц, 2 Н), 4,85 (s, 2H), 3,86 (d, J=12,7 Гц, 2 Н), 3,07 (t, J=5,6 Гц, 2 Н), 2,65 (m, 1 Н), 1,90 4-[1-(4-Бензилфталазин-1-ил)пиперидин-4-ил]фениламин (100 мг, 0,241 ммоль), ацетилхлорид (23,9 мкл, 0,336 ммоль) и ТЭА (62,4 мкл, 0,448 ммоль) смешивают в ДМФ (5 мл) и смесь перемешивают при комнатной температуре в течение 12 ч. Затем смесь фильтруют через целит и промывают с помощью МеОН. Органический растворитель удаляют и получают неочищенный продукт. Очистка неочищенного продукта с помощью ВЭЖХ с детектированием при длине волны, равной 220 нм, с использованием аце- 27016564 тонитрила в воде (от 30 до 100% с 3% 1-пропанола) дает искомое соединение (12 мг, 11%). 1H ЯМР (400 МГц, ДМСО-d6):= 9,86 (s, 1H), 8,13 (m, 2 Н), 7,91 (m, 2 Н), 7,18-7,54 (m, 9 Н), 4,59 (s,2 Н), 3,89 (d, J=12,7 Гц, 2 Н), 3,10 (t, J=10,1 Гц, 2 Н), 2,77 (m, 1H), 2,01 (s, 3H), 1,99 (m, 4 Н). МС-ВР (m/z, MH+): измерено 437,2322; рассчитано 437,2341. Синтез соединений примеров 39-54 и 130-147 по пути В. Общая методика присоединения аминов к гетероарилхлоридам В сосуде для микроволнового реактора объемом 2 мл объединяют требуемые аминофталазин III(0,33 ммоль, 1 экв.) и гетероарилхлорид (0,46 ммоль, 1,4 экв.). Добавляют триэтиламин (68 мкл, 0,49 ммоль, 1,5 экв.) и NMP (1 мл). Сосуд герметично закрывают и облучают в микроволновом реакторе (условия высокой мощности) при 180 С в течение 15 мин. Затем к реакционной смеси добавляют воду (15 мл) и получают осадок, который отделяют фильтрованием, промывают дополнительным количеством холодной воды и затем сушат в вакууме. Затем продукты очищают с помощью флэш-хроматографии на силикагеле или ВЭЖХ с обращенной фазой. Пример 39. 2-[4-(4-Бензилфталазин-1-ил)пиперазин-1-ил]пиримидин-5-карбонитрил С использованием общей методики 1-бензил-4-пиперазин-1-илфталазин (56 мг, 0,184 ммоль) и 2 хлор-5-цианопиримидин (44,5 мг, 0,239 ммоль) добавляют в микроволновой реактор, снабженный мешалкой, и добавляют MeCN (0,5 мл) и NMP (0,5 мл). Сосуд герметично закрывают и реакционную смесь облучают в микроволновом реакторе в условиях высокой мощности при 180 С в течение 15 мин. Продукт наблюдают в виде главного пика (m/z; M+1= 408). Соединение очищают с помощью препаративной ВЭЖХ с использованием методики С 8-254 нм. 1 Н ЯМР (400 МГц, CD3OD):= 8,70 (s, 2 Н), 8,51 (t, J=16 Гц, 8 Гц, 2 Н), 8,19 (m, 2 Н), 7,36 (m, 4 Н),7,36 (m, 1H), 4,78 (s, 2 Н), 4,29 (t, J=10 Гц, 6 Гц, 4 Н), 3,92 (t, J=10 Гц, 6 Гц, 4 Н). Примеры 40-54 и 130-141. В представленной ниже таблице (табл. 2) приведены примеры соединений, полученных по пути В по методике, аналогичной описанной выше. Таблица 2
МПК / Метки
МПК: C07D 405/14, C07D 401/14, A61K 31/4545, C07D 401/12, C07D 491/048, C07F 9/58, C07D 487/04, C07D 417/14, C07D 498/14, C07D 401/04, C07D 237/30, C07D 401/06, A61K 31/502, C07D 237/28, C07D 403/12
Метки: сигнала, hedgehog, бензил, передачи, пиридинилпроизводные, пути, качестве, модуляторов
Код ссылки
<a href="https://eas.patents.su/30-16564-benzil-i-piridinilproizvodnye-v-kachestve-modulyatorov-puti-peredachi-signala-hedgehog.html" rel="bookmark" title="База патентов Евразийского Союза">Бензил- и пиридинилпроизводные в качестве модуляторов пути передачи сигнала hedgehog</a>
Предыдущий патент: Модуляторы активности рецептора хемокина, кристаллические формы и способ их получения
Следующий патент: Способ воздействия на индуктивную связь между двумя расположенными на расстоянии друг от друга телами, а также устройство для осуществления способа
Случайный патент: Способ запроса альтернативной системы связи












