Модуляторы активности рецептора хемокина, кристаллические формы и способ их получения
Номер патента: 16563
Опубликовано: 30.05.2012
Авторы: Чжао Рулин, Данциа Джон В., Сяо Цили, Ян Майкл Г., Рандаззо Майкл Е., Мадрик Богуслав М., Картер Перси Х.
Формула / Реферат
1. Соединение, представляющее собой N-((1R,2S,5R)-5-(трет-бутиламино)-2-((S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамид или его фармацевтически приемлемую соль.
2. Соединение по п.1, представляющее собой кристаллическую форму N-((1R,2S,5R)-5-(трет-бутиламино)-2-((S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида или его фармацевтически приемлемую соль.
3. Кристаллическая форма по п.2, характеризующаяся следующими параметрами элементарной ячейки:
размеры элементарной ячейки:
a=18,7240(4),
b=8,0171(2),
c=19,6568(5);
α=90;
β=114,935(2);
γ=90;
V(Å3)=2675,7(1);
пространственная группа P212121;
молекулы/элементарная ячейка 2,
где измерение указанной кристаллической формы осуществляют при комнатной температуре около 22°C.
4. Кристаллическая форма по пп.2, 3, характеризующаяся с помощью дифракционной рентгенограммы на порошке, включающей три или большее количество 2θ значений (CuKα l=1,5418 Å), выбранных из 5,5, 9,1, 12,1, 14,0 и 19,2, при температуре около 22°C.
5. Кристаллическая форма по пп.2-4, дополнительно характеризующаяся с помощью дифракционной рентгенограммы на порошке, включающей четыре или большее количество 2θ значений (CuKα l=1,5418 Å), выбранных из 5,5, 9,1, 12,1, 14,0 и 19,2, при температуре приблизительно 22°C.
6. Кристаллическая форма по пп.2-5, характеризующаяся фракционными атомными координатами в соответствии с табл. 3.
7. Кристаллическая форма по пп.2-6, имеющая дифракционную рентгенограмму на порошке, по существу, в соответствии с фиг. 2.
8. Фармацевтическая композиция, содержащая соединение по пп.1-7 и фармацевтически приемлемый носитель или разбавитель.
9. Способ лечения заболевания у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества соединения по пп.1-7, где заболевание выбрано из диабета, ожирения, метаболического синдрома, инсульта, нейропатической боли, ишемической кардиомиопатии, псориаза, гипертензии, склеродермии, остеоартрита, аневризмы, лихорадки, сердечно-сосудистого заболевания, болезни Крона, застойной сердечной недостаточности, аутоиммунных заболеваний, ВИЧ-инфекции, ВИЧ-ассоциированной деменции, псориаза, идиопатического фиброза легких, атеросклероза трансплантата, физически или химически вызванной травмы головного мозга, воспалительного заболевания кишечника, альвеолита, колита, системной красной волчанки, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, рассеянного склероза, атеросклероза, васкулита, нестабильных бляшек, ревматоидного артрита, рестеноза, венозной неоинтимальной гиперплазии, неоинтимальной гиперплазии диализ-трансплантата, неоинтимальной гиперплазии артериовенозного шунта, пересадки органа, хронической нефропатии аллотрансплантата и рака.
10. Способ по п.9, отличающийся тем, что заболевание выбрано из диабета, ожирения, болезни Крона, системной красной волчанки, гломерулонефрита, рассеянного склероза, атеросклероза, рестеноза и пересадки органа.
11. Способ по пп.9, 10, отличающийся тем, что заболевание выбрано из рассеянного склероза, атеросклероза, болезни Крона и диабета.
12. Способ получения соединения формулы (X)
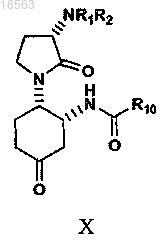
включающий следующие стадии:
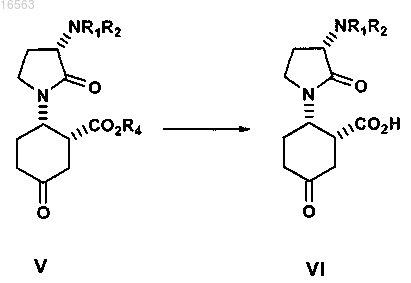
гидролиз сложноэфирного остатка соединения формулы V гидролизующим агентом для образования кислоты соединения VI в интервале температур от приблизительно -5 до приблизительно 5°C
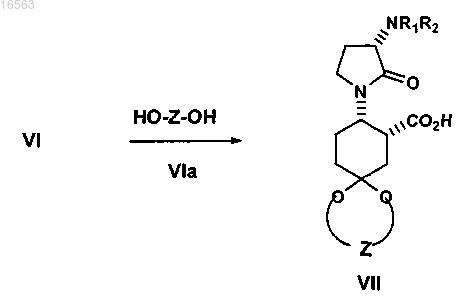
взаимодействие соединения формулы VIa, HO-Z-OH, с соединением формулы VI (необязательно in situ) в присутствии кислотного катализатора с получением соединения формулы VII, имеющего остаток карбоновой кислоты
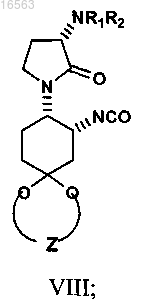
превращение остатка карбоновой кислоты кеталя формулы VII в соответствующий изоцианат формулы VIII
взаимодействие изоцианата формулы VIII с соединением формулы R10COW в присутствии соответствующего ангидрида кислоты (R10CO)2O с образованием амида формулы IX, имеющего остаток кеталя
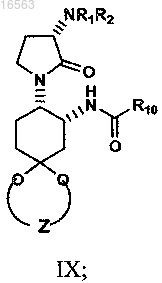
гидролиз кетального остатка амида формулы IX с образованием соединения формулы X,
где R1 и R2 независимо представляют собой водород или защитную группу амина;
R4 и R10 независимо представляют собой C1-6алкил или бензил;
W представляет собой OH или O-C1-6алкил;
Z представляет собой -C2H4-.
13. Способ получения соединения формулы (XI)

включающий:
a) добавление кислоты Льюиса в раствор соединения формулы X, полученного способом по п.12, и амина, имеющего формулу HNR8R9, причем R8 и R9 независимо представляют собой водород или C1-6алкил, в апротонном растворителе, чтобы образовать имин-енамин; и
b) обработку имин-енамина восстанавливающим агентом с получением соединения формулы XI, имеющего аминопирролидонильный остаток.
14. Соединение (7R,8S)-8-((3S)-3-(((бензилокси)карбонил)амино)-2-оксо-1-пирролидинил)-1,4-диоксаспиро[4.5]декан-7-карбоновой кислоты или его соль.
15. Соединение бензил ((3S)-1-((7R,8S)-7-(азидокарбонил)-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамата или его соль.
16. Соединение бензил ((3S)-1-((7R,8S)-7-изоцианато-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамата или его соль.
17. Соединение бензил ((3S)-1-((7R,8S)-7-ацетамидо-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамата или его соль.
18. Соединение бензил ((3S)-1-((1S,2R)-2-ацетамидо-4-оксоциклогексил)-2-оксо-3-пирролидинил)карбамата или его соль.
19. Соединение бензил ((3S)-1-((1S,2R,4R)-2-ацетамидо-4-(трет-бутиламино)циклогексил)-2-оксо-3-пирролидинил)карбамата или его соль.
Текст
МОДУЛЯТОРЫ АКТИВНОСТИ РЕЦЕПТОРА ХЕМОКИНА, КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ Изобретение описывает новый антагонист или частичный агонист/антагонист активности MCPI рецептора: N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамид или его фармацевтически приемлемую соль или сольват, имеющие неожиданную комбинацию из требуемых фармакологических характеристик. Также описаны кристаллические формы по настоящему изобретению. Фармацевтические композиции, содержащие их, и способы их применения в виде агентов лечения воспалительных заболеваний, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний также являются целью настоящего изобретения. Соединения, которые являются полезными промежуточными соединениями процесса, также описаны в настоящем изобретении. 016563 Область техники, к которой относится изобретение Объектом настоящего изобретения является N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамид или его фармацевтически приемлемая соль, сольват или пролекарство и их кристалические формы, имеющие неожиданные комбинации желательных фармакологических характеристик. Фармацевтические композиции, содержащие их,и способы их применения в виде агентов лечения воспалительных, аллергических, аутоиммунных, метаболических, рака и/или сердечно-сосудистых заболеваний являются также объектом настоящего изобретения. Настоящее изобретение также включает в себя способ получения соединений формул (X) и (XI): где R1, R2, R8, R9 и R10 являются такими, как описано далее. Соединения, которые являются полезными промежуточными соединениями способа, также охватываются данным изобретением. Сведения о предшествующем уровне техники Хемокины являются хемотаксическими цитокинами с молекулярной массой 6-15 кДа, которые высвобождаются большим числом клеток для привлечения и активации, помимо других типов клеток, макрофагов, T- и B-лимфоцитов, эозинофилов, базофилов и нейтрофилов (описано в обзоре: Charo andRasonhoff, New Eng. J. Med. 2006, 354, 610-621; Luster, New Eng. J. Med. 1998, 338, 436-445 и Rollins,Blood 1997, 90, 909-928). Существует два больших класса хемокинов, CXC и CC, в зависимости от того,отделены ли первые два остатка цистеина в аминокислотной последовательности одной аминокислотой(CXC) или они являются смежными (CC). CXC хемокины, такие как интерлейкин-8 (IL-8), нейтрофилактивирующий белок-2 (NAP-2) и белок, стимулирующий активность роста меланомы (MGSA), являются хемотаксическими, в первую очередь, для нейтрофилов и Т-лимфоцитов, в то время как СС хемокины,такие как RANTES, MIP-1, MIP-1, хемотаксические белки моноцитов (MCP-1, MCP-2, MCP-3, MCP-4 и MCP-5) и эотаксины (-1 и -2) являются хемотаксическими, помимо других типов клеток, для макрофагов, Т-лимфоцитов, эозинофилов, дендритных клеток и базофилов. Также существуют хемокины лимфотактин-1, лимфотактин-2 (оба C хемокины) и фракталкин (CX3C хемокин), которые не попадают ни в одно из основных подсемейств хемокинов. Хемокины связываются со специфическими рецепторами клеточной поверхности, принадлежащими к семейству белков с 7-трансмембранным доменом, сопряженных с G-белком (см. обзор Horuk,Trends Pharm. Sci 1994, 15, 159-165), которые обозначаются как "хемокиновые рецепторы". При связывании с соответствующими лигандами хемокиновые рецепторы преобразуют внутриклеточный сигнал через связанные тримерные G-белки, что приводит, среди прочих реакций, к быстрому возрастанию концентрации внутриклеточного кальция, изменениям в форме клеток, повышенной экспрессии молекул клеточной адгезии, дегрануляции и способствует миграции клеток. Существует по меньшей мере десять типов хемокиновых рецепторов человека, которые связываются или реагируют на CC хемокины с последующими характерными эффектами (описано в обзоре Zlotnik and Oshie Immunity 2000, 12, 121):CCR-11 [MCP-1, MCP-2 и MCP-4] (Schweickert, et al., J. Biol. Chem. 2000, 275, 90550). Наряду с хемокиновыми рецепторами млекопитающих цитомегаловирусы млекопитающих, герпесвирусы и поксвирусы, как было показано, экспрессируют в инфицированных клетках белки со связывающими свойствами хемокиновых рецепторов (см. обзор: Wells и Schwartz, Curr. Opin. Biotech. 1997, 8,741-748). Хемокины CC человека, такие как RANTES и MCP-3, могут вызывать быструю мобилизацию кальция через кодированные вирусом рецепторы. Экспрессия рецепторов может облегчать развитие инфекции, способствуя нарушению нормального иммунного надзора и ответа на инфекцию. Кроме того,хемокиновые рецепторы человека, такие как CXCR4, CCR-2, CCR-3, CCR5 и CCR8, могут действовать как корецепторы при инфицировании клеток млекопитающих микробами, например вирусами иммунодефицита человека (ВИЧ). Хемокины и соответствующие им рецепторы задействованы в качестве важных медиаторов воспалительных, инфекционных и иммунных расстройств и заболеваний, включая астму и аллергические заболевания, так же как и аутоиммунные патологии, такие как ревматоидный артрит и атеросклероз (описаны в обзоре Charo and Rasonhoff, New Eng. J. Med. 2006, 354, 610-621; Z. Gao and W.A. Metz, Chem.Reports Med. Chem. 2000, 35, 191; Saunders and Tarby, Drug Disc. Today. 1999, 4, 80; Premack and Schall,Nature Medicine. 1996, 2, 1174). Например, хемокин хемоаттрактант моноцитов 1 типа (MCP-1) и его рецептор CC хемокиновый рецептор 2 (CCR-2) играют ключевую роль в привлечении лейкоцитов к местам воспаления и в последующей активации этих клеток. Когда хемокин MCP-1 связывается с CCR-2, он вызывает быстрое увеличение внутриклеточной концентрации кальция, повышенную экспрессию молекул клеточной адгезии, дегрануляцию клеток и способствует миграции лейкоцитов. Демонстрация значения взаимодействия MCP-1/CCR-2 была осуществлена с помощью экспериментов с генетически модифицированными мышами. Мыши MCP-1-/- были не способны к привлечению моноцитов в места вирусного воспаления после иммунной провокации нескольких разных типов (Bao Lu, et al., J. Exp. Med. 1998, 187,601). Аналогично, мыши CCR-2-/- были не способны привлекать нейтрофилы или продуцировать интерферон- при провокации; более того, лейкоциты нулевых по CCR-2 мышей не мигрировали в ответ наMCP-1 (Landin Boring, et al., J. Clin. Invest. 1997, 100, 2552), тем самым демонстрируя специфичность взаимодействия MCP-1/CCR-2. Две другие группы исследователей независимо друг от друга сообщили о таких же результатах с разными линиями мышей CCR-2-/- (William A. Kuziel, et al., Proc. Natl. Acad. Sci.USA. 1997, 94, 12053 и Takao Kurihara, et al., J. Exp. Med. 1997, 186, 1757). Жизнеспособность и обычно нормальное состояние здоровья животных MCP-1-/- и CCR-2-/- заслуживают внимание, поскольку нарушение взаимодействия MCP-1/CCR-2 не вызывает критических физиологических расстройств. При совместном рассмотрении эти данные приводят к выводу, что молекулы, которые блокируют действияMCP-1/CCR-2, будут пригодны в лечении большого числа воспалительных и аутоиммунных расстройствC. Wiessner, C. Exp. Opin. Ther. Targets. 2003, 7, 35). Эта гипотеза в настоящее время подтверждена на нескольких животных моделях различных заболеваний, как описано ниже. Известно, что MCP-1 повышается у пациентов с ревматоидным артритом (Alisa Koch, et al., J. Clin.Invest. 1992, 90, 772-779). Более того, некоторые доклинические исследования показали потенциальную терапевтическую ценность антагонизма взаимодействия MCP-1/CCR-2 в лечении ревматоидного артрита. Как было недавно показано, ДНК вакцина, кодирующая MCP-1, облегчает течение вызванного полиадъювантом хронического артрита у крыс (Sawsan Youssef, et al,. J. Clin. Invest. 2000, 106, 361). Аналогично, симптомы заболевания могут сдерживаться путем непосредственного введения антител к MCP-1 крысам с коллагениндуцированным артритом (Hiroomi Ogata, et al., J. Pathol. 1997, 182, 106) или вызванным клеточными стенками стрептококков артритом (Ralph С. Schimmer, et al., J. Immunol. 1998, 160,1466). Возможно, наиболее важно, что пептидный антагонист MCP-1, MCP-1 (9-76), как было показано, и предотвращает начало заболевания, и уменьшает симптомы заболевания (в зависимости от времени введения) в мышиной модели артрита MRL-1pr (Jiang-Hong Gong, et al., J. Exp. Med. 1997, 186, 131). Более того, было показано, что введение низкомолекулярных антагонистов CCR-2 снижает балльную оценку выраженности клинических проявлений в модели артрита на грызунах (C. M. Brodmerkel, et al., J.Immunol. 2005, 175, 5370 и М. Xia, et al., патентная заявка США 0069123, 2006). Введение анти-CCR-2 антител имеет различные эффекты на мышиный CIA, в зависимости от времени введения (H. Bruhl, et al.J. Immunol. 2004, 172, 890). Последние исследования с мышами CCR-2-/- предполагают, что потеря CCR-2 может ухудшать течение артрита в моделях на грызунах в специфических экспериментальных условиях(M.P. Quinones, et al. J. Clin. Invest. 2004, 113, 856; M.P. Quinones, et al. J. Mol. Med. 2006, 84, 503). Известно, что MCP-1 повышается в атеросклеротических бляшках, и было показано, что циркулирующие уровни MCP-1 снижаются при лечении терапевтическими агентами (Abdolreza Rezaie-Majd, etal., Arterioscler. Thromb. Vasc. Biol. 2002, 22, 1194-1199). Некоторые ключевые исследования показали потенциальную терапевтическую ценность антагонизма взаимодействия MCP-1/CCR-2 в лечении атеросклероза. Например, когда MCP-1-/- мышей скрещивают с LDL рецептор-дефицитными мышами, наблюдается 83% снижение отложения липидов в аорте (Long Gu, et al., Mol. Cell. 1998, 2, 275). Сходным образом, когда генетически удаляют MCP-1 у мышей, которые уже сверхэкспрессируют аполипопротеин В человека, полученные мыши защищены от образования атеросклеротических бляшек по сравнению с контрольными мышами MCP-1+/+ apoB (Jennifa Gosling, et al., J. Clin. Invest. 1999, 103, 773). Аналогично,когда CCR-2-/- мышей скрещивают с мышами аполипопротеин E-/-, наблюдается существенное снижение появления атеросклеротических бляшек (Landin Boring, et al., Nature. 1998, 394, 894; T.C. Dawson, et al.Atherosclerosis. 1999, 143, 205). В конечном счете, когда мышам аполипопротеин E-/- вводят ген, кодирующий пептидный антагонист CCR-2, размер бляшек уменьшается и повышается стабильность бляшки(W. Ni, et al. Circulation. 2001, 103, 2096-2101). Пересадка костного мозга от мышей CCR-2-/- мышамApoE3-Leiden подавляет ранний атерогенез (J. Guo, et al. Arterioscler. Thromb. Vasc. Biol. 2003, 23, 447),но обладает минимальным действием на сформированные бляшки (J. Guo, et al. Arterioscler. Thromb.Vasc. Biol. 2005, 25, 1014). Пациенты с сахарным диабетом 2 типа обычно демонстрируют инсулинорезистентность, как одно из отличительных свойств заболевания. Инсулинорезистентность также связана с группированием патологий, известных как "метаболический синдром" или "синдром X", который включает ожирение, атеросклероз, гипертензию и дислипидемию (см. обзор: Eckel, et al. Lancet. 2005, 365, 1415). Общепризнано,что воспаление играет роль в утяжелении патологического процесса при диабете 2 типа и "синдроме X"MCP-1 известен, как играющий роль в инсулинорезистентности, вызванной ожирением. В культуре, преадипоциты человека стабильно экспрессируют MCP-1 (Gerhardt, Mol. Cell. Endocrinology 2001, 175, 81).CCR-2 экспрессируется на адипоцитах; добавление MCP-1 к дифференцированным адипоцитам in vitro снижает стимулированный инсулином захват глюкозы и экспрессию нескольких адипогенных геновSci. USA. 1999, 96, 6902). Пациенты с диабетом 2 типа имеют более высокие уровни циркулирующегоMCP-1, чем в контроле без диабета (S. Nomura, et al. Clin. Exp. Immunol. 2000, 727, 437), и высвобождение MCP-1 из жировой ткани может быть снижено путем применения противодиабетическим лечением,таким как метформин или тиазолидиндионы (J.M. Bruun, et al. J. Clin. Endocrinol. Metab. 2005, 90, 2282). Аналогично, MCP-1 был также сверхэкспрессирован в мышиных экспериментальных моделях ожирения и, в первую очередь, продуцировался жировой тканью (Sartipy and Loskutoff, Proc. Natl. Acad. Sci. USA. 2003, 100, 7265). У мышей с ожирением экспрессия MCP-1 предшествует или появляется одновременно с началом инсулинорезистентности (H. Xu, et al. J. Clin. Invest. 2003, 772, 1821). Другое исследование показало, что экспрессия MCP-1 положительно коррелирует с массой тела в перигонадальной жировой ткани мышей (Weisberg, et al. J. Clin. Invest. 2003, 772, 1796). Следуя этим данным, развитие инсулинорезистентности у мышей db/db ослабляли либо путем генетической делеции MCP-1, либо путем гениндуцированной экспрессии доминантного негативного пептида (H. Kanda, et al. J. Clin. Invest. 2006, 116, 1494). Следующее логическое преобразование может быть также продемонстрировано: сверхэкспрессия MCP-1 в жировой ткани обеспечивала инсулинорезистентность (N. Kamei, et al. J. Biol. Chem. 2006, 281, 26602). Также имеется один противоречивый результат, показывающий, что генетическая делеция MCP-1 не воздействует на инсулинорезистентность у мышей db/db (F.Y. Chow, et al. Diabetologia 2007, 50, 471). Следуя данным о MCP-1, прямые исследования с CCR-2 (MCP-1 рецептор) показали, что он играет роль в формировании ожирения и вызванной ожирением инсулинорезистентности. Соблюдение диеты с большим количеством жиров повышает число циркулирующих воспалительных моноцитов CCR-2+ как в диком типе мышей (С.L. Tsou, et al. J. Clin. Invest. 2007, 777, 902), так и у мышей ApoE-/- (F. Tacke, et al. J.Clin. Invest. 2007, 117, 185). Генетическая делеция CCR-2 снижает число активированных макрофагов в жировой ткани мышей (С.N. Lumeng, et al. Diabetes. 2007, 56, 16), но не воздействует на популяцию M2 макрофагов жировой ткани, которые, как полагают, поддерживают "худое" состояние (С.N. Lumeng, et al.J. Clin. Invest. 2007, 777, 175). Генетическая делеция CCR-2 уменьшает вызванное диетой ожирение и улучшает чувствительность к инсулину в модели с вызванным диетой ожирением (S.P. Weisberg, et al.Clin. Invest. 2006, 776, 115; P. Cornelius, R.P. Gladue, R.S. Sebastian, патент WO 2006/013427 A2, 2006), в зависимости от экспериментальных условий (A. Chen, et al. Obes. Res. 2005, 13, 1311). Введение низкомолекулярного антагониста CCR-2 также улучшает чувствительность к инсулину в такой же модели(S.P. Weisberg, et al. J. Clin. Invest. 2006, 116, 115). Два исследования описывают важную роль CCR-2 в вызванном гипертензией сосудистом воспалении, ремоделировании и гипертрофии (E. Bush et al., Hypertension. 2000, 36, 360; M. Ishibashi, et al. Circ.-3 016563 Известно, что MCP-1 повышается у людей с рассеянным склерозом, и было показано, что эффективное лечение интерфероном -1b снижает экспрессию MCP-1 в мононуклеарных клетках периферической крови, предполагая что MCP-1 играет роль в прогрессировании заболевания (Carla Iarlori, et al., J.Neuroimmunol, 2002, 123, 170-179). Другие исследования продемонстрировали потенциальную терапевтическую ценность антагонизма взаимодействия MCP-1/CCR-2 в лечении рассеянного склероза; все эти исследования были продемонстрированы на экспериментальном аутоиммунном энцефаломиелите (EAE),традиционной модели рассеянного склероза. Введение антител к MCP-1 животным с EAE значительно снижает частоту рецидива заболевания (K.J. Kennedy, et al., J. Neuroimmunol. 1998, 92, 98). Более того,два сообщения показали, что мыши CCR-2-/- устойчивы к EAE (В.Т. Fife, et al., J. Exp. Med. 2000, 192,899; L. Izikson, et al., J. Exp. Med. 2000, 192, 1075). Следующее сообщение расширяет эти начальные наблюдения путем проверки эффектов делеции CCR-2 у мышей из разных линий (S. Gaupp, et al. Am. J.Pathol. 2003, 162, 139). В частности, введение низкомолекулярного антагониста CCR-2 также ослабляет прогрессирование заболевания у мышей C57BL/6 (C.M. Brodmerkel, et al. J. Immunol. 2005, 175, 5370). Известно, что MCP-1 повышается у пациентов с развившимся после пересадки легкого синдромом облитерирующего бронхиолита (Martine Reynaud-Gaubert, et al., J. of Heart and Lung Transplant., 2002, 21,721-730; John Belperio, et al., J. Clin. Invest. 2001, 108, 547-556). В мышиной модели синдрома облитерирующего бронхиолита введение антитела к MCP-1 приводит к ослаблению облитерации дыхательных путей; аналогично, мыши CCR-2-/- были устойчивы к облитерации дыхательных путей в такой же моделиMCP-1/CCR-2 может быть полезным в лечении отторжения органов после пересадки. Кроме того, исследования показали, что нарушение оси MCP-1/CCR-2 было способно продлить жизнеспособность пересаженных островков поджелудочной железы (I. Lee et al. J. Immunol 2003, 171, 6929; R. Abdi et al., J.Immunol. 2004, 172, 767). В крысиных моделях с трансплантатами, как было показано, CCR-2 и MCP-1 повышаются в трансплантатах, в которых развилась васкулопатия трансплантата (K. Horiguchi et al., J.Heart Lung Transplant. 2002, 21, 1090). В другом исследовании анти-MCP-1 генная терапия ослабляла васкулопатию трансплантата (A. Saiura et al., Artherioscler Thromb. Vase. Biol. 2004, 24, 1886). Одно исследование описывает подавление образования неоинтимы в экспериментально пересаженных венах путем блокирования MCP-1 (Н. Tatewaki et al., J. Vase Surg. 2007, 45, 1236). Другие исследования демонстрируют потенциальную терапевтическую ценность антагонизма взаимодействия MCP-1/CCR-2 в лечении астмы. Разрушение MCP-1 нейтрализующим антителом у мышей, сенсибилизированных овальбумином, приводило к заметному уменьшению гиперчувствительности бронхов и воспаления (Jose-Angel Gonzalo, et al., J. Exp. Med. 1998, 188, 157). Это доказывает возможность снижения аллергического воспаления дыхательных путей у мышей, сенсибилизированных яйцамиSchistosoma mansoni, путем введения антител к MCP-1 (Nicholas W. Lukacs, et al., J. Immunol. 1997, 158,4398). Учитывая это, MCP-1-/- мыши показывают сниженный ответ на сенсибилизацию яйцамиSchistosoma mansoni (Bao Lu, et al., J. Exp. Med. 1998, 187, 601). Другие исследования демонстрируют потенциальную терапевтическую ценность антагонизма взаимодействия MCP-1/CCR-2 в лечении болезни почек. Введение антител к MCP-1 в мышиной модели гломерулонефрита приводит к заметному уменьшению образования гломерулярных полумесяцев и отложения коллагена I типа (Clare M. Lloyd, et al., J. Exp. Med. 1997, 185, 1371). Кроме того, мышиMCP-1-/- с вызванным нефротоксическим сывороточным нефритом демонстрируют существенно меньшее повреждение канальцев, чем аналогичные особи MCP-1+/+ (Gregory H. Tesch, et al., J. Clin. Invest. 1999, 103, 73). Некоторые исследования демонстрируют потенциальную терапевтическую ценность антагонизма взаимодействия MCP-1/CCR-2 в лечении системной красной волчанки. Мыши CCR-2-/- показывают увеличенную выживаемость и меньшую патологию почек относительно аналогичных особей "дикого" типа в мышиной модели системной красной волчанки (G. Perez de Lema, et al. J. Am. Soc. Neph. 2005, 16,3592). Эти данные согласуются с модифицирующей болезнь активностью, обнаруженной в последних исследованиях генетической делеции MCP-1 (S. Shimizu, et al. Rheumatology (Oxford), 2004, 43, 1121;Gregory H. Tesch, et al., J. Exp. Med. 1999, 190, 1813), или введения пептидного антагониста CCR-2 (Н.Hasegawa, et al. ArthritisRheumatism 2003, 48, 2555) в моделях волчанки на грызунах. Заметное 30-кратное увеличение CCR-2+ лимфоцитов собственной пластинки наблюдалось в тонкой кишке пациентов с болезнью Крона, по сравнению с непораженной подвздошной кишкой (S.J. Connor, et al. Gut. 2004, 55, 1287). Также следует отметить, что было расширение субпопуляции циркулирующих CCR-2+/CD14+/CD56+ моноцитов у пациентов с активной болезнью Крона по сравнению с контролем. Ряд исследований на грызунах продемонстрировал потенциальную терапевтическую ценность антагонизма взаимодействия MCP-1/CCR-2 в лечении болезни/колита Крона. Мыши CCR-2-/- были защищены от колита, вызванного декстраном натрия сульфата (Pietro G. Andres, et al., J. Immunol. 2000,164, 6303). Введение низкомолекулярного антагониста CCR-2, CCR5 и CXCR3 (сродство связывания = 24, 236 и 369 нМ соответственно) также защищает от колита, вызванного декстраном натрия сульфата(H. Tokuyama, et al. Int. Immunol. 2005, 17, 1023). В конечном счете, мыши MCP-1-/- показали существенное снижение повреждения толстой кишки (и макроскопически и гистологически) в моделях гаптенин-4 016563 дуцированного колита (W.I. Khan, et al. Am. J. Physiol. Gastrointest. Liver Physiol. 2006, 291, G803). Два сообщения описывают сверхэкспрессию MCP-1 в клетках эпителия кишечника и слизистой оболочки кишки пациентов с воспалительным заболеванием кишечника (H.С. Reinecker, et al.,Gastroenterology, 1995, 108, 40 and Michael C. Grimm, et al., J. Leukoc. Biol. 1996, 59, 804). Одно исследование описывает связь полиморфизма промоутера в гене MCP-1 и склеродермии (системного склероза) (S. Karrer et al., J. Invest. Dermatol. 2005, 124, 92). В сходных моделях фиброза тканей ингибирование оси CCR-2/MCP-1 уменьшает фиброз кожи (T. Yamamoto and K. Nishioka, J. InvestJ. Pathol. 2004, 165, 237; T. Wada et al., J. Am. Soc. Nephrol. 2004, 75, 940), сердца (S. Hayashidani et al.,Circulation. 2003, 108, 2134) и печени (S. Tsuruta et al., Int. J. Mol. Med. 2004, 14, 837). Одно исследование демонстрирует потенциальную терапевтическую ценность антагонизма взаимодействия MCP-1/CCR-2 в лечении альвеолита. Когда крысы с легкими, поврежденными IgA иммунными комплексами, были внутривенно пролечены антителами против крысиного MCP-1 (JE), симптомы альвеолита были частично ослаблены (Michael L. Jones, et al., J. Immunol. 1992, 149, 2147). Некоторые исследования демонстрируют потенциальную терапевтическую ценность антагонизма взаимодействия MCP-1/CCR-2 в лечении рака (см. обзор: M.J. Craig and R.D. Loberg, Cancer MetastasisR.D. Loberg, Curr. Cancer Drug Targets. 2006, 6, 659). Когда иммунодефицитных мышей, несущих клетки рака молочной железы человека, лечат анти-MCP-1 антителами, наблюдается ингибирование легочных микрометастазов и увеличение выживаемости (Rosalba Salcedo, et al., Blood. 2000, 96, 34-40). Используя препараты опухолей человека, была обнаружена связь экспрессии CCR-2 с прогрессированием рака предстательной железы (Y. Lu, et al. J. Cell. Biochem. 2007, 101, 676). In vitro, экспрессия MCP-1, как было показано, опосредует рост и инвазию клеток рака предстательной железы (Y. Lu, et al. Prostate 2006,66, 1311); более того, MCP-1, экспрессируемый клетками рака предстательной железы, вызывает резорбцию костей предшественниками костного мозга человека (Y. Lu, et al., Cancer Res. 2007, 67, 3646). Многие исследования описывают потенциальную терапевтическую ценность антагонизма взаимодействия MCP-1/CCR-2 в лечении рестеноза. У людей уровни MCP-1 прямо коррелируют с риском рестеноза (F. Cipollone, et al. Arterioscler. Thromb. Vasc. Biol. 2001, 21, 327). Мыши, дефицитные по CCR-2 или MCP-1, демонстрируют уменьшение площади интимы и соотношения интима/медиа (относительно животных того же помета с "диким" типом) после повреждения артерии (Merce Roque, et al. Arterioscler.Biophys Res Commun. 2003, 310, 936). У мышей трансфекция доминантного негативного ингибитораMCP-1 в скелетной мышце (K. Egashira, et al. Circ. Res. 2002, 90, 1167) также уменьшает гиперплазию интимы после повреждения артерии. Блокада CCR-2 с помощью нейтрализующих антител уменьшает гиперплазию неоинтимы после стентирования у приматов (C. Horvath, et al. Circ. Res. 2002, 90, 488). Два сообщения описывают сверхэкспрессию MCP-1 у крыс с вызванной черепно-мозговой травмой(J.S. King, et al., J. Neuroimmunol. 1994, 56, 127 и Joan W. Berman, et al., J. Immunol. 1996, 156, 3017). Кроме того, исследования показывают, что и мыши CCR-2-/- (О.В. Dimitrijevic, et al. Stroke 2007, 38, 1345), и мыши MCP-1-/- (P.M. Hughes, et al. J. Cereb. Blood Flow Metab. 2002, 22, 308) частично защищены от ишемического/реперфузионного повреждения. Известно, что моноциты/макрофаги играют важную роль в развитии нейропатической боли (Liu T.,van Rooijen N., Tracey D.J., Pain. 2000, 86, 25). Учитывая это, в последнее время была описана потенциальная роль CCR-2 в лечении воспалительной и нейропатической боли. Мыши CCR-2-/- показали измененные ответы на воспалительную боль относительно аналогичных особей "дикого" типа, включая уменьшение болевого поведения после инъекции формалина в подошву и несколько уменьшенную механическую аллодинию после инъекции CFA в подошву (C. Abbadie, et al. Proc. Natl. Acad. Sci, USA. 2003, 100, 7947). Кроме того, мыши CCR-2-/- не показывают значительную механическую аллодинию после повреждения седалищного нерва. Аналогичным образом, низкомолекулярный антагонист CCR-2 уменьшает механическую аллодинию до -80% от уровня до повреждения при введении внутрь(C. Abbadie, J.A. Lindia, and H. Wang, WO PCT 110376, 2004). Одно исследование описывает ключевую роль MCP-1 в ишемической кардиомиопатии(N.G. Frangogiannis, et al., Circulation 2007, 115, 584). Другое исследование описывает ослабление экспериментальной сердечной недостаточности вследствие ингибирования MCP-1 (S. Hayashidani et al.,Circulation. 2003, 108, 2134). Другие исследования предусматривают доказательство того, что MCP-1 сверхэкспрессирован при различных заболеваниях, не упомянутых выше. Эти сообщения предусматривают соответствующие доказательства того, что MCP-1 антагонисты могут быть полезными лекарственными средствами при таких болезнях. Другое исследование демонстрирует сверхэкспрессию MCP-1 в трансплантатах сердца грызунов, предполагая роль MCP-1 в патогенезе атеросклероза трансплантата (Mary E. Russell, et al. Proc. Natl.Acad. Sci. USA., 1993, 90, 6086). Сверхэкспрессия MCP-1 была отмечена в клетках эндотелия легких у пациентов с идиопатическим легочным фиброзом (Harry N. Antoniades, et al., Proc. Natl. Acad. Sci. USA.Garzino-Demo, WO 99/46991). Кроме того, полиморфизм CCR-2, как было показано, связан с саркоидозом по меньшей мере в одной из подгрупп пациентов (P. Spagnolo, et al. Am. J. Respir Crit Care Med. 2003, 168, 1162). Также необходимо отметить, что CCR-2 задействован в качестве корецептора для некоторых штаммов ВИЧ (В.J. Doranz, et al., Cell. 1996, 85, 1149). Также было установлено, что применение CCR-2 в качестве корецептора ВИЧ может коррелировать с прогрессированием заболевания (Ruth I. Connor, et al., J.Exp. Med. 1997, 185, 621). Эта находка согласуется с последним открытием того, что присутствие мутантного CCR-2, CCR-2-64I положительно коррелирует с замедленным началом ВИЧ-инфекции в человеческой популяции (Michael W. Smith, et al., Science 1997, 277, 959). Хотя MCP-1 не участвует в этих процессах, возможно антагонисты MCP-1, которые действуют через связывание с CCR-2, могут обладать благоприятными терапевтическими эффектами в замедлении прогрессирования заболевания в СПИД у ВИЧ-инфицированных пациентов. Необходимо отметить, что CCR-2 также является рецептором для хемокинов человека MCP-2,MCP-3 и MCP-4 (Luster, New Eng. J. Med. 1998, 338, 436-445). Поскольку новые соединения формулы (I),описанные в настоящем патенте, проявляют антагонизм в отношении MCP-1 путем связывания с CCR-2 рецептором, возможно, эти соединения формулы (I) также являются эффективными антагонистами эффектов MCP-2, MCP-3 и MCP-4, которые опосредуются через CCR-2. Соответственно, когда в данном описании приводится ссылка на "антагонизм MCP-1", надо понимать, что это эквивалентно "антагонизму хемокиновой стимуляции CCR-2". Соответственно, соединения, которые модулируют хемокиновую активность, могут демонстрировать широкий спектр применения в лечении воспалительных, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. Патентная публикация WO 2005021500 A1(включенная в данное описание посредством ссылки и принадлежащая настоящему заявителю) раскрывает соединения, которые модулируют активность MCP-1, MCP-2, MCP-3 и MCP-4 посредством CCR-2. Ссылка также раскрывает различные процессы приготовления этих соединений, включая многоэтапный синтез, который включает введение и последующее удаление защитных групп. Желательно обнаружить новые соединения с улучшенными фармакологическими характеристиками по сравнению с известными модуляторами хемокинов. Например, желательно найти новые соединения с улучшенной ингибирующей CCR-2 активностью и избирательностью к CCR-2 относительно других сопряженных с G-белком рецепторов (т.е. 5-HT2A рецепторов). Также необходимо найти соединения с предпочтительными и улучшенными характеристиками в одной или более из следующих категорий:(a) фармацевтические свойства (т.е. растворимость, проницаемость, возможность создания препаратов с замедленным высвобождением);(b) потребность в дозе (например, более низкие дозировки и/или однократное суточное дозирование);(c) факторы, которые снижают амплитудные характеристики концентрации в крови (т.е. клиренс и/или объем распределения);(d) факторы, которые повышают концентрацию активного препарата на рецепторе (т.е. связывание белками, объем распределения);(e) факторы, которые снижают предрасположенность к клиническим взаимодействиям между лекарствами (ингибирование или индукция фермента цитохром P450, такое как ингибирование CYP 2D6,см. G.K. Dresser, J.D. Spence, D.G. Bailey, Glin. Pharmacokinet. 2000,38, 41-57, который включен в данное описание посредством ссылки);(f) факторы, которые снижают возможность нежелательных побочных эффектов (например, фармакологическая избирательность, кроме сопряженных с G-белком рецепторов, потенциальная химическая или метаболическая реакционность, ограниченное проникновение в ЦНС и/или ионоканальная избирательность). В особенности желательно найти соединения, обладающие желаемой комбинацией вышеупомянутых фармакологических характеристик. Также желательно в технологии обеспечить новые и/или улучшенные способы получения таких соединений. Эти способы могут быть охарактеризованы, помимо прочего: а) гибкой адаптацией к крупномасштабному производству, такому как масштаб опытного производства или промышленный масштаб; б) этапами процесса и/или методиками, позволяющими улучшить чистоту (включая хиральную чистоту),стабильность и/или легкость обращения с промежуточными соединиями и/или конечными соединениями и/или в) меньшим числом стадий процесса.-6 016563 Сущность изобретения Настоящее изобретение обеспечивает новый MCP-1 антагонист или частичный агонист/антагонист активности рецептора: N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин 4-иламино)пирролидин-1-ил)циклогексил)ацетамид или его фармацевтически приемлемую соль или сольват, имеющие неожиданные комбинации желательных фармакологических характеристик. Также обеспечиваются кристалические формы по настоящему изобретению. Фармацевтические композиции,содержащие их, и способы их применения в виде агентов для лечения заболеваний, выбранных из диабетов, ожирения, метаболического синдрома, инсульта, нейропатической боли, ишемической кардиомиопатии, псориаза, гипертензии, склеродермии, остеоартрита, аневризмы, лихорадки, сердечно-сосудистого заболевания, болезни Крона, застойной сердечной недостаточности, аутоиммунных заболеваний, ВИЧинфекции, ВИЧ-ассоциированной деменции, псориаза, идиопатического фиброза легких, атеросклероза трансплантата, физически или химически вызванной травмы головного мозга, воспалительного заболевания кишечника, альвеолита, колита, системной красной волчанки, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, рассеянного склероза, атеросклероза, васкулита, нестабильных бляшек, ревматоидного артрита, рестеноза, венозной неоинтимальной гиперплазии, неоинтимальной гиперплазии диализ-трансплантата, неоинтимальной гиперплазии артериовенозного шунта, пересадки органа,хронической нефропатии аллотрансплантата и рак, являются также объектом настоящего изобретения. Настоящее изобретение также обеспечивает способ получения соединений формулы (X) включающий следующие стадии: гидролиз сложноэфирного остатка соединения формулы V гидролизующим агентом для образования кислоты соединения VI в интервале температур от приблизительно -5 до приблизительно 5C взаимодействие соединения формулы VIa, HO-Z-OH, с соединением формулы VI (необязательно insitu) в присутствии кислотного катализатора с получением соединения формулы VII, имеющего остаток карбоновой кислоты превращение остатка карбоновой кислоты кеталя формулы VII в соответствующий изоцианат формулы VIII-7 016563 взаимодействие изоцианата формулы VIII с соединением формулы R10COW в присутствии соответствующего ангидрида кислоты (R10CO)2O c образованием амида формулы IX, имеющего остаток кеталя: гидролиз кетального остатка амида формулы IX с образованием соединения формулы X,где R1 и R2 независимо представляют собой водород или защитную группу амина;R4 и R10 независимо представляют собой C1-6 алкил или бензил;Z представляет собой -C2H4-. Настоящее изобретение также обеспечивает способ получения соединения формулы (XI)a) добавление кислоты Льюиса в раствор соединения формулы X, полученного способом по п.12 и амина, имеющего формулу HNR8R9, причем R8 и R9 независимо представляют собой водород илиb) обработку имин-енамина восстанавливающим агентом, чтобы получить соединение формулы XI,имеющее аминопирролидонильный остаток. Также настоящее изобретение обеспечивает следующие соединения:(7R,8S)-8-3S)-3-бензилокси)карбонил)амино)-2-оксо-1-пирролидинил)-1,4-диоксаспиро[4.5]декан-7-карбоновую кислоту или ее соль; бензил 3S)-1-7R,8S)-7-(азидокарбонил)-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль; бензил 3S)-1-7R,8S)-7-изоцианато-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль; бензил 3S)-1-7R,8S)-7-ацетамидо-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль; бензил 3S)-1-1S,2R)-2-ацетамидо-4-оксоциклогексил)-2-оксо-3-пирролидинил)карбамат или его соль; бензил 3S)-1-1S,2R,4R)-2-ацетамидо-4-(трет-бутиламино)циклогексил)-2-оксо-3-пирролидинил)карбамат или его соль. Краткое описание чертежей Фиг. 1. Экспериментальные и модельные порошковые рентгенограммы N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, гемигидрат, форма H0.5-4. Фиг. 2. Экспериментальные и модельные порошковые рентгенограммы N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, свободное основание, форма N-2. Фиг. 3. Экспериментальные и модельные порошковые рентгенограммы N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, 1,75 моль H2O, форма H1.75-5. Фиг. 4. Экспериментальные и модельные порошковые рентгенограммы N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, сольват моноэтанола, форма E-1. Фиг. 5. Экспериментальные и модельные порошковые рентгенограммы N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)-8 016563 ацетамида, сольват моноуксусной кислоты, форма HAC-1. Фиг. 6. Экспериментальные и модельные порошковые рентгенограммы N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, сольваты моно-R-пропиленгликоля, форма RPG-3. Фиг. 7. Дифференциальная сканирующая калориметрия DSC N-1R,2S,5R)-5-(трет-бутиламино)-2S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида,гемигидрат, форма H0.5-4. Фиг. 8. Термогравиметрический анализ TGA N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, гемигидрат, формаH0.5-4. Фиг. 9. Дифференциальная сканирующая калориметрия DSC N-1R,2S,5R)-5-(трет-бутиламино)-2S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, свободное основание, форма N-2. Фиг. 10. Термогравиметрический анализ TGA N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, свободное основание,форма N-2. Фиг. 11. Изотерма сорбции пара N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, свободное основание,форма N-2 при температуре 25C. Фиг. 12. Дифференциальная сканирующая калориметрия DSC N-1R,2S,5R)-5-(трет-бутиламино)2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида,1,75 моль H2O, форма H 1.75-5. Фиг. 13. Термогравиметрический анализ TGA N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, 1,75 моль H2O, формаH 1.75-5. Фиг. 14. Дифференциальная сканирующая калориметрия DSC N-1R,2S,5R)-5-(трет-бутиламино)2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, сольват моноуксусной кислоты, форма HAC-1. Фиг. 15. Термогравиметрический анализ TGA N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, сольват моноуксусной кислоты, форма НАС-1. Фиг. 16. Дифференциальная сканирующая калориметрия DSC N-1R,2S,5R)-5-(трет-бутиламино)2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, сольват моноэтанола, форма E-1. Фиг. 17. Термогравиметрический анализ TGA N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, сольват моноэтанола,форма E-1. Фиг. 18. Дифференциальная сканирующая калориметрия DSC N-1R,2S,5R)-5-(трет-бутиламино)2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, сольват моно-R-пропиленгликоля, форма RPG-3. Фиг. 19. Термогравиметрический анализ TGA K-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, сольват моно-Rпропиленгликоля, форма RPG-3. Фиг. 20. Модель внутрикожной пробы у обезьян cynomolgus: соединение по примеру 1 ингибирует рекруитмент мононуклеарных клеток к коже. Фиг. 21. 48-часовой TG перитонит у мыши hCCR-2 KI: ингибирование соединением по примеру 1 инфильтрации моноцитов/макрофагов в брюшной полости. Фиг. 22. EAE (экспериментальный аутоиммунный энцефаломиелит) у мыши hCCR-2 KI: лечение соединением по примеру 1 снижает баллы клинической оценки. Фиг. 23. Протонный спектр ЯМР соединения по примеру 1, 2-е альтернативное получение,стадия 3 - соединение 7. Фиг. 24. Протонный спектр ЯМР соединения по примеру 1, 2-е альтернативное получение,стадия 4 - соединение 8. Фиг. 25. Протонный спектр ЯМР соединения по примеру 1, 2-е альтернативное получение,стадия 4 - соединение 9. Фиг. 26. Протонный спектр ЯМР соединения по примеру 1, 2-е альтернативное получение,стадия 4 - соединение 10. Фиг. 27. Протонный спектр ЯМР соединения по примеру 1, 2-е альтернативное получение,стадия 5 - соединение 11.-9 016563 Подробное описание Настоящее изобретение предусматривает новый антагонист или частичный агонист/антагонист активности рецептора MCP-1: N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамид или его фармацевтически приемлемую соль или сольват, обладающие непредвиденной комбинацией желательных фармакологических характеристик. Кристаллические формы настоящего изобретения также предусмотрены. Фармацевтические композиции, их содержащие, и способы их применения в качестве агентов для лечения воспалительных,аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний также являются целью данного изобретения.[N-1R,2S,5R)-5-(трет-Бутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил]ацетамид неожиданно демонстрирует желаемую комбинацию фармакологических характеристик, включая неожиданно высокую степень пероральной биодоступности в комбинации с указаниями на то, что оно высокоэффективно и имеет отличные критерии безопасности. Известные модуляторы рецепторов CCR-2, такие как раскрыты в патентной заявке WO 2005021500,опубликованной 10 марта 2005 г. (патент США 7163937, поданный 16 января 2007 г., принадлежащий настоящему заявителю), которые демонстрируют адекватную степень проницаемости мембран (ключевой фактор пероральной биодоступности), недостаточно эффективны, как было измерено по их сродству связывания CCR-2 (мера эффективности), и/или у них был недостаток соответствующих критериев безопасности, как показала селективность ионного канала, измеренная посредством hERG и исследований ионных каналов Na+. Напротив, как показывают данные, представленные в данном описании, в разделе, озаглавленном"Сравнительные фармакологические характеристики", относительно полярной молекулы N-1R,2S,5R)5-(трет-бутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамид демонстрирует неожиданно высокую степень мембранной проницаемости и поддерживает мощное сродство связывания CCR-2 наряду с отличной селективностью ионного канала. Соответственно, настоящее изобретение предусматривает новый модулятор хемокинов, обладающий улучшенными фармакологическими характеристиками, который будет полезен в лечении воспалительных, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. Настоящее изобретение также обеспечивает способ получения соединений формулы (X) где R1 и R2 независимо представляют собой водород или защитную группу амина;R4 и R10 независимо представляют собой C1-6 алкил или бензил;Z представляет собой -C2H4-. Настоящее изобретение также обеспечивает способ получения соединения формулы (XI) Также настоящее изобретение обеспечивает следующие соединения:(7R,8S)-8-3S)-3-бензилокси)карбонил)амино)-2-оксо-1-пирролидинил)-1,4-диоксаспиро[4.5]декан-7-карбоновую кислоту или ее соль,бензил 3S)-1-7R,8S)-7-(азидокарбонил)-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль,бензил 3S)-1-7R,8S)-7-изоцианато-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль,бензил 3S)-1-7R,8S)-7-ацетамидо-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль,- 10016563 бензил 3S)-1-1S,2R)-2-ацетамидо-4-оксоциклогексил)-2-оксо-3-пирролидинил)карбамат или его соль,бензил 3S)-1-1S,2R,4R)-2-ацетамидо-4-(трет-бутиламино)циклогексил)-2-оксо-3-пирролидинил)карбамат или его соль. Воплощения В первом воплощении изобретение относится к N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамиду и его фармацевтически приемлемой соли. Другое воплощение представляет собой кристаллическую форму N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, свободное основание. Другое воплощение представляет собой кристаллическую форму N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, свободное основание, где кристалическая форма содержит N-2 форму. Другое воплощение представляет собой N-2 форму, которая характеризуется с помощью (или имеющая) параметров элементарной ячейки, главным образом равных следующим значениям: размеры элементарной ячейки:V(3)=2675,7(1); пространственная группа P212121; молекулы/элементарная ячейка 2,где измерение указанной кристаллической формы осуществляют при комнатной температуре около 22C. Другое воплощение в N-2 форме, которая характеризуется с помощью (или имеющая) порошковой рентгенограммы, включающей три или большее количество 2 значений (CuK =1,5418 ), выбранных из 5,5, 9,1, 12,1, 14,0 и 19,2, при температуре около 22C. Другое воплощение представляет собой N-2 форму, которая характеризуется с помощью (или имеющая) порошковой рентгенограммы, дополнительно включающей четыре или большее количество 2 значений (CuK =1,5418 ), выбранных из 5,5, 9,1, 12,1, 14,0 и 19,2, при температуре около 22C. Другое воплощение представляет собой N-2 форму, которая характеризуется с помощью (или имеющая) фракционных атомных координат, по существу, являющихся такими, как приведено в табл. 3. Другое воплощение представляет собой N-2 форму, которая характеризуется с помощью (или имеющая) порошковой рентгенограммы, в основном в соответствии с фиг. 2. Другое воплощение представляет собой кристаллическую форму N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)ирролидин-1-ил)циклогексил)ацетамида, свободное основание, включая форму H1.75-5 (1,75 моль воды), которая характеризуется с помощью параметров элементарной ячейки, представленных в табл. 1; 3, или 4, или большим количеством 2 значений (CuK =1,5418 ), выбранных из табл. 9; фракционные атомные координаты, по существу, представлены в табл. 4 и/или порошковая рентгенограмма в основном соответствует фиг. 3. Другое воплощение представляет собой кристаллическую форму N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, свободное основание, включающая форму H0.5-4 (гемигидрат), которая характеризуется с помощью параметров элементарной ячейки, представленных в табл. 1; 3, или 4, или большего количества 2 значений (CuK =1,5418 ), выбранных из табл. 9; фракционные атомные координаты, по существу,представлены в табл. 2 и/или рентгенограмма на порошке, по существу, соответствует фиг. 1. Другое воплощение представляет собой кристаллическую форму N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)ирролидин-1-ил)циклогексил)ацетамида, свободное основание, включая форму E-1 (сольват моноэтанола), которая характеризуется с помощью параметров элементарной ячейки, представленных в табл. 1; 3, или 4, или большего количества 2 значений (CuK =1,5418 ), выбранных из табл. 9; фракционные атомные координаты, по существу,представлены в табл. 5 и/или рентгенограмма на порошке, по существу, соответствует фиг. 4. Другое воплощение представляет собой кристаллическую форму N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)ирролидин-1-ил)циклогексил)ацетамида, свободное основание, включая форму HAC-1 (сольват моноуксусной кислоты), которая характеризуется с помощью параметров элементарной ячейки, представленных в табл. 1; 3, или 4, или большего количества 2 значений (CuK =1,5418 ), выбранных из табл. 9; фракционные атомные ко- 11016563 ординаты, по существу, представлены в табл. 6 и/или рентгенограмма на порошке, по существу, соответствует фиг. 5. Другое воплощение представляет собой образцы кристаллической формы N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, свободное основание, включая форму IPA-1 (сольват моноизопропанола), которая характеризуется с помощью параметров элементарной ячейки, представленных в табл. 1; 3, или 4, или большего количества 2 значений (CuK =1,5418 ), выбранных из табл. 9; и/или фракционных атомных координат, по существу, являющихся такими, как приведено в табл. 7. Другое воплощение представляет собой кристаллическую форму N-1R,2S,5R)-5-(третбутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, свободное основание, включая форму RPG-3 (сольват моно-R-пропиленгликоля), которая характеризуется с помощью параметров элементарной ячейки, представленных в табл. 1; 3, или 4, или большего количества 2 значений (CuK =1,5418 ), выбранных из табл. 9; фракционные атомные координаты, по существу, представлены в табл. 8 и/или рентгенограмма на порошке, по существу, соответствует фиг. 6. Другое воплощение представляет собой фармацевтическую композицию, содержащую фармацевтически приемлемые носитель и соединение по примерам. Другое воплощение представляет собой способ модулирования хемокина или хемокиновой активности рецептора, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по примерам. Другое воплощение является способом лечения расстройств, включающим введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения примеров, указанные расстройства выбраны из следующих: диабеты, ожирение, метаболический синдром, инсульт, нейропатическая боль, ишемическая кардиомиопатия, псориаз, гипертензия, склеродермия, остеоартрит, аневризма,лихорадка, сердечно-сосудистое заболевание, болезнь Крона, застойная сердечная недостаточность, аутоиммунные заболевания, ВИЧ-инфекция, ВИЧ ассоциированная деменция, псориаз, идиопатический фиброз легких, атеросклероз трансплантата, физически- или химически вызванная травма головного мозга, воспалительное заболевание кишечника, альвеолит, колит, системная красная волчанка, нефротоксический сывороточный нефрит, гломерулонефрит, астма, рассеянный склероз, атеросклероз, васкулит,нестабильные бляшки, ревматоидный артрит, рестеноз, гиперплазия венозной неоинтимы, гиперплазия неоинтимы диализ трансплантата, гиперплазия интимы артериовенозного шунта, пересадка органа, хроническая нефропатия аллотрансплантата и рак. Другое воплощение является способом лечения расстройств, включающим введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения примеров, отличающимся тем, что указанные расстройства выбраны из следующих: диабеты, ожирение, болезнь Крона, псориаз,идиопатический фиброз легких, атеросклероз трансплантата, физически- или химически вызванная травма головного мозга, воспалительное заболевание кишечника, альвеолит, колит, системная красная волчанка, нефротоксический сывороточный нефрит, гломерулонефрит, астма, рассеянный склероз, атеросклероз, ревматоидный артрит, рестеноз, пересадка органа и рак. Другое воплощение является способом лечения расстройств, включающим введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения примеров, отличающимся тем, что указанные расстройства выбраны из следующих: диабеты, ожирение, болезнь Крона, системная красная волчанка, гломерулонефрит, рассеянный склероз, атеросклероз, рестеноз и пересадка органа. Другое воплощение является способом лечения расстройств, включающим введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения примеров, отличающимся тем, что указанные расстройства выбраны из следующих: рассеянный склероз, атеросклероз, болезнь Крона и диабеты. Другое воплощение представляет собой способ лечения расстройств, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по примерам, где указанные расстройства выбраны из рестеноза, пересадки органа и рака. Другое воплощение представляет собой способ лечения диабетов, включающий введение пациенту,нуждающемуся в этом, терапевтически эффективного количества соединения по примерам. Другое воплощение представляет собой способ лечения болезни Крона, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по примерам. Другое воплощение представляет собой способ лечения рассеянного склероза, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по примерам. Другое воплощение представляет собой способ лечения атеросклероза, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по примерам. Другое воплощение представляет собой способ лечения рестеноза, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по примерам.- 12016563 Другое воплощение представляет собой способ лечения пересадки органа, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по примерам. Другое воплощение представляет собой способ лечения рака, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по примерам. Другое воплощение представляет собой способ лечения рака, где рак выбран из рака молочной железы, рака печени, рака предстательной железы и меланомы. Другое воплощение представляет собой способ лечения воспалительных, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по примерам. Другое воплощение представляет собой способ лечения воспалительных, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний, которые, по крайней мере,частично опосредованы CCR-2, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по примерам. Другим воплощением является соединение по примерам для получения лекарственного средства для лечения диабетов, ожирения, метаболического синдрома, инсульта, нейропатической боли, ишемической кардиомиопатии, псориаза, гипертензии, склеродермии, остеоартрита, аневризмы, лихорадки,сердечно-сосудистого заболевания, болезни Крона, застойной сердечной недостаточности, аутоиммунных заболеваний, ВИЧ-инфекции, ВИЧ-ассоциированной деменции, псориаза, идиопатического фиброза легких, атеросклероза трансплантата, физически- или химически вызванной травмы головного мозга,воспалительного заболевания кишечника, альвеолита, колита, системной красной волчанки, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, рассеянного склероза, атеросклероза, васкулита, нестабильных бляшек, ревматоидного артрита, рестеноза, гиперплазии венозной неоинтимы, гиперплазии неоинтимы диализ-трансплантата, гиперплазии интимы артериовенозного шунта, пересадки органа, хронической нефропатии аллотрансплантата и рака. Другим воплощением является соединение по примерам для применения в терапии. Изобретение может быть воплощено в его конкретных формах, без отступления от сущности или его существенных признаков. Настоящее изобретение также охватывает все комбинации альтернативных аспектов и воплощений изобретения, отмеченных в настоящем изобретении. Следует понимать, что любое и все воплощения могут быть взяты вместе с любым другим воплощением для описания дополнительных воплощений по настоящему изобретению. Кроме того, любые элементы воплощений (включая предпочтительные аспекты) предназначены для объединения с любым и всеми другими элементами из любого воплощения, чтобы описать дополнительные воплощения. Воплощения способа. Настоящее изобретение также обеспечивает новый способ получения соединений формулы (X) включающий следующие стадии: гидролиз сложноэфирного остатка соединения формулы V гидролизующим агентом для образования кислоты соединения VI в интервале температур от приблизительно -5 до приблизительно 5C взаимодействие соединения формулы VIa, HO-Z-OH, с соединением формулы VI (необязательно insitu) в присутствии кислотного катализатора с получением соединения формулы VII, имеющего остаток карбоновой кислоты превращение остатка карбоновой кислоты кеталя формулы VII в соответствующий изоцианат формулы VIII взаимодействие изоцианата формулы VIII с соединением формулы R10COW в присутствии соответствующего ангидрида кислоты (R10CO)2O c образованием амида формулы IX, имеющего остаток кеталя гидролиз кетального остатка амида формулы IX с образованием соединения формулы X, гдеR1 и R2 независимо представляют собой водород или защитную группу амина;R4 и R10 независимо представляют собой C1-6 алкил или бензил;Z представляет собой -C2H4 В другом воплощении настоящее изобретение обеспечивает новый способ получения соединения формулы IV, включающий связывание производного аминокислоты структуры III или его соли с циклогексаноном формулы II или его солью (см. получение в WO 2005021500), чтобы получить соединение структуры IV или его соль,имеющую замещенную амидную боковую цепь где Ra и Rb независимо представляют собой C1-6 алкокси илиRa и Rb вместе с атомом, к которому они присоединены, объединены, чтобы образовать карбонил,тиокарбонил, циклический ацеталь или циклический тиоацеталь, где циклический ацеталь или циклический тиоацеталь выбраны из -O-Z-O- и -S-Z-S-, Z представляет собой -(CT1T2)2, -(CT1T2)3 илиT1, T2 и T3 в каждом случае независимо выбраны из водорода, C1-4 алкила, C2-4 алкенила, галогена,- 14016563 гидрокси, циано, нитро, CF3, O-C1-4 алкила, OCF3 и C(=O)-C1-4 алкила (предпочтительно T1, T2 и T3, каждый, представляют собой водород);R1, R2 и R3 независимо представляют собой водород или защитную группу амина;R4 представляет собой низший C1-6 алкил или необязательно замещенный бензил;R13 в каждом случае представляет собой C1-6 алкил. Предпочтительные защитные группы амина представляют собой группы, которые могут быть удалены путем гидролиза или гидрогенолиза в стандартных условиях. Такие группы включают без ограничения, карбобензилокси (Cbz) группу, трет-бутилоксикарбонил (Boc), флуоренилметилоксикарбонильную (Fmos) группу, бензильную (Bn) группу или п-метоксибензильную (РМВ) группу. Более предпочтительными являются Cbz, Boc или Bn группы (в особенности Cbz и Bn). В еще одном воплощении настоящее изобретение обеспечивает новый способ, гдеRa и Rb вместе с атомами углерода, к которому они присоединены, объединены, чтобы образовать карбонильную или 1,3-диоксолановую группу (в особенности 1,3-диоксолановую группу);V представляет собой OH. В следующем воплощении, где Y представляет собой -SMe, изобретение обеспечивает способ, дополнительно включающий алкилирование соединения формулы IV группой R12X, где X представляет собой галоген, чтобы образовать его соль сульфония. Агент алкилирования предпочтительно представляет собой метилйодид. В следующем воплощении изобретение обеспечивает способ, где циклогексанон формулы IV представляет собой толуолсульфонатую соль. В следующем воплощении изобретение обеспечивает способ, где соединение формулы IV представляет собой соль сульфония. В следующем воплощении изобретение обеспечивает способ, где связывание проводят в инертной атмосфере, такой как азот или аргон (предпочтительно азот) в апротонном растворителе, таком как пропионитрил, изопропилацетат, н-бутилацетат, трет-бутилацетат или ацетонитрил (в особенности ацетонитрил и/или этилацетат). В еще одном воплощении изобретение обеспечивает способ, где связывание может быть достигнуто путем взаимодействия соединения формулы II с диимидным связывающим реагентом в присутствии активатора и основания третичного амина. Диимидный связывающий реагент включает реагенты, например, такой как EDAC. Примеры активаторов включают HOBt (указанный термин включает его гидраты) и N',N'-4-диметиламинопиридин. Основание третичного амина, включает, например, триэтиламин,N-N-дизопропил-N-этиламин и три-н-пропиламин. В еще одном воплощении изобретение обеспечивает способ, где диимидный связывающий реагент представляет собой EDAC, активатор представляет собой HOBt (указанный термин включает его гидраты) и основание третичного амина представляет собой триэтиламин. В следующем воплощении изобретение обеспечивает способ, где мольные соотношения соединения формулы II к диимидному связывающему реагенту, к активатору, к третичному амину составляют приблизительно 1:0,090-1,50, 1:0,95-1,50, 1:2,00-3,00 соответственно. Указанные мольные соотношения предпочтительно составляют приблизительно 1:0,095-1,05,1:0,95-1,10 и 1:2,10-2,20 соответственно. В одном из воплощений изобретение обеспечивает новый способ получения соединения формулы включающий циклизацию боковой цепи производного аминокислоты соединения формулы IV или его соли, чтобы получить соединение формулы V, имеющее сложноэфирный остаток.- 15016563 В еще одном воплощении, где Ra и Rb независимо представляют собой C1-6 алкокси или Ra и Rb вместе с атомом углерода, к которому они оба присоединены, объединены, чтобы образовать тиокарбонил,циклический ацеталь или циклический тиоацеталь, изобретение обеспечивает способ, который необязательно дополнительно включает стадию гидролиза Ra и Rb групп для того, чтобы комбинация из Ra и Rb вместе с атомом углерода, к которому они присоединены, образовала карбонил. Гидролиз может быть проведен в растворителе, таком как ацетон, бутанон, ацетонитрил и изопропанол или их водные растворы и предпочтительно проводится в водном растворе ацетона. Предпочтительно стадия гидролиза следует за стадией циклизации. В еще одном воплощении изобретение обеспечивает способ, где циклизацию проводят путем объединения соединения формулы IV или его соли с основанием в присутствии растворителя. Такими основаниями могут быть, например, без ограничения, карбонат цезия, бикарбонат цезия, карбонат калия,трет-бутилат натрия, гексаметилдисилазид натрия и предпочтительно карбонат цезия. В следующем воплощении изобретение обеспечивает способ, где циклизацию проводят в инертной атмосфере, такой как азот или аргон (предпочтительно азот) в растворителе, включая, например, без ограничения, ДМСО, ДМФ, ДМА, N-метилпирролидон, сульфолан (в особенности, ДМСО и/или ДМФ). В следующем воплощении изобретение обеспечивает способ получения соединения формулы V включающий гидролиз сложноэфирного остатка соединения формулы V гидролизующим агентом с образованием кислоты соединения VI в интервале температур от приблизительно -5 до приблизительно 5C. Агенты гидролиза сложного эфира хорошо известны среднему специалисту в данной области и включают гидроксиды щелочных металлов, MOH, где M представляет собой Li, Na или K, предпочтительно гидролизующий агент представляет собой водный раствор NaOH. Предпочтительно стадию гидролиза проводят в двухфазных условиях с органическим растворителем, который частично смешивается с водой. Предпочтительные органические растворители представляют собой ациклические или циклические эфиры, включая ТГФ, 2-метилТТФ, 1,2-диметоксиэтан, 1,4-диоксан, в особенности ТГФ. Альтернативно, в еще одном воплощении, где Ra и Rb вместе с атомом, к которому они присоединены, объединены, чтобы образовать карбонил, изобретение обеспечивает способ получения соединения формулы VII включающий взаимодействие соединения формулы VIa, HO-Z-OH, с соединением формулы VI (необязательно in situ) в присутствии кислотного катализатора, что дает соединение формулы VII, где Z представляет собой -C2H4-. Предпочтительно соединение формулы VIa представляет собой этиленгликоль и кислотный катализатор представляет собой п-толуолсульфоновую кислоту или ее гидрат.- 16016563 В следующем воплощении изобретение обеспечивает способ получения соединения формулы VIII включающий преобразование кеталя формулы VII в промежуточный изоцианат формулы VIII. Преобразование предпочтительно проводят с помощью перегруппировки по Курциусу. В еще одном воплощении изобретение обеспечивает способ, где стадию преобразования проводят с помощью перегруппировки по Курциусу, включающую следующие стадии:a) смешивание, по существу, безводного раствора формулы VII с основанием (основание представляет собой, например, без ограничения, алкиламин, в особенности третичный амин, предпочтительно триэтиламин);b) добавление галогенформиата (например, хлорформиата, предпочтительно изо-BuO2CCl) в раствор при температуре в интервале от приблизительно -10 до приблизительно 0C, чтобы образовать смешанный ангидрид кислоты формулы VII;c) обработка смешанного ангидрида реагентом азида (предпочтительно NaN3) в присутствии катализатора фазового переноса (предпочтительно соль тетралкиламмония, такая как бромид тетрабутиламмония, приблизительно при 5 мол.%) при температуре в интервале от приблизительно -10 до приблизительно 0C, чтобы образовать азид кислоты формулы VIIad) нагревание, по существу, безводного раствора ацилазида формулы VIIa, чтобы образовать соответствующий изоцианат формулы VIII. Предпочтительно, по существу, безводный раствор ацилазида сушат над молекулярными ситами. В еще одном воплощении изобретение обеспечивает способ получения соединения формулы IX,имеющего кетальный остаток включающий взаимодействие изоцианата формулы VIII (необязательно in situ) с соединением формулыR10COW (например, уксусной кислотой) в присутствии соответствующего ангидрида кислоты (т.е.(R10CO)2O) с образованием амида формулы IX, где R10 представляет собой C1-6 алкил (R10 предпочтительно представляет собой метил) и W представляет собой OH или O-C1-6 алкил. В следующем воплощении изобретение обеспечивает способ получения соединения формулы X включающий гидролиз кетального остатка амида формулы IX с образованием соединения формулы X.- 17016563 Условия гидролиза кеталя и реагенты хорошо известны среднему специалисту в данной области. Предпочтительно гидролиз проводят путем нагревания раствора соединения IX, имеющего кетальный остаток, в органическом растворителе (например, ацетоне) и соляной кислоты (приблизительно, 1H) при температуре в интервале от приблизительно 45 до приблизительно 55C в течение приблизительно 2-4 ч. В еще одном воплощении изобретение обеспечивает способ получения соединения формулы XI включающий восстановительное аминирование соединения формулы X амином формулы HNR8R9 в присутствии кислоты Льюиса, далее агентом восстановления с образованием соединения формулы XI,имеющего аминопирролидонильный остаток. В следующем воплощении изобретение обеспечивает способ, где восстановительное аминирование включает следующие стадии:a) добавление кислоты Льюиса (предпочтительно реагент титана, включая, без ограничения,TiCl2(O-изопропил)2) в раствор соединения X и амина, имеющего формулу HNR8R9 в апротонном растворителе, чтобы образовать имин-енамин формулы Xab) обработка имин-енамина формулы Xa агентом восстановления (предпочтительно борандиметилсульфид), чтобы получить соединение формулы XI, имеющее аминопирролидонильный остаток. В вышеупомянутых стадиях апротонным растворителем может быть, например, без ограничения,дихлорметан, ацетонитрил, ДМСО, ДМФ и N-метилпирролидинон (предпочтительно дихлорметан). В следующем воплощении изобретение обеспечивает способ, где амин формулы HN(R8)(R9) предпочтительно представляет собой трет-бутиламин. В еще одном воплощении изобретение обеспечивает способ получения соединения формулы X включающий следующие стадии: гидролиз сложноэфирного остатка соединения формулы V агентом гидролиза, чтобы образовать кислоту соединения VI в интервале температур от приблизительно -5 до приблизительно 5C взаимодействие соединения формулы VIa, HO-Z-OH, с соединением формулы VI (необязательно insitu) в присутствии кислотного катализатора, что дает соединение формулы VII, имеющее остаток карбоновой кислоты взаимодействие соединения формулы VIa, HO-Z-OH (предпочтительно алкиленгликоль, в особенности этиленгликоль), с соединением формулы VI (необязательно in situ) в присутствии кислотного катализатора (предпочтительно п-толуолсульфоновой кислоты или ее гидрата), что дает соединение формулы VII, имеющее остаток карбоновой кислоты преобразование остатка карбоновой кислоты кеталя формулы VII в соответствующий промежуточный изоцианат формулы VIII взаимодействие изоцианата формулы VIII (необязательно in situ) с соединением формулы R10COW(например, уксусная кислота) в присутствии соответствующего ангидрида кислоты (т.е. (R10CO)2O) с образованием амида формулы IX, имеющего кетальный остаток гидролиз кетального остатка амида формулы IX с образованием соединения формулы X где R1 и R2 независимо представляют собой водород или защитную группу амина;R4 и R10 независимо представляют собой C1-6 алкил или бензил;Z представляет собой -C2H4-. В еще одном воплощении изобретение обеспечивает способ получения соединения формулы XI, где соединение формулы VII представляет собой(7R,8S)-8-3S)-3-бензилокси)карбонил)амино)-2-оксо-1-пирролидинил)-1,4 диоксаспиро[4.5]декан-7-карбоновую кислоту или ее соль;- 19016563 соединение формулы VIIa представляет собой бензил 3S)-1-7R,8S)-7-(азидокарбонил)-1,4 диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль; соединение формулы VIII представляет собой бензил 3S)-1-7R,8S)-7-изоцианато-1,4 диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль; соединение формулы IX представляет собой бензил 3S)-1-7R,8S)-7-ацетамидо-1,4 диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль; соединение формулы X представляет собой бензил 3S)-1-1S,2R)-2-ацетамидо-4 оксоциклогексил)-2-оксо-3-пирролидинил)карбамат или его соль; соединение формулы XI представляет собой бензил 3S)-1-1S,2R,4R)-2-ацетамидо-(третбутиламино)циклогексил)-2-оксо-3-пирролидинил)карбамат или его соль. В следующем воплощении изобретение обеспечивает соединение формулы VI или его соль где R1 и R2 независимо выбраны из водорода и защитной группы амина, выбранной из Boc, Cbz и бензила (предпочтительно R1 представляет собой водород и R2 представляет собой Cbz);Z представляет собой -C2H4-. Предпочтительным соединением формулы VI является (1R,2S)-2-S)-3-(бензилоксикарбониламино)-2-оксопирролидин-1-ил)-5-оксоциклогексанкарбоновая кислота или ее соль. В следующем воплощении изобретение обеспечивает соединение формулы VI, которое представляет собой (1R,2S)-2-S)-3-(бензилоксикарбониламино)-2-оксопирролидин-1-ил)-5-оксоциклогексанкарбоновую кислоту или ее соль. В следующем воплощении изобретение обеспечивает новое соединение формулы VII или его соль где R1 и R2 независимо выбраны из водорода и защитной группы амина, выбранной из Boc, Cbz и бензила (предпочтительно R1 представляет собой водород и R2 представляет собой Cbz);Z представляет собой -C2H4-. Предпочтительным соединением формулы VII является (7R,8S)-8-3S)-3-бензилокси)карбонил)амино)-2-оксо-1-пирролидинил)-1,4-диоксаспиро[4.5]декан-7-карбоновая кислота. В следующем воплощении изобретение обеспечивает соединение формулы VII, которое представляет собой (7R,8S)-8-3S)-3-бензилокси)карбонил)амино)-2-оксо-1-пирролидинил)-1,4-диоксаспиро[4.5]декан-7-карбоновую кислоту или его соль. В следующем воплощении изобретение обеспечивает новые соединения формулы VIIa или их соли где R1 и R2 независимо выбраны из водорода и защитной группы амина, выбранной из Boc, Cbz и бензила (предпочтительно R1 представляет собой водород и R2 представляет собой Cbz). Предпочтительным соединением формулы VIIa является бензил 3S)-1-7R,8S)-7-(азидокарбонил)1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат.- 20016563 В еще одном воплощении изобретение обеспечивает соединение формулы VIIa, которое представляет собой бензил 3S)-1-7R,8S)-7-(азидокарбонил)-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3 пирролидинил)карбамат или его соль. В 35-м воплощении изобретение обеспечивает соединение формулы VIII или его соль где R1 и R2 независимо выбраны из водорода и защитной группы амина, выбранной из Boc, Cbz или бензила (предпочтительно R1 представляет собой водород и R2 представляет собой Cbz);Z представляет собой -C2H4-. Предпочтительным соединением формулы VIII является бензил 3S)-1-7R,8S)-7-изоцианато-1,4 диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат. В еще одном воплощении изобретение обеспечивает соединение формулы VIII, которое представляет собой бензил 3S)-1-7R,8S)-7-изоцианато-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль. В следующем воплощении изобретение обеспечивает соединение формулы IX или его соль где R1 и R2 независимо выбраны из водорода и защитной группы амина, выбранной из Boc, Cbz или бензила (предпочтительно R1 представляет собой водород и R2 представляет собой Cbz);R10 представляет собой C1-6 алкил (предпочтительно метил). Предпочтительным соединением формулы IX является бензил 3S)-1-7R,8S)-7-ацетамидо-1,4 диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат. В еще одном воплощении изобретение обеспечивает соединение формулы IX, которое представляет собой бензил 3S)-1-7R,8S)-7-ацетамидо-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль. В следующем воплощении изобретение обеспечивает соединение формулы X или его соль где R1 и R2 независимо представляют собой водород или защитную группу амина, выбранную изR10 представляет собой C1-6 алкил. Предпочтительно R1 представляет собой водород, R2 представляет собой Cbz и R10 представляет собой метил. Предпочтительным соединением формулы X является бензил 3S)-1-1S,2R)-2-ацетамидо-4 оксоциклогексил)-2-оксо-3-пирролидинил)карбамат. В еще одном воплощении изобретение обеспечивает соединение формулы X, которое представляет собой бензил 3S)-1-1S,2R)-2-ацетамидо-4-оксоциклогексил)-2-оксо-3-пирролидинил)карбамат или его соль.- 21016563 В следующем воплощении изобретение обеспечивает соединение формулы XI или его соль где R1 и R2 независимо представляют собой водород или защитную группу амина, выбранную изR8 и R9 независимо представляют собой водород или C1-6 алкил иR10 представляет собой C1-6 алкил. Предпочтительно R1 представляет собой водород, R2 представляет собой Cbz, R8 представляет собой водород, R9 представляет собой трет-бутил и R10 представляет собой метил. Предпочтительным соединением формулы XI является бензил 3S)-1-1S,2R,4R)-2-ацетамидо-4(трет-бутиламино)циклогексил)-2-оксо-3-пирролидинил)карбамат. В следующем воплощении изобретение обеспечивает соединение формулы XI, которое представляет собой бензил 3S)-1-1S,2R,4R)-2-ацетамидо-4-(трет-бутиламино)циклогексил)-2-оксо-3 пирролидинил)карбамат или его соль. В следующем воплощении изобретение обеспечивает соединение, выбранное из(7R,8S)-8-3S)-3-бензилокси)карбонил)амино)-2-оксо-1-пирролидинил)-1,4 диоксаспиро[4.5]декан-7-карбоновой кислоты или ее соли; бензил 3S)-1-7R,8S)-7-(азидокарбонил)-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамата или его соли; бензил 3S)-1-7R,8S)-7-изоцианато-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамата или его соли; бензил 3S)-1-7R,8S)-7-ацетамидо-1,4-диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамата или его соли; бензил 3S)-1-1S,2R)-2-ацетамидо-4-оксоциклогексил)-2-оксо-3-пирролидинил)карбамата или его соли и бензил 3S)-1-1S,2R,4R)-2-ацетамидо-4-(трет-бутиламино)циклогексил)-2-оксо-3-пирролидинил)карбамата или его соли. В еще одном воплощении изобретение обеспечивает способ, где соединение формулы VII представляет собой (7R,8S)-8-3S)-3-бензилокси)карбонил)амино)-2 оксо-1-пирролидинил)-1,4-диоксаспиро[4.5]декан-7-карбоновую кислоту или ее соль; соединение формулы VIIa представляет собой бензил 3S)-1-7R,8S)-7-(азидокарбонил)-1,4 диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль; соединение формулы VIII представляет собой бензил 3S)-1-7R,8S)-7-изоцианато-1,4 диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль; соединение формулы IX представляет собой бензил 3S)-1-7R,8S)-7-ацетамидо-1,4 диоксаспиро[4.5]дец-8-ил)-2-оксо-3-пирролидинил)карбамат или его соль; соединение формулы X представляет собой бензил 3S)-1-1S,2R)-2-ацетамидо-4 оксоциклогексил)-2-оксо-3-пирролидинил)карбамат или его соль; и соединение формулы XI представляет собой бензил 3S)-1-1S,2R,4R)-2-ацетамидо-4-(третбутиламино)циклогексил)-2-оксо-3-пирролидинил)карбамат или его соль. В еще одном воплощении изобретение обеспечивает способ, где соединение представляет собойN-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин 1-ил)циклогексил)ацетамид или его соль. Настоящее изобретение может быть воплощено в других конкретных формах без отступления от сущности или его существенных признаков. Таким образом, упомянутые выше воплощения не должны быть рассмотрены как ограничивающие. Любое и все воплощения по настоящему изобретению могут быть взяты вместе с любым другим воплощением или воплощениями, для описания дополнительных воплощений. Каждый индивидуальный элемент (включая предпочтительные аспекты) воплощения является своим собственным независимым воплощением. Кроме того, элемент любого воплощения предназначен, чтобы быть объединенным с любым и всеми другими элементами из любого воплощения, чтобы описать дополнительные воплощения. Кроме того, настоящее изобретение охватывает комбинации различных воплощений, части воплощений, определений, описаний и примеры по изобретению, отмеченные в настоящем изобретении.- 22016563 Определения Далее представлены определения терминов, используемых в настоящем описании и прилагаемой формуле изобретения. Исходное определение, обеспеченное для группы или термина в настоящем изобретении, применяется к указанной группе или термину на протяжении всего описания и в формуле изобретения, индивидуально или как часть другой группы, если иное не указано. Термин "алкил" относится к прямой или разветвленной цепи углеводородной группы, имеющей от 1 до 12 атомов углерода, предпочтительно от 1 до 6 атомов углерода. Когда числа показаны в нижнем индексе после символа "C", нижний индекс определяет более конкретно число атомов углерода, которые может содержать отдельная группа. Например, "C1-6 алкил" относится к прямой или разветвленной цепи алкильных групп, содержащих от 1 до 6 атомов углерода, таких как метил, этил, н-пропил, изопропил,н-бутил, трет-бутил, н-пентил и т.д. Нижний индекс "O" относится к связи. Таким образом, термин гидрокси(C0-2)алкил или (C0-2)гидроксиалкил включает гидрокси, гидроксиметил и гидроксиэтил. Алкильные группы могут быть замещены от 1 до 2 групп, выбранных из (C1-6)алкила, (C2-6)алкенила,гидрокси, галогена, циано, нитро, CF3, O(C1-6 алкила), OCF3, C(=O)H, C(=O)(C1-6 алкила), CO2H,CO2(C1-6 алкила), NHCO2(C1-6 алкила), -S(C1-6 алкила), NH2, NH(C1-6 алкила), N(C1-6 алкила)2, N(CH3)3+,SO2(C1-6 алкила), C(=O)(C1-4 алкилена)NH2, C(=O)(C1-4 алкилен)NH(алкила), C(=O)(C1-4 алкилен)N(C14 алкила)2, C3-7 циклоалкила, фенила, бензила, фенилэтила, фенилокси, бензилокси, нафтила, от 4- до 7 членного гетероцикло и/или от 5- до 6-членного гетероарила. Когда замещенный алкил замещен арилом,гетероцикло, циклоалкилом или гетероарильной группой, то указанные кольцевые системы являются теми, как определено ниже, и, таким образом, могут иметь ноль, один, два или три заместителя, также как определено ниже. Рассматриваемые в настоящем изобретении соединения могут иметь асимметричные центры. Соединения по настоящему изобретению, содержащие асимметрично замещенный атом, могут быть выделены в оптически активной или рацемической форме. Среднему специалисту хорошо известны способы получения оптически активных форм, такие как путем разделения рацемических форм или с помощью синтеза из оптически активных исходных продуктов. Большинство геометрических изомеров олефинов,C=N двойных связей и им подобные могут также присутствовать в соединениях, описанных в настоящем изобретении, и все такие стабильные изомеры рассмотрены в настоящем изобретении. Описаны цис- и транс-геометрические изомеры соединений по настоящему изобретению и могут быть выделены в виде смеси изомеров или как отдельные изомерные формы. Имеются в виду все хиральные, диастереомерные,рацемические формы и все геометрические изомерные формы структур, за исключением конкретной стереохимии или если изомерная форма конкретно определена. Один из энантиомеров соединений, раскрытых в настоящем изобретении, может проявлять лучшую активность по сравнению с другим. Таким образом, все стереохимические формы рассмотрены как часть настоящего изобретения. Когда неоходимо, разделение рацемического продукта может быть достигнуто с помощью ВЭЖХ, с использованием хиральной колонки или путем разделения, используя агент разделения, такой как камфоновый хлорид, как в статье Steven D. Young, et al., Antimicrobial Agents andChemotherapy, 1995, 2602-2605. Выражение "фармацевтически приемлемый", используемое в настоящем изобретении, относится к тем соединениям, веществам, композициям и/или дозируемым формам, которые находятся в области официальной медицинской практики, пригодным для применения в контакте с тканями человека и животных без излишней токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, соразмерно приемлемому соотношению польза/риск. Как используют в настоящем изобретении, термин "фармацевтически приемлемые соли" относится к производным раскрытых соединений, где исходное соединение модифицируют путем применения его кислотной или основной соли. Примеры фармацевтически приемлемых солей включают, но без ограничения, неорганические или органические кислотные соли основных остатков, таких как амины; щелочные или органические соли кислотных остатков, такие как карбоновые кислоты; и им подобные. Фармацевтически приемлемые соли включают обычные нетоксичные соли или соли четвертичного аммония исходного соединения, образованного, например, из нетоксичных неорганических или органических кислот. Например, такие обычные нетоксичные соли включают те, которые произведены из неорганических кислот, таких как хлористо-водородная, бромисто-водородная, серная, сульфаминовая, фосфорная,азотная и им подобные; и соли, полученные из органических кислот, таких как уксусная, пропионовая,янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памоевая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая,2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изэтиновая и им подобные. Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из исходного соединения, которое содержит основной или кислотный остаток с помощью обычных химических способов. В целом такие соли могут быть получены путем взаимодействия форм свободной кислоты или основания таких соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе или в их смеси; в целом безводные среды, подоб- 23016563 ные простому эфиру, этилацетату, этанолу, изопропанолу или ацетонитрилу, являются предпочтительными. Перечни подходящих солей представлены в Remington's Pharmaceutical Sciences, 17th ed., MackPublishing Company, Easton, PA, 1985, p. 1418, раскрытие которой при этом включено как ссылка. Термины "стабильное соединение" и "стабильная структура" предназначены для обозначения соединения, которое является достаточно устойчивым, чтобы сохраниться при выделении до пригодной степени чистоты из реакционной смеси и при добавлении в эффективный терапевтический агент. Настоящее изобретение предназначено для воплощения стабильных соединений. Термин "терапевтически эффективное количество" предназначен для включения количества соединения по настоящему изобретению само по себе или количества комбинаций заявленных соединений или количества соединения по настоящему изобретению в комбинацию с другими активными ингредиентами, эффективными для ингибирования MCP-1 или эффективными для лечения или профилактики расстройств. Как используют в настоящем изобретении, "обработка" или "лечение" охватывают лечение болезненного состояния у млекопитающего, в особенности у человека, и включают:(a) профилактику болезненного состояния, имеющегося у млекопитающего, в частности, когда такое млекопитающее предрасположено к болезненному состоянию, но еще не было диагностировано на его наличие;(c) снятие болезненного состояния, т.е. вызывание регрессии болезненного состояния. Наименования, используемые в настоящем изобретении, характеризующие конкретную форму, например "N-2", не должны быть рассмотрены, как ограничение относительно любого другого вещества,обладающего подобными или идентичными физическими и химическими характеристиками, а скорее нужно подразумевать, что эти обозначения представляют собой простые идентификаторы, которые должны интерпретироваться в соответствии с характеристической информацией, также представленной в настоящем изобретении. Настоящее изобретение обеспечивает по крайней мере в части кристаллические формы свободного основания N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида как нового продукта, в частности в фармацевтически приемлемой форме. В определенных предпочтительных воплощениях кристаллические формы свободного основания являются, по существу, чистой формой. Предпочтительные воплощения кристалических форм свободного основания раскрыты в примере 2 как формы E-1, HAC-1, IPA-1, N-2, RPG-3, H0.5-4 иH1.75-5. Как используют в настоящем изобретении, термин "полиморф" относится к кристаллическим формам, имеющим одинаковую химическую структуру, но различные пространственные расположения молекул, атомов и/или ионов, формирующих кристалл. Как используют в настоящем изобретении, термин "сольват" относится к кристаллической форме молекулы, атома и/или ионов, которая дополнительно содержит молекулы растворителя, или растворители включены в кристалическую структуру. Молекулы растворителя в сольвате могут присутствовать в нормальном расположении и/или неупорядоченном расположении. Сольват может содержать или стехиометрическое, или нестехиометрическое количество молекул растворителя. Например, сольват с нестехиометрическим количеством молекул растворителя может возникнуть из частичной потери растворителя из сольвата. Как используется в настоящем изобретении, термин "аморфный" относится к твердой форме молекулы, атома и/или ионов, которая не является кристаллической. Аморфное твердое вещество не показывает характерную дифракционную рентгенограмму. Как используется в настоящем изобретении, "по существу, чистый", когда используется в отношении к кристаллической форме, означает соединение, имеющее чистоту более чем 90 вес.%, включая более чем 90, 91, 92, 93, 94, 95, 96, 97, 98 и 99 вес.%, а также включая чистоту, равную приблизительно 100 вес.%. соединения, в расчете на вес соединения. Остающийся материал включает другую форму(ы) соединения, и/или реакционные примеси, и/или примеси при обработке, являющиеся результатом ее получения. Например, кристаллическую форму N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида можно считать, по существу, чистой в том, что она имеет чистоту более чем 90 вес.%, как измерено методами, которые являются в настоящее время известными и общепринятыми в данной области, где отставшее менее чем 10 вес.% вещество включает другую форму(ы)N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида и/или реакционные примеси, и/или примеси при обработке. Образцам кристаллических структур по изобретению можно обеспечить, по существу, чистую фазовую однородность, идентифицируемую наличием доминирующего количества единственной кристаллической структуры и, необязательно, незначительных количеств одной или более других кристаллических форм. Присутствие более чем одной кристаллической формы в образце может быть определено методами, такими как порошковая дифракция рентгеновских лучей (PXRD) или твердофазная ядерная маг- 24016563 нитно-резонансная спектроскопия (SSNMR). Например, присутствие экстра-пиков при сравнении экспериментально измеренной рентгенограммы PXRD с модельной рентгенограммой PXRD может указывать на более чем одну кристаллическую форму в образце. Модельная рентгенограмма PXRD может быть вычислена на основе данных рентгеновского анализа монокристалла. См. статью Smith, D.K.,"A FORTRAN Program for Calculating X-Ray Powder Diffraction Patterns," Lawrence Radiation Laboratory,Livermore, California, UCRL-7196 (April 1963). Предпочтительно кристаллическая структура имеет, по существу, чистую фазовую однородность,как обозначено, посредством менее чем 10%, предпочтительно менее чем 5% и более предпочтительно менее чем 2% общей площади пика в экспериментально измеренной рентгенограмме PXRD, являющейся результатом экстра-пиков, которые отсутствуют на модельной рентгенограмме PXRD. Наиболее предпочтительна кристаллическая форма, имеющая, по существу, чистую фазовую однородность менее чем с 1% от общей площади пика в экспериментально измеренной рентгенограмме PXRD, являющейся результатом экстра-пиков, которые отсутствуют на модельной рентгенограмме PXRD. Процедуры для получения кристаллических форм известны в данной области техники. Кристаллические формы могут быть получены разнообразными методами, включая, например, кристаллизацию или перекристаллизацию из подходящего растворителя, сублимацию, рост из расплава, переход в твердую фазу из другой фазы, кристаллизацию из суперкритической жидкости и реактивное распыление. Способы кристаллизации или перекристаллизации кристаллических форм из растворяющей смеси включают, например, выпаривание растворителя, уменьшение температуры растворяющей смеси, использование кристаллической затравки в пересыщенной растворяющей смеси молекулы и/или соли, замораживание, высушивающее растворяющую смесь, и добавление антирастворителей (противорастворителей) к растворяющей смеси. Формы могут быть охарактеризованы и идентифицированы с использованием рентгеноструктурного анализа, который основан на измерениях элементарной ячейки и интенсивности монокристалла формы при фиксированной аналитической температуре. Детальное описание анализа элементарных ячеек и интенсивности раскрывается в StoutJensen, X-Ray Structure Determination: A Practical Guide, MacmillanCo., New York (1968), глава 3, которая включена в настоящее описание в качестве ссылки. Альтернативно, уникальное расположение атомов в кристаллической решетке может быть охарактеризовано согласно наблюдаемым фракционным атомным координатам; см. ссылку StoutJensen для экспериментального определения фракционных координат для структурного анализа. Другим средством характеристики кристаллической структуры является порошковый рентгеноструктурный анализ, в котором экспериментальный или наблюдаемый профиль дифракции сравнивают с модельным профилем, представляющим чистое вещество в виде порошка, оба измеряют при одной и той же аналитической температуре и измерения для тестируемой формы характеризуют в виде ряда значений 2 и интенсивностей. Термин "незначительная потеря массы", используемый в настоящем изобретении, как охарактеризовано TGA, указывает на присутствие беспримесной (несольватированной) кристаллической формы. Термин "незначительное поглощение влаги%", также используемый в настоящем изобретении, как охарактеризовано изотермой сорбции влажности, указывает на то, что тестируемая форма является негигроскопичной. В одном воплощении изобретения кристаллическая форма N-1R,2S,5R)-5-(трет-бутиламино)-2S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида обеспечивается, по существу, в чистой форме. Эта кристаллическая форма может использоваться в фармацевтических композициях, которые могут необязательно включать один или более других компонентов, например, выбранных из группы, состоящей из наполнителей, носителей и одного из других активных фармацевтических компонентов или активных химических объектов других молекулярных структур. Предпочтительно кристаллическая форма имеет, по существу, чистую фазовую однородность, как обозначено, менее чем 10%, предпочтительно менее чем 5% и более предпочтительно менее чем 2% общей площади пика в экспериментально измеренной рентгенограмме PXRD, являющейся результатом экстра-пиков, которые отсутствуют на модельной рентгенограмме PXRD. Наиболее предпочтительна кристаллическая форма, имеющая, по существу, чистую фазовую однородность с менее чем 1% общей площади пика в экспериментально измеренной рентгенограмме PXRD, являющейся результатом экстрапиков, которые отсутствуют на модельной рентгенограмме PXRD. В другом воплощении изобретения обеспечивается композиция, состоящая, по существу, из кристаллических форм N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 ламино)пирролидин-1-ил)циклогексил)ацетамида. Композиция этого воплощения может включать по крайней мере 90 вес.%. формы в расчете на ее вес в композиции. Присутствие реакционных примесей реакции и/или примесей при обработке может быть определено аналитическими методами, известными в данной области, такими как, например, хроматография,спектроскопия ядерного магнитного резонанса, масс-спектрометрия или инфракрасная спектроскопия.- 25016563 Кристаллические формы могут быть получены разнообразием методов, включая, например, кристаллизацию или перекристаллизацию из подходящего растворителя, сублимацию, рост из расплава, переход в твердую фазу из другой фазы, кристаллизацию из суперкритической жидкости и реактивное распыление. Способы кристаллизации или перекристаллизации кристаллических форм из растворяющей смеси включают, например, выпаривание растворителя, уменьшение температуры растворяющей смеси,использование кристаллической затравки в пересыщенной растворяющей смеси молекулы и/или соли,замораживание, высушивающее растворяющую смесь, и добавление антирастворителей (противорастворителей) к растворяющей смеси. Могут использоваться высокопроизводительные способы кристаллизации для получения кристаллических форм, включая полиморфы. Кристаллы лекарства, включая полиморфы, способы получения и характеристики кристаллов лекарства обсуждаются в Solid-State Chemistry of Drugs, S.R. Byrn, R.R. Pfeiffer и J.G. Stowell, 2nd Edition,SSCI, West Lafayette, Indiana (1999). Для методов кристаллизации, которые используют растворитель, выбор растворителя или растворителей обычно зависит от одного или более факторов, таких как растворимость соединения, методики кристаллизации и давления пара растворителя. Могут использоваться комбинации растворителей; например, соединение может быть солюбилизировано в первом растворителе для получения раствора с последующим добавлением антирастворителя, для уменьшения растворимости соединения в растворе и образования кристаллов. "Антирастворитель" представляет собой растворитель, в котором соединение имеет низкую растворимость. Подходящие растворители для получения кристаллов включают полярные и неполярные растворители. В одном методе получения кристаллов N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамид суспендируют и/или перемешивают в подходящем растворителе, чтобы получить суспензию, которая может быть нагрета, чтобы ускорить растворение. Термин "суспензия", как используется в настоящем изобретении, означает насыщенный раствор свободного основания, который может также содержать дополнительное количество соединения, чтобы получить гетерогенную смесь соединения и растворителя при данной температуре. Подходящие растворители в этом отношении включают, например, полярные апротонные растворители и полярные протонные растворители и смеси двух или большего количества растворителей, как раскрыто в настоящем изобретении. Кристаллические затравки могут быть добавлены к любой смеси для кристаллизации для ускорения кристаллизации. Как будет понятно квалифицированному специалисту, применение затравки используется для управления ростом конкретной кристаллической структуры или для управления распределением размера частиц кристаллического продукта. Соответственно, вычисление количества необходимых затравок зависит от размера доступной затравки и желательного размера средней частицы продукта, как описано, например, в "Programmed Cooling of Batch Crystallizers", J.W. Mullin и J. Nyvlt, ChemicalEngineering Science 1971, 26, 369-377. Вообще затравки небольшого размера необходимы для эффективного управления ростом кристаллов в партии. Затравка небольшого размера может быть получена просеиванием, помолом или тонким измельчением больших кристаллов или микрокристаллизацией растворов. Должна быть предпринята осторожность, чтобы размалывание или тонкое измельчение кристаллов не привели ни к какому изменению в кристалличности заданной кристаллической формы (т.е. изменения на аморфную форму или на другой полиморф). Охлажденная кристаллизационная смесь может быть офильтрована под вакуумом и выделенные твердые частицы могут быть промыты подходящим растворителем, таким как холодный перекристаллизационный растворитель, и высушены при продувке азотом для получения заданной кристаллической формы. Выделенные твердые частицы могут быть проанализированы подходящей спектроскопической или аналитической методикой, такой как SSNMR, DSC, PXRD, или подобной, чтобы удостовериться в образовании предпочтительной кристаллической формы продукта. Получающуюся кристаллическую форму обычно производят в количестве более чем приблизительно 70 вес.%. отдельного выхода, предпочтительно более чем 90 вес.%. отдельного выхода в расчете на вес N-1R,2S,5R)-5-(трет-бутиламино)2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, первоначально используемого в процедуре кристаллизации. Продукт может быть перемолот или пропущен через сито для измельчения продукта, в случае необходимости. Кристаллические формы могут быть получены непосредственно из реакционной среды конечного процесса для полученияN-1R,2S,5R)-5-(трет-бутиламино)-2-S)-2-оксо-3-(6(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида. Это может быть достигнуто, например, с использованием на заключительной стадии процесса растворителя или смеси растворителей, из которых может быть выкристаллизовано свободное основание. Альтернативно, кристаллические формы могут быть получены дистилляцией или методами добавления растворителя. Подходящие растворители с этой целью включают любой из тех растворителей, которые описаны в настоящем изобретении, включая протонные полярные растворители, такие как спирты, и апротонные полярные растворители, такие как кетоны.- 26016563 Посредством общей методики реакционная смесь может быть отфильтрована, чтобы удалить любые нежелательные примеси, неорганические соли и т.п., с последующей промывкой реакционным или кристаллизационным растворителем. Получающийся раствор может быть сконцентрирован, чтобы удалить избыток растворителя или газообразные включения. Если используется дистилляция, то окончательное количество собранного продукта перегонки может измениться, в зависимости от факторов процесса, включая, например, размер сосуда, мощность перемешивания и т.п. Посредством общей методики реакционный раствор может быть дистиллирован приблизительно до 1/10 от первоначального объема прежде, чем осуществится замена растворителя. Может быть отобрана и протестирована проба, чтобы определить содержание реакционной смеси и вес.% продукта в соответствии со стандартными методами процесса. Если желательно, то дополнительный реакционный растворитель может быть добавлен или удален, чтобы оптимизировать концентрацию реакционной смеси. Предпочтительно заключительную концентрацию регулируют приблизительно до 50 вес.%, при которой обычно получается суспензия. Предпочтительно могут быть добавлены растворители непосредственно в реакционный сосуд, не дистиллируя реакционную смесь. Предпочтительные растворители с этой целью представляют собой те растворители, которые могут в конечном счете встраиваться в кристаллическую решетку, как обсуждается выше в связи со сменой растворителя. Хотя заключительная концентрация может изменяться в зависимости от желаемой чистоты, отделения и т.п., заключительная концентрация свободного основания в растворе составляет предпочтительно от приблизительно 4 до приблизительно 7%. Реакционная смесь может быть перемешана после добавления растворителя и одновременно нагрета. Для иллюстрации, реакционную смесь можно перемешивать в течение приблизительно 1 ч, нагревая приблизительно до 70C. Реакционную смесь предпочтительно отфильтровывают горячей и промывают или реакционным растворителем, или добавленным растворителем, или их комбинацией. Кристаллы затравки могут быть добавлены к любому раствору для инициирования кристаллизации. Различные формы, описанные в настоящем изобретении, могут быть различимы друг от друга с помощью разных аналитических методов, известных квалифицированным в данной области специалистам. Такие способы включают, но не ограничиваясь, рентгеновскую дифракцию на порошке (PXRD) и/или термогравиметрический анализ (TGA). Конкретно, формы могут быть охарактеризованы и идентифицированы с использованием рентгеноструктурного анализа, который основан на измерениях элементарной ячейки монокристалла конкретной формы при фиксированной аналитической температуре. Детальное описание элементарных ячеек раскрывается в StoutJensen, X-Ray Structure Determination: A PracticalGuide, Macmillan Co., New York (1968), глава 3, которая включена в настоящее описание в качестве ссылки. Альтернативно, уникальное расположение атомов в кристаллической решетке может быть охарактеризовано согласно наблюдаемым фракционным атомным координатам. Другим средством характеристики кристаллической структуры является порошковый рентгеноструктурный анализ, в котором профиль дифракции сравнивают с модельным профилем, представляющим чистое вещество в виде порошка,оба измеряют при одной и той же аналитической температуре и измерения для тестируемой формы характеризуют в виде ряда значений 2 (обычно четыре или более). Могут использоваться другие способы характеристики формы, такие как твердофазная ядерная магнитно-резонансная спектроскопия (SSNMR), дифференциальная сканирующая калориметрия (DSC),теплография и макроскопическое исследование кристаллической или аморфной морфологии. Эти параметры могут также использоваться в комбинации, чтобы охарактеризовать изучаемую форму. Специалист в данной области оценит, что рентгенограммы могут быть получены с ошибкой измерения, которая зависит от используемых условий измерения. В частности, общеизвестно, что интенсивности на рентгенограмме могут колебаться в зависимости от используемых условий измерения и формы или морфологии кристалла. Должно быть понятно, что относительные интенсивности могут также изменяться в зависимости от экспериментальных условий и, соответственно, точный порядок интенсивностей не должен приниматься во внимание. Дополнительно, ошибка измерения угла дифракции для типичной рентгенограммы составляет обычно приблизительно 0,2 или менее, предпочтительно приблизительно 0,1 (как обсуждается в дальнейшем), и такая степень ошибки измерения должна быть принята во внимание, как имеющая отношение к вышеупомянутым углам дифракции. Следовательно, должно быть понятно, что кристаллические формы настоящего изобретения не ограничиваются кристаллическими формами, которые обеспечиваются рентгенограммами, по существу, идентичными рентгенограммам, изображенным на приложенных фигурах, раскрытых в настоящем изобретении. Любые кристаллические формы, которые обеспечиваются рентгенограммами, по существу, идентичными рентгенограммам, раскрытым на приложенных фигурах, находятся в пределах области охраны настоящего изобретения. Способность устанавливать существенные идентичности рентгенограмм находится в пределах области знаний среднего специалиста. Кетоэфир V гидролизуют в его соответствующую кетокислоту VI путем суспендирования соединения V в органическом растворителе, частично смешанном с водой, таком как ациклические или циклические эфиры, включая ТГФ, 2-метил ТГФ, 1,2-диметоксиэтан, 1,4-диоксан, ТГФ является предпочтительным, и добавления водного основания, такого как водные растворы гидроксидов щелочных металловMOH, где M представляет собой Li, Na или K, 1 н. NaOH, являющегося предпочтительным основанием,при температуре в интервале от -5 до 5C. Двухфазную смесь затем взбалтывают при температуре 5C в течение по крайней мере 1 ч. Низкая температура для добавления основания и реакции является существенной, чтобы минимизировать эпимеризацию у атома углерода, смежного с эфирной группой. Затем добавляют несмешиваемый с водой растворитель, предпочтительно метил-трет-бутиловый эфир и слои разделяют. Продукт затем переносят из водного раствора обратно в органический растворитель, предпочтительно дихлорметан, устанавления значения pH с помощью кислоты, предпочтительно 3 н. раствораHCl и соединение VI используют в растворе на следующей стадии. Схема 2 Кетализация кетокислоты VI в кеталь кислоты VII Раствор соединения VI, предпочтительно в дихлорметане, заменяют путем растворения в негигроскопическом, с более высокой температурой кипения растворителе, таком как толуол, трифтортолуол,ксилолы, с более высокой температурой кипения эфирах, таких как н-бутил- или изобутилацетат, предпочтительно толуол. Затем добавляют гликоль формулы HO-Z-OH (где Z является тем, как определеноsupra), предпочтительно этиленгликоль (1,2 экв.), а затем каталитическое количество (0,5-2 мол.%) кислоты, предпочтительно п-толуолсульфоновую кислоту, и смесь отгоняют при атмосферном давлении,пока не завершится образование соединения VII. Продукт VII кристаллизуют путем добавления этилацетата после охлаждения до температуры приблизительно 70C. После дальнейшего охлаждения до комнатной температуры соединение VII выделяют путем фильтрации и последующего высушивания приблизительно с 70% выходом (для HO(CH2)2OH, R1=H, R2=CBz). Схема 3 Преобразование кеталя кислоты VII в невыделенный кеталь изоцианат VIII и затем в кеталь амидIX с помощью кислотной активации/азидирования, перегруппировки по Курциусу и ацилирования Кетокислоту VII вначале активируют путем преобразования в ее смешанный ангидрид, используя третичные амины, предпочтительно триэтиламин и галогенформиаты, предпочтительно изобутилхлорформиат, в сухих растворителях, таких как толуол, трифтортолуол, 1,2-дихлорэтан, 1-хлорбутан, ксилолы, предпочтительно сухой толуол, путем добавления галогенформиата, чтобы предварительно охладить- 28016563 раствор соединения VII и триалкиламина. Предпочтительные интервалы температур для образования смешанного ангидрида равны от -10 до 0C. Приблизительно через 30 мин добавляют водный раствор азида щелочных металлов, предпочтительно 30 вес.% азида натрия и катализатор фазового переноса,такого как соли тетралкиламмония, предпочтительно бромид тетрабутиламмония (5 мол.%) и двухфазную смесь энергично взбалтывают в течение приблизительно 1 ч в интервале температур от -10 до 0C. Органическую фазу затем отделяют и полученный раствор ацилазида сушат, 4 молекулярные сита являются предпочтительным агентом высушивания. Перегруппировку по Курциусу и сопутствующее улавливание изоцианата VIII in situ с карбоновой кислотой с образованием амида кеталя IX осуществляют путем первоначального добавления карбоновой кислоты, предпочтительно уксусной кислоты и ее соответствующего ангидрида, предпочтительно уксусного ангидрида, в сухой раствор ацилазида и последующего нагревания смеси до температуры 80-90C в течение 1-4 ч. Применение ангидрида в объединении с карбоновой кислотой является важным, чтобы минимизировать образование примеси. После парциального удаления растворителя и карбоновой кислоты путем дистилляции продукт кристаллизуют при охлаждении до комнатной температуры. Соединение IX выделяют путем фильтрации и высушивания с 65-78% выходом (для Z=-(CH2)2-, R1=H, R2=CBz, R10=Me). Схема 4 Гидролиз кеталя амида IX до кетоамида X Кетальный гидролиз соединения IX в кетоамид X осуществляют путем нагревания раствора соединения IX в органическом, смешанном с водой растворителем, предпочтительно ацетоне и водном растворе сильной кислоты, предпочтительно 1 н. растворе HCl, в течение 2-4 ч. Предпочтительная температура для гидролиза имеет значение 45-55C. После удаления ацетона продукт экстрагируют дихлорметаном,который заменяют на этилацетат путем дистилляции. Продукт X кристаллизуют из этилацетата при охлаждении до комнатной температуры и выделяют путем фильтрации и высушивания с 85-90% выходом(для НО(CH2)2OH, R1=H, R2=CBz, R10=Me). Схема 5 Восстановительное аминирование кетоамида X в аминоамид XI К сухому раствору соединения X, предпочтительно в дихлорметане, добавляют первичный или вторичный амин, предпочтительно трет-бутиламин (5 экв.), а затем кислоту Льюиса, предпочтительноTiCl2(OPr-изо)2 (1,2 экв.), при температуре в интервале от -20 до 0C. Полученную иминную смесь нагревают до температуры 10-20C и добавляют боран (1,1-1,2 экв.) в виде комплекса с диметилсульфидом или ТГФ, предпочтительно диметилсульфидом. Реакционную смесь взбалтывают в течение 4-6 ч и затем добавляют насыщенный водный раствор этилацетата. Соли титана удаляют путем фильтрации и продуктXI экстрагируют из органического фильтрата с водой в виде его соли водным раствором кислоты, предпочтительно 1 н. раствором HCl. Затем добавляют дихлорметан и водный раствор основания, предпочтительно концентрированный гидроксид аммония, добавляют к взбалтываемой двухфазной смеси, пока значение pH не доведут до 8,0-8,5. Обогащенную продуктом фазу дихлорметана затем отделяют и промывают дважды водным раствором хлорида аммония, чтобы удалить нежелательный трансизомер соединения XI и, наконец, водой. Дихлорметан заменяют на этилацетат путем дистилляции и соединениеXI кристаллизуют из этилацетата при охлаждении и добавлении гептана. Соединение XI выделяют путем фильтрации и высушивания с 65-70% выходом (для R1=H, R2=CBz, R8=H, R9=трет-Bu, R10=Me).
МПК / Метки
МПК: C07D 317/72, A61K 31/4025, C07D 403/12, C07D 207/273
Метки: рецептора, получения, кристаллические, хемокина, активности, модуляторы, формы, способ
Код ссылки
<a href="https://eas.patents.su/30-16563-modulyatory-aktivnosti-receptora-hemokina-kristallicheskie-formy-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы активности рецептора хемокина, кристаллические формы и способ их получения</a>
Предыдущий патент: Скважинный раствор, способ проведения скважинной операции с применением этого раствора, применение полимера
Следующий патент: Бензил- и пиридинилпроизводные в качестве модуляторов пути передачи сигнала hedgehog
Случайный патент: Илоскреб к радиальному отстойнику












