Пиразолиновые соединения в качестве антагонистов минералокортикоидных рецепторов
Номер патента: 16370
Опубликовано: 30.04.2012
Авторы: Чэнь Сянян, Лонг Скотт Аллен, Арансет Грасиела Барбиери, Хокерман Сьюзн Ландис, Рейтц Дэвид Брюс, Мейерз Марвин Джей, Махони Мэтью Уильям, Рико Джозеф Джерис
Формула / Реферат
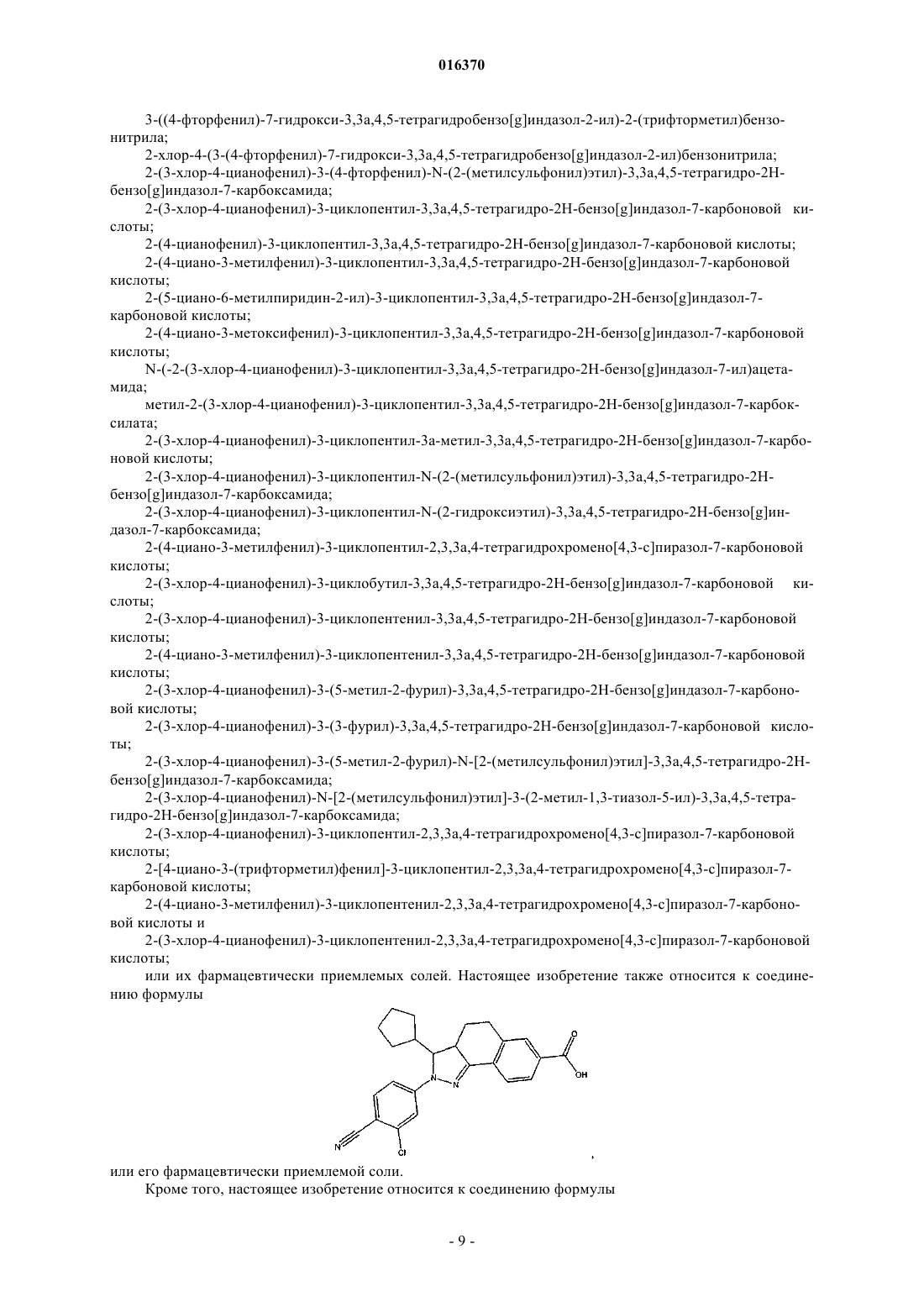
1. Соединение или фармацевтически приемлемая соль соединения, где соединение имеет структуру формулы (I)
где X выбирают из группы, состоящей из -CH2- и -O-;
R1 выбирают из группы, состоящей из циклопентила, циклобутила и фенила, где циклопентильный, циклобутильный и фенильный заместители R1 могут быть необязательно замещены одним или несколькими заместителями, независимо выбранными из группы, состоящей из хлора, фтора, метила, этила, пропила, хлорметила, дихлорметила, трихлорметила, фторметила, дифторметила и трифторметила;
R2 выбирают из группы, состоящей из водорода и (C1-C8)алкила;
R3A и R3B независимо выбирают из группы, состоящей из водорода и (C1-C8)алкила;
R4, R6 и R7 независимо выбирают из группы, состоящей из водорода, галогена, гидрокси, (C1-C8)алкила, галоген(C1-C8)алкила, гидрокси(C1-C8)алкила и (C1-C8)алкокси;
R5 выбирают из группы, состоящей из водорода, -(CH2)mOR50, -(CH2)mC(O)R50, -(CH2)mC(O)OR50,
-(CH2)mC(O)NR51R52, -(CH2)mNR51R52, -(CH2)mN(R51)C(O)R52 и -(CH2)mS(O)nR50;
m равно 0, 1, 2, 3, 4, 5 или 6;
n равно 0, 1 или 2;
R50 выбирают из группы, состоящей из водорода и (C1-C8)алкила;
R51 и R52 независимо выбирают из группы, состоящей из водорода и (C1-C8)алкила; или R51 и R52 образуют вместе с атомом азота, к которому они присоединены, 5- или 6-членный кольцевой гетероциклил; где алкильные заместители R50, R51 и R52 и гетероциклильный заместитель R51/R52 могут быть независимо и необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогена, пирролидинила, -OR53, -C(O)R53, -C(O)OR53, -C(O)NR54R55, -NR54R55, -N(R56)C(O)R53, -S(O)pR53 и
-S(O)pNR54R55;
p равно 0, 1 или 2;
R53 выбирают из группы, состоящей из водорода, (C1-C8)алкила, галоген(C1-C8)алкила, гидрокси(C1-C8)алкила и карбокси(C1-C8)алкила;
R54 и R55 независимо выбирают из группы, состоящей из водорода, (C1-C8)алкила, галоген(C1-C8)алкила, гидрокси(C1-C8)алкила и карбокси(C1-C8)алкила; или R54 и R55 образуют вместе с атомом азота, к которому они присоединены, 5- или 6-членный кольцевой гетероциклил;
R56 выбирают из группы, состоящей из водорода и (C1-C8)алкила; и
R8 выбирают из группы, состоящей из фенила, пиридинила и пиримидинила; где фенильный, пиридинильный и пиримидинильный заместители могут быть необязательно замещены одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена, циано, гидрокси, карбокси, (C1-C8)алкила, галоген(C1-C8)алкила, циано(C1-C8)алкила, гидрокси(C1-C8)алкила, карбокси(C1-C8)алкила, (C1-C8)алкокси, галоген(C1-C8)алкокси, циано(C1-C8)алкокси, амино, (C1-C8)алкиламино, ди(C1-C8)алкиламино и (C1-C8)алкоксикарбонила.
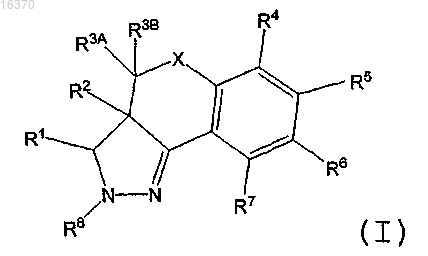
2. Соединение или фармацевтически приемлемая соль соединения, где соединение имеет структуру формулы (II)
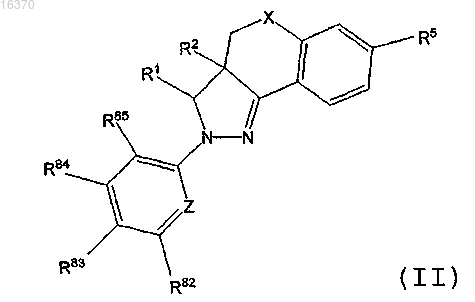
где X выбирают из группы, состоящей из -CH2- и -O-;
Z выбирают из группы, состоящей из -C(R81)- и -N-;
R1 выбирают из группы, состоящей из циклопентила, циклобутила и фенила; где циклопентильный, циклобутильный и фенильный заместители R1 могут быть необязательно замещены одним или несколькими заместителями, независимо выбранными из группы, состоящей из хлора, фтора, метила, этила, пропила, хлорметила, дихлорметила, трихлорметила, фторметила, дифторметила и трифторметила;
R2 выбирают из группы, состоящей из водорода или (C1-C4)алкила;
R5 выбирают из группы, состоящей из -(CH2)mOR50, -(CH2)mC(O)OR50 и -(CH2)mC(O)NR51R52; где
m равно 0, 1, 2 или 3;
R50 выбирают из группы, состоящей из водорода и (C1-C6)алкила;
R51 и R52 независимо выбирают из группы, состоящей из водорода и (C1-C6)алкила; где (C1-C6)алкильные заместители R50, R51 и R52 могут быть независимо и необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -OR53, -C(O)R53, -C(O)OR53, -C(O)NR54R55,
-NR54R55, -N(R56)C(O)R53, -S(O)pR53 и -S(O)pNR54R55;
p равно 0, 1 или 2;
R53 выбирают из группы, состоящей из водорода, (C1-C6)алкила, галоген(C1-C6)алкила, гидрокси(C1-C6)алкила и карбокси(C1-C6)алкила;
R54 и R55 независимо выбирают из группы, состоящей из водорода, (C1-C6)алкила, галоген(C1-C6)алкила, гидрокси(C1-C6)алкила и карбокси(C1-C6)алкила; и
R81, R82, R83, R84 и R85 независимо выбирают из группы, состоящей из водорода, хлора, фтора, циано, гидрокси, карбокси, метила, этила, трихлорметила, трифторметила, цианометила, гидроксиметила, карбоксиметила, метокси, амино, метиламино и диметиламино.
3. Соединение по п.2, где R2 представляет собой водород.
4. Соединение по п.3, где
R5 представляет собой -(CH2)mC(O)OR50; где
m равно 0, 1, 2 или 3;
R50 выбирают из группы, состоящей из водорода и (C1-C6)алкила; где (C1-C6)алкильный заместитель R50 может быть независимо и необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -OR53, -C(O)R53, -C(O)OR53, -C(O)NR54R55, -NR54R55, -N(R56)C(O)R53,
-S(O)pR53 и -S(O)pNR54R55;
p равно 0, 1 или 2;
R53 выбирают из группы, состоящей из водорода, (C1-C6)алкила, галоген(C1-C6)алкила, гидрокси(C1-C6)алкила и карбокси(C1-C6)алкила; и
R54 и R55 независимо выбирают из группы, состоящей из водорода, (C1-C6)алкила, галоген(C1-C6)алкила, гидрокси(C1-C6)алкила и карбокси(C1-C6)алкила.
5. Соединение по п.3, где
X представляет собой -CH2-;
Z представляет собой -C(R81)-;
R1 выбирают из группы, состоящей из циклопентила, циклобутила и фенила; где фенильный заместитель R1 может быть необязательно замещен фтором;
R5 представляет собой -(CH2)mC(O)OR50; где
m равно 0;
R50 представляет собой водород;
каждый R81, R84 и R85 представляет собой водород и
R82 и R83 независимо выбирают из группы, состоящей из хлора, циано и метила.
6. Соединение по п.5, где R82 представляет собой хлор и R83 представляет собой циано.
7. Соединение по п.5, где R1 представляет собой циклопентил.
8. Соединение по п.5, где R1 представляет собой фенил; где фенильный заместитель R1 может быть необязательно замещен фтором.
9. Соединение по п.3, где
X представляет собой -O-;
Z представляет собой -C(R81)-;
R1 выбирают из группы, состоящей из циклопентила, циклобутила и фенила; где фенильный заместитель R1 может быть необязательно замещен фтором;
R5 представляет собой -(CH2)mC(O)OR50; где
m равно 0;
R50 представляет собой водород;
каждый R81, R84 и R85 представляет собой водород и
R82 и R83 независимо выбирают из группы, состоящей из хлора, циано и метила.
10. Соединение по п.3, где
X представляет собой -CH2-;
Z представляет собой -N-;
R1 выбирают из группы, состоящей из циклопентила, циклобутила и фенила; где фенильный заместитель R1 может быть необязательно замещен фтором;
R5 представляет собой -(CH2)mC(O)OR50; где
m равно 0;
R50 представляет собой водород;
каждый R81, R84 и R85 представляет собой водород и
R82 и R83 независимо выбирают из группы, состоящей из хлора, циано и метила.
11. Соединение по п.3, где
X представляет собой -O-;
Z представляет собой -N-;
R1 выбирают из группы, состоящей из циклопентила, циклобутила и фенила; где фенильный заместитель R1 может быть необязательно замещен фтором;
R5 представляет собой -(CH2)mC(O)OR50; где
m равно 0;
R50 представляет собой водород;
каждый R81, R84 и R85 представляет собой водород и
R82 и R83 независимо выбирают из группы, состоящей из хлора, циано и метила.
12. Соединение, выбранное из группы, состоящей из
2-(3-хлор-4-цианофенил)-3-(4-фторфенил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
3-((4-фторфенил)-7-гидрокси-3,3a,4,5-тетрагидробензо[g]индазол-2-ил)-2-метилбензонитрила;
3-((4-фторфенил)-7-гидрокси-3,3a,4,5-тетрагидробензо[g]индазол-2-ил)-2-(трифторметил)бензонитрила;
2-хлор-4-(3-(4-фторфенил)-7-гидрокси-3,3a,4,5-тетрагидробензо[g]индазол-2-ил)бензонитрила;
2-(3-хлор-4-цианофенил)-3-(4-фторфенил)-N-(2-(метилсульфонил)этил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоксамида;
2-(3-хлор-4-цианофенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
2-(4-цианофенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
2-(4-циано-3-метилфенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
2-(5-циано-6-метилпиридин-2-ил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
2-(4-циано-3-метоксифенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
N-(2-(3-хлор-4-цианофенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-ил)ацетамида;
метил-2-(3-хлор-4-цианофенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоксилата;
2-(3-хлор-4-цианофенил)-3-циклопентил-3a-метил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
2-(3-хлор-4-цианофенил)-3-циклопентил-N-(2-(метилсульфонил)этил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоксамида;
2-(3-хлор-4-цианофенил)-3-циклопентил-N-(2-гидроксиэтил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоксамида;
2-(4-циано-3-метилфенил)-3-циклопентил-2,3,3a,4-тетрагидрохромено[4,3-c]пиразол-7-карбоновой кислоты;
2-(3-хлор-4-цианофенил)-3-циклобутил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
2-(3-хлор-4-цианофенил)-3-циклопентенил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
2-(4-циано-3-метилфенил)-3-циклопентенил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
2-(3-хлор-4-цианофенил)-3-(5-метил-2-фурил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
2-(3-хлор-4-цианофенил)-3-(3-фурил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
2-(3-хлор-4-цианофенил)-3-(5-метил-2-фурил)-N-[2-(метилсульфонил)этил]-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоксамида;
2-(3-хлор-4-цианофенил)-N-[2-(метилсульфонил)этил]-3-(2-метил-1,3-тиазол-5-ил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоксамида;
2-(3-хлор-4-цианофенил)-3-циклопентил-2,3,3a,4-тетрагидрохромено[4,3-c]пиразол-7-карбоновой кислоты;
2-[4-циано-3-(трифторметил)фенил]-3-циклопентил-2,3,3a,4-тетрагидрохромено[4,3-c]пиразол-7-карбоновой кислоты;
2-(4-циано-3-метилфенил)-3-циклопентенил-2,3,3a,4-тетрагидрохромено[4,3-c]пиразол-7-карбоновой кислоты и
2-(3-хлор-4-цианофенил)-3-циклопентенил-2,3,3a,4-тетрагидрохромено[4,3-c]пиразол-7-карбоновой кислоты
или их фармацевтически приемлемых солей.
13. Соединение по п.3, выбранное из группы, состоящей из
2-(3-хлор-4-цианофенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты;
2-(4-циано-3-метилфенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты и
2-(4-циано-3-метоксифенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты
или их фармацевтически приемлемых солей.
14. Соединение формулы
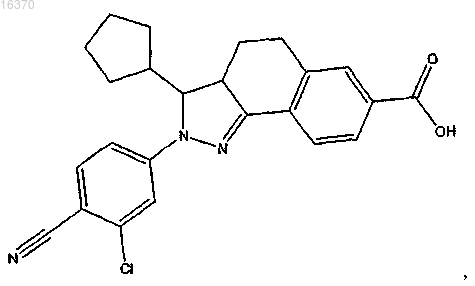
или его фармацевтически приемлемая соль.
15. Соединение формулы
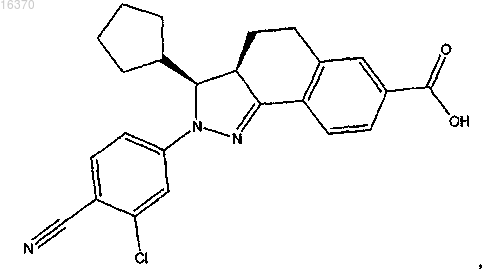
или его фармацевтически приемлемая соль.
16. Соединение формулы
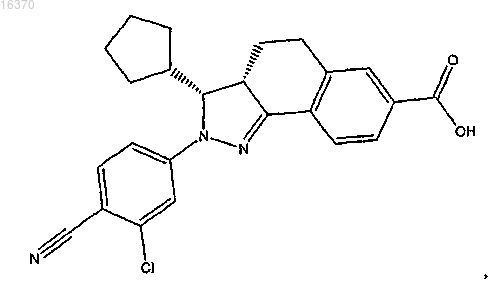
или его фармацевтически приемлемая соль.
17. Соединение формулы
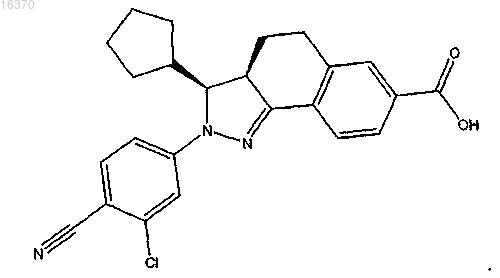
18. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-17 или его фармацевтически приемлемых солей и фармацевтически приемлемый носитель.
19. Композиция по п.18, дополнительно содержащая терапевтически эффективное количество одного или нескольких соединений, выбранных из группы, состоящей из диуретиков, ингибиторов ангиотензин-превращающего фермента, блокаторов рецептора ангиотензина II, блокаторов кальциевых каналов, β-блокаторов, α-блокаторов, α,β-блокаторов, антагонистов альдостеронового рецептора и ингибиторов ренина.
20. Способ лечения патологического состояния, выбранного из группы, состоящей из состояний сердечно-сосудистой системы, состояний почек, состояний печени, состояний сосудов, воспалительных состояний, боли, ретинопатии, невропатии, инсулинопатии, отека, эндотелиальной дисфункции и барорецепторной дисфункции, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения по любому из пп.1-17 или его фармацевтически приемлемых солей.
Текст
ПИРАЗОЛИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АНТАГОНИСТОВ МИНЕРАЛОКОРТИКОИДНЫХ РЕЦЕПТОРОВ В изобретении раскрыты соединения и фармацевтически приемлемые соли соединений, которые имеют структуру формулы (I) где значения R1, R2, R3A, R3B, R4, R5, R6, R7, R8 и X определены в подробном описании настоящего изобретения. Также раскрыты соответствующие фармацевтические композиции, способы лечения и промежуточные продукты. 016370 Область техники, к которой относится изобретение Настоящее изобретение относится к классу пиразолиновых соединений, имеющих структуру формулы (I) или формулы (II), и к фармацевтическим композициям, содержащим соединение формулы (I) или формулы (II). Настоящее изобретение также относится к способам лечения субъекта путем введения субъекту терапевтически эффективного количества соединения формулы (I) или формулы (II). Настоящее изобретение дополнительно относится к способам получения соединения формулы (I) или формулы(II) и соответствующих промежуточных продуктов. Предпосылки создания изобретения Гипертензией страдает приблизительно 20% взрослого населения в развитых странах. У населения в возрасте от 60 лет и выше этот процент возрастает приблизительно до 60-70%. Гипертензия также ассоциирована с повышенным риском возникновения других физиологических осложнений, включая удар,инфаркт миокарда, фибрилляцию желудочков, сердечную недостаточность, болезнь периферических сосудов и почечную недостаточность. Хотя в различных группах лекарственных средств доступен целый ряд гипотензивных средств, эффективность и безопасность таких лекарств варьирует от пациента к пациенту. Антагонисты минералокортикоидных рецепторов представляют собой класс лекарств, которые могут быть применимы для лечения гипертензии и/или родственных физиологических осложнений (Jewell,C.W., et al., CardiovascularHematological Agents in Medicinal Chemistry (2006) vol. 4, p. 129-153). Минералокортикоиды, такие как альдостерон, участвуют в регуляции водно-солевого баланса у млекопитающих. Активация минералокортикоидного рецептора может индуцировать гипертензию и обуславливать другие вредные воздействия на сердечно-сосудистую систему и физиологические эффекты. В настоящее время доступны два антагониста минералокортикоидных рецепторов, спиронолактон (ALDACTONE) и эплеренон (INSPRA), которые показаны для лечения гипертензии и сердечной недостаточности(Baxter, J. D., et al., Molecular and Cellular Endocrinology (2004) vol. 217, p. 151-165). Желательна идентификация дополнительных соединений, которые являются антагонистами минералокортикоидных рецепторов. Такие соединения могут быть применимы для лечения субъектов, страдающих гипертензией или предрасположенных к ней и/или сходными физиологическими проблемами, и дополнительного расширения диапазона способов лечения, приемлемых для таких субъектов. И спиронолактон, и эплеренон имеют стероидное строение. Настоящее изобретение, в частности, относится к антагонистам минералокортикоидных рецепторов, не являющимся стероидными соединениями. Применение нестероидного антагониста минералокортикоидных рецепторов потенциально обеспечивает определенные преимущества над стероидным антагонистом минералокортикоидных рецепторов, включая,например, дополнительное улучшение селективности относительно рецепторов половых гормонов; менее сложный и затратный химический синтез и тому подобное. В литературе сообщалось о трициклических пиразолах. Например, в заявке WO 06/086358 (опубликованной 17 августа 2006 года) сообщалось о классе трициклических пиразолов в качестве ингибиторов митотического кинезина. В литературе сообщалось о нестероидных соединениях, применимых в качестве антагонистов минералокортикоидных рецепторов. Например: в заявке WO 06/076202 (опубликованной 20 июля 2006 года) сообщалось о классе карбоксамидов имидазола в качестве антагонистов минералокортикоидных рецепторов; в заявке WO 06/012642 (опубликованной 2 февраля 2006 года) сообщалось о классе карбоксамидов пиррола в качестве антагонистов минералокортикоидных рецепторов; в заявке WO 04/052847 (опубликованной 24 июня 2004 года) сообщалось о классе дибензосуберанов в качестве антагонистов минералокортикоидных рецепторов; в заявке WO 05/066161 (опубликованной 21 июля 2005 года) сообщалось о классе дибензосуберанов в качестве антагонистов минералокортикоидных рецепторов; в заявке WO 03/078394 (опубликованной 25 сентября 2003 года) сообщалось о классе 3,3 бисарилоксиндолов в качестве антагонистов минералокортикоидных рецепторов; в заявке WO 05/097118 (опубликованной 20 октября 2005 года) сообщалось о классе 4-арил-1,4 дигидропиридинов в качестве антагонистов минералокортикоидных рецепторов; в заявке WO 04/067529 (опубликованной 12 августа 2004 года) сообщалось о классе 3 бензилиндолов в качестве антагонистов минералокортикоидных рецепторов; в заявке WO 04/077821 (опубликованной 27 июля 2006 года) сообщалось о классах бензоксазинтионов и тетрагидрохинолинов в качестве антагонистов минералокортикоидных рецепторов; в заявке WO 06/010142 (опубликованной 26 января 2006 года) сообщалось о классе арилбензоксазинонов/тионов в качестве антагонистов минералокортикоидных рецепторов.-1 016370 Краткое описание сущности изобретения В одном варианте осуществления настоящее изобретение относится к классу соединений, имеющих структуру формулы (I) и к их фармацевтически приемлемым солям; где значения R1, R2, R3A, R3B, R4, R5, R6, R7, R8 и X определены в подробном описании настоящего изобретения. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение, имеющее структуру формулы (I), или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение, имеющее структуру формулы (I), или его фармацевтически приемлемую соль; одно или несколько дополнительных фармацевтически активных соединений и фармацевтически приемлемый носитель. В другом варианте осуществления настоящее изобретение относится к способам лечения патологического состояния у субъекта путем введения субъекту терапевтически эффективного количества соединения, имеющего структуру формулы (I). Патологические состояния, которые могут подвергаться лечению в соответствии с настоящим изобретением, включают состояния сердечно-сосудистой системы(включая гипертензию и сердечную недостаточность), состояния почек, состояния печени, состояния сосудов, ретинопатию, невропатию (включая периферическую невропатию), инсулинопатию, отек, эндотелиальную дисфункцию, барорецепторную дисфункцию и тому подобное. В другом варианте осуществления настоящее изобретение относится к способам лечения патологического состояния у субъекта путем введения соединения, имеющего структуру формулы (I), в сочетании с другим фармацевтически активным соединением. Патологические состояния, которые могут подвергаться лечению в соответствии с настоящим изобретением, включают состояния сердечно-сосудистой системы (включая гипертензию и сердечную недостаточность), состояния почек, состояния печени, состояния сосудов, ретинопатию, невропатию (включая периферическую невропатию), инсулинопатию,отек, эндотелиальную дисфункцию, барорецепторную дисфункцию и тому подобное. В другом варианте осуществления настоящее изобретение относится к применению соединения,имеющего структуру формулы (I), или его фармацевтически приемлемой соли для производства лекарственного средства для лечения у субъекта патологического состояния. Патологические состояния, которые могут подвергаться лечению в соответствии с настоящим изобретением, включают состояния сердечно-сосудистой системы (включая гипертензию и сердечную недостаточность), состояния почек, состояния печени, состояния сосудов, ретинопатию, невропатию (включая периферическую невропатию),инсулинопатию, отек, эндотелиальную дисфункцию, барорецепторную дисфункцию и тому подобное. В другом варианте осуществления настоящее изобретение относится к способам получения соединения, имеющего структуру формулы (I), или его фармацевтически приемлемой соли. В другом варианте осуществления настоящее изобретение относится к промежуточным соединениям, применимым для получения соединения, имеющего структуру формулы (I), или его фармацевтически приемлемой соли. Подробное описание изобретения Это подробное описание вариантов осуществления предназначено лишь для ознакомления других специалистов в данной области техники с настоящим изобретением, его основами и его практическим применением с тем, чтобы другие специалисты в данной области техники могли адаптировать и применять изобретения в их многочисленных формах, наилучшим образом соответствующих требованиям конкретного применения. Поэтому указанные изобретения не ограничиваются рассмотренными в этом описании вариантами осуществления и могут быть различным образом модифицированы.A. Сокращения и определения. Используемое применительно к 1H-ЯМР обозначение относится к химическому сдвигу 1H-ЯМР сигнала. Используемое применительно к 1H-ЯМР сокращение "ушир." относится к уширенному сигналу 1HЯМР. Используемое применительно к 1H-ЯМР сокращение "д" относится к дублетному пику 1H-ЯМР. Используемое применительно к 1H-ЯМР сокращение "дд" относится к дублету дублетов в пике 1HЯМР. Сокращение "MCBP" относится к масс-спектроскопии высокого разрешения (ионизация электро-2 016370 распылением со сканированием масс положительно заряженных ионов). Сокращение "m/z" относится к пику масс-спектра. Используемое применительно к 1H-ЯМР сокращение "м" относится к мультиплетному пику 1HЯМР. Используемое применительно к 1H-ЯМР сокращение "кв." относится к квартетному пику 1H-ЯМР. Используемое применительно к 1H-ЯМР сокращение "с" относится к синглетному пику 1H-ЯМР. Используемое применительно к 1H-ЯМР сокращение "т" относится к триплетному пику 1H-ЯМР. Термин "алкил" относится к неразветвленному или разветвленному насыщенному гидрокарбильному заместителю (т.е. заместителю, содержащему только углерод и водород), содержащему в одном варианте осуществления приблизительно от 1 приблизительно до 20 атомов углерода; в другом варианте осуществления приблизительно от 1 приблизительно до 12 атомов углерода; в другом варианте осуществления приблизительно от 1 приблизительно до 10 атомов углерода; в другом варианте осуществления приблизительно от 1 приблизительно до 8 атомов углерода; в другом варианте осуществления приблизительно от 1 приблизительно до 6 атомов углерода; в другом варианте осуществления приблизительно от 3 приблизительно до 6 атомов углерода; в другом варианте осуществления приблизительно от 1 приблизительно до 4 атомов углерода; в другом варианте осуществления приблизительно от 1 приблизительно до 3 атомов углерода и в другом варианте осуществления приблизительно от 1 приблизительно до 2 атомов углерода. Примеры таких заместителей включают метил, этил, пропил (включая н-пропил и изопропил), бутил (включая н-бутил, изобутил, втор-бутил и трет-бутил), пентил, изоамил, гексил и тому подобное. Термин "алкенил" относится к неразветвленному или разветвленному насыщенному гидрокарбильному заместителю, содержащему одну или несколько двойных связей и приблизительно от 2 приблизительно до 20 атомов углерода; в другом варианте осуществления приблизительно от 2 приблизительно до 12 атомов углерода; в другом варианте осуществления приблизительно от 2 приблизительно до 6 атомов углерода; в другом варианте осуществления приблизительно от 3 приблизительно до 6 атомов углерода; и в другом варианте осуществления приблизительно от 2 приблизительно до 4 атомов углерода. Примеры алкенила включают этенил (также известный как винил), аллил, пропенил (включая 1-пропенил и 2 пропенил) и бутенил (включая 1-бутенил, 2-бутенил и 3-бутенил). Термин "алкенил" охватывает заместители, имеющие "цис" и "транс" ориентацию или в качестве альтернативы "E" и "Z" ориентацию. Термин "бензил" относится к метильному радикалу, замещенному фенилом. Термин "циклоалкил" относится к насыщенному карбоциклическому заместителю, содержащему от 3 приблизительно до 14 атомов углерода. В другом варианте осуществления циклоалкильный заместитель содержит от 3 приблизительно до 8 атомов углерода. В другом варианте осуществления циклоалкильный заместитель содержит от 3 приблизительно до 6 атомов углерода; в другом варианте осуществления производства от 3 приблизительно до 4 атомов углерода. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил и циклогексил. Термин "арил" относится к карбоциклической ароматической системе, содержащей одно, два или три кольца, в которой кольца могут быть соединены вместе в виде боковых групп или могут быть конденсированы. Термин "арил" относится к ароматическим заместителям, таким как фенил, нафтил и антраценил. Термин "арилалкил" относится к алкилу, замещенному арилом. В отдельных случаях число атомов углерода в гидрокарбильном заместителе (например, в алкиле,алкениле, алкиниле, циклоалкиле, циклоалкениле, ариле и тому подобное) указывается приставкой "CxCy-", в которой х представляет собой минимальное и у представляет собой максимальное число атомов углерода в заместителе. Так, например, "C1-C6-алкил" относится к алкильному заместителю, содержащему от 1 до 6 атомов углерода. Для дополнительного пояснения C3-C6-циклоалкил относится к насыщенному карбоциклилу, содержащему от 3 до 6 атомов углерода в кольце. Термины "гидрокси" и "гидроксил", каждый,относятся к -OH. Гидроксил может быть использован отдельно для обозначения заместителя, как в "гидроксильной группе". При использовании в сочетании с другим термином (терминами) приставка "гидрокси" указывает на то, что заместитель, применительно к которому используется приставка, замещен одним или несколькими гидроксильными заместителями. Соединения, содержащие атом углерода с одним или несколькими гидроксильными заместителями,включают, например, спирты, енолы и фенол. Термин "гидроксиалкил" относится к алкилу, который замещен по крайней мере одним гидроксизаместителем. Примеры гидроксиалкила включают гидроксиметил, гидроксиэтил, гидроксипропил и гидроксибутил. Термин "алкиламино" относится к аминогруппе, в которой по крайней мере одна алкильная цепь связана с атомом азота аминогруппы вместо атома водорода. Примеры алкиламинозаместителей включают моноалкиламино, такой как метиламино (представленный формулой -NH(CH3, и диалкиламино,такой как диметиламино (представленный формулой -N(CH3)2). Термин "аминокарбонил" относится к -C(O)-NH2. Термин "галоген" относится к фтору, хлору, брому или йоду (который может отображаться как -I).-3 016370 В одном варианте осуществления галоген представляет собой хлор. В другом варианте осуществления галоген представляет собой фтор. Приставка "галоген" указывает на то, что заместитель, применительно к которому используется приставка, замещен одним или несколькими независимо выбранными галогенами. Например, галогеналкил относится к алкилу, который замещен по крайней мере одним галогеном. Если более одного атома водорода замещены галогеном, то галогены могут быть одинаковыми или разными. Примеры галогеналкилов включают хлорметил, дихлорметил, дифторхлорметил, дихлорфторметил, трихлорметил, 1 бромэтил, фторметил, дифторметил, трифторметил, 2,2,2-трифторэтил, дифторэтил, пентафторэтил, дифторпропил, дихлорпропил и гептафторпропил. В качестве дополнительного пояснения термин "галогеналкокси" относится к алкокси, который замещен по крайней мере одним галогеном. Примеры галогеналкокси-заместителей включают хлорметокси, 1-бромэтокси, фторметокси, дифторметокси, трифторметокси (также известный как "перфторметилокси") и 2,2,2-трифторэтокси. Следует понимать, что если заместитель замещен более чем одним галогеном, то такие галогены могут быть одинаковыми или разными (если иное не определено особо). Термин "оксо" относится к =О. Термин "окси" относится к эфирному заместителю и может быть отражен как -O-. Термин "алкокси" относится к алкилу, связанному с атомом кислорода, который также может быть представлен как -O-R, где R представляет собой алкильную группу. Примеры алкокси включают метокси, этокси, пропокси и бутокси. Термин "алкилкарбонил" относится к -C(O)-алкилу, например "этилкарбонилу". Примеры других алкилкарбонилов включают метилкарбонил, пропилкарбонил, бутилкарбонил, пентилкарбонил и гексилкарбонил. Термин "аминоалкилкарбонил" относится к -C(O)-алкил-NH2, например "аминометилкарбонилу". Термин "алкоксикарбонил" относится к -C(O)-O-алкилу, например "этоксикарбонилу". Примеры других алкоксикарбонилов включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, пентоксикарбонил и гексилоксикарбонил. В другом варианте осуществления, если атом углерода карбонила соединен с атомом углерода второго алкила, полученная функциональная группа представляет собой простой эфир. Термины "тио" и "тиа" относятся к двухвалентному атому серы, и такой заместитель может быть отображен как -S-. Например, тиоэфир представлен как "алкилтиоалкил" или в качестве альтернативы алкил-S-алкил. Термин "тиол" относится к сульфгидрильному заместителю и может быть отображен как -SH. Термин "сульфонил" относится к -S(O)2-. Так, например, "алкилсульфонилалкил" относится к алкил-S(O)2-алкилу. Примеры алкилсульфонила включают метилсульфонил, этилсульфонил и пропилсульфонил. Термин "аминосульфонил" относится к -S(O)2-NH2. Термин "сульфинил" относится к -S(O)-. Так, например, термины "алкилсульфинилалкил" или "алкилсульфоксидоалкил" относятся к алкил-S(O)-алкилу. Типичные алкилсульфинильные группы включают метилсульфинил, этилсульфинил, бутилсульфинил и гексилсульфинил. Термин "спиросоединение" относится к двум или трем кольцам, которые содержат только один общий атом, и два или три кольца не соединены мостиком. Общий кольцевой атом называется спироатомом. Спиросоединение может содержать один или несколько гетероатомов; и такое соединение подпадает под представленное ниже определение гетероциклила. Термин "гетероциклил" относится к насыщенной, частично насыщенной или полностью ненасыщенной кольцевой структуре, содержащей всего от 3 до 14 атомов в кольце. По крайней мере один из атомов кольца представляет собой гетероатом (т.е. атом кислорода, азота или серы), а оставшиеся атомы в кольце независимо выбирают из группы, состоящей из атомов углерода, кислорода, азота или серы. Гетероциклил может представлять собой единственное кольцо, которое типично содержит от 3 до 7 атомов в кольце, более типично от 3 до 6 атомов в кольце и еще более типично от 5 до 6 атомов в кольце. Примеры однокольцевых гетероциклилов включают без ограничения азетидинил, фуранил, дигидрофуранил, тетрагидрофуранил, тиофуранил, дигидротиофуранил, тетрагидротиофуранил, пирролил, пирролинил, пирролидинил, имидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, тиазолинил, изотиазолинил, тиазолидинил, оксатиазолил, оксадиазолил, фуразанил, оксатриазолил (включая 1,2,3,4 оксатриазолил или 1,2,3,5-оксатриазолил), диоксазолил (включая 1,2,3-диоксазолил, 1,2,4-диоксазолил,1,3,2-диоксазолил или 1,3,4-диоксазолил), оксатиоланил, пиранил (включая 1,2-пиранил или 1,4 пиранил), дигидропиранил, пиридинил (также известный как "пиридил"), пиперидинил, пиридазинил,пиримидинил (также известный как "пиримидил"), пиразинил, пиперазинил, триазинил, оксазинил, оксазолидинил, изоксазолидинил, оксатиазинил, оксадиазинил, морфолинил, азепинил, оксепинил, тиепинил и диазепинил. Гетероциклил может также содержать 2 или 3 конденсированных вместе кольца, где по крайней мере одно такое кольцо содержит в качестве атома кольца по крайней мере один гетероатом (например,-4 016370 атом азота, кислорода или серы). Примеры конденсированных двухкольцевых гетероциклилов включают без ограничения индолизинил, 4H-хинолизинил, пуринил, нафтиридинил, птеридинил, индолил, изоиндолил, индоленинил, фталазинил, хиноксалинил, хиназолинил, бензодиазинил, бензопиранил, бензотиопиранил, бензоксазолил, бензодиоксолил, бензодиоксанил, бензоксадиазолил, бензофуранил, изобензофуранил, бензотиенил, бензотиазолил, бензотиадиазолил, бензимидазолил, бензотриазолил, бензоксазинил, тетрагидроизохинолинил, карбазолил, ксантенил и акридинил. Дополнительные примеры конденсированных кольцевых гетероциклилов включают тетрагидродиоксолопирролил и тетрагидротриазолопиразинил. Термин "гетероарил" относится к ароматическому гетероциклилу, содержащему от 5 до 14 атомов в кольце. Гетероарил может представлять собой единственное кольцо или содержать 2 или 3 конденсированных кольца. Примеры гетероарильных заместителей включают 6-членные кольцевые заместители,такие как пиридинил (также известный как "пиридил"), пиразил, пиримидинил (также известный как"пиримидил") и пиридазинил; 5-членные кольцевые заместители, такие как триазолил, имидазил, фуранил, тиофуранил, пиразолил, оксазолил, изоксазолил, тиазолил, оксадиазолил и изотиазолил; 6/5 членные конденсированные кольцевые заместители, такие как бензотиофуранил, бензизоксазолил, бензоксазолил и пуринил; и 6/6-членные конденсированные кольцевые заместители, такие как хинолинил,изохинолинил, циннолинил и хиназолинил. Термин "гетероциклилалкил" относится к алкилу, замещенному гетероциклилом. Термин "гетероциклоалкил" относится к полностью насыщенному гетероциклилу. Заместитель является "замещаемым", если он содержит по крайней мере один атом углерода, серы,кислорода или азота, который связан с одним или несколькими атомами водорода. Так, например, водород, галоген и циано не подпадают под это определение. Если заместитель описан как "замещенный", то вместо водорода атом углерода или азота заместителя содержит неводородный заместитель. Так, например, замещенный алкильный заместитель представляет собой алкильный заместитель, в котором вместо водорода алкильный заместитель содержит по крайней мере один неводородный заместитель. С целью пояснения, монофторалкил представляет собой алкил, замещенный фтором, а дифторалкил представляет собой алкил, замещенный двумя фторами. Следует понимать, что при наличии более одного замещения в заместителе неводородные заместители могут быть одинаковыми или разными (если иное не определено особо). Если заместитель описан как "необязательно замещенный", то заместитель может быть либо (1) незамещенным, либо (2) замещенным. Если атом углерода заместителя описан как необязательно замещенный одним или несколькими заместителями из перечня, то один или несколько атомов водорода на атоме углерода (в той степени, в которой они присутствуют) могут по отдельности и/или вместе заменены независимо выбранным необязательным заместителем. Если атом азота заместителя описан как необязательно замещенный одним или несколькими заместителями из перечня, то один или несколько атомов водорода на атоме азота (в той степени, в которой они присутствуют) могут по отдельности и/или вместе заменены независимо выбранным необязательным заместителем. В данном описании термины "заместитель", "радикал" и "группа" используются взаимозаменяемо. Если группа заместителей коллективно описана как необязательно замещенные одним или несколькими заместителями из перечня, то группа может включать: (1) незамещаемые заместители, (2) замещаемые заместители, которые не замещены необязательными заместителями, и/или (3) замещаемые заместители, которые замещены одним или несколькими необязательными заместителями. Если заместитель описан как необязательно содержащий вплоть до определенного числа неводородных заместителей, то заместитель может быть либо (1) незамещенным; либо (2) содержать до определенного числа неводородных заместителей или до максимального числа замещаемых положений на заместителе, меньшее из двух. Так, например, если заместитель описан как гетероарил, необязательно содержащий до 3 неводородных заместителей, то любой гетероарил менее чем с 3 замещаемыми положениями может необязательно содержать столько же неводородных заместителей, сколько гетероарил имеет замещаемых положений. Для пояснения, тетразолил (который имеет только одно замещаемое положение) может необязательно содержать до одного неводородного заместителя. Для дополнительного пояснения, если атом азота аминогруппы описан как необязательно содержащий до 2 неводородных заместителей, то атом азота может содержать до 2 неводородных заместителей, если атом азота аминогруппы является первичным атомом азота, тогда как атом азота аминогруппы может необязательно содержать лишь до 1 неводородного заместителя, если атом азота аминогруппы является вторичным атомом азота. Приставка к мультифрагментному заместителю относится только к первому фрагменту. Для пояснения, термин "алкилциклоалкил" содержит два фрагмента: алкил и циклоалкил. Так, приставка C1-C6- вC1-C6-алкилциклоалкиле означает, что алкильный фрагмент алкилциклоалкила содержит от 1 до 6 атомов углерода; приставка C1-C6- не описывает циклоалкильный фрагмент. Для дополнительного пояснения,приставка "галоген" в галогеналкоксиалкиле указывает на то, что только алкоксифрагмент алкоксиалкильного заместителя замещен одним или несколькими галогенами. Если замещение галогеном может альтернативно или дополнительно происходить в алкильном фрагменте, то заместитель вместо этого должен быть описан как "галогензамещенный алкоксиалкил", а не как "галогеналкоксиалкил". И в за-5 016370 ключение, если замещение галогеном может происходить в алкильном фрагменте, то заместитель вместо этого должен быть описан как "алкоксигалогеналкил". Если заместитель состоит из нескольких фрагментов, если иное не указано особо, то предполагается, что конечный фрагмент служит точкой присоединения к оставшейся части молекулы. Например, в заместителе A-B-C фрагмент С присоединен к оставшейся части молекулы. В заместителе A-B-C-D фрагмент D присоединен к оставшейся части молекулы. Аналогичным образом, в заместителе аминокарбонилметил метильный фрагмент присоединен к оставшейся части молекулы. В заместителе трифторметиламинокарбонил карбонильный фрагмент присоединен к оставшейся части молекулы. Для описания заместителя, в котором несколько первых фрагментов предполагаются в качестве заместителей единственного второго фрагмента, могут быть использованы круглые скобки. В заместителе(гидроксиметил)(этил)пиперидинил и гидроксиметильный фрагмент и этильный фрагмент непосредственно присоединены к пиперидинильному фрагменту. В качестве альтернативы, если заместитель не является замещаемым, то круглые скобки не требуются. Например, "фторхлорметан" описывает атом углерода, связанный непосредственно с атомом хлора, атомом фтора и двумя атомами водорода. Если заместители описаны как "независимо выбранные" из группы, то каждый заместитель выбирают независимо от другого. Таким образом, каждый заместитель может быть идентичным другому заместителю (заместителям) или отличаться от него (них). Термин "фармацевтически приемлемый носитель" относится к носителю, который совместим с другими ингредиентами композиции, и не является вредным для субъекта. Такие носители могут представлять собой фармацевтически приемлемый материал, композицию или основу, такие как жидкий или твердый заполнитель, разбавитель, наполнитель, растворитель или герметик, участвующие в доставке или транспортировке химического агента. Предпочтительная композиция зависит от способа введения. Термины "предупреждать", "профилактика" или "предупреждение" относятся либо к предупреждению развития доклинически очевидного состояния вообще или к предупреждению развития доклинически очевидной стадии состояния у субъекта. Профилактика включает без ограничения профилактическое лечение субъекта с риском развития состояния. Термин "терапевтически эффективное количество" относится к такому количеству лекарства или фармацевтического средства, которое вызывает биологический или медицинский ответ со стороны ткани, системы или животного, искомого для исследователя или врача. Термин "лечение" (и соответствующие термины "лечить" и "лечение") включает паллиативное, восстановительное и профилактическое лечение субъекта. Термин "паллиативное лечение" относится к лечению, которое облегчает или снижает эффект или интенсивность состояния у субъекта без излечения состояния. Термин "профилактическое лечение" (и соответствующий термин "профилактическое лечение") относится к лечению, которое предупреждает возникновение состояния у субъекта. Термин "восстановительное лечение" относится к лечению, которое останавливает развитие, уменьшает патологические проявления или полностью устраняет состояние у субъекта.B. Соединения. Настоящее изобретение относится к классу соединений (включая фармацевтически приемлемые соли), где соединения имеют структуру формулы (I):R1 выбирают из группы, состоящей из циклопентила, циклобутила и фенила; где циклопентильный,циклобутильный и фенильный заместители R1 могут быть необязательно замещены одним или несколькими заместителями, независимо выбранными из группы, состоящей из хлора, фтора, метила, этила,пропила, хлорметила, дихлорметила, трихлорметила, фторметила, дифторметила и трифторметила;R2 выбирают из группы, состоящей из водорода и (C1-C8)алкила;R3A и R3B независимо выбирают из группы, состоящей из водорода и (C1-C8)алкила;R4, R6 и R7 независимо выбирают из группы, состоящей из водорода, галогена, гидрокси, (C1C8)алкила, галоген(C1-C8)алкила, гидрокси(C1-C8)алкила и (C1-C8)алкокси;R50 выбирают из группы, состоящей из водорода и (C1-C8)алкила;R51 и R52 независимо выбирают из группы, состоящей из водорода и (C1-C8)алкила; или R51 и R52 образуют вместе с атомом азота, к которому они присоединены, 5- или 6-членный кольцевой гетероциклил; где алкильные заместители R50, R51 и R52 и гетероциклильный заместитель R51/R52 могут быть независимо и необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогена, пирролидинила, -OR53, -C(O)R53, -C(O)OR53, -C(O)NR54R55, -NR54R55,-N(R56)C(O)R53, -S(O)pR53 и -S(O)pNR54R55;R54 и R55 независимо выбирают из группы, состоящей из водорода, (C1-C8)алкила, галоген(C1C8)алкила, гидрокси(C1-C8)алкила и карбокси(C1-C8)алкила; или R54 и R55 образуют вместе с атомом азота, к которому они присоединены, 5- или 6-членный кольцевой гетероциклил;R56 выбирают из группы, состоящей из водорода и (C1-C8)алкила; иR8 выбирают из группы, состоящей из фенила, пиридинила и пиримидинила; где фенильный, пиридинильный и пиримидинильный заместители могут быть необязательно замещены одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена, циано, гидрокси, карбокси, (C1-C8)алкила, галоген(C1-C8)алкила, циано(C1-C8)алкила, гидрокси(C1-C8)алкила, карбокси(C1C8)алкила, (C1-C8)алкокси, галоген(C1-C8)алкокси, циано(C1-C8)алкокси, амино, (C1-C8)алкиламино,ди(C1-C8)алкиламино и (C1-C8)алкоксикарбонила. Настоящее изобретение также относится к подклассу соединений (включая фармацевтически приемлемые соли), где соединения имеют структуру формулы (II):R1 выбирают из группы, состоящей из циклопентила, циклобутила и фенила; где циклопентильный,циклобутильный и фенильный заместители R1 могут быть необязательно замещены одним или несколькими заместителями, независимо выбранными из группы, состоящей из хлора, фтора, метила, этила,пропила, хлорметила, дихлорметила, трихлорметила, фторметила, дифторметила и трифторметила;R2 выбирают из группы, состоящей из водорода или (C1-C4)алкила;R50 выбирают из группы, состоящей из водорода и (C1-C6)алкила;R51 и R52 независимо выбирают из группы, состоящей из водорода и (C1-C6)алкила,где (C1-C6)-алкильные заместители R50, R51 и R52 могут быть независимо и необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -OR53, -C(O)R53,-C(O)OR53, -C(O)NR54R55, -NR54R55, -N(R56)C(O)R53, -S(O)pR53 и -S(O)pNR54R55;R54 и R55 независимо выбирают из группы, состоящей из водорода, (C1-C6)алкила, галоген(C1C6)алкила, гидрокси(C1-C6)алкила и карбокси(C1-C6)алкила; иR81, R82, R83, R84 и R85 независимо выбирают из группы, состоящей из водорода, хлора, фтора, циано, гидрокси, карбокси, метила, этила, трихлорметила, трифторметила, цианометила, гидроксиметила,карбоксиметила, метокси, амино, метиламино и диметиламино. В одном варианте осуществления соединений формулы (II) R2 представляет собой водород. В другом варианте осуществления соединений формулы (II) R2 представляет собой водород; R5 представляет собой (CH2)mC(O)OR50; где m равно 0, 1, 2 или 3;R50 выбирают из группы, состоящей из водорода и (C1-C6)алкила; где (C1-C6) - алкильный заместитель; R50 может быть независимо и необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -OR53, -C(O)R53, -C(O)OR53, C(O)NR54R55, -NR54R55,-7 016370R54 и R55 независимо выбирают из группы, состоящей из водорода, (C1-C6)алкила, галоген(C1C6)алкила, гидрокси(C1-C6)алкила и карбокси(C1-C6)алкила. В другом варианте осуществления соединений формулы (II) R2 представляет собой водород;R1 выбирают из группы, состоящей из циклопентила, циклобутила и фенила; где фенильный заместитель R1 может быть необязательно замещен фтором;R50 представляет собой водород; каждый R81, R84 и R85 представляет собой водород иR82 и R83 независимо выбирают из группы, состоящей из хлора, циано и метила. В другом варианте осуществления соединений формулы (II) R82 представляет собой хлор и R83 представляет собой циано. В еще одном варианте осуществления R1 представляет собой циклопентил. В еще одном варианте осуществления R1 представляет собой фенил; где фенильный заместитель R1 может быть необязательно замещен фтором. В другом варианте осуществления соединений формулы (II) R2 представляет собой водород;R1 выбирают из группы, состоящей из циклопентила, циклобутила и фенила; где фенильный заместитель R1 может быть необязательно замещен фтором;R50 представляет собой водород; каждый R81, R84 и R85 представляет собой водород иR82 и R83 независимо выбирают из группы, состоящей из хлора, циано и метила. В другом варианте осуществления соединений формулы (II) R2 представляет собой водород;R1 выбирают из группы, состоящей из циклопентила, циклобутила и фенила; где фенильный заместитель R1 может быть необязательно замещен фтором; R5 представляет собой -(CH2)mC(O)OR50; где m равно 0;R50 представляет собой водород; каждый R81, R84 и R85 представляет собой водород иR82 и R83 независимо выбирают из группы, состоящей из хлора, циано и метила. В другом варианте осуществления соединений формулы (II) R2 представляет собой водород;R1 выбирают из группы, состоящей из циклопентила, циклобутила и фенила; где фенильный заместитель R1 может быть необязательно замещен фтором;R50 представляет собой водород; каждый R81, R84 и R85 представляет собой водород иR82 и R83 независимо выбирают из группы, состоящей из хлора, циано и метила. В другом варианте осуществления соединения формулы (II) выбирают из группы, состоящей из 2-(3-хлор-4-цианофенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты; 2-(4-циано-3-метилфенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты и 2-(4-циано-3-метоксифенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты; или их фармацевтически приемлемых солей. Настоящее изобретение также относится к группе соединений, состоящей из 2-(3-хлор-4-цианофенил)-3-(4-фторфенил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты; 3-4-фторфенил)-7-гидрокси-3,3a,4,5-тетрагидробензо[g]индазол-2-ил)-2-метилбензонитрила;N-(-2-(3-хлор-4-цианофенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-ил)ацетамида; метил-2-(3-хлор-4-цианофенил)-3-циклопентил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоксилата; 2-(3-хлор-4-цианофенил)-3-циклопентил-3a-метил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты; 2-(3-хлор-4-цианофенил)-3-циклопентил-N-(2-(метилсульфонил)этил)-3,3a,4,5-тетрагидро-2Hбензо[g]индазол-7-карбоксамида; 2-(3-хлор-4-цианофенил)-3-циклопентил-N-(2-гидроксиэтил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоксамида; 2-(4-циано-3-метилфенил)-3-циклопентил-2,3,3a,4-тетрагидрохромено[4,3-c]пиразол-7-карбоновой кислоты; 2-(3-хлор-4-цианофенил)-3-циклобутил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты; 2-(3-хлор-4-цианофенил)-3-циклопентенил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты; 2-(4-циано-3-метилфенил)-3-циклопентенил-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты; 2-(3-хлор-4-цианофенил)-3-(5-метил-2-фурил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты; 2-(3-хлор-4-цианофенил)-3-(3-фурил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты; 2-(3-хлор-4-цианофенил)-3-(5-метил-2-фурил)-N-[2-(метилсульфонил)этил]-3,3a,4,5-тетрагидро-2Hбензо[g]индазол-7-карбоксамида; 2-(3-хлор-4-цианофенил)-N-[2-(метилсульфонил)этил]-3-(2-метил-1,3-тиазол-5-ил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоксамида; 2-(3-хлор-4-цианофенил)-3-циклопентил-2,3,3a,4-тетрагидрохромено[4,3-c]пиразол-7-карбоновой кислоты; 2-[4-циано-3-(трифторметил)фенил]-3-циклопентил-2,3,3a,4-тетрагидрохромено[4,3-c]пиразол-7 карбоновой кислоты; 2-(4-циано-3-метилфенил)-3-циклопентенил-2,3,3a,4-тетрагидрохромено[4,3-c]пиразол-7-карбоновой кислоты и 2-(3-хлор-4-цианофенил)-3-циклопентенил-2,3,3a,4-тетрагидрохромено[4,3-c]пиразол-7-карбоновой кислоты; или их фармацевтически приемлемых солей. Настоящее изобретение также относится к соединению формулы или его фармацевтически приемлемой соли. Кроме того, настоящее изобретение относится к соединению формулы или его фармацевтически приемлемой соли; соединению формулы или его фармацевтически приемлемой соли; а также к соединению формулыC. Изомеры. Соединения по настоящему изобретению могут находиться в виде стереоизомеров, таких как энантиомеры и диастереоизомеры. Например, соединения (включая соединения формул (I) и (II, как правило, содержат два или несколько асимметрических атомов углерода и могут находиться в форме одного или нескольких стереоизомеров (например, отдельных энантиомеров, диастереоизомеров и их смесей). Более конкретно, соединения по настоящему изобретению могут находиться в форме 3R,3aR стереоизомера, 3S,3aS стереоизомера, 3S,3aR стереоизомера, 3R,3aS стереоизомера или смеси двух или нескольких из указанных стереоизомеров. В одном варианте осуществления соединение формул (I) или (II) имеет 3R,3aR конфигурацию. В другом варианте осуществления соединение формул (I) или (II) имеет 3S,3aS конфигурацию. В другом варианте осуществления соединение формул (I) или (II) имеет 3S,3aR конфигурацию. В другом варианте осуществления соединение формул (I) или (II) имеет 3R,3aS конфигурацию. В другом варианте осуществления соединение формул (I) или (II) находится в виде смеси двух или нескольких стереоизомеров, выбранных из группы, состоящей из 3R,3aR стереоизомера, 3S,3aS стереоизомера, 3S,3aR стереоизомера и 3R,3aS стереоизомера. Кроме того, если соединение по настоящему изобретению содержит алкенильную группу или фрагмент, то могут появляться геометрические изомеры.P. Таутомерные формы. Настоящее изобретение включает таутомерные формы соединений формул (I) и (II). Если структурные изомеры могут взаимно превращаться из-за низкого энергетического барьера, то может возникать таутомерная изомерия ("таутомерия"). Она принимает форму протонной таутомерии в соединениях формулы (I) или формулы (II), содержащих, например, имино, кето или оксимную группы, или так называемой валентной таутомерии в соединениях, которые содержат ароматический фрагмент. Следовательно,отдельное соединение может проявлять более одного типа изомерии. Различные соотношения таутомеров в твердой и жидкой форме зависят от различных заместителей в молекуле, а также от конкретной методики кристаллизации, использованной для выделения соединения.E. Соли. Соединения по настоящему изобретению могут использоваться в форме солей, полученных из неорганических и органических кислот. В зависимости от конкретного соединения соль соединения может быть предпочтительной вследствие одного или нескольких физических свойств соли, таких как повышенная фармацевтическая стабильность в условиях изменяющихся температур и влажности или желаемая растворимость в воде или масле. В отдельных случаях соль соединения может быть также использована в качестве вспомогательного средства при выделении, очистке и/или разделении соединения.- 10016370 Если соль предназначена для введения пациенту (в отличие, например, от использования in vitro),то типичная соль является фармацевтически приемлемой. Термин "фармацевтически приемлемая соль" относится к соли, полученной путем объединения соединения формул (I) или (II) с кислотой или основанием, анион или катион которых соответственно считается в целом приемлемым для употребления человеком. Фармацевтически приемлемые соли особенно применимы в качестве продуктов способов по настоящему изобретению, так как они лучше растворимы в воде по сравнению с исходным соединением. Для использования в медицине соли соединений по настоящему изобретению представляют собой нетоксичные "фармацевтически приемлемые соли". Соли, охватываемые термином "фармацевтически приемлемые соли", относятся к нетоксичным солям соединений по настоящему изобретению, которые, как правило, получают путем осуществления взаимодействия свободного основания с подходящей органической или неорганической кислотой. Подходящие фармацевтически приемлемые кислотно-аддитивные соли соединений по настоящему изобретению, если возможно, включают соли, полученные из неорганических кислот, например из хлористо-водородной, бромисто-водородной, фтористо-водородной, борной, фторборной, фосфорной, метафосфорной, азотной, угольной, сульфоновой и серной кислот, или из органических кислот, например из уксусной, бензолсульфоновой, бензойной, лимонной, яблочной, этансульфоновой, фумаровой, глюконовой, гликолевой, изотионовой, молочной, лактобионовой, малеиновой, метансульфоновой, трифторметансульфоновой, янтарной, толуолсульфоновой, винной и трифторуксусной кислот. Подходящие органические кислоты, как правило, включают, например, алифатический, циклоалифатический, ароматический, аралифатический, гетероциклический, карбоциклический и сульфоновый классы органических кислот. Конкретные примеры подходящих солей органических кислот включают ацетат, трифторацетат, формиат, пропионат, сукцинат, гликолят, глюконат, диглюконат, лактат, малат,тартрат, цитрат, аскорбат, глюкуронат, малеат, фумарат, пируват, аспартат, глутамат, бензоат, антранилат, мезилат, стеарат, салицилат, пара-гидроксибензоат, фенилацетат, манделат, эмбонат (памоат), метансульфонат, этансульфонат, бензолсульфонат, пантотенат, толуолсульфонат, 2-гидроксиэтансульфонат, сульфанилат, циклогексиламиносульфонат, альгинат, -гидроксибутират, галактарат, галактуронат, адипат, бутират, камфорат, камфорсульфонат, циклопентанпропионат, додецилсульфат, гликогептаноат, глицерофосфат, гептаноат, гексаноат, никотинат, 2-нафталинсульфонат, оксалат, пальмоат,пектинат, 3-фенилпропионат, пикрат, пивалат, тиоцианат, тозилат и ундеканоат. В другом варианте осуществления примеры подходящих аддитивных солей включают ацетаты, аспартаты, бензоаты, безилаты, бикарбонаты/карбонаты, бисульфаты/сульфаты, бораты, камзилаты, цитраты, эдизилаты, эзилаты, формиаты, фумараты, глюцептаты, глюконаты, глюкуронаты, гексафторфосфаты, гибензаты, гидрохлориды/хлориды, гидробромиды/бромиды, гидройодиды/йодиды, изетионаты, лактаты, малаты, малеаты, нитраты, оротаты, оксалаты, пальмитаты, памоаты, фосфаты/гидрофосфаты/дигидрофосфаты, сахараты, стеараты, сукцинаты, тартраты, тозилаты и трифторацетаты. В другом варианте осуществления характерные соли включают бензолсульфонат, гидробромид и гидрохлорид. Кроме того, если соединения по настоящему изобретению содержат кислотный фрагмент, то их подходящие фармацевтически приемлемые соли могут включать соли щелочных металлов, например соли натрия или калия; соли щелочно-земельных металлов, например соли кальция или магния; и соли,образованные с подходящими органическими лигандами, например четвертичные аммониевые соли. В другом варианте осуществления основно-аддитивные соли получают из оснований, которые образуют нетоксичные соли, включая соли алюминия, аргинина, бензатина, холина, диэтиламина, диоламина, глицина, лизина, меглумина, оламина, трометамина и цинка. Органические соли могут быть получены из вторичных, третичных и четвертичных аминов, таких как трометамин, диэтиламин, N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумин (N-метилглюкамин) и прокаин. Основные азотсодержащие группы могут быть кватернизованы агентами, такими как низший алкил(C1-C6)галогениды (например, метил-, этил-, пропил- и бутилхлориды, бромиды и йодиды), диалкилсульфаты (например, диметил-, диэтил-, дибутил- и диамилсульфаты), длинноцепочечные галогениды (например,децил-, лаурил-, миристил- и стеарилхлориды,бромиды и йодиды), арилалкилгалогениды (например, бензил- и фенэтилбромиды) и другие. В одном варианте осуществления также могут образовываться полусоли кислот и оснований, например полусульфаты и соли полукальция.F. Пролекарства. В объем настоящего изобретения также включены так называемые "пролекарства" соединений формул (I) и (II). Так, некоторые производные соединений согласно любой из формул (I) или (II), которые сами по себе могут обладать слабой фармакологической активностью или не обладать ею, при введении в организм или при нанесении на тело могут преобразовываться в обладающие желаемой активностью соединения согласно любой из формул (I) или (II), например, путем гидролитического расщепления. Такие производные называют "пролекарствами". Дополнительная информация о применении пролекарств может быть найдена в "Pro-drugs as NovelDrug Design", Pergamon Press, 1987 (ed. E.B. Roche, American Pharmaceutical Association). Пролекарства в соответствии с настоящим изобретением могут быть получены, например, путем замены подходящих функциональных групп в соединениях согласно любой из формул (I) или (II) определенными фрагментами, известными специалистам в данной области техники как "профрагменты", как описано, например,в "Design of Prodrugs" by hours Bundgaard (Elseview, 1985).G. Способы лечения. Настоящее изобретение также относится к способам лечения патологического состояния у субъекта, имеющего такое состояние или предрасположенного к нему, путем введения субъекту терапевтически эффективного количества одного или нескольких описанных выше соединений формул (I) и (II). В одном варианте осуществления лечение является профилактическим лечением. В другом варианте осуществления лечение является паллиативным лечением. В другом варианте осуществления лечение является восстановительным лечением. 1. Патологические состояния. Патологические состояния, которые могут подвергаться лечению в соответствии с настоящим изобретением, включают без ограничения состояния сердечно-сосудистой системы, состояния почек, состояния печени, состояния сосудов, воспалительные состояния, боль, ретинопатию, невропатию (такую как периферическую невропатию), инсулинопатию, отек, эндотелиальную дисфункцию, барорецепторную дисфункцию и тому подобное. Патологические состояния сердечно-сосудистой системы включают без ограничения гипертензию,сердечную недостаточность (такую как застойная сердечная недостаточность), диастолическую дисфункцию (такую как диастолическая дисфункция левого желудочка, диастолическая сердечная недостаточность и нарушенное диастолическое наполнение), систолическую дисфункцию (такую как систолическая сердечная недостаточность), аритмию, ишемию, гипертрофическую кардиомиопатию, внезапную сердечную смерть, фиброз миокарда и сосудов, нарушенную эластичность артерий, некротические повреждения миокарда, повреждения сосудов, инфаркт миокарда, гипертрофию левого желудочка, сниженную фракцию изгнания, повреждения сердца, гипертрофию сосудистой стенки, утолщение эндотелия, фибриноидный некроз коронарных артерий, удар и тому подобное. Патологические состояния почек включают без ограничения гломерулосклероз, терминальную стадию почечной недостаточности, диабетическую нефропатию, снижение почечного кровотока, увеличение фракции клубочковой фильтрации, протеинурию, снижение скорости клубочковой фильтрации,снижение клиренса креатинина, микроальбуминурию, артериопатию почек, ишемические повреждения,тромботические повреждения, фибриноидный некроз клубочков, очаговый тромбоз клубочковых капилляров, набухание и пролиферацию интракапиллярных (эндотелиальных и мезангиальных) и/или экстракапиллярных клеток (полулуния), разрастание ретикулярного мезангиального матрикса со значительной гиперклеточностью или без нее, злокачественный нефросклероз (такой как ишемическая ретракция,тромбонекроз капиллярных клубочков, фибриноидный некроз артерий и тромботические микроангиопатические повреждения с повреждением клубочков и микрососудов) и тому подобное. Патологические состояния печени включают без ограничения цирроз печени, асцит печени, застой в печени и тому подобное. Патологические состояния сосудов включают без ограничения тромботическое заболевание сосудов (такое как внутристеночный фибриноидный некроз, экстравазация и фрагментация эритроцитов и люминальный и/или интрамуральный тромбоз), пролиферативную артериопатию (такую как набухшие миоинтимальные клетки, окруженные муцинозным внеклеточным матриксом, и нодулярное утолщение),атеросклероз, снижение пластичности сосудов (такое как ригидность, сниженная желудочковая эластичность и сниженная эластичность сосудов), эндотелиальная дисфункция и тому подобное. Воспалительные состояния включают без ограничения артрит (например, остеоартрит), воспалительные заболевания дыхательных путей (например, хроническое обструктивное заболевание легких(COPD и тому подобное. Боль включает без ограничения острую боль, хроническую боль (например, артралгия) и тому подобное. Отек включает без ограничения отек периферических тканей, застой в печени, застой в селезенке,асцит печени, застой в дыхательных путях или легких и тому подобное. Инсулинопатии включают без ограничения резистентность к инсулину, сахарный диабет I типа, сахарный диабет II типа, чувствительность к глюкозе, предиабетическое состояние, синдром X и тому подобное. В одном варианте осуществления патологическое состояние выбирают из группы, состоящей из состояний сердечно-сосудистой системы, состояний почек и состояний печени. В другом варианте осуществления патологическое состояние представляет собой состояние сердечно-сосудистой системы. В другом варианте осуществления состояние представляет собой патологическое состояние сердечно-сосудистой системы, выбранное из группы, состоящей из гипертензии, сердечной недостаточности (в частности сердечной недостаточности после инфаркта миокарда), гипертрофии левого желудочка и уда- 12016370 ра. В другом варианте осуществления патологическое состояние представляет собой гипертензию. В другом варианте осуществления патологическое состояние представляет собой сердечную недостаточность. В другом варианте осуществления патологическое состояние представляет собой гипертрофию левого желудочка. В другом варианте осуществления патологическое состояние представляет собой удар. В другом варианте осуществления патологическое состояние представляет собой патологическое состояние почек. В другом варианте осуществления патологическое состояние представляет собой нефропатию. В другом варианте осуществления патологическое состояние представляет собой сахарный диабетII типа. 2. Субъекты. Субъекты, подходящие для лечения в соответствии с настоящим изобретением, включают млекопитающих. Млекопитающие в соответствии с настоящим изобретением включают без ограничения собак,кошек, жвачных, коз, лошадей, овец, свиней, грызунов, зайцеобразных, приматов и тому подобное и охватывают млекопитающих в утробе. В одном варианте осуществления подходящими субъектами являются люди. Люди могут быть любого пола и на любой стадии развития. 3. Введение и дозировки. Соединения по настоящему изобретению, как правило, вводят в терапевтически эффективном количестве. В одном варианте осуществления соединения по настоящему изобретению вводят в количестве, антагонистически действующем на минералокортикоидные рецепторы. Соединения по настоящему изобретению могут быть введены любым подходящим путем в форме фармацевтической композиции, адаптированной с учетом такого пути введения, и в дозе, эффективной для намеченного лечения. Терапевтически эффективные дозы соединений по настоящему изобретению,требуемые для профилактики, подавления развития или лечения заболевания, легко определяются специалистом в данной области техники с использованием доклинических и клинических подходов, хорошо известных в области медицины. Схема введения лекарственного средства для соединений и/или содержащих соединения композиций основывается на целом ряде факторов, включая тип, возраст, массу, пол и заболевание пациента; тяжесть состояния; путь введения и активность конкретно используемого соединения. Таким образом,схема введения лекарственного средства может варьировать в зависимости от конкретной ситуации. Для лечения упомянутых выше состояний применимы дозировки приблизительно от 0,001 мг приблизительно до 100 мг соединения по настоящему изобретению на 1 кг массы тела в сутки. В одном варианте осуществления общая суточная доза соединения по настоящему изобретению (введенная однократно или поделенная на дробные дозы) обычно составляет приблизительно от 0,001 мг/кг приблизительно до 20 мг/кг (т.е. мг соединения/кг массы тела). В другом варианте осуществления общая суточная доза соединения по настоящему изобретению составляет приблизительно от 0,005 мг/кг приблизительно до 10 мг/кг. В другом варианте осуществления общая суточная доза составляет приблизительно от 0,005 мг/кг приблизительно до 5 мг/кг. В другом варианте осуществления общая суточная доза составляет приблизительно от 0,01 мг/кг приблизительно до 1 мг/кг. В другом варианте осуществления общая суточная доза составляет приблизительно от 0,8 мг/кг приблизительно до 15 мг/кг. В другом варианте осуществления общая суточная доза составляет приблизительно от 0,2 мг/кг приблизительно до 4 мг/кг. Указанные дозировки приведены для среднего человека с массой приблизительно от 65 кг приблизительно до 75 кг. Врач легко сможет определить дозировки для субъектов, чья масса выходит за границы указанного диапазона, таких как дети. Для достижения желаемой суточной дозы введение соединения по настоящему изобретению может повторяться много раз в сутки (обычно не более 4 раз). Для удобства соединения по настоящему изобретению могут вводиться в виде единичной дозированной формы. При желании, для увеличения общей суточной дозы может использоваться многократный прием в течение суток единичной дозированной формы. Единичная дозированная форма, например, может представлять собой таблетку или капсулу, содержащую приблизительно 0,01, 0,05, 0,1, 0,5, 1, 5, 10,15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 250 или 500 мг соединения по настоящему изобретению. В одном варианте осуществления единичная дозированная форма содержит приблизительно от 0,01 мг приблизительно до 500 мг соединения по настоящему изобретению. В другом варианте осуществления единичная дозированная форма содержит приблизительно от 0,05 мг приблизительно до 250 мг соединения по настоящему изобретению. В другом варианте осуществления единичная дозированная форма содержит приблизительно от 0,1 мг приблизительно до 200 мг соединения по настоящему изобретению. В другом варианте осуществления единичная дозированная форма содержит приблизительно от 0,5 мг приблизительно до 150 мг соединения по настоящему изобретению.H. Применение при получении лекарственного средства. Настоящее изобретение также относится к применению соединения формул (I) или (II) в качестве лекарственного средства (такого как таблетка, содержащая единичную дозу, или капсула, содержащая- 13016370 единичную дозу). В другом варианте осуществления настоящее изобретение относится к применению соединения формул (I) или (II) для производства лекарственного средства (такого как таблетка, содержащая единичную дозу, или капсула, содержащая единичную дозу) для лечения одного или нескольких из состояний,ранее указанных в расположенных выше разделах, посвященных способам лечения. В одном варианте осуществления состояние представляет собой гипертензию. В другом варианте осуществления состояние представляет собой сердечную недостаточность.I. Фармацевтические композиции. Для лечения указанных выше состояний соединения формул (I) или (II) могут быть введены как соединение в чистом виде. В качестве альтернативы фармацевтически приемлемые соли подходят для медицинских применений вследствие их лучшей растворимости в воде по сравнению с исходным соединением. Кроме того, соединения по настоящему изобретению могут быть введены в форме фармацевтической композиции, содержащей соединение формул (I) или (II) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Носитель может быть твердым, жидким или и тот и другой, и может быть включен в состав с соединением в виде композиции для единичного дозирования, например, таблетки, которая может содержать от 0,05 до 95 мас.% активных соединений. Также могут присутствовать другие фармакологически активные вещества. Активные соединения по настоящему изобретению могут быть введены любым подходящим путем,причем типовая форма фармацевтической композиции адаптирована с учетом введения таким путем, и в дозе, эффективной для намеченного лечения. Активные соединения и композиции, например, могут быть введены перорально, ректально, парентерально или местно. Пероральное введение твердой дозированной формы может осуществляться, например, путем введения дискретных элементов, таких как капсул в твердой или мягкой оболочке, пилюль, облаток, пастилок или таблеток, каждая из которых содержит заранее определенное количество по крайней мере одного соединения по настоящему изобретению. В другом варианте осуществления пероральное введение может осуществлять путем введения порошковых или гранулированных форм. В другом варианте осуществления пероральная дозированная форма является подъязычной, такой как, например, пастилка. В таких твердых дозированных формах соединения формул (I) или (II) обычно объединены с одним или несколькими адъювантами. В случае капсул, таблеток и пилюль дозированные формы могут также содержать буферные вещества или могут быть получены с использованием энтеросолюбильных покрытий. В другом варианте осуществления пероральное введение может осуществляться в виде жидкой дозированной формы. Жидкие дозированные формы для перорального введения включают, например,фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители, обычно используемые в данной области техники (например, воду). Такие композиции также могут содержать адъюванты, такие как смачивающие средства, эмульгаторы, суспендирующие средства, вкусовые добавки (например, подсластители) и/или ароматизаторы. В другом варианте осуществления настоящее изобретение относится к парентеральной дозированной форме. "Парентеральное введение" включает, например, подкожные инъекции, внутривенные инъекции, интраперитонеальное введение, внутримышечные инъекции, интрастернальные инъекции и инфузии. Инъецируемые препараты (например, стерильные инъецируемые водные или масляные суспензии) могут быть получены в соответствии с уровнем техники с использованием подходящих диспергирующих, смачивающих и/или суспендирующих средств. В другом варианте осуществления настоящее изобретение относится к местной дозированной форме. В еще одном варианте осуществления настоящее изобретение относится к дозированной форме для интраназального введения или введения путем ингаляции. В еще одном варианте осуществления настоящее изобретение относится к ректальной дозированной форме. Также могут использоваться другие носители и способы введения, известные в области фармации. Фармацевтические композиции по настоящему изобретению могут быть получены по любой из хорошо известных в области фармации методик, таких как эффективные методики получения составов и введения. Представленные выше соображения касаемо эффективных составов и методик введения хорошо известны в данной области техники и описаны в стандартных учебниках. Получение лекарственной формы рассматривается, например, в Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania, 1975; Liberman, et al., Eds., Pharmaceutical Dosage Forms, Marcel Decker, NewJ. Комбинации и комбинированная терапия. Соединения по настоящему изобретению могут быть применимы, по отдельности или в комбинации с другими фармацевтически активными соединениями, для лечения патологических состояний, таких как описанные выше. Соединение (соединения) по настоящему изобретению и другое фармацевтически активное соединение (соединения) могут быть введены одновременно (в одной и той же дозированной форме и раздельных дозированных формах) или последовательно. Соответственно в одном варианте осуществления настоящее изобретение относится к способам лечения патологического состояния- 14016370 путем введения субъекту фармацевтически эффективного количества одного или нескольких соединений формул (I) или (II) и одного или нескольких дополнительных фармацевтически активных соединений. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции,содержащей одно или несколько соединений формул (I) или (II), одно или несколько дополнительных фармацевтически активных соединений и фармацевтически приемлемый носитель. В одном варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с одним или несколькими диуретиками. Примеры подходящих диуретиков включают: (a) петлевые диуретики, такие как фуросемид (такой как LASIX), торсемид (такой какDEMADEX), беметанид (такой как BUMEX) и этакриновая кислота (такой как EDECRIN); (b) тиазидные диуретики, такие как хлортиазид (такой как DIURIL, ESIDRIX или HYDRODIURIL), гидрохлортиазид (такой как MICROZIDE или ORETIC), бентиазид, гидрофлуметиазид (такой какSALURON), бендрофлуметиазид, метилхлортиазид, политазид, трихлорметиазид и индапамид (такой как LOZQL); (c) фталимидиновые диуретики, такие как хлорталидон (такой как HYGROTON) и метолазон (такой как ZAROXOLYN); (d) хиназолиновые диуретики, такие как хинетазон; и (e) калийсберегающие диуретики, такие как триамтерен (такой как DYRENIUM) и амилорид (такой какMIDAMOR или MODURETIC). Предпочтительно совместно вводимый диуретик (диуретики) представляют собой калийвыводящие диуретики. Калийвыводящие диуретики представляют собой диуретики, которые могут вызывать усиление секреции калия, что может приводить к пониженному содержанию калия, включая снижение содержания калия в сыворотке крови. Примеры калийвыводящих диуретиков включают без ограничения петлевые диуретики, такие как фуросемид и торсемид; тиазидные диуретики,такие как хлортиазид и гидрохлортиазид; и фталимидные диуретики, такие как хлорталидон. В другом варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с петлевым диуретиком. В еще одном варианте осуществления петлевой диуретик выбирают из фуросемида и торсемида. В еще одном варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с фуросемидом. В еще одном варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с торсемидом. В другом варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с тиазидным диуретиком. В еще одном варианте осуществления тиазидный диуретик выбирают из группы, состоящей из хлортиазида и гидрохлортиазида. В еще одном варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с хлортиазидом. В еще одном варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с гидрохлортиазидом. В другом варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с фталимидиновым диуретиком. В еще одном варианте осуществления фталимидиновый диуретик представляет собой хлорталидон. В другом варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с одним или несколькими ингибиторами ангиотензин-превращающего фермента. Примеры подходящих ингибиторов ангиотензин-превращающего фермента включают квинаприл (такой как ACCUPRIL), периндоприл (такой как ACEON), каптоприл (такой как CAPOTEN), эналаприл(такой как VASOTEC), ENALAPRILAT, рамиприл (такой как ALTACE), цилазаприл, делаприл,фозиноприл (такой как MONOPRIL), зофеноприл, индолаприл, беназеприл (такой как LOTENSIN),лизиноприл (такой как PRINIVIL и ZESTRIL), спираприл, трандолаприл (такой как MAVIK), периндеп, пентоприл, моэксиприл (такой как UNIVASC), фазидотрил, S-аллимеркаптокаптоприл и пивоприл. В другом варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с одним или несколькими блокаторами рецептора ангиотензина II. Примеры подходящих блокаторов рецептора ангиотензина II включают кандесартан (такой как ATACAND), эпросартан (такой как TEVETEN), ирбесартан (такой как AVEPRO), лосартан (такой как COZAAR), олмесартан, олмесортан медоксомил (такой как BENICAR), тазосартан, телмисартан (такой какMICARDIS), валсартан (такой как DIOVAN), золасартан, FI-6828K, RNH-6270, UR-7198, Way126227, KRH-594, TAK-536, BRA-657 и TA-606. В другом варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с одним или несколькими блокаторами кальциевых каналов. Примеры подходящих блокаторов кальциевых каналов включают нифедипин (такой как ADALAT, ADALAT CC и PROCARDIA), верапамил (такой как CALAN, COVERA-HS, ISOPTIN SR и VERELAN), дилтиазем- 15016370 В другом варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с одним или несколькими -блокаторами. Примеры подходящих -блокаторов включают тимолол (такой как BLOCARDEN), картеолол (такой как CARTROL), карведилол (такой какTOPROL-XL), атенолол (такой как TENORMIN), пиндолол (такой как VISKEN), ацебутолол и бисопролол. В другом варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с одним или несколькими -блокаторами. Примеры подходящих -блокаторов включают празосин, доксазосин (такой как CARDURA), феноксибензамин (такой как DIBENZYLINE),теразосин (такой как HYTRIN), CDRI-93/478 и CR-2991. В другом варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с одним или несколькими ,-блокаторами. Примером подходящего ,-блокатора является лабеталол (такой как NORMODYNE или TRANDATE). В другом варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с одним или несколькими антагонистами рецептора альдостерона. Примеры подходящих антагонистов рецептора альдостерона включают эплеренон (такой как INSPRA) или спиронолактон (такой как ALDACTONE). В другом варианте осуществления одно или несколько соединений формул (I) или (II) могут быть введены совместно с одним или несколькими ингибиторами ренина. Примеры подходящих ингибиторов ренина включат алискирен (SPP 100), SPP-500/600 и YS-004-39.K. Наборы. Настоящее изобретение дополнительно относится к наборам, которые подходят для осуществления описанных выше способов лечения или профилактики. В одном варианте осуществления набор содержит первую дозированную форму, содержащую одно или несколько соединений по настоящему изобретению, и контейнер для дозированной формы, в количествах, достаточных для осуществления способов по настоящему изобретению. В другом варианте осуществления набор по настоящему изобретению содержит одно или несколько соединений формул (I) или (II) и диуретик. В другом варианте осуществления набор по настоящему изобретению содержит одно или несколько соединений формул (I) или (II) и ингибитор ангиотензин-превращающего фермента. В другом варианте осуществления набор по настоящему изобретению содержит одно или несколько соединений формул (I) или (II) и антагонист рецептора ангиотензина II. В другом варианте осуществления набор по настоящему изобретению содержит одно или несколько соединений формул (I) или (II) и антагонист альдостероновых рецепторов.L. Промежуточные соединения. В другом варианте осуществления настоящее изобретение относится к новым промежуточным соединениям, применимым для получения соединений формул (I) или (II). В другом варианте осуществления новые промежуточные соединения, применимые для получения соединений формул (I) или (II), выбирают из группы, состоящей из 4-гидразинил-2-метилбензонитрила гидрохлорида; 4-гидразинил-2-(трифторметил)бензонитрила гидрохлорида; 4-гидразинил-2-метоксибензонитрила гидрохлорида; 5-гидразинилпиколинонитрила дигидрохлорида; 6-гидразинил-2-метилникотинонитрила; 4-гидразинил-2-(метоксиметил)бензонитрила гидрохлорида; 2-диметиламино)метил)-4-гидразинилбензонитрила дигидрохлорида и 2-(бензилокси)-4-гидразинилбензонитрила. В другом варианте осуществления новые промежуточные соединения, применимые для получения соединений формул (I) или (II), выбирают из группы, состоящей из этил-7-(4-фторбензилиден)-8-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата; метил-6-(циклопентилметилен)-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата; метил-6-(циклобутилметилен)-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата; метил-5-оксо-6-тетрагидрофуран-3-ил)метилен)-5,6,7,8-тетрагидронафталин-2-карбоксилата; метил-5-оксо-6-тетрагидро-2H-пиран-4-ил)метилен)-5,6,7,8-тетрагидронафталин-2-карбоксилата; трет-бутил-4-6-(метоксикарбонил)-1-оксо-3,4-дигидронафталин-2(1H)илиден)метил)пиперидин-1 карбоксилата; метил-6-(5-метил-2-фурилметилен)-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата; метил-6-(циклопент-1-ен-1-илметилен)-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата; метил-6-(2-фурилметилен)-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата; метил-6-(3-фурилметилен)-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата;M. Общие схемы синтеза. Соединения по настоящему изобретению могут быть получены с использованием способов, проиллюстрированных в общих схемах синтеза, и экспериментальных методик, подробно описанных ниже. Указанные общие схемы синтеза и экспериментальные методики представлены с целью иллюстрации и не должны считаться ограничивающими. Исходные вещества, использованные для получения соединений по настоящему изобретению, являются коммерчески доступными или могут быть получены с использованием обычных способов, известных в данной области техники (таких как способы, описанные вCOMPENDIUM OF ORGANIC SYNTHETIC METHODS, vol. I-VI (издательства Wiley-Interscience) или другие стандартные справочники). Ниже на схеме 1 представлен общий способ получения пиразолиновых соединений по настоящему изобретению. Если иное не указано особо, то значения заместителей R1, R5, R6, R8 и X, представленных на схеме 1, определены в раскрытых ранее различных вариантах осуществления настоящего изобретения. Схема 1 Способ A. Получение ,-ненасыщенного кетона 2. Способ A1. Пирролидин (1,2 экв.) или другой циклический вторичный амин, такой как пиперидин, при комнатной температуре добавляют к смеси кетона 1 (1 экв.) и альдегида R1CHO (2 экв.) в спирте, таком как метанол (2 мл/ммоль кетона 1). Приблизительно через 1-6 ч смесь охлаждают приблизительно до 0C. Полученный осадок фильтруют и промывают, например, холодным спиртом, таким как метанол, с получением ,-ненасыщенного кетона 2. Способ A2. Смесь кетона 1 (1,0 экв.) и альдегида R1CHO (1,2 экв.) в концентрированной хлористо-водородной кислоте и этаноле нагревают при кипении с обратным холодильником в течение ночи. В качестве альтернативы, вместо концентрированной хлористо-водородной кислоты может быть использован 4 н. хлористый водород в диоксане. Затем дефлегмированную смесь разбавляют водой, фильтруют и сушат с получением ,-ненасыщенного кетона 2. Способ A3. Раствор кетона 1 (1 экв.) в тетрагидрофуране (приблизительно 2,5 мл/ммоль кетона 1) по каплям добавляют в атмосфере азота к 1 М раствору гексаметилдисилазида лития в тетрагидрофуране (1,05 экв.),охлажденному на бане со льдом. После завершения добавления полученную смесь перемешивают приблизительно в течение 30 мин. Раствор альдегида R1CHO (1,05 экв.) в тетрагидрофуране (приблизительно 2,5 мл/ммоль кетона 1) добавляют к смеси, которую затем оставляют нагреваться до комнатной температуры при перемешивании. Приблизительно через 2 ч смесь гасят добавлением насыщенного хлорида аммония и экстрагируют этилацетатом. Органические слои сушат над сульфатом натрия и концентрируют. Неочищенный продукт очищают по методу флэш-хроматографии на силикагеле (этилацетат/гептаны) или ВЭЖХ с обращенной фазой (ацетонитрил/вода/0,1% трифторуксусная кислота) с получением ,-ненасыщенного кетона 2. Способ B. Конденсация пиразолина. Смесь ,-ненасыщенного кетона 2 (1 ммоль), гидрохлорида гидразина (R8NHNH2) (1,2-1,5 ммоль) и абсолютного этанола (приблизительно 8 мл/ммоль ,-ненасыщенного кетона 2) барботируют аргоном и перемешивают приблизительно при 80C в течение приблизительно 4-24 ч. Смесь охлаждают до комнатной температуры и фильтруют. Полученные твердые вещества промывают этанолом с получением пиразолина 3. Ниже на схеме 2 представлена дополнительная дериватизация пиразолиновых соединений, полученных в соответствии со схемой 1. Если иное не указано особо, то значения заместителей R1, R2, R8, R50,R51, R52 и X, представленных на схеме 2, определены в раскрытых ранее различных вариантах осуществ- 17016370 ления настоящего изобретения. В качестве альтернативы пиразолины 5, 6, 7 и 8 могут быть получены с использованием в качестве исходного вещества кетона 1, содержащего желаемые заместители R5 и R6 (по мере необходимости вводя защитную группу, а затем снимая защитную группу с указанных заместителей с использованием традиционной химии защитных групп). Схема 2 Способ C. Производные пиразолиновой кислоты. К раствору сложного пиразолинового эфира 4 (1 экв.) в тетрагидрофуране (6 мл/ммоль пиразолинового эфира 4) и метаноле (2 мл/ммоль пиразолинового эфира 4) добавляют 2,5 н. гидроксид натрия (2 мл/ммоль пиразолинового эфира 4). Полученную смесь перемешивают при комнатной температуре до завершения реакции, определяемой по методу ВЭЖХ (1-24 ч). Смесь концентрируют под струей азота приблизительно до половины начального объема и подкисляют добавлением водной хлористоводородной кислоты для снижения pH до значения меньше приблизительно 4. Смесь разбавляют водой и фильтруют с получением пиразолиновой кислоты 5. Способ D. R2-замещенные пиразолины. Заместитель R2 может быть введен путем обработки сложного пиразолинового эфира 4 сильным основанием, таким как диизопропиламид лития (LDA) или гексаметилдисилазид лития (LHMDS), и алкилирующим агентом, таким как алкилгалогенид R2X. Затем алкилированный сложный пиразолиновый эфир может быть гидролизован, как описано в способе C, с получением алкилированной пиразолиновой кислоты 6. Способ E. Производные сложного пиразолинового эфира. К смеси пиразолиновой кислоты 5 (1 экв.), спирта R50OH (1,2 экв.) и 4-(диметиламино)пиридина(1,2 экв.) в безводном тетрагидрофуране (5 мл/200 мг пиразолиновой кислоты 5) под струей азота добавляют гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (1,2 экв.). Смесь перемешивают в течение ночи, обрабатывают избытком 1 н. хлористо-водородной кислоты и экстрагируют этилацетатом. Органический слой упаривают. Остаток растворяют в дихлорметане и очищают по методу хроматографии на силикагеле с этилацетатом/гептанами. Требуемые фракции объединяют и упаривают с получением сложного пиразолинового эфира 7. Если требуется замещение в R2 положении, то вместо пиразолиновой кислоты 5 может быть использована пиразолиновая кислота 6. Способ F. Производные пиразолинового амида. К раствору пиразолиновой кислоты 5 (1 ммоль) в 5 мл безводного диметилформамида в атмосфере азота при комнатной температуре добавляют гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3 тетраметилурония (1,1 ммоль), а затем N,N-диизопропилэтиламин (1,5 ммоль). Смесь перемешивают в течение приблизительно 5 мин и добавляют амин NHR51R52 (1,5 ммоль). Смесь дополнительно перемешивают в течение 1 ч. Затем смесь фильтруют и очищают по методу ВЭЖХ с обращенной фазой (ацетонитрил/вода/0,1% трифторуксусная кислота). Фракции, содержащие чистый продукт, объединяют и лиофилизируют с получением пиразолинового амида 8. Если требуется замещение в R2-положении, то вместо пиразолиновой кислоты 5 может быть использована пиразолиновая кислота 6. Способ G. Хиральное разделение. Пиразолиновые соединения по настоящему изобретению (включая исходные вещества) могут содержать один или несколько хиральных центров. Если в результате синтеза соединение получают в виде смеси энантиомеров и диастереоизомеров, то желаемый энантиомер или диастереоизомер (или желаемую насыщенную энантиомером смесь или насыщенную диастереоизомером смесь) может быть получен с использованием традиционных способов хирального разделения. Традиционные способы, которые могут быть использованы, включают хроматографию (такую как ВЭЖХ) или сверхкритическую жидкостную хроматографию на асимметрической смоле. Примеры подходящих смол включают без ограниченияChiralcel OJ-H, Chiralpak AD-H, Chiralpak IA и Chiralpak AS-H. Путем концентрирования элюата получают обогащенную смесь. Насыщенный стереоизомером пиразолин может быть дополнительно дериватизован, как отражено на схеме 2, способом, аналогичным описанному для пиразолинов 4, 5 и 6. Ниже на схемах 3a, 3b и 3c представлено несколько альтернативных схем синтеза, которые могут быть использованы для синтеза гидразина R8NHNH2, используемого в схеме 1. Если иное не указано особо, то значения заместителей R81, R82, R84 и R85, представленных в схеме 1, определены в раскрытых- 18016370 ранее различных вариантах осуществления настоящего изобретения и Ar представляет собой арил или гетероарил. Схема 3a Способ H. Получение из галогенированного арилнитрила. Раствор пара-галогензамещенного арилнитрила/гетероарилнитрила нагревают при кипении с обратным холодильником с избытком моногидрата гидразина в спирте, таком как этанол. После завершения реакции смесь разбавляют водой и фильтруют. Затем арилгидразин/гетероарилгидразин может быть преобразован до гидрохлорида путем обработки эквивалентом безводного хлористого водорода в диэтиловом эфире. Полученный гидрохлорид гидразина выделяют путем фильтрации. Способ I. Получение из анилина. Ариланилины или гетероариланилины могут быть преобразованы до соответствующего арилгидразина или гетероарилгидразина путем диазотирования и последующего восстановления. Соответственно ледяную смесь анилина в сильной водной кислоте, такой как концентрированная хлористо-водородная кислота или водная серная кислота, обрабатывают нитритом натрия (обычно 1-1,1 экв.). Через небольшой период времени, обычно через 15-60 мин, полученную смесь добавляют к ледяной суспензии избытка хлорида олова в сильной водной кислоте, такой как концентрированная хлористо-водородная кислота или водная серная кислота. Затем смесь оставляют нагреваться до комнатной температуры в течение нескольких часов. Затем смесь нейтрализуют водным основанием и экстрагируют подходящим органическим растворителем, таким как этилацетат, с выделением арилгидразида/гетероарилгидразида. Затем арилгидразид/гетероарилгидразид может быть преобразован до гидрохлорида путем обработки эквивалентом безводного хлористого водорода в диэтиловом эфире. Полученный гидрохлорид гидразина выделяют путем фильтрации. Способы J и K. Получение из арилгалогенидов. Арилгидразины и гетероарилгидразины могут быть получены путем сочетания арилгалогенида/гетероарилгалогенида с гидразоном бензофенона в присутствии палладиевого катализатора, фосфинового лиганда и основания (Mauger and Mignani (2005) Advanced Synthesis and Catalysis 347(6), 773-782;(1999) 121(44) 10251-10263 (способ J). Продукт сочетания затем гидролизуют путем нагревания при кипении с обратным холодильником в водной кислоте и органическом сорастворителе, таком как тетрагидрофуран, с получением арилгидразина/гетероарилгидразина (способ K). Ниже на схеме 4 представлена схема синтеза, которая может быть использована для получения кетона 11 (т.е. кетона 1, где R5 представляет собой метоксикарбонил и R6 представляет собой водород) для использования в качестве реагента в схеме 1. Схема 4 Способы L и M. Получение тетралона 11. Способом, сходным с описанным Gerlach и Wollmann в Tetrahedron Letters (1992), 33(38), 5499-5502,кетон 11 может быть получен из фенолового кетона 9 путем введения трифлатной группы путем обработки трифторметансульфоновым ангидридом и пиридином в подходящем органическом растворителе,таком как хлористый метилен и гептан, с последующим катализируемым палладием карбонилированием с окисью углерода в диметилформамиде и метаноле.- 19016370 Синтез других кетонов, применимых для получения описанных в схеме 1 пиразолинов, описан в литературе (например, смотри Reiter et al., Bioorganic and Medicinal Chemistry Letters, 7, 2307-2312; Koch(1985), 50(24), 4933-4938). Такие кетоны могут быть дополнительно дериватизованы путем использования обычных способов, используемых в данной области техники (таких как способы, раскрытые в COMPENDIUM OF ORGANIC SYNTHETIC METHODS, vol. I-VI (издательства Wiley-Interscience) или других стандартных справочниках). Ниже на схеме 5 представлена схема синтеза, которая может быть использована для получения пиразолиновой кислоты 14 (т.е. пиразолиновой кислоты 5a, где X представляет собой углерод, а положениеR5 карбоксизаместителя указано), которая может быть дополнительно дериватизована, как показано в схеме 2. Схема 5 Способ N. Конденсация пиразолина. Пиразолин 13a может быть получен путем конденсации R8NHNH2 с ,-ненасыщенным кетоном 12(полученным, как описано в схеме 1, способ A1) в нагреваемом при кипении с обратным холодильником спирте, таком как метанол или этанол, и с 1-2 экв. 4 н. хлористого водорода в диоксане или другим подходящим источником хлористого водорода. Через 4-24 ч реакционную смесь охлаждают и выделяют сложный пиразолиновый эфир 13a путем фильтрации. Способ O. Хиральное разделение. Стереоизомернообогащенные сложные пиразолиновые эфиры 13b, как правило, могут быть получены с использованием хроматографии, такой как ВЭЖХ, на асимметрической смоле с подвижной фазой, содержащей углеводород или галогенированный углеводород, такой как гептан, гексан или дихлорметан, и дополнительно содержащей сорастворитель, такой как изопропанол (приблизительно от 0 приблизительно до 50 об.%, типично приблизительно от 2 приблизительно до 20 об.%), и алкиламин (например, от 0 до 5 об.%, типично 0,1 об.% диэтиламина). Стереоизомернообогащенные соединения, как правило, могут быть также получены с использованием сверхкритической жидкостной хроматографии(SFC) на асимметрической смоле с подвижной фазой, содержащей спирт (приблизительно от 30 приблизительно до 60 об.%, типично приблизительно 50 об.%) и диоксид углерода. Примеры применимых смол включают без ограничения Chiralcel OJ-H, Chiralpak AD-H, Chiralpak IA и Chiralpak AS-H. Путем концентрирования элюата получают стереоизомернообогащенную смесь 13b. Способ P. Гидролиз. Смесь сложного пиразолинового эфира 13b в подходящем органическом растворителе, таком как тетрагидрофуран, в инертной атмосфере обрабатывают триметилсиланоатом натрия (обычно 1-3 экв.). Взаимодействие осуществляют при температуре от комнатной температуры до 50C. Смесь 2-хлор-4-фторбензонитрила (20,0 г, 129 ммоль), моногидрата гидразина (9,4 мл, 193 ммоль) и этанола (80 мл) нагревали при кипении с обратным холодильником в течение 4 ч (способ H и схема 3a).- 20016370 Смесь разбавляли водой (200 мл). Осадок фильтровали, промывали водой и сушили с получением не совсем белого твердого вещества (16,8 г). Твердое вещество суспендировали в диэтиловом эфире (400 мл) и обрабатывали 2 н. хлористым водородом/эфиром (50 мл, 100 ммоль). Осадок фильтровали, промывали диэтиловым эфиром и сушили с получением гидрохлорида 2-хлор-4-гидразинилбензонитрила в виде белого твердого вещества (16,3 г, 79,9 ммоль, выход 62%). 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 9,63 Смесь 4-фтор-2-метилбензонитрила (20,4 г, 151 ммоль), моногидрата гидразина (14,6 мл, 302 ммоль) и этанола (80 мл) нагревали при кипении с обратным холодильником в течение 48 ч (способ H и схема 3a). Смесь разбавляли водой (200 мл). Осадок фильтровали, промывали водой и сушили с получением не совсем белого твердого вещества (16,1 г). Твердое вещество суспендировали в диэтиловом эфире (400 мл) и обрабатывали 2 н. хлористым водородом/эфиром (55 мл, 110 ммоль). Осадок фильтровали,промывали диэтиловым эфиром и сушили с получением гидрохлорида 4-гидразинил-2 метилбензонитрила в виде белого твердого вещества (15,6 г, 85,0 ммоль, выход 56%). 1H-ЯМР (400 МГц,ДМСО-d6)м.д. 8,42 (ушир.с, 1H), 8,33 (ушир.с, 3H), 7,51 (д, J=8,6 Гц, 1H), 6,81 (д, J=1,9 Гц, 1H), 6,74 Указанное в заголовке соединение получали в соответствии с методикой подготовительного примера 1 из 4-фтор-2-(трифторметил)бензонитрила (1,89 г, 10 ммоль) вместо 2-хлор-4-фторбензонитрила при 80C с получением не совсем белого твердого вещества (1,89 г, 8,0 ммоль, выход 80%). MC (ЭР) m/z 202 Указанное в заголовке соединение получали в соответствии с методикой подготовительного примера 1 из 4-фтор-2-метоксибензонитрила (4,97 г, 32,9 ммоль) вместо 2-хлор-4-фторбензонитрила, нагревая при кипении с обратным холодильником в течение ночи с получением гидрохлорида 4-гидразинил-2 метоксибензонитрила (3,54 г, 17,8 ммоль, выход 54%). 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 3,82 (с, 3H),6,44 (дд, J=8,46, 2,01 Гц, 1H), 6,64 (д, J=2,15 Гц, 1H), 7,41 (д, J=8,32 Гц, 1H), 7,99 (с, 2H), 8,40 (с, 1H). MC(20 мл) при 0C медленно добавляли нитрит натрия (590 мг, 9,2 ммоль) в воде (3 мл), поддерживая температуру ниже 10C. Этот раствор перемешивали на бане со льдом в течение 30 мин, а затем медленно обрабатывали ледяным раствором дигидрата хлорида олова(II) (5,7 г, 25,2 ммоль) в 20% хлористоводородной кислоте (20 мл), поддерживая температуру ниже 10C. Раствор перемешивали при 0C в течение 15 мин и нагревали до комнатной температуры в течение 30 мин. Реакционную смесь нейтрализовывали добавлением гидроксида аммония и отфильтровывали полученные соли олова. Фильтрат трижды экстрагировали этилацетатом, сушили над сульфатом магния, фильтровали и упаривали. Полученный твердый остаток растворяли в этилацетате и тетрагидрофуране и обрабатывали 4 н. хлористым водородом в диоксане (приблизительно 3 мл). Смесь упаривали, полученное твердое вещество растирали с диэтиловым эфиром и сушили в высоком вакууме в течение ночи с получением смеси (2/1) дигидрохлорида 5-гидразинилпиколинонитрила и исходного вещества (875 мг). MC (ЭР) m/z 135 (M+H). Подготовительный пример 6. 6-Гидразинил-2-метилникотинонитрил К суспензии 6-хлор-2-метилникотинонитрила (6,2 ммоль) в 6,2 мл этанола добавляли моногидрат гидразина (9,3 ммоль). Затем полученную смесь нагревали до 80C в течение ночи. Смесь охлаждали до комнатной температуры и добавляли 2 мл воды. Смесь снова нагревали до 80C до получения прозрачного раствора, а затем оставляли охлаждаться до комнатной температуры, и в заключении на бане со льдом. Твердое вещество собирали путем фильтрации, промывали холодным 50% этанолом и сушили в вакууме с получением 550 мг желаемого твердого продукта. 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 2,41 (с,3H), 4,41 (с, 2H), 6,60 (ушир.с, 1H), 7,66 (д, J=8,59 Гц, 1H), 8,47 (с, 1H). MC (ЭР) m/z 149 (M+H). Подготовительный пример 7. 2-(Бромметил)-4-фторбензонитрил Раствор 2-метил-4-фторбензонитрила(3,5 г, 25,9 ммоль) в 40 мл тетрахлорида углерода обрабатывали N-бромсукцинимидом(4,6 г, 25,9 ммоль) и бензоильным пероксидом (157 мг, 0,65 ммоль). Смесь нагревали при кипении с обратным холодильником в течение 3 ч, охлаждали до комнатной температуры и оставляли перемешиваться в течение ночи. Твердые вещества отфильтровывали и промывали тетрахлоридом углерода. Фильтрат конденсировали и очищали по методу колоночной флэш-хроматографии с прямой фазой на колонке с 50 г силикагеля (градиент 550% этилацетат/гексаны). Разделялись два пика. Было определено, что элюируемый вторым пик представлял собой желаемый продукт. Чистые фракции этого пика собирали и концентрировали в вакууме с получением 2-(бромметил)-4-фторбензонитрила (1,35 г, 0,63 ммоль, выход 25%) в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 4,79 (с, 2H), 7,44 (дт, J=8,59, 2,69 Гц, 1H), 7,68 (дд, J=9,53,2,55 Гц, 1H), 8,01 (дд, J=8,59, 5,64 Гц, 1H). Подготовительный пример 8. 4-Фтор-2-(метоксиметил)бензонитрил Раствор 2-(бромметил)-4-фторбензонитрила (501 мг, 2,3 ммоль) в метаноле (5 мл) обрабатывали метоксидом натрия (5,6 мл 0,5 М раствора в метаноле, 2,81 ммоль) и перемешивали в течение 1 ч при комнатной температуре, затем нагревали до 55C в течение 2 ч. Смесь охлаждали до комнатной температуры, конденсировали досуха и сразу очищали по методу колоночной флэш-хроматографии с прямой фазой на колонке с 20 г силикагеля (градиент 5-60% этилацетат/гексаны). Чистые фракции собирали и концентрировали в вакууме с получением 4-фтор-2-(метоксиметил)бензонитрила (110 мг, 0,66 ммоль, выход 28%) в виде масла. 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 7,97 (дд, J=8,46, 5,50 Гц, 1H), 7,46 (дд, J=9,53,2,55 Гц, 1H), 7,39 (тд, J=8,59, 2,69 Гц, 1H), 4,58 (с, 2H), 3,37 (с, 3H). Подготовительный пример 9. Гидрохлорид 4-гидразинил-2-(метоксиметил)бензонитрила Смесь 4-фтор-2-(метоксиметил)бензонитрил (110 мг, 0,67 ммоль), моногидрата гидразина (133 мг,0,13 мл, 2,6 ммоль) и этанола (5 мл) нагревали при кипении с обратным холодильником в течение ночи. Смесь охлаждали до комнатной температуры и конденсировали. Остаток растворяли в метаноле и обрабатывали 2,0 н. хлористым водородом в диэтиловом эфире. Растворитель удаляли и сушили твердое вещество с получением гидрохлорида 4-гидразинил-2-(метоксиметил)бензонитрила в виде не совсем белого твердого вещества. Подготовительный пример 10. 2-Диметиламино)метил)-4-фторбензонитрил Смесь 2-(бромметил)-4-фторбензонитрила (423 мг, 1,9 ммоль) и 2,0 М диметиламина (4 мл) перемешивали при комнатной температуре в течение 30 мин. Затем смесь концентрировали, очищали по методу колоночной флэш-хроматографии с прямой фазой на колонке с 20 г силикагеля (градиент 5-45% этилацетат/гексаны) и концентрировали в вакууме с получением 2-диметиламино)метил)-4 фторбензонитрила (241 мг, 1,35 ммоль, 68%). 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 7,92 (дд, J=8,59, 5,37 Гц, 1H), 7,42 (дд, J=9,94, 2,69 Гц, 1H), 7,35 (тд, J=8,46, 2,69 Гц, 1H), 3,56 (с, 2H), 2,19 (с, 6H). Подготовительный пример 11. Дигидрохлорид 2-диметиламино)метил)-4-гидразинилбензонитрила(101 мг, 0,10 мл, 2,0 ммоль) и этанола (5 мл) нагревали в течение ночи при 90C. Смесь охлаждали до комнатной температуры и концентрировали досуха. Остаток растворяли в диэтиловом эфире и обрабатывали 2,0 М хлористым водородом в диэтиловом эфире. Полученное твердое вещество фильтровали и сушили с получением дигидрохлорида 2-диметиламино)метил)-4-гидразинилбензонитрила (430 мг, 1,63 ммоль, выход 100%). 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 9,26 (с, 1H), 7,80 (д, J=8,59 Гц, 1H), 7,36 (д,J=2,15 Гц, 1H), 7,08 (дд, J=8,59, 2,15 Гц, 1H), 4,35 (с, 2H), 2,78 (с, 6H). MC (ЭР) m/z 191 (M+H). Подготовительный пример 12. 2-(Бензилокси)-4-фторбензонитрил К перемешанной суспензии гидрида натрия (1,15 г, 28,7 ммоль) в толуоле (50 мл) при комнатной температуре медленно добавляли бензиловый спирт (3,25 г, 30 ммоль). Смесь перемешивали в течение 30 мин, затем одной порцией добавляли 2,4-дифторбензонитрил и продолжали перемешивание в течение ночи. Смесь гасили добавлением воды, трижды экстрагировали этилацетатом, промывали солевым раствором, сушили над сульфатом магния, фильтровали и конденсировали. Неочищенный продукт растворяли в горячем этилацетате и растирали с гексанами с получением 2-(бензилокси)-4-фторбензонитрила(5,4 г, 23,8 ммоль, выход 88%) в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 5,30 Раствор 2-(бензилокси)-4-фторбензонитрила (4,8 г, 21 ммоль) в этаноле (80 мл) обрабатывали моногидратом гидразина (2,6 г, 2,5 мл, 53 ммоль) и нагревали при кипении с обратным холодильником в течение 3 суток. Смесь охлаждали до комнатной температуры и концентрировали. Добавляли воду, трижды экстрагировали остаток этилацетатом, сушили над сульфатом магния, фильтровали и концентрировали с получением 2-(бензилокси)-4-гидразинилбензонитрила (3,8 г, 15,8 ммоль, выход 75%) в виде не совсем белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 4,27 (с, 2H), 5,16 (с, 2H), 6,36 (дд,J=8,73, 1,75 Гц, 1H), 6,61 (д, J=1,61 Гц, 1H), 7,30 (д, J=8,59 Гц, 1H), 7,32-7,51 (м, 5H), 7,78 (с, 1H). MC К раствору перйодата натрия (28,3 г, 0,13 моль) в воде (250 мл) добавляли раствор 1,2 циклогександиола (12,0 г, 0,10 моль) в этиловом эфире (150 мл). Раствор перемешивали в течение 30 мин при температуре окружающей среды. К этому раствору добавляли 20% водный гидроксид калия (40 мл) и перемешивали раствор в течение 1 ч. Слои разделяли, органический слой промывали водой и солевым раствором, сушили над сульфатом магния. Путем концентрирования в вакууме получали циклопент-1 енкарбальдегид в виде желтого масла (6,0 г, выход 62%). ВЭЖХ с обращенной фазой на C-18 колонке 4,650 мм, tR=0,825 мин (10-90% ацетонитрил/вода в течение 4 мин при скорости 4 мл/мин с детектированием при 254 нм при 20C); 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 1,83-1,93 (м, 2H), 2,36 (тд, J=7,65, 2,15 Гц, 2H), 2,50-2,59 (м, 2H), 7,01-7,08 (м, 1H), 9,73 (с, 1H). Подготовительный пример 15. Метил-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилатMolecular) в 4 н. хлористо-водородной кислоте в метаноле нагревали при кипении с обратным холодильником в течение 18 ч. Раствор охлаждали до температуры окружающей среды и концентрировали в вакууме. Остаток разбавляли этилацетатом и промывали насыщенным раствором бикарбоната натрия и насыщенным хлоридом натрия и сушили над сульфатом магния. Путем фильтрации, а затем концентрирования в вакууме получали метил-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилат в виде коричневого твердого вещества (4,76 г, выход 86%). ВЭЖХ с обращенной фазой на С-18 колонке 4,650 мм, tR=1,90 мин (10-90% ацетонитрил/вода в течение 4 мин при скорости 4 мл/мин с детектированием при 254 нм при 20C); 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 1,99-2,08 (м, 2H), 2,58-2,66 (м, 2H), 2,99 (т, J=6,04 Гц, 2H),3,85 (с, 3H), 7,83-7,87 (м, 1H), 7,91 (д, J=0,81 Гц, 1H), 7,92-7,97 (м, 1H). Подготовительный пример 16. Этил-6-(4-фторбензилиден)-5-оксо-5,6,7,8-тетрагидронафталин-2 карбоксилат Указанное в заголовке соединение получали в соответствии со способом A2. Неочищенный осадок представлял собой смесь этил-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата, этил-6-(4-фторбензилиден)-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата и 6-(4-фторбензилиден)-5-оксо-5,6,7,8 тетрагидронафталин-2-карбоновой кислоты. Смесь объединяли с 4-фторбензальдегидом (0,5 мл), этанолом (40 мл) и 4 н. хлористым водородом/диоксаном (10 мл) и нагревали при кипении с обратным холодильником в течение 20 ч. Раствор вливали в 200 мл воды, фильтровали и сушили с получением этил-6(4-фторбензилиден)-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата в виде не совсем белого твердого вещества (826 мг, 2,55 ммоль, выход 49%). 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 1,33 (т, J=7,12 Гц, 3H),3,06 (м, 4H), 4,34 (кв, J=6,98 Гц, 2H), 7,31 (т, J=8,86 Гц, 2H), 7,62 (дд, J=8,59, 5,64 Гц, 2H), 7,74 (с, 1H),7,94 (м, 2H), 8,06 (д, J=8,59 Гц, 1H). MC (ЭР) m/z 325 (M+H). Подготовительный пример 17. Этил-7-(4-фторбензилиден)-8-оксо-5,6,7,8-тетрагидронафталин-2 карбоксилат Указанное в заголовке соединение получали в соответствии со способом A2 из 8-оксо-5,6,7,8 тетрагидронафталин-2-карбоновой кислоты и 4-фторбензальдегида в виде не совсем белого твердого вещества (выход 64%). 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 1,34 (т, J=7,12 Гц, 3H), 3,05 (м, 4H), 4,34 (кв,J=7,25 Гц, 2H), 7,30 (м, 2H), 7,54 (д, J=7,79 Гц, 1H), 7,61 (м, 2H), 7,74 (с, 1H), 8,10 (дд, J=7,92, 2,01 Гц,1H), 8,49 (д, J=1,88 Гц, 1H). MC (ЭР) m/z 325 (M+H). Подготовительный пример 18. Метил-6-(циклопентилметилен)-5-оксо-5,6,7,8-тетрагидронафталин 2-карбоксилат(30 мл) добавляли циклопентанкарбоксальдегид (3,3 г, 33,3 ммоль) и пирролидин (2,78 мл, 33,3 ммоль). Раствор перемешивали в течение 20 ч при температуре окружающей среды. Реакционную смесь повторно добавляли 0,5 мл циклопентанкарбоксальдегида. Полученный осадок собирали путем вакуумфильтрации с получением метил-6-(циклопентилметилен)-5-оксо-5,6,7,8-тетрагидронафталин-2 карбоксилата в виде твердого вещества (2,8 г, выход 60%). ЖХ/МС на C-18 колонке 4,650 мм, tR=6,71 мин (10-90% ацетонитрил/вода в течение 8 мин при скорости 2 мл/мин с детектированием при 254 нм при 50C). MC (ЭР) m/z 285 (M+H); 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 1,24-1,39 (м, 2H), 1,52-1,74 (м,4H), 1,76-1,89 (м, 2H), 2,77 (т, J=5,77 Гц, 2H), 2,79-2,90 (м, 1H), 2,97 (т, J=6,44 Гц, 2H), 3,85 (с, 3H), 6,71 Раствор метил-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата (600 мг, 2,9 ммоль) в тетрагидрофуране (10 мл) охлаждали до температуры бани со льдом и обрабатывали 1,0 М гексаметилдисилазидом лития в тетрагидрофуране (5 мл). После перемешивания в течение 20 мин медленно добавляли циклобутанкарбоксальдегид (J. Med. Chem. 1989, 32, 1001-6) (24 мл 0,5 М раствора в тетрагидрофуране),смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 3 суток. Смесь вливали в воду, трижды экстрагировали этилацетатом, промывали солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали по методу колоночной флэш-хроматографии с прямой фазой на колонке с 50 г силикагеля (градиент 5-50% этилацетат/гексаны). Чистые фракции собирали и концентрировали в вакууме с получением метил-6-(циклобутилметилен)-5 оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата (300 мг, 1,1 ммоль, выход 38%). 1H-ЯМР (400 МГц,ДМСО-d6)м.д. 1,81-2,03 (м, 4H), 2,14-2,27 (м, 2H), 2,71 (т, J=6,58 Гц, 2H), 2,93-3,00 (м, 2H), 3,34-3,44 (м,1H), 3,88 (с, 3H), 6,91 (д, J=9,13 Гц, 1H), 7,84-7,95 (м, 2H), 8,01 (д, J=8,06 Гц, 1H). MC (ЭР) m/z 271(3 мл) добавляли -тетрагидрофуран-3-карбоксальдегид (240 мг, 2,4 ммоль) и пирролидин (0,20 мл, 2,4 ммоль). Раствор перемешивали в течение 20 ч при температуре окружающей среды и в течение 4 ч при 45C. Реакционную смесь концентрировали в вакууме. По методу хроматографии (на силикагеле, этилацетат/гексан) получали -метил-5-оксо-6-тетрагидрофуран-3-ил)метилен)-5,6,7,8-тетрагидронафталин-2-карбоксилат (смесь стереоизомеров) в виде оранжевого масла (200 мг, выход 58%). ЖХ/МС наC-18 колонке 4,650 мм, tR=2,52 мин (10-90% ацетонитрил/вода в течение 4 мин при скорости 4 мл/мин с детектированием при 254 нм при 50C). MC (ЭР) m/z 287 (M+H). Подготовительный пример 21. Метил-5-оксо-6-тетрагидро-2H-пиран-4-ил)метилен)-5,6,7,8 тетрагидронафталин-2-карбоксилат Раствор метил-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилата (2,9 ммоль), тетрагидропиран-4 карбальдегида (3,2 ммоль) и пиперидина (3,2 ммоль) в 6 мл метанола нагревали до 65C в течение ночи. Охлажденную смесь разбавляли этилацетатом, промывали водой и солевым раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали на силикагеле, элюируя 10-40% этилацетатом в гексане, с получением 430 мг желаемого продукта. MC (ЭР) m/z 301 (M+H). Подготовительный пример 22. трет-Бутил-4-6-(метоксикарбонил)-1-оксо-3,4-дигидронафталин 2(1H)илиден)метил)пиперидин-1-карбоксилат- 25016370 Получали в соответствии с методикой подготовительного примера 21, кроме как используя третбутил-4-формилпиперидин-1-карбоксилат вместо тетрагидропиран-4-карбальдегида, с получением указанного в заголовке соединения с выходом 71%. MC (ЭР) m/z 422 (M+Na). Подготовительный пример 23. Метил-6-(5-метил-2-фурилметилен)-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилат Указанное в заголовке соединение получали в соответствии со способом A3 из сложного метилового эфира 5-оксо-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (396 мг, 1,9 ммоль) и 5-метил-2 фуральдегида (192 мг, 2,0 ммоль). MC (ЭР) m/z 297 (M+H). Подготовительный пример 24. Метил-6-(циклопент-1-ен-1-илметилен)-5-оксо-5,6,7,8 тетрагидронафталин-2-карбоксилат Указанное в заголовке соединение получали в соответствии со способом A3 из сложного метилового эфира 5-оксо-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (396 мг, 1,9 ммоль) и 1 циклопентенкарбальдегида (220 мг, 2,0 ммоль) с выходом 70%. MC (ЭР) m/z 283 (M+H). Подготовительный пример 25. Метил-6-(2-фурилметилен)-5-оксо-5,6,7,8-тетрагидронафталин-2 карбоксилат Указанное в заголовке соединение получали в соответствии со способом A3 из сложного метилового эфира 5-оксо-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (396 мг, 1,9 ммоль) и 2-фуральдегида Указанное в заголовке соединение получали в соответствии со способом A3 из сложного метилового эфира 5-оксо-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (396 мг, 1,9 ммоль) и 3-фуральдегида Указанное в заголовке соединение получали в соответствии со способом A3 из сложного метилового эфира 5-оксо-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (396 мг, 1,9 ммоль) и 2-метил-1,3 тиазол-5-карбальдегида (220 мг, 2,0 ммоль) с выходом 60%. MC (ЭР) m/z 314 (M+H). Подготовительный пример 28. Метил-6-(изоксазол-5-илметилен)-5-оксо-5,6,7,8-тетрагидронафталин-2-карбоксилат. Указанное в заголовке соединение получали в соответствии со способом A3 из сложного метилового эфира 5-оксо-5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (396 мг, 1,9 ммоль) и изоксазол-5 карбальдегида (200 мг, 2,0 ммоль) с выходом 55%. MC (ЭР) m/z 284 (M+H). Подготовительный пример 29. Этил-[3-(4-фторбензилиден)-4-оксо-3,4-дигидро-2H-хромен-7- 26016370 ил]ацетат Указанное в заголовке соединение получали в соответствии со способом A2 из метил-[4-оксо-3,4 дигидро-2H-хромен-7-ил]ацетата (L.A. Reiter et al. Bioorganic and Medicinal Chemistry Letters, 1997, 7 2307-2312) и 4-фторбензальдегида с выходом 45%. MC (ЭР) m/z 341 (M+H). Подготовительный пример 30. Метил-3-(4-фторбензилиден)-4-оксохроман-7-карбоксилат Указанное в заголовке соединение получали в соответствии со способом A2 из метил-4 оксохроман-7-карбоксилата (Koch, K., and Biggers, M.S. J. Org. Chem. 1994, 59, 1216-1218) и 4 фторбензальдегида с использованием метанола и 4 н. хлористого водорода/диоксана. Не совсем белое твердое вещество (выход 76%). 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 3,88 (с, 3H), 5,48 (с, 1H), 7,35 (т,J=8,59 Гц, 2H), 7,50-7,61 (м, 3H), 7,66 (д, J=7,25 Гц, 1H), 7,80 (с, 1H), 8,01 (д, J=8,06 Гц, 1H). Подготовительный пример 31. Метил-3-(циклопентилметилен)-4-оксохроман-7-карбоксилат Указанное в заголовке соединение получали в соответствии с общим способом A1 из метил-4 оксохроман-7-карбоксилата (Koch, K., and Biggers, M.S. J. Org. Chem. 1994, 59, 1216-1218) и циклопентанкарбоксальдегида в виде не совсем белого твердого вещества (2,12 г, 7,42 ммоль, выход 76%). MC Указанное в заголовке соединение получали в соответствии с общим способом A1 из метил-4 оксохроман-7-карбоксилата (Koch, K., and Biggers, M.S. J. Org. Chem. 1994, 59, 1216-1218) и изобутиральдегида. После перемешивания в течение ночи раствор распределяли между 1 н. хлористым водородом и этилацетатом. Органические слои промывали 1 н. хлористым водородом и солевым раствором, сушили (сульфат натрия) и концентрировали. Неочищенный продукт очищали по методу флэшхроматографии (0-20% этилацетат/гексаны) с получением метил-3-(2-метилпропилиден)-4-оксохроман 7-карбоксилата в виде маслянистого твердого вещества (730 мг, 2,8 ммоль, выход 58%). 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 7,95 (д, J=8,2 Гц, 1H), 7,62 (дд, J=8,2, 1,6 Гц, 1H), 7,53 (д, J=1,6 Гц, 1H), 6,65 (дт,J=10,3, 1,7 Гц, 1H), 5,22 (д, J=1,6 Гц, 2H), 3,88 (с, 3H), 2,73-2,86 (м, 1H), 1,04 (д, J=6,6 Гц, 6H). MC (ЭР) Указанное в заголовке соединение получали в соответствии со способом A1 из метил-4 оксохроман-7-карбоксилата (Koch, K., and Biggers, M.S. J. Org. Chem. 1994, 59, 1216-1218) и циклопропанкарбоксальдегида в виде не совсем белого твердого вещества (1,14 г, выход 91%). 1H-ЯМР (400 МГц,ДМСО-d6)м.д. 0,75-0,86 (м, 2H), 1,00-1,11 (м, 2H), 1,80-1,95 (м, 1H), 3,87 (с, 3H), 5,31 (д, J=1,56 Гц, 2H),6,27 (д, J=11,33 Гц, 1H), 7,52 (д, J=1,56 Гц, 1H), 7,60 (дд, J=8,20, 1,56 Гц, 1H), 7,94 (д, J=8,20 Гц, 1H). MC- 27016370 циклопент-1-енкарбальдегид (465 мг, 4,8 ммоль) и пирролидин (0,40 мл, 4,8 ммоль). Раствор перемешивали в течение 1 ч при температуре окружающей среды. Полученный коричневый осадок собирали путем вакуум-фильтрации и сушили с получением метил-3-(циклопентенилметилен)-4-оксохроман-7 карбоксилата (444 мг, выход 64%). ЖХ/МС на C-18 колонке 4,650 мм, tR=6,49 мин (10-90% ацетонитрил/вода в течение 8 мин при скорости 2 мл/мин с детектированием при 254 нм при 50C). MC (ЭР) m/z 285 (M+H). 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 1,88-1,99 (м, 2H), 2,43 (д, J=13,16 Гц, 2H), 2,63 (т, J=6,98 Гц, 2H), 3,85 (с, 3H), 5,36 (с, 2H), 6,45 (ушир.с, 1H), 7,37 (с, 1H), 7,49 (д, J=1,34 Гц, 1H), 7,60 (дд, J=8,06,1,61 Гц, 1H), 7,93 (д, J=8,32 Гц, 1H). Подготовительный пример 35. 3-(4-Фторбензилиден)-4-оксохроман-7-илтрифторметансульфонат Указанное в заголовке соединение получали в соответствии со способом А 1 из 4-оксохроман-7 илтрифторметансульфоната (500 мг, 1,7 ммоль) (патент США 5550152; пример 1, стадия C) и 4 фторбензальдегида (0,21 мл, 2,0 ммоль) с получением 3-(4-фторбензилиден)-4-оксохроман-7 илтрифторметансульфоната (260 мг, 0,65 ммоль, выход 40%) в виде твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 5,52 (д, J=1,88 Гц, 2H), 7,25 (дд, J=8,73, 2,28 Гц, 1H), 7,31-7,39 (м, 3H), 7,56 (дд,J=8,73, 5,50 Гц, 2H), 7,80 (с, 1H), 8,06 (д, J=8,86 Гц, 1H). MC (ЭР) m/z 403 (M+H). Подготовительный пример 36. N-(6-(Циклопентилметилен)-5-оксо-5,6,7,8-тетрагидронафталин-2 ил)ацетамид Смесь 6-ацетамидо-1-тетралона (Ryan Scientific) (200 мг, 0,98 ммоль) и циклопентанкарбоксальдегида (0,21 мл, 1,9 ммоль) в метаноле (2 мл) обрабатывали пирролидином (0,25 мл, 2,9 ммоль) при комнатной температуре в течение 1 ч, а затем нагревали при 55C в течение ночи. Смесь охлаждали до комнатной температуры, обрабатывали 1 н. хлористым водородом (4 мл), фильтровали через Chem Elute tube Указанное в заголовке соединение получали из этил-6-(4-фторбензилиден)-5-оксо-5,6,7,8 тетрагидронафталин-2-карбоксилата (подготовительный пример 16; 324 мг, 1,0 ммоль) и гидрохлорида 2 хлор-4-гидразинилбензонитрила (подготовительный пример 1; 306 мг, 1,5 ммоль) в соответствии со способом B (желтое твердое вещество, 394 мг, 0,830 ммоль, выход 83%). Указанное в заголовке соединение присутствовало, главным образом, в виде -этил(3RS,3aRS)-2-(3-хлор-4-цианофенил)-3-(4-фторфенил)3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты. 1H-ЯМР (400 МГц, ДМСО-d6)м.д. 0,80 Указанное в заголовке соединение получали из этил-2-(3-хлор-4-цианофенил)-3-(4-фторфенил)3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоксилата (пример 1; 330 мг, 0,696 ммоль) в соответствии Указанное в заголовке соединение получали из 2-(3-хлор-4-цианофенил)-3-(4-фторфенил)-3,3a,4,5 тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты, полученной в примере 2, с использованием хирального разделения (например, способ G) (Chiralcel OJ-H 30250 мм, 50% этанол/диоксид углерода, 70 мл/мин). Элюируемый первым пик: хиральная ВЭЖХ, tR=2,3 мин (Chiralcel OJ-H 4,6250 мм; 50% этанол/диоксид углерода, 3 мл/мин). Пример 4. Указанное в заголовке соединение получали из 2-(3-хлор-4-цианофенил)-3-(4-фторфенил)-3,3a,4,5 тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты, полученной в примере 2, с использованием хирального разделения (например, способ G) (Chiralcel OJ-H 30250 мм, 50% этанол/диоксид углерода, 70 мл/мин). Элюируемый вторым пик: хиральная ВЭЖХ, tR=4,0 мин (Chiralcel OJ-H 4,6250 мм; 50% этанол/диоксид углерода, 3 мл/мин). Пример 6. 2-(4-Циано-3-метилфенил)-3-(4-фторфенил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7 карбоновая кислота Указанное в заголовке соединение получали из этил-6-(4-фторбензилиден)-5-оксо-5,6,7,8 тетрагидронафталин-2-карбоксилата (подготовительный пример 16; 324 мг, 1,0 ммоль) и гидрохлорида 4 гидразинил-2-метилбензонитрила (подготовительный пример 2; 275 мг, 1,5 ммоль) в соответствии со способом B и способом C (твердое вещество, 290 мг, 0,68 ммоль, выход 68%). Указанное в заголовке соединение присутствовало, главным образом, в виде -(3RS,3aRS)-2-(4-циано-3-метилфенил)-3-(4 фторфенил)-3,3a,4,5-тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты. 1H-ЯМР (400 МГц, ДМСОd6)м.д. 0,71-0,87 (м, 1H), 1,76-1,84 (м, 1H), 2,36 (с, 3H), 2,84-3,01 (м, 2H), 3,86-3,98 (м, 1H), 5,87 (д,J=11,28 Гц, 1H), 6,65-7,36 (м, 6H), 7,48 (д, J=8,60 Гц, 1H), 7,76 (с, 1H), 7,82 (дд, J=8,19, 1,75 Гц, 1H), 8,10 Указанное в заголовке соединение получали из 2-(4-циано-3-метилфенил)-3-(4-фторфенил)-3,3a,4,5 тетрагидро-2H-бензо[g]индазол-7-карбоновой кислоты, полученной в примере 6, с использованием хирального разделения (например, способ G) (Chiralpak AD-H 21250 мм, 50% метанол/диоксид углерода,50 мл/мин). Элюируемый вторым пик: хиральная ВЭЖХ, tR=3,8 мин (Chiralpak AD-H 4,6250 мм; 50%
МПК / Метки
МПК: C07D 405/04, A61K 31/4162, C07D 493/04, C07D 231/54, C07D 401/04, A61K 31/416, A61P 9/12
Метки: пиразолиновые, соединения, качестве, минералокортикоидных, рецепторов, антагонистов
Код ссылки
<a href="https://eas.patents.su/30-16370-pirazolinovye-soedineniya-v-kachestve-antagonistov-mineralokortikoidnyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Пиразолиновые соединения в качестве антагонистов минералокортикоидных рецепторов</a>
Предыдущий патент: Объемная опорная конструкция
Следующий патент: Система радиосвязи и устройство мобильной станции
Случайный патент: Способ и устройство для наблюдения состояния сети