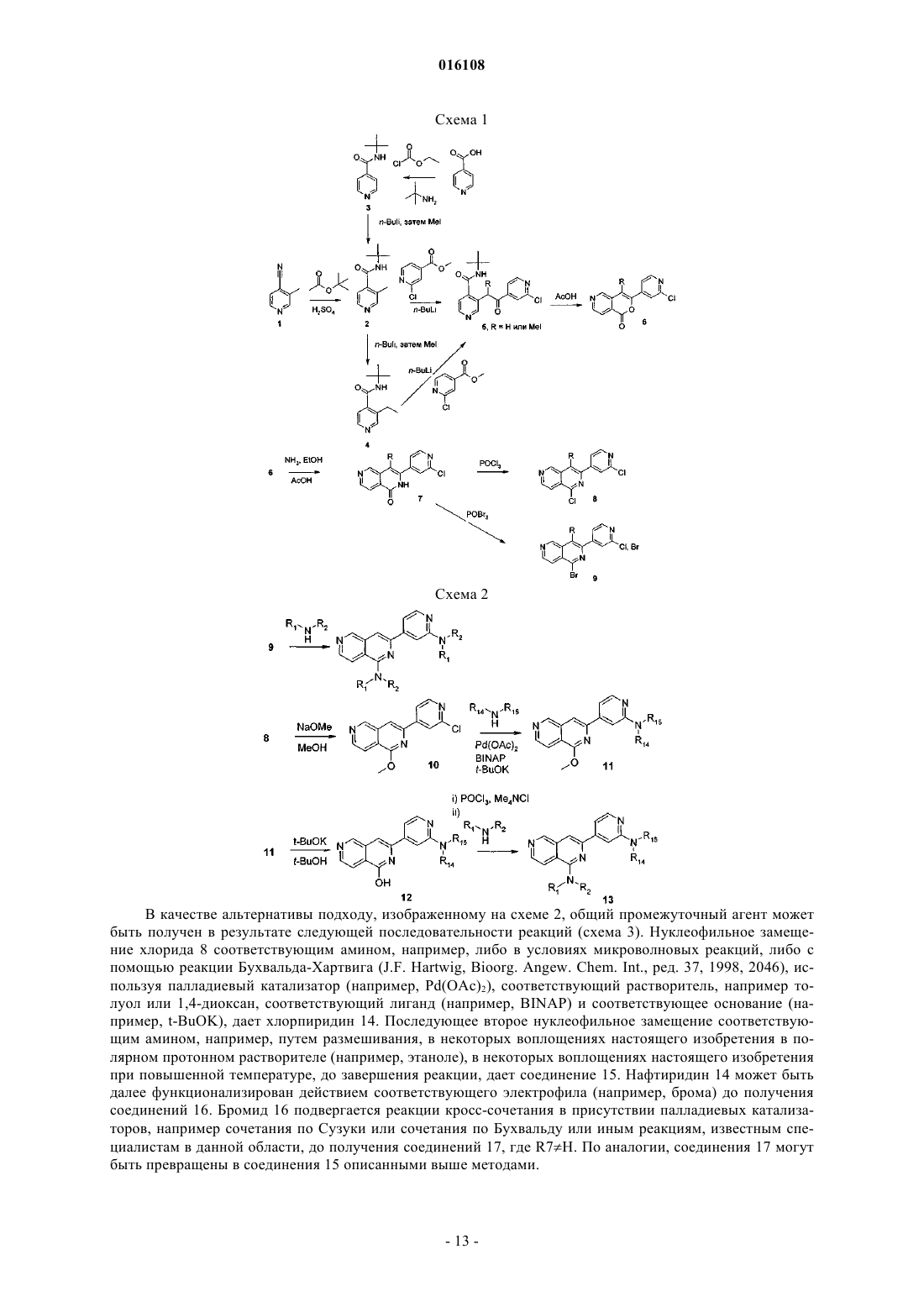
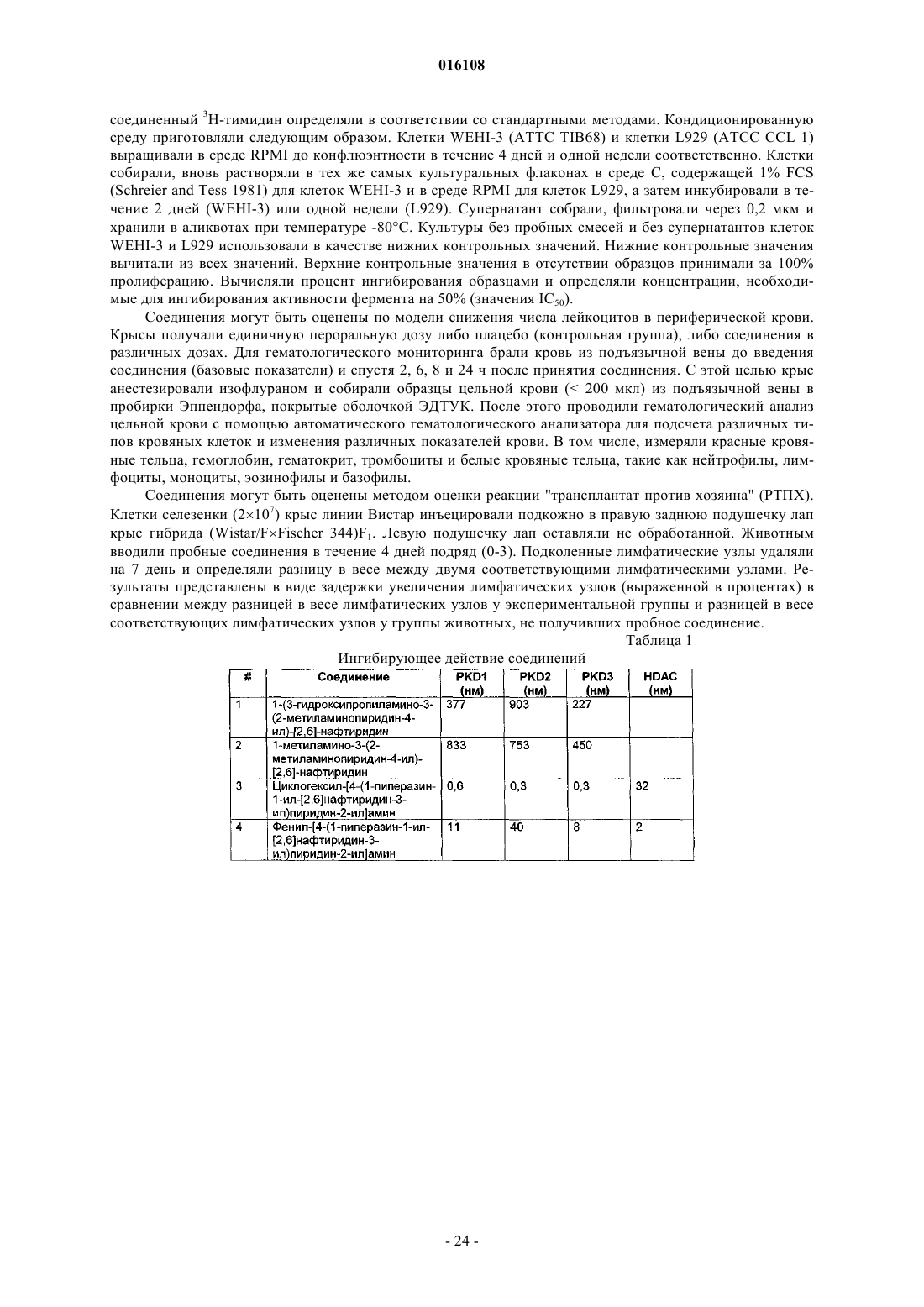
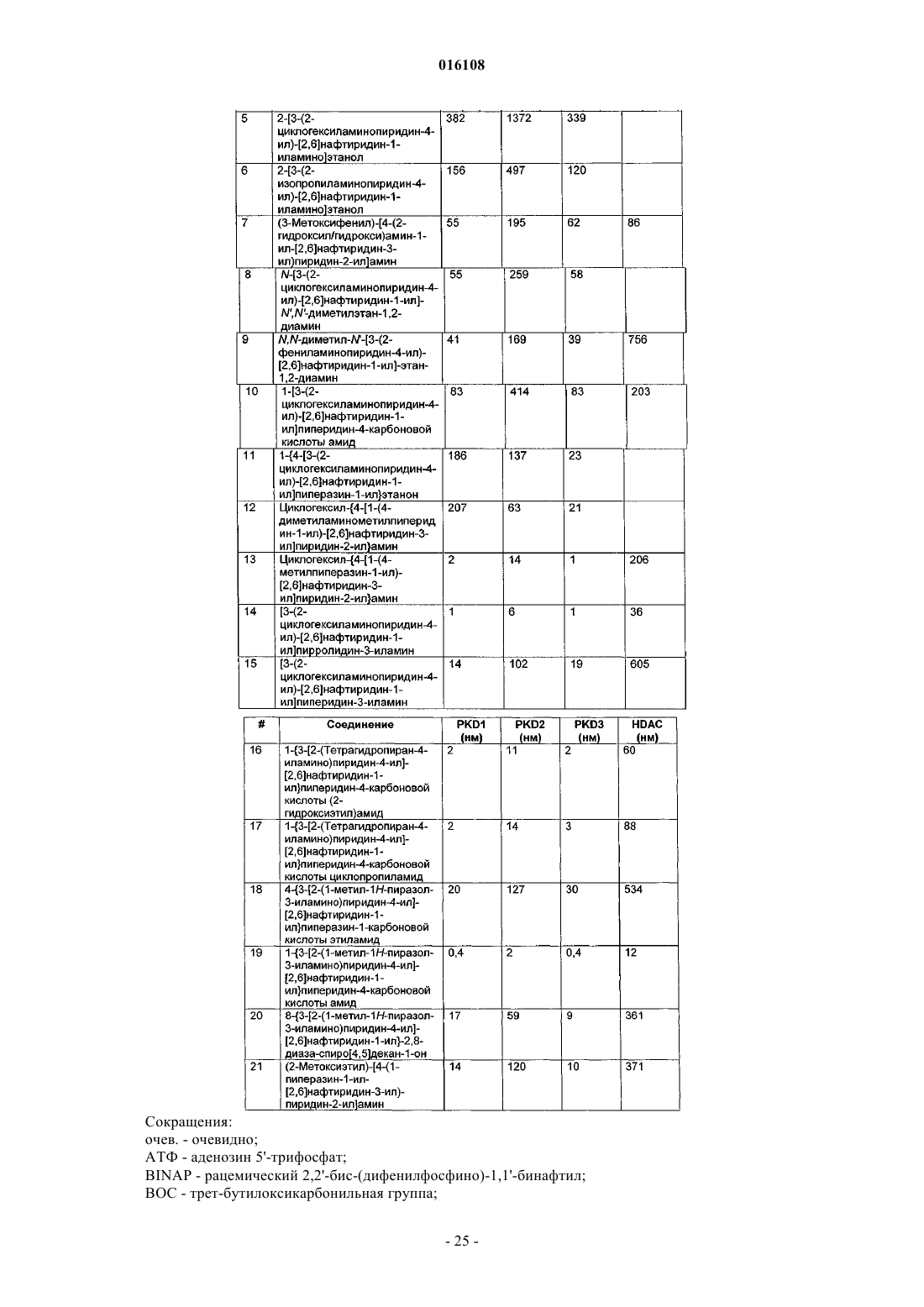
[2,6]нафтиридины, применимые в качестве ингибиторов протеинкиназы
Номер патента: 16108
Опубликовано: 28.02.2012
Авторы: Меридит Эрик, Юн Таеён, Сиска Сэра, Ван-Эйс Маурис, Монович Лорен Г., Фон-Матт Анетте, Гауль Кристоф, Джеуэлл Чарлз Франсис Джр., Каппарелли Майкл Пол, Доблер Маркус Рольф
Формула / Реферат
1. Соединение формулы (I)
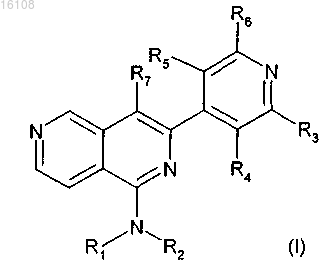
где R1 и R2 представляют независимо водород, (C1-C7)алкил, (C3-C7)циклоалкил, гетероциклил, каждый из которых может быть необязательно замещен одним или двумя R8, где R8 представляет собой водород, галоген, (C1-C7)алкил, R9-O-, (R10)(R11)N-, (R12)(R13)N-C(O)-, (C6-C10)арил, гетероциклил или гетероарил, при этом указанные гетероциклил и гетероарил могут быть необязательно замещены одной или двумя (C1-C7)алкильными группами;
R1 и R2, взятые вместе с атомом азота, к которому они присоединены, необязательно образуют 4-7-членное кольцо;
R3 представляет собой (R14)(R15)N- или галоген;
R4, R5, R6 и R7 представляют независимо водород, галоген, (C1-C7)алкил, (C3-C7)циклоалкил, (C6-C10)арил-(C1-C7)алкил, (C6-C10)арил или (C1-C7)алкокси;
R9, R10, R11, R12 и R13 представляют независимо водород, (C1-C7)алкил-O-C(O)-, (C1-C7)алкил-NH-C(O)-, (C1-C7)алкил-C(O)-NH-C(O)-, (C3-C7)циклоалкил, (C3-C7)циклоалкил-(C1-C7)алкил-, R16-SO2-, R17-C(O)-, гетероциклил или (C1-C7)алкил, при этом указанный гетероциклил может быть также необязательно замещен одной или двумя (C3-C7)циклоалкил-(C1-C7)алкил- группами, а указанный (C1-C7)алкил может быть также необязательно замещен одной или двумя группами, выбранными из гидрокси, (C1-C7)алкокси, (C1-C7)алкиламина, ди(C1-C7)алкиламина или гетероарила;
R10 и R11, взятые вместе с атомом азота, к которому они присоединены, необязательно образуют 5-7-членное кольцо;
R12 и R13, взятые вместе с атомом азота, к которому они присоединены, необязательно образуют 5-7-членное кольцо;
R14 и R15 представляют независимо водород, (C1-C7)алкил, (C6-C10)арил, (C3-C7)циклоалкил, (C6-C10)арил-(C1-C7)алкил-, гетероциклил или гетероарил, где указанные (C1-C7)алкил, (C6-C10)арил, (C3-C7)циклоалкил и гетероарил могут быть также необязательно замещены одной или двумя группами, выбранными из (C1-C7)алкила, (C1-C7)алкокси, гидрокси, галогена, галоген(C1-C7)алкила, циано или R18-NH-C(O)-;
R16 представляет собой (C6-C10)арил или гетероарил;
R17 представляет собой гетероциклил или (C1-C7)алкил, необязательно замещенный одной или двумя группами, выбранными из H2N-, (C6-C10)арил-(C1-C7)алкила- и (C1-C7)алкил-C(O)-NH-;
R18 представляет собой гетероциклил-(C1-C7)алкил-;
где термин "гетероарил" относится к 5-10-членной моноциклической или бициклической ароматической кольцевой системе, имеющей 1-8 гетероатомов, выбранных из N, O и S; и
где термин "гетероциклил" относится к необязательно замещенной, насыщенной или ненасыщенной неароматической 4-, 5-, 6- или 7-членной моноциклической или 7-, 8-, 9-, 10-, 11- или 12-членной бициклической кольцевой системе, имеющей по меньшей мере один гетероатом, выбранный из N, O и S; причем N и S могут быть также необязательно окислены до различных степеней окисления; или
его фармацевтически приемлемая соль; или его оптический изомер; или смесь оптических изомеров.
2. Соединение по п.1, где
R1 и R2 представляют независимо водород, (C1-C7)алкил, (C3-C7)циклоалкил, 4-7-членный гетероциклил, каждый из которых может быть необязательно замещен одним или двумя R8, где R8 представляет собой водород, (C1-C7)алкил, R9-O-, (R10)(R11)N-, (R12)(R13)N-C(O)-, (C6-C10)арил, 5-7-членный гетероарил или 4-7-членный гетероциклил;
R3 представляет собой (R14)(R15)N- или галоген;
R4 и R5 представляют независимо водород, галоген, (C1-C7)алкил, (C3-C7)циклоалкил или (C1-C7)алкокси;
R9, R10, R11, R12 и R13 представляют независимо водород, (C1-C7)алкил-O-C(O)-, (C1-C7)алкил-NH-C(O)-, (C1-C7)алкил-C(O)-NH-C(O)-, (C3-C7)циклоалкил, (C3-C7)циклоалкил-(C1-C7)алкил, R16-SO2-, R17-C(O)-, 4-7-членный гетероциклил или (C1-C7)алкил, при этом указанный 4-7-членный гетероциклил может быть также необязательно замещен одним или двумя (C3-C7)циклоалкил-(C1-C7)алкильными группами, а указанный (C1-C7)алкил может быть также необязательно замещен одной или двумя группами, выбранными из гидрокси, (C1-C7)алкокси, (C1-C7)диалкиламина или 5-7-членного гетероарила;
R12 и R13, взятые вместе с атомом азота, к которому они присоединены, необязательно образуют 5-7-членное кольцо;
R14 и R15 представляют независимо водород, (C1-C7)алкил, (C6-C10)арил, (C3-C7)циклоалкил, (C6-C10)арил-(C1-C7)алкил-, 4-7-членный гетероциклил или 5-7-членный гетероарил, при этом указанные (C1-C7)алкил, (C3-C7)циклоалкил, (C6-C10)арил и 5-7-членный гетероарил могут быть также необязательно замещены одной или двумя группами, выбранными из (C1-C7)алкила, (C1-C7)алкокси, гидрокси, галогена, (C1-C7)галогеналкила или R14-NH-C(O)-;
R16 представляет собой (C6-C10)арил или 5-7-членный гетероарил;
R17 представляет собой 4-7-членный гетероциклил или (C1-C7)алкил, необязательно замещенный одной или двумя группами, выбранными из H2N-, (C6-C10)арил-(C1-C7)алкил- или (C1-C7)алкил-C(O)-NH-;
R18 представляет собой 4-7-членный гетероциклил-(C1-C7)алкил-; или
его фармацевтически приемлемая соль; или его оптический изомер; или смесь оптических изомеров.
3. Способ ингибирования активности протеинкиназ семейства PKD у пациента, включающий введение пациенту терапевтически эффективной дозы соединения по п.1.
4. Способ лечения у пациентов нарушений и заболеваний, обусловленных действием протеинкиназ семейства PKD, включающий введение пациенту терапевтически эффективной дозы соединения по п.1.
5. Способ лечения по п.4, когда нарушение или заболевание у пациента характеризуется аномальной активностью протеинкиназ семейства PKD.
6. Способ лечения по п.4, когда нарушение или заболевание у пациента характеризуется аномальной экспрессией протеинкиназ семейства PKD.
7. Способ лечения по п.4, когда нарушение или заболевание представляет собой паралич сердца, рак кишечника, регуляцию роста клеток, аутоиммунное нарушение или гиперпролиферативные поражения кожи.
8. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 и один или более фармацевтически приемлемых носителей.
9. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 и один или более терапевтически активных агентов, выбранных из: (i) ингибитора HMG-Co-A редуктазы или его фармацевтически приемлемой соли; (ii) антагониста рецепторов ангиотензина II или его фармацевтически приемлемой соли; (iii) ингибитора ангиотензинпревращающего фермента (АПФ) или его фармацевтически приемлемой соли; (iv) блокатора кальциевых каналов (БКК) или его фармацевтически приемлемой соли; (v) двойного ингибитора ангиотензинпревращающего фермента и нейтральной эндопептидазы (АПФ/НЭП) или его фармацевтически приемлемой соли; (vi) антагониста эндотелина или его фармацевтически приемлемой соли; (vii) ингибитора ренина или его фармацевтически приемлемой соли; (viii) диуретика или его фармацевтически приемлемой соли; (ix) миметика ApoA-I; (x) противодиабетического агента; (xi) агента, снижающего вес; (xii) блокатора рецепторов альдостерона; (xiii) блокатора рецепторов эндотелина и (xiv) ингибитора белка, переносящего эфиры холестерина (CETP).
10. Применение соединения формулы (I) по п.1 для приготовления фармацевтической композиции для лечения у пациентов нарушений и заболеваний, обусловленных действием протеинкиназ семейства PKD.
11. Применение соединения формулы (I) по п.1 для приготовления фармацевтической композиции для лечения у пациентов нарушений и заболеваний, характеризующихся аномальной активностью протеинкиназ семейства PKD.
12. Применение соединения формулы (I) по п.1 для приготовления фармацевтической композиции для лечения у пациентов нарушений и заболеваний, характеризующихся аномальной экспрессией протеинкиназ семейства PKD.
13. Применение фармацевтической композиции по п.8 или 9 для приготовления лекарственного препарата для лечения у пациентов нарушений и заболеваний, обусловленных действием протеинкиназ семейства PKD.
14. Применение фармацевтической композиции по п.8 или 9 для приготовления лекарственного препарата для лечения у пациентов нарушений и заболеваний, характеризующихся аномальной активностью протеинкиназ семейства PKD.
15. Применение фармацевтической композиции по п.8 или 9 для приготовления лекарственного препарата для лечения у пациентов нарушений и заболеваний, характеризующихся аномальной экспрессией протеинкиназ семейства PKD.
16. Применение по п.10, когда нарушение или заболевание представляет собой паралич сердца, рак кишечника, регуляцию роста клеток, аутоиммунное нарушение или гиперпролиферативные поражения кожи.
Текст
Настоящее изобретение представляет соединение формулы (I) Доблер Маркус Рольф, Джеуэлл Чарлз Франсис Джр., Меридит Эрик,Монович Лорен Г., Сиска Сэра (US),Фон-Матт Анетте (CH), Ван-Эйс Маурис (FR), Юн Таен (US), Гауль Кристоф (CH), Каппарелли Майкл Пол (US) Веселицкая И.А., Пивницкая Н.Н.,Кузенкова Н.В., Веселицкий М.Б.,Каксис Р.А., Комарова О.М., Белоусов Ю.В. (RU) Указанное соединение представляет собой селективный ингибитор семейства киназ AGC и кальмодулин-зависимых киназ, таких как, например, MARK 1/2/3, PKD-1/2/3, PKN-1/2, CDK-9,CaMKII, ROCK-I/II, ингибиторы фосфорилирования гистондеацетилазы (HDAC) или ингибиторы других киназ. В заключении настоящее изобретение также представляет фармацевтическую композицию. 016108 Настоящее изобретение относится к новым соединениям, которые могут являться селективными ингибиторами семейства киназ AGC и кальмодулин-зависимых киназ, таких как, например, MARK 1/2/3,PKD-1/2/3, PKN-1/2, CDK-9, CaMKII, ROCK-I/II, ингибиторами фосфорилирования гистондеацетилазы(HDAC) или ингибиторами других киназ. Селективность, от которой будут зависеть структурные изменения указанных киназ, для лечения нарушений или заболеваний, вызванных селективными AGC или кальмодулин-зависимыми киназами. Настоящее изобретение представляет соединение формулы (I) где R1 и R2 представляют независимо водород, алкил, циклоалкил, гетероциклил, каждый из которых может быть необязательно замещен одним или двумя R8, где R8 представляет собой водород, галоген, алкил, R9-O-, (R10)(R11)N-, (R12)(R13)N-C(O)-, арил, гетероциклил или гетероарил, при этом указанные гетероциклил и гетероарил могут быть необязательно замещены одной или двумя алкильными группами;R9, R10, R11, R12 и R13 представляют независимо водород, алкил-O-C(O)-, алкил-NH-C(O)-, алкилC(O)-NH-C(O)-, циклоалкил, циклоалкилалкил-, R16-SO2-, R17-C(O)-, гетероциклил или алкил, при этом указанный гетероциклил может быть также необязательно замещен одной или двумя циклоалкилалкилгруппами, а указанный алкил может быть также необязательно замещен одной или двумя группами, выбранными из гидрокси, алкокси, алкиламина, диалкиламина или гетероарила;R14 и R15 представляют независимо водород, алкил, арил, циклоалкил, арилалкил-, гетероциклил или гетероарил, где указанные алкил, циклоалкил, арил и гетероарил могут быть далее необязательно замещены одной или двумя группами, выбранными из алкил, алкокси, гидрокси, галогена, галогеналкила, циано и R18-NH-C(O)-;R16 представляет собой арил или гетероарил;R17 представляет собой гетероциклил или алкил, необязательно замещенный одной или двумя группами, выбранными из H2N-, арилалкил- и алкил-C(O)-NH-;R18 представляет собой гетероциклилалкил-; или его фармацевтически приемлемую соль; или его оптический изомер; или смесь оптических изомеров. Настоящее изобретение представляет соединение формулы (I), где R1 и R2 представляют независимо водород, (C1-C7)алкил, (C3-C7)циклоалкил, 4-7-членный гетероциклил, каждый из которых может быть необязательно замещен одним или двумя R8, где R8 представляет собой водород, (C1-C7)алкил, R9O-, (R10)(R11)N-, (R12)(R13)N-C(O)-, (C6-C10)арил, 5-7-членный гетероарил или 4-7-членный гетероциклил;R9, R10, R11, R12 и R13 представляют независимо водород, (C1-C7)алкил-O-C(O)-, (C1-C7)алкил-NHC(O)-, (C1-C7)алкил-C(O)-NH-C(O)-, (C3-C7)циклоалкил, (C3-C7)циклоалкил-(C1-C7)алкил, R16-SO2-, R17C(O)-, 4-7-членный гетероциклил или (C1-C7)алкил, при этом указанный 4-7-членный гетероциклил может быть далее необязательно замещен одним или двумя (C3-C7)циклоалкил-(C1-C7) алкильными группами, а указанный (C1-C7)алкил может быть далее необязательно замещен одной или двумя группами, выбранными из гидрокси, (C1-C7)алкокси, (C1-C7)диалкиламина или 5-7-членного гетероарила;R14 и R15 представляют независимо водород, (C1-C7)алкил, (C6-C10)арил, (C3-C7)циклоалкил, (C6C10)арил-(C1-C7)алкил-, 4-7-членный гетероциклил или 5-7-членный гетероарил, при этом указанные (C1-1 016108C7)алкил, (C3-C7)циклоалкил, (C6-C10)арил и 5-7-членный гетероарил могут быть также необязательно замещены одной или двумя группами, выбранными из (C1-C7)алкила, (C1-C7)алкокси, гидрокси, галогена,(C1-C7)галогеналкила или R14-NH-C(O)-;R17 представляет собой 4-7-членный гетероциклил или (C1-C7)алкил, необязательно замещенный одной или двумя группами, выбранными из H2N-, (C6-C10)арил-(C1-C7)алкил- или (C1-C7)алкил-C(O)-NH-;R18 представляет собой 4-7-членный гетероциклил-(C1-C7)алкил-; или его фармацевтически приемлемую соль; или его оптический изомер; или смесь оптических изомеров. Для толкования формулы настоящего изобретения применяются следующие определения, и во всех соответствующих случаях термины, используемые в единственном числе, относятся и к множественному числу, и наоборот. Использованный здесь термин "алкил" относится к предельно насыщенной разветвленной или неразветвленной группе углеводородов. В некоторых воплощениях настоящего изобретения алкил содержит от 1 до 20 атомов углеводорода или больше. В некоторых воплощениях настоящего изобретения от 1 до 16 атомов углеводорода, от 1 до 10 атомов углеводорода, от 1 до 7 атомов углеводорода или от 1 до 4 атомов углеводорода. Типичные примеры алкила включают, но не ограничиваются перечисленным, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, 3-метилгексил, 2,2-диметилпентил, 2,3-диметилпентил, н-гептил, н-октил, н-нонил, ндецил и т.п. Использованный здесь термин "галогеналкил" относится к алкилу, как это понятие определено в данном документе, то есть замещенному одной или более галогруппами, как это понятие определено в данном документе. Галогеналкил может быть моногалогеналкилом, дигалогеналкилом или полигалогеналкилом, в том числе пергалоалкилом. Моногалогеналкил может иметь один атом йода, брома, хлора или фтора внутри алкильной группы. Дигалогеналкильные и полигалогеналкильные группы содержат два или более одинаковых атома галогена или сочетание различных галогенных групп внутри алкила. Полигалогеналкил содержит до 12, или 10, или 8, или 6, или 4, или 3, или 2 галогенных групп. Примеры галогеналкила включают, но не ограничиваются перечисленным, фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, пентафторэтил, гептафторпропил, дифторхлорметил, дихлорфторметил, дифторэтил, дифторпропил, дихлорэтил и дихлорпропил. Пергалоалкил относится к алкилу, у которого все атомы водорода замещены атомами галогена. Термин "арил" относится к моноциклическим или бициклическим ароматическим углеводородным группам, имеющим 6-20 атомов углеводорода в кольцевой структуре. В некоторых воплощениях настоящего изобретения арил представляет собой (C6-C10)арил. Примеры включают, но не ограничиваются перечисленным, фенил, бифенил, нафтил или тетрагидронафтил, каждый из которых может быть необязательно замещен 1-4 заместителями, такими как алкил, трифторметил, циклоалкил, галоген, гидрокси,алкокси, ацил, алкил-C(O)-O-, арил-O-, гетероарил-O-, амино, тиол, алкил-S-, арил-S-, нитро, циано, карбокси, алкил-O-C(O)-, карбамоил, алкил-S(O)-, сульфонил, сульфонамидо, гетероциклил и т.п. Кроме того, использованный здесь термин "арил" относится к ароматическому заместителю, который может являться одним ароматическим кольцом или несколькими ароматическими кольцами, которые соединены друг с другом, связаны ковалентно или присоединены к общей группе, например к метиленовым или этиленовым звеньям. Общей соединяющей группой также может являться карбонил, как в бензофеноне, или кислород, как в дифенилоксиде, или азот, как в дифениламине. Использованный здесь термин "алкокси" относится к алкил-O-, где алкил определен выше. Типичные примеры алкокси включают, но не ограничиваются перечисленным, метокси, этокси, пропокси, 2 пропокси, бутокси, трет-бутокси, пентилокси, гексилокси, циклопропилокси-, циклогексилокси- и т.п. В некоторых воплощениях настоящего изобретения алкоксигруппы содержат примерно 1-7 атомов углерода или более. В некоторых воплощениях настоящего изобретения - примерно 1-4 атомов углерода. Использованный здесь термин "ацил" относится к группе R-C(O)-, состоящей из 1-10 атомов углеводорода прямой, разветвленной или циклической конфигурации или к сочетанию таковых, прикрепленных к исходной структуре через карбонильное соединение. Данная группа может быть насыщенной или ненасыщенной, а также алифатической или ароматической. В некоторых воплощениях настоящего изобретения R в ацильном радикале представляет собой алкил, или алкокси, или арил, или гетероарил. Кроме того, в некоторых воплощениях настоящего изобретения один или более атомов углерода в ацильном радикале могут быть замещены азотом, кислородом или серой, если при этом точкой присоединения к исходной структуре по-прежнему является карбонил. Примеры ацила включают, но не ограничиваются перечисленным, ацетил, бензоил, пропионил, изобутирил, трет-бутоксикарбонил, бензилоксикарбонил и т.п. Низший ацил относится к ацилу, содержащему от одного до четырех атомов углерода. Использованный здесь термин "карбамоил" относится к H2NC(O)-, алкил-NHC(O)-, (алкил)2NC(O)-,арил-NHC(O)-, алкил(арил)-NC(O)-, гетероарил-NHC(O)-, алкил(гетероарил)-NC(O)-, арилалкилNHC(O)-, алкил(арилалкил)-NC(O)- и т.п. Использованный здесь термин "сульфонил" относится к R-SO2-, где R представляет собой водород,алкил, арил, гетероарил, арилалкил, гетероарилалкил, алкокси, арилокси, циклоалкил или гетероциклил.-2 016108 Использованный здесь термин "сульфонамидо" относится к алкил-S(O)2-NH-, арил-S(O)2-NH-, арилалкил-S(O)2-NH-, гетероарил-S(O)2-NH-, гетероарилалкил-S(O)2-NH-, алкил-S(O)2-N(алкил)-, арилS(O)2-N(алкил)-, арилалкил-S(O)2-N(алкил)-, гетероарил-S(O)2-N(алкил)-, гетероарилалкил-S(O)2N(алкил)- и т.п. Использованный здесь термин "гетероциклил" или "гетероцикло" относится к необязательно замещенному, насыщенному или ненасыщенному неароматическому кольцу или кольцевой системе, каковой является, например, 4-, 5-, 6- или 7-членная моноциклическая, 7-, 8-, 9-, 10-, 11- или 12-членная бициклическая или 10-, 11-, 12-, 13-, 14- или 15-членная трициклическая кольцевая система, и которая содержит хотя бы один гетероатом, выбранный из O, S и N, где N и S также могут быть необязательно окислены до различной степени окисления. Гетероциклическая группа может быть прикреплена к гетероатому или к атому углерода. Гетероциклил может содержать конденсированные циклы или кольца с мостиком, а также спироциклические кольца. Примеры гетероциклических соединений включают тетрагидрофуран(ТГФ), дигидрофуран, 1,4-диоксан, морфолин, 1,4-дитиан, пиперазин, пиперидин, 1,3-диоксолан, имидазолидин, имидазолин, пирролин, пирролидин, тетрагидропиран, дигидрофуран, оксатиолан, дитиолан,1,3-диоксан, 1,3-дитиан, оксатиан, тиоморфолин и т.п. Термин "гетероциклил" далее относится к гетероциклическим группам, как они определены в настоящем документе, замещенным 1, 2 или 3 заместителями, выбранными из групп, состоящих из следующих элементов: (a) алкил; (b) гидрокси (или защищенный гидрокси); (c) галоген; (d) оксо, то есть =O;(e) амино, алкиламино или диалкиламино; (f) алкокси; (g) циклоалкил; (h) карбоксил; (i) гетероциклоокси, где гетероциклоокси обозначает гетероциклическую группу, связанную через кислородный мостик;(j) алкил-O-C(O)-; (k) меркапто; (l) нитро; (m) циано; (n) сульфамоил или сульфонамидо; (o) арил; (p) алкил-C(O)-O-; (q) арил-C(O)-O-; (r) арил-S-; (s) арилокси; (t) алкил-S-; (u) формил, то есть HC(O)-; (v) карбамоил; (w) арилалкил- и (x) арил, замещенный алкилом, циклоалкилом, алкокси, гидрокси, амино,алкил-C(O)-NH-, алкиламино, диалкиламино или галогеном. Использованный здесь термин "циклоалкил" относится к насыщенным или ненасыщенным моноциклическим, бициклическим или трициклическим углеводородным группам, состоящим из 3-12 атомов углеводорода, в некоторых воплощениях настоящего изобретения из 3-9 или 3-7 атомов углеводорода,каждый из которых может быть необязательно замещен одним или двумя, или тремя, или более заместителями, такими как алкил, галоген, оксо, гидрокси, алкокси, алкил-C(O)-, ациламино, карбамоил, алкилNH-, (алкил)2N-, тиол, алкил-S-, нитро, циано, карбокси, алкил-O-C(O)-, сульфонил, сульфонамидо,сульфамоил, гетероциклил и т.п. Типичные моноциклические углеводородные группы включают, но не ограничиваются перечисленным, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил и циклогексенил и т.п. Типичные бициклические углеводородные группы включают борнил, индил, гексагидроиндил, тетрагидронафтил, декагидронафтил, бицикло[2.1.1]гексил, бицикло[2.2.1]гептил, бицикло[2.2.1]гептенил, 6,6-диметилбицикло[3.1.1]гептил, 2,6,6-триметилбицикло[3.1.1]гептил, бицикло[2.2.2]октил и т.п. Типичные трициклические углеводородные группы включают адамантил и т.п. Использованный здесь термин "сульфамоил" относится к H2NS(O)2-, алкил-NHS(O)2-, (алкил)2NS(O)2-, арил-NHS(O)2-, алкил(арил)-NS(O)2-, (арил)2NS(O)2-, гетероарил-NHS(O)2-, (арилалкил)NHS(O)2-, (гетероарилалкил)-NHS(O)2- и т.п. Использованный здесь термин "арилокси" относится как к группе -O-арил, так и к группе-O-гетероарил, где арил и гетероарил определены в настоящем документе. Использованный здесь термин "гетероарил" относится к 5-14-членной моноциклической, или бициклической, или полициклической ароматической кольцевой системе, содержащей от 1 до 8 гетероатомов, выбранных из N, O или S. В некоторых воплощениях настоящего изобретения гетероарил представляет собой 5-10- или 5-7-членную кольцевую систему. Типичные гетероарильные группы включают 2 или 3-тиенил, 2- или 3-фурил, 2- или 3-пирролил, 2-, 4- или 5-имидазолил, 3-, 4- или 5- пиразолил, 2-, 4 или 5-тиазолил, 3-, 4- или 5-изотиазолил, 2-, 4- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 3- или 5-1, 2, 4 триазолил, 4- или 5-1, 2, 3-триазолил, тетразолил, 2-, 3- или 4-пиридил, 3- или 4-пиридазинил, 3-, 4- или 5-пиразинил, 2-пиразинил, 2-, 4- или 5-пиримидинил. Термин "гетероарил" также относится к группе, в которой гетероароматическое кольцо прикреплено конденсированием к одному или более арилу, циклоалифатическому или гетероциклическому кольцам, где радикал или точка присоединения находится на гетероароматическом кольце. Примеры включают, но не ограничиваются перечисленным, 1-, 2-, 3-, 5-, 6-, 7- или 8-индолизинил, 1-, 3-, 4-, 5-, 6- или 7 изоиндолил, 2-, 3-, 4-, 5-, 6- или 7-индолил, 2-, 3-, 4-, 5-, 6- или 7-индазолил, 2-, 4-, 5-, 6-, 7- или 8 пуринил, 1-, 2-, 3-, 4-, 6-, 7-, 8- или 9-хинолизинил, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолил, 1-, 3-, 4-, 5-, 6-, 7 или 8-изохинолил, 1-, 4-, 5-, 6-, 7- или 8-фталазинил, 2-, 3-, 4-, 5- или 6-нафтиридинил, 2-, 3-, 5-, 6-, 7- или 8-хиназолинил, 3-, 4-, 5-, 6-, 7- или 8-циннолинил, 2-, 4-, 6- или 7-птеридинил, 1-, 2-, 3-, 4-, 5-, 6-, 7- или 8-4aH карбазолил, 1-, 2-, 3-, 4-, 5-, 6-, 7- или 8-карбазолил, 1-, 3-, 4-, 5-, 6-, 7-, 8- или 9-карболинил, 1-, 2-,3-, 4-, 6-, 7-, 8-, 9- или 10-фенантридинил, 1-, 2-, 3-, 4-, 5-, 6-, 7-, 8- или 9-акридинил, 1-, 2-, 4-, 5-, 6-, 7-, 8 или 9-перимидинил, 2-, 3-, 4-, 5-, 6-, 8-, 9- или 10-фенатролинил, 1-, 2-, 3-, 4-, 6-, 7-, 8- или 9-феназинил,1-, 2-, 3-, 4-, 6-, 7-, 8-, 9- или 10-фенотиазинил, 1-, 2-, 3-, 4-, 6-, 7-, 8-, 9- или 10-феноксазинил, 2-, 3-, 4-, 5-,6- или 1-, 3-, 4-, 5-, 6-, 7-, 8-, 9- или 10-бензилизохинолинил, 2-, 3-, 4- или тиено[2,3-b]фуранил, 2-, 3-, 5-,-3 016108 6-, 7-, 8-, 9-, 10- или 11-7H-пиразино[2,3-c]карбазолил, 2-, 3-, 5-, 6- или 7-2H-фуро[3,2-b]пиранил, 2-, 3-,4-, 5-, 7- или 8-5H-пиридо[2,3-d]-o-оксазинил, 1-, 3- или 5-1H-пиразоло[4,3-d]оксазолил, 2-, 4- или 54Hимидазо[4,5-d]тиазолил, 3-, 5- или 8-пиразино[2,3-d]пиридазинил, 2-, 3-, 5- или 6- имидазо[2,1b]тиазолил, 1-, 3-, 6-, 7-, 8- или 9-фуро[3,4-c]циннолинил, 1-, 2-, 3-, 4-, 5-, 6-, 8-, 9-, 10 или 11-4Hпиридо[2,3-c]карбазолил, 2-, 3-, 6- или 7-имидазо[1,2-b][1,2,4]триазинил, 7-бензо[b]тиенил, 2-, 4-, 5-, 6 или 7-бензоксазолил, 2-, 4-, 5-, 6- или 7-бензимидазолил, 2-, 4-, 4-, 5-, 6- или 7-бензотиазолил, 1-, 2-, 4-,5-, 6-, 7-, 8- или 9-бензоксазинил, 2-, 4-, 5-, 6-, 7- или 8-бензоксазинил, 1-, 2-, 3-, 5-, 6-, 7-, 8-, 9-, 10- или 11-1H-пирроло[1,2-b][2]бензазапинил. Типичные конденсированные гетероарильные группы включают,но не ограничиваются перечисленным, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолинил, 1-, 3-, 4-, 5-, 6-, 7- или 8 изохинолинил, 2-, 3-, 4-, 5-, 6- или 7-индолил, 2-, 3-, 4-, 5-, 6- или 7-бензо[b]тиенил, 2-, 4-, 5-, 6- или 7 бензоксазолил, 2-, 4-, 5-, 6- или 7-бензимидазолил, 2-, 4-, 5-, 6- или 7-бензотиазолил. Гетероарильная группа может быть моно-, би-, три- или полициклической; в некоторых воплощениях настоящего изобретения - моно-, би- или трициклической; еще в некоторых воплощениях - моноили бициклической. Использованный здесь термин "галоген" или "гало" относится к фтору, хлору, брому и йоду. Использованный здесь термин "изомеры" относится к различным соединениям, имеющим одну и ту же молекулярную формулу, но отличающимся расположением и конфигурацией атомов. Также использованный здесь термин "оптический изомер" или "стереоизомер" относится к любой из возможных стереоизомерных конфигураций, которые существуют для данного соединения настоящего изобретения, и включает геометрические изомеры. При этом подразумевается, что заместитель может быть присоединен при хиральном центре атома углерода. Следовательно, изобретение включает энантиомеры, диастереомеры и рацематы соединения. "Энантиомеры" представляют собой пару стереоизомеров, которые являются неналагающимися зеркальными изображениями друг друга. Смесь 1:1 пары энантиомеров называется "рацемической" смесью. Этот термин используется для обозначения рацемической смеси, когда это уместно. "Диастереоизомеры" представляют собой стереоизомеры, обладающие по крайней мере двумя асимметричными атомами, которые не являются зеркальными изображениями друг друга. Абсолютная стереохимия подробно определяется по R,S-системе Кана-Ингольда-Прелога. Когда соединение является чистым энантиомером, стереохимия при каждом хиральном углероде определяется либо по R, либо по S. Полученные соединения, абсолютная конфигурация которых неизвестна, могут обозначаться (+) или (-) в зависимости от направления (право- или левовращающие), в котором они вращают плоскость поляризации света при длине волны D-линии натрия. Определенные соединения, описанные в данном документе,содержат один или более асимметричных центров и поэтому могут привести к образованию энантиомеров, диастереомеров и других стереоизомерных форм, которые определяются в терминах абсолютной стереохимии как (R)- или (S)-. Подразумевается, что настоящее изобретение включает всевозможные подобные изомеры, в том числе рацемические смеси, оптически чистые формы и промежуточные смеси. Оптически активные (R)- и (S)-изомеры могут быть получены с помощью хиральных синтонов или хиральных реагентов, или какими-либо традиционными методами. Если соединение содержит двойную связь, то заместителем может быть E- или Z-конфигурация. Если соединение содержит дизамещенный циклоалкил, то заместитель циклоалкила может обладать цис- или транс-конфигурацией. Кроме того,подразумевается, что все таутомерные формы тоже являются частью настоящего изобретения. Использованный здесь термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют биологическую эффективность и свойства соединений данного изобретения и которые не являются нежелательными с биологической или какой-либо другой точки зрения. Во многих случаях соединения данного изобретения могут образовывать кислотные и/или основные соли, благодаря присутствию амино и/или карбоксильных групп или других подобных групп. Фармацевтически приемлемые соли,полученные посредством присоединения кислоты, могут быть образованы с помощью неорганических кислот и органических кислот. Неорганические кислоты, из которых могут быть образованы соли, включают, например, хлористо-водородную кислоту, бромисто-водородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Органические кислоты, из которых могут быть образованы соли,включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винно-каменную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, p-толуолсульфоновую кислоту, салициловую кислоту и т.п. Фармацевтически приемлемые соли, полученные посредством присоединения основания, могут быть образованы с помощью неорганических и органических оснований. Неорганические основания, из которых могут быть образованы соли, включают, например, натрий, калий,литий, аммоний, кальций, магний, железо, цинк, медь, марганец, алюминий и т.п.; при этом особенно предпочтительными являются соли аммония, калия, натрия, кальция и магния. Органические основания,из которых могут быть образованы соли, включают, например, первичные, вторичные и третичные амины, замещенные амины, в том числе природные замещенные амины, циклические амины, основные ионообменные смолы и т.п., особенно такие, как изопропиламин, триметиламин, диэтиламин, триэтиламин,трипропиламин и этаноламин. Фармацевтически приемлемые соли настоящего изобретения могут быть-4 016108 синтезированы из исходного соединения, из основной или кислотной группы общепринятыми химическими методами. Как правило, такие соли могут быть получены с помощью реакции свободных кислотных форм данных соединений со стехиометрическим количеством соответствующего основания (например, гидроксидом, карбонатом, бикарбонатом Na, Ca, Mg или K и т.п.) или с помощью реакции свободных основных форм данных соединений со стехиометрическим количеством соответствующей кислоты. Подобные реакции обычно проводятся в воде или в органическом растворителе, или в смеси того и другого. Как правило, по возможности предпочтительной является неводная среда, например эфир, этилацетат, этанол, изопропанол или ацетонитрил. Списки остальных подходящих солей приведены, например, в работе "Фармацевтические науки" Ремингтона (Remington's Pharmaceutical Sciences), 20-е изд., Mack Publishing Company, Easton, Pa., (1985). Использованный здесь термин "фармацевтически приемлемый носитель" включает любые и всякие растворители, дисперсионные среды, оболочки, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные агенты, противогрибковые агенты), изотонические агенты, задерживающие абсорбцию вещества, соли, консерванты, лекарственные препараты, стабилизаторы, связующие вещества, эксципиенты, дезинтегрирующие агенты, смазки, подслащивающие агенты, ароматизаторы, красители, в виде материалов и их сочетаний, хорошо известных специалистам, обладающим обычными познаниями в области, к которой относится настоящее изобретение (см., например, "Фармацевтические науки" Ремингтона (Remington's Pharmaceutical Science), 18-е изд., Mack Printing Company,1990, с. 1289-1329, которые включены в настоящий документ посредством ссылки). За исключением случаев, когда какой-либо общепринятый носитель несовместим с активным компонентом, он может использоваться в терапевтической или фармацевтической композиции. Термин "терапевтически эффективное количество" соединения настоящего изобретения относится к количеству соединения настоящего изобретения, которое способно вызвать биологическую или медицинскую реакцию у субъекта, например снижение или ингибирование активности фермента или белка,или улучшение симптомов, облегчение состояния, замедление или приостановку прогрессирования заболевания, или предупреждение заболевания и т.д. В одном неограничивающем варианте воплощения изобретения термин "терапевтически эффективное количество" относится к количеству соединения настоящего изобретения, которое при получении субъектом является эффективным для: (1) хотя бы частичного облегчения, подавления, предупреждения и/или улучшения состояния, или нарушения, или заболевания:(i) обусловленных протеинкиназами семейства PKD, или (ii) связанными с действием протеинкиназ семейства PKD, или (iii) характеризующимися патологической активностью протеинкиназ семейства PKD; или (2) снижения или подавления действия протеинкиназ семейства PKD; или (3) снижения или ингибирования экспрессии протеинкиназ семейства PKD. В другом неограничивающем варианте воплощения термин "терапевтически эффективное количество" относится к количеству соединения настоящего изобретения, которое при введении в клетку или ткань, или неклеточный биологический материал, или среду является эффективным хотя бы для частичного снижения или ингибирования активности протеинкиназ семейства PKD; или хотя бы частичного снижения или подавления экспрессии протеинкиназ семейства PKD. Значение термина "терапевтически эффективное количество", как показано выше на примере воплощения настоящего изобретения для протеинкиназ семейства PKD, также применимо в том же смысле и ко всем другим релевантным протеинам/пептидам/ферментам, таким как, например,MARK1/2/3, PKN-1/2, CDK-9, CaMKII, ROCK-I/II, гистондеацетилаза (HDAC) или другим киназам и т.д. Использованный здесь термин "субъект" относится к животному. В некоторых воплощениях настоящего изобретения животное является млекопитающим. Субъект также относится, например, к приматам (т.е. людям), коровам, овцам, козам, лошадям, собакам, кошкам, кроликам, крысам, мышам, рыбам, птицам и т.п. Использованный здесь термин "нарушение" или "заболевание" относится к любому расстройству или отклонению от нормального функционирования; нездоровому физическому или психическому состоянию, см. "Иллюстрированный медицинский словарь Дорланда" (Dorland's Illustrated Medical Dictionary, W.B. Saunders Co., 27-е изд., 1988). Использованный здесь термин "ингибирование" или "ингибирующий" относится к снижению или подавлению исходного состояния, симптома или нарушения, или заболевания, или значительному уменьшению основной активности биологической деятельности или процесса. В некоторых воплощениях настоящего изобретения состояние или симптом, или нарушение, или заболевание обусловлено активностью протеинкиназ семейства PKD. Еще в некоторых воплощениях настоящего изобретения состояние или симптом, или нарушение, или заболевание связано с патологической активностью протеинкиназ семейства PKD, или состояние или симптом, или нарушение, или заболевание связано с патологической экспрессией протеинкиназ семейства PKD. Термин "ингибирование" или "ингибирующий" также применим в том же смысле к другим ферментам/протеинам/пептидам, т.е. MARK1/2/3, PKN-1/2, CDK-9,CaMKII, ROCK-I/II, гистондеацетилаза (HDAC) или другим киназам и т.д. Использованный здесь термин "лечение" какого-либо заболевания или нарушения относится в одном варианте воплощения настоящего изобретения к улучшению при заболевании или нарушении (т.е. замедлению или задержке, или уменьшению развития заболевания, или по крайней мере одного из его-5 016108 клинических симптомов). В другом варианте воплощения термин "лечение" относится к облегчению или улучшению хотя бы одного физического показателя, включая параметры, остающиеся незаметными для пациента. В еще одном варианте воплощения "лечение" относится к корректировке заболевания или нарушения либо на физическом уровне (например, стабилизация наблюдаемых симптомов), либо на физиологическом уровне (например, стабилизация физических показателей), либо в обоих отношениях. В еще одном варианте воплощения "лечение" относится к предупреждению или задержке возникновения или развития, или прогрессирования заболевания или нарушения. Использованный здесь термин "патологический" относится к активности или свойству, которое отличается от нормальной активности или свойства. Использованный здесь термин "патологическая активность" относится к активности, которая отличается от активности природного гена или протеина, или гена или протеина дикого типа, или которая отличается от активности гена или протеина у здорового субъекта. Патологическая активность может быть интенсивнее или слабее нормальной активности. В одном варианте воплощения изобретения "патологическая активность" включает патологическую (чрезмерную или недостаточную) выработку мРНК,считанной с гена. В другом варианте воплощения изобретения "патологическая активность" включает патологический (чрезмерный или недостаточный) синтез полипептидов в генах. В другом варианте воплощения изобретения патологическая активность относится к уровню мРНК или полипептидов, отличающемуся от нормального уровня указанных мРНК или полипептидов примерно на 15%, примерно на 25%, примерно на 35%, примерно на 50%, примерно на 65%, примерно на 85%, примерно на 100% или больше. В некоторых воплощениях настоящего изобретения патологический уровень мРНК или полипептидов может быть либо выше, либо ниже нормального уровня указанных мРНК или полипептидов. Еще в одном варианте воплощения изобретения патологическая активность относится к функциональной активности протеина, отличающейся от нормальной активности протеина дикого типа. В некоторых воплощениях настоящего изобретения патологическая активность может быть интенсивнее или слабее нормальной активности. В некоторых воплощениях настоящего изобретения патологическая активность вызвана мутациями соответствующего гена, при этом мутации могут являться мутациями в кодирующей области гена или некодирующих областях, например в области транскрипционного промотора. Мутации могут являться мутациями замены, удаления, вставки. Подразумевается, что использованные здесь термины "один", "какой-либо", "определенный" и другие подобные термины, употребленные в контексте настоящего изобретения (особенно в контексте формулы изобретения), распространяются как на единственное, так и на множественное число, если не указано иначе в данном документе или явно не противоречит контексту. Подразумевается, что приведение в данном документе диапазонов значений служит исключительно для того, чтобы сокращенным способом указать на каждое отдельное значение внутри указанного диапазона. Если не указано иначе в этом документе, каждое отдельное значение величин, включенное в данное описание изобретения, следует понимать, как если бы оно было отдельно приведено в данном документе. Все способы, описанные в данном документе, могут выполняться в любом подходящем порядке, если не указано иначе в данном документе, или если это иным способом явно не противоречит контексту. Подразумевается, что любые и все примеры или пояснительные комментарии (например, "такие как"), приведенные в данном документе,служат исключительно для того, чтобы лучше осветить суть изобретения, и не налагают ограничений на объем притязаний изобретения. Никакие формулировки в данном описании изобретения не должны пониматься как указание на какой-либо незаявленный элемент, существенно необходимый для практического применения изобретения. Любой асимметричный атом углерода в соединениях настоящего изобретения может находиться в(R)-, (S)- или (R,S)-конфигурации, в некоторых воплощениях настоящего изобретения - в (R)- или (S)конфигурации. Заместители в атомах с ненасыщенными связями могут, если это возможно, находиться в цис-(Z)- или транс-(E)-форме. Следовательно, соединения настоящего изобретения могут находиться в форме одного из возможных изомеров или их сочетаний, например в форме существенно чистых геометрических (цис или транс) изомеров, диастереомеров, оптических изомеров (антиподов), рацематов или их сочетаний. Любые результирующие сочетания изомеров могут быть разделены по физико-химическим различиям их составляющих на чистые геометрические или оптические изомеры, диастереомеры, рацематы,например, путем хроматографии и/или фракционной кристаллизации. Любые результирующие рацематы конечных продуктов или промежуточных продуктов можно разложить на оптические антиподы известными способами, например путем разделения их диастереомерных солей с помощью оптически активной кислоты или основания, освобождая оптически активное кислотное или основное соединение. В частности, для разложения соединений настоящего изобретения на их оптические антиподы можно использовать группу имидазолила, например, методом фракционной кристаллизации соли, образованной оптически активной кислотой, например винно-каменной кислотой,дибензоилвинной кислотой, диацетилвинной кислотой, ди-O,O'-p-толуол винной кислотой, миндальной кислотой, яблочной кислотой или камфор-10-сульфоновой кислотой. Рацемические продукты также могут быть разложены путем хиральной хроматографии, например жидкостной хроматографией высокого-6 016108 давления (ЖХВД) с помощью хирального адсорбента. И, наконец, соединения настоящего изобретения могут быть получены либо в свободной форме,либо как их соли, либо как их пролекарственные производные. Когда в соединениях настоящего изобретения присутствует основная группа, соединения могут быть преобразованы в их соли присоединения кислоты, в частности в соли присоединения кислоты с группой имидазолила в структуре, в некоторых воплощениях настоящего изобретения - фармацевтически приемлемые соли. Они образованы с помощью неорганических кислот или органических кислот. Приемлемые неорганические кислоты включают, но не ограничиваются перечисленным, хлористоводородную кислоту, серную кислоту, фосфорную или галогенводородную кислоту. Приемлемые органические кислоты включают, но не ограничиваются перечисленным, карбоновые кислоты, такие как (C1C4)алканкарбоновые кислоты, которые, например, могут быть не замещены или замещены галогеном,например уксусная кислота; такие как насыщенные или ненасыщенные дикарбоновые кислоты, например щавелевая, янтарная, малеиновая или фумаровая кислота; такие как гидроксикарбоновые кислоты,например гликолевая, молочная, яблочная, винно-каменная или лимонная кислота; такие как аминокислоты, например аспарагиновая или глутаминовая кислота, органические сульфоновые кислоты; такие как(C1-C4)алкилсульфоновые кислоты, например метансульфоновая кислота; или арилсульфоновые кислоты, незамещенные или замещенные, например, галогеном. Предпочтительными являются соли, образованные с хлористо-водородной кислотой, метансульфоновой кислотой и малеиновой кислотой. Когда в соединениях настоящего изобретения присутствует кислотная группа, соединения могут быть преобразованы в соли с фармацевтически приемлемыми основаниями. Подобные соли включают соли щелочных металлов, такие как соли натрия, лития и калия; соли щелочно-земельных металлов, такие как соли кальция и магния; соли аммония с органическими основаниями, например соли триметиламина, соли диэтиламина, соли трис-(гидроксиметил)метиламина, соли дициклогексиламина и соли Nметил-D-глюкамина; соли с аминокислотами, такие как аргинин, лизин и т.п. Соли могут быть образованы общепринятыми способами преимущественно в присутствии какого-либо эфирного или спиртового растворителя, например низшего алканола. Из растворов последнего соли могут быть осаждены с помощью эфиров, например диэтилового эфира. Получающиеся в результате соли могут быть преобразованы в свободные соединения с помощью обработки кислотой. Эти и другие соли также могут использоваться для очистки полученных соединений. Когда в одной молекуле присутствует как основная группа, так и кислотная группа, соединения настоящего изобретения могут также образовывать внутренние соли. Настоящее изобретение также представляет пролекарства соединений настоящего изобретения, которые превращаются in vivo в соединения настоящего изобретения. Пролекарство представляет собой активное или неактивное соединение, которое вследствие физиологического действия in vivo, которым может являться, например, гидролиз, метаболизм и т.п., после введения этого пролекарства субъекту химически превращается в соединение данного изобретения. Пригодность и способы изготовления и употребления пролекарств хорошо известны специалистам в данной области. Пролекарства могут быть концептуально разделены на две неисключительные категории: пролекарства-биопредшественники и пролекарства-носители, см. The Practice of Medicinal Chemistry, Ch. 31-32 (Ред. Wermuth, Academic Press, SanDiego, Calif., 2001). Как правило, пролекарства-биопредшественники представляют собой соединения,которые неактивны или обладают низкой активностью по сравнению с соответствующими активными лекарственными соединениями, которые содержат одну или более защитную группу и преобразуются в активную форму под действием метаболизма или сольволиза. И активная лекарственная форма, и все выделяющиеся метаболические продукты должны обладать допустимо низкой токсичностью. Обычно образование активного лекарственного соединения затрагивает метаболический процесс или реакцию одного из следующих типов. 1. Окислительные реакции, такие как окисление спиртовой, карбонильной и кислотной функций,гидроксилирование алифатических углеродов, гидроксилирование алициклических атомов углеводорода,окисление ароматических атомов углеводорода, окисление двойных связей углерод-углерод, окисление азотсодержащих функциональных групп, окисление кремния, окислительное N-деалкилирование фосфора, мышьяка и серы, окислительное O- и S-деалкилирование, окислительное дезаминирование, а также другие окислительные реакции. 2. Реакции редукции, такие как редукция карбонильных групп, редукция спиртовых групп и двойных связей углерод-углерод, редукция азотсодержащих функциональных групп и иные реакции редукции. 3. Реакции без изменения состояния окисления, такие как гидролиз сложных эфиров и простых эфиров, гидролитическое расщепление одинарных связей углерод-азот, гидролитическое расщепление неароматических гетероциклических соединений, гидратация и дегидратация при множественных связях, новые атомные связи, получающиеся в результате реакций дегидратации, гидролитическое дегалогенирование, отщепление молекул галоидоводорода и иные подобные реакции. Пролекарства-носители представляют собой лекарственные соединения, содержащие транспортный сегмент, например, такие, которые улучшают усвоение и/или локализованную доставку к сайту (сайтам)-7 016108 действия. Для такого пролекарства-носителя желательно, чтобы сцепление между молекулами лекарства и транспортным сегментом являлось ковалентной связью, пролекарство было неактивным или менее активным, чем лекарственное соединение, и любые выделяющиеся транспортные сегменты были допустимо нетоксичными. Для пролекарства, в котором транспортный сегмент предназначен для улучшения усвоения, обычно выделение транспортного сегмента должно происходить быстро. В иных случаях желательно использовать вещества, которые обеспечивают медленное высвобождение, например, определенные полимеры или другие вещества, такие как циклодекстрины, см. Cheng и соавт., патент США US 20040077595, сер. номер заявки 10/656838, который включен в настоящий документ посредством ссылки. Подобные пролекарства-носители зачастую оказываются полезными для перорально принимаемых лекарственных препаратов. Пролекарства-носители можно использовать, например, для улучшения одного или более из перечисленных ниже показателей: повышения липофильности, увеличения продолжительности фармакологического эффекта, повышения сайт-специфичности, снижения токсичности и неблагоприятных побочных реакций и/или улучшения технологии приготовления лекарственного средства (например, устойчивости, растворимости в воде, подавления нежелательных изменений органолептических или физиохимических свойств). Например, липофильность можно повысить эстерификацией гидроксильных групп липофильными карбоновыми кислотами или карбоксильных групп спиртами, например алифатическими спиртами. Wermuth, The Practice of Medicinal Chemistry, Ch. 31-32, ред. Wermuth, Academic Press, San Diego, Calif., 2001. Примерами пролекарств являются, например, сложные эфиры свободных карбоновых кислот и Sацил и O-ацил производные тиолов, спиртов или фенолов, где ацил понимается, как это определено в данном документе. Предпочтительными являются фармацевтически приемлемые производные сложных эфиров, которые претерпевают изменения, обусловленные сольволизом, при физиологических условиях исходных карбоновых кислот, к ним относятся, например, сложные эфиры низших алкилов, сложные эфиры циклоалкилов, сложные эфиры низших алкенилов, сложные эфиры бензилов, сложные эфиры моно- или дизамещенных низших алкилов, такие как сложные эфиры -(амино, моно- или динизший алкиламино, карбокси, низший алкоксикарбонил)низших алкилов, сложные эфиры -(низший алканоилокси,низший алкоксикарбонил или динизший алкиламинокарбонил)низших алкилов, такие как сложный эфир пивалоилоксиметила и т.п., традиционно применяемые в данной области. Кроме того, амины маскируются под видом производных, замещенных арилкарбонилоксиметилом, расщепленных эстеразами invivo, высвобождающих свободное лекарственное средство и формальдегид (Bundgaard, J. Med. Chem.,2503 (1989. Кроме того, лекарственные средства, содержащие кислотную NH-группу, такие как имидазол, имид, индол и т.п., маскируются с помощью N-ацилоксиметильных групп (Bundgaard, Design ofProdrugs, Elsevier (1985. Гидроксигруппы маскируются под видом сложных эфиров и эфиров. EP 039051 (Sloan and Little) описывает пролекарства гидроксамовой кислоты оснований Манниха, их получение и применение. Поскольку существует тесная зависимость между соединениями, соединениями в форме их солей и пролекарствами, то подразумевается, что любые упоминания соединений настоящего изобретения относятся и к соответствующим пролекарственным формам соединений настоящего изобретения, когда это уместно и целесообразно. Более того, соединения настоящего изобретения, включая их соли, также могут быть получены в форме их гидратов или могут содержать иные растворители, используемые для их кристаллизации. Соединения настоящего изобретения обладают ценными фармакологическими свойствами. Соединения настоящего изобретения применимы в качестве ингибиторов протеинкиназ семейства PKD. Протеинкиназы семейства PKD представляют собой семейство протеинкиназ серина/треонина, которые классифицированы в настоящее время как надсемейство Ca2+/кальмодулин-зависимых протеинкиназ(CaMK). В настоящее время семейство PKD включает PKD1, 2 и 3. Недавно были представлены отчеты,демонстрирующие биологические функции PKD, см. Wang Q.J., "PKD на перекрестке сигнализированияDAG и PKC" ("PKD at the crossroads of DAG and PKC signaling"), TRENDS in Pharmacological Sciences,27(6): 3170323 (2006). Например, было установлено, что активация PKD регулирует деление транспортной несущей среды из аппарата Гольджи в цитоплазматическую мембрану, см. Liljedahl, M. и соавт.,"протеинкиназа D регулирует деление транспортных носителей клеточных поверхностей из сети трансГольджи", Cell., 104:409-420 (2001). PKD играет важную роль в подвижности, инвазии и адгезии клеток. Было также показано, что PKD вызывают пролиферативный эффект во многих клеточных системах и оказывают антиапоптотические эффекты в опухолевых клетках, см. Prigozhina, N.L. и соавт., "Антероградное движение мембран, обусловленное действием протеинкиназы D, необходимое для подвижности фибробластов" ("Protein kinase D-mediated anterograde membrane trafficking is required for fibroblast motility"), Curr. Biol., 14:88-98 (2004), Rozengurt E. и соавт., "Участие протеинкиназы D в передаче сигнала"("Protein kinase D signaling"), JBC, 280(14): 13205-13208 (2005). Было также установлено, что PKD регулируют агонист-зависимую гипертрофию сердца посредством ядерного экспорта гистоновой деацетилазы класса II (HDAC5), см. Vega, R.B. и соавт., "Протеинкиназы C и D вызывают агонист-зависимую гипертрофию сердца посредством ядерного экспорта гистондеацетилазы 5" ("Protein kinase C and D mediateagonist-dependent cardiac hypertrophy through nuclear export of histone deacetylase 5"), Mol. Cell. Biol., 24: 8374-8385 (2004). PKD также принимает участие в ответной реакции на окислительный стресс, активируя транскрипционный фактор Nf-kB для защиты клетки от гибели в условиях окислительного стресса,см. Storz, P. и Toker, A., "Протеинкиназа D вызывает стрессиндуцированную активацию NF-kB и способ выживаемости" ("Protein kinase D mediates a stress-induced NF-kB activation and survival pathway"), EMBOJ., 22: 109-120 (2003). Sjoblom, T. и соавт. связывали PKD с раком молочной железы и колоректальным раком, см. Sjoblom, Т. и соавт., "Согласованные кодирующие последовательности рака молочной железы и колоректального рака у человека" ("The consensus coding sequences of human breast and colorectal cancers"), Science, 314: 268-274 (2006). Было установлено, что PKD регулирует экспрессию генов, связанную с иммунным ответом и функцией кожи, см. Matthews, S.A. и соавт., "Существенная роль протеинкиназ семейства D в регуляции гистондеацетилазы-2 у B-лимфоцитов" ("Essential role for protein kinase D family(2006), Irie, A. и соавт., "Протеинкиназа D2 способствует либо регуляции промотора IL-2, либо индукции гибели клеток в ответ на стимуляцию T-клеточных рецепторов, в зависимости от ее активности в клеткахstimulation depending on its activity in Jurkat cells"), Int. Immunology, 18(12): 1737-1747 (2006), Bollag, W.B. и соавт., "Протеинкиназа D и пролиферация кератиноцитов" ("Protein kinase D and keratinocyte proliferation"), Drug News Perspect, 17(2):117 (2004) и т.д. Данные о биологических функциях PKD показывают,что PKD задействована в заболеваниях или нарушениях, таких как сердечная недостаточность, колоректальный рак, регуляция клеточного роста, аутоиммунные нарушения или гиперпролиферативные поражения кожи и т.д. Соответственно соединения настоящего изобретения, применяемые в качестве ингибиторов протеинкиназ семейства PKD, полезны и при нарушениях или заболеваниях, обусловленных протеинкиназами семейства PKD или восприимчивых к ингибированию протеинкиназ семейства PKD. В частности, соединения настоящего изобретения, применяемые в качестве ингибиторов протеинкиназ семейства PKD, полезны для лечения следующих нарушений или заболеваний: сердечная недостаточность,колоректальный рак, регуляция клеточного роста, аутоиммунные нарушения или гиперпролиферативные поражения кожи и т.д. Кроме того, соединения настоящего изобретения применимы в качестве ингибиторов CaMKII.CaMKII представляет собой внутриклеточный фермент, находящийся в цитоплазме и ядре, способный фосфорилировать несколько различных субстратов. Результаты исследований связывают или показывают участие CaMKII в гипертрофии, сердечной недостаточности, кардиоаритмии, толерантности к опоидам и зависимости от опиоидов, остеопорозе и т.д., см. Ai X., Bers D.M., Pogwizd S.M. (2005) "Усиленная активация Ca2+/кальмодулин-зависимой протеинкиназы в аритмогенной кроличьей модели паралича сердца" ("Enhanced Ca2+/Calmodulin-dependent protein kinase activation in an arrhythmogenic rabbit model"Ca2+/кальмодулин-зависимая протеинкиназа модулирует фосфорилирование рианодинового рецептора сердца и выход Ca2+ из саркоплазматического ретикулума при параличе сердца" ("Ca2+/calmodulindependent protein kinase modulates cardiac ryanodine receptor phosphorylation and sarcoplasmic reticulumCa2+ leak in heart failure"). Circulation Research; 97 (12): 1314-22. Anderson M.E. (2006) "Продление интервала OT и аритмия: неразрывная связь" ("OT interval prolongation and arrhythmia: an unbreakable connection") Journal of Internal Medicine; 259 (1):81-90, Mills G.D., Kubo H., Harris D.M. и соавт. (2006) "Фосфолирование фосфоламбана треонин-17 снижает адренергический сократительный ответ сердца при гипертрофии, вызванной хронической перегрузкой давлением" ("Phosphorylation of phospholamban at threonine17 reduces cardiac adrenergic contractile responsiveness in chronic pressure overload-induced hypertrophy"),American Journal of Physiology-Heart and Circulatory Physiology; 291 (1):H61-H70, Seales E.C., Micoli K.J.,McDonald J.M. (2006) "Кальмодулин является критическим регулятором остеокластической дифференциации, функции и выживания" ("Calmodulin is a critical regulator of osteoclastic differentiation, function,and survival"), Journal of Cellular Biochemistry; 97 (1):45-55, Tang L., Shukla P.K., Wang L.X. и соавт. (2006)"Обратимость толерантности и зависимости от антиноцицептивного действия морфия путем острого супраспинального ингибирования Ca2+/кальмодулин-зависимых протеинкиназ II" ("Reversal of morphineprotein kinase II"), Journal of Pharmacology and Experimental Therapeutics; 317 (2):901-9, Wang Z.J., Tang L.,Xin L.L. (2003) "Обратимость толерантности и зависимости от антиноцицептивного действия морфия путем острого спинного ингибирования Ca2+/кальмодулин-зависимых протеинкиназ II" ("Reversal ofmorphine antinociceptive tolerance by acute spinal inhibition of Ca2+/calmodulin-dependent protein kinase II"),European Journal of Pharmacology, 465 (1-2):199-200, Zhang R., Khoo M.S.C., Wu Y.J., et al. (2005) "Ингибирование кальмодулин-зависимых протеинкиназ II защищает от структурных заболеваний сердца"("Calmodulin kinase II inhibition protects against structural heart disease"), Nature Medicine; 11 (4):409-17,Zhang T., Dalton N., Maier L.S. и соавт. (2002) "Дельта-изоформа CaMKII активируется при гипертрофии сердца и индуцирует дилатационную кардиомиопатии и сердечную недостаточность" ("The delta(c) isoform of CaMKII is activated in cardiac hypertrophy and induces dilated cardiomyopathy and heart failure"), Circulation; 106(19):255.-9 016108 Соответственно соединения настоящего изобретения, применяемые в качестве ингибиторовCaMKII, полезны и для лечения нарушений или заболеваний, обусловленных CaMKII или восприимчивых к ингибированию CaMKII. В частности, соединения настоящего изобретения, применяемые в качестве ингибиторов CaMKII, полезны для лечения следующих нарушений или заболеваний: гипертрофия,сердечная недостаточность, аритмия сердца, толерантность к опоидам и зависимость от опиоидов или остеопороз и т.д. Кроме того, соединения настоящего изобретения применимы в качестве ингибиторов MARK. Ингибиторы MARK связаны со следующими заболеваниями, но не ограничиваясь перечисленным: раковые опухоли, аутоиммунные заболевания, повреждения тканей, нарушения центральной нервной системы,нейродегенеративные расстройства, фиброз, поражения костей, полиглутаминовые болезни, анемии, талассемии, воспалительные процессы, сердечно-сосудистые заболевания и т.д. см. Dequiedt, F. и соавт.,"Молекулярная и клеточная биология" ("Molecular and Cellular Biology"), (2006)26,7086-7102. Кроме того, соединения настоящего изобретения применимы в качестве ингибиторов PRK. PRK задействована в различных процессах, включая регуляцию цитоскелетной организации, апоптоз и пролиферацию клеток (описано в Mukai, 2003). PRK расположены в цитозоли, но при этом оказываются способными перемещаться в ядро в зависимости от полученного сигнала. В этой связи высказывалось предположение, что PRK может играть роль в транскрипционной регуляции экспрессии генов. PRK имеет отношение к гипертрофии сердца и сердечной недостаточности, см. WO 2005074941 и Morissette, M. и соавт., American Journal of Physiology, Heart Circulation Physiology (2000) H1769-1774. Кроме того, соединения настоящего изобретения применимы в качестве ингибиторов CDK9. Ингибиторы CDK9 имеют отношение к гипертрофии сердца, как показано в следующих публикациях: NatureMedicine (2002) 8, 1310; WO 200402226 и EMBO Journal (2004) 23, 3559. Кроме того, соединения настоящего изобретения применимы в качестве ингибиторов ROCK. Ингибиторы CDK9 имеют отношение к гипертрофии сердца, как показано в следующих публикациях: Journalof Hypertension (2005) 23, 87 и Journal of Molecular and Cellular Cardiology (2003) 35, 59. Кроме того, соединения настоящего изобретения применимы в качестве ингибиторов протеинкиназHDAC Class Ha, которые могут включать, но не ограничиваются перечисленным, PKC, PKD, MARK,CaMKII и PRK. Данный вопрос был недавно освещен в журнале Cardiovascular Research (2007) 73, 667. Соединения настоящего изобретения получены из общедоступных соединений способами, известными специалистам в данной области, включая одно или несколько из следующих условий, но не ограничиваясь ими. В рамках данного документа, только легкоудаляемая группа, не входящая в состав определенного требуемого конечного продукта соединения настоящего изобретения, называется "защитной группой",если не указано иначе в конкретных случаях. Защита функциональных групп подобными защитными группами, как самими защитными группами, так и реакциями их расщепления, описаны, например, в таких авторитетных справочниках, как J.F.W. McOmie, "Защитные группы в органической химии" ("Protective Groups in Organic Chemistry"), Plenum Press, London and New York 1973, in T.W. Greene and P.G.M.Chemie"), Houben Weyl, 4-е изд., том 15/I, Georg Thieme Verlag, Stuttgart 1974, в H.-D. Jakubke и Н. Jeschkeit, "Аминокислоты, пептиды, протеины" ("Aminosauren, Peptide, Proteine"), Verlag Chemie, Weinheim,Deerfield Beach, Basel 1982 и в статье Jochen Lehmann, "Химия углеводородов: моносахариды и производные" ("Chemie der Kohlenhydrate: Monosaccharide und Derivate"), Georg Thieme Verlag, Stuttgart, 1974. Соли соединений настоящего изобретения, имеющие хотя бы одну солеобразующую группу, могут быть получены общеизвестными способами. Например, соли соединения настоящего изобретения, обладающие кислотными группами, могут быть образованы, например, взаимодействием данных соединений с соединениями металлов, такими как соли щелочных металлов подходящих органических карбоновых кислот, например натриевая соль 2-этилгексановой кислоты; с соединениями органических щелочных металлов или щелочно-земельных металлов, такими как соответствующие гидроксиды, карбонаты или гидрокарбонаты, такие как гидроксид, карбонат или гидрокарбонат натрия или калия; с соответствующими соединениями кальция или с аммиаком или каким-либо подходящим органическим амином, при этом стехиометрическое количество солеобразующего агента или только небольшой его избыток используется в некоторых воплощениях настоящего изобретения. Соли присоединения кислоты, образованные из соединений настоящего изобретения, получают традиционными способами, например путем обработки кислотой или соответствующим анионообменным реагентом. Внутренние соли соединений настоящего изобретения, содержащие кислоту, и основные солеобразующие группы, например свободная карбоксигруппа и свободная аминогруппа, могут быть образованы, например, путем нейтрализации солей, таких как соли присоединения кислоты, до изоэлектрической точки, например, слабыми основаниями, или путем обработки анионитами. Соли могут быть преобразованы в свободные соединения традиционными способами; соли металлов и аммония могут быть преобразованы, например, путем обработки соответствующими кислотами, а- 10016108 соли присоединения кислоты, например, путем обработки соответствующими основными агентами. Смеси изомеров, получаемые в соответствии с изобретением, могут быть разделены общеизвестными способами на отдельные изомеры; диастереоизомеры могут быть разделены, например, путем декомпозиции на полифазные растворяющие смеси, путем рекристаллизации и/или путем хроматографического разделения, например, через силикагель, или путем, например, жидкостной хроматографии среднего давления на обращенно-фазовой колонке, а рацематы могут быть разделены, например, путем образования солей с помощью оптически чистых солеобразующих реагентов, и разделение смеси диастереоизомеров, таким образом, получено, например, методами фракционной кристаллизации или методом хроматографии на колонке с оптически активными веществами. Промежуточные продукты и конечные продукты могут быть выделены и/или очищены стандартными способами, например, используя хроматографические методы, методы распределения, (ре-)кристаллизацию и т п. Следующее применимо в общем случае ко всем процессам, описанным выше и ниже в этом документе. Все описанные стадии технологического процесса могут быть выполнены при общеизвестных условиях реакций, включая конкретные реакции, о которых упоминалось в данном документе, в отсутствие или, традиционно, в присутствии растворителей или разбавителей, в том числе, например, растворителей или разбавителей, инертных по отношению к используемым реагентам и растворяющих их, в отсутствие или присутствии катализаторов, конденсирующих или нейтрализующих агентов, например анионитов,таких как катионообменники, например, в форме H+, в зависимости от характера конкретной реакции и/или реагентов при пониженной, нормальной или повышенной температуре, например в температурном диапазоне от приблизительно -100C до приблизительно 190C, в том числе, например, от приблизительно -80C до приблизительно 150C, например, при температуре от -80 до -60C, при комнатной температуре, при температуре от -20 до 40C или при температуре флегмы, под атмосферным давлением или в закрытом сосуде, когда это целесообразно, под давлением, и/или в инертной среде, например в атмосфере аргона или азота. На каждой стадии реакций образованные смеси изомеров могут быть разделены на отдельные изомеры, например диастереоизомеры или энантиомеры, или на любые нужные смеси изомеров, например рацемические смеси или смеси диастереоизомеров, например, по аналогии с методами, описанными в разделе "Дополнительные стадии технологического процесса". Растворители, из которых могут быть выбраны растворители, подходящие для каждой конкретной реакции, включают конкретные растворители, о которых упоминалось в данном документе, или, например, воду, сложные эфиры, такие как низшие алкилы-низшие алканоаты, например этилацетат, эфиры,такие как алифатические эфиры, например диэтиловый эфир, или циклический эфиры, например тетрагидрофуран или диоксан, жидкие ароматические углеводороды, такие как бензол или толуол, спирты,такие как метанол, этанол, 1- или 2-пропанол, нитрилы, такие как ацетонитрил, галогенизированные углеводороды, такие как метиленхлорид или хлороформ, кислотные амиды, такие как диметилформамид или диметилацетамид, основания, такие как гетероциклические азотные основания, например пиридин или N-метилпирролидин-2-он, ангидриды карбоновых кислот, такие как ангидриды низших алкановых кислот, например уксусный ангидрид, циклические, линейные или разветвленные углеводороды, такие как циклогексан, гексан или изопентан, или смеси этих растворителей, например водные растворы, если не указано иначе в описании конкретных технологий. Подобные смешанные растворители могут также использоваться для выделения веществ, например, методом хроматографии или декомпозиции. Соединения, включая их соли, также могут быть получены в форме гидратов, или их кристаллы могут содержать, например, растворитель, используемый для кристаллизации. Могут присутствовать различные кристаллические формы. Изобретение также относится к таким видам технологического процесса, во время которых полученное на любой стадии процесса промежуточное вещество используется в качестве исходного материала, а затем осуществляются остальные стадии технологического процесса, или при которых исходный материал образован в условиях реакции или используется в форме производного, например, в защищенной форме или в виде соли, или соединение, образованное процессом согласно изобретению, получено в соответствии с условиями процесса и подвергается дальнейшей обработке in situ. Все исходные материалы, элементы, реагенты, кислоты, основания, дегидратирующие агенты, растворители и катализаторы, использованные для синтеза соединений настоящего изобретения, либо имеются в продаже, либо могут быть получены методами органического синтеза, известными любому человеку, обладающему обычными познаниями в области, к которой относится настоящее изобретение(Houben-Weyl, 4-е изд., 1952, "Методы органического синтеза" ("Methods of Organic Synthesis"), издательство Thieme, т. 21). Как правило, соединения формулы (I) могут быть получены по схемам 1-4. Первым шагом синтеза является приготовление общих промежуточных дигалогенов 8 и 9, как показано на схеме 1. Изоникотинамиды 2 могут быть получены, исходя из 3-метилизоникотинонитрила (1), как описано в литературе(Y.G. Gu и соавт., Bioorg. Med. Chem. Lett, 9 (10), 1999, 1341) или с помощью реакции сочетания 3 метилизоникотиновой кислоты с трет-бутиламином в присутствии общего дегидратирующего реагента,как оксалилхлорид/N,N-диметилформамид и основания (например, триэтиламина) в соответствующем растворителе (например, дихлорметане). Альтернативно, заместитель 3-пиридила может быть введен вN-трет-бутилизоникотинамид 3 путем депротонирования с участием амидов, используя очень сильное основание (например, n-BuLi), с последующей обработкой подходящим электрофилом (например, метилйодидом). Пиколин 2 может быть далее обработан подходящим основанием (например, n-BuLi) с последующим улавливанием подходящим электрофилом (например, йодометаном) до получения 4. Инициированная основанием конденсация соединения 2 или 4 со сложным метиловым эфиром 2 хлоризоникотиновой кислоты дает 5. Циклизация, обусловленная кислотой (например, кислой аминокислотой) приводит к образованию лактона 6, а его обработка нуклеофильным реагентом (например,аммиаком в этаноле) с последующим окислением (например, AcOH) дает желаемый лактам 7. Последующая реакция с галогенирующим агентом (например, оксихлоридом фосфора POCl3 или оксибромид фосфора POBr3) дает общие промежуточные продукты 8 и 9. Дигалоид 9 может быть напрямую превращен в соединения по формуле 1, где R1=R14 и R2=R15 путем обработки соответствующим нуклеофилом амином HNR1R2 (например, n-бутиламином) в автоклаве при повышенной температуре (например, 130C). При более низких температурах (например, 45C) галоген нафтиридина селективно смещается, что позволяет дальнейшее получение галогенпиридина и образование соединений по формуле 1, где R1R14 и R2R15. Альтернативно, обработка соединения 8 метоксидом натрия в метаноле приводит к образованию соединения 10, что позволяет провести последующую функционализацию фрагментов хлорпиридила в соединения по формуле 1. Нуклеофильного замещения соответствующим амином можно достичь, например, либо в условиях микроволновых реакций или с помощью реакции Бухвальда-Хартвига (J.F.Hartwig, Angew. Chem. Int. Ed., 37, 1998, 2046), используя в качестве исходного материала палладий (например, Pd(OAc)2), соответствующий растворитель, например толуол или 1,4-диоксан, соответствующий лиганд (например, BINAP) и соответствующее основание (например, t-BuOK). R1 или R2 в формуле 11 можно далее функционализировать, например, методом омыления сложным эфиром с последующим получением амида реакцией сочетания. Гидролиз имидата 11 с использованием t-BuOK в водном раствореt-BuOH дает 12. Соединение 13 получено обработкой соответствующим хлорирующим агентом (например, POCl3) и последующим нуклеофильным замещением подходящим амином, например, путем размешивания, в некоторых воплощениях настоящего изобретения в полярном протонном растворителе (например, этаноле), в некоторых воплощениях настоящего изобретения при повышенной температуре, до завершения реакции. Любой из радикалов R1, R2, R14 или R15 впоследствии подвержен дальнейшей функционализации как промежуточное соединение 11 или 12, например, с помощью реакции образования амидов, и любой из радикалов R1, R2, R14, или R15 может быть окончательно лишен защитных свойств(например, вследствие расщепления (трет-бутоксикарбонильной группы BOC) с помощью сильной кислоты, такой как трифторуксусная кислота (ТФК), в соответствующем растворителе, таком как дихлорметан (ДХМ. В зависимости от описанных этапов соединения настоящего изобретения могут быть получены как нейтральные соединения или в любых солевых формах (например, в форме гидрохлорида,соли трифторуксусной кислоты). В качестве альтернативы подходу, изображенному на схеме 2, общий промежуточный агент может быть получен в результате следующей последовательности реакций (схема 3). Нуклеофильное замещение хлорида 8 соответствующим амином, например, либо в условиях микроволновых реакций, либо с помощью реакции Бухвальда-Хартвига (J.F. Hartwig, Bioorg. Angew. Chem. Int., ред. 37, 1998, 2046), используя палладиевый катализатор (например, Pd(OAc)2), соответствующий растворитель, например толуол или 1,4-диоксан, соответствующий лиганд (например, BINAP) и соответствующее основание (например, t-BuOK), дает хлорпиридин 14. Последующее второе нуклеофильное замещение соответствующим амином, например, путем размешивания, в некоторых воплощениях настоящего изобретения в полярном протонном растворителе (например, этаноле), в некоторых воплощениях настоящего изобретения при повышенной температуре, до завершения реакции, дает соединение 15. Нафтиридин 14 может быть далее функционализирован действием соответствующего электрофила (например, брома) до получения соединений 16. Бромид 16 подвергается реакции кросс-сочетания в присутствии палладиевых катализаторов, например сочетания по Сузуки или сочетания по Бухвальду или иным реакциям, известным специалистам в данной области, до получения соединений 17, где R7H. По аналогии, соединения 17 могут быть превращены в соединения 15 описанными выше методами. В качестве альтернативы нафтиридины 14 могут быть получены напрямую из нитрила 18 обработкой нуклеофилом HNR1R2 по схеме 4. Схема 4 В качестве альтернативы нафтиридины 13 могут быть получены из 7 с помощью реакции кросссочетания в присутствии палладиевых катализаторов между фрагментом хлорпирина и амином HR14R15,с последующим хлорированием с POCl3 до получения 19 и обработкой нуклеофилом HNR1R2 по схеме 5. Соединения 19 могут быть далее галогенированы электрофильными галогенирующими агентами, такими как N-бромсукцинимид или ему подобными, до получения соединения 20. Замещение 1-нафтил хлорида соответствующими нуклеофилами HR14R15 приводит к соединениям 21. Все остальные галогены в соединениях 21 могут быть превращены в группы R известными в данной области методами, такими как сочетания по Сузуки. Схема 5 Любой из радикалов R1, R2, R14 или R15 может впоследствии быть подвержен дальнейшей функционализации, как промежуточное соединение 14, 16 или 17, например, с помощью реакции образования амидов, и любой из радикалов R1-R4 может быть окончательно лишен защитных свойств (например,вследствие расщепления трет-бутоксикарбонильной группы BOC с помощью сильной кислоты, такой как трифторуксусная кислота (ТФК), в соответствующем растворителе, таком как дихлорметан (ДХМ. В зависимости от описанных этапов соединения настоящего изобретения могут быть получены как нейтральные соединения или в любых солевых формах (например, в форме гидрохлорида, соли трифторуксусной кислоты), кислоты, например трифторуксусной кислоты (ТФК) в соответствующем растворителе,например дихлорметане (ДХМ). В зависимости от описанных этапов соединения настоящего изобретения могут быть получены как нейтральные соединения или в любых солевых формах (например, в форме гидрохлорида, соли трифторуксусной кислоты).- 14016108 Как правило, энантиомеры соединений настоящего изобретения могут быть получены методами разложения рацемических смесей, известными специалистам в данной области, например, путем образования и рекристаллизации диастереомерных солей, или методом хиральной хроматографии, или разделением методом ВЭЖХ с использованием хиральных неподвижных фаз. В исходных соединениях и промежуточных продуктах, преобразованных в соединения настоящего изобретение способами, описанными в данном документе, присутствующие функциональные группы,такие как аминогруппы, тиолы, карбоксильные группы и гидроксильные группы, необязательно защищены обычными защитными группами, принятыми в препаративной органической химии. К защищенным аминогруппам, тиолам, карбоксильным и гидроксильным группам относятся такие группы, которые могут быть преобразованы при умеренных условиях в свободные аминогруппы, тиолы, карбоксильные и гидроксильные группы без разрушения молекулярной структуры или иных нежелательных побочных реакций. Введение защитных групп предназначено для защиты функциональных групп от нежелательных реакций с компонентами реакций при условиях, созданных для осуществления желаемого химического превращения. Необходимость и выбор защитных групп для конкретной реакции известны специалистам в данной области и зависят от природы функциональной группы, нуждающейся в защите (гидроксильная группа, аминогруппа и т.д.), структуры и устойчивости молекулы, частью которой является заместитель и условия реакции. Хорошо известные защитные группы, удовлетворяющие этим условиям, их введение и удаление описаны, например, в работе McOmie, "Защитные группы в органической химии" ("Protective Groups inOrganic Chemistry"), Plenum Press, London, NY (1973) и в работе Greene и Wuts, "Защитные группы в органическом синтезе" ("Protective Groups in Organic Synthesis"), John Wiley and Sons, Inc., NY (1999). Описанные выше реакции проводятся в соответствии со стандартными методами, в присутствии или в отсутствии разбавителя, в некоторых воплощениях настоящего изобретения в присутствии разбавителя, инертного к реагентам и являющегося растворителем таковых; катализаторов, конденсирующих или указанных иных агентов соответственно, и/или в инертных атмосферах, при низких температурах,комнатной температуре или повышенных температурах; в некоторых воплощениях настоящего изобретения в или близко к точке кипения применяемых растворителей, и при атмосферном давлении или давлении выше атмосферного. Предпочтительные растворители, катализаторы и условия реакций изложены в прилагаемых иллюстративных примерах. Далее, изобретение включает в себя любые вариации описанных технологических процессов, во время которых полученный на любой стадии процесса промежуточный продукт используется в качестве исходного материала, и осуществляются остальные стадии технологического процесса, или при которых исходный материал образован in situ в условиях реакции, или при которых компоненты реакции используются в форме их солей или оптически чистых антиподов. В другом аспекте настоящее изобретение представляет фармацевтическую композицию, состоящую из соединения настоящего изобретения и фармацевтически приемлемого носителя. Фармацевтическая композиция может быть составлена для различных типов введения, таких как пероральное введение, парентеральное введение, ректальное введение и т.д. Кроме того, фармацевтические композиции настоящего изобретения могут быть изготовлены в твердой форме, включая капсулы, таблетки, пилюли, гранулы,порошки или суппозитории, или в жидкой форме, включая растворы, суспензии или эмульсии. Фармацевтические композиции могут быть подвергнуты традиционным способам фармацевтической обработки, таким как стерилизация, и/или могут содержать традиционные инертные разбавители, смазочные агенты или буферные агенты, а также адъюванты, такие как консерванты, стабилизаторы, смачивающие реагенты, эмульгаторы, буферы и т.д. В некоторых воплощениях настоящего изобретения фармацевтические композиции являются таблетками и желатиновыми капсулами, содержащими активный компонент наряду с:b) смазками, такими, например, как двуокись кремния, тальк, стеариновая кислота, ее магниевая или кальциевая соль, и/или полиэтиленгликоль; а для таблеток такжеc) связующими веществами, такими, например, как силикат магния алюминия, крахмальная паста,желатин, трагакант, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и/или поливинилпирролидон; при желанииd) разрыхлителями, такими, например, как крахмалы, агар, альгиновая кислота или ее натриевая соль, или шипучие смеси; и/илиe) абсорбентами, красителями, вкусовыми добавками и подсластителями. Таблетки могут быть покрыты или пленочной оболочкой, или энтеросолюбильной оболочкой в соответствии с методами, известными в данной области. Соответствующие композиции для перорального введения включают эффективную дозу соединения настоящего изобретения в форме таблеток, таблеток для рассасывания, водной или масляной суспензии, дисперсные порошки или гранулы, эмульсию, твердые или мягкие капсулы, сиропы или эликсиры.- 15016108 Композиции, предназначенные для перорального использования, получают в соответствии с любыми методами изготовления фармацевтической композиции, известными в данной области, и эти композиции могут содержать один или несколько агентов, выбранных из группы, содержащей подслащивающие агенты, ароматизаторы, красящие агенты и консервирующие агенты, для того чтобы обеспечить лекарственные препараты с фармацевтически элегантным дизайном и привлекательным вкусом. Таблетки содержат активный компонент в сочетании с нетоксичными фармацевтически приемлемыми эксципиентами, пригодными для изготовления таблеток. К таким эксципиентам относятся, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие агенты и разрыхлители, например кукурузный крахмал или альгиновая кислота; связывающие агенты, например крахмал, желатин или гуммиарабик; и смазочные агенты, например стеарат магния, стеариновая кислота или тальк. Таблетки не покрыты или покрыты оболочкой традиционными методами для замедления распада и абсорбции в желудочно-кишечном тракте и таким образом обеспечивают длительное действие на протяжении более долгого времени. Например, могут применяться материалы, обеспечивающие задержку по времени, такие как глицерил моностеарат или глицерил дистеарат. Композиции для перорального применения могут быть представлены в виде твердых желатиновых капсул, в которых активный компонент содержится в сочетании с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный компонент смешан с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Инъецируемые композиции являются в некоторых воплощениях настоящего изобретения водными изотоническими растворами или суспензиями, а суппозитории преимущественно приготовлены из жировых эмульсий или суспензий. Указанные композиции могут быть стерилизованы и/или содержать адъюванты, такие как консервирующие, стабилизирующие, смачивающие или эмульгирующие агенты, промоторы, соли для регуляции осмотического давления и/или буферы. Кроме того, они могут содержать другие терапевтически ценные вещества. Указанные композиции приготовлены в соответствии с традиционными методами смешивания, гранулирования или покрытия оболочкой соответственно и содержат приблизительно 0,1-75%, в некоторых воплощениях настоящего изобретения приблизительно 1-50% активного компонента. Соответствующие композиции для трансдермального применения включают эффективную дозу соединения настоящего изобретения в сочетании с носителем. Эффективные носители включают абсорбируемые фармакологически приемлемые растворители, способствующие проникновению через кожу. Например, трансдермальные аппликаторы изготовлены в форме повязки, состоящей из элемента обратной стороны, резервуара, содержащего соединение необязательно в сочетании с носителем, необязательно преграждающий элемент для регулирования скорости введения соединения через кожу пациента с контролируемой или заданной на длительный промежуток времени скоростью введения и средства для крепления аппликатора к коже. Соответствующие композиции для местного применения, например на кожу или глаза, включают водные растворы, суспензии, мази, крема, гели или распыляемые композиции, например, в виде аэрозолей и т.п. Подобные устройства для местного применения особенно подходят для кожного применения,например для лечения рака кожи, например, для профилактического использования в солнцезащитных кремах, лосьонах, аэрозолях и т.п. Поэтому они особенно пригодны для композиций местного применения, в том числе косметических, хорошо известных в данной области. В таком случае они могут содержать солюбилизаторы, стабилизаторы, агенты, повышающие тонус, буферы и консерванты. Кроме того, настоящее изобретение представляет безводные фармацевтические композиции и лекарственные формы, содержащие соединения настоящего изобретения в качестве активных компонентов, поскольку вода может способствовать расщеплению некоторых соединений. Например, в фармацевтике широко распространено понимание, что добавление воды (например, 5%) влияет на длительность хранения, и учитывается при определении таких характеристик, как срок годности или устойчивость композиций с течением времени, см., например, Jens T. Carstensen, "Устойчивость лекарственных препаратов: принципы и их применение" (Drug Stability: PrinciplesPractice), 2-е изд., Marcel Dekker, NY,N.Y., 1995, с. 379-80. В действительности, вода и тепло ускоряют расщепление некоторых соединений. Поэтому влияние воды на композицию может иметь огромное значение, поскольку влага и/или влажность обычно присутствуют в процессе изготовления, обработки, упаковки, хранения, транспортировки и использования лекарственных препаратов. Безводные фармацевтические композиции и лекарственные формы настоящего изобретения могут быть получены с использованием безводных компонентов или компонентов с низким содержанием влаги и в условиях с низким содержанием влаги или при пониженной влажности. Фармацевтические композиции и лекарственные формы, содержащие лактозу и по крайней мере один активный компонент, который содержит первичный или вторичный амин, являются в некоторых воплощениях настоящего изобретения безводными, если предполагается, что во время их изготовления, упаковки и/или хранения они будут подвержены значительному воздействию влаги и/или влажности. Безводные фармацевтические композиции необходимо приготовлять и хранить таким образом, что- 16016108 бы сохранялась их безводная природа. Соответственно в некоторых воплощениях настоящего изобретения безводные композиции упаковываются в такие материалы, которые, как известно, предотвращают воздействие воды и поэтому могут использоваться в качестве фармацевтически приемлемых средств. Примерами подходящих упаковок являются, но не ограничиваются перечисленным, герметичные упаковки из фольги, пластмассовые упаковки, емкости, содержащие одноразовую дозу (например, ампулы),блистерные упаковки и контурные упаковки ленточного типа. Кроме того, изобретение представляет фармацевтические композиции и лекарственные формы, содержащие один или несколько агентов, которые снижают скорость распада активного компонента соединения настоящего изобретения. Подобные агенты, называемые в данном документе "стабилизаторами", включают, но не ограничиваются перечисленным, антиоксиданты, такие как аскорбиновая кислота,pH-буферы или солевые буферы и т.д. Фармацевтические композиции содержат терапевтически эффективную дозу соединения настоящего изобретения, как определено выше, либо сами по себе или в сочетании с одним, двумя или более терапевтическими агентами, например, каждым из них в терапевтической дозе, принятой в данной области. Подобные терапевтические агенты содержат по крайней мере один, два или более компонентов, выбранных из следующих групп: (i) антагонист рецепторов ангиотензина II или его фармацевтически приемлемая соль; (ii) ингибитор ГМГ-КоА-редуктазы или его фармацевтически приемлемая соль; (iii) ингибитор ангиотензинпревращающего фермента (АПФ) или его фармацевтически приемлемая соль; (iv) блокатор кальциевых каналов (БКК) или его фармацевтически приемлемая соль; (v) двойной ингибитор ангиотензинпревращающего фермента и нейтральной эндопептидазы (АПФ/НЭП) или его фармацевтически приемлемая соль; (vi) антагонист рецепторов эндотелина или его фармацевтически приемлемая соль; (vii) ингибитор ренина или его фармацевтически приемлемая соль; (viii) диуретик или его фармацевтически приемлемая соль; (ix) миметик ApoA-I; (x) противодиабетический агент; (xi) агент, снижающий вес; (xii) блокатор рецепторов альдостерона; (xiii) блокатор рецепторов эндотелина; (xiv) ингибитор белка, переносящего эфиры холестерина (CEPT); (xv) ингибитор протонной помпы Na/K-АТФазы; (xvi) блокатор адренергических бета-рецепторов или блокатор альфа-адренергических рецепторов; (xvii) ингибитор нейтральной эндопептидазы (НЭП) и (xviii) инотропный агент. Более того, описанные выше сочетания могут вводиться субъекту одновременно, раздельно или последовательно. Одновременное введение (применение) может заключаться в введении установленного сочетания двух или трех или более активных компонентов или в одновременном введении двух, трех или более соединений, составленных независимо друг от друга. Последовательное введение (применение) в некоторых воплощениях настоящего изобретения означает введение одного (или более) соединения или сочетания активных компонентов в одно время, введение другого соединения или активных компонентов в другое время, то есть в пошаговом режиме; в некоторых воплощениях настоящего изобретения показано, что такое сочетание является более эффективным, чем введение отдельных соединений независимо друг от друга (особенно при проявлении синергизма). Раздельное введение (применение) в некоторых воплощениях настоящего изобретения означает введение соединений или сочетания активных компонентов независимо друг от друга в разное время; в некоторых воплощениях настоящего изобретения это означает, что два, три или более соединений вводятся таким образом, чтобы не наблюдалось наложения измеримых уровней в крови, зависящих от действия обоих соединений одновременно (в одно и то же время). Также возможно сочетание одного, двух или более последовательных, раздельных и одновременных введений в некоторых воплощениях настоящего изобретения таким образом, чтобы сочетание соединение-лекарственные препараты оказывало совместный терапевтический эффект, превосходящий эффект от сочетания соединение-лекарственные препараты, применяемого независимо с достаточно длинными временными интервалами, при которых не наблюдается совместный эффект их терапевтического действия, при этом синергистический эффект является особенно предпочтительным. В качестве альтернативы фармацевтические композиции содержат терапевтически эффективную дозу соединения настоящего изобретения, как определено выше, либо каждую по отдельности, либо в сочетании с одним или несколькими терапевтическими агентами, например каждым в эффективной терапевтической дозе, принятой в данной области, выбранным из группы, состоящей из антиэстрогена; антиандрогена; агониста гонадорелина; ингибитора топоизомеразы I; ингибитора топоизомеразы II; активного агента микротрубочек; алкилирующего агента; антинеопластического антиметаболита; соединений платины; соединения, избирательно подавляющего/снижающего активность протеинкиназы или липидкиназы, или активность протеинфосфатазы или липидфосфатазы, антиангиогенного соединения; соединения, индуцирующего процессы клеточной дифференцировки; моноклональных антител; ингибитора циклооксигеназы; бифосфоната; ингибитора гепараназы; модификатора биологического ответа; ингибитора изоформ онкогена Ras; ингибитора теломеразы; ингибитора протеазы, ингибитора матричной металлопротеиназы, ингибитора метионин аминопептидазы; ингибитора протеасомы; агентов, избирательно подавляющих, снижающих или ингибирующих активность Flt3-тирозинкиназы; ингибитораHSP90; антипролиферативных антител; ингибитора HDAC; соединения, избирательно подавляющего,снижающего или ингибирующего активность/функцию серин/треонин mTOR-киназы; антагониста ре- 17016108 цепторов соматостатина; антилейкозного соединения; веществ, разрушающих опухолевые клетки; связующего агента EDG-рецепторов; ингибитора рибонуклеотид редуктазы; ингибитора декарбоксилазы Sаденозилметионина; моноклонального антитела с целенаправленным действием на VEGF или VEGFR; фотодинамической терапии; ангиостатического стероида; имплантата, содержащего кортикостероиды; антагониста AT1-рецептора и ингибитора АПФ. Кроме того, настоящее изобретение предоставляет фармацевтическую композицию или сочетание соединений настоящего изобретения для использования в качестве лекарственного препарата; применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической композиции, предназначенной для замедления прогрессирования и/или лечения нарушений или заболеваний, обусловленных действием протеинкиназы семейства PKD, или характеризующихся патологической активностью PKD, или патологической экспрессией PKD; применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической композиции, предназначенной для замедления прогрессирования и/или лечения следующих нарушений или заболеваний: сердечная недостаточность, колоректальный рак, регуляция клеточного роста, аутоиммунные нарушения или гиперпролиферативные поражения кожи и т.д. Кроме того, настоящее изобретение предоставляет фармацевтическую композицию или сочетание соединений настоящего изобретения для использования в качестве лекарственного препарата; применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической композиции, предназначенной для замедления прогрессирования и/или лечения нарушений или заболеваний, обусловленных действием протеинкиназы семейства CaMKII, или характеризующихся патологической активностью CaMKII, или патологической экспрессией CaMKII; применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической композиции, предназначенной для замедления прогрессирования и/или лечения следующих нарушений или заболеваний: гипертрофия, сердечная недостаточность, аритмия сердца, толерантность к опиоидам и зависимость от опиоидов или остеопорози и т.д. Кроме того, настоящее изобретение предоставляет фармацевтическую композицию или сочетание соединений настоящего изобретения для использования в качестве лекарственного препарата; применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической композиции, предназначенной для замедления прогрессирования и/или лечения нарушений или заболеваний, обусловленных действием MARK, или характеризующихся патологической активностью MARK, или патологической экспрессией MARK; применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической композиции, предназначенной для замедления прогрессирования и/или лечения следующих нарушений или заболеваний: раковые заболевания, аутоиммунные заболевания, тканевые повреждения, нарушения центральной нервной системы, нейродегенеративные расстройства, фиброз, поражения костей, полиглутаминовые болезни, анемии, талассемия, воспалительные процессы, сердечно-сосудистые заболевания и т.д. Кроме того, настоящее изобретение предоставляет фармацевтическую композицию или сочетание соединений настоящего изобретения для использования в качестве лекарственного препарата; применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической композиции, предназначенной для замедления прогрессирования и/или лечения нарушений или заболеваний, обусловленных действием PRK, или характеризующихся патологической активностью MARK, или патологической экспрессией PRK; применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической композиции,предназначенной для замедления прогрессирования и/или лечения следующих нарушений или заболеваний: гипертрофия сердца, сердечная недостаточность. Кроме того, настоящее изобретение предоставляет фармацевтическую композицию или сочетание соединений настоящего изобретения для использования в качестве лекарственного препарата; применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической композиции, предназначенной для замедления прогрессирования и/или лечения нарушений или заболеваний, обусловленных действием CDK9, или характеризующихся патологической активностью MARK, или патологической экспрессией CDK9; применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической композиции, предназначенной для замедления прогрессирования и/или лечения следующих нарушений или заболеваний: гипертрофия сердца. Кроме того, настоящее изобретение предоставляет фармацевтическую композицию или сочетание соединений настоящего изобретения для использования в качестве лекарственного препарата; применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической композиции, предназначенной для замедления прогрессирования и/или лечения нарушений или заболеваний, обусловленных действием ROCK, или характеризующихся патологической активностью MARK, или патологической экспрессией ROCK; применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической компози- 18016108 ции, предназначенной для замедления прогрессирования и/или лечения следующих нарушений или заболеваний: гипертрофия сердца. Кроме того, настоящее изобретение предоставляет применение фармацевтической композиции или сочетаний соединений настоящего изобретения для приготовления фармацевтической композиции,предназначенной для замедления прогрессирования и/или лечения следующих нарушений или заболеваний: например, заболевания или нарушения, обусловленные T-лимфоцитами, B-лимфоцитами, тучными клетками, лаброцитами, эозинофилами или кардиомиоцитами, например острое или хроническое отторжение органов или тканей алло- или ксенотрансплантатов, реакция "трансплантат против хозяина", реакция "хозяин против трансплантата", атеросклероз, церебральный инфаркт, окклюзия сосудов вследствие сосудистых повреждений, таких ангиопластика, рестеноз, фиброз (особенно пульмональный, но и другие виды фиброзов, например фиброз почек), ангиогенез, гипертензия, сердечная недостаточность, хроническое обструктивное заболевание легких, заболевания ЦНС, такие как болезнь Альцгеймера или боковой амиотрофический склероз, рак, инфекционные заболевания, такие как СПИД, септический шок или синдром расстройства дыхания у взрослых, ишемическое/реперфузионное повреждение, например миокардиальный инфаркт, инсульт, ишемия кишечника, почечная недостаточность, геморрагический шок или травматический шок. Соединения данного изобретения также применимы для лечения и/или предупреждения острых или хронических воспалительных заболеваний или нарушений или аутоиммунных заболеваний, например саркоидоза, пневмофиброза, идиопатической интерстициальной пневмонии, обструктивных заболеваний дыхательных путей, в том числе таких, как бронхиальная астма, наследственная бронхиальная астма, экзогенная бронхиальная астма, пылевая астма, особенно хроническая или застарелая бронхиальная астма (например, поздняя бронхиальная астма и гиперчувствительность дыхательных путей), бронхит, в том числе бронхиальная астма, младенческая астма, ревматоидный артрит, остеоартрит, соматическая эритематозная волчанка, волчаночный нефротический синдром, зоб Хасимото, рассеянный склероз, миастения гравис, сахарный диабет I типа и связанные с ним осложнения, сахарный диабет II типа, развивающийся у взрослых, увеит, нефротический синдром, стероидо-зависимый и стероидорезистентный нефротический синдром, ладонно-подошвенный пустулез, аллергический энцефаломиелит, гломерулонефрит, псориаз, псориатический артрит, атопическая экзема (атопический дерматит),аллергический контактный дерматит, раздражительный контактный дерматит, а также экзематозный дерматит, себорейная экзема, лишай красный плоский, пемфигус, буллезный пемфигоид, буллезный эпидермолиз, уртикария, болезнь Квинке, ангионевротический отек, васкулит, эритемы, кожная эозинофилия, угревая сыпь, очаговая алопеция, эозинофильный фасциит, атеросклероз, конъюнктивит, кератоконъюнктивит, кератит, весенний конъюнктивит, увеит при болезни Бехчета, герпетический кератит,коническая роговица, синдром Шегрена, дистрофия роговицы эпителиальная, помутнение роговицы белого цвета, пемфигоид конъюнктивы, язва Мурена, склерит, офтальмопатия Грейвса, внутриглазное воспаление тяжелой степени, воспаление слизистой оболочки или кровеносных сосудов, такие как заболевания, связанные с повышенным синтезом лейкотриенов B4, язвы желудка, сосудистые повреждения,вызванные ишемическими заболеваниями и тромбозом, гипертрофия сердца, ишемическая болезнь кишечника, воспалительные заболевания кишечника (например, гранулематозная Крона или неспецифический язвенный колит), некротический энтероколит, заболевания почек, в том числе интерстициальный нефрит, синдром Гудпасчера гемолитический уремический синдром и диабетическая нефропатия, следующие нервные заболевания: множественный миозит, синдром Гийена-Барре, болезнь Меньера и радикулопатия, коллагеновые болезни, в том числе склеродермия, гранулематоз Вегенера и синдром Шегрена, хронические аутоиммунные заболевания печени, в том числе аутоиммунный гепатит, первичный билиарный цирроз печени и склерозирующий холангит, частичная резекция печени, острый некроз печени(например, некроз, вызванный токсинами, вирусным гепатитом, шоком или аноксией), цирроз печени,фульминантный гепатит, пустулезный псориаз, болезнь Бехчета, хронический активный гепатит, синдром Эванса, поллиноз, идиопатический гипопаратиреоз, болезнь Аддисона, аутоиммунный атрофический гастрит, люпоидный гепатит, тубулоинтерстициальный нефрит, мембранозный нефрит или ревматический полиартрит. Соединения по формуле (I) применимы для лечения опухолей, например рака груди, рака мочеполовой системы, рака легких, рак, эпидермоид рака желудка и кишечника, меланомы, рака яичников, рака поджелудочной железы, нейробластомы, рак головы и/или шеи или рака мочевого пузыря, или, в более широком смысле, рака почек, головного мозга или желудка; в частности (i) рака молочной железы; эпидермоидных опухолей, например эпидермоидного рака головы и/или шеи или опухоли полости рта; рака легких, например мелкоклеточного или немелкоклеточного рака легких; опухолей желудочно-кишечного тракта, например колоректальный рак; или опухолей мочеполовой системы, например опухолей предстательной железы (особенно гормон-рефрактерная опухоль предстательной железы); или (ii) пролиферативных заболеваний, то есть заболеваний, резистентных к другим видам химиотерапии; или (iii) опухолей, резистентных к другим видам химиотерапии вследствие множественной лекарственной устойчивости. Также они полезны для лечения опухолей кровеносной и лимфатической системы(например, для лечения болезни Ходжкина, неходжкинской лимфомы, лимфомы Беркитта, СПИДассоциированной лимфомы, злокачественных иммунопролиферативных заболеваний, множественной миеломы и злокачественных неоплазм плазматических клеток, лимфоидной лейкемии, острой или хро- 19016108 нический миелоидной лейкемии, остром или хроническом лимфолейкозе, моноцитарной лейкемии, лейкемии других типов специфических типов клеток, лейкемия неспецифических типов клеток, прочих специфических и неспецифических злокачественных лимфоидных неоплазм, неоплазм гемопоэтических клеток и связанных с ними тканей, например диффузной крупноклеточной лимфомы, T-клеточной лимфомы или кожной T-клеточной лимфомы). Рак костного мозга включает, например, острую или хроническую миелоидную лейкемию. Всегда, когда в данном документе упоминаются опухоли, опухолевые заболевания, карцинома или рак, также подразумеваются и метастазы в первоначальном органе или ткани и/или в любом другом месте альтернативно или дополнительно к местам образования опухолей и/или метастаз. Фармацевтическая композиция или сочетание соединений настоящего изобретения могут быть представлены в следующих дозировках: приблизительно 1-1000 мг активных компонентов на приблизительно 50-70 кг веса пациента, в некоторых воплощениях настоящего изобретения приблизительно 1-500 мг, или приблизительно 1-250 мг, или приблизительно 1-150 мг, или приблизительно 0,5-100 мг, или приблизительно 1-50 мг активных компонентов. Терапевтически эффективная доза соединения, фармацевтической композиции или их сочетания зависит от вида субъекта, его веса, возраста и индивидуального состояния, нарушения или заболевания, подлежащих лечению, и их степени тяжести. Терапевт, врачконсультант или ветеринар, обладающие обычными познаниями в данной области, могут без труда определить эффективную дозу каждого активного компонента, необходимую для предупреждения, лечения или подавления прогрессирования конкретного нарушения или заболевания. Свойства вышеупомянутых дозировок можно продемонстрировать с помощью испытаний in vitro иin vivo преимущественно на млекопитающих, например мышах, крысах, собаках, обезьянах, или на отдельных органах, тканях и соответствующих композициях. Соединения настоящего изобретения можно применять in vitro в форме растворов, например, в некоторых воплощениях настоящего изобретения водных растворов, и in vivo либо энтерально, либо парентерально, либо преимущественно внутривенно, например, в качестве суспензии или водного раствора. Дозировка in vitro может варьироваться приблизительно от 10-3 до 10-9 единиц молярной концентрации. Терапевтически эффективная доза in vivo может варьироваться в зависимости от способа введения в пределах приблизительно 0,1-500 мг/кг, в некоторых воплощениях настоящего изобретения в пределах приблизительно 1-100 мг/кг. Действие соединений в соответствии с настоящим изобретением можно оценить следующими методами in vitro и in vivo, подробно описанными в данной области применения: например, на модели чувствительных к соли крыс линии Dahl (DSS), как описано в журнале "Journal of Hypertension" (2005) 23,87, на модели мышей при перегрузке давлением, журнал "Circulation" (1999) 84, 735, или методами, описанными в настоящем документе, например модели РТПХ или модели снижения числа лейкоцитов в периферической крови. Для измерения активности протеинкиназы D1 (PKD1) использовали метод резонансного переноса энергии флуоресценции с разрешением по времени (TR-FRET) с применением технологии LANCE фирмы Перкин-Элмер. В данном случае, в качестве субстрата реакции использовали биотинилированный пептид синтид-2. Фосфорилирование субстрата синтида-2 выявляли специфическим антителом, которое распознает фосфорилированные пептиды. Второй флуорофор (APC) конъюгирован со стрептавидином,который связывает биотинилированный пептид синтид-2. Для осуществления детекции флуорофор европия может быть приведен в возбужденное состояние светом с длиной волны 340 нм, который затем испускает излучение при 615 нм. Таким образом, когда меченное европием вторичное антитело связывается с фосфорилированным пептидом, оно приводится в близкий контакт с APC и возбуждает этот флуорофор. APC испускает излучение при 665 нм, и соотношение 665 нм:615 нм, регистрируемое прибором,является показателем активности PKD1. Данный анализ проводится с использованием полноразмерного фермента дикого типа, экспрессированного в клетках насекомых Sf9 и очищенного от них. Буферный раствор состоит из 35 мМ Tris-HClpH 7,5, 5 мм MgCl2, 0,02% Tween-20, 20 мм АТФ, 1 мм ДТТ и 0,2 мг/мл фермента PKD1. Ферментативная реакция была инициирована добавлением 2 мкМ пептидного субстрата синтида-2 и проводилась в течение 50 мин при комнатной температуре. Реакция была остановлена буферным раствором для остановки и детекции, состоящим из 50 мМ ЭДТУК, 0,18 мг/мл кроличьих поликлональных антител антифосфо синтид-2, 0,5 нм меченных европием антикроличьих IgG и 10 нм APC, конъюгированного со стрептавидином. После 1 ч инкубации с буферным раствором для остановки и детекции результаты реакции регистрировали на фотометре Envision 2100, используя двойной протокол Eu/APC LANCE. Как описано выше, определяется соотношение 665 нм:615 нм для измерения фосфорилирования субстрата и активности фермента. Соединения обычно оцениваются по 11-балльной системе оценки эффекта дозы три раза для каждой концентрации. Значения IC50 вычисляются с помощью программы Activity Base (IDBS). Для измерения активности протеинкиназы D2 (PKD2) использовали метод резонансного переноса энергии флуоресценции с разрешением по времени (TR-FRET) с применением технологии LANCE фирмы Перкин-Элмер). В данном случае, в качестве субстрата реакции использовали биотинилированный пептид синтид-2. Фосфорилирование субстрата синтида-2 выявляли специфическим антителом, ко- 20016108 торое распознает фосфорилированные пептиды. Второй флуорофор (АРС) конъюгирован со стрептавидином, который связывает биотинилированный пептид синтид-2. Для детекции флуорофор европия может быть приведен в возбужденное состояние светом с длиной волны 340 нм, который затем испускает излучение при 615 нм. Таким образом, когда меченное европием вторичное антитело связывается с фосфорилированным пептидом, оно приводится в близкий контакт с APC и возбуждает этот флуорофор.APC испускает излучение при 665 нм, и соотношение 665 нм:615 нм, регистрируемое прибором, является показателем активности PKD2. Данный анализ проводится с использованием полноразмерного фермента дикого типа, приобретенного у корпорации Invitrogen. Буферный раствор состоит из 35 мм Tris-HCl pH 7,5, 5 мм MgCl2, 0,02%Tween-20, 20 мм АТФ, 1 мм ДТТ и 0,2 мг/мл фермента PKD2. Ферментативная реакция была инициирована добавлением 2 мм пептидного субстрата синтида-2 и проводилась в течение 50 мин при комнатной температуре. Реакция была остановлена буферным раствором для остановки и детекции, состоящим из 50 мм ЭДТУК, 0,18 мг/мл кроличьих поликлональных антител антифосфо синтид-2, 0,5 нм меченных европием антикроличьих IgG и 10 нм APC, конъюгированного со стрептавидином. После 1 ч инкубации с буферным раствором для остановки и детекции результаты реакции регистрировали на фотометре Envision 2100, используя двойной протокол Eu/APC LANCE. Как описано выше, определяется соотношение 665 нм:615 нм для измерения фосфорилирования субстрата и активности фермента. Соединения обычно оцениваются по 11-балльной системе оценки эффекта дозы три раза для каждой концентрации. Значения IC50 вычисляются с помощью программы Activity Base (IDBS). Для измерения активности протеинкиназы D3 (PKD3) использовали метод резонансного переноса энергии флуоресценции с разрешением по времени (TR-FRET) с применением технологии LANCE фирмы Перкин-Элмер. В данном случае, в качестве субстрата реакции использовали биотинилированный пептид синтид-2. Фосфорилирование субстрата синтида-2 выявляли специфическим антителом, которое распознает фосфорилированные пептиды. Второй флуорофор (APC) конъюгирован со стрептавидином,который связывает биотинилированный пептид синтид-2. Для осуществления детекции флуорофор европия может быть приведен в возбужденное состояние светом с длиной волны 340 нм, который затем испускает излучение при 615 нм. Таким образом, когда меченное европием вторичное антитело связывается с фосфорилированным пептидом, оно приводится в близкий контакт с APC и возбуждает этот флуорофор. APC испускает излучение при 665 нм, и соотношение 665 нм:615 нм, регистрируемое прибором,является показателем активности PKD3. Данный анализ проводится с использованием полноразмерного фермента дикого типа, приобретенного у корпорации Invitrogen. Буферный раствор состоит из 35 мм Tris-HCl pH 7,5, 5 мм MgCl2, 0,02%Tween-20, 20 мм АТФ, 1 мм ДТТ и 0,2 мг/мл фермента PKD3. Ферментативная реакция была инициирована добавлением 2 мм пептидного субстрата синтида-2 и проводилась в течение 50 мин при комнатной температуре. Реакция была остановлена буферным раствором для остановки и детекции, состоящим из 50 мм ЭДТУК, 0,18 мг/мл кроличьих поликлональных антител антифосфо синтид-2, 0,5 нм меченных европием антикроличьих IgG и 10 нм APC, конъюгированного со стрептавидином. После 1 ч инкубации с буферным раствором для остановки и детекции результаты реакции регистрировали на фотометре Envision 2100, используя двойной протокол Eu/APC LANCE. Как описано выше, определяется соотношение 665 нм:615 нм для измерения фосфорилирования субстрата и активности фермента. Соединения обычно оцениваются по 11-балльной системе оценки эффекта дозы три раза для каждой концентрации. Значения IC50 вычисляются с помощью программы Activity Base (IDBS). Кальций/кальмодулин-зависимая киназа II (CaMKII) активируется связыванием кальмодулина, связанного с кальцием. Биохимическое исследование in vitro проводили, используя гомогенный анализ сближения методом усиленной люминесценции или по технологии AlphaScreen (фирма ПеркинЭлмер). В анализе используются микрошарики "донор" и "акцептор", которые после сближения и последующего возбуждения лазером излучают усиленный световой сигнал в диапазоне 520-620 нм. В этом исследовании биотинилированный пептидный субстрат аутокамтид-2 (autocamtide-2) для CaMKII связывается с покрытыми стрептавидином микрошариками донора AlphaScreen. Фосфорилирование субстрата распознается антителом, специфическим к фосфорилированному пептиду аутокамтиду-2, связанному с микрошариками акцептора, покрытыми протеином A. Поэтому фосфорилирование аутокамтида-2 протеинкиназой CaMKII распознаются антителом, сблизит микрошарики акцептора и донора, что приведет к излучению сильного сигнала. Анализ проводили с изоформой протеинкиназы человека CaMKII и кальмодулином (MilliporeCorp.). Буферный раствор данного исследования состоит из 20 мм HEPES рН 7,2, 10 мм MgCl2, 1 ммCaCl2, 0,1% БСА, 30 мм АТФ и 1 мм ДТТ. Конечная концентрация CaMKII и кальмодулина составляет 0,78 нг/мл и 20 мг/мл соответственно. Реакцию инкубировали при комнатной температуре в течение 30 мин. Реакцию остановили добавлением смеси для погашения/детекции, разведенной до конечной концентрации при добавлении к реакционной смеси 20 мм HEPES рН 7,2, 0,1% БСА, 45 мм ЭДТУК, разведение в соотношении 3:1000 между антителом фосфатазы Thr286 и микрошариками донора стрептавидина AlphaScreen и покрытыми протеином A микрошариками акцептора (фирма Перкин-Элмер), каж- 21016108 дого в концентрации 30 мг/мл. После добавления смеси для погашения/детекции реакцию инкубировали при комнатной температуре в темноте в течение 3 ч. Результаты реакции регистрировали на анализатореEnvision (фирма Перкин-Элмер). Смеси, получаемые в результате исследования, обычно оценивали по 10-балльной шкале оценки эффекта дозы при половинном шаге с максимальной концентрацией 30 мкМ. Соединения данного изобретения тестировали на то, какое действие они оказывают на различные изотипы PKC следующими методами. Исследование проводили на микротитрационном планшете белого цвета с прозрачным дном с 384 лунками, имеющими несвязывающую поверхность. Смесь для реакции(25 мкл) содержит 1,5 мкМ субстрата акцептора тридекапептида, который имитирует последовательность псевдосубстрата PKC с замещением AlaSer, 10 мкМ 33 Р-АТФ, 10 мм Mg(NO3)2, 0,2 мм CaCl2,PKC при концентрации протеина в диапазоне от 25 до 400 нг/мл (в зависимости от используемых изотипов), липосомы (содержащие 30 мол.% фосфатидилсерина, 5 мол.% диацилглицерина и 65 мол.% фосфатидилхолина) в конечной концентрации липидов 0,5 мм, в буфере из 20 мм Tris-HCl pH 7,4 + 0,1% БСА. Инкубацию проводили в течение 60 мин при комнатной температуре. Реакцию останавливали добавлением 50 мкл смеси для остановки реакции (100 мм ЭДТУК, 200 мм АТФ, 0,1% Triton Х-100, 0,375 мг/лунка микрошариков для проведения SPA-анализа, покрытых стрептавидином в фосфатно-солевом буферном растворе без Ca, Mg). После 10 мин инкубации при комнатной температуре суспензию центрифугировали в течение 10 мин при 300 г. Суммарную радиоактивность измеряли счетчиком Trilux в течение 1 мин. Измерение IC50 производили в рабочем порядке путем инкубирования последовательно разведенного ингибитора при концентрациях, варьирующихся в пределах 1-1000 нм. Значения IC50 вычисляли по графику подбором аппроксимирующей кривой с помощью программы XL fit. Человеческий рекомбинант PKC использовали при условиях анализа, описанных выше. Человеческий рекомбинантPKC приобретали у компании Oxford Biomedical Research и использовали при условиях анализа, как описано выше. Человеческий рекомбинант PKC1 приобретали у компании Oxford Biomedical Research и использовали при условиях анализа, как описано выше. Человеческий рекомбинант PKC приобретали у компании Oxford Biomedical Research и использовали при условиях анализа, как описано выше. Человеческий рекомбинант PKC приобретали у компании Oxford Biomedical Research и использовали при условиях анализа, как описано выше. Человеческий рекомбинант PKC приобретали у компании PanVera и использовали при условиях анализа, как описано выше. Анализ PKN-2 проводили с использованием системы Upstate IC50 Profiler Express. В конечном объеме реакции 25 мл человеческого рекомбинанта PKN-2 (5-10 mU) инкубировали с 50 мм Tris pH 7,5,0,1 мм EGTA, 0,1% -меркаптоэтанола, 30 мм ундекапептида (AKRRRLSSLRA), 10 мМ ацетата магния и-33P-ATP (удельная активность приблизительно 500 имп/(минпмоль), в требуемой концентрации). Реакцию инициировали добавлением смеси Mg/АТФ. После инкубации в течение 40 мин при комнатной температуре реакцию останавливали добавлением 5 мл 3%-ного раствора фосфорной кислоты. После этого 10 мл полученного в результате реакции соединения капали на плоский фильтр P30 и промывали три раза в течение 5 мин в 75 мм фосфорной кислоты и один раз в метаноле, а затем сушили и подсчитывали сцинтилляции. Анализ ROCK-II проводили с использованием системы Upstate IC50 Profiler Express. В конечной реакции 25 мл человеческого рекомбинанта ROCK-II (5-10 mU) инкубировали с 50 мм Tris pH 7,5, 0,1 мМ EGTA, 30 мм KEAKEKRQEQIAKRRRLSSLRASTSKSGGSQK, 10 мм ацетата магния и -33P-АТР(удельная активность приблизительно 500 имп/(минпмоль), в требуемой концентрации). Реакцию инициировали добавлением смеси Mg/АТФ. После инкубации в течение 40 мин при комнатной температуре реакцию останавливали добавлением 5 мл 3%-ного раствора фосфорной кислоты. После этого 10 мл полученного в результате реакции соединения капали на плоский фильтр P30 и промывали три раза в течение 5 мин в 75 мм фосфорной кислоты и один раз в метаноле, а затем сушили и подсчитывали сцинтилляции. Анализ CDK9 проводили с использованием системы Upstate IC50 Profiler Express. В конечной реакции 25 мкл CDK9/циклин Т 1 (h) (5-10 mU) инкубировали с 8 мм MOPS pH 7,0, 0,2 мм ЭДТУК, 100 мкмKTFCGTPEYLAPEVRREPRILSEEEQEMFRDFDYIADWC, 10 мм ацетата магния и [-33P-ATP] (удельная активность приблизительно 500 имп/(минпмоль), в требуемой концентрации). Реакцию инициировали добавлением смеси Mg/АТФ. После инкубации в течение 40 мин при комнатной температуре реакцию останавливали добавлением 5 мкл 3%-ного раствора фосфорной кислоты. После этого 10 мкл полученного в результате реакции соединения капали на плоский фильтр P30 и промывали три раза в течение 5 мин в 75 мм фосфорной кислоты и один раз в метаноле, а затем сушили и подсчитывали сцинтилляции. Анализ MARK1 проводили с использованием системы Upstate IC50 Profiler Express. В конечной реакции 25 мкл MARK1 (h) (5-10 mU) инкубировали с 8 мм MOPS pH 7,0, 0,2 мм ЭДТУК, 100 мкмKKKVSRSGLYRSPSMPENLNRPR, 10 мм ацетата магния и [-33P-ATP] (удельная активность приблизительно 500 имп/(минпмоль), в требуемой концентрации). Реакцию инициировали добавлением смесиMg/АТФ. После инкубации в течение 40 мин при комнатной температуре реакцию останавливали добавлением 5 мкл 3%-ного раствора фосфорной кислоты. После этого 10 мкл полученного в результате реак- 22016108 ции соединения капали на плоский фильтр P30 и промывали три раза в течение 5 мин в 75 мм фосфорной кислоты и один раз в метаноле, а затем сушили и подсчитывали сцинтилляции. Анализ MARK2 проводили с использованием фермента, приобретенного у корпорации Invitrogen. Для этого анализа приготовляли следующие маточные растворы. Буферный раствор для проведения анализа A 1 MARK2 получали из 25 мм TrisHCl, 5 мм MgCl2 и 1 мм ДТТ. Буфер для разбавления ферментов A 1,7 MARK2 получали из 42,5 мм Трис-HCl/Tris-HCl (pH 7,4), 1,7 мм ДТТ, 17% глицерола, 0,034%Triton X-100 и 1,7 мг/мл БСА. Раствор A 2 АТР получали из 400 мкм АТФ, разведенного в буфере для киназной реакции. Буфер A 3 для остановки реакций получали из 25 мм ЭДТУК в воде. Соединения данного анализа повторно растворили в 100% ДМСО и разбавляли до 5 нужной концентрации посева в воде MilliQ до получения конечной концентрации 2,44% ДМСО. Реагент для проведения анализа A 2 АТР получали из 400 мкм АТФ в буфере для киназной реакции (2). Реагент 3,33MARK2/CHKtide получен добавлением 3,33 пм фермента MARK2 и 5,3 мкм CHKtide к буферу для разбавления ферментов 1,7 MARK2. В буфере 1 Lance развели реагенты для детекции (18 мкл на 1 лунку) до получения следующих концентраций: киназа SA-APC 27,5 нм козлиные антикроличьи антитела, меченные европием (Eu-goat-anti-rabbit) 1,1 нм ингибиторы Cdc25-фосфатазы (anti phospho-cdc25C) 1,1 нм Анализ выполняли, используя указанные выше реагенты следующими этапами: 1) добавляли по 6 мкл ферментной смеси MARK2 на лунку, 2) вносили по 4 мкл водного раствора ДМСО в каждую из лунок планшета (2,44% ДМСО), добавляя к смеси MARK2 и инкубировали в течение 10 мин, 3) добавляли по 10 мкл смеси MARK2 и инкубировали в течение 30 мин, 4) останавливали реакцию добавлением 10 мкл буфера для остановки реакции. Метод детекции Lance проводили следующим образом: 1) по окончании анализа MARK2 переносили 2 мкл полученной смеси на планшет Optiplate фирмы Перкин-Элмер,2) добавляли 18 мкл реагентов для детекции Lance, 3) инкубировали в темноте при комнатной температуре в течение 3 ч и 4) обрабатывали данные, считанные с планшета, путем сопоставления и объединения. Соединения оценивали с помощью анализа ядерного экспорта HDAC5 в 384-луночных планшетах,позволяющего проводить высокопроизводительный скрининг (ВПС) для идентификации малых молекул,блокирующих агонист-зависимый ядерный экспорт из HDAC5. Для проведения этого анализа использовали систему анализа изображений высокой информационной емкости компании Cellomics (GiulianoTaylor 1998) и аденовирус, кодирующий зеленый флуоресцентный белок (GFP), меченный HDAC5. Миоциты желудочков новорожденной крысы (NRVM) инфицировали вирусом, кодирующим GFP-HDAC5, и высевали в покрытые желатином лунки 384-луночных планшетов. Клетки подвергли воздействию соединения и возбуждали простагландином (PGF2a), дающим сильный толчок ядерному экспорту HDAC5. После двухчасового воздействия клетки становятся неподвижными и подсчитывается количество местонахождений GFP-HDAC5 с помощью системы компании Cellomics, которая определяет относительную интенсивность флуоресценции в цитоплазматическом компартменте в сравнении с ядерным компартментом. Реакцию двунаправленной аллогенной смешанной культуры лимфоцитов (MLR) проводили в соответствии со стандартными методами (см. журнал "Иммунологические методы", 1973, 2, 279 и Meo T. и соавт., "Иммунологические методы" ("Immunological Methods"), New York, Academic Press, 1979, 227-39). Коротко говоря, клетки селезенки мышей линии CBA и BALB/c (1,6 105 клеток каждого штамма на каждую лунку титрационных микропланшетов с плоским дном для тканевых культур, в общей сложности 3,2105 клеток) инкубировали в среде RPMI, содержащей 10% FCS, 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина (Gibco BRL, Базель, Швейцария), 50 мкм 2 меркаптоэтанола (Fluka, Buchs, Швейцария) и серийно разведенные растворы. Проводили семь троекратных разведений дублетами на пробную смесь. После четырех дней инкубации добавляли 1 Ci 3H-тимидин. Клетки собирали после дополнительного пятичасового инкубационного периода и присоединенный 3H-тимидин определяли в соответствии со стандартными методами. Фоновые значения (нижние контрольные показатели) MLR указывают на пролиферацию клеток только линии BALB/c. Нижние значения вычитали из всех значений. Верхние контрольные значения в отсутствие образцов принимали за 100% пролиферацию. Вычисляется процент ингибирования образцами и определяются концентрации, необходимые для ингибирования активности фермента на 50% (значения IC50). Анализ пролиферации клеток костного мозга. Клетки костного мозга мышей линии CBA (2,5104 клеток на 1 лунку титрационных микропланшетов с плоским дном для тканевых культур) инкубировали в 100 мкл среды RPMI, содержащей 10% FCS,100 ЕД/мл пенициллина, 100 мкг/мл стрептомицина (Gibco BRL, Базель, Швейцария), 50 мкм 2 меркаптоэтанола (Fluka, Buchs, Швейцария), среду, обусловленную WEHI-3 (7,5 об.%), и среду, обусловленнуюL929 (3 об.%), в качестве источника для факторов роста и серийно разведенные растворы. Проводили семь троекратных разведений дублетами на пробную смесь. После четырех дней инкубации добавляли 1Ci 3H-тимидин. Клетки собирали после дополнительного пятичасового инкубационного периода и при- 23016108 соединенный 3H-тимидин определяли в соответствии со стандартными методами. Кондиционированную среду приготовляли следующим образом. Клетки WEHI-3 (ATTC TIB68) и клетки L929 (ATCC CCL 1) выращивали в среде RPMI до конфлюэнтности в течение 4 дней и одной недели соответственно. Клетки собирали, вновь растворяли в тех же самых культуральных флаконах в среде C, содержащей 1% FCS(Schreier and Tess 1981) для клеток WEHI-3 и в среде RPMI для клеток L929, а затем инкубировали в течение 2 дней (WEHI-3) или одной недели (L929). Супернатант собрали, фильтровали через 0,2 мкм и хранили в аликвотах при температуре -80C. Культуры без пробных смесей и без супернатантов клетокWEHI-3 и L929 использовали в качестве нижних контрольных значений. Нижние контрольные значения вычитали из всех значений. Верхние контрольные значения в отсутствии образцов принимали за 100% пролиферацию. Вычисляли процент ингибирования образцами и определяли концентрации, необходимые для ингибирования активности фермента на 50% (значения IC50). Соединения могут быть оценены по модели снижения числа лейкоцитов в периферической крови. Крысы получали единичную пероральную дозу либо плацебо (контрольная группа), либо соединения в различных дозах. Для гематологического мониторинга брали кровь из подъязычной вены до введения соединения (базовые показатели) и спустя 2, 6, 8 и 24 ч после принятия соединения. С этой целью крыс анестезировали изофлураном и собирали образцы цельной крови ( 200 мкл) из подъязычной вены в пробирки Эппендорфа, покрытые оболочкой ЭДТУК. После этого проводили гематологический анализ цельной крови с помощью автоматического гематологического анализатора для подсчета различных типов кровяных клеток и изменения различных показателей крови. В том числе, измеряли красные кровяные тельца, гемоглобин, гематокрит, тромбоциты и белые кровяные тельца, такие как нейтрофилы, лимфоциты, моноциты, эозинофилы и базофилы. Соединения могут быть оценены методом оценки реакции "трансплантат против хозяина" (РТПХ). Клетки селезенки (2107) крыс линии Вистар инъецировали подкожно в правую заднюю подушечку лап крыс гибрида (Wistar/FFischer 344)F1. Левую подушечку лап оставляли не обработанной. Животным вводили пробные соединения в течение 4 дней подряд (0-3). Подколенные лимфатические узлы удаляли на 7 день и определяли разницу в весе между двумя соответствующими лимфатическими узлами. Результаты представлены в виде задержки увеличения лимфатических узлов (выраженной в процентах) в сравнении между разницей в весе лимфатических узлов у экспериментальной группы и разницей в весе соответствующих лимфатических узлов у группы животных, не получивших пробное соединение. Таблица 1 Ингибирующее действие соединенийHOBt - 1-гидрокси-7-азабензотриазол; ЖХВД - жидкостная хроматография высокого давления; ИКС - инфракрасная спектроскопия; ЖХ-МС - жидкостная хроматография и масс-спектрометрия;TrisHCl - амино-трис-(гидроксиметил)метан гидрохлорид. Примеры Следующие примеры приведены в качестве иллюстрации настоящего изобретения и не должны трактоваться как его ограничения. Температура указана в градусах по Цельсию. Если не оговорено иначе, все выпаривания проводили при пониженном давлении, в некоторых воплощениях настоящего изобретения между приблизительно 15 мм рт. ст. и 100 мм рт. ст. (=20-133 мбар). Структура конечных продуктов, промежуточных продуктов и исходных материалов подтверждается стандартными аналитическими методами, такими как, например, микроанализ и спектроскопические исследования, напримерMC, ИКС, ЯМР. Используются общепринятые в данной области сокращения. Было установлено, что соединения, приведенные в следующих примерах, имеют значения IC50 в диапазоне от приблизительно 0,1 нм до приблизительно 1000,00 нм для протеинкиназ семейства PKD и других ферментов. Было установлено, что соединения, приведенные в следующих примерах, имеют значения IC50 в диапазоне от приблизительно 1 нм до приблизительно 1000,00 нм для CaMKII. Было установлено, что соединения, приведенные в следующих примерах, имеют значения IC50 в диапазоне от приблизительно 1 нм до приблизительно 1000,00 нм для PKN. Было установлено, что соединения, приведенные в следующих примерах, имеют значения IC50 в диапазоне от приблизительно 1 нм до приблизительно 1000,00 нм для ROCK. Было установлено, что соединения, приведенные в следующих примерах, имеют значения IC50 в диапазоне от приблизительно 1 нм до приблизительно 1000,00 нм для CDK9. Пример 1. К соединению 3-метилпиридин 1-окись, оксид (15,90 г, 150 ммоль) добавляли при температуре 0C в течение 30 мин диметилсульфат (15,60 мл). Получившуюся в результате реакции смесь размешивали в- 26016108 течение ночи при температуре 40C. Добавляли раствор KCN (10,75 г, 165 ммоль) в смеси EtOH-вода 11(120 мл) и реакционную смесь размешивали в течение ночи при температуре 40C. Реакционную смесь концентрировали под вакуумом, а остаток разделили на EtOAc и EtOH-воду. Водную фазу экстрагировали этилацетатом и смешанные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Очисткой методом колоночной флэш-хроматографии (силикагель, циклогексан/EtOAc 85:15) получали титульное соединение в виде кристаллов оранжевого цвета (6,00 г, 50,80 ммоль, 34%): 1H ЯМР (400 МГц, ДМСО-d6)ppm 8,76 (с., 1H), 8,64 (д., J=4,9 Гц, 1H), 7,80 (д., J=4,9 Гц,1H). Изоникотиновую кислоту (10 г, 80,4 ммоль) помещали в 5-горлую колбу объемом 750 мл, снабженную верхней мешалкой, внутренним термометром и подводом азота. Добавляли дихлорметан (300 мл) и охлаждали суспензию до 0C. Добавляли триэтиламин (17,6 мл, 121 ммоль), поддерживая при этом температуру ниже 0C, в момент растворения исходного материала. К прозрачному раствору добавляли по каплям этилхлорформиат (9,5 мл, 98,1 ммоль) в течение 25 мин, поддерживая при этом температуру ниже 0C. Реакционную смесь размешивали при температуре 0C в течение 30 мин. Трет-бутиламин (10,4 мл, 96,5 ммоль) медленно добавляли к реакционной смеси при температуре 0C, давали раствору нагреться до к.т., после чего размешивали в течение 3,5 ч. Реакционную смесь разбавляли водой (100 мл) и отделяли слой дихлорметана. Органическую фазу промывали 1 М HCl (100 мл), а водную фазу, содержащую продукт, нейтрализовали до уровня рН 9 раствором NaOH. Водную фазу дважды промывали этилацетатом (2100 мл), а объединенные органические фазы, высушенные над Na2SO4, фильтровали и концентрировали под вакуумом до получения твердого продукта бледно-желтого цвета (9,8 г, 68,4%):(72,63 мл, 538,84 ммоль), а затем концентрированную H2SO4 (12,32 мл, 874,46 ммоль). Смесь размешивали в течение 8 ч при к.т., после чего разбавляли насыщенным водным раствором NaHCO3 и ДХМ (50 мл). Органический слой промывали H2O, рассолом, сушили над безводным Na2SO4, а затем упаривали при пониженном давлении до получения твердого продукта белого цвета (29,30 г, 152,44 ммоль, 95%). В качестве альтернативы титульное соединение получали из N-трет-бутилизоникотинамида. Nтрет-Бутилизоникотинамид (9 г, 50,5 ммоль) помещали в 5-горлую колбу объемом 750 мл, снабженную верхней мешалкой, внутренним термометром и подводом азота. После чего добавляли тетрагидрофуран(225 мл) и прозрачный раствор охлаждали до -75C. Раствор 1,6 М н-бутиллития в гексане (69 мл, 110 ммоль) добавляли по каплям в течение 40 мин, поддерживая при этом температуру ниже -70C. Реакционную смесь размешивали при температуре -70C в течение 1 ч. Добавляли метилиодид (3,5 мл, 55 ммоль), поддерживая при этом температуру ниже -70C. Раствор размешивали при температуре -75C в течение 30 мин, а затем давали нагреться до к.т. и размешивали в течение ночи. Реакционную смесь охлаждали до 0C и добавляли насыщенный водный раствор хлорида аммония (50 мл). Реакционную смесь разбавляли водой (150 мл) и этилацетатом (150 мл) и отделяли органический слой. Водную фазу промывали этилацетатом (150 мл). Объединенные органические фазы промывали рассолом (100 мл), высушивали над Na2SO4, профильтровали и концентрировали под вакуумом до получения твердого продукта бледно-желтого цвета. Твердую массу желтого цвета сначала растирали в порошок с гексаном (30 мл), а затем рекристаллизовали эфиром трет-бутилметила (20 мл) до получения твердого продукта бледно желтого цвета (5,1 г, 53,1 %): MC (ИЭР) m/z 193 (M+1); 1 Н-ЯМР (400 МГц, CDCl3)ppm 8,45 (д.д., J=8,4 Гц,2H), 7,17 (д., J=8 Гц, 1H), 5,60 (ш.с., 1H), 2,39 (с., 3H), 1,46 (с., 9H). Из N-трет-бутил-3-метилизоникотинамида титульное соединение получают, как описано выше в примере 1C. н-Бутиллитий (1,6 М раствора в гексане, 14,96 мл, 23,94 ммоль) добавляли с сильным магнитным перемешиванием к раствору N-трет-бутил-3-метилизоникотинамида (2,19 г, 11,4 ммоль) в тетрагидрофуране (30 мл), а затем охлаждали баней ацетон/сухой лед до получения красноватого раствора с белым осадком. Дополнительно добавляли тетрагидрофуран (10 мл) в течение 30 мин для лучшего размешивания. По прошествии еще 75 мин к размешиваемой смеси добавляли метилйодид (782 мл, 12,54 ммоль). Цвет этой гетерогенной смеси изменился с красного на тускло-желтый. Реакцию гасили хлоридом аммония (1,92 г, 35,91 ммоль) в смеси EtOH-вода (125 мл). Полученную смесь экстрагировали этилацетатом (475 мл). Объединенные экстракты этилацетата сушили над сульфатом натрия, фильтровали и упаривали до получения 2,76 г масла желтого цвета. Масло дважды хроматографировали на колонке RediSep с силикагелем (120 г), элюируя 20%-ным раствором ацетона в метиленхлориде, с градиентом до 40% в течение 20 мин до получения 646,3 мг (выход продукта 27%) титульного соединения: 1H ЯМР (400 МГц, CDCl3)ppm 8,50 (с., 1H), 8,46 (д., J=5,05 Гц, 1H), 7,16 (д., J=4,80 Гц, 1H), 5,61 (ш.с., 1H), 2,80 (q,J=7,58 Гц, 2H), 1,48 (с., 9H), 1,27 (т., J=7,58 Гц, 3H). К раствору N-трет-бутил-3-метилизоникотинамида из описанного выше примера 1C (10,40 г, 51,40 ммоль) в ТГФ (220 мл) добавляли n-BuLi (69,0 мл, 110 ммоль, 1,6 М в гексане) при температуре -78C в инертной среде. Реакционную смесь размешивали в течение 30 мин при температуре -78C, получали суспензию темно-красного цвета, а затем добавляли по капле сложный метиловый эфир 2 хлоризоникотиновой кислоты (9,5 г, 54,8 ммоль) в виде раствора в ТГФ (20 мл). Прозрачный раствор желтого цвета продолжали размешивать в течение 2 ч при температуре -78C. Реакцию гасили добавлением 150 мл насыщенного водного раствора NH4Cl при температуре -78C. Суспензию бледно-белого цвета экстрагировали дважды EtOAc и промывали насыщенным водным раствором NaCl: MC (ИЭР) m/z 332,8 (M+1). Получают из примера 1D по аналогии с примером 1 Е: MC (ИЭР) m/z 346,1 (M+1). Сырой N-трет-бутил-3-(2-(2-хлорпиридин-4-ил)-2-оксоэтил)изоникотинамид из описанного выше примера 1E (6,83 г, 20,46 ммоль) суспендировали в уксусной кислоте и поддерживали при температуре 100C в течение ночи. Смесь охлаждали до к.т. и упаривали при пониженном давлении. К остатку добавляли H2O и продукт экстрагировали EtOAc. Объединенные органические слои промывали рассолом, сушили над безводным Na2SO4, а затем концентрировали. Твердый продукт растирали в порошок с Et2O до получения беловатого твердого продукта (60%): MC (ИЭР) m/z 259,7 (M+1); 1H ЯМР (400 МГц, CDCl3)9,12 (с., 1H), 8,86 (д., J=5,5 Гц, 1H), 8,56 (д., J=5,5 Гц, 1H), 8,18 (д., J=5,1 Гц, 1H), 8,03 (с., 1H), 7,93 (д.,J=5,1 Гц, 1H), 7,77 (с., 1H). Получают из примера 1F по аналогии с примером 1G: MC (ИЭР) m/z 273,2 (M+1). 3-(2-Хлорпиридин-4-ил)-1H-пирано[4,3-c]пиридин-1-он (1,66 г, 6,41 ммоль) суспендировали в смеси EtOH-вода (35 мл), добавляли 28,5% NH4OH (26 мл) при к.т. и размешивали в течение ночи. После этого растворитель упаривали и осадок сушили при пониженном давлении при температуре 45C в течение 30 мин до получения твердого вещества белого цвета. Неочищенный продукт суспендировали вEtOH-вода (35 мл), добавляли 4 N HCl (8,7 мл) и размешивали в течение ночи при к.т. Смесь фильтровали и полученное твердое вещество сушили под высоким вакуумом (1,50 г, 91%): MC (ИЭР) m/z 257,7 Получают из примера 1H по аналогии с примером 1I: MC (ИЭР) m/z 272,2 (M+1). Смесь 3-(2-хлорпиридин-4-ил)-2,6-нафтиридин-1-ола (1,29 г, 5,02 ммоль), POCl3 (35 мл) и хлорида тетраметиламмония (2,6 г, 23,72 ммоль) нагревали с обратным холодильником при температуре 110C в течение 36 ч. Затем POCl3 удаляли дистилляцией и осторожно добавляли охлажденный льдом 10%-ный раствор K2CO3. После этого полученную смесь экстрагировали EtOAc, промывали водой, рассолом, затем сушили над безводным раствором Na2SO4 и концентрировали при пониженном давлении. Сырой остаток промывали охлажденным метанолом (5 мл) до получения твердого вещества зеленоватокоричневого цвета (1,05 г, 3,80 ммоль, 76%): MC (ИЭР) m/z 277,1 (M+1); 1H ЯМР (400 МГц, CDCl3)9,55 (с., 1H), 8,88 (д., J=6,1 Гц, 1H), 8,75 (с., 1H), 8,55 (д., J=5,6 Гц, 1H), 8,27 (с., 1H), 8,25 (д., J=6,1 Гц,1H), 8,18 (д., J=5,5 Гц, 1H). По аналогии с описанным выше примером 1K продукт в примере 1I можно обработать POBr3 до получения смеси титульных соединений. Получают из примера 1J по аналогии с примером 1K: MC (ИЭР) m/z 290,2 (M+1).
МПК / Метки
МПК: A61P 35/00, A61K 31/4375, C07D 471/04, C07D 519/00
Метки: ингибиторов, протеинкиназы, 2,6]нафтиридины, применимые, качестве
Код ссылки
<a href="https://eas.patents.su/30-16108-26naftiridiny-primenimye-v-kachestve-ingibitorov-proteinkinazy.html" rel="bookmark" title="База патентов Евразийского Союза">[2,6]нафтиридины, применимые в качестве ингибиторов протеинкиназы</a>
Предыдущий патент: Установка и способ сухого вывода/охлаждения тяжелых зол и регулирования сгорания остатков с высоким содержанием несгоревшего материала
Следующий патент: Устройство для обучения или игры
Случайный патент: Крыша транспортного средства, по меньшей мере, с одним люком