Производные триазола
Номер патента: 15254
Опубликовано: 30.06.2011
Авторы: Хёльцеманн Гюнтер, Грайнер Хартмут, Цецанне Бертрам, Грэдлер Ульрих, Амендт Кристиане
Формула / Реферат
1. Соединения, выбранные из группы, включающей
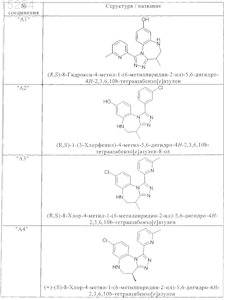
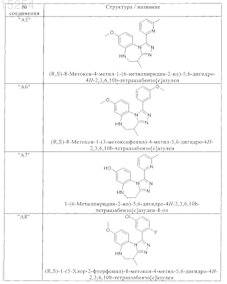

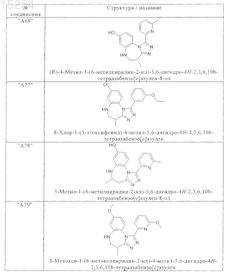
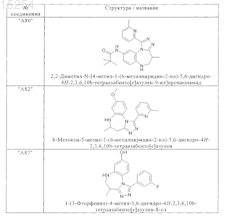
и их фармацевтически пригодные сольваты, соли, таутомеры и стереоизомеры, включая их смеси во всех соотношениях.
2. Лекарственные средства, содержащие по меньшей мере одно соединение по п.1 и/или его фармацевтически пригодные соли, сольваты, таутомеры и стереоизомеры, включая их смеси во всех соотношениях, и необязательно наполнители и/или вспомогательные вещества.
3. Применение соединений, выбранных из группы, включающей
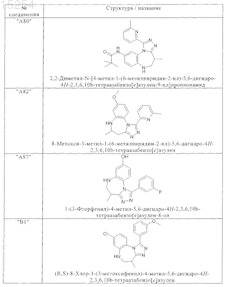
и их фармацевтически пригодных солей, сольватов, таутомеров и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения и/или борьбы с раком, ростом опухоли, ростом метастаз, фиброза, рестеноза, ВИЧ инфекции, болезни Альцгеймера, атеросклероза и/или для стимуляции заживления ран.
4. Применение по п.3, где опухоль выбрана из группы, включающей опухоли плоского эпителия, мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, головного мозга, предстательной железы, мочеполового тракта, лимфатической системы, желудка, гортани, легкого, аденокарциному легкого, мелкоклеточный рак легкого, рак поджелудочной железы, глиобластому, рак толстой кишки, рак молочной железы, опухоль крови и иммунной системы, острый миелоидный лейкоз, хронический миелоидный лейкоз, острый лимфолейкоз, хронический лимфолейкоз.
5. Применение соединений по п.3 и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения солидных опухолей, где терапевтически эффективное количество соединения по п.3 вводят в комбинации с соединением, выбранным из группы 1) модулятора эстрогенового рецептора, 2) модулятора андрогенового рецептора, 3) модулятора ретиноидного рецептора, 4) цитотоксического агента, 5) антипролиферативного агента, 6) ингибитора пренилпротеинтрансферазы, 7) ингибитора HMG-CoA редуктазы, 8) ингибитора ВИЧ протеазы, 9) ингибитора обратной транскриптазы и 10) другого ингибитора ангиогенеза.
6. Применение соединений по п.3 и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения солидных опухолей, где терапевтически эффективное количество соединения по п.3 вводят в комбинации с лучевой терапией и соединением из группы 1) модулятора эстрогенового рецептора, 2) модулятора андрогенового рецептора, 3) модулятора ретиноидного рецептора, 4) цитотоксического агента, 5) антипролиферативного агента, 6) ингибитора пренилпротеин-трансферазы, 7) ингибитора HMG-CoA редуктазы, 8) ингибитора ВИЧ протеазы, 9) ингибитора обратной транскриптазы и 10) другого ингибитора ангиогенеза.
Текст
Новые производные триазола являются ингибиторами киназы TGF- рецептора I и могут применяться, в частности, для лечения опухолей.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) 015254 Предпосылки создания изобретения Объектом изобретения является выявление новых соединений, обладающих ценными свойствами, в частности тех, которые могут применяться для приготовления лекарственных средств. Настоящее изобретение относится к соединениям и к применению соединений, которые принимают участие в ингибировании, регуляции и/или модуляции передачи сигналов с помощью киназ, в особенности TGF- рецепторных киназ, а также к фармацевтическим композициям, которые содержат эти соединения, и к применению соединений для лечения заболеваний, индуцированных киназой. Трансформирующий фактор ростаявляется прототипом суперсемейства TGF-, семейства высоконсервативных, плейотропных факторов роста, которые выполняют важные функции как при эмбриональном развитии, так и во взрослом организме. У млекопитающих было идентифицировано три изоформы TGF- (TGF- 1, 2 и 3), TGF- 1 является наиболее распространенной изоформой (Kingsley (1994)TGF- 1 обнаружен в мезенхимных и эпителиальных клетках. TGF- синтезируется в виде предшественника пропротеина и высвобождается в неактивной форме во внеклеточный матрикс (Derynck (1985) Nature 316: 701-705; Bottinger (1996) PNAS 93: 5877-5882). За исключением отщепленного проучастка, который также известен как латентный ассоциированный пептид (LAP), и остатков, ассоциированных со зрелым участком, одна из 4 изоформ латентных TGF- связывающих белков (LTBP 1-4) также может связываться с TGF- (Gentry (1988) Mol Cell Biol 8: 4162-4168, Munger (1997) Kindey Int 51: 1376-1382). Активация неактивного комплекса, которая необходима для развития биологического действия TGF-, в настоящее время еще полностью не изучена. Тем не менее, установлено, что необходима протеолитическая обработка, например, с помощью плазмина, трансглутаминазы плазмы или тромбоспондина(Munger (1997) Kindey Int 51: 1376-1382). Активированный лиганд TGF- опосредует свое биологическое действие посредством трех TGF- рецепторов на мембране, универсально экспрессируемых рецепторов I типа и II типа и рецепторов III типа бетагликана и эндоглина, последний экспрессируется только в эндотелиальных клетках (Gougos (1990) J Biol Chem 264: 8361-8364, Loeps-Casillas (1994) J Cell Biol 124:557568). В обоих TGF- рецепторах III типа отсутствует внутриклеточный домен киназы, который облегчает передачу сигналов в клетку. Так как TGF- рецепторы III типа связывают все три изоформы TGF- с высокой аффиностью и TGF- рецептор II типа также обладает высокой аффинностью для лигандов, связанных с рецептором III типа, то полагают, что биологическая функция состоит в регулировании доступности лигандов для TGF- рецепторов I типа и II типа (Lastres (1996) J Cell Biol 133:1109-1121; LopesCasillas (1993) Cell 73: 1435-1344). Структурно очень сходные рецепторы I типа и II типа в цитоплазматическом участке содержат домен серин/треонин киназы, который отвечает за передачу сигналов. TGFрецептор II типа связывает TGF-, после этого TGF- рецептор I типа захватывается этим комплексом,передающим сигнал. Домен серин/треонин киназы рецептора II типа является конститутивно активным и способен фосфорилировать радикалы серила в этом комплексе в так называемом GS домене рецептора I типа. Это фосфорилирование активирует рецептор киназы I типа, который в таком состоянии сам способен фосфорилировать внутриклеточные сигнальные медиаторы, SMAD белки, и таким образом иницировать внутриклеточную передачу сигналов (обобщение в Derynck (1997) Biochim Biophys Acta 1333: F105F150). Белки семейства SMAD служат субстратами для всех киназ рецепторов семейства TGF-. В настоящее время было идентифицировано 8 SMAD белков, которые могут быть разделены на 3 группы: (1) связанные с рецептором SMAD (R-SMAD) являются непосредственными субстратами киназ рецептора(SMAD4); и (3) ингибирующие SMAD (SMAD6, 7), которые ингибируют активность вышеописанныхSMAD белков. Среды различных R-SMAD, SMAD2 и SMAD3 являются TGFспецифическими сигнальными медиаторами. В TGF- сигнальном каскаде, SMAD2/SMAD3 фосфорилируются таким образом с помощью TGF- рецептора I типа, что предоставляет им возможность связывания с SMAD4. Полученный комплекс SMAD2/SMAD3 и SMAD4 в таком виде может перемещаться в ядро клетки, где он может инициировать транскрипцию TGFрегулируемых генов непосредственно или с помощью других белков (обобщение в Itoh (2000) Eur J Biochem 267: 6954-6967; Shi (2003) Cell 113: 685-700). Спектр действий TGF- очень широкий и зависит от типа клетки и дифференцированного состояния (Roberts (1990) Handbook of Experimental Pharmacology: 419-472). Клеточными функциями, на которые влияет TGF-, являются апоптоз, пролиферация, дифференциация, подвижность и адгезия клеток. Следовательно, TGF- влияет на многие биологические процессы. При эмбриональном развитии он экспрессируется в сайтах морфогенеза и в особенности в участках эпителиально-мезенхимного взаимодействия, где он индуцирует важные процессы дифференциации (Pelton (1991) J. Cell. Biol. 115:1091-1105).TGF- также осуществляет ключевую функцию в самовосстановлении и поддержании недифференцированного состояния стволовых клеток (Mishra (2005) Science 310: 68-71). Дополнительно, TGF- также осуществляет важные функции в регуляции иммунной системы. Он обладает, как правило, иммунодепрессивным действием, поскольку он ингибирует, в частности, пролиферацию лимфоцитов и ограничи-1 015254 вает активность тканевых макрофагов. Таким образом, TGF- позволяет снова затихнуть воспалительным реакциям и таким образом помогает предотвратить чрезмерные иммунные реакции (Bogdan (1993)Ann NY Acad Sci 685: 713-739, обобщение в Letterio (1998) Annu Rev Immunol 16: 137-161). Другой функцией TGF- является регуляции пролиферации клеток. TGF- ингибирует рост клеток эндотелиального, эпителиального и гематопоэтического происхождения, но стимулирует рост клеток мезенхимного происхождения (Tucker (1984) Science 226:705-707, Shipley (1986) Cancer Res 46:2068-2071, Shipley(1985) PNAS 82: 4147-4151). Дальнейшей важной функцией TGF- является регуляция адгезии клеток и взаимодействий между клетками. TGF- стимулирует сборку внеклеточного матрикса путем индукции белков внеклеточного матрикса, таких как, например, фибронектин и коллаген. Дополнительно TGFуменьшает экспрессию металлопротеаз, вызывающих распад матрикса, и ингибиторов металлопротеазBiol Chem 264: 1860-1869); Edwards (1987) EMBO J 6: 1899-1904). Широкий спектр активности TGF- обозначает, что TGF- выполняет важные функции во многих физиологических ситуациях, таких как заживление ран, и в патологических процессах, таких как рак и фиброз.TGF- является одним из ключевых факторов роста при заживлении ран (обобщение в O'Kane(1997) Int J Biochem Cell Biol 29: 79-89). В фазе грануляции TGF- высвобождается из тромбоцитов в участке повреждения. Затем TGF- сам регулирует свою выработку в макрофагах и индуцирует секрецию других факторов роста, например, с помощью моноцитов. Наиболее важными функциями при заживлении ран является стимуляция хемотаксиса воспалительных клеток, синтез внеклеточного матрикса и регуляции пролиферации, дифференциации и экспрессии генов всех важных типов клеток, вовлеченных в процесс заживления ран. При патологических состояниях эти TGFопосредуемые действия, в особенности регуляция продукции внеклеточного матрикса (ЕСМ), может приводить к фиброзу или рубцам кожи (Border (1994) NTGF- способствует гипертрофии клеток почки и патологическому накоплению внеклеточного матрикса. Прерывание TGF- пути передачи сигналов с помощью лечения с анти-TGF- антителами предотвращает распространение мезангиального матрикса, прогрессирующее уменьшение функции почек, и уменьшает образование пораженных участков диабетической гломерулопатии у животных с диабетом (BorderTGF- также имеет важное значение при фиброзе печени. Активация, необходимая для развития фиброза печени, звездчатых клеток печени с образованием миофибробластов, основных производителей внеклеточного матрикса при развитии цирроза печени, стимулируется TGF-. Также было показано, что прерывание такого TGF- пути передачи сигналов уменьшает фиброз на экспериментальных моделях(Yata (2002) Hepatology 35:1022-1030; Arias (2003) ВМС Gastroenterol 3:29) TGF- также выполняет ключевую функцию в возникновении злокачественного новообразования (обобщение в Derynck (2001) NatureGenetics: 29: 117-129; Elliott (2005) J Clin Onc 23: 2078-2093). На ранних стадиях развития злокачественного новообразования, TGF- противодействует развитию злокачественного новообразования. Такое опухолеподавляющее действие, главным образом, основывается на способности TGF- ингибировать деление эпителиальных клеток. В отличие от этого TGF- способствует росту злокачественного новообразования и образованию метастаз на поздних стадиях опухолей. Это может быть обусловлено тем фактом, что в большинстве эпителиальных опухолей развивается устойчивость к рост-ингибирующему действию TGF-, и TGF- одновременно поддерживает рост раковых клеток посредством других механизмов. Эти механизмы включают стимулирование ангиогенеза, иммуносупрессорное действие, которое позволяет опухолевым клеткам избегать контролирующей функции иммунной системы (иммунологического надзора), и стимулирование инвазивности и образование метастаз. Образование инвазивного фенотипа опухолевых клеток является основной предпосылкой для образования метастаз. TGF- способствует этому процессу благодаря его способности регулировать адгезию клеток, подвижность и образование внеклеточного матрикса. Кроме того, TGF- индуцирует переход от эпителиального фенотипа клетки в инвазивный мезенхимный фенотип (эпителиальный мезенхимный перевод = ЕМТ). Важная роль, которую выполняет TGF- в стимуляции роста злокачественного новообразования, также была показана с помощью исследований, в которых обнаружена взаимосвязь между сильной экспрессией TGF- и плохим прогнозом. Повышенные TGF- уровни были обнаружены, в частности, у пациентов с раком предстательной железы, молочной железы, кишечника и легких (Wikstrm (1998) Prostate 37: 19-29; Hasegawa(2001) Cancer 91: 964-971; Friedman (1995), Cancer Epidemiol Biomarkers Prev. 4:549-54). Вследствие рак-стимулирующих действий TGF-, описанных выше, ингибирование TGF- пути передачи сигналов, например путем ингибирования TGF- рецептора I типа, предоставляется возможность для терапевтического направления. В результате различных доклинических исследований было показа-2 015254 но, что прерывание TGF- пути передачи сигнала действительно должно ингибировать рост злокачественного новообразования. Следовательно, лечение растворимым TGF- рецептором II типа уменьшает образование метастаз у трансгенных мышей, которые образуются при инвазивном раке молочной железы при развитии заболевания (Muraoka (2002) J Clin Invest 109: 1551-1559, Yang (2002) J Clin Invest 109: 1607-1615). Линии опухолевых клеток, которые экспрессируют дефектный TGF- рецептор II типа, проявляют уменьшенный опухолевый и метастатический рост (Oft (1998) Curr Biol 8: 1243-1252, McEachern (2001)Int J Cancer 91:76-82, Yin (1999) Jclin Invest 103: 197-206). Состояния, которые "характеризуются повышенной активностью TGF-", включают состояния, при которых стимулируется синтез TGF- таким образом, что TGF- содержится в повышенных количествах,или при которых латентный белок TGF- нежелательно активирован или превращен в активный TGFбелок, или при которых TGF- рецепторы повышенно регулированы, или при которых TGF- белок проявляет повышенное связывание с клетками или внеклеточным матриксом в участке заболевания. Таким образом, в любом случае "повышенная активность" относится к любому состоянию, при котором биологическая активность TGF- является нежелательно высокой, независимо от причины. Многие заболевания связаны со сверхпродукцией TGF-1. Ингибиторы TGF- внеклеточных путей передачи сигналов пригодны для лечения фибропролиферативных заболеваний. В частности, фибропролиферативные заболевания включают нарушения почек,связанные с нерегулируемой активностью TGF- и чрезмерным фиброзом, включая гломерулонефрит(GN), такой как мезангиальный пролиферативный GN, иммунный GN и полулунный GN. Другие почечные нарушения включают диабетическую нефропатию, почечный интерстициальный фиброз, почечный фиброз у пациентов с трансплантатами, получавших циклоспорин, и нефропатию, связанную с ВИЧ. Коллагеновые заболевания сосудов включают прогрессирующий системный склероз, полимиозит, склерорму, дерматомиозит, эозинофильный фасцит, кольцевидную склеродерму или заболевания, связанные с проявлением синдрома Raynaud. Легочные фиброзы, которые развиваются вследствие чрезмерной активности TGF-, включают респираторный дистресс-синдром взрослых, идиопатический легочный фиброз и интерстициальный легочный фиброз, часто связанный с аутоиммунными нарушениями, такими как системная красная волчанка и склерорма, химический контакт или аллергии. Другим аутоиммунным нарушением, связанным с фибропролиферативными характеристиками, является ревматоидный артрит. Заболевания глаз, связанные с фибропролиферативным состоянием, включая повторное хирургическое вмешательство на сетчатке, сопровождающееся пролиферативной витреоретинопатией, экстракция катаракты с факопротезированием и послеглаукомная дренажная хирургия, часто связаны со сверхпродукцией TGF-1. Фиброзные заболевания, связанные со сверхпродукцией TGF-1, можно разделить на хронические состояния, такие так фиброз почек, легких и печени, и более острые состояния, такие как кожное рубцевание и рестеноз (Chamberlain, J. Cardiovascular Drug Reviews, 19 (4): 329-344). Синтез и секреция TGF1 опухолевыми клетками также может приводить к супрессии иммунной системы, что наблюдается у пациентов с агрессивными опухолями головного мозга или молочной железы (Arteaga, и др. (1993) J.Clin. Invest. 92: 2569-2576). Течение лейшманиозной инфекции у мышей кардинально изменяется с помощью TGF-1 (Barral-Netto и др. (1992) Science 257: 545-547). TGF-1 обостряет течение заболевания,тогда как TGF-1 антитела останавливают прогрессирование заболевания у генетически чувствительных мышей. Генетически резистентные мыши становятся чувствительными к лейшманиозной инфекции при введении TGF-1. Значительные воздействия TGF-1 на отложение внеклеточного матрикса обобщено (Rocco и Ziyadeh (1991) в Contemporary Issues in Nephrology v. 23, Hormones, autocoids и the kidney, ed. Jay Stein,Churchill Livingston, New York pp. 391-410; Roberts, и др. (1988) Rec. Prog. Hormone Res. 44: 157-197) и включают стимуляцию синтеза и ингибирование распада компонентов внеклеточного матрикса. Поскольку структурные и фильтрационные свойства клубочков значительно зависят от состава внеклеточного матрикса мезангия и мембран клубочков, то не является неожиданным существенное влияние TGF1 на почки. Накопление мезангиального матрикса при пролиферативном гломерулонефрите (Border и др. (1990) Kidney Int. 37: 689-695) и диабетической нефропатии (Mauer и др. (1984) J. Clin. Invest. 74: 1143-1155) очевидно и является доминантными патологическими особенностями заболеваний. Уровни(Yamamoto и др. (1993) Proc. Natl. Acad. Sci. 90: 1814-1818). TGF-1 является важным медиатором развития почечного фиброза на многих животных моделях (Phan и др. (1990) Kidney Int. 37: 426; Okuda и др.(1990) J. Clin. Invest. 86: 453). Подавление экспериментально индуцированного гломерулонефрита у крыс показано с помощью антисыворотки против TGF-1 (Border и др. (1990) Nature 346: 371) и белка внеклеточного матрикса, декорина, который может связывать TGF-1 (Border и др. (1992) Nature 360: 361-363). Избыток TGF-1 приводит к образованию рубцовой ткани в коже. Было показано, что нейтрализующие TGF-1 антитела при инъекции в края заживающих ран ингибируют образование рубцов, не-3 015254 влияя на скорость заживления раны или растяжимость раны (Shah и др. (1992) Lancet 339: 213-214). В то же время происходит уменьшение ангиогенеза, уменьшение количества макрофагов и моноцитов в ране и уменьшение количества дезорганизованных отложений коллагеновых волокон в рубцовой ткани.TGF-1 может являться фактором прогрессирующего утолщения стенок артериальных сосудов, которое развивается вследствие пролиферации гладких миоцитов и отложения внеклеточного матрикса в артериях после баллонной ангиопластики. Диаметр суженой артерии может уменьшаться на 90% в результате такого утолщения, и поскольку уменьшение диаметра происходит, главным образом, вследствие внеклеточного матрикса, а не протопластов гладких миоцитов, то представляется возможным открывать такие сосуды на 50% просто путем уменьшения интенсивности отложения внеклеточного матрикса. В неповрежденных артериях свиньи, трансфектированной in vivo геном TGF-1, экспрессия гена TGF-1 связана как с синтезом внеклеточного матрикса, так и с гиперплазией (Nabel и др. (1993) Proc. Natl. Acad.Sci. USA 90: 10759-10763). Индуцированная TGF-1 гиперплазия не является настолько интенсивной,как индуцированная PDGF-BB, но внеклеточный матрикс более распространенный у TGF-1 трансфектантов. Не было обнаружено отложений внеклеточного матрикса, связанного с гиперплазией, индицированной FGF-1 (секретируемая форма FGF) на это модели переноса гена у свиней (Nabel (1993) Nature 362: 844-846). Существует несколько типов злокачественных новообразований, при которых TGF-1, продуцируемый опухолью, может быть вредным. Клетки MATLyLu рака предстательной железы у крыс (Steiner и Barrack (1992) Mol. Endocrinol 6: 15-25) и клетки MCF-7 рака молочной железы человека (Arteaga и др.(1993) Cell Growth и Differ. 4: 193-201) становятся более канцерогенными и метастатическими после трансфекции вектором, экспрессирующим TGF-1 мыши. TGF-1 связан с ангиогенезом, метастазами и плохим прогнозом при раке предстательной железы и прогрессирующем раке желудка у людей (Wikstrom, P. и др. (1998) Prostate 37: 19-29; Saito, H. и др. (1999) Cancer 86: 1455-1462). При раке молочной железы плохой прогноз связан с повышением TGF- (Dickson и др. (1987) Proc. Natl. Acad. Sci. USA 84: 837-841; Kasid и др. (1987) Cancer Res. 47: 5733-5738; Daly и др. (1990) J. Cell Biochem. 43: 199-211; Barrett-Lee и др. (1990) Br. J Cancer 61: 612-617; King и др. (1989) J. Steroid Biochem. 34: 133-138; Welch и др.(1990) Proc. Natl. Acad. Sci. USA 87: 7678-7682; Walker и др. (1992) Eur. J. Cancer 238 : 641-644), и индукция TGF-1 вследствие лечения тамоксифеном (Butta и др. (1992) Cancer Res. 52: 4261- 4264) связана с неэффективностью лечения тамоксифеном рака молочной железы (Thompson и др. (1991) Br. J. Cancer 63: 609-614). Анти-TGF-1 антитела ингибируют рост клеток MDA-231 рака молочной железы у атимических мышей (Arteaga и др. (1993) J. Clin. Invest. 92: 2569-2576), лечение, которое взаимосвязано с повышением активности естественных клеток-киллеров селезенки. Клетки СНО, трансфектированные латентным TGF-1, также проявляют сниженную NK активность и повышенный рост опухоли у бесшерстых мышей (Wallick и др. (1990) J. Exp. Med. 172: 1777-1784). Следовательно, TGF-, который секретируется опухолями молочной железы, может вызывать эндокринную иммунную супрессию. Показано, что высокие концентрации TGF-1 в плазме указывают на плохой прогноз для пациентов с прогрессирующим раком молочной железы (Anscher и др. (1993) N. Engl. J. Med. 328: 1592-1598). Пациенты с высокими уровнями циркулирующего TGF- перед химиотерапией в высоких дозах и аутологической пересадкой костного мозга имеют высокий риск окклюзионного заболевания вен печени (15-50% всех пациентов с коэффициентом смертности вплоть до 50%) и идиопатического интерстициального пневмонита (4060% всех пациентов). При обобщении этих наблюдений можно сделать выводы в том, что: 1) повышенные уровни в плазме TGF-1 можно использовать для идентификации пациентов с рисками и 2) уменьшение TGF-1 может снижать заболеваемость и смертность при этих общепринятых лечениях пациентов с раком молочной железы. Многие злокачественные клетки секретируют трансформирующий фактор роста(TGF-), эффективный иммунодепрессант, что подтверждает тот факт, что продукция TGF- может являться существенным механизмом избегания опухолью иммунологического надзора хозяина. Создание субпопуляции лейкоцитов с нарушенной TGF- передачей сигналов в хозяинах, несущих опухоль, предоставляет потенциальные возможности для иммунотерапии злокачественного новообразования. Модель трансгенных животных с нарушенной передачей сигналов TGF- в Т-клетках способна искоренить обычно летальную опухоль лимфатической ткани EL4, которая сверхэкспрессирует TGF- (Gorelik и Flavell, (2001), NatureMedicine 7 (10): 1118-1122). Понижающая регуляция секреции TGF- в опухолевых клетках приводит к восстановлению иммуногенности в хозяине, тогда как нечувствительность T-клеток к TGF- приводит к ускоренной дифференциации и аутоиммунности, элементам, которые могут быть необходимыми для борьбы с опухолями,экспрессирующими собственный антиген в толерантном хозяине. Иммунодепрессивные действия TGFтакже вовлечены в субпопуляцию ВИЧ-пациентов с более низкой ответной иммунной реакцией по сравнению с предполагаемой на основе подсчета их CD4/CD8 T-клеток (Garba и др. J. Immunology (2002) 168: 2247-2254). TGF- нейтрализующее антитело способно реверсировать действие в культуре, что указывает на то, что ингибиторы TGF- сигналов могут быть полезными для реверсирования супрессии иммун-4 015254 ной системы, присутствующей у подгруппы ВИЧ-пациентов. При ранних стадиях канцерогенеза TGF-1 может действовать в качестве эффективного супрессора опухоли и может опосредовать действия некоторых химиопрофилактических средств. Однако в определенной точке при развитии и прогрессировании злокачественных новообразований, опухолевые клетки начинают избегать TGFзависимого ингибирования параллельно с появлением биологически активного TGF- в микроокружении. Двойственный характер влияния TGF- на подавление опухоли/стимулирование опухоли наиболее очевидно поясняется на трансгенной системе, сверхэкспрессирующей TGF- в кератиноцитах. Несмотря на то что трансгенные объекты более устойчивые к образованию доброкачественных поражений кожи, скорость метастатического превращения у трансгенных объектов существенно увеличена (Cui и др. (1996) Cell 86 (4): 531-42). Продукция TGF-1 злокачественными клетками в первичных опухолях повышается при дальнейших стадиях прогрессирования опухоли. Исследования большинства эпителиальных раков подтвердили тот факт, что повышенная продукция TGFв злокачественных опухолях людей проявляется как относительно позднее событие при прогрессировании опухоли. Кроме того, этот связанный с опухолью TGF- обеспечивает опухолевым клеткам селективное преимущество и способствует прогрессированию опухоли. Действие TGF-1 на взаимодействия клетка/клетка и клетка/строма приводит к большей предрасположенности к инвазии и метастазам. Связанный с опухолью TGF- может обеспечивать опухолевым клеткам избегание от иммунологического надзора, поскольку он является эффективным ингибитором размножения клона активированных лимфоцитов. Было показано, что TGF- ингибирует также продукцию ангиостатина. Терапевтические подходы лечения злокачественных новообразований, такие как лучевая терапия и химиотерапия, вызывают продукцию в опухоли активированного TGF-, отбирая таким образом популяцию злокачественных клеток, резистентных к рост-ингибирующим действиям TGF-. Следовательно, эти противораковые лечения повышают риск и скорость развития опухолей с усиленным ростом и инвазивностью. В этой ситуации средства, нацеленные на TGFопосредованную передачу сигналов, могут являться чрезвычайно эффективной терапевтической стратегией. Показано, что резистентность опухолевых клеток кTGF- нивелирует многие цитотоксические действия лучевой терапии и химиотерапии, и зависимая от лечения активация TGF- в строме даже может быть вредной, поскольку он сам делает микроокружение более благоприятным для развития опухоли и способствует повреждению тканей, приводящему к фиброзу. Развитие ингибиторов TGF- передачи сигналов, возможно, будет являться положительным как для самостоятельного лечения прогрессирующего злокачественного новообразования, таких для комбинирования с другими видами лечений. Соединения пригодны для лечения злокачественного новообразования и других болезненных состояний, вызываемых TGF-, путем ингибирования TGF- у нуждающегося в этом пациента путем введения указанному пациенту указанного(ых) соединения(й). TGF- также будут являться полезными для лечения атеросклероза (Т.A. McCaffrey: TGF-ps and TGF- Receptors in Atherosclerosis: Cytokine andFunctional Role of TGF- in Alzeheimer's Disease Microvascular Injury: Lessons from Trangenic Mice: Neurochemistry International 2001, 39, 393-400). Было обнаружено, что соединения в соответствии с изобретением и их соли обладают очень ценными фармакологическими свойствами, а также хорошей переносимостью. В особенности они проявляют ингибирующие свойства по отношению к TGF- рецепторной I киназе. Соединения в соответствии с изобретением предпочтительно обладают благоприятной биологической активностью, которую легко можно продемонстрировать с помощью исследований на основе ферментов, например исследований, описанных в данной заявке. В таких исследованиях на основе ферментов соединения в соответствии с изобретением предпочтительно проявляют и вызывают ингибирующее действие, которое обычно подтверждается значениями IC50 в подходящем интервале, предпочтительно в микромолярном интервале и более предпочтительно в наномолярном интервале. Как обсуждалось в настоящем изобретении, эти пути передачи сигналов значимы для различных заболеваний. Таким образом, соединения в соответствии с изобретением пригодны для профилактики и/или лечения заболеваний, которые зависят от указанных путей передачи сигналов путем взаимодействия с одним или несколькими указанными путями передачи сигналов. Следовательно, настоящее изобретение относится к соединениям в соответствии с изобретением в качестве промоторов или ингибиторов, предпочтительно в качестве ингибиторов, путей передачи сигналов, описанных в данной заявке. Таким образом, изобретение предпочтительно относится к соединениям в соответствии с изобретением в качестве промоторов или ингибиторов, предпочтительно в качестве ингибиторов TGF- пути передачи сигнала. Кроме того, настоящее изобретение относится к применению одного или более соединений в соответствии с изобретением для лечения и/или профилактики заболеваний, предпочтительно заболеваний,описанных в данной заявке, которые вызываются, опосредуются или распространяются с помощью повышенной активности TGF-. Следовательно, настоящее изобретение относится к соединениям в соот-5 015254 ветствии с изобретением в качестве лекарственных средств и/или активных компонентов лекарственных средств для лечения и/или профилактики указанных заболеваний и к применению соединений в соответствии с изобретением для приготовления лекарственного средства для лечения и/или профилактики указанных заболеваний, а также к способу лечения указанных заболеваний, который включает введение одного или нескольких соединений в соответствии с изобретением пациенту, нуждающемуся в таком введении. Хозяин или пациент может принадлежать к любому виду млекопитающих, например, такому как приматы, предпочтительно человек; грызуны, включая мышей, крыс и хомячков, кролики; лошади, коровы, собаки, коты и т.д. Животные модели представляют интерес для экспериментальных исследований,поскольку они обеспечивают модель для лечения заболевания человека. Чувствительность определенной клетки к лечению с помощью соединений в соответствии с изобретением может быть определена при исследованиях в условиях in vitro. В общем случае культуру клеток объединяют с соединением в соответствии с изобретением при различных концентрациях в течение периода времени, достаточного для того, чтобы позволить активным веществам индуцировать гибель клетки или ингибировать миграцию, обычно в интервале времени приблизительно от одного часа до одной недели. Для исследования в условиях in vitro можно использовать культивируемые клетки из образца биопсии. Затем подсчитывают жизнеспособные клетки, оставшиеся после обработки. Доза будет изменяться в зависимости от конкретного применяемого соединения, конкретного заболевания, состояния пациента и т.д. Обычно терапевтическая доза будет достаточной для существенного уменьшения нежелательной популяции клеток в ткани-мишени, при поддержании жизнеспособности пациента. Лечение в общем случае продолжают до тех пор, пока не будет достигнуто существенное уменьшение, например по меньшей мере приблизительно 50% уменьшение популяции клеток, представляющих интерес, при этом лечение можно продолжать до тех пор, пока, по существу, в организме не будут определяться нежелательные клетки. Для идентификации пути сигнальной трансдукции и определения взаимодействия между различными сигнальными путями различными учеными были разработаны приемлемые модели или модельные системы, например модели на основе культур клеток (например, Khwaja и др., ЕМВО, 1997, 16, 2783-93) и модели трансгенных животных (например, White и др., Oncogene, 2001, 20, 7064-7072). С целью проверки определенных этапов каскада для сигнальной трансдукции можно использовать соединения, которые препятствуют этому процессу, для модуляции сигнала (например, Stephens и др., Biochemical J.,2000, 351, 95-105). Соединения в соответствии с изобретением могут также быть полезными в качестве реагентов для тестирования зависимых от киназы путей сигнальной трансдукции у животных и/или на моделях культур клеток, а также на любом из клинических расстройств, указанных в данной заявке. Измерение киназной активности представляет собой известный способ, который может осуществить любой специалист в данной области. Общие аналитические системы для определения киназной активности с субстратами, например гистоном (например, Alessi и др., FEBS Lett. 1996, 399, 3, стр. 333-338) или основным миелиновым белком, описаны в литературе (например, Campos-Gonzalez, R. и Glenney, Jr.,J.R. 1992 J. Biol. Chem. 267, стр. 14535). Для идентификации ингибиторов киназы доступными являются различные аналитические системы. В исследовании сцинтилляционной схожести (Sorg и др., J. of. Biomolecular Screening, 2002, 7, 11-19) и анализе флэш-планшетов измеряют радиоактивное фосфорилирование белка или пептида в качестве субстрата с ATP. В присутствии ингибиторного соединения не выявляется никакого сигнала или выявляется снижение радиоактивного сигнала. Кроме того, в качестве аналитических способов являются полезными способы гомогенного переноса энергии флуоресцентного резонанса с разрешением во времени(HTR-FRET) и флуоресцентной поляризации (FP) (Sills и др., J. of Biomolecular Screening, 2002, 191-214). В других нерадиоактивных способах анализа на основе ELISA используются специфические фосфо-антитела (фосфо-AB). Фосфо-AB связываются только с фосфорилированным субстратом. Это связывание может быть определено с использованием вторичного антиовечьего антитела, конъюгированного с пероксидазой, с помощью хемолюминисценции (Ross и др., 2002, Biochem. J.), только что опубликованная рукопись (BJ20020786). Известный уровень техники Соединения B2, B3, B4, B5, B8, B9, B10, B12, B14, B16, B17, B19, B20 описаны в DE 2409308 в качестве активных компонентов лекарственных средств, обладающих аналгетическим и/или воспалительным действием. Соединения B1, B6, B7, B11, B13, B15, B18, B21, B22 описаны Е. Szarvasi и др. в Eur. J. Med. 1978,13, 113-119 в качестве активных компонентов лекарственных средств, обладающих аналгетическим и/или противовоспалительным действием. Другие триазоло-1,5-бензодиазепины известны из DE 2318673.V. Ambrogi и др. в J. Heterocyclic Chem. 31, 1349-1352 (1994) описали серосодержащие производные 4,5-дигидро-s-триазоло[3,4-d]-1,5-бензотиазепина.V. Ambrogi и др. в II Farmaco 48, 665-676 (1993) описали 1,4-бензотиазины и 1,5-бензотиазепины,обладающие действием на центральную нервную систему. Другие производные триазола описаны в качестве ингибиторов TGF- в WO 03/042211 A1. Еще другие производные триазола известны в качестве ингибиторов TGF- в WO 2004/026307 A1. Бициклические пиррольные производные описаны в качестве ингибиторов TGF- в WO 02/094833. Сущность изобретения Изобретение относится к соединениям, выбранным из группы, включающей и их фармацевтически пригодные производные, сольваты, соли, таутомеры и стереоизомеры, включая их смеси во всех соотношениях. Изобретение также относится к оптически активным формам (стереоизомерам), энантиомерам, рацематам, диастереомерам, а также гидратам и сольватам указанных соединений. Под сольватами соединений подразумевают аддукты молекул инертного растворителя на соединениях, которые образуются благодаря их силе взаимного притяжения. Сольваты представляют собой, например, моногидраты или дигидраты или алкоголяты. Под фармацевтически пригодными производными подразумевают, например, соли соединений в соответствии с изобретением, а также так называемые пролекарства соединений. Под производными пролекарств подразумевают соединения в соответствии с изобретением, которые являются модифицированными, например, алкильной или ацильной группами, сахарами или олигопептидами, и которые быстро расщепляются в организме с образованием активных соединений в соответствии с изобретением. Это понятие также включает производные биоразлагаемых полимеров соединений в соответствии с изобретением, как описано, например, в Int. J. Pharm. 115, 61-67 (1995). Выражение "эффективное количество" обозначает количество лекарственного средства или фармацевтического активного компонента, которое вызывает в ткани, системе, животном или человеке биологическую или медицинскую ответную реакцию, которую предполагает или желает получить, например,исследователь или лечащий врач. Дополнительно выражение "терапевтически эффективное количество" обозначает то количество, которое имеет следующие последствия по сравнению с соответствующим субъектом, который не получал этого количества: улучшение лечения, излечение, предотвращение или элиминацию заболевания, синдрома, состояния, жалобы, расстройства или побочных действий, или также уменьшение прогрессирования заболевания, жалобы, расстройства или побочных действий, или также уменьшения прогрессирования заболевания, жалобы или расстройства. Выражение "терапевтически эффективное количество" также охватывает количества, которые эффективны для повышения нормальной физиологической функции.-9 015254 Изобретение также относится к применению смесей соединений в соответствии с изобретением,например смесей двух диастереомеров, например, в соотношении 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:100 или 1:1000. Особенно предпочтительными являются смеси стереоизомерных соединений. Соединения в соответствии с изобретением, а также исходные вещества для их получения могут,кроме того, быть получены при помощи методов, известных per se, как описано в литературе (например,в стандартных работах, таких как Houben-Weyl, Methoden der organischen Chemie [Методы органической химии], Georg-Thieme-Verlag, Штутгарт), в соответствии с условиями реакций, которые известны и приемлемы для указанных реакций. Также при этом можно применять разнообразные модификации, которые известные per se, но о которых здесь подробно не упоминается. Соединения в соответствии с изобретением предпочтительно могут быть получены путем взаимодействия производных тетрагидробензо[b][1,4]диазепин-2-тиона с карбогидразидами. Обычно реакцию осуществляют в инертном растворителе. В зависимости от применяемых условий, время реакции составляет от нескольких минут до 14 дней, температура реакции находится в интервале приблизительно от -15 до 150C, обычно в интервале от 30 до 130C, особенно предпочтительно в интервале от 60 до 120C. Подходящими инертными растворителями являются, например, углеводороды, такие как гексан,петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен,1,2-дихлорэтан, четыреххлористый углерод, хлороформ или дихлорметан; спирты, такие как метанол,этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; гликолевые эфиры, такие как этиленгликольмонометиловый или моноэтиловый эфир, этиленгликольдиметиловый эфир (диглим); кетоны,такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид(ДМФА); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО); сероуглерод, карбоновые кислоты, такие как муравьиная кислота или уксусная кислота, нитросоединения,такие как нитрометан или нитробензол; сложные эфиры, такие как этилацетат, или смеси указанных растворителей. Особенно предпочтительным является 1-бутанол. Подходящим для расщепления простых эфиров является обработка трибромидом бора в стандартных условиях. Фармацевтические соли и другие формы Соединения, раскрытые в изобретении, могут использоваться в своей заключительной, несолевой форме. С другой стороны, настоящее изобретение также относится к применению таких соединений в форме их фармацевтически приемлемых солей, которые могут быть получены с помощью разнообразных органических и неорганических кислот и оснований в соответствии со способами, хорошо известными в данной области техники. Фармацевтически приемлемые формы солей соединений в соответствии с изобретением готовят, главным образом, при использовании традиционных способов. В случае, если соединение в соответствии с изобретением содержит группу карбоновой кислоты, то его приемлемая соль может быть образована с помощью реакции соединения с приемлемым основанием для получения соответствующей соли присоединения основания. Примерами таких оснований являются гидроксиды щелочных металлов, включая гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочно-земельных металлов, такие как гидроксид бария и гидроксид кальция; алкоксиды щелочных металлов, например этанолят калия и пропанолят натрия; а также различные органические основания, такие как пиперидин, диэтаноламин и N-метилглутамин. Сюда также включены соли алюминия соединений в соответствии с изобретением. Для некоторых соединений в соответствии с изобретением соли присоединения кислоты могут быть образованы путем обработки указанных соединений фармацевтически приемлемыми органическими и неорганическими кислотами, например гидрогалогенидами, такими как гидрохлорид, гидробромид или гидройодид; другими минеральными кислотами, и их соответствующими солями, такими как сульфат, нитрат или фосфат и др.; и алкил- и моноарилсульфонатами, такими как этансульфонат, толуолсульфонат и бензолсульфонат; и другими органическими кислотами и их соответствующими солями, такими как ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, салицилат, аскорбат и др. Таким образом, фармацевтически приемлемые соли присоединения кислоты соединений в соответствии с изобретением включают следующие соли, но не ограничиваясь только ими: ацетат,адипат, альгинат, аргинат, аспартат, бензоат, бензолсульфонат (безилат), бисульфат, бисульфит, бромид,бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, цитрат, циклопентанпропионат,диглюконат, дигидрофосфат, динитробензоат, додецилсульфат, этансульфонат, фумарат, галактерат (из слизевой кислоты), галактуронат, глюкогептаноат, глюконат, глутамат, глицерофосфат, гемисукцинат,гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2 гидроксиэтансульфонат, йодид, изетионат, изобутират, лактат, лактобионат, малат, малеат, малонат,манделат, метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, олеат, пальмоат, пектинат, персульфат, фенилацетат, 3-фенилпропионат, фосфат,фосфонат, фталат. Кроме того, основные соли соединений в соответствии с изобретением включают, но не ограничи- 10015254 ваясь только ими, соли алюминия, аммония, кальция, меди, железа(III), железа(II), лития, магния, марганца(III), марганца(II), калия, натрия и цинка. Предпочтительными среди перечисленных выше солей являются аммонийные соли щелочных металлов натрия и калия и соли щелочно-земельных металлов кальция и магния. Соли соединений в соответствии с изобретением, которые имеют происхождение от фармацевтически приемлемых органических нетоксических оснований, включают, но не ограничиваясь только ими, соли первичных, вторичных и третичных аминов, замещенных аминов, также включая природные замещенные амины, циклические амины и основные ионообменные смолы, например аргинин,бетаин, кофеин, хлорпрокаин, холин, N,N'-дибензилэтилендиамин (бензатин), дициклогексиламин, диэтаноламин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, Nэтилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лидокаин, лизин, меглумин, N-метил-D-глюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы,прокаин, пурины, теобромин, триэтаноламин, триэтиламин, триметиламин, трипропиламин и трис(гидроксиметил)метиламин (трометамин). Соединения в соответствии с настоящим изобретением, которые включают основные азотсодержащие группы, могут быть кватернизированы с помощью таких агентов, как С 1-С 4-алкилгалогениды, например метил-, этил-, изопропил- и трет-бутилхлориды, бромиды и йодиды; ди-C1-C4-алкилсульфаты,например диметил-, диэтил- и диамилсульфаты; C10-C18-алкилгалогениды, например децил-, додецил-,лаурил-, миристил- и стеарилхлориды, бромиды и йодиды; и арил-C1-C4-алкилгалогениды, например бензилхлорид и фенетилбромид. Указанные соли позволяют получать как растворимые в воде, так и растворимые в масле соединения в соответствии с изобретением. Предпочтительные фармацевтические соли, указанные выше, включают, но не ограничиваясь только ими, ацетат, трифторацетат, безилат, цитрат, фумарат, глюконат, гемисукцинат, гиппурат, гидрохлорид, гидробромид, изетионат, манделат, меглумин, нитрат, олеат, фосфонат, пивалат, фосфат натрия,стеарат, сульфат, сульфосалицилат, тартрат, тиомалат, тозилат и трометамин. Кислотно-аддитивные соли основных соединений в соответствии с изобретением получают путем приведения в контакт формы свободных оснований с достаточным количеством желаемой кислоты для получения соли традиционным способом. Свободное основание можно регенерировать путем приведения в контакт формы соли с основанием и выделения свободного основания традиционным способом. Формы свободного основания в некоторой степени отличаются от своих соответствующих форм солей своими определенными физическими свойствами, такими как растворимость в полярных растворителях,однако во всем остальном соли являются эквивалентными своим соответствующим формам свободных оснований для целей настоящего изобретения. Как было указано, фармацевтически приемлемые соли присоединения основания соединений в соответствии с изобретением образуются с металлами или аминами, такими как щелочные металлы и щелочно-земельные металлы или органические амины. Предпочтительные металлы представляют собой натрий, калий, магний и кальций. Предпочтительные органические амины представляют собой N,N'дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, N-метил-D-глюкамин и прокаин. Соли присоединения основания кислых соединений в соответствии с изобретением получают путем приведения в контакт формы свободной кислоты с достаточным количеством желаемого основания для получения соли традиционным способом. Форма свободной кислоты может быть регенерирована путем приведения в контакт формы соли с кислотой и выделения формы свободной кислоты известным способом. Формы свободной кислоты в некоторой степени отличаются от своих соответствующих форм солей определенными физическими свойствами, такими как растворимость в полярных растворителях, однако во всем остальном соли являются эквивалентными своим соответствующим формам свободных кислот для целей настоящего изобретения. Если соединение в соответствии с изобретением включает более чем одну группу, которая способна к образованию фармацевтически приемлемых солей этого типа, то изобретение также охватывает составные соли. Примеры типичных составных форм солей включают, но не ограничиваясь только ими,битартрат, диацетат, дифумарат, димеглумин, дифосфат, динатрий и тригидрохлорид. В свете описанного выше можно увидеть, что выражение фармацевтически приемлемая соль в контексте данной заявки предназначено для обозначения активного компонента, который включает соединение в соответствии с изобретением в форме своей соли, особенно в том случае, если указанная форма соли обеспечивает указанному активному компоненту улучшенные фармакокинетические свойства по сравнению со свободной формой указанного активного компонента или другой солью указанного активного компонента, которые использовались ранее. Фармацевтически приемлемая форма соли активного компонента может также изначально обеспечивать желаемое фармакокинетическое свойство указанному активному компоненту, которым он ранее не обладал, а также может даже положительно влиять на фармакодинамику указанного активного компонента в отношении его терапевтической активности в организме. Изобретение, кроме того, относится к лекарственным средствам, содержащим по меньшей мере одно соединение в соответствии с изобретением и/или его фармацевтически пригодные производные, соль- 11015254 ваты и стереоизомеры, включая их смеси во всех соотношениях, и, необязательно, наполнители и/или вспомогательные вещества. Лекарственные препараты могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Такая единица может включать, например, от 0,5 мг до 1 г, предпочтительно от 1 до 700 мг, более предпочтительно от 5 до 100 мг соединения в соответствии с изобретением, в зависимости от состояния, подвергаемого лечению, способа введения, а также возраста, веса тела и состояния пациента, или фармацевтические композиции могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Предпочтительными дозированными единицами лекарственных препаратов являются те, которые содержат суточную дозу или часть суточной дозы, как указано выше, или соответствующую порцию их активного компонента. Лекарственные средства этого типа также могут быть получены способом, который хорошо известен в области фармацевтики. Лекарственные препараты могут адаптироваться для введения при помощи любого подходящего способа, например путем перорального (включая буккальное или подъязычное), ректального, назального,местного (включая буккальное, подъязычное или трансдермальное), вагинального или парентерального(включая подкожное, внутримышечное, внутривенное или внутрикожное) введения. Такие препараты могут быть приготовлены с помощью любого способа, известного в области фармацевтики, например путем объединения активного компонента с наполнителем(ями) или вспомогательным(ыми) веществом(ами). Лекарственные препараты, адаптированные для перорального введения, могут вводиться в виде отдельных единиц, таких как, например, капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; пищевых пен или пенистых пищевых продуктов; или жидких эмульсий масло-в-воде или жидких эмульсий вода-в-масле. Так, например, в случае перорального введения в виде таблетки или капсулы, активный компонент может быть объединен с пероральным, нетоксичным и фармацевтически приемлемым инертным наполнителем, таким как, например, этанол, глицерин, вода и т.п. Порошки получают путем измельчения соединения до подходящего небольшого размера и смешивания его с фармацевтическим наполнителем,измельченным аналогичным способом, таким как, например, пищевой углеводород, такой как, например,крахмал или маннит. Также можно добавлять ароматизатор, консервант, диспергирующее вещество и краситель. Капсулы получают путем приготовления порошковой смеси, как описано выше, и заполняют ею желатиновые капсулы определенной формы. Перед заполнением капсул к порошковой смеси можно добавлять скользящие и смазывающие вещества, такие как, например, высокодисперсная кремниевая кислота, тальк, стеарат магния, стеарат кальция или полиэтиленгликоль в твердой форме. Для улучшения доступности лекарственного средства, заключенного в капсулу, также можно добавлять дезинтегрирующее вещество или солюбилизатор, такой как, например, агар-агар, карбонат кальция или карбонат натрия. Дополнительно, если это является желательным или необходимым, в смесь также можно добавлять подходящие связующие, смазывающие вещества, дезинтеграторы, а также красители. Подходящими связующими являются крахмал, желатин, природные сахара, такие как, например, глюкоза или -лактоза,подсластители, приготовленные из кукурузы, естественных и синтетических резин, такие как, например,аравийская камедь, трагакантовая камедь или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Смазывающие вещества, которые могут применяться в таких дозированных формах,включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтеграторы включают, но не ограничиваясь только ими, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Лекарственные средства в виде таблеток получают, например, путем приготовления порошковой смеси, гранулирования или сухого прессования смеси, добавления смазывающего вещества и дезинтегратора и прессования полученной смеси в таблетки. Порошковую смесь готовят путем смешивания соединения, измельченного подходящим образом, с разбавителем или основанием,как описано выше, и необязательно со связующим, таким как, например, карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем растворения, таким как, например, парафин,усилителем поглощения, таким как, например, четвертичная соль, и/или абсорбентом, таким как, например, бентонит, каолин или дикальцийфосфат. Порошковую смесь можно гранулировать путем смачивания со связующим, таким как, например,сироп, крахмальная паста, слизь акации или растворы целлюлозы или полимерных веществ и прессования ее через сито. В качестве альтернативы грануляции, порошковую смесь можно пропускать через таблетировочную машину, получая куски неправильной формы, которые распадаются, образуя гранулы. Гранулы можно замасливать путем добавления стеариновой кислоты, стеарата, талька или минерального масла для предотвращения слипания в таблетировочной литейной форме. После этого смазанную смесь спрессовывают, получая таблетки. Соединения в соответствии с изобретением также можно объединять с сыпучим инертным наполнителем и затем подвергать прямому прессованию, получая таблетки без осуществления стадий грануляции или сухого прессования. Таблетки также можно покрывать прозрач- 12015254 ным или светонепроницаемым защитным слоем, состоящим из шеллакового запечатывающего слоя, слоя сахара или полимерного вещества и глянцевого слоя воска. К этим покрытиям также можно добавлять красители для возможности различения между разными дозируемыми единицами. Жидкости для перорального введения, такие как, например, раствор, сиропы и эликсиры, могут быть приготовлены в виде дозируемых единиц таким образом, чтобы они содержали заранее установленное количество соединения. Сиропы могут быть получены путем растворения соединения в водном растворе с подходящим ароматизатором, тогда как эликсиры готовят с применением нетоксичного спиртового наполнителя. Суспензии могут быть приготовлены путем диспергирования соединения в нетоксичном наполнителе. Также можно добавлять солюбилизаторы и эмульсификаторы, такие как, например,этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбита, консерванты, ароматические добавки, такие как, например, масло мяты перечной, или натуральные заменители сахара или сахарин, или другие искусственные заменители сахара и т.п. Лекарственные препараты для перорального введения в виде дозированных единиц могут быть инкапсулированы в микрокапсулы, если это является желательным. Также лекарственный препарат может быть приготовлен таким образом, чтобы пролонгировать или замедлить высвобождение, например, путем применения покрытий или заделывания требуемого вещества в полимеры, воск и т.п. Соединения в соответствии с изобретением и их соли, сольваты и физиологически функциональные производные также могут вводиться в виде липосомных систем доставки, таких как, например, небольшие однослойные пузырьки, большие однослойные пузырьки и многослойные пузырьки. Липосомы могут быть образованы с помощью различных фосфолипидов, таких как, например, холестерин, стеариламин или фосфатидилхолины. Соединения в соответствии с изобретением и их соли, сольваты и физиологически функциональные производные также могут доставляться с помощью моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения. Соединения также могут быть соединены с растворимыми полимерами в качестве нацеливающих носителей лекарственных средств. Такими полимерами могут являться поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидофенол, полигидроксиэтиласпартамидофенол или полиэтиленоксид полилизина, замещенный пальмитоиловыми радикалами. Кроме того, соединения можно связывать с биоразлагаемыми полимерами, которые пригодны для обеспечения контролируемого высвобождения лекарственного средства, например полимолочной кислотой, поли-эпсилон-капролактоном, полигидроксимасляной кислотой, полиортоэфирами,полиацеталями, полидигидроксипиранами, полицианоакрилатами и перекрестно-сшитыми или амфипатическими блок-сополимерами гидрогелей. Лекарственные препараты, адаптированные для трансдермального введения, могут вводиться в виде независимых пластырей для удлиненного, тесного контакта с эпидермисом реципиента. Таким образом, например, активный компонент может доставляться из пластыря путем ионофореза, как в общем описано в Pharmaceutical Research, 3(6), 318 (1986). Фармацевтические композиции, адаптированные для местного введения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для лечения глаз или других наружных тканей, например рта и кожи, предпочтительно применяются лекарственные препараты в виде местной мази или крема. Для приготовления лекарственного препарата в виде мази активный компонент может применяться с парафиновым или смешивающимся с водой мазевым основанием. Альтернативно, для получения крема активный компонент может быть приготовлен с основой для крема типа масло-в-воде или основой вода-в-масле. Лекарственные препараты, адаптированные для местного введения в глаза, включают глазные капли, в которых активный компонент растворен или суспендирован в подходящем носителе, предпочтительно в водном растворителе. Лекарственные препараты, адаптированные для местного введения в полость рта, включают лепешки, пастилки и жидкости для полоскания рта. Лекарственные препараты, адаптированные для ректального введения, могут вводиться в виде суппозиториев или клизм. Лекарственные препараты, адаптированные для интраназального введения, в которых носитель представляет собой твердое вещество, включают крупный порошок, имеющий размер частичек, например, в интервале 20-500 мкм, который вводится путем вдыхания, то есть путем быстрого вдоха через нос из контейнера, содержащего порошок, который придерживают возле носа. Подходящие лекарственные препараты для введения в виде интраназального аэрозоля или носовых капель с жидкостью в качестве носителя включают растворы активного вещества в воде или в масле. Лекарственные препараты, адаптированные для введения путем ингаляции, включают тонкоизмельченные частички в виде пыли или тумана, которые могут быть получены с помощью различных диспергирующих устройств под давлением с аэрозолями, распылителями или инсуффляторами. Лекарственные препараты, адаптированные для вагинального введения, могут вводиться в виде пессариев, тампонов, кремов, гелей, паст, пен или аэрозолей. Лекарственные препараты, адаптированные для парентерального введения, включают водные или- 13015254 неводные стерильные растворы для инъекций, содержащие антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, с помощью которых лекарственное средство поддерживается изотоническим по отношению к крови реципиента, подвергаемого лечению; и водные или неводные стерильные суспензии, которые могут содержать суспензионную среду и загустители. Лекарственные препараты могут вводиться с помощью емкостей для однократного или многократного введения, например запечатанных ампул и флаконов, и храниться в лиофилизированном состоянии, при этом непосредственно перед введением необходимо только добавить стерильную жидкость-носитель, например воду для инъекций. Растворы и суспензии для инъекций, приготовленные согласно рецептуре, могут быть приготовлены из стерильных порошков, гранул и таблеток. Также является очевидным, что дополнительно к предпочтительным вышеописанным составляющим лекарственные препараты также могут содержать другие вещества, которые используются в данной области для конкретных типов лекарственных средств; например, лекарственные препараты, пригодные для перорального введения, могут содержать ароматизаторы. Терапевтически эффективное количество соединения в соответствии с изобретением зависит от многих факторов, включая, например, возраст и вес животного, определенное состояние, которое необходимо лечить, и его тяжесть, природу лекарственного средства и способ введения, и в конченом счете оно может быть определено лечащим врачом или ветеринаром. Тем не менее, эффективное количество соединения в соответствии с изобретением для лечения роста опухолей, например рака ободочной кишки или молочной железы, как правило, находится в интервале от 0,1 до 100 мг/кг веса тела реципиента (млекопитающего) в сутки и предпочтительно обычно находится в интервале от 1 до 10 мг/кг веса тела в сутки. Следовательно, действующее суточное количество для взрослого млекопитающего весом 70 кг обычно может составлять от 70 до 700 мг, причем это количество может вводиться в виде отдельной дозы один раз в день или обычно в виде циклов частичных доз (таких как, например, два, три, четыре, пять или шесть раз) в день, таким образом, что общая суточная доза является аналогичной. Эффективное количество его соли или сольвата или физиологически функционального производного может быть определено в виде доли эффективного количества соединения в соответствии с изобретением per se. Также можно предположить, что аналогичные дозы пригодны для лечения других состояний, описанных выше. Кроме того, изобретение относится к лекарственным средствам, содержащим по меньшей мере одно соединение в соответствии с изобретением и/или его фармацевтически пригодные производные, сольваты и стереоизомеры, включая их смеси во всех соотношениях, и по меньшей мере один дополнительный активный компонент лекарственного средства. Изобретение также относится к комплекту (набору), состоящему из отдельных пакетов:(а) эффективного количества соединения в соответствии с изобретением и/или его фармацевтически пригодных производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, и(б) эффективного количества дополнительного активного компонента лекарственного средства. Комплект включает подходящие емкости, такие как коробки, индивидуальные бутылки, пакеты или ампулы. Комплект может включать, например, отдельные ампулы, каждая из которых содержит эффективное количество соединения в соответствии с изобретением и/или его фармацевтически пригодных производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, и эффективное количество дополнительного активного компонента лекарственного средства в растворенной или лиофиллизированной форме. Применение Настоящие соединения, выбранные из группы, включающей и их фармацевтически пригодные производные, соли, сольваты, таутомеры и стереоизомеры, включая их смеси во всех соотношениях, пригодны в качестве фармацевтических активных компонентов для млекопитающих, в особенности для людей, для приготовления лекарственного средства для лечения и/или борьбы со злокачественным новообразованием, роста опухоли, роста метастаз, фиброза, рестеноза, ВИЧ инфекции, Альцгеймера, атеросклероза и/или для стимуляции заживления ран. Наиболее предпочтительным является применение для лечения заболевания, где заболевание представляет собой солидную опухоль. Солидную опухоль предпочтительно выбирают из группы опухолей плоского эпителия, мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, головного мозга, предстательной железы, мочеполового тракта, лимфатической системы, желудка, гортани и/или легкого. Солидную опухоль также предпочтительно выбирают из группы, включающей аденокарциному легкого, мелкоклеточный рак легкого, рак поджелудочной железы, глиобластомы, рак толстой кишки и рак молочной железы. Кроме того, предпочтительным является применение для лечения опухоли крови и иммунной системы, предпочтительно для лечения опухоли, выбранной из группы, включающей острый миелоидный лейкоз, хронический миелоидный лейкоз, острый лимфолейкоз и/или хронический лимфолейкоз. Данные соединения также подходят для комбинирования с известными противораковыми агентами. Эти известные противораковые агенты включают следующие: модуляторы эстрогенового рецептора,модуляторы андрогенового рецептора, модуляторы ретиноидного рецептора, цитотоксические агенты,- 17015254 антипролиферативные агенты, ингибиторы пренил-протеин-трансферазы, ингибиторы HMG-CoA редуктазы, ингибиторы ВИЧ протеазы, ингибиторы обратной транскриптазы и другие ингибиторы ангиогенеза. Данные соединения в особенности подходят для применения одновременно с лучевой терапией. Синергетические эффекты ингибирования VEGF в комбинации с лучевой терапией описаны в данной области техники (см. WO 00/61186)."Модуляторы эстрогенового рецептора" относятся к соединениям, которые препятствуют или ингибируют связывание эстрогена с рецептором, независимо от механизма. Примеры модуляторов эстрогенового рецептора включают, но не ограничиваясь только ими, тамоксифен, ралоксифен, идоксифен,LY353381, LY 117081, торемифен, фулвестрант, 4-[7-(2,2-диметил-1-оксопропокси-4-метил-2-[4-[2-(1 пиперидинил)этокси]фенил]-2H-1-бензопиран-3-ил]фенил-2,2-диметилпропаноат, 4,4'-дигидроксибензофенон-2,4-динитрофенилгидразон и SH646."Модуляторы андрогенового рецептора" относятся к соединениям, которые препятствуют или ингибируют связывание андрогенов с рецептором, независимо от механизма. Примеры модуляторов андрогенового рецептора включают финастерид и другие ингибиторы 5-редуктазы, нилутамид, флутамид,бикалутамид, лиарозол и абиратерон ацетат."Модуляторы ретиноидного рецептора" относятся к соединениям, которые препятствуют или ингибируют связывание ретиноидов с рецептором, независимо от механизма. Примеры таких модуляторов ретиноидного рецептора включают бексаротен, третиноин, 13-цис-ретиноевая кислота, 9-цис-ретиноевая кислота, -дифторметилорнитин, ILX23-7553, транс-N-(4'-гидроксифенил)ретинамид и N-4-карбоксифенилретинамид."Цитотоксические агенты" относятся к соединениям, которые приводят к смерти клетки, главным образом, посредством прямого действия на функционирование клетки или ингибируют или препятствуют делению клетки, включая алкилирующие агенты, факторы некроза опухоли, интеркалирующие агенты, ингибиторы микротрубулина и ингибиторы топоизомеразы. Примеры цитотоксических агентов включают, но не ограничиваясь только ими, тирапазимин, сертенеф, кахектин, ифосфамид, тазонермин,лонидамин, карбоплатин, алтретамин, преднимустин, дибромодулцитол, ранимустин, фотемустин, недаплатин, оксалиплатин, темозоломид, гептаплатин, эстрамустин, импросульфан тозилат, трофосфамид,нимустин, диброспидиум хлорид, пумитепа, лобаплатин, сатраплатин, профиромицин, цисплатин, ирофулвен, дексифосфамид, цис-аминдихлор(2-метилпиридин)платина, бензилгуанин, глуфосфамид,GPX100, (транс,транс,транс)бис-му-(гексан-1,6-диамин)му-[диаминплатина(II)]бис[диамин(хлор)платина(II)]тетрахлорид, диаризидинилспермин, триоксид мышьяка, 1-(11-додециламино-10-гидроксиундецил)-3,7-диметилксантин, зорубицин, идарубицин, даунорубицин, бисантрен, митоксантрон, пирарубицин, пинафид, валрубицин, амрубицин, антинеопластон, 3'-деамино-3'-морфолино-13-деоксо-10 гидроксикарминомицин, аннамицин, галарубицин, элинафид, MEN10755 и 4-деметокси-3-деамино-3 азиридинил-4-метилсульфонилдаунорубицин (см. WO 00/50032). Примеры ингибиторов микротрубулина включают паклитаксел, виндезин сульфат, 3',4'-дидегидро 4'-деокси-8'-норвинкалеукобластин, доцетаксол, ризоксин, доластатин, мивобулин изетионат, ауристатин, цемадотин, RPR109881, BMS184476, винфлунин, криптофицин, 2,3,4,5,6-пентафтор-N-(3-фтор-4 метоксифенил)бензолсульфонамид,ангидровинбластин,N,N-диметил-L-валил-L-валил-N-метил-Lвалил-L-пролил-L-пролин-трет-бутиламид, TDX258 и BMS188797. Ингибиторами топоизомеразы являются, например, топотекан, гикаптамин, иринотекан, рубитекан,6-этоксипропионил-3',4'-O-эксобензилиденчартреузин, 9-метокси-N,N-диметил-5-нитропиразоло[3,4,5k1]акридин-2-(6H)пропанамин,1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо"Антипролиферативные агенты" включают антисмысловые РНК и ДНК олигонуклеотиды, такие как G3139, ODN698, RVASKRAS, GEM231 и INX3001, и антиметаболиты, такие как, например, эноцитабин, кармофур, тегафур, пентостатин, доксифлуридин, триметрексат, флударабин, капецитабин, галоцитабин, цитарабин окфосфат, фостеабин натрия гидрат, ралтитрексед, палтитрексид, эмитефур, тиазофурин, децитабин, нолатрексед, пеметрексед, нелзарабин, 2'-деокси-2'-метилиденцитидин, 2'-фторометилен-2'-деоксицитидин,N-[5-(2,3-дигидробензофурил)сульфонил]-N'-(3,4-дихлорфенил)мочевина,N6-[4-деокси-4-[N2-[2(E),4(E)-тетрадекадиеноил]глициламино]-L-глицеро-В-L-манногептопиранозил] аденин, аплидин, эктеинасцидин, троксацитабин, 4-[2-амино-4-оксо-4,6,7,8-тетрагидро-3H-пирими- 18015254 дино[5,4-b]-1,4-тиазин-6-ил-(S)-этил]-2,5-тиеноил-L-глутаминовая кислота, аминоптерин, 5-фтороурацил, аланозин, сложный эфир 11-ацетил-8-(карбамоилоксиметил)-4-формил-6-метокси-14-окса-1,11 диазатетрацикло(7.4.1.0.0)тетрадека-2,4,6-триен-9-илуксусной кислоты, свайнсонин, лометрексол, дексразоксан, метиониназа, 2'-циано-2'-деокси-N4-палмитоил-1-B-D-арабинофуранозил цитозин и 3 аминопиридин-2-карбоксальдегид тиосемикарбазон. "Антипролиферативные агенты" также включают моноклональные антитела к факторам роста, отличающиеся от тех, которые перечислены для "ингибиторов ангиогенеза", такие как трастузумаб, и подавляющие опухоли гены, такие как p53, которые могут быть доставлены с помощью переноса генов, опосредованного рекомбинантным вирусом (см., например,патент US6069134). Исследование in-vitro (фермента) для определения эффективности ингибиторов ингибированияTGFопосредованных действий. В качестве примера, тестировали способность ингибиторов элиминировать TGFопосредованное ингибирование роста. Клетки эпителиальной клеточной линии легких Mv1Lu высевали при определенной плотности клеток в микротитровальный планшет на 96 лунок и культивировали в течение ночи в стандартных условиях. На следующий день среду заменяли средой, содержащей 0,5% FCS и 1 нг/мл TGF-, и добавляли тестируемые вещества в определенных концентрация, обычно в виде серийных разведений с 5-кратными стадиями. Концентрация растворителя ДМСО была постоянной и равнялась 0,5%. Еще через 2 дня клетки окрашивали кристаллическим фиолетовым. После экстрагирования кристаллического фиолетового из фиксированных клеток, спектрофотометрично измеряли абсорбцию при 550 нм. Ее можно использовать в качестве количественной оценки присутствующих прилипающих клеток и, следовательно, пролиферации клеток при культивировании. Таблица 1 Ингибирование TGF Клеточное исследование для тестирования ингибиторов киназы TGF- рецептора I Исследование киназы осуществляли в виде исследования флэш-планшета на 384 лунок. 31,2 нМ GST-ALK5, 439 нМ GST-SMAD2 и 3 мМ ATP (с 0,3 мкКи 33 Р-ATP/лунку) инкубировали в общем объеме 35 мкл (20 мМ HEPES, 10 мМ MgCl, 5 мМ MnCl, 1 мМ DTT, 0,1% BSA, pH 7,4) без тестируемого вещества или с тестируемым веществом (5-10 концентраций) при 30C в течение 45 мин. Реакцию останавливали с помощью 25 мкл 200 мМ раствора EDTA, фильтровали с отсасыванием при комнатной температуре через 30 мин и лунки промывали 3 раза 100 мкл 0,9% раствора NaCl. Радиоактивность измеряли на TopCount. Значения IC50 рассчитывали с помощью RS1. При указании выше и ниже вся температура приведена в градусах Цельсия (C). В последующих примерах "обычная обработка" обозначает, что при необходимости добавляют воду, pH устанавливают,при необходимости, на значение от 2 до 10, в зависимости от состава конечного продукта, смесь экстрагируют этилацетатом или дихлорметаном, фазы разделяют, органическую фазу высушивают над сульфатом натрия и выпаривают и продукт очищают при помощи хроматографии на силикагеле и/или кристаллизации. Rf значения на силикагеле; элюент: этилацетат/метанол 9:1. Масс-спектрометрия (MS): EI (ионизация электронным ударом) M+APCI-MS (химическая ионизация при атмосферном давлении - масс-спектрометрия) (M+H)+. Время удерживания Rt [мин]: определение осуществляли с помощью ВЭЖХ Колонка: Chromolith SpeedROD, 504,6 мм 2 ( заказа 1.51450.0001) от Merck Градиент: 5,0 мин, t = 0 мин, A:B = 95:5, t = 4,4 мин, A:B = 25:75, t = 4,5 мин до t = 5,0 мин: A:B =- 19015254 0:100 Скорость потока: 3,00 мл/мин Элюент A: вода + 0,1% ТФУ (трифторуксусная кислота) Элюент B: ацетонитрил + 0,08% ТФУ Длина волны: 220 нм Пример 1. Приготовление (R,S)-8-гидрокси-4-метил-1-(6-метилпиридин-2-ил)-5,6-дигидро-4H-2,3,6,10b-тетраазабензо[e]азулена (A1) осуществляли аналогично следующей схеме: 1.1. Приготовление 5-метокси-2-нитроанилина. 10 г 5-хлор-2-нитроанилина растворяли в 100 мл метанола и добавляли 32,3 г метилата натрия. Реакционную смесь нагревали при кипении в колбе с обратным холодильником в течение 18 ч. После охлаждения смесь упаривали насухо, добавляли 500 мл воды и неочищенный продукт выделяли путем фильтрации. При высушивании получали 9,15 г 5-метокси-2-нитроанилина. 1.2. Приготовление (R,S)-3-(5-метокси-2-нитрофениламино)-2-метилпропионовой кислоты. 9,15 г 5-метокси-2-нитроанилина растворяли в 60 мл ТГФ и добавляли 6,5 мл 2-метакрилонитрила и 1,35 мл 40% раствора гидроксида бензилтриметиламмония в метаноле. Реакционную смесь нагревали при кипении приблизительно в течение 20 ч и после охлаждения упаривали, получая маслянистый остаток. Неочищенный продукт растворяли в 400 мл метанола и 150 мл воды и добавляли 150 мл 32% раствора гидроксида натрия. Смесь нагревали при кипении в течение 3 ч, охлаждали, упаривали и подвергали обычной обработке, получая 8,9 г (R,S)-3-(5-метокси-2-нитрофениламино)-2-метилпропионовой кислоты в виде неочищенного продукта. 1.3. Приготовление (R,S)-8-метокси-4-метил-1-(6-метилпиридин-2-ил)-5,6-дигидро-4H-2,3,6,10bтетраазабензо[e]азулена. 8,9 г полученной (R,S)-3-(5-метокси-2-нитрофениламино)-2-метилпропионовой кислоты растворяли в 40 мл воды и 40 мл уксусной кислоты, добавляли 8,4 г цинка (грубоизмельченного) и смесь нагревали при кипении в течение 18 ч. При осуществлении водной обработки получали 2,35 г (R,S)-7-метокси-3 метил-1,3,4,5-тетрагидробензо[b]-1,4-диазепин-2-она, который подвергали реакции без дополнительной очистки. Для этого неочищенный продукт растворяли в 25 мл пиридина, добавляли 5,1 г 2,4-бис(4 метоксифенил)-2,4-дитиоксо-1,3,2,4-дитиадифосфетана и смесь нагревали при 110C в течение 3 ч. После охлаждения смесь подвергали водной обработке и неочищенный продукт осаждали путем добавления простого диэтилового эфира. При высушивании получали 2,34 г (R,S)-7-метокси-3-метил-1,3,4,5 тетрагидробензо[b]-1,4-диазепин-2-тиона. Его нагревали при 110C в течение 17 ч вместе с 6 метилпиридин-2-карбогидразида в 5 мл 1-бутанола. После охлаждения и водной обработки, маслянистый неочищенный продукт очищали с помощью препаративной ВЭЖХ, получая 78 мг (R,S)-8-метокси-4 метил-1-(6-метилпиридин-2-ил)-5,6-дигидро-4H-2,3,6,10b-тетраазабензо[e]азулена. 1.4. 60 мг (R,S)-8-метокси-4-метил-1-(6-метилпиридин-2-ил)-5,6-дигидро-4H-2,3,6,10b-тетраазабензо[e]азулена растворяли в 2,5 мл дихлорметана и по каплям добавляли 162 мкл трибромида бора. Через 6 ч при комнатной температуре смесь упаривали насухо и неочищенный продукт очищали с помощью препаративной ВЭЖХ, получая 40 мг A1.- 20015254 Следующие соединения получали аналогично. Следующие примеры относятся к лекарственным средствам. Пример A. Флаконы для инъекций pH раствора 100 г активного компонента формулы I и 5 гNa2HPO4 в 3 л бидистиллированной воды устанавливали на 6,5, используя 2 н. соляную кислоту, стерилизовали фильтрацией, переносили во флаконы для инъекций, лиофилизировали в стерильных условиях и запечатывали в стерильных условиях. Каждый флакон для инъекций содержит 5 мг активного компонента. Пример Б. Суппозитории. Смесь 20 г активного компонента формулы I расплавляли с 100 г соевого лецитина и 1400 г какаового масла, разливали в пресс-формы и охлаждали. Каждый суппозиторий содержит 20 мг активного компонента. Пример В. Раствор. Раствор приготавливали с 1 г активного компонента формулы I, 9,38 г NaH2PO42H2O, 28,48 гNa2HPO412H2O и 0,1 г бензалконийхлорида в 940 мл бидистиллированной воды. pH раствора устанавливали на 6,8 и объем раствора доводили до 1 л и стерилизовали путем облучения. Этот раствор может использоваться в форме глазных капель. Пример Г. Мазь. 500 мг активного компонента формулы I смешивали с 99,5 г вазелина в асептических условиях. Пример Д. Таблетки. Смесь 1 кг активного компонента формулы I, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг- 23015254 талька и 0,1 кг стеарата магния спрессовывали для получения таблеток обычным способом таким образом, чтобы каждая таблетка содержала 10 мг активного компонента. Пример Е. Драже. Таблетки спрессовывали аналогично примеру Д и затем покрывали обычным способом покрытием из сахарозы, картофельного крахмала, талька, трагаканта и красителя. Пример Ж. Капсулы. 2 кг активного компонента формулы I помещали в твердые желатиновые капсулы обычным способом таким образом, чтобы каждая капсула содержала 20 мг активного компонента. Пример З. Ампулы. Раствор 1 кг активного компонента формулы I в 60 л бидистиллированной воды стерилизовали фильтрацией, переносили в ампулы, лиофилизировали в стерильных условиях и запечатывали в стерильных условиях. Каждая ампула содержит 10 мг активного компонента. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения, выбранные из группы, включающей и их фармацевтически пригодные сольваты, соли, таутомеры и стереоизомеры, включая их смеси во всех соотношениях. 2. Лекарственные средства, содержащие по меньшей мере одно соединение по п.1 и/или его фармацевтически пригодные соли, сольваты, таутомеры и стереоизомеры, включая их смеси во всех соотношениях, и необязательно наполнители и/или вспомогательные вещества. 3. Применение соединений, выбранных из группы, включающей и их фармацевтически пригодных солей, сольватов, таутомеров и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения и/или борьбы с раком, ростом опухоли, ростом метастаз, фиброза, рестеноза, ВИЧ инфекции, болезни Альцгеймера, атеросклероза и/или для стимуляции заживления ран. 4. Применение по п.3, где опухоль выбрана из группы, включающей опухоли плоского эпителия,мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, головного мозга, предстательной железы, мочеполового тракта, лимфатической системы,желудка, гортани, легкого, аденокарциному легкого, мелкоклеточный рак легкого, рак поджелудочной железы, глиобластому, рак толстой кишки, рак молочной железы, опухоль крови и иммунной системы,острый миелоидный лейкоз, хронический миелоидный лейкоз, острый лимфолейкоз, хронический лимфолейкоз. 5. Применение соединений по п.3 и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения солидных опухолей, где терапевтически эффективное количество соединения по п.3 вводят в комбинации с соединением, выбранным из группы 1) модулятора эстрогенового рецептора, 2) модулятора андрогенового рецептора, 3) модулятора ретиноидного рецептора, 4) цитотоксического агента, 5) антипролиферативного агента, 6) ингибитора пренилпротеинтрансферазы, 7) ингибитора HMG-CoA редуктазы, 8) ингибитора ВИЧ протеазы, 9) ингибитора обратной транскриптазы и 10) другого ингибитора ангиогенеза. 6. Применение соединений по п.3 и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения солидных опухолей, где терапевтически эффективное количество соединения по п.3 вводят в комбинации с лучевой терапией и соединением из группы 1) модулятора эстрогенового рецептора, 2) модулятора андрогенового рецептора, 3) модулятора ретиноидного рецептора, 4) цитотоксического агента, 5) антипролиферативного агента, 6) ингибитора пренилпротеинтрансферазы, 7) ингибитора HMG-CoA редуктазы, 8) ингибитора ВИЧ протеазы, 9) ингибитора обратной транскриптазы и 10) другого ингибитора ангиогенеза. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61K 31/55, A61P 35/00, C07D 487/04, A61K 31/38, C07D 513/04
Метки: триазола, производные
Код ссылки
<a href="https://eas.patents.su/30-15254-proizvodnye-triazola.html" rel="bookmark" title="База патентов Евразийского Союза">Производные триазола</a>
Предыдущий патент: Производные 3,6-дигидро-2-оксо-6н-1,3,4-тиадиазина
Следующий патент: Способ получения стабильного экстракта из грецких орехов, экстракт, полученный данным способом, и его применение
Случайный патент: Сервопривод для арматуры












