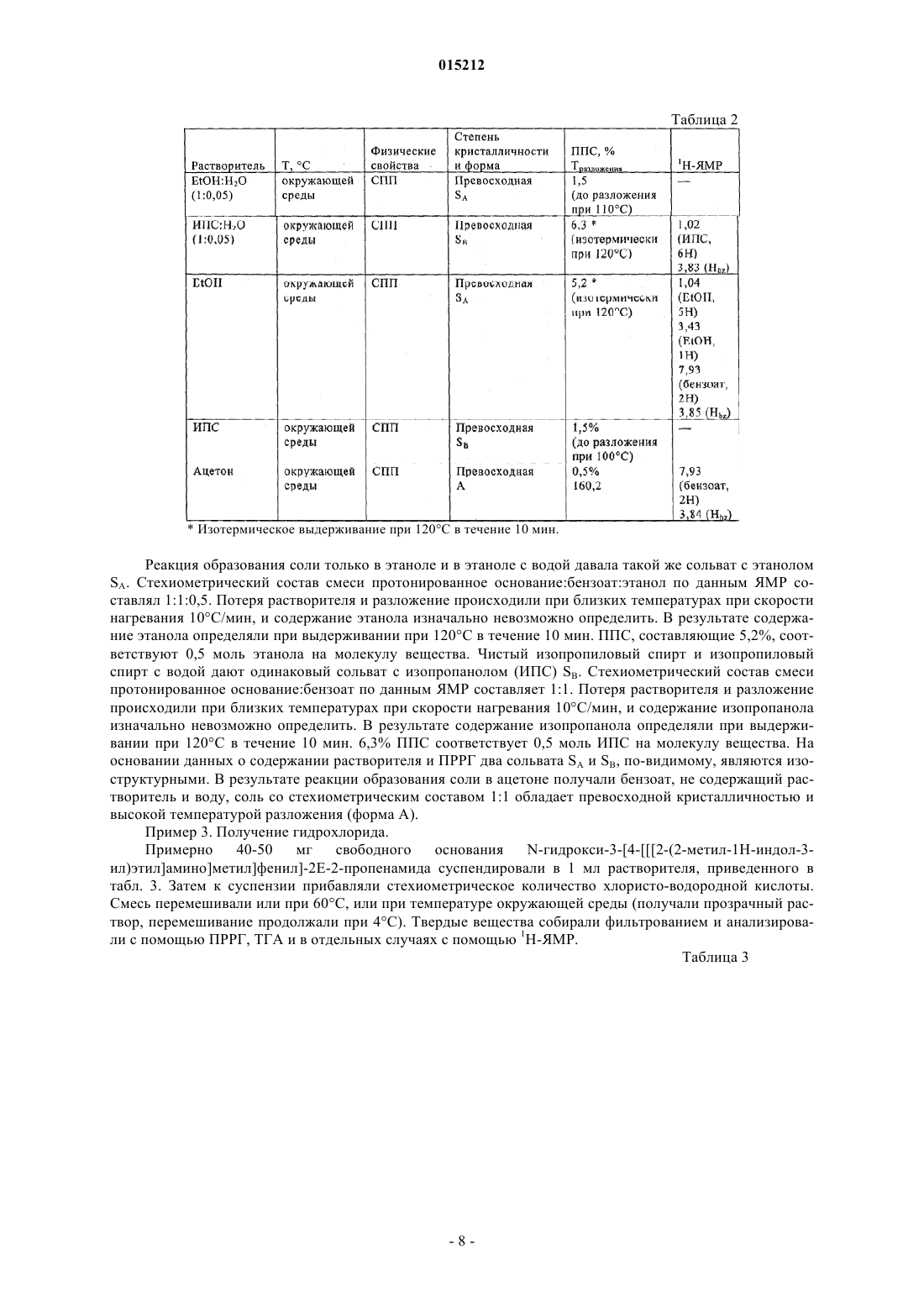
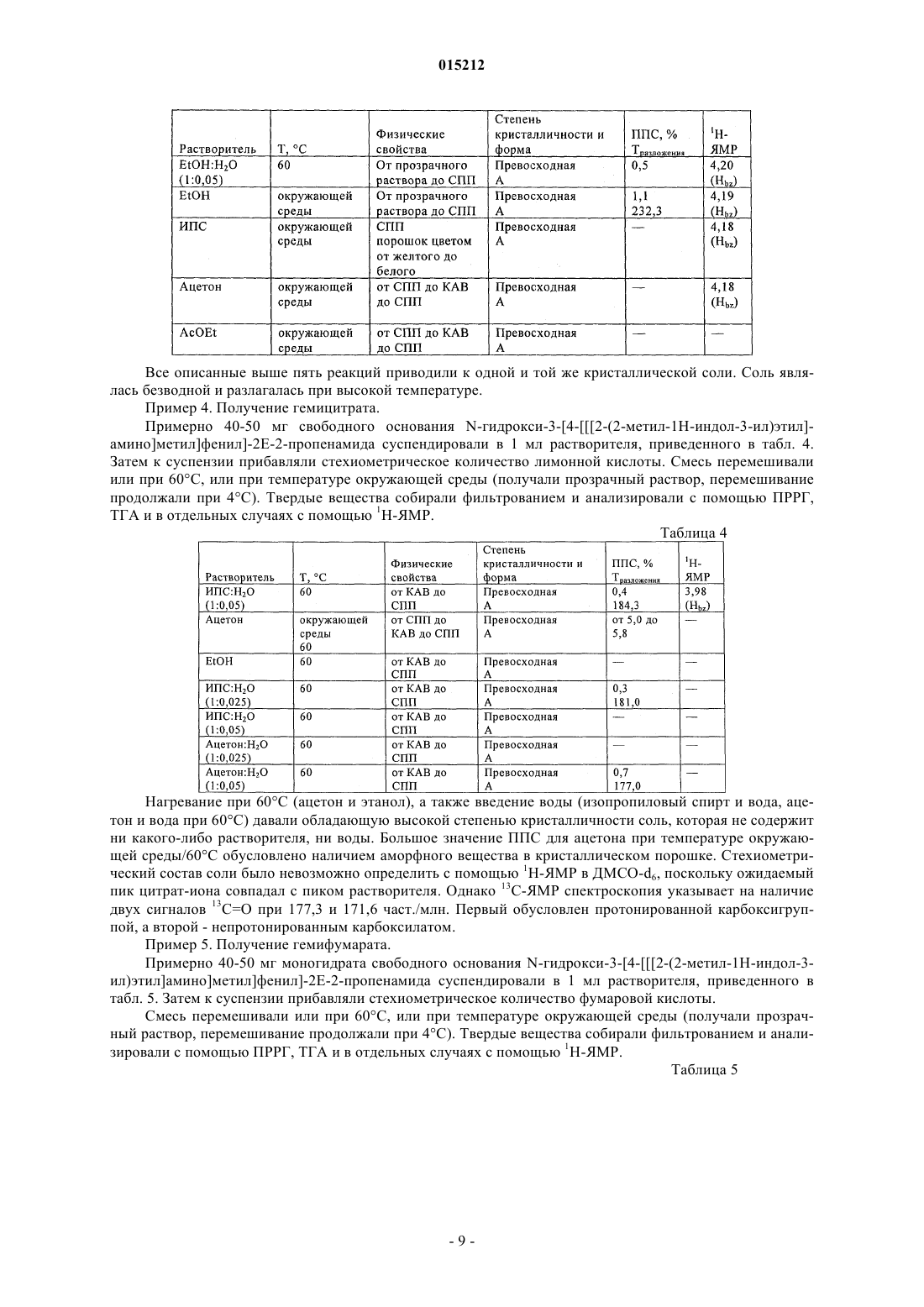
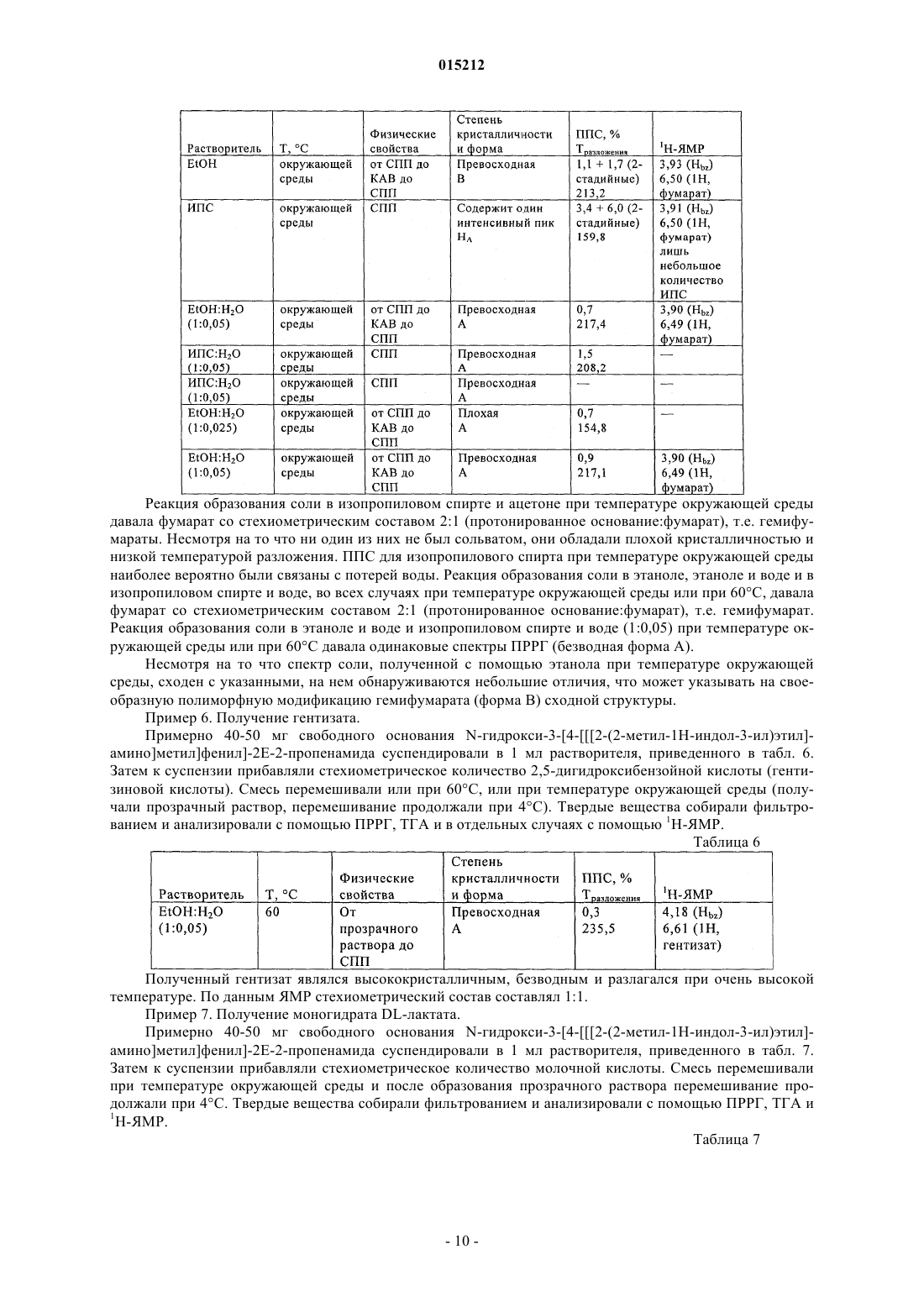
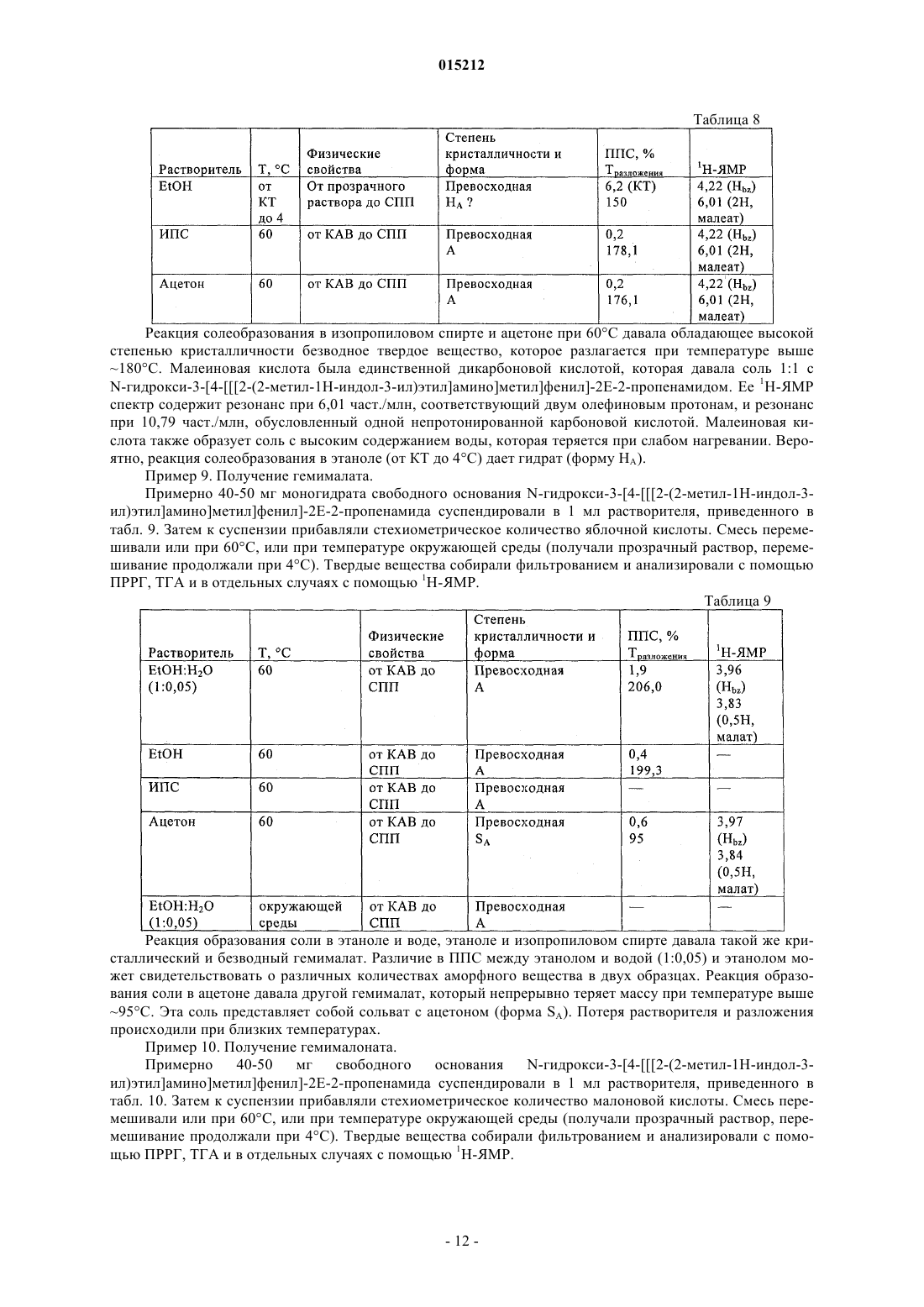
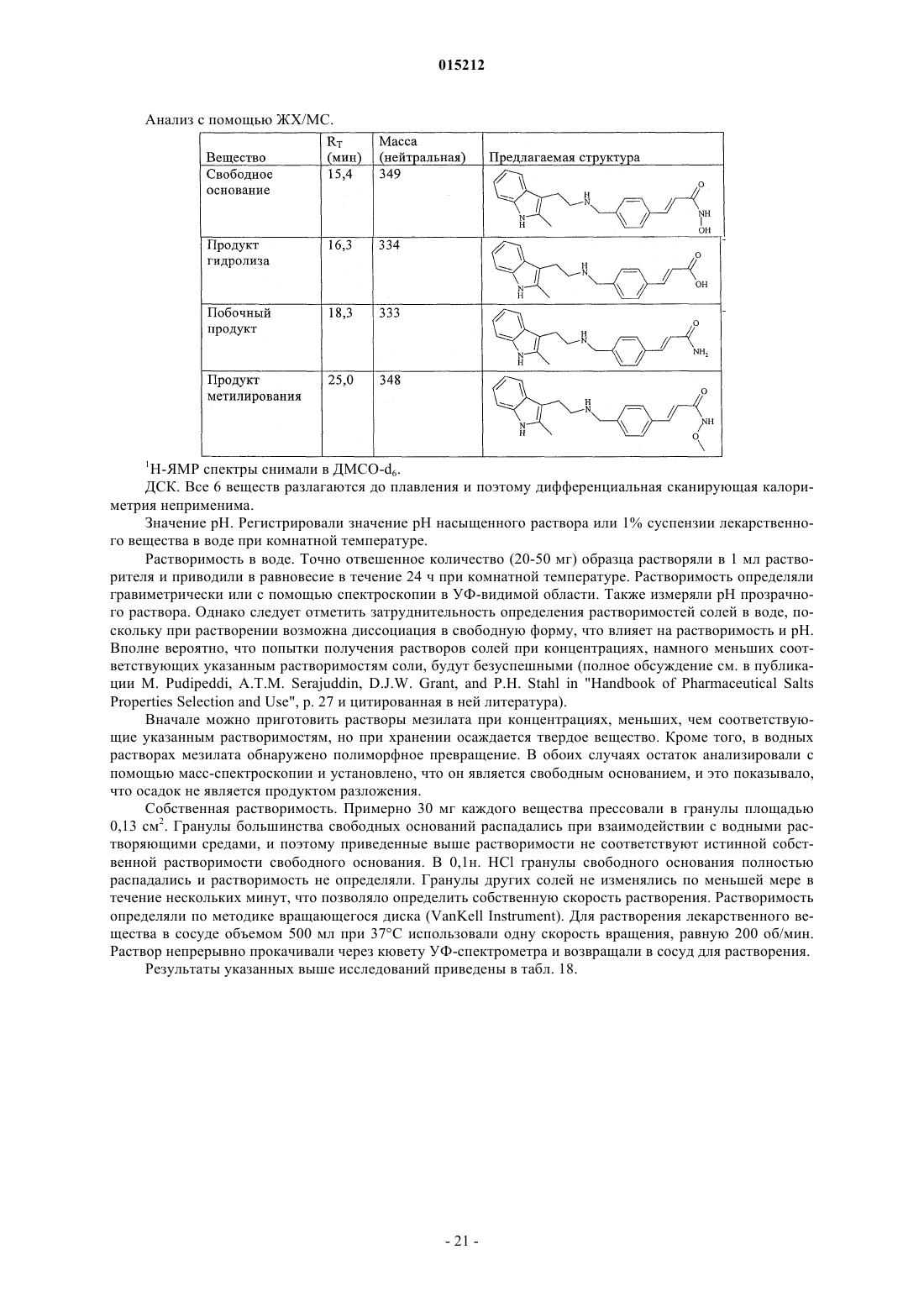
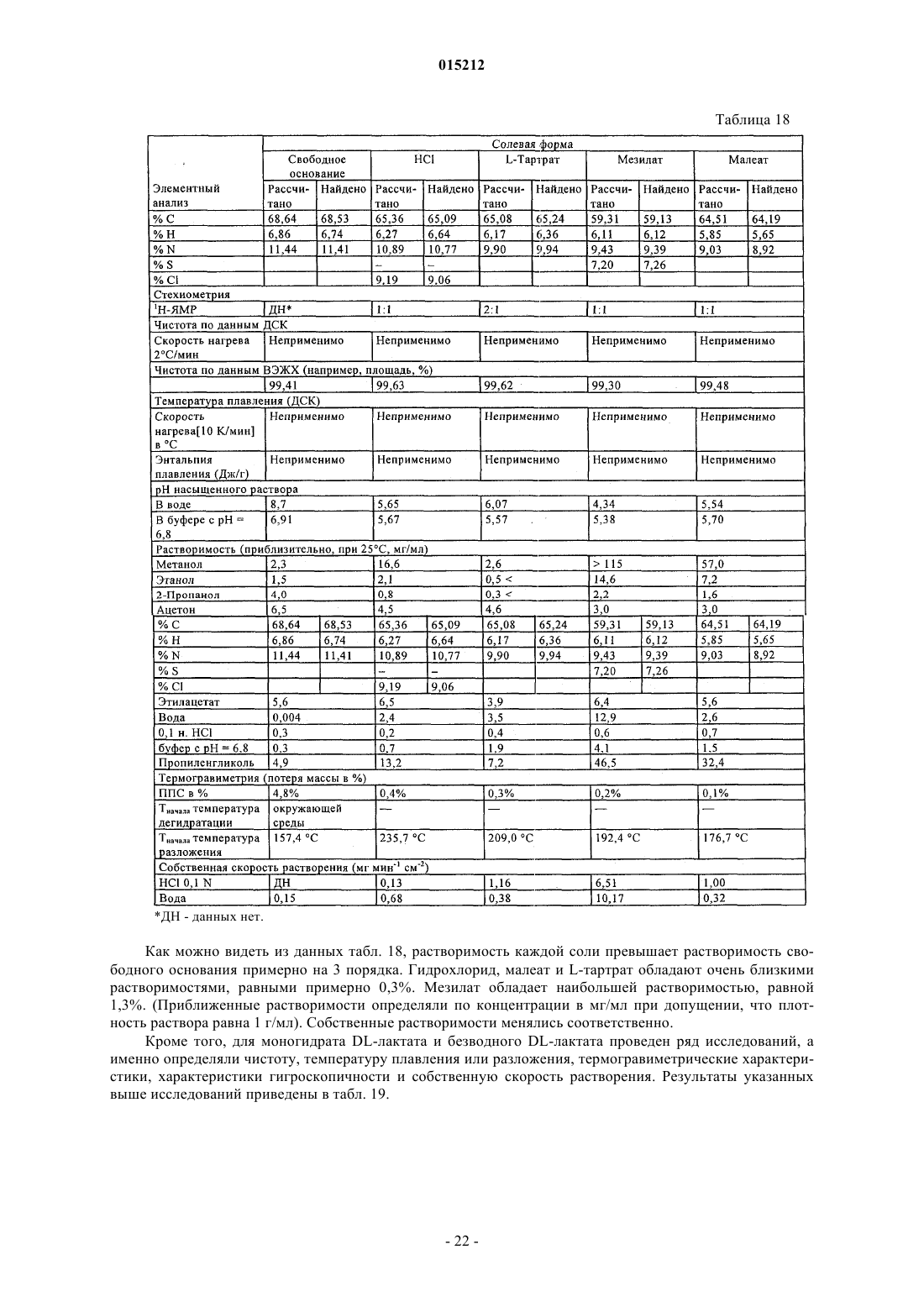
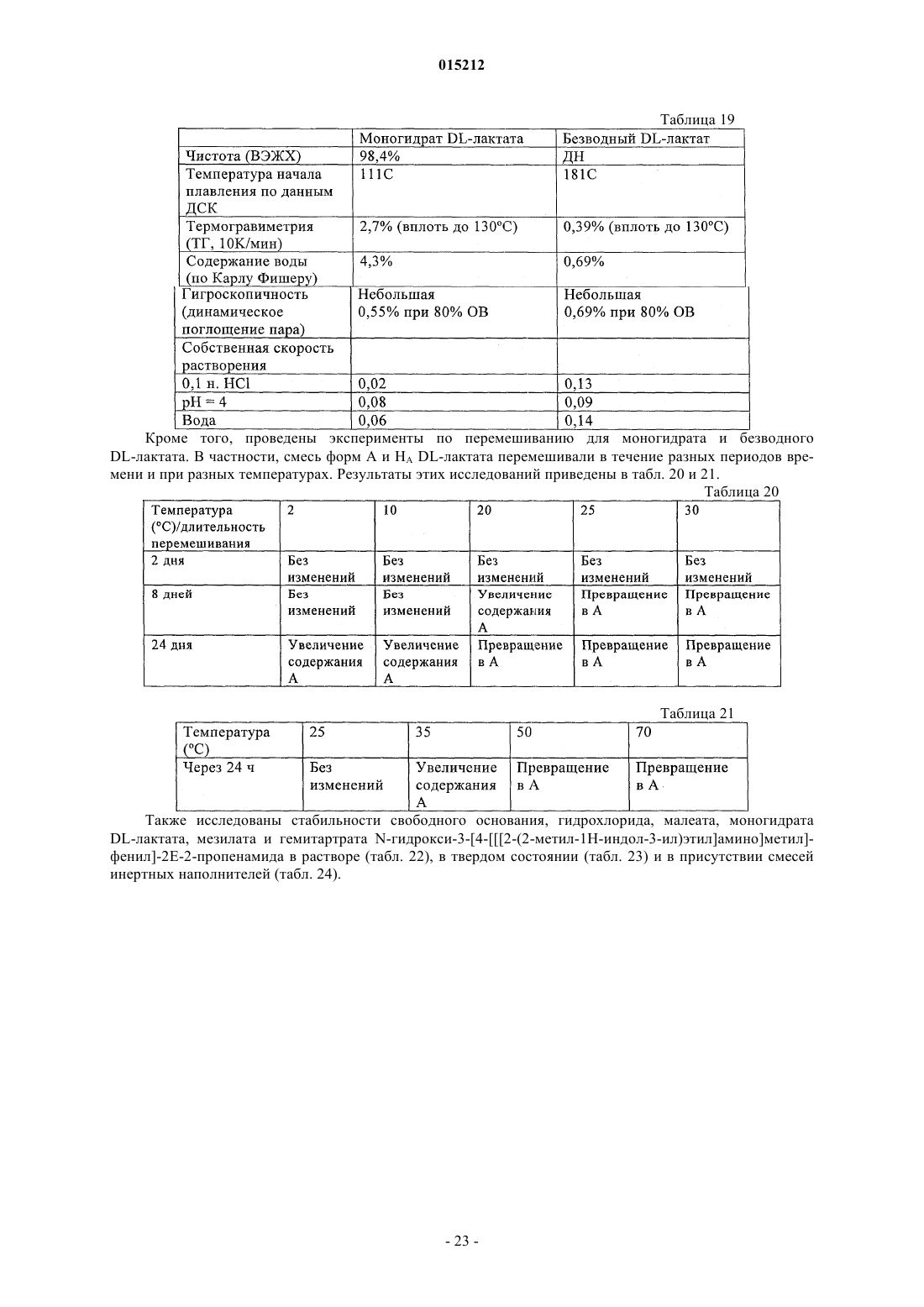
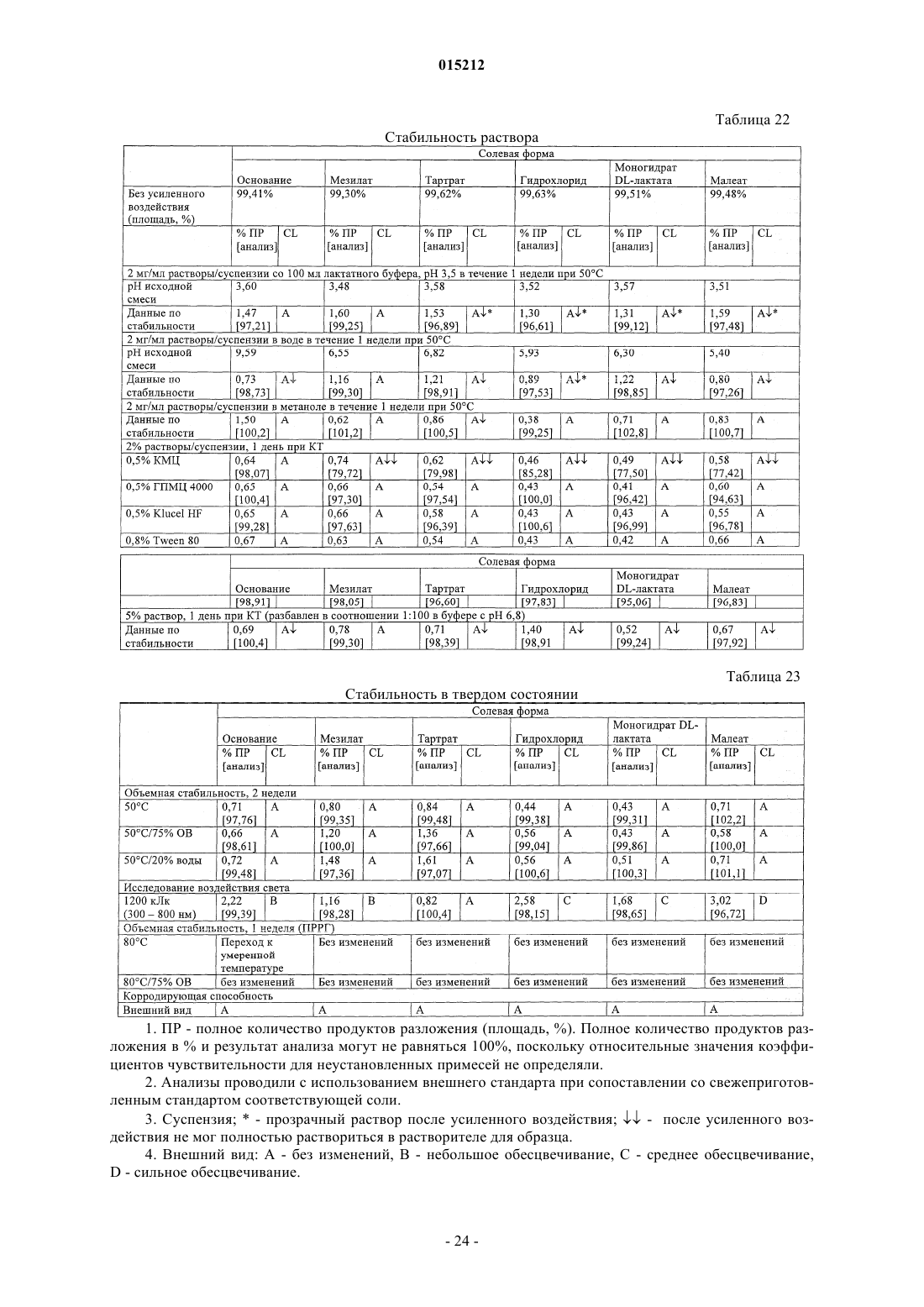
Соли n-гидрокси-3-[4-[[[2-(2-метил-1н-индол-3-ил)этил]амино]метил]фенил]-2е-2-пропенамида
Номер патента: 15212
Опубликовано: 30.06.2011
Авторы: Байва Джоджиндер С., Папоутсакис Димитрис, Ацемоглы Мурат, Штовассер Франк, Карпински Пьотр, Слейд Джоел
Формула / Реферат
1. Соль N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида, выбранная из гидрохлорида, лактата, малеата, мезилата, тартрата, ацетата, бензоата, цитрата, фумарата, гентизата, малата, малоната, оксалата, фосфата, пропионата, сульфата, сукцината, а также натриевой, калиевой, кальциевой и цинковой солей.
2. Соль по п.1, представляющая собой гидрохлорид N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
3. Соль по п.2, представляющая собой гидрохлорид состава 1:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
4. Соль по п.1, представляющая собой лактат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
5. Соль по п.4, представляющая собой лактат состава 1:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
6. Соль по п.4, представляющая собой моногидрат лактата.
7. Соль по п.4, представляющая собой безводный лактат.
8. Соль по п.4, представляющая собой DL-лактат.
9. Соль по п.8, представляющая собой моногидрат DL-лактата N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
10. Соль по п.8, представляющая собой безводный DL-лактат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
11. Соль по п.4, представляющая собой L-лактат.
12. Соль по п.11, представляющая собой безводный L-(+)-лактат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
13. Соль по п.4, представляющая собой D-лактат.
14. Соль по п.13, представляющая собой безводный D-(-)-лактат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
15. Соль по п.1, представляющая собой малеат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
16. Соль по п.15, представляющая собой малеат состава 1:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
17. Соль по п.1, представляющая собой мезилат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
18. Соль по п.17, представляющая собой мезилат состава 1:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
19. Соль по п.1, представляющая собой тартрат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
20. Соль по п.19, представляющая собой гемитартрат состава 2:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
21. Соль по п.1, представляющая собой ацетат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
22. Соль по п.21, представляющая собой ацетат состава 1:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
23. Соль по п.1, представляющая собой бензоат N-гидрокси-3-[4-[[[2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
24. Соль по п.23, представляющая собой бензоат состава 1:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
25. Соль по п.1, представляющая собой цитрат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
26. Соль по п.25, представляющая собой гемицитрат состава 2:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
27. Соль по п.1, представляющая собой фумарат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
28. Соль по п.27, представляющая собой гемифумарат состава 2:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
29. Соль по п.1, представляющая собой гентизат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
30. Соль по п.29, представляющая собой гентизат состава 1:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
31. Соль по п.1, представляющая собой малат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
32. Соль по п.31, представляющая собой гемималат состава 2:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
33. Соль по п.1, представляющая собой малонат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
34. Соль по п.33, представляющая собой гемималонат состава 2:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
35. Соль по п.1, представляющая собой оксалат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
36. Соль по п.1, представляющая собой фосфат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
37. Соль по п.36, представляющая собой фосфат состава 1:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
38. Соль по п.1, представляющая собой пропионат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
39. Соль по п.38, представляющая собой пропионат состава 1:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
40. Соль по п.1, представляющая собой сульфат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
41. Соль по п.40, представляющая собой сульфат состава 1:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
42. Соль по п.1, представляющая собой сукцинат N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
43. Соль по п.42, представляющая собой гемисукцинат состава 2:1 N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
44. Соль по п.1, представляющая собой натриевую соль N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
45. Соль по п.1, представляющая собой калиевую соль N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
46. Соль по п.1, представляющая собой кальциевую соль N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
47. Соль по п.1, представляющая собой цинковую соль N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамида.
48. Фармацевтическая композиция, включающая:
(a) терапевтически эффективное количество соли по любому из пп.1-47 и
(b) по меньшей мере один фармацевтически приемлемый носитель, разбавитель, растворитель или инертный наполнитель.
49. Способ лечения заболевания, которое реагирует на ингибирование активности гистондеацетилазы, включающий стадию введения субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соли по любому из пп.1-47.
Текст
015212 Предпосылки создания изобретения Область техники, к которой относится изобретение Настоящее изобретение относится к солям N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, а также к содержащим их фармацевтическим композициям и к способам лечения с их применением. Уровень техники Соединение N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамид (альтернативно, N-гидрокси-3-(4-[2-(2-метил-1 Н-индол-3-ил)этиламино]метилфенил)акриламид) имеет формулу (I) рассмотренную в WO 02/22577. Этому соединению приписаны ценные фармакологические характеристики; в частности, его можно использовать, например, в качестве ингибитора гистондезацетилазы, применимого для лечения заболеваний, которые реагируют на ингибирование активности гистондезацетилазы. В WO 02/22577 не описаны ни конкретные соли, ни гидраты солей, ни сольваты N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Краткое изложение сущности изобретения Настоящее изобретение относится к солям N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Предпочтительными вариантами осуществления настоящего изобретения являются гидрохлорид, лактат, малеат, мезилат, тартрат, ацетат, бензоат, цитрат, фумарат,гентизат, малат, малонат, оксалат, фосфат, пропионат, сульфат, сукцинат натрия, калия, кальция и цинкаN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Настоящее изобретение также относится к фармацевтическим композициям, включающим:(а) терапевтически эффективное количество предлагаемой в настоящем изобретении соли(b) по меньшей мере один фармацевтически приемлемый носитель, разбавитель, растворитель или инертный наполнитель. Настоящее изобретение также относится к способу лечения заболевания, которое реагирует на ингибирование активности гистондезацетилазы, включающему стадию введения субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества предлагаемой в настоящем изобретении солиN-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Краткое описание чертежей На фиг. 1 приведены порошковые рентгенограммы (ПРРГ) форм A, B, C, HA и HB свободного основанияN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. На фиг. 2 приведена порошковая рентгенограмма гидрохлорида N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. На фиг. 3 А-3 С приведены порошковые рентгенограммы форм A, HA и SA соответственноDL-лактата N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. На фиг. 3D и 3 Е приведены порошковые рентгенограммы безводных L-лактата и D-лактата соответственно N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. На фиг. 4 приведены порошковые рентгенограммы форм A и HA малеата N-гидрокси-3-[4-2-(2 метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. На фиг. 5 приведены порошковые рентгенограммы форм А, В и С гемитартрата N-гидрокси-3-[42-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. На фиг. 6 приведены порошковые рентгенограммы форм А и В мезилата (метансульфоната)N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. На фиг. 7 приведены порошковые рентгенограммы форм А и SA ацетата N-гидрокси-3-[4-2-(2 метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. На фиг. 8 приведены порошковые рентгенограммы форм A, SA и SB бензоата N-гидрокси-3-[4-2(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предлагаемого в настоящем изобретении. На фиг. 9 приведены порошковые рентгенограммы цитрата N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предлагаемого в настоящем изобретении. На фиг. 10 приведены порошковые рентгенограммы форм А, В и HA гемифумарата N-гидрокси-3[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида.-1 015212 На фиг. 11 приведены порошковые рентгенограммы гентизата N-гидрокси-3-[4-2-(2-метил-1Hиндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предлагаемого в настоящем изобретении. На фиг. 12 приведены порошковые рентгенограммы форм А и SA гемималата N-гидрокси-3-[4-2(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предлагаемого в настоящем изобретении. На фиг. 13 приведены порошковые рентгенограммы малоната N-гидрокси-3-[4-2-(2-метил-1Hиндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предлагаемого в настоящем изобретении. На фиг. 14 приведены порошковые рентгенограммы оксалата N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предлагаемого в настоящем изобретении. На фиг. 15 приведены порошковые рентгенограммы форм A, SA, SB и HA фосфатаN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. На фиг. 16 приведены порошковые рентгенограммы форм А и SA пропионатаN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. На фиг. 17 приведены порошковые рентгенограммы форм А и SA сульфатаN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. На фиг. 18 приведены порошковые рентгенограммы форм А, В, SA и HA гемисукцинатаN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Подробное описание изобретения При использовании в настоящем изобретении термин "соль" означает соединение, полученное по реакции лекарственного вещества, являющегося органической кислотой или основанием, с фармацевтически приемлемым неорганическим или органическим основанием или кислотой соответственно; при использовании в настоящем изобретении "соль" включает гидраты и сольваты солей, полученных в контексте настоящего изобретения. Типичные фармацевтически приемлемые неорганические или органические кислоты или основания перечислены в табл. 1-8 публикации Handbook of Pharmaceutical Salts,P.H. Stahl и C.G. Wermuth (eds.), VHCA, Zurich 2002, p. 334-345. При использовании в настоящем изобретении термин "полиморфная" означает определенную "кристаллическую модификацию" или "полиморфную форму" или "кристаллическую форму", которая отличается от других по характеристикам порошковой рентгенограммы, физико-химическим и/или фармакокинетическим характеристикам и термодинамической стабильности. Первый вариант осуществления настоящего изобретения относится к солям N-гидрокси-3-[4-2-(2 метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. В предпочтительных вариантах осуществления соль выбрана из группы, включающей гидрохлорид, лактат, малеат, мезилат (метансульфонат), тартрат, ацетат, бензоат, цитрат, фумарат, гентизат, малат, малонат, оксалат, фосфат, пропионат,сульфат, сукцинат натрия, калия, кальция и цинка N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Особенно предпочтительные варианты осуществления настоящего изобретения включают гидрохлорид, лактат (DL-лактат, L-лактат, D-лактат; безводные, гидратированные и сольватированные формы), малеат, мезилат и гемитартрат N-гидрокси-3-[4-2-(2 метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Соответственно, настоящее изобретение относится к гидрохлориду N-гидрокси-3-[4-2-(2-метил 1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к гидрохлориду состава 1:1 N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Гидрохлорид обладает хорошей растворимостью в воде, равной 2,4 мг/мл, и высокой собственной скоростью растворения. Он также обладает хорошей растворимостью в метаноле и заметной растворимостью в других обычных органических растворителях. Он образует одну, обладающую превосходной кристалличностью, безводную/несольватированную полиморфную форму, обладающую температурой разложения, равной примерно 235,7 С. Она является негигроскопичной (0,32%) и представляет собой преобладающую форму N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2 пропенамида в присутствии хлорид-иона в высокой концентрации. После установления равновесия при температуре окружающей среды другие полиморфные формы не обнаруживаются; гидрохлорид превращается в свободное основание в фосфатном буфере (рН 6,8). ПРРГ гидрохлорида N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2 пропенамида приведена на фиг. 2. Настоящее изобретение также относится к лактату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 1:1 лактату N-гидрокси-3-[4-2-(2 метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, моногидрату лактата N-гидрокси-3[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида или безводному лактатуN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. В одном предпочтительном варианте осуществления настоящего изобретения лактат представляет собой DL-лактат, более предпочтительно 1:1 моногидрат DL-лактата N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида или 1:1 безводный DL-лактат N-гидрокси-3-[42-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида.-2 015212 Полиморфные формы A, HA и SA DL-лактата можно видеть на ПРРГ, представленных на фиг. 3 А-3 С соответственно. DL-лактат обладает превосходной растворимостью в воде и высокой собственной скоростью растворения. Полиморфная форма А DL-лактата (безводный DL-лактат) плавится и разлагается примерно при 183-186 С и является немного гигроскопичной и обладает потерями при сушке(ППС), равными 0,2% до 120 С. Форма А является более стабильной в органических растворителях и в воде, чем другие формы DL-лактата. При большинстве условий форма А не превращается в какую-либо другую форму, хотя после установления равновесия при рН 1 и 2 образуется хлорид и при 0 и 10 С и в смеси ацетон/вода форма А наблюдалась наряду с формой HA DL-лактата. Форма HA DL-лактата (моногидрат DL-лактата) плавится и разлагается примерно при 120 С и является немного гигроскопичной и обладает ППС, равными 0,4% до 110 С, 3,0% до 130 С и 4,4% до 155 С (с разложением). При большинстве условий форма HA медленно превращается в форму А, хотя после установления равновесия при рН 1 и 2 образуется хлорид. После установления равновесия в метаноле форма HA DL-лактата превращается в форму SA, которая является монометанольным сольватом DL-лактата. Форма SA плавится и разлагается примерно при 123 С и обладает ППС, равными 5,9% до 140 С (с разложением). В другом предпочтительном варианте осуществления настоящего изобретения лактат представляет собойN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2 пропенамида; более предпочтительно, если лактат представляет собой безводный L-(+)-лактатN-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. ПРРГ для L-(+)-лактата N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е 2-пропенамида приведена на фиг. 3D. И плавление, и разложение происходят примерно при 184,7 С для безводной формы L-(+)-лактата N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]2 Е-2-пропенамида. В еще одном предпочтительном варианте осуществления настоящего изобретения лактат представляет собой D-(-)-лактат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида; более предпочтительно, если лактат представляет собой безводныйD-(-)-лактат N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. ПРРГ D-(-)-лактата N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2 пропенамида приведена на фиг. 3 Е. И плавление, и разложение происходят примерно при 184,1 С для безводной формы D-(-)-лактата N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]2 Е-2-пропенамида. Настоящее изобретение также относится к малеату N-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 1:1 малеату N-гидрокси-3-[4-2-(2 метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Малеиновая кислота является единственной дикарбоновой кислотой, как солеобразующим реагентом, которая образует соль состава 1:1 с N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамидом. Полиморфные формы А и HA малеата можно видеть на ПРРГ, приведенных на фиг. 4. Форма А малеата при нагревании разлагается без плавления примерно при 177 С. Ее ППС составляют менее 0,2% при 150 С, и она негигроскопична. Малеат обладает хорошей растворимостью в воде, равной 2,6 мг/мл, и высокой собственной скоростью растворения. Он обладает хорошей растворимостью в метаноле и этаноле и существенной растворимостью в других обычных органических растворителях. Форма HA малеата, гидрат формы А, при нагревании разлагается без плавления примерно при 150 С. ППС составляют примерно 6,0% при 100 С. Настоящее изобретение также относится к мезилату (или метансульфонату) N-гидрокси-3-[4-2(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 1:1 мезилатуN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Формы А и В мезилата можно видеть на ПРРГ, приведенных на фиг. 5. Форма А мезилата при нагревании разлагается без плавления примерно при 192 С. Ее ППС составляют менее 0,2% при 150 С, и форма А является весьма незначительно гигроскопичной (влажность менее 0,35% при 85% относительной влажности (ОВ. Мезилат обладает превосходной растворимостью в воде, равной 12,9 мг/мл, и высокой собственной скоростью растворения. Он обладает высокой растворимостью в метаноле и этаноле и существенной растворимостью в других органических растворителях. После установления равновесия форма А превращается в форму В в воде, в гидрохлорид в 0,1 н. HCl и в свободное основание в фосфатном буфере (рН 6,8). Форму В мезилата можно получить по реакции в этилацетате при температуре окружающей среды с последующим нагреванием дисперсии до 50 С или путем превращения формы А в воде. Мезилат выделяется по меньшей мере в четырех кристаллических модификациях, две из которых обладают высокой степенью кристалличности, незначительной гигроскопичностью (0,82%), представляют собой белые твердые вещества (включая формы А и В), а две остальные обладают желтой окраской и содержат превышающее стехиометрический избыток количество метансульфоновой кислоты, т.е. дополнительно менее 0,5 моль на 1 моль N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида; две последние формы являются сильно гигроскопичными, т.е. увеличение массы составляет не менее 40% при 93% ОВ.-3 015212 Настоящее изобретение также относится к тартрату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 2:1 тартрату (гемитартрату)N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида и более предпочтительно к 2:1 L-тартрату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]2 Е-2-пропенамида. Формы А, В и С гемитартрата можно видеть на ПРРГ, приведенных на фиг. 6. Форма А L-тартрата,безводный гемитартрат, при нагревании разлагается без плавления примерно при 209 С. ППС составляют менее 0,3% при 150 С, и форма А является незначительно гигроскопичной (влажность менее 0,5% при 85% ОВ). L-Тартрат обладает хорошей растворимостью в воде, равной 3,5 мг/мл, и высокой собственной скоростью растворения. Он обладает хорошей растворимостью в ацетоне, этилацетате и в других обычных органических растворителях и ограниченной растворимостью в спиртах. После установления равновесия форма А превращается в форму С в метаноле, в гидрохлорид в 0,1 н. HCl и в свободное основание в фосфатном буфере (рН 6,8). Форма В тартрата, а также безводный гемитартрат при нагревании разлагаются без плавления выше 160 С. ППС составляют менее 2,0% при 150 С, что указывает на ее гигроскопичный характер. Форму С тартрата получают путем установления равновесия формы А в ацетоне при температуре окружающей среды. Настоящее изобретение также относится к ацетату N-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 1:1 ацетату N-гидрокси-3-[4-2-(2 метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Формы А и SA ацетата можно видеть на ПРРГ, приведенных на фиг. 7. Форма А ацетата при нагревании быстро разлагается без плавления при температуре выше 60 С. Она обладает растворимостью в воде, равной примерно 2 мг/мл. Форма SA ацетата является сольватом с ацетоном и обладает ППС, равными 13,5% примерно при 140 С. Этот сольват стабилен при температуре ниже 90 С. Настоящее изобретение также относится к бензоату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 1:1 бензоату N-гидрокси-3-[4-2 метил-1H-индол-3-ил)этил]амино]метил]фенил-2 Е-2-пропенамида. Формы A, SA и SB бензоата можно видеть на ПРРГ, приведенных на фиг. 8. Форма А бензоата, выделенная после реакции в ацетоне, обладает превосходной степенью кристалличности и высокой температурой разложения, превышающей 160 С. Ее ППС составляют менее 0,6% при 140 С. Она обладает растворимостью в воде, равной примерно 0,7 мг/мл. Форма SA бензоата представляет собой сольват с этанолом, обладающий ППС, равными 5,2%, до разложения, которые происходят при температуре выше 110 С. Форма SB бензоата представляет собой сольват с 2-пропанолом, обладающий ППС, равными 6,3%, до разложения, которые происходят при температуре выше 100 С. Настоящее изобретение также относится к цитрату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 2:1 цитрату (гемицитрату)N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Цитрат можно видеть на ПРРГ, приведенной на фиг. 9. Гемицитрат обладает растворимостью в воде, равной примерно 1,2 мг/мл. Он образует одну кристаллическую безводную/несольватированную полиморфную форму, обладающую температурой разложения, равной примерно 180 С. Настоящее изобретение также относится к фумарату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно - 2:1 фумарату (гемифумарат)N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Формы А, В и HA гемифумарата можно видеть на ПРРГ, приведенных на фиг. 10. Форма А гемифумарата, выделенная после реакции в этаноле и воде (1:0,05), обладает превосходной степенью кристалличности и высокой температурой разложения, равной 217 С. Ее ППС составляют менее 0,7% при 200 С. Она обладает растворимостью в воде, равной примерно 0,4 мг/мл. Форма В гемифумарата, выделенная после реакции в этаноле, обладает хорошей степенью кристалличности и температурой разложения, превышающей 160 С. Она обладает двухступенчатыми ППС: около 1,1% вплоть до 150 С и затем 1,7% в диапазоне от 150 до 200 С. Форма HA гемифумарата, возможно, являющаяся гидратом, выделенная после реакции в 2-пропаноле, обладает превосходной степенью кристалличности и температурой разложения, превышающей 100 С. Она обладает двухступенчатыми ППС: около 3,5% вплоть до 75 С и затем 6% в диапазоне от 75 до 150 С. Настоящее изобретение также относится к генгизату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 1:1 гентизату N-гидрокси-3-[4-2(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Гентизат можно видеть на ПРРГ, приведенной на фиг. 11. Гентизат обладает растворимостью в воде, равной примерно 0,3 мг/мл. Он образует одну кристаллическую и безводную/несольватированную полиморфную форму. Настоящее изобретение также относится к малату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 2:1 малату (гемималату)-4 015212 Формы А и SA гемималата можно видеть на ПРРГ, приведенных на фиг. 12. Форма А гемималата,выделенная после реакции в этаноле и воде (1:0,05) или в неразбавленном этаноле и 2-пропаноле, обладает превосходной степенью кристалличности и высокой температурой разложения, равной 206 С. Она обладает равными 2% ППС вплоть до 175 С. Она обладает растворимостью в воде, равной примерно 1,4 мг/мл. Форма SA гемималата получена по реакции солеобразования в ацетоне. Она обладает превосходной степенью кристалличности, но постепенно разлагается, начиная примерно с 80 С. Ее ППС вплоть до 75 С составляют 0,6%. Настоящее изобретение также относится к малонату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 2:1 малонату (гемималонату)N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Малонат можно видеть на ПРРГ, приведенной на фиг. 13. Гемималонат обладает растворимостью в воде, равной примерно 2 мг/мл. Он образует одну кристаллическую и безводную/несольватированную полиморфную форму, обладающую температурой разложения, равной выше 170 С. Настоящее изобретение также относится к оксалату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Оксалат можно видеть на ПРРГ, приведенной на фиг. 14. Настоящее изобретение также относится к фосфату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 1:1 фосфату N-гидрокси-3-[4-2-(2 метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Формы A, SA, SB и HA фосфата можно видеть на ПРРГ, приведенных на фиг. 15. Форма А фосфата,выделенная после реакции в ацетоне, обладает превосходной степенью кристалличности и высокой температурой разложения, равной 187 С. Она обладает равными 1% ППС вплоть до 165 С. Она обладает растворимостью в воде, равной примерно 6 мг/мл. Форма SA фосфата, выделенная после реакции в этаноле, обладает хорошей степенью кристалличности и при нагревании постепенно теряет массу. Она обладает равными 6,6% ППС вплоть до 150 С. Форма SB фосфата, выделенная после реакции в 2-пропаноле, обладает превосходной степенью кристалличности и при нагревании постепенно теряет массу. Она обладает равными примерно 7% ППС вплоть до 150 С. Форма HA фосфата, гидрат, выделенный после реакции в этаноле и воде (1:0,05), обладает превосходной степенью кристалличности и высокой температурой разложения, равной примерно 180 С. Она обладает равными 7% ППС вплоть до 150 С. Настоящее изобретение также относится к пропионату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 1:1 пропионату N-гидрокси-3-[42-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Формы А и SA пропионата можно видеть на ПРРГ, приведенных на фиг. 16. Форма А пропионата,выделенная после реакции в ацетоне, обладает превосходной степенью кристалличности; ее температура разложения равна около 99 С. Она обладает равными примерно 7% ППС вплоть до 140 С. Она обладает растворимостью в воде, равной примерно 4 мг/мл. Форма SA пропионата, выделенная после реакции в 2-пропаноле, представляет собой сольват с 2-пропанолом, обладающий превосходной степенью кристалличности. При нагревании она постепенно теряет массу и ППС составляют примерно 15% вплоть до 140 С. Настоящее изобретение также относится к сульфату N-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 1:1 сульфату N-гидрокси-3-[4-2(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Формы А и SA сульфата можно видеть на ПРРГ, приведенных на фиг. 17. Форма А сульфата, выделенная после реакции в этилацетате в виде желтого гигроскопичного порошка, обладает плохой кристалличностью, высокой температурой разложения, равной около 160 С, и обладает равными примерно 7% ППС вплоть до 150 С. Она видимо гигроскопична при условиях окружающей среды. Форма SA сульфата,выделенная после реакции в 2-пропаноле, представляет собой сольват с 2-пропанолом, обладающий превосходной степенью кристалличности и высокой температурой разложения, равной около 162 С. Она обладает равными примерно 9-12% ППС вплоть до 150 С. Настоящее изобретение также относится к сукцинату N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, предпочтительно к 2:1 сукцинату (гемисукцинату)N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Формы А, В, HA и SA гемисукцината можно видеть на ПРРГ, приведенных на фиг. 18. Форма А гемисукцината, воспроизводимо выделяющаяся после реакции в этаноле и воде (1:0,05) или в неразбавленном этаноле, обладает превосходной степенью кристалличности и очень высокой температурой разложения, равной около 204 С. Она обладает равными примерно 1,1% ППС вплоть до 200 С. Она обладает растворимостью в воде, равной примерно 0,4 мг/мл. Форма В гемисукцината, выделенная после реакции в ацетоне или этилацетате, обладает хорошей степенью кристалличности и высокой температурой разложения, превышающей 150 С. Она обладает двухступенчатыми ППС: примерно 1,5% вплоть до 125 С и еще 1,3-2,9% вплоть до 150 С. Форма SA гемисукцината, выделенная после реакции в 2-пропаноле, представляет собой сольват с 2-пропанолом, обладающий хорошей степенью кристаллич-5 015212 ности и высокой температурой разложения, равной около 155 С. Она обладает двухступенчатыми ППС: примерно 3% вплоть до 70 С и еще 4,6% вплоть до 140 С. Форма HA моногидрат гемисукцината, выделенный после реакции в 2-пропаноле и воде (1:0,05), обладает превосходной степенью кристалличности и высокой температурой разложения, равной около 180 С. Она обладает равными примерно 4,6% ППС вплоть до 160 С, что соответствует моногидрату. Настоящее изобретение также относится к натриевой соли N-гидрокси-3-[4-2-(2-метил-1 Н-индол 3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Эта кристаллическая соль, выделяющаяся в виде желтого порошка, является явно гигроскопичной. Настоящее изобретение также относится к калиевой соли N-гидрокси-3-[4-2-(2-метил-1 Н-индол 3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Эта кристаллическая соль, выделяющаяся в виде желтого порошка, является явно гигроскопичной. Настоящее изобретение также относится к кальциевой соли N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Эту соль можно выделить в виде аморфного вещества, обладающего температурой стеклования, превышающей температуру окружающей среды. Хотя и представляющая собой аморфное вещество, эта соль менее гигроскопична, чем соли натрия или калия. Настоящее изобретение также относится к цинковой соли N-гидрокси-3-[4-2-(2-метил-1 Н-индол 3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Эту соль можно выделить в виде аморфного вещества, обладающего температурой стеклования, превышающей температуру окружающей среды. Хотя и представляющая собой аморфное вещество, эта соль менее гигроскопична, чем соли натрия или калия. Второй вариант осуществления настоящего изобретения относится к а фармацевтической композиции, включающей:(a) терапевтически эффективное количество соли N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида и(b) по меньшей мере один фармацевтически приемлемый носитель, разбавитель, растворитель или инертный наполнитель."Терапевтически эффективное количество" означает количество соли, предлагаемой в настоящем изобретении, которое при введении нуждающемуся в нем субъекту достаточно для лечения патологических состояний, протекание которых облегчается путем ингибирования активности гистондезацетилазы. Количество конкретного соединения, предлагаемого в настоящем изобретении, которое будет терапевтически эффективным, меняется в зависимости от таких факторов, как патологическое состояние и его тяжесть, индивидуальность нуждающегося в нем субъекта и т.п., и это количество без труда могут определить специалисты с общей подготовкой в данной области техники. По меньшей мере один фармацевтически приемлемый носитель, разбавитель, растворитель или инертный наполнитель может без труда определить специалист с общей подготовкой в данной области техники, и он будет зависеть от выбранного пути введения. Иллюстративные примеры подходящих путей введения включают пероральное, назальное, парентеральное, местное, чрескожное и ректальное. Фармацевтические композиции, предлагаемые в настоящем изобретении, могут находиться в любой фармацевтической форме, которую специалист в данной области техники считает подходящей. Подходящие фармацевтические формы включают твердые, полужидкие, жидкие и лиофилизированные препараты, такие как таблетки, порошки, капсулы, суппозитории, суспензии, липосомы и аэрозоли. Третий вариант осуществления настоящего изобретения относится к способу лечения заболевания,которое реагирует на ингибирование активности гистондезацетилазы, включающему стадию введения субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соли N-гидрокси-3[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. Как отмечено выше, иллюстративные примеры путей введения включают пероральное, назальное, парентеральное, местное,чрескожное и ректальное. Введение кристаллической формы можно выполнять путем введения фармацевтической композиции, предлагаемой в девятом варианте осуществления настоящего изобретения, или путем введения других эффективных средств. Ниже с помощью примеров будут описаны предпочтительные варианты осуществления настоящего изобретения. Следует понимать, что эти примеры приведены только для иллюстрации настоящего изобретения и их не следует рассматривать в качестве каким-либо образом ограничивающих объем настоящего изобретения. В приведенных ниже примерах при указании степени кристалличности "превосходная" указывает на материал, обладающий основными пиками на ПРРГ, которые являются узкими и обладают интенсивностями, превышающими примерно 70 импульсов; "хорошая" указывает на материал, обладающий основными пиками на ПРРГ, которые являются узкими и обладают интенсивностями в диапазоне 30-70 импульсов; и "плохая" указывает на материал, обладающий основными пиками на ПРРГ, которые являются широкими и обладают интенсивностями менее 30 импульсов. Кроме того, ППС означает потерю массы, определенную при температуре между температурой окружающей среды и температурой разложения. Последняя примерно означает точку начала роста на зависимости первой производной от температуры на термогравиметрической кривой. Это не является точным началом разложения, поскольку по-6 015212 теря массы для разных солей происходит с разной скоростью. Поэтому реальная температура разложения может быть ниже указанной. Образование соли, стехиометрический состав и наличие или отсутствие растворителей подтверждаются с помощью химических сдвигов 1 Н-ЯМР (ядерный магнитный резонанс) для соответствующих солеобразующих реагентов и растворителей, использованных в реакции (в таблицах приведен только один характеристический химический сдвиг для солеобразующих реагентов или растворителей). По данным ЯМР невозможно определить содержание воды, поскольку пики воды являются широкими. Степень протонирования свободного основания оценивают по изменению химического сдвига бензильных (Hbz) протонов. Кроме того, соли, предлагаемые в настоящем изобретении, осаждаются в виде сыпучих порошков (СПП), клейких аморфных веществ (КАВ) (которые обладают смолообразной консистенцией и склонны к агломерации с образованием единой сферической массы или прилипают к стенкам емкости, в которой проводят реакцию) или аморфных гелей (АГ). Кроме того, "-" указывает,что измерения не проводились. Пример 1. Получение ацетата. Примерно 40-50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 1. Затем к суспензии прибавляли стехиометрическое количество уксусной кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА (термогравиметрический анализ) и в отдельных случаях с помощью 1 Н-ЯМР. Таблица 1 Реакция образования соли в ацетоне давала высококристаллическую соль с отношениемN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида к ацетату 1:1,определенную как стехиометрический сольват с ацетоном SA. Реакция образования соли в изопропиловом спирте и этилацетате при 60 С давала такой же кристаллический несольватированный ацетат (форма А). Происходящая при этом потеря массы при температуре выше 105 С происходит или из-за потери воды (если соль является гидратом), или из-за потери уксусной кислоты, или из-за потери и воды и уксусной кислоты. Пример 2. Получение бензоата. Примерно 40-50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 2. Затем к суспензии прибавляли стехиометрическое количество бензойной кислоты. Смесь перемешивали при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Изотермическое выдерживание при 120 С в течение 10 мин. Реакция образования соли только в этаноле и в этаноле с водой давала такой же сольват с этаноломSA. Стехиометрический состав смеси протонированное основание:бензоат:этанол по данным ЯМР составлял 1:1:0,5. Потеря растворителя и разложение происходили при близких температурах при скорости нагревания 10 С/мин, и содержание этанола изначально невозможно определить. В результате содержание этанола определяли при выдерживании при 120 С в течение 10 мин. ППС, составляющие 5,2%, соответствуют 0,5 моль этанола на молекулу вещества. Чистый изопропиловый спирт и изопропиловый спирт с водой дают одинаковый сольват с изопропанолом (ИПС) SB. Стехиометрический состав смеси протонированное основание:бензоат по данным ЯМР составляет 1:1. Потеря растворителя и разложение происходили при близких температурах при скорости нагревания 10 С/мин, и содержание изопропанола изначально невозможно определить. В результате содержание изопропанола определяли при выдерживании при 120 С в течение 10 мин. 6,3% ППС соответствует 0,5 моль ИПС на молекулу вещества. На основании данных о содержании растворителя и ПРРГ два сольвата SA и SB, по-видимому, являются изоструктурными. В результате реакции образования соли в ацетоне получали бензоат, не содержащий растворитель и воду, соль со стехиометрическим составом 1:1 обладает превосходной кристалличностью и высокой температурой разложения (форма А). Пример 3. Получение гидрохлорида. Примерно 40-50 мг свободного основанияN-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 3. Затем к суспензии прибавляли стехиометрическое количество хлористо-водородной кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Таблица 3 Все описанные выше пять реакций приводили к одной и той же кристаллической соли. Соль являлась безводной и разлагалась при высокой температуре. Пример 4. Получение гемицитрата. Примерно 40-50 мг свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 4. Затем к суспензии прибавляли стехиометрическое количество лимонной кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ,ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Таблица 4 Нагревание при 60 С (ацетон и этанол), а также введение воды (изопропиловый спирт и вода, ацетон и вода при 60 С) давали обладающую высокой степенью кристалличности соль, которая не содержит ни какого-либо растворителя, ни воды. Большое значение ППС для ацетона при температуре окружающей среды/60 С обусловлено наличием аморфного вещества в кристаллическом порошке. Стехиометрический состав соли было невозможно определить с помощью 1 Н-ЯМР в ДМСО-d6, поскольку ожидаемый пик цитрат-иона совпадал с пиком растворителя. Однако 13 С-ЯМР спектроскопия указывает на наличие двух сигналов 13 С=О при 177,3 и 171,6 част./млн. Первый обусловлен протонированной карбоксигруппой, а второй - непротонированным карбоксилатом. Пример 5. Получение гемифумарата. Примерно 40-50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 5. Затем к суспензии прибавляли стехиометрическое количество фумаровой кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Таблица 5 Реакция образования соли в изопропиловом спирте и ацетоне при температуре окружающей среды давала фумарат со стехиометрическим составом 2:1 (протонированное основание:фумарат), т.е. гемифумараты. Несмотря на то что ни один из них не был сольватом, они обладали плохой кристалличностью и низкой температурой разложения. ППС для изопропилового спирта при температуре окружающей среды наиболее вероятно были связаны с потерей воды. Реакция образования соли в этаноле, этаноле и воде и в изопропиловом спирте и воде, во всех случаях при температуре окружающей среды или при 60 С, давала фумарат со стехиометрическим составом 2:1 (протонированное основание:фумарат), т.е. гемифумарат. Реакция образования соли в этаноле и воде и изопропиловом спирте и воде (1:0,05) при температуре окружающей среды или при 60 С давала одинаковые спектры ПРРГ (безводная форма А). Несмотря на то что спектр соли, полученной с помощью этанола при температуре окружающей среды, сходен с указанными, на нем обнаруживаются небольшие отличия, что может указывать на своеобразную полиморфную модификацию гемифумарата (форма В) сходной структуры. Пример 6. Получение гентизата. Примерно 40-50 мг свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 6. Затем к суспензии прибавляли стехиометрическое количество 2,5-дигидроксибензойной кислоты (гентизиновой кислоты). Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Таблица 6 Полученный гентизат являлся высококристалличным, безводным и разлагался при очень высокой температуре. По данным ЯМР стехиометрический состав составлял 1:1. Пример 7. Получение моногидрата DL-лактата. Примерно 40-50 мг свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 7. Затем к суспензии прибавляли стехиометрическое количество молочной кислоты. Смесь перемешивали при температуре окружающей среды и после образования прозрачного раствора перемешивание продолжали при 4 С. Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и 1 Н-ЯМР. Таблица 7(1:1) DL-лактат, моногидрат. Соль является кристаллической, начинает дегидратироваться при температуре выше 77 С и разлагается при температуре выше 150 С. Пример 8. Получение малеата. Примерно 40-50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 8. Затем к суспензии прибавляли стехиометрическое количество малеиновой кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Реакция солеобразования в изопропиловом спирте и ацетоне при 60 С давала обладающее высокой степенью кристалличности безводное твердое вещество, которое разлагается при температуре выше 180 С. Малеиновая кислота была единственной дикарбоновой кислотой, которая давала соль 1:1 сN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамидом. Ее 1 Н-ЯМР спектр содержит резонанс при 6,01 част./млн, соответствующий двум олефиновым протонам, и резонанс при 10,79 част./млн, обусловленный одной непротонированной карбоновой кислотой. Малеиновая кислота также образует соль с высоким содержанием воды, которая теряется при слабом нагревании. Вероятно, реакция солеобразования в этаноле (от КТ до 4 С) дает гидрат (форму HA). Пример 9. Получение гемималата. Примерно 40-50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 9. Затем к суспензии прибавляли стехиометрическое количество яблочной кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Таблица 9 Реакция образования соли в этаноле и воде, этаноле и изопропиловом спирте давала такой же кристаллический и безводный гемималат. Различие в ППС между этанолом и водой (1:0,05) и этанолом может свидетельствовать о различных количествах аморфного вещества в двух образцах. Реакция образования соли в ацетоне давала другой гемималат, который непрерывно теряет массу при температуре выше 95 С. Эта соль представляет собой сольват с ацетоном (форма SA). Потеря растворителя и разложения происходили при близких температурах. Пример 10. Получение гемималоната. Примерно 40-50 мг свободного основанияN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 10. Затем к суспензии прибавляли стехиометрическое количество малоновой кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Все реакции дают один и тот же гемималонат. Степень кристалличности обычно является хорошей,хотя пятно аморфного вещества не видно во всех спектрах ПРРГ. Ассоциация воды с этими веществами,вероятно, обусловлена увеличенным поглощением воды аморфным компонентом. Условия окружающей среды во время синтеза, видимо, приводят к получению соли лучшего качества. Пример 11. Получение мезилата. Примерно 40-50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 11. Затем к суспензии прибавляли стехиометрическое количество метансульфоновой кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Таблица 11 Реакция образования соли в этилацетате после перемешивания при комнатной температуре давала желтую соль. Соль (форма А) являлась кристаллической, характеризовалась 2-стадийной потерей массы и по данным ЯМР не содержала никакого растворителя, но, видимо, содержала более одной молекулы метансульфоната (мезилата). Реакция образования соли в ацетоне после нагревания при 60 С давала белый порошок. Порошок обладал превосходной степенью кристалличности, но мог представлять собой смесь более одной полиморфной формы (формы А и В). По данным ЯМР соль не содержала никакого растворителя, но, видимо, содержала более одной молекулы метансульфоната. Другая реакция образования соли в этилацетате, которую инициировали при температуре окружающей среды и затем полученную суспензию желтоватого порошка нагревали до 50 С, позволяла выделить новую форму В, представленную на фиг. 5. Пример 12. Получение оксалата. Примерно 40-50 мг свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 12. Затем к суспензии прибавляли стехиометрическое количество солеобразующего реагента - щавелевой кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Оксалаты, хотя и осаждающиеся сразу после прибавления щавелевой кислоты к суспензиямN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, было трудно выделить и при фильтровании они, видимо, поглощали воду. Пример 13. Получение фосфата. Примерно 40-50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 13. Затем к суспензии прибавляли стехиометрическое количество фосфорной кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Таблица 13 В результате реакции образования соли в этаноле и изопропиловом спирте получали гемисольваты с этанолом и изопропанолом (формы SA и SB соответственно). В этаноле и воде с помощью ЯМР были обнаружены только следы этанола, несмотря на большие ППС. Вещество являлось или гигроскопическим, или гидратом (форма HA), который терял воду при осторожном нагревании и в вакууме (потеря воды, измеренная с помощью ТГА, завершалась при 60 С при скорости нагрева 10 С/мин). Реакция образования соли в ацетоне и этилацетате давала аналогичный кристаллический и безводный фосфат(форма А). Стехиометрический состав, вероятнее всего, составлял 1:1. Соль обладала высокой температурой разложения. Пример 14. Получение пропионата. Примерно 40-50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 14. Затем к суспензии прибавляли стехиометрическое количество пропионовой кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор,перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Реакция образования соли в этаноле давала непрореагировавшее свободное основание (вероятнее всего, форма HB). Изопропиловый спирт давал сольват пропионата с ИПС (форма SA). По данным ЯМР содержание ИПС составляло 0,5. Соль характеризуется потерей массы, составляющей 15%, что соответствует потере ИПС и неидентифицированного компонента. Реакция образования соли в ацетоне и этилацетате давала одинаковую кристаллическую и несольватированную соль (форма А). Потеря массы,составляющая 6,3-7%, начинающаяся при 100 С, происходит из-за потери воды, пропионовой кислоты или разложения продукта. После завершения потери массы (140 С) соль разлагается. Следует отметить,что при растворении вещества в ДМСО (диметилсульфоксид) для анализа методом ЯМР были обнаружены свободная пропионовая кислота и только следы пропионата. Пример 15. Получение сульфата. Примерно 40-50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 15. Затем к суспензии прибавляли стехиометрическое количество серной кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1H-ЯМР. Таблица 15 Реакция образования соли в изопропиловом спирте давала белую кристаллическую соль. Эту соль определяли как сольват с изопропанолом (форма SA), содержащий 1,5 моль ИПС на молекулу вещества. В ДМСО 0,5 моль ИПС протонированы. Реакция образования соли в этилацетате давала желтый гигроскопический порошок (форма А). В процессе фильтрования образец заметно поглощал воду, и его плохая степень кристалличности объясняется этим эффектом. Пример 16. Получение гемисукцината. Примерно 40-50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 16. Затем к суспензии прибавляли стехиометрическое количество янтарной кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1H-ЯМР. Выделяли четыре явно различных гемисукцината: моногидрат (форма А) (этанол при температуре окружающей среды), гемисольват с изопропанолом (форма SA) (изопропиловый спирт) и две несольватированные формы А и В. Форма А обладала более высокой степенью кристалличности, минимальной потерей массы вплоть до 200 С и более высокой температурой разложения. Кроме того, ее можно синтезировать с хорошей воспроизводимостью, как показано синтезом в этаноле и этаноле и воде при 60 С. Пример 17. Получение геми-L-тартрата. Примерно 40-50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл растворителя, приведенного в табл. 17. Затем к суспензии прибавляли стехиометрическое количество винной кислоты. Смесь перемешивали или при 60 С, или при температуре окружающей среды (получали прозрачный раствор, перемешивание продолжали при 4 С). Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ, ТГА и в отдельных случаях с помощью 1 Н-ЯМР. Таблица 17 Реакция образования соли свободного основания с винной кислотой требовала нагревания до повышенных температур. Высококристаллическую безводную соль, разлагающуюся при температуре выше 200 С, выделяли в виде гемитартрата и обозначали как форму А. Форму В выделяли в изопропиловом спирте и воде при 60 С и, несмотря на структуру, очень сходную со структурой формы А, на ПРРГ были видны существенные различия.DL-молочную кислоту (4,0 г, 85% раствор в воде, что соответствует 3,4 г чистой DL-молочной кислоты) разбавляли водой (27,2 г) и раствор нагревали при 90 С (внутренняя температура) в течение 15 ч. Раствор охлаждали до комнатной температуры и использовали в качестве раствора молочной кислоты на следующей стадии получения соли. Свободное основание N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е 2-пропенамида формы HA (10,0 г) помещали в 4-горлую колбу для проведения реакции с механической мешалкой. Прибавляли деминерализованную воду (110,5 г) и суспензию нагревали при 65 С (внутренняя температура) в течение 30 мин. К этой суспензии в течение 30 мин при 65 С прибавляли раствор DLмолочной кислоты. Во время прибавления раствора DL-молочной кислоты суспензия превращалась в раствор. Капельную воронку промывали деминерализованной водой (9,1 г) и раствор перемешивали при 65 С еще в течение 30 мин. Раствор охлаждали до 45 С (внутренняя температура) и при этой температуре прибавляли затравочные кристаллы (10 мг моногидрата DL-лактата N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида DL-лактат моногидрат). Суспензию охлаждали до 33 С и перемешивали при этой температуре в течение еще 20 ч. Суспензию еще раз нагревали до 65 С, перемешивали в течение 1 ч при этой температуре и охлаждали до 33 С в течение 1 ч. После дополнительного перемешивания при 33 С в течение 3 ч продукт отделяли фильтрованием и отфильтрованный осадок промывали деминерализованной водой (220 г). Влажный отфильтрованный осадок сушили в вакууме при 50 С и получали безводный DL-лактат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида в виде кристаллического продукта. По данным ВЭЖХ и 1H-ЯМР продукт соответствовал моногидрату соли (форма HA). ПРРГ указывала на присутствие безводной формы. Дополнительные эксперименты по получению соли проводили по методике, описанной выше, раствор продукта фильтровали при 65 С, а затем охлаждали до 45 С, вносили затравку и кристаллизовали. Во всех случаях в качестве продукта получали форму А (безводная форма). Пример 19. Получение безводного DL-лактата.DL-молочную кислоту (2,0 г, 85% раствор в воде, что соответствует 1,7 г чистой DL-молочной кислоты) разбавляли водой (13,6 г) и раствор нагревали при 90 С (внутренняя температура) в течение 15 ч. Раствор охлаждали до комнатной температуры и использовали в качестве раствора молочной кислоты на последующей стадии получения соли. Свободное основание N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е 2-пропенамида формы HA (5,0 г) помещали в 4-горлую реакционную колбу с магнитной мешалкой. Прибавляли деминерализованную воду (54,85 г) и суспензию нагревали до 48 С (внутренняя температура) в течение 30 мин. К этой суспензии в течение 30 мин при 48 С прибавляли раствор DL-молочной кислоты. Прибавляли затравочные кристаллы (в виде суспензии 5 мг DL-лактата N-гидрокси-3-[4-2-(2-метил 1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида DL-лактат, безводная форма А, в 0,25 г воды) и перемешивание продолжали в течение еще 2 ч при 48 С. Температуру повышали до 65 С (внутренняя температура) в течение 30 мин и суспензию перемешивали в течение еще 2,5 ч при этой температуре. Затем температуру понижали до 48 С в течение 2 ч и продолжали перемешивание при этой температуре в течение еще 22 ч. Продукт отделяли фильтрованием и отфильтрованный осадок промывали деминерализованной водой (210 г). Влажный отфильтрованный осадок сушили в вакууме при 45-50 С и получали безводный DL-лактат N-гидрокси-3-[4-2-(2-метил 1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида DL-лактат (форма А) в виде кристаллического продукта. Плавление и разложение происходили одновременно при 183,3 С. Пример 20. Превращение моногидрата DL-лактата в безводный DL-лактат.DL-молочную кислоту (0,59 г, 85% раствор в воде, что соответствует 0,5 г чистой DL-молочной кислоты) разбавляли водой (4,1 г) и раствор нагревали при 90 С (внутренняя температура) в течение 15 ч. Раствор охлаждали до комнатной температуры и использовали в качестве раствора молочной кислоты на последующей стадии получения соли. 10 г моногидрата DL-лактата N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида помещали в 4-горлую реакционную колбу. Прибавляли воду (110,9 г), затем прибавляли раствор молочной кислоты. Капельную воронку, через которую прибавляли молочную кислоту, промывали водой (15,65 г). Суспензию нагревали до 82 С (внутренняя температура) и получали раствор. Раствор перемешивали в течение 15 мин при 82 С, в горячем виде фильтровали в другую колбу для проведения реакции и получали прозрачный раствор. Температуру понижали до 50 С и прибавляли затравочные кристаллы (в виде суспензии 10 мг DL-лактата N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, безводная форма, в 0,5 г воды). Температуру понижали до 33 С и перемешивание продолжали в течение еще 19 ч при этой температуре. Полученную суспензию повторно нагревали при 65 С (внутренняя температура) в течение 45 мин, перемешивали при 65 С в течение 1 ч и охлаждали до 33 С в течение 1 ч. После перемешивания при 33 С в течение еще 3 ч продукт отделяли фильтрованием и влажный отфильтрованный осадок промывали водой (50 г).- 17015212 Продукт сушили в вакууме при 50 С и получали кристаллический безводный DL-лактатDL-молочную кислоту (8,0 г, 85% раствор в воде, что соответствует 6,8 г чистой DL-молочной кислоты) разбавляли водой (54,4 г) и раствор нагревали при 90 С (внутренняя температура) в течение 15 ч. Раствор охлаждали до комнатной температуры и использовали в качестве раствора молочной кислоты на последующей стадии получения соли. Свободное основание N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е 2-пропенамида формы HA (20 г) помещали в стеклянный реактор объемом 1 л и прибавляли смесь этанол/вода (209,4 г смеси 1:1 мас./мас.). Светло-желтую суспензию нагревали при 60 С (внутренняя температура) в течение 30 мин и в течение 30 мин при этой температуре прибавляли раствор молочной кислоты. Капельную воронку промывали водой (10 г). Раствор охлаждали до 38 С в течение 2 ч и при 38 С прибавляли затравочные кристаллы (20 мг DL-лактата N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, безводная форма). После перемешивания при 38 С в течение еще 2 ч смесь охлаждали до 25 С в течение 6 ч. Охлаждение продолжали от 25 до 10 С в течение 5 ч, от 10 до 5 С в течение 4 ч и от 5 до 2 С в течение 1 ч. Суспензию перемешивали в течение еще 2 ч при 2 С и продукт отделяли фильтрованием. Влажный отфильтрованный осадок промывали водой(230 г) и продукт сушили в вакууме при 45 С и получали кристаллический безводный DL-лактатN-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида (форма А). Пример 22. Получение натриевой соли. Примерно 50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл метанола. Затем к суспензии прибавляли стехиометрическое количество гидроксида натрия. Смесь перемешивали при 50 С. После образования прозрачного раствора перемешивание продолжали при 4 С. Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ и ТГА. Натриевую соль N-гидрокси-3-[4-2-(2 метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида выделяли в виде желтого сильно гигроскопичного порошка, который при фильтровании поглощал воду. Пример 23. Получение калиевой соли. Примерно 50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл метанола. Затем к суспензии прибавляли стехиометрическое количество гидроксида калия. Смесь перемешивали при 50 С. После образования прозрачного раствора перемешивание продолжали при 4 С. Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ и ТГА. Калиевую соль N-гидрокси-3-[4-2-(2-метил 1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида выделяли в виде желтого сильно гигроскопичного порошка, который при фильтровании поглощал воду. Пример 24. Получение кальциевой соли. Примерно 50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл метанола. Затем к суспензии прибавляли стехиометрическое количество гидроксида натрия. Смесь перемешивали при 50 С. После образования прозрачного раствора прибавляли стехиометрическое количество дихлорида кальция, что сразу же приводило к осаждению желтоватого твердого вещества. Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ и ТГА. Кальциевая соль N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида была менее гигроскопичной, чем натриевая или калиевая соль N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, и ее можно было легко выделить. Пример 25. Получение цинковой соли. Примерно 50 мг моногидрата свободного основания N-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида суспендировали в 1 мл метанола. Затем к суспензии прибавляли стехиометрическое количество гидроксида натрия. Смесь перемешивали при 50 С. После образования прозрачного раствора прибавляли стехиометрическое количество сульфата цинка, что сразу же приводило к осаждению желтоватого твердого вещества. Твердые вещества собирали фильтрованием и анализировали с помощью ПРРГ и ТГА. Цинковая соль N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида была менее гигроскопичной, чем натриевая или калиевая соль N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, и ее можно было легко выделить.- 18015212 Пример 26. Получение гидрохлорида. 3,67 г (10 ммоль) моногидрата свободного основания (N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида) и 40 мл абсолютного этанола помещали в 3-горлую колбу объемом 250 мл, снабженную магнитной мешалкой и капельной воронкой. К суспензии при перемешивании по каплям прибавляли 7,5 мл 2 М HCl (15 ммоль, 50% избыток) и получали прозрачный раствор. Белое твердое вещество осаждалось за 10 мин и перемешивание продолжали при температуре окружающей среды в течение еще 2 ч. Смесь охлаждали в бане со льдом в течение примерно 30 мин и белое твердое вещество отделяли фильтрованием. Его один раз промывали холодным этанолом (10 мл) и сушили в течение ночи в вакууме и получали 3,72 г хлорида N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида (96,2%). Следует отметить, что HCl использовали в избытке для улучшения выхода, хотя эквимолярное количество обеспечивало выход, равный более 80%. Образование двузамещенной соли путем протонирования метил-1H-индол-3-ильного кольца не происходило даже при использовании большого избыткаHCl. Реакции с 1, 1,5 и 2 экв. HCl давали в качестве продукта один и тот же монохлорид. Кроме того,данные ЯМР не обнаруживали сдвигов каких-либо протонов вблизи кольца, что должно было бы происходить при протонировании. Пример 27. Получение L-тартрата. 3,67 г (10 ммоль) моногидрата свободного основания (N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида) и 50 мл абсолютного этанола помещали в 250 мл 3-горлую колбу с магнитной мешалкой и капельной воронкой. Смесь нагревали до 60 С и к горячей суспензии по каплям прибавляли 0,83 г (5,5 ммоль, 10% избыток) L-винной кислоты, растворенной в 15 мл абсолютного этанола. Сначала формировались большие желтые агломераты, которые препятствовали эффективному перемешиванию, но со временем они превращались в сыпучий и поддающийся перемешиванию желтый порошок. Перемешивание продолжали при 60 С в течение 2 ч. Затем смесь охлаждали до комнатной температуры и помещали в баню со льдом примерно на 30 мин. Желтый порошок собирали фильтрованием и один раз промывали холодным абсолютным этанолом (10 мл). Порошок сушили в течение ночи в вакууме и получали 4,1 г L-тартрата (гемитартрата) N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида (96,6%). Пример 28. Получение моногидрата DL-лактата. 3,67 г (10 ммоль) моногидрата свободного основания (N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида) формы HA и 75 мл ацетона помещали в 3-горлую колбу объемом 250 мл с магнитной мешалкой и капельной воронкой. К суспензии при перемешивании по каплям прибавляли 10 мл 1 М молочной кислоты в воде (10 ммоль) в 20 мл ацетона и получали прозрачный раствор. Перемешивание продолжали при температуре окружающей среды и примерно через 1 ч белое твердое вещество выпадало в осадок. Смесь охлаждали в бане со льдом и перемешивали в течение еще 1 ч. Белое твердое вещество собирали фильтрованием и один раз промывали холодным ацетоном(15 мл). Затем вещество сушили в вакууме и получали 3,94 г моногидрата DL-лактатаN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида (86,2%). Пример 29. Получение мезилата. 3,67 г (10 ммоль) моногидрата свободного основания (N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида) и 75 мл ацетона помещали в 3-горлую колбу объемом 250 мл с магнитной мешалкой и капельной воронкой. К суспензии при перемешивании по каплям прибавляли 0,65 мл (10 ммоль) метансульфоновой кислоты, растворенной в 20 мл этилацетата, и получали поддающуюся перемешиванию суспензию сыпучего желтого порошка. Смесь нагревали до 50 С и выдерживали в течение ночи, и в течение этого времени желтый порошок превращался в белое твердое вещество. Суспензию охлаждали до комнатной температуры и белое твердое вещество собирали фильтрованием. Вещество один раз промывали холодным этилацетатом (15 мл) и сушили в течение ночи в вакууме и получали 4,38 г мезилата N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида (98,3%). Следует отметить, что образующийся сначала желтый порошок представляет собой форму мезилата, которая содержит более чем эквимолярное количество метансульфоновой кислоты. В результате это твердое вещество очень гигроскопично. После осторожного нагревания при температуре от 40 до 50 С в течение 2-4 ч желтый порошок превращается в белое кристаллическое вещество, содержащее эквимолярное количество метансульфоновой кислоты. Эта соль негигроскопична. Также рекомендуется прибавлять метансульфоновую кислоту при температуре окружающей среды и потом повышать температуру. Было обнаружено, что прибавление кислоты при повышенной температуре приводит к быстрому выпадению осадка соли в виде мягкого и смолообразного материала.- 19015212 Пример 30. Получение малеата. 3,67 г (10 ммоль) моногидрата свободного основания (N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида) и 75 мл ацетона помещали в 250 мл 3-горлую колбу с магнитной мешалкой и капельной воронкой. Смесь нагревали до 45 С и к горячей суспензии по каплям прибавляли 1,16 г (10 ммоль) малеиновой кислоты в 25 мл ацетона. Несмотря на то что прибавление проводили медленно, соль выпадала в осадок в виде мягкого и смолообразного твердого вещества, затрудняющего перемешивание. Перемешивание продолжали при 45 С в течение ночи и в течение этого времени твердое вещество превращалось в сыпучий белый порошок. Смесь охлаждали до комнатной температуры и помещали в баню со льдом приблизительно на 30 мин. Белое твердое вещество собирали фильтрованием, один раз промывали холодным ацетоном (15 мл) и сушили в течение ночи в вакууме и получали 4,21 г малеата N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2 пропенамида (90,5%). Следует отметить, что более подходящим растворителем для синтеза является 2-пропанол. Однако при оптимизации условий синтеза было обнаружено, что в дополнение к искомой форме из 2-пропанола может быть выделена еще одна полиморфная модификация в виде желтого порошка с низкой температурой разложения (118,9 С). Пример 31. Получение безводного L-(+)-лактата. Свободное основание N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е 2-пропенамида (20,0 г) обрабатывали L-(+)-молочной кислотой (6,8 г) по методике, описанной в примере 19, и получали кристаллический L-(+)-лактат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, безводную форму. Плавление и разложение происходили одновременно при 184,7 С. ПРРГ приведена на фиг. 3D (2=9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6, 25,2, 29,9). Пример 32. Получение безводного D-(-)-лактата. Свободное основание N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е 2-пропенамида (20,0 г) обрабатывали D-(-)-молочной кислотой (6,8 г) по методике, описанной в примере 19, и получали кристаллический D-(-)-лактат N-гидрокси-3-[4-2-(2-метил-1H-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида, безводную форму. Плавление и разложение происходили одновременно при 184,1 С. ПРРГ приведена на фиг. 3 Е (2=9,9, 11,4, 13,8, 18,1, 18,5, 19,7, 20,2, 21,6, 25,2). Физические характеристики свободного основания, гидрохлорида, DL-лактата, малеата, мезилата и тартрата. Для свободного основания, хлорида, малеата, мезилата и тартрата N-гидрокси-3-[4-2-(2-метил 1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида проведен целый ряд исследований, а именно определяли элементный состав, стехиометрию, чистоту, температуру плавления или разложения, рН насыщенного раствора, растворимость, термогравиметрические характеристики, характеристики гигроскопичности, собственную скорость растворения и стабильность. Методика ВЭЖХ. Прибор:Zorbax SB-C18 (3,5 мкм), 150 мм длина 3,0 мм внутренний диаметр Подвижная фаза: Инжектируемый объем: 5 мкл Инжектируемая масса: 1 мкг Детектирование: УФ, 280 нм Растворитель для образца: метанол Все образцы готовили/разбавляли до концентрации, равной 0,2 мг/мл, в метаноле до проведения анализа с помощью ВЭЖХ. Свежеприготовленный образец каждой соли использовали в качестве эталонного стандарта при анализе с калибровкой по внешнему стандарту.H-ЯМР спектры снимали в ДМСО-d6. ДСК. Все 6 веществ разлагаются до плавления и поэтому дифференциальная сканирующая калориметрия неприменима. Значение рН. Регистрировали значение рН насыщенного раствора или 1% суспензии лекарственного вещества в воде при комнатной температуре. Растворимость в воде. Точно отвешенное количество (20-50 мг) образца растворяли в 1 мл растворителя и приводили в равновесие в течение 24 ч при комнатной температуре. Растворимость определяли гравиметрически или с помощью спектроскопии в УФ-видимой области. Также измеряли рН прозрачного раствора. Однако следует отметить затруднительность определения растворимостей солей в воде, поскольку при растворении возможна диссоциация в свободную форму, что влияет на растворимость и рН. Вполне вероятно, что попытки получения растворов солей при концентрациях, намного меньших соответствующих указанным растворимостям соли, будут безуспешными (полное обсуждение см. в публикации М. Pudipeddi, А.Т.М. Serajuddin, D.J.W. Grant, and P.H. Stahl in "Handbook of Pharmaceutical SaltsProperties Selection and Use", p. 27 и цитированная в ней литература). Вначале можно приготовить растворы мезилата при концентрациях, меньших, чем соответствующие указанным растворимостям, но при хранении осаждается твердое вещество. Кроме того, в водных растворах мезилата обнаружено полиморфное превращение. В обоих случаях остаток анализировали с помощью масс-спектроскопии и установлено, что он является свободным основанием, и это показывало,что осадок не является продуктом разложения. Собственная растворимость. Примерно 30 мг каждого вещества прессовали в гранулы площадью 0,13 см 2. Гранулы большинства свободных оснований распадались при взаимодействии с водными растворяющими средами, и поэтому приведенные выше растворимости не соответствуют истинной собственной растворимости свободного основания. В 0,1 н. HCl гранулы свободного основания полностью распадались и растворимость не определяли. Гранулы других солей не изменялись по меньшей мере в течение нескольких минут, что позволяло определить собственную скорость растворения. Растворимость определяли по методике вращающегося диска (VanKell Instrument). Для растворения лекарственного вещества в сосуде объемом 500 мл при 37 С использовали одну скорость вращения, равную 200 об/мин. Раствор непрерывно прокачивали через кювету УФ-спектрометра и возвращали в сосуд для растворения. Результаты указанных выше исследований приведены в табл. 18. Как можно видеть из данных табл. 18, растворимость каждой соли превышает растворимость свободного основания примерно на 3 порядка. Гидрохлорид, малеат и L-тартрат обладают очень близкими растворимостями, равными примерно 0,3%. Мезилат обладает наибольшей растворимостью, равной 1,3%. (Приближенные растворимости определяли по концентрации в мг/мл при допущении, что плотность раствора равна 1 г/мл). Собственные растворимости менялись соответственно. Кроме того, для моногидрата DL-лактата и безводного DL-лактата проведен ряд исследований, а именно определяли чистоту, температуру плавления или разложения, термогравиметрические характеристики, характеристики гигроскопичности и собственную скорость растворения. Результаты указанных выше исследований приведены в табл. 19. Кроме того, проведены эксперименты по перемешиванию для моногидрата и безводногоDL-лактата. В частности, смесь форм А и НА DL-лактата перемешивали в течение разных периодов времени и при разных температурах. Результаты этих исследований приведены в табл. 20 и 21. Таблица 20 Также исследованы стабильности свободного основания, гидрохлорида, малеата, моногидратаDL-лактата, мезилата и гемитартрата N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида в растворе (табл. 22), в твердом состоянии (табл. 23) и в присутствии смесей инертных наполнителей (табл. 24). 1. ПР - полное количество продуктов разложения (площадь, %). Полное количество продуктов разложения в % и результат анализа могут не равняться 100%, поскольку относительные значения коэффициентов чувствительности для неустановленных примесей не определяли. 2. Анализы проводили с использованием внешнего стандарта при сопоставлении со свежеприготовленным стандартом соответствующей соли. 3. Суспензия;- прозрачный раствор после усиленного воздействия;- после усиленного воздействия не мог полностью раствориться в растворителе для образца. 4. Внешний вид: А - без изменений, В - небольшое обесцвечивание, С - среднее обесцвечивание,D - сильное обесцвечивание. 1. Использовали свежеприготовленные стандарты. 2. ПР - полное количество продуктов разложения (площадь, %) и ЛВ - лекарственное вещество(Примечание: 1% стеарат магния сначала смешивали с солью). Смесь 7: 50% цетиловый спирт+49% HPCLH21+1% стеарат магния. Смесь 8: 100% полиэтиленгликоль 3350. Свободное основание, гидрохлорид, DL-лактат, малеат, мезилат и тартраты N-гидрокси-3-[4-2-(2 метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида обладают очень хорошими характеристиками стабильности и в растворе, и в твердом состоянии. Наблюдается составляющее примерно 1,5% полное разложение всех солей и свободного основания в растворе в лактатном буфере (рН 3,5), воде и метаноле. Соли также обладают очень высокой стабильностью во всех исследованных растворах (в КМЦ (карбоксиметилцеллюлоза), ГПМЦ (гидроксипропилметилцеллюлоза), Klucel и Tween-80). Кроме того, свободное основание, гидрохлорид, DL-лактат, малеат, мезилат и тартратыN-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида также обладают очень высокой стабильностью в смесях с инертными наполнителями, исследованных после выдерживания в течение 2 недель при 50 С/75% ОВ. Дополнительные исследования. Проведены дополнительные исследования растворимости указанных ниже солей в воде и при рН 1 путем суспендирования 5-15 мг соли в 1 мл растворителя. Образцам давали прийти в равновесие при температуре окружающей среды в течение не менее 20 ч. Надосадочную жидкость фильтровали и использовали для определения растворимости, которое проводили гравиметрически, для определения растворимости в воде и с помощью спектроскопии в УФ-видимой области при рН 1. Твердый остаток анализировали с помощью ПРРГ. Кроме того, твердые образцы указанных ниже солей выдерживали при 93% ОВ в течение 7 или 10 дней. Затем их анализировали с помощью ПРРГ и ТГА, если последний представлялся необходимым. Можно было обнаружить только необратимые или медленно обратимые явления. Результаты приведены в табл. 25. Как можно видеть из табл. 25, большинство солей не претерпевает каких-либо необратимых превращений после хранения при 93% ОВ в течение 7 или 10 дней. Однако обнаружено следующее: ацетат превращался в новую форму, которая была выделена после установления равновесия соли в воде. Вероятно, что эта новая форма представляет собой гидрат. Твердые остатки после установления равновесия в воде исследованы с помощью ПРРГ и других методик, если это представлялось необходимым. Результаты можно подытожить следующим образом. Не обнаружены структурные изменения для цитрата, гентизата, малата и фосфата. Твердый остаток пришедшего в равновесие пропионата содержал только свободное основание. Ацетат, бензоат, фумарат и сукцинат превращались в новые полиморфные формы. Поскольку анализ с помощью ПРРГ показал, что во всех случаях, кроме пропионата, раствор находился в равновесии с соответствующей солью, растворимости в воде, приведенные в табл. 25, типичны для солей (Chapter 2, in Handbook of Pharmaceuticals Salts; Authors: M. Pudipeddi, А.Т.М. Serajuddin,D.J.W. Grant, and P.H. Stahl). Во время установления равновесия в растворах в буфере при рН 1 все соли превращались в хлорид. Это проявлялось в узком диапазоне наблюдавшихся растворимостей, которые всегда находились в диапазоне от 0,3 до 0,6 мг/мл (S=0,25 мг/мл для хлорида). Хотя настоящее изобретение описано выше с помощью предпочтительных вариантов осуществления, понятно, что без отклонения от основных положений, раскрытых в настоящем изобретении, в него можно внести многочисленные изменения и модификации. В соответствии с этим предполагается, что все такие изменения и модификации входят в сущность и в широком смысле в объем прилагаемой формулы изобретения. Все заявки на патенты, патенты и другие публикации, цитированные в настоящем изобретении, во всей своей полноте включены в настоящее изобретение в качестве ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соль N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида,выбранная из гидрохлорида, лактата, малеата, мезилата, тартрата, ацетата, бензоата, цитрата, фумарата,гентизата, малата, малоната, оксалата, фосфата, пропионата, сульфата, сукцината, а также натриевой,калиевой, кальциевой и цинковой солей. 2. Соль по п.1, представляющая собой гидрохлорид N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 3. Соль по п.2, представляющая собой гидрохлорид состава 1:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 4. Соль по п.1, представляющая собой лактат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 5. Соль по п.4, представляющая собой лактат состава 1:1 N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 6. Соль по п.4, представляющая собой моногидрат лактата. 7. Соль по п.4, представляющая собой безводный лактат. 8. Соль по п.4, представляющая собой DL-лактат. 9. Соль по п.8, представляющая собой моногидрат DL-лактата N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 10. Соль по п.8, представляющая собой безводный DL-лактат N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 11. Соль по п.4, представляющая собой L-лактат. 12. Соль по п.11, представляющая собой безводный L-(+)-лактат N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 13. Соль по п.4, представляющая собой D-лактат. 14. Соль по п.13, представляющая собой безводный D-(-)-лактат N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 15. Соль по п.1, представляющаясобой малеат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 16. Соль по п.15, представляющая собой малеат состава 1:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 17. Соль по п.1, представляющая собой мезилат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 18. Соль по п.17, представляющая собой мезилат состава 1:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 19. Соль по п.1, представляющая собой тартрат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 20. Соль по п.19, представляющая собой гемитартрат состава 2:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 21. Соль по п.1, представляющая собой ацетат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 22. Соль по п.21, представляющая собой ацетат состава 1:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 23. Соль по п.1, представляющая собой бензоат N-гидрокси-3-[4-2-(2-метил-1H-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 24. Соль по п.23, представляющая собой бензоат состава 1:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 25. Соль по п.1, представляющая собой цитрат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 26. Соль по п.25, представляющая собой гемицитрат состава 2:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 27. Соль по п.1, представляющая собой фумарат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 28. Соль по п.27, представляющая собой гемифумарат состава 2:1 N-гидрокси-3-[4-2-(2-метил 1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 29. Соль по п.1, представляющая собой гентизат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 30. Соль по п.29, представляющая собой гентизат состава 1:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 31. Соль по п.1, представляющая собой малат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида.- 27015212 32. Соль по п.31, представляющая собой гемималат состава 2:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 33. Соль по п.1, представляющая собой малонат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 34. Соль по п.33, представляющая собой гемималонат состава 2:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 35. Соль по п.1, представляющая собой оксалат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 36. Соль по п.1, представляющая собой фосфат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 37. Соль по п.36, представляющая собой фосфат состава 1:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 38. Соль по п.1, представляющая собой пропионат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 39. Соль по п.38, представляющая собой пропионат состава 1:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 40. Соль по п.1, представляющая собой сульфат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 41. Соль по п.40, представляющая собой сульфат состава 1:1 N-гидрокси-3-[4-2-(2-метил-1 Ниндол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 42. Соль по п.1, представляющая собой сукцинат N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 43. Соль по п.42, представляющая собой гемисукцинат состава 2:1 N-гидрокси-3-[4-2-(2-метил 1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 44. Соль по п.1, представляющая собой натриевую соль N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 45. Соль по п.1, представляющая собой калиевую соль N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 46. Соль по п.1, представляющая собой кальциевую соль N-гидрокси-3-[4-2-(2-метил-1 Н-индол 3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 47. Соль по п.1, представляющая собой цинковую соль N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3 ил)этил]амино]метил]фенил]-2 Е-2-пропенамида. 48. Фармацевтическая композиция, включающая:(a) терапевтически эффективное количество соли по любому из пп.1-47 и(b) по меньшей мере один фармацевтически приемлемый носитель, разбавитель, растворитель или инертный наполнитель. 49. Способ лечения заболевания, которое реагирует на ингибирование активности гистондеацетилазы, включающий стадию введения субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соли по любому из пп.1-47.
МПК / Метки
МПК: A61K 31/4045, A61P 35/00, C07D 209/14
Метки: n-гидрокси-3-[4-[[[2-(2-метил-1н-индол-3-ил)этил]амино]метил]фенил]-2е-2-пропенамида, соли
Код ссылки
<a href="https://eas.patents.su/30-15212-soli-n-gidroksi-3-4-2-2-metil-1n-indol-3-iletilaminometilfenil-2e-2-propenamida.html" rel="bookmark" title="База патентов Евразийского Союза">Соли n-гидрокси-3-[4-[[[2-(2-метил-1н-индол-3-ил)этил]амино]метил]фенил]-2е-2-пропенамида</a>
Предыдущий патент: Легкая древесная панель и способ ее изготовления
Следующий патент: Устройство для защиты от повреждений для узла регулирования давления
Случайный патент: Пекарное устройство для выпекания пищевых продуктов на основе теста и способ выпекания таких продуктов