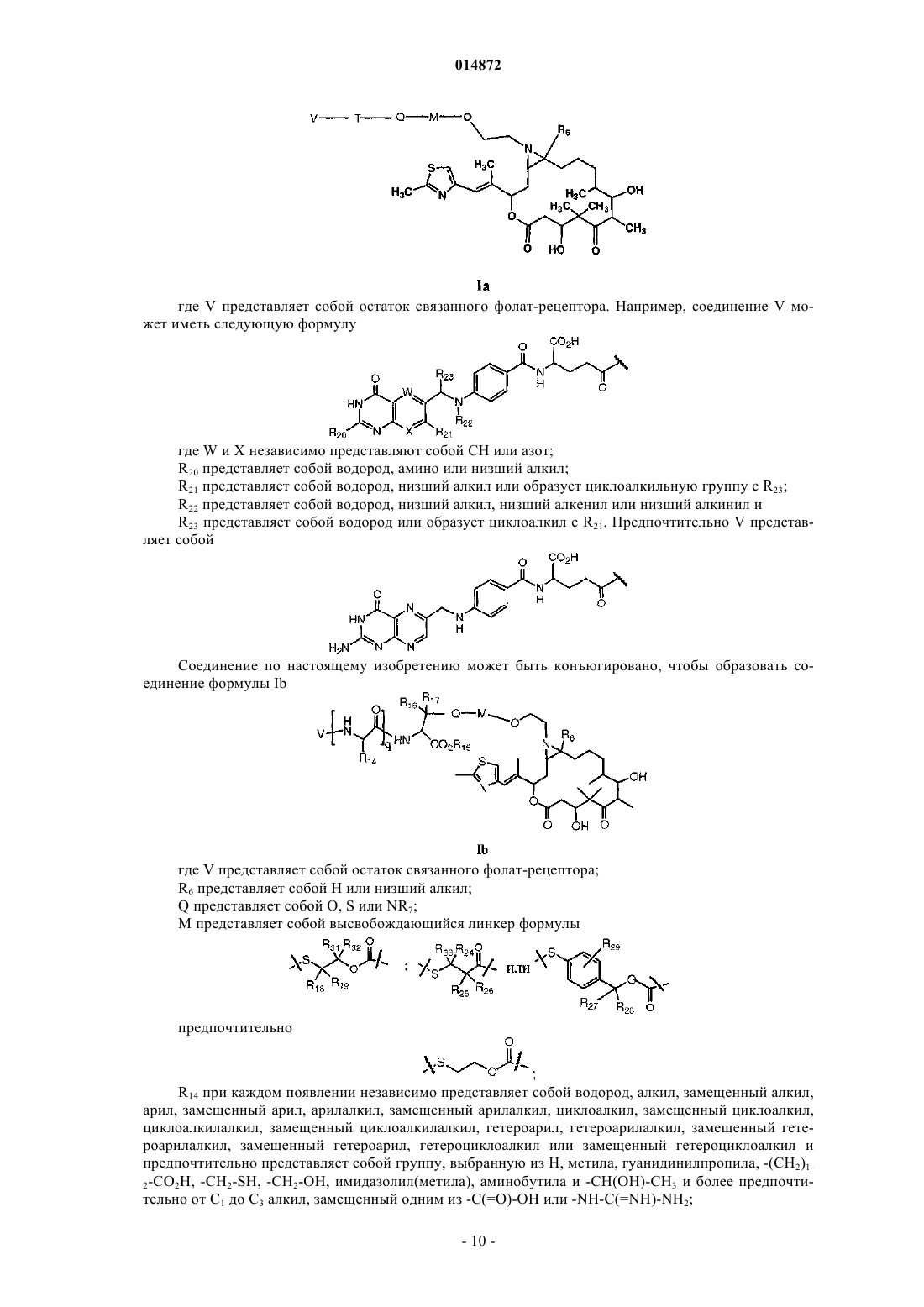
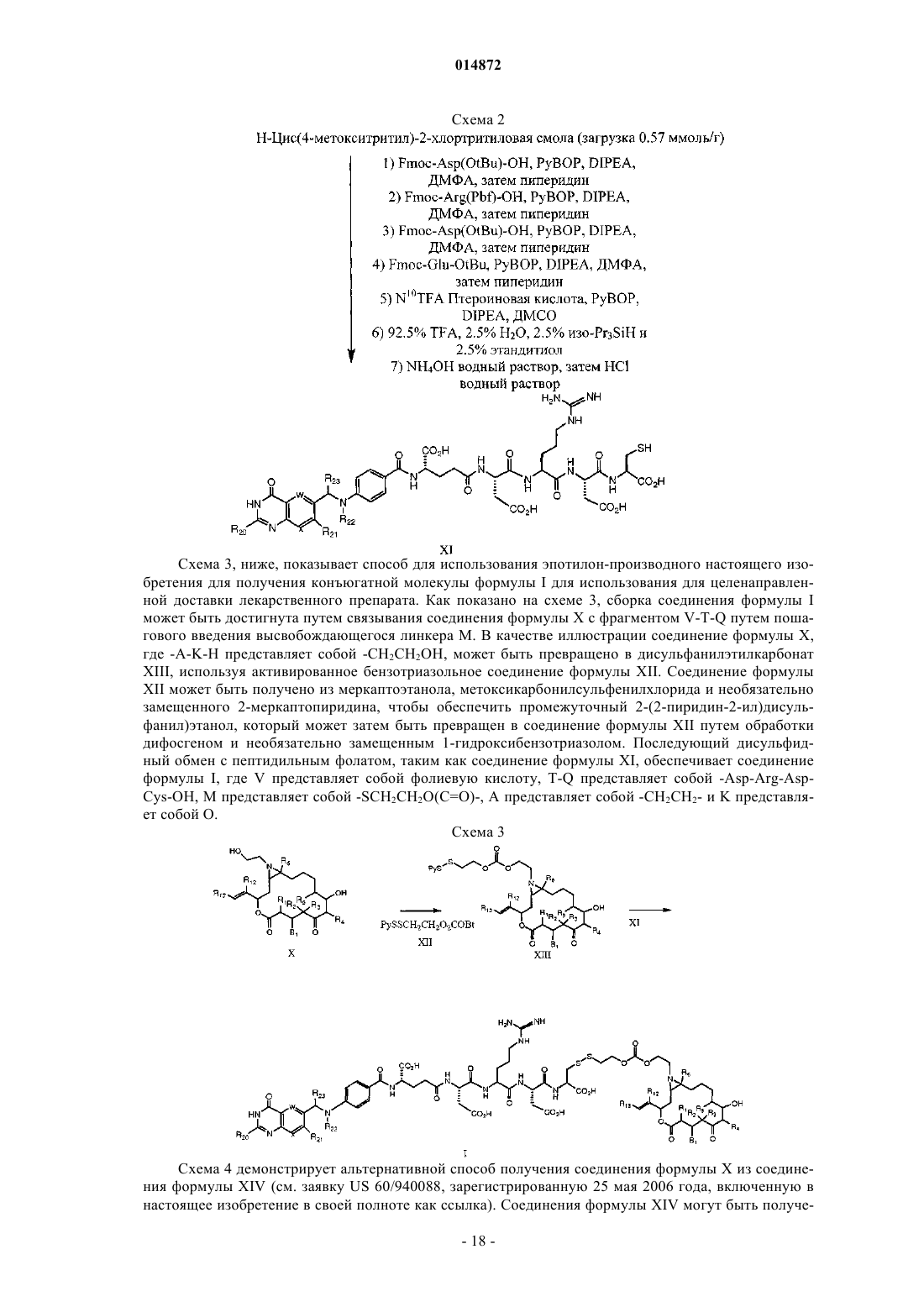
Азиридинилэпотилоновые соединения
Номер патента: 14872
Опубликовано: 28.02.2011
Авторы: Влахов Ёнтчо Р., Вит Грегори Д., Лимон Кристофер П., Сунг-Хун Ким
Формула / Реферат
1. Соединение формулы G
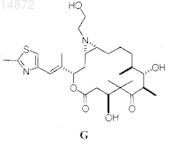
2. Применение соединения по п.1 для получения лекарственного средства для лечения рака у пациента.
Текст
Настоящее изобретение относится к соединению формулы G и применению соединения формулы G для получения лекарственного препарата для лечения рака у пациента. 014872 Область техники Настоящее изобретение относится к азиридинилэпотилоновому аналогу и способу его применения. Уровень техники Эпотилоны А и В являются встречающимися в природе соединениями, которые были открытыHofle et al. в качестве выделенных из продуктов ферментирования микроорганизма Sorangium cellulosum (см., например, WO 93/10121). Hofle et al. также открыли 37 природных вариантов эпотилона и родственные соединения, продуцируемые Sorangium cellulosum, включая эпотилоны С, D, E, F и другие изомеры и варианты (см., например, US 6624310). В то время как в 1993 году Hofle et al. доложили о цитотоксических эффектах эпотилонов А и В, в 1995 году исследователи из Merck сообщили, что эпотилон В проявляет эффекты, стабилизирующие микротрубочки, сходные с паклитакселом (TAXOL) (см. D.M. Bollag "Epothilones, a New Class of Microtubule-Stabilizing Agents with aTaxol-like Mechanism of Action," Cancer Research, vol. 55 (June 1995), на с. 2325-2333). Различные производные и аналоги существующих в природе эпотилонов были открыты в Bristol-Myers Squibb Co. Примеры аналогов эпотилонов включают аналог азаэпотилона В, известный как иксабепилон, 21-замещенные аналоги эпотилона В, включая 21-амино аналог, 2,3-олефиновые аналоги, С-3 цианоаналоги, циклопропиловые аналоги и гетероциклические аналоги, включая аналоги азиридинил-эпотилона. См., например, US 6605599; 6262094; 6399638; 6498257; 6380395 и 6800653, каждый из которых включен здесь как ссылка. Другие авторы также сообщали об открытии других производных и аналогов эпотилона. См., например, WO 99/65913, 98/25929; 00/99/07692; 99/67252; 00/00485; 00/37473; 01/83800; 99/67253, 99/07692, 00/00485, 00/49021, 00/66589, 03/045324,04/014919, 04/056832, 03/022844; US 6441186; 6284781; 6660758; 6380394; 6242469; 6531497; 6441186; 6489314; 6589968; 6930102; US 2004/0072870 A1; 2003/0023082 A1; 2004/0053910 A1; 2004/0152708 A1, которые все включены в данное описание посредством ссылки. Существующие в природе эпотилоны и их аналоги, подобно другим стабилизирующим микротрубочки агентам, могут быть полезными в лечении пролиферативных заболеваний, таких как рак, и обычно действуют путем уничтожения (или прекращения роста) опухолевых клеток, других патогенных клеток и инородных патогенов. Часто, тем не менее, противораковые лекарственные средства атакуют не только опухолевые клетки, но также и нормальные ткани, приводя к нежелательным побочным эффектам. Кроме того, противораковые лекарственные средства обычно имеют ограниченную растворимость, так что приготовление и доставка этих агентов может представлять собой сложную задачу, что ведет к использованию повышающих растворимость агентов, таких как CREMOPHOR. Цитотоксичность некоторых противораковых лекарственных средств и/или ингредиентов препаратов, как известно, вызывает нейропатию или другие побочные эффекты, такие как реакции гиперчувствительности. Эти неблагоприятные побочные эффекты подчеркивают потребность в противораковых лечебных средствах, которые являются избирательными для популяций патогенных клеток и тем самым приводят к низкой токсичности в отношении организма пациента. Тем не менее, как обсуждается в WO 2004/054622 А 1 ученые в течение многих лет пытаются применять моноклональные антитела (mAbs) в нацеленной лекарственной терапии для доставки химиотерапевтических агентов пациентам, но недостатки, в частности, отмечаются на уровне отщепляемых групп, связующих групп и формы лекарства, высвобождаемого в клетке. Сообщается, что успешное лечение опухолей моноклональными антителами ограничено неадекватным проникновением антитела в опухоль и гетерогенным распределением соответствующего опухольассоциированного антигена в опухолевой ткани (см. Klar et al., WO 05/074901).US 2005/0002942 раскрывает витаминный рецептор связывания нацеленных лекарственных конъюгатов, которые являются пригодными для нацеленной лекарственной терапии. Имеется необходимость в технологии для идентифицирования противораковых агентов, которые могут быть использованы для получения конъюгатов, таких как те, которые описаны в US 2005/0002942, в интересах обеспечения нацеленной лекарственной терапии для лечения рака. Сущность изобретения Настоящее изобретение относится к соединению формулы X Настоящее изобретение также относится к применению соединения формулы G для получения лекарственного средства для лечения рака у пациента. Краткое описание чертежей Фиг. 1 демонстрирует коэффициент выживания KB клонов (коэффициент выживания; ось у) после лечения возрастающими концентрациями (концентрация (нМ); ось х) соединения G (черточки), соединения СС (треугольники), соединения АА (ромбы) или иксабепилона (квадраты); фиг. 2 демонстрирует противоопухолевое действие in vivo в качестве меры средней массы опухоли (мг; ось у) через несколько дней после имплантирования опухоли (ось х) в группе без лечения (контроль, черные кружки), в группе лечения только соединением J (серые квадраты), соединением J в присутствии аналога фолата (черные черточки) или в группе лечения соединением G (серые ромбы). Подробное описание изобретения Определения терминов Следующие определения терминов используют в настоящем описании. Исходное определение,обеспеченное для группы или термина в настоящем изобретении, применено к такой группе или термину на всем протяжении настоящего описания само по себе или как часть другой группы, если иное не указано. Термин "фолатсвязывающая группа" или ее аналог либо производное при использовании в данном описании означает функциональную группу, которая будет связываться с белком фолатного рецептора (немоноклональное антитело), который сверхэкспрессирован или предпочтительно экспрессирован на раковые клетки. Например, известно, что фолатный рецептор (FR) сверхэкспрессирован в клетках рака яичников и других раковых клетках. Характерные аналоги и производные фолата раскрыты в заявке US 2005/0002942, принадлежащей Vlahov et al., (далее "Vlahov"), включенной в данное описание посредством ссылки. Термин "высвобождающийся линкер" при использовании в данном описании означает бивалентную связующую группу, которая включает по меньшей мере одну отщепляемую связь, которая может быть расщеплена в физиологических условиях (например, рН-лабильная, восстановительнолабильная, кислотолабильная, окислительно-лабильная или ферментно-лабильная связь). Необходимо понимать, что такие физиологические условия, приводящие к расщеплению связи, включают стандартные реакции химического гидролиза, которые отмечаются, например, при физиологическом рН, или в виде результата компартментализации в клеточную органеллу, такую как эндосому,обладающую более низкой рН, чем рН цитозоля, или в качестве результата реакции с клеточным восстанавливающим агентом, таким как глутатион. Понятно, что расщепляемая связь может соединять два смежных атома внутри высвобождающегося линкера и/или соединять другие группы с высвобождающимся линкером, таким как Q и K,как описано в настоящей заявке, при каждом или на обоих концах линкера. Термины "алкил" и "алк" или сами по себе, или в комбинации с некоторой другой группой, относятся к прямой или разветвленной цепи алканового (углеводородного) радикала, присоединенного по любому доступному атому углерода, содержащему от 1 до 10 атомов углерода, предпочтительно от 1 до 6 атомов углерода, более предпочтительно от 1 до 4 атомов углерода. Примеры таких групп включают, но без ограничения, метил, этил, пропил, изопропил, н-бутил, трет-бутил, изобутил, пентил, гексил, гептил, 4,4-диметилпентил, октил, 2,2,4-триметилпентил и им подобные. Термин "низший алкил" или "низший алкилен" обозначают алкил с прямой или разветвленной цепью,имеющий от одного до четырех атомов углерода. Когда нижний индекс используют со сылкой на-2 014872 алкил или другую группу, нижний индекс относится к числу атомов углерода, которые может содержать группа. Например, термин "С 0-4 алкил" включает связь и алкильные группы, содержащие от 1 до 4 атомов углерода и термин "С 1-4 алкил" обозначает алкильные группы, содержащие от 1 до 4 атомов углерода. Термин "алкилен" относится к двухвалентному углеводородному радикалу, как описано выше для термина "алкил", но с двумя точками присоединения. Например, метиленовая группа представляет собой -СН 2- группу и этиленовая группа представляет собой -СН 2-СН 2- группу. Когда термин алкил используют вместе с другой группой, как в гетероциклоалкиле или циклоалкилалкиле, это означает, что другая идентифицированная (первоначально названная) группа связана непосредственно через алкильную группу, как определено выше, (например, которая может быть с прямой или разветвленной цепью). Таким образом, термин "алкил", используемый в указанном примере, относится к алкилену, например двухвалентной алкильной группе, имеющей две пригодные точки присоединения. Например, циклопропилС 1-4 алкил обозначает циклопропильную группу, присоединенную через алкилен с прямой или разветвленной цепью, имеющий от одного до четырех атомов углерода, и гидроксиалкил обозначает группу ОН, присоединенную через алкилен с прямой или разветвленной цепью, имеющий от одного до десяти атомов углерода, предпочтительно от 1 до 6 атомов углерода, более предпочтительно от 1 до 4 атомов углерода. В случае заместителей,как в "замещенном циклоалкилалкиле" алкиленовая часть группы, кроме того, имеющая прямую или разветвленную цепь, может быть замещена как представлено ниже для замещенных алкильных групп и/или первоначально названная группа (например, циклоалкил) может быть замещена как представлено в настоящем изобретении для этой названной группы (например, циклоалкил). Термин "замещенный алкил" относится к алкильной группе, замещенной одним или большим количеством заместителей, предпочтительно от 1 до 4 заместителей по любой возможной точке присоединения. Тем не менее, когда алкильная группа замещена разнообразными галогеновыми заместителями, алкил может содержать, если позволяет валентность, до 10 заместителей, более предпочтительно до семи заместителей. Алкильные заместители могут включать одну или большее количество следующих групп, выбранных из галогена (например, единственный галогеновый заместитель или разнообразные галогеновые заместители, образующие в последнем случае группы,такие как перфторалкильная группа или алкильная группа, несущая Cl3 или CF3), циано, -ORa, -SRa,-C(=O)Ra, -C(=O)ORa, -OC(=O)Ra, -OC(=O)ORa, -NRaRb, -C(=O)NRaRb, -OC(=O)NRaRb, -S(=O)Ra, S(O)2Ra, -NHS(O)2Ra, -NHS(O)2NHRa, -NHC(=O)NHRa, -NHC(=O)Ra, -NHC(O)2Ra, -NHC(=N-CN)Ra,арила, гетероцикла, циклоалкила и/или гетероарила, где группы Ra и Rb независимо выбраны из водорода, алкила, алкенила, циклоалкила, гетероцикло, арила и гетероарила и где каждый Ra и/или Rb в свою очередь необязательно замещен от одной до четырех группами, выбранными из алкила, алкенила, галогена, галогеналкила, галогеналкокси, циано, нитро, амино, алкиламино, аминоалкил,гидрокси, гидроксиалкил, алкокси, тиола, алкилтио, фенила, бензила, фенилокси, бензилокси, С 37 циклоалкила, содержащего пять или шесть членов гетероцикло или гетероарила и/или низшего алкила или низшего алкенила, замещенного от одной до четырех группами, выбранными из гидрокси,циано, галогена, галогенС 1-4 алкила, галогенС 1-4 алкокси, циано, нитро, амино, С 1-4 алкиламино, аминоС 1-4 алкила, гидроксиС 1-4 алкила, С 1-4 алкокси, тиола и/или С 1-4 алкилтио. Во избежание неопределенности термин "замещенный низший алкил" обозначает алкильную группу, имеющую от одного до четырех атомов углерода и от одного до четырех заместителей, выбранных из тех, которые непосредственно представлены выше для замещенных алкильных групп. В случае замещенного низшего алкила предпочтительные группы Ra и Rb выбирают из водорода, низшего алкила, низшего алкенила, С 3-7 циклоалкила, фенила и содержащего от пяти до шести членов моноциклического гетероцикло и/или гетероарила, в свою очередь необязательно замещенного, как указано выше. Термин "алкенил" относится к прямой или разветвленной цепи углеводородного радикала, содержащего от 2 до 12 атомов углерода и по крайней мере одну углерод-углеродную двойную связь. Примеры таких групп включают этенил или аллил. Термин "замещенный алкенил" относится к алкенильной группе, замещенной одним или большим количеством заместителей, предпочтительно от 1 до 4 заместителей по любой возможной точке присоединения. Примеры заместителей включают алкил, замещенный алкил и те группы, представленные выше как заместители для алкила. Термины "алкокси" и "алкилтио" относятся к алкильной группе как описано выше, присоединенной через кислородную связь (-О-) или серную связь (-S-) соответственно. Термины "замещенный алкокси" и "замещенный алкилтио" относятся к замещенной алкильной группе, как описано выше, присоединенную через кислородную или серную связь соответственно. Термин "низший алкокси" или С 1-4 алкокси представляет собой группу OR, где R представляет собой низший алкил (алкил, содержащий от 1 до 4 атомов углерода). Термин "амино" представляет собой NH2. Алкиламино представляет собой -NRcRd, где по крайней мере один из Rc и Rd представляют собой алкил или замещенный алкил, а другие Rc и Rd выбирают из водорода, алкила и замещенного алкила. Термин "аминоалкил" обозначает аминогруппу, присоединенную через алкиленовую группу (-алкилен-NH2), и алкиламиноалкил обозначает ал-3 014872 киламино, как определено выше, присоединенный через алкиленовую группу (-алкилен-NRcRd). Термин "арил" относится к циклическим, ароматическим углеводородным группам, которые имеют от 1 до 3 ароматических колец, главным образом моноциклические или бициклических группы, такие как фенил или нафтил. Арильные группы, которые являются бициклическими или трициклическими, могут включать по крайней мере одно полностью ароматическое карбоциклическое кольцо, но другое конденсированное кольцо или кольца могут быть ароматическими или неароматическими и могут необязательно содержать гетероатомы при условии, что в этих случаях точка присоединения будет к ароматическому карбоциклическому кольцу. Кроме того, когда арильная группа конденсируется с гетероциклическим или циклоалкильным кольцом, гетероциклическое и/или циклоалкильное кольцо может иметь один или большее количество карбонильных атомов углерода, то есть присоединено через двойную связь к атому кислорода для определения карбонильной группы. Таким образом, примеры "арила" могут включать без ограничения и им подобные. Термин "арилен" относится к двухвалентному арильному радикалу, то есть к арильной группе,как определено выше, имеющей две точки присоединения к двум другим группам по любым доступным точкам присоединения арильного кольца. Ариленовые кольца могут также быть замещены любой из групп, подходящих для замещения на арильные группы, определенные в настоящем изобретении. Термин "замещенный арил" относится к арилу или ариленовой группе, как определено выше,замещенной одним или большим количеством заместителей, предпочтительно от 1 до 4 заместителей по любой точке присоединения. Заместители включают алкил, замещенный алкил, алкенил, замещенный алкенил, также как те группы, представленные выше как заместители для алкила. Термин "карбоциклический" обозначает насыщенное или ненасыщенное моноциклическое,бициклическое или трициклическое кольцо (предпочтительно моно- или бициклическое), в котором все атомы всех колец представляют собой углерод. Таким образом, термин включает циклоалкильные и арильные кольца. Карбоциклическое кольцо может быть замещено, в этом случае заместители выбирают из тех, которые представлены выше для циклоалкильных и арильных групп. Термин "циклоалкил" относится к полностью насыщенной или частично насыщенной циклической углеводородной группе, содержащей от 1 до 3 колец и от 3 до 7 атомов углерода в кольце. Примеры полностью насыщенных циклоалкильных групп включают циклопропил, циклобутил,циклопентил и циклогексил. Примеры частично насыщенных циклоалкильных групп включают циклобутенил, циклопентенил и циклогексенил. Термин "циклоалкил" включает такие группы,имеющие мостик, содержащий от трех до четырех атомов углерода. Кроме того, циклоалкильные группы, которые являются бициклическими или трициклическими, должны включать по крайней мере одно полностью насыщенное или частично насыщенное углеводородное кольцо, но другие конденсированные кольца могут быть ароматическими или неароматическими и могут содержать гетероатомы при условии, что в этих случаях точка присоединения будет к циклической, неароматической углеводородной группе. Кроме того, один или большее количество атомов углерода циклоалкильной группы могут образовывать углерод-кислородную двойную связь для определения карбонильной группы. Таким образом, примеры "циклоалкильных" групп могут включать без огра-4 014872 ничения и им подобные. Термин "циклоалкилен" относится к двухвалентному циклоалкильному радикалу, то есть циклоалкильной группе, как определено выше, имеющей две точки присоединения к двум другим группам по любым доступным двум точкам присоединения циклоалкильного кольца. Термин "замещенный циклоалкил" относится к циклоалкильной группе, как определено выше,замещенной по любой возможной точке присоединения одним или большим количеством заместителей, предпочтительно от 1 до 4 заместителей. Циклоалкильные заместители включают алкил, замещенный алкил, алкенил, замещенный алкенил и те группы, представленные выше, как заместители для алкила. Термин "гуанидинил" обозначает группу Таким образом, гуанидинилалкил обозначает алкильную группу, связанную с гуанидинилом,такую как группа, имеющая формулу Термин "галоген" или "гало" относится к фтору, хлору, брому и йоду. Термин "гетероатомы" включает кислород, серу и азот. Термин "галогеналкил" обозначает алкил, имеющий один или большее количество галогеновых заместителей, включая, без ограничения, группы, такие как -CH2F, -CHF2 и -CF3. Термин "галогеналкокси" обозначает алкоксигруппу, имеющую один или большее количество галогеновых заместителей. Например, "галогеналкокси" включает -OCF3. Когда термин "ненасыщенное", используемый в настоящем изобретении, относится к кольцу или группе, кольцо или группа могут быть полностью ненасыщенными или частично ненасыщенными. Термин "гетероарил" относится к ароматической группе, которая содержит от 4 до 7 членов в моноциклической, от 7 до 11 членов в бициклической или от 10 до 15 членов в трициклической кольцевой системе, которая имеет по крайней мере одно кольцо, содержащее по крайней мере один гетероатом. Каждое кольцо гетероарильной группы, содержащее гетероатом, может содержать один или два атома кислорода или серы и/или от одного до четырех атомов азота, при условии, что общее число гетероатомов в каждом кольце равно четырем или меньшему числу и каждое кольцо имеет по крайней мере один атом углерода. Конденсированные кольца, укомплектованные бициклическими и трициклическими группами, могут содержать только атомы углерода и могут быть насыщенными,частично насыщенными или ненасыщенными. Атомы азота и серы могут необязательно быть окислены и атомы азота могут необязательно быть кватернизованы. Гетероарильные группы, которые являются бициклическими или трициклическими, могут включать по крайней мере одно полностью ароматическое кольцо, но другое конденсированное кольцо или кольца могут быть ароматическими или неароматическими и могут быть карбоциклическими при условии, что в этих случаях точка присоединения будет по любому доступному атому азота или атому углерода ароматического, содержащего гетероатом, кольца. Кроме того, определение гетероарильньгх групп само включает кольца, где один или большее количество атомов углерода присоединено через двойную связь к атому кислорода для определения карбонильной группы (при условии, что гетероарильная группа является ароматической) и также когда гетероарильная группа конденсируется с гетероциклическим или циклоалкильним кольцом, гетероциклическое и/или циклоалкильное кольцо может иметь одну или большее количество карбонильных групп.-5 014872 Примеры моноциклических гетероарильных групп включают пирролил, пиразолил, пиразолинил, имидазолил, оксазолил, изоксазолил, тиазолил (то есть), тиадиазолил, изотиазолил, фуранил, тиенил, оксадиазолил, пиридил, пиразинил, пиримидинил, пиридазинил, триазинил и им подобные. Кроме того, так как определение гетероарильных групп само включает кольца, где один или большее количество атомов углерода определяют карбонильную группу, кольца, такие как 2,4 дигидро-[1,2,4]триазол-3-он (то есть) и им подобные, являются включенными. Примеры бициклических гетероарильных групп включают индолил, бензотиазолил, бензодиоксолил, бензоксакзолил, бензотиенил, хинолинил, тетрагидроизохинолинил, изохинолинил, бензимидазолинил, бензопиранил, индолизинил, бензофуранил, хромонил, кумаринил, бензопиранил,циннолинил, хиноксалинил, индазолил, пирролопиридил, фуропиридинил, дигидроизоиндолил, тетрагидрохинолинил и им подобные. Примеры трициклических гетероарильных групп включают карбазолил, бензидолил, фенантроллинил, акридинил, фенантридинил, ксантенил и им подобные. Термин "гетероалкилен" относится к двухвалентному гетероарильному радикалу, то есть гетероарильной группе, как определено выше, имеющей две точки присоединения к двум другим группам по любым доступным двум точкам присоединения гетероарильного кольца. Термин "замещенные гетероарильные" группы представляет собой гетероарильные группы,как определено выше, замещенные одним или большим количеством заместителей, предпочтительно от 1 до 4 заместителей по любой возможной точке присоединения. Примеры заместителей включают, но без ограничения, алкил, замещенный алкил, алкенил, замещенный алкенил, также как те группы, представленные выше, как заместители для алкила. Термины "гетероцикл", "гетероциклический" и "гетероцикло" используются поочередно и каждый относится к полностью насыщенной или частично ненасыщенной неароматической циклической группе, которая может быть замещенной или незамещенной, например, которая содержит от 4 до 7 членов в моноциклической, от 7 до 11 членов в бициклической или от 10 до 15 членов в трициклической кольцевой системе, которая имеет по крайней мере один гетероатом по крайней мере в одном углеводородном кольце. Каждое кольцо гетероциклической группы, содержащее гетероатом,может иметь 1, 2 или 3 гетероатома, выбранных из атомов азота, кислорода и серы, где гетероатомы азота и серы также необязательно могут быть окислены и гетероатомы азота также необязательно могут быть кватернизованы. Предпочтительно два смежных гетероатома не могут быть одновременно выбраны из кислорода и азота. Гетероциклические группы, которые являются бициклическими или трициклическими, могут включать по крайней мере одно неароматическое некарбоциклическое кольцо, но другое конденсированное кольцо или кольца могут быть ароматическими или неароматическими и могут быть карбоциклическими, при условии, что в этих случаях точка присоединения будет по любому доступному атому азота или атому углерода неароматического, содержащего гетероатом, кольца. Кроме того, определение гетероциклических групп само включает кольца, где один или большее количество атомов углерода присоединено через двойную связь к атому кислорода для определения карбонильной группы (при условии, что гетероциклическая группа является неароматической) и также когда гетероциклическая группа имеет к тому же конденсированное дополнительное кольцо, такое дополнительное кольцо может иметь одну или большее количество карбонильных групп. Примеры моноциклических гетероциклических групп включают пирролидинил, имидазолидинил, тетрагидрофурил, пиперидинил, пиперазинил, пиразолидинил, имидазолинил, пирролинил,тетрагидропиранил, морфолинил, тиаморфолинил и им подобные. Термины "замещенный гетероцикл," "замещенный гетероциклический" и "замещенный гетероцикло" относятся к гетероцикл-, гетероциклическим или гетероциклогруппам, как определено выше, замещенным одним или большим количеством заместителей, предпочтительно от 1 до 4 заместителей по любой возможной точке присоединения. Примеры заместителей включают алкил,замещенный алкил, алкенил, замещенный алкенил, также как те группы, представленные выше как примеры алкильных заместителей. Термин "гидрокси" относится до -ОН. Термин "тиол" обозначает группу -SH. Термин "четвертичный азот" относится к четырехвалентному положительно заряженному атому азота, включая, например, положительно заряженный атом азота в тетраалкиламмонийной группе (например, тетраметиламмоний или N-метилпиридиний), положительно заряженный атом азота в протонированной аммонийной группе (например, триметилгидроаммоний или N-гидропиридиний),положительно заряженный атом азота в N-оксидах амина (например, N-метилморфолин-N-оксид или пиридин-N-оксид) и положительно заряженный атом азота в N-аминоаммонийной группе (например, N-аминопиридиний).-6 014872 Когда функциональную группу называют "защищенной", это означает, что группа находится в измененной форме, чтобы снизить, особенно предотвратить нежелательные побочные реакции по защищенному положению. Подходящие защитные группы для способов и соединений, описанных в настоящем изобретении, включают, без ограничения, те, которые описаны в обычных руководствах,в том числе Greene T.W. et al. Protective Groups in Organic Synthesis, Wiley, N.Y. (1991), включенное в настоящее изобретение как ссылка. Альтернативные воплощения изобретения Настоящее изобретение имеют формулу G или общую формулу X Другое воплощение изобретения включает применение соединения для получения лекарственного средства для лечения рака у пациентов, в особенности для использования при получении средств, содержащих конъюгатные соединения для нацеленной лекарственной терапии опухолей,которые сверхэкспрессируют или предпочтительно экспрессируют фолатный рецептор. Применение агента для повышающей регуляции уровня фолатного рецептора (FR) может быть эффективно для повышения экспрессии FR в некоторых раковых клетках или типах опухолей для увеличения воздействия, полученного при введении соединений по изобретению пациентам, и/или улучшения течения различных заболеваний или типов опухолей, которые могут быть пролечены соединениями по изобретению, связывающими фолатные рецепторы. Экспрессия фолатного рецептора в некоторых раковых опухолях может быть стимулирована путем введения индуктора фолатного рецептора, который избирательно повышает уровень фолатного рецептора в раковых клетках,тем самым улучшая эффективность нацеленной на фолатный рецептор терапии. Например, положительные по эстрогеновому рецептору (ER+) раки молочной железы экспрессируют низкие уровни фолатных рецепторов. Лечение индуктором фолатных рецепторов, таким как тамоксифен, антагонист эстрогена, как известно, стимулирует экспрессию фолатных рецепторов в ER+ раках молочной железы, повышая восприимчивость клеток ER+ рака молочной железы к лечению нацеленными на фолатный рецептор терапевтическими средствами. Примеры индукторов фолатного рецептора для повышающей регуляции фолатного рецептора(FR) включают антагонисты эстрогенных рецепторов, такие как тамоксифен; агонисты прогестероновых рецепторов, такие как прогестин; агонисты андрогенных рецепторов, такие как тестостерон и дигидрокситестостерон и агонисты глюкокортикоидных рецепторов, такие как дексаметазон. Примеры индукторов фолатного рецептора для повышающей регуляции фолатного рецептора(FR) включают агонисты рецепторов ретиноевой кислоты, такие как полностью трансретиноевая кислота (ATRA), тетраметилнафталенилпропенилбензоевая кислота (TTNPB), 9-цис-ретиноевая кислота (9-цис-RA), CD33336, LG101093 и CD2781. Соединение по настоящему изобретению может образовывать соли или сольваты, которые также находятся в рамках указанного изобретения. Ссылка на соединение формулы G (X) в настоящем изобретении подразумевает включение ссылки к его солям и сольватам, рацематам, диастереомерам и энантиомерам, если иное не указано. Термин "соль(и)", как применяемый в настоящем изобретении, относится к кислотным и/или основным солям, образованным с неорганическими и/или органическими кислотами и основаниями. Кроме того, когда соединение формулы G (X) содержит-7 014872 оба как основной остаток, такой как, без ограничения, пиридинилимидазолил, амин или гуанидинил, и кислотный остаток, такой как, без ограничения, карбоновую кислоту, могут быть образованы цвиттероны, которые являются включенными в термин "соль(и)" в виде, используемом в настоящем изобретении. Фармацевтически приемлемые (то есть нетоксичные, физиологически приемлемые) соли являются предпочтительными, хотя другие соли являются также полезными, например, на стадиях выделения или очистки, которые могут быть применены при получении. Соли соединения формулы G (X) могут быть образованы, например, путем взаимодействия соединения формулы G(X) с количеством кислоты или основания, таким как эквивалентное количество, в среде, такой как в одной из которых соль выпадает в осадок или в водной среде, с последующей лиофилизацией. Соединение формулы G (X), которое содержит основной остаток, такой как, без ограничения,амин, гуанидинильную группу или пиридильное, или имидазолильное кольца, может образовывать соли с различными органическими и неорганическими кислотами. Примеры кислотно-аддитивных солей включают ацетаты (такие как те, которые образованы с уксусной кислотой или тригалогенуксусной кислотой, например трифторуксусной кислотой), адипаты, альгинаты, аскорбаты, аспараты,бензоаты, бензолсульфонаты, бисульфаты, бораты, бутираты, цитраты, камфораты, камфорсульфонаты, циклопентанпропионаты, диглюконаты, додецилсульфаты, этансульфонаты, фумараты, глюкогептаноаты, глицерофосфаты, гемисульфаты, гептаноаты, гексаноаты, гидрохлориды, гидробромиды, гидроиодиды, гидроксиэтансульфонаты (например, 2-гидроксиэтансульфонаты), лактаты,малеаты, метансульфонаты, нафталинсульфонаты (например, 2-нафталинсульфонаты), никотинаты,нитраты, оксалаты, пектинаты, персульфаты, фенилпропионаты (например, 3-фенилпропионаты),фосфаты, пикраты, пивалаты, пропионаты, салицилаты, сукцинаты, сульфаты (такие как те, которые образованы с серной кислотой), сульфонаты (такие как те, которые упомянуты в настоящем изобретении), тартраты, тиоцианаты, толуолсульфонаты, такие как тозилаты, ундеканоаты и им подобные. Соединение формулы G (X), которое содержит кислотный остаток, такой как, без ограничения,карбоновую кислоту, может образовывать соли с различными органическими и неорганическими основаниями. Примеры основных солей включают аммонийные соли; соли щелочных металлов,такие как соли натрия, лития и калия; соли щелочно-земельных металлов, такие как соли кальция и магния; соли с органическими основаниями (например, органические амины), такими как бензатины, дициклогексиламины, гидрабамины (образованные с N,N-бис-(дегидроабиетил)этилендиамином), N-метил-D-глюкамины, N-метил-D-гликамиды, трет-бутиламины; и соли с аминокислотами, такими как аргинин, лизин и им подобные. Основные азотсодержащие группы могут быть кватернизованы с агентами, такими как низшие алкилгалоиды (например, метил-, этил-, пропил- и бутилхлориды, бромиды и иодиды), диалкилсульфаты (например, диметил-, диэтил-, дибутил- и диамилсульфаты), галоиды с длинной цепью (например, децил-, лаурил-, миристил- и стеарилхлориды, бромиды и иодиды), аралкилгалоиды (например, бензил- и фенэтилбромиды) и другие. Сольваты соединения по изобретению также рассмотрены в настоящем изобретении. Сольваты соединения формулы G (X) включают, например, гидраты. Желаемая стереохимия для конечных соединений может быть достигнута путем использования исходных продуктов, имеющих соответствующую желаемую стереохимию и с последующей поддержкой стереоселективности во время процесса получения. Альтернативно, соединения могут быть получены в виде рацематов или диастереомеров и затем желаемая стереохимия может быть достигнута через разделение конфигурационных изомеров, которое может быть осуществлено с помощью любого подходящего способа, известного среднему специалисту, например, такой как колоночная хроматография. Воплощения, показанные в настоящем изобретении в виде примеров, предпочтительно предназначены для иллюстрации, а не для ограничения. Другие воплощения изобретения будут очевидны среднему специалисту в области, такой как,например, при рассмотрении комбинаций воплощений, на которые ссылаются выше, и рассмотрены как находящиеся в рамках настоящего изобретения. Применение Один из белков, который сверхэкспрессируется или предпочтительно экспрессируется в определенных раковых клетках, является фолатным рецептором. Фолиевая кислота требуется для синтеза ДНК и определенные человеческие опухолевые клетки, как известно, сверхэкспрессируют фолатсвязыващие белки. Например, обе публикации Campbell et al. "Folate Binding Protein is a Marker forOvarian Cancer", Cancer Research, vol. 51 (Oct. 1, 1991), at p.5329-38 и Coney et al. "Cloning of a Tumor-Associated Antigen: MOv18 and MOv19 Antibodies Recognize Folate-binding Protein" Cancer Research, vol. 51 (Nov. 15, 1991), at p.6125-31 сообщают, что фолатсвязывающие белки представляют собой маркеры рака яичников. Сверхэкспрессия фолатного рецептора также известна при других раковых образованиях, таких как, например, рак кожи, рак почки, рак молочной железы, рак легкого, рак толстой кишки, рак носа, рак глотки, рак грудной железы и рак мозга, так же как при других раковых образованиях, на которые ссылаются в настоящем изобретении. Соединение по настоящему изобретению является полезным и может быть доставлено в виде-8 014872 агента производного эпотилона, стабилизирующего микротрубочки, в опухоли, которые экспрессируют фолатный рецептор. Они являются полезными при лечении множества раковых образований и других пролиферативных заболеваний, особенно тех раковых образований, характеризующихся раковыми клетками или опухолями, которые экспрессируют фолатный рецептор. Термин "связанное с фолатным рецептором состояние", используемый в настоящем изобретении, включает болезни или нарушения, характеризующиеся экспрессией фолатного рецептора, или другими словами те болезни или нарушения, которые могут быть диагностированы или подвергнуты лечению на уровне экспрессии фолатного рецептора в пораженной ткани по сравнению с нормальной тканью. Соединение по настоящему изобретению является полезным для образования конъюгатов. Например, соединение по изобретению может быть использовано, чтобы образовать следующее конъюгатное соединение формулы I где V представляет собой фолат или аналог либо его производное;Q представляет собой О, S или NR7; М представляет собой высвобождающийся линкер;B1 представляет собой гидроксил или цианогруппу и R1 представляет собой водород или B1 иR1 взяты вместе, чтобы образовать двойную связь;R2, R3 и R5 независимо представляют собой водород, алкил, замещенный алкил, арил или замещенный арил или R2 и R3 могут быть взяты вместе с атомом углерода, к которому они присоединены, чтобы образовать необязательно замещенный циклоалкил;R4 представляет собой водород, алкил, алкенил, замещенный алкил, замещенный алкенил, арил или замещенный арил;R6 представляет собой водород, алкил или замещенный алкил;R7a, R7, R8, R9, R10 и R11 независимо представляют собой водород, алкил, замещенный алкил,циклоалкил, замещенный циклоалкил, арил, замещенный арил, гетероциклоалкил, замещенный гетероциклоалкил, гетероарил или замещенный гетероарил;R12 представляет собой Н, алкил, замещенный алкил или галоген;R13 представляет собой арил, замещенный арил, гетероарил или замещенный гетероарил;m имеет значение от 0 до 6; Т имеет формулу где R14 при каждом появлении независимо представляет собой водород, алкил, замещенный алкил, арил, замещенный арил, арилалкил, замещенный арилалкил, циклоалкил, замещенный циклоалкил, циклоалкилалкил, замещенный циклоалкилалкил, гетероарил, гетероарилалкил, замещенный гетероарилалкил, замещенный гетероарил, гетероциклоалкил или замещенный гетероциклоалкил;q имеет значения от 1 до 10 иR15, R16 и R17 независимо представляют собой водород, алкил, замещенный алкил или циклоалкил. В качестве другого неограничивающего примера соединение по изобретению может быть использовано, чтобы образовать следующий конъюгат формулы Ia: где V представляет собой остаток связанного фолат-рецептора. Например, соединение V может иметь следующую формулу где W и X независимо представляют собой СН или азот;R20 представляет собой водород, амино или низший алкил;R21 представляет собой водород, низший алкил или образует циклоалкильную группу с R23;R22 представляет собой водород, низший алкил, низший алкенил или низший алкинил иR23 представляет собой водород или образует циклоалкил с R21. Предпочтительно V представляет собой Соединение по настоящему изобретению может быть конъюгировано, чтобы образовать соединение формулы Ib где V представляет собой остаток связанного фолат-рецептора;Q представляет собой О, S или NR7; М представляет собой высвобождающийся линкер формулыR14 при каждом появлении независимо представляет собой водород, алкил, замещенный алкил,арил, замещенный арил, арилалкил, замещенный арилалкил, циклоалкил, замещенный циклоалкил,циклоалкилалкил, замещенный циклоалкилалкил, гетероарил, гетероарилалкил, замещенный гетероарилалкил, замещенный гетероарил, гетероциклоалкил или замещенный гетероциклоалкил и предпочтительно представляет собой группу, выбранную из Н, метила, гуанидинилпропила, -(CH2)12-CO2H, -CH2-SH, -СН 2-ОН, имидазолил(метила), аминобутила и -СН(ОН)-СН 3 и более предпочтительно от C1 до С 3 алкил, замещенный одним из -С(=О)-ОН или -NH-C(=NH)-NH2;q имеет значения от 1 до 10, предпочтительно от 1 до 5;R15, R16 и R17 независимо представляют собой водород, низший алкил или замещенный низший алкил; иR18, R19, R31, R32, R33, R24, R25, R26, R27, R28 и R29, каждый независимо, представляет собой Н,низший алкил, замещенный низший алкил, циклоалкил или замещенный циклоалкил или любой изR18 и R19; R31 и R32; R19 и R31; R33 и R24; R25 и R26; R24 и R25 или R27 и R28 могут быть взяты вместе,чтобы образовать циклоалкил. Соединение по настоящему изобретению главным образом пригодно для образования конъюгатных соединений, включая их фармацевтически приемлемые соли и сольваты формулы Для любой двухвалентной группы, представленной в настоящем изобретении, такой как (CR8R9)-(CH2)m-Z-, которая является способной к введению в соединения формулы I, включение должно быть осуществлено слева направо. Например, в следующей ситуации, где А определен в виде -(CR8R9)-(CH2)m-Z-, метиленовая группа присоединена к K и Z группа присоединена к атому азота азиридинильного кольца, в следующем виде: В качестве неограничивающего примера такие связанные с фолатным рецептором раки включают рак яичников и раки кожи, молочной железы, легкого, толстой кишки, носа, глотки, грудной железы, печени, почки, селезенки и/или головного мозга; мезотелиомы, аденому гипофиза, рак шейки матки, почечно-клеточный рак или другой рак почки, рак хороидального сплетения и эпителиальные опухоли (см. Asok, Antony, "Folate Receptors: Reflections on a Personal Odyssey and a Perspective on Unfolding Truth," Advanced Drag Delivery Reviews 56 (2004) at 1059-66). Кроме того, применение антиэстрогенного средства (такого как тамоксифен, ICI 182, 780), может быть эффективно для повышения экспрессии FR в некоторых раковых клетках или типах опухолей для увеличения пользы, полученной при введении соединения по изобретению пациентам и/или для улучшения течения различных заболеваний или типов опухолей, которые могут быть пролечены соединением согласно данному изобретению. Например, заболевания, которые могут быть пролечены соединением по настоящему изобретению и/или при комбинированной терапии, включающей соединение по настоящему изобретению в комбинации с антиэстрогенным средством, могут также включать, без ограничений, следующие раки, включая те, что перечислены выше и/или таковые мочевого пузыря, поджелудочной железы,желудка, щитовидной железы и предстательной железы; гематопоэтические опухоли лимфоидного ростка, включая лейкозы, такие как острый лимфоцитарный лейкоз и острый лимфобластный лейкоз, и лимфомы, такие как В-клеточная лимфома, Т-клеточная лимфома, ходжкинская лимфома,неходжкинская лимфома, волосатоклеточная лимфома и лимфома Беркитта; гематопоэтические опухоли миелоидного ростка, включая острые и хронические миелогенные лейкозы и промиелоцитарный лейкоз; опухоли центральной и периферической нервной системы, включая астроцитому,нейробластому, глиому и шванномы; опухоли мезенхимального происхождения, включая фибросаркому, рабдомиосаркому и остеосаркому; и другие опухоли, включая меланому, пигментную ксе- 11014872 родерму, семиному, кератоакантому, фолликулярный рак щитовидной железы и тератокарциному. Соединение по настоящему изобретению полезно в лечении пациентов, которые были предварительно пролечены по поводу рака, так же как и те, которые предварительно не были пролечены по поводу рака. Способ по этому изобретению может применяться в лечении рака первой линии и второй линии. Более того, соединение формулы (X) может быть полезно в лечении рефрактерных или резистентных раков. Соединение по настоящему изобретению может также быть полезно в лечении других состояний, чувствительных к агентам, стабилизирующим микротрубочки, действующих через фолатный рецептор, включая помимо прочего артрит, в особенности воспалительный артрит и другие воспалительные состояния, опосредованные через активированные макрофаги и расстройства центральной нервной системы, такие как болезнь Альцгеймера. Кроме того, соединение по настоящему изобретению может быть введено в комбинации с другими противораковыми и цитотоксическими агентами и лечебными воздействиями, применяемыми в лечении рака и других пролиферативных заболеваний. В лечении рака комбинация соединения по настоящему изобретению и одного или более вспомогательных агентов и/или других лечебных воздействий может быть выгодной. Второй агент может иметь такой же или другой механизм действия по сравнению с соединением по формуле (X). Особенно полезными являются комбинации противораковых и цитотоксических препаратов, в которых второй препарат действует другим образом или в другую фазу клеточного цикла, чем активная функциональная группа соединения по настоящему изобретению. Примеры классов противораковых и цитотоксических агентов включают помимо прочего алкилирующие агенты, такие как препараты азотистого иприта, алкилсульфонаты, препараты нитрозомочевины, этиленимины и триазены; антиметаболиты, такие как антагонисты фолата, аналоги пурина и аналоги пиримидина; антибиотики и антитела, такие как моноклональные антитела; ферменты; ингибиторы фарнезил-протеин трансферазы; гормональные агенты, такие как глюкокортикоиды, эстрогены/антиэстрогены, андрогены/антиандрогены, прогестины и антагонисты фактора,высвобождающего лютеинизирующий гормон; разрушающие микротрубочки агенты, такие как эктеинасцидины или их аналоги и производные; стабилизирующие микротрубочки агенты; продукты растительного происхождения, такие как алкалоиды барвинка, эпиподофиллотоксины и таксаны; ингибиторы топоизомеразы; ингибиторы пренил-протеин трансферазы; координационные комплексы с платиной; ингибиторы киназы, включая мультикиназные ингибиторы и/или ингибиторы Src киназы или Src/abl; ингибиторы трансдукции сигналов; и другие агенты, применяемые в качестве противораковых и цитотоксических агентов, таких как биологические модификаторы ответа, факторы роста и иммуномодуляторы. Соединение формулы X может также быть использовано в сочетании с лучевой терапией. Другие примеры противораковых агентов, которые могут быть использованы в комбинации с соединением по изобретению, включают ингибиторы Src киназы, 'N-(2-хлор-6-метилфенил)-2-6[4-(2-гидроксиэтил)-1-пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамид и другие соединения, описанные в US 6596746 и заявке US11/051208, поданной 4 февраля 2005 года,включенных в данное описание посредством ссылки; иксабепилон, аналог азаэпотилона В и/или другие аналоги эпотилонов, описанные в US 6605599; 6262094; 6288237; 6291684; 6359140; 6365749; 6380395; 6399638; 6498257; 6518421; 6576651; 6593115; 6613912; 6624310; заявке US 2003/0060623, опубликованной в марте 2003 года; DE 4138042.8; WO 97/19086, 98/22461, 98/25929,98/38192, 99/01124, 99/02224, 99/02514, 99/03848, 99/07692, 99/27890, 99/28324, 99/43653, 99/54330,99/54318, 99/54319, 99/65913, 99/67252, 99/67253, 00/00485, заявках US 2004/0053910 и 2004/0152708; ингибиторы циклинзависимой киназы, указанные в WO 99/24416 (см. также US 6040321); ингибиторы пренил-протеин трансферазы, указанные в WO 97/30992 и 98/54966; агенты фарнезилпротеин трансферазы, описанные в US 6011029; CTLA-4 антитела, описанные в публикации РСТ WO 01/14424, и/или CTLA-4 антитело, описанное в публикации РСТ WO 00/37504, такое как, например, антитело, известное как СР-675206 (тицилимунаб) ORENCIA; MDX-010; винфлунин (Javlor) и эрбитукс (цетиксумаб). Другие агенты, потенциально применимые в комбинации с соединением по настоящему изобретению, могут включать паклитаксел (TAXOL), доцетаксел (TAXOTERE), другие агенты, такие как гидроксимочевина, прокарбазин, митотан, гексаметилмеламин, цисплатин и карбоплатин; авастин и герцептин. Фармацевтические композиции, полученные в соответствии с настоящим изобретением, могут также быть приготовлены или совместно вводиться с другими терапевтическими агентами, которые выбраны из-за их особенной пригодности для введения при лечении вышеупомянутых патологических состояний. Например, соединения по изобретению могут быть приготовлены с агентами для предотвращения тошноты, гиперчувствительности и раздражения желудка, такими как антиэметики и H1 и Н 2 антигистаминные средства.- 12014872 Вышеупомянутые другие терапевтические агенты при использовании в комбинации с соединениями по настоящему изобретению могут быть использованы, например, в таких количествах,которые указаны в Physicians' Desk Reference (PDR) или других, определенных средним специалистом. Одно из воплощений по настоящему изобретению включает использование соединения по настоящему изобретению при получении фармацевтических композиций для лечения рака, в особенности для использования при получении фармацевтических композиций для применения при целенаправленной доставке лекарственного препарата к опухолям, которые сверхэкспрессируют или предпочтительно экспрессируют фолат-рецептор. Фармацевтические композиции по настоящему изобретению могут вводиться с любой целью, описанной в данном описании, посредством любого подходящего способа, например парентеральным, таким как подкожная, внутривенная, внутримышечная или интрастернальная инъекция или инфузионные методики (например, в виде стерильных водных или неводных растворов или суспензий для инъекций) и/или в дозированных лекарственных формах, содержащих нетоксичные, фармацевтически приемлемые носители или разбавители. Настоящее соединение может, например, быть введено в форме, подходящей для немедленного высвобождения или замедленного высвобождения, с помощью применения устройств, таких как подкожные имплантаты или осмотические помпы. Показательные композиции для парентерального введения включают растворы или суспензии для инъекций, которые могут содержать, например, подходящие нетоксичные разбавители или растворители, подходящие для парентерального введения, такие как маннитол, 1,3-бутандиол, вода,раствор Рингера, изотонический раствор хлорида натрия (0,9% препарат хлорида натрия для инъекций (физиологический раствор) или 5% препарат глюкозы для инъекций), или другие подходящие диспергирующие или смачивающие и суспендирующие агенты, включая синтетические моно- или диглицериды и жирные кислоты. Фармацевтически приемлемые композиции и/или способы введения соединения по изобретению могут включать применение сорастворителей, включая помимо прочего этанол, N,N-диметилацетамид, пропиленгликоль, глицерин и полиэтиленгликоли, например полиэтиленгликоль 300 и/или полиэтиленгликоль 400, могут содержать применение сурфактантов(фармацевтически приемлемый поверхностно-активный агент, который может быть использован для увеличения распространения соединения или смачивающих свойств путем снижения их поверхностного натяжения), включая помимо прочего CREMOPHOR, SOLUTOL HS 15, полисорбат 80, полисорбат 20, полоксамер, пирролидоны, такие как N-алкилпирролидон (например, Nметилпирролидон) и/или поливинилпирролидон; могут также содержать применение одного или более "буферов" (например, ингредиент, который придает способность сопротивляться изменению в эффективной кислотности или щелочности среды при добавлении порций кислоты или основания),включая помимо прочего натрия фосфат, натрия цитрат, диэтеноламин, триэтаноламин, L-аргинин,L-лизин, L-гистидин, L-аланин, глицин, натрия карбонат, трометамин (также известный как, трис[гидроксиметил]аминометан или Tris), и/или их смеси. Эффективное количество соединения по настоящему изобретению может быть определено средним специалистом и включает характерные дозировки для взрослого человека от около 0,01-10 мг/кг массы тела активного соединения в день, которые могут быть введены в одной дозе или в форме разделенных индивидуальных доз, таких как от 1 до 4 раз в день. Предпочтительный диапазон включает дозу от около 0,02 до 5 мг/кг массы тела с диапазоном от около 0,05 до 0,3 наиболее предпочтительным. Необходимо понимать, что конкретный уровень дозирования и частота дозирования для любого конкретного субъекта может варьировать и будет зависеть от множества факторов, включая активность применяемого соединения, метаболической стабильности и длительности действия этого соединения, биологического вида, возраста, массы тела, общего состояния здоровья,пола и диеты субъекта, способа и времени введения, скорость выведения, лекарственные взаимодействия и тяжесть конкретного патологического состояния. Предпочтительные субъекты включают животных, наиболее предпочтительно виды млекопитающих, таких как люди и домашние животные, такие как собаки, кошки и им подобные, подверженные патологическим состояниям, связанным со стабилизацией микротрубочек. Соединение по настоящему изобретению было протестировано в одном или более исследованиях, описанных ниже, и/или исследованиях, известных в данной области, и демонстрирует измеряемый уровень активности в качестве агента, стабилизирующего микротрубочки. Исследования Исследование выживания клоногенных клеток. Раковые клетки высевают в количестве 3.0 Е+05 клеток в Т 75 фалкон с 10 мл среды RPMI1640,свободной от фолиевой кислоты и содержащей 10% фетальную бычью сыворотку и 25 мкМ HEPES. Клетки выращивают в 37 С инкубаторе, содержащем 5% СО 2 в течение 2 дней. На второй день надосадочную фракцию удаляют из флаконов и флаконы делят на две группы. Клетки одной группы инкубируют с 5 мл среды, содержащей 100 М фолиевой кислоты (Sigma), в течение 30 мин и другие выращивают в 5 мл среды без добавления фолиевой кислоты. Клетки затем обрабатывают 20 нМ- 13014872 эпотилона, аналога эпотилона, конъюгированного эпотилона или конъюгированного аналога эпотилона в течение одного часа. По окончании инкубации препараты удаляют из флаконов и клетки отмывают PBS буфером 3. После отмывания 5 мл полной среды добавляют в каждый флакон и клетки выращивают в СО 2 инкубаторе в течение 23 ч. Следующим утром клетки удаляют из флаконов путем трипсинизации, число клеток определяют и затем клетки высевают в 6-луночные планшеты. Через 10 дней после высевания колонии окрашивают кристаллическим фиолетовым и подсчитывают. Определяют коэффициент выживания. Исследование in vitro MTS пролиферации/цитотоксичности.In vitro цитотоксичность оценивают в опухолевых клетках, используя основанный на тетразолии колориметрический анализ, который использует метаболическое превращение MTS (3-(4,5 диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфенил)-2 Н-тетразолия внутренняя соль) в восстановленную форму, которая поглощает свет длиной волны 492 нм. Клетки высевают за 24 ч до добавления аналога эпотилона или конъюгированного аналога эпотилона. Затем проводят 72 часовую инкубацию при 37 С с последовательно разбавленным соединением, MTS, в комбинации с электронсвязывающим агентом феназин метосульфатом, добавляют к клеткам. Инкубацию продолжают в течение 3 ч, затем оптическую плотность среды при 492 нм измеряют с помощью спектрофотометра, чтобы получить число выживших клеток относительно контрольных популяций. Результаты выражают как средние цитотоксические концентрации (значения IC50). Исследование фолатного рецептора. Все операции по приготовлению образцов, используемых в FR исследовании, выполняют при 4 С. Образцы тканей гомогенизируют в буфере гомогенизации (10 мМ Tris, pH 8,0, по 0,02 мг/мл лейпептина и апротинина; 1 мл буфера на 50 мг ткани), используя гомогенизатор PowerGen 125. Крупный дебрис удаляют с помощью легкого центрифугирования (3000 g в течение 15 мин). Осадки мембран затем собирают путем центрифугирования при 40,000 g в течение 60 мин и ресуспендируют в буфере солюбилизации (50 мМ Tris, pH 7,4, 150 мМ NaCl, 25 мМ н-октилD-глюкопиранозид, 5 мМ EDTA и 0,02% азида натрия). Нерастворимое вещество удаляют с помощью второго центрифугирования 40,000 g в течение 60 мин и общую концентрацию белка надосадочной фракции определяют с помощью метода с бицинхониновой кислотой (ВСА) (Pierce Chemical). Каждый образец затем разбавляют до 0,25 мг/мл в буфере солюбилизации и 100 мкл помещают внутрь каждого из двух микроконцентраторов Microcon-30 (30,000-MW cutoff, Millipore). Образцы затем центрифугируют при 14,000 g в течение 10 мин при комнатной температуре для прохождения всей жидкости через мембрану, так же как и для задержки солюбилизированных FR на поверхности мембраны микроконцентратора. Все последующие этапы центрифугирования выполняют, используя те же параметры. Затем 55 мкл 30 мМ ацетатного буфера (рН 3,0) добавляют в каждый микроконцентратор,после чего выполняют этап центрифугирования. Затем 55 мкл забуференного фосфатом физиологического раствора (PBS) распределяют в каждый микроконцентратор, после чего проводят еще одно центрифугирование. Затем 50 мкл реактива, связывающего [3 Н]фолиевую кислоту (120 нМKCl и 25 мМ н-октилD-глюкопиранозид) или 50 мкл конкурирующего реактива (связывающий реактив и 120 нМ немеченой фолиевой кислоты) добавляют в соответствующие концентраторы. После этого проводят 20-минутную инкубацию при комнатной температуре, концентраторы отмывают/центрифугируют три раза 75 мкл 50 нМ н-октилD-глюкопиранозида, 0,7 М NaCl в PBS, рН 7,4. После последнего отмывания концентрат, содержащий солюбилизированные FR, возвращают с мембранной поверхности микроконцентраторов путем двукратного орошения 100 мкл PBS, содержащего 4% Triton Х-100. Образцы затем считывают в жидкостном сцинтилляционном счетчике(Packard Bioscience). Значения чисел импульсов в минуту (cpm) конвертируют в пикомоли FR, основываясь на cpm известного стандарта, и конечные результаты нормализуют относительно содержания белка в образце. Животные и опухоли. Самок мышей CD2F1 (Harlan Sprague-Dawley Inc., 20-22 г), содержащихся в контролируемой среде с обеспечением неограниченного доступа к воде и пище, использовали в этих исследованиях. Мышиный рак легкого FR(-) Madison 109 (M109) lung carcinoma (Marks et al., 1977) и FR-экспрессирующий (FR(+ 98M109 вариант были использованы для оценки эффективности эпотилона,аналога эпотилона (например, производного эпотилона), конъюгата фолат-эпотилон или конъюгата фолат-аналог эпотилона. Кроме того, эпидермоидный рак головы и шеи человека KB, выращенный в голых мышах, был также использован для этой цели. Лекарственное лечение и оценка противоопухолевой эффективности Для введения аналогов эпотилона мышам используется наполнитель, состоящий из следующего: CREMOPHOR/этанол/вода (1:1:8, по объему). Соединения были сначала растворены в смесиCREMOPHOR/этанол (50:50). Конечное разбавление до требуемой концентрации производят менее чем за 1 ч до введения лекарственного препарата. Мышам вводят агенты посредством болюсной- 14014872 внутривенной инъекции в хвостовую вену. Конъюгаты фолат-аналог эпотилона готовят в стерильном забуференном фосфатом физиологическом растворе и вводят мышам посредством болюсной внутривенной инъекции в хвостовую вену в объеме 0,01 мл/г массы мыши. Лечение каждого животного основано на индивидуальной массе тела. Требуемое число животных, необходимое для выявления значимого ответа, собирают в начале эксперимента и каждому подкожно вводят взвесь опухолевых клеток (2% мас./об.). Опухоли выращивают в течение 4 дней. На четвертый день животных равномерно распределяют в различные группы лечения и контроля. Пролеченных животных ежедневно проверяют на связанную с лечением токсичность/смертность. Животных каждой группы взвешивают перед началом лечения (Wt1) и затем повторно после последней лечебной дозы (Wt2). Разница в массе тела (Wt2-Wt1) обеспечивает измерение связанной с лечением токсичности. Ответ опухоли определяют путем измерения опухолей штангенциркулем дважды в неделю, пока опухоли не достигают заранее определенного "целевого" размера 1 gm. Массу опухоли (мг) оценивали по формуле масса опухоли = (длинаширина 2) - 2. Противоопухолевую активность оценивали по отношению к максимально переносимой дозе (MTD),которая определяется как уровень дозы непосредственно ниже вызывающей избыточную токсичность (т.е. более чем одну смерть). Когда происходила смерть, день гибели записывали. Гибель пролеченных мышей до достижения опухолью целевого размера рассматривалась как гибель от лекарственной токсичности. Ни одна из контрольных мышей не погибла, имея опухоль размером меньше целевого. Группы лечения с более чем одной гибелью, вызванной лекарственной токсичностью, рассматривались как имеющие избыточную токсичность, и их данные не были включены в оценку противоопухолевой эффективности соединения. Конечная точка ответа опухоли была выражена в терминах задержки опухолевого роста (Т-С параметр), определяемой как разница во времени (сутки), требуемого для пролеченных опухолей (Т), чтобы достичь предварительно определенного целевого размера, по сравнению с таковым в контрольной группе(С). Для оценки доли погибших клеток сначала подсчитывают время удвоения объема опухоли (TVDT) с помощью формулыTVDT = среднее время (сутки) достижения контрольными опухолями целевого размера - среднее время (сутки) достижения контрольными опухолями половины целевого размера и порядок доли погибших клеток = Т-С - (3,32 TVDT). Статистическая оценка данных выполнялась с помощью теста Уилкоксона, обобщенного Гэханом. Сокращения Следующие сокращения используются в схемах и примерах в настоящем изобретении для простоты ссылки:CBZ-OSu - N-(бензилоксикарбонилокси)сукцинимид,DCM - дихлорметан,DEA - диэтиламин,DIAD - диизопропилазодикарбоксилат,DIPEA - диизопропилэтиламин,DMA - диметиламин,ДМФА - диметилформамид,DMSO - диметилсульфоксид,EDC - гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида,EtOH - этанол,EtOAc - этилацетат,FR - фолатный рецептор,HOBt - н-гидроксибензотриазол,HPCL - высокоэффективная жидкостная хроматография,iPr-OH или IPA - изопропиловый спирт,LC/MS - жидкостная хроматография/масс-спектр,LDA - диизопропиламид лития МеОН - метанол,OTES - о-триэтилсилил,OMS - мезилат,Ph - фенил,Pd/C - палладий на угле,РуВОР - бензотриазол-1-ил-окситрипирролидинофосфония гексафторфосфат,Ру - пиридил,RT - комнатная температура,- 15014872Sat'd - насыщенный,ТГФ - тетрагидрофуран,TFA - трифторуксусная кислота,ТСХ - тонкослойная хроматография,TESCL - хлортриэтилсилан,UV - ультрафиолет. Способы получения Соединение по настоящему изобретению может в целом быть получено в соответствии со следующими схемами и умением среднего специалиста и/или используя способы, представленные в US 6605599; 6831090; 6800653; 6291684; 6719540; 7172884, US 2005/0002942 и Organic Letters, 2001, 3,2693-2696, раскрытие которых в настоящем изобретении включено как ссылка и/или в последующих примерах. Как показано на схеме 1, соединение формулы G (X) может быть получено из соединения формулы II. Соединение формулы II может быть получено путем ферментации (см., например,Gerth et al. "Studies on the Biosynthesis of Epothilones: The Biosynthetic Origin of the Carbon Skeleton",Journal of Antibiotics, vol. 53, No. 12 (Dec. 2000) и Hofle et al. "Epothilone A and B- Novel 16Membered Macrolides: Isolation, Crystal Structure, and Conformation in Solution", Angew. Chem. Int. Ed.Engl., vol. 35, No. 13/14, 1567-1569 (1996), раскрытие которых здесь включено как ссылка) или с помощью синтеза (см., например, Vite et al. US 6605599; 6242469; 6867333 и 2006/004065 и Johnson etal. Organic Letters, 2000, 2:1537-1540), раскрытие которых здесь включено как ссылка. Например,соединение формулы II, где R2, R3, R4, R5 и R12 представляют собой метил, В 1 представляет собой гидроксил, R1 и R6 представляют собой водород и R2 представляет собой 2-метилтиазол-4-ил, отнесено к эпотилону А и может быть получено из ферментации Sorangium cellulosum, как упомянуто выше. Соединение формулы II может быть превращено в соединение формулы III, где Р представляет собой силилзащитную группу, такую как триэтилсилил, трет-бутилдиметилсилил, третбутилдифенилсилил, триизопропилсилил и им подобные (см., например, Greene et al. "Protectivegroups in Organic Synthesis", John Wiley and Sons, Inc.). Например, соединение формулы III, где Р представляет собой триэтилсилил, может быть получено путем обработки соединения формулы II хлортриэтилсиланом в присутствии основания Ханига. В случае, где В 1 представляет собой гидроксил в соединении формулы II, тогда B1 также будет превращен в соответствующий силильный эфир. Галогенгидрин формулы IV (где Y представляет собой Cl, Br или I) может быть получен из соединения формулы III путем обработки металлгалоидной солью с помощью способов, известных среднему специалисту. Например, раскрытие эпоксида, используя эфират магнийбромида при низкой температуре (от -20 до -5 С) может обеспечить диастереомерные галогенгидрины, где Y представляет собой бром. Соединение формулы V может быть получено из соединения формулы IV путем замещения галогена, используя, например, азид натрия в полярном растворителе, таком как диметилформамид. Средним специалистом будет признано, что стереохимия при С 12, как изображено на схеме I, не должна толковаться как ограничение, но скорее как пример. Если желательно, инверсия стереохимии при С 12 положении может быть достигнута, следуя методике по Мицунобу, которая хорошо известна в технологии. Например, обработка соединения формулы V п-нитробензойной кислотой, диэтилазодикарбоксилатом и трифенилфосфином обеспечивает соответствующий нитробензоатный эфир, который может затем быть отщепленным путем мягкого гидролиза сложного эфира, используя, например, метанольные растворы аммония, чтобы обеспечить соединение формулы VI. С другой стороны, стереохимия для С 12, как изображено для соединения формулы VI, не является ограничением и изображена как таковая, чтобы показать, что обработка соединения формулы V, как описано, будет инвертировать стереохимию по этому положению. Альтернативно, другие органические кислоты, азодикарбоксилаты и органофосфины, могут быть использованы для осуществления инверсии по Мицунобу. Соединение формулы VII, где OG представляет собой уходящую группу, такую как мезилат, тозилат, нозилат, трифлат и им подобные, может быть получено из соединения формулы VI с помощью способов, известных среднему специалисту. Например, обработка соединения формулы VI метансульфонилхлоридом и триэтиламином в подходящем органическом растворителе, таком как дихлорметан, обеспечивает соединение формулы VII, где OG представляет собой мезилат. Соединение формулы VIII может быть получено из соединения формулы VII путем восстановления азидогруппы агентом восстановления, таким как органофосфин(например, триметилфосфин). Альтернативно, соединение формулы VIII может быть получено непосредственно из соединения формулы VI, используя органофосфиновый агент восстановления,такой как трифенилфосфин. Соединение формулы IX может быть получено из соединения формулыVIII с помощью способов, известных среднему специалисту (см., например, US 6800653 и RegueiroRen et al. Organic Letters, 2001, 3, 2693-2696). Например, соединение формулы IX, где Н-K-А- представляет собой 2-гидроксиэтил, может быть получено из соединения формулы VIII путем алкилирования азиридинового кольца, используя, например, избыток 2-бромэтанола и основания, такого как карбонат калия. Соединение формулы X может быть получено из соединения формулы IX путем- 16014872 удаления защитной группы силильного эфира, используя способы, известные среднему специалисту(см., например Greene et al. "Protective groups in Organic Synthesis", John Wiley and Sons, Inc.). Например, когда P представляет собой триэтилсилил, обработка соединения формулы IX трифторуксусной кислотой в дихлорметане приводит к снятию защиты, чтобы обеспечить соединение формулы X. Схема 1 Схема 2 показывает способ получения фолатового аналога или производного соединения формулы V и двухвалентного линкера T-Q, имеющего формулу XI, представленную ниже, который может быть использован с соединением по изобретению для получения конъюгатных молекул для целенаправленной доставки лекарственного препарата, например, как через формулу I, ранее описанную. Как показано на схеме 2, аналог фолата и двухвалентный линкер могут быть скомбинированы,используя способы, известные среднему специалисту, главным образом в случае, где V представляет собой фолиевую кислоту или аналог фолиевой кислоты, как описано, например, у Jackson et al.Advanced Drug. Delivery Rev., 56(2004) 1111-1125, раскрытие которого в настоящем изобретении включено как ссылка и T-Q представляет собой пептид. Например, пептидильный фолат XI может быть получен, как показано на схеме 2. Последовательное пептидное связывание на загруженной цистеином полистирольной смоле с Fmoc-защищенным аспаратом, аргинином, аспаратом и затем глутаматом, может быть осуществлено, используя РуВОР в виде агента связывания и пиперидин в виде агента Fmoc-снятия защиты. N10-Трифторацетамид защищенная птероевая кислота может быть получена в две стадии путем ферментативного (карбоксипептидаза G) превращения фолиевой кислоты в птероиновую кислоту с последующим N-снятием защиты, используя трифторуксусный ангидрид. Затем связывание N10-защищенной птероиновой кислоты с нанесенным на смолу пептидом с последующим снятием со смолы трифторуксусной кислотой и удаление N10-трифторацетильной группы, используя гидроксид аммония, обеспечивает V-T-Q фрагмент соединения формулы I, где V представляет собой фолиевую кислоту и T-Q представляет собой -Asp-Arg-Asp-Cys-OH. Альтернативно, аналоги птероиновой кислоты могут быть использованы вместо птероиновой кислоты и другие аминокислоты могут быть использованы вместо тех, которые представлены на схеме 2. Схема 3, ниже, показывает способ для использования эпотилон-производного настоящего изобретения для получения конъюгатной молекулы формулы I для использования для целенаправленной доставки лекарственного препарата. Как показано на схеме 3, сборка соединения формулы I может быть достигнута путем связывания соединения формулы X с фрагментом V-T-Q путем пошагового введения высвобождающегося линкера М. В качестве иллюстрации соединение формулы X,где -A-K-H представляет собой -СН 2 СН 2 ОН, может быть превращено в дисульфанилэтилкарбонатXIII, используя активированное бензотриазольное соединение формулы XII. Соединение формулыXII может быть получено из меркаптоэтанола, метоксикарбонилсульфенилхлорида и необязательно замещенного 2-меркаптопиридина, чтобы обеспечить промежуточный 2-(2-пиридин-2-ил)дисульфанил)этанол, который может затем быть превращен в соединение формулы XII путем обработки дифосгеном и необязательно замещенным 1-гидроксибензотриазолом. Последующий дисульфидный обмен с пептидильным фолатом, таким как соединение формулы XI, обеспечивает соединение формулы I, где V представляет собой фолиевую кислоту, T-Q представляет собой -Asp-Arg-AspCys-ОН, М представляет собой -SCH2CH2O(C=О)-, А представляет собой -СН 2 СН 2- и K представляет собой О. Схема 3 Схема 4 демонстрирует альтернативной способ получения соединения формулы X из соединения формулы XIV (см. заявку US 60/940088, зарегистрированную 25 мая 2006 года, включенную в настоящее изобретение в своей полноте как ссылка). Соединения формулы XIV могут быть получе- 18014872 ны с помощью способов, хорошо известных среднему специалисту, например путем ферментацииChem. Int. Ed. Engl., vol. 35, No. 13/14, 1567-1569 (1996), раскрытие которых в настоящем изобретении включено как ссылка) или с помощью общего синтеза (см., например, Vite et al. US 6605599; 6242469; 6867333 и заявку US 2006/004065, раскрытие которых в настоящем изобретении включено как ссылка в ее полноте). Например, соединение формулы XIV, где R2, R3, R4, R5 и R12 представляют собой метил, B1 представляет собой гидроксил, R1 и R6 представляют собой водород и R2 представляет собой 2-метилтиазол-4-ил, отнесено к эпотилону С и может быть получено из ферментацииSorangium cellulosum, как упомянуто выше. Соединение формулы XIV может быть превращено в соединение формулы XV, где Р представляет собой силилзащитную группу, такую как триэтилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, триизопропилсилил и им подобные (см.,например, Greene et al. "Protective groups in Organic Synthesis", John Wiley and Sons, Inc.). Например,соединение формулы XV, где Р представляет собой триэтилсилил, может быть получено путем обработки соединения формулы XIV хлортриэтилсиланом в присутствии основания, такого как основание Ханига. В случае, где B1 представляет собой гидроксил в соединении формулы XIV, тогда В 1 также будет превращен в соответствующий силильный эфир. Галогенгидрин формулы XVI илиXVII (где Y представляет собой Cl, Br или I) может быть получен из соединения формулы XV путем обработки галогенирующим агентом, таким как Y2. Например, электрофильное присоединение в полярных растворителях, таких как ацетонитрил, используя йод, может стереоселективно обеспечить региоизомерные галогенгидрины формул XVI и XVII, где Y представляет собой йод. Альтернативно, N-галогенсукцинимиды могут также быть использованы для идентичного преобразования. Соединение формулы XVIII может быть получено из соединений формул XVI и/или XVII путем закрытия эпоксидного кольца в присутствии оснований, таких как триэтиламин или основание Ханига в полярной/водной системе растворителей, такой как ацетонитрил/вода. Если желательно, соединение формулы XIV может быть непосредственно превращено в соединения формулы XVI и/илиXVII (где Р представляет собой Н), которые могут затем быть превращены в эпоксид XVIII (где Р представляет собой Н). Соединение формулы XVIII может быть превращено в азидоспирты формулVI и XIX путем азидного замещения в присутствии неорганических азидных солей или тетраалкиламмоний азидов в спиртовых растворителях. В случае, когда Р представляет собой силилзащитную группу, соединения формул XX и/или XXI, где OG представляет собой уходящую группу,такую как мезилат, тозилат, нозилат, трифлат и им подобные, могут быть получены из соединений формул VI и/или XIX с помощью способов, известных среднему специалисту. Например, обработка соединения формулы VI и/или XIX метансульфонилхлоридом и триэтиламином в подходящем органическом растворителе, таком как дихлорметан, обеспечивает соединения формул XX и XXI, гдеOG представляет собой мезилат. Соединение формулы VIII может быть получено из соединений формул XX и/или XXI путем восстановления азидогруппы через способы, известные среднему специалисту. Например, соединение VIII может быть получено из соединений формул XX и/или XXI через реакцию с агентом восстановления, таким как органофосфин (например, триметилфосфин) в полярных растворителях, таких как ацетонитрил. Альтернативно, когда Р представляет собой Н,соединение формулы VIII может быть непосредственно получено из соединений формул VI и/илиXIX путем восстановления азидогруппы агентом восстановления, таким как органофосфин (например, трифенилфосфин) в полярных растворителях, таких как ацетонитрил. Соединение формулы IX может быть получено из соединения формулы VIII с помощью способов, известных среднему специалисту (см., например, US 6800653 и Regueiro-Ren et al. Organic Letters, 2001, 3, 2693-2696). Например, соединение формулы IX, где Н-K-А- представляет собой 2-гидроксиэтил, может быть получено из соединения формулы VIII путем алкилирования азиридинового кольца, используя, например, избыток 2-бромэтанола и основания, такого как карбонат калия. В случае, когда Р представляет собой триалкилсилил, соединение формулы X может быть получено из соединения формулы IX путем удаления защитной группы силилового эфира, используя способы, известные среднему специалисту (см., например, Greene et al. "Protective groups in Organic Synthesis", John Wiley and Sons,Inc.). Например, когда Р представляет собой триэтилсилил, обработка соединения формулы IX трифторуксусной кислотой в дихлорметане приводит к снятию защиты, чтобы обеспечить соединение формулы X. Далее изобретение будет описано со ссылкой на следующие иллюстративные примеры. Примеры Пример 1. Как описано в подробном описании выше, аналоги и производные фолата описаны в Vlahov. В исследованиях и разработках, направленных на нацеливание фолатного рецептора конъюгированных эпотилонов и аналогов эпотилонов опухолевой клетки, несколько соединений были конъюгированы с фолатом. Другие аналоги эпотилона, например азиридинил-эпотилоны, известны в данной области (см.,например, US 6399638; Regueiro-Ren A. et al. (2001) Org. Letters. 3:2693-96) и демонстрируют мощную противоопухолевую цитотоксичность. Например, было проведено MTS исследование, в котором сравнивалась относительная цитотоксическая мощность ряда аналогов эпотилона в отношении двух резистентных к таксану линий опухолевых клеток (HCTVM46 и А 2790 Тах) (см. табл. 1).HCTVM46 является клеточной линией рака толстой кишки человека, полученной из чувствительной НСТ 116 исходной линии, является резистентной к таксанам за счет сверхэкспрессии транспортера лекарственных средств 170-кДа р-гликопротеина. А 2780 Тах является клеточной линией рака яичников человека, производной от исходной линии А 2780, и является резистентной к паклитакселу из-за- 20014872 мутации в аминокислотной последовательности тубулина, которая нарушает способность паклитаксела связываться. Как показано в табл. 1, различные аналоги азиридинил-эпотилона (соединения СС-ЕЕ) демонстрируют мощную противоопухолевую активность в отношении клеточных линий как рака толстой кишки НСТ 116, так и рака яичников А 2780, по сравнению с другими известными противоопухолевыми агентами, например паклитакселом, соединением АА и эпотилоном В. Таблица 1 Средняя IC50SD подсчитывается по четырем отдельным экспериментам. 2 Несмотря на противоопухолевую активность соединений азиридинил-эпотилона СС-ЕЕ, гидроксильные группы этих молекул, способные к конъюгированию с фолатом, находятся у С 3 и С 7 атомов углерода. Соответственно, после поиска ряда соединений и аналогов эпотилонов остается необходимость открыть соединение, которое будет легкодоступно для конъюгирования с фолатом и которое будет демонстрировать активность через специфическое высвобождение активной функциональной группы эпотилона в опухолевых клетках. Открыто соединение G азиридинил-эпотилон, имеющее формулу Соединение G (см. примеры 2 и 3) неожиданно легко конъюгируется с фолиевой кислотой, образуя соединение J (см. пример 2) с относительным сродством 0,77 к фолатному рецептору по сравнению с фолиевой кислотой. Неожиданно полярная гидроксильная группа боковой цепи азиридина не воздействует нежелательно на противоопухолевую активность азиридиновых аналогов эпотилона. Это важно, поскольку существует аналог азиридинового эпотилона, например соединение G, которое опосредует противоопухолевые эффекты через высвобождение из фолиевой кислоты. Эффективность соединения G и трех других высокоэффективных аналогов эпотилона (иксабепилон, соединение АА и соединениеBB) была оценена посредством исследования образования колоний, которое описано выше. Концентрация, необходимая для уничтожения 90% клоногенных клеток рака KB (IC90), была определена после экспозиции лекарственного препарата в течение 17 ч. Как показано на фиг. 1, соединение G демонстрирует IC90 4,3 нМ, и было примерно в 2, 4 и 16 раз более эффективным, чем соединение СС, соединение АА и иксабепилон соответственно. Конъюгирование соединения G до образования соединения J не нарушало противоопухолевую активность соединения G. Соединение J демонстрировало существенную цитотоксическую активность в отношении опухолевых клеток in vivo. Дальнейшее доказательство опосредованного через FR механизма доставки лекарственного средства соединения J основано на наблюдении, что совместное введение аналога фолата в 20-кратном избытке дозы соединения J может существенно конкурировать с соединением J за связывание рецептора и защищать FR(+) 98M109 опухоли от противоопухолевых эффектов соединения J(фиг. 2). Поскольку соединение G и конъюгат (соединение J) имеют неожиданные противоопухолевые эффекты как in vitro, так и in vivo, и поскольку противоопухолевая активность соединения J может быть приписана FR(+)-опосредованным эффектам, также описанным здесь, является конъюгация азиридинил-эпотилона аналога соединения G (см. примеры 2 и 3) до образования соединения J (см. пример 2). Пример 2. Получение соединения J. К перемешиваемому раствору эпотилона А (5,0 г, 10,1 ммоль), имидазола (3,40 г, 49,9 ммоль) иDIPEA (28,5 мл, 163,6 ммоль) в безводном ДМФА (100 мл) в атмосфере N2 добавляют триэтилсилилхлорид (15,0 мл, 89,4 ммоль). После завершения добавления реакционный раствор нагревают при температуре 55 С (температура масляной бани) в течение 12 ч для получения по хроматограмме единственного пятна (тжх) желаемого продукта. Указанную выше реакцию повторяют в течение более двух раз. ДМФА объединенного раствора отгоняют в высоком вакууме. Пенистый остаток очищают с помощью колоночной хроматографии (силикагель, Е. Merck, 230-400 меш, 600 г; смесь 5:95, 10:90 и 15:85 EtOAc/гексаны) для получения 19.4 г (88,6%) соединения А в виде твердого вещества белого цвета. ВЭЖХ: ES Industries FluoroSep RP Phenyl, 4,6250 мм, изократическое, 30 мин, 100%В (В = 90% МеОН/Н 2 О + 0,2% Н 3 РО 4), скорость потока при 1,0 мл/мин, УФ 254, t = 23,15 мин. LC/MS- 22014872 К перемешиваемому раствору [1S-[1R,3R(E),7R,10S,11R,12R,16S-8,8,10,12-тетраметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-7,11-бис-[(триэтилсилил)окси]-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона (5,0 г, 6,92 ммоль) в безводном дихлорметане (140 мл) при температуре -20 С в атмосфере N2 добавляют MgBr2-Et2O (32,13 г, 24,78 ммоль) тремя порциями через каждые два часа, пока значение внутренней температуры поддерживается ниже -5 С. Через приблизительно 7 ч реакционную смесь разбавляют дихлорметаном и промывают насыщенным растворомNaHCO3 (2), сушат над безводным Na2SO4 и упаривают в вакууме для получения пены. Остаток очищают с помощью колоночной хроматографии (силикагель, Е. Merck, 230-400 меш, 180 г; смесь 5:95, 7,5:92,5 и 12,5:87,5 EtOAc/гексаны) для получения соединения В (2.5 г, 45% выход) в виде пены белого цвета вместе с регенерированным исходным продуктом (0,9 г, 18%). ВЭЖХ: ES Industries FluoroSep RP Phenyl, 4,6250 мм, изократическое, 30 мин, 100%В (В = 90% МеОН/Н 2 О + 0,2% Н 3 РО 4), скорость потока при 1,0 мл/мин, УФ 254, t = 14,37 мин (100% чистота) LC/MS (ES+): 802 (М+Н). С. Получение [4S-[4R,7S,8R,9R,13S,14R,16R(Е)-14-азидо-13-гидрокси-5,5,7,9-тетраметил-16-[1-метил-2-(2-метил-4-тиазолил)этенил]-4,8-бис-[(триэтилсилил)окси]-1-оксациклогексадекан-2,6-диона. К раствору [4S-[4R,7S,8R,9R,13S,14S,16R(E)-14-бром-13-гидрокси-5,5,7,9-тетраметил-16-[1-метил-2-(2-метил-4-тиазолил)этенил]-4,8-бис-[(триэтилсилил)окси]-1-оксациклогексадекан-2,6-диона (9,9 г, 12,3 ммоль) в 1,2 л ДМФА добавляют азид натрия (8,01 г, 123,3 ммоль) и 18 краун-6-эфир (3,26 г, 12,3 ммоль) при комнатной температуре в атмосфере N2. Прозрачный раствор перемешивают механически при комнатной температуре в течение 7 дней. Раствор разбавляютEtOAc (4 л) и промывают Н 2 О (63 л). Органический слой сушат (Na2SO4) и затем упаривают для получения 9,2 г сырого продукта. Колоночная хроматография (силикагель 450 г, 5 - 15% смесьEtOAc/гексан) дает 6,7 г (71% выход) соединения С в виде пены белого цвета. ВЭЖХ: YMC ODS-A S5, 4,650 мм, изократическое, 30 мин, 100%В (В = 90% МеОН/Н 2 О + 0,2% Н 3 РО 4), скорость потока при 4,0 мл/мин, УФ 254 нм, t = 2,00 мин. LC/MS (ES+) 765 (М+Н).(7,0 г, 9,15 ммоль), 4-нитробензойную кислоту (3,82 г, 22,9 ммоль) и трифенилфосфин (6,0 г,22,9 ммоль) растворяют в ТГФ (100 мл). Добавляют диэтилазодикарбоксилат (9,0 мл 40% раствор в толуоле, 22,9 ммоль) в течение более 5 мин. Температуру реакционной смеси поддерживают при комнатной в течение 4 ч, концентрируют и очищают с помощью хроматографии на силикагеле (ступенчатый градиент от 5% смеси этилацетат/гексаны до 15% смеси этилацетат/гексаны), чтобы выделить нитробензоатный эфир в виде пены белого цвета (7,3 г, 87%).LC-MS: Phenomenex C18, 4.650 мм, изократическое, 15 мин, 100%В (В = 90% МеОН/Н 2 О + 0,1% TFA), скорость потока при 4,0 мл/мин, УФ 220 нм. Время задержки = 8,9 мин. MS (ESI) M+H = 886,7. Нитробензоатный эфир соединения D (7,3 г, 7,98 ммоль) растворяют в этилацетате (35 мл) и охлаждают до температуры 0 С. Добавляют аммиак в метаноле (350 мл 2 М раствор в метаноле) и реакционную смесь перемешивают при комнатной температуре в течение 4 ч, концентрируют и очищают с помощью хроматографии на силикагеле (ступенчатый градиент от 10% смеси этилацетат/гексаны до 30% смеси этилацетат/гексаны), чтобы выделить [4S-[4R,7S,8R,9R,13R,14R,16R(E)-14-азидо 13-гидрокси-5,5,7,9-тетраметил-16-[1-метил-2-(2-метил-4-тиазолил)этенил]-4,8-бис-[(триэтилсилил)окси]-1-оксациклогексадекан-2,6-дион в виде стекловидного твердого вещества белого цвета (5,97 г, 98%).LC-MS: Phenomenex С 18, 4,650 мм, изократическое, 5 мин, 100%В (В = 90% МеОН/Н 2 О + 0,1% TFA), скорость потока при 4,0 мл/мин, УФ 220 нм. Время задержки - 2,25 мин. MS (ESI) M+H(5,97 г, 7,8 ммоль) и триэтиламин (4,34 мл, 31,2 ммоль) растворяют в дихлорметане (85 мл) и охлаждают до температуры 0 С. Добавляют по каплям метансульфонилхлорид (1,8 мл, 23,4 ммоль) в течение более 5 мин. Через 10 мин реакционную смесь удаляют из бани со льдом и перемешивают при комнатной температуре. Еще через 3 ч реакционную смесь переносят в насыщенный растворNaHCO3 (300 мл), экстрагируют дихлорметаном (3100 мл), сушат над Na2SO4, концентрируют и переносят на следующую стадию без дополнительной очистки. Сырой метансульфонатный эфир растворяют в ТГФ/Н 2 О (12:1, 130 мл). Добавляют триэтиламин (2,2 мл, 16 ммоль) и триметилфосфин (16 ммоль, 16 мл 1,0 М раствора в ТГФ) и реакционную смесь перемешивают при комнатной температуре. Через 3 ч реакционную смесь нагревают при температуре 45 С в течение 7 ч, концентрируют и очищают с помощью хроматографии на силикагеле (ступенчатый градиент от 2% смеси метанол/хлороформ до 5% смеси метанол/хлороформ),чтобы выделить соединение F в виде твердого вещества белого цвета (5,08 г, 88% в течение двух стадий).LC-MS: Phenomenex C18, 4,650 мм, изократическое, 5 мин, 100%В (В=90% МеОН/Н 2 О + 0,1% TFA), скорость потока при 4,0 мл/мин, УФ 220 нм. Время задержки = 0,298 мин. MS (ESI)(1,05 г,1,46 ммоль) в ацетонитриле (20 мл) и нагревают до температуры 82 С. Через 4 ч добавляют дополнительное количество 2-бромэтанола (0,52 мл, 7,3 ммоль) и K2CO3 (1.4 г, 10.2 ммоль). Через 5 ч добавляют дополнительное количество 2-бромэтанола (0,21 мл, 2,92 ммоль). Через 3 ч реакционную смесь охлаждают до комнатной температуры, фильтруют через целит, промывают ацетонитрилом (55 мл), дихлорметаном (25 мл), концентрируют и переносят на следующую стадию без дополнительной очистки. Сырой реакционный продукт растворяют в дихлорметане (40 мл), охлажденном до температуры 0 С и добавляют трифторуксусную кислоту (8,0 мл). Через час реакционную смесь концентрируют, переносят в насыщенный раствор NaHCO3 (200 мл), экстрагируют дихлорметаном (3100 мл), сушат над Na2SO4, концентрируют и очищают с помощью хроматографии на силикагелеLC-MS: Waters Sunfire C18, 4,650 мм, градиент от 0 до 100%В в течение более 4 мин (А = 10% МеОН/Н 2 О + 0,1% TFA; В = 90% МеОН/Н 2 О + 0,1% TFA), скорость потока при 4,0 мл/мин, УФ 220 нм. Время задержки = 2,12 мин. MS (ESI) M+H = 537,52.(S)-2-(4-2-Амино-4-оксо-3,4-дигидроптеридин-6-ил)метиламино)бензамидо)-5-S)-3-карбокси-1-S)-1-S)-3-карбокси-1-S)-1-карбокси-2-меркаптоэтиламино)-1-оксопропан-2-иламино)-5 гуанидино-1-оксопентан-2-иламино)-1-оксопропан-2-иламино)-5-оксопентановую кислоту синтезируют с помощью твердофазного пептидного синтеза в пять стадий на основе Н-цис-(4 метокситритил)-2-хлортритил-смолы. Табл. 2 показывает количество реагентов, использованных в синтезе.Fmoc защиту проводят путем обработки 20% пиперидином в ДМФА, 2 (10 мин), перед каждым аминокислотным связыванием. Указанную последовательность повторяют в течение каждой стадии аминокислотного связывания.- 25014872 Синтез N10-TFA-защищенной птероиновой кислоты. К 10 л 0,1 М трис-основного раствора (121,1 г трис-основания в 10 л воды) в механически перемешиваемой круглодонной колбе объемом 22 л, оборудованной нагревательным кожухом, добавляют 200 г (0,453 моль) фолиевой кислоты. Смесь перемешивают, чтобы растворить фолиевую кислоту и затем добавляют 500 мг (3,67 ммоль) хлорида цинка. Добавляют карбоксипептидазу G (1320 одноразовых расфасовок, доступных от Sigma) и значение рН доводят до 7,3 с помощью 1 N HCl и поддерживают на протяжении всей реакции. Смесь защищают от света и нагревают при температуре 30 С в течение 8-10 дней (используют автотитратор, чтобы удерживать значение понижающейся константы рН во время превращения 4-5 дня). Контролирование реакции осуществляют с помощью аналитической ВЭЖХ, пока не будет достигнуто 80% превращение (дальнейшее превращение желательно, но не оптимизировано). Продукт высаживают из реакционной смеси путем доведения значения рН раствора до 3,0, используя 6 N HCl. Суспензию переносят в центрифужную пробирку и центрифугируют при 4000 об/мин в течение 10 мин. Супернатант декантируют. Влажное твердое вещество затем непосредственно очищают следующим образом (влажное твердое вещество может быть заморожено в течение хранения или сначала высушено сублимацией; однако хранение влажных твердых частиц в морозильнике до растворения было более эффективным). К 40 г сырой птероиновой кислоты в 700 мл воды добавляют 1,0 М NaOH, пока значение рН не станет равным 11,5. Смесь фильтруют (Whatman type 1) и затем хроматографируют (колонка: 10120 см; стационарная фаза: 8 кг DEAE целлюлозы; мобильная фаза: 1,0 М NaCl/0,01 М NaOH, pH 11,5; скорость потока: 17 мл/мин). Один литр фракций, окрашенных в желтый цвет, собирают и анализируют с помощью ВЭЖХ. Значение рН фракций, содержащих чистую птероиновую кислоту, доводят до 3 с помощью 6 М HCl в течение выпадения в осадок птероиновой кислоты. Смесь центрифугируют при 3000 об/мин в течение 20 мин. Супернатант деканируют и промывают водой (3). Твердое вещество сушат сублимацией в течение по крайней мере 72 ч. Влияние оставшейся воды на следующую стадию неизвестно. Птероиновую кислоту затем сушат над Р 2 О 5 в высоком вакууме в течение более 24 ч (следует отметить, что аналогичные результаты в стадии установления защиты получают без указанной дополнительной стадии высушивания). Затем добавляют 100 г (0,32 моль) птероиновой кислоты в круглодонную колбу объемом 5 л, оборудованную механической мешалкой и вводом аргона, и сохраняют в высоком вакууме в течение ночи. Добавляют газообразный аргон, а затем 3500 г(2316 мл) трифторуксусного ангидрида. Колбу герметизируют с помощью резиновой пробки или адаптера ввода аргона и затем содержимое энергично перемешивают. Колбу защищают от света и содержимое перемешивают при комнатной температуре в атмосфере аргона в течение 7 дней (контролирование реакции осуществляют с помощью ВЭЖХ аликвот, разбавленных 20 каждую водой и ДМСО). Смесь упаривают досуха на роторе и обрабатывают 2,5 л 3% раствором трифторуксусной кислоты в воде. Смесь перемешивают в течение ночи при комнатной температуре для гидролиза побочных ангидридов. Упаривание на роторе дает сухое твердое вещество. Твердое вещество суспендируют в 2 л воды и затем центрифугируют в центрифужной колбе объемом 250 мл при 3000 об/мин в течение 20 мин. Супернатант удаляют и твердое вещество промывают водой и центрифугируют (4 раза). Твердое вещество сушат сублимацией в течение 3 дней, переносят в желтого цвета колбы и сушат в высоком вакууме в присутствии Р 2 О 5 в течение 2 дней (чистота 95%; оставшуюсяTFA определяют с помощью элементарного анализа). Стадия отщепления. Защищенное промежуточное соединение выделяют из смолы, используя реагент отщепления,полученный из 92,5% (50 мл) TFA, 2,5% (1,34 мл) Н 2 О, 2,5% (1,34 мл) триизопропилсилана и 2,5%(1,34 мл) этандитиола. Реагент отщепления добавляют в реакционную колбу (25 мл). Аргон пробулькивают через смесь в течение 1,5 ч. Жидкость дренируют из колбы и смолу промывают оставшимся реагентом (38 мл). Летучие вещества концентрируют путем роторного упаривания до объема 10 мл. Добавляют диэтиловый эфир (35,0 мл) для стилизирования высаживания. Твердое вещество собирают центрифугированием и сушат для получения 1,25 г отделенного продукта. Стадия снятия защиты.N10-трифторацетильную защитную группу в порции птероиновой кислоты удаляют в основных условиях. Исходя из 250 мг защищенного промежуточного соединения в 10 мл воды, значение рН доводят до 9,3 и поддерживают в течение часа, используя смесь 4:1 Н 2 О:гидроксид аммония(1-2 мл). Через час значение рН доводят до 5 с помощью 1 N HCl (1 мл) и продукт очищают препаративной ВЭЖХ, чтобы получить 125 мг соединения Н. ВЭЖХ условия очистки. Колонка: Waters NovaPak C18 30019 мм. Растворитель А: буфер 10 мМ, ацетат аммония, рН 5. Растворитель В: ацетонитрил.- 26014872 Элюирование: от 1 до 20%В в течение 40 мин при 15 мл/мин. Общий выход из объединенных реакций: 625 мг. К раствору метоксикарбонилсульфенилхлорида (10 мл, 110 ммоль) в дихлорметане (100 мл),охлажденному до температуры 0 С, добавляют по каплям меркаптоэтанол (7,6 мл, 110 ммоль). Реакционной смеси дают возможность перемешиваться при температуре 0 С в течение 30 мин. После указанного периода добавляют раствор 2-меркаптопиридина (12,2 г, 110 ммоль) в дихлорметане(160 мл). Раствору дают возможность взаимодействовать при температуре 0 С в течение часа и затем дают возможность нагреться до комнатной температуры еще в течение часа. Наблюдают твердый продукт, который выпадает из раствора. ТСХ (смесь 1:1 петролейный эфир/EtOAc) показывает,что образуется значительное количество продукта. Реакционную смесь концентрируют до объема 125 мл. Смесь фильтруют через воронку Бюхнера. Фильтровальную лепешку промывают дихлорметаном и затем сушат под вакуумом в течение ночи, чтобы получить 2-(2-(пиридин-2-ил)дисульфанил)этанол (23,6 г), в виде HCl соли. Раствор дифосгена (2,28 г, 11,5 ммоль) в 15 мл безводном дихлорметане перемешивают в атмосфере аргона в круглодонной колбе и охлаждают на бане соли со льдом. Делительную воронку со смесью 2-(пиридин-2-илдисульфанил)этанола (5,01 г, 22,4 ммоль) и триэтиламина (2,25 г,22,2 ммоль) в 65 мл безводном дихлорметане помещают на круглодонную колбу. Смесь добавляют по каплям в течение более 20 мин. Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают еще в течение часа. ТСХ анализ реакционной смеси показывает, что исходный продукт израсходован и образован "streaking" менее полярного хлорформиатного продукта, ТСХ (смесь 6:4 EtOAc:гексанами): RF исходного продукта 0,4; RF хлорформиатного продукта: 0,8. Реакционную смесь перемешивают в круглодонной колбе в атмосфере аргона и охлаждают на бане соли со льдом. Добавляют смесь 3,02 г, 22,4 ммоль HOBt и 2,23 г, 22,0 ммоль триэтиламина в 10 мл безводном дихлорметане в капельную воронку, присоединенную к круглодонной колбе. Смесь медленно добавляют в круглодонную колбу, поддерживая температуру реакционной смеси при 2 С. Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение ночи. Затем из реакционной смеси отгоняют приблизительно 27 мл дихлорметана при атмосферном давлении. Затем смеси дают возможность остыть до комнатной температуры и перемешивают в течение 2 ч. Твердые вещества собирают фильтрованием и фильтровальную лепешку промывают 20 мл дихлорметана. Твердые вещества затем сушат под вакуумом при температуре 40 С на роторном испарителе, чтобы получить 7,81 г твердого вещества грязно-белого цвета. Указанный продукт анализируют с помощью 1 Н ЯМР и определяют наличие желаемого продукта. 3. Получение 2-1S,3S,7S,10R,11S,12S,16R)-7,11-дигидрокси-8,8,10,12-тетраметил-3-Е)-1-(2 метилтиазол-4-ил)проп-1-ен-2-ил)-5,9-диоксо-4-окса-17-азабицикло[14.1.0]гептадекан-17-ил)этил-2(2-(пиридин-2-ил)дисульфанил)этилкарбоната.[1S-[1R,3R(E),7R,10S,11R,12R,16S-7,11-дигидрокси-17-[2-гидроксиэтил]- 27014872 8,8,10,12-тетраметил-3-[1-метил-2-(2-метил-4-тиазолил)этенил]-4-окса-17-азабицикло[14.1.0]гептадекан 5,9-диона в безводном дихлорметане при температуре 0 С добавляют последовательно DMAP (1.2 экв.) и бензо[d][1,2,3]триазол-1-ил-2-(2-(пиридин-2-ил)дисульфанил)этилкарбонат (1.0 экв.). Реакционную смесь перемешивают при температуре 0 С в атмосфере аргона и контролирование осуществляют с помощью ТСХ каждые 10 мин. Добавляют дополнительное количество DMAP (1,2 экв.) и при необходимости добавляют соединение I (2) (1,0 экв.), пока все соединение G не будет израсходовано. Реакционную смесь гасят МеОН (1 мл) при температуре 0 С, растворитель удаляют под вакуумом и остаток очищают с помощью хроматографии (силикагель, 2,5-5% МеОН в DCM), чтобы получить указанное в заголовке соединение в виде твердого вещества бежевого цвета. Количества соединений и рециклов представлены ниже в табл. 3. Общий выход из 2,95 г соединения G составляет 2,80 г Каждая хроматографическая очистка, как правило, дает чистый продукт вместе с некоторыми примесями (80-90% чистота) продукта. Примеси продукта объединяют с сырым продуктом из следующей группы для хроматографической очистки. Для групп 2 и 4 проводят две хроматографические очистки. К 15 мл Н 2 О (пробулькивают аргон в течение 10 мин перед использованием) добавляют (S)-2(4-2-амино-4-оксо-3,4-дигидроптеридин-6-ил)метиламино)бензамидо)-5-S)-3-карбокси-1-S)-1S)-3-карбокси-1-S)-1-карбокси-2-меркаптоэтиламино)-1-оксопропан-2-иламино)-5-гуанидино-1 оксопентан-2-иламино)-1-оксопропан-2-иламино)-5-оксопентановую кислоту (498 мг, 0,534 ммоль) в центрифужной пробирке объемом 50 мл. К указанной суспензии, пока пробулькивают аргон, добавляют по каплям насыщенный раствор NaHCO3 (пробулькивают аргон в течение 10 мин перед использованием), пока значение рН полученного раствора не достигнет 6,9. Быстро добавляют 21S,3S,7S,10R,11S,12S,16R)-7,11-дигидрокси-8,8,10,12-тетраметил-3-Е)-1-(2-метилтиазол-4 ил)проп-1-ен-2-ил)-5,9-диоксо-4-окса-17-азабицикло[14.1.0]гептадекан-17-ил)этил-2-(2-(пиридин-2 ил)дисульфанил)этилкарбонат (400 мг, 0,534 ммоль) в ТГФ и полученный гомогенный раствор пе- 28014872 ремешивают в атмосфере аргона в течение 30 мин. Развитие реакции контролируют с помощью аналитической ВЭЖХ в течение 15 мин. Пик продукта появляется через 6,4 мин в условиях аналитической ВЭЖХ. Смесь разбавляют 15 мл фосфатного буфера и ТГФ удаляют под вакуумом. Мутный раствор центрифугируют и фильтруют. Фильтрат желтого цвета разделяют на две порции и очищают с помощью препаративной ВЭЖХ. Чистые фракции (98% чистота) объединяют и подвергают лиофилизации. Хвостовые фракции (98% чистота) собирают и повторно очищают каждые 3-6 хроматографических периодов, чтобы обеспечить 700 мг указанного в заголовке соединения в виде порошка белого цвета (содержит 11,8% от веса воды и 8,7% от веса натрия и соли фосфата натрия,как определяют с помощью Karl Fischer и элементарного анализа). Параметры препаративной ВЭЖХ. Колонка: Waters Nova-Pak HR C186 мкм 30300 мм. Мобильная фаза А: 7,0 мМ буфер фосфата натрия, рН 7,2. Мобильная фаза В: ацетонитрил. Способ: 10-50%В в течение 30 мин, скорость потока: 40 мл/мин. Параметры аналитической ВЭЖХ. Колонка: Waters Symmetry С 18 3,5 мкм 4,675 мм. Мобильная фаза А: 10 мМ. Буфер ацетата триэтиламмония (ТЕАОАс), рН 7,5. Мобильная фаза В: ацетонитрил. Способ: 20-40%В в течение 10 мин, скорость потока: 1,0 мл/мин. Точная масса м/е (C67H92N16022S3). Вычислено: 1570.58907 (М+2 Н), 785.29454 (М+2 Н)2+, 523.86563 (М+3 Н)3+, 393.15118(М+4 Н)4+. Получено: (М+2 Н)2+ при 785.29100 (4,5 част. на млн.), (М+3 Н)3+ при 523.86431 (2.5 част. на млн.), (М+4 Н)4+ при 393.14996 (3.1 част. на млн.). Пример 3. Альтернативное получение соединения J. Эпотилон С (54,3 г, 113,7 ммоль) растворяют в ацетонитриле (480 мл) и воде (50 мл). Раствор охлаждают до температуры в интервале от -5 до -10 С. В реакционную смесь добавляют йод(144,3 г, 568,4 ммоль) и температуру реакционной смеси удерживают по крайней мере в течение 15 ч. Реакционную смесь гасят 15% раствором метабисульфита натрия (900 мл). Смесь экстрагируют этилацетатом (21,1 л). Органические фазы собирают и промывают последовательно насыщенным раствором бикарбоната натрия (675 мл) и насыщенным раствором хлорида натрия (675 мл). Растворители упаривают при пониженном давлении для получения сырого соединения А в виде масла желтого цвета (85,6 г). Соединение А используют в следующей реакции без дополнительной очистки. ВЭЖХ: Phenomex Luna C8 (2) 3um, 4,6150 мм, изократическое, 18 мин, 36%В, 17 мин, 56%ВACN:вода (95:5, скорость потока при 1,0 мл/мин, УФ 245. Время задержки = 22,4 мин. 3 В. Получение [1R,3S,7S,10R,11S,12S,16S]-7,11-дигидрокси-8,8,10,12-тетраметил-3-[(Е)-1-[2 метилтиазол-4-ил]проп-1-ен-2-ил]-4,17-диоксабицикло[14.1.0]гептадекан-5,9-диона.
МПК / Метки
МПК: A61K 31/427, A61K 31/396, C07D 491/04, A61P 35/00
Метки: азиридинилэпотилоновые, соединения
Код ссылки
<a href="https://eas.patents.su/30-14872-aziridinilepotilonovye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Азиридинилэпотилоновые соединения</a>
Предыдущий патент: Способ получения 4-азастероидов
Следующий патент: Производные 6-гетероарилпиридоиндолона, способ их получения и применение в терапии
Случайный патент: Способ образования моделей коллектора с использованием синтетических стратиграфических колонок