Способ получения 4-азастероидов
Формула / Реферат
1. Способ получения 4-азастероидов формулы

в которой R1 и R2независимо выбраны из группы, включающей водород, F, Cl, Br, I, C1-С6-алкил и C1-С6-алкоксигруппу, где каждый алкильный и/или алкоксильный фрагмент необязательно замещен одним или большим количеством атомов галогенов, или
R4 выбран из группы, включающей водород, (N,N-ди-C1-C6-алкиламино)метил, 2-(N,N-ди-C1-C6-алкиламино)этил, C1-С6-алкил, C1-С6-алкоксигруппу, фенил и бензил, где каждый алкильный и/или алкоксильный фрагмент необязательно замещен одним или большим количеством атомов галогенов или где каждый фенильный и/или бензильный фрагмент необязательно содержит один или большее количество заместителей, выбранных из группы, включающей NO2, F, Cl, Br, I, C1-С3-алкил, C1-C3-алкоксигруппу, диметиламиногруппу и диэтиламиногруппу, и
Q7 обозначает карбонильный атом кислорода или обозначает R7-1 и R7-2, где один из R7-1 и R7-2 обозначает водород, а другой выбран из группы, включающей водород, F, Cl, Br, I, C1-С6-алкил и C1-C6-алкоксигруппу, где каждый алкильный и/или алкоксильный фрагмент необязательно замещен одним или большим количеством атомов галогенов, или
R9 обозначает водород или F, и
Q11 обозначает карбонильный атом кислорода или обозначает R11-1 и R11-2, где один из R11-1 и R11-2 обозначает водород, а другой выбран из группы, включающей водород, цианогруппу, циано-C1-C3-алкил, ацетоксигруппу, СООН и СОО-М+, где М+ обозначает Na+, K+ или NH+4, и
R16 выбран из группы, включающей водород, цианогруппу, C1-С3-алкил, циано-C1-С3-алкил, ацетоксигруппу, СООН и СОО-М+, где М+ обозначает Na+, K+ или NH+4, и
COOR обозначает СООН или СОО-М+, где М+ обозначает Na+, K+или NH+4,
включающий следующие 3 стадии:
(i) превращение соединения формулы

в которой R1, R2, Q7, R9, Q11 и R16 являются такими, как определено выше,
с помощью галогеноформной реакции, необязательно в присутствии полярной органической добавки, в соединение формулы
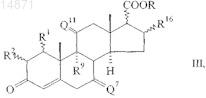
в которой R1, R2, Q7, R9, Q11, R16 и COOR являются такими, как определено выше, которое
(ii) с помощью реакции озонолиза и окислительной обработки превращают в соединение формулы
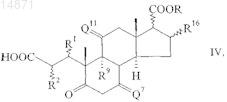
в которой R1, R2, Q7, R9, Q11, R16 и COOR являются такими, как определено выше, которое
(iii) циклизуют с азотсодержащим соединением формулы H2NR4, в которой R4 является таким, как определено выше, в соединение формулы I, в которой R1, R2, R4, Q7, R9, Q11, R16 и COOR являются такими, как определено выше.
2. Способ по п.1, в котором галогеноформная реакция является бромоформной реакцией.
3. Способ по п.1 или 2, в котором полярная органическая добавка выбрана из группы, включающей трет-бутиловый спирт, ацетонитрил и пропионитрил.
4. Способ по любому из пп.1-3, в котором стадию (ii) проводят в растворителе, выбранном из группы, включающей H2O, C1-C4-спирт, ацетонитрил, пропионитрил, метиленхлорид и хлороформ.
5. Способ по любому из пп.1-4, в котором в конце стадии (ii) после окислительной обработки к реакционной смеси для удаления пероксидов прибавляют восстановительный реагент.
6. Способ по любому из пп.1-5, в котором азотсодержащее соединение формулы H2NR4 на стадии (iii) выбрано из группы, включающей C1-C6-алкиламины, их растворимые соли, NH3, NH4Cl, NH4Br и NH4OAc.
7. Способ по любому из пп.1-6, в котором стадию (iii) проводят при температуре от 80 до 150°С, предпочтительно от 110 до 140°С.
8. Способ по пп.1-7, в котором стадию (iii) проводят в присутствии неокисляющей протонной кислоты, выбранной из группы, включающей уксусную кислоту, пропионовую кислоту, масляную кислоту, изомасляную кислоту, бензойную кислоту, HCl, HBr и HI.
9. Способ по любому из пп.1-8, в котором стадию (iii) проводят в присутствии полярной органической добавки, выбранной из группы, включающей трет-бутилметиловый эфир, C1-C4-алканолы, этиленгликоль, ацетонитрил и диметилсульфоксид.
10. Способ по любому из пп.1-9 получения 3-оксо-4-азаандрост-5-ен-17b-карбоновой кислоты формулы I при R1= R2 = R4= R7-1 = R7-2 = R9 = R11-1 = R11-2 = R16 = H и COOR = СООН (Ia), в котором стадия (ii) является бромоформной реакцией и в котором стадию (iii) проводят путем введения 17b-карбокси-5-оксо-А-нор-3,5-секоандростан-3-оевой кислоты формулы IVa или ее соли в реакцию с NH3 или растворимой солью аммония, предпочтительно с NH3 в этиленгликоле или NH4OAc в АсОН, с получением соединения Ia или его соли.
Текст
В изобретении описан способ получения 4-стероидов формулы в которой R1 и R2 независимо выбраны из группы, включающей водород, F, Cl, Br, I, C1-C6-алкил и C1-C6 алкоксигруппу, и R4 выбран из группы, включающей водород, (N,N-ди-C1-C6-алкиламино)метил, 2-(N,N-диC1-C6-алкиламино)этил, C1-C6-алкил, C1-С 6-алкоксигруппу, фенил и бензил, и Q7 обозначает карбонильный атом кислорода или обозначает R7-1 и R7-2, где один из R7-1 и R7-2 обозначают водород, а другой выбран из группы, включающей водород, F, Cl, Br, I, C1-С 6-алкил и C1-С 6-алкоксигруппу, и R9 обозначает водород илиF, и Q11 обозначают карбонильный атом кислорода или обозначает R11-1 и R11-2, где один из R11-1 и R11-2 обозначает водород, а другой выбран из группы, включающей водород, цианогруппу, циано-C1-C3-алкил, ацетоксигруппу, СООН и СОО-М+, где М+ обозначает Na+, K+ или NH+4, и R16 выбран из группы, включающей водород, цианогруппу, C1-C3-алкил, циано-C1-C3-алкил, ацетоксигруппу, СООН и СОО-М+, где М+ обозначает Na+, K+ или NH+4, и COOR обозначает СООН или СОО-М+, где М+ обозначает Na+, K+ или NH+4. Этот трехстадийный способ включает (i) галогеноформную реакцию 17-ацетилпроизводного стероида с превращением ацетильной группы в группу -COOR, (ii) последующий озонолиз кольца А и (iii) повторное замыкание кольца А по реакции с соответствующим азотсодержащим соединением формулы H2NR4 с получением соединения приведенной выше формулы I. 014871 Настоящее изобретение относится к способу получения 4-азастероидов формулы в которой R1, R2, R4, Q7, R9, Q11, R16 и COOR являются такими, как определено ниже. Трехстадийный способ включает (i) галогеноформную (с образованием тригалгенпроизводных метана) реакцию 17-ацетилстероида с превращением ацетильной группы в группу -COOR, (ii) последующий озонолиз кольца А и (iii) повторное замыкание кольца А по реакции с соответствующим азотсодержащим соединением формулы H2NR4 с получением соединения формулы I. Соединения формулы I являются ключевыми промежуточными продуктами для получения фармацевтически активных 4-азастероидов, например 17-замещенных-4-аза-5,17-андростен-3-онов, в том числе финастерида (проскар), обладающего способностью эффективно ингибировать 5-редуктазу,применимых при лечении угрей, алопеции и доброкачественной гипертрофии предстательной железы. Подробное исследование способности различных 4-азастероидов ингибировать 5-редуктазу и их получение описано в публикации Rasmusson, Gary H. et al. J. Med. Chem., 29, 1986, 2298-2315.Rasmusson, Gary H. et al. получили 17-карбокси-5-оксо-А-нор-3,5-секоандростан-3-оевую кислоту с выходом около 75% путем окисления 3-оксо-4-андростен-17-карбоновой кислоты с помощью дорогостоящих окислительных реагентов, таких как NaIO4 и KMnO4. В WO 90/15045 описан способ, в котором кольцо А и ненасыщенную ацильную боковую цепь стероида подвергают озонолизу одновременно. Недостатком описанного в WO 90/15045 способа является удаление ненасыщенной ацильной боковой цепи, что приводит к значительной потере вещества. В примерах 1-3 теряются 4 атома углерода и 3 атома кислорода или 8 атомов углерода соответственно, тогда как в способе, предлагаемом в настоящем изобретении, теряется 1 атом углерода. В соответствии с принципом "экономии атомов", введенным в публикации Trost, B.M. (Science, 254, 1991, 1471), потеря большого количества атомов в химической реакции является неблагоприятной. В ЕР-А-0277002 на схеме I описано окисление различных стероидов смесью оксид рутения/перйодат натрия в органическом растворителе, приводящее к соответствующей кислоте. Однако пример осуществления указанного способа не приведен и на схеме не указаны никакие дополнительные подробности. В насыщенных жестких кольцевых структурах, таких как стероиды, кольцевые атомы углерода содержат:(a) 2 одновалентных заместителя или 1 двухвалентный заместитель, присоединенный к атому углерода, который является частью одного кольца и обладает двумя кольцевыми углерод-углеродными связями, или(b) 1 одновалентный заместитель, присоединенный к атому углерода, который является частью двух конденсированных колец и обладает тремя кольцевыми углерод-углеродными связями. Каждый из двух заместителей в случае (а) находится в экваториальном или аксиальном положении по отношению к кольцу и вследствие инверсии кольца может переходить из экваториального положения в аксиальное или в обратном направлении. Однако расположение этих двух заместителей относительно кольца и друг относительно друга не меняется. В структурных формулах, описывающих такие кольцевые структуры, в соответствии с общепринятой нумерацией стероидных систем, т.е. заместитель Rn-1, в котором n обозначает номер соответствующего атома углерода Cn, расположенного "ниже" другого заместителя, считается находящимся в -положении (например, R1-1 или -R1) и его связь с атомом углерода Cn обозначается прерывистой, пунктирной или штриховой линией. Соответственно, заместитель Rn-2, присоединенный "выше" другого (Rn-1), считается находящимся в -положении и его связь с атомом углерода Cn обозначается широкой или жирной линией или сплошной клинообразной линией. В настоящем изобретении символ Qn в структурных формулах обозначает 1 двухвалентный заместитель или 2 одновалентных заместителя Rn (т.е. Rn-1 или Rn-2). Если в соответствии со случаем (b) к каркасу кольца присоединен только 1 одновалентный заместитель (например, R9 присоединен к C9), то его относительное положение описывается как находящееся ниже (т.е. R9-1) или выше (т.е. R9-2) каркаса кольца.R1 и R2 независимо выбраны из группы, включающей водород, F, Cl, Br, I, C1-C6-алкил и C1-C6 алкоксигруппу, где каждый алкильный и/или алкоксильный фрагмент необязательно замещен одним или большим количеством атомов галогенов.R4 выбран из группы, включающей водород, (N,N-ди-C1-C6-алкиламино)метил, 2-(N,N-ди-C1-C6 алкиламино)этил, C1-C6-алкил, C1-C6-алкоксигруппу, фенил и бензил, где каждый алкильный и/или алкоксильный фрагмент необязательно замещен одним или большим количеством атомов галогенов или где каждый фенильный и/или бензильный фрагмент необязательно содержит один или большее количество заместителей, выбранных из группы, включающей NO2, F, Cl, Br, I, C1-C3-алкил, C1-C3-алкоксигруппу, диметиламиногруппу и диэтиламиногруппу.Q7 обозначает карбонильный атом кислорода или обозначает R7-1 и R7-2, где один из R7-1 и R7-2 обозначает водород, а другой выбран из группы, включающей водород, F, Cl, Br, I, C1-С 6-алкил и C1-С 6 алкоксигруппу, где каждый алкильный и/или алкоксильный фрагмент необязательно замещен одним или большим количеством атомов галогенов.R9 обозначает водород или F.Q11 обозначает карбонильный атом кислорода или обозначает R11-1 и R11-2, где один из R11-1 и R11-2 обозначает водород, а другой выбран из группы, включающей водород, цианогруппу, циано-С 1-С 3-алкил,ацетоксигруппу, СООН и СОО-М+, где М+ обозначает Na+, K+ или NH+4.COOR обозначает СООН или СОО-М+, где М+ обозначает Na+, K+ или NH+4. Здесь и ниже в настоящем изобретении термин "С 1-Cn-алкил" обозначает линейную или разветвленную алкильную группу, содержащую от 1 до n атомов углерода. C1-C10-Алкил обозначает, например,метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, 1,4-диметилпентил,гексил, гептил, 1,5-диметилгексил, децил или 4-этил-1,5-диметилгексил. Здесь и ниже в настоящем изобретении термин "C1-С 6-алкоксигруппа" обозначает линейную или разветвленную алкоксигруппу, содержащую от 1 до 6 атомов углерода, например метокси-, этокси-, пропокси-, изопропокси-, бутокси-, изобутокси-, втор-бутокси-, пентилокси- или гекислоксигруппу. Здесь и ниже в настоящем изобретении термин "циано-C1-C6-алкил" обозначает линейную алкильную группу, содержащую от 1 до 6 атомов углерода совместно с концевой цианогруппой, например цианометил, цианоэтил, цианопропил, цианобутил, цианопентил или цианогексил. Здесь и ниже в настоящем изобретении термин "C3-C18-алкановая кислота" обозначает линейную или разветвленную алкановую кислоту, содержащую от 3 до 18 атомов углерода, например пропионовую кислоту, масляную кислоту, октановую кислоту, нонановую кислоту, декановую кислоту, ундекановую кислоту, додекановую кислоту или октадекановую кислоту. Здесь и ниже в настоящем изобретении термин "C8-C18-алкансульфоновая кислота" обозначает линейную или разветвленную алкансульфоновую кислоту, содержащую от 8 до 18 атомов углерода, например октансульфоновую кислоту, додекансульфоновую кислоту. Здесь и ниже в настоящем изобретении термин "C1-С 6-алкиламиногруппа" обозначает линейную или разветвленную алкиламиногруппу, содержащую от 1 до 6 атомов углерода, например метиламино-,этиламино-, пропиламино-, бутиламино-, пентиламино- или гексиламиногруппу. Здесь и ниже в настоящем изобретении термин "C1-С 6-алкиламин" обозначает линейный или разветвленный алкиламин, содержащий от 1 до 6 атомов углерода, например метиламин, этиламин, пропиламин, бутиламин, пентиламин или гексиламин. Здесь и ниже в настоящем изобретении термин "С 1-С 4-спирт" обозначает линейный или разветв-2 014871 ленный спирт, содержащий от 1 до 4 атомов углерода, т.е. метанол, этанол, пропанол, изопропанол, нбутанол, втор-бутанол или трет-бутанол. Решаемой технической задачей является разработка применимого в промышленном масштабе способа получения стероидных секо-кислот, в котором окислительное расщепление стероидного кольца A можно провести отдельно от образования карбоксигруппы, присоединенной к атому C17 стероидного каркаса. Кроме того, необходимо исключить применение дорогостоящих реагентов, таких как NaIO4. Другим объектом настоящего изобретения является экономически привлекательная последовательность реакций получения промежуточных 4-азастероидов формулы I, включающая минимальную обработку и минимальное количество стадий выделения соединений формулы IV. Указанные выше задачи можно решить способом по п.1 формулы изобретения. Для преодоления недостатков известных способов согласно изобретению разработан способ, который позволяет образовать карбоксигруппу, присоединенную к атому C17 стероидного каркаса, и провести очистку соединения формулы III до расщепления стероидного кольца А. Поскольку отдельное окисление ен-оксо-боковой цепи соединений, раскрытых в WO 90/15045, невозможно без повреждения кольца А,карбоксигруппу, присоединенную к атому C17, было необходимо ввести в совершенно другом режиме реакции и с использованием других исходных соединений. С помощью галогеноформной реакции соединения формулы II, содержащие ацетильную группу, присоединенную к атому C17, легко и с высоким выходом можно превратить в соединения формулы III. Галогеноформная реакция совершенно не влияет на ен-оксо-фрагмент стероидного кольца А, и соединения формулы III можно очистить, так чтобы они соответствовали требованиям, предъявляемым к стероидным лекарственным средствам. Раздельно выполнение обеих стадий окисления позволяет использовать исходные соединения низкого качества. Предложен способ получения 4-азастероидных кислот формулы в которой R1, R2, R4, Q7, R9, Q11, R16 и COOR являются такими, как определено выше, включающий следующие три стадии: в которой R1, R2, Q7, R9, Q11 и R16 являются такими, как определено выше, с помощью галогеноформной реакции необязательно в присутствии полярной органической добавки в соединение формулы(ii) с помощью реакции озонолиза и окислительной обработки превращают в соединение формулы(iii) циклизуют с азотсодержащим соединением формулы H2NR4, в которой R4 является таким, как определено выше, в соединение формулы I. В предпочтительном варианте осуществления галогеноформная реакция стадии (i) является бромоформной реакцией. Указанную галогеноформную реакцию предпочтительно проводить в водном растворе необязательно в присутствии полярной органической добавки. Такая добавка, являясь инертной при условиях проведения галогеноформной реакции, может выступать в качестве солюбилизатора исходного соединения. В предпочтительном варианте осуществления полярная органическая добавка выбрана из группы,включающей трет-бутиловый спирт, ацетонитрил и пропионитрил. Стадию (i) предпочтительно проводить в присутствии основания, высвобождающего гидроксидион. Таким основанием может быть гидроксид, или бикарбонат, или карбонат щелочного и/или щелочноземельного металла, который способен высвобождать гидроксид-ионы путем депротонирования воды,содержащейся в реакционной смеси. Особенно предпочтительно, если основание выбрано из группы,включающей LiOH, NaOH, KOH, Ba(ОН)2, Mg(OH)2, Ca(OH)2, NaHCO3, KHCO3, Na2CO3, K2CO3 и их смеси, более предпочтительно NaOH, KOH, NaHCO3 и их смеси. За стадией (i) необязательно следует стадия очистки. Вследствие более высокой полярности и способности образовывать соли соединения формулы III можно отделить от соединений формулы II с помощью жидкость-жидкостной экстракции. Другой подходящей методикой очистки является перекристаллизация продукта из смеси С 1-С 4-спирт/вода. Предпочтительно использовать смесь метанол/вода при температуре от 30 до 80 С. Озонолиз предпочтительно проводить путем пропускания озона через раствор соединения формулыIII в инертном растворителе. Предпочтительно, если растворитель на стадии (ii) выбран из группы,включающей Н 2 О, С 1-С 4-спирты, ацетонитрил, пропионитрил, метиленхлорид и хлороформ. В предпочтительном варианте осуществления стадию (ii) проводят при температуре ниже -10 С,более предпочтительно равной или ниже -15 С. Озонолиз проводят до обеспечения достаточной степени превращения, а затем через реакционную смесь пропускают кислород для удаления по меньшей мере большей части избыточного озона. Для проведения окислительной обработки в реакционную смесь прибавляют основание, высвобождающее гидроксид-ион. Подходящим высвобождающим гидроксид-ион основанием является гидроксид, или бикарбонат, или карбонат щелочного и/или щелочно-земельного металла, который способен высвобождать гидроксид-ионы путем депротонирования воды, содержащейся в реакционной смеси. Особенно предпочтительно, если основание выбрано из группы, включающей LiOH, NaOH, KOH, Ba(ОН)2, Mg(OH)2,Ca(OH)2, NaHCO3, KHCO3, Na2CO3, K2CO3 и их смеси, более предпочтительно NaOH, KOH, NaHCO3 и их смеси. За завершением процедуры окислительной обработки можно следить с помощью, например,окислительно-восстановительного титрования или полярографии. После окончания процедуры окислительной обработки для удаления остаточного озона и, возможно, образовавшихся пероксидов реакционную смесь обрабатывают восстановительным реагентом. В предпочтительном варианте осуществления восстановительный реагент выбран из группы, включающейNaHSO3, KHSO3, SO2, три-С 1-С 3-алкилфосфины, три-С 1-С 3-алкилфосфиты, трифенилфосфин и их смеси,предпочтительно NaHSO3 или SO2. Особенно предпочтительно поддерживать реакционную смесь при температуре от 20 до 100 С в течение не менее 5 мин после прибавления восстановительного реагента. Полнота удаления пероксидов и озона зависит от длительности и температуры обработки. При 60 С часто достаточна продолжительность восстановления, составляющая менее 1 ч, при 100 С достаточно нескольких минут. После окончания озонолиза и окислительной обработки в щелочном водном растворе остаются соли кислот формулы III. Для получения протонированных соединений формулы III предпочтительно проводить жидкость-жидкостную экстракцию. Более предпочтительно, если перед экстракцией установить значение рН водной фазы, равное ниже 7, более предпочтительно от 3 до 6. В другом особенно предпочтительном варианте осуществления после удаления избытка окислителей и установления значения рН равным ниже 7 к водному раствору прибавляют целит и смесь фильтруют для удаления липких соединений и повышения качества продукта. В другом особенно предпочтительном варианте осуществления жидкость-жидкостную экстракцию проводят с использованием трет-бутилметилового эфира (ТБМЭ), CHCl3, CH2Cl2, 1,1,1-трихлорэтана,1,2-дихлорпропана, метилацетата или этилацетата. Экстракцию водной смеси предпочтительно проводить с использованием этилацетата при рН, равном от 4,5 до 5,5. В предпочтительном способе с использованием CH2Cl2 для экстракции продукт необязательно осаждают из CH2Cl2 путем изменения полярности растворителя посредством прибавления неполярного растворителя, такого как метилциклогексан. Предпочтительно, если реакцию циклизации на стадии (iii) проводят при температуре от 80 до 150 С, особенно предпочтительно от 110 до 140C. В другом предпочтительном варианте осуществления реакцию циклизации проводят в присутствии неокисляющей протонной кислоты и/или полярной органической добавки, предназначенной для облег-4 014871 чения сольватации. Предпочтительно, если неокисляющей протонной кислотой является органическая или неорганическая кислота, выбранная из группы, включающей уксусную кислоту, пропионовую кислоту, масляную кислоту, изомасляную кислоту, бензойную кислоту, HCl, HBr, HI и их смеси. Особенно предпочтительно, если протонной кислотой является уксусная кислота или пропионовая кислота. Предпочтительно, если полярная органическая добавка выбрана из группы, включающей третбутилметиловый эфир, C1-C4-алканолы, этиленгликоль, ацетонитрил и диметилсульфоксид. В предпочтительном варианте осуществления R4 в азотсодержащем соединении формулы H2NR4 обозначает водород или C1-С 6-алкил, необязательно замещенный одним или большим количеством атомов галогенов. В другом предпочтительном варианте осуществления используют растворимые соли азотсодержащих соединений формулы H2NR4, например NH4Cl, NH4Br, ацетат аммония, пропионат аммония, бутират аммония, или гидрохлориды, или гидробромиды C1-С 6-алкиламинов. В другом предпочтительном варианте осуществления азотсодержащее соединение формулы H2NR4 или его соль можно использовать в виде раствора в присутствии неокисляющей протонной кислоты и/или полярной добавки,определенных выше. Особенно предпочтительно, если азотсодержащее соединение выбрано из группы, включающей C1 С 6-алкиламины, их растворимые соли, NH3, NH4Cl, NH4Br и NH4OAc, предпочтительно NH3 и NH4OAc. В особенно предпочтительном варианте осуществления получают 3-оксо-4-азаандрост-5-ен-17 карбоновую кислоту формулы или его соль вводят в бромоформную реакцию, необязательно в присутствии полярной органической добавки, с получением прогестероновой кислоты формулы(ii) с помощью реакции озонолиза и окислительной обработки превращают в 17-карбокси-5-оксоА-нор-3,5-секоандростан-3-оевую кислоту формулы(iii) циклизуют по реакции с NH3 или его растворимой солью, предпочтительно с NH3 в этиленгликоле или NH4OAc в AcOH, с получением соединения Ia или его соли. В предпочтительном варианте осуществления бромоформную реакцию соединения IIa на стадии (i) проводят в присутствии трет-бутанола. Озонолиз соединения IIIa на стадии (ii) предпочтительно проводить в метаноле при температуре ниже -10 С. В другом предпочтительном варианте осуществления окислительную обработку проводят-5 014871 при рН 9. После завершения окислительной обработки пероксиды удаляют предпочтительно с использованием NaHSO3 в качестве восстановительного реагента. В предпочтительном варианте осуществления циклизацию соединения IVa на стадии (III) проводят с помощью NH4OAc при температуре от 110 до 140 С. Стадию (iii) необязательно проводят в присутствии неокисляющей протонной кислоты, предпочтительно в присутствии уксусной кислоты. Настоящее изобретение иллюстрируется приведенными ниже неограничивающими примерами. Примеры Пример 1. 3-Оксо-4-андрост-4-ен-17-карбоновая кислота (IIIa формулы III при R1 = R2 = R7-1 - R7-2= R9 = R11-1 = R11-2 = R16 = Н, COOR = СООН). В трехгорлый реактор объемом 1 л, снабженный механической мешалкой и термометром, в атмосфере азота помещают 30% NaOH (379 г, 2840 ммоль, 9,46 экв.) и дистиллированную воду (459 мл). Раствор NaOH охлаждают до температуры, равной от 0 до 5 С, в течение не менее 60 мин прибавляют бром(214,8 г, 1344 ммоль, 4,48 экв.) и получают оранжевый раствор гипобромита натрия. Затем до использования раствор перемешивают еще 30 мин при 0C. В трехгорлый реактор объемом 3 л, снабженный механической мешалкой, термометром и насадкой для перегонки, в атмосфере азота помещают прогестерон (IIa, 94,5 г, 300 ммоль, 1,0 экв.), трет-бутанол (910 мл) и перемешивают при 25 С. Затем в течение 70 мин прибавляют раствор 30% NaOH (197 г, 1477 ммоль, 4,92 экв.) и дистиллированную воду (474 мл),поддерживая температуру равной 25 С. Желтый раствор охлаждают до 0 С, а затем в течение 60 мин обрабатывают раствором NaOBr. Затем гетерогенную смесь перемешивают в течение 3 ч при 0 С. После завершения реакции в течение 15 мин к холодной реакционной смеси (слабо экзотермическая реакция) прибавляют раствор сульфита натрия (37,8 г, 364 ммоль, 1,21 экв.) в воде (147 мл). Раствор выдерживают в течение ночи (15 ч) при 20 С. Затем трет-бутиловый спирт удаляют отгонкой при температуре от 23 до 37 С и давлении от 90 до 65 мбар. Таким образом из реакционной смеси удаляют 807 г спирта. Затем к розовой реакционной смеси прибавляют дистиллированную воду (1200 мл), а после этого толуол(300 мл) и смесь нагревают до 35 С. Через 15 мин перемешивание прекращают и фазам дают разделиться. После этого отделенную водную фазу (2780 г, рН 14) подкисляют до рН 3, в течение 90 мин прибавляя 37% HCl (244 г, 2476 ммоль, 8,25 экв.), и полученный раствор перемешивают при комнатной температуре в течение еще 60 мин, а затем фильтруют. Осадок на фильтре промывают дистиллированной водой (2180 мл) и влажный продукт (217 г) сушат в вакууме (45 С, примерно 20 мбар). Выделяют 85,5 гR = R7-2 = R9 = R11-1 = R11-2 = R16 = Н, COOR = СООН). В трехгорлый реактор объемом 2 л, снабженный механической мешалкой, термометром и насадкой для перегонки, в атмосфере азота помещают неочищенную этиохоленовую кислоту (170 г, ВЭЖХ 77%(мас./мас., метанол (1360 мл) и дистиллированную воду (340 мл), перемешивают и затем кипятят с обратным холодильником (65 С). Суспензию перемешивают в течение 2 ч и затем в течение 75 мин охлаждают до 0 С. Полученную суспензию фильтруют и осадок на фильтре промывают холодным раствором метанол/вода (60:40) (2100 мл). После сушки в вакууме (45 С, примерно 20 мбар) получают 110 г (84%,ВЭЖХ 99% (мас./мас.), 99% площади) чистой этиохоленовой кислоты (IIIa). Пример 3. 17-Карбокси-5-оксо-А-нор-3,5-секоандростан-3-оевая кислота (IVa формулы IV при R1 2= R = R7-1 = R7-2 = R9 - R11-1 = R11-2 = R16 - Н, COOR = СООН). Этиохоленовую кислоту (IIIa, 79,1 г, 250 ммоль) в атмосфере азота помещают в сосуд для озонолиза и растворяют в метаноле (750 мл). Смесь охлаждают до -15 С (внутренняя температура) и в течение примерно 4 ч обрабатывают озоном. После завершения реакции поток озона останавливают и через смесь в течение 15 мин пропускают O2. Затем реакционную смесь помещают в атмосферу N2 и после этого при такой же температуре прибавляют воду (425 мл), что приводит к образованию осадка. В течение следующих 2 ч смеси дают нагреться от -15 до 40 С. Для проведения окислительной обработки значение рН смеси доводят до 11 путем прибавления 30% раствора гидроксида натрия (93 мл). Реакционную смесь концентрируют в вакууме (40 С, примерно 150 мбар) (492 г дистиллята), оставшийся желтый раствор(713 г) при комнатной температуре экстрагируют трет-бутилметиловым эфиром (500 мл). Органическую фазу отделяют и обрабатывают с помощью 40% NaHSO3 (125 мл) для удаления пероксидов, затем концентрируют на роторном испарителе (35 С и 30 мбар) и получают светло-желтый продукт (100 г). Затем значение рН оставшегося водного раствора в течение 30 мин доводят до 3 путем обработки с помощью 35% HCl (65 мл) при комнатной температуре, а затем экстрагируют трет-бутилметиловым эфиром(600 мл). Отделяют органический раствор, а затем его промывают с помощью 40% NaHSO3 (125 мл) для удаления пероксидов, а затем водой (125 мл). После концентрирования на роторном испарителе (35 С,20 мбар) и сушки (16 ч) в вакууме получают 92,7 г (ВЭЖХ 72% (мас./мас.), 73% площади) тонкоизмельченного белого порошка 17-карбокси-5-оксо-А-нор-3,5-секоандростан-3-оевой кислоты (IVa). Пример 4. 3-Оксо-4-азаандрост-5-ен-17-карбоновая кислота (Ia формулы I при R1 = R2 = R4 = R7-1 =R7-2 = R9 = R11-1 = R11-2 = R16 = Н, COOR = СООН). В трехгорлый реактор объемом 1000 мл, снабженный механической мешалкой, термометром и насадкой для перегонки, в атмосфере азота помещают раствор 17-карбокси-5-оксо-А-нор-3,5 секоандростан-3-оевой кислоты в трет-бутилметиловом эфире (IVa, 700 мл). Растворитель отгоняют в вакууме (100 мбар/температура бани равна примерно 60 С) до получения объема, равного 1/3 от исходного. Затем прибавляют уксусную кислоту (760 мл) и перегонку продолжают, пока не начинает отгоняться уксусная кислота. Прибавляют ацетат аммония (132,5 г, 1700 ммоль, примерно 7 экв.) и реакционную смесь кипятят с обратным холодильником (примерно 120 С) в течение 1 ч (температура бани равна примерно 140 С). Через 1 и 2 ч степень превращения проверяют с помощью тонкослойной хроматографии. Реакционную смесь после этого концентрируют (отгоняют 40% уксусной кислоты). Реакционную смесь (желто-оранжевая суспензия) в течение 1 ч охлаждают примерно до 60 С. Затем примерно при 60 С к реакционной смеси медленно прибавляют воду (830 мл) (примерно 1 ч) и суспензию медленно (1 ч) охлаждают до 20 С. Через 0,5 ч (20 С) суспензию фильтруют и осадок на фильтре промывают водой (2100 мл) и раствором вода/этанол (1:1; об./об.) (2100 мл). Сушка при 80 С (примерно 20 мбар/примерно 16 ч) дает 68,9 г (83% полный выход, с поправкой на анализ, из этиохоленовой кислоты) светло-желтовато-коричневого продукта 3-оксо-4-азаандрост-5-ен-17-карбоновой кислоты (Ia)(IVa) (450 г, 1,33 моль) прибавляют 2100 мл уксусной кислоты и отгоняют этилацетат. Затем охлажденную смесь в атмосфере азота переносят в трехгорлый реактор объемом 10 л, снабженный механической мешалкой, термометром и насадкой для перегонки, и после этого прибавляют ацетат аммония (560 г,7,2 моль). Реакционную смесь кипятят с обратным холодильником в течение 1 ч и затем в течение 0,5 ч охлаждают до 60 С. После этого медленно прибавляют воду (3360 мл) и суспензию медленно охлаждают до 20 С. Через 0,5 ч суспензию фильтруют и осадок на фильтре промывают водой (2840 мл) и смесью вода/этанол [об./об., 1:1] (3840 мл). Сушка при 50 С (примерно 20 мбар/примерно 16 ч) дает 355 г(74,5% полный выход) 3-оксо-4-азаандрост-5-ен-17-карбоновой кислоты (Ia) цветом от белого до светло-желтовато-коричневого при чистоте, равной примерно 100%. Сравнительный пример 1. 17-Карбокси-5-оксо-А-нор-3,5-секоандростан-3-оевая кислота (формулаI, R1 = R2 = R7-1 = R7-2 =R9=R11-1= R11-2= R16= Н, COOR = СООН). Трехгорлый реактор объемом 1000 мл, снабженный механической мешалкой, термометром, устройством прибавления NaOH при контроле рН и счетчиком пузырьков, продувают азотом и затем в него помещают 200 мл деионизированной воды, 9,7 г NaHCO3 (115,5 ммоль), 16,2 г этиохоленовой кислоты(50 ммоль) и 58 мг RuCl3H2O (0,37 ммоль) и 16 мл ацетонитрила. Взвесь охлаждают до 10 С при энергичном перемешивании (примерно 1000 об/мин). Сначала значение рН раствора доводят до 8,0 путем прибавления NaOH (30%). К суспензии при перемешивании в течение 3,5 ч прибавляют раствор 105,9 гOXONE (345 ммоль, моноперсульфат формулы 2KHSO5KHSO4K2SO4, выпускающийся фирмой Aldrich) в 425 мл деионизированной воды, и значение рН смеси поддерживают равным от 8,0 до 8,4 путем прибавления 30% раствора NaOH. Реакционную смесь выдерживают в течение 1,5 ч. После завершения превращения этиохоленовой кислоты прибавляют 4,3 г NaHSO3 (40 ммоль). Реакционную смесь нагревают при 60 С в течение 1 ч (цвет меняется от коричневого до светло-зеленого) и затем охлаждают до 20 С. Прибавляют CH2Cl2 (254 мл). Значение рН раствора доводят до 1,5 путем прибавления концентрированной HCl. После разделения фаз водную фазу экстрагируют с помощью 80 мл CH2Cl2. Затем объединенные органические слои фильтруют, сушат над Na2SO4. Оставшуюся воду удаляют из влажного продукта при 55 С в вакууме. Выход равен примерно 90%, по данным ВЭЖХ чистота составляет примерно 60%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 4-азастероидов формулы в которой R1 и R2 независимо выбраны из группы, включающей водород, F, Cl, Br, I, C1-С 6-алкил и C1-С 6 алкоксигруппу, где каждый алкильный и/или алкоксильный фрагмент необязательно замещен одним или большим количеством атомов галогенов, илиR4 выбран из группы, включающей водород, (N,N-ди-C1-C6-алкиламино)метил, 2-(N,N-ди-C1-C6 алкиламино)этил, C1-С 6-алкил, C1-С 6-алкоксигруппу, фенил и бензил, где каждый алкильный и/или алкоксильный фрагмент необязательно замещен одним или большим количеством атомов галогенов или где каждый фенильный и/или бензильный фрагмент необязательно содержит один или большее количество заместителей, выбранных из группы, включающей NO2, F, Cl, Br, I, C1-С 3-алкил, C1-C3 алкоксигруппу, диметиламиногруппу и диэтиламиногруппу, иQ7 обозначает карбонильный атом кислорода или обозначает R7-1 и R7-2, где один из R7-1 и R7-2 обозначает водород, а другой выбран из группы, включающей водород, F, Cl, Br, I, C1-С 6-алкил и C1-C6 алкоксигруппу, где каждый алкильный и/или алкоксильный фрагмент необязательно замещен одним или большим количеством атомов галогенов, илиR9 обозначает водород или F, иQ11 обозначает карбонильный атом кислорода или обозначает R11-1 и R11-2, где один из R11-1 и R11-2 обозначает водород, а другой выбран из группы, включающей водород, цианогруппу, циано-C1-C3-алкил,ацетоксигруппу, СООН и СОО-М+, где М+ обозначает Na+, K+ или NH+4, иCOOR обозначает СООН или СОО-М+, где М+ обозначает Na+, K+ или NH+4,включающий следующие 3 стадии: в которой R1, R2, Q7, R9, Q11 и R16 являются такими, как определено выше,с помощью галогеноформной реакции, необязательно в присутствии полярной органической добавки, в соединение формулы(ii) с помощью реакции озонолиза и окислительной обработки превращают в соединение формулы(iii) циклизуют с азотсодержащим соединением формулы H2NR4, в которой R4 является таким, как определено выше, в соединение формулы I, в которой R1, R2, R4, Q7, R9, Q11, R16 и COOR являются такими, как определено выше. 2. Способ по п.1, в котором галогеноформная реакция является бромоформной реакцией. 3. Способ по п.1 или 2, в котором полярная органическая добавка выбрана из группы, включающей трет-бутиловый спирт, ацетонитрил и пропионитрил. 4. Способ по любому из пп.1-3, в котором стадию (ii) проводят в растворителе, выбранном из группы, включающей H2O, C1-C4-спирт, ацетонитрил, пропионитрил, метиленхлорид и хлороформ. 5. Способ по любому из пп.1-4, в котором в конце стадии (ii) после окислительной обработки к реакционной смеси для удаления пероксидов прибавляют восстановительный реагент. 6. Способ по любому из пп.1-5, в котором азотсодержащее соединение формулы H2NR4 на стадииNH4OAc. 7. Способ по любому из пп.1-6, в котором стадию (iii) проводят при температуре от 80 до 150 С,предпочтительно от 110 до 140 С.-8 014871 8. Способ по пп.1-7, в котором стадию (iii) проводят в присутствии неокисляющей протонной кислоты, выбранной из группы, включающей уксусную кислоту, пропионовую кислоту, масляную кислоту,изомасляную кислоту, бензойную кислоту, HCl, HBr и HI. 9. Способ по любому из пп.1-8, в котором стадию (iii) проводят в присутствии полярной органической добавки, выбранной из группы, включающей трет-бутилметиловый эфир, C1-C4-алканолы, этиленгликоль, ацетонитрил и диметилсульфоксид. 10. Способ по любому из пп.1-9 получения 3-оксо-4-азаандрост-5-ен-17-карбоновой кислоты формулы I при R1 = R2 = R4 = R7-1 = R7-2 = R9 = R11-1 = R11-2 = R16 = H и COOR = СООН (Ia), в котором стадия(ii) является бромоформной реакцией и в котором стадию (iii) проводят путем введения 17-карбокси-5 оксо-А-нор-3,5-секоандростан-3-оевой кислоты формулы IVa или ее соли в реакцию с NH3 или растворимой солью аммония, предпочтительно с NH3 в этиленгликоле или NH4OAc в АсОН, с получением соединения Ia или его соли.
МПК / Метки
МПК: C07J 73/00
Метки: получения, способ, 4-азастероидов
Код ссылки
<a href="https://eas.patents.su/10-14871-sposob-polucheniya-4-azasteroidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 4-азастероидов</a>
Предыдущий патент: Антитела к белку steap-1 и их применение
Следующий патент: Азиридинилэпотилоновые соединения
Случайный патент: Способ и устройство для изготовления продукта из нетканого материала












