Производные 6-гетероарилпиридоиндолона, способ их получения и применение в терапии
Номер патента: 14873
Опубликовано: 28.02.2011
Авторы: Бурри Бернар, Казелла Пьер, Чиапетти Паола, Жегам Самир, Дерок Жан-Мари, Мюно Иветт, Вермют Камилль Жорж
Формула / Реферат
1. Соединение формулы (I)

в которой
R1 обозначает атом водорода или (С1-С4)алкильную группу, CN, CF3 или CHF2;
R2 обозначает атом водорода или (С1-С4)алкильную группу;
R3 обозначает фенил, не замещенный или замещенный одним или несколькими заместителями, выбираемыми независимо из атома галогена, (С1-С4)алкильной группы, (С1-С4)алкоксильной группы;
R4 обозначает гетероциклический радикал, выбираемый из
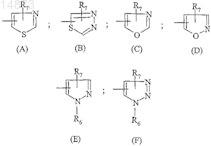
R5 обозначает атом водорода, атом галогена, (С1-С4)алкильную группу, (С1-С4)алкоксильную группу;
R6 выбирают из атома водорода, группы -SO2-R12, (С1-С6)алкильной, (С1-С6)моно- или перфторалкильной группы, группы -(CH2)n-NR8R9, -(СН2)n-NH-CO-(C1-C4)алкильной группы, -(СН2)n-NH-SO2-(C1-C4)алкильной группы, группы -(CH2)n-NH-(CH2)m-NR8R9, группы -(СН2)n-NH-(CH2)m-OR10, группы -(СН2)n-O-(CH2)m-NR8R9, -(CH2)n-O-(CH2)m-O-(C1-C4)алкильной группы, группы -(CH2)nHal, группы -(C1-C6)алкил-O-R10, группы -CO2-(CH2)m-O-R10, группы -(CH2)n-COOR11; (C1-C6)алкилкарбонильной, (C1-C6)моно- или перфторалкилкарбонильной, CO-NH-R10, -СО-(C1-C6)алкил-О-(С1-С4)алкильной группы;
R7 выбирают из атома водорода, (C1-C6)алкильной, (C1-C6)моно- или перфторалкильной группы, группы
-(CH2)n-NR8R9, -(СН2)n-NH-CO-(C1-C4)алкильной группы, -(СН2)n-NH-SO2-(C1-C4)алкильной группы, группы -(CH2)n-NH-(CH2)m-NR8R9, группы -(CH2)n-NH-(CH2)m-OR10, группы -(СН2)n-O-(CH2)m-NR8R9, -(СН2)n-O-(CH2)m-O-(C1-C4)алкильной группы, группы -(CH2)nHal, группы -(C1-C6)алкил-O-R10, группы -CO2-(CH2)m-O-R10, группы -(СН2)n-COOR11; (C1-C6)алкилкарбонильной, (C1-C6)моно- или перфторалкилкарбонильной, CO-NH-R10, -СО-(C1-C6)алкил-О-(С1-С4)алкильной группы;
R8 и R9, каждый независимо один от другого, обозначают атом водорода или (С1-С4)алкильную группу,
или R8и R9 вместе с атомом азота, с которым они соединены, образуют гетероциклический радикал, выбираемый из пирролидин-1-ила, пиперидин-1-ила или морфолин-4-ила или пиперазинила, необязательно замещенного на его втором атоме азота;
R10 обозначает атом водорода, (С1-С4)алкильную группу, (С1-С4)алкилкарбонильную группу, (C3-C6)циклоалкилкарбонильную группу, (C3-C6)циклоалкил(С1-С4)алкилкарбонильную группу, (C3-C6)циклоалкильную группу, (С5-С6)гетероциклоалкильную группу, (С1-С6)моно- или перфторалкильную группу, (C3-C6)циклоалкил(С1-С4)алкильную группу;
R11 обозначает атом водорода или (С1-С6)алкильную группу;
R12 обозначает (С1-С6)алкильную группу, (C1-C6)моно- или перфторалкильную группу, циклоалкильную группу, циклоалкилалкильную группу, (С1-С6)алкил-О-(С1-С4)алкильную группу;
m обозначает 1, 2;
n обозначает 0, 1, 2;
Hal обозначает атом галогена,
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
2. Соединение формулы (I) согласно п.1, в которой
R1 обозначает атом водорода или (С1-С4)алкильную группу;
R2 обозначает атом водорода или (С1-С4)алкильную группу;
R3 обозначает фенил, не замещенный или замещенный одним или несколькими заместителями, выбираемыми, независимо, из атома галогена, (С1-С4)алкильной группы, (С1-С4)алкоксильной группы;
R4 обозначает гетероциклический радикал, выбираемый из
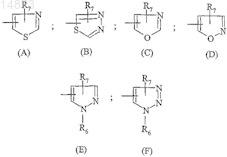
R5 обозначает атом водорода, атом галогена, (С1-С4)алкильную группу, (С1-С4)алкоксильную группу;
R6 обозначает атома водорода или (С1-С4)алкильную группу;
R7 обозначает атом водорода, (С1-С4)алкильную группу; группу -(CH2)n-NR8R9, группу -(CH2)nHal, CH2-O-R10, группу -(CH2)n-COOR11;
R8 и R9,каждый независимо один от другого, обозначают атом водорода или (C1-C4)алкильную группу;
или R8и R9 вместе с атомом азота, с которым они соединены, образуют гетероциклический радикал, выбираемый из пирролидин-1-ила, пиперидин-1-ила или морфолин-4-ила;
R10 обозначает атом водорода, (C1-C4)алкильную группу, (C1-C4)алкилкарбонильную группу, (C3-C6)циклоалкилкарбонильную группу;
R11 обозначает атом водорода или (C1-C4)алкильную группу;
n обозначает 0 или 1;
Hal обозначает атом галогена;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
3. Соединение формулы (IA) по п.1 или 2, в которой R4 обозначает 1,3-тиазол, замещенный R7, и заместители R1-R7имеют значения, указанные для соединений формулы (I) в п.1; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
4. Соединение формулы (IB) по п.1 или 2, в которой R4 обозначает 1,3,4-тиадиазол, замещенный R7, и заместители R1-R7 имеют значения, указанные для соединений формулы (I) в п.1; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
5. Соединение формулы (IC) по п.1 или 2, в которой R4 обозначает 1,3-оксазол, замещенный R7, и заместители R1-R7имеют значения, указанные для соединений формулы (I) в п.1; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
6. Соединение формулы (ID) по п.1 или 2, в которой R4 обозначает изоксазол, замещенный R7, и заместители R1-R7имеют значения, указанные для соединений формулы (I) в п.1; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
7. Соединение формулы (IE) по п.1 или 2, в которой R4 обозначает 1H-пиразол, замещенный R6 и R7, и заместители R1-R7 имеют значения, указанные для соединений формулы (I) в п.1; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
8. Соединение формулы (IF) по п.1 или 2, в которой R4 обозначает 1,2,3-триазол, замещенный R6 и R7, и заместители R1-R7 имеют значения, указанные для соединений формулы (I) в п.1; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
9. Соединение формулы (I) по п.1 или 2, в которой
R1 обозначает атом водорода или метил;
R2 обозначает метил;
R3 обозначает 2,4-дихлорфенил;
R4 обозначает гетероциклический радикал, выбираемый из
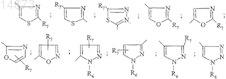
R5 обозначает атом водорода;
R6 обозначает атом водорода, метил или этил;
R7 обозначает атом водорода, метил, амино, метиламино, аминометил, (диметиламино)метил, пирролидин-1-илметил, хлорметил, гидроксиметил, этоксиметил, [(2,2-диметилпропаноил)окси]метил, [(циклопропилкарбонил)окси]метил, метоксикарбонил, 2-метокси-2-оксоэтил, карбоксиметил;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
10. Соединение формулы (I) по п.1 или 2, в которой
R1 обозначает атом водорода или метил;
R2 обозначает метил;
R3 обозначает 2,4-дихлорфенил;
R4 обозначает
2-метил-1,3-тиазол-4-ил, 2-амино-1,3-тиазол-4-ил, 2-(метиламино)-1,3-тиазол-4-ил, 2-(гидроксиметил)-1,3-тиазол-4-ил, 2-(этоксиметил)-1,3-тиазол-4-ил, 2-[[(2,2-диметилпропаноил)окси]метил]-1,3-тиазол-4-ил, 2-[(циклопропилкарбонил)окси]метил;
1,3-тиазол-2-ил, 4-метил-1,3-тиазол-2-ил, 4-амино-1,3-тиазол-2-ил, 4-(аминометил)-1,3-тиазол-2-ил, 4-[(диметиламино)метил]-1,3-тиазол-2-ил, 4-(пирролидин-1-илметил)-1,3-тиазол-2-ил, 4-(хлорметил)-1,3-тиазол-2-ил, 4-(2-метокси-2-оксоэтил)-1,3-тиазол-2-ил, 4-(карбоксиметил)-1,3-тиазол-2-ил;
1,3-оксазол-4-ил, 2-метил-1,3-оксазол-4-ил, 2-амино-1,3-оксазол-4-ил, 2-(гидроксиметил)-1,3-оксазол-4-ил, 2-(этоксиметил)-1,3-оксазол-4-ил, 2-[[(2,2-диметилпропаноил)окси]метил]-1,3-оксазол-4-ил;
1,3-оксазол-5-ил, 2-метил-1,3-оксазол-5-ил, 2-(этоксиметил)-1,3-оксазол-5-ил;
1,3-оксазол-2-ил, 4-метил-1,3-оксазол-2-ил, 5-метил-1,3-оксазол-2-ил;
изоксазол-5-ил, 4-метилизоксазол-5-ил, 3-(метоксикарбонил)изоксазол-5-ил;
1H-пиразол-5-ил, 1-этил-1H-пиразол-5-ил, 3-(метоксикарбонил)-1H-пиразол-5-ил, 3-метил-1H-пиразол-5-ил, 3-амино-1H-пиразол-5-ил;
1-метил-1H-пиразол-3-ил, 1-этил-1Н-пиразол-3-ил;
3-амино-1H-пиразол-4-ил;
5-амино-1,3,4-тиадиазол-2-ил;
1H-1,2,3-триазол-4-ил;
R5 обозначает атом водорода;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
11. Соединение формулы (I) по п.1 или 2, выбираемое из
6-(2-амино-1,3-тиазол-4-ил)-3-(2,4-дихлорфенил)-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
3-(2,4-дихлорфенил)-6-[2-(гидроксиметил)-1,3-тиазол-4-ил]-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
3-(2,4-дихлорфенил)-1,9-диметил-6-(2-метил-1,3-тиазол-4-ил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
пивалата[4-[3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-ил]-1,3-тиазол-2-ил]метила;
3-(2,4-дихлорфенил)-6-[2-(этоксиметил)-1,3-тиазол-4-ил]-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
3-(2,4-дихлорфенил)-1,9-диметил-6-(2-метил-1,3-оксазол-4-ил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
3-(2,4-дихлорфенил)-1,9-диметил-6-(2-метил-1,3-оксазол-5-ил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
6-(3-амино-1H-пиразол-5-ил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
6-[(4-аминометил-1,3-тиазол-2-ил)]-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
6-(3-амино-1H-пиразол-4-ил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
3-(2,4-дихлорфенил)-1,9-диметил-6-(1H-пиразол-5-ил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
12. Соединение формулы (I) по п.1 или 2, выбираемое из следующих соединений:
3-(2,4-дихлорфенил)-6-(1-метоксиметил-1Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он;
3-(4-бромфенил)-6-(1-этил-1Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он;
6-(2-аминотиазол-5-ил)-3-(2-хлор-4-фторфенил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он;
3-(2,4-дихлорфенил)-6-(2-метоксиметилтиазол-4-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он;
3-(2,4-дихлорфенил)-6-[1-(2,2-диметилпропионил)-4-метил-1Н-пиразол-3-ил]-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он;
3-(2,4-дихлорфенил)-6-(5-этоксиметил-1-метил-1Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он;
3-(4-фторфенил)-6-(1-метоксиметил-1Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он;
3-(4-фторфенил)-6-(1-метоксиметил-4-метил-1Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он;
3-(4-хлорфенил)-6-(2-этоксиметилтиазол-4-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он;
3-(2,4-дихлорфенил)-6-[1-(2,2-диметилпропионил)-1Н-пиразол-3-ил]-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он;
3-(2,4-дихлорфенил)-6-(1-метоксиметил-1Н-[1,2,3]триазол-4-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
13. Способ получения соединений формулы (IA) по п.1, в которой R4= ![]() отличающийся тем, что соединение формулы
отличающийся тем, что соединение формулы
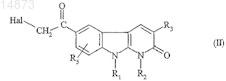
в которой R1, R2, R3 и R5имеют значения, указанные для соединения формулы (I) по п.1, и Hal обозначает атом галогена, подвергают взаимодействию с соединением формулы
![]()
в которой R7 имеет значения, указанные для соединения формулы (I) по п.1.
14. Способ получения соединений формулы (IA) по п.1, в которой R4= ![]() отличающийся тем, что соединение формулы
отличающийся тем, что соединение формулы
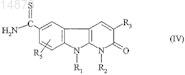
в которой R1, R2, R3 и R5имеют значения, указанные для соединения формулы (I) по п.1, подвергают взаимодействию с соединением формулы
![]()
в которой R7 имеет значения, указанные для соединения формулы (I) по п.1, и Hal обозначает атом галогена.
15. Способ получения соединений формулы (IB) по п.1, в которой R4= ![]() отличающийся тем, что соединение формулы
отличающийся тем, что соединение формулы
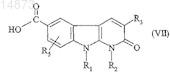
в которой R1, R2, R3 и R5имеют значения, указанные для соединения формулы (I) по п.1, подвергают взаимодействию с соединением формулы
![]()
в которой R7 имеет значения, указанные для соединения формулы (I) по п.1.
16. Способ получения соединений формулы (IC) по п.1, в которой R4= ![]() отличающийся тем, что соединение формулы
отличающийся тем, что соединение формулы
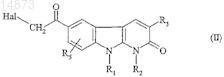
в которой R1, R2, R3 и R5имеют значения, указанные для соединения формулы (I) по п.1, и Hal обозначает атом галогена, подвергают взаимодействию с соединением формулы
![]()
в которой R7 имеет значения, указанные для соединения формулы (I) по п.1.
17. Способ получения соединений формулы (IC) по п.1, в которой R4= ![]() отличающийся тем, что:
отличающийся тем, что:
А) соединение формулы

в которой R1, R2, R3 и R5имеют значения, указанные для соединения формулы (I) по п.1, подвергают взаимодействию с соединением формулы
![]()
в которой R7 имеет значения, указанные для соединения формулы (I) по п.1, с получением соединения формулы
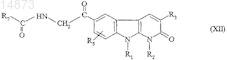
В) полученное соединение формулы (XII) циклизуют под действием кислоты.
18. Способ получения соединений формулы (IC) по п.1, в которой R4= ![]() отличающийся тем, что соединение формулы
отличающийся тем, что соединение формулы
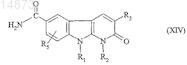
в которой R1, R2, R3 и R5имеют значения, указанные для соединения формулы (I) по п.1, подвергают взаимодействию с соединением формулы
![]()
в которой R7 имеет значения, указанные для соединения формулы (I) по п.1, и Hal обозначает атом галогена.
19. Способ получения соединений формулы (IC) по п.1, в которой R4= ![]() отличающийся тем, что соединение формулы
отличающийся тем, что соединение формулы
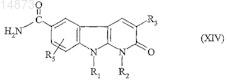
в которой R1, R2, R3 и R5имеют значения, указанные для соединения формулы (I), подвергают взаимодействию с соединением формулы
![]()
в которой R7 имеет значения, указанные для соединения формулы (I), и Hal обозначает атом галогена.
20. Способ получения соединений формулы (ID) по п.1, в которой R4= ![]() отличающийся тем, что соединение формулы
отличающийся тем, что соединение формулы
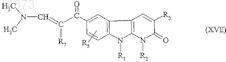
в которой R1, R2, R3, R5и R7 имеют значения, указанные для соединения формулы (I) по п.1, подвергают взаимодействию с гидроксиламином.
21. Способ получения соединений формулы (ID) по п.1, в которой R4= ![]() отличающийся тем, что соединение формулы (XX)
отличающийся тем, что соединение формулы (XX)
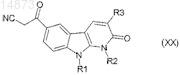
в которой R1, R2и R3 имеют значения, указанные для соединения формулы (I) по п.1, подвергают взаимодействию с гидроксиламином.
22. Способ получения соединений формулы (ID) по п.1, в которой R4= ![]() отличающийся тем, что соединение формулы
отличающийся тем, что соединение формулы
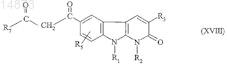
в которой R1, R2, R3, R5и R7 имеют значения, указанные для соединения формулы (I) по п.1, подвергают взаимодействию с гидроксиламином.
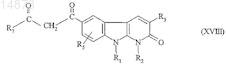
23. Способ получения соединений формулы (IE) по п.1, в которой R4= ![]() отличающийся тем, что соединение формулы
отличающийся тем, что соединение формулы
в которой R1, R2, R3, R5и R7 имеют значения, указанные для соединения формулы (I) по п.1, подвергают взаимодействию с соединением формулы
NH2-NH-R6 (XIX),
в которой R6 имеет значения, указанные для соединения формулы (I) по п.1.
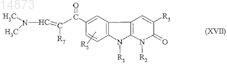
24. Способ получения соединений формулы (IE) по п.1, в которой R4= ![]() отличающийся тем, что соединение формулы
отличающийся тем, что соединение формулы
в которой R1, R2, R3, R5и R7 имеют значения, указанные для соединения формулы (I) по п.1, подвергают взаимодействию с гидразином формулы
NH2-NH-R6 (XIX).
25. Способ получения соединений формулы (IF) по п.1, в которой R4= ![]() отличающийся тем, что соединение формулы
отличающийся тем, что соединение формулы
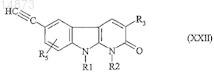
в которой R1, R2, R3 и R5имеют значения, указанные для соединения формулы (I) по п.1, подвергают взаимодействию с азидом натрия.
26. Лекарственное средство, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-12, или аддитивную соль этого соединения с фармацевтически приемлемой кислотой, или гидрат или сольват соединения формулы (I).
27. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-12 или фармацевтически приемлемую соль, гидрат или сольват этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
28. Применение соединения формулы (I) по любому из пп.1-12 для получения лекарственного средства, предназначенного для лечения и профилактики заболеваний, вызванных или обострившихся в результате пролиферации опухолевых клеток.
29. Применение соединения формулы (I) по любому из пп.1-12 для получения лекарственного средства, предназначенного для лечения рака молочной железы; рака легких; рака тонкого кишечника, рака толстого кишечника и прямой кишки; рака дыхательных путей, ротоглотки и нижней части глотки; рака пищевода; рака печени, рака желудка, рака желчных путей, рака желчного пузыря, рака поджелудочной железы; рака мочевых путей, в том числе почек, уротелия и мочевого пузыря; рака женских половых путей, в том числе рака матки, шейки матки, яичников, хлоркарциномы и трофобластомы; рака мужских половых путей, в том числе рака предстательной железы, семенных пузырьков, яичек, опухолей половых клеток; рака желез внутренней секреции, в том числе рака щитовидной железы, гипофиза, надпочечников; рака кожи, в том числе гемангиом, меланом, сарком, включая саркому Капоши; опухолей мозга, нервов, глаз, рака мозговой оболочки, включая астроцитомы, глиомы, глиобластомы, ретинобластомы, нейриномы, нейробластомы, шванномы, менингиомы; опухолей, происходящих из злокачественных гематопоэтических опухолей, включая лейкемию, хлоромы, плазмацитомы, фунгоидный микоз, лимфому или лейкемию Т-клеток, неходжкинскую лимфому, злокачественную гемопатию, миеломы.
Текст
ПРОИЗВОДНЫЕ 6-ГЕТЕРОАРИЛПИРИДОИНДОЛОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ Изобретение относится к соединениям, отвечающим формуле (I), в которой R1 обозначает атом водорода или (C1-С 4)алкил, CN, CF3 или CHF2; R2 обозначает атом водорода или (C1-С 4)алкил; R3 обозначает фенил незамещенный или замещенный; R4 обозначает гетероциклический радикал; R5 обозначает атом водорода, атом галогена, (C1-C4)алкил, (C1-C4)алкоксил. Изобретение относится также к способу получения указанных соединений и к их применению в терапии 014873 Изобретение относится к производным 6-гетероарилпиридоиндолона, к способу их получения и к применению в терапии. В патенте Франции 9708409 описаны соединения формулыx обозначает атом водорода или хлора, или метил, или метокси;r2 обозначает метил или этил; илиr1 и r2 образуют вместе группу (СН 2)3;r3 обозначает либо фенил, необязательно замещенный атомом галогена, или метил, или метокси,либо тиенил. В описании к этому патенту отмечается, что соединения формулы (А), имеющие сродство к сайтам омега-модуляторов, ассоциированных с рецепторами GABAA, могут быть использованы для лечения заболеваний, обусловленных нарушениями в ГАМК-эргической передаче, ассоциированными с подтипами рецепторов GABAA, таких как тревожные состояния, нарушения сна, эпилепсия и т.д. В международных заявках на патенты WO 2002/087574 и WO 2002/087575 описано применение соединений формулы (A) в качестве противораковых агентов и их комбинацию с другими противораковыми агентами. В международной заявке на патент WO 2002/041817 описаны соединения формулы: в которой Ra, Rb, Rc, Rd и Re имеют различные значения. Эти соединения обладают противораковой активностью. Настоящее изобретение относится к соединениям, отвечающим формуле (I)R1 обозначает атом водорода или (C1-C4)алкильную группу, группу CN, CF3 или CHF2;R2 обозначает атом водорода или (C1-C4)алкильную группу;R3 обозначает фенил, незамещенный или замещенный одним или несколькими заместителями, выбираемыми, независимо, из атома галогена, (C1-C4) алкильной группы, (C1-C4) алкоксильной группы;R6 выбирают из атома водорода, группы SO2-R12, (С 1-С 6)алкильной, (С 1-С 6)моно- или перфторалкильной группы, группы -(СН 2)n-NR8R9,-(СН 2)n-NH-CO-(C1-C4)алкильной группы,-(СН 2)n-NH-SO2-(C1-C4)алкильной группы,-(CH2)n-NH-(CH2)m-NR8R9 группы, группы -(СН 2)n-NH-(CH2)m-OR10, группы -(CH2)n-O-(CH2)mNR8R9,-(СН 2)n-O-(СН 2)m-O-(C1-C4)алкильной группы, группы -(CH2)nHal,группы -(С 1-С 6)алкил-O-R10,группы -CO2-(CH2)m-O-R10,-1 014873 группы -(СН 2)n-COOR11,(С 1-С 6)алкилкарбонильной, (С 1-С 6)моно- или перфторалкилкарбонильной, -CO-NH-R10, -СО-(С 1-С 6) алкил-О-(С 1-С 4)алкильной группы,- R7 выбирают из атома водорода, (С 1-С 6)алкильной, (С 1-С 6)моно- или перфторалкильной группы,группы -(СН 2)n-NR8R9,-(СН 2)n-NH-CO-(C1-C4)алкильной группы,-(СН 2)n-NH-SO2-(C1-C4)алкильной группы, группы -(СН 2)n-NH-(CH2)m-NR8R9,группы -(CH2)n-NH-(CH2)m-OR10,группы -(CH2)n-O-(CH2)m-NR8R9,-(CH2)n-O-(CH2)m-O-(C1-C4)алкильной группы, группы - (СН 2)nHal,группы -(С 1-С 6)алкил-O-R10,группы -CO2-(CH2)m-O-Rl0,группы -(СН 2)n-COOR11,(С 1-С 6)алкилкарбонильной, (С 1-С 6)моно- или перфторалкилкарбонильной, -CO-NH-R10, -СО-(С 1-С 6) алкил-О-(С 1-С 4)алкильной группы,R8 и R9 обозначают, каждый независимо друг от друга, атом водорода или (С 1-С 4)алкильную группу; или R8 и R9, вместе с атомом азота, с которым они соединены, образуют гетероциклический радикал, выбираемый из пирролидин-1-ила, пиперидин-1-ила, морфолин-4-ила или пиперазинила, необязательно замещенного на втором атоме азота,R10 обозначает атом водорода, (С 1-С 4)алкильную группу, (С 1-С 4)алкилкарбонильную группу, (С 3-С 6) циклоалкилкарбонильную группу, (С 3-С 6)циклоалкил(С 1-С 4)алкилкарбонильную группу, (C3-C6) циклоалкильную группу, (С 5-С 6)гетероциклоалкильную группу, (С 1-C6)моно- или перфторалкильную группу,(C3-C6)циклоалкил(С 1-С 4)алкильную группу,R11 обозначает атом водорода или (С 1-С 6)алкильную группу;Hal обозначает атом галогена в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата. Соединения формулы (I) могут содержать один или несколько асимметрических атомов углерода. Следовательно, они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, в том числе рацемические смеси, составляют часть изобретения. Соединения формулы (I) могут существовать в виде оснований или кислотно-аддитивных солей. Такие аддитивные соли составляют часть изобретения. Эти соли преимущественно получают с фармацевтически приемлемыми кислотами, но соли с другими кислотами, пригодными, например, для очистки или выделения соединений формулы (I), также составляют часть изобретения. Соединения формулы (I) могут также существовать в виде гидратов или сольватов, более конкретно в виде ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты или сольваты также составляют часть изобретения. В рамках настоящего изобретения подразумевается под атомом галогена: фтор, хлор, бром или иод;(С 1-С 6)алкильной группой: алифатическую насыщенную линейную или разветвленную группу, содержащую 1-6 атомов углерода. В качестве примера можно назвать метильную, этильную, пропильную,изопропильную, бутильную, изобутильную, втор.бутильную, трет.бутильную, пентильную или гексильную группы, а также их изомеры;(С 1-С 6)алкоксильной группой: О-алкильный радикал, в котором алкильная группа является группой,определенной выше;(C3-C6)циклоалкильной группой: циклическую алкильную группу с 3-6 атомами углерода, такую как циклопропильная, циклобутильная, циклопентильная или циклогексильная группа;(С 5-С 6)гетероциклоалкильной группой понимают, в частности, тетрагидропирановый, тетрагидрофурановый, морфолиниловый, пиперидиновый, пирролидиновый и пиперазиниловый циклы, которые сами необязательно замещены алкильным радикалом. Среди соединений формулы (I) согласно изобретению различают соединения формулы (IA), в которой R4 представляет собой 1,3-тиазол, замещенный R7, а заместители R1-R7 имеют значения, указанные для соединений формулы (I). соединения формулы (IB), в которой R4 представляет собой 1,3,4-тиадиазол, замещенный R7, а заместители R1-R7 имеют значения, указанные для соединений формулы (I). соединения формулы (IC), в которой R4 представляет собой 1,3-оксазол, замещенный R7, а замести-2 014873 тели R1-R7 имеют значения, указанные для соединений формулы (I). соединения формулы (ID), в которой R4 представляет собой изоксазол, замещенный R7, а заместители R1-R7 имеют значения, указанные для соединений формулы (I). соединения формулы (IE), в которой R4 представляет собой 1H-пиразол, замещенный R6 и R7, а заместители R1-R7 имеют значения, указанные для соединений формулы (I). соединения формулы (IF), в которой R4 представляет собой 1,2,3-триазол, замещенный R6 и R7, а заместители R1-R7 имеют значения, указанные для соединений формулы (I). Из соединений формулы (I) согласно изобретению можно назвать предпочтительными соединения,которые определены следующим образом:R1 обозначает атом водорода или метил, CHF2,R2 обозначает метил;R6 выбирают из атома водорода, группы -SO2-R12, -(С 1-С 6)алкильной, (С 1-С 6)моно- или перфторалкильной группы, группы -(СН 2)n-NR8R9, -(СН 2)n-NH-CO-(C1-C4)алкильной группы, -(СН 2)n-NH-SO2-(C1C4)алкильной группы, группы -(CH2)n-NH-(CH2)m-NR8R9, группы -(CH2)n-O-(CH2)m-NR8R9, -(СН 2)n-O(CH2)m-O-(C1-C4)алкильной группы, группы -(CH2)nHal, группы -(С 1-С 6)алкил-O-R10, группы -CO2(CH2)m-O-R10, группы -(СН 2)n-COOR11;(C1-C6)алкилкарбонольной, (С 1-C6)моно- или перфторалкилкарбонильной группы, -CO-NH-R10,R7 выбирают из атома водорода, -(C1-C6)алкильной, (С 1-С 6)моно- или перфторалкильной группы,группы -(СН 2)n-NR8R9,(СН 2)n-NH-CO-(C1-C4)алкильной группы,(СН 2)n-NH-SO2-(C1-C4)алкильной группы, группы -(CH2)n-NH-(CH2)m-NR8R9, группы -(СН 2)n-O(CH2)m-NR8R9,-(СН 2)n-O-(CH2)m-O-(C1-C4)алкильной группы,группы -(СН 2)nHal,группы -(C1-C6)алкил-O-R10,группы -CO2-(CH2)m-O-R10,группы -(CH2)n-COOR11;(C1-C6)алкилкарбонильной, (C1-C6)моно- или перфторалкилкарбонильной группы, -CO-NH-R10,причем радикалы R8, R9, R10, R11, n и m имеют вышеуказанные значения,причем указанные выше продукты формулы (I) находятся в виде основания или кислотноаддитивной соли, а также в виде гидрата или сольвата. В качестве неограничивающего примера можно указать следующие радикалы: если R6 и/или R7 обозначают: группу -(СН 2)n-NR8R9, то эта группа может представлять собой, например, CH2-NH2, СН 2-NH(алк),СН 2-N(алк)2, СН 2-гетероциклоалкил,группу -(СН 2)n-NH-(CH2)m-NR8R9, то эта группа может представлять собой, например, (СН 2)nNH(СН 2)m-гетероциклоалкил,группу -(СН 2)n-O-(CH2)m-NR8R9, то эта группа может представлять собой, например, -(СН 2 )n-O(CH2)m-гетероциклоалкил,группу -(СН 2)nHal, то эта группа может представлять собой, например, СН 2-Cl,группу -(С 1-С 6)алкил-O-R10, то эта группа может представлять собой, например, СН 2-ОН, СН 2-ОСН 3 или СН 2-О-С 2 Н 5,группу -CO-NH-R10, то эта группа может представлять собой, например, -CO-NH-(C1-C4)алкил. Можно отметить, что когда R6 или R7 обозначает группу -(CH2)n-NR8R9, группу -(СН 2)n-NH-(CH2)m-3 014873NR8R9 или группу -(СН 2)n-O-(CH2)m-NR8R9, то эти NR8R9-группы обозначают, в частности, гетероциклический радикал, выбираемый из пирролидин-1-ила, пиперидин-1-ила или морфолин-4-ила или пиперазинила, необязательно замещенного на втором атоме азота алкильным радикалом. Таким образом, настоящее изобретение относится к соединениям, отвечающим формулеR1 обозначает атом водорода или (С 1-С 4)алкильную группу,R2 обозначает атом водорода или (С 1-С 4)алкильную группу,R3 обозначает фенил, незамещенный или замещенный одним или несколькими заместителями, выбираемыми независимо из атома галогена, (C1-C4)алкильной группы, (C1-C4)алкоксильной группы;R6 обозначает атом водорода или (С 1-С 4)алкильную группу,R7 обозначает атом водорода, (С 1-С 4)алкильную группу, группу -(CH2)n-NR8R9, группу -(СН 2)nHal,группу -CH2-O-R10, группу -(CH2)n-COOR11;R8 и R9, каждый независимо один от другого, обозначают атом водорода или (С 1-С 4)алкильную группу,или R8 и R9 вместе с атомом азота, с которым они соединены, образуют гетероциклический радикал, выбираемый из пирролидин-1-ила, пиперидин-1-ила или морфолин-4-ила;R11 обозначает атом водорода или (С 1-С 4)алкильную группу,n обозначает 0 или 1;Hal обозначает атом галогена, в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата. Из соединений формулы (I) согласно изобретению можно назвать предпочтительными те соединения, которые определены следующим образом:R1 обозначает атом водорода или метил,R2 обозначает метил;R7 обозначает атом водорода, метил, амино, метиламино, аминометил, (диметиламино)метил, пирролидин-1-илметил, хлорметил, гидроксиметил, этоксиметил, [(2,2-диметилпропаноил)окси]метил,[(циклопропилкарбонил)окси]метил, метоксикарбонил, 2-метокси-2-оксоэтил, карбоксиметил; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.-4 014873 Среди соединений названной последней группы можно назвать соединения формулы (I), в которыхR1 обозначает атом водорода или метил,R2 обозначает метил;R5 обозначает атом водорода; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата. Среди соединений формулы (I) согласно изобретению можно назвать, в частности, следующие соединения: 6-(2-амино-1,3-тиазол-4-ил)-3-(2,4-дихлорфенил)-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он; 3-(2,4-дихлорфенил)-6-[2-(гидроксиметил)1,3-тиазол-4-ил]-1-метил-1,9-дигидро-2H-пиридо-[2,3-b] индол-2-он; 3-(2,4-дихлорфенил)-1,9-диметил-6-(2-метил-1,3-тиазол-4-ил)-1,9-дигидро-2H-пиридо-[2,3-b]индол 2-он; пивалат [4-[3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-ил]-1,3 тиазол-2-ил]метила; 3-(2,4-дихлорфенил)-6-[2-(этоксиметил)1,3-тиазол-4-ил]-1,9-диметил-1,9-дигидро-2H-пиридо-[2,3b]индол-2-он; 3-(2,4-дихлорфенил)-1,9-диметил-6-(2-метил-1,3-оксазол-4-ил)-1,9-дигидро-2H-пиридо-[2,3-b]индол-2-он; 3-(2,4-дихлорфенил)-1,9-диметил-6-(2-метил-1,3-оксазол-5-ил)-1,9-дигидро-2H-пиридо-[2,3-b]индол-2-он; 6-(3-амино-1H-пиразол-5-ил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо-[2,3-b]индол-2-он; 6-[4-(аминометил)-1,3-тиазол-2-ил]-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо-[2,3b] индол-2-он; 6-(3-амино-1H-пиразол-4-ил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо-[2,3-b]индол-2-он; 3-(2,4-дихлорфенил)-1,9-диметил-6-(1H-пиразол-5-ил)-1,9-дигидро-2H-пиридо-[2,3-b]индол-2-он; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата. Среди соединений формулы (I) согласно изобретению можно назвать, в частности, следующие соединения: 3-(2,4-дихлорфенил)-6-(1-метоксиметил-1 Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо-[2,3b]индол-2-он; 3-(4-бромфенил)-6-(1-этил-1 Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо-[2,3-b]индол-2-он; 6-(2-аминотиазол-5-ил)-3-(2-хлор-4-фторфенил)-1,9-диметил-1,9-дигидропиридо-[2,3-b]индол-2-он; 3-(2,4-дихлорфенил)-6-(2-метоксиметилтиазол-4-ил)-1,9-диметил-1,9-дигидропиридо-[2,3-b]индол 2-он; 3-(2,4-дихлорфенил)-6-[1-(2,2-диметилпропионил)-4-метил-1 Н-пиразол-3-ил]-1,9-диметил-1,9 дигидропиридо-[2,3-b]индол-2-он; 3-(2,4-дихлорфенил)-6-(5-этоксиметил-1-метил-1 Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он; 3-(4-фторфенил)-6-(1-метоксиметил-1 Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо-[2,3-b]индол-2-он; 3-(4-фторфенил)-6-(1-метоксиметил-4-метил-1 Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он;-5 014873 3-(4-хлорфенил)-6-(2-этоксиметилтиазол-4-ил)-1,9-диметил-1,9-дигидропиридо-[2,3-b]индол-2-он; 3-(2,4-дихлорфенил)-6-[1-(2,2-диметилпропионил)-1 Н-пиразол-3-ил]-1,9-диметил-1,9 дигидропиридо-[2,3-b]индол-2-он; 3-(2,4-дихлорфенил)-6-(1-метоксиметил-1 Н-[1,2,3]триазол-4-ил)-1,9-диметил-1,9-дигидропиридо-[2,3-b]индол-2-он; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата. В дальнейшем описании под защитной группой Gp и G'p подразумевают группу, которая позволяет,с одной стороны, защитить реакционноспособную группу, такую как гидроксильную или аминогруппу, в процессе синтеза и, с другой стороны, восстановить сохранившуюся реакционноспособную группу в конце синтеза. Примеры защитных групп, а также способы защиты и снятия защиты изложены в публикации "Protective Groups in Organic Synthesis", Green et al. ,2nd Edition (John WileySons, Inc., New York,1991). Под удаляемой группой в дальнейшем тексте подразумевают группу, которая легко отщепляется от молекулы путем гетеролитического разрыва связи с уходом электронной пары. Эту группу легко заменяют другой группой в процессе, например, реакции замещения. Такими удаляемыми группами являются, например, галогены или активированная гидроксильная группа, такая как метансульфонатная, бензолсульфонатная, паратолуолсульфонатная, трифторметансульфокислота, ацетатная и другие группы. Примеры удаляемых групп и условия их получения приведены в публикации "Advanced Organic Chemistry", J.March, 3rd Edition, Wiley Interscience, c.310-316, 1985. Согласно изобретению соединения общей формулы (I) могут быть получены известными специалисту способами, такими как описаны далее. в соответСогласно изобретению можно получить соединения формулы (IA), в которой R4= ствии со способом, характеризующимся тем, что осуществляют взаимодействие соединения формулы в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), и Hal обозначает атом галогена, с соединением формулы в которой R7 имеет значения, указанные для соединения формулы (I). Реакцию осуществляют в растворителе, таком как N-метилпирролидин-2-он, метанол или этанол,при температуре от комнатной до температуры кипения растворителя. в соответСогласно изобретению можно получить соединения формулы (IA), в которой R4= ствии со способом, характеризующимся тем, что осуществляют взаимодействие соединения формулы в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), с соединением формулы в которой R7 имеет значения, указанные для соединения формулы (I), и Hal обозначает атом галоге Реакцию осуществляют без растворителя или в растворителе, таком как ацетонитрил или 1,4 диоксан, при температуре от комнатной до температуры кипения растворителя. Более конкретно, можно получить соединение формулы (IA), в которой R4= действия соединения формулы путем взаимо в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), и Hal обозначает атом галогена, с 2-(трибутилстаннил)-1,3-тиазолом в присутствии Cu2O, ацетата палладия (II) и 1,3 бис(дифенилфосфино)пропана, в растворителе, таком как N-метилпирролидон-2-он, и при температуре-6 014873 от комнатной до 100 С. в соответСогласно изобретению можно получить соединения формулы (IB), в которой R4= ствии со способом, характеризующимся тем, что осуществляют взаимодействие соединения формулы в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), с соединением формулы: в которой R7 имеет значения, указанные для соединения формулы (I). Реакцию осуществляют в присутствии POCl3 при температуре от комнатной до температуры кипения растворителя. в соответСогласно изобретению можно получить соединения формулы (IC), в которой R4= ствии со способом, характеризующимся тем, что осуществляют взаимодействие соединения формулы: в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), и Hal обозначает атом галогена, с соединением формулы в которой R7 имеет значения, указанные для соединения формулы (I). Реакцию осуществляют без растворителя или в растворителе, таком как N-метилпирролидин-2-он,метанол или этанол, при температуре от комнатной до 160 С. в соответстСогласно изобретению можно получить соединения формулы (IC), в которой вии со способом, характеризующимся тем, что А) осуществляют взаимодействие соединения формулы: в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), с функциональным производным кислоты формулы в которой R7 имеет значения, указанные для соединения формулы (I), с получением соединения формулыB) циклизуют полученное соединение формулы (XII) под действием кислоты. На стадии А), когда обрабатывают соединение формулы (X) кислотой формулы (XI), как таковой,то работают в присутствии агента сочетания, используемого в химии пептидов, такого как 1,3-дициклогексилкарбодиимид или гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония или гексафторфосфат бензотриазол-1-илокситрис(пирролидино)фосфония или тетрафторборат 2-(1N-бензотриазол-1-ил)-1,1,3,3-тетраметилурония, в присутствии основания, такого как триэтиламин, N,N-диизопропилэтиламин или 4-диметиламинопиридин, в растворителе, таком как дихлорметан, дихлорэтан, N,Nдиметилформамид или тетрагидрофуран, при температуре от -10 С до температуры кипения растворителя. В качестве функционального производного кислоты (XI) можно использовать хлорангидрид кислоты, ангидрид, смешанный ангидрид, алкиловый(С 1-С 4) сложный эфир, в котором алкил является линейным или разветвленным, активированный сложный эфир, например, сложный эфир п-нитрофенила.-7 014873 Таким образом, согласно изобретению можно вводить во взаимодействие хлорангидрид кислоты,полученный в результате реакции тионилхлорида или оксалилхлорида с кислотой формулы (XI), и соединение формулы (X), в растворителе, таком как хлорированный растворитель (например, дихлорметан,дихлорэтан, хлороформ), эфир (например, тетрагидрофуран, диоксан) или амид (например, N,Nдиметилформамид), в инертной атмосфере при температуре от 0 С до комнатной температуры в присутствии третичного амина, такого как триэтиламин, N-метилморфолин или пиридин. Один вариант осуществления заключается в получении смешанного ангидрида кислоты формулы(XI) путем взаимодействия этилхлорформиата с кислотой формулы (XI) в присутствии основания, такого как триэтиламин, и в последующей реакции его с соединением формулы (X) в растворителе, таком как дихлорметан, в инертной атмосфере при комнатной температуре в присутствии основания, такого как триэтиламин. На стадии В) реакцию циклизации осуществляют под действием кислоты, такой как серная кислота,при температуре от 0 С до комнатной температуры. Более конкретно, можно получить соединение формулы (IC), в которой, путем взаимодействия соединения формулы (X) с триэтилортоацетатом, в присутствии каталитического количества кислоты, такой как толуол-4-сульфоновая кислота, при температуре от комнатной до 150 С. Более конкретно, можно также получить соединение формулы (IC), в которой модействия соединения формулы:, путем взаи в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), с 1-[(изоцианометил)сульфонил]-4-метилбензолом в присутствии основания, такого как карбонат калия, в растворителе, таком как метанол, и при температуре от комнатной до температуры кипения растворителя. в соответСогласно изобретению можно получить соединения формулы (IC), в которой ствии со способом, характеризующимся тем, что осуществляют взаимодействие соединения формулы в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), с соединением формулы в которой R7 имеет значения, указанные для соединения формулы (I) и Hal обозначает атом галогена. Реакцию осуществляют в условиях, описанных в Chem. Ber., 1982, 115(7), 2494-2507. в соответстСогласно изобретению можно получить соединения формулы (IC), в которой R4= вии со способом, характеризующимся тем, что осуществляют взаимодействие соединения формулы(XIV) с соединением формулы (V) в условиях, описанных в Tetrahedron, 1989, 45(19), 6249-6262. Более конкретно, можно получить соединения формулы (IC), в которой взаимодействием соединения формулы (XIV) с 1,3-диоксол-2-оном в присутствии кислоты, такой как Н 3 РО 4 при температуре от комнатной до 170 С. Более конкретно, можно также получить соединения формулы (IC), в которой действием соединения формулы взаимо в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), с пропаргиловым спиртом в присутствии кислоты, такой как серная кислота, при температуре от -20C до комнатной тем-8 014873 пературы. И, наконец, можно также получить соединения формулы (IC), в которой R4= ции соединения формулы путем циклиза в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I). Реакцию циклизации осуществляют в присутствии ацетата ртути и кислоты, такой как уксусная кислота, при температуре от комнатной температуре до 120 С. в соответСогласно изобретению можно получить соединения формулы (ID), в которой ствии со способом, характеризующимся тем, что осуществляют взаимодействие соединения формулы в которой R1, R2, R3, R5 и R7 имеют значения, указанные для соединения формулы (I), с гидроксиламином. Реакцию осуществляют в растворителе, таком как метанол, и при температуре от комнатной до температуры кипения растворителя. в соотСогласно изобретению можно получить соединения формулы (ID), в которой R4= ветствии со способом, характеризующимся тем, что осуществляют взаимодействие соединения формулы в которой R1, R2, R3, R5 и R7 имеют значения, указанные для соединения формулы (I), с гидроксиламином. Реакцию осуществляют в растворителе, таком как метанол, и при температуре от комнатной до температуры кипения растворителя. в соотСогласно изобретению можно получить соединения формулы (ID), в которой ветствии со способом, характеризующимся тем, что осуществляют взаимодействие соединения формулы в которой R1, R2 и R3, имеют значения, указанные для соединения формулы (I), с гидроксиламином. Реакцию осуществляют в растворителе, таком как метанол, и при температуре от комнатной до температуры кипения растворителя. в соответСогласно изобретению можно получить соединения формулы (IE), в которой R4= ствии со способом, характеризующимся тем, что осуществляют взаимодействие соединения формулы: в которой R1, R2, R3, R5 и R7 имеют значения, указанные для соединения формулы (I), с соединением формулы NH2-NH-R6 (XIX), в которой R6 имеют значения, указанные для соединения формулы (I). Реакцию осуществляют в растворителе, таком как метанол, при температуре от комнатной до температуры кипения растворителя. Согласно изобретению можно получить соединения формулы (IE), в которой в соответствии со способом, характеризующимся тем, что осуществляют взаимодействие соединения формулы в которой R1, R2, R3, R5 и R7 имеют значения, указанные для соединения формулы (I), с гидразином формулы (XIX). Реакцию осуществляют в растворителе, таком как метанол или этанол, при температуре от комнатной до температуры кипения растворителя. Более конкретно, можно получить соединения формулы (IE), в которой R4= действия соединения формулы путем взаимо в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), с гидразином. Реакцию осуществляют в растворителе, таком как этанол, при температуре от комнатной до температуры кипения растворителя. Более конкретно, можно получить соединения формулы (IE), в которой R4= действия соединения формулы путем взаимо в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), с гидразином. Реакцию осуществляют в присутствии кислоты, такой как уксусная кислота, в растворителе, таком какMeOH, при температуре от комнатной до температуры кипения растворителя. в соотСогласно изобретению можно получить соединения формулы (IF), в которой R4= ветствии со способом, характеризующимся тем, что осуществляют взаимодействие соединения формулы: в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), с азидом натрия. Реакцию осуществляют в присутствии аммонийхлорида в растворителе, таком как N,N-диметилформамид, при температуре от комнатной до 200 С. Соединение формулы (I), в которой R1 и/или R2 обозначают (C1-C4)алкильную группу, можно также получить путем реакции соединения формулы (I), в которой R1 и/или R2 обозначают атом водорода, с(C1-C4)алкилгалогенидом в присутствии основания, такого как гидрид натрия, в растворителе, таком какN,N-диметилформамид, при температуре от комнатной до температуры кипения растворителя. Соединения формулы (I), в которой R4 обозначает гетероцикл, замещенный R7=-(CH2)n-NR8R9,можно также получить путем реакции соответствующего соединения формулы (I), в котором R7=-(CH2)nHal, с амином формулы HNR8R9 в присутствии основания, такого как карбонат щелочного металла, в растворителе, таком как диметилсульфоксид или N,N-диметилформамид, при температуре от комнатной до температуры кипения растворителя. Соединения формулы (I), в которой R4 обозначает гетероцикл, замещенный R7=-CH2-O-R10, гдеR10=(C1-C4)алкил, можно также получить путем реакции соответствующего соединения формулы (I), в котором R7=-CH2-OH, с (C1-C4) алкилгалогенидом, в присутствии основания, такого как гидрид натрия, в растворителе, таком как N,N-диметилформамид, при температуре от комнатной до температуры кипенияR10=(С 1-С 4)алкилкарбонил или (С 3-C6 )-циклоалкилкарбонил, можно также получить путем реакции соответствующего соединения формулы (I), в котором R7=-CH2-OH, с (С 1-С 4) алкилкарбонилгалогенидом или (C3-C6)-циклоалкилкарбонилгалогенидом, в присутствии основания, такого как пиридин, при температуре от 0 С до комнатной температуры. Соединения формулы (I), в которой R4 обозначает гетероцикл, замещенный R6=(C1-C4)алкил, можно также получить путем реакции соответствующего соединения формулы (I), в котором R6=H, с (C1-С 4) алкилгалогенидом в присутствии основания, такого как гидрид натрия, в растворителе, таком как N,Nдиметилформамид, при температуре от 0C до температуры кипения растворителя. Полученные таким образом соединения формулы (I) могут быть в дальнейшем выделены из реакционной среды и очищены в соответствии с классическими способами, например путем кристаллизации или хроматографии. Полученные таким образом соединения формулы (I) могут быть в дальнейшем выделены в виде свободного основания или соли в соответствии в классическими способами. Соединения формулы (II) получают путем взаимодействия соединения формулы в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), с соединением формулы в которой Hal обозначает атом водорода, в условиях реакции Фриделя-Крафтца. Следовательно, реакцию осуществляют в присутствии кислоты Льюиса, такой как хлорид алюминия, в растворителе, таком как дихлорметан, при температуре от 0C до комнатной температуры. Соединения формулы (III) являются известными продуктами или их получают известными способами. Соединения формулы (IV) получают путем взаимодействия соединения формулы в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), с О,O'диэтилдитиофосфатом в смеси N-метилпирролидин-2-она и воды при температуре от комнатной до температуры 100 С. Соединения формулы (V) являются известными или их получают в соответствии с известными способами. Соединения формулы (VI) являются известными и их получают согласно способам, описанным в заявке WO 2004/041817. Соединения формулы (VII) получают классическим гидролизом соединений формулы в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), и Alk обозначает(C1-C2)алкил. Реакцию осуществляют, действуя основанием, таким как гидроксид калия, в растворителе,таком как метанол, этанол, смешанным с водой, при температуре от комнатной до температуры кипения растворителя. Соединения формулы (VIII) и (IX) являются известными или их получают в соответствии с известными способами. Соединения формулы (X) получают взаимодействием соединений формулы (II) с гексаметилентетрамином в растворителе, таком как хлороформ, при комнатной температуре с последующим кислым гидролизом. Соединения формулы (XI) являются известными или их получают в соответствии с известными способами. Соединения формулы (XIII) получают взаимодействием соединений формулы (XV) с NaH2PO2 в присутствии основания, такого как пиридин, кислоты, такой как уксусная кислота, и катализатора, такого как никель Ренея, при температуре от комнатной до температуры кипения реакционной среды. Соединения формулы (XIV) получают взаимодействием соединений формулы (VI) с 1,1,1,3,3,3- 11014873 гексаметилдисилазаном в присутствии PdCl2(PPh3)2 в растворителе, таком как N,N-диметилформамид,при температуре от комнатной до температуры кипения растворителя. Соединения формулы (XV) являются известными продуктами и их получают согласно способам,описанным в заявке WO 2004/041817. Соединения формулы (XVI) получают взаимодействием соединений формулы (VII) с пропаргиламином в соответствии со способами пептидного сочетания, описанными выше. Соединения формулы (XVII) получают путем взаимодействия соединений формулы в которой R1, R2, R3, R5 и R7 имеют значения, указанные для соединения формулы (I), с реактивом Бредерика (трет.бутокси-бис(диметиламино)метан) при нагревании. Соединения формулы (XVIII) получают взаимодействием соединений формулы (XXVI), в которойR7=H, с соединением формулы: в которой R7 имеет значения, указанные для соединений формулы (I), a Alk обозначает (C1-C4)алкил, в присутствии основания, такого как гидрид натрия, в растворителе, таком как N,Nдиметилформамид, при температуре от 0C до температуры кипения растворителя. Соединения формулы (XIX) являются известными или их получают в соответствии с известными способами. Соединения формулы (XX) получают путем реакции соединения формулы (II) с цианидом калия, в растворителе, таком как этанол, смешанным с водой, при температуре от комнатной до температуры кипения растворителя. Соединения формулы (XIX) получают взаимодействием соединения формулы: в которой R1, R2, R3 и R5 имеют значения, указанные для соединения формулы (I), с реактивом Бредерика при нагревании. Соединения формулы (XXII) получают взаимодействием соединения формулы (VI) с (триметилсилил)ацетиленом в присутствии Pd(PPh3)4 в растворителе, таком как пирролидин, при температуре 150 С с последующим щелочным гидролизом. Соединения формулы (XXIII) и (XXV) являются известными и их получают согласно способам,описанным в заявке WO 2004/041817. Соединения формулы (XXIV) и (XXVII) являются известными и их получают согласно известным способам. Соединения формулы (XXVI) получают взаимодействием соединений формулы (XXIII) с соединениями формулы в которой R7 имеет значения, указанные для соединений формулы (I), и Hal обозначает атом галогена, в присутствии кислоты Льюиса, такой как хлорид алюминия, в растворителе, таком как дихлорметан, при температуре от 0C до комнатной температуры. Соединения формулы (XXVIII) получают, следуя схеме I, представленной ниже: Схема I- 12014873 Если нет противоположного указания, спектры ядерно-магнитного резонанса (ЯМР 1 Н) протона регистрировали в ДМСО-d6, эталон помещали в ДМСО-d6, который находился при 2,50 ч./млн тетраметилсилана. Наблюдаемые сигналы ЯМР записывали следующим образом: с: синглет; с.ушир.: синглет ушир.; д: дуплет; дд: дуплет расщепленный; т: триплет; тд: триплет расщепленный; кв: квадруплет; м: массив; мт: мультиплет. Описанные ниже примеры иллюстрируют получение некоторых соединений согласно изобретению. Эти примеры не являются ограничительными и служат только для иллюстрации настоящего изобретения. Номера соединений, описанных в примерах, соответствуют номерам, приведенным в табл.1, представленной ниже, которая описывает химическую структуру и физические свойства некоторых соединений согласно изобретению. В примерах синтеза и примерах получения, следующих ниже, применялась следующая аббревиатура:A) N'-Фенилгидразид муравьиной кислоты. К раствору 20 г гидрохлорида фенилгидразина в 150 мл метилформиата и 60 мл воды прибавляют 25 г K2CO3, кипятят с обратным холодильником в течение 1 ч и оставляют при перемешивании на 12 ч при ТА. Образовавшийся осадок центрифугируют, промывают его смесью пропан-2-ол/петролейный эфир. Получают 18,8 г целевого соединения.B) N-Метил-N'-фенилацетогидразид. Кипятят с обратным холодильником раствор 170 мг 2 М раствора LiAlH4 в THF, медленно прибавляют суспензию 18,8 г соединения, полученного на предыдущей стадии, в 120 мл THF и продолжают кипятить с обратным холодильником в течение 15 ч. Охлаждают реакционную смесь на ледяной бане,добавляют по каплям 6 мл воды, затем 20 мл 1 М NaOH, фильтруют минеральные соли, промывают ихAcOEt и концентрируют фильтрат под вакуумом. Обрабатывают остаток 150 мл AcOEt, добавляют раствор 48 г K2CO3 в 100 мл воды, затем 11 мл уксусного ангидрида и оставляют при перемешивании в течение 2 ч при ТА. После декантации сушат органическую фазу над MgSO4 и выпаривают растворитель под вакуумом. Обрабатывают остаток петролейным эфиром и центрифугируют полученный кристаллизованный продукт. Получают 19,9 г целевого соединения.C) Гидрохлорид N-[1,3-дигидро-2H-индол-2-илиден]метанамина. Нагревают при 80 С в течение 16 ч раствор 19,9 г соединения, полученного на предыдущей стадии,в 80 мл POCl3. После охлаждения до ТА добавляют эфир, центрифугируют образовавшийся осадок и промывают его эфиром. Обрабатывают осадок в 60 мл EtOH, нагревают с обратным холодильником в течение 4 ч, центрифугируют осадок и промывают его эфиром. Получают 12 г целевого соединения.D) 3-(2,4-Дихлорфенил)-1-метил-1,9-дигидро-2 Н-пиридо[2,3-b]индол-2-он. Нагревают при 110C в течение 15 мин раствор 5 г соединения, полученного на предыдущей стадии, в 25 мл АсОН, добавляют 7,5 г метил-2-(2,4-дихлорфенил)-3-(диметиламино)акрилата и нагревают при 110 С в течение 16 ч. В реакционную среду добавляют воду, центрифугируют образовавшийся осадок и промывают его смесью пропан-2-ол/петролейный эфир (50/50; об./об.). Получают 7,8 г целевого соединения.- 13014873 Охлаждают до 0 С раствор 2 г соединения, полученного на предыдущей стадии, в 60 мл DCM, добавляют 3,1 г AlCl3, затем 1 мл бромацетилхлорида и оставляют на 1 ч при перемешивании при температуре 0 С. Выливают реакционную смесь на лед, экстрагируют AcOEt и хроматографируют на силикагеле, элюируя смесью AcOEt/циклогексан (50/50; об./об.), затем AcOEt. Получают 1,2 г целевого соединения. ЯМР 1 Н: ДМСО-d6 (300 МГц):(ч./млн): : 3,71 : с : 3H; 4,94 : с : 2 Н; 7,44-7,48 : м : 2 Н; 7,59 : д : 1 Н; 7,70 : с : 1 Н; 7,90 : д : 1 Н; 8,32 : с : 1 Н; 8,68 : с : 1 Н; 12,61 : с : 1 Н. Синтез 1.2. 6-(Бромацетил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол 2-он.A) N,1-Диметил-1H-индол-2-амин. Получают это соединение согласно условиям, описанным в WO 2004/041817, Т.пл.=249 С.B) 3-(2,4-Дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Кипятят с обратным холодильником в течение 15 мин раствор 3 г соединения, полученного на предыдущей стадии, в 15 мл АсОН, прибавляют 4,2 г метил-2-(2,4-дихлофенил)-3-(диметиламино)акрилата и кипятят с обратным холодильником в течение 16 ч. В реакционную среду добавляют воду, центрифугируют образовавшийся осадок и промывают его при помощи МеОН, затем при помощи AcOEt. Получают 4,1 г целевого соединения.C) 6-(Бромацетил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Охлаждают до 0 С раствор 1,2 г соединения, полученного на предыдущей стадии, в 40 мл DCM,прибавляют 1,8 г AlCl3, затем добавляют по каплям 0,6 мл бромацетилхлорида и оставляют на 1 ч для перемешивания при ТА. Выливают реакционную смесь на лед, экстрагируют DCM, сушат органическую фазу над Na2SO4 и выпаривают растворитель под вакуумом. Хроматографируют остаток на силикагеле,элюируя смесью AcOEt/циклогексан (75/25; об./об.), затем AcOEt. Получают 1 г целевого соединения. ЯМР 1 Н: ДМСО-d6 (300 МГц):(ч./млн): 4,01 : с : 3 Н; 4,19 : с : 3 Н; 4,93 : с : 2 Н; 7,41-7,49 : м : 2 Н; 7,69 : д : 1 Н; 7,75 : д : 1 Н; 7,91 : дд : 1 Н; 8,34 : с : 1 Н; 8,67 : д : 1 Н. Синтез 1.3. 6-(Хлорацетил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол 2-он. Охлаждают до 0 С раствор 0,7 г соединения, полученного на стадии В синтеза 1.2, в 25 мл DCM,прибавляют 1,04 г AlCl3, затем добавляют по каплям 0,19 мл хлорацетилхлорида и оставляют на 1 ч для перемешивания при ТА. Выливают реакционную смесь на лед, экстрагируют DCM, сушат органическую фазу над Na2SO4 и выпаривают растворитель под вакуумом. Хроматографируют остаток на силикагеле,элюируя смесью AcOEt/циклогексан (75/25; об./об.), затем AcOEt и, наконец, смесью AcOEt/MeOH/NH3(90/10/1; об./об./об). Обрабатывают смесью AcOEt/циклогексан (25/75; об./об.) и центрифугируют образовавшийся осадок. Получают 0,56 г целевого соединения. ЯМР 1 Н: ДМСО-d6 (300 МГц):(ч./млн): 4,03 : с : 3 Н; 4,21 : с : 3 Н; 5,22 : с : 2 Н; 7,43-7,51 : м : 2 Н; 7,70 : д : 1 Н; 7,76 : д : 1 Н; 7,91 : дд : 1 Н; 8,35 : с : 1 Н; 8,66 : с : 1 Н. Синтез 1.4. 6-Бром-3-(2,4-дихлорфенил)-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Получают это соединение согласно условиям, описанным в примере 114 международной заявкиA) N'-(4-Цианофенил)ацетогидразид. К раствору 5 г гидрохлорида 4-цианофенилгидразина в 40 мл уксусной кислоты добавляют 2,7 г ацетата натрия, затем нагревают при 80 С в течение 20 ч. Реакционную смесь концентрируют в вакууме,обрабатывают остаток водой, экстрагируют при помощи AcOEt, промывают органическую фазу насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель под вакуумом. Растирают остаток в смеси EP/AcOEt (90/10; об./об.) и центрифугируют образовавшийся осадок. Получают 4,8 г целевого соединения. ЯМР 1 Е: CDCl3 (300 МГц):(ч./млн): 1,92 : с : 3H; 6,75 : д : 2 Н; 7,53 : д : 2 Н; 8,25 : с : 1 Н; 9,76 : с : 1 Н.B) N'-(4-Цианофенил)-N,N'-диметилацетогидразид. К суспензии 2,8 г 60%-го NaH в масле в 50 мл DMF прибавляют по каплям и при ТА раствор 4,8 г соединения, полученного на предыдущей стадии, в 20 мл DMF и оставляют при перемешивании до окончания газовыделения. Добавляют затем 6,8 мл метилиодида и оставляют для перемешивания в течение 2 ч при ТА. Реакционную смесь выливают в насыщенный раствор NH4Cl, экстрагируют при помощиAcOEt, промывают органическую фазу насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Обрабатывают остаток в ЕР и центрифугируют образовавшийся осадок. Получают 4,5 г целевого соединения. ЯМР 1 Н: CDCl3(300 МГц):(ч./млн): 2,04 : с : 3H; 3,03 : с : 3H; 3,21 : с : 3H; 6,70 : д: 3H; 7,57 : д : 2 Н.- 14014873 Нагревают при 75 С в течение 1 ч 30 мин раствор 4,0 г соединения, полученного на предыдущей стадии, в 30 мл POCl3. После охлаждения до ТА образовавшийся осадок центрифугируют и промывают его эфиром. Получают 3,4 г целевого соединения.D) 3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-карбонитрил. Нагревают при 100 С в течение 15 мин смесь 0,4 г соединения, полученного на предыдущей стадии,в 4 мл уксусной кислоты, затем прибавляют 0,43 г метил-2-(2,4-дихлорфенил)-3-(диметиламино)акрилата и нагревают при 100 С в течение 3 ч. После охлаждения до ТА к реакционной смеси добавляют воду,центририфугируют образовавшийся бежевый осадок и промывают его водой. Обрабатывают осадок МеОН и выпаривают растворитель под вакуумом. Получают 0,5 г целевого соединения. ЯМР 1 Н: ДМСО-d6 (300 МГц):(ч./млн): 4,02 : с : 3H; 4,21 : с : 3H; 7,42-7,51 : м : 2 Н; 7,66-7,70 : м : 2 Н; 7,83 : д: 1 Н; 8,31 : с : 1 Н; 8,42 : с : 1 Н. Синтез 1.6. 3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-карботиоамид. К раствору 0,5 г соединения, полученного в синтезе 1.5, в 10 мл NMP и 1,5 мл воды прибавляют 0,4 мл O,O'-диэтилдитиофосфата и нагревают при 90 С в течение ночи. После охлаждения до ТА реакционную смесь выливают в насыщенный раствор NH4Cl, центрифугируют образовавшийся осадок, промывают его водой, затем смесью пропан-2-ол/ЕР(50/50; об./об.). Обрабатывают осадок МеОН и упаривают растворитель под вакуумом. Хроматографируют остаток на силикагеле, элюируя смесью DCM/MeOH от(99/1; об./об.) до (98/2; об./об.). Получают 0,41 г целевого соединения. Синтез 1.7. 3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-карбальдегид. К раствору 0,45 г соединения, полученного в синтезе 1.5, в 30 мл пиридина, 10 мл уксусной кислоты и 6 мл воды прибавляют 3,4 мл NaH2PO2 и 1,7 мл никеля Ренея и нагревают при 65C в течение 36 ч. Фильтруют катализатор, промывают МеОН и концентрируют фильтрат под вакуумом. Обрабатывают остаток водой, экстрагируют при помощи AcOEt, промывают органическую фазу насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель под вакуумом. Обрабатывают остаток смесьюA) 3-(2,4-Дихлорфенил)-6-(гидроксиметил)-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,5 г соединения, полученного в синтезе 1.7, в 15 мл EtOH прибавляют 0,06 г NaBH4 и кипятят с обратным холодильником в течение 5 ч. После охлаждения до ТА прибавляют 1 мл 6 н. NaOH и концентрируют под вакуумом. Растирают остаток в воде, центрифугируют образовавшийся осадок и промывают его водой. Обрабатывают осадок МеОН и выпаривают растворитель в вакууме. Получают 0,49 г целевого соединения.B) 6-(Хлорметил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,49 г соединения, полученного на предыдущей стадии, и 0,53 мл триэтиламина в 10 млDCM прибавляют 0,27 мл метансульфонилхлорида и оставляют для перемешивания в течение 3 суток при ТА. Хроматографируют реакционную смесь на силикагеле, элюируя смесью AcOEt/циклогексанC) [3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-ил]ацетонитрил. К смеси 0,2 г соединения, полученного на предыдущей стадии, и 0,049 г NaCN в 2 мл DCM прибавляют по каплям 3 мл DMSO и оставляют на ночь для перемешивания при ТА. Добавляют воду и AcOEt,декантируют, промывают органическую фазу водой, сушат над Na2SO4 и выпаривают растворитель под вакуумом. Обрабатывают остаток МеОН и выпаривают под вакуумом. Получают 0,18 г целевого соединения.D) 2-[3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-ил]-3-(диметиламино)акрилонитрил. Нагревают при 100 С в течение ночи смесь 0,18 г соединения, полученного на предыдущей стадии,и 5 мл реактива Бредерика. После охлаждения до ТА добавляют ЕР и воду, центрифугируют образовавшийся осадок, промывают его водой, затем смесью ЕР/пропан-2-ол (50/50; об./об.). Обрабатывают осадок МеОН и выпаривают под вакуумом. Получают 0,15 г целевого соединения. ЯМР 1 Н: ДМСО-d6 (300 МГц):(ч./млн): 3,19 : с : 6 Н; 4,00 : с : 3H; 4,13 : с : 3H; 7,22-7,26 : дд : 1 Н; 7,39-7,46 : м : 3H; 7,54 : д : 1 Н; 7,68 : с : 1 Н; 7,80 : с : 1 Н; 8,18 : с: 1 Н. Синтез 1.9. 3-(2,4-Дихлорфенил)-6-[3-(диметиламино)проп-2-еноил]-1-метил-9-2-(триметилсилил)A) 6-Ацетил-3-(2,4-дихлорфенил)-1-метил-1,9-дигидро-2 Н-пиридо[2,3-b]индол-2-он. Охлаждают до 0 С раствор 1,5 г соединения, полученного на стадии D синтеза 1.1, в 60 мл DCM,прибавляют 2,33 г AlCl3, затем 0,624 мл ацетилхлорида и оставляют на 2 ч для перемешивания при ТА. Реакционную смесь выливают на лед, экстрагируют при помощи DCM, центрифугируют образовавшийся осадок, экстрагируют маточные растворы после центрифугирования при помощи DCM, сушат органическую фазу над MgSO4 и выпаривают в вакууме. Объединяют остаток с осадком, растирают в смеси МеОН/эфир и центрифугируют. Получают 1,36 г целевого соединения.B) 6-Ацетил-3-(2,4-дихлорфенил)-1-метил-2-(триметилсилил)этокси]метил]-1,9-дигидро-2 Н-пиридо[2,3-b]индол-2-он. К раствору 1 г соединения, полученного на предыдущей стадии, в 13 мл DMF прибавляют 0,311 г 60%-го NaH в масле, затем 0,69 мл 2-(триметилсилил)этоксиметилхлорида и оставляют на 5 ч для перемешивания при ТА. Добавляют насыщенный раствор NaCl, экстрагируют при помощи AcOEt, промывают органическую фазу насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Хроматографируют остаток на силикагеле, элюируя циклогексаном, затем смесью циклогексан/AcOEt с градиентом от (90/10; об./об.) до (50/50; об./об.). Получают 0,639 г целевого соединения.C) 3-(2,4-Дихлорфенил)-6-[3-(диметиламино)проп-2-еноил]-1-метил-9-2-(триметилсилил)этокси] метил]-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Нагревают при 100 С в течение ночи раствор 0,25 г соединения, полученного на предыдущей стадии, в 5 мл реактива Бредерика. После охлаждения до ТА прибавляют ЕР, центрифугируют образовавшийся осадок, промывают его ЕР и сушат. Получают 0,236 г целевого соединения. Синтез 1.10. 3-(2,4-Дихлорфенил)-6-[3-(диметиламино)проп-2-еноил]-1,9-диметил-1,9-дигидро-2Hпиридо[2,3-b]индол-2-он.A) N'-(4-Иодфенил)ацетогидразид. Кипятят с обратным холодильником в течение 5 ч смесь 10 г 4-иодфенилгидразина в 80 мл уксусной кислоты. Концентрируют реакционную смесь под вакуумом, обрабатывают остаток водой, центрифугируют образовавшийся осадок и промывают его смесью пропан-2-ол/ЕР (50/50; об./об.). Получают 9 г целевого соединения.B) N'-(4-Иодфенил)-N,N'-диметилацетогидразид. К суспензии 3,9 г 60%-го NaH в масле в 50 мл DMF прибавляют раствор 9 г соединения, полученного на предыдущей стадии, в 30 мл DMF и оставляют на 5 мин для перемешивания при ТА. Добавляют затем 6,1 мл метилиодида и оставляют на 1 ч для перемешивания при ТА. Выливают реакционную смесь в насыщенный раствор NH4Cl, экстрагируют при помощи AcOEt, промывают органическую фазу насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель под вакуумом. Маслянистый остаток растирают в ЕР и центрифугируют образовавшийся осадок. Получают 6,7 г целевого соединения.C) Гидрохлорид N-[5-иод-1-метил-1,3-дигидро-2H-индол-2-илиден)метанамина. Нагревают при 80 С в течение 16 ч смесь 6,7 г соединения, полученного на предыдущей стадии, и 50 мл POCl3. После охлаждения до ТА добавляют эфир, центрифугируют образовавшийся осадок и промывают его эфиром. Обрабатывают осадок 20 мл EtOH и кипятят с обратным холодильником в течение 5 ч. Центрифугируют образовавшийся осадок и промывают его эфиром. Получают 4,4 г целевого соединения.D) 3-(2,4-Дихлорфенил)-6-иод-1,9-диметил-1,9-дигидро-2 Н-пиридо[2,3-b]индол-2-он. Кипятят с обратным холодильником в течение 15 мин раствор 1,4 г соединения, полученного на предыдущей стадии, в 8 мл уксусной кислоты, добавляют 1,2 г метил-2-(2,4-дихлорфенил)-3-(диметиламино)акрилата, затем кипятят с обратным холодильником в течение 16 ч. Выливают реакционную смесь в воду, экстрагируют AcOEt, промывают органическую фазу насыщенным раствором NaCl, сушат надMgSO4 и выпаривают растворитель под вакуумом. Хроматографируют остаток на силикагеле, элюируя смесью AcOEt/циклогексан (75/25; об./об.). Обрабатывают полученный продукт смесью AcOEt/циклогексан (25/75; об./об.) и центрифугируют образовавшийся осадок. Получают 1,3 г целевого соединения. Т.пл.=223-225 С.E) 6-Ацетил-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,4 г соединения, полученного на предыдущей стадии, в 15 мл NMP прибавляют 0,5 гCu2O, затем дегазируют реакционную смесь барботированием аргона в течение 30 мин. Прибавляют затем 0,075 г ацетата палладия(II), 0,273 г 1,3-бис(дифенилфосфин)пропана и 0,64 мл трибутил(1-этоксивинил)станнана, затем нагревают при 80 С в течение 8 часов. Выливают реакционную смесь в 100 мл 1 н.HCl, выдерживают 10 мин при перемешивании и центрифугируют образовавшийся осадок. Хроматографируют осадок на силикагеле, элюируя смесью AcOEt/циклогексан (75/25; об./об.). Растирают полученный продукт в смеси AcOEt/циклогексан (75/25; об./об.) и центрифугируют образовавшийся осадок.[2,3-b]индол-2-он. Нагревают при 100 С в течение ночи раствор 0,5 г соединения, полученного на предыдущей стадии,в 5 мл реактива Бредерика. После охлаждения до комнатной температуры добавляют ЕР, центрифугируют образовавшийся осадок и промывают его ЕР. Получают 0,575 г целевого соединения. Синтез 1.11. 3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-карбоксамид. Барботируют в течение 5 мин CO через раствор 1,2 8 г соединения, полученного на стадии D синтеза 1.10, 0,055 г PdCl2 (PPh3)2 и 2,24 мл 1,1,1,3,3,3-гексаметилдисилазана в 8,5 мл DMF, затем нагревают при 80 С в течение 12 ч в атмосфере CO. После охлаждения до ТА добавляют 1,39 мл МеОН и выдерживают 10 мин при перемешивании. Выливают реакционную смесь в 56 мл 2 н. H2SO4, центрифугируют образовавшийся осадок и промывают его водой, затем AcOEt. Экстрагируют фильтрат при помощиAcOEt, промывают органическую фазу насыщенным раствором NaHCO3, насыщенным раствором NaCl,сушат над MgSO4 и выпаривают растворитель в вакууме. Осадок и остаток хроматографируют на силикагеле, элюируя смесью AcOEt/циклогексан (80/20; об./об.). Получают 0,6 г целевого соединения. ЯМР 1 Н: CDCl3(300 МГц):(ч./млн): 4,09 : с : 3H; 4,17 : с : 3H; 7,28-7,45 : м : 3H; 7,50 : д : 1 Н; 7,79 : дд : 1 Н; 8,02 : с : 1 Н; 8,25 : д : 1 Н. Синтез 1.12. Метил-4-[3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1 Н-пиридо[2,3-b]индол-6-ил]-2,4-диоксобутаноат. Охлаждают до 5C раствор 0,3 г соединения, полученного на стадии Е синтеза 1.10, в 4 мл DMF,прибавляют 0,036 г 60%-го NaH в масле и 0,1 г диметилоксалата, выдерживают 1 ч при перемешивании при ТА, затем нагревают 1 ч при температуре 50 С. После охлаждения до ТА добавляют 2,4 н. растворHCl, экстрагируют при помощи AcOEt, промывают органическую фазу водой, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 0,46 г целевого соединения, которое используют без очистки. Синтез 1.13. 3-(2,4-Дихлорфенил)-6-[3-(диметиламино)-2-метилпроп-2-еноил]-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он.A) 3- (2,4-Дихлорфенил)-1,9-диметил-6-пропионил-1,9-дигидро-2H-пиридо[2, 3-b]индол-2-он. Охлаждают до 0C раствор 0,9 г соединения, полученного на стадии В синтеза 1.2, в 50 мл DCM,прибавляют маленькими порциями 1,34 г AlCl3, затем прибавляют по каплям 0,5 мл пропионилхлорида и выдерживают 2 ч при перемешивании при 0 С. Реакционную смесь выливают на лед, экстрагируют при помощи DCM, сушат органическую фазу над Na2SO4 и выпаривают растворитель в вакууме. Остаток обрабатывают смесью EP/AcOEt (90/10; об./об.) и центрифугируют образовавшийся осадок. Получают 0,65 г целевого соединения. В) 3-(2,4-Дихлорфенил)-6-[3-(диметиламино)-2-метилпроп-2-еноил]-1,9-диметил-1,9-дигидро-2Hпиридо[2,3-b]индол-2-он. Нагревают при 100C в течение 16 ч смесь 0,6 г соединения, полученного на предыдущей стадии, и 2 мл реактива Бредерика. После охлаждения до ТА прибавляют ЕР и центрифугируют образовавшийся осадок. Получают 0,63 г целевого соединения. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 2,04 : с : 3H; 2,98 : с : 6 Н; 4,02 : с : 3H; 4,17 : с : 3H; 6,89 : с : 1 Н; 7,26 : д : 1 Н; 7,44 : м : 2 Н; 7,59 : д : 1 Н; 7,68 : с : 1 Н; 7,89 : с : 1 Н; 8,2 9 : с : 1 Н. Синтез 1.14. 1-[3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-ил]бутан-1,3-дион. Перемешивают в течение 10 мин смесь 0,052 г 60%-го NaH в масле и 0,12 мл AcOEt в 2 мл THF, затем прибавляют раствор 0,246 г соединения, полученного на стадии Е Синтеза 1.10, 2 капли EtOH и 0,0035 г дибензо-18-кроун-6 эфира в 2 мл THF и нагревают в течение 3 ч при температуре 80 С. После охлаждения до ТА прибавляют 1 н. раствор HCl, экстрагируют при помощи AcOEt и выпаривают растворитель в вакууме. Обрабатывают остаток MeOH, центрифугируют образовавшийся осадок и промывают его МеОН. Получают 0,242 г целевого соединения. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 2,17 : с : 2 Н; 2,25 : с : 1 Н; 4,02 : с : 3H; 4,20 : с : 3H; 6,63 : с : 1 Н; 7,40-7,52 : м : 2 Н; 7,67-7,80 : м : 2 Н; 7,85-7,95 : м: 1 Н; 8,36 : д : 1 Н; 8,62 : д : 1H. Синтез 1.15. 3-(2,4-Дихлорфенил)-6-этинил-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он.A) 3-(2,4-Дихлорфенил)-1,9-диметил-6-[(триметилсилил)этинил]-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Барботируют в течение 5 мин аргон через раствор 0,5 г соединения, полученного на стадии D синтеза 1.10, 0,161 г (триметилсилил)ацетилена и 0,06 г Pd(PPh3)4 в 5 мл пирролидина, затем нагревают при- 17014873 150 С в микроволновой печи. Реакционную смесь хроматографируют на силикагеле, элюируя смесьюB) 3-(2,4-Дихлорфенил)-6-этинил-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,29 г соединения, полученного на предыдущей стадии, в 6,7 мл THF, 1,7 мл МеОН и 0,3 мл воды прибавляют 0,079 г KOH и выдерживают 3 ч при перемешивании при ТА. Концентрируют в вакууме и остаток хроматографируют на силикагеле, элюируя смесью AcOEt/циклогексан (80/20; об./об.). Растирают полученный продукт в MeOH, центрифугируют образовавшийся осадок и промывают его MeOH. Получают 0,292 г целевого соединения. Т.пл.=184-185 С. Синтез 1.16. 3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6 карбоновая кислота.A) Метил-4-(2-ацетилгидразино)бензоат. Растворяют 5,5 г метил-4-гидразинбензоата в 38,2 мл AcOH, содержащей 2,4 г ацетата натрия, нагревают 18 ч при температуре 80 С. Центрифугируют минеральные соли, затем выпаривают и обрабатывают минимальным количеством Et2O. Центрифугируют и получают 7,97 г целевого соединения.B) Метил-4-(2-ацетил-1,2-диметилгидразин)бензоат. Суспензируют 2,95 г 95%-го NaH в 90 мл DMF и прибавляют по каплям 8,135 г соединения, полученного на предыдущей стадии, растворенного в минимальном количестве DMF, затем через несколько минут прибавляют по каплям 9,75 мл метилиодида. Перемешивают 1 ч при ТА. Выливают среду в насыщенный раствор NH4Cl и экстрагируют AcOEt. Органическую фазу промывают NaCl, сушат, выпаривают с получением 5,4 г целевого продукта.C) Метил-1-метил-2-(метиламино)-1 Н-индол-5-карбоксилат. Смешивают 5,4 г соединения, полученного на предыдущей стадии, и 62 мл оксихлорида фосфора и нагревают 2 ч 30 мин при температуре 80 С. Выпаривают среду и обрабатывают при помощи AcOEt. Образовавшийся твердый продукт центрифугируют, промывают AcOEt, сушат с получением 4 г целевого соединения. ЯМР 1H: : MeOD (250 МГц): 3,2 ч./млн: с : 3H; 3,6 ч./млн : с : 3H; 3,9 ч./млн : с : 3H; 7,3-7,4 ч./млн : м : 2 Н; 8,1-8,2 ч./млн : м : 2 Н.D) Метил-3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-карбоксилат. Нагревают в течение 2 ч при 100 смесь 25,47 г соединения, полученного на предыдущей стадии, и 27,4 г метил-2-(2,4-дихлорфенил)-3-(диметиламино)акрилата в 100 мл уксусной кислоты. Выливают горячую реакционную смесь в 500 мл смеси вода/лед, центрифугируют образовавшийся осадок, промывают его водой, затем эфиром и сушат. Получают 22 г целевого продукта.E) 3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-карбоновая кислота. К смеси 9,5 г соединения, полученного на предыдущей стадии, в 100 мл МеОН прибавляют раствор 5,14 г KOH в виде таблеток в 90 мл воды и кипятят с обратным холодильником в течение 18 ч. После охлаждения до ТА с последующим охлаждением в ледяной бане реакционную смесь подкисляют до рН=1 добавлением 5 н. раствора HCl и разбавляют водой для осуществления перемешивания. Центрифугируют образовавшийся осадок и промывают его водой и сушат. Получают 9,1 г целевого соединения. Синтез 1.17. 3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-N-проп-2-ин-1-ил-2,9-дигидро-1H-пиридо[2,3-b]индол-6-карбоксамид. Перемешивают в течение ночи при ТА смесь 0,2 г соединения, полученного в синтезе 1.16, 0,038 мл пропаргиламина, 0,285 г РуВОР и 0,096 мл DIPEA в 7 мл DCM и 1,3 мл DMF. Концентрируют реакционную смесь под вакуумом, обрабатывают остаток насыщенным раствором NH4Cl, экстрагируют при помощи AcOEt, сушат органическую фазу над MgSO4 и выпаривают растворитель под вакуумом. Остаток обрабатывают смесью MeOH/DCM и центрифугируют образовавшийся осадок. Получают 0,21 г целевого соединения. Пример 1. Соединение 1. 3-(2,4-Дихлорфенил)-1-метил-6-(2-метил-1,3-тиазол-4-ил)-1,9-дигидро 2 Н-пиридо[2,3-b]индол-2-он. К раствору 0,5 г соединения, полученного в синтезе 1.1, в 3 мл NMP прибавляют 0,08 г тиоацетамида, затем нагревают в течение 30 мин при температуре 150 С. После охлаждения до ТА добавляют воду и AcOEt, декантируют, промывают органическую фазу насыщенным раствором NH4Cl, насыщенным раствором NaCl, сушат над Na2SO4 и выпаривают растворитель в вакууме. Обрабатывают остаток смеси МеОН/ЕР (50/50; об./об.), центрифугируют образовавшийся осадок и промывают его AcOEt. Получают 0,21 г целевого соединения. Т.пл.350 С (разл.). ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 2,72 : с : 3H; 3,70 : с : 3H; 7,46-7,52 : м : 3H; 7,69 : с : 1 Н; 7,77-7,85 : м : 2 Н; 8,25 : с : 1 Н; 8,44 : с : 1 Н; 12,21 : с : 1 Н.A) Пивалат [4-[3-(2,4-дихлорфенил)-1-метил-2-оксо-2, 9-дигидро-1H-пиридо[2,3-b]индол-6-ил]-1,3 тиазол-2-ил]метила. К раствору 0,33 г соединения, полученного в синтезе 1.1, в 15 мл EtOH прибавляют 0, 12 г пивалата 2-амино-2-тиоксоэтила и кипятят с обратным холодильником в течение 3 суток. Обрабатывают реакционную смесь в DCM и МеОН и хроматографируют на силикагеле, элюируя смесью AcOEt/циклогексанB) 3-(2,4-Дихлорфенил)-6-[2-(гидроксиметил)-1,3-тиазол-4-ил]-1-метил-1,9-дигидро-2H-пиридо[2,3b]индол-2-он. К раствору 0,016 г натрия в 10 мл МеОН прибавляют суспензию 0,18 г соединения, полученного на предыдущей стадии, в 5 мл МеОН и перемешивают 16 ч при ТА. Добавляют воду, экстрагируют при помощи AcOEt, сушат органическую фазу над MgSO4 и выпаривают растворитель в вакууме. Хроматографируют остаток на силикагеле, элюируя смесью AcOEt/циклогексан (90/10; об./об.). Получают 0,06 г целевого соединения. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 3,69 : с : 3H; 4,80 : с : 2 Н; 6,11 : м : 1 Н; 7,46-7,52 : м : 3H; 7,69 : с : 1 Н; 7,82 : д : 1 Н; 7,88 : с : 1 Н; 8,25 : с : 1 Н; 8,44 : с : 1 Н; 12,20 : с : 1 Н. Пример 4. Соединение 4. 3-(2,4-Дихлорфенил)-1-метил-6-(2-метил-1,3-оксазол-4-ил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,2 г соединения, полученного в синтезе 1.1, в 2 мл NMP прибавляют 0,064 г ацетамида,затем нагревают при 150 С в течение 2 ч. Добавляют воду, экстрагируют при помощи AcOEt, сушат органическую фазу над Na2SO4 и выпаривают растворитель в вакууме. Хроматографируют остаток на силикагеле, элюируя смесью AcOEt/циклогексан (75/25; об./об.). Обрабатывают полученный продукт в 5 мл МеОН, растирают его, центрифугируют образовавшийся осадок и промывают его ЕР. Получают 0,12 г целевого продукта. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 2,45 : с : 3H; 3,67 : с : 3H; 7,44-7,52 : м : 3H; 7,60 : д : 1 Н; 7,67 : с : 1 Н; 8,20-8,34 : м : 3H; 12,18 : с : 1 Н. Пример 5. Соединение 5. 3-(2,4-Дихлорфенил)-1-метил-6-(2-метил-1,3-оксазол-5-ил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он.A) Гидрохлорид 6-(аминоацетил)-3-(2,4-дихлорфенил)-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она. Перемешивают в течение 2 ч при ТА смесь 0,845 г соединения, полученного в синтезе 1.1, и 0,255 г гексаметилентетрамина в 13 мл хлороформа. Центрифугируют образовавшийся осадок, промывают егоDCM, затем эфиром. Осадок обрабатывают в 3,5 мл EtOH, прибавляют 0,395 мл 37% HCl и нагревают в течение 16 ч при температуре 50 С. Центрифугируют образовавшийся осадок, промывают его водой и сушат в вакууме. Получают 0,547 г целевого продукта.B) 3-(2,4-Дихлорфенил)-1-метил-6-(2-метил-1,3-оксазол-5-ил)-1,9-дигидро-2H-пиридо[2,3-b]индол 2-он. К раствору 0,5 г соединения, полученного на предыдущей стадии, в 10 мл триэтилортоацетата прибавляют 6 мг паратолуолсульфоновой кислоты, моногидрат, затем нагревают при 140 С в течение 45 мин. После охлаждения до ТА реакционную смесь растворяют в DCM и хроматографируют на силикагеле, элюируя при помощи AcOEt, затем смесью AcOEt/MeOH (93/3; об./об.). Получают 0,045 г целевого соединения. Т.пл.=338-340 С. Пример 6. Соединение 6. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(2-метил-1,3-тиазол-4-ил)-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,2 г соединения, полученного в синтезе 1.2, в 20 мл МеОН прибавляют 0,047 г тиоацетамида, затем кипятят с обратным холодильником в течение 48 ч. Центрифугируют образовавшийся осадок и промывают его ЕР. Растворяют осадок в DCM и хроматографируют на силикегеле, элюируя смесью DCM/MeOH (99/1; об./об.). Получают 0,13 г целевого соединения. Т.пл.=253-254 С.- 19014873 ЯМР 1H: : ДМСО-d6 (300 МГц):(ч./млн): 2,70 : с : 3H; 3,99 : с : 3H; 4,15 : с : 3H; 7,44 : м : 2 Н; 7,627,67 : м : 2 Н; 7,79 : с : 1 Н; 7,86 : д : 1 Н; 8,26 : с : 1 Н; 8,43 : с : 1 Н. Пример 7. Соединение 7. 3-(2,4-Дихлорфенил)-1,9-диметил-6-[2-(метиламино)-1,3-тиазол-4-ил)1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,2 г соединения, полученного в синтезе 1.2, в 10 мл MeOH прибавляют 0,045 г Nметилтиомочевины, затем кипятят с обратным холодильником в течение 16 ч. Центрифугируют образовавшийся осадок и промывают его смесью пропан-2-ол/EP. (50/50; об./об.). Получают 0,19 г целевого соединения. ЯМР 1H: : ДМСО-d6 (300 МГц):(ч./млн): 3,03 : с : 3H; 4,03: с : 3H; 4,20 : с : 3H; 7,08 : с : 1 Н; 7,427,48 : м : 2 Н; 7,70-7,72 : м : 3H; 8,23 : с : 1 Н; 8,30 : с : 1 Н. Пример 8. Соединение 8. Пивалат [4-[3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1Hпиридо[2,3-b]индол-6-ил]-1,3-тиазол-2-ил]метила. К раствору 0,45 г соединения, полученного в синтезе 1.2, в 20 мл EtOH прибавляют 0,25 г пивалата 2-амино-2-тиоксоэтила и кипятят с обратным холодильником в течение 3 суток. Центрифугируют образовавшийся осадок и промывают его смесью МеОН/ЕР (50/50; об./об.). Растворяют осадок в DCM и хроматографируют на силикагеле, элюируя смесью DCM/MeOH (99/1; об./об.). Обрабатывают полученный продукт в ЕР и центрифугируют осадок. Получают 0,4 г целевого соединения. Т.пл.=193-195 С. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 1,23 : с : 9 Н; 4,02: с : 3H; 4,18 : с : 3H; 5,46 : с : 2 Н; 7,47 : с : 2 Н; 7,68 : с : 2 Н; 7,89 : м : 1 Н; 8,04 : с : 1 Н; 8,28 : с : 1 Н; 8,48 : с : 1 Н. Пример 9. Соединение 9. 3-(2,4-Дихлорфенил)-6-[2-(гидроксиметил)-1,3-тиазол-4-ил]-1,9 диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,017 г натрия в 20 мл МеОН прибавляют 0,2 г соединения 8 и оставляют для перемешивания на 6 часов при ТА. Центрифугируют образовавшийся осадок, промывают его водой, смесью пропан-2-ол/ЕР (50/50; об./об.), затем DCM. Получают 0,16 г целевого соединения. Т.пл.=261-262 С. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 4,01 : с : 3H; 4,17 : с : 3H; 4,80 : с : 2 Н; 6,12 : с : 1 Н; 7,46 : с : 2 Н; 7,64-7,69 : м : 2 Н; 7,88-7,92 : м : 2 Н; 8,28 : с : 1 Н; 8,46 : с : 1 Н. Пример 10. Соединение 10. 3-(2,4-Дихлорфенил)-6-[2-(этоксиметил)-1,3-тиазол-4-ил]-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,13 г соединения 9 в 10 мл DMF прибавляют 0,02 г 60%-го NaH в масле и перемешивают 30 мин при ТА. Добавляют затем 0,05 мл иодэтана и перемешивают 1 ч при ТА. Выливают реакционную смесь в насыщенный раствор NH4Cl, экстрагируют при помощи AcOEt, промывают органическую фазу насыщенным раствором NaCl, сушат над Na2SO4 и выпаривают растворитель в вакууме. Хроматографируют остаток на силикагеле, элюируя AcOEt. Обрабатывают полученный продукт в ЕР и центрифугируют образовавшийся осадок. Получают 0,1 г целевого соединения. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 1,20 : т: 3H; 3,64 : кв : 2 Н; 4,02 : с : 3H; 4,18 : с : 3H; 4,81 : с : 2 Н; 7,46 : с : 2 Н; 7,65-7,69 : м : 2 Н; 7,89 : д : 1 Н; 7,99 : с : 1 Н; 8,28 : с : 1 Н; 8,47 : с : 1 Н. Пример 11. Соединение 11. Циклопропанкарбоксилат [4-[3-(2,4-дихлорфенил)-1,9-диметил-2 оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-ил]-1,3-тиазол-2-ил]метила. К раствору 0,1 г соединения 9 в 5 мл пиридина прибавляют 0,1 мл циклопропанкарбонилхлорида и перемешивают 48 ч при ТА. Выливают реакционную смесь в воду, экстрагируют при помощи AcOEt,промывают органическую фазу насыщенным раствором NH4Cl, сушат над Na2SO4 и выпаривают растворитель в вакууме. Хроматографируют остаток на силикагеле, элюируя смесью AcOEt/циклогексан (90/10; об./об.). Обрабатывают полученный продукт смесью AcOEt/циклогексан (10/90; об./об.) и центрифугируют образовавшийся осадок. Получают 0,105 г целевого соединения. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 0,91-0,99 : м : 4 Н; 1,77 : м : 1 Н; 4,03 : с : 3H; 4,18 : с : 3H; 5,44 : с : 2 Н; 7,47 : м : 2 Н; 7,67-7,70 : м : 2 Н; 7,90 : д : 1 Н; 8,05 : с : 1 Н; 8,29 : с : 1 Н; 8,49 : с : 1 Н. Пример 12. Соединение 12. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(1,3-оксазол-4-ил)-1,9-дигидро 2H-пиридо[2,3-b]индол-2-он. Нагревают при 160 С в течение 35 мин раствор 0,1 г соединения, полученного в синтезе 1.2, в 1 мл формамида. После охлаждения реакционную смесь выливают в насыщенный раствор NaHCO3, экстрагируют при помощи DCM, сушат органическую фазу над MgSO4 и выпаривают растворитель в вакууме. Хроматографируют остаток на силикагеле, элюируя при помощи AcOEt. Получают 0,042 г целевого продукта. Т.пл.=221-222 С. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 4,01 : с : 3H; 4,17 : с : 3H; 7,43-7,50 : м : 2 Н; 7,67-7,75 : м : 3H; 8,25 : с : 1 Н; 8,32 : с : 1 Н; 8,47 : д : 1 Н : 8,55 : с: 1 Н. Пример 13: Соединение 13. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(2-метил-1,3-оксазол-4-ил)-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он.- 20014873 К раствору 0,3 г соединения, полученного в синтезе 1.2, в 2 мл NMP прибавляют 0,22 г ацетамида и нагревают при 150 С в течение 30 мин. После охлаждения смесь экстрагируют при помощи AcOEt, промывают органическую фазу насыщенным раствором NH4Cl, затем 1 н. раствором HCl, сушат над Na2SO4 и выпаривают растворитель в вакууме. Хроматографируют остаток на силикагеле, элюируя смесьюAcOEt/циклогексан (90/10; об./об.). Получают 0,11 г целевого продукта. Т.пл.=222-223 С. ЯМР 1H: : ДМСО-d6 (300 МГц):(ч./млн): 2,47 : с : 3H; 4,01 : с : 3H; 4,16 : с : 3H; 7,46 : м : 2 Н; 7,627,69 : м : 3H; 8,25 : с : 1 Н; 8,26 : с : 1 Н; 8,38 : с : 1 Н. Пример 14. Соединение 14. 6-(2-Амино-1,3-оксазол-4-ил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,3 г соединения, полученного в синтезе 1.2, в 2 мл NMP прибавляют 0,22 г карбамида и нагревают при 150 С в течение 30 мин. После охлаждения добавляют воду и центрифугируют образовавшийся осадок. Хроматографируют осадок, растворенный в MeOH, на силикагеле, элюируя смесьюAcOEt/циклогексан (75/25; об./об.). Получают 0,04 г целевого продукта. Т.пл.=295-297 С. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 3,95 : с : 3H; 4,10 : с : 3H; 6,62 : с : 2 Н; 7,37-7,43 : м : 2 Н; 7,51 : с : 2 Н; 7,63 : с : 1 Н; 7,75 : с : 1 Н; 8,06 : с : 1 Н; 8,13 : с : 1 Н. Пример 15: Соединение 15. 3-(2,4-Дихлорфенил)-6-[2-(гидроксиметил)-1,3-оксазол-4-ил]-1,9 диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,2 г соединения, полученного в синтезе 1.2, в 2 мл NMP прибавляют 0,39 г 2(тетрагидро-2 Н-пиран-2-илокси)ацетамида и нагревают при 150 С в течение 1 ч 30 мин. Выливают реакционную смесь в воду и центрифугируют образовавшийся осадок. Хроматографируют осадок, растворенный в смеси AcOEt/DCM, на силикагеле, элюируя при помощи AcOEt. Обрабатывают полученный продукт смесью AcOEt/циклогексан (10/90; об./об.) и центрифугируют осадок. Получают 0,035 г целевого соединения. ЯМР 1H: : ДМСО-d6 (300 МГц):(ч./млн): 4,02 : с : 3H; 4,18 : с : 3H; 4,56 : д : 2 Н; 5,72 : т: 1 Н; 7,47 : м : 1 Н; 7,69 : м : 3H; 8,26 : с : 1 Н; 8,30 : с : 1 Н; 8,49 : с : 1 Н. Пример 16. Соединение 16. 3-(2,4-Дихлорфенил)-6-[2-(этоксиметил)-1,3-оксазол-4-ил]-1,9 диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,12 г соединения 15 в 4 мл DMF прибавляют 0,032 г 60%-го NaH в масле и перемешивают 30 мин при ТА. Добавляют затем 0,06 мл иодэтана и перемешивают 1 ч при ТА. Выливают реакционную смесь в воду, экстрагируют при помощи AcOEt, промывают органическую фазу насыщенным раствором NH4Cl, сушат над Na2SO4 и выпаривают растворитель в вакууме. Обрабатывают остаток смесью AcOEt/EP (20/80; об./об.) и центрифугируют образовавшийся осадок. Получают 0,07 г целевого соединения. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 1,15 : т: 3H; 3,56 : кв : 2 Н; 4,02 : с : 3H; 4,17 : с : 3H; 4,58 : с : 2 Н; 7,43-7,50 : м : 2 Н; 7,67 : м : 3H; 8,27 : с : 1 Н; 8,31 : с : 1 Н; 8,53 : с : 1 Н. Пример 17. Соединение 17. Пивалат [4-[3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро 1H-пиридо[2,3-b]индол-6-ил]-1,3-оксазол-2-ил]метила. К раствору 0,1 г соединения 15 в 4 мл пиридина прибавляют 0,14 мл пивалоилхлорида и оставляют на 2 ч для перемешивания при ТА. Добавляют воду, экстрагируют при помощи AcOEt, промывают органическую фазу насыщенным раствором NH4Cl, сушат над Na2SO4 и выпаривают растворитель под вакуумом. Хроматографируют остаток на силикагеле, элюируя смесью AcOEt/циклогексан (75/25; об./об.). Обрабатывают полученный продукт смесью эфир/ЕР и центрифугируют образовавшийся осадок. Получают 0,07 г целевого соединения. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 1,19 : с : 9 Н; 4,02 : с : 3H; 4,18 : с : 3H; 5,24 : с : 2 Н; 7,437,50 : м : 2 Н; 7,69 : с : 3H; 8,26 : с : 1 Н; 8,56 : с : 1 Н. Пример 18: Соединение 18. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(2-метил-1,3-оксазол-5-ил)-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он.A) Гидрохлорид 6-(аминоацетил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b] индол-2-она. Это соединение получают в соответствии с условиями, описанными в примере 5, стадия A, из соединения, полученного в синтезе 1.2.B) 3-(2,4-Дихлорфенил)-1,9-диметил-6-(2-метил-1,3-оксазол-5-ил)-1,9-дигидро-2H-пиридо[2,3-b] индол-2-он. Это соединение получают в соответствии с условиями, описанными в примере 5, стадия В. Т.пл.=239-240 С. Пример 19. Соединение 19. 3-(2,4-Дихлорфенил)-6-[2-(этоксиметил)-1,3-оксазол-5-ил]-1,9 диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он.- 21014873 Перемешивают в течение 16 ч при ТА смесь 0,25 г соединения, полученного в примере 18, стадия А, 0,058 мл этоксиуксусной кислоты, 0,318 г РуВОР и 0,29 мл DIPEA в 3 мл DCM. Добавляют насыщенный раствор NH4Cl, экстрагируют при помощи DCM, сушат над MgSO4 и выпаривают растворитель в вакууме. Хроматографируют остаток на силикагеле, элюируя при помощи AcOEt, затем смесью[2,3-b]индол-2-он. Перемешивают в течение 20 ч при ТА раствор 0,268 г соединения, полученного на предыдущей стадии, в 0,5 мл концентрированной H2SO4. Добавляют воду, экстрагируют при помощи AcOEt, сушат органическую фазу над MgSO4 и выпаривают растворитель в вакууме. Хроматографируют на силикагеле, элюируя смесью AcOEt/циклогексан (50/50; об./об.), затем при помощи AcOEt. Получают 0,04 г целевого соединения. Т.пл.=179-180 С. Пример 20. Соединение 20. 6-(3-Амино-1H-пиразол-5-ил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9 дигидро-2 Н-пиридо[2,3-b]индол-2-он.A) 3-[3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-ил]-2-оксопропаннитрил. К раствору 0,7 г соединения, полученного в синтезе 1.2, в 11 мл EtOH и 2 мл воды прибавляют 0,19 г KCN и кипятят с обратным холодильником в течение 4 ч. Центрифугируют образовавшийся осадок,растворяют его в смеси MeOH/AcOEt и хроматографируют на силикагеле, элюируя смесью AcOEt/циклогексан (75/25; об./об.), затем при помощи AcOEt. Получают 0,2 г целевого соединения.B) 6-(3-Амино-1H-пиразол-5-ил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b] индол-2-он. К раствору 0,2 г соединения, полученного на предыдущей стадии, в 10 мл EtOH прибавляют 0,2 мл гидразинмоногидрата и кипятят с обратным холодильником в течение 16 ч. Хроматографируют реакционную смесь на силикагеле, элюируя при помощи AcOEt, затем смесью AcOEt/MeOH/NH3 (90/10/0,2; об./об./об.). Получают 0,05 г целевого соединения. Т.пл.=284-286 С. Пример 21. Соединение 21. 6-(2-Амино-1,3-тиазол-4-ил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,25 г соединения, полученного в Синтезе 1.3, в 12 мл МеОН прибавляют 0,053 г тиомочевины и кипятят с обратным холодильником в течение 16 ч. Центрифугируют образовавшийся осадок,промывают его насыщенным раствором K2CO3, МеОН, смесью AcOEt/EP (50/50; об./об.). Получают 0,18 г целевого соединения. Т.пл.=272-273 С. Пример 22. Соединение 22. 3-(2,4-Дихлорфенил)-1-метил-6-(1,3-тиазол-2-ил)-1,9-дигидро-2 Нпиридо[2,3-b]индол-2-он. К раствору 0,25 г соединения, полученного в синтезе 1.4, в 10 мл NMP прибавляют 0,37 г Cu2O, затем дегазируют реакционную смесь в течение 10 мин. Прибавляют затем 0,055 г ацетата палладия (II),0,2 г 1,3-бис(дифенилфосфино)пропана и 1 г 2-(трибутилстаннил)-1,3-тиазола, затем нагревают при 100C в течение 16 ч. После охлаждения до ТА выливают реакционную смесь в 30% раствор АсОН, экстрагируют при помощи AcOEt, сушат органическую фазу над MgSO4 и выпаривают растворитель в вакууме. Хроматографируют остаток на силикагеле, элюируя при помощи AcOEt. Обрабатывают полученный продукт AcOEt и центрифугируют образовавшийся осадок. Получают 0,06 г целевого соединения. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн): 3,71 : с : 3H; 7,46-7,88 : м : 7 Н; 8,37 : с : 1 Н; 8,50 : с : 1 Н; 12,37 : с : 1 Н. Пример 23. Соединение 23. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(1,3-тиазол-2-ил]-1,9-дигидро 2H-пиридо[2,3-b]индол-2-он. К суспензии 0,35 г 60%-го NaH в масле в 10 мл DMF прибавляют 0,25 г соединения 22 и оставляют для перемешивания при ТА до прекращения выделения газа. Прибавляют затем 0,07 мл метилиодида и оставляют для перемешивания при ТА в течение 1 ч. Добавляют воду, экстрагируют при помощиAcOEt, органическую фазу сушат над MgSO4 и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикагеле, элюируя при помощи AcOEt. Обрабатывают полученный продукт смесьюAcOEt/циклогексан (25/75; об./об.), центрифугируют образующийся осадок и промывают его ЕР. ЯМР 1H: : ДМСО-d6 (300 МГц):(ч./млн): 4,04 : с : 3H; 4,20 : с : 3H; 7,43-7,51 : м : 2 Н; 7,69-7,75 : м : 3H; 7,88-7,94 : м : 2 Н; 8,41 : с : 1 Н; 8,51 : с : 1 Н. Пример 24. Соединение 24. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(4-метил-1,3-оксазол-2-ил)-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. Охлаждают до -15 С 10 мл концентрированной H2SO4, прибавляют 0,6 г соединения, полученного в Синтезе 1.5, и 0,092 мл пропаргилового спирта и оставляют на 3 часа для перемешивания при 0 С, затем- 22014873 в течение ночи при ТА. Реакционную среду выливают в смесь лед/Н 2 О, добавляют Na2CO3 до получения рН=7, экстрагируют при помощи AcOEt, органическую фазу промывают насыщенным раствором NaCl,сушат над MgSO4 и выпаривают растворитель в вакууме. Остаток хроматографируют на силикагеле,элюируя при помощи AcOEt, затем смесью AcOEt/МеОН (99/1; об./об.). Обрабатывают полученный продукт смесью пропан-2-ол/ЕР (50/50; об./об.) и центрифугируют образовавшийся осадок. Получают 0,015 г целевого соединения. Т.пл.=258-261 С. Пример 25. Соединение 25. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(4-метил-1,3-тиазол-2-ил)-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. В герметически закрытой трубке нагревают при 80 С в течение ночи смесь 0,2 г соединения, полученного в Синтезе 1.6, и 3 мл хлорацетона. После охлаждения до ТА реакционную смесь выливают в насыщенный раствор NaHCO3, центрифугируют образовавшийся осадок, промывают его водой, затем смесью пропан-2-ол/ЕР (50/50; об./об.). Получают 0,175 г целевого соединения. Т.пл.=255-257 С. Пример 26. Соединение 26. 6-(4-Амино-1,3-тиазол-2-ил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. Кипятят с обратным холодильником в течение ночи смесь 0,2 г соединения, полученного в Синтезе 1,6, и 0,04 мл бромацетонитрила в 5 мл ацетонитрила. После охлаждения до ТА добавляют MeOH и концентрируют в вакууме. Хроматографируют остаток на силикагеле, элюируя смесью AcOEt/циклогексан(90/10; об./об.). Обрабатывают полученный продукт смесью ЕР/МеОН/эфир и центрифугируют образовавшийся осадок. Получают 0,06 г целевого продукта. Т.пл.300 С (разл.). ЯМР 1H: : ДМСО-d6 (300 МГц):(ч./млн): 4,02 : с : 3H; 4,18 : с : 3H; 5,39 : с : 2 Н; 5,87 : с : 1 Н; 7,437,50 : м : 2 Н; 7,60-7,70 : м : 3H; 8,35-8,39 : м : 2 Н. Пример 27. Соединение 27. 6-[4-(Хлорметил)-1,3-тиазол-2-ил]-3-(2,4-дихлорфенил)-1,9-диметил 1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К суспензии 0,2 г соединения, полученного в синтезе 1.6, в 6 мл 1,4-диоксана прибавляют 0,073 г 1,3-дихлорацетона и кипятят с обратным холодильником в течение ночи. После охлаждения до ТА концентрируют в вакууме, обрабатывают остаток водой, затем смесью эфир/МеОН (50/50; об./об.), эфиром и центрифугируют образовавшийся осадок. Хроматографируют осадок на силикагеле, элюируя смесьюDCM/MeOH (99/1; об./об.). Обрабатывают полученный продукт эфиром и центрифугируют. Получают 0,145 г целевого соединения. Т.пл.=277-281 С (разл.). Пример 28. Соединение 28. 6-[4-(Аминометил)-1,3-тиазол-2-ил]-3-(2,4-дихлорфенил)-1,9 диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он.[2,3-b]индол-2-он. К раствору 0,4 г соединения 27 в 15 мл ДМСО прибавляют 0,16 г NaN3 и нагревают при 50 С в течение ночи. Выливают реакционную смесь в воду и центрифугируют образовавшийся осадок. Обрабатывают осадок смесью AcOEt/MeOH и выпаривают растворители в вакууме. Растирают остаток в смеси эфир/МеОН и центрифугируют образовавшийся осадок. Получают 0,33 г целевого соединения.[2,3-b]индол-2-он. Гидрируют в течение 24 ч при ТА и давлении 4 бара смесь 0,33 г соединения, полученного на предыдущей стадии, и 0,033 г 10% Pd/C в 10 мл MeOH и 40 мл уксусной кислоты. Фильтруют катализатор,промывают МеОН и концентрируют фильтрат под вакуумом. Обрабатывают остаток насыщенным раствором K2CO3, экстрагируют при помощи AcOEt, сушат органическую фазу над Na2SO4 и выпаривают растворитель под вакуумом. Хроматографируют остаток на силикагеле, элюируя смесью DCM/MeOH/ триэтиламин (95/5/1; об./об./об). Растирают полученный продукт в эфире и центрифугируют образовавшийся осадок. Получают 0,12 г целевого соединения. Т.пл.=261-266 С. Пример 29. Соединение 29. 3-(2,4-Дихлорфенил)-1,9-диметил-6-[4-(пирролидин-1-метил)-1,3 тиазол-2-ил]-1,9-дигидро-2 Н-пиридо[2,3-b]индол-2-он. К раствору 0,1 г соединения 27 в 3 мл DMF прибавляют 0,068 г K2CO3 и 0,021 мл пирролидина и нагревают при 80 С в течение ночи. После охлаждения до ТА реакционную смесь выливают в 1 н. раствор HCl, промывают водную кислую фазу при помощи AcOEt, подщелачивают добавлением 2 н. раствора NaOH, экстрагируют при помощи AcOEt, сушат органическую фазу над Na2SO4 и выпаривают растворитель под вакуумом. Растирают остаток в воде, центрифугируют образовавшийся осадок, обрабатывают при помощи МеОН и упаривают растворитель в вакууме. Растворяют остаток в смеси МеОН/пиридин и хроматографируют на силикагеле, элюируя смесью AcOEt/MeOH/NH4OH 28% (89/10/1; об./об./об.). Растирают полученный продукт в эфире и центрифугируют образовавшийся осадок. Получают 0,03 г целевого соединения. Т.пл.=222-226 С. Пример 30. Соединение 31. Метил-[2-[3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H- 23014873 пиридо[2,3-b]индол-6-ил]-1,3-тиазол-4-ил]ацетат. К суспензии 0,16 г соединения, полученного в синтезе 1.6, в 6 мл 1,4-диоксана прибавляют 0,07 г метил-4-хлор-3-оксобутаноата и кипятят с обратным холодильником в течение ночи. После охлаждения до ТА реакционную смесь концентрируют под вакуумом, растирают остаток в воде, затем в смеси ЕР/пропан-2-ол (50/50; об./об.), затем в смеси эфир/МеОН (50/50; об./об.), затем в эфире и центрифугируют образовавшийся остаток. Получают 0,145 г целевого соединения. Т.пл.=198-201 С. Пример 31. Соединение 32. [2-[3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1 Н-пиридо[2,3-b]индол-6-ил]-1,3-тиазол-4-ил]уксусная кислота. К раствору 0,345 г соединения 31 в 10 мл MeOH и 3,5 мл воды прибавляют 0,168 г моногидрата гидроксида лития и кипятят с обратным холодильником в течение 48 ч. После охлаждения до ТА реакционную смесь выливают в 2 н. раствор NaOH, промывают водную фазу при помощи AcOEt, подкисляют добавлением бн раствора HCl, экстрагируют при помощи AcOEt, сушат органическую фазу над Na2SO4 и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесьюAcOEt/MeOH/AcOH (94,5/5/0,5; об./об./об), затем (89/10/1; об./об./об.). Получают 0,09 г целевого соединения. Т.пл.=234-239 С. Пример 32. Соединение 33. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(1,3-оксазол-5-ил]-1,9-дигидро 2H-пиридо[2,3-b]индол-2-он. К раствору 0,145 г соединения, полученного в синтезе 1.7, в 4 мл МеОН прибавляют 0,073 г 1[(изоцианометил)сульфонил]-4-метилбензола и 0,062 г K2CO3, затем кипятят с обратным холодильником в течение 3 ч. Реакционную смесь концентрируют под вакуумом, обрабатывают остаток водой, центрифугируют образовавшийся осадок и промывают его водой. Хроматографируют осадок на силикагеле,элюируя смесью AcOEt/циклогексан (80/20; об./об.), затем AcOEt. Обрабатывают полученный продукт смесью MeOH/DCM, центрифугируют образовавшийся осадок и промывают его МеОН. Получают 0,048 г целевого соединения. Т.пл.=170-174 С. Пример 33. Соединение 34. 6-(3-Амино-1H-пиразол-4-ил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,15 г соединения, полученного в синтезе 1.8, в 5 мл МеОН прибавляют 0,044 мл гидразинмоногидрата, затем 0,029 мл уксусной кислоты и кипятят с обратным холодильником в течение ночи. Реакционную смесь концентрируют под вакуумом, растворяют остаток в смеси DCM/AcOEt и хроматографируют на силикагеле, элюируя при помощи AcOEt, смесью AcOEt/MeOH (95/5; об./об.), затем смесью AcOEt/MeOH/триэтиламин (90/10/2; об./об./об.). Полученный продукт растирают в эфире и центрифугируют образовавшийся осадок. Получают 0,05 г целевого соединения. Т.пл.=240-245 С. Пример 34. Соединение 35. 3-(2,4-Дихлорфенил)-6-изоксазол-5-ил-1-метил-1,9-дигидро-2Hпиридо[2,3-b]индол-2-он.A) 3-(2,4-Дихлорфенил)-6-изоксазол-5-ил-1-метил-9-2-(триметилсилил)этокси]метил]-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Кипятят с обратным холодильником в течение 3 ч раствор 0,236 г соединения, полученного в синтезе 1.9, и 0,043 г гидрохлорида гидроксиламина в 3 мл МеОН. После охлаждения до ТА добавляют ЕР,центрифугируют образовавшийся осадок, промывают его эфиром и сушат. Получают 0,147 г целевого соединения.B) 3-(2,4-Дихлорфенил)-6-изоксазол-5-ил-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Нагревают при 100C в течение 3 суток смесь, содержащую 0,147 г соединения, полученного на предыдущей стадии, 10 мл 3 М HCl и 5 мл THF. После охлаждения до ТА смесь подщелачивают добавлением 1 н раствора NaOH, экстрагируют при помощи AcOEt и концентрируют органическую фазу под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью циклогексан/AcOEt (50/50; об./об.),затем AcOEt и затем смесью AcOEt/MeOH (95/5; об./об.). Полученный продукт обрабатывают при помощи MeOH, центрифугируют образовавшийся осадок и промывают его MeOH и эфиром. Получают 0,053 г целевого соединения. Т.пл.=320-323 С. Пример 35. Соединение 36. 3-(2,4-Дихлорфенил)-1-метил-6-(1H-пиразол-5-ил)-1,9-дигидро-2Hпиридо[2,3-b]индол-2-он.A) 3-(2,4-Дихлорфенил)-1-метил-6-(1H-пиразол-5-ил)-9-2-(триметилсилил)этокси]метил]-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Кипятят с обратным холодильником в течение 24 ч раствор 0,208 г соединения, полученного в синтезе 1.9, и 0,068 мл гидразинмоногидрата в 4 мл MeOH. После охлаждения до ТА добавляют ЕР, центрифугируют образовавшийся осадок, промывают его ЕР и сушат. Получают 0,149 г целевого соединения.B) 3-(2,4-Дихлорфенил)-1-метил-6-(1H-пиразол-5-ил)-1,9-дигидро-2 Н-пиридо[2,3-b]индол-2-он. Нагревают при 100C в течение 2 суток смесь 0,098 г соединения, полученного на предыдущей стадии, 6,7 мл 3 М HCl и 3,3 мл THF. После охлаждения до ТА смесь подщелачивают добавлением 1 н. раствора NaOH, экстрагируют при помощи AcOEt и концентрируют органическую фазу под вакуумом. Ос- 24014873 таток обрабатывают при помощи МеОН, центрифугируют образовавшийся осадок и промывают его МеОН и эфиром. Получают 0,02 г целевого соединения. Т.пл.=246-250 С. Пример 36. Соединение 37. 3-(2,4-Дихлорфенил)-1-метил-6-(1-метил-1H-пиразол-3-ил)-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он.A) 3-(2,4-Дихлорфенил)-1-метил-6-(1-метил-1H-пиразол-3-ил)-9-2-(триметилсилил)этокси]метил]1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору, содержащему 0,099 г соединения, полученного в примере 35, стадия А, в 2 мл DMF,прибавляют 0,011 г 60%-го NaH в масле, затем 0,017 мл иодметана и оставляют на ночь для перемешивания при ТА. Добавляют насыщенный раствор NaHCO3, экстрагируют AcOEt, сушат органическую фазу над MgSO4 и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью AcOEt/циклогексан (60/40; об./об.), затем AcOEt. Получают 0,111 г целевого соединения.B) 3-(2,4-Дихлорфенил)-1-метил-6-(1-метил-1H-пиразол-3-ил)-1,9-дигидро-2H-пиридо[2,3-b]индол 2-он. Нагревают при 100C в течение 4 суток смесь 0,111 г соединения, полученного на предыдущей стадии, 7,4 мл 3 М HCl и 3,7 мл THF. После охлаждения до ТА смесь подщелачивают добавлением 1 н раствора NaOH, экстрагируют при помощи AcOEt, сушат органическую фазу над MgSO4 и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью AcOEt/циклогексан (80/20; об./об.), затем AcOEt. Получают 0,28 г целевого соединения. ЯМР 1 Н: : ДМСО-d6 (400 МГц): 3,7 с : 3H; 3,95 : с : 3H; 6,65 : с : 1 Н; 7,40-7,50 : м : 2 Н; 7,55-7,70 : м : 3H; 7,75 : д : 1 Н; 8,15 : с : 1 Н; 8,25 : с : 1 Н; 10,70 : се :1 Н. Пример 37. Соединение 38. 3-(2,4-Дихлорфенил)-6-(1-этил-1H-пиразол-5-ил)-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он.A) 3-(2,4-дихлорфенил)-6-(1-этил-1H-пиразол-5-ил)-1-метил-9-2-(триметилсилил)этокси]метил]1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Кипятят с обратным холодильником в течение ночи раствор 0,15 г соединения, полученного в синтезе 1.9, и 0,118 мл этилгидразиноксалата в 5 мл MeOH. После охлаждения до ТА добавляют насыщенный раствор NaHCO3, экстрагируют при помощи DCM, сушат органическую фазу над MgSO4 и выпаривают растворитель под вакуумом. Получают 0,158 г целевого соединения.B 3-(2,4-Дихлорфенил)-6-(1-этил-1H-пиразол-5-ил)-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2 он. Нагревают при 100C в течение 3 суток смесь 0,158 г соединения, полученного на предыдущей стадии, 10 мл 3 М HCl и 5 мл THF. После охлаждения до ТА смесь подщелачивают добавлением 1 н. раствора NaOH, экстрагируют AcOEt, сушат органическую фазу над MgSO4 и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью AcOEt/циклогексан (80/20; об./об.). Обрабатывают полученный продукт при помощи МеОН и оставляют на ночь для кристаллизации. Получают 0,045 г целевого соединения. Т.пл.=255-258 С. Пример 38. Соединение 39. 3-(2,4-Дихлорфенил)-6-изоксазол-5-ил-1,9-диметил-1,9-дигидро-2Hпиридо[2,3-b]индол-2-он. Перемешивают в течение 48 ч при ТА смесь 0,221 г соединения, полученного в синтезе 1.10, 0,042 мл уксусной кислоты и 0,051 г гидрохлорида гидроксиламина в 3 мл МеОН. Концентрируют под вакуумом, экстрагируют остаток при помощи DCM, промывают органическую фазу раствором NaHCO3, водой, насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикагеле, элюируя при помощи AcOEt. Полученный продукт растирают в смесиMeOH/DCM/AcOEt и центрифугируют образовавшийся осадок. Т.пл.=241-242 С. Пример 39. Соединение 40. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(1H-пиразол-5-ил)-1,9-дигидро 2H-пиридо[2,3-b]индол-2-он. Перемешивают в течение 48 ч при ТА смесь 0,114 г соединения, полученного в синтезе 1.10, 0,021 мл уксусной кислоты и 0,018 мл гидразинмоногидрата в 1 мл МеОН. Концентрируют под вакуумом, экстрагируют остаток при помощи DCM, промывают органическую фазу насыщенным раствором NaHCO3,водой, затем насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикагеле, элюируя при помощи AcOEt. Полученный продукт растирают в МеОН и центрифугируют образовавшийся осадок. Получают 0,027 г целевого соединения. Т.пл.=281-282 С. Пример 40. Соединение 41. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(1-метил-1H-пиразол-3-ил)-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,23 г соединения 40 в 8 мл DMF прибавляют 0,033 г 60%-го NaH в масле и оставля- 25014873 ют на 5 мин для перемешивания при ТА. Добавляют затем 0,051 мл иодметана и оставляют на ночь для перемешивания при ТА. Добавляют насыщенный раствор NaHCO3, экстрагируют при помощи AcOEt,сушат органическую фазу над MgSO4 и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикагеле, элюируя при помощи AcOEt. Полученный продукт обрабатывают в МеОН, центрифугируют образовавшийся осадок и промывают его МеОН, затем эфиром. Получают 0,103 г целевого соединения. ЯМР 1 Н: : ДМСО-d6 (300 МГц):3,88 : с : 3H; 4,01 : с : 3H; 4,19 : с : 3H; 6,68 : д : 1 Н; 7,46 : м: 2 Н; 7,61 : м : 1 Н; 7,71 : м : 3H; 8,28 : с : 2 Н. Пример 41. Соединение 42. 3-(2,4-Дихлорфенил)-6-(1-этил-1H-пиразол-3-ил)-1,9-диметил-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,23 г соединения 40 в 8 мл DMF прибавляют 0,033 г 60% NaH в масле и оставляют на 5 мин для перемешивания при ТА. Добавляют затем 0,065 мл иодэтана и оставляют на ночь для перемешивания при ТА. Добавляют насыщенный раствор NaHCO3, экстрагируют AcOEt, сушат органическую фазу над MgSO4 и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикателе, элюируя при помощи AcOEt. Полученный продукт обрабатывают в МеОН, центрифугируют образовавшийся осадок и промывают его МеОН, затем эфиром. ЯМР 1 Н: : ДМСО-d6 (300 МГц):(ч./млн) 1,41 : т: 3H; 4,02 : с : 3H; 4,16 : м : 5 Н; 6,68 : д : 1 Н; 7,46 : м : 2 Н; 7,61 : д : 1 Н; 7,68 : д : 1 Н; 7,76 : м : 2 Н; 8,29 : д: 2 Н. Пример 42. Соединение 43. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(1,3-оксазол-2-ил)-1,9-дигидро 2H-пиридо[2,3-b]индол-2-он. Нагревают при 170C в течение ночи смесь 0,2 г соединения, полученного в синтезе 1.11, 0,047 г 1,3-диоксол-2-она и 1 г Н 3 РО 4. После охлаждения до ТА добавляют воду и AcOEt и оставляют на 10 мин для перемешивания. После декантации органическую фазу сушат над MgSO4 и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикагеле, элюируя при помощи AcOEt. Получают 0,062 г целевого соединения. Т.пл.=232-233 С. Пример 43. Соединение 44. Метил-5-[3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1Hпиридо[2,3-b]индол-6-ил]-1H-пиразол-3-карбоксилат.A) 5-[3-(2,4-Дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-ил]-1H-пиразол-3-карбоновая кислота. К раствору 0,364 г соединения, полученного в синтезе 1.12, в 10 мл EtOH, прибавляют 0,04 мл гидразинмоногидрата, затем кипятят с обратным холодильником в течение 5 ч. Концентрируют реакционную смесь под вакуумом и остаток хроматографируют на силикагеле, элюируя при помощи AcOEt, затем с градиентом смеси AcOEt/MeOH/триэтиламин (45/45/10; об./об./об.). Получают 0,27 г целевого соединения, которое используют без очистки.B) Метил-5-[3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1 Н-пиридо[2,3-b]индол-6-ил]1 Н-пиразол-3-карбоксилат. К раствору, содержащему 0,27 г соединения, полученного на предыдущей стадии, в 5 мл МеОН,добавляют 0,1 мл H2SO4 и кипятят с обратным холодильником в течение 12 ч. Реакционную смесь концентрируют под вакуумом, обрабатывают остаток смесью пиридин/МеОН, растирают, центрифугируют нерастворившуюся часть и промывают ее МеОН. Фильтрат хроматографируют на силикагеле, элюируя при помощи AcOEt. Получают 0,068 г целевого соединения. Т.пл.=290-292 С. Пример 44. Соединение 45. Метил-5-[3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1Hпиридо[2,3-b]индол-6-ил]-изоксазол-3-карбоксилат. К раствору 0,364 г соединения, полученного в синтезе 1.12, в 5 мл МеОН прибавляют 0,156 г гидрохлорида гидроксиламина, затем кипятят с обратным холодильником в течение 4 ч. Концентрируют реакционную смесь в вакууме и остаток хроматографируют на силикагеле, элюируя при помощи AcOEt. Обрабатывают остаток МеОН, центрифугируют образующийся осадок и промывают его МеОН, затем эфиром. Получают 0,037 г целевого соединения. Т.пл.=280-281 С. Пример 45. Соединение 46. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(4-метилизоксазол-5-ил)-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. К суспензии 0,3 г соединения, полученного в синтезе 1.13, в 7 мл МеОН прибавляют 0,09 г гидрохлорида гидроксиламина и оставляют на 48 ч для перемешивания при ТА. Центрифугируют образующийся осадок и промывают его смесью циклогексан/AcOEt (75/25; об./об.). Получают 0,25 г целевого соединения. Т.пл.=233-234 С. Пример 46. Соединение 47. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(3-метил-1H-пиразол-5-ил)-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. Перемешивают в течение ночи при ТА раствор, содержащий 0,12 г соединения, полученного в синтезе 1.14, и 0,109 г гидразинмоногидрата в 3 мл МеОН. Растворяют реакционную смесь добавлениемDCM и МеОН и хроматографируют на силикагеле, элюируя при помощи AcOEt, затем смесьюAcOEt/MeOH (95/5; об./об.). Получают 0,09 г целевого соединения. Т.пл.=309-310 С. Пример 47. Соединение 48. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(1H-1,2,3-триазол-4-ил)-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. Нагревают в микроволновой печи при температуре 190C в течение 30 мин смесь 0,178 г соединения, полученного в синтезе 1.15, 0,410 г NaN3 и 0,337 г NH4Cl в 5 мл DMF. Прибавляют насыщенный раствор NaHCO3, экстрагируют при помощи AcOEt, сушат органическую фазу над MgSO4 и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью AcOEt/циклогексан (70,30; об./об.). Полученный продукт обрабатывают смесью DCM/MeOH и центрифугируют образующийся осадок. Получают 0,031 г целевого соединения. Т.пл.=274-275 С. Пример 48. Соединение 49. 6-(5-Амино-1,3,4-тиадиазол-2-ил)-3-(2,4-дихлорфенил)-1,9-диметил 1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. К раствору 0,6 г соединения, полученного в синтезе 1.16, в 6 мл POCl3 прибавляют 0,15 г гидразинкарботиамида, затем кипятят с обратным холодильником в течение 3 ч. Охлаждают реакционную смесь,добавляют по каплям воду до образования осадка, затем кипятят с обратным холодильником в течение 2 ч. После охлаждения до ТА подщелачивают смесь добавлением 1 н. NaOH, центрифугируют осадок, обрабатывают его смесью DCM/MeOH и хроматографируют на силикагеле, элюируя смесью AcOEt/MeOH/NH4OH (95/5/0,5; об./об./об.). Получают 0,065 г целевого соединения. Т.пл.=321-323 С. Пример 49. Соединение 50. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(5-метил-1,3-оксазол-2-ил)-1,9 дигидро-2H-пиридо[2,3-b]индол-2-он. Нагревают при 120C в течение 4 ч смесь, состоящую из 0,21 г соединения, полученного в синтезе 1.17, 0,017 г ацетата ртути и 5,5 мл уксусной кислоты. Концентрируют под вакуумом, обрабатывают остаток насыщенным раствором K2CO3, экстрагируют при помощи DCM, сушат органическую фазу надMgSO4 и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикагеле, элюируя при помощи AcOEt, затем смесью AcOEt/MeOH (99/1; об./об.). Растирают полученный продукт в МеОН и центрифугируют образующийся осадок. Получают 0,076 г целевого соединения. Т.пл.=289-292 С. Пример 50. Соединение 30. Соединение 30, указанное в таблице, получено так, как описано в примере 29. Пример 51. 3-(2,4-Дихлорфенил)-6[1-(2-гидроксиэтил)-1 Н-пиразол-3-ил]-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он.[2,3-b]индол-2-он. Нагревают при 45 С в течение 16 ч раствор, содержащий 311 мг (0,56 ммоль) соединения А, т.е. 3(2,4-дихлорфенил)-1,9-диметил-6-1-[2-(тетрагидропиран-2-илокси)этил]-1 Н-пиразол-3-ил-1,9-дигидропиридо[2,3-b]индол-2-она, 2,7 мл уксусной кислоты, 1,3 мл THF и 0,7 мл H2O. Охлаждают реакционную среду, адсорбируют на диоксиде кремния и очищают флеш-хроматографией, элюируя смесьюAcOEt/циклогексан 20%, затем 100% AcOEt и, в заключение, AcOEt/МеОН 5%. Обрабатывают остаток при помощи МеОН, фильтруют и промывают с помощью МеОН. Получают 147 мг продукта белого цвета. Т.пл.=239-240 С. ЯМР 1 Н : ДМСО-d6 (300 МГц): 3,80 (д, J=5,08, 2H); 4,02 (с, 3H); 4,19 (м, 5 Н); 4,95 (м, 1 Н); 6,70 (д,J=2,16, 1H); 7,46 (м, 2 Н); 7,62 (д, J=8,64, 1H); 7,70 (д, J=1,62, 1H); 7,71-7,81 (м, 2 Н); 8,30 (с, 2 Н). Пример 52. 3-(2,4-Дихлорфенил)-6-(2-этил-4-метил-2 Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он. Работают так, как указано в примере 37, описанном выше, исходя из 3-(2,4-дихлорфенил)-6-(3 диметиламино-2-метилакрилоил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-она, полученного в синтезе 1.13, описанном выше, и этилгидразиноксалата. ЯМР 1 Н ДМСО-d6 (300 МГц): 1,20 (т, J=7,1, 3 Н), 1,94 (с, 3 Н); 3,97-7,04 (м, 5 Н); 4,20 (с, 3H); 7,25 (д,J=8,4, 1H); 7,35 (с, 1 Н); 7,42-7,49 (м, 2 Н); 7,69 (с, 1 Н); 7,74 (д, J=8,4, 1H); 7,91 (с, 1 Н); 8,32 (с, 1 Н). Пример 53. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(4-метил-2 Н-пиразол-3-ил)-1,9-дигидропиридо[2,3b]индол-2-он. Работают так, как указано в примере 40, описанном выше, исходя из 3-(2,4-дихлорфенил)-6-(3- 27014873 диметиламино-2-метилакрилоил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-она, полученного в Синтезе 1.13, описанном выше, и гидразингидрата. ЯМР 1 Н ДМСО-d6 (300 МГц): 2,23 (с, 3H); 4,03 (с, 3H); 4,18 (с, 3 Н); 7,43-7,57 (м, 4 Н); 7,67-7,70 (м,2 Н); 8,09 (с, 1 Н); 8,31 (с, 1 Н); 12, 67 (с, 1 Н). Пример 54. 3-(2,4-Дихлорфенил)-1,9-диметил-6-(3-метилизоксазол-5-ил)-1,9-дигидропиридо[2,3-b] индол-2-он. Работают так, как указано в примере 44, описанном выше, исходя из 1-[3-(2,4-дихлорфенил)-1,9 диметил-2-оксо-2,9-дигидро-1 Н-пиридо[2,3-b]индол-6-ил]-бутан-1,3-диона, полученного в Синтезе 1.14,описанном выше, и гидрохлорида гидроксиламина. Т.пл.=288-289 С. ЯМР 1 Н ДМСО-d6 (300 МГц): 2,29 (с, 3H); 4,02 (с, 3H); 4,20 (с, 3H); 6,80 (с, 1 Н); 7,40-7,51 (м, 2 Н); 7,70 (д, J=1,93, 1H); 7,75 (д, J=1,69, 2 Н); 8,34 (с, 1 Н); 8,42 (с, 1 Н). Пример 55. 6-(5-Аминоизоксазол-3-ил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидропиридо[2,3-b] индол-2-он. Перемешивают при 50 С в течение 24 ч, затем при комнатной температуре в течение 18 ч раствор,содержащий 300 мг (0,707 ммоль) соединения 3-[3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро 1 Н-пиридо[2,3-b]индол-6-ил]-3-оксопропионитрила, полученного в примере 20 А, 238 мг (2,9 ммоль) ацетата натрия и 152 мг (2,2 ммоль) гидрохлорида гидроксиламина в 4 мл СН 2 С 12 и 4 мл MeOH. Концентрируют реакционную среду путем абсорбирования на диоксиде кремния, очищают на колонке с диоксидом кремния, элюируя смесю AcOEt/циклогексан 20%, затем 100% AcOEt. Получают 67 мг порошка бежевого цвета. Т.пл.=234-235 С. ЯМР 1 Н ДМСО-d6 (300 МГц): 4,01 (с, 3H); 4,18 (с, 3H); 5,44 (с, 1 Н); 6,74 (с, 2 Н); 7,40-7,50 (м, 2 Н); 7,68 (м, 3H); 8,27 (с, 1 Н); 8,31 (с, 1 Н). Пример 56. 3-(2,4-Дихлорфенил)-6-(2-этоксиметилоксазол-5-ил)-1-метил-1,9-дигидропиридо-[2,3-b] индол-2-он. А) Соединение A. N-2-[3-(2,4-Дихлорфенил)-1-метил-2-оксо-2,9-дигидро-1 Н-пиридо[2,3-b]индол 6-ил]-2-оксоэтил-2-этоксиацетамид. Растворяют 756 мг (1,73 ммоль) гидрохлорида 6-(аминоацетил)-3-(2,4-дихлорфенил)-1-метил-1,9 дигидро-2 Н-пиридо[2,3-b]индол-2-она, полученного в примере 5 А, описанном выше, 180 мкл (1,90 ммоль) этоксиуксусной кислоты, 991 мг (1,90 ммоль) PyBOP и 905 мкл (5,2 ммоль) диизопропилэтиламина в 9 мл CH2Cl2. Перемешивают при комнатной температуре в течение 16 ч. Добавляют насыщенный раствор NH4Cl, затем экстрагируют с помощью CH2Cl2, сушат над MgSO4, фильтруют и концентрируют под вакуумом. Очищают путем хроматографии на колонке из диоксида кремния, элюируя при помощиAcOEt, затем смесью AcOEt/MeOH 3%. Получают 841 мг масла коричневого цвета. ЯМР 1 Н ДМСО-d6 (300 МГц): 1,17-1,35 (м, 3H); 3,58 (м, 2 Н); 3,70 (с, 3H); 3,94 (с, 2 Н); 4,74 (д,J=5,34, 2H); 7,40-7,52 (м, 2 Н); 7,59 (д, J=8,54, 1 Н); 7,70 (с, 1 Н); 7,90 (д, J=8,51, 1H); 7,95 (м, 1 Н); 8,37 (с,1 Н); 8,71 (с, 1 Н).B) 3-(2,4-Дихлорфенил)-6-(2-этоксиметилоксазол-5-ил)-1-метил-1,9-дигидропиридо-[2,3-b]индол-2 он. Перемешивают при комнатной температуре в течение 20 ч раствор соединения A, т.е. N-2-[3-(2,4 дихлорфенил)-1-метил-2-оксо-2,9-дигидро-1 Н-пиридо[2,3-b]индол-6-ил]-2-оксоэтил-2-этоксиацетамида(841 мг, 1,73 ммоль) в 2 мл H2SO4. Добавляют Н 2 О, экстрагируют с помощью EtOAc и CH2Cl2, концентрируют без высушивания. Адсорбируют на диоксиде кремния и очищают путем хроматографии на колонке с диоксидом кремния, элюируя с помощью AcOEt. Обрабатывают остаток в Et2O, фильтруют и промывают минимальным количеством Et2O. Получают 372 мг порошка бежевого цвета. Т.пл.=320 С (разл.) ЯМР 1 Н ДМСО-d6 (300 МГц): 1,16 (т, J=6,99, 3H); 3,52-3,62 (кв, J=3,72, 2 Н); 3,70 (с, 3H); 4,58 (с,2 Н); 7,40-7,50 (м, 2 Н); 7,55 (м, 1 Н); 7,58 (м, 2 Н); 7,70 (д, J=1,62, 1H); 8,26 (с, 1 Н); 8,30 (с, 1 Н); 12,35 (с,1 Н). Пример 57. 3-(2,4-Дихлорфенил)-6-(1,5-диметил-1 Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он. Работают так, как указано в примере 36, описанном выше, исходя из 3-(2,4-дихлорфенил)-1,9 диметил-6-(3-метил-1 Н-пиразол-5-ил)-1,9-дигидро-2 Н-пиридо[2,3-b]индол-2-она, полученного в примере 46, описанном выше, и иодметана. Т.пл.=286-287 С. ЯМР 1 Н ДМСО-d6 (300 МГц): 2,28 (с, 3H); 3,75 (с, 3H); 4,00 (с, 3H); 4,15 (с, 3H); 6,47 (с, 1 Н); 7,407,50 (м, 2 Н); 7,58 (д, J=8,61, 1 Н); 7,69 (м, 2 Н); 8,23 (д, J=1,24, 1H); 8,27 (с, 1 Н). Пример 58. 3-(2,4-Дихлорфенил)-6-(1-этил-5-метил-1 Н-пиразол-3-ил)-1,9-диметил-1,9-дигидропиридо[2,3-b]индол-2-он. Работают так, как указано в примере 36, описанном выше, исходя из 3-(2,4-дихлорфенил)-1,9 диметил-6-(3-метил-1 Н-пиразол-5-ил)-1,9-дигидро-2 Н-пиридо[2,3-b]индол-2-она, полученного в примереA) Соединение А. Этиловый эфир 4-[3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1Hпиридо[2,3-b]индол-6-ил]-2,4-диоксобутановой кислоты. Растворяют 940 мг (6,4 ммоль) диэтилоксалата в 5 мл безводного THF. Прибавляют 273 мг (6,8 ммоль) 60%-го NaH, затем перемешивают при комнатной температуре в течение 10 мин. Добавляют раствор 1,3 г (3,2 ммоль) соединения 6-(бромацетил)-3-(2,4-дихлорфенил)-1,9-диметил-1,9-дигидро-2 Нпиридо[2,3-b]индол-2-она, полученного в синтезе 1.2, описанном выше, и 18 мг (0,052 ммоль) дибензо 18-краун-6-эфира, растворенного в 20 мл безводного THF, а также несколько капель безводного EtOH. Нагревают при 70C в атмосфере аргона в течение 3 ч. Снижают температуру до комнатной. В реакционную среду добавляют AcOEt и промывают органическую фазу 1 н. раствором HCl. Испаряют досуха органическую фазу, растирают в воде полученный продукт и фильтруют. Обрабатывают с помощью EtOH и испаряют досуха. Получают 1,85 г оранжевого порошка. ЯМР 1 Н ДМСО-d6 (300 МГц): 1,32 (т, J=7,08, 3H); 4,03 (с, 3H), 4,21 (с, 3H); 4,29-4,36 (кв, J=7,07,2 Н); 7,30 (с, 1 Н), 7,43-7,52 (м, 2 Н); 7,71 (с, 1 Н); 7,80 (д, J=8,85, 1H); 8,00-8,04 (дд, J=1,74, J=8,77, 1 Н); 8,48B) этиловый эфир 5-[3-(2,4-дихлорфенил)-1,9-диметил-2-оксо-2,9-дигидро-1 Н-пиридо[2,3-b]индол 6-ил]-1-этил-1 Н-пиразол-3-карбоновой кислоты. Растворяют 930 мг (1,85 ммоль) соединения A, т.е. этилового эфира 4-[3-(2, 4-дихлорфенил)-1,9 диметил-2-оксо-2,9-дигидро-1 Н-пиридо[2,3-b]индол-6-ил]-2,4-диоксобутановой кислоты в 20 мл абсолютного этанола. Добавляют 583 мг (5,56 ммоль) этилгидразиноксалата и кипятят с обратным холодильником в течение ночи. Реакционную среду испаряют досуха и растирают остаток в насыщенном раствореK2CO3. Фильтруют и промывают водой. Очищают на колонке с диоксидом кремния с помощью AcOEt. Получают 510 мг продукта в виде белой пены. ЯМР 1 Н ДМСО-d6 (300 МГц): 1,28-1,33 (м, 6 Н); 4,03 (с, 3H); 4,18-4,32 (м, 7 Н), 6,83 (с, 1 Н); 7,39-7,50
МПК / Метки
МПК: C07D 471/04, A61P 35/00, A61K 31/4375
Метки: терапии, способ, производные, получения, применение, 6-гетероарилпиридоиндолона
Код ссылки
<a href="https://eas.patents.su/30-14873-proizvodnye-6-geteroarilpiridoindolona-sposob-ih-polucheniya-i-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 6-гетероарилпиридоиндолона, способ их получения и применение в терапии</a>
Предыдущий патент: Азиридинилэпотилоновые соединения
Следующий патент: Соединения для ингибирования апоптоза
Случайный патент: Система учета тепла для однотрубной вертикальной системы отопления здания или сооружения












