Карбаматные соединения в качестве агонистов рецептора 5-нт4
Номер патента: 14819
Опубликовано: 28.02.2011
Авторы: Маркесс Дэниэл, Чои Сеок-Ки, Лонг Дэниэл, Голдблум Адам, Фазери Пол Р.
Формула / Реферат
1. Соединение формулы (I)
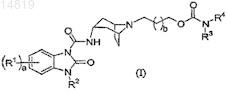 ,
,
в котором R1 является галогеном или C1-3алкилом, где C1-3алкил необязательно замещен гидроксилом или галогеном;
R2 является водородом или C1-3алкилом, где C1-3алкил необязательно замещен гидроксилом;
R3 является C1-3алкилом или водородом;
R4 является -(СН2)1-3C(О)NRaRb,
![]()
или R3и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент, выбранный из:
(i) формулы (a)
![]()
(ii) формулы (b)
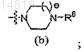
(iii) формулы (c)
![]()
где R5 является -OC(O)NRaRb, -C(O)NRaRb, -NRdS(О)2С1-3алкилом, -NRdC(O)Rc, -NRdS(O)2NRaRb или
-NRdC(O)ORe;
R6является -C(O)Rf, -(CH2)2ORg, -S(O)2NRaRb, -S(O)2C1-3алкилом или -S(O)2(CH2)1-3S(O)2C1-3алкилом;
Ra, Rb и Rc являются независимо водородом или C1-3алкилом;
Rd является водородом или C1-3алкилом, в котором C1-3алкил необязательно замещен гидроксилом;
Re является C1-3алкилом;
Rf является водородом, C1-3алкилом, тетрагидрофуранилом или -NRaRb;
Rg является водородом или C1-3алкилом;
a=0, 1 или 2;
b=0, 1, 2 или 3;
c=0, 1 или 2;
d=1 или 2 и
e=1 или 2;
при условии, что когда c=0, тогда d=2 и R5 является -C(O)NRaRb; а когда c=2, тогда d=1;
или его фармацевтически приемлемой соли, или сольвата, или стереоизомера.
2. Соединение по п.1, в котором a=0.
3. Соединение по п.1, в котором R2 является этилом или изопропилом.
4. Соединение по п.1, в котором b=1.
5. Соединение по п.1, в котором R3 и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент формулы (b).
6. Соединение по п.1, в котором R3 и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент формулы (c).
7. Соединение по п.1, в котором
R2 является этилом или изопропилом;
R3 является C1-3алкилом и
R4 является -(CH2)1-3C(O)NRaRb или ![]() ,
,
или R3и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент, выбранный из формул (a)-(c);
R5 является -OC(O)NRaRb или -C(O)NRaRb;
R6 является -C(O)Rf, -(CH2)2ORgили -S(O)2NRaRb;
Ra, Rb и Rg являются независимо водородом или метилом;
Rf является метилом, тетрагидрофуранилом или -NRaRb;
Rg является водородом или C1-3алкилом;
a=0;
b=1;
c=1 или 2;
d=1 и
e=1.
8. Соединение по п.7, в котором R3 и R4вместе с атомом азота, к которому они присоединены, образуют фрагмент формулы (b), где R6 является -C(O)Rf.
9. Соединение по п.1, в котором это соединение выбрано из
3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло-[3.2.1]окт-8-ил}пропилового сложного эфира 4-(тетрагидрофуран-2-карбонил)пиперазин-1-карбоновой кислоты;
3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло-[3.2.1]окт-8-ил}пропилового сложного эфира 4-(2-гидроксиэтил)пиперазин-1-карбоновой кислоты;
3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло-[3.2.1]окт-8-ил}пропилового сложного эфира 4-ацетилпиперазин-1-карбоновой кислоты;
3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло-[3.2.1]окт-8-ил}пропилового сложного эфира 4-диметилкарбамоилоксипиперидин-1-карбоновой кислоты;
3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло-[3.2.1]окт-8-ил}пропилового сложного эфира 3-карбамоилпиперидин-1-карбоновой кислоты;
3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло-[3.2.1]окт-8-ил}пропилового сложного эфира 1,1-диоксо-1l6-тиоморфолин-4-карбоновой кислоты;
3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло-[3.2.1]окт-8-ил}пропилового сложного эфира (1,1-диоксотетрагидро-1l6-тиофен-3-ил)метилкарбаминовой кислоты;
3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло-[3.2.1]окт-8-ил}пропилового сложного эфира (R)-2-карбамоилпирролидин-1-карбоновой кислоты;
3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло-[3.2.1]окт-8-ил}пропилового сложного эфира 4-ацетил[1,4]диазепан-1-карбоновой кислоты;
3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло-[3.2.1]окт-8-ил}пропилового сложного эфира диметилкарбамоилметилметилкарбаминовой кислоты;
3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло-[3.2.1]окт-8-ил}пропилового сложного эфира 4-диметилкарбамоилпиперазин-1-карбоновой кислоты и
3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло-[3.2.1]окт-8-ил}пропилового сложного эфира 4-диметилсульфамоилпиперазин-1-карбоновой кислоты и
их фармацевтически приемлемые соли, сольваты или стереоизомеры.
10. Соединение по п.1, в котором этим соединением является 3-{(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-ил}пропиловый сложный эфир 1,1-диоксо-1l6-тиоморфолин-4-карбоновой кислоты или его фармацевтически приемлемые соль, сольват или стереоизомер.
11. Фармацевтическая композиция для лечения медицинских состояний, связанных с активностью рецептора 5-HT4, содержащая терапевтически эффективное количество соединения по любому из пп.1-10 и фармацевтически приемлемый носитель.
12. Применение соединения по любому из пп.1-10 для использования в терапии.
13. Применение соединения по любому из пп.1-10 для производства медикамента для лечения медицинского состояния у млекопитающего, сопряженного с активностью рецептора 5-HT4.
14. Применение по п.13, в котором медицинское состояние является расстройством пониженной моторики желудочно-кишечного тракта.
15. Применение по п.14, в котором расстройство пониженной моторики является хроническим запором, синдромом раздраженной толстой кишки, сопровождающимся преимущественно запором, диабетическим и идиопатическим гастропарезом или функциональной диспепсией.
16. Способ получения соединения формулы (I)
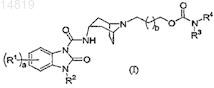 ,
,
в котором R1, R2, R3, R4, a и b определены в п.1,
или его соли, или сольвата, или стереоизомера;
способ включает:
(a) реакцию соединения формулы (III)
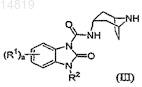
с соединением формулы (IV)
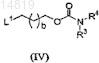 ,
,
в котором L1 является уходящей группой; или
(b) реакцию соединения формулы (V)

в котором A является уходящей группой,
с соединением формулы (VI)
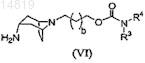
для получения соединения формулы (I) или его соли, или сольвата, или стереоизомера.
17. Способ лечения млекопитающего с медицинским состоянием, сопряженным с активностью рецептора 5-HT4, включающий введение млекопитающему терапевтически эффективного количества фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение по любому из пп.1-10.
18. Способ по п.17, в котором медицинское состояние является синдромом раздраженной толстой кишки, хроническим запором, функциональной диспепсией, задержкой опорожнения желудка, гастроэзофагальной рефлюксной болезнью, гастропарезом, послеоперационной кишечной непроходимостью, кишечной псевдонепроходимостью и задержкой прохождения, обусловленной действием лекарственных средств (наркотиков).
19. Способ лечения расстройства пониженной моторики желудочно-кишечного тракта у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение по любому из пп.1-10.
20. Способ по п.19, в котором расстройство пониженной моторики является хроническим запором, синдромом раздраженной толстой кишки, сопровождающимся преимущественно запором, диабетическим и идиопатическим гастропарезом или функциональной диспепсией.
21. Способ исследования биологической системы или образца, содержащих рецептор 5-HT4, включающий:
(a) приведение этой биологической системы или образца в контакт с соединением по любому из пп.1-10 и
(b) определение эффекта, вызванного этим соединением, в биологической системе или образце.
Текст
КАРБАМАТНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АГОНИСТОВ РЕЦЕПТОРА 5-HT4 Изобретение обеспечивает создание новых агонистов рецептора 5-НТ 4, являющихся бензоимидазолон-карбоксамидными производными карбаматных соединений формулы (I) в которой R1, R2, R3, R4, a и b определены в описании изобретения. Изобретение также обеспечивает создание фармацевтических композиций, содержащих такие соединения, способы использования таких соединений для лечения заболеваний, сопряженных с активностью рецептора 5-НТ 4,и способы и интермедиаты, пригодные для приготовления таких соединений. 014819 Предпосылки создания изобретения Область техники, к которой относится изобретение Это изобретение направлено на создание бензоимидазолон-карбоксамидных производных карбаматных соединений, применимых в качестве агонистов рецептора 5-HT4. Это изобретение также направлено на создание фармацевтических композиций, содержащих такие соединения, способ применения таких соединений для лечения или предупреждения медицинских состояний, опосредуемых активностью рецептора 5-HT4, и способов и интермедиатов, применимых для получения таких соединений. Уровень техники Серотонин (5-гидрокситриптамин, 5-HT) является нейротрансмиттером, широко распространенным в организме, как в центральном, так и в периферическом отделах нервной системы. Идентифицировано не менее семи подтипов рецепторов серотонина и показаны взаимосвязи между многими физиологическими функциями и взаимодействием серотонина с этими различными рецепторами. Поэтому имеется значительный интерес к разработке терапевтических агентов, нацеленных на конкретные подтипы рецепторов 5-HT. В частности, характеристика рецептора 5-HT4 и идентификация фармацевтических агентов, взаимодействующих с ними, была в центре внимания значительных недавних исследований. (См., например,обзор Langlois and Fischmeister, J. Med. Chem. 2003, 46, 319-344). Агонисты рецептора 5-HT4 применимы для лечения расстройств пониженной моторики желудочно-кишечного тракта. Такие расстройства включают синдром раздраженной толстой кишки (СРТК), хронический запор, функциональную диспепсию,задержку опорожнения желудка, гастроэзофагальную рефлюксную болезнь (ГЭРВ), гастропарез, послеоперационную кишечную непроходимость, кишечную псевдонепроходимость и задержку прохождения,обусловленную действием лекарственных средств (или наркотиков). Кроме того, предполагают, что некоторые соединения-агонисты рецептора 5-HT4 можно использовать для лечения расстройств центральной нервной системы, включая расстройства познавательных способностей, поведенческие расстройства,расстройства настроения и расстройства контроля вегетативных функций. Несмотря на широкую применимость фармацевтических агентов, модулирующих активность рецептора 5-HT4, в настоящее время в клинике применяют мало соединений, являющихся агонистами рецептора 5-HT4. В соответствии с этим имеется необходимость в новых агонистах рецептора 5-HT4, обеспечивающих достижение требуемых эффектов с минимальными побочными эффектами. Предпочтительные агенты могут обладать, наряду с другими свойствами, повышенной селективностью, эффективностью, фармакокинетическими свойствами и/или длительностью действия. Сущность изобретения Это изобретение обеспечивает создание новых соединений, обладающих активностью агонистов рецептора 5-HT4. Показано, что наряду с другими свойствами соединения этого изобретения являются сильными и селективными агонистами рецептора 5-HT4. Кроме того, соединения этого изобретения демонстрируют благоприятные фармакокинетические свойства, которые предполагают хорошую биодоступность при пероральном введении. В соответствии с этим данное изобретение относится к созданию соединения формулы (I) в которой R1 является галогеном или C1-3 алкилом, где C1-3 алкил необязательно замещен гидроксилом или галогеном;R2 является водородом или C1-3 алкилом, где C1-3 алкил необязательно замещен гидроксилом;Ra, Rb и Rc являются независимо водородом или C1-3 алкилом;Rd является водородом или C1-3 алкилом, в котором C1-3 алкил необязательно замещен гидроксилом;Rg является водородом или C1-3 алкилом;e=1 или 2; при условии, что когда c=0, тогда d=2 и R5 является -C(O)NRaRb; а когда c=2, тогда d=1; или фармацевтически приемлемой его соли, или сольвата, или стереоизомера. Это изобретение также относится к созданию фармацевтической композиции, содержащей соединение этого изобретения и фармацевтически приемлемый носитель. Кроме того, это изобретение относится к способу лечения заболевания или патологического состояния, обусловленного активностью рецептора 5-HT4, т.е. расстройства пониженной моторики желудочно-кишечного тракта; этот способ включает введение млекопитающему терапевтически эффективного количества соединения или фармацевтической композиции этого изобретения. Соединения этого изобретения можно также применять в качестве инструментов исследований, например для изучения биологических систем или образцов или для изучения активности других химических соединений. В соответствии с этим в других методических аспектах этого изобретения оно предоставляет способ применения соединения формулы (I) или его фармацевтически приемлемой соли, или сольвата, или стереоизомера в качестве инструмента для исследования биологической системы или образца или для открытия новых агонистов рецептора 5-HT4; этот способ заключается в контактировании биологической системы или образца с соединением этого изобретения и определении эффектов, вызванных этим соединением в биологической системе или образце. В отдельных и специальных аспектах это изобретение относится к способам синтеза и интермедиатам, описанным здесь и применимым для приготовления соединений этого изобретения. Это изобретение также относится к созданию соединения этого изобретения, описанного здесь, для применения в терапии, а также использованию соединения этого изобретения в производстве лекарственной формы или медикамента для лечения заболевания или патологического состояния, связанного с активностью рецептора 5-HT4, т.е. расстройства пониженной моторики желудочно-кишечного тракта у млекопитающего. Подробное описание изобретения Это изобретение относится к созданию новых бензоимидазолон-карбоксамидных производных карбаматных агонистов рецептора 5-HT4 формулы (I) или их фармацевтически приемлемых солей, или сольватов, или стереоизомеров. Следующие заместители и значения предназначены для представления типичных примеров различных аспектов этого изобретения. Эти типичные значения предназначены для дополнительного определения таких аспектов и не предназначены для исключения других значений или для ограничения объема притязаний этого изобретения. В предпочтительных аспектах этого изобретения R1 является галогеном или C1-3 алкилом или R1 является фтором, хлором, бромом или метилом. В предпочтительном аспекте R2 является водородом. В другом предпочтительном аспекте R2 является C1-3 алкилом, в котором C1-3 алкил необязательно замещен гидроксилом. В еще одном предпочтительном аспекте R2 является водородом или C1-3 алкилом. В других предпочтительных аспектах этого изобретения R2 является метилом, этилом, пропилом или изопропилом; R2 является этилом или изопропилом или R2 является изопропилом. В предпочтительных аспектах R3 является C1-3 алкилом; R3 является метилом или этилом или R3 является метилом. В предпочтительном аспекте R4 является -(CH2)1-3C(O)NRaRb. В другом предпочтительном аспекте R4 является. В еще одном предпочтительном аспекте R4 является -(CH2)1-3C(O)NRaRb или В предпочтительном аспекте этого изобретения R3 и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент формулы (a), (b) и (c). В предпочтительном аспекте R3 и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент формулы (a). В другом предпочтительном аспекте R3 и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент формулы (a), в которой R5 является -OC(O)NRaRb или-C(O)NRaRb. В предпочтительном аспекте R3 и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент формулы (b). В другом предпочтительном аспекте R3 и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент формулы (b), в которой R6 является -C(O)Rf, -(CH2)2ORg или-S(О)2NRaRb или R6 является -C(O)Rf и e=1. В еще одном аспекте изобретения R3 и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент формулы (c). В предпочтительных аспектах Ra, Rb, Rc, Rd и Rg независимо являются водородом, метилом или этилом или Ra, Rb, Rc, Rd и Rg независимо являются водородом или метилом. В предпочтительных аспектах Re является метилом или этилом или Re является метилом. В предпочтительных аспектах Rf является C1-3 алкилом, тетрагидрофуранилом или -NRaRb или Rf является метилом, тетрагидрофуранилом или -NRaRb. В другом предпочтительном аспекте Rf является тетрагидрофуранилом. В другом предпочтительном аспекте Rf является C1-3 алкилом или Rf является метилом. В еще одном другом предпочтительном аспекте Rf является -NRaRb, в котором Ra и Rb определены здесь. В предпочтительных аспектах a=0 или 1 или а=0 или 2. В другом предпочтительном аспекте a=0. В предпочтительных аспектах b=0, 1 или 2 или b=1 или 2. В другом предпочтительном аспекте b=1. В предпочтительном аспекте c=1 или 2. В другом предпочтительном аспекте c=1. В предпочтительном аспекте d=1. В предпочтительном аспекте e=1. В одном аспекте изобретение представляет соединение формулы (I), в которой c=1 или 2; d=1 и e=1. В другом аспекте изобретение представляет соединение формулы (I), в которомR4 является -(CH2)1-3C(О)NRaRb или или R3 и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент, выбранный из формул (a)-(c); в которомR6 является -C(O)Rf, -(CH2)2ORg или -S(O)2NRaRb. В еще одном другом аспекте это изобретение представляет соединение формулы (I), где R3 и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент, выбранный из формул (a)-(c),в котором:Ra, Rb и Rg независимо являются водородом или метилом;c=1 или 2; d=1 и e=1. В еще одном аспекте изобретение представляет соединение формулы (I), в которомR2 является этилом или изопропилом;R4 является - (СН 2)1-3C(О)NRaRb или или R3 и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент, выбранный из формул (a)-(c), в которомRa, Rb и Rg независимо являются водородом или метилом;-3 014819 Правила присвоения химических названий, использованные здесь, проиллюстрированы для соединения примера 1 которое в соответствии с программой AutoNom, поставляемой MDL Information Systems, GmbH (Франкфурт,Германия),названо 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1 карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловым сложным эфиром 4-(тетрагидрофуран-2 карбонил)пиперазин-1-карбоновой кислоты. Обозначение (1S,3R,5R) описывает относительную ориентацию связей бициклической кольцевой системы, которые изображены сплошными и пунктирными клиньями. Во всех соединениях этого изобретения, описанных выше, бензоимидазолон-карбоксамид расположен в эндоположении к азабициклооктановой группе. Особо можно отметить следующие соединения: 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловый сложный эфир 4-(тетрагидрофуран-2-карбонил)пиперазин-1 карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловый сложный эфир 4-(2-гидроксиэтил)пиперазин-1-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловый сложный эфир 4-ацетилпиперазин-1-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловый сложный эфир 4-диметилкарбамоилоксипиперидин-1-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловый сложный эфир 3-карбамоилпиперидин-1-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропиловый сложный эфир 1,1-диоксо-16-тиоморфолин-4-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловый сложный эфир (1,1-диоксотетрагидро-16-тиофен-3-ил)метилкарбаминовой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловый сложный эфир (R)-2-карбамоилпирролидин-1-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловый сложный эфир 4-ацетил-[1,4]диазепан-1-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловый сложный эфир диметилкарбамоилметил-метилкарбаминовой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловый сложный эфир 4-диметилкарбамоилпиперазин-1-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловый сложный эфир 4-диметилсульфамоилпиперазин-1-карбоновой кислоты. Как показано на конкретных соединениях, перечисленных выше, соединения изобретения могут содержать один или более хиральных центров. Соответственно это изобретение включает рацемические смеси, чистые стереоизомеры и смеси таких изомеров, обогащенные стереоизомерами, если не указано иначе. Когда представлен конкретный стереоизомер, специалист в данной области должен понимать, что небольшие количества других стереоизомеров могут присутствовать в композиции этого изобретения,если не указано иначе, при условии, что присутствие таких других изомеров не делает невозможным какое-нибудь (любое) использование этой композиции.-4 014819 Определения В описаниях соединений, композиций и способов этого изобретения следующие термины имеют следующие значения, если не указано иначе. Термин "алкил" означает одновалентную насыщенную углеводородную группу, которая может быть линейной или разветвленной или одновременно и линейной, и разветвленной. Типичные алкильные группы включают, например, метил, этил, н-пропил (н-Пр), изопропил (и-Пр), н-бутил (н-Бу), вторбутил, изобутил, трет-бутил и т.п. Термин "галоген" означает фтор, хлор, бром или йод. Термин "соединение" означает соединение, полученное синтетически или любым другим способом,таким как метаболизм. Термин "терапевтически эффективное количество" означает количество, достаточное для обеспечения лечения при введении пациенту, нуждающемуся в лечении. Термин "лечение", как он использован здесь, означает лечение заболевания, расстройства или медицинского состояния у пациента, такого как млекопитающее (конкретно, человек), которое включает:(a) предотвращение появления заболевания, расстройства или медицинского состояния, т.е. профилактическое воздействие на пациента;(b) ослабление заболевания, расстройства или медицинского состояния, т.е. устранение или регресс заболевания, расстройства или медицинского состояния у пациента;(c) подавление заболевания, расстройства или медицинского состояния, т.е. замедление или приостановку развития заболевания, расстройства или медицинского состояния у пациента; или(d) ослабление симптомов заболевания, расстройства или медицинского состояния у пациента. Термин "фармацевтически приемлемая соль" означает соль, полученную из кислоты или основания,которая является приемлемой для введения пациенту, такому как млекопитающее. Такие соли можно получить из фармацевтически приемлемых неорганических или органических кислот и из фармацевтически приемлемых оснований. Обычно фармацевтически приемлемые соли соединений настоящего изобретения получают из кислот. Соли, полученные из фармацевтически приемлемых кислот, включают, но не ограничиваются ими,уксусную, адипиновую, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, бромисто-водородную, хлористо-водородную, молочную, малеиновую, яблочную, миндальную, метансульфоновую, муциновую (слизевую), азотную, пантотеновую, фосфорную, янтарную, серную, винную, п-толуолсульфоновую, ксинафоевую (1-гидрокси-2 нафтоевую кислоту), нафталин-1,5-дисульфоновую кислоты и им подобные. Термин "сольват" означает комплекс или агрегат, образованный одной или более молекул растворенного вещества, т.е. соединения этого изобретения или фармацевтически приемлемой его соли, и одной или более молекул растворителя. Такие сольваты обычно являются кристаллическими твердыми веществами с фиксированным молярным соотношением растворенного вещества и растворителя. Типичные растворители включают, например, воду, метанол, этанол, изопропанол, уксусную кислоту и т.п. Когда этим растворителем является вода, образованный сольват является гидратом. Следует понимать, что термин "или его фармацевтически приемлемая соль, или сольват, или стереоизомер" включает все формы, включая варианты с перестановкой слов "соль", "сольват" и "стереоизомер", такие как сольват фармацевтически приемлемой соли стереоизомера соединения формулы (I). Термин "уходящая группа" означает функциональную группу или атом, который может быть замещен другой функциональной группой или атомом в реакции замещения, такой как реакция нуклеофильного замещения. Например, типичные уходящие группы включают группы хлора, брома и йода; группы сульфоновых сложных эфиров, такие как мезилат, тозилат, брозилат, нозилат и т.п.; алкоксигруппы, такие как ацетоксигруппа, трифторацетоксигруппа и т.п. Термин "уходящая группа" также охватывает такие группы, как -OC6F5, -CCl3, пара-OC6H4NO2 и имидазолил. Термин "защищенное производное" означает производное конкретного соединения, в котором одна или более функциональных групп этого соединения защищены от нежелательных реакций с помощью защитной или блокирующей группы. Функциональные группы, которые могут быть защищены, включают, например, карбоксильные кислотные группы, аминогруппы, гидроксильные группы, карбонильные группы и т.п. Типичные защитные группы для карбоновых кислот включают сложные эфиры (такие как п-метоксибензиловый сложный эфир), амиды и гидразиды; для аминогрупп - карбаматы (такие как трет-бутоксикарбонил) и амиды; для гидроксильных групп - простые и сложные эфиры; для тиольных групп - простые и сложные тиоэфиры; для карбонильных групп - ацетали и кетали; и т.п. Такие защитные группы хорошо известны специалистам в данной области; они описаны, например, в T.W. Greene and-5 014819 Термин "аминозащитная группа" означает защитную группу, пригодную для предотвращения нежелательных реакций при аминном азоте. Типичные аминозащитные группы включают, но не ограничиваются ими, формил; ацильные группы, например алканоильные группы, такие как ацетил; алкоксикарбонильные группы, такие как трет-бутоксикарбонил (Boc); арилметоксикарбонильные группы, такие как бензилоксикарбонил (Cbz) и 9-флуоренилметоксикарбонил (Fmoc); арилметильные группы, такие как бензил (Bn), тритил (Tr) и 1,1-ди-(4'-метоксифенил)метил; силильные группы, такие как триметилсилил(TMS) и трет-бутилдиметилсилил (TBDMS); и т.п. Общие синтетические процедуры Соединения этого изобретения можно получить из легкодоступных исходных материалов с использованием следующих общих способов и методик. Хотя конкретный аспект настоящего изобретения проиллюстрирован приведенными ниже схемами, специалисты в данной области должны понимать, что все аспекты настоящего изобретения можно реализовать, используя способы, описанные здесь, или используя другие способы, реагенты и исходные материалы, известные специалистам в данной области. Следует также понимать, что там, где указаны типичные или предпочтительные условия процесса (т.е. температура реакции, времена, молярные соотношения реагентов, растворители, значения давления и т.д.),можно также использовать другие технологические условия, если не указано иначе. Оптимальные реакционные условия можно подбирать применительно к используемым конкретным реагентам или растворителю, и специалист в данной области может определить такие условия с помощью обычных методик оптимизации. Кроме того, специалисту в данной области должно быть очевидно, что обычные защитные группы могут быть необходимы для предотвращения нежелательных реакций определенных функциональных групп. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящие условия защиты и ее снятия хорошо известны в данной области. Например, многие защитные группы, а также их введение и удаление описаны в T.W. Greene and G.M. Wuts, Protecting Groups in OrganicSynthesis, Third Edition, Wiley, New York, 1999 и в ссылках, приведенных там. Заместители и переменные величины, показанные на следующих схемах, имеют значения, указанные здесь, если не оговорено иначе. В одном из способов синтеза соединение формулы (I) можно получить, как показано на схеме A. Схема A Бензоимидазолон-карбоксамидный тропановый интермедиат (III) реагирует с соединением формулы (IV), в котором L1 является уходящей группой, с образованием соединения формулы (I). Обычно L1 является SN2-специфичной уходящей группой, такой как хлор, йод или бром. Соединение формулы IV вводят в контакт с бензоимидазолон-карбоксамидом тропана (III), взятого в количестве от примерно 0,25 до примерно 1,5 экв., в инертном разбавителе в присутствии основания, такого какN,N-диизопропилэтиламин (DIPEA), и катализатора, такого как йодид натрия. Пригодные инертные разбавители включают диметилформамид, ацетонитрил, тетрагидрофуран, N-метил-2-пирролидон и т.п. Пригодные основания также включают, например, триэтиламин, 1,8-диазабицикло-[5.4.0]ундец-7-ен(DBU) и карбонат калия. Пригодные катализаторы также включают, например, йодид калия и йодид тетрабутиламмония. Эту реакцию обычно проводят при температуре от примерно 40 до примерно 100C в течение времени от примерно 2 до примерно 24 ч или до существенного завершения реакции. Продукт формулы (I) выделяют и очищают традиционными способами. Например, этот продукт можно сконцентрировать до сухого состояния при пониженном давлении, растворить в водном растворе слабой кислоты и очистить с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Следует понимать, что в способе схемы A и в других способах, описанных здесь, использующих соединение формулы (III), это соединение формулы (III) можно применять в форме свободного основания или в форме соли с соответствующим регулированием условий реакции, при необходимости, как это известно специалистам в данной области.-6 014819 Соединение формулы (III) можно получить, как показано на схеме B. Схема B В схеме B интермедиат (a), необязательно замещенный 1,3-дигидробензоимидазол-2-оном, реагирует с интермедиатом (b), в котором W является уходящей группой (такой как галоген, т.е. фтор, хлор или бром), а A является уходящей группой, выбранной таким образом, чтобы при других условиях она реагировала с W (такой как -OC6F5, -CCl3, пара-OC6H4NO2 или имидазол-1-ил); или W и A являются имидазол-1-илом; с образованием соединения формулы (V), которое реагирует с интермедиатом (c), в которомP1 представляет аминозащитную группу, такую как Boc, с образованием интермедиата (d). Защитную группу P1 стандартными способами удаляют из интермедиата (d) с образованием соединения формулы(III). Хотя оптимальные условия реакции могут изменяться в зависимости от конкретных использованных реагентов или растворителей, специалист в данной области может легко определить такие условия с помощью обычных способов оптимизации. Например, в типичном способе, использующем 4-нитрофенилхлорформиат в качестве интермедиата(b), бензоимидазолоновый интермедиат (a) растворяют в инертной атмосфере в инертном разбавителе,таком как тетрагидрофуран, эфир, ДМФ или в их комбинации, в присутствии сильного основания,такого как гидрид натрия, литий-диизопропиламин или н-бутиллитий, и вводят в контакт с 4-нитрофенилхлорформиатом, взятом в количестве от примерно 1 до примерно 1,3 экв. Смесь перемешивают при температуре от примерно 0 до примерно 40C в течение времени от примерно 12 до примерно 24 ч или до существенного завершения реакции с образованием активированного сложного эфира, соединения формулы (V). Это соединение формулы (V) выделяют и очищают или оно может реагироватьin situ с защищенным аминотропаном (интермедиатом (c в присутствии инертного разбавителя, такого как тетрагидрофуран, при температуре от примерно 30 до примерно 90C в течение времени от примерно 10 до примерно 24 ч с образованием защищенного интермедиата (d). Используя традиционные способы, удаляют аминозащитную группу P1 из интермедиата (d) с образованием бензоимидазолон-карбоксамида тропана соединения формулы (III). Вариант вышеописанного способа получения интермедиата (III) с использованием 4-нитрофенилхлорформиата в качестве интермедиата (b) описан в примере 13. Альтернативно, соединение формулы (I) можно получить, как показано на схеме C. Схема C Бензоимидазолон-карбоксамидный интермедиат (V) реагирует с тропан-алкилен-карбоксамидным соединением формулы (VI) с образованием соединения формулы (I). Соединение формулы (V), синтез которого описан в схеме B, либо выделяют и очищают, либо оно реагирует in situ с соединением формулы (VI) в присутствии инертного разбавителя, такого как тетрагидрофуран, при температуре от примерно 30 до примерно 90C в течение времени от примерно 10 до примерно 24 ч или до завершения реакции с образованием соединения формулы (I).-7 014819 Бензоимидазолоновый интермедиат (a) можно получить, как показано на схеме D. Схема D В схеме D необязательно замещенный 2-фторнитробензол реагирует с первичным амином, интермедиатом (e), с образованием интермедиата (f), который восстанавливают до диаминофенила, интермедиата (g). Этот диаминофенил реагирует с карбонилдиимидазолом в присутствии инертного разбавителя,такого как тетрагидрофуран, при температуре от примерно 20 до примерно 40C в течение времени от примерно 12 до примерно 30 ч с образованием бензоимидазолонового интермедиата (a). Типичный синтез соединения интермедиата (а) описан в препаративной методике 1. Замещенное соединение интермедиата (а) можно также легко получить способом, сходным с описанным в литературе. См., например, The Journal of Chemical Research (1), 21-22 (2005); Heteroatom Chemistry, 5 (5/6):437-40(1994) и Ger. Often., 3839743, 31 May 1990. Защищенный аминотропан, интермедиат (c), использованный в реакции, описанной в этом изобретении, получают из легкодоступного исходного материала. Например, в том случае, когда аминозащитной группой P1 является Boc, защищенный аминотропан можно приготовить, как показано на схеме E. Схема E Как подробно описано ниже в препаративной методике 2, чтобы получить Вос-защищенный интермедиат (c'), 2,5-диметокситетрагидрофуран приводят в контакт с бензиламином, взятым в количестве от примерно 1 до примерно 2 экв., с небольшим избытком (например, 1,1 экв.) 1,3-ацетондикарбоновой кислоты в кислом водном растворе в присутствии буферного агента, такого как гидрофосфат натрия. Реакционную смесь нагревают до температуры от примерно 60 до примерно 100C для декарбоксилирования всех карбоксилированных интермедиатов с получением продукта, 8-бензил-8-азабицикло[3.2.1]октан-3 она, обычно называемого N-бензилтропаноном. Этот N-бензилтропаноновый интермедиат обычно реагирует с небольшим избытком ди-трет-бутилдикарбоната (обычно (Boc)2O), например с 1,1 экв., в атмосфере водорода в присутствии переходного металла в качестве катализатора с образованием трет-бутилового сложного эфира 3-оксо-8 азабицикло[3.2.1]октан-8-карбоновой кислоты. Эту реакцию обычно проводят при комнатной температуре в течение времени от примерно 12 до примерно 72 ч. Наконец, трет-бутиловый сложный эфир 3-оксо-8-азабицикло[3.2.1]октан-8-карбоновой кислоты приводят в контакт с большим избытком (например, не менее чем с 25 экв.) формиата аммония в инертном разбавителе, таком как метанол, в присутствии переходного металла в качестве катализатора с образованием продукта, интермедиата (c) в эндоконфигурации с высокой стереоспецифичностью (например, при отношении эндо/экзо 99:1). Эту реакцию обычно проводят при комнатной температуре в течение времени от примерно 12 до примерно 72 ч или до существенного завершения реакции. Целесообразно добавлять формиат аммония отдельными порциями. Например, трет-бутиловый сложный эфир 3-оксо-8-азабицикло[3.2.1]октан-8-карбоновой кислоты приводят в контакт с начальной порцией формиата аммония от примерно 15 до примерно 25 экв. Спустя примерно 12-36 ч добавляют дополнительную порцию формиата аммония в количестве от примерно 5 до примерно 10 экв. Следующее добавление можно повторить после такого же интервала. Продукт, интемедиат (c), можно очистить традиционными способами, такими как щелочная экстракция. Соединение формулы (IV) можно легко получить стандартными способами из обычного исходного материала, как описано на схеме F. В схеме F интермедиат (h), в котором L1 и L2 являются уходящими группами, реагирует с вторичным амином (i) с образованием соединения формулы (IV). Этот вторичный амин (i) растворяют в инертном разбавителе, таком как дихлорметан, и добавляют интермедиат (h) в присутствии основания, такого как N,N-диизопропилэтиламин, при температуре от примерно 0 до примерно 40C в течение времени от примерно 30 мин до примерно 4 ч. Продукт, соединение формулы (IV), можно очистить традиционными способами, такими как ВЭЖХ. Обычно L1 и L2 являются уходящими галогеновыми группами, такими как хлор, йод, бром; мезилат также можно использовать в качестве уходящей группы L1. Применимые основания могут включать,например, триэтиламин, DBU и карбонат калия. Применимые инертные разбавители могут включать ацетонитрил, тетрагидрофуран и N,N-диметилформамид. Промежуточные соединения формул (h) и (i) доступны коммерчески или могут быть синтезированы из легкодоступных исходных материалов. Синтез многих вторичных аминов, т.е. промежуточных соединений формулы (i), которые можно использовать в схеме F, описан в разделе примеров. Соединение формулы (VI) можно получить, как показано на схеме G. Схема G В схеме G интермедиат (j), в котором P2 является аминозащитной группой, реагирует с соединением формулы (IV) с образованием защищенного интермедиата (k), с которого затем снимают защиту для получения соединения формулы (VI). Реакцию схемы G обычно проводят в условиях аминосочетания,описанного выше для реакции схемы A. Соединение формулы (j) можно приготовить, защищая аминный азот защищенного аминотропанового интермедиата (c) с помощью аминозащитной группы P2 и затем удаляя P1 с азота азабициклооктановой группы. Защитные группы P1 и P2 выбирают так, чтобы они удалялись при различных условиях. Например, если в качестве Р 1 выбран Boc, то в качестве P2 можно использовать Cbz. Защитную группуBoc обычно удаляют обработкой кислотой, такой как трифторуксусная кислота, с образованием соли этой кислоты и интермедиата. Если желательно, эту соль кислоты и интермедиата можно перевести в свободное основание обычной обработкой основанием. Защитную группу Cbz обычно удаляют гидрогенолизом над подходящим металлическим катализатором, таким как палладий на угле. Дальнейшие подробности относительно конкретных условий реакции и других способов получения типичных соединений этого изобретения или их промежуточных соединений описаны ниже в примерах. Соответственно в методическом аспекте это изобретение предоставляет способ получения соединения формулы (I) или его соли, или сольвата, или стереоизомера, в котором R1, R2, R3, R4, а и b определены здесь; этот способ включает:(a) реакцию соединения формулы (III)-9 014819 или (b) реакцию соединения формулы (V) с образованием соединения формулы (I) или его соли, или сольвата, или стереоизомера. В дополнительных вариантах осуществления это изобретение направлено на другие описанные здесь способы и на продукты, полученные любым из описанных здесь способов. Фармацевтические композиции Бензоимидазолон-карбоксамидные производные карбаматных соединений этого изобретения обычно вводят пациенту в форме фармацевтической композиции. Такие фармацевтические композиции можно вводить пациенту любым приемлемым способом, включая, но не ограничиваясь ими, оральный, ректальный, вагинальный, назальный, ингаляционный, местный (включая трансдермальный) и парентеральный способы введения. Соответственно в одном из аспектов, направленных на композицию, это изобретение направлено на создание фармацевтической композиции, содержащей фармацевтически приемлемый носитель или эксципиент и терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. Необязательно, но если желательно, такие фармацевтические композиции могут содержать и другие терапевтические и/или лекарственные агенты. Фармацевтические композиции настоящего изобретения обычно содержат терапевтически эффективное количество соединения настоящего изобретения или фармацевтически приемлемую его соль. Обычно такие фармацевтические композиции содержат от примерно 0,1 до примерно 95 мас.% активного агента, предпочтительно от примерно 5 до примерно 70 мас.% и более предпочтительно от примерно 10 до примерно 60 мас.% активного агента. В фармацевтических композициях настоящего изобретения можно использовать любой традиционный носитель или эксципиент. Выбор конкретного носителя или эксципиента, или комбинаций носителей или эксципиентов, будет зависеть от способа введения, применяемого для лечения конкретного пациента или типа медицинского состояния или заболевания. В этом отношении приготовление соответствующей фармацевтической композиции для конкретного способа введения известно для специалистов в области фармацевтики. Ингредиенты для таких композиций доступны коммерчески, например уSigma, P.О. Box 14508, St. Louis, MO 63178. Традиционные способы приготовления лекарственных форм описаны в Remington: The Science and Practice of Pharmacy, 20th Edition, Lippincott WilliamsWhite,Baltimore, Maryland (2000) и H.C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7thEdition, Lippincott WilliamsWhite, Baltimore, Maryland (1999). Типичные примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не ограничиваются ими, следующие: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу, такую как микрокристаллическая целлюлоза и ее производные, такие как натрий-карбоксиметилцеллюлоза,этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк;(8) эксципиенты, такие как масло какао и суппозиторные воски; (9) масла, такие как арахисовое масло,хлопковое масло, сафлоровое масло, сезамовое масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы (многоатомные спирты), такие как глицерин,сорбит, маннит и полиэтиленгликоль; (13) сложные эфиры, такие как этилолеат и этиллаурат; (14) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновая кислота; (16) апирогенная вода; (17) изотонический раствор соли; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатные буферные растворы и (21) другие нетоксичные совместимые вещества, применяемые в фармацевтических композициях. Фармацевтические композиции настоящего изобретения обычно готовят, тщательно и тонко перемешивая или гомогенизуя соединение этого изобретения с фармацевтически приемлемым носителем и одним или более необязательными ингредиентами. Если нужно или желательно, полученную однородную смесь можно затем оформить или загрузить в таблетки, капсулы, пилюли и т.п., используя традиционные способы и оборудование.- 10014819 Фармацевтические композиции этого изобретения предпочтительно формируют в единичные дозированные формы. Термин "единичная дозированная форма" означает физически дискретную единицу,пригодную для дозирования пациенту, т.е. каждая единица содержит конкретное количество активного агента, рассчитанное на произведение желаемого терапевтического эффекта, либо отдельно, либо в комбинации с одной или более дополнительных единиц. Например, такие единичные дозированные формы могут быть капсулами, таблетками, пилюлями и т.п. В предпочтительном варианте осуществления фармацевтические композиции этого изобретения пригодны для перорального введения. Фармацевтические композиции, пригодные для перорального введения, могут быть в форме капсул, таблеток, пилюль, пастилок, каше, драже, порошков, гранул или в виде раствора или суспензии в водной или неводной жидкости; или в виде жидкой эмульсии "масло-вводе" или "вода-в-масле"; или в виде эликсира или сиропа; и т.п.; каждая такая форма содержит конкретное количество соединения настоящего изобретения в качестве активного агента. Для перорального введения в твердой лекарственной форме (т.е. в виде капсул, таблеток, пилюль и т.п.) фармацевтические композиции этого изобретения должны содержать соединение настоящего изобретения в качестве активного агента и один или более фармацевтически приемлемых носителей, таких как цитрат натрия или дикальцийфосфат. Необязательно или альтернативно, такие твердые лекарственные формы могут также содержать: (1) наполнители или разбавители, такие как крахмалы, микрокристаллическая целлюлоза, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; (2) связующие,такие как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или камедь акации; (3) увлажнители, такие как глицерин; (4) дезинтеграторы, такие как агар-агар, карбонат кальция,крахмал картофеля или тапиоки, альгиновая кислота, определенные силикаты и/или карбонат натрия; (5) агенты, замедляющие растворение, такие как парафин; (6) ускорители абсорбции, такие как четвертичные аммонийные соединения; (7) смачивающие агенты, такие как цетиловый спирт и/или моностеарат глицерина; (8) абсорбенты, такие как каолин и/или бентонитовая глина; (9) смазывающие агенты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и/или их смеси; (10) красители и (11) буферные агенты. Агенты, способствующие выделению, смачивающие агенты, покрывающие агенты, подсластители,отдушки и ароматизаторы, консерванты и антиоксиданты также могут присутствовать в фармацевтических композициях этого изобретения. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, цистеингидрохлорид, бисульфат натрия, метабисульфат натрия, сульфит натрия и т.п.; (2) жирорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол(ВНТ), лецитин, пропилгаллат, альфа-токоферол и т.п.; и (3) хелаторы металлов, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТА), сорбит, винная кислота, фосфорная кислота и т.п. Покрывающие агенты для таблеток, капсул, пилюль и т.п. включают агенты, используемые для кишечных покрытий, такие как ацетат-фталат целлюлозы (CAP), поливинил-ацетат-фталат (PVAP), фталат гидроксипропилметилцеллюлозы, сополимеры метакриловой кислоты и сложных эфиров метакриловой кислоты, ацетат-тримеллитат целлюлозы (CAT), карбоксиметилэтилцеллюлоза (CMEC), ацетат-сукцинат гидроксипропилметилцеллюлозы (HPMCAS) и т.п. При желании фармацевтические композиции настоящего изобретения можно приготовить в лекарственной форме для медленного или контролируемого высвобождения активного ингредиента, используя, например, гидроксипропилметилцеллюлозу в различных пропорциях или другие полимерные матрицы, липосомы и/или микросферы. Кроме того, фармацевтические композиции настоящего изобретения могут необязательно содержать контрастные агенты и могут быть приготовлены таким образом, чтобы выделять активный ингредиент только, или предпочтительно, в определенной части желудочно-кишечного тракта и необязательно с задержкой выделения. Примеры таких композиций с заливкой, которые можно использовать, включают полимерные вещества и воски. Активный ингредиент может также быть в микроинкапсулированной форме, если это необходимо, с одним или более описанных выше эксципиентов. Применимые жидкие лекарственные формы включают, например, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Такие жидкие лекарственные формы обычно содержат активный ингредиент и инертный разбавитель, такой как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (такие как хлопковое, арахисовое, кукурузное, оливковое, касторовое и сезамовое масла),глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана и их смеси. Суспензии, в дополнение к активному ингредиенту, могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, сложные эфиры полиоксиэтиленсорбита и сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агарагар и трагакант и их смеси.- 11014819 Альтернативно, фармацевтические композиции этого изобретения готовят в лекарственной форме для ингаляционного введения. Фармацевтические композиции, применимые для ингаляционного введения, обычно имеют форму аэрозоля или порошка. Такие композиции обычно вводят, используя хорошо известные средства доставки, такие как дозирующие ингаляторы, порошковые ингаляторы, небулайзеры или аналогичные средства доставки. При ингаляционном введении с использованием контейнера под давлением фармацевтические композиции этого изобретения обычно содержат активный ингредиент и подходящий газ-вытеснитель, такой как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой пригодный газ. Кроме того, фармацевтическая композиция может быть в форме капсулы или картриджа (изготовленного, например, из желатина), содержащих соединение этого изобретения и порошок, пригодный для использования в порошковом ингаляторе. Пригодные порошковые основы включают, например, лактозу или крахмал. Соединение настоящего изобретения можно также вводить трансдермально, используя известные системы трансдермальной доставки и эксципиенты. Например, соединение этого изобретения можно смешать с усилителями проницаемости, такими как пропиленгликоль, монолаурат полиэтиленгликоля,азациклоалкан-2-оны и т.п., и включить в системы доставки типа пластырей. При желании в таких трансдермальных композициях можно использовать дополнительные эксципиенты, включая гелеобразующие агенты, эмульгаторы и буферные средства. Следующие лекарственные формы иллюстрируют типичные фармацевтические композиции настоящего изобретения. Пример лекарственной формы A. Твердые желатиновые капсулы для перорального введения готовят следующим образом. Типичная методика. Ингредиенты тщательно смешивают и затем загружают в твердую желатиновую капсулу (260 мг композиции в капсуле). Пример лекарственной формы B. Твердые желатиновые капсулы для перорального введения готовят следующим образом. Типичная методика. Ингредиенты тщательно смешивают и затем пропускают через сито 45 меш США и загружают в твердую желатиновую капсулу (200 мг композиции в капсуле). Пример лекарственной формы C. Капсулы для перорального введения готовят следующим образом. Типичная методика. Ингредиенты тщательно смешивают и затем загружают в желатиновую капсулу (310 мг композиции в капсуле).- 12014819 Пример лекарственной формы D. Таблетки для перорального введения готовят следующим образом. Типичная методика. Активный ингредиент, крахмал и целлюлозу пропускают через сито 45 меш США и тщательно смешивают. Раствор поливинилпирролидона смешивают с полученными порошками и затем эту смесь пропускают через сито 14 меш США. Полученные таким образом гранулы сушат при 50-60C и пропускают через сито 18 меш США. Затем к гранулам добавляют натрийкарбоксиметилкрахмал, стеарат магния и тальк (предварительно пропущенные через сито 60 меш США). После смешивания смесь прессуют на таблетировочной машине в таблетки массой 100 мг. Пример лекарственной формы E. Таблетки для перорального введения готовят следующим образом. Типичная методика. Ингредиенты тщательно перемешивают и затем прессуют в таблетки (440 мг композиции в таблетке). Пример лекарственной формы F. Простые рифленые таблетки для перорального введения готовят следующим образом. Типичная методика. Ингредиенты тщательно перемешивают и затем прессуют в простые рифленые таблетки (215 мг композиции в таблетке). Пример лекарственной формы G. Суспензию для перорального введения готовят следующим образом. Типичная методика. Ингредиенты смешивают, формируя суспензию, содержащую 10 мг активного ингредиента в 10 мл суспензии.- 13014819 Пример лекарственной формы H. Сухой порошок для ингаляционного введения готовят следующим образом. Типичная методика. Активный ингредиент измельчают до микронного размера частиц и затем смешивают с лактозой. Эту смесь затем загружают в желатиновые ингаляционные картриджи. Содержимое картриджа вводят с помощью порошкового ингалятора. Пример лекарственной формы I. Сухой порошок для ингаляционного введения дозирующим ингалятором готовят следующим образом. Типичная методика. Суспензию, содержащую 5 мас.% соединения настоящего изобретения и 0,1 мас.% лецитина, готовят диспергированием 10 г микронизованного активного соединения (со средним размером частиц менее 10 мкм) в растворе 0,2 г лецитина в 200 мл деминерализованной воды. Эту суспензию сушат распылением и полученный материал измельчают до среднего размера частиц менее 1,5 мкм. Эти частицы загружают в картриджи со сжатым 1,1,1,2-тетрафторэтаном. Пример лекарственной формы J. Лекарственную форму для инъекций готовят следующим образом. Типичная методика. Указанные выше ингредиенты смешивают и рН доводят до 40,5, используя 0,5 н. HCl или 0,5 н. NaOH. Пример лекарственной формы K. Капсулы для перорального введения готовят следующим образом. Типичная методика. Ингредиенты тщательно смешивают и затем загружают в желатиновые капсулы (размер 1, белые, непрозрачные) (264 мг композиции в капсуле). Пример лекарственной формы L. Капсулы для перорального введения готовят следующим образом. Типичная методика. Ингредиенты тщательно смешивают и затем загружают в желатиновые капсулы (размер 1, белые, непрозрачные) (148 мг композиции в капсуле). Следует понимать, что любую форму соединений этого изобретения (т.е. свободное основание,фармацевтическую соль или сольват), пригодную для конкретного способа введения в организм, можно использовать в фармацевтических композициях, обсуждаемых выше. Бензоимидазолон-карбоксамидные производные карбаматных соединений этого изобретения являются агонистами рецептора 5-HT4 и поэтому могут быть полезны для лечения медицинских состояний,опосредуемых рецепторами 5-HT4 или сопряженных с активностью рецепторов 5-HT4, т.е. медицинских состояний, которые облегчаются при лечении агонистом рецептора 5-HT4. Такие медицинские состояния включают, но не ограничиваются ими, синдром раздраженной толстой кишки (СРТК), хронический запор, функциональную диспепсию, задержку опорожнения желудка, гастроэзофагальную рефлюксную болезнь (ГЭРБ), гастропарез, послеоперационную кишечную непроходимость, кишечную псевдонепроходимость и задержку прохождения, обусловленную действием лекарственных средств (или наркотиками). Кроме того, предполагают, что некоторые соединения-агонисты рецептора 5-HT4 можно использовать для лечения расстройств центральной нервной системы, включая расстройства познавательных способностей, поведенческие расстройства, расстройства настроения и расстройства контроля вегетативных- 14014819 функций. Конкретно, соединения этого изобретения улучшают моторику желудочно-кишечного тракта(ЖКТ) и поэтому могут быть полезными для лечения расстройств ЖКТ, вызванных пониженной моторикой у млекопитающих, включая людей. Такие расстройства моторики ЖКТ включают, например, хронический запор, синдром раздраженной толстой кишки, сопровождающийся преимущественно запором,диабетический и идиопатический гастропарез и функциональную диспепсию. Поэтому в одном аспекте это изобретение предоставляет способ повышения моторики желудочнокишечного тракта у млекопитающего; этот способ заключается во введении этому млекопитающему терапевтически эффективного количества фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение настоящего изобретения. При использовании для лечения расстройств со сниженной моторикой ЖКТ или других состояний,опосредуемых рецепторами 5-HT4, соединение этого изобретения обычно вводят перорально в единичной дневной дозе или множественными дозами в течение дня, хотя можно использовать и другие формы введения. Количество активного агента, введенного с дозой, или общее количество, введенное за день,обычно определяет врач с учетом всех существенных факторов, включая состояние болезни, подвергаемое лечению, выбранный способ введения, природу вводимого соединения и его относительную активность, возраст, массу тела и индивидуальную реакцию пациента, тяжесть симптомов у этого пациента и т.п. Дозы, применимые для лечения расстройств со сниженной моторикой ЖКТ или других расстройств, опосредуемых рецепторами 5-HT4, находятся в диапазоне от примерно 0,0007 до примерно 20 мг/кг/день активного агента, включая диапазон от примерно 0,0007 до примерно 1 мг/кг/день. Для среднего веса 70 кг человека это составляет от примерно 0,05 до примерно 70 мг активного агента в день. В одном аспекте этого изобретения соединения настоящего изобретения используют для лечения хронического запора. При использовании для лечения хронического запора соединения настоящего изобретения обычно вводят перорально в единичной дозе или множественными дозами в течение дня. Предпочтительно доза для лечения хронического запора находится в диапазоне от примерно 0,05 до примерно 70 мг/день. В другом аспекте этого изобретения соединения настоящего изобретения используют для лечения синдрома раздраженной толстой кишки. При лечении синдрома раздраженной толстой кишки, преимущественно сопровождающегося запором, соединения настоящего изобретения обычно вводят перорально в единичной дозе или множественными дозами в течение дня. Предпочтительно доза для лечения синдрома раздраженной толстой кишки, преимущественно сопровождающегося запором, находится в диапазоне от примерно 0,05 до примерно 70 мг/день. В другом аспекте этого изобретения соединения настоящего изобретения используют для лечения диабетического гастропареза. При лечении диабетического гастропареза соединения настоящего изобретения обычно вводят перорально в единичной дозе или множественными дозами в течение дня. Предпочтительно доза для лечения диабетического гастропареза находится в диапазоне от примерно 0,05 до примерно 70 мг/день. В еще одном аспекте этого изобретения соединения настоящего изобретения используют для лечения функциональной диспепсии. При лечении функциональной диспепсии соединения настоящего изобретения обычно вводят перорально в единичной дозе или множественными дозами в течение дня. Предпочтительно доза для лечения функциональной диспепсии находится в диапазоне от примерно 0,05 до примерно 70 мг/день. Это изобретение также предоставляет способ лечения млекопитающего с заболеванием, сопряженным с активностью рецептора 5-HT4; этот способ заключается во введении этому млекопитающему терапевтически эффективного количества соединения настоящего изобретения или фармацевтической композиции, содержащей соединение настоящего изобретения. Поскольку соединения настоящего изобретения являются агонистами рецептора 5-HT4, такие соединения также полезны в качестве научных инструментов при исследовании или изучении биологических систем или образцов, имеющих рецепторы 5-HT4, или для открытия новых агонистов рецептора 5-HT4. Более того, поскольку соединения настоящего изобретения проявляют селективное связывание с рецепторами 5-HT4 по сравнению со связыванием с рецепторами 5-HT других подтипов, особенно рецепторов 5-HT3, такие соединения особенно полезны для изучения эффектов селективного агонизма рецепторов 5-HT4 в биологической системе или образце. Любую подходящую биологическую систему или образец с рецепторами 5-HT4 можно использовать в таких исследованиях, которые можно проводить какin vitro, так и in vivo. Типичные биологические системы или образцы, пригодные для таких исследований, включают, но не ограничиваются ими, клетки, клеточные экстракты, плазматические мембраны,образцы тканей, млекопитающих (таких как мыши, крысы, морские свинки, кролики, собаки, свиньи и т.д.) и т.п. В этом аспекте изобретения биологическую систему или образец, содержащий рецептор 5-HT4, приводят в контакт с количеством соединения этого изобретения, действующим на рецептор 5-HT4. Затем определяют эффекты воздействия на рецептор 5-HT4, используя традиционные способы и аппаратуру,- 15014819 такие как анализ связывания радиолигандов и функциональные тесты. Такие функциональные тесты включают опосредуемые лигандами изменения внутриклеточного уровня циклического аденозинмонофосфата (цАМФ), опосредуемые лигандами изменения активности фермента аденилилциклазы (которая синтезирует цАМФ), опосредуемые лигандами изменения во включении аналогов гуанозинтрифосфата(ГТФ), таких как [35S]ГТФS (гуанозин-5'-О-(-тио)трифосфата) или ГТФ-Bu, в изолированные мембраны посредством катализируемого рецептором обмена аналогов ГТФ с аналогами ГДФ, опосредуемые лигандами изменения во внутриклеточном уровне свободных ионов кальция (измеренного, например, с помощью флуоресцентного ридера планшетов или FLIPR от Molecular Devices, Inc.) и измерения активации митоген-активируемой протеинкиназы (МАРК). Соединение этого изобретения может воздействовать на рецепторы 5-HT4 или повышать их активацию в любом из функциональных тестов, перечисленных выше, или в тестах сходной природы. Количество соединения этого изобретения, действующее на рецепторы 5-HT4, обычно находится в диапазоне от примерно 1 до примерно 500 нМ. Кроме того, соединения настоящего изобретения можно использовать в качестве научных инструментов для открытия новых агонистов рецепторов 5-HT4. В этом варианте осуществления связывание с рецептором 5-HT4 или функциональные данные для испытываемого соединения или группы испытываемых соединений сравнивают со связыванием с рецептором 5-HT4 или функциональными данными для соединения настоящего изобретения, чтобы идентифицировать испытываемые соединения с повышенным связыванием или функциональной активностью, если таковые имеются. Этот аспект изобретения включает в качестве отдельного варианта осуществления генерирование сравнительных данных (используя соответствующие тесты) и анализ результатов тестов для идентифицирования интересных испытываемых соединений. Наряду с другими свойствами соединения настоящего изобретения являются сильными агонистами рецептора 5-HT4 и проявляют значительную селективность по отношению к рецептору подтипа 5-HT4 по сравнению с рецептором подтипа 5-HT3 в тестах со связыванием радиолигандов. Кроме того, типичные соединения настоящего изобретения проявляли улучшенные фармакокинетические свойства в модели на крысах. Соединения этого изобретения могут поэтому проявлять хорошую биодоступность при пероральном введении. Кроме того, типичные соединения этого изобретения, испытанные in vitro на модели с фиксацией потенциала с использованием выделенных целых клеток, экспрессирующих кардиальный калиевый канал hERG, показали отсутствие неприемлемого уровня ингибирования тока ионов калия. Тест с фиксацией потенциала является общепринятым доклиническим способом оценки способности фармакологических агентов изменять картину кардиальной реполяризации, специфично вызывать так называемую QT-пролонгацию, которую связывают с сердечной аритмией (Cavero et al., Opinion in Pharmacotherapy, 2000, 2, 947-73, Fermini et al., Nature Reviews Drug Discovery, 2003, 2, 439-447). Соответственно фармацевтические композиции, содержащие соединения этого изобретения, могут обладать приемлемым кардиологическим профилем. Эти свойства, а также полезность соединений этого изобретения можно продемонстрировать с помощью различных тестов in vitro и in vivo, хорошо известных специалистам в данной области. Типичные тесты с дополнительными подробностями описаны в следующих примерах. Примеры Следующие биологические и синтетические примеры даны для иллюстрации этого изобретения и не должны истолковываться как ограничивающие объем данного изобретения. В примерах, описанных ниже, следующие сокращения имеют следующий смысл, если не указано иначе. Сокращения, не определенные ниже, имеют общепринятое значение.(Aldrich, Fluka, Sigma и др.) и использовали без дополнительной очистки. Реакции проводили в атмосфере азота, если не указано иначе. Мониторинг протекания реакций проводили с помощью тонкослойной хроматографии (ТСХ), аналитической высокоэффективной жидкостной хроматографии (ВЭЖХ) и массспектрометрии, подробности которых приведены ниже и отдельно в конкретных примерах реакций. Ре- 16014819 акционные смеси обрабатывали, как описано специально для каждой реакции; обычно их очищали экстракцией и другими способами очистки, такими как кристаллизация, зависимая от температуры и растворителя, а также осаждение. Кроме того, реакционные смеси обычно очищали с помощью препаративной ВЭЖХ (общий протокол приведен ниже). Идентификацию продуктов реакции обычно проводили с помощью масс- и 1 Н ЯМР-спектрометрии. Для ЯМР-измерений образцы растворяли в дейтерированном растворителе (CD3OD, CDCl3 или DMSO-d6); 1 Н ЯМР-спектры получали на приборе Varian Gemini 2000(300 МГц) в стандартных условиях наблюдения. Если не указано иначе, масс-спектрометрическую идентификацию соединений выполняли методом ионизации при электрораспылении (ESMS) на прибореApplied Biosystems (Foster City, CA) модели API 150 EX или на приборе Agilent (Palo Alto, CA) модели 1100 LC/MSD. Общий протокол аналитической ВЭЖХ. Каждое неочищенное соединение растворяли в 50% MeCN/H2O (с 0,1% TFA) при концентрации 0,5-1,0 мг/мл и анализировали с использованием аналитической ВЭЖХ: 1) с аналитической колонкой с обращенной фазой Zorbax Bonus-RP (с размером частиц 3,5 мкм,2,150 мм); 2) скорость потока: 0,5 мл/мин; 3) 5% MeCN/H2O, содержащий 0,1% TFA (изократично; 0-0,5 мин); 5% MeCN/H2O, содержащий 0,1% TFA, до 75% MeCN/H2O, содержащего 0,1% TFA (линейный градиент; 0,5-4 мин); 4) детектирование: 214, 254 и 280 нм. Другие условия указаны там, где это необходимо. Общий протокол очистки с помощью ВЭЖХ. Неочищенные соединения растворяли в 50% водной уксусной кислоте в концентрации 50-100 мг/мл, фильтровали и фракционировали с помощью препаративной ВЭЖХ: 1) колонка; YMC Pack-Pro C18 (50a20 мм; ID=5 мкм); 2) линейный градиент: 10% А/90% В до 50% А/50% В в течение 30 мин; 3) скорость потока: 40 мл/мин; 4) детектирование: 214 нм. Приготовление вторичных аминов. Приготовление различных вторичных аминов, использованных в качестве интермедиатов в синтезах соединения формулы (I), описано ниже.N-Сульфонильные производные пиперазина готовили из N-Boc-пиперазина по реакции с соответствующим сульфонилхлоридом (iPr2NEt, CH2Cl2, 0 С) и снимая защиту N-Boc-группы (CF3CO2H, CH2Cl2). 1-Метансульфонилпиперазин: 1 Н ЯМР (CDCl3; нейтрально):(м.д.) 3,1 (т, 4H), 2,9 (т, 4H), 2,7 (с, 3H). Метансульфонилпиперазин приготовили также по реакции метансульфонилхлорида с избытком пиперазина (2 экв.) в воде.N-Производные пиперазина, такие как 1-(диметиламинокарбонил)пиперазин и 1-(диметиламиносульфонил)пиперазин, готовили по реакции иперазина с диметиламинохлорформиатом или диметиламиносульфамоилхлоридом соответственно. Рацемические или отдельные хиральные изомерные формы 3-ацетиламинопирролидина готовили,обрабатывая N1-Boc-3-аминопирролидин (рацемат, 3R или 3S) ацетилхлоридом (iPr2NEt, CH2Cl2, 0 С) и снимая защиту N-Boc-группы (CF3CO2H, CH2Cl2). 3-(Ацетамидо)пирролидин: 1 Н ЯМР (DMSO-d6; соль TFA):(м.д.) 4,2 (квинтет, 1H), 3,3-3,1 (м, 3H), 2,9 (м, 1 Н), 2,0 (м, 1 Н), 1,8N -Boc-(3R)-аминопирролидин пропионилсульфонилхлоридом или циклогексилметилсульфонилхлоридом (iPr2NEt, CH2Cl2, 0 С) и снимая защиту N-Boc-группы (CF3CO2H, CH2Cl2). Производные тетрагидро-3-тиофенамин-1,1-диоксида готовили, следуя протоколу Loev, В. J. Org.Chem. 1961, 26, 4394-9, по реакции 3-сульфолена с соответствующим первичным амином в метаноле(S)-1,1-Диоксотетрагидро-16-тиофен-3-иламин готовили следующим образом: 1) N-Boc-защита (S)-3-тетрагидротиофенамина (Dehmlow, E.V.; Westerheide, R. Synthesis 1992, 10,947-9) обработкой (Boc)2O в метаноле при комнатной температуре в течение примерно 12 ч; 2) окисление обработкой mCPAB в дихлорметане N-Boc-защищенного (S)-1,1-диоксотетрагидро 16-тиофен-3-иламина при 0 С в течение примерно 5 ч и 3) снятие N-Boc-защиты сульфонового производного с помощью TFA в дихлорметане при комнатной температуре в течение 1 ч с образованием свободного амина, который выделяли в виде соли TFA.(R)-1,1-Диоксотетрагидро-16-тиофен-3-иламин готовили тем же способом, но заменив(пиперидин-4-карбоксамид) и 1-(тетрагидро-2 фуроил)пиперазин доступны коммерчески; их приобретали из коммерческих источников. 4-Пиперидинолдиметилкарбамат готовили по реакции диметиламинохлорформиата сa) Приготовление N-изопропил-N-(2-нитрофенил)амина. К холодному раствору 2-фторнитробензола (31,8 г, 0,225 моль) в этаноле (300 мл), охлаждаемому на ледяной бане, добавили изопропиламин (54,0 мл, 0,634 моль), а затем раствор карбоната калия (31,1 г,0,225 моль) в воде (120 мл). Смесь перемешивали 1 ч при 0 С, затем 6 ч кипятили с обратным холодильником. Реакцию остановили охлаждением смеси до комнатной температуры; выпариванием при пониженном давлении получили остаток оранжевого цвета. Этот остаток распределили между этиловым эфиром (800 мл) и солевым раствором (300 мл). Органический слой осушили и профильтровали, получив указанный в заголовке интермедиат (39 г) в виде жидкости оранжевого цвета. 1b) Приготовление N-(2-аминофенил)-N-изопропиламина. К смеси этанола (600 мл) и 2 М раствора гидроксида натрия (320 мл), охлаждаемой на ледяной бане, медленно добавили цинковую пыль (59,5 г). Продолжая перемешивать цинковую суспензию, добавили N-изопропил-N-(2-нитрофенил)амин (41 г, 0,228 моль), растворенный в этаноле (50 мл). Смесь перемешивали 30 мин при 0 С, затем нагрели до 85C. Смесь перемешивали 12 ч при 85 С до обесцвечивания рефлюкса из обратного холодильника. Затем смесь охладили до 0 С и профильтровали. Собранное твердое вещество промыли EtOAc (200 мл). Фильтрат и промывной раствор объединили и выпарили под вакуумом для удаления избытка летучих растворителей. При этом концентрировании смесь стала бледной желто-коричневой. Водный концентрат экстрагировали EtOAc (800 мл). Органический раствор сконцентрировали до сухого состояния, в результате чего получили указанный в заголовке интермедиат (33 г) в виде масла коричнево-розового цвета, которое использовали на следующей стадии без дальнейшей обработки. 1c) Приготовление 1-изопропил-1,3-дигидро-2 Н-бензимидазол-2-она. К раствору продукта стадии (b), N-(2-аминофенил)-N-изопропиламина, (34 г, 0,226 моль) в тетрагидрофуране (500 мл) добавили твердый карбонилдиимидазол (36,7 г, 0,226 моль). Смесь перемешивали в атмосфере азота при комнатной температуре примерно 24 ч. Смесь сконцентрировали под вакуумом и полученный остаток темно-коричневого цвета распределили между EtOAc (700 мл) и солевым раствором(300 мл). Затем органический слой несколько раз промыли 1 М фосфорной кислотой (3300 мл) до перехода темно-коричневого цвета органического слоя в бледно-желтый. Этот органический раствор выпарили досуха, в результате чего получили указанный в заголовке интермедиат (34 г) в виде масла бледножелтого цвета, медленно твердевшего при стоянии. Чистоту материала оценили с помощью 1 Н ЯМР, которая не обнаружила никаких детектируемых загрязнений. 1 Н ЯМР (CD3OD, 300 МГц):(м.д.) 7,2 (м, 1 Н), 7,0 (м, 3 Н), 4,6 (гептет, 1 Н), 1,46 (д, 6 Н);(m/z): [M+H]+ рассчитано для C10H12N2O 177,09; найдено 177,2. Аналитическая ВЭЖХ: время удерживания - 2,7 мин (чистота 99%): 1) колонка: Zorbax, Bonus-RP, размер частиц 3,5 мкм, 2,150 мм; 2) скорость потока: 0,5 мл/мин; 3) изократические условия (10% растворителя B/90% растворителя A) от 0 до 0,5 мин; затем линейный градиент до 50% растворителя B/50% растворителя A в течение 5 мин (растворитель A: 98% воды/2% MeCN/0,1% TFA; растворитель B: 90% MeCN/10% воды/0,1% TFA. ТСХ-анализ (на пластинах силикагеля): Rf=0,5 (CH2Cl2). Жидкостная хроматография с масс-спектрометрией (ЖХМС) (m/z): [М+Н]+ рассчитано дляa) Приготовление 8-бензил-8-азабицикло[3.2.1]октан-3-она. Концентрированную соляную кислоту (30 мл) добавили к гетерогенному раствору 2,5-диметокситетрагидрофурана (82,2 г, 0,622 моль) в воде (170 мл) при перемешивании. В отдельной колбе охлажденную до 0 С (на ледяной бане) концентрированную соляную кислоту (92 мл) медленно добавили к раствору бензиламина (100 г, 0,933 моль) в воде (350 мл). Раствор 2,5-диметокситетрагидрофурана перемешивали приблизительно 20 мин, разбавили водой (250 мл), затем добавили раствор бензиламина, после чего добавили раствор 1,3-ацетондикарбоновой кислоты (100 г,0,684 моль) в воде (400 мл) и затем добавили раствор гидрофосфата натрия (44 г, 0,31 моль) в воде(200 мл); рН довели от 1 до примерно 4,5 40%-ным NaOH. Полученный раствор перемешивали в течение ночи. Затем раствор подкислили от рН 7,5 до рН 3 50%-ной соляной кислотой, нагрели до 85 С и перемешивали 2 ч. Раствор охладили до комнатной температуры, подщелочили до рН 12 40%-ным NaOH и экстрагировали DCM (3500 мл). Объединенные органические слои промыли солевым раствором, осушили, профильтровали, сконцентрировали при пониженном давлении и получили неочищенный интермедиат, указанный в заголовке, в виде вязкого масла коричневого цвета (52 г). К раствору этого неочищенного интермедиата в метаноле (1000 мл) добавили ди-третбутилдикарбонат (74,6 г, 0,342 моль) при 0 С. Этому раствору дали нагреться до комнатной температуры и его перемешивали в течение ночи. При пониженном давлении удалили метанол и полученное масло растворили в дихлорметане (1000 мл). Этот интермедиат экстрагировали 1 М Н 3 РО 4 (1000 мл) и промыли дихлорметаном (3250 мл). Водный слой подщелочили до рН 12 водным NaOH и экстрагировали дихлорметаном (3500 мл). Объединенные органические слои осушили, профильтровали, сконцентрировали при пониженном давлении и получили указанный в заголовке интермедиат в виде вязкого масла светло-коричневого цвета. 1 Н ЯМР (CDCl3):(м.д.) 7,5-7,2 (м, 5 Н, С 6 Н 5), 3,7 (с, 2 Н, CH2Ph), 3,45 (шир. с, 2H, CH-NBn), 2,7-2,6b) Приготовление трет-бутилового сложного эфира 3-оксо-8-азабицикло[3.2.1]октан-8-карбоновой кислоты. К раствору 8-бензил-8-азабицикло[3.2.1]октан-3-она (75 г, 0,348 моль) в EtOAc (300 мл) добавили раствор ди-трет-бутилдикарбоната (83,6 г, 0, 383 моль, 1,1 экв.) в EtOAc (300 мл). Полученный раствор и жидкость, использованную для промывки (100 мл EtOAc), добавили в 1-литровый сосуд Парра для гидрирования, содержащий 23 г гидроксида палладия (20% Pd по массе в расчете на сухое вещество на угле,50% воды; например, катализатор Перлмана), под током азота. Реакционный сосуд дегазировали (пятикратным чередованием вакуума и N2) и наполнили газообразным Н 2 до давления 60 psi (0,42 МПа). Реакционный раствор перемешивали в течение двух дней, при необходимости добавляя Н 2 для поддержания его давления на уровне 60 psi (0,42 МПа), до завершения реакции, установленного мониторированием тонкослойной хроматографией на силикагеле. Затем черный раствор профильтровали через слой Celite,сконцентрировали при пониженном давлении и получили указанный в заголовке интермедиат в виде вязкого масла желто-оранжевого цвета. Его использовали на следующей стадии без дополнительной обработки. 1c) Приготовление трет-бутилового сложного эфира (1S,3R,5R)-3-амино-8-азабицикло[3.2.1]октан-8 карбоновой кислоты. К раствору продукта предыдущей стадии (75,4 г, 0,335 моль) в метаноле (1 л) добавили формиат аммония (422,5 г, 6,7 моль), воду (115 мл) и 65 г палладия на активированном угле (10% в расчете на сухую массу, 50% воды, тип Degussa E101NE/W) под азотом при перемешивании механической мешалкой. Через 24 и 48 ч добавили дополнительные порции формиата аммония (каждый раз по 132 г,2,1 моль). После прекращения реакции, установленного мониторированием аналитической ВЭЖХ, добавили Celite (500 г) и полученную густую суспензию отфильтровали, а затем собранное твердое вещество промыли метанолом (500 мл). Фильтраты объединили и сконцентрировали при пониженном давлении. Полученный мутный двухфазный раствор разбавили 1 М фосфорной кислотой до конечного объема 1,5-2,0 л с рН 2 и промыли дихлорметаном (3700 мл). Водный слой подщелочили до рН 12 40%-ным NaOH и экстрагировали дихлорметаном (3700 мл). Объединенные органические слои осушили, профильтровали и сконцентрировали на роторном испарителе, затем при высоком вакууме. Получили указанный в заголовке интермедиат (52 г) с тривиальным названием N-Boc-эндо-3-аминотропан в виде твердого вещества белого или бледно-желтого цвета. По данным 1 Н ЯМР-анализа соотношение эндо- и экзо-изомеров амина в этом продукте составляло более 99:1 (по данным аналитической ВЭЖХ, чистота составляла более 96%).a) Приготовление трет-бутилового сложного эфира (1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3 дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]октан-8-карбоновой кислоты. К холодной суспензии гидрида натрия (9,25 г; 231,4 ммоль; 60% дисперсия в минеральном масле) в сухом THF (1000 л) на ледяной бане добавили продукт препаративной методики 1, 1-изопропил-1,3 дигидро-2 Н-бензимидазол-2-он (27,2 г, 154,2 ммоль), в THF (50 мл) в атмосфере азота. Смесь перемешивали 30 мин при 0-5 С, затем добавили 4-нитрофенилхлорформиат (34,2 г, 170 ммоль) в THF (50 мл). Смесь перемешивали в течение ночи, позволив ей постепенно нагреться до комнатной температуры. К образованному активированному сложному эфиру затем добавили трет-бутиловый сложный эфир(1S,3R,5R)-3-амино-8-азабицикло[3.2.1]октан-8-карбоновой кислоты (36,7 г, 162 ммоль) в THF (50 мл). Смесь перемешивали примерно 12 ч при комнатной температуре и примерно 3 ч при температуре около 75 С. К этому времени ЖХМС образца реакционной смеси показала завершение реакции сочетания. Смесь сконцентрировали в вакууме, растворили в дихлорметане (1 л) и промыли сначала 1 M Н 3 РО 4, затем насыщенным раствором NaHCO3. Органический раствор осушили и выпарили; получили интермедиат, указанный в заголовке, в виде остатка бледно-желтого цвета, который использовали на следующей стадии без дополнительной обработки.b) Приготовление (8-азабицикло[3.2.1]окт-3-ил)амида N-(1S,3R,5R)-3-изопропил-2-оксо-2,3 дигидробензоимидазол-1-карбоновой кислоты в виде соли трифторацетата. К холодному раствору трет-бутилового сложного эфира (1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3 дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]октан-8-карбоновой кислоты (продукт предыдущей стадии) в дихлорметане (200 мл) на ледяной бане добавили трифторуксусную кислоту(200 мл). Смесь перемешивали примерно 30 мин при 5C и примерно 1 ч при комнатной температуре. После выпаривания этой смеси к маслянистому остатку добавили этиловый эфир (500 мл), что привело к затвердеванию этого остатка. Осадок собрали, промыли большим количеством этилового эфира и высушили в вакууме; получили интермедиат, указанный в заголовке, (47 г) в виде соли TFA. Упомянутый выше интермедиат также обычно называют эндо-N-(8-азабицикло[3.2.1]окт-3-ил)-3-изопропил-2-оксо 2,3-дигидробензимидазол-1-карбоксамидом.c) Приготовление (8-азабицикло[3.2.1]окт-3-ил)амида N-(1S,3R,5R)-3-изопропил-2-оксо-2,3 дигидробензоимидазол-1-карбоновой кислоты (свободного основания). К суспензии продукта предыдущей стадии (15 г, 33,9 ммоль) в дихлорметане (500 мл) добавили воду (500 мл). К реакционной смеси добавили N,N-диизопропилэтиламин (20 мл) для доведения рН водного слоя до 8-9. Слои разделили, сохранив органический слой. Водный слой экстрагировали второй раз дихлорметаном (100 мл). Полученные экстракты объединили и затем промыли солевым раствором. После сушки над Na2SO4 и фильтрации удалили растворитель и получили свободное основание указанного в заголовке соединения (9,7 г) в виде порошка желтого цвета. 1 Н ЯМР (DMSO-d6): 1,48 (д, 6 Н), 1,40-2,00 (м, 8 Н), 3,53 (м, 2 Н), 4.07 (м, 1 Н), 4,69 (септет, 1 Н), 7,21N,N-диизопропилэтиламин (192 мкл, 1,1 ммоль). Реакционной смеси позволили в течение 2 ч нагреться до комнатной температуры, после чего смесь выпарили и получили масло пшеничного цвета, которое использовали без дальнейшей очистки.e) Синтез 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира 4-(тетрагидрофуран-2-карбонил)пиперазин-1 карбоновой кислоты. 3-Хлорпропил-4-(тетрагидрофуран-2-илкарбонил)пиперазин-1-карбоксилат (335 мг, 1,1 ммоль) растворили в диметилформамиде (5,0 мл) и добавили к твердому свободному основанию продукта стадии(с) (118 мг, 0,36 ммоль) и NaI (164 мг, 0,72 ммоль). Добавили N,N-диизопропилэтиламин (64 мкл,0,36 ммоль) и смесь перемешивали в течение ночи при 90 С. Удалили летучие вещества и провели очистку с помощью препаративной ВЭЖХ (на обращенной фазе) в градиенте 15-45% в течение 50 мин; скорость потока 20 мл/мин. Получили соль TFA указанного в заголовке соединения в виде твердого вещества белого цвета (45 мг).,Используя процессы, описанные в примере 1, за исключением того, что на стадии (d) 1-(тетрагидрофуран-2-илкарбонил)пиперазин заменен 2-пиперазин-1-илэтанолом, приготовили указанное в заголовке соединение (13,8 мг) в виде соли TFA.(m/z): [M+H]+ рассчитано для C28H42N6O5 543,32; наблюдается 543,5. Примеры 3-12. Используя процессы, описанные в примере 1, за исключением того, что на стадии (d) 1-(тетрагидрофуран-2-илкарбонил)пиперазин заменен соответствующими реагентами, приготовили следующие соединения примеров 3-12:a) Приготовление трет-бутилового сложного эфира (1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3 дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]октан-8-карбоновой кислоты. В 500-миллилитровую реакционную колбу, содержащую 1-изопропил-1,3-дигидро-2 Нбензимидазол-2-он (17,6 г, 100 ммоль) и 4-нитрофенилхлорформиат (20,2 г, 100 ммоль) в атмосфере азота, добавили дихлорметан (350 мл), а затем медленно добавили триэтиламин (30,5 мл, 220 ммоль). Раствор перемешивали 15 мин и затем добавили трет-бутиловый сложный эфир (1S,3R,5R)-3-амино-8 азабицикло[3.2.1]октан-8-карбоновой кислоты (22,6 г, 100 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь промыли насыщенным водным раствором бикарбоната натрия (2200 мл). Дистилляцией удалили дихлорметан и добавили МТВЕ (350 мл). Раствор МТВЕ промыли 1 н. фосфорной кислотой (2200 мл), насыщенным раствором бикарбоната натрия(200 мл) и водой (200 мл). Органический слой осушили над безводным сульфатом натрия (40 г) и профильтровали, а затем дистилляцией удалили растворитель; в результате получили указанный в заголовке интермедиат в виде твердого вещества желтовато-коричневого цвета (35,7 г, выход 83%).b) Приготовление соли трифторацетата (8-азабицикло[3.2.1]окт-3-ил)амида N-(1S,3R,5R)-3 изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбоновой кислоты. В 500-миллилитровой колбе трет-бутиловый сложный эфир (1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3 дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]октан-8-карбоновой кислоты (21,4 г,50 ммоль) растворили в дихлорметане (200 мл). Добавили трифторуксусную кислоту (37 мл, 500 ммоль) и реакционную смесь перемешивали 3 ч при комнатной температуре. Реакционную смесь промыли водой(2100 мл). Растворитель в органическом слое удалили дистилляцией и добавлением МТВЕ (200 мл) осадили порошкообразный неочищенный продукт. После перемешивания в течение 1 ч при комнатной температуре твердое вещество отделили фильтрованием, промыли МТВЕ (225 мл) и высушили под вакуумом. Получили интермедиат, указанный в заголовке (21,0 г, выход 97%).(150 мл) при комнатной температуре и добавили N,N-диизопропилэтиламин (19,2 мл, 110 ммоль). После перемешивания в течение 10 мин при комнатной температуре реакционную смесь охладили на ледяной бане приблизительно до 5 С. С помощью капельной воронки к этой реакционной смеси добавили 1-хлор-3-хлорметоксипропан (11,8 мл, 100 ммоль) с такой скоростью, которая поддерживала температуру реакции ниже 10 С. После завершения этого добавления реакционной смеси позволили нагреться до комнатной температуры. Реакционную смесь промыли водой (2100 мл) и органическую фазу осушили над безводным сульфатом натрия (25 г). После фильтрации растворитель удалили дистилляцией и получили указанное в заголовке соединение в виде маслянистого твердого вещества, затвердевавшего при стоянии (24,0 г, выход 94%).e) Синтез 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира 1,1-диоксо-16-тиоморфолин-4-карбоновой кислоты. К раствору соли трифоторацетата (8-азабицикло[3.2.1]окт-3-ил)амида N-(1S,3R,5R)-3-изопропил-2 оксо-2,3-дигидробензоимидазол-1-карбоновой кислоты (8,8 г, 20 ммоль) в дихлорметане (100 мл) добавили воду (100 мл). Водный слой довели до рН 12 для получения свободного основания этой соли. Органический слой отделили, осушили над сульфатом натрия и дистилляцией удалили растворитель. Свободное основание растворили в N-метил-2-пирролидоне (100 мл) и этот раствор перенесли в 250-миллилитровую колбу, содержащую 3-хлорпропиловый сложный эфир 1,1-диоксо-16 тиоморфолин-4-карбоновой кислоты (7,2 г, 28 ммоль) и NaI (3,0 г, 20 ммоль). ДобавилиN,N-диизопропилэтиламин (4,2 мл, 24 ммоль) и реакционную смесь нагрели до 50 С в течение 18 ч. Растворитель удалили дистилляцией. Остаток неочищенного продукта растворили в EtOAc (200 мл), промыли водой (250 мл) и осушили над сульфатом натрия (10 г). Растворитель удалили дистилляцией и получили остаток неочищенного продукта (12 г). Этот остаток неочищенного продукта очистили с помощью препаративной ВЭЖХ на двухдюймовой колонке, заполненной диоксидом кремния с инактивированными основными группами (BDS); скорость потока: 200 мл/мин; элюент А: 0,1% TFA в воде; элюент В: 90% ацетонитрила/10% 0,1%-ной TFA в- 22014819 воде; градиент (время, %В): (0, 5); (25, 30); (35, 80); (45, 80); (50, 5); (60, 5). Продукт выделили лиофилизацией чистой фракции и получили указанное в заголовке соединение (3,4 г, выход 26%). 1 Н ЯМР (DMSO-d6):(м.д.): 9,35 (д, 1 Н), 8,07 (д, 1 Н), 7,46 (д, 1 Н), 7,22 (т, 1 Н), 7,16 (т, 1 Н), 4,69(m/z): [М+Н]+ рассчитано для C26H37N5O6S 548,2; найдено 548,4. Тест 1. Радиолигандный анализ связывания на 5-HT4(С)-рецепторах человека.a) Мембранный препарат 5-HT4(С). Клетки HEK-293 (эмбриональной почки человека), стабильно трансфицированные кДНК человеческого рецептора 5-HT4(с) (Bmax6,0 пмоль/мг белка, определено радиолигандным анализом связывания с мембранами с использованием [3 Н]-GR113808), выращивали во флаконах Т-225 в среде Игла, модифицированной по Дульбекко, (DMEM), содержащей 4500 мг/л D-глюкозы и пиридоксин-гидрохлорида(GIBCO-Invitrogen Corp., Carlsbad CA: Cat 11965) с добавлением 10% эмбриональной телячьей сыворотки (FBS) (GIBCO-Invitrogen Corp.: Cat 10437), 2 мМ L-глутамина и (100 единиц) пенициллина (100 мкг)стрептомицина/мл (GIBCO-Invitrogen Corp.: Cat 15140) во влажном инкубаторе в атмосфере 5% CO2 при 37 С. Клетки выращивали при непрерывном селекционном давлении генетицина (800 мкг/мл; GIBCOInvitrogen Corp.: Cat 10131), добавленного в среду. Клетки выращивали до приблизительной конфлюэнтности в 60-80% (35 пассажей субкультур). За 20-22 ч до сбора клетки дважды промывали и заливали средой DMEM без сыворотки. Все стадии приготовления мембран выполняли на льду. Клеточный монослой снимали осторожным механическим взбалтыванием и диспергированием с помощью 25-миллилитровой пипетки. Клетки собирали центрифугированием при 1000 об/мин (5 мин). Для приготовления мембран осажденные клетки ресуспендировали в ледяном 50 мМ растворе 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты (HEPES), рН 7,4 (буфер мембранного препарата) (40 мл на общее количество клеток, получаемое из 30-40 флаконов Т-225) и гомогенизовали в политроновом дезинтеграторе (настройка 19,210 с) на льду. Полученные гомогенаты центрифугировали 5 мин при 1200 g и 4 С. Осадок отбрасывали, а супернатант центрифугировали 20 мин при 40000 g. Осадок промывали один раз ресуспендированием в буфере мембранного препарата и центрифугированием при 40000 g (20 мин). Окончательный осадок ресуспендировали в 50 мМ HEPES, рН 7,4 (тестовый буфер) (эквивалент одного флакона Т 225 на 1 мл). Концентрацию белка этой мембранной суспензии определяли методом Bradford (Bradford, 1976). Мембраны хранили замороженными в аликвотах при -80 С.b) Радиолигандные анализы связывания. Радиолигандные анализы связывания проводили в аналитических 96-луночных глубоких 1,1-миллилитровых полипропиленовых планшетах (Axygen) в образцах общим объемом 400 мкл, содержащих 2 мкг мембранного белка в 50 мМ растворе HEPES рН 7,4, содержащем 0,025% бычьего сывороточного альбумина (BSA). Исследования насыщения связывания для определения значений Kd для радиолиганда проводили с использованием [3 Н]-GR113808 (Amersham Inc., Bucks, UK: Cat TRK944; удельная активность 82 Ки/ммоль) при 8-12 различных концентрациях от 0,001 до 5,0 нМ. Анализы вытеснения для определения значений pKi этих соединений проводили при 0,15 нМ [3 Н]-GR113808 и 11 различных концентрациях испытываемого соединения от 10 пМ до 100 мкМ. Испытываемые соединения получали в виде 10 мМ запасных растворов в DMSO; их разбавляли до 400 мкМ в 50 мМ растворе HEPES рН 7,4 при 25 С, содержащем 0,1% BSA, затем готовили серийные разбавления (1:5) в том же буфере. Неспецифическое связывание определяли в присутствии 1 мкМ немеченого GR113808. Анализируемые образцы инкубировали 60 мин при комнатной температуре, затем реакции связывания останавливали быстрым фильтрованием в 96-луночном планшете со стекловолокнистыми фильтрами GF/B (Packard BioScience Co., Meriden, CT), предварительно пропитанными 0,3% полиэтиленимином. Фильтровальные планшеты промывали три раза буфером фильтрования (ледяной 50 мМ HEPES, рН 7,4) для удаления несвязанной радиоактивности. Планшеты сушили, в каждую лунку добавляли по 35 мкл жидкого сцинтиллятора Microscint-20 (Packard BioScience Co., Meriden, CT) и планшеты просчитывали в жидкостном сцинтилляционном счетчике Packard Topcount (Packard BioScience Co., Meriden,CT). Данные по связыванию анализировали нелинейным регрессионным анализом, используя программуGraphPad Prism (GraphPad Software, Inc., San Diego, CA), с использованием 3-параметрической модели для одноцентровой конкуренции. Минимум кривой фиксировали на величине неспецифического связывания, определенной в присутствии 1 мкМ GR113808. Величины Ki для испытываемых соединений рассчитывали по программе Prism по значениям IC50 наилучшей аппроксимации, а значение Kd радиолиганда рассчитывали, используя уравнение Cheng-Prusoff (Cheng and Prussof, Biochemical Pharmacology, 1973,22, 3099-108): Ki=IC50/(1+[L]/Kd), где [L] - концентрация [3H]-GR113808. Результаты выражали в виде отрицательных десятичных логарифмов значений Ki (pKi).- 23014819 Испытываемые соединения, имеющие большие значения pKi в этом тесте, имеют большее сродство связывания с рецептором 5-HT4. Соединения настоящего изобретения, испытанные в этом тесте, имели значения pKi от примерно 7,0 до примерно 9,0, обычно от примерно 7,5 до примерно 8,5. Например, соединение примера 1 показало в этом тесте значение pKi, равное 7,9. Тест 2. Радиолигандный анализ связывания на 5-HT3A-рецепторах человека: определение селективности подтипов рецептора.a) Мембранный препарат 5-HT3A. Клетки HEK-293 (эмбриональной почки человека), стабильно трансфицированные кДНК человеческого рецептора 5-HT3A были получены от д-ра Michael Bruess (University of Bonn, GDR)(Bmax9,0 пмоль/мг белка, определено радиолигандным анализом связывания с мембранами с использованием [3 Н]-GR65630). Клетки выращивали во флаконах Т-225 или в "клеточных фабриках" в 50% среде Игла, модифицированной по Дульбекко, (DMEM) (GIBCO-Invitrogen Corp., Carlsbad CA: Cat 11965) и 50% Ham's F12 (GIBCO-Invitrogen Corp., Carlsbad CA: Cat 11765) с добавлением 10% термоинактивированной эмбриональной телячьей сыворотки (FBS) (Hyclone, Logan, UT: Cat SH30070.03) и (50 единиц) пенициллина (50 мкг)-стрептомицина/мл (GIBCO-Invitrogen Corp.: Cat 15140) во влажном инкубаторе в атмосфере 5% CO2 при 37C. Клетки выращивали до приблизительной конфлюэнтности в 70-80% (35 пассажей субкультур). Все стадии приготовления мембран выполняли на льду. При сборе клеток отсасывали среду и клетки промывали фосфатным буферным солевым раствором по Дульбекко без Са 2+ и Mg2+ (dPBS). Клеточный монослой снимали осторожным механическим взбалтыванием. Клетки собирали центрифугированием при 1000 об/мин (5 мин). Дальнейшие стадии приготовления мембранного препарата следовали протоколу, описанному выше для мембран, экспрессирующих рецепторы 5-HT4(С).b) Радиолигандные анализы связывания. Радиолигандные анализы связывания проводили в аналитических 96-луночных полипропиленовых планшетах в образцах общим объемом 200 мкл, содержащих 1,5-2 мкг мембранного белка в 50 мМ растворе HEPES рН 7,4, содержащем 0,025% BSA. Исследования насыщения связывания для определения значений Kd радиолиганда проводили с использованием [3H]-GR65630 (PerkinElmer Life Sciences Inc.,Boston, MA: Cat NET1011; удельная активность 85 Ки/ммоль) при 12 различных концентрациях от 0,005 нМ до 20 нМ. Анализы вытеснения для определения значений pK1 этих соединений проводили при 0,50 нМ [3H]-GR65630 и одиннадцати различных концентрациях испытываемого соединения от 10 пМ до 100 мкМ. Испытываемые соединения получали в виде 10 мМ запасных растворов в DMSO (см. раздел 3.1); их разбавляли до 400 мкМ в 50 мМ растворе HEPES рН 7,4 при 25 С, содержащем 0,1% BSA, а затем готовили серийные разбавления (1:5) в том же буфере. Неспецифическое связывание определяли в присутствии 10 мкМ немеченого MDL72222. Анализируемые образцы инкубировали 60 мин при комнатной температуре, затем реакции связывания останавливали быстрым фильтрованием в 96-луночном планшете со стекловолокнистыми фильтрами GF/B (Packard BioScience Co., Meriden, CT), предварительно пропитанными 0,3% полиэтиленимином. Фильтровальные планшеты промывали три раза буфером фильтрования (ледяной 50 мМ HEPES, рН 7,4) для удаления несвязанной радиоактивности. Планшеты сушили, в каждую лунку добавляли по 35 мкл жидкого сцинтиллятора Microscint-20 (Packard BioScienceCo., Meriden, CT) и планшеты просчитывали в жидкостном сцинтилляционном счетчике PackardTopcount (Packard BioScience Co., Meriden, CT). Данные по связыванию анализировали, используя процедуру нелинейного регрессионного анализа,описанную выше для определения значений Ki. Минимум кривой фиксировали на величине неспецифического связывания, определенной в присутствии 10 мкМ MDL72222. Величину [L] в уравнении ChengPrusoff определяли как концентрацию [3 Н]-GR65630. Селективность для рецептора подтипа 5-HT4 относительно рецептора подтипа 5-HT3 рассчитывали как отношение Ki(5-HT3A)/Ki(5-HT4(с. Соединения настоящего изобретения, испытанные в этом тесте,имели селективность рецепторных подтипов (5-HT4/5-HT3), характеризуемую числами от примерно 10 до примерно 950, обычно от примерно 50 до примерно 500. Например, соединение примера 1 показало селективность рецепторных подтипов, характеризуемую числом 160. Тест 3. Определение накопления цАМФ в целых клетках HEK-293, экспрессирующих человеческие рецепторы 5-HT4(С), методом Flashplate. В этом тесте функциональные возможности испытываемого соединения определяли, измеряя количество циклического АМФ, продуцируемого в клетках HEK-293, экспрессирующих рецепторы 5-HT4,при их контакте с различными концентрациями испытываемого соединения.a) Клеточные культуры. Клетки HEK-293 (эмбриональной почки человека), стабильно трансфецированные клонированной человеческой кДНК рецептора 5-HT4(с), приготовили с двумя уровнями плотности экспрессируемых рецепторов: (1) при плотности около 0,5-0,6 пмоль/мг белка, определенной радиолигандным анализом связывания с мембранами с использованием [3 Н]-GR113808, и (2) при плотности около 6,0 пмоль/мг белка. Клетки выращивали во флаконах Т-225 в среде Игла, модифицированной по Дульбекко, (DMEM), содержащей 4500 мг/л D-глюкозы (GIBCO-Invitrogen Corp., Carlsbad CA: Cat 11965) с добавлением 10% эмбриональной телячьей сыворотки (FBS) (GIBCO-Invitrogen Corp.: Cat 10437) и (100 единиц) пенициллина (100 мкг)-стрептомицина/мл (GIBCO-Invitrogen Corp.: Cat 15140) во влажном инкубаторе в атмосфере 5% CO2 при 37C. Клетки выращивали при непрерывном селекционном давлении генетицина (800 мкг/мл; GIBCO-Invitrogen Corp.: Cat 10131), добавленного в среду.b) Приготовление клеток. Клетки выращивали до приблизительной конфлюэнтности в 60-80%. За 20-22 ч до сбора клетки дважды промывали и заливали средой DMEM без сыворотки, содержащей 4500 мг/л D-глюкозы (GIBCOInvitrogen Corp., Carlsbad CA: Cat 11965). Для сбора клеток среду отсасывали и в каждый флакон Т-225 добавляли по 10 мл версена (GIBCO-Invitrogen Corp., Carlsbad CA: Cat 15040). Клетки инкубировали 5 мин при комнатной температуре и затем механически извлекали из флаконов. Суспензию клеток переносили в центрифужную пробирку, содержащую равный объем предварительно подогретого (37 С) раствора dPBS, и центрифугировали 5 мин при 1000 об/мин. Супернатант отбрасывали, а осадок ресуспендировали в предварительно подогретом (37 С) буфере стимуляции (10 мл эквивалентно 2-3 флаконам Т-225). Этот момент отмечали как нулевую точку времени. Клетки просчитывали в счетчике Coulter (счет выше 8 мкм, продуктивность составила 1-2107 клеток на флакон). Клетки ресуспендировали при концентрации 5105 клеток/мл в предварительно подогретом (37 С) буфере стимуляции (поставляемом в наборе для Flashplate-анализа) и преинкубировали при 37C в течение 10 мин. Определение цАМФ проводили в формате радиоиммунного анализа с использованием 125I-цАМФ иFlashplate-регистрации активации системы аденилилциклазы (SMP004B, PerkinElmer Life Sciences Inc.,Boston, MA) в соответствии с инструкциями изготовителя. Клетки выращивали и подготавливали, как описано выше. Конечные концентрации клеток в тесте составляли 25103 клеток на лунку, а конечный объем анализируемого образца составлял 100 мкл. Испытываемые соединения получали в виде 10 мМ запасных растворов в DMSO; их разбавляли до 400 мкМ в 50 мМ растворе HEPES рН 7,4 при 25 С, содержащем 0,1% BSA, затем готовили серийные разбавления(1:5) в том же буфере. Определения накопления цАМФ проводили при 11 различных концентрациях испытываемого соединения в диапазоне от 10 пМ до 100 мкМ (конечные концентрации в анализируемом образце). Каждый планшет включал образцы для построения кривой зависимости 5-HT-ответа от концентрации (от 10 пМ до 100 мкМ). Клетки инкубировали со встряхиванием при 37 С в течение 15 мин и останавливали реакцию добавлением 100 мкл ледяного буфера детектирования (поставляемого с набором для Flashplate-теста) в каждую лунку. Планшеты закрывали и инкубировали в течение ночи при 4C. Связанную радиоактивность количественно определяли методом спектроскопии сцинтилляционной близости с использованием Topcount (Packard BioScience Co., Meriden, CT). Количество цАМФ, произведенного в 1 мл реакционной смеси, определяли экстраполяцией по стандартной кривой для цАМФ в соответствии с инструкциями изготовителя, содержащимися в руководстве для пользователей. Полученные данные анализировали нелинейным регрессионным анализом с помощью программы GraphPad Prism (GraphPad Software, Inc., San Diego, CA) с использованием 3-параметрической сигмоидальной модели для зависимости эффекта от дозы (с наклоном, ограниченным до единицы). Данные по эффективности представляли в виде значений pEC50, т.е. отрицательного десятичного логарифма значения ЕС 50, где ЕС 50 обозначает концентрацию, соответствующую 50% максимального ответа. Испытываемое соединение, демонстрирующее большее значение pEC50 в этом тесте, является более сильным агонистом рецептора 5-HT4. Соединения настоящего изобретения, испытанные в этом тесте с использованием клеток линии (1), обладающих плотностью около 0,5-0,6 пмоль/мг белка, имели значение pEC50 в диапазоне от примерно 7,5 до примерно 9,0, обычно в диапазоне от примерно 8,0 до примерно 9,0. Например, соединение примера 1 имело значение рЕС 50, равное 8,4. Тест 4. Анализ ингибирования тока ионов калия в целых клетках, экспрессирующих кардиальный калиевый канал hERG, в экспериментах "вольт-кламп" in vitro. Клетки CHO-K1, стабильно трансфицированные кДНК hERG, были получены от Gail Robertson изUniversity of Wisconsin. До использования клетки держали в криогенном хранилище. Пролиферация и пассаж клеток происходили в среде Игла, модифицированной по Дульбекко/F12 с добавлением 10% эмбриональной телячьей сыворотки и 200 мкг/мл генетицина. Клетки высевали на покровные стекла, покрытые поли-D-лизином (100 мкг/мл) в 35-мм 2-чашках (содержащих 2 мл среды) при плотности, достаточной для выбора изолиро ванных клеток для исследования "вольт-кламп". Чашки содержали во влажном инкубаторе в атмосфере 5% CO2 при 37 С.- 25014819 Внеклеточный раствор готовили не реже, чем один раз в семь дней; до использования его хранили при 4 С. Этот внеклеточный раствор содержал (мМ): NaCl (137), KCl (4), CaCl2 (1,8), MgCl2 (1), глюкозу(10), 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту (HEPES) (10), рН доводили до 7,4 добавлением NaOH. Этот внеклеточный раствор, в отсутствие или в присутствии испытываемого соединения,держали в резервуарах, из которых он протекал в камеру записи со скоростью приблизительно 0,5 мл/мин. Внутриклеточный раствор готовили, разделяли на аликвоты и хранили при -20 С до дня использования. Этот внутриклеточный раствор содержал (мМ): KCl (130), MgCl2 (1), соль этиленгликоль-бис-(бета-аминоэтиловый эфир)-N,N,N',N'-тетрауксусной кислоты] (EGTA) (5), MgATP (5),4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту (HEPES) (10), рН доводили до 7,2 добавлением KOH. Все эксперименты проводили при комнатной температуре (20-22 С). Покровные стекла, на которые высевали клетки, переносили в камеру записи и непрерывно перфузировали. Между клеткой и пэтч-электродом образовывали гигаомный контакт. После достижения стабильного пэтч-контакта начинали запись в режиме "вольт-кламп" с начальным поддерживающим потенциалом, равным -80 мВ. После достижения стабильного тока целой клетки их подвергали воздействию испытываемым соединением. Стандартный протокол вольтажа был следующим: стадия от исходного потенциала -80 до 20 мВ длительностью 4,8 с, реполяризация до -50 мВ в течение 5 с, затем возвращение к исходному поддерживающему потенциалу (-80 мВ). Этот протокол вольтажа повторяли каждые 15 с(0,067 Гц). Амплитуды пикового тока в течение фазы реполяризации определяли с использованием программы pClamp. Испытываемые соединения в концентрации 3 мкМ перфузировали над клетками в течение 5 мин, после чего следовал 5-минутный период отмывки в отсутствие соединения. В конце эксперимента в перфузат добавляли положительный контроль (цисаприд, 20 нМ) для проверки функции клетки. Стадия от -80 до 20 мВ активирует канал hERG, вызывая выходящий ток. Стадия обратного изменения до -50 мВ дает выходящий хвостовой ток, когда канал восстанавливается от инактивации и деактивируется. Амплитуды пикового тока в фазе реполяризации определяли с использованием программы pClamp. Данные контроля и испытываемого объекта экспортировали в Origin (OriginLab Corp., NorthamptonMA), где индивидуальные амплитуды тока нормализовывали к амплитудам начального тока в отсутствие соединения. Рассчитывали средние значения нормализованного тока и стандартные ошибки для всех экспериментальных условий и строили графики зависимостей от времени в ходе эксперимента. Сравнивали степени ингибирования K+-тока, наблюдавшиеся после 5-минутного воздействия испытываемого соединения или контрольного носителя (обычно 0,3% DMSO). Статистические сравнения между экспериментальными группами выполняли с использованием двухпопуляционного независимогоt-теста (Microcal Origin v. 6.0). Различия считали значимыми при р 0,05. Чем меньше процент ингибирования тока калиевых ионов, определенный в этом тесте, тем меньше способность испытываемых соединений изменять картину реполяризации сердца при их использовании в качестве терапевтических агентов. Соединения настоящего изобретения, испытанные в этом тесте при концентрации 3 мкМ, обычно демонстрировали ингибирование тока калиевых ионов менее 40%, более типично - менее 25%. Например, соединение примера 1 демонстрировало в этом тесте ингибирование около 9%. Тест 5. Модель пероральной биодоступности in vitro: определение проницаемости Сасо-2. Определения проницаемости клеток Сасо-2 выполняли для моделирования способности испытываемых соединений проникать через кишечник и попадать в кровоток после перорального введения. Определяли скорость, с которой испытываемые соединения в растворе проникают через клеточный монослой, сконструированный для моделирования плотных контактов монослоев тонкого кишечника человека. Клетки Сасо-2 (аденокарциномы толстой кишки человека) были получены из АТСС (American TypeCulture Collection; Rockvile, MD). Для исследования проницаемости клетки высевали при плотности 63000 клеток/см 2 на предварительно увлажненные поликарбонатные фильтры-вставки Transwells (Costar;Cambridge, MA). Монослой клеток формировался в культуре через 21 день. После культивирования вTranswells-планшете мембраны, содержащие клеточный монослой, отделяли от этого планшета и вставляли в диффузионную камеру (Costar; Cambridge, MA). Эту диффузионную камеру помещали в нагревательный блок, снабженный циркуляцией внешней воды, термостатированной при 37 С для контроля температуры. Воздухораспределитель поставлял смесь 95% O2 и 5% CO2 в каждую половину диффузионной камеры и создавал ламинарный поток через клеточный монослой, что эффективно уменьшало граничный неперемешиваемый слой. Определение проницаемости проводили с испытываемым соединением в концентрации 100 мкМ и с 14C-маннитом для мониторирования целостности монослоя. Все эксперименты проводили при 37 С в течение 60 мин. Образцы отбирали в нулевой момент и через 30 и 60 мин с донорной и акцепторной сторон камеры. Образцы анализировали с помощью ВЭЖХ или просчитывали в жидкостном сцинтилляционном счетчике для определения концентраций испытываемого соединения и маннита. Рассчитывали коэффициент проницаемости (Kp) в см/с.- 26014819 В этом тесте величину Kp, большую чем примерно 1010-6 см/с, считали показателем хорошей биодоступности. Соединения этого изобретения, испытанные в этом тесте, обычно демонстрировали значения Kp между примерно 2010-6 и примерно 6010-6 см/с, более типично - между примерно 3010-6 и 6010-6 см/с. Например, соединение примера 1 показывало значение Kp, равное 6010-6 см/с. Тест 6. Фармакокинетическое исследование на крысах. Лекарственные формы испытываемых соединений в виде водных растворов были приготовлены в 0,1% молочной кислоте при рН между примерно 5 и примерно 6. Испытываемые соединения вводили самцам крыс Sprague-Dawley (линии CD, Charles River Laboratories, Wilmington, MA) внутривенно (в/в) в дозе 2,5 мг/кг или перорально (п/о) в дозе 5 мг/кг. Объем доз был равен 1 мл/кг при в/в введении и 2 мл/кг при п/о введении. Серийные образцы крови отбирали у животных до введения и через 2 мин (только при в/в введении), 5, 15 и 30 мин, 1, 2, 4, 8 и 24 ч после введения. Концентрации испытываемых соединений в плазме крови определяли жидкостной хроматографией с масс-спектрометрией(ЖХ-MC/МС) (MDS SCIEX, API 4000, Applied Biosystems, Foster City, CA) с нижним пределом определения 1 нг/мл. Стандартные фармакокинетические параметры оценивали с помощью некомпартментного анализа(модель 201 для в/в введения и модель 200 для п/о введения), используя WinNonlin (версия 4.0.1,Pharsight, Mountain View, CA). Максимум на кривой зависимости концентрации испытываемого соединения в плазме крови от времени обозначали как Cmax. Площадь под кривой концентрация-время от момента введения до последней измеряемой концентрации (AUC(0-t рассчитывали по правилу линейных трапеций. Пероральную биодоступность (F(%, т.е. нормализованное по дозе отношение AUCF (%)=AUC п/о/AUC в/вДозав/в/Дозап/о 100%. Полагают, что испытываемое соединение, демонстрирующее большие значения параметров Cmax,AUC (0-t) и F (%), должно иметь большую биодоступность при пероральном введении. Соединения настоящего изобретения, испытанные в этом тесте, имели значения Cmax между примерно 0,15 и примерно 0,35 мкг/мл и значения AUC (0-t) между примерно 0,5 и примерно 1,1 мкгч/мл. В частности, соединение примера 1 имело следующие значения: Cmax=0,32 мкг/мл; AUC (0-t)=0,97 мкгч/мл и пероральную биодоступность F (%)=55%. Хотя настоящее изобретение описано со ссылками на конкретные варианты его осуществления,специалистам в данной области следует понимать, что можно сделать различные изменения и произвести эквивалентные замены без отступления от сущности и объема настоящего изобретения. Кроме того,можно сделать многие модификации для адаптации к конкретной ситуации, материалу, составу вещества, способу, стадии или стадиям способа, к целям, сущности и объему настоящего изобретения. Все такие модификации предназначены для сохранения в рамках, обозначенных формулой изобретения, прилагаемой ниже. Кроме того, все публикации, патенты и патентные документы, процитированные выше,полностью включены в описание в качестве ссылок, как и индивидуальные упомянутые ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I),в котором R1 является галогеном или C1-3 алкилом, где C1-3 алкил необязательно замещен гидроксилом или галогеном;R2 является водородом или C1-3 алкилом, где C1-3 алкил необязательно замещен гидроксилом;Ra, Rb и Rc являются независимо водородом или C1-3 алкилом;Rd является водородом или C1-3 алкилом, в котором C1-3 алкил необязательно замещен гидроксилом;Rg является водородом или C1-3 алкилом;e=1 или 2; при условии, что когда c=0, тогда d=2 и R5 является -C(O)NRaRb; а когда c=2, тогда d=1; или его фармацевтически приемлемой соли, или сольвата, или стереоизомера. 2. Соединение по п.1, в котором a=0. 3. Соединение по п.1, в котором R2 является этилом или изопропилом. 4. Соединение по п.1, в котором b=1. 5. Соединение по п.1, в котором R3 и R4 вместе с атомом азота, к которому они присоединены,образуют фрагмент формулы (b). 6. Соединение по п.1, в котором R3 и R4 вместе с атомом азота, к которому они присоединены,образуют фрагмент формулы (c). 7. Соединение по п.1, в которомR2 является этилом или изопропилом;,R4 является -(CH2)1-3C(O)NRaRb или или R3 и R4 вместе с атомом азота, к которому они присоединены, образуют фрагмент, выбранный из формул (a)-(c);Ra, Rb и Rg являются независимо водородом или метилом;Rg является водородом или C1-3 алкилом;e=1. 8. Соединение по п.7, в котором R3 и R4 вместе с атомом азота, к которому они присоединены,образуют фрагмент формулы (b), где R6 является -C(O)Rf. 9. Соединение по п.1, в котором это соединение выбрано из 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира 4-(тетрагидрофуран-2-карбонил)пиперазин-1 карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира 4-(2-гидроксиэтил)пиперазин-1-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира 4-ацетилпиперазин-1-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира 4-диметилкарбамоилоксипиперидин-1 карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8- 28014819 азабицикло[3.2.1]окт-8-илпропилового сложного эфира 3-карбамоилпиперидин-1-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира 1,1-диоксо-16-тиоморфолин-4-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира(1,1-диоксотетрагидро-16-тиофен-3 ил)метилкарбаминовой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира (R)-2-карбамоилпирролидин-1-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира 4-ацетил[1,4]диазепан-1-карбоновой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира диметилкарбамоилметилметилкарбаминовой кислоты; 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира 4-диметилкарбамоилпиперазин-1-карбоновой кислоты и 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо-2,3-дигидробензоимидазол-1-карбонил)амино]-8 азабицикло[3.2.1]окт-8-илпропилового сложного эфира 4-диметилсульфамоилпиперазин-1-карбоновой кислоты и их фармацевтически приемлемые соли, сольваты или стереоизомеры. 10. Соединение по п.1, в котором этим соединением является 3-(1S,3R,5R)-3-[(3-изопропил-2-оксо 2,3-дигидробензоимидазол-1-карбонил)амино]-8-азабицикло[3.2.1]окт-8-илпропиловый сложный эфир 1,1-диоксо-16-тиоморфолин-4-карбоновой кислоты или его фармацевтически приемлемые соль, сольват или стереоизомер. 11. Фармацевтическая композиция для лечения медицинских состояний, связанных с активностью рецептора 5-HT4, содержащая терапевтически эффективное количество соединения по любому из пп.1-10 и фармацевтически приемлемый носитель. 12. Применение соединения по любому из пп.1-10 для использования в терапии. 13. Применение соединения по любому из пп.1-10 для производства медикамента для лечения медицинского состояния у млекопитающего, сопряженного с активностью рецептора 5-HT4. 14. Применение по п.13, в котором медицинское состояние является расстройством пониженной моторики желудочно-кишечного тракта. 15. Применение по п.14, в котором расстройство пониженной моторики является хроническим запором, синдромом раздраженной толстой кишки, сопровождающимся преимущественно запором, диабетическим и идиопатическим гастропарезом или функциональной диспепсией. 16. Способ получения соединения формулы (I)(a) реакцию соединения формулы (III)(b) реакцию соединения формулы (V)
МПК / Метки
МПК: C07D 451/04, A61P 1/00, A61K 31/46
Метки: карбаматные, соединения, рецептора, качестве, 5-нт4, агонистов
Код ссылки
<a href="https://eas.patents.su/30-14819-karbamatnye-soedineniya-v-kachestve-agonistov-receptora-5-nt4.html" rel="bookmark" title="База патентов Евразийского Союза">Карбаматные соединения в качестве агонистов рецептора 5-нт4</a>
Предыдущий патент: Энантиоселективное получение s-энантиомера омепразола или смеси s- и r-энантиомеров омепразола, обогащенной s-энантиомером омепразола
Следующий патент: Применение композиций, содержащих антагонист каппа-опиоидных рецепторов бупренорфин, для лечения эмоционально неустойчивых расстройств личности
Случайный патент: Комплексное бесхлорное удобрение с микроэлементами и биологически активной добавкой для моркови и способ его получения












