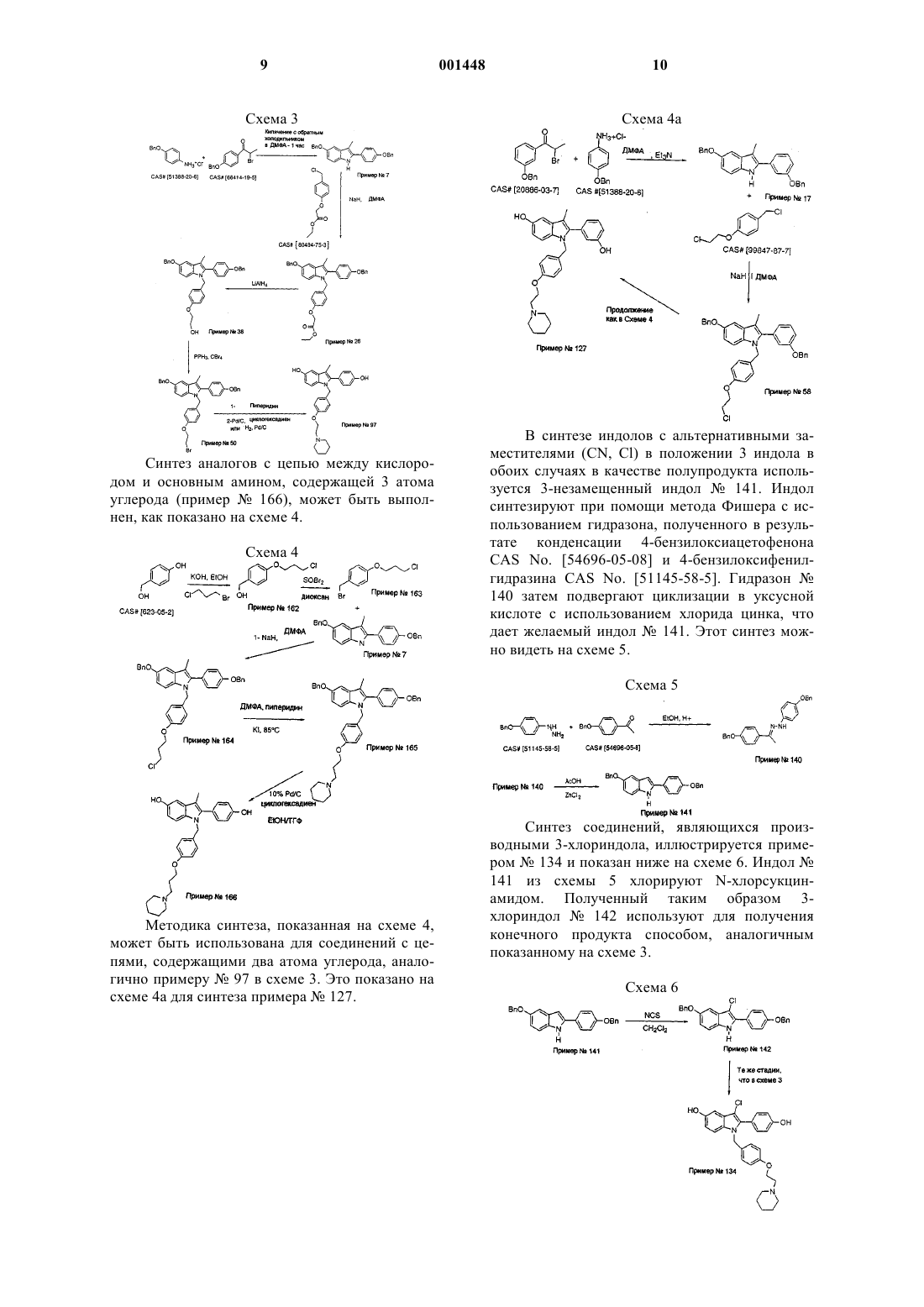
Производные 2-фенил-1- [4-(2-аминоэтокси)бензил] индола в качестве эстрогенных агентов
Номер патента: 1448
Опубликовано: 23.04.2001
Авторы: Коллини Мишель Дэвид, Трэн Бэч Динх, Миллер Крис Пол, Сантилли Артур Аттилио
Формула / Реферат
1. Производные 2-фенил-1-[4-(2-аминоэтокси)бензил] индола общей структурной формулы I или II
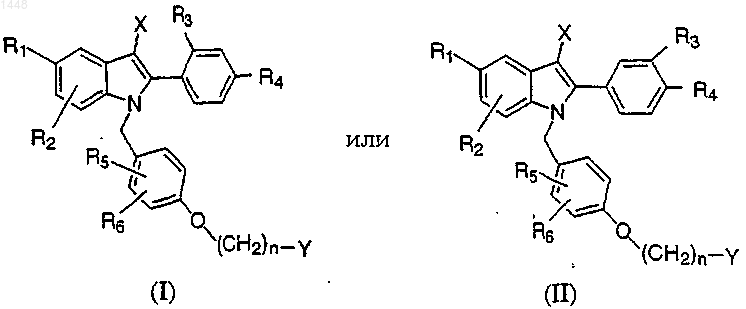
где R1 выбран из Н, ОН, -О-(С=O)-(C1-C12)алкила (где алкил представляет собой линейную цепь или разветвленную), -О-(C1-C12)алкила (где алкил представляет собой линейную цепь, разветвленную или циклическую цепь), галогена; или -O-(C1-C4)-галогенированного алкила (включая трифторметокси и трихлорметокси);
R2, R3, R4, R5 и R6 независимо выбраны из Н, ОН, -O-(С=O)-(C1-C12)алкила (где алкил представляет собой линейную цепь или разветвленную), -О-(C1-C12)алкила (где алкил представляет собой линейную цепь, или разветвленную, или циклическую), галогена или -O-(C1-C4)галогенированного алкила (включая трифторметокси и трихлорметокси), циано, (C1-C6)алкила (линейная цепь или разветвленная) или трифторметила, при условии, что когда R1 представляет собой Н, R2 не является группой ОН;
X выбран из Н, (C1-C6)алкила, циано, трифторметила, галогена;
n равно 2 или 3;
Y выбран из:
а) группы
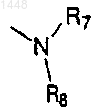
где R7 и R8 независимо выбраны из группы, включающей Н, (C1-C6)алкил или фенил, необязательно замещенный (C1-C6)алкилом (линейная цепь или разветвленная), (C1-C6)алкокси (линейная цепь или разветвленная), галогеном, -ОН, -СF3 или -OCF3; или
R7 и R8, соединенные вместе, образуют группу -(СН2)Р, где р является целым числом от 2 до 6, предпочтительно от 4 до 6, причем образованное при этом кольцо является необязательно замещенным 1-3 заместителями, выбранными из (C1-С3)алкила, трифторметила, галогена, водорода и фенила;
б) пяти-, шести- или семичленного насыщенного, ненасыщенного или частично ненасыщенного гетероцикла, содержащего вплоть до двух гетероатомов, или замещенных гетероатомов, выбранных из группы, включающей -O-, -NH-, -N(C1-C4-алкил)- и -N=, и необязательно замещенного 1-3 заместителями, независимо выбранными из гидроксила, галогена, (C1-C4)-алкила, тригалогенметила, (C1-C4)алкокси, тригалогенметокси, (C1-C4)ацилокси, (C1-C4)алкилтио, (C1-C4)алкилсульфинила, (C1-C4)-алкилсульфонила, гидрокси (C1-C4)алкила, -СO2Н, -CONHR1, -NH2, (C1-C4)алкиламино, ди(C1-C4)алкиламино, -NHSO2R1, -NHCOR1 и фенила, необязательно замещенного 1-3 (C1-C4)алкилами;
в) бициклического гетероцикла, содержащего 6-12 атомов углерода, либо с мостиковой связью, либо конденсированного и содержащего вплоть до двух гетероатомов или замещенных гетероатомов, выбранных из группы, включающей -O-, -NH- и -N(C1-C4алкил)-, необязательно замещенного 1-3 заместителями, независимо выбранными из группы, включающей водород, гидроксил, галоген, (C1-C4)алкил, тригалогенметил, (C1-С4)алкокси, тригалогенметокси, (C1-C4)ацилокси, (C1-C4)алкилтио, (C1-C4)алкилсульфинил, (C1-C4)алкилсульфонил, гидрокси-(C1-C4)алкил, -СO2Н, -CONHR1, -NH2, (C1-C4)алкиламино, ди(С1-С4)алкиламино, -NHSO2R1, -NHCOR1 и фенил, необязательно замещенный 1-3 (C1-C4)алкилами;
и их фармацевтически приемлемые соли.
2. Соединение по п.1, где R1 выбран из Н, ОН, -O(С=O)(C1-C4)алкила, -С(C1-C4)-алкила или галогена; R2, R3, R4, R5 и R6 независимо выбраны из Н, ОН, -O-(С=O)(C1-C4)алкила, -O-(C1-C4)алкила, галогена, циано, (C1-C6)-алкила или трифторметила, при условии, что, когда R1 представляет собой Н, R2 не является группой ОН; X выбран из Н, (C1-C6)алкила, циано, трифторметила или галогена; Y представляет собой группу
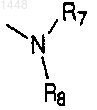
где R7 и R8 независимо выбраны из Н, (C1-C6)алкила или объединены группой -(СН2)р-, где р является целым числом от 2 до 6, таким образом, что образуется кольцо, причем кольцо является необязательно замещенным до трех заместителями, выбранными из группы, включающей водород, гидроксил, галоген, (C1-C4)алкил, тригалогенметил, (C1-C4)алкокси, тригалогенметокси, (C1-C4)алкилтио, (C1-C4)алкилсульфинил, (C1-C4)алкилсульфонил, гидрокси(C1-C4)алкил, -СO2Н, -CONH(C1-C4)алкил, -NH2, (C1-C4)алкиламино, ди(C1-C4)алкиламино, -NHSO2(C1-C4)алкил и -NHCO(C1-C4)алкил;
и их фармацевтически приемлемые соли.
3. Соединение по п.1, где R1 представляет собой ОН; R2, R3, R4, R5 и R6 независимо выбраны из Н, ОН, -O-(С=O)(C1-C4)алкила, -О-(C1-C4)алкила, галогена, циано, (C1-C6)-алкила или трифторметила, при условии, что, когда R1 представляет собой Н, R2 не является группой ОН; X выбран из группы, содержащей Cl, CN, СF3 или СН3; Y представляет собой группу
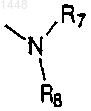
R7 и R8 связаны вместе в виде группы -(СН2)r-, где r является целым числом от 4 до 6, с образованием кольца, необязательно замещенного до трех заместителями, выбранными из группы, включающей водород, гидроксил, галоген, (C1-C4)-алкил, тригалогенметил, (C1-C4)алкокси, тригалогенметокси, (C1-C4)алкилтио, (C1-C4)алкилсульфинил, (C1-C4)алкилсульфонил, гидрокси(C1-C4)алкил, -СО2Н, -CONH(C1-C4)алкил, -NH2, (C1-C4)-алкиламино, ди(C1-C4)алкиламино, -NHSO2(C1-C4)алкил и -NHCO-(C1-C4)алкил;
и их фармацевтически приемлемые соли.
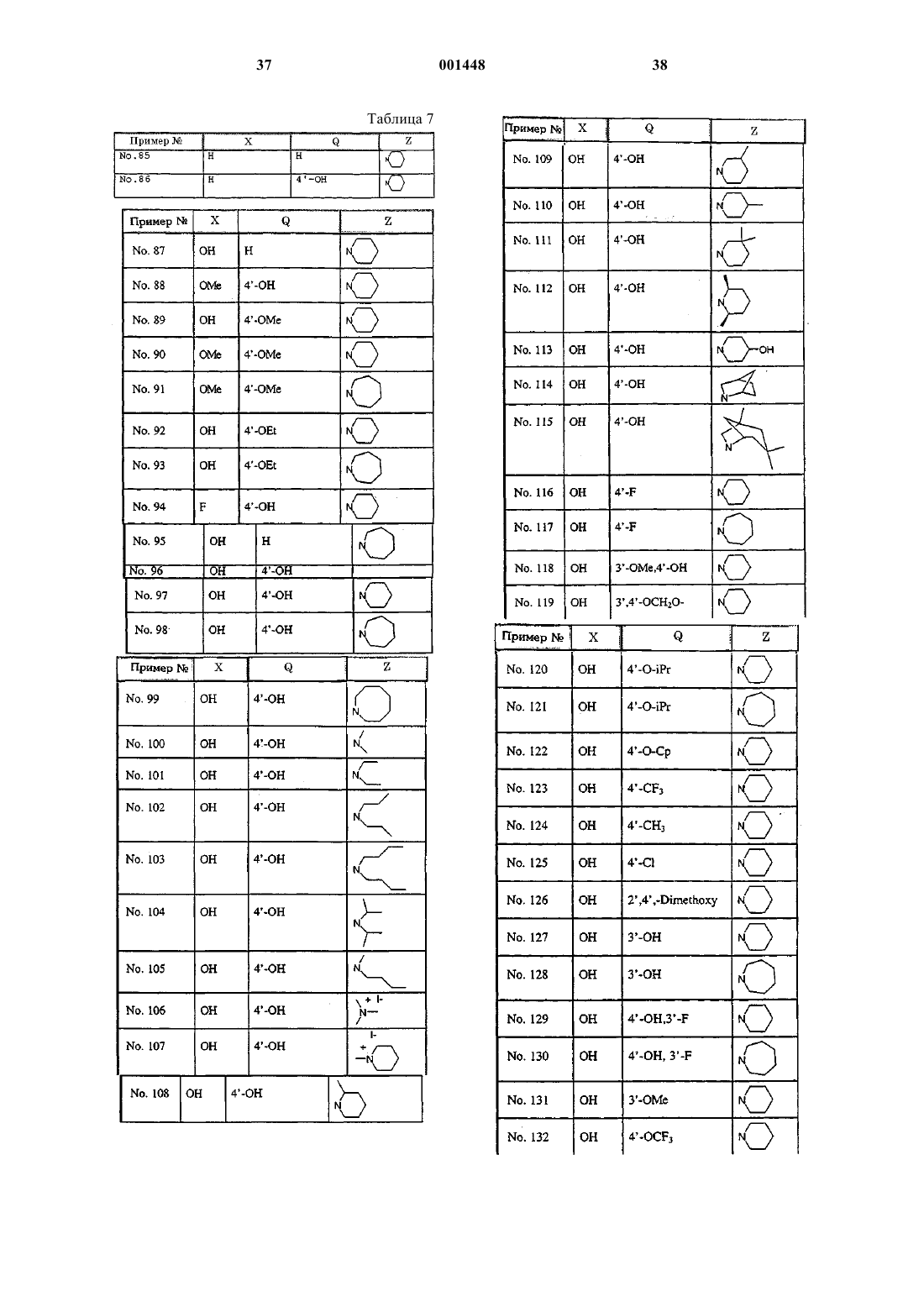
4. Соединение по п.1, которое является одним из следующих
5-Бензилокси-2-(4-этоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-фенил-3-метил-1-[4-(2-азепан-1-илэтокси)-бензил]-1H-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1-[4-(2-азепан-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1-[4-(2-диизопропиламино-1-илэтокси)бензил]-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1-[4-(2-бутилметиламино-1-илэтокси)бензил]-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1-{2-[4-(диметиламино)этокси]бензил}-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1-{4-[2-(2-метилпиперидин-1-ил)этокси]бензил}-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1-{4-[2-(3-метилпиперидин-1-ил)этокси]бензил}-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1-{4-[2-(4-метилпиперидин-1-ил)этокси]бензил}-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1-{4-[2-((цис)-2,6-диметилпиперидин-1-ил)этокси]бензил}-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-{4-[2-(1,3,3-триметил-6-азабицикло[3,2,1]окт-6-ил)этокси]бензил}-1Н-индол или его фармацевтически приемлемая соль;
(1S,4R)-5-Бензилокси-2-(4-бензилоксифенил)-3-метил-{4-[2-(2-азабицикло[2,2,1]гепт-6-ил)этокси]бензил}-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-фторфенил)-3-метил-1-[4-(2-азепан-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-фторфенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль ;
5-Бензилокси-2-(4-хлорфенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(3,4-метилендиоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-изопропоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-метилфенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол или его фармацевтически приемлемая соль;
1-[4-(2-Азепан-1-илэтокси)бензил]-5-бензилокси-2-(3-бензилоксифенил)-3-метил-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилокси-3-фторфенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилокси-3-фторфенил)-3-метил-1-[4-(2-азепан-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(3-метоксифенил)-1-[4-(2-пиперидин-1-илэтокси)бензил]-3-метил-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-2-(4-трифторметоксифенил)-1Н-индол или его фармацевтически приемлемая соль;
(2-{4-[5-Бензилокси-2-(4-бензилоксифенил)-3-метилиндол-1-илметил]фенокси}этил)циклогексиламин или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1-{4-[2-(4-метилпиперазин-1-ил)этокси]бензил}-1Н-индол или его фармацевтически приемлемая соль;
1-[4-(2-Азепан-1-илэтокси)бензил]-5-бензилокси-2-(3-метоксифенил)-3-метил-1Н-индол или его фармацевтически приемлемая соль ;
4-{3-Метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол} (НСl);
4-{3-Метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-2-ил}фенол гидрохлорид (НСl);
3-Метил-2-фенил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-5-ол (НСl);
4-{5-Метокси-3-метил-1-{4-[2-пиперидин-1-илэтокси]бензил}-1Н-индол-2-ил}фенол или его фармацевтически приемлемая соль;
2-(4-Метоксифенил)-3-метил-1-{4-[2-пиперидин-1-илэтокси]бензил}-1Н-индол-5-ол или его фармацевтически приемлемая соль;
5-Метокси-2-(4-метоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол (НСl);
1-[4-(2-Азепан-1-илэтокси)бензил]-5-метокси-2-(4-метоксифенил)-3-метил-1Н-индол (НСl);
2-(4-Этоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)-бензил]-1Н-индол-5-ол или его фармацевтически приемлемая соль;
1-[4-(2-Азепан-1-илэтокси)бензил]-2-(4-этоксифенил)-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
4-{5-Фтор-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-2-ил}фенол (НСl);
1-[4-(2-Азепан-1-илэтокси)бензил]-3-метил-2-фенил-1Н-индол-5-ол (НСl);
2-(4-Гидроксифенил)-3-метил-1-[4-(2-пирролидин-1-илэтокси)бензил]-1Н-индол-5-ол или его фармацевтически приемлемая соль;
1-[4-(2-Азепан-1-илэтокси)бензил]-2-(4-гидроксифенил)-3-метил-1Н-индол-5-ол (НСl);
Ацетатная соль 1-[4-(2-азепан-1-илэтокси)бензил]-2-(4-гидроксифенил)-3-метил-1Н-индол-5-ола;
1-[4-(2-Азокан-1-илэтокси)бензил]-2-(4-гидроксифенил)-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-3-метил-1-[4-(2-диметиламиноэтокси)-бензил]-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-3-метил-1-[4-(2-диэтиламиноэтокси)-бензил]-1Н-индол-5-ол или его фармацевтически приемлемая соль;
1-[4-(2-Дипропиламиноэтокси)бензил]-2-(4-гидроксифенил)-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
1-[4-(2-Дибутиламиноэтокси)бензил]-2-(4-гидроксифенил)-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
1-[4-(2-Диизопропиламиноэтокси)бензил]-2-(4-гидроксифенил)-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
1-{4-[2-(Бутилметиламино)этокси]бензил}-2-(4-гидроксифенил)-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-3-метил-1-{4-[2-(2-метилпиперидин-1-ил)этокси]бензил}-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-3-метил-1-{4-[2-(3-метилпиперидин-1-ил)этокси]бензил}-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-3-метил-1-{4-[2-(4-метилпиперидин-1-ил)этокси]бензил}-1Н-индол-5-ол (НСl);
1-{4-[2-(3,3-Диметилпиперидин-1-ил)этокси]бензил}-2-(4-гидроксифенил)-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
1-{4-[2-((цис)-2,6-Диметилпиперидин-1-ил)этокси]бензил}-2-(4-гидроксифенил)-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-1-{4-[2-(4-гидроксипиперидин-1-ил)-этокси]бензил}-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
(1S,4R)-1-{4-[2-(2-Азабицикло[2,2,1]гепт-2-ил)этокси]бензил}-2-(4-гидроксифенил)-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-3-метил-1-{4-[2-(1,3,3-триметил-6-азабицикло[3,2,1]окт-6-ил)этокси]бензил}-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Фторфенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)-бензил]-1H-индол-5-ол (НСl);
1-[4-(2-Азепан-1-илэтокси)бензил]-2-(4-фторфенил)-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(3-Метокси-4-гидроксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-5-ол (НСl);
2-Бензо[1,3]диоксол-5-ил-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-5-ол (НСl);
2-(4-Изопропоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-5-ол (НСl);
1-[4-(2-Азепан-1-илэтокси)бензил]-2-(4-изопропоксифенил)-3-метил-1Н-индол-5-ол (НСl);
2-(4-Циклопентилоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-5-ол или его фармацевтически приемлемая соль;
3-Метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-2-(4-трифторметилфенил)-1Н-индол-5-ол или его фармацевтически приемлемая соль;
3-Метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-2-п-толил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Хлорфенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)-бензил]-1Н-индол-5-ол (НСl);
2-(2,4-Диметоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(3-Гидроксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-5-ол или его фармацевтически приемлемаясоль;
1-[4-(2-Азепан-1-илэтокси)бензил]-2-(3-гидроксифенил)-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль ;
2-(3-Фтор-4-гидроксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(3-Фтор-4-гидроксифенил)-3-метил-1-[4-(азепан-1-илэтокси)бензил]-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(3-Метоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)-бензил]-1Н-индол-5-ол или его фармацевтически приемлемая соль;
3-Метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-2-(4-трифторметоксифенил)-1Н-индол-5-ол или его фармацевтически приемлемая соль;
3-Хлор-2-(4-гидроксифенил)-1-[4-(2-пирролидин-1-илэтокси)-бензил]-1Н-индол-5-ол (НСl);
3-Хлор-2-(4-гидроксифенил)-1-[4-(2-пиперидин-1-илэтокси)-бензил]-1Н-индол-5-ол (НСl);
3-Хлор-2-(4-гидроксифенил)-1-[4-(2-азепан-1-илэтокси)-бензил]-1Н-индол-5-ол (НСl);
3-Хлор-2-(4-гидрокси-2-метилфенил)-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-3-этил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-5-ол (НСl);
5-Гидрокси-2-(4-гидроксифенил)-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-3-карбонитрил (НСl);
1-[4-(2-Азепан-1-илэтокси)бензил]-5-гидрокси-2-(4-гидроксифенил)-1Н-индол-3-карбонитрил (НСl);
5-Бензилокси-2-(4-бензилоксифенил)-3-хлор-1-[4-(2-пиперидин-1-илэтокси)бензил]-1H-индол или его фармацевтически
приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-хлор-1-[4-(2-азепан-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(2-метил-4-бензилоксифенил)-3-хлор-1-[4-(2-пиперидин-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-этил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-циано-1-[4-(2-пиперидин-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-циано-1-[4-(2-азепан-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
Дипропионат 1-[4-(2-азепан-1-илэтокси)бензил]-2-(4-гидроксифенил)-3-метил-1Н-индол-5-ола (НСl);
Дипивалат 1-[4-(2-азепан-1-илэтокси)бензил]-2-(4-гидроксифенил)-3-метил-1Н-индол-5-ола (НСl);
5-Бензилокси-2-(4-бензилоксифенил)-1-[4-(3-пиперидин-1-илпропокси)бензил]-3-метил-1Н-индол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-3-метил-1-{4-[3-(пиперидин-1-ил)-пропокси]бензил}-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-1-[3-метокси-4-(2-пиперидин-1-илэтокси)бензил]-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-1-[3-метокси-4-(2-азепан-1-илэтокси)бензил]-3-метил-1Н-индол-5-ол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1-[3-метокси-4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1-[2-метокси-4-(2-азепан-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
Дипивалат 2-(4-гидроксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1Н-индол-5-ола или его фармацевтически приемлемая соль;
5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
5-Бензилокси-2-(3-бензилоксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1H-индол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)-бензил]-1Н-индол-5-ол или его фармацевтически приемлемая соль;
2-(4-Гидроксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)-бензил]-1Н-индол-5-ол метиодид; или
2-(4-Гидроксифенил)-3-метил-1-[4-(2-диметиламиноэтокси)-бензил]-1Н-индол-5-ол метиодид.
5. Фармацевтическая композиция, содержащая соединение по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент.
6. Способ лечения или предотвращения потери костной ткани у млекопитающих, заключающийся во введении млекопитающему, нуждающемуся в этом, эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
7. Способ лечения или предотвращения состояний или синдромов заболеваний, которые вызваны или связаны с дефицитом эстрогена у млекопитающих, заключающийся во введении млекопитающему, нуждающемуся в этом, эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
8. Способ лечения или предотвращения сердечно-сосудистых заболеваний у млекопитающих, заключающийся во введении млекопитающему, нуждающемуся в этом, эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
9. Способ лечения или предотвращения заболеваний у млекопитающих, которые являются результатом пролиферации или патологического развития, деятельности или роста эндометриальных или подобных эндометриальным тканей, заключающийся во введении млекопитающему, нуждающемуся в этом, эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
10. Способ получения соединения формулы I или II, определенных в п.1, включающий взаимодействие соединения формулы
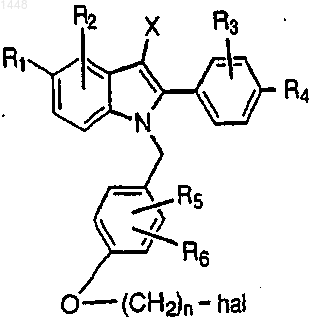
где n, R1-R6 и X указаны выше и hal представляет собой хлор или бром, с соединением формулы
HNR7R8,
где R7 и R8 указаны в п.1,
с получением соответствующего соединения формулы I или II; причем, если необходимо, осуществляют защиту любых реакционноспособных групп-заместителей в течение проведения способа и удаление этой защиты;
если желательно, преобразуют присутствующую фенольную группу в фосфат, сульфат, сульфамат или сульфатный сложный эфир; и далее, если желательно, превращают соединение формулы I или II в фармацевтически приемлемую соль.
11. Способ получения соединения формулы I или II, определенных в п.1, включающий взаимодействие соединения формулы
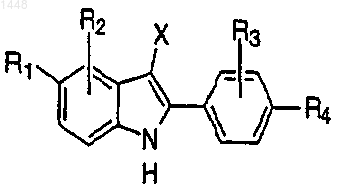
где R1-R4 и X указаны в п.1,
в присутствии основания, например NaH, с соединением формулы
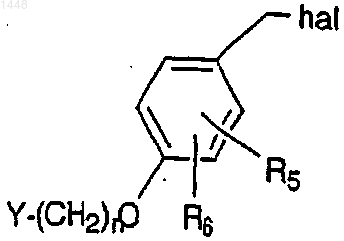
где n, R5, R6 и Y указаны в п.1 и hal представляет собой галоген, например Сl или Вr,
с получением соответствующего соединения формулы I или II; причем, если необходимо, осуществляют защиту любых реакционноспособных групп-заместителей в течение проведения способа и удаление этой защиты;
если желательно, преобразуют присутствующую фенольную группу в фосфат, сульфат, сульфамат или сульфатный сложный эфир; и далее, если желательно, превращают соединение формулы I или II в фармацевтически приемлемую соль.
Текст
1 Настоящее изобретение относится к новым производным 2-фенил-1-[4-(2-аминоэтокси) бензил]индола, которые применимы в качестве эстрогенных агентов, а также к фармацевтическим композициям и способам лечения, в которых используются эти соединения. Использование гормонозамещающей терапии для предотвращения потери костной ткани(остеопороза) у женщин в постклимактерический период хорошо обосновано. Обычный порядок лечения требует введения в организм добавочного эстрогена с использованием таких составов, которые содержат эстрон, эстриол,этинилэстрадиол или коньюгировaнные эстрогены, выделенные из источников природного происхождения (т.е. коньюгировaнные эстрогены Premarin производства Wyeth-Ayerst). Некоторым пациентам терапия может быть противопоказана ввиду пролиферативных эффектов,которые несбалансированные эстрогены (эстрогены, вводимые не в сочетании с прогестинами) оказывают на ткань матки. Эта пролиферация связана с повышенным риском эндометриоза и/или рака эндометрия. Воздействие несбалансированных эстрогенов на ткань молочной железы менее очевидно, но оно имеет некоторое значение. Необходимость в эстрогенах, которые могут поддерживать сохраняющее костную ткань действие и при этом свести к минимуму пролиферативные эффекты на матку и молочную железу, является очевидной. Показано, что некоторые антиэстрогены нестероидного характера сохраняют костную массу при исследованиях на модели овариэктомированных крыс, а также при клинических исследованиях на людях. Например, тамоксифен (tamoxifen, продаваемый как Novadex тамоксифенцитрат компанией Zeneca Pharmaceuticals, Wilmington, Delaware) является применяемым паллиативным средством для лечения рака молочной железы и,как было показано, оказывает влияние на костную ткань человека подобно агонистам эстрогена. Однако в матке он является также частичным агонистом, и это служит причиной определенного беспокойства. Показано, что ралоксифен (raloxifen), бензотиофеновый антиэстроген,стимулирует рост матки у подвергнутых овариэктомии крыс в меньшей степени, чем тамоксифен, сохраняя в то же время способность сберегать кости. Соответствующим обзором по избирательным к тканям эстрогенам является статьяTissue-Selective Actions of Estrogen Analogs,Воnе Vol. 17, No. 4, October 1995, 181S-190S. Об использовании индолов в качестве антагонистов эстрогена сообщается Von Angerer,Chemical Abstracts, Vol. 99, No. 7 (1983), Abstract No. 53886u. См. также J. Med. Chem. 1990,33, 2635-2640; J. Med. Chem. 1987, 30, 131-136. См. также Ger. Offen., DE 3821148 A1 891228 иWO 96/03375. Эти соединения известного уровня техники обладают некоторым структурным подобием с представленными в настоящем изо 001448 2 бретении соединениями, но являются функционально иными. У соединений, содержащих основной амин, отсутствует фенильная группа,которая делает побочную цепь жесткой. Известные для этих соединений данные указывают на то, что у них может иметь место более слабое связывание с рецептором эстрогена, чем у соединений согласно настоящему изобретению, и что содержащие побочную цепь основного характера соединения, о которых сообщается, оказывают некоторое утеротрофическое действие на матку крыс. Одно соединение из перечисленного в WO 96/03375 семейства соединений обладает бензильной группой, но не имеет побочной цепи основного характера. Большинство из этих соединений относится к классу соединений, лучше всего характеризуемых как соединения, являющиеся "истыми антиэстрогенами". Многие из соединений, описанных в настоящем изобретении, благодаря их особой побочной цепи, действуют на матку как чистые антиэстрогены, однако, проявляют сильную эстрогенную активность на костную и сердечнососудистую системы. У родственных соединений известного уровня техники такого действия не проявляется. В WO А 93 17383 (Kar Bio АВ) описываются индоловые антиэстрогены с длинными неразветвленными цепями. В другом родственном патенте WO А 93 10741 описывается 5 гидроксииндол с общим дескриптором, включающим другие побочные цепи. В WO 93/23374(Otsuka Pharmaceuticals, Japan) описываются соединения, которые отличаются от настоящего изобретения, где R3 в представленных ниже формулах I и II определяется как тиоалкил, и в данной ссылке описаны не такие соединения,которые имеют цепи от азота индола, имеющие такую же структуру, как в соединениях, предложенных в настоящем изобретении. В тех случаях, когда заявляемая побочная цепь является подобной той, которая описана в указанном источнике, соединения с этой цепью являются амидами. В настоящем изобретении ацилированные индолы не заявляются. 2-Фенилиндолы общего структурного типа, изображаемого формулами (I) и (II), являются агонистами/антагонистами эстрогена, пригодными для лечения заболеваний, связанных с недостатком эстрогена. У соединений согласно настоящему изобретению проявляется сильное связывание с рецептором эстрогена. Испытанияin vitro, включая испытание со щелочной фосфатазой клеток Ишикавы и испытание на трансфекцию ERE, показывают, что эти соединения являются антиэстрогенами с собственной эстрогенностью от малой до полностью отсутствующей, и доказано, что они способны полностью противодействовать эффектам, вызываемым 17-эстрадиолом, проявляя в то же время слабое раздражающее влияние или полное отсутствие такого влияния на матку в испытании 3 на матке крыс в том случае, когда они введены сами по себе. В дополнение к этому, некоторые из этих соединений способны тормозить потерю костной ткани у подвергнутых овариэктомии крыс, проявляя в то же время слабое раздражающее влияние или полное отсутствие такого влияния на матку. Эти соединения снижают также прибавление в весе, обычно наблюдаемое у подвергнутых овариэктомии животных, а также снижают общий уровень содержания холестерина. Настоящее изобретение включает соединения формул I и II, данных нижеR2, R3, R4, R5 и R6 независимо выбраны из Н, ОН, -O-(С=O)-(C1-C12)алкила (линейного или разветвленного), -О-(C1-С 12)алкила (линейного,разветвленного или циклического), галогена или-О-(C1-C4)галогенированного алкила (включая трифторметокси и трихлорметокси), циано, (C1C6)алкила (линейного или разветвленного), или трифторметила, при условии, что, когда R1 представляет собой Н, R2 не является группой ОН; где R7 и R8 независимо выбраны из группы,включающей Н, (C1-C6)алкил или фенил, необязательно замещенный (C1-C6)алкилом (линейным или разветвленным), (C1-C6)алкокси (линейная цепь или разветвленная), галогеном,-ОН, -СF3 или -ОСF3; илиR7 и R8 вместе образуют группу -(СН 2)p,где р равно целому числу от 2 до 6, предпочтительно от 4 до 6, образованное кольцо может быть необязательно замещено 1-3 заместителями, выбранными из (C1-С 3)алкила, трифторметила, галогена, водорода и фенила. б) пяти-, шести- или семичленного насыщенного, ненасыщенного или частично ненасыщенного гетероцикла, содержащего вплоть до двух гетероатомов, выбранных из группы,включающей -O-, -NH-, -N(С 1-С 4 алкил)- и -N=, 001448 4 необязательно замещенного 1-3 заместителями,независимо выбранными из группы, включающей водород, гидроксил, галоген, (С 1-С 4)алкил,тригалогенметил, (С 1-С 4)алкокси, тригалогенметокси, (С 1-С 4)ацилокси, (С 1-С 4)алкилтио, (С 1 С 4)алкилсульфинил,(C1-C4)алкилсульфонил,гидрокси(С 1-С 4)алкил, -СO2 Н, -CONHR1, -NH2,(С 1-С 4)алкиламино,ди(С 1-С 4)алкиламино,-NHSO2R1, -NHCOR1 и фенил, необязательно 13 замещенный (С 1-С 4)алкилом; в) бициклического гетероцикла, содержащего 6-12 атомов углерода, либо с мостиковой связью, либо конденсированного и содержащего вплоть до двух гетероатомов, или замещенных гетероатомов, выбранных из группы, включающей -О-, -NH- и -N(С 1-С 4aлкил)-, необязательно замещенного 1-3 заместителями, независимо выбранными из группы, включающей водород,гидроксил, галоген, (С 1-С 4)алкил, тригалогенметил, (С 1-С 4)алкокси, тригалогенметокси, (С 1(С 1-С 4)алкилтио,(С 1 С 4)ацилокси,С 4)алкилсульфинил, (С 1-С 4)алкилсульфонил, гидрокси(С 1 С 4)алкил, -СО 2 Н, -CONHR1, -NH2, (С 1-С 4)алкиламино, ди(С 1-С 4)алкиламино, -NHSO2R1,-NHCOR1 и фенил, необязательно 1-3 замещенный (С 1-С 4)алкилом; и их фармацевтически приемлемые соли. Более предпочтительными соединениями согласно настоящему изобретению являются соединения, имеющие общие структурные формулы I или II, указанные выше,где R1 выбран из Н, ОН, -O(С=O)(С 1-С 12)алкила,-C(С 1-С 12)алкила, галогена;R2, R3, R4, R5 и R6 независимо выбраны из Н, ОН, -O-(С=O)(С 1-С 12)алкила, -О-(С 1-С 12) алкила, галогена, циано, (C1-C6)алкила или тригалогенметила, предпочтительно трифторметила, при условии, когда R1 представляет собой Н,R2 не является группой ОН; где R7 и R8 независимо выбраны из Н, (С 1 С 6)алкила или объединены группой -(СН 2)р, где р является целым числом от 2 до 6, таким образом, что образуется кольцо, причем кольцо является необязательно замещенным до трех заместителями, выбранными из группы, включающей водород, гидроксил, галоген, (С 1-С 4)алкил, тригалогенметил, (С 1-С 4)алкокси, тригалогенметокси, (С 1-С 4)-алкилтио, (С 1-С 4)алкилсульфинил, (С 1-С 4)алкилсульфонил, гидрокси(С 1-С 4)алкил, -СО 2 Н, -CN, -CONH(С 1-С 4)алкил,-NH2, (С 1-С 4)алкиламино, ди(С 1-С 4)алкиламино,-NHSO2(С 1-С 4)алкил и -NHCO(С 1-С 4)алкил; и их фармацевтически приемлемые соли. 5 Указанные выше кольца, образуемые связанными R7 и R8, могут включать, но не ограничиваются ими, азиридиновые, азетидиновые,пирролидиновые, пиперидиновые, гексаметиленаминовые или гептаметиленовые кольца. Наиболее предпочтительными соединениями согласно настоящему изобретению являются соединения, имеющие структурные формулы I или II, указанные выше, в которых R1 представляет собой ОН; R2-R6 указаны выше; X выбран из группы, содержащей Cl, CN, CF3 или СН 3; a Y представляет собой группу и R7 и R8 связаны вместе в виде группы -(СН 2)r-,где r является целым числом от 4 до 6, с образованием кольца, необязательно замещенного до трех заместителями, выбранными из группы,содержащей водород, гидроксил, галоген, (С 1 С 4)-алкил, тригалогенметил, (С 1-С 4)алкокси,тригалогенметокси, (С 1-С 4)-алкилтио, (С 1-С 4) алкилсульфинил, (С 1-С 4)алкилсульфонил, гид-СO2 Н,-CONH(С 1 рокси-(С 1-С 4)алкил,С 4)алкил, -NH2, (С 1-С 4)алкиламино, ди-(С 1 С 4)алкиламино, -NHSO2(С 1-С 4)алкил и -NHCO(С 1-С 4)алкил; и их фармацевтически приемлемые соли. В другом варианте реализации настоящего изобретения, когда R7 и R8 связаны вместе в виде группы -(СН 2)p, где р является целым числом от 2 до 6, предпочтительно от 4 до 6, образованное таким образом кольцо является необязательно замещенным 1-3 заместителями, выбранными из группы, включающей (С 1 С 3)алкил, трифторметил, галоген, водород, фенил и -CN. Изобретение включает сульфаты, сульфаматы и сульфатные эфиры фенольных групп. Сульфаты могут быть легко получены путем взаимодействия свободных фенольных соединений с триоксидом серы, образующим комплекс с амином, таким как пиридин, триметиламин, триэтиламин и т.п. Сульфаматы могут быть получены путем обработки свободного фенольного соединения желаемым амино или алкиламино, или диалкиламиносульфамилхлоридом в присутствии подходящего основания,такого как пиридин. Сульфатные эфиры могут быть получены путем взаимодействия свободного фенола с желаемым алкансульфонилхлоридом в присутствии подходящего основания,такого как пиридин. Кроме этого, настоящее изобретение включает соединения, содержащие образуемые с фенольной группой фосфаты, а также диалкилфосфаты. Фосфаты могут быть получены путем взаимодействия фенола с подходящим хлорфосфатом. Диалкилфосфаты могут быть гидролизованы с получением свободных фосфатов. Предложены также фосфинаты,при получении которых фенол взаимодействует 6 с желаемым диалкилфосфиновым хлоридом с получением желаемого диалкилфосфината фенола. Изобретение включает формы приемлемых солей, образуемые путем реакции присоединения либо неорганических, либо органических кислот. Применимыми являются неорганические кислоты, такие как соляная кислота, бромоводородная кислота, йодоводородная кислота, серная кислота, фосфорная кислота, азотная кислота, а также применимыми являются органические кислоты, такие как уксусная кислота,пропионовая кислота, лимонная кислота, малеиновая кислота, яблочная кислота, винная кислота, фталевая кислота, янтарная кислота,метансульфоновая кислота, толуолсульфоновая кислота, нафталинсульфоновая кислота, камфорсульфоновая кислота, бензолсульфоновая кислота. Известно, что соединения, в которых имеется основной азот, могут образовывать комплексы со многими различными кислотами(как протонными, так и непротонными), и обычно является предпочтительным введение соединений по настоящему изобретению в виде кислотно-аддитивной соли. Кроме этого, настоящее изобретение включает образуемые описываемыми здесь соединениями соли четвертичного аммония. Эти соли могут быть получены путем взаимодействия нуклеофильных аминов из побочной цепи с обладающим подходящей реакционной способностью алкилирующим агентом, таким как алкилгалогенид или бензилгалогенид. Настоящее изобретение относится также к способам получения соединений формул I и II,которые включают один из следующих: а) взаимодействие соединения формулы где n, R1-R6 и X определены, как указано выше,a hal представляет собой хлор или бром, с соединением формулы НN7R8 где R7 и R8 указаны выше, с получением соответствующего соединения формулы I или II; или б) взаимодействие соединения формулы где n, R5, R6 и Y указаны выше, a hal представляет собой галоген, например, Сl или Вr с получением соответствующего соединения формулыI; если необходимо, защиту любых реакционноспособных групп-заместителей в процессе каждого из вышеуказанных способов и удаление этой защиты; и если желательно, превращение присутствующей фенольной группы в фосфат, сульфат,сульфамат или сульфатный сложный эфир; и далее, если это желательно, превращение соединения формулы I или II в фармацевтически приемлемую соль. Способы синтеза Соединения согласно настоящему изобретению могут быть синтезированы в соответствии с общим направлением синтеза согласно схеме 1, данной ниже. Схема 1 8 бензильная группа, которая удобным образом может быть удалена при помощи нескольких стандартных способов, в особенности гидрогенолиза. Для синтеза соединений с X=Н, галоген,трифторметил, циано, нитро, может быть предпочтительным альтернативный вариант синтеза,показанный на схеме 2. Введение галогенов в положение 3 может быть легко выполнено при помощи таких реагентов, как N-хлорсукцинимид, N-бромсукцинимид или N-иодсукцинимид. Полученное производное 3-иодиндола может быть использовано как полупродукт при получении соединения,содержащего 3 трифторметил, в реакции сочетания с использованием палладиевого катализатора и бис(трифторметил)ртути (II). Соединение с цианогруппой в положении 3 может быть получено путем электрофильного цианирования или, в альтернативном варианте, положение 3 может быть формилировано (например, солью формилиминия), затем формильная группа может быть превращена в оксим и далее дегидратирована до нитрила. В другом варианте, 3-цианосоединение может быть синтезировано путем взаимодействия 3-незамещенного индола с хлорсульфонилизоцианатом с последующей обработкой 3-этиламином. Производное с нитрогруппой в положении 3 может быть получено путем обработки индола нитритом натрия и уксусной кислотой. Специалисту в данной области понятно,что пути синтеза этим не ограничиваются, и другие пути также являются доступными. Схема 2 Первоначальный синтез индола выполняется путем нагревания соответствующим образом замещенного альфа-бромкетона (b) с желательным анилином (а) в ДМФА с образованием индола (с). Продукт реакции затем алкилируют бромбензилхлоридом (е) с получением замещенного индола (f). Бензилхлорид (е) может быть легко получен из альдегида (d) в 2 стадии,как указано. Продукт (g) может быть получен из(f) путем восстановления сложного эфира, превращения спирта в бромид, замещения бромида желаемым амином в подходящем растворителе,таком как ТГФ или ДМФА, и, наконец, если это необходимо, снятия защиты. Защита необходима, когда либо R1, либо R2, либо оба эти радикала представляют собой защищенный фенол. Предпочтительной защитной группой является Способы синтеза избранных репрезентативных примеров даны на следующих схемах: Синтез аналогов с цепью между кислородом и основным амином, содержащей 3 атома углерода (пример 166), может быть выполнен, как показано на схеме 4. Схема 4 В синтезе индолов с альтернативными заместителями (CN, Cl) в положении 3 индола в обоих случаях в качестве полупродукта используется 3-незамещенный индол 141. Индол синтезируют при помощи метода Фишера с использованием гидразона, полученного в результате конденсации 4-бензилоксиацетофенонаCAS No. [54696-05-08] и 4-бензилоксифенилгидразина CAS No. [51145-58-5]. Гидразон 140 затем подвергают циклизации в уксусной кислоте с использованием хлорида цинка, что дает желаемый индол 141. Этот синтез можно видеть на схеме 5. Схема 5 Методика синтеза, показанная на схеме 4,может быть использована для соединений с цепями, содержащими два атома углерода, аналогично примеру 97 в схеме 3. Это показано на схеме 4 а для синтеза примера 127. Синтез соединений, являющихся производными 3-хлориндола, иллюстрируется примером 134 и показан ниже на схеме 6. Индол 141 из схемы 5 хлорируют N-хлорсукцинамидом. Полученный таким образом 3 хлориндол 142 используют для получения конечного продукта способом, аналогичным показанному на схеме 3. Схема 6 11 3-Цианопроизводные синтезируют из промежуточного продукта, которым является индол 141, как показано на схеме 7. Взаимодействие полупродукта - индола 141 с хлорсульфонил-изоцианатом с последующим добавлением 3-этиламина приводит к получению 3 цианоиндола 155. Побочную цепь получают путем превращения бензилового спирта CASNo. [111728-87-1] в бензилбромид 156 с использованием тионилбромида в среде ТГФ. Индол алкилируют побочной цепью в ДМФА с использованием гидрида натрия с получением промежуточного соединения 157. Последнее может быть использовано для получения конечного продукта 138 способом, аналогичным показанному на схеме 4. Схема 7 Соединения согласно изобретению являются частичными агонистами эстрогена и проявляют высокое сродство к рецептору эстрогена. Однако в отличие от многих эстрогенов,многие из этих соединений не вызывают возрастания массы сырой ткани матки. При нахождении в матке эти соединения являются антиэстрогенами и могут полностью противодействовать трофическим воздействиям агонистов эстрогена на ткани матки. Вследствие избирательной по отношению к тканям природы этих соединений они применимы при лечении или предотвращении состояний или синдромов заболеваний у млекопитающих, которые вызываются или связаны с недостатком эстрогена (в определенных тканях, таких как кости или ткани сердечно-сосудистой системы) или с избытком эстрогена (в матке или молочных железах). Они могут также использоваться в методах лечения заболеваний или расстройств, которые являются результатом пролиферации или патологического развития, деятельности или роста эндометриальных или подобных эндометриальным тканей. Представленные соединения обладают способностью вести себя подобно агонистам эстрогена, снижая уровень холестерина и предотвращая потерю костной ткани. Эти соединения применимы для лечения многих заболева 001448 12 ний, которые вызываются воздействием эстрогена или избытком либо недостатком эстрогена,включая остеопороз, гипертрофию простаты,облысение у мужчин, вагинальную атрофию и атрофию кожи, угри, дисфункциональное маточное кровотечение, эндометриальные полипы,доброкачественное заболевание молочной железы, лейомиомы матки, аденомиоз, рак яичника,бесплодие, рак молочной железы, эндометриоз,рак эндометрия, синдром поликистоза яичников, сердечно-сосудистые заболевания, контрацепцию, болезнь Альцгеймера, прогрессирующее ухудшение мышления и другие расстройства центральной нервной системы (ЦНС), а также определенные виды рака, включая, в числе прочих, меланому, рак простаты, разновидности рака прямой кишки, разновидности рака ЦНС. Кроме того, эти соединения могут использоваться для контрацепции у женщин, находящихся в предклимактерическом периоде, и гормонозамещающей терапии у женщин в постклимактерическом периоде, или в случае других состояний, связанных с недостатком эстрогена, когда может быть полезной добавка эстрогена в организм. Они могут также применяться при состояниях заболевания, когда полезной является аменоррея, таких как лейкемия, удаление эндометрия, хроническое заболевание почек или печени либо заболевания или расстройства,связанные со свертываемостью. Соединения согласно настоящему изобретению могут также применяться в методах лечения и предотвращения разрежения кости, которое может являться результатом дисбаланса у данного индивида между образованием новых костных тканей и рассасыванием более старых тканей, что ведет к сеточному разрежению кости. Такое истощение кости наступает у ряда индивидуумов, в частности, у женщин в постклимактерическом периоде, женщин, подвергшихся двусторонней овариэктомии, пациентов, которые подвергаются, или которые были подвергнуты различным видам расширенной кортикостероидной терапии, пациентов, испытывающих гонадную дисгенезию, и пациентов,страдающих от синдрома Кушинга. Использование этих соединений может также относиться к случаям специальной необходимости в восстановлении костей, включая зубы и ротовые кости, у пациентов с переломами костей, нарушенной структурой костей, и пациентов, подвергшихся хирургическому лечению, относящемуся к костям, и/или имплантации протезов. В дополнение к тем проблемам, которые описаны выше, эти соединения могут использоваться при лечении остеоартрита, гипокальциемии,гиперкальциемии, болезни Педжета, остеомаляции (размягчения костей), множественной миеломы и других форм рака, оказывающих разрушительное влияние на ткани кости. Понятно,что способы лечения перечисленных здесь заболеваний включают введение пациенту, кото 13 рый требует такого лечения, фармацевтически эффективного количества одного или нескольких соединений согласно настоящему изобретению или его фармацевтически приемлемой соли. Настоящее изобретение включает также фармацевтические композиции, в которых используется одно илинесколько из представленных соединений и/или их фармацевтически приемлемых солей, наряду с одним или несколькими фармацевтически приемлемыми носителями, эксципиентами и т.п. Понятно, что дозировка, режим и способ введения этих соединений будут изменяться в соответствии с заболеванием и с индивидуумом,который подвергается лечению, и будут устанавливаться занимающимся этим вопросом практикующим врачом. Предпочтительным является, чтобы введение одного или нескольких из приведенных здесь соединений начиналось с низкой дозы и повышалось до тех пор, пока не будут достигнуты желаемые эффекты. Эффективное введение этих соединений может быть осуществлено в дозе, составляющей от около 0,1 до около 1000 мг/день. Предпочтительно введение будет составлять от около 10 до около 600 мг/день, более предпочтительно от около 50 до около 600 мг/день в виде разовой дозы или разделенное на две или большее число доз. Такие дозы могут вводиться любым способом, пригодным для того, чтобы направить описываемые здесь активные соединения в кровоток реципиента, включая пероральное, при помощи имплантатов, парентеральное (включая внутривенные, внутрибрюшинные и подкожные инъекции), ректальное, вагинальное и чрескожное введение. Следует понимать, что для целей настоящего описания понятие "чрескожное введение" включает любые способы введения через поверхность тела и внутренние покровы, включая эпителиальные и слизистые ткани. Введение такими способами можно проводить с использованием настоящих соединений или их фармацевтически приемлемых солей, находящихся в лосьонах, кремах, пенах, пластырях, суспензиях,растворах и суппозиториях (ректальных и вагинальных). Составы для перорального введения, содержащие активные соединения согласно настоящему изобретению, могут содержать любые традиционно используемые пероральные формы, включая таблетки, капсулы, трансбуккальные формы, пастилки, лепешки и пероральные жидкости, суспензии или растворы. Капсулы могут содержать смеси активного соединения(соединений) с инертными наполнителями и/или разбавителями, такими как фармацевтически приемлемые крахмалы (например, кукурузный, картофельный крахмал, или тапиока),сахара, искусственные подсластители, порошкообразные целлюлозы, такие как кристаллические и микрокристаллические целлюлозы, различные виды муки, желатины, камеди и т.п. 14 Пригодные составы в виде таблеток могут быть изготовлены стандартными способами спрессовывания, влажного гранулирования или сухого гранулирования, и в них могут использоваться фармацевтически приемлемые разбавители, связующие агенты, смазывающие вещества, разрыхлители, суспендирующие агенты или стабилизаторы, включая, но не ограничиваясь указанными веществами, стеарат магния, стеариновую кислоту, тальк, лаурилсульфат натрия,микрокристаллическую целлюлозу, кальциевую соль карбоксиметилцеллюлозы, поливинилпирролидон, желатин, альгиновую кислоту, аравийскую камедь, ксантановую камедь, цитрат натрия, сложные силикаты, карбонат кальция,глицин, декстрин, сахарозу, сорбит, дикальцийфосфат, сульфат кальция, лактозу, каолин, маннит, хлорид натрия, тальк, безводные крахмалы и порошкообразный сахар. В описываемых здесь пероральных составах могут использоваться стандартные технологии, обеспечивающие задержку высвобождения или высвобождение в определенное время, чтобы изменить поглощение активного соединения (соединений). Составы для введения в виде суппозиториев могут быть изготовлены из традиционных веществ, включая масло какао, с добавлением или без добавления восков, чтобы изменить температуру плавления суппозиториев, и глицерина. Могут также использоваться растворимые в воде основы для суппозиториев, такие как полиэтиленгликоли различной молекулярной массы. В описываемых здесь реакциях, могут использоваться безводные растворители AldrichSure Seal, используемые без дополнительной очистки, которые произведены фирмой AldrichChemical Company. Все реакции проводились в атмосфере азота. Хроматографию выполняли с использованием силикагеля с размером зерна 230-400 меш (Merck Grade 60, Aldrich ChemicalCompany). Тонкослойную хроматографию выполняли на пластинках Silica Gel 60F254 производства ЕМ Science. Спектры 1 Н ЯМР получали на приборе Bruker АМ-400 или Bruker DPX-300 в ДМСО, и химические сдвиги даны в млн-1. Температуры плавления определяли на приборе Томаса-Хувера (Thomas-Hoover apparatus), и они являются нескорректированными. ИКспектры записывали на спектрофотометреPerkin-Elmer с дифракционной решеткой или на спектрофотометре Perkin-Elmer 784. Массспектры записывали на масс-спектрометре Kratos MS или на масс-спектрометре 50 Finnigan 8230. Элементные анализы выполняли на элементном анализаторе Perkin-Elmer 2400. Данные элементного анализа, которые сообщаются для соединений, находятся в пределах отклонения в 0,4% от теоретического значения, полученного для данной формулы, если не указано иначе. Номенклатуру соединений обычно получали путем использования программы Beilstein Синтез -бромкетонов Способ а Синтез -бромкетонов легко осуществляется просто путем растворения исходного фенилкетона в этиловом эфире (0,05-0,10 М) и добавления по каплям при комнатной температуре 1,1 эквивалента брома. Реакцию можно контролировать при помощи тонкослойной хроматографии по расходу исходных веществ. Реакционную смесь обрабатывают промыванием водным раствором бикарбоната натрия, а затем 10% водным раствором сульфита натрия. Эфирный слой промывают насыщенным раствором соли и сушат над сульфатом натрия. Упаривание реакционной смеси обычно дает бромкетоны с хорошим выходом и чистотой. Бромкетоны брали как они есть (без очистки или получения их характеристик) для следующей стадии. 3-Meтилиндолы Схема 8 Способ 1. Иллюстрируется примером 7. 5-Бензилокси-2-(4-бензилоксифенил)-3 метил-1 Н-индол. Колбу заполняли солянокислым 4 бензилоксианилином САS No. [51145-58-5](45 г, 0,23 моль), 4'-бензилокси-2-бромфенил 16 пропиофеноном CAS No. [66414-19-5] (21 г,0,066 моль) и 50 мл ДМФА. Реакционную смесь нагревали с обратным холодильником в течение 30 мин, после чего охлаждали до комнатной температуры, а затем проводили распределение между 250 мл этилацетата (EtOAc) и 100 мл 1 н НСl (водн.). EtOAc промывали NaHCO3 (водн.) и насыщенным раствором соли, затем сушили над MgSO4. Раствор упаривали и остаток поглощали СН 2 Сl2 и добавляли гексан для высаживания 25 г сырого твердого продукта. Твердую фазу растворяли в СН 2 Сl2 и выпаривали на силикагеле и хроматографировали с использованием смеси СН 2 Сl2/гексан (1:5) с получением 9,2 г светло-коричневого твердого продуктаMS EI m/z 419. Способ 2 (показан на схеме 8). Также иллюстрируется примером 7. Используемые реагенты были теми же, что и в способе 1, за исключением того, что в этом способе дополнительно использовался триэтиламин. Бромкетон CAS No. [66414-19-5] (50 г,0,16 моль) в 200 мл ДМФА обрабатывали солянокислым анилином CAS No. [51145-58-5] (44 г,0,22 моль) и реакционную смесь продували азотом в течение около 10 мин. Добавляли триэтиламин (54,6 мл) и реакционную смесь нагревали при 120 С в течение 2 ч. Анализ методом тонкослойной хроматографии (EtOAc/гексан) показал, что исходное вещество исчезло, образуя более полярное пятно. Реакционной смеси давали остыть и добавляли дополнительно 48 г солянокислого анилина. Реакционную смесь нагревали до 150 С в течение 2 ч. Добавляли дополнительно 5 г солянокислого анилина и реакционную смесь нагревали при 150 С дополнительно в течение 30 мин. Реакционной смеси давали остыть до комнатной температуры и затем выливали ее в приблизительно 1,5 л воды и экстрагировали 2 л этилацетата. Твердую фазу при необходимости растворяли в дополнительном количестве этилацетата. Слой этилацетата промывали 1 л 1 н водного раствора NaOH, 1 л воды, насыщенным раствором соли, затем сушили над сульфатом магния и фильтровали. Органические слои упаривали с получением сырого твердого продукта, который перемешивали с 500 мл метанола и фильтровали. Полученный твердый продукт затем перемешивали с 500 мл этилового эфира и фильтровали. В другом варианте твердый продукт перемешивали с метанолом и эфиром до тех пор, пока он не становится белесого цвета, и его температура плавления не становилась аналогичной таковой, как описано для 7 в способе 1. Выход реакции составлял 36 г продукта. Физические характеристики для индолов. Следующие 3-метилиндолы ( 1-20) были синтезированы согласно методике, описанной в общих чертах на схеме 2, с использованием метода 2 при применении соответствующим образом замещенных бромкетонов (полученных как описано выше) и анилинов (производимых промышленно; фирма Aldrich) в качестве исходных веществ. Пример 1. 2-Фенил-3-метил-1 Н-индол. Т.пл.=90-94 С; 1 Н ЯМР (ДМСО) 11,13 (с,1 Н), 7,68-7,64 (м, 2 Н), 7,54-7,46 (м, 3 Н), 7,377,32 (м, 2 Н), 7,12-7,06 (м, 1 Н), 7,03-6,97 (м, 1 Н),2,40 (с, 3 Н); MS eI m/z 207 (М+). Пример 1a. 5-Фтор-2-(4-бензилоксифенил)-3-метил-1 Н-индол. Т.пл.=143-146 С. Пример 2. 2-(4-Бензилоксифенил)-3 метил-1 Н-индол. Т.пл.=118-120 С; 1 Н ЯМР (ДМСО) 11,03(с, 1 Н), 7,77-7,74 (дд, 2 Н, 1,8 Гц, J=5,0 Гц), 7,507,48 (д, 4 Н, J=8,3 Гц), 7,42-7,25 (м, 4 Н), 7,147,13 (д, 1 Н, J=2,2 Гц), 6,87-6,83 (дд, 1 Н, J=2,3 Гц, J=6,3 Гц), 5,13 (с, 2 Н), 2,37 (с, 3 Н); ИК (КВr) 3360, 1600 см-1; MS EI m/z 396 (М+); CHN рассчитан для C23H18F3NO2. Этиловые зфиры 3-метилиндольных производных уксусной кислоты Схема 9 Экспериментальная методика синтеза этиловых эфиров 3-метилиндольных производных уксусной кислоты Способ 3. Иллюстрируется примером 26. Этиловый эфир 4-[5-бензилокси-2-(4 бензилоксифенил)-3-метилиндол-1-илметил] феноксиуксусной кислоты. Раствор 5-бензилокси-2-(4-бензилоксифенил)-3-метил-1 Н-индола (индол из примера 7) (32 г, 77 ммоль) в ДМФА (0,15 л) охлаждали до 0 С и обрабатывали гидридом натрия (2,2 г,89 ммоль). Реакционную смесь перемешивали в течение 20 мин и затем добавляли бензилхлоридCAS No. [80494-75-3] (29 г, 127 ммоль) и реакционную смесь перемешивали в течение 18 ч при комнатной температуре. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Этилацетат промывали насыщенным раствором соли и сушили над сульфатом магния. Этилацетат упаривали и растирали с эфиром с получением 21 г белого твердого вещества. Фильтрат упаривали и растирали с эфиром с получением дополнительно 7 г белого твердого вещества с общим выходом 28 г: Т.пл.=129131 С; 1 Н ЯМР (ДМСО) 7,47 (д, 4 Н, J=7,2 Гц),7,39 (кв, 4H, J=7, 9 Гц), 7,36-7,32 (м, 1 Н), 7,29 (д,2 Н, J=8,8 Гц), 7,19 (д, 1 Н, J=9,0 Гц), 7,13-7,09(м, 4 Н), 6,80 (дд, 1 Н, J=8,8, 2,4 Гц), 6,73 (с, 4 Н),5,16 (с, 2 Н), 5,13 (с, 2 Н), 5,11 (с, 2 Н), 4,66 (с,2 Н), 4,11 (кв, 2H, J=7,2 Гц), 2,15 (с, 3 Н), 1,16 (т,3 Н, J=7,2 Гц); MS EI m/z 612. Физические характеристики этиловых эфиров производных индола. Следующие продукты алкилирования индолов были получены согласно схеме 9 с использованием способа 3 при применении соответствующим образом замещенных 3 метилиндолов, выбранных из ( 1-16), в качестве исходных веществ. Пример 21. Этиловый эфир 4-[2 фенил-3-метилиндол-1-илметил]фенокси уксусной кислоты. Масло; 1 Н ЯМР (ДМСО) 7,57-7,30 (м, 7 Н),7,13-7,02 (м, 2 Н), 6,77-6,70 (м, 4 Н), 5,22 (с, 2 Н),4,65 (с, 2 Н), 4,09 (кв, 2H, J=7,2 Гц), 2,20 (с, 3 Н),1,15 (т, 3 Н, J=7,0 Гц); MS EI m/z 399 (М+). Пример 22. Этиловый эфир 4-[5 бензилокси-2-фенил-3-метилиндол-1-илметил] феноксиуксусной кислоты. Экспериментальная методика синтеза 3 метилиндол-фенетанолов Способ 4. Иллюстрируется примером 38. 2-4-[5-Бензилокси-2-(4-бензилоксифенил)-3-метилиндол-1-илметил]феноксиэтанол. Раствор 26 с предыдущей стадии (5,5 г,8,8 ммоль) в ТГФ (50 мл) охлаждали до 0 С и по каплям добавляли раствор LiAlH4 (10 мл, 1 М) в ТГФ. Через 30 мин выдерживания при 0 С реакционную смесь тщательно гасили водой и распределяли между EtOAc и 1 н НСl. EtOAc сушили при помощи MgSO4, упаривали и хроматографировали на силикагеле смесьюEtOAc/гексан (2:3) с получением 4,0 г 38 в виде белой пены: 1 Н ЯМР (ДМСО) 7,48-7,46 (м,4 Н), 7,42-7,27 (м, 8 Н), 7,20 (д, 1 Н, J=8,8 Гц),7,12-7,10 (м, 3 Н), 6,80 (дд, 1 Н, J=8,8, 2,4 Гц),6,73 (с, 4 Н), 5,15 (с, 2 Н), 5,13 (с, 2 Н), 5,11 (с,2 Н), 4,80 (т, 1 Н, J=5,5 Гц), 3,86 (т, 2 Н, J=4,8 Гц),3,63 (кв, 2H, J=5,3 Гц), 2,15 (с, 3 Н). Физические характеристики индольных производных фенетанолов. Следующие соединения были получены согласно схеме 10 и способу 4 при применении этиловых зфиров соответствующим образом Экспериментальная методика синтеза 3 метилиндолфенетилбромида Способ 5. Иллюстрируется примером 50. Пример 50. 5-Бензилокси-2-(4-бензилоксифенил)-1-[4-(2-бромэтокси)бензил]-3 метил-1 Н-индол. К раствору соединения из примера 38(2,9 г, 8,7 ммоль) и РРН 3 (2,3 г, 8,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, а затем упаривали и хроматографировали на силикагеле, применяя градиентное элюирование смесью EtOAc/гексан состава от 1:4 до чистого EtOAc с получением 3,2 г белого твердого вещества: Т.пл.=131134 С; 1 Н ЯМР (ДМСО) 7,64-7,30 (м, 10 Н), 7,29(т, 2 Н, J=5,3 Гц), 3,73 (т, 2 Н, J=5,5 Гц), 2,15 (с,3 Н); MS FAB 631/633 (М+Н+, присутствует Вr). Физические характеристики индолфенетилбромидов. Следующие соединения были получены согласно схеме 11, как описано в способе 5, при применении соответствующим образом замещенных производных индола, выбранных из 35-45. Пример 47. 1-[4-(2-Бромэтокси)бензил]2-фенил-3-метил-1 Н-индол. Масло; 1 Н ЯМР (ДМСО) 7,57-7,32 (м, 7 Н),7,13-7,02 (м, 2 Н), 6,74 (с, 4 Н), 5,21 (с, 2 Н), 4,19(дд, 1 Н, J=8,8 Гц, J=2,5 Гц), 6,72 (м, 4 Н), 5,17 (с,2 Н), 5,11 (с, 2 Н), 4,19 (т, 2 Н, J=5,5 Гц), 3,72 (т,2 Н, J=5,5 Гц), 2,16 (с, 3 Н); MS EI m/z 559 (М+). Данные для некоторых 3-метилиндолфенилэтилхлоридов, используемых в качестве промежуточных соединений. Схема 12 29 Экспериментальная методика синтеза 3 метилиндол-фенетилхлорида Способ 5 а. Иллюстрируется примером 58. 5-Бензилокси-2-(3-бензилоксифенил)-1-[4(2-хлорэтокси)бензил]-3-метил-1 Н-индол. К раствору 9,7 г, (0,0231 моль) 5 бензилокси-3-метил-2-(3-бензилоксифенил)-1 Ниндола (индол из примера 17) в 80 мл безводного ДМФА добавляли 0,85 г гидрида натрия (60% в минеральном масле). После перемешивания этой смеси в течение 30 мин (до того времени, когда выделение пузырьков больше не наблюдалось) добавляли 4,8 г 1-хлорметил-4(2-хлорэтокси)бензола CAS No. [99847-87-7]. Реакционной смеси давали прореагировать при комнатной температуре в течение ночи. К реакционной смеси добавляли 200 мл этилацетата и затем промывали водой (3100 мл). Органический раствор собирали, промывали насыщенным раствором соли, удаляли, сушили над сульфатом магния, фильтровали и выпаривали досуха в роторном испарителе. Продукт перекристаллизовывали из этилацетата. Т.пл.=125127 С; 1 Н ЯМР (ДМСО) 7,48-7,46 (д, 2 Н, J=6,8 Гц), 7,40-7,35 (м, 7 Н), 7,33-7,28 (м, 2 Н), 7,237,21 (д, 1 Н, J=8,8 Гц), 7,13-7,12 (д, 1 Н, J=2,2 Гц),7,07-7,04 (м, 1 Н), 6,94-6,92 (д, 2 Н, J=6,l Гц),6,83-6,80 (дд, 1 Н, J=2,5 Гц, J=6,3 Гц), 6,78-6,72(м, 4 Н), 5,14 (с, 2 Н), 5,11 (с, 2 Н), 5,04 (с, 2 Н),4,13-4,10 (т, 2 Н, J=5,l Гц), 3,86-3,84 (т, 2 Н, J=5,1 Гц), 2,14 (с, 3 Н); MS EI 587 (М+); CHN рассчитан для C38H34ClNO3. Физические характеристики для индол фенетилхлоридов. Следующие соединения были получены согласно схеме 12, как описано в способе 5 а,при применении соответствующим образом замещенных производных индола 18,20. Пример 59. 5-Бензилокси-2-(4-бензилокси-3-фторфенил)-1-[4-(2-хлорэтокси)бензил]3-метил-1 Н-индол. Т.пл.=88-91 С; 1H ЯМР (ДМСО) 7,49-7,43 Экспериментальная методика синтеза 3 метиламиноэтоксииндола Способ 6. Иллюстрируется примером 63. Замещение бромида 5-Бензилокси-2-(4-бензилоксифенил)-3 метил-1-[4-(2-пиперидин-1-илэтокси)бензил]1 Н-индол. Раствор соединения из примера 50 (3,2 г, 5,0 ммоль) в ТГФ (50 мл) обрабатывали пиперидином (5,0 мл, 50 ммоль) и нагревали с обратным холодильником. Через 5 ч реакционную смесь упаривали и поглощали EtOAc, промывали насыщенным NаНСО 3, сушили над MgSO4 и проводили колоночную хроматографию на силикагеле, применяя градиентное элюирование с изменением от смеси EtOAc/гексан до чистогоEtOAc. Продукт (2,7 г) представлял собой белое твердое вещество с Т.пл.=93-95 С; 1 Н ЯМР(м, 4 Н), 1,36-1,32 (м, 2 Н); MS FAB 637 (M+H+). Альтернативная методика Способ 6 а. Замещение хлоридов. Иллюстрируется примером 76. Пример 3258) в 10 мл ДМФА добавляли 1,1 мл (0,0112 моль) пиперидина и 0,93 г (0,0561 моль) йодистого калия. Реакционную смесь нагревали до 40-50 С в течение 4 ч. После охлаждения реакционной смеси до комнатной температуры добавляли 150 мл этилацетата и смесь промывали водой (3100 мл). Органический раствор собирали, промывали насыщенным раствором соли, удаляли, сушили над сульфатом магния,фильтровали и выпаривали с получением 1,0 г продукта после его очистки. Т.пл.=125-126 С; 1 Н ЯМР (ДМСО) 7,487,45 (д, 2 Н, J=7,2 Гц), 7,41-7,35 (м, 7 Н), 7,337,28 (м, 2 Н), 7,23-7,21 (д, 1 Н, J=9,0 Гц), 7,137,12 (д, 1 Н, J=2,4 Гц), 7,06-7,03 (м, 1 Н), 6,956,91 (м, 2 Н), 6,83-6,80 (дд, 1 Н, J=2,4 Гц, J=6,3 Гц), 6,75-6,70 (м, 4 Н), 5,13 (с, 2 Н), 5,11 (с, 2 Н),5,02 (с, 2 Н), 3,93-3,90 (т, 2 Н, J=6,0 Гц), 2,56-2,53(т, 2 Н, J=5, 9 Гц), 2,49-2,48 (м, 4 Н), 2,14 (с, 3 Н),1,46-1,40 (м, 4 Н), 1,35-1,31 (м, 2 Н); ИК (КВr) 3400, 2900 см-1; MS EI m/z 636 (М+); CHN рассчитан для С 43H44N2 О 3 + 0,25 Н 2O. Физические характеристики для аминозамещенных соединений. Следующие соединения бьши получены согласно схеме 13 с использованием способа 6,за исключением соединений 76-84, которые были получены с использованием способа 6 а. Пример(м, 4 Н), 5,15 (с, 2 Н), 5,13 (с, 2 Н), 5,11 (с, 2 Н),3,94 (т, 2 Н, J=5,9 Гц), 2,59 (т, 2 Н), 2,42 (м, 4 Н),2,29 (м, 4 Н), 2,15 (с, 3 Н), 2,12 (с, СН); MS EI m/z 652 (М+); CHN рассчитан для С 43 Н 45N3 О 3. Пример 84. 1-[4-(2-Азепан-1-илэтокси) бензил]-5-бензилокси-2-(3-метоксифенил)-3 метил-1 Н-индол. Т.пл.=103-105 С; 1 Н ЯМР (ДМСО) 7,477,45 (д, 2 Н, J=8,1 Гц), 7,41-7,35 (м, 7 Н), 7,327,29 (т, 2 Н, 7,0 Гц), 7,23-7,21 (д, 1 Н, J=8,7 Гц),7,13-7,12 (д, 1 Н, J=2,l Гц), 7,06-7,03 (м, 1 Н),6,95-6,91 (м, 2 Н), 6,83-6,80 (м, 1 Н), 6,75-6,73 (м,4 Н), 5,13 (с, 2 Н), 5,11 (с, 2 Н), 5,02 (с, 2 Н), 3,903,87 (т, 2 Н, J=6,0 Гц), 2,76-2,73 (т, 2 Н, J=6,0 Гц),2,49-2,48 (м, 4 Н), 2,13 (с, 3 Н), 1,51 (с, 8 Н); ИК 3400, 2900 см-1; MS EI m/z 650 (М+); CHN рассчитан для С 44 Н 46N2 О 3. Данные и методики для соединений из табл. 11 (таблица данных по испытанию с рецептором эстрогена дана ниже текста). 39 Гидрирование индолов, содержащих бензиловый эфир (зфиры) Способ 7. Иллюстрируется примером 97. 2-(4-Гидроксифенил)-3-метил-1-[4-(2 пиперидин-1-илэтокси)бензил]-1 Н-индол-5-ол. Суспензию 10% Pd/C (1,1 г) в EtOH обрабатывали раствором соединения 63 (2,2 г, 3,4 ммоль) в смеси ТГФ/EtOH. Добавляли циклогексадиен (6,0 мл, 63 ммоль) и реакционную смесь перемешивали в течение 48 ч. Катализатор отфильтровывали на Целите и реакционную смесь упаривали и хроматографировали на силикагеле, применяя градиентное элюирование смесью МеОН/СН 2 Сl2 (от 1:19 до 1:10) с получением 0,8 г продукта в виде белого твердого вещества. Т.пл.=109-113 С; СНN рассчитан для(с, 1 Н), 7,14 (д, 2 Н, J=8,6 Гц) 7,05 (д, 1 Н, J=8,6 Гц), 6,84 (д, 2 Н, J=8,8 Гц), 6,79 (д, 1 Н, J=2,2 Гц),6,74 (с, 4 Н), 6,56 (дд, 1 Н, J=8,8, 2,4 Гц), 5,09 (с,2 Н), 3,95-3,93 (м, 2 Н), 2,60-2,51 (м, 2 Н), 2,392,38 (м, 4 Н) , 2,09 (с, 3 Н), 1,46-1,45 (м, 4 Н), 1,351,34 (м, 2 Н); ИК 3350 (ушир.), 2920, 1620, 1510 см-1; MS (EI) m/z 456. В альтернативном варианте соединения можно растворять в растворе ТГФ/EtOH (или в других подходящих растворителях) и гидрировать при помощи Н 2 и 10% Pd/C, используя либо баллон, либо гидрогенизатор Парра. Обе методики являются эффективными. Во многих примерах соединения были получены в виде кислотно-аддитивных солей. Методика получения соли с НСl дана ниже (способ 8). Способ 8. 1,0 г соединения из примера 97 в виде свободного основания после процесса гидрирования, описанного выше, в большой пробирке растворяли в 20 мл МеОН. Этот раствор обрабатывали медленным добавлением 2,6 мл 1,0 н НСl и затем 4,0 мл деионизированной воды. Пробирка была частично открыта в атмосферу, чтобы поддерживать медленное испарение растворителей. Приблизительно через 10 мин начинали появляться кристаллы, и через 4 ч раствор фильтровали и твердые кристаллы промывали водой. Продукт представлял собой 0,42 г белых кристаллических пластинок с температурой плавления 184-185 С. Маточная жидкость дала дополнительно 0,30 г белого твердого вещества с температурой плавления 177-182 С. CHN рассчитан для С 29 Н 32N2 О 3 + НСl + 1 Н 2O. В альтернативном варианте соединения могут быть получены в виде четвертичных солей аммония. Ниже дана в качестве образца методика синтеза соединения 107 (способ 9). Способ 9. Пример 107. 2-(4-Гидроксифенил)-3 метил-1-[4-(2-пиперидин-1-илэтокси)бензил]1 Н-индол-5-ол метиодид. 0,8 г соединения из примера 97 растворяли в 18 мл ТГФ и обрабатывали 2 мл ме 001448 40 тилйодида. Раствор нагревали с обратным холодильником в течение часа. Реакционной смеси давали дойти до комнатной температуры и твердую фазу отфильтровывали с получением 0,72 г кристаллического твердого вещества. Т.пл.=214-217 С,CHN рассчитан для С 29 Н 32N2 О 3 + СН 3I + 0,5 Н 2 О. Пример 106. 1-[4-(2-Диметиламиноэтокси)бензил]-2-(4-гидроксифенил)-3-метил 1 Н-индол-5-ол метиодид получали подобно 107, за исключением того, что в качестве исходного вещества использовали 100: Т.пл.=245250 С; 1 Н ЯМР (ДМСО) 9,66 (с, 1 Н), 8,69 (с,1 Н), 7,16 (д, 2 Н, J=8,4 Гц), 7,05 (д, 1 Н, J=8,8 Гц),6,84 (д, 1 Н, J=8,6 Гц), 6,81-6,75 (м, 6 Н), 6,56 (дд,1 Н, J=2,4 Гц, 8,7 Гц), 5,12 (с, 2 Н), 4,34 (м, 2 Н),3,70 (т, 2 Н, J=4,6 Гц), 3,11 (с, 9 Н), 2,09 (с, 3 Н); ИК (КВr) 3250, 1500, 1250; MS EI m/z 416 (М+);CHN рассчитан для C26H28N2 О 3 + 1,09 СН 3I + 0,8 Н 2 О. Физические характеристики конечных, незащищенных соединений. Следующие соединения являются либо свободными основаниями, либо солями, образуемыми с НСl, либо солями, образуемыми с уксусной кислотой (ацетатами). Они были получены согласно методике, описанной в способе 7, с использованием соответствующих простых бензиловых эфиров в качестве полупродуктов. В тех случаях, когда соединение из табл. 1 не содержит свободную фенольную функциональность, это значит, что не было необходимости его дебензилировать, и способ 7 не применяли. Ниже представлены физические характеристики для этих соединений ( 85,90-91). Пример 85. 4-3-Метил-1-[4-(2-пиперидин-1-ил-этокси)бензил]-lH-индол (НСl). Т.пл.=134-137 С; 1 Н ЯМР (ДМСО) 10,33 43 Пример 98. Уксуснокислая соль. Получена путем осаждения свободного основания 98 из ацетона и уксусной кислоты. Т.пл.=174-178 С. Пример 99. 1-[4-(2-(Азокан-1-илэтокси) бензил]-2-(4-гидроксифенил)-3-метил-1Hиндол-5-ол. Т.пл.=98-102 С; 1 Н ЯМР (ДМСО) 9,63 (с,1 Н), 8,68 (с, 1 Н), 7,15-7,13 (м, 2 Н), 7,05 (д, 1 Н,J=8,5 Гц), 6,83 (дд, 2 Н, J=2,0 Гц, 6,6 Гц), 6,79 (д,1 Н, J=2,2 Гц), 6,73 (с, 4 Н), 6,55 (дд, 1 Н, J=2,2 Гц,8,6 Гц), 5,08 (с, 2 Н), 3,89 (т, 2 Н, J=5,7 Гц), 2,74(63,0 г, 280,0 ммоль) в чистом этаноле (800 мл). Добавляли каталитическое количество уксусной кислоты (5 капель). Реакционную смесь нагре 50 вали с обратным холодильником в течение 2,5 ч. В процессе нагревания с обратным холодильником из горячего раствора выкристаллизовывался конденсированный продукт. Реакционную смесь охлаждали до комнатной температуры. Желаемый продукт собирали при помощи вакуумной фильтрации в виде светло-желтого твердого вещества (85 г, 86%). Т.пл.=165-174 С; 1 Н ЯМР (ДМСО) 8,91 (с, 1 Н), 7,68 (д, 2 Н, J=8,8 Гц),7,48-7,32 (м, 10 Н), 7,12 (д, 2 Н, J=9 Гц), 7,00 (д,2 Н, J=8,8 Гц), 6,88 (д, 2 Н, J=9,0 Гц), 5,11 (с, 2 Н),5,01 (с, 2 Н), 2,17 (с, 3 Н); MS EI m/z 422 (М+). Пример 141. Получение индола из гидразона. 5-Бензилокси-2-(4-бензилоксифенил)-1 Ниндол. Колбу заполняли N-(4-бензилоксифенил)N'-[1-(4-бензилоксифенил)этилиден]гидразином( 140) (10,0 г, 23,7 ммоль), ZnCl2 (8,06 г, 59,17 ммоль), уксусной кислотой (70 мл). Реакционную колбу нагревали до 105 С в течение не более чем 20 мин. В продолжение периода нагревания реакционную смесь тщательно контролировали при помощи тонкослойной хроматографии на исчезновение исходного вещества. Протекание реакции можно было наблюдать по тому, как во время нагревания из раствора выкристаллизовывался продукт. Затем реакционную смесь охлаждали до комнатной температуры и наблюдали выпадение дополнительного количества продукта. Содержимое реакционной колбы выливали в делительную воронку, содержащую эфир (100 мл) и Н 2 О (200 мл), которую энергично встряхивали. Нерастворимый остаток, представлявший собой желаемый продукт, оставался в эфирном слое, и его собирали при помощи вакуумной фильтрации. Затем продукт очищали путем растирания в эфире с получением светлосерого твердого вещества (4,4 г, 46%). Т.пл.=202-204 С; 1 Н ЯМР (ДМСО) 11,24 (с, 1 Н),7,73 (д, 2 Н, J=8,8 Гц), 7,48-7,41 (м, 4 Н), 7,457,27 (м, 6 Н), 7,25 (д, 1 Н, J=8,6 Гц), 7,12-7,04 (м,3 Н), 6,77 (дд, 1 Н, J=2,4 Гц, 8,6 Гц), 6,65 (д, 1 Н,J=1,5 Гц), 5,14 (с, 2 Н), 5,08 (с, 2 Н); ИК 3420,3000, 1625 см-1; MS EI m/z 405 (М+); CHN рассчитан для С 28 Н 23NO2 + 0,40 Н 2 О. Пример 142. Хлорирование индола с целью получения 5-бензилокси-3-хлор-2-(4 бензилоксифенил)-1 Н-индола. Колбу заполняли 5-бензилокси-2-(4 бензилоксифенил)-1 Н-индолом 141 (8,0 г,20,0 ммоль) и СН 2 Сl2 (50 мл). Реакционную смесь охлаждали до 0 С, добавляли нхлорсукцинимид (2,9 г, 22 ммоль). Реакционную смесь перемешивали при 0 С в течение 20 мин. Затем реакционную смесь промывали 10% раствором сульфита натрия, сушили над MgSО 4 и упаривали. К образовавшейся коричневой твердой фазе добавляли МеОН и смесь перемешивали в течение 15 мин. Твердую фазу отфильтровывали с получением 6,8 г светло-коричневого твердого вещества (78%). Т.пл.=157-160 С; 1 Н 51 ЯМР (ДМСО) 11,5 (с, 1 Н), 7,80 (д, 2 Н, J=7,0 Гц),7,42-7,28 (м, 11 Н), 7,17 (д, 2 Н, J=8,7 Гц), 7,01 (д,1 Н, J=2,2 Гц), 6,88 (дд, 1 Н, J=8,8 Гц, J= 2,4 Гц),5,17 (с, 2 Н), 5,13 (с, 2 Н); MS EI m/z 439 (М+). Пример 143. 5-Бензилокси-3-хлор-2-(2 метил-4-бензилоксифенил)-1H-индол. Этот индол синтезировали аналогично индолу 142 из непосредственно предшествующего примера: 1H ЯМР (ДМСО) 11,34 (с, 1 Н),7,48-7,44 (м, 4 Н), 7,42-7,24 (м, 8 Н), 7,02 (дд, 2 Н,J=9,3 Гц, J=2,4 Гц), 6,95 (дд, 1 Н, J=8,4 Гц, J=2,6 Гц), 6,88 (дд, 1 Н, J=8,8 Гц, J=2,4 Гц), 5,16 (с,2 Н), 5,14 (с, 2 Н), 2,23 (с, 3 Н); MS EI m/z 453(М+). Пример 144. Алкилирование индола с получением этилового эфира 4-[5-бензилокси 2-(4-бензилоксифенил)-3-хлориндол-1-илметил] феноксиуксусной кислоты. Эту реакцию проводили аналогично реакции, описанной для синтеза этиловых эфиров 3 метилиндол-производных уксусной кислоты,описанных в способе 3. Т.пл.=90-94 С; 1 Н ЯМР (ДМСО) 7,45 (д,4 Н, J=7,8 Гц), 7,41-7,26 (м, 9 Н), 7,14 (д, 2 Н,J=8,7 Гц), 7,04 (д, 1 Н, J=2,4 Гц), 6,91 (дд, 1 Н,J=9,0 Гц, J=2,5 Гц), 6,80-6,74 (м, 4 Н), 5,24 (с,2 Н), 5,15 (с, 2 Н), 5,14 (с, 2 Н), 4,66 (с, 2 Н), 4,12m/z 631 (М+). Пример 145. Восстановление 144 с получением 2-4-[5-бензилокси-2-(4-бензилоксифенил)-3-хлориндол-1-илметил]фенокси этанола. Эту реакцию проводили аналогично реакции, описанной для синтеза 3-метилиндолов,описанных в способе 4. Соединения не очищали и их характеристики не определяли, а использовали их в том виде, как они получены, для следующей стадии. Пример 146. Бромирование 145 с получением бензилокси-2-(4-бензилоксифенил)-1[4-(2-бромэтокси)бензил]-3-хлор-1 Н-индола. Эту реакцию проводили аналогично реакции, описанной для синтеза 3-метилиндолов,описанных в способе 5. Т.пл.=155-158 С; 1 Н ЯМР (ДМСО) 7,45 (д, 4 Н, J=7,8 Гц), 7,41-7,25m/z 651 (М+). Пример 147. Замещение 146 пиперидином с получением 5-бензилокси-2-(4 бензилоксифенил)-3-хлор-1-[4-(2-пиперидин-1 илэтокси)бензил]-1 Н-индола. Эту реакцию проводили аналогично реакции, описанной для синтеза 3-метилиндолов,описанных в способе 6, используя пиперидин для замещения бромида. Т.пл.=96-98 С; 1 Н ЯМР (ДМСО) 7,45 (д,4 Н, J=7,8 Гц), 7,40-7,30 (м, 9 Н), 7,14 (д, 2 Н,J=8,7 Гц), 7,04 (д, 1 Н, J=2,4 Гц), 6,91 (дд, 1 Н, 001448(м, 4 Н), 1,38-1,31 (м, 2 Н). Пример 148. 5-Бензилокси-2-(4-бензилоксифенил)-3-хлор-1-[4-(2-азепан-1-илэтокси) бензил]-1 Н-индол. Реакцию проводили таким же образом, как указано выше, за исключением того, что в качестве замещающего амина использовали гексаметиленамин. Т.пл.=94-97 С; 1 Н ЯМР (ДМСО) 7,45 (д,4 Н, J=7,8 Гц), 7,42-7,30 (м, 9 Н), 7,14 (д, 2 Н,J=8,7 Гц), 7,04 (д, 1 Н, J=2,4 Гц), 6,91 (дд, 1 Н,J=9,0 Гц, J=2,5 Гц), 6,74 (с, 4 Н), 5,24 (с, 2 Н),5,15 (с, 2 Н), 5,14 (с, 2 Н), 3,93 (т, 2 Н, J=6,0 Гц),2,75 (т, 2 Н, J=6,0 Гц), 2,63-2,59 (м, 4 Н), 1,58-1,44(м, 8 Н); MS EI m/z 671 (М+). Пример 149. 5-Бензилокси-2-(2-метил 4-бензилоксифенил)-3-хлор-1-[4-(2-пиперидин 1-илэтокси)бензил]-1 Н-индол. Реакции для получения этого соединения аналогичны таковым, используемым для получения 147. Масло; 1 Н ЯМР (ДМСО) 7,50-7,29 (м,11 Н), 7,17 (д, 1 Н, J=8,4 Гц), 7,05 (д, 1 Н, J=2,4 Гц), 7,02 (д, 1 Н, J=2,4 Гц), 6,93-6,85 (м, 2 Н),6,75-6,65 (м, 4 Н), 5,14 (с, 2 Н), 5,13 (с, 2 Н), 5,07(м, 2 Н), 3,92 (т, 2 Н, J=5,9 Гц), 2,55 (т, 2 Н, J=5,9 Гц), 2,42-2,29 (м, 4 Н), 1,94 (с, 3 Н), 1,44-1,40 (м,4 Н), 1,38-1,34 (м, 2 Н). Пример 133. 3-Хлор-2-(4-гидрооксифенил)-1-[4-(2-пирролидин-1-илэтокси)бензил]1 Н-индол-5-ол (НСl). Синтезирован, как описано для примера 134. Т.пл.=233-235 С; 1H ЯМР (ДМСО) 10,50(с, 1 Н), 9,88 (с, 1 Н), 9,01 (с, 1 Н), 7,80-7,20 (м,3 Н), 6,90-6,80 (м, 7 Н), 6,68 (дд, 1 Н, J=2,4 Гц, 8,8 Гц), 5,20 (с, 2 Н), 4,22 (т, 2 Н, J=4,8 Гц), 3,47 (т,2 Н, J=4,8 Гц), 3,10 (ушир. м, 4 Н), 1,90 (с, 4 Н); ИК (КВr) 3400, 1625, 1475, 825 см-1; MS EI m/z 462 (М+); CHN рассчитан для С 27 Н 27 СlN2 О 3 + 1 НСl + 0,75 Н 2 О. Пример 134. Удаление образующего простой эфир бензила с получением 3-хлор-2(4-гидроксифенил)-1-[4-(2-пиперидин-1 илэтокси)бензил]-1 Н-индол-5-ола (НСl). Образующую простой эфир бензильную группу удаляли аналогично тому, как описано в методике для 3-метилиндолов, описанных в способе 7. Затем это соединение преобразовывали в солянокислую соль, как описано ранее в методе 8; Т.пл.=207-209 С; 1 Н ЯМР (ДМСО) 10,10 (ушир. с, 1 Н), 9,86 (с, 1 Н), 9,07 (с, 1 Н),7,26 (д, 2 Н, J=8,6 Гц), 7,22 (д, 1 Н, J=8,8 Гц), 6,87 53 Пример 135. 3-Хлор-2-(4-гидроксифенил)-1-[4-(2-азепан-1-илэтокси)бензил]-1 Ниндол-5-ол (НСl). Синтезирован, как описано для примера 134. Т.пл.=196-198 С; 1 Н ЯМР (ДМСО) 10,10(ушир. с, 1 Н), 9,86 (с, 1 Н), 9,07 (с, 1 Н), 7,26 (д,2 Н, J=8,8 Гц), 7,22 (д, 1 Н, J=9,0 Гц), 6,87 (д, 2 Н,J=8,6 Гц), 6,84-6,78 (м, 5 Н), 6,65 (дд, 1 Н, J=8,8 Гц, J=2,2 Гц), 5,20 (с, 2 Н), 4,27 (т, 2 Н, J=5,0 Гц),3,45-3,30 (м, 4 Н), 3,21-3,10 (м, 2 Н), 1,82-1,76 (м,4 Н), 1,65-1,46 (м, 4 Н); MS EI m/z 491 (М+); CHN рассчитан для С 29 Н 31 СlN2 О 3 + 1 НСl + 0,37 Н 2 О; ИК (КВr) 3400, 3200, 1450, 1125. Пример 136. 3-Хлор-2-(4-гидроокси-2 метилфенил)-1-[4-(2-пиперидин-1-илэтокси) бензил]-1 Н-индол-5-ол. Синтезирован, как описано для примера 134, за исключением того, что соединение не преобразовывали в соль. Пена; 1 Н ЯМР (ДМСО) 9,64 (с, 1 Н), 9,01 (с,1 Н), 7,25 (д, 1 Н, J=8,8 Гц), 7,03 (д, 1 Н, J=8,1 Гц),6,79 (д, 1 Н, J=2,4 Гц), 6,78-6,65 (м, 7 Н), 5,064,92 (м, 2 Н), 3,94 (т, 2 Н, J=5,9 Гц), 2,62-2,57 (м,2 Н), 2,42-2,32 (м, 4 Н), 3,90 (с, 3 Н), 1,48-1,40 (м,4 Н), 1,40-1,32 (м, 2 Н); MS EI m/z 490 (М+); ИК(КВr) 3430, 2900, 1450 см-1; CHN рассчитан для С 29 Н 31 СlN2 О 3 + 1,0 Н 2 О. Синтез 3-этилиндольного аналога 137 Это соединение синтезировали в точности аналогично примеру, данному выше для 3 метилиндолов, применяя способы а и 2-8. Единственное отличие состоит в том, что использовавшееся исходное вещество представляет собой 4'-(бензилокси)-бутирофенон CAS No.[26945-71-1] вместо 4'-(бензилокси)-пропиофенона. Характеристики промежуточных соединений следуют далее. Пример 150. 5-Бензилокси-2-(4-бензилоксифенил)-3-этил-1 Н-индол. Т.пл.=101-108 С; MS EI m/z 433 (М+). Пример 151. Этиловый эфир 4-[5 бензилокси-2-(4-бензилоксифенил)-3-этилиндол-1-илметил]феноксиуксусной кислоты. Т.пл.=72-75 С; MS EI m/z 625 (M+). Пример 152. 2-4-[5-Бензилокси-2-(4 бензилоксифенил)-3-этилиндол-1-илметил] феноксизтанол. Т.пл.=105-113 С; MS EI m/z 583 (М+). Пример 153. Бензилокси-2-(4-бензилоксифенил)-1-[4-(2-бромэтокси)бензил]-3-этил 1 Н-индол. Т.пл.=140 С (разлаг.); MS EI m/z 647,645 Пример 155. 5-Бензилокси-3-циано-2(4-бензилоксифенил)-1 Н-индол. В реакционной колбе смешивали 5 бензилокси-2-(4-бензилоксифенил)-lH-индол 141 (5,90 г, 14,6 ммоль) с СН 2 Сl2 (90 мл) и охлаждали до 0 С (исходное вещество не полностью растворялось в СН 2 Сl2). При энергичном перемешивании добавляли по каплям раствор хлорсульфонилизоцианата (2,26 г, 16,6 ммоль) в СН 2 Сl2 (25 мл) в течение 45 мин. Реакция протекала при 0 С в течение 2 ч до тех пор, пока тонкослойной хроматографией регистрировалось образование нерастворимого N-хлорсульфониламидного промежуточного продукта. После этого периода по каплям добавляли Et3N(1,47 г, 14,6 мл) в СН 2 Сl2 (25 мл) в течение 45 мин при 0 С. Нерастворимый остаток становился растворимым в реакционном растворителе по мере того, как завершалось добавление Et3N. Реакция дополнительно протекала в течение 1 ч при 0 С и в течение 2 ч при комнатной температуре. Протекание реакции можно было наблюдать по образованию нерастворимой твердой фазы продукта по мере того, как шло время реакции. Растворитель удаляли и твердый остаток 55 очищали путем растирания с метанолом получением (4,0 г, 63,8%). Т.пл.=238-242 С; 1 Н ЯМРMS EI m/z 430 (М+). Пример 156. 4-(2-Хлорэтокси)бензилбромид. К 4-(2-хлорэтокси)бензиловому спирту САS No. [111728-87-1] (6,4 г, 34,31 ммоль) в диоксане (100 мл) при 0 С медленно добавляли тионилбромид (7,13 г, 34,31 ммоль). Реакция протекала при 0 С в течение 5 мин. Реакционную смесь разбавляли эфиром (200 мл) и промывали Н 2 О (130 мл), затем NaHCО 3 (225 мл) и насыщенным раствором соли (30 мл). Органический экстракт сушили над MgSО 4 и упаривали. Неочищенный продукт очищали при помощи хроматографии на силикагеле (15%(д, 2 Н, J=8,8 Гц), 6,93 (д, 2 Н, J=8,8 Гц), 4,68 (с,2 Н), 4,24 (т, 2 Н, J=5,05 Гц), 3,93 (т, 2 Н, J=5,27 Гц); MS EI m/z 248 (М+). Пример 157. Бензилокси-2-(4-бензилоксифенил)-1-[4-(2-хлорэтокси)бензил]-3 циано-1 Н-индол. В реакционной колбе исходное вещество,представляющее собой 3-цианоиндол 155(2,86 г, 6,64 ммоль), растворяли в ДМФА (25 мл) при 0 С и медленно добавляли NaH (191,2 мг, 8 ммоль). Реакционную смесь перемешивали при 0 С в течение 20 мин. Приготовленный, как указано выше, содержащий анион индола раствор, взятый при помощи шприца, медленно добавляли в отдельную реакционную колбу,содержащую 4-(2-хлорэтокси)-бензилбромид 156 (1,81 г, 7,28 ммоль) в ДМФА (15 мл) при 0 С. Реакционную смесь перемешивали при 0 С в течение 20 мин и доводили до комнатной температуры в течение 1 ч. Реакцию гасили несколькими каплями Н 2 О. Реакционную смесь распределяли между EtOAc (2100 мл) и Н 2 О(80 мл). Органический экстракт промывали насыщенным раствором соли (80 мл), сушили надMgSO4 и упаривали. Неочищенный продукт очищали путем растирания с эфиром с получением продукта в виде твердого вещества белого цвета (2,80 г, 70,4%). Т.пл.=160-162 С; 1 Н ЯМРMS EI m/z 598 (М+). Примеры 158 и 159. Замещение группы хлорпиперидином и гексаметиленамином выполняли аналогично методике, описанной в способе 6, с использованием 157 в качестве исходного вещества, см. выше.m/z 661 (М+). Примеры 138 и 139. Бензиловую часть простых эфиров удаляли путем переноса водорода с использованием 1,4 циклогексадиена и 10% Pd/C как описано в способе 7. Соединения преобразовывали в их соответствующие солянокислые соли, как описано в способе 8. Пример 138. 5-Гидрокси-2-(4-гидроксифенил)-1-[4-(2-пиперидин-1-илэтокси)бензил]1 Н-индол-3-карбонитрил (НСl). Т.пл.=173-175 С; 1H ЯМР (ДМСО) 10,40(м, 2 Н), 1,85-1,70 (м, 4 Н), 1,65-1,50 (м, 4 Н); ИК 3300, 2200, 1250 см-1; MS EI m/z 481 (М+); CHN рассчитан для C30H31N3O3 + 1 НСl + 1 Н 2O. Сложные зфиры индолов 97 и 98. Способ 9. Пример 162. Дипивалат 2-(4-гидроксифенил)-3-метил-1-[4-(2-пиперидин-1-ил-этокси) бензил]-1 Н-индол-5-ола. В качестве исходного вещества для этого синтеза использовали свободное основание из примера 97. Соединение 97 (1,0 г, 2,5 ммоль) в 20 мл СН 2 Сl2 обрабатывали диизопропилэтиламином (0,7 г, 6,3 ммоль) и каталитическим количеством ДМАФ. Реакционную смесь охлаждали до 0 С и обрабатывали пивалоилхлоридом (0,7 мл, 5,6 ммоль), давали ей дойти до комнатной температуры и перемешивали в течение ночи. Реакционную смесь подвергали обработке разбавлением СН 2 Сl2 и промыванием водой и насыщенным раствором соли. После высушивания над MgSО 4 раствор упаривали и хроматографировали на силикагеле (МеОН/ СН 2 Сl2, 1:19) с получением желаемого вещества в виде оранжевой пены (1,08 г). Это вещество поглощали 15 мл этилацетата и обрабатывали 2,5 мл 1 М раствора HCl/Et2 О. Добавляли гексан до тех пор, пока раствор не становился мутным. Продукт выпадал в осадок в виде соли с НСl. Это вещество перекристаллизовывали из смеси этилацетат/гексан с получением 0,42 г чистого 162: Т.пл.=182-185 С; СНN рассчитан для С 39 Н 48N2 О 5 + НСl + 0,25 Н 2 О. Пример 160. Дипропионат 1-[4-(2 азепан-1-илэтокси)бензил]-2-(4-гидроксифенил)-3-метил-1 Н-индол-5-ола (НСl). Соединение получали аналогично примеру 162, за исключением того, что в качестве исходного вещества использовалось соединение из примера 98 и в качестве ацилирующего агента использовался пропионилхлорид: Т.пл.=170,5-172 С;(M+Na)+. Пример 161. Дипивалат 1-[4-(2-азепан 1-илэтокси)бензил]-2-(4-гидроксифенил)-3 метил-1 Н-индол-5-ола (НСl). Соединение получали аналогично примеру 162, за исключением того, что в качестве исходного вещества использовалось соединение из примера 98: Т.пл.=143-151 С; CHN рассчитан для C40H50N2O5 + НСl + 0,75 Н 2 О. Экспериментальная часть для примера 166. Пример 166. 2-(4-Гидроксифенил)-3 метил-1-4-[3-(пиперидин-1-ил)-пропокси]бензил-1 Н-индол-5-ол. Указанное в заголовке соединение получали согласно схеме 16, и стадии процесса представлены ниже. Способ 11. Пример 163 а. 4-(3-хлорпропокси)бензиловый спирт. Раствор 4-гидроксибензилового спирта(16,0 г, 100 ммоль) и гидроксидом калия (5,0 г,89 ммоль) и кипятили с обратным холодильником в течение 2 ч. Раствор охлаждали и фильтровали, а затем фильтрат упаривали. Продукт упаривания поглощали эфиром и промывали водой, насыщенным раствором соли и сушили над сульфатом магния. Вещество хроматографировали на силикагеле с использованием смеси этилацетат/гексан (3:7) с получением 11,6 г продукта в виде твердого вещества белого цвета: Т.пл.=65 С; 1 Н ЯМР (ДМСО) 7,21 (д, 2 Н, 59J=8,8 Гц), 6,88 (д, 2 Н, J=8,8 Гц), 5,03 (т, 1 Н,J=5,7 Гц), 4,40 (д, 2 Н, J=5,5 Гц), 4,05 (т, 2 Н, J=6,l Гц), 3,77 (т, 2 Н, J=6,4 Гц); MS EI m/z 200. Способ 12. Пример 163b. 4-(3-хлорпропокси)бензилбромид. Раствор, содержащий 4-(3-хлорпропокси) бензиловый спирт 162 (10,6 г, 52,8 ммоль) в диоксане (0,125 л) охлаждали до 0 С и обрабатывали добавлением по каплям тионилбромида(12,0 г, 58,0 ммоль). Через 10 мин реакция завершалась. Диоксан разбавляли диэтиловым эфиром и промывали водой, насыщенным раствором соли, а затем сушили над MgSО 4. Продукт реакции упаривали с получением 15 г масла: 1H ЯМР (ДМСО) 7,36 (д, 2 Н, J=8,8 Гц), 6,92 164. 5-Бензилокси-2-(4 бензилоксифенил)-1-[4-(3-хлорпропокси)бензил]-3-метил-1 Н-индол. Раствор, содержащий 5-бензилокси-2-(4 бензилоксифенил)-3-метил-1 Н-индол 7 (6,5 г,15,5 ммоль) в ДМФА (60 мл) охлаждали до 0 С и обрабатывали путем добавления гидрида натрия (0,68 г, 17,0 ммоль) и перемешивали в течение 20 мин. Затем медленно добавляли раствор 4-(3-хлорпропокси)-бензилбромида 163 в ДМФА (10 мл). Реакционной смеси давали достичь комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Этилацетат промывали водой, насыщенным раствором соли и сушили над сульфатом магния и упаривали. Продукт упаривания обрабатывали метанолом, и в осадок выпадало 5 г желаемого продукта в виде белого твердого вещества с температурой плавления 130-132 С. Способ 14. Пример 165. 5-Бензилокси-2-(4-бензилоксифенил)-1-[4-(3-пиперидин-1-илпропокси) бензил]-3-метил-1 Н-индол. Раствор 5-бензилокси-2-(4-бензилоксифенил)-1-[4-(3-хлорпропокси)бензил]-3-метил-1 Ниндола 164 (3 г, 5,1 ммоль), йодистого калия(2,5 г, 15,3 ммоль) и пиперидина (3,0 мл, 30,6 ммоль) нагревали в ДМФА (30 мл) при 100 С в течение 18 ч. Реакционную смесь обрабатывали путем выливания в воду и экстрагирования этилацетатом. Органический слой промывали водой, насыщенным раствором соли и сушили над сульфатом магния. Раствор упаривали до получения масла и продукт осаждали путем добавления метанола. Продукт получали в виде белого твердого вещества: Т.пл.=104-106 С; 1H ЯМР (ДМСО) 7,47 (д, 4 Н, J=7,5 Гц), 7,38 (кв,4H, J=7,9 Гц), 7,36-7,30 (м, 1 Н), 7,28 (д, 2 Н,J=8,3 Гц), 7,19 (д, 1 Н, J=8,8 Гц), 7,12-7,10 (м,4 Н), 6,80 (дд, 1 Н, J=8,8, 2,0 Гц), 6,72 (с, 4 Н), 5,14MS EI m/z 650. Способ 15. Пример 166. 2-(4-Гидроксифенил)-3 метил-1-4-[3-(пиперидин-1-ил)пропокси]бензил-1 Н-индол-5-ол. Раствор 5-бензилокси-2-(4-бензилоксифенил)-1-[4-(3-пиперидин-1-илпропокси)бензил]3-метил-1 Н-индола 165 (2,35 г) в тетрагидрофуране (25 мл) и этаноле (25 мл) добавляли к 2,3 г 10% палладия на углероде. Добавляли циклогексадиен (10 мл) и реакционной смеси давали перемешиваться при комнатной температуре в течение 18 ч. Катализатор отфильтровывали через целит и реакционную смесь упаривали и хроматографировали на силикагеле с использованием смеси дихлорметан/метанол (4:1), чтобы элюировать продукт (0,8 г) в виде белой пены: Т.пл.=125-130 С; 1 Н ЯМР (ДМСО) 9,68 (с, 1 Н),8,70 (с, 1 Н), 7,15 (д, 2 Н, J=8,6 Гц), 7,05 (д, 1 Н,J=8,8 Гц), 6,85 (д, 2 Н, J=8,6 Гц), 6,80 (д, 1 Н,J=2,4 Гц), 6,74 (д, 4 Н, J=2,6 Гц), 6,57 (дд, 1 Н,J=8,6, 2,2 Гц), 5,09 (с, 2 Н), 3,88 (т, 2 Н, J=6,4 Гц),3,60-3,15 (м, 2 Н), 2,62-2,38 (м, 4 Н), 2,09 (с, 3 Н),1,92-1,78 (м, 2 Н), 1,55-1,43 (м, 4 Н), 1,42-1,30 (м,2 Н); ИК (КВr) 3400 (ушир.), 2900, 1620, 1515 см-1; MS EI m/z 470. Синтез 167 и 168. Схема 17 Схема синтеза для примеров 167 и 168
МПК / Метки
МПК: A61K 31/404, C07D 209/22, A61P 9/00
Метки: индола, эстрогенных, 2-фенил-1, качестве, 4-(2-аминоэтокси)бензил, агентов, производные
Код ссылки
<a href="https://eas.patents.su/30-1448-proizvodnye-2-fenil-1-4-2-aminoetoksibenzil-indola-v-kachestve-estrogennyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-фенил-1- [4-(2-аминоэтокси)бензил] индола в качестве эстрогенных агентов</a>
Предыдущий патент: Окклюзионное приспособление, направляемое с помощью чрескожного катетера
Следующий патент: Устройство для индикации электрической неисправности в устройстве коммутации, в частности, в дифференциальном выключателе.
Случайный патент: Текстильная сетка