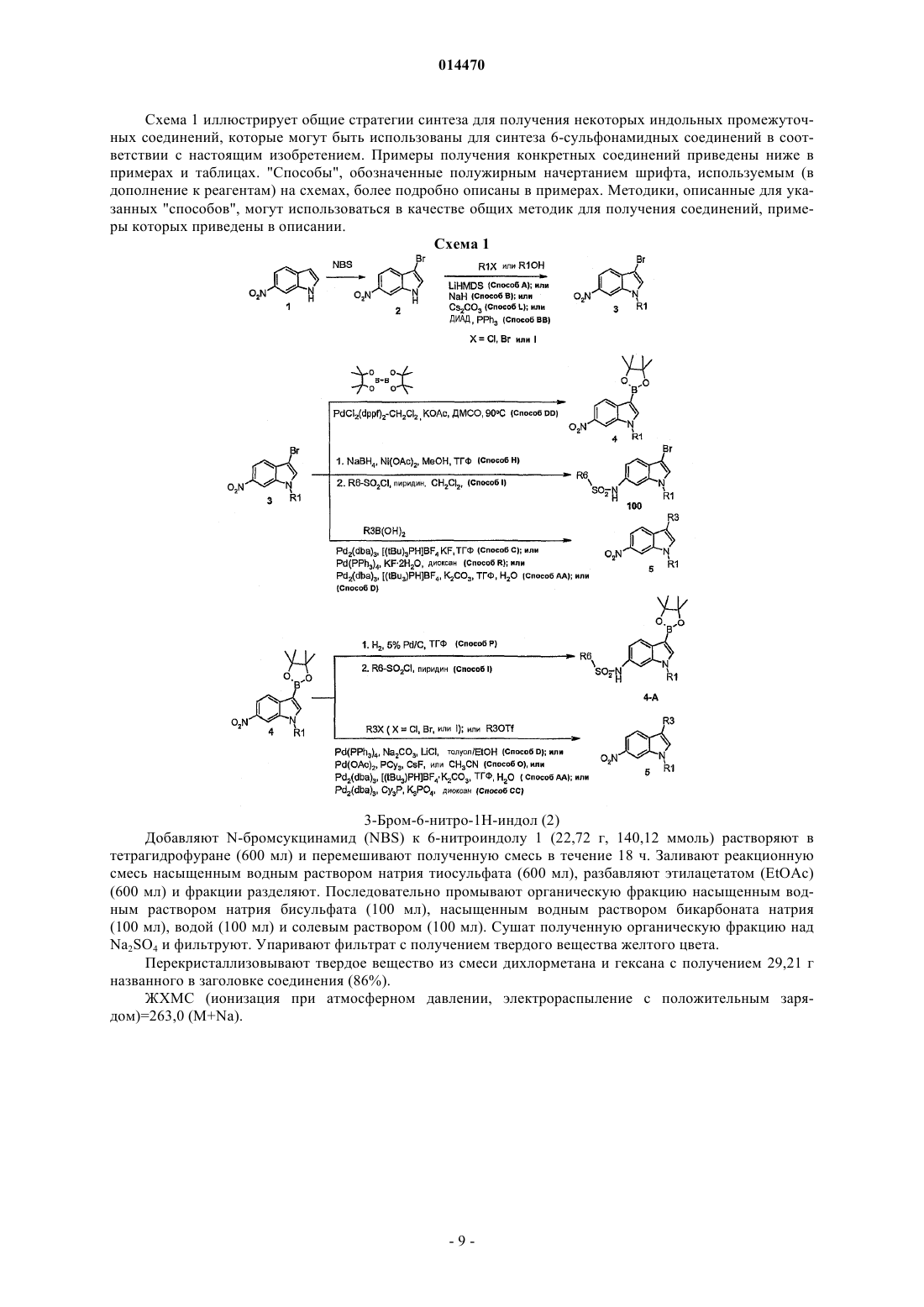
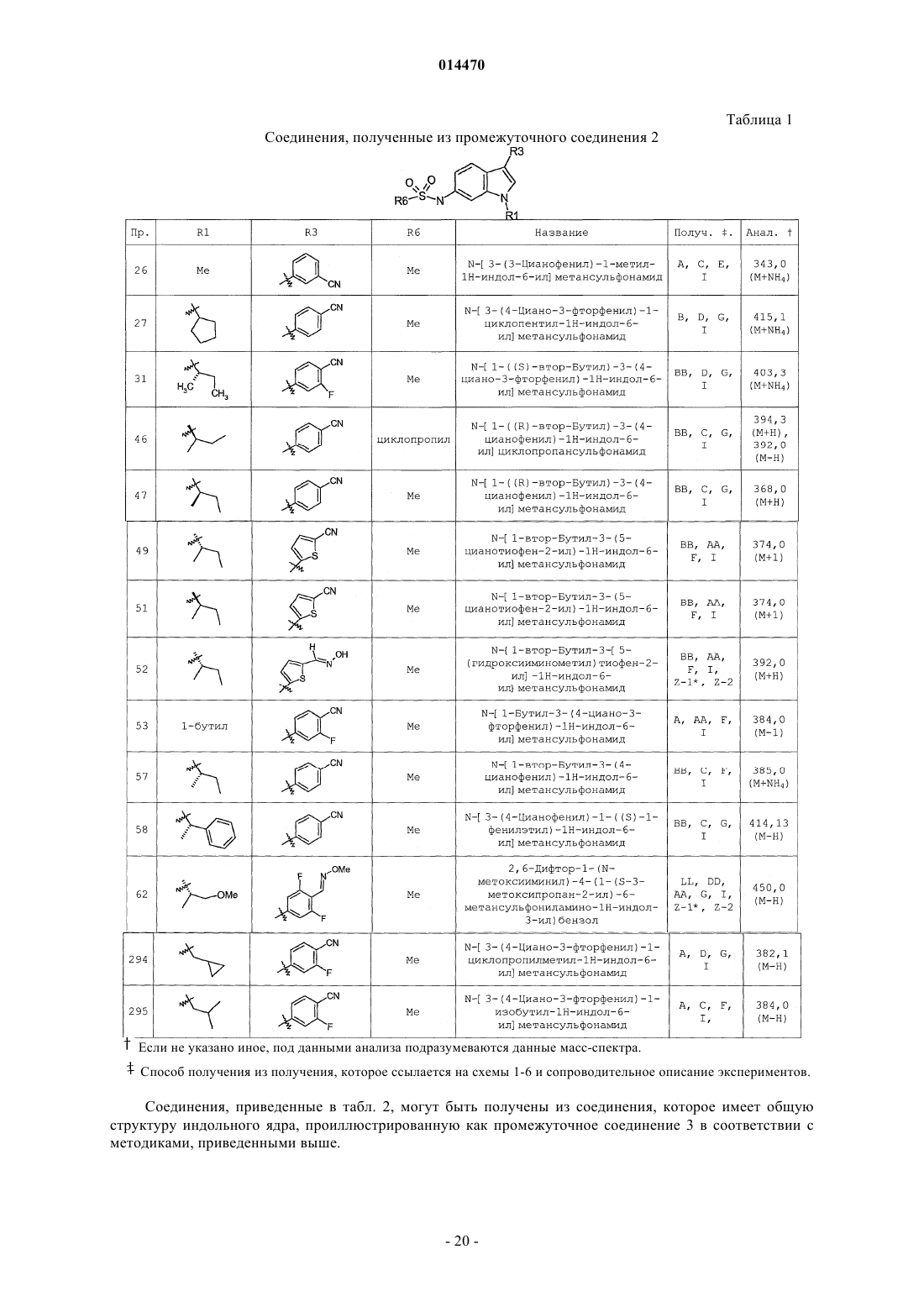
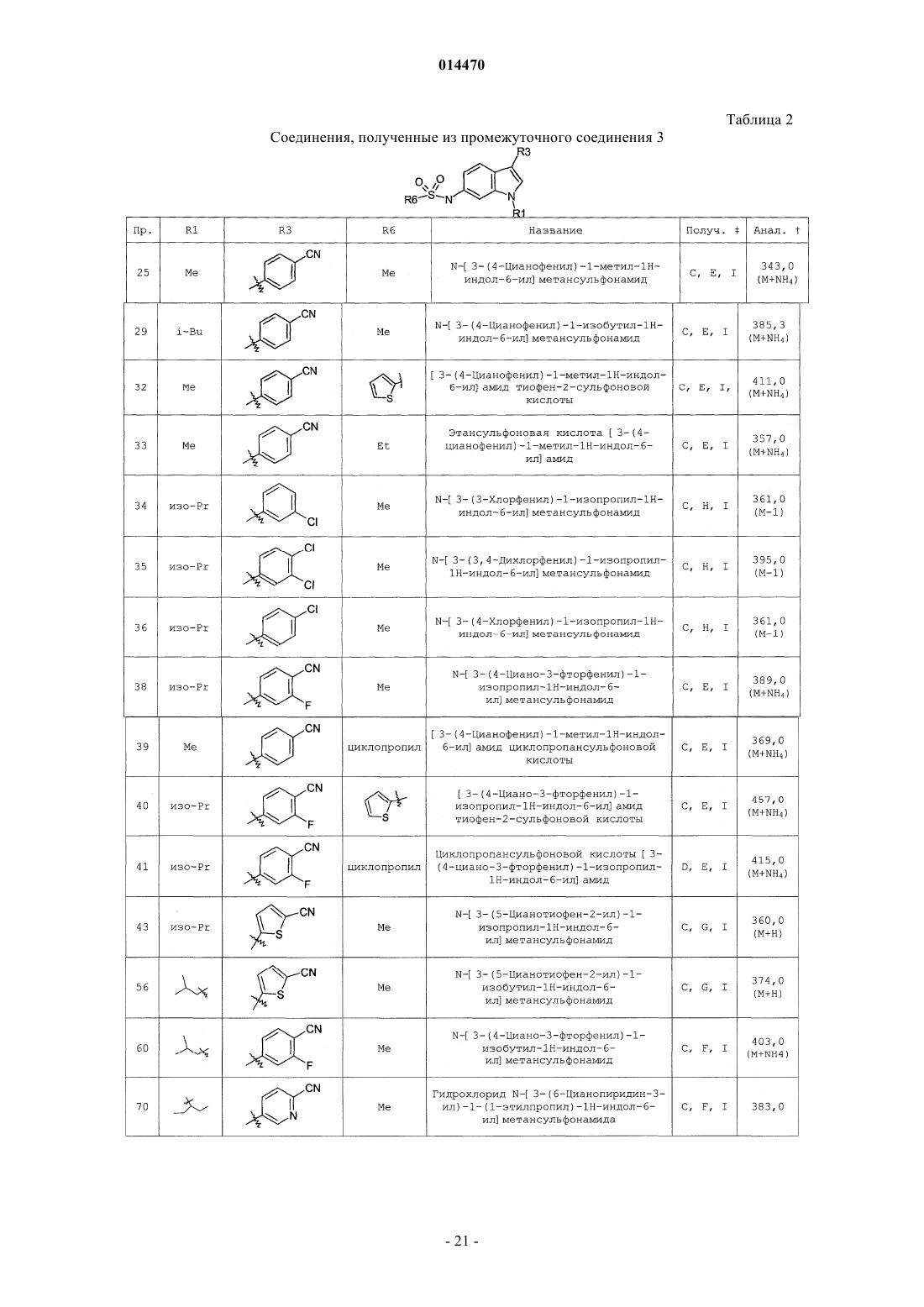
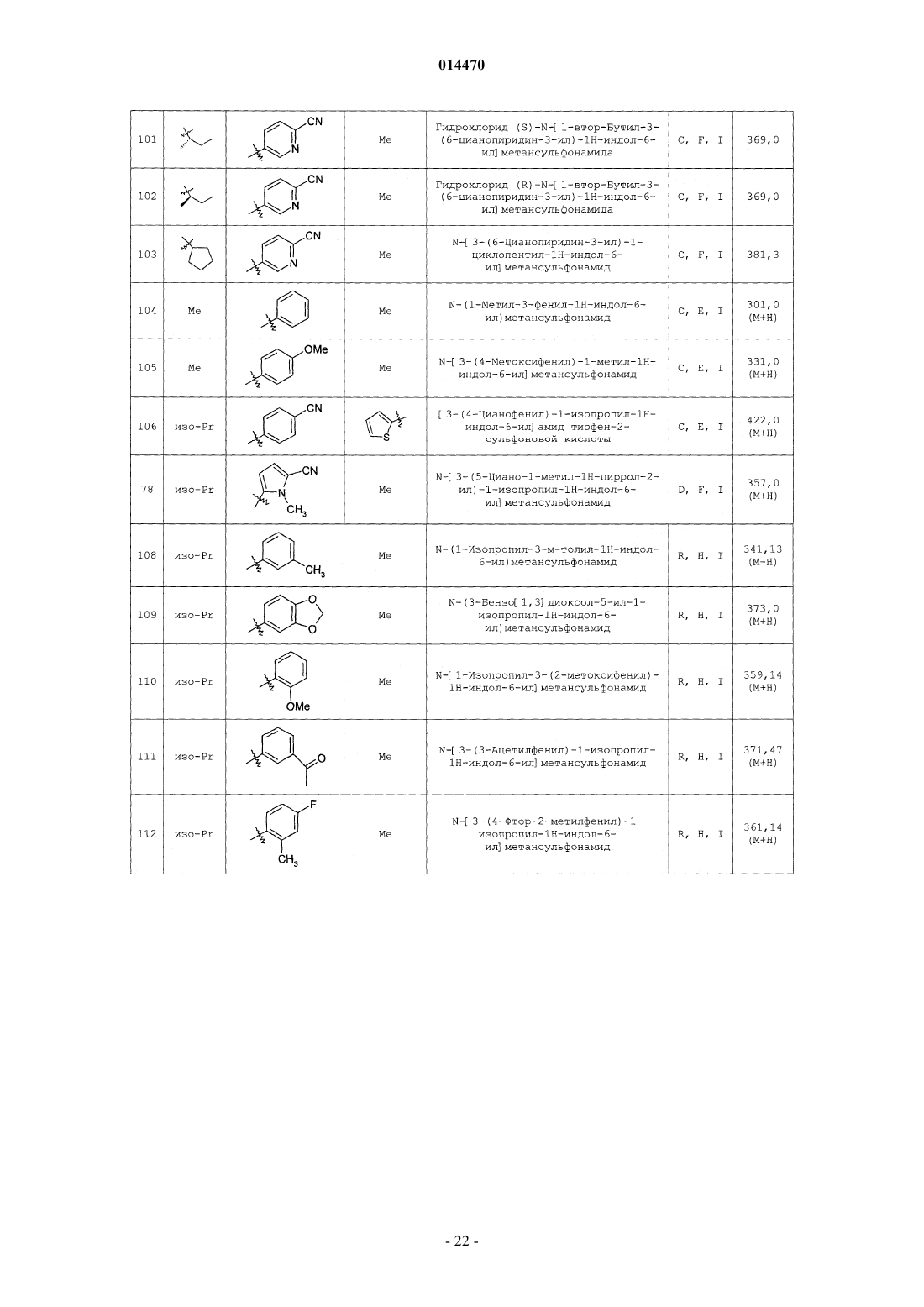
Индолсульфонамидные модуляторы рецепторов прогестерона
Номер патента: 14470
Опубликовано: 30.12.2010
Авторы: Мюль Брайан Стефен, Додж Джеффри Алан, Джоунз Скотт Алан, Юй Ко-Лун, Кларк Кристиан Александер, Йи Ин Квонг, Блейш Томас Джон, Лугар Чарльз Виллис III, Лопес Хосе Эдуардо, Ричардсон Тимоти Иво
Формула / Реферат
1. Соединение формулы I
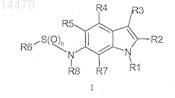
где n равно 1 или 2;
R1 выбран из C1-C8-алкила, C1-C6-алкил-O-C1-C6-алкила, C3-C8-циклоалкила, C1-C6-алкилциклоалкила, C0-C3-алкил-С(О)OR12, C1-C6-алкиларила, арила, C1-C6-алкилпиридинила, пиридинила, тетрагидрофуранила, тетрагидропиранила, -SOnC1-C6-алкила, -SOnC0-C6-алкилциклоалкила и -SOn-пиридинила, где каждый из арила и пиридинила, перечисленных отдельно или в комбинации с алкильным фрагментом, необязательно замещен 1-3 группами, независимо выбранными из -CN и -ОСН3, при условии, что арил не является исключительно ди- или тризамещенным алкоксизаместителем;
R2 выбран из Н, галогена и C1-C6-алкила;
R3 выбран из бензо[1,3]диоксола, бензотиофенила, хромен-2-ила, 2,3-дигидробензо[1,4]диоксинила, 2,3-дигидробензофуранила, 2,3-дигидро-1H-индолила, 1,3-дигидробензимидазол-2-ила, 1,3-дигидроиндол-2-ила, фуранила, индан-1-ила, индазолила, изоксазолила, фенила, пиразолила, пиридинила, 1,2,3,4-тетрагидрохинолинила, тиофенила и тиазолила, каждый из которых необязательно замещен 1-3 группами, независимо выбранными из галогена, -CN, -NO2, -NH2, C1-C3-алкила, C2-C3-алкинила, C1-C3-галогеналкила, C1-C3-гидроксиалкила, -O-C1-C3-алкила, -O-C1-C3-галогеналкила, -SCH3, -(C(S)NH2), -C=N-OH, -C=N-O-C1-C6-алкила, -C(O)OCH3, C(O)NH2, 1-метилтетразол-5-ила, C(O)R12 и (C(O)NHC3-циклоалкил);
R4, R5 и R7, каждый, представляют собой Н;
R6 выбран из C1-C6-алкила и тиофенила;
R8 выбран из Н, C1-C4-алкила;
R12 выбран из Н, C1-C6-алкила, C1-C6-алкилциклоалкила и NH2;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R6 представляет собой СН3.
3. Соединение формулы I, где
R1 выбран из C1-C6-алкила, C3-C8-циклоалкила, C1-C6-алкилциклоалкила, C1-C4-алкил-O-C1-C4-алкила;
R2 представляет собой Н;
R3 выбран из фенила, тиофенила, пиридинила, пиразолила, фуранила, тиазолила и бензотиофенила, каждый из которых замещен 1-3 группами, независимо выбранными из галогена, -CN, C1-C3-алкила, C1-C3-галогеналкила, -NO2, -O-C1-C3-алкила, -C(O)R12, -C=N-O-C1-C6-алкила и -C=N-OH;
R6 представляет собой C1-C6-алкил;
R8 представляет собой Н;
R12 выбран из Н, C1-C6-алкила, C1-C6-алкилциклоалкила;
или его фармацевтически приемлемая соль.
4. Соединение, выбранное из следующего:
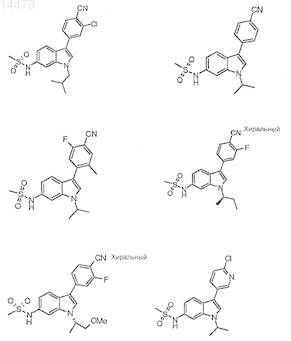
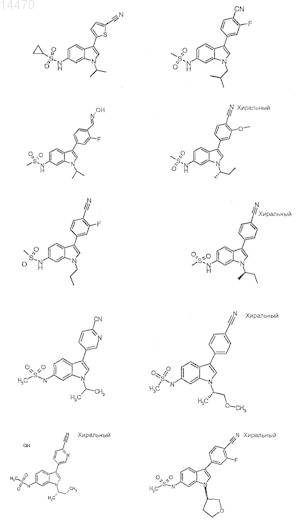
5. 2-Фтор-4-(1-(S-3-метоксипропан-2-ил)-6-метансульфониламино-1Н-индол-3-ил)бензонитрил.
6. Фармацевтическая композиция, содержащая соединение по любому из пп.1-5 и по крайней мере один из носителя, разбавителя и эксципиента.
7. Применение соединения по любому из пп.1-5 в качестве лекарственного средства.
8. Способ получения соединения формулы I
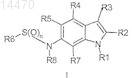
или его фармацевтически приемлемой соли,
где n равно 1 или 2;
R1 выбран из C1-C8-алкила, C1-C6-алкил-О-C1-C6-алкила, C3-C8-циклоалкила, C1-C6-алкилциклоалкила, C0-C3-алкил-С(О)OR12, C1-C6-алкиларила, арила, C1-C6-алкилпиридинила, пиридинила, тетрагидрофуранила, тетрагидропиранила, -SOnC1-C6-алкила, -SOnC0-C6-алкилциклоалкила и -SOn-пиридинила, где каждый из арила и пиридинила, перечисленных отдельно или в комбинации с алкильным фрагментом, необязательно замещен 1-3 группами, независимо выбранными из -CN и -ОСН3; при условии, что арил не является исключительно ди- или тризамещенным алкоксизаместителем;
R2 выбран из Н, галогена и C1-C6-алкила;
R3 выбран из бензо[1,3]диоксола, бензотиофенила, хромен-2-ила, 2,3-дигидробензо[1,4]диоксинила, 2,3-дигидробензофуранила, 2,3-дигидро-1H-индолила, 1,3-дигидробензимидазол-2-ила, 1,3-дигидроиндол-2-ила, фуранила, индан-1-ила, индазолила, изоксазолила, фенила, пиразолила, пиридинила, 1,2,3,4-тетрагидрохинолинила, тиофенила и тиазолила, каждый из которых необязательно замещен 1-3 группами, независимо выбранными из галогена, -CN, -NO2, -NH2, C1-C3-алкила, C2-C3-алкинила, C1-C3-галогеналкила, C1-C3-гидроксиалкила, -O-C1-C3-алкила, -O-C1-C3-галогеналкила, -SCH3, -(C(S)NH2), -C=N-OH, -C=N-O-C1-C6-алкила, -С(O)ОСН3, C(O)NH2, 1-метилтетразол-5-ила, C(O)R12 и (C(O)NHC3-циклоалкил);
R8 выбран из Н, C1-C4-алкила;
R12 выбран из Н, C1-C6-алкила, C1-C6-алкилциклоалкила и NH2;
где указанный способ включает сочетание соединения формулы II
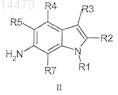
с основанием и R6SO2Cl,
где R6 выбран из C1-C6-алкила и тиофенила.
9. Применение соединения для производства лекарственного средства для лечения и/или профилактики лейомиом у млекопитающего, включающее введение указанному млекопитающему эффективной дозы соединения по любому из пп.1-5, его фармацевтически приемлемой соли.
10. Применение соединения для производства лекарственного средства для лечения или профилактики эндометриоза, включающее введение пациенту, который нуждается в таком лечении или профилактике, эффективного количества соединения по любому из пп.1-5, его фармацевтически приемлемой соли.
11. Фармацевтическая композиция, содержащая соединение по любому из пп.1-5, для лечения лейомиом или эндометриоза.
Текст
ИНДОЛСУЛЬФОНАМИДНЫЕ МОДУЛЯТОРЫ РЕЦЕПТОРОВ ПРОГЕСТЕРОНА Блейш Томас Джон, Кларк Кристиан Александер, Додж Джеффри Алан, Джоунз Скотт Алан, Лопес Хосе Эдуардо, Лугар Чарльз Виллис III, Мюль Брайан Стефен,Ричардсон Тимоти Иво, Йи Ин Квонг, Юй Ко-Лун (US) Раскрыты соединения формулы I(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 014470 Область изобретения Данное изобретение относится к области медицинской органической химии, фармакологии и медицины. Кроме того, данное изобретение относится к новым соединениям и способам, пригодным для лечения опухолей, гинекологических расстройств, а также связанных с ними симптомов и осложнений. Предпосылки изобретения Лейомиомы представляют собой наиболее распространенные нераковые опухоли у женщин детородного возраста. Лейомиомы матки (или фибромиомы) рассматриваются как доброкачественные опухоли мышечной и соединительной ткани, которые развиваются в пределах или присоединены к стенке матки. Результаты ультразвукового исследования показывают, что более чем у 70% женщин развиваются фибромиомы к моменту достижения климактерического периода (Baird et al., Am. J. Obstet. Gynecol. 2005; 188: 100-107; и Cramer et al., Am. J. Clin. Pathol. 1990; 90: 435-438). Хотя не у всех женщин присутствуют симптомы, оправдывающие терапию, у значительного количества женщин развиваются умеренные или тяжелые симптомы, включая аномальные маточные кровотечения, чувство давления и боль в тазовой области, а также репродуктивная дисфункция. Существующие возможности лечения включают хирургическое вмешательство, например гистерэктомию и миомэктомию. Менее агрессивные процедуры включают эмболизацию маточной артерии и термоабляционную коагуляцию. Медикаментозная терапия включает лечение гормонами. В настоящий момент единственный одобренный FDA (Управлением по контролю за продуктами и медикаментами США) вид гормональной терапии заключается в применении агониста GnRH (гонадотропинвысвобождающий гормон) до хирургического вмешательства (Walker and Stewart, Science, 2005; 308; 1589-1592). Терапия агонистом GnRH часто ограничивается 1-3 месяцами из-за значительного снижения плотности костной ткани, которая при длительном применении приводит к остеопорозу. В дальнейшем размеры миом, леченных агонистом GnRH, часто возвращаются до предоперационных в пределах нескольких недель после прекращения терапии. Поэтому такое лечение часто применяется для уменьшения размеров миомы, которое позволяет женщине подготовиться к возможному хирургическому удалению(Stewart, Lancet, 2001; 357; 293-298). Такие схемы вызывают нежелательные последствия для женщин, которые желают зачать ребенка позже. Очевидно, что гистерэктомия делает невозможным зачатие ребенка в будущем, и другие виды хирургического лечения также подвергают пациентку риску, в том числе разрыв матки и рецидивирующие фибромиомы. Медикаментозное лечение также может вызывать существенные побочные эффекты. Например, агонисты GnRH создают в организме условия, в высокой степени сходные с условиями климактерического периода, которые сопровождаются такими побочными эффектами, как приливы, сухость влагалища и, как отмечалось выше, снижение плотности костной ткани. Эти и другие проблемы подчеркивают существующую необходимость в лечении и облегчении гинекологических расстройств, таких как миомы вообще, более конкретно, но не исключительно, лейомиомы, а также эндометриоз, и сопровождающих их симптомов. В качестве еще одной предпосылки следующие ссылки описывают индольные или индолиновые структуры и их терапевтическое применение. которые заявлены как пригодные в качестве модуляторов 5-НТ-6.Hsieh et al. в US 6933316 раскрывают индольные соединения приведенной ниже формулы, замещенные, как описано в описании которые заявлены как обладающие противораковой активностью с действием, направленным на полимеризацию/деполимеризацию микротрубочек. Приведенные выше ссылки не описывают эффективного лечения аномального роста ткани или соединений, пригодных в качестве лигандов рецептора прогестерона. Кроме того, описанные соединения демонстрируют одну или более нежелательных характеристик, в том числе низкую биодоступность, низкую аффинность связывания с прогестероном, неспецифическое связывание с рецепторами гормонов вообще, т.е. отсутствие специфического связывания с рецептором прогестерона (PR), и неэффективны или демонстрируют низкую эффективность в лечении опухолей в целом и более конкретно - неэффек-1 014470 тивны или демонстрируют низкую эффективность в лечении миом, лейомиом и эндометриоза. Таким образом, по-прежнему существует потребность в эффективных соединениях и способе(ах) лечения опухолей, гинекологических расстройств и связанных с ними осложнений. Данное изобретение направлено на удовлетворение такой потребности. Краткое описание изобретения Если не указано другое, в настоящем изобретении будет использоваться следующая система нумерации для ядра индола, показанного ниже В данном изобретении предлагается соединение формулы I где n равно 1 или 2 и R1-R8 описаны в данном описании. Для целей данного изобретения предпочтительные соединения по настоящему изобретению представляют собой селективные модуляторы рецептора прогестерона (SPRM). В другой форме настоящее изобретение также предлагает фармацевтическую композицию, содержащую соединение формулы I, определенное выше, и один или более из следующего: носитель, разбавитель и эксципиент. Настоящее изобретение также предлагает способ получения соединения формулы I. В одной форме способ включает сочетание соединения формулы II с основанием и R6SO2Cl. Такой способ может также включать восстановление нитрогруппы в соединении формулы IIA до амина В другой форме способ включает замену галогена (X) в положении 3 индола в формуле III необязательно замещенным арилом, необязательно замещенным гетероарилом или необязательно замещенной группой бициклического арила или бициклического гетероарила. Такой способ может включать на первой стадии замещение галогена более реакционноспособной уходящей группой,такой как группа диоксоборолана,образованная,например,из бис-(пинаколят)дибора. В другой форме настоящее изобретение предлагает способ модулирования активности рецептора прогестерона и/или лечения заболеваний, опосредованных модуляцией активности рецептора прогестерона у млекопитающего, в том числе негуманоидного млекопитающего и человека (более конкретно женского пола). Способ включает введение пациенту терапевтически эффективной композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль, сольват, энантиомер, рацемат,диастереомер или смесь диастереомеров. В предпочтительном варианте способ включает введение соединения формулы I или его фармацевтически приемлемой соли, сольвата, энантиомера, рацемата, диастереомера или смеси диастереомеров, демонстрирующих высокую степень селективности связывания с рецептором прогестерона (PR). В более предпочтительном варианте вводимые соединения демонстри-2 014470 руют селективность связывания с рецептором прогестерона, которая приблизительно в 5 раз превышает селективность связывания с рецептором андрогена (AR), рецептором глюкортикоида (GR) и рецептором минералокортикоида (MR), по результатам сравнения индивидуальных значений IC50 или значения Ki,полученных в соответствующих анализах связывания. В другом предпочтительном варианте способ включает введение соединения формулы I или его фармацевтически приемлемой соли, сольвата, энантиомера, рацемата, диастереомера или смеси диастереомеров, способных или выбранных таким образом,чтобы оказывать действие агониста PR, действие антагониста PR, действие частичного агониста PR или действие частичного антагониста PR или обеспечивать комбинацию этих аффектов. Еще в одной форме настоящее изобретение предлагает способ лечения или облегчения влияния одного или более из следующего: опухолей; новообразований; миомы (миом); лейомиом (фибромиомы матки); эндометриоза (аденомиоза); послеоперационных спаек брюшины; гиперплазии эндометрия; синдрома поликистоза яичников; карцином и аденокарцином матки, яичника, молочной железы, ободочной и прямой кишки и предстательной железы; бесплодия; для контроля фертильности; женской сексуальной функции; других гинекологических или менструальных синдромов, таких как аномальные или дисфункциональные кровотечения, аменорея, меноррагия, гиперменорея и дисменорея; или патологических осложнений перечисленных выше расстройств/синдромов у млекопитающего, в том числе негуманоидного млекопитающего и человека (более конкретно женского пола). В другой форме настоящее изобретение предлагает способ лечения эндометриоза или симптомов и патологических осложнений эндометриоза. В другой форме настоящее изобретение предлагает способ лечения или облегчения влияния гинекологических или менструальных расстройств у млекопитающего путем введения указанному млекопитающему терапевтически эффективной дозы соединения формулы I или его фармацевтически приемлемой соли, сольвата, энантиомера, рацемата, диастереомера или смеси диастереомеров. Еще в одной форме настоящее изобретение предлагает применение соединения для производства лекарственного средства для лечения или облегчения влияния одного или более из лейомиом, эндометриоза и дисфункциональных кровотечений. Настоящее изобретение также предлагает комбинированную терапию, вводимую в виде параллельной, последовательной или прерывистой схемы лечения, включая соединение формулы I и один или более из селективных модуляторов рецептора эстрогена (SERM), эстрогена, агонистов ER, антагонистовER, селективных модуляторов рецептора андрогена (SARM), агонистов гонадотропин-высвобождающего гормона (GnRH), антагонистов, прогестерона (Р 4), прогестинов, а также других агонистов и модуляторовPR. Подробное описание изобретения В одной форме данное изобретение предлагает новые соединения формулы IR1 выбран из C1-C8-алкила, C2-C6-алкенила, C2-C6-алкинила, C1-C6-гидроксиалкила,C1-C6-галогеналкила, C1-C6-цианоалкила, C1-C6-алкиларила, C1-C6-алкилгетероарила, C3-C8-циклоалкила,C1-C6-алкилциклоалкила, C1-C6-алкилдициклоалкила, C1-C6-алкилгетероциклила, гетероциклила, арила,гетероарила, C1-C6-алкил-O-R9, C0-C6-алкил-C(S)R9, C0-C6-алкил-CO2R9, -SOnR11, где каждый из циклоалкила, гетероциклила, арила и гетероарила, перечисленных по отдельности или в комбинации с алкильным фрагментом, необязательно замещен 1-3 группами, независимо выбранными из галогена, -CN, -ОН,оксо, C1-C3-алкила, C1-C3-галогеналкила, C1-C3-цианоалкила, C2-C5-алкенила, C0-C3-алкил-NO2,-O-C1-C3-алкила, C1-C3-гидроксиалкила, C0-C3-алкил-NR12R13, C0-C3-алкил-С(О)R12, C0-C3-алкилС(О)OR12,C(O)NR12R13,C(S)NR12R13,CH2OR12,-SR12,S(O)nR12,-S(O)nNR12R13,-N(R9)C(O)NR12R13, -N(R12)С(О)OR13, -N(R12)S(O)nR13, -N(R12)S(O)nNR12R13, -C=N-OR10 и -циклоCN4R9; при условии, что арил и гетероарил не являются исключительно ди- или тризамещенными алкоксизаместителями;R3 выбран из необязательно замещенного арила, необязательно замещенного гетероарила или необязательно замещенного бициклического гетероарила, где замещенный арил, замещенный гетероарил и бициклический гетероарил замещены 1-3 группами, независимо выбранными из галогена,-CN, -ОН, оксо, C1-C3-алкила, C1-C3-галогеналкила, C1-C3-цианоалкила, C2-C5-алкенила, C2-C6-алкинила,C0-C3-алкил-NO2, -O-C1-C3-алкила, -O-C1-C3-галогеналкила, C1-C3-гидроксиалкила, C0-C3-алкилNH12R13, C0-C3-алкил-С(О)R12, C0-C3-алкил-C(О)OR12, -C(O)NR12R13, -C(S)NR12R13, -CH2OR12,-SR12, S(O)nR12, -S(O)nNR12R13, -N(R9)С(O)NR12R13, -N(R12)С(О)OR13, -N(R12)S(O)nR13,-3 014470-N(R12)S(O)nNR12R13, -C=N-OR10 и -цикло-CN4R9; каждый из R4, R5 и R7 независимо выбран из Н, галогена, -ОН, -CN, C1-C6-алкила,C1-C6-галогеналкила, C2-C4-алкенила, C2-C4-алкинила, -O-C1-C4-алкила, -O-C1-C4-галогеналкила;R6 выбран из C1-C6-алкила, C1-C6-галогеналкила, C2-C6-алкенила, C3-C8-циклоалкила,C1-C6-алкилциклоалкила, гетероциклила, C1-C3-алкилгетероциклила, фенила, C1-C3-алкилгетероарила,C0-C3-алкил-NR9R10 и -N(H)C(O)R9, где каждый из циклоалкила, гетероциклила, фенила и гетероарила,перечисленных по отдельности или в комбинации с алкильным фрагментом, необязательно замещен 1-3 группами, независимо выбранными из галогена, -CN, -ОН, оксо, C1-C3-алкила, C1-C3-галогеналкила,C1-C3-цианоалкила, C2-C5-алкенила, C0-C3-алкил-NO2, -O-C1-C3-алкила и C1-C3-гидроксиалкила;R9 независимо выбран из Н, C1-C6-алкила, C1-C6-галогеналкила, C0-C6-алкилгетероциклила,C1-C6-алкилциклоалкила;R11 выбран из C1-C6-алкила, -NR9R9, C0-C6-алкилциклоалкила, арила, гетероарила, где арильные и гетероарильные группы необязательно замещены 1-3 группами, независимо выбранными из галогена, CN и -O-C1-C3-алкила;R12 и R13 независимо выбраны из Н, C1-C6-алкила, C1-C6-галогеналкила, C1-C6-алкилциклоалкила;C1-C6-алкиларила, C0-C6-алкилгетероарила, C1-C6-гидроксиалкила, C2-C6-алкенила и C3-C8-циклоалкила; или их фармацевтически приемлемую соль. В одной форме более предпочтительные группы R1 включают C1-C6-алкил, C1-C6-алкенил,C1-C6-алкинил, C1-C6-галогеналкил, C3-C8-циклоалкил, C1-C6-алкилциклоалкил, арил, C1-C6-алкиларил,гетероарил, C1-C6-алкилгетероарил, C1-C6-алкилгетероциклил, -SOnR11 и C1-C6-алкил-S-R9, где каждый из циклоалкила, гетероциклила, арила и гетероарила, перечисленных по отдельности или в комбинации с алкильным фрагментом, необязательно замещен 1-3 группами, независимо выбранными из галогена, CN, -ОН, -NO2, C1-C3-алкила, C1-C3-галогеналкила и C1-C3-гидроксиалкила. В другой форме предпочтительные R1 группы включают гетероциклил, C1-C6-алкилгетероциклил,арил, C1-C6-алкиларил, гетероарил и C1-C6-алкилгетероарил, каждый из которых необязательно замещен 1-3 группами, независимо выбранными из галогена, -CN, -ОН, -NO2, C1-C3-алкила, C1-C3-галогеналкила иR3 включают бензо[1,3]диоксол,бензофуранил,бензо[1,2,5]тиадиазолил,бензотиофенил,хромен-2-онил,2,3-дигидробензо[1,4]диоксинил,2,3-дигидробензофуранил, 2,3-дигидро-1 Н-индолил, 1,3-дигидробензимидазол-2-онил, 1,3-дигидроиндол-2-онил, фуранил, индан-1-онил, индазолил, изобензофуран-1-онил, изоксазолил, нафталинил, фенил, пиразолил, пиридинил, пиримидил, пирролил, хинолинил, 1,2,3,4-тетрагидрохинолинил, тиофенил,тиазолил, тетрагидрофуранил и тетрагидропиранил, каждый из которых необязательно замещен 1-3 группами, независимо выбранными из галогена, -CN, -ОН, -NO2, C1-C3-алкила, C1-C3-галогеналкила,C1-C3-гидроксиалкила, -O-C1-C3-алкила, -C(S)NR9R9, -C=N-OH, -C=N-OR11 и C(O)R11. Более предпочтительные группыC0-C6-алкил-NR9R10. Более предпочтительно группы R6 включают C1-C6-алкил, C1-C6-алкилциклоалкил и гетероциклил. Настоящее изобретение также охватывает лечение и облегчение незлокачественных состояний, таких как миомы, лейомиомы (фибромиомы матки), эндометриоз (аденомиоз), послеоперационные спайки брюшины и гиперплазия эндометрии или их патологические последствия. Настоящее изобретение также включает лечение и/или облегчение бесплодия; контроль фертильности; лечение и/или облегчение женской сексуальной дисфункции и гинекологических или менструальных расстройств или синдромов, таких как аномальные или дисфункциональные кровотечения, аменорея, меноррагия, гиперменорея и дисменорея, или патологические последствия перечисленных болезней,расстройств и/или синдромов. Настоящее изобретение также включает лечение и/или облегчение злокачественных состояний, таких как карциномы и аденокарциномы яичника, молочной железы, ободочной и прямой кишки и предстательной железы или патологические последствия перечисленных заболеваний, расстройств и/или синдромов. Термин "модуляция" включает, не ограничиваясь ими, повышающее регулирование, понижающее регулирование, ингибирование, агонизм, антагонизм рецептора, необходимый для обеспечения экспрессии гена и соответствующих биологических последствий такого вмешательства. Выражение "заболевания, связанные с модуляцией рецептора" или "заболевания, опосредованные активностью рецептора" обозначает какое-либо физиологическое расстройство любого происхождения,реакцию на введение модулятора рецептора, такого как агонист, антагонист, частичный агонист или частичный антагонист, а также их смеси.-4 014470 В структурах, показанных в данном описании, следующее обозначение указывает на атом или точку присоединения показанной группы к остальной части молекулы. Общие химические термины, используемые для характеристики описанных соединений, имеют обычное значение. Например, термин "C1-6-алкил", или " (C1-C6)-алкил", или "C1-C6-алкил" обозначает неразветвленную или разветвленную алифатическую цепь, содержащую 1-6 атомов углерода. Если не указано иное, термин "алкил" обозначает C1-C6-алкил. Если конкретно не указано иное, атом углерода алкильной группы присоединен к остальной части молекулы, на которую сделана ссылка. При использовании в комбинации с заместителем алкильная группа может представлять собой алкиленовую группу,присоединяющую заместитель к остальной части молекулы, на которую сделана ссылка. Термин "C0-C6-алкил" обозначает алкильную группу, как указано выше, однако, если используется термин С 0, алкильная группа отсутствует. В этом варианте остальные группы(а) присоединены непосредственно к остальной части молекулы, на которую сделана ссылка, без промежуточной алкиленовой группы. Термины "алкенил" и "алкинил", например C2-C6-алкенильная группа (или C2-C6-алкинильная группа), в данном описании означают, что соответствующие группы могут включать 1, 2 или 3 двойные связи(или тройные связи). Если в группе присутствует более чем одна двойная или тройная связь, двойные и тройные связи могут быть сопряженными или не сопряженными. Изобретение также предусматривает, что термины "C1-C6-алкил", "C2-C6-алкенил" и подобные термины также включают указанный алкил или алкенил или подобный фрагмент, который может быть хиральным, регио- или стереоизомерным. Такие хиральные, или регио-, или стереоизомерные фрагменты как заместители также включены в настоящее изобретение. Термин "циклоалкил" в данном описании обозначает циклический фрагмент C3-C8, содержащий только атомы углерода в кольце, где к каждому атому углерода в кольце присоединено соответствующее количество атомов водорода или он необязательно замещен одним или более заместителями, как описано в данном описании. Понятно, что термин также подразумевает, что кольцо может содержать одну или более двойных углерод-углеродных связей. Термин "гетероцикл", "гетероциклил" или "гетероциклический" обозначает 5-10-членную моноили конденсированную бициклическую систему колец, которые могут быть насыщенными или частично ненасыщенными, и могут содержать 1-5 гетероатомов. Термин "гетероатом" в данном описании обозначает атом, выбранный из N, S или О. Гетероцикл,гетероциклил или гетероциклические кольца необязательно могут быть замещены при атомах углерода,азота или атоме(ах) серы в кольце, если не определено иное, одним или более заместителями из приведенного ниже перечня. Гетероциклическое кольцо присоединено к соединению или субструктуре, на которые сделана ссылка. В одной форме предпочтительными являются моногетероциклические кольца. В другой форме предпочтительные гетероциклические группы включают бензотиофен, диоксаран, гексаметиленимино, индолил, изохинолил, морфолино, пиперидинил, пиридинил, пирролидинил, хинолил,тетразолил и тиоморфолино. Как вывод, термин "алкилгетероциклический" или "алкилгетероцикл" означает, что алкильная группа присоединена к гетероциклу и точкой прикрепления к остальной части молекулы или субструктуры, на которую сделана ссылка, является алкильная группа (или алкиленовая группа). Термин "галогеналкил" в данном описании обозначает алкильную группу (как отмечалось выше),замещенную одним или более атомами галогена, выбранными из F, Br, Cl и I. В выбранных формах настоящего изобретения предпочтительными являются дифторалкильные, например, дифторметильные группы, -CHF2. Термин "гидроксиалкил" в данном описании обозначает алкильную группу, замещенную одной или более гидроксильными группами, где к углеродному атому алкильной группы присоединена молекула,на которую делается ссылка, или ее часть. Термин "алкокси" или "-O-C1-C6-алкил" в данном описании обозначает алкильную группу, присоединенную к молекуле, на которую делается ссылка, или ее части через атом кислорода. Термины "арил" или "необязательно замещенный арил" обозначают циклический ароматический фрагмент. Примеры арильных фрагментов включают моноциклические или бициклические конденсированные кольца, такие как, не ограничиваясь ими, фенил, нафталин, фенантрен, антрацен и т.п. Если арильный фрагмент является замещенным, он может содержать один или более заместителей, приведенных в списке ниже. Термины "фенил" или "необязательно замещенный фенил" обозначают ароматический фрагмент,содержащий 6 атомов углерода в кольце с соответствующим количеством водородных атомов. Необязательно замещенный фенильный фрагмент может содержать один или более заместителей, приведенных в списке ниже, которые присоединены к углеродным атомам кольца.-5 014470 Термин "алкиларил" обозначает алкильный фрагмент, замещенный арильной группой (как изложено выше). Например, C1-C6-алкиларил указывает на то, что арильная группа присоединена к фрагментуC1-C6-алкил (или алкиленовой группе) и что результирующий C1-C6-алкиларил присоединен к остальной части молекулы, на которую делается ссылка, через алкильный фрагмент (или алкиленовую группу). Бензил представляет собой предпочтительный алкиларильный фрагмент. Термин "гетероарил" или "гетероароматический" обозначает замещенное или незамещенное 5-10 членное кольцо(ца), рассматривающееся как такие, которые имеют ароматический характер и содержат от 1 до 4 гетероатомов в кольце. Гетероарил или гетероароматические кольца в данном описании включают моноциклические или бициклические конденсированные системы колец. В настоящем изобретении для бициклической гетероарильной или гетероароматической конденсированной системы колец оба кольца не обязательно должны быть ароматическими. Например, бициклические бензоконденсированные кольца включены в определение гетероарильных и гетероароматических колец. Если не указанно иное, ароматическое кольцо непосредственно присоединено к индольному соединению или субструктуре, на которую делается ссылка. Примеры гетероатомов включают О, S и N. Характерные примеры гетероарила включают, не ограничиваясь ими, бенздиоксолил, бензимидазолил, бензофурил, бензотиенил,фурил, имидазолил, имидазолидинонил, имидазопиридинил, индазолил, индолил, изотиазолил, изобензофуранил, изоксазолил, морфолинил, оксадиазолил, оксазолил, хинил, пиранил, пиразинил, пиразолил,пиридазинил, пиридил, пиримидинил, пирролидинил, пирролил, тетрагидрофуранил, тетрагидрохинолил, тетразолил, тиадиазолил, тиазолил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, триазолонил, тиенил и их изомеры. Если не указано иное, гетероарильный или гетероароматический фрагмент, в том числе гетероатомы, могут быть замещены одним или более заместителями из приведенного ниже списка. Если конкретно не указано иное, термин "необязательно замещенный" или "замещенный", который используется в связи с такими группами, как арил, гетероарил, циклоалкил и/или гетероциклил, обозначает группы, независимо от того, используются ли они отдельно или в сочетании с другой группой или фрагментом, и означает, что группа замещена одним или более заместителями, приведенными в данном списке - обычно, но исключительно путем замены одного или более атомов водорода. Заместители включают галоген, -CN, -ОН, оксо(=O), C1-C3-алкил, C1-C3-галогеналкил, C1-C3-цианоалкил,C2-C5-алкенил, C0-C3-алкил-NO2, -O-C1-C3-алкил (или C1-C3-алкокси), C1-C3-гидроксиалкил, C0-C3-алкилNR12R13, C0-C3-алкил-C(O)R12, C0-C3-алкил-C(O)OR12, -C(O)NR12R13, -C(S)NR12R13, -CH2OR12,-SR12, -S(O)nR12, -S(O)nNR12R13, -N(R9)C(O)NR12R13, -N(R12)С(O)OR13, -N(R12)S(O)nR13,-N(R12)S(O)nNR12R13, -C=N-OR12, -цикло-CN4R12 (необязательно замещенный тетразол), где n=1 или 2 и где R12 и R13 независимо выбраны из Н, C1-C6-алкила, C1-C6-галогеналкила, C1-C6-алкилциклоалкила;C1-C6-алкиларила, C0-C6-алкилгетероарила, C1-C6-гидроксиалкила, C2-C6-алкенила и C3-C8-циклоалкила. Предпочтительные заместители выбраны из группы, состоящей из F, Cl, -CN, -NO2, СН 3, C1-C3-алкила,-CF3, -CHF2, -CH2CN, C2-C4-алкенила, -C(O)R12, -C(O)OR12, -С(О)NR12R13, -C(O)H, -CH2OR12, -OR12,-SR12, -NR12R13 и -C=N-OR12. Термин "пролекарства" описывает производные соединений по изобретению, которые содержат химически или метаболически отщепляемые группы и превращаются в результате сольволиза или при физиологических условиях в соединения по изобретению, которые обладают фармацевтической активностью in vivo. Производные соединений по настоящему изобретению проявляют активность в форме производных кислот и оснований, но форма кислого производного часто обеспечивает преимущество растворимости,совместимости с тканями или отсроченного высвобождения в организме млекопитающего (см.Bundgard, H., Design of Prodrugs, p. 7-9, 21-24, Elsevier, Amsterdam 1985). Пролекарства включают производные кислот, такие как эфиры, полученные реакцией кислотного исходного соединения с подходящим спиртом, или амиды, полученные реакцией кислотного исходного соединения с подходящим амином. Простые алифатические эфиры (например, метиловый, этиловый, пропиловый, изопропиловый, бутиловый, втор-бутиловый, трет-бутиловый) или ароматические эфиры, полученные в результате взаимодействия с кислотными группами в соединениях по настоящему изобретению, представляют собой предпочтительные пролекарства. Другие предпочтительные эфиры включают морфолиноэтокси, диэтилгликольамид и диэтиламинокарбонилметокси. В некоторых случаях желательным является получение пролекарства по типу двойного эфира, такого как (ацилокси)алкильные эфиры или алкоксикарбонилокси)окси)алкильные эфиры. В данном описании термин "защитная группа" обозначает группу, пригодную для маскировки реакционноспособных участков молекулы с целью повышения реакционноспособности другой группы или осуществления реакции на другом целевом участке или участках, после который защитная группа может быть удалена. Защитные группы обычно используются, чтобы защитить или замаскировать функциональные группы, в том числе, не ограничиваясь ими, -ОН, -NH и -СООН. Подходящие защитные группы известны специалисту в данной области из уровня техники и описаны в Protecting groups in Organic-6 014470 В данном описании термин "сольват" обозначает кристалл (или кристаллы) соединения по изобретению, образованный таким образом, что он включает стехиометрическое или нестехиометрическое количество соединения формулы I и молекулы растворителя. Типичные сольватирующие растворители включают, например, воду, метанол, эфир, этанол, этилацетат, ацетон, ацетонитрил и диметилформамид. Если растворитель представляет собой воду, необязательно может применяться термин "гидрат" для обозначения стехиометрического или нестехиометрического количества соединения и воды (или "гемигидрат" для обозначения половины от стехиометрического количества воды). В тех случаях когда соединение по изобретению содержит кислотные или основные функциональные группы, могут быть образованы различные соли, которые обладают лучшей водорастворимостью и/или физиологической совместимостью, чем исходное соединение. Соли получают подходящими способами, известными из уровня техники, например обрабатывая кислотное соединение основанием или подвергая кислотное соединение действию ионообменной смолы. В определение фармацевтически приемлемых солей включены аддитивные соли относительно нетоксичных неорганических и органических оснований или кислот и соединений по настоящему изобретению (см., например, соли, описанныеProperties, Selection, and Use", Wermuth, C.G. and Stahl, P.H. (eds.) Verlag Helvtica Chimica Acta, 2002, которые включены в данное описание путем ссылки). Обычно используемые основно-аддитивные соли включают, например, соли, образованные аргинином, бенетамином, бензатином, диэтаноламином, диэтиламином, этилендиамином, меглумином, лизином, магнием, пиперазином, кальцием, калием, натрием, трометамином и цинком, а также соли аммония, четверичного аммония и катионов аминной природы, полученных из азотистых оснований достаточной основности, чтобы образовать соли с соединениями по настоящему изобретению. Кроме того, основная группа(ы) соединения по изобретению может(гут) реагировать с подходящими органическими или неорганическими кислотами с образованием солей. Обычно используемые кислотно-аддитивные соли включают, например, ацетат, адипат, бензолсульфонат, бензоат, цитрат, этансульфонат, фумарат, D-глюконат, бромид, хлорид, лактат, лактобионат,малеат, метансульфонат, нафталин-2-сульфонат, соли фосфорной, янтарной, серной, винной и п-толуолсульфоновой кислот. Соединение, представленное формулой I, может существовать в форме любого из его стереохимических изомеров, изомеров положения или региоизомеров, все из которых включены в настоящее изобретение. Некоторые соединения по изобретению могут включать один или более хиральных центров и,таким образом, могут существовать в оптически активных формах. Дополнительные асимметрические атомы углерода могут присутствовать в группе заместителя, такой как алкильная группа. ИзомерыR- и S- и их смеси, в том числе рацемические смеси, а также смеси энантиомеров или цис- и трансизомеров включены в данное изобретение. Подобным образом, если соединения содержат алкинил, алкинилен, оксимы и группу O-алкилированного оксима, существуют возможность существования цис- и транс-изомерных форм соединений. Все такие изомеры, а также их смеси включены в изобретение. Если желательно получение конкретного изомера, он может быть получен по способам, хорошо известным из уровня техники, с использованием стереоспецифических реакций исходных материалов, которые содержат асимметрические центры и уже разделены. Альтернативно, целевой стереоизомер может быть получен по способам, которые приводят к образованию смесей стереоизомеров, с последующим разделением известными способами. Например, рацемическая смесь может реагировать с единственным энантиомером некоторого другого соединения, т.е. хиральным агентом разделения. Дальнейшее описание ссылается на предпочтительные соединения по настоящему изобретению,которые представлены формулой IR1-R8 являются такими, как описано в данном изобретении,и фармацевтически приемлемые соли формулы I. Соединения по настоящему изобретению, которые конкретно представлены в примерах и/или описаны в данном описании, называются и нумеруются с использованием "AUTONOM" для ISIS/Draw, версия 2.5 SP1 или CHEMDRAW ULTRA AUTONOM, версия 7.0.1. Предпочтительные соединения по изобретению приведены в представленных ниже таблицах, включенных в данное описание, и могут также включать сольваты фармацевтически приемлемых солей, их энантиомеры, рацематы, диастереомеры и смеси диастереомеров. Геометрические изомеры, связанные с двойными связями, и оптические изомеры, связанные с асимметрическими атомами углерода соединений формулы I, также входят в объем данного изобретения как пригодные для лечения заболеваний, связанных с модуляцией рецептора PR.-7 014470 Общая схема синтеза индольных промежуточных соединений для использования в настоящем изобретении. Соединения по настоящему изобретению могут быть синтезированы, как показано на следующих схемах, в примерах и общих методиках. Однако последующее обсуждение не предназначено для ограничения контекста настоящего изобретения каким-либо способом, поскольку специалист в данной области может без ненужного экспериментирования экстраполировать приведенные в данном описании схемы и примеры на другие конкретные соединения в пределах данного изобретения. Многие реактивы и исходные материалы могут быть легко получены от коммерческих поставщиков или легко доступны специалисту в данной области. Другие необходимые реактивы и исходные материалы могут быть получены по методикам, выбранным из числа стандартных способов органической химии и химии гетероциклических соединений, способов, аналогичных способам синтеза известных подобных реактивов или исходных материалов, и методикам, описанным в получениях и примерах ниже, в том числе любых новых методик. Обозначения R, R1, R2, R3, R4, R5, R6 и т.д., используемые в пределах следующего раздела, применяются с целью иллюстрации различных способов синтеза соединений по изобретению и/или иллюстрации вариабельности заместителей в боковой цепи макромолекулы и не обязательно являются синонимами, в контексте или по значению, подобных групп, используемых в общей структуре соединений формулы I. Однако группы в конечных соединениях на схемах, занимающих сходные положения, являются расширительными, в контексте и по значению, по сравнению с группами, занимающими подобное положение,как определено для общей структуры соединений формулы I. Описаны конкретные примеры каждого из способов, перечисленных на схемах 1-5. Понятно, что условия, т.е. конкретные значения температуры(интервалы), растворители, длительность реакции и т.п., могут быть изменены квалифицированными специалистами в данной области для получения всех конкретных соединений, описанных в данном описании. Поэтому способы и примеры предлагают общие методики, которые могут использоваться для получения соединений по настоящему изобретению. В данном описании используются следующие термины и сокращения в значениях, определенных ниже.-8 014470 Схема 1 иллюстрирует общие стратегии синтеза для получения некоторых индольных промежуточных соединений, которые могут быть использованы для синтеза 6-сульфонамидных соединений в соответствии с настоящим изобретением. Примеры получения конкретных соединений приведены ниже в примерах и таблицах. "Способы", обозначенные полужирным начертанием шрифта, используемым (в дополнение к реагентам) на схемах, более подробно описаны в примерах. Методики, описанные для указанных "способов", могут использоваться в качестве общих методик для получения соединений, примеры которых приведены в описании. Схема 1 3-Бром-6-нитро-1H-индол (2) Добавляют N-бромсукцинамид (NBS) к 6-нитроиндолу 1 (22,72 г, 140,12 ммоль) растворяют в тетрагидрофуране (600 мл) и перемешивают полученную смесь в течение 18 ч. Заливают реакционную смесь насыщенным водным раствором натрия тиосульфата (600 мл), разбавляют этилацетатом (EtOAc)(600 мл) и фракции разделяют. Последовательно промывают органическую фракцию насыщенным водным раствором натрия бисульфата (100 мл), насыщенным водным раствором бикарбоната натрия(100 мл), водой (100 мл) и солевым раствором (100 мл). Сушат полученную органическую фракцию надNa2SO4 и фильтруют. Упаривают фильтрат с получением твердого вещества желтого цвета. Перекристаллизовывают твердое вещество из смеси дихлорметана и гексана с получением 29,21 г названного в заголовке соединения (86%). ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=263,0 (M+Na).-9 014470 3-Бром-1-метил-6-нитро-1H-индол (3, R1=Me) Способ А. Добавляют 1 М раствор литиия гексаметилдисилазида в смеси тетрагидрофурана (31,2 мл,31,17 ммоль) и метилиодида (2,6 мл, 41,56 ммоль) к раствору 3-бром-6-нитро-1 Н-индола 2 (5,01 г,20,78 ммоль) в N,N-диметилформамида (100 мл) при 0 С. Нагревают реакционную смесь до комнатной температуры и перемешивают в течение 5 ч. Заливают насыщенным водным раствором хлорида аммония(100 мл), разбавляют этилацетатом (200 мл) и фракции разделяют. Последовательно промывают органическую фракцию 10% водным раствором хлорида лития (75 мл), насыщенным водным раствором бикарбоната натрия (75 мл), водой (275 мл) и солевым раствором (75 мл). Сушат полученную органическую фракцию над Na2SO4 и фильтруют. Фильтрат упаривают с получением остатка. Остаток с неочищенным продуктом адсорбируют на силикагеле. Хроматографируют остаток на колонке с силикагелем, элюируя дихлорметаном в гексане (5-50% об./об.) с получением 4,13 г названного в заголовке соединения (78%). ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=255,0 (М+Н). 3-Бром-1-изопропил-6-нитро-1H-индол (3', R1=изо-Pr) Получают по методике, описанной выше (способ А) для 3-бром-1-метил-6-нитро-1 Н-индола (3), со следующими модификациями: используют изопропилиодид вместо метилиодида и перемешивают реакционную смесь при комнатной температуре в течение 18 ч. Далее добавляют 1 М раствор лития гексаметилдисилазида в смеси тетрагидрофурана (15,5 мл, 15,5 ммоль) и изопропилиодида (2,1 мл, 20,74 ммоль). Нагревают полученную смесь до 40 С и перемешивают в течение 6 ч. Охлаждают смесь до комнатной температуры и очищают продукт, как описано выше, с получением 4,37 г названного в заголовке соединения (74%). ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=285,0 (М+Н). 3-Бром-1-изобутил-6-нитро-1H-индол (3, R1=изо-Bu) Способ В. Добавляют NaH (1,2 экв.) к раствору 3-бром-6-нитроиндола 2 (15 г, 62 ммоль) в 250 мл ДМФА. Перемешивают реакционную смесь в течение 1 ч, после чего добавляют изобутилиодид (17,2 мл,149 ммоль, 2,4 экв.). Полученный раствор перемешивают при комнатной температуре. Когда красный цвет, связанный с анионом, превратится в коричневый, добавляют дополнительно NaH и изобутилиодид до тех пор, пока большая часть исходного материала прореагирует. Добавляют 600 мл 5 М раствораNaOH и экстрагируют 2200 мл эфира (Et2O). В результате образуется трехслойный раствор, где продукт находится в слое Et2O, а исходный материал - в среднем слое, вода/ДМФА. Объединяют Et2O экстракты и промывают 5 M раствором NaOH, водой (2) и солевым раствором. Сушат органические фракции надNa2SO4, фильтруют и упаривают. Перекристаллизовывают из смеси CH2Cl2/гексан с получением 15,73 г,52,9 ммоль, 85% названного в заголовке соединения. 1 Н ЯМР (CDCl3)8,28 (д, 1 Н, J=2,2 Гц), 8,04 (дд, 1 Н, J=1,8, 8,8 Гц), 7,59 (д, 1 Н, J=8,8 Гц), 7,35 (с,1 Н), 3,96 (д, 2 Н, J=8,8 Гц), 2,18 (м, 1 Н), 0,93 (д, 6 Н, J=6,6 Гц). Альтернативно, заместитель R1 может быть присоединен к индолу в положении N1 с использованием способа L, описанного ниже для 4-[1-(3-метилбутил)-6-нитро-1H-индол-3-ил]бензонитрила (11,R1=изо-Pr). Следующие 2 способа иллюстрируют альтернативные методики синтеза, дающие промежуточное соединение, индол 3. 3-Бром-1-[(S)-втор-бутил]-6-нитро-1 Н-индол (3'", R1=(S)-втор-Bu) Способ ВВ. Добавляют трифенилфосфин (19,04 г, 72,60 ммоль) и (R)-2-бутанол (6,14 мл, 66,38 ммоль) к дихлорметановому (400 мл) раствору, содержащему 3-бром-6-нитро-1 Н-индол (10,00 г, 41,49 ммоль). Охлаждают полученную смесь до 0 С и при перемешивании добавляют диизопропилазодикарбоксилат(13,98 мл, 70,53 ммоль) в виде раствора в дихлорметане (50 мл) на протяжении 45 мин. По окончании добавления ледяную баню удаляют и перемешивают реакционную смесь в течение 3,5-4 ч при комнатной температуре. Упаривают сырую реакционную смесь под вакуумом и очищают полученное масло флэш-хроматографией (силикагель, загружают 30% CH2Cl2/гексан; градиент 15-35% CH2Cl2 в гексане). Получают продукт (8,83 г, 72%) в виде желтого кристаллического твердого вещества. 1 Н ЯМР (CDCl3)8,34 (д, 1 Н, J=2,0 Гц), 8,04 (дд, 1 Н, J=8,8, 2,0 Гц), 7,59 (д, 1 Н, J=8,8 Гц), 7,45 (с,1 Н), 4,47 (секстет, 1 Н, J=6,9 Гц), 1,89 (квинтет, 2 Н, J=6,9 Гц), 1,53 (д, 3 Н, J=6,9 Гц), 0,84 (т, 3 Н,J=7,5 Гц); Способ ВВ. Добавляют трифенилфосфин (20,64 г, 78,69) ммоль и (S)-2-бутанол (6,11 мл, 66,52 ммоль) к дихлорметановому (400 мл) раствору, содержащему 3-бром-6-нитро-1 Н-индол (10,02 г, 41,57 ммоль). Охлаждают полученную смесь до 0 С и при перемешивании добавляют диизопропилазодикарбоксилат(10,71 мл, 54,02 ммоль) в виде раствора в дихлорметане (20 мл) на протяжении 15 мин. По окончании добавления ледяную баню удаляют и перемешивают реакционную смесь в течение 3,5-4 ч при комнатной температуре. Упаривают сырую реакционную смесь под вакуумом, после чего очищают полученное масло флэш-хроматографией (силикагель, загружают 30% H2Cl2/гексан; градиент 15-35% CH2Cl2 в гексане) с получением 8,46 г (68%) продукта в виде желтого кристаллического твердого вещества. 1 Н ЯМР (CDCl3)8,34 (д, 1 Н, J=2,0 Гц), 8,04 (дд, 1 Н, J=8,8, 2,0 Гц), 7,59 (д, 1 Н, J=8,8 Гц), 7,45 (с,1 Н), 4,47 (секстет, 1 Н, J=6,9 Гц), 1,89 (квинтет, 2 Н, J=6,9 Гц), 1,53 (д, 3 Н, J=6,9 Гц), 0,84 (т, 3 Н, J=7,5 Гц); МС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом) отношение массы к заряду 297 (М+1, 79Br), 299 (М+1, 81Br). 1-Изопропил-6-нитро-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1H-индол (4, R1=изо-Pr) Способ DD. В колбу объемом 500 мл помещают высушенный под вакуумом ацетат калия (37,50 г,382,00 ммоль), 3-бром-1-изопропил-6-нитро-1 Н-индол, 3' (32,40 г, 114,50 ммоль), бис-(пинаколят)дибор(430 мл). Нагревают полученную смесь на масляной бане до 85 С и перемешивают смесь в течение ночи. Охлаждают реакционную смесь темного цвета до комнатной температуры, заливают обильным количеством воды и экстрагируют полученную водную смесь дихлорметаном. Промывают объединенные экстракты водой и солевым раствором. Сушат полученную органическую фракцию над сульфатом натрия,фильтруют и фильтрат упаривают под вакуумом. Полученное загрязненное масло очищают флэшхроматографией (силикагель; загружают 30% CH2Cl2/гексан, градиент 2,5-20% этилацетата в гексане). Материал с этой колонки может быть дополнительно очищен флэш-хроматографией (силикагель, градиент 30-60% CH2Cl2 в гексане) с получением продукта (22,7 г, 60%) в виде желтого кристаллического твердого вещества. 1 Н ЯМР (CDCl3)8,32 (арр. с, 1 Н), 8,03-8,04 (м, 2 Н), 7,90 (с, 1 Н), 4,69-4,79 (м, 1 Н), 1,56 (д, 6 Н,J=6,7 Гц), 1,35 (ушир.с, 12 Н); МС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом) отношение массы к заряду 331 (М+1). 5-(1-Изопропил-6-нитро-1H-индол-3-ил)пиридин-2-карбонитрил (5, R1=изо-Pr, R3=2-цианопиридин) Названное в заголовке соединение получают из 1-изопропил-6-нитро-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1 Н-индола (4, R1=изо-Pr) и 5-бром-2-цианопиридина с использованием способа D, описанного ниже. ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=307,0 (М+Н). Альтернативно, нитрогруппа может быть превращена в сульфонамид на индольном ядре с получением промежуточных соединений, имеющих структуру, показанную для соединения 100 на схеме 1 выше, с использованием способа Н и способа I для 6-амино-1-изопропил-3-(3,4,5-трифторфенил)-1Hиндола и N-[1-изопропил-3-(3,4,5-трифторфенил)-1H-индол-6-ил]метансульфонамида (6, R1=изо-Pr,R3=3,4,5-трифторфенил, R6=Me) соответственно, как описано ниже. 4-(1-Изопропил-6-нитро-1H-индол-3-ил)бензонитрил (5, R1=изо-Pr, R3=4-бензонитрил) Способ С. Объединяют 3-бром-1-изопропил-6-нитро-1 Н-индол, 3', (350 мг, 1,24 ммоль), трис-(дибензилиденацетон)дипалладий(0) (110 мг, 0,12 ммоль), три-трет-бутилфосфония тетрафторборат (70 мг,0,24 ммоль), 4-цианофенилбороновую кислоту (364 мг, 2,48 ммоль), калия фторид (216 мг, 3,72 ммоль) и тетрагидрофуран (6 мл) в атмосфере азота в колбе объемом 50 мл. Нагревают реакционную смесь до 40 С, выдерживая при этой температуре в течение 18 ч. Охлаждают реакционную смесь до комнатной температуры и фильтруют через слой целита. Промывают слой целита этилацетатом (200 мл). Затем фильтраты собирают и упаривают. Очищают осаждением или кристаллизацией из этилацетата с получением 260,2 мг названного в заголовке соединения (69%). ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=306,0 (М+Н).(3', R1=изо-Pr) (194,5 мг, 0,5 ммоль), арилборной кислоты (0,75 ммоль) и KF2H2O (141 мг, 1,5 ммоль) в 5 мл [1,4]диоксана в атмосфере N2. Нагревают реакционную смесь до 80 С и перемешивают при этой температуре в течение ночи. Выпаривают растворитель под вакуумом. Растворяют остаток в этилацетате(10 мл), затем промывают водой (5 мл). Упаривание органической фракции и очистка с использованием колоночной хроматографии дает целевое соединение (50-80%). 2-Фтор-4-(6-нитро-1H-индол-3-ил)бензонитрил (9F)A. Растворяют 2-фтор-4-бромбензонитрил (200 г, 990 ммоль, 1,00 экв.) и триизопропилборат (228 г,1188 ммоль, 1,2 экв.) в 700 мл ТГФ и 1400 мл толуола. Охлаждают смесь на бане со смесью сухой лед/ацетон до внутренней температуры -75 С. Медленно добавляют H-BuLi (396 мл 2,5 М раствора в гексане) на протяжении 2 ч. По окончании добавления образуется тонкая суспензия светло-красного цвета. Раствор перемешивают при -74 С, выдерживая при этой температуре в течение 15 мин, дают раствору нагреться до -20 С, после чего заливают 1500 мл 2,5 М HCl. Дают раствору нагреться до комнатной температуры. Фракции разделяют, водную фракцию экстрагируют EtOAc, объединенные органические фракции сушат с помощью Na2SO4, фильтруют и упаривают под вакуумом с получением твердого вещества светло-коричневого цвета. Твердое вещество растирают с гексаном и переносят в воронку со стеклянным фильтром. Промывают еще раз гексаном с получением бледно-желтого фильтрата. Перемешивают твердое вещество светло-коричневого цвета с холодным CH2Cl2 и фильтруют. Промывают небольшим количеством CH2Cl2 с получением твердого вещества практически белого цвета и коричневого фильтрата. Сушат твердое вещество в вакуумной печи при температуре 40 С с получением 112 г(679 ммоль, 69%) 3-фтор-4-цианофенилбороновой кислоты в виде твердого вещества практически белого цвета.B. 4-(1-Бензолсульфонил-6-нитро-1 Н-индол-3-ил)-2-фторбензонитрил получают из 1-бензолсульфонил-3-бром-6-нитро-1 Н-индола (7) и 3-фтор-4-цианофенилбороновой кислоты с использованием способа АА: Pd2(dba)3, [(трет-Bu3)РН]BF4, K2CO3, ТГФ, H2O. Очищают осаждением из смесиEtOAc/гексан. Удаляют бензолсульфонильную защитную группу с использованием ТБАФ и ТГФ, как описано для 4-(6-нитро-1H-индол-3-ил)бензонитрила (9) ниже. ЖХМС (ионизация при атмосферном давлении ES-)=280,0 (М-1). 1-Изопропил-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1 Н-индол-6-иламин Способ Р. Добавляют раствор 1-изопропил-6-нитро-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2 ил)-1 Н-индол, (4, R1=изо-Pr) (14,48 г, 43,88 ммоль) в этаноле к суспензии 5% палладия на угле (1,44 г) и этанола в реакционном сосуде Парра. Помещают содержимое сосуда в атмосферу водорода(60 фунт/дюйм 2) и встряхивают на шейкере Парра при комнатной температуре в течение 18 ч. По истечении 18 ч содержимое реакционного сосуда фильтруют через слой целита и упаривают полученный фильтрат под вакуумом. Полученный сырой кристаллический материал светло-розового цвета (11,84 г,90%) может быть использован без дополнительной очистки. 1 Н ЯМР (ДМСО-d6)7,39 (с, 1 Н), 7,39 (д, 1 Н, J=8,3 Гц), 6,54 (д, 1 Н, J=1,8 Гц), 6,41 (дд, 1 Н,J=8,3 Гц, 1,8 Гц), 4,73 (ушир.с, 2 Н), 4,37 (септет, 1 Н, J=6,8 Гц), 1,37 (д, 6 Н, J=6,8 Гц), 1,23 (ушир.с, 12 Н); МС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом) отношение массы к заряду 301 (М+1).I. В круглодонную колбу помещают 1-изопропил-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1 Н-индол-6-иламин (11,83 г, 39,43 ммоль), дихлорметан (400 мл) и пиридин (6,40 мл, 78,87 ммоль). Охлаждают полученный раствор до 0 С; при перемешивании медленно добавляют метансульфонилхлорид (12,20 мл, 157,73 ммоль). Перемешивают реакционную смесь в течение ночи, позволяя ей достичь комнатной температуры. Гасят реакцию насыщенным водным раствором бикарбоната натрия. Экстрагируют полученную водную фракцию дихлорметаном. Объединяют экстракты и промывают объединенные экстракты насыщенным водным раствором бикарбоната натрия, водой и солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Очищают полученное твердое вещество флэш-хроматографией (силикагель; градиент 65-100% дихлорметана в гексане, затем градиент до 2,5% этилацетата в дихлорметане) с получением 12,0 г (80%) продукта в виде светло-розовой твердой пены. 1 Н ЯМР (CDCl3)7,96 (д, 1 Н, J=8,4 Гц), 7,69 (с, 1 Н), 7,39 (д, 1 Н, J=1,9 Гц), 6,88 (дд, 1 Н, J=8,4 Гц,1,9 Гц), 6,38 (ушир.с, 1 Н), 4,56 (септет, 1 Н, J=6,8 Гц), 2,91 (с, 3 Н), 1,49 (д, 6 Н, J=6,8 Гц), 1,34 (с, 12 Н); МС (IS-) отношение массы к заряду 377 (М-1).(240 мкл, 1,96 ммоль), толуол (4 мл), этанол (4 мл) и 2 М водный раствор натрия карбоната (1,7 мл,3,43 ммоль) в колбе объемом 50 мл, оборудованной обратным холодильником. Помещают колбу в атмосферу азота и добавляют тетракис-(трифенилфосфин)палладий(0) (58 мг, 0,05 ммоль). Кипятят реакционную смесь с обратным холодильником в течение 4 ч, затем охлаждают до комнатной температуры. Фильтруют раствор через слой целита, который промывают этилацетатом (50 мл). Промывают объединенные фильтраты насыщенным водным раствором бикарбоната натрия (20 мл), водой (20 мл), солевым раствором (20 мл). Сушат полученный органический раствор над Na2SO4 и фильтруют. Упаривают фильтрат и адсорбируют полученный остаток на силикагель. Хроматографируют остаток на колонке с силикагелем, элюируя дихлорметаном в гексане (2-50% об./об.) с получением 140,7 мг названного в заголовке соединения (43%). ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=335,0 (М+Н). 4-(1-Изопропил-6-нитро-1H-индол-3-ил)фталонитрил (5, R1=изо-Pr, R3=фталонитрил) Способ О. Помещают 1-изопропил-6-нитро-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1H-индол (4)(4 мл) и пропускают азот через раствор на протяжении 15 мин. Добавляют цезия фторид (446 мг, 2,936 ммоль), помещают реакционный сосуд на масляную баню,которую предварительно нагревают до 90 С, и перемешивают в течение 30 мин. Охлаждают реакционную смесь до комнатной температуры, выливают в воду (15 мл) и экстрагируют водную фракцию CH2Cl2(215 мл). Сушат полученный органический раствор над Na2SO4, фильтруют и упаривают под вакуумом. Растирают полученный остаток с CH2Cl2 и гексаном с получением 102 мг названного в заголовке соединения (95%) в виде твердого вещества желтого цвета. 1 Н ЯМР (ДМСО-d6)8,705 (с, 1 Н), 8,640 (д, 1 Н, J=2,1 Гц), 8,506 (д, 1 Н, J=1,8 Гц), 8,280 (дд, 1 Н,J=1,8, 8,5 Гц), 8,191 (д, 1 Н, J=9,1 Гц), 8,137 (д, 1 Н, J=8,5 Гц), 8,015 (дд, 1 Н, J=2,1, 9,1 Гц), 5,072 (квинтет,1 Н, J=6,7 Гц), 1,511 (д, 6 Н, J=6,7 Гц). 4-(1-Изопропил-6-нитро-1H-индол-3-ил)-3-метил-5-карбонитрилтиофен-2-ил (5, R1=изо-Pr,R3=3-метил-5-карбонитрилтиофен-2-ил) Способ АА. Объединяют 1-изопропил-6-нитро-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1H-индол (4,R1=изо-Pr) (1,1 г, 1,00 экв., 3,5 ммоль), 5-бром-4-метил-2-тиофенкарбонитрил (0,7 г, 1,00 экв., 3,5 ммоль) и карбонат калия (1,0 г, 2,2 экв., 7,6 ммоль) в смеси ТГФ (10 мл) и воды (5 мл). Смесь продуваютN2 в течение 20 мин с помощью постоянного потока N2 под поверхностью. Затем добавляют трис-(дибензилиденацетон)дипалладий(0) (158 мг, 0,05 экв., 170 мкмоль) и три-трет-бутилфосфония тетрафторборат (101 мг, 0,1 экв., 350 мкмоль), и нагревают смесь до 40 С в герметично закупоренной емкости в атмосфере N2. Протекание реакции контролируют с помощью ТСХ (30% EtOAc/гексан); когда не остается исходного материала, охлаждают смесь до комнатной температуры и добавляют 10 мл этилацетата. Промывают смесь водой, затем солевым раствором и сушат над MgSO4. MgSO4 удаляют фильтрацией и фильтрат упаривают под вакуумом с получением твердого вещества. Перекристаллизовывают твердое вещество из смеси дихлорметан/гексан. Выход 0,789 г (70%). ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=326,0 (М+Н). 1-Изопропил-3-[5-(3-метил-1H-тетразол-5-ил)тиофен-2-ил]-6-нитро-1 Н-индол Способ СС. В колбу объемом 50 мл, оборудованную обратным холодильником, помещают 1-изопропил-6 нитро-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1H-индол (4, R1=изо-Pr) (700 мг, 2,1 ммоль),5-(5-бромтиофен-2-ил)-1-метил-1 Н-тетразол (466 мг, 1,9 ммоль), трис-(дибензилиденацетон)дипалладий(0) (17 мг, 0,019 ммоль) и трициклогексилфосфин (13 мг, 0,0047 ммоль) в диоксане (5,5 мл). Трижды дегазируют в атмосфере азота; затем добавляют 1,3 М водный раствор фосфата калия (2,5 мл,3,2 ммоль) в колбу объемом 50 мл, оборудованную обратным холодильником. Нагревают реакционную смесь до 100 С, выдерживая при этой температуре в течение 4 ч. Охлаждают реакционную смесь до комнатной температуры, разбавляют водой (20 мл) и этилацетатом (20 мл); после чего фракции разделяют. Трижды экстрагируют водную фракцию этилацетатом (10 мл). Органические фракции объединяют; сушат над MgSO4; удаляют твердое вещество фильтрацией и фильтрат упаривают под вакуумом. Очищают хроматографией на колонке с силикагелем, элюируя этилацетатом в гексане с получением 0,3 г (39%)- 13014470 названного в заголовке материала. 1 Н ЯМР (CDCl3)8,39 (с, 1 Н), 8,09 (д, 1 Н, J=9,1 Гц), 8,02 (д, 1 Н, J=9,1 Гц), 7,78 (д, 1 Н, J=3,9 Гц),7,75 (с, 1 Н), 7,28 (д, 1 Н, J=3,9 Гц), 4,79 (квинтет, 1 Н, J=6,5 Гц), 4,37 (с, 3 Н), 1,62 (д, 6 Н, J=6,5 Гц). Общий синтез индолов для применения по данному изобретению. Схема 2 иллюстрирует дополнительные стратегии синтеза для получения индолов 6 из индольных промежуточных соединений, синтезированных выше. Некоторые из способов, обозначенные на схеме полужирным начертанием шрифта, описаны выше; другие способы описаны ниже, после схемы. Схема 2(250 мг, 0,82 ммоль) в колбу объемом 50 мл и добавляют суспензию оксида платины(II) (16 мг) в тетрагидрофуран (9 мл). Помещают реакционную смесь в атмосферу водорода с давлением 1 атм и перемешивают до тех пор, пока исходный материал не прореагирует. Фильтруют через слой целита, который промывают этилацетатом (50 мл). Упаривают объединенные фильтраты с получением 225,0 мг названного в заголовке соединения (99%). ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=276,0 (М+Н). 5-(6-Амино-1-изопропил-1H-индол-3-ил)пиридин-2-карбонитрил Способ F. Названное в заголовке соединение может быть получено из 5-(1-изопропил-6-нитро-1 Н-индол-3 ил)пиридин-2-карбонитрила (4, R1=изо-Pr, R3=5-(2-цианопиридин по способу, в значительной мере сходному с описанным выше для 4-(6-амино-1-изопропил-1H-индол-3-ил)бензонитрила, за исключением того, что Degussa тип Е 101 NE/W 10% палладий на активированном угле может быть использован взамен оксида платины(II) в способе Е. ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=277,0 (М+Н). 5-(6-Амино-1-изопропил-1H-индол-3-ил)тиофен-2-карбонитрил Способ G. Добавляют N,N-диметилформамид (2 мл) и дигидрат дихлорида олова(II) (992 мг,4,40 ммоль) в колбу объемом 50 мл, где находится 5-(1-изопропил-6-нитро-1 Н-индол-3-ил)тиофен-2 карбонитрил (4, R1=изо-Pr, R3=2-цианотиофен) (136,3 мг, 0,44 ммоль) в атмосфере азота. Нагревают до 60 С и перемешивают в течение 45 мин. Охлаждают до комнатной температуры и заливают насыщенным водным раствором бикарбоната натрия (15 мл). Фильтруют через слой целита, который промывают этилацетатом (100 мл). Промывают объединенные фильтраты насыщенным водным раствором бикарбоната натрия (20 мл), водой (20 мл), солевым раствором (20 мл), сушат (Na2SO4) и фильтруют. Фильтрат упаривают с получением 107,9 мг названного в заголовке соединения (87%). ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=282,0 (М+Н).- 14014470 6-Амино-1-изопропил-3-(3,4,5-трифторфенил)-1H-индол Способ Н. Помещают 1-изопропил-6-нитро-3-(3,4,5-трифторфенил)-1H-индол (4, R1=изо-Pr, R3=3,4,5 трифторбензол) (136,1 мг, 0,41 ммоль), тетрагидрат ацетата никеля(II) (204 мг, 0,82 ммоль), тетрагидрофуран (2,5 мл) и метанол (2,5 мл) в колбу объемом 50 мл. Добавляют натрия боргидрид (62 мг,1,64 ммоль) маленькими порциями. Как только выделение газа прекращается, гасят реакцию насыщенным водным раствором хлорида аммония (5 мл), разбавляют этилацетатом (10 мл) и фракции разделяют. Промывают органическую фракцию насыщенным водным раствором бикарбоната натрия (5 мл), водой(5 мл), солевым раствором (5 мл), сушат (Na2SO4), фильтруют и упаривают. Полученный материал может использоваться без дополнительной очистки в следующем примере.N-[1-Изопропил-3-(3,4,5-трифторфенил)-1H-индол-6-ил]метансульфонамид (6, R1=изо-Pr,R3=3,4,5-трифторфенил, R6=Me) Способ I. Помещают 6-амино-1-изопропил-3-(3,4,5-трифторфенил)-1H-индол (116,6 мг, 0,38 ммоль), полученный, как описано выше, дихлорметан (3,0 мл) и пиридин (62 мкл, 0,76 ммоль) в атмосфере азота в колбу объемом 25 мл. Охлаждают реакционную смесь до 0 С и добавляют метансульфонилхлорид(33 мкл, 0,42 ммоль). Дают реакционной смеси нагреться до комнатной температуры при перемешивании в течение 3 ч. Гасят реакцию насыщенным водным раствором бикарбоната натрия (5 мл), разбавляют этилацетатом (10 мл) и фракции разделяют. Промывают органическую фракцию водой (5 мл), солевым раствором (5 мл), сушат (Na2SO4) и фильтруют. Упаривают фильтрат и адсорбируют сырой продукт на силикагель. Очищают хроматографией на силикагеле, элюируя этилацетатом в дихлорметанеN-[3-(5-Хлортиофен-2-ил)-1-изопропил-1H-индол-6-ил]метансульфонамид (6, R1=изо-Pr,R3=5-хлортиофен-2-ил и R6=метил) Способ J. Помещают N-[1-изопропил-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1 Н-индол-6-ил]метансульфонамид (266 мг, 0,70 ммоль), карбонат калия (242 мг, 1,75 ммоль), 2-бром-5-хлортиофен (207 мг,1,05 ммоль), диоксан (6 мл) и воду (1 мл) с последующим добавлением тетракис(трифенилфосфин)палладия(0) (20 мг, 0,018 ммоль) в закупоренную пробирку в атмосфере азота. Нагревают реакционную смесь до 100 С, выдерживая при этой температуре в течение ночи, затем охлаждают до комнатной температуры. Разбавляют реакционную смесь этилацетатом и последовательно промывают полученную смесь водой и солевым раствором. Сушат органическую фракцию над MgSO4. Хроматографируют сырой остаток на колонке с силикагелем, элюируя гексаном и этилацетатом (градиент) с получением 89 мг (34%) названного в заголовке соединения. 1 Н ЯМР (CDCl3)7,79 (д, 1 Н, J=8,8 Гц), 7,42 (д, 1 Н, J=1,8 Гц), 7,35 (с, 1 Н), 6,97 (дд, 1 Н, J=2,0,8,6 Гц), 6,93 (д, 1 Н, J=4,0 Гц), 6,88 (д, 1 Н, J=4,0 Гц), 4,50-4,67 (м, 1 Н), 2,97 (с, 3 Н), 1,52 (д, 6 Н, J=6,6 Гц). Альтернативно, заместитель R3 может быть присоединен к индолу в положении 3 с использованием способа Q, описанного ниже для N-[3-(2-цианофенил)-1-изопропил-1 Н-индол-6-ил]метансульфонамида(4,25 мг, 0,018 ммоль; 4,25 мг), 2-(дифенилфосфино)-2'-(N,N-диметиламино)бифенил (11,5 мг,0,030 ммоль), фосфат калия (84,2 мг, 0,396 ммоль) и 1,4-диоксан (1,00 мл) в емкость для обработки микроволнами объемом 10 мл, оборудованную мешалкой. Продувают реакционную смесь азотом, после чего сосуд закупоривают крышкой. Сосуд помещают в микроволновой реактор при температуре 150 С, выдерживая при этой температуре в течение 15 мин с нагреванием мощностью 250 Вт. Протекание реакции контролируют с использованием ЖХ/МС. Охлаждают реакционную смесь до комнатной температуры и гасят насыщенным водным раствором хлорида аммония. Экстрагируют полученную смесь этилацетатом. Промывают объединенные экстракты насыщенным водным раствором хлорида аммония, водой и солевым раствором. Сушат полученный раствор над сульфатом натрия (в гранулах) и упаривают под вакуумом. Растворяют полученное твердое вещество в дихлорметане и очищают на хроматотроне (1 ММ пластина силикагеля) градиент 0-2% этилацетата в дихлорметане. Может возникнуть необходимость во втором цикле очистки. В таком случае очищают материал, элюируя с градиентом 30-40% этилацетата в гексане с получением N-[3-(4-циано-2-метилфенил)-1-изопропил-1 Н-индол-6-ил]метансульфонамид, 35 мг(75%) в виде твердого вещества практически белого цвета.N-[3-(2-Тиоамидфенил)-1-изопропил-1 Н-индол-6-ил]метансульфонамид (6, R1=изо-Pr,R3=2-тиоамид, R6=Me) Циано (или нитрильный) заместитель в N-[3-(2-цианофенил)-1-изопропил-1 Н-индол-6 ил]метансульфонамиде может быть превращен в тиоамидную группу с использованием реагента Лоэссона (Lawesson) в соответствии с модифицированной методикой, описанной Thomsen et al. Org.N-[3-(6-Циано-5-фторпиридин-3-ил)-1-изопропил-1 Н-индол-6-ил]метансульфонамид Способ X. Пропускают N2 через смесь N-[1-изопропил-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1 Ниндо-6-ил]метансульфонамида (0,186 г, 0,493 ммоль), 5-бром-2-циано-3-фторпиридина (0,090 г,0,448 ммоль), K3PO4 (1,3 М) (0,60 мл) и диоксана (1,2 мл) в течение 5 мин. Добавляют трициклогексилфосфин (3,0 мг, 0,011 ммоль) и Pd2(dba)3 (4,1 мг, 0,0045 ммоль). Закупоривают пробирку и перемешивают при 100 С, выдерживая при этой температуре в течение 18 ч. После охлаждения до комнатной температуры экстрагируют EtOAc и промывают NaHCO3. Сушат органическую фракцию с помощью MgSO4. Очищают сырой остаток с помощью хроматографии на силикагеле с получением 0,112 г (выход 67%) названного в заголовке соединения. МС: 373,0 (М+Н).(100 мг,0,302 ммоль) и (3,5-дифтор-4-гидроксиметилфенил)бороновой кислоты (42,5 мг, 0,302 ммоль) в емкость для обработки микроволнами объемом 10 мл. Добавляют этанол (4 мл) и 1 н. раствор карбоната калия(847,4 мг, 0,362 мл, 0,362 ммоль). Добавляют смолу FC-1032 (19,3 мг, 9,1 мкмоль, 0,47 ммоль/г) и укупоривают сосуд. Нагревают с помощью микроволн до 110 С, выдерживая при этой температуре в течение 15 мин. Фильтруют реакционную смесь и упаривают под вакуумом. Очищают Isco на диоксиде кремния(0-50% EtOAc/гексан). Упаривают с получением названного в заголовке соединения (127 мг, 55%). Данные 1 Н-ЯМР (ДМСО) согласуются со структурой продукта. Синтез различных заместителей, которые могут быть присоединены к индолу в положении 3 или положении N-1, описан ниже. 3-Амино-5-бромпиридин-2-карбоновой кислоты амид. Добавляют NaBH4 (0,663 г, 17,5 ммоль) маленькими порциями к раствору в метаноле (50 мл) 5-бром-2-циано-3-нитропиридина (2,00 г, 8,77 ммоль) и тетрагидрат ацетата никеля(II) (4,37 г,17,5 ммоль) при 0 С. После перемешивания при комнатной температуре в течение 20 мин добавляют воду и EtOAc. Пропускают смесь через слой целита. Экстрагируют EtOAc. Сушат объединенные EtOAc экстракты над MgSO4. Очищают сырой продукт с помощью хроматографии на силикагеле с получением 0,75 г (выход 40%) амида 3-амино-5-бромпиридин-2-карбоновой кислоты. МС: 216,0/218,0 (М+Н). 5-Бром-3-фторпиридин-2-карбоновой кислоты амид. Перемешивают раствор амида 3-амино-5-бромпиридин-2-карбоновой кислоты (0,75 г, 3,47 ммоль) и тетрафторбората нитрозония (0,487 г, 4,16 ммоль) в дихлорметане (50 мл) при 23 С, выдерживая при этой температуре в течение 18 ч. Растворитель выпаривают. Осуществляют азеотропную перегонку остатка с толуолом. Остаток суспендируют в толуоле (20 мл) и кипятят с обратным холодильником в течение 2 ч. Смесь упаривают и сырой продукт очищают хроматографией на диоксиде кремния (градиент 10-100% EtOAc в гексане) с получением амида 5-бром-3-фторпиридин-2-карбоновой кислоты (0,378 г,50%). МС: 221,0 (М+Н). 5-Бром-2-циано-3-фторпиридин. Перемешивают смесь амида 5-бром-3-фторпиридин-2-карбоновой кислоты (0,375 мг, 1,71 ммоль) иNaCl (0,120 г, 2,05 ммоль) в CH2Cl2 (20 мл). По истечении 15 мин добавляют POCl3 (0,795 мл,8,55 ммоль) и кипятят смесь с обратным холодильником в течение ночи. Охлаждают смесь до комнатной температуры и разбавляют CH2Cl2; промывают насыщенным раствором NaHCO3 и сушат над MgSO4. Очищают сырой продукт хроматографией на диоксиде кремния (градиент 0-50% EtOAc в гексане) с получением 0,25 г (выход 73%) 5-бром-2-циано-3-фторпиридина.- 16014470 5-Бром-2-циано-3-метоксипиридин. Смешивают натрия метоксид (141 мг, 2,61 ммоль) и 5-бром-2-циано-3-фторпиридин (105 мг,0,52 ммоль) в ТГФ (5 мл) и кипятят с обратным холодильником в течение 18 ч. Добавляют фосфатный буферный раствор (рН 7) и экстрагируют EtOAc. Сушат экстракты EtOAc над MgSO4. Удаляют высушивающий агент и фильтрат упаривают. Сырой продукт очищают хроматографией на силикагеле и элюируют смесью EtOAc/гексан (0-30%) с получением 77 мг (выход 69%) 5-бром-2-циано-3-метоксипиридина. 5-Бром-2-циано-3-хлорпиридин. Добавляют NaNO2 (83,0 мг, 1,20 ммоль) к суспензии 3-амино-5-бром-2-цианопиридина (198 мг,1,00 ммоль) в смеси 37% HCl (2,00 мл) и H2O (0,5 мл) при 0 С и перемешивают в течение 1 ч. Добавляют порошок меди (15 мг) и кипятят смесь с обратным холодильником в течение 30 мин. Охлаждают смесь и заливают льдом, подщелачивая с помощью 5 н. раствора NaOH. Экстрагируют EtOAc и промывают органический экстракт солевым раствором, сушат над MgSO4. Сырой продукт очищают хроматографией на силикагеле и элюируют с градиентом 0-30% EtOAc в гексане с получением 110 мг (выход 50%) 5-бром-2 циано-3-хлорпиридина. 4-Бромнафтален-1-карбонитрил. Обрабатывают ультразвуком суспензию 4-бромнафталин-1-иламина (0,974 г, 4,386 ммоль) в смеси воды (6 мл) и концентрированной HCl (2 мл) в течение 10 мин. Охлаждают полученную суспензию до 0 С. Медленно добавляют нитрит натрия (0,336 г, 4,869 ммоль) в воде (2 мл) с такой скоростью, чтобы поддерживать температуру ниже 5 С. Перемешивают полученную смесь в течение 30 мин, после чего нейтрализуют твердым бикарбонатом натрия. Полученный раствор добавляют порциями к раствору цианида калия (0,717 г, 11,010 ммоль) и цианида меди (0,464 г, 5,181 ммоль) в воде (10 мл). Образуется осадок. Нагревают реакционную смесь до 70 С, выдерживая при этой температуре в течение 30 мин, затем экстрагируют водную реакционную смесь этилацетатом (320 мл). Органические фракции объединяют и промывают последовательно водой (30 мл), насыщенным раствором хлорида аммония (30 мл) и раствором бикарбоната натрия (30 мл). Полученные органические фракции сушат (Na2SO4); удаляют твердое вещество фильтрацией и фильтрат упаривают под вакуумом. Очищают полученный остаток флэшхроматографией с градиентом от гексана до 20% этилацетата в гексане с получением 0,864 г (85%) 4-бромнафтален-1-карбонитрила в виде светло-коричневого твердого вещества. 1 Н ЯМР (CDCl3)8,314 (дд, 1 Н, J=2,4, 7,0 Гц), 8,235 (дд, 1 Н, J=2,4, 7,0 Гц), 7,836 (д, 1 Н, J=7,6 Гц),7,728 (м, 3 Н). 4-Бром-2-фторбензамид. В колбу помещают кислый оксид аллюминия (Al2O3) (3,03 г, 29,718 ммоль) и метансульфоновую кислоту (10 мл). Нагревают полученный раствор до 120 С и добавляют 4-бром-2-фторбензонитрил(2,00 г, 9,999 ммоль) в виде одной порции. Перемешивают полученную смесь в течение 30 мин, затем охлаждают до комнатной температуры и выливают в воду (50 мл). Экстрагируют водную смесь дихлорметаном (330 мл). Объединяют органические фракции; сушат (Na2SO4); твердое вещество удаляют фильтрацией и фильтрат упаривают под вакуумом с получением 2,14 г (98%) 4-бром-2-фторбензамида в виде твердого вещества белого цвета. 1 Н ЯМР (ДМСО-d6)7,706 (д, 2 Н, J=21,1 Гц), 7,598 (дд, 1 Н, J=1,9, 10,1 Гц), 7,557 (дд, 1 Н, J=8,0,8,0 Гц), 7,446 (ддд, 1 Н, J=0,4, 1,9, 8,1 Гц). 5-(4-Бром-2-фторфенил)-1H-тетразол. В колбу помещают 4-бром-2-фторбензонитрил (3,0 г, 15,0 ммоль) и азидотрибутилолово (10 г,30,0 ммоль). Нагревают смесь до 80 С, выдерживая при этой температуре в течение 24 ч, затем реакционную смесь охлаждают и разбавляют 15 мл диэтилового эфира. Выливают полученный раствор в 15 мл диэтилового эфира, насыщенные газообразной хлористо-водородной кислотой. Отделяют образовавшееся твердое вещество фильтрацией и промывают гексаном с получением 3,1 г (85%) названого в заголовке соединения. ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=243,0 (М+Н). 5-(4-Бром-2-фторфенил)-1-метил-1 Н-тетразол. Добавляют сухой ДМФА к гидриду натрия (0,2 г, 4,8 ммоль), который предварительно трижды промывают гексаном. Охлаждают полученную суспензию до 0 С и добавляют порциями 5-(4-бром-2-фторфенил)-1 Н-тетразол (1,0 г, 4,4 ммоль). Перемешивают смесь в течение 30 мин, затем добавляют метилиодид (0,68 г, 4,8 ммоль) и продолжают перемешивать реакционную смесь при комнатной температуре, контролируя протекание реакции с помощью ТСХ. После завершения реакции заливают реакционную смесь 10% раствором NaHSO4 (50 мл); разбавляют этилацетатом (50 мл) и фракции разделяют. Водную фракцию трижды экстрагируют этилацетатом (25 мл). Органические фракции объединяют и сушат над MgSO4. Удаляют твердое вещество фильтрацией и фильтрат упаривают под вакуумом. Хроматографируют остаток на колонке с силикагелем, элюируя 20% этилацетата в гексане, с получением 0,68 г (65%) названного в заголовке материала.NH3 в МеОН (50 мл). Нагревают смесь в укупоренной пробирке до 100 С, выдерживая при этой температуре в течение 18 ч. Очищают остаток на силикагеле с элюированием 30% EtOAc в гексане с пошаговым градиентом до 80% EtOAc в гексане. Получают 0,7 г (64%). ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=221,8 (М+Н). 5-Бром-4-метил-2-тиофенкарбонитрил. В колбу помещают 5-бром-4-метил-2-тиофенкарбоксамид (1,2 г, 1,0 экв., 5,4 ммоль) и POCl3(30 мл). Перемешивают смесь при комнатной температуре в течение 18 ч. Очищают остаток на силикагеле, элюируя 30% EtOAc в гексане, с получением названного в заголовке соединения (0,7 г, 64%). 1 Н ЯМР (CDCl3)7,27 (с, 1 Н), 2,17 (с, 3 Н). 4-Бром-3-метил-2-триофенкарбоксамид. В колбу помещают 4-бром-3-метил-2-тиофенкарбоновую кислоту (2,0 г, 1,0 экв., 9,0 ммоль) и тионилхлорид (30 мл). Смесь перемешивают при комнатной температуре в течение 18 ч. Полученную смесь упаривают под вакуумом, после чего остаток суспендируют в 7 н. NH3 в МеОН (50 мл). Перемешивают в течение 1 ч. Упаривают под вакуумом с получением 1,9 г (100%) названного в заголовке соединения. ЖХМС (ионизация при атмосферном давлении, электрораспыление с положительным зарядом)=221,8 (М+Н). 4-Бром-3-метил-2-фиофенкарбонитрил. Растворяют 4-бром-3-метил-2-тиофенкарбоксамид в 30 мл POCl3 и перемешивают смесь при комнатной температуре в течение 18 ч. Затем реакционную смесь упаривают под вакуумом и остаток очищают хроматографией (силикагель, 5% этилацетата в гексане) с получением названного в заголовке соединения (0,9 г, 49%). 1 Н-ЯМР (CDCl3)9,44 (с, 1 Н), 4,40 (с, 3 Н). 4-Бром-2-фтор-6-метоксибензонитрил. Способ DF1. Растворяют 4-бром-2,5-дифторбензонитрил (1,5 г, 6,9 ммоль) в ТГФ (10 мл). Добавляют растворNaOMe (1,9 г, 25% (мас.) в МеОН (8,3 ммоль. Перемешивают реакционную смесь в течение ночи при комнатной температуре. Упаривают под вакуумом и очищают хроматографией на силикагеле (градиент 0-50% EtOAc в гексане/30 мин). Упаривают выбранные фракции под вакуумом с получением названного в заголовке соединения (1,5 г, 94%) в виде твердого вещества белого цвета. Данные 1 Н-ЯМР согласуются со структурой соединения. ТСХ (20% EtOAc в гексане) Rf=0,28. 4-Бром-2-фтор-6-метоксибензальдегид. Способ DF2. Растворяют 4-бром-2-фтор-6-метоксибензонитрил (1,15 г, 5,0 ммоль) в дихлорметане (50 мл) и охлаждают до 0 С. Добавляют DIBAL (6,0 мл, 1 н. раствор в метиленхлориде 1,2 ммоль). Перемешивают реакционную смесь в течение приблизительно 1 ч при 0 С. Добавляют 5 н. HCl (20 мл) и перемешивают полученный раствор в течение приблизительно 10 мин. Экстрагируют дихлорметаном, промывают солевым раствором, сушат над Na2SO4, фильтруют и упаривают под вакуумом. Очищают хроматографией на силикагеле (градиент 0-50% EtOAc в гексане/30 мин). Упаривают выбранные фракции под вакуумом без нагревания с получением названного в заголовке соединения (485 мг, 44%) в виде твердого вещества белого цвета. Данные 1 Н-ЯМР согласуются со структурой соединения. 5-Бром-2-дифторметил-1-фтор-3-метоксибензол. Способ DF3. Растворяют 4-бром-2-фтор-6-метоксибензальдегид (485 мг, 2,0 ммоль) в дихлорметане (5 мл); добавляют ДАСТ (0,3 мл, 2,2 ммоль) и кипятят с обратным холодильником в течение ночи в закупоренной пробирке. Охлаждают до комнатной температуры и переносят непосредственно на картридж для хроматографии на силикагеле. Очищают хроматографией на силикагеле (градиент 0-50% EtOAc в гексане/30 мин) и упаривают под вакуумом с получением названного в заголовке соединения (353 мг,70% выход) в виде бесцветного масла. ТСХ (20% EtOAc/гексан) Rf=0,50. Данные 1 Н-ЯМР согласуются со структурой соединения.- 18014470 2-Бром-5-этинилтриметилсиланпиридин. Кипятят с обратным холодильником смесь 2-бром-5-иодпиридина (1 г, 3,5 ммоль), этинилтриметилсилана (360 мг, 3,67 ммоль), иодида меди(I) (20 мг, 0,1 ммоль) и тетракис(трифенилфосфин)палладия(0) (121 мг, 0,01 ммоль) в триэтиламине (10 мл) в атмосфере N2 в закупоренной пробирке в течение 3 дней. Растворитель выпаривают. Очистка сырого остатка хроматографией на силикагеле дает 800 мг (90%) целевого продукта. 4-Бром-2-тиофенкарбонитрил. Кипятят с обратным холодильником смесь 4-бром-2-тиофенкарбоновой кислоты (960 мг,4,63 ммоль) и SOCl2 (5 мл) в течение 1 ч. Избыток SOCl2 выпаривают. К остатку добавляют ТГФ (5 мл). Полученный раствор медленно добавляют по каплям к концентрированному раствору NH4OH (15 мл) на ледяной бане. Перемешивают смесь в течение ночи. Смесь упаривают с последующим добавлениемEtOAc, промывают солевым раствором и сушат над MgSO4; фильтруют и упаривают под вакуумом. К остатку добавляют NaCl (307 мг, 5,26 ммоль) и дихлорметан (10 мл) и кипятят с обратным холодильником в течение 30 мин. По окончании добавления POCl3 (3,36 г, 21,9 ммоль) смесь кипятят с обратным холодильником в течение 1 ч. Разбавляют смесь дихлорметаном и промывают водным растворомNaHCO3, солевым раствором и сушат над MgSO4; фильтруют и упаривают под вакуумом с получением 753 мг целевого продукта. 4-Бром-2,6-диметилбензонитрил. Помещают 4-бром-2,6-диметилфениламин (4,49 г, 22,4 ммоль), воду (25 мл) и концентрированную хлористо-водородную кислоту (8,0 мл) в трехгорлую колбу и обрабатывают ультразвуком до образования суспензии. Охлаждают суспензию до 0 С и добавляют раствор нитрита натрия (1,67 г, 24,2 ммоль) в воде (5 мл) по каплям таким образом, чтобы поддерживать температуру реакции ниже 5 С. Перемешивают реакционную смесь при 0 С, выдерживая при этой температуре в течение 30 мин после окончания добавления. Осторожно нейтрализуют реакционную смесь твердым бикарбонатом натрия. Нейтрализованную реакционную смесь добавляют порциями в круглодонную колбу, содержащую цианид меди(I)(2,42 г, 27,0 ммоль), калия цианид (3,65 г, 56,1 ммоль) и воду (25 мл), при 70 С. Перемешивают полученный раствор в течение 30 мин при температуре 70 С. Охлаждают реакционную смесь до комнатной температуры и экстрагируют толуолом (375 мл). Объединяют органические фракции, промывают водой и солевым раствором. Сушат над сульфатом натрия и упаривают под вакуумом. Очищают флэш-хроматографией (градиент от 2 до 20% этилацетата в гексане) с получением 4-бром-2,6-диметилбензонитрила (3,36 г, 15,99 ммоль, 71%). 1H ЯМР (CDCl3)7,50 (с, 1 Н), 2,46 (с, 6 Н). 4-Бром-2-хлор-6-метилбензонитрил. Получают по способу, в существенной степени сходному с получением 4-бром-2,6 диметилбензонитрила из 4-бром-2-хлор-6-метилфениламина. 1 Н ЯМР (ДМСО-d6)7,52 (с, 1 Н), 7,38 (с, 1 Н) 2,53 (с, 3 Н). 4-Бром-2,6-дихлорбензонитрил. Получают по способу, в существенной степени сходному с получением 4-бром-2,6 диметилбензонитрила из фениламина. 1 Н ЯМР (CDCl3)7,59 (с, 2 Н). 4-Бром-3-метоксибензонитрил. Получают по способу, в существенной степени сходному с получением 4-бром-2,6 диметилбензонитрила из фениламина. 1 Н ЯМР (CDCl3)7,62 (д, 1 Н, J=7,9 Гц), 7,09 (дд, 1 Н, J=7,9 Гц, 1,8 Гц), 7,07 (д, 1 Н, J=1,8 Гц), 3,91 (с,3 Н). 4-Бром-2-фтор-5-метилбензонитрил. Получают по способу, в существенной степени сходному с получением 4-бром-2,6 диметилбензонитрила. 1 Н ЯМР (CDCl3)7,46 (м, 2 Н), 2,40 (с, 3 Н). Соединения, приведенные в табл. 1, могут быть получены из соединения, которое имеет общую структуру индольного ядра, проиллюстрированную как промежуточное соединение 2, в соответствии с описанными выше методиками.- 19014470 Таблица 1 Соединения, полученные из промежуточного соединения 2 Если не указано иное, под данными анализа подразумеваются данные масс-спектра. Способ получения из получения, которое ссылается на схемы 1-6 и сопроводительное описание экспериментов. Соединения, приведенные в табл. 2, могут быть получены из соединения, которое имеет общую структуру индольного ядра, проиллюстрированную как промежуточное соединение 3 в соответствии с методиками, приведенными выше.- 20014470 Таблица 2 Соединения, полученные из промежуточного соединения 3 См. экспериментальный раздел. Если не указано иное, под данными анализа подразумеваются данные масс-спектра. Способ получения из получения, которое ссылается на схемы 1-6 и сопроводительное описание экспериментов.См. способы Z-1 и Z-2 ниже.- 24014470 Соединения, приведенные в табл. 3, могут быть получены из соединения, которое имеет общую структуру индольного ядра, проиллюстрированную как промежуточное соединение 4 в соответствии с методиками, приведенными выше. Таблица 3 Соединения, полученные из промежуточного соединения 4 Если не указано иное, под данными анализа подразумеваются данные масс-спектра. Способ получения из получения, который ссылается на схемы 1-6 и сопроводительное описание экспериментов.- 27014470 Соединения, приведенные в табл. 4, могут быть получены из соединений, имеющих общую структуру индольного ядра, проиллюстрированную как промежуточное соединение 4-А, в соответствии с методиками, приведенными выше. Таблица 4 Соединения, полученные из промежуточного соединения 4-А
МПК / Метки
МПК: C07D 209/24, C07D 401/04, C07D 403/10, C07D 409/14, C07D 209/10, C07D 403/04, C07D 209/14, C07D 409/04, C07D 405/04, C07D 209/12, C07D 209/18
Метки: прогестерона, индолсульфонамидные, рецепторов, модуляторы
Код ссылки
<a href="https://eas.patents.su/30-14470-indolsulfonamidnye-modulyatory-receptorov-progesterona.html" rel="bookmark" title="База патентов Евразийского Союза">Индолсульфонамидные модуляторы рецепторов прогестерона</a>
Предыдущий патент: Бинарные смеси гиалуроновой кислоты и их терапевтическое применение
Следующий патент: Сжигающая колонна и способ ее работы
Случайный патент: Способ сооружения опорного кольца в криволинейной стене