Производные пирролопирролона в качестве ингибиторов нейтрофильной эластазы
Номер патента: 1437
Опубликовано: 26.02.2001
Авторы: Ша Прайтом, Джонсон Мартин Редпат, Макдоналд Саймон Джон Фосетт, Финч Гарри, Доул Майкл Деннис, Инглис Грэм Джордж Адам, Гаррисон Ли Эндрю, Смит Робин Эндрю
Формула / Реферат
1. Соединение общей формулы (I)
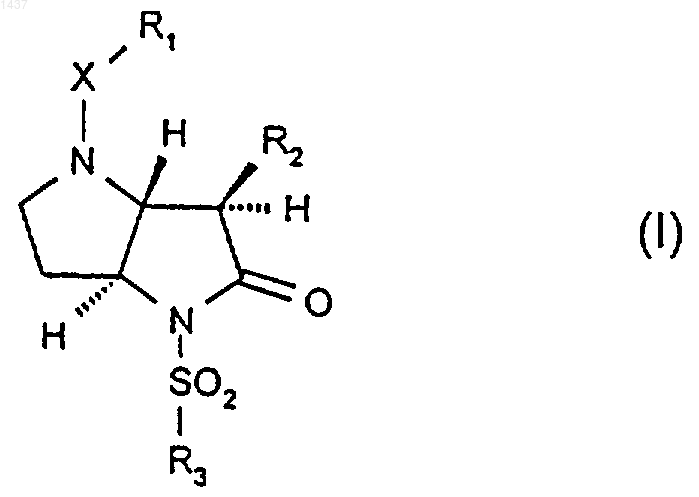
где
R1 представляет собой C1-6алкил, С2-6алкенил; арил, арил-С1-4алкил, арил-С2-4алкенил, гетероарил, гетероарил-С1-4алкил или гетероарил-С2-4-алкенил, или такую группу, в которой арильная или гетероарильная группировка замещена одной или более чем одной С1-4алкильной, галогено, тетразолильной, трифторметилсульфонамидной, NR9CO-C1-8алкильной, -(CH2)m-NR4R5, -CN, -COOR9, -CONR9R10, -NO2, -SO2-С1-6алкильной, -CF3 или C1-6алкоксигруппой; -(CH2)n-NR4R5; С2-8алкенил-NR4R5; -(CH2)nCONR4R5; -(CH2)nNR9CO-C1-6алкил; С2-8алкенил-СООR9; (CH2)nCOOR9 и С2-8алкенил-СОNR4R5;
Х представляет собой
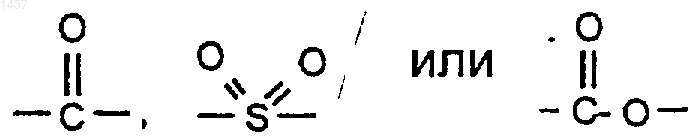
(где карбонил связан с кольцевым азотом);
R2 представляет собой С2-4алкил, С2-4алкенил, C1-3алкокси или C1-3алкилтио;
R3 представляет собой C1-6алкил; -СН2(СF2)0-4СF3; арил или гетероарил, причем арил или гетероарил является моноциклическим или имеет два конденсированных кольца, одно из которых может быть насыщенным, и арильная и гетероарильная группы могут быть замещены одной или более чем одной С1-4алкильной, галогено, -NR7R8, -SO2NR7R8, -CONR7R8, C1-6алкилэфирной, -CN, -СН2OН, -О-С1-6алкильной, -CF3 или нитрогруппой; арил-С1-4алкил, арил-С1-4алкил-NН- или арил-С2-4алкенил, или такие группы, где арил замещен одной или более чем одной С1-4алкильной или галогеногруппой;
R4 и R5 независимо представляют собой водород, С1-4алкил, С1-4алкокси, -(CH2)1-4CONR11R12, -СО-С1-4алкил или фенил, возможно замещенный одной или более чем одной С1-4алкильной или галогеногруппой, или R4 и R5 могут быть объединены так, что NR4R5 представляет собой моно-, би- или трициклическую кольцевую систему, содержащую 4-15 атомов углерода в кольце, где одно или более чем одно кольцо может быть возможно прервано одним или более чем одним гетероатомом, выбранным из О, N или S, и где один или более чем один кольцевой атом углерода может иметь карбонильную функциональность;
или -(CH2)n-NR4R5 может представлять собой группу формулы 1а
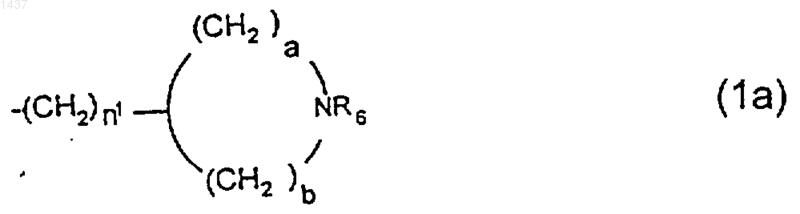
где
R6 представляет собой водород или карбоксиС1-6алкилэфир, n1 равно 0 - 6, и а и b независимо представляют собой целые числа 0-3, при условии, что а+b находится в интервале 3-5;
R7, R8, R9, R10, R11, R12 независимо представляют собой водород или С1-4алкил;
алкил представляет собой как разветвленный, так и нормальный алкил и может представлять собой также циклоалкил, когда присутствуют три или более чем три атома углерода;
арил представляет собой фенил, нафтил или тетрагидронафтил;
гетероарил представляет собой ароматический 5- или 6-членный моноциклический гетероцикл, содержащий один или более чем один гетероатом серы, азота или кислорода, либо конденсированную бициклическую систему, состоящую из двух 5- или 6-членных колец, содержащих один или более чем один указанный гетероатом, причем одно кольцо является возможно насыщенным;
m представляет собой целое число от 0 до 8;
n представляет собой целое число от 1 до 9;
и его соли и сольваты.
2. Соединение по п.1, где R2 представляет собой н-пропил или изопропил.
3. Соединение по п.2, где R2 представляет собой изопропил.
4. Соединение по любому из пп.1-3, где R3 представляет собой C1-6алкил.
5. Соединение по п.4, где R3 представляет собой метил.
6. Соединение по любому из пп.1-5, где Х представляет собой -СО- или -SO2.
7. Соединение по п.6, где Х представляет собой -СО-.
8. Соединение по любому из пп.1-7, где R1 представляет собой С2-8алкенил-NR4R5.
9. Соединение по п.8, где R1 представляет собой -CH=CH-CH2-NR4R5.
10. Соединение по любому из пп.1-7, где R1 представляет собой фенил, фуранил, тиофенил или пирролил, замещенный группой -(CH2)n'-NR4R5 и n' представляет собой целое число от 1 до 5.
11. Соединение по п.10, где n' представляет собой целое число от 1 до 3.
12. Соединение по любому из пп.8-11, где -NR4R5 вместе представляет собой морфолин, пирролидин, пиперидин, азепин, пиперазин или 4-метилпиперазин, или один или оба из R4 и R5 представляют собой С1-4алкил, а другой (если он не представляет собой С1-4алкил) представляет собой водород.
13. Соединение по любому из пп.1-7, где R1 представляет собой фенил, замещенный -NНСО-С1-8алкилом.
14. Соединение по п.13, где R1 представляет собой фенил, замещенный -NHCOMe.
15. Соединение по п.1, которое представляет собой
(3R*,3аR*,6аS*)-1-метансульфонил-4-(4-пиперидин-1-ил-бут-2-(Е)-еноил-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(6-азепин-1-ил-гексаноил-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(3-пиперидин-1-ил-пропионил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-1-метансульфонил-4-(4-пиперидин-1-илметил-бензоил)-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
N-[4-(4-метансульфонил-5-оксо-6R*-пропил-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-сульфонил)фенил]-ацетамид;
(3R*,3аR*,6аS*)-1-метансульфонил-4-[(метил-фенил-амино)-ацетил]-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
N-[4-(4-метансульфонил-5-оксо-6R*-пропил-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-карбонил)-фенил]-ацетамид;
4-(4-метансульфонил-5-оксо-6R*-пропил-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-сульфонил)-N-(2-пиперидин-1-ил-этил)-бензамид;
N-(2-диметиламиноэтил)-4-(4-метансульфонил-5-оксо-6R*-пропил-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-сульфонил)-бензамид;
(3R*,3аR*,6аS*)-1-метансульфонил-4-[4-(4-метил-пиперазин-1-карбонил)-бензолсульфонил]-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
этиловый эфир (3R*,3аR*,6аS*)-4-(4-метансульфонил-5-оксо-6-пропил-гексагидро-пирроло[3,2-b]пиррол-1ил)-4-оксо-бут-2Е-еновой кислоты;
4-(4-метансульфонил-5-оксо-6-пропил-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-ил)-4-оксо-бут-2Е-еновую кислоту;
(3R*,3аR*,6аS*)-1-(4-метансульфонил-5-оксо-6-пропил-гексагидро-пирроло[3,2-b]пиррол-1-ил)-4-(4-метил-пиперазин-1-ил)-бут-2Е-ен-1,4-дион;
(3R*,3аR*,6аS*)-4-бут-2Е-еноил-1-метансульфонил-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-1-метансульфонил-4-{3-[4-(4-метил-пиперазин-1-илметил)-фенил]-(Е)-акрилоил}-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-1-метансульфонил-4-[3-(4-пиперидин-1-илметил-фенил)-(Е)-акрилоил]-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
N-{4-[3-(4-метансульфонил-5-оксо-6R*-пропил-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-ил)-3-оксо-(Е)-пропенил]-фенил}-ацетамид;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(4-пиперидин-1-ил-бут-2Е-еноил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-азепин-1-ил-бут-2Е-еноил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-циклопропиламино-бут-2Е-еноил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-[4-(4-ацетил-пиперазин-1-ил)-бут-2Е-еноил]-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-[4-(2,6-диметил-пиперидин-1-ил)-бут-2Е-еноил]-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
метиловый эфир 1-[4-(6R*-изопропил-4-метансульфонил-5-оксо-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-ил)-4-оксо-бут-2Е-енил]-пирролидин-2S-карбоновой кислоты;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-[4-(метил-пропил-амино)-бут-2Е-еноил]-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(4-морфолин-4-ил-бут-2Е-еноил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-[4-(4-метил-пиперазин-1-ил)-бут-2Е-еноил]-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-диизопропиламино-бут-2Е-еноил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-диэтиламино-бут-2Е-еноил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(4-пирролидин-1-ил-бут-2Е-еноил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-[4-(метокси-метил-амино)-бут-2Е-еноил]-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-диметиламино-бут-2Е-еноил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-[4-(2,5-диметил-пирролидин-1-ил)-бут-2Е-еноил]-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
2-{[4-(6R*-изопропил-4-метансульфонил-5-оксо-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-ил)-4-оксо-бут-2Е-енил]-метил-амино}-ацетамид;
(3R*,3аR*,6аS*)-3-изопропил-4-(4-изопропиламино-бут-2Е-еноил)-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
амид 1-[4-(6R*-изопропил-4-метансульфонил-5-оксо-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-ил)-4-оксо-бут-2Е-енил]-пиперидин-4-карбоновой кислоты;
(3R*,3аR*,6аS*)-4-[4-(5,8-дифтор-1,3,3а,4,9,9а-гексагидро-(3аS*,9аS*)-бензо[f]изоиндол-2-ил)-бут-2Е-еноил]-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R,3аR,6аS)-3-изопропил-1-метансульфонил-4-(4-пиперидин-1-ил-бут-2Е-еноил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-[3-(4-пиперидин-1-илметил-фенил)-(Е)-акрилоил]-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-[3-(4-диметиламинометил-фенил)-(Е)-акрилоил]-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-1-этансульфонил-4-(3-пиперидин-1-ил-пропионил)-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(4-пирролидин-1-илметил-бензоил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(4-пиперидин-1-илметил-бензоил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-диметиламинометил-бензоил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-[4-(4-метил-пиперазин-1-илметил)-бензоил]-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(4-морфолин-4-илметил-бензоил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-азепин-1-илметил-бензоил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-4-[4-(изопропиламино-метил)-бензоил]-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-циклопропиламинометил-бензоил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-{4-[(4-метил-пропил-амино)-метил]-бензоил}-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-диэтиламинометил-бензоил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
метиловый эфир 1-[4-(6R*-изопропил-4-метансульфонил-5-оксо-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-карбонил)-бензил]-пирролидин-2S*-карбоновой кислоты;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-[4-(октагидро-изохинолин-2-илметил-бензоил]-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-[4-(4-ацетил-пиперазин-1-илметил)-бензоил]-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-[4-(2,5-диметил-пирролидин-1-илметил)-бензоил]-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
амид 1-[4-(6R*-изопропил-4-метансульфонил-5-оксо-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-карбонил)-бензил]-пиперидин-4-карбоновой кислоты;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(4-пиперазин-1-илметил-бензоил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-[3-(4-метилпиперазин-1-илметил-бензоил]-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(3-циклопропиламинометил-бензоил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
амид 1-[3-(6R*-изопропил-4-метансульфонил-5-оксо-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-карбонил)-бензил]-пиперидин-4-карбоновой кислоты;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(3-пиперидин-1-илметил-бензоил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(3-пирролидин-1-илметил-бензоил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3aR*,6aS*)-1 -метансульфонил-4-(4-пиперидин-1 -илметил-бензолсульфонил)-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-азепин-1-илметил-бензолсульфонил)-1-метансульфонил-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-диметиламинометил-бензолсульфонил)-1-метансульфонил-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-диметиламинометил-бензолсульфонил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(4-пиперидин-1-илметил-бензолсульфонил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-азепин-1-илметил-бензолсульфонил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6а3*)-4-[4-(2,6-диметил-пиперидин-1-илметил)-бензоил]-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6а3*)-4-{4-[(диизопропиламино)-метил]-бензоил}-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-1-бензолсульфонил-4-(6-пиперидин-1-ил-гексаноил)-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
N-[4-(6R*-изопропил-4-метансульфонил-5-оксо-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-сульфонил)-фенил]-ацетамид;
(3R*,3аR*,6аS*)-1-метансульфонил-4-[4-(2-оксо-пирролидин-1-ил)-бензолсульфонил]-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(4-метансульфонил-бензолсульфонил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(4-трифторметил-бензолсульфонил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(4-нитро-бензолсульфонил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-бутокси-бензолсульфонил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(фуран-2-карбонил)-1-метансульфонил-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-1-метансульфонил-3-пропил-4-(тиофен-2-карбонил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3рR*,6аS*)-4-(4-амино-бензолсульфонил)-1-метансульфонил-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(3-амино-бензолсульфонил)-1-метансульфонил-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(2-амино-бензолсульфонил)-1-метансульфонил-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(4-амино-бензолсульфонил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-1-метансульфонил-3-пропил-4-(пиридин-2-карбонил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3aR*,6aS*)-1 -метансульфонил-4-(1 -метил-1 Н-пиррол-2-карбонил)-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
N-[5-(4-метансульфонил-5-оксо-6R*-пропил-гексагидро-(3аS*,6аR*)-пирроло[3,2-b]пиррол-1-карбонил)-пиридин-2-ил]-ацетамид;
(3R*,3аR*,6аS*)-1-метансульфонил-3-пропил-4-(1Н-пиррол-2-карбонил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-1-метансульфонил-3-пропил-4-(пиридин-4-карбонил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-1-метансульфонил-3-пропил-4-(пиридин-3-карбонил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(фуран-2-карбонил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(тиофен-2-карбонил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(5-пиперидин-1-илметил-фуран-2-карбонил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(5-диметиламинометил-фуран-2-карбонил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(5-циклопропиламинометил-фуран-2-карбонил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-4-(3-диметиламинометил-бензоил)-3-изопропил-1-метансульфонил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-1-метансульфонил-4-[4-(4-метил-пиперазин-1-ил)-бут-2Е-еноил]-3-пропил-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-(4-пиперидин-4-ил-бутирил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-изопропил-1-метансульфонил-4-[4-(1-метил-пиперидин-4-ил)-бутирил]-гексагидро-пирроло[3,2-b]пиррол-2-он;
(3R*,3аR*,6аS*)-3-циклопропил-1-метансульфонил-4-(4-пиперидин-1-ил-бут-2Е-еноил)-гексагидро-пирроло[3,2-b]пиррол-2-он;
или его фармацевтически приемлемая соль, сольват или энантиомер любого из них.
16. Соединение по п.1, которое представляет собой (3S,3aR,6aS)-3-изопропил-1-метансульфонил-4-(4-пиперидин-1-ил-бут-2Е-еноил)-гексагидро-пирроло[3,2-b]пиррол-2-он или его фармацевтически приемлемую соль или сольват.
17. Применение соединения по любому из пп.1-16 в качестве фармацевтического средства.
18. Фармацевтическая композиция, содержащая соединение по любому из пп.1-16 в смеси с одним или более чем одним физиологически приемлемым разбавителем или носителем.
19. Способ лечения или профилактики хронического бронхита, при котором человеку или животному вводят эффективное количество соединения по любому из пп.1-16.
20. Применение соединения по любому из пп.1-16 в производстве лекарственного средства для лечения или профилактики хронического бронхита.
21. Способ лечения или профилактики хронического обструктивного заболевания легких, при котором человеку или животному вводят эффективное количество соединения по любому из пп.1-16.
22. Применение соединения по любому из пп.1-16 в производстве лекарственного средства для лечения или профилактики хронического обструктивного заболевания легких.
23. Способ получения соединения формулы (I), как оно определено в п.1, который включает в себя конденсацию соединения формулы (II)
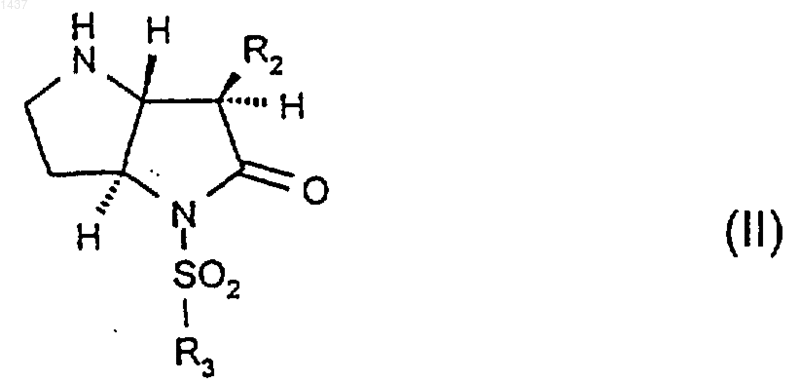
с соединением R1COOH, RCOY, R1OCO.Y или R1SO2Y, где Y представляет собой реакционноспособную группу, такую как галоген, где R1, R2 и R3 такие как определено в п.1, и, при желании или необходимости, превращение полученного свободного кислотного или основного соединения формулы (I) в форму физиологически приемлемой соли или наоборот, или превращение одной солевой формы в другую физиологически приемлемую солевую форму.
24. Соединение формулы (II)
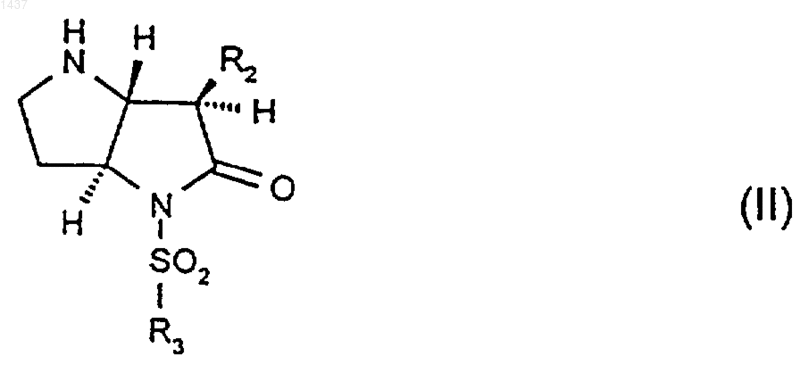
где R2и R3 такие, как определено в п.1, или его производное, в котором атом азота в пирролидине является защищенным, или его соль.
25. Соединение формулы (III)
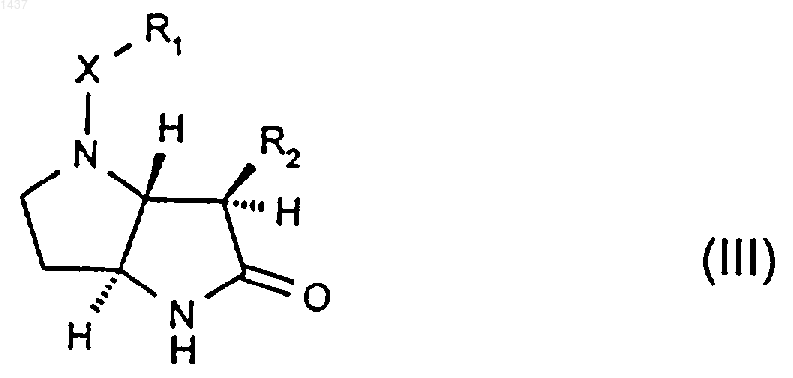
где R1, X и R2 такие, как определено в п.1, или его производное, в котором атом азота в пирролидиноне является защищенным, или его соль.
26. Соединение по п.24 или п.25, где R2 представляет собой изопропил.
27. Соединение формулы (ХХII)a
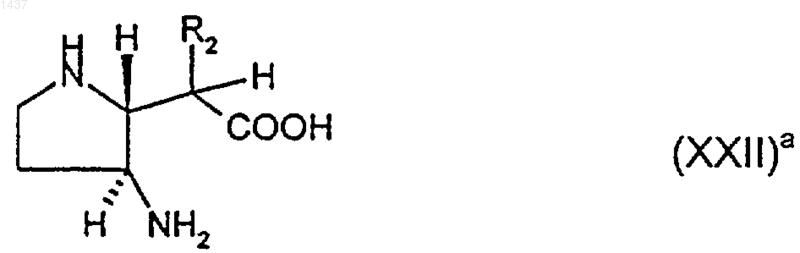
где R2 представляет собой С2-4алкил, С2-4алкенил или C1-3алкилтио, или его производное, в котором один или оба атома азота являются защищенными и/или группа карбоновой кислоты является защищенной как С1-6алкиловый эфир, или его соль.
28. Соединение формулы (XXII)1
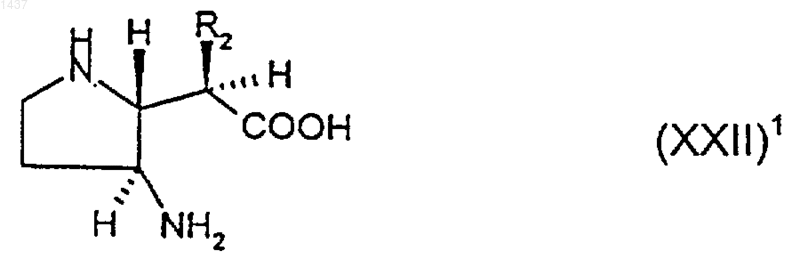
где R2 такой, как определено в п.27, или его производное, в котором один или оба атома азота являются защищенными и/или группа карбоновой кислоты является защищенной как С1-6алкиловый эфир, или его соль.
29. Соединение по п.27 или п.28, где первичная аминогруппа защищена трифторацетилом.
30. Соединение по любому из пп.27-29, где R2 представляет собой изопропил.
31. Соединение формулы (XX)1
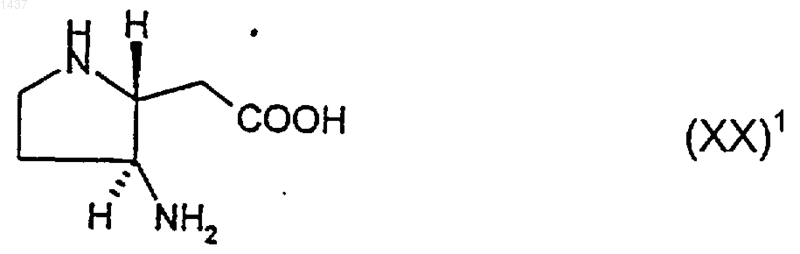
или его производное, в котором один или оба атома азота являются защищенными и/или группа карбоновой кислоты является защищенной как C1-6алкиловый эфир, или его соль.
32. Соединение по любому из пп.27-31, где группа карбоновой кислоты защищена как С1-6алкиловый эфир, особенно этиловый эфир.
33. Соединение формулы (XXIII)1
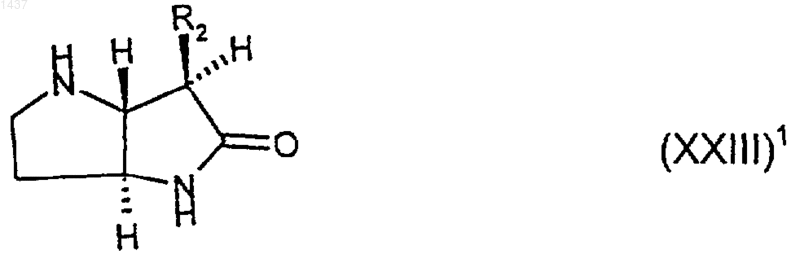
где R2 такой, как определено в п.1, или его производное, в котором один или оба атома азота являются защищенными, или его соль.
34. Соединение формулы (XXIII)1 по п.33, где R2 представляет собой изопропил.
35. Соединение формулы (ХХIIIа)
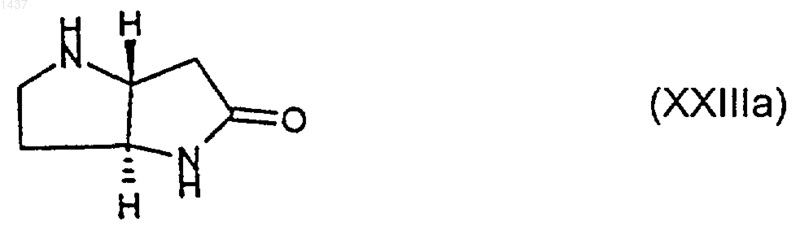
или его производное, в котором один или оба атома азота являются защищенными, или его соль.
36. Соединение формулы (V)
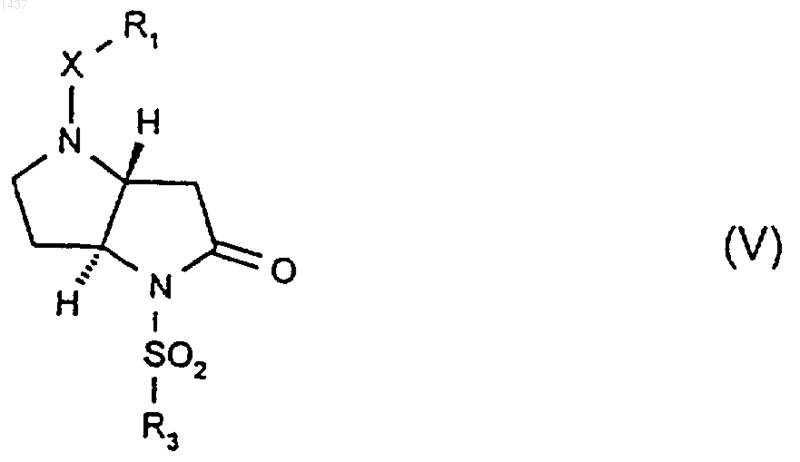
где R1, X и R3 являются такими, как определено в п.1, или его соль.
37. Соединение по любому из пп.24-36 в форме очищенного индивидуального энантиомера.
38. Способ получения соединения формулы (XXI I)3
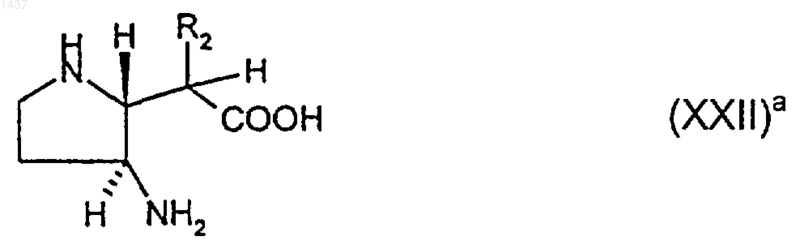
где R2 такой, как определено в п.27, или его производного, в котором один или оба атома азота являются защищенными, и/или группа карбоновой кислоты является защищенной как C1-6алкиловый эфир, или его соли, который включает в себя стадии: (i) взаимодействия соединения формулы (XXIX)2

или его производного, в котором один или оба атома азота являются защищенными, с соединением формулы XXX
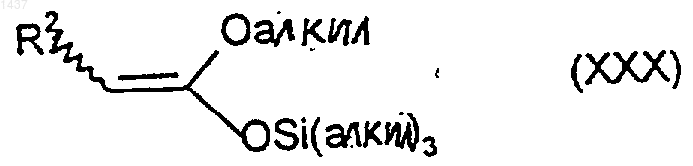
где R2 такой, как определено в п.27, илш ё производным, в котором О-алкильная группировка замещена OSi(алкил)3группировкой, и (ii) возможно введения защиты или снятия защиты с атома азота и/или группы карбоновой кислоты в продукте стадии (i).
39. Способ по п.38, который далее включает в себя стадии превращения соединения формулы (XXII)a или его производного, в котором один или оба кольцевых атома азота являются защищенными, и/или группа карбоновой кислоты является защищенной как C1-6алкиловый эфир, в соединение формулы (I), как оно определено в п.1.
40. Способ лечения или профилактики астмы, при котором человеку или животному вводят эффективное количество соединения по п.1.
Текст
Настоящее изобретение относится к терапевтически активным бициклическим соединениям, способам производства указанных соединений, фармацевтическим препаратам, содержащим указанные соединения и применению указанных соединений в химиотерапии. В частности, мы обнаружили группу бициклических соединений, которые являются эффективными при лечении воспалительных заболеваний. Воспаление является первичной реакцией на повреждение ткани или микробную инвазию и характеризуется связыванием циркулирующих лейкоцитов с сосудистым эндотелием и экстравазацией их через сосудистый эндотелий. Циркулирующие лейкоциты включают в себя нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты. Различные формы воспалений подразумевают различные типы инфильтрующих лейкоцитов. Воспалительный процесс может быть задействован различными путями, в том числе инфекцией, повреждением ткани и аутоиммунными реакциями. Как часть воспалительного процесса,нейтрофилы двигаются из кровотока в участок поражения ткани. Нейтрофилы содержат большие количества различных внутриклеточных гранул, и когда они активированы в участке воспаления, то содержимое этих гранул секретируется в ткань. Различные гранулы содержат множество ферментов и других белков, многие из которых обладают антибактериальными свойствами. Одним из ферментов, найденных в азурофильных гранулах, является нейтрофильная эластаза. Нейтрофильная эластаза обладает широким спектром действия в организме. Например, в легких фермент увеличивает выработку слизи и изменяет клеточный состав эпителия. Фермент также вызывает изменения сосудистой проницаемости в микроциркуляции многих тканей и является сильным деструктивным агентом по отношению к компонентам соединительной ткани. Несмотря на то, что внутри организма существуют эндогенные ингибиторы эластазы, в том числе антитрипсин и ингибитор протеазы лейкоцитов, активность эластазы вовлечена в патогенез ряда болезненных состояний, включая воспалительные заболевания дыхательных путей, суставов и кожи. Этот фермент также является ответственным за некоторые или большую часть симптомов острого респираторного дистресс-синдрома (ARDS) и других острых воспалительных состояний, вызванных травмой и/или сепсисом. Теперь мы обнаружили новую группу соединений, которые ингибируют нейтрофильную эластазу. Следовательно, соединения обладают потенциальным терапевтическим преимуществом при лечении и значительном улучшении симптомов заболеваний, в которые вовлечена активность эластазы. 2 Так, согласно одному из аспектов этого изобретения предложено соединение общей формулы (I)R1 представляет собой C1-6 алкил; С 2-6 алкенил; арил, арил-С 1-4 алкил, арил-С 2-4 алкенил, гетероарил, гетероарил-С 1-4 алкил, или гетероарилС 2-4 алкенил, или такую группу, в которой арильная или гетероарильная группировка замещена одной или более чем одной С 1-4 алкильной, галогено, тетразолильной, трифторметилсульфонамидной, NR9 СО-С 1-8 алкильной, -(CH2)m-NR4R5,-CN, -COOR9, -CONR9R10, -NO2, -SO2-С 1-6 алкил,-СF3 или-СН 2 (СF2)0-4 СF3; арил или гетероарил, причем арил или гетероарил являются моноциклическими или имеют два конденсированных кольца,одно из которых может быть насыщенным, и арильная и гетероарильная группы могут быть замещены одной или более чем одной С 1-4 алкильной, галогено, -NR7R8, -SO2NR7R8,-CONR7R8, C1-6 алкилэфирной, -CN, -CH2OH,-O-C1-6 алкильной, -СF3 или нитрогруппой; арилС 1-4 алкил, арил-С 1-4 алкил-NН- или арил-С 2-4 алкенил, или такие группы, где арил замещен одной или более чем одной С 1-4 алкильной или галогеногруппой;R4 и R5 независимо представляют собой водород,С 1-4 алкил,С 1-4 алкокси,-(CH2)1-4CONR11R12, -СО-С 1-4 алкил или фенил, возможно замещенный одной или более чем одной С 1-4 алкильной или галогеногруппой, или R4 и R5 могут быть объединены так, что NR4R5 представляет собой моно-, би- или трициклическую кольцевую систему, содержащую 4-15 кольцевых атомов углерода, где одно или более чем одно кольцо может быть возможно прервано одним или более чем одним гетероатомом, выбранным из О, N или S, и где один или более чем один кольцевой атом углерода может иметь карбонильную функциональность; или -(CH2)n-NR4R5 может представлять собой группу формулы 1 а где R6 представляет собой водород или карбоксиС 1-6 алкиловый эфир, n1 равно 0 - 6, и а и b независимо представляют собой целые числа 0-3,при условии, что а+b находится в интервале 3-5;R7, R8, R9, R10, R11, R12 независимо представляют собой водород или С 1-4 алкил;m представляет собой целое число от 0 до 8;n представляет собой целое число от 1 до 9; и его соли и его сольваты. Формула (I) показывает относительную стереохимию хиральных центров. Изобретение включает в себя соединения формулы (I) как в форме рацемата, так и в форме, в которой один энантиомер преобладает или является единственным. Обычно, мы предпочитаем предлагать соединение формулы (I) в энантиомерно чистой форме. Несмотря на то, что используемый здесь"алкил" включает в себя как разветвленный, так и нормальный алкил, он также может включать в себя циклоалкил, если присутствуют три или более чем три атома углерода. Когда R4 и R5 объединены так, что -NR4R5 представляет собой моно-, би- или трициклическую кольцевую систему, то одно или более чем одно кольцо может быть ненасыщенным или ароматическим. Примеры кольцевых систем, которые может представлять -NR4R5,включают в себя ненасыщенные моноциклы,такие как азетидин, пирролидин, пиперидин,азепин, пиперазин, морфолин; бициклы, такие как дигидрозохинолин, тетрагидрозохинолин,октагидроизохинолин, дезметилтропан; и трициклы, такие как гексагидробензоизоиндол. Карбонилсодержащие кольцевые системы включают в себя пирролон (например пиррол-2-он) и оксопиридин (например 2-оксо-2 Н-пиридин и 4-оксо 4 Н-пиридин). Кольцевые атомы углерода могут быть замещены С 1-4 алкильной, CONR'R", COOR'(R', R" независимо представляют собой водород или С 1-4 алкил) или галогенной группами, а кольцевые атомы азота могут быть замещены С 1-4 алкильной или -СО-С 1-4 алкильной группами. Особенно подходящие заместители углерода включают в себя метил (например как в 2,5 диметилпирролидине и 2,6-диметилпиперидине),-CONH2(например,как в 4-(Н 2NСО)пиперидине) и -СООМе (например, как в 2(МеОСО)-пирролидине). Подходящие заместители азота включают в себя метил (например, как в 4-метилпиперазине) и -СОМе (например, как в 4-(МеСО)-пиперазине). Подходящие алкильные группы R4, R5 включают в себя метил, этил, н-пропил, изопропил и циклопропил. Подходящие алкоксигруппы R4, R5 включают в себя метокси. 4 Подходящие -(CH2)1-4CONR11R12 группы R4,R5 включают в себя -CH2CONH2. Подходящие -СО-С 1-4 алкильные группы R4,R5 включают в себя -СОМе. Подходящие алкильные группы R1 включают в себя метил, этил и пропил. Подходящие C2-6 алкенильные группыR1 включают в себя СН=СН-СН 3. Подходящие арильные группы R1 имеют вплоть до двух колец. Приемлемо они включают в себя фенил и нафтил, наиболее приемлемо фенил. Подходящие арилалкильные группы R1 включают в себя фенилметил и фенилэтил. Подходящие арилалкенильные группы R1 включают в себя стирил. Особенно подходящие R1 арильные заместители включают в себя С 1-4 алкил, такой как метил или этил; С 1-6 алкокси, такой как метокси,этокси и н-бутокси; галогено, такой как хлоро,бромо или йодо; -SO2 С 1-6 алкил, такой какNНСОМе. Часто это будет 1, 2 или 3 таких заместителя. Подходящие гетероарильные группы R1 включают в себя группы, содержащие гетероатомы серы, азота или кислорода. Подходящие гетероарильные группы R1 будут иметь вплоть до двух колец. Примеры включают в себя имидазолил, возможно N-замещенный С 1-4 алкилом; пиридил; фуранил; пирролил и тиенил. Подходящие гетероарил-алкильные и-алкенильные группы R1 включают в себя пиридилметил, пиридилэтил и пиридилэтенил. Подходящие R1 гетероарильные заместители включают в себя заместители, описанные выше относительно арильных заместителей. Подходящие -(CH2)n-NR4R5 группы для R1 также включают в себя группы вышеупомянутой формулы (la), в которой n1 равно 0, а равно 2, и b равно 2, или n1 равно 0, а равно 0 и b равно 3. Карбоксиалкилэфирные группы R6 включают в себя трет-бутил. Подходящие C2-8 алкенилNR4R5 группы R1 в частности включают в себя -CH=CH-CH2-NR4R5 группы. Такие подходящие NR4R5 группы включают в себя морфолин, азепин; пирролидин(возможно замещенный СООМе или метилом); пиперидин (возможно замещенный -CONH2 или метилом); пиперазин (возможно 4-замещенный метилом или -МеСО); -NНС 1-4 алкил, такой какR1 включают в себя СН=СН-СО-(4-метил-1 пиперазин). Предпочтительные R1 группы включают в себя С 2-8 алкенил-NR4R5; фенил, фуранил, тиофенил или пирролил, замещенные группой (CH2)nNR4R5 (где n' представляет собой целое число от 1 до 5), и фенил, замещенный -NНСОС 1-8 алкилом. Особенно предпочтительные R1 группы включают в себя группы, которые только что были определены, в которых NR4R5 представляет собой морфолин, пирролидин, пиперидин, азепин, пиперазин или 4-метилпиперазин,либо один или оба R4 и R5 представляют собой С 1-4 алкил (например метил, н-пропил или циклопропил), а другой (если он не представляет собой С 1-4 алкил) представляет собой водород. Также предпочтительно то, что n' представляет собой целое число от 1 до 3, в особенности 1. Когда R1 представляет собой фенил,замещенный-NHCOC1-8 алкилом,предпочтительной С 1-8 алкильной группой является метил. Когда R1 представляет собой С 2-8 алкенилNR4R5, предпочтительной группой является С 3-6 алкенил-NR4R5, в особенности CH=CH-CH2NR4R5. Предпочтительные Х группы включают в себя -СО- и -SO2-. Особенно предпочтительно,когда Х представляет собой -СО-. Подходящие алкильные группы R2 включают в себя этил, н-пропил и изопропил. Подходящие алкенильные группы R2 включают в себя -СН 2-СН=СН 2. Подходящие алкокси и алкилтио группы R2 включают в себя метокси и метилтио. Предпочтительно R2 представляет собой С 24 алкил, особенно н-пропил или изопропил, в частности изопропил. Подходящие алкильные группы R3 включают в себя метил, этил и пропил, особенно метил. Подходящие -CH2(CF2)0-4CF3 группы R3 включают в себя СН 2 СF3. Подходящие арильные группы R3 включают в себя фенил, нафтил и тетрагидронафталин. Подходящие заместители таких арильных групп R3 включают в себя NH2, N(СН 3)2,SO2N(СН 3)2, NO2 и алкил, алкокси и галогено группы, которые определены выше и являются подходящими в отношении R1 арильных заместителей. Другие подходящие заместители также включают в себя CONH2, метиловый эфир 6 Подходящие гетероарильные группы R3 включают в себя группы, содержащие серу, азот или кислород, такие как бензотиофенил, бензотиадиазолил, тиофенил, изоксазолил, пиридинил,хинолинил, изохинолинил, тетрагидрохинолинил и тетрагидроизохинолинил. Подходящие заместители для таких групп включают в себя арильные заместители R3, упомянутые выше. Подходящие арилалкильные и арилалкиламиногруппы R3 включают в себя фенилметил,фенилэтил, фенилпропил, фенилметиламино и фенилэтиламино. Подходящие аралкенильные группы R3 включают в себя стирил. Подходящие заместители для таких R3 групп включают в себя алкил (особенно метил) или галогено. Предпочтительно R3 представляет собой С 1-6 алкил, особенно метил или этил, в частности метил.R7, R8, R9, R10, R11 и R12 предпочтительно представляют собой водород или метил.n предпочтительно представляет собой целое число от 1 до 5, более предпочтительно целое число от 1 до 3, в частности 1.m предпочтительно представляет собой целое число от 0 до 3, в особенности 1 или 2. Если соединения формулы (I) способны образовывать соли, настоящее изобретение распространяется на физиологически приемлемые соли соединений формулы (I). Подходящие физиологически приемлемые соли соединений формулы(I) включают в себя неорганические основные соли, такие как соли щелочных металлов (например соли натрия и калия) и соли аммония, и органические основные соли. Подходящие органические основные соли включают в себя соли аминов, такие как соли триалкиламина (например триэтиламина), диалкиламина (например дициклогексиламина), возможно замещенного бензиламина (например фенилбензиламина или п-бромбензиламина), прокаина, этаноламина,диэтаноламина,N-метилглюкозамина и три(гидроксиметил)метиламина и соли аминокислот (например соли лизина и аргинина). Подходящие неорганические и органические кислотные соли включают в себя гидрохлорид, трифторацетат и тартрат. Наиболее предпочтительные соединения по изобретению имеют следующую структуру:(показана относительная стереохимия) где R100 представляет собой группировку формулы -СН=СН-СН 2-пиперидин-1-ил (Е-изомер),СН=СН-СН 2-NН(циклопропил)(Е-изомер),-фенил-4-[СН 2-(4-метилпиперазин-1-ил)], фенил 4-[СН 2-NН(циклопропил)] или фенил-4-[СН 2N(Ме)(н-пропил)]. Особенно предпочтительным является (3S, 3aS, 6aR) энантиомер. Способность соединений формулы (I) ингибировать активность нейтрофильной эластазы может быть продемонстрирована, например, с использованием следующих in vitro и in vivo тестов. Тесты in vitro нейтрофильной эластазы человека Содержание теста: 50 мМ Tris/HCl (pH 8,6) 150 мМ NаСl 11,8 нМ очищенной нейтрофильной эластазы человека Подходящие концентрации тестируемого соединения приготовлены из 10 мМ основного раствора в диметилсульфоксиде, разбавленного водой. Вышеупомянутые значения являются конечными концентрациями после добавления раствора субстрата (см. ниже). Вышеупомянутую смесь культивируют в течение 15 мин при 30 С, причем за это время остаточную активность эластазы измеряют в течение 10 мин в BioTek 340i планшет-ридере после добавления 0,6 мМ МеО-сукцинил-аланилаланил-пролил-валил-п-нитроанилида. Скорость увеличения поглощения при 405 нм пропорциональна активности эластазы. Составляют график зависимости активности фермента от концентрации ингибитора, а ИК 50 определяют, используя подходящее программное обеспечение для обработки кривой. Активность ингибиторов нейтрофильной эластазы человека in vivo Самок хомяков (100-150 г) анестезируют, и в трахею закапывают (через небольшой надрез) 0,1 мл растворителя (7% диметилсульфоксида) или раствора ингибитора. В точно определенное время после введения ингибитора таким же самым способом закапывают нейтрофильную эластазу человека (75 меджународных единиц в 0,1 мл). Через 45 мин после закапывания эластазы животных умерщвляют. Стерильный физиологический раствор доставляют в легкие через канюлю 23 размера, прикрепленную к шприцу для подкожных инъекций. После пяти промывок аликвотами по 2,5 мл собирают бронхоальвеолярную жидкость лаважа (приблизительно 1,52,0 мл). Жидкости лаважа разбавляют равным объемом 2%-ного раствора карбоната натрия. Для обеспечения разрушения клеток перед спектрофотометрическим определением концентрации гемоглобина применяют ультразвук. Степень кровоизлияния выражают в виде концентрации гемоглобина, а действие ингибитора эластазы выражают как % ингибирования кровоизлияния по сравнению с растворителемконтролем. Соответственно, соединения формулы (I) обладают потенциальным терапевтическим преимуществом при лечении и значительном улучшении симптомов заболеваний, при которых вовлечена активность эластазы. В частности,такие заболевания включают в себя бронхит, в 8 том числе хронический бронхит. Такие заболевания включают в себя также любое хроническое обструктивное заболевание легких (ARDC). Примеры болезненных состояний, при которых соединения по изобретению обладают потенциальными терапевтическими преимуществами, включают в себя воспалительные заболевания дыхательных путей, такие как бронхит(в том числе хронический бронхит), бронхоэктаз,астма и гиперреактивные состояния легкого,острый респираторный дистресс-синдром и септический шок, воспалительные или деструктивные состояния легкого, такие как эмфизема и кистозный фиброз, и воспалительные или деструктивные состояния наружной ткани, такие как заболевания кожи (например волчанка и псориаз), и периодонтальное заболевание, в том числе гингивит. Другие примеры болезненных состояний и условий, при которых соединения по изобретению обладают потенциальными терапевтическими преимуществами, включают в себя заживление и лечение ожогов, сердечнососудистые заболевания, такие как инфаркт миокарда и удар,заболевание периферийных сосудов, в том числе перемежающуюся хромоту, атеросклероз, реперфузионное повреждение,сердечнососудистые изменения, происходящие при хирургии экстрапульмонального кровообращения,и септицемия. Соединения по изобретению также можно применять при лечении заболеваний соединительной ткани, таких как ревматоидный артрит,остеоартрит и спондилит, и воспалительных состояний почек, таких как гломерулонефрит. Их также можно применять при лечении некоторых лейкозов, в том числе острого миелолейкоза, острого миеломоноцитарного лейкоза и хронических моноцитарных лейкозов, и при предотвращении или ингибировании метастазирования твердых опухолей, например раков легкого,груди, предстательной железы и желудка и меланомы. Конкретным аспектом настоящего изобретения является применение соединений формулы(I) при лечении хронического бронхита. Хронический бронхит является состоянием, которое наступает в результате воздействия на поверхность дыхательных путей вредных химических веществ или агентов или является вторичным по отношению к другому заболеванию. Симптомы данного состояния вызывает чрезмерная секреция слизи на поверхность дыхательных путей. Этот избыток слизи не может быть эффективно удален, и результатом является пониженный газообмен в легких, приводящий к затрудненному дыханию и гипоксемии, возвратным микробным инфекциям и персистентному кашлю, ассоциированному с отхаркиванием слизистого материала. Предполагаемый механизм чрезмерной секреции слизи включает в себя накопление нейтрофилов в дыхательных путях после воздейст 9 вия раздражающих материалов на эпителий; нейтрофилы выделяют эластазу на поверхность дыхательных путей, и этот фермент вызывает как увеличение количества слизи, выделяемой на поверхности дыхательных путей, так и значительное изменение клеточного состава эпителия дыхательных путей. Следовательно, ингибирование активности эластазы путем введения соединений по данному изобретению является подходом для лечения хронического бронхита. Ослабленная функция легкого в ARDC (например в хронических бронхитах с обструкцией воздушного потока) также является следствием опосредованного эластазой повреждения легкого, которое приводит к сужению и воспалению дыхательных путей. Таким образом, ингибитор эластазы будет улучшать легочную функцию. Как указано выше, соединения формулы (I) применяют в медицине и ветеринарии, в частности в качестве ингибиторов ферментной нейтрофильной эластазы. Таким образом, далее в настоящем изобретении предложено соединение формулы (I) или его физиологически приемлемая соль или сольват для применения в медицине или ветеринарии, в частности при лечении состояний, при которых вовлечена активность эластазы, таких как хронический бронхит. Очевидно, что ссылки здесь на лечение распространяются на профилактику, а также на лечение установленных состояний. Согласно другому аспекту данного изобретения предложено применение соединения формулы (I) или его физиологически приемлемой соли или сольвата для производства лекарственного средства для лечения состояний, при которых вовлечена активность эластазы, в частности хронического бронхита. В еще одном или альтернативном аспекте предложен способ лечения человека или животного с состоянием, вызванным или опосредованным активностью эластазы, при котором указанному человеку или животному вводят эффективное количество соединения формулы (I) или его физиологически приемлемой соли или сольвата. Соединения по изобретению могут быть приготовлены в виде препаратов для введения любым приемлемым способом, и, следовательно,изобретение также охватывает в своем объеме фармацевтические композиции для применения в терапии, содержащие соединение формулы (I) или его физиологически приемлемую соль или сольват в смеси с одним или более чем одним физиологически приемлемым разбавителем или носителем. Согласно изобретению предложен также способ получения такой фармацевтической композиции, который включает в себя смешивание ингредиентов. Соединения по изобретению могут быть,например, приготовлены в виде препаратов для 10 перорального, буккального, парентерального,местного или ректального введения. Таблетки и капсулы для перорального введения могут содержать традиционные эксипиенты, такие как связывающие агенты, например сироп, аравийскую камедь, желатин, сорбит, трагакант, слизь крахмала или поливинилпирролидон; наполнители, например лактозу, микрокристаллическую целлюлозу, сахар, маисовый крахмал, фосфат кальция или сорбит; смазывающие агенты, например стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль или диоксид кремния; разрыхлители, например картофельный крахмал, кроскармелозунатрий или крахмальный гликолат натрия; или смачивающие агенты, такие как лаурилсульфат натрия. Таблетки могут быть покрыты в соответствии со способами, хорошо известными в технике. Пероральные жидкие препараты могут быть в форме, например,водных или масляных суспензий, растворов,эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для разведения водой или другим подходящим растворителем перед применением. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например сироп сорбита, метилцеллюлозу, сироп глюкозы/сахара, желатин, гидроксиметилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия или гидрогенизированные пищевые жиры; эмульгаторы, например лецитин, сорбитмоноолеат или аравийскую камедь; неводные растворители (которые могут включать в себя пищевые жиры), например миндальное масло,фракционированное кокосовое масло, жирные эфиры, пропиленгликоль или этиловый спирт; или консерванты, например метил- или пропилп-гидроксибензоаты или сорбиновую кислоту. Препараты также могут содержать буферные соли, корригенты, красители и/или подсластители (например маннит) в зависимости от назначения. Для буккального введения композиции могут принимать форму таблеток или пастилок,приготовленных традиционным способом. Соединения также могут быть приготовлены в виде суппозиториев, например содержащих традиционные суппозиторные основы, такие как масло какао или другие глицериды. Соединения по изобретению также могут быть приготовлены для парентерального введения путем болюсной инъекции или непрерывной инфузии и могут быть представлены в форме стандартной дозы, например в виде ампул, пузырьков, шприцев для небольшого объема вливаний или предварительно заполненных шприцев, или в виде контейнеров, содержащих много доз вместе с добавленными консервантами. Композиции могут принимать такие формы, как растворы, суспензии или эмульсии в водных или неводных растворителях, и могут содержать агенты, входящие в состав препарата, такие как антиоксиданты, буферы, антимикробные агенты и/или агенты, регулирующие токсичность. Альтернативно, активный ингредиент может быть в форме порошка для разведения в подходящем растворителе, например стерильной, свободной от пирогена воде, перед применением. Сухой твердый препарат можно получить заполнением стерильным порошком в стерильных условиях отдельных стерильных контейнеров или заполнением стерильным раствором в стерильных условиях каждого контейнера и лиофилизацией. Под местном введением здесь подразумевается введение путем инсуффляции и ингаляции. Примеры различных типов препарата для местного введения включают в себя мази, кремы,лосьоны, порошки, пессарии, распылители, аэрозоли, капсулы или патроны для использования в инсуффляторе или ингаляторе или капли (например, капли для глаз или носа). Мази и кремы можно, например, приготовить на водной или масляной основе с добавлением подходящих загустителей и/или гелеобразующих агентов и/или растворителей. Так, такие основы могут, например, включать в себя воду и/или масло, такое как жидкий парафин или растительное масло, такое как арахисовое масло или касторовое масло, или растворитель, такой как полиэтиленгликоль. Загустители, которые можно использовать, включают в себя мягкий парафин,стеарат алюминия, кетостеариловый спирт, полиэтиленгликоли, микрокристаллический воск и пчелиный воск. Лосьоны могут быть приготовлены на водной или масляной основе, и они обычно будут также содержать один или более чем один эмульгатор, стабилизатор, диспергирующий агент, суспендирующий агент и загуститель. Порошки для наружного применения могут быть приготовлены с помощью любой подходящей порошковой основы, например талька, лактозы или крахмала. Капли могут быть приготовлены на водной или неводной основе, также содержащей один или более чем один диспергирующий агент, солюбилизирующий агент или суспендирующий агент. Композиции спреев могут быть приготовлены, например, в виде водных растворов или суспензий или в виде аэрозолей, доставляемых из упаковок, находящихся под давлением, с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана,дихлортетрафторэтана, 1,1,1,2,3,3-гептафторпропана, 1,1,1,2-тетрафторэтана, диоксида углерода или другого подходящего газа. Капсулы и патроны для использования в ингаляторе или инсуффляторе, например желатиновые, могут быть приготовлены в виде препаратов, содержащих порошковую смесь соединения по изобретению и подходящую порошковую основу, такую как лактозу или крахмал. Фармацевтические композиции по изобретению также можно применять в комбинации с 12 другими терапевтическими агентами, например противовоспалительными агентами, такими как кортикостероиды или NSAIDs (нестероидные противовоспалительные лекарственные средства), бронхорасширяющими средствами, такими как бета-2-адренергические агонисты и ксантины(например теофиллин), муколитическими агентами, антимускаринами, антилейкотриенами,ингибиторами клеточной адгезии (например,антагонистами ICAM), антиоксидантами (например, N-ацетилцистеин), легочными поверхностно-активными веществами и/или противомикробными и противовирусными агентами. Композиции по изобретению также можно применять в комбинации с генной заместительной терапией. Таким образом, далее в изобретении предложена комбинация, содержащая соединение формулы (I) или его физиологически приемлемую соль или сольват вместе с другим терапевтически активным агентом. Комбинацию, упомянутую выше, приемлемо представлять для применения в форме фармацевтического препарата, и, таким образом,фармацевтические препараты, включающие в себя комбинацию, как определено выше, вместе с ее фармацевтически приемлемым носителем,представляют собой еще один аспект изобретения. Индивидуальные компоненты таких комбинаций можно вводить либо последовательно либо одновременно в отдельных или комбинированных фармацевтических препаратах. Соответствующие дозы известных терапевтических агентов будут очевидны квалифицированным специалистам. Соединения по изобретению можно приемлемо вводить в количествах, например, от 0,01 до 50 мг/кг веса тела, лучше от 0,05 до 25 мг/кг веса тела, перорально один или более чем один раз в день. Точная доза, конечно, будет зависеть от возраста и состояния пациента, выбранного конкретного способа введения и заболевания,которое лечат. Соединения, конкретно названные ранее, предпочтительно вводят перорально для лечения бронхита. Для других показаний могут быть необходимы другие способы введения, например внутривенно для ARDS. Соединения формулы (I) обладают подходящей продолжительностью действия. Соединения формулы (I) и их соли и сольваты можно получить по методике, описанной ниже, составляющей дальнейший аспект настоящего изобретения. Способ по изобретению для получения соединения формулы (I) включает в себя(i) конденсацию соединения формулы (II)R1SO2Y, где Y представляет собой реакционноспособную группу, такую как галоген; или(ii) сульфонилирование соединения формулы (III) соединением YO2SR3, где Y представляет собой реакционноспособную группу, такую как галоген, например хлор; или(iii) получение соединения формулы (I), где Х представляет собой(vii) получение соединения формулы (I) окислением соответствующего соединения формулы (VIII) где Ха представляет собой серу или SO; или(viii) получение соединения формулы (I), в которой R1 представляет собой арил, замещенный группой -(CH2)m'NR4R5, где m' является целым числом от 1 до 8, восстановительным аминированием соответствующего соединения формулы (IX) взаимодействием соединения формулы (IV) с соединением R1OH, где Y представляет собой реакционноспособную группу, такую как группы, указанные выше; или(iv) получение соединения формулы (I), в которой R2 представляет собой С 2-4 алкил или С 2-4 алкенил, взаимодействием соединения формулы (V) последовательно с основанием, а затем с соединением R2Y, где Y представляет собой реакционноспособную группу, такую, как группы, указанные выше, и R2 представляет собой С 2-4 алкил или С 2-4 алкенил; или (v) циклизацию соединения формулы (VI)(ix) получение соединения формулы (I), в которой R1 представляет собой -(CH2)nNR4R5,восстановительным аминированием соответствующего соединения формулы (X)(х) получение соединения формулы (I), в которой R1 представляет собой арил, замещенный группой -(CH2)m'NR4R5, где m' является целым числом от 1 до 8, взаимодействием соответствующего соединения формулы (XI) или его эфира карбоновой кислоты; или(vi) получение соединения формулы (I), где Х представляет собой окислением соединения формулы (VII) где Хa представляет собой серу или SO; или где Hal представляет собой галогенид, особенно хлор или бром, с соединением формулы HNR4R5; или(xi) получение соединения формулы (I), в которой R1 представляет собой -(CH2)nNR4R5 илиC2-8 алкенилNR4R5,взаимодействием соответствующего соединения формулы (ХII)(xii) получение соединения формулы (I),где R1 содержит N-С 1-4 алкилпиперазинильную группировку, при котором алкилируют соответствующее соединение формулы (I), где пиперазин является неалкилированным; или(xiii) получение соединения формулы (I),где R1 содержит N-С 1-4 алкилпиперазинильную группировку, при котором выполняют восстановительное алкилирование соответствующего неалкилированного соединения формулы (I); или(xiv) превращение одного соединения формулы (I) в другое соединение формулы (I); или(xv) очистку одного энантиомера соединения формулы (I) от его рацемической смеси; и при желании или необходимости превращение полученного свободного кислотного или основного соединения формулы (I) в форму физиологически приемлемой соли или наоборот, или превращение одной солевой формы в другую физиологически приемлемую солевую форму. Способ (i) Реакцию конденсации с соединениемR1COOH приемлемо проводить в присутствии сочетающего агента, такого как 1-(3-N,Nдиметиламинопропил)-3-этилкарбодиимид,и растворителя, такого как дихлорметан, DMF, или тетрагидрофуран, при подходящей температуре между 0 С и температурой окружающей среды. Очевидно, что в качестве альтернативы использованию R1COOH могут быть использованы производные от кислоты, такие как хлорангидрид, ангидрид или смешанный ангидрид. Реакционные условия будут соответственно изменены, например путем включения основания. Реакцию с R1SO2Y и R1OCO.Y приемлемо проводить в присутствии основания, такого как триэтиламин, и растворителя, такого как DCM,при подходящей температуре между 0 С и температурой окружающей среды. Способ (ii) Реакцию сульфонилирования приемлемо проводить в присутствии литийбис (триметилсилил)амида (LHMDS) или NaH в растворителе,таком как тетрагидрофуран, при подходящей температуре между -78 и 0 С. 16 Способ (iii) Данную реакцию приемлемо проводить в присутствии органического основания, такого как триэтиламин, и в растворителе, таком как дихлорметан, при подходящей температуре 025 С. Способ (iv) Данную реакцию приемлемо проводить в присутствии сильного основания, такого какLHMDS, в присутствии растворителя, такого как тетрагидрофуран, при пониженной температуре,такой как от -78 до 0 С. Способ (v) Реакцию циклизации приемлемо проводить в присутствии 2-хлор-1-метилпиридинийхлорида или 1-(3-N,N-диметиламинопропил)-3 этилкарбодиимида (EDC) в растворителе, таком как дихлорметан, при подходящей температуре 0 С - температура дефлегмации. Данная реакция также может быть выполнена с использованием производного тиоэфира карбоновой кислоты соединения формулы (VI). Способы (vi и vii) Данные реакции окисления можно проводить традиционным образом, таким как окисление надкислотой. Способы (viii и ix) Реакция восстановительного аминирования может быть выполнена обработкой альдегида амином в присутствии кислоты, например уксусной кислоты, в инертном растворителе, таком как DCM или THF, с последующим добавлением мягкого восстановителя, такого как триацетоксиборгидрид натрия. Способы (х и хi) Данные реакции могут быть выполнены соединением реагентов, возможно в присутствии основания, такого как триэтиламин или карбонат калия, в инертном апротонном растворителе,таком как ДМF или MeCN. Относительно реакции (xi) следует отметить, что для алкенилгалогенида во время реакции наблюдалась тенденция к перегруппировке с образованием -алкениламина. Способ (xii) Данная реакция может быть выполнена обработкой соединения, содержащего пиперазинил, алкилгалогенидом (например метилбромидом), возможно с предшествующим отщеплением протона (например основанием, нВuLi). Способ (xiii) Восстановительное алкилирование может быть выполнено сначала продуцированием промежуточного иминиевого соединения в результате взаимодействия неалкилированного пиперазинильного соединения формулы (I) с карбонилсодержащим соединением (например формальдегидом), в обычных условиях, например в инертном растворителе (таком как DCM), в присутствии кислоты, например ледяной уксусной кислоты, а затем восстановлением его восстано 17 вителем, например цианборгидридом натрия или триацетоксиборгидридом натрия. Способ (xiv) Примеры типичных взаимных превращений включают в себя восстановление NO2 группы доNH2 и алкенильной группы до алкильной; неполное или полное восстановление арильной или гетероарильной системы; и удаление Nзащитных групп,таких как третбутоксикарбонил или CBZ (бензилоксикарбонил). Такие реакции могут быть проведены традиционным образом, например гидрированием над палладием-на-угле в растворителях, таких как этилацетат или тетрагидрофуран. Способ (xv) Очистка индивидуального энантиомера может быть достигнута с помощью традиционных способов, таких как хиральная хроматография (например хиральная HPLC) и кристаллизация с гомохиральной кислотой (например виннокаменной кислотой). Физиологически приемлемые основные соли соединений формулы (I) могут быть приемлемо получены обработкой соединения формулы(I) подходящим основанием, таким как бикарбонат, например бикарбонат натрия, в присутствии подходящего растворителя. Кислотные соли,такие как гидрохлорид, трифторацетат или тартрат, могут быть получены обработкой основного соединения формулы (I) желаемой кислотой. Промежуточные соединения формулы (II) могут быть приемлемо получены по методике,приведенной ниже на схеме 1 Схема 1 Стадия (i) Соединения формулы (XIII) являются либо известными соединениями, либо они могут быть получены способом, аналогичным способу получения известных соединений. P1 является Nзащитной группой, предпочтительно CBZ (бензилоксикарбонилом). Стадия (i) представляет собой реакцию дополнительной N-защиты. P2 в формуле (XIV) является другой N-защитной группой,предпочтительно ВОС(третбутилоксикарбонилом). Когда Р 2 представляет собой ВОС, реакцию приемлемо проводить с использованием (ВОС)2 О. Реакцию приемлемо проводить в присутствии основания, такого как триэтиламин или 4 диметиламинопиридин, в растворителе, таком как этилацетат, при подходящей температуре 025 С. Стадия (ii) Это превращение приемлемо проводить с использованием п-толуолсульфоната пиридиния в растворителе, таком как ацетон/вода, при подходящей температуре между 25-27 С. Стадия (iii) Эта стадия представляет собой реакцию конденсации-перегруппировки, которую приемлемо проводить с использованием эфира 2 фенилтионилуксусной кислоты (PhSOCH2CO2R13) и пиперидина в растворителе, таком как ацетонитрил, при температуре окружающей среды. Подходящей R13 группой является С 1 алкильная группа, предпочтительно метильная. 6 Стадия (iv) Эта стадия представляет собой реакцию замещения Mitsunobu с использованием фталимида, РРh3 (трифенилфосфина) и DEAD (диэтилазодикарбоксилата) в присутствии растворителя,такого как THF при подходящей температуре 040 С. Стадия (v) Эта стадия представляет собой реакцию снятия защиты, предпочтительно с использованием сильной кислоты, такой как TFA, в растворителе, таком как DCM, при подходящей температуре 0-40 С. Стадия (vi) Эта стадия представляет собой реакцию циклизации, которую приемлемо проводить как внутримолекулярную реакцию Михаэля. Приемлемо использовать NaH в растворителе, таком как THF, при температуре, такой как 0-25 С. Стадия (vii) На этой стадии протекают две реакции: снятия защиты с азота и повторной защиты. Фталимидогруппу приемлемо удалять гидразингидратом в растворителе, таком как этанол, при температуре между 0 С и температурой дефлегмации. Защитную группу Р 3 вводят обычным способом. Если Р 3 представляет собой ВОС, то реакцию приемлемо выполнять с (ВОС)2O. Стадия (viii) Когда R2 представляет собой алкил или алкенил, тогда R2 боковую цепь можно вводить алкилированием, используя в качестве реагентаR2-Y, где Y является реакционноспособной группой, такой как бром или йод. Таким образом, реакцию проводят с использованием основания, предпочтительно сильного основания,такого как LHMDS. С LHMDS приемлемо использовать сорастворитель DMPU в THF. Подходящие температуры реакции находятся в интервале от -78 до 50 С. В этих условиях реакция обычно протекает с хорошим стереохимическим регулированием. Когда R2 представляет собой тиоалкил, тогда реакция может быть выполнена обработкой соединения формулы (XX) трет-бутилмагнийхлоридом и литийбис(триметилсилил)амидом, а затем алкилдисульфидом. Реакцию предпочтительно выполняют в малополярном растворителе, таком как THF или смесь THF и N,N,N',N'тетраметилэтилендиамина, при температуре ниже 0 С. Когда R2 представляет собой алкокси,тогда реакция может быть выполнена путем получения промежуточного гидрокси-соединения,используя последовательно реагенты: гексаметилдисилазид калия и 3-фенил-2-(фенилсульфонил)оксазиридин (обычно при -78 С в THF), а затем, после очистки, путем обработки промежуточного гидроксисоединения алкилгалогенидом(особенно йодидом) в присутствии оксида серебра(I). Стадия (iх) Эта стадия представляет собой реакцию гидролиза эфира, с последующей реакцией снятия защиты с азота. Первую из реакций проводят обычным способом, например используя КОН в водном этаноле при подходящей температуре 2580C. Последнюю из реакций проводят обычным способом, например используя НСl в диоксане при подходящей температуре 0-50 С, или если защитной группой является трифторацетат, то обрабатывая основанием. Стадия (х) Эта стадия представляет собой реакцию циклоконденсации, которую приемлемо проводить в присутствии 2-хлор-1-метилпиридиний 20 йодида и подходящего основания, такого какN,N-диизопропилэтиламин, в растворителе, таком как дихлорметан, при подходящей температуре 0 С - температура дефлегмации. Мы нашли также, что возможно использование соединения формулы (XXII) в виде эфира карбоновой кислоты, причем в этом случае гидролиз эфира на стадии (ix) не является необходимым. В этом случае предпочтительные условия для реакции циклоконденсации включают в себя использование алкильного реактива Гриньяра, например третBuMgCl в THF при температуре между -20 и 25 С. Стадия (xi) Эта стадия представляет собой реакцию сульфонилирования лактама. Ее приемлемо проводить путем взаимодействия с R3SO2-Y, где Y является реакционноспособной группой, предпочтительно хлором, в присутствии LHMDS,NaH или КН в растворителе, таком как THF, при подходящей температуре от -78 до 0 С. Стадия (xii) Эта стадия представляет собой реакцию снятия защиты с азота, которую можно проводить обычным способом. Так, когда P1 представляет собой CBZ, стадию приемлемо проводить путем гидрирования над катализатором Pd(OH)2 в растворителях, таких как этилацетат или THF. Промежуточные соединения формулы (III) могут быть получены взаимодействием лишенного защиты соединения формулы (XXIII) из схемы 1 с R1COOH, R1SO2Y или R1OCO.Y способом, описанным выше относительно способа(Первоначальное снятие защиты с азота можно проводить так, как описано выше на стадии (xii. Промежуточные соединения формулы (IV) могут быть получены из соединения формулы(II) например взаимодействием с трифосгеном, в растворителе, таком как DCM, при подходящей температуре 0-25 С. Промежуточные соединения формулы (V) могут быть получены способом, аналогичным способу для соединения формулы (I), полученному через соединение формулы (II), и по схеме 1, но при этом опускают стадию алкилирования(viii). Этот последний способ приводит к промежуточным соединениям (XXIIa) и (XXIIIa), которые имеют строение, соответствующее строению промежуточных соединений (XXII) и(XXIII), кроме случая, когда R2 представляет собой водород. Промежуточные соединения формулы (VI) могут быть получены из соединения формулы(XXII) способом, аналогичным описанному выше для получения соединения формулы (III) из соединения формулы (XXIII) вместе с главным способом (ii), указанным выше. Промежуточные соединения формулы (VII) могут быть получены взаимодействием соедине 21 ния формулы (II) с подходящим R1 сульфенилили тионилгалогенидом обычным способом. В случае, когда R2 представляет собой объемистую алкильную, алкилтио или алкенильную группу (особенно изо-Рr или трет-Вu), мы обнаружили, что соединения формулы (XXI) предпочтительно получать по следующей схеме 2,указанной ниже. Схема 2 Стадия (i) Для образования сложных алкиловых эфиров реакцию можно проводить в стандартных условиях, например путем обработки спирта,например метанола, в присутствии SOCl2. Стадия (ii) Реакция циклизации будет происходить при перемешивании в воде с Dowex 2 х 8 (предпочтительно 400 меш). Стадия (iii)P4 является защитной группой. Способы защиты аминогрупп хорошо известны квалифицированным специалистам, однако мы предпочитаем использовать трифторацетат (TFA). Амин, защищенный ТФА, образуется путем обработки соединения формулы (XXVI) метилтрифторацетатом в полярном протонном растворителе, например МеОН. Стадия (iv) Подходящие защитные группы P1 включают в себя CBZ. В этом случае соединение формулы (XXVII) можно обработать сильным основанием, таким как LHMDS или нВuLi в инертном растворителе, таком как THF, а затем CBZCI. Стадия (v) Это превращение будет происходить при обрабатывании соединения формулы (XXVIII) восстановителем, например борогидридом натрия, а затем концентрированной серной кислотой в присутствии растворителя, такого как алкиловый спирт, например этанол. Стадия (vi) Реакция соединений формулы (XXIX) и 22 инертном растворителе, например дихлорметане. Группа "алкил" в Оалкил и OSi(алкил)3 обычно представляет собой C1-6 алкил. В соединении формулы (XXX) подходящие алкильные группы в силилалкильной группировке включают в себя метил, изопропил и трет-бутил. Предпочтительным Оалкилом является OEt, a предпочтительным OSi(алкил)3 является OSi(i-Рr)3 илиOSi(Ме)2(трет-Вu). Также предусмотрено использование вариантов соединений формулы(XXX), в которых Оалкил заменяют наC1-3 алкилтио, могут быть получены обработкой соответствующего эфира карбоновой кислоты(R2CH2COOEt или другого сложного алкилового эфира, причем соединения являются либо известными, либо они могут быть получены известными способами) сильным основанием (например LHMDS), а затем триалкилсилилхлоридом (таким как триметилсилихлорид) или триалкилсилилтрифлатом. Обычно реакцию осуществляют при низкой температуре (ниже 0 С) в инертном растворителе (таком как THF) в присутствии DMPU. Соединения формулы (VIII), где Хa представляет собой S, могут быть получены взаимодействием соответствующего соединения формулы (III) с соединением формулы R3SSR3 в стандартных условиях для нуклеофильного замещения. Соединения формулы (VIII), где Ха представляет собой SO могут быть получены перкислотным окислением соответствующего соединения, где Ха представляет собой S. Соединения формулы (VII) могут быть получены аналогичным образом. Соединения формулы (IX), (X), (XI) и (XII) могут быть получены из соединений формулы(II), следуя традиционным способам, по существу известным. Дальнейший аспект изобретения конкретно относится к получению соединений формулы (I) скорее в форме единственных энантиомеров, чем в форме рацемической смеси. Промежуточные соединения на схеме синтеза приемлемо получать гомохиральным синтезом или разделением рацемической смеси. В одном из примеров этого аспекта изобретения получают (2R,3S) энантиомер соединения формулы (XX). Процедура показана на схеме 3. Стадия а Соединения формулы (XXXI)(S) являются либо известными соединениями, либо они могут быть получены способом, аналогичным способу получения известных соединений. P4 является защитной группой, такой как Р 3, рассмотренной выше, и приемлемо представляет собой ВOC. Реакцию приемлемо проводить с использованием PIFA (фенилйодсилбис(трифторацетата и основания, такого как пиридин, в водном растворителе, таком как водным THF, диоксан или ацетонитрил. Этот способ описан Stansfield C.F.CBZ. Эту реакцию защиты можно проводить традиционным способом. Например реакцию приемлемо проводить в растворителе, смешивающемся с водой, таком как THF, DMF или диоксан,используяN-(бензилоксикарбонилокси)сукцинамид,бензилоксикарбонилхлорид или любой подходящий источник бензилоксикарбонильной группы, при регулировании щелочного рН карбонатом натрия. Альтернативным способом, стадия b1, соединение формулы (XXXIII) может быть получено традиционным образом из (S) диаминомасляной кислоты. Стадия с Данную реакцию приемлемо проводить в две стадии. На первой стадии реакцию проводят при пониженной температуре с N-метилморфолином, а затем с алкилхлорформиатом, таким как этилхлорформиат, в органическом растворителе,таком как DCM, диоксан или THF. На второй стадии продукт приемлемо восстанавливать боргидридом натрия при пониженной температуре,такой как от -20 до 10 С, в растворителе, таком как THF. Стадия d Эту реакцию окисления можно приемлемо проводить любым подходящим способом, например используя оксалилхлорид в ДМСО и метилендихлорид в атмосфере азота при пониженной температуре, такой как от -30 до -70 С, а 24 затем триэтиламин. Промежуточное соединение можно не выделять. Стадия е Эту реакцию приемлемо проводить, используя реагент Виттига, такой как трифенилфосфоран R13O2 ССН=Рh3, или также можно проводить, используя фосфонат в реакции Wadsworth-Emmons. Стадия f Эту реакцию присоединения Михаэля приемлемо проводить, используя литийбис (триметилсилиламид) или другое подходящее сильное основание в подходящем органическом растворителе, таком как THF, эфир или толуол, и предпочтительно в присутствии комплексообразующего агента, такого как тетраметилэтилендиамин. В другом примере этого аспекта изобретения получают (2S,3R) энантиомер соединения формулы (XX). Процедура показана на схеме 4. Схема 4 Стадия а Эту реакцию приемлемо проводить, используя бензиловый спирт, PIFA и триэтиламин при повышенной температуре в подходящем растворителе, таком как DMF. Она аналогична методике Moutevelis-Minakakis and Photaki [J.Chem. Soc., Perkin Trans 1, 1985, 2277]. Соединения формулы (XXXI)(R) являются известными или аналогичны известным соединениям [Zaoral, Collect. Czech. Chem. Commun,1979, 44(4), 1179-86]. Стадия b Эту стадию проводят способом, аналогичным описанному выше для схемы 3, стадий с, d,e и f. В еще одном примере этого аспекта изобретения соединение формулы (XX) разделяют. Этого достигают приемлемым образом путем превращения такого соединения в соответствующий амин (XX)1 Это превращение приемлемо выполнять,используя любую сильную кислоту, такую какDCM, и щелочную промывку. Затем соединение формулы (XX)1 разделяют следующим образом: Любой подходящий разделяющий агент,предпочтительно (+)ди-п-толуоилвинную кислоту +)DPTTA), а затем перекристаллизацию,которую приемлемо проводить из этанола, используют для получения тартрата S-ряда, формулы (XX)2 (S) Обычно проводят две кристаллизации.R-ряд Любой подходящий разделяющий агент,предпочтительно (-)ди-п-толуоил-винную кислоту -)DPTTA), а затем перекристаллизацию, которую приемлемо проводить из этанола, используют для получения тартрата R-ряда, формулы Опять же обычно проводят две кристаллизации. После этой стадии разделения соединения формулы (XX)2 (S) и (XX)2 (R) можно снова защитить с получением желаемых соединений формулы (XX) (S) и (XX) (R). В качестве альтернативы вышеупомянутым способам промежуточные соединения могут быть разделены колоночной хроматографией,например с использованием хиральной HPLC системы. Промежуточные соединения формулы(XXIII) приемлемо разделять этим путем. Далее, должно быть ясно, что химию, показанную на схемах 3 и 4, можно воспроизвести,используя рацемические соединения. Например,схема 3 может быть воспроизведена с использованием диаминомасляной кислоты в качестве исходного материала. Ее используют для обеспечения другого пути получения рацемических промежуточных соединений (XX)1, которые затем можно разделить как описано выше. Схемы 3 или 4 также можно использовать для получения другого энантиомера. Альтернативный гомохиральный синтез некоторых промежуточных соединений формулы(XXIII) (особенно соединений, где R2 представляет собой алкил, алкенил или алкилтио), исходя из D-аспарагина, приведен на схеме 5: Стадия а Эта реакция может быть выполнена обработкой метилтрифторацетатом в полярном протонном растворителе, таком как метанол, в присутствии основания, такого как триэтиламин. Стадия b Эта реакция может быть выполнена обработкой ацетилхлоридом в соответствующем спирте, таком как метанол, при низкой температуре (обычно ниже 0 С). Стадия с Эта реакция дегидрирования может быть выполнена обработкой тозилхлоридом в присутствии пиридина в инертном растворителе. Стадия d Эта реакция восстановительной циклизации может быть выполнена перемешиванием раствора соединения формулы (XXXIX) в полярном протонном растворителе, таком как этанол, в атмосфере водорода в присутствии подходящего металлического катализатора, такого как 5% родий на окиси алюминия. Стадии e-f Эти реакции проводят в условиях, описанных выше для схемы 2, стадий (iv)-(vi). Стадия h Эту реакцию снятия защиты проводят путем обработки основанием, таким как карбонат калия. Стадия i Эта реакция замыкания кольца может быть выполнена обработкой трет-бутилмагнийхлоридом в инертном растворителе, таком как THF,в присутствии тетраметилэтилендиамина или следуя условиям схемы 1, стадия (х). Альтернативный синтез соединений формулы (XXVIII) (R), основанный на (R)метионине, приведен на схеме 6. Схема 6 Стадия (i) Эта стадия представляет собой обычную реакцию защиты, которая, в случае когда Р 2 представляет собой ВОС, может быть выполнена взаимодействием с (ВОС)2O в присутствии основания (например NaOH) в полярном растворителе, таком как диоксан/вода. Стадия (ii) Это превращение может быть выполнено обработкой бикарбонатом аммония в присутствии подходящего растворителя, такого как пиридин/DMF и в присутствии (ВОС)2O или подходящего эквивалента. Стадия (iii) Эта стадия представляет собой обычную реакцию защиты, которая, в случае когда P1 представляет собой CBZ, может быть выполнена взаимодействием с нBuLi, а затем с CBZ-Cl в присутствии инертного растворителя, такого как ТНF, при температуре ниже -50 С. Стадия (iv) Эта реакция может быть выполнена обработкой RX, где RX представляет собой соединение, способное превращать серу в SMe группировке в сульфоний, например MeI, бензилйодид или Me2SO4, в подходящем растворителе, например пропаноне или ацетонитриле. Обычно R будет представлять собой алкил или аралкил, а Х будет представлять собой галогенид, особенно йодид, или сульфат. Защита амида является приемлемой, но не необходимой для этой реакции. Стадия (v) Эта реакция замыкания кольца может быть выполнена обработкой Dowex 2 х 8 400 меш ОНсмолой в подходящем растворителе, например МеСN. Альтернативно, реакция замыкания кольца может быть выполнена обработкой карбонатом калия в подходящем растворителе, напримерMeCN. Стадия (vi) Снятие защиты может быть выполнено обычным способом, например, ВОС, защитная 28 группа может быть удалена обработкой HCl, например в диоксане. Стадия (vii) Эта реакция может быть выполнена обработкой алкиловым эфиром трифторуксусной кислоты (например метиловым эфиром) в присутствии подходящего основания, например Nметилморфолина. Очевидно, что реакции на схемах 5 и 6 могут быть выполнены, исходя из (L)-аспарагина и(S)-метионина, соответственно, с получением энантиомеров соединений, указанных на схемах. Альтернативно, их можно выполнять, используя исходные рацемические материалы, причем в этом случае будет необходима стадия хирального разделения. Было обнаружено, что если соединения формулы (XLV) в рацемической форме получают по схеме 6 из рацемического метионина, то изомеры соединений формулы (XLV) могут быть разделены посредством динамического разделения. Таким образом, рацемическое соединение формулы (XLV) может быть обработано гомохиральной ди-п-толуоил-винной кислотой в присутствии 3,5-дихлор-2-гидроксибензальдегида в качестве катализатора в инертном растворителе,например THF. В результате получают гомохиральную соль соединения формулы (XLV). Соединение формулы (XXVIII)1 затем может быть получено последующей обработкой метиловым эфиром трифторуксусной кислоты в присутствииN-метилморфолина. Другой альтернативный синтез соединений формулы (XXIII) из схемы 1 в гомохиральной форме, в которой R2 представляет собой изопропил, представлен на схеме 7 Схема 7(XXIII)1 может быть также получен после выделения противоположного энантиомера из хиральной HPLC на третьей стадии. Соединение формулы (LIV) на схеме 7 может быть альтернативно получено по следующей схеме 8 Схема 8 Очевидно, что способ схемы 8 может быть также адаптирован для получения соединений противоположной хиральности. Квалифицированным специалистам будет очевидно, что вышеупомянутые способы синтеза для получения соединений формулы (I) могут быть модифицированы так, чтобы можно было пренебрегать защитными группами, или так,чтобы можно было использовать альтернативные защитные группы (например группы, описанные Т W Greene "Protective Groups InorganicSynthesis", 2nd Ed (1991) J WileySons) во время обычной оптимизации условий эксперимента. Многие из промежуточных соединений,описанных здесь, являются новыми и формируют важный аспект изобретения. Соответственно,мы предлагаем согласно дальнейшему аспекту изобретения новые соединения формулы (II) (в том числе (II)1), (III), (IV), (V), (VI), (VII), (VIII),(IX), (X), (XI), (XII), (XVI), (XVII), (XVIII),(XIX), (XX) (в том числе (XX)1 и (XX)2), (XXI) (в том числе (XXI)1), (XXII), (XXIIa), (XXIII) (в том числе (XXIII)1), (ХХIIIа), (XXVII) (в том числе(XXVII)1), (XXVIII) (в том числе (XXVIII)1),(XXIX) (в том числе (XXIX)1), (XXX), (XXXIV)(XL), (XLII)-(XLIV) и (XLVI)-(LXII) и их лишенные защиты производные и производные, в которых защищен один или более чем один атом азота и/или карбоновая кислота защищена как С 1-6 алкиловый эфир (особенно этиловый эфир). Предпочтительные защитные группы включают в себя CBZ, ВОС и трифторацетил. Обычно мы предпочитаем защищать азот в кольце пирролидина или пирролидинона группой CBZ. Также мы предлагаем промежуточные соединения в форме соли по желанию. Мы предлагаем промежуточные соединения в виде рацемических смесей или в форме очищенного единственного энантиомера. Новые хиральные промежуточные соединения в описанных выше разделах, относящихся к хиральным соединениям и способам разделения, также формируют важный аспект данного изобретения. Кроме того, как аспект данного изобретения, предложены способы получения промежуточных соединений. Промежуточные соединения формулы (II),(III), (V), (XX), (XXII), (XXIIа), (XXIII), (ХХШа),(XXVIII) и (XXIX) и их лишенные защиты производные и производные, в которых защищен один или более чем один атом азота и/или карбоновая кислота защищена как C1-6 алкиловый эфир, представляют особый интерес, особенно когда они в форме очищенного единственного энантиомера. Следующие неограничивающие примеры иллюстрируют настоящее изобретение. Сокращения ВОС трет-бутилоксикарбонил;HPLC жидкостная хроматография высокого давления; ТСХ тонкослойная хроматография; относительная стереохимия. Получение промежуточных соединений Промежуточное соединение 1. Бензиловый эфир (4,4-диэтокси-бутил)-карбаминовой кислоты. Три порции бензилхлорформиата (260 мл) в дихлорметане (170 мл) последовательно добавляют за 1 ч 40 мин к интенсивно перемешиваемой смеси 4-аминобутиральдегида диэтилацеталя(910 мл) в дихлорметане (3 л) и водного карбоната натрия (1 М, 3 л). Перемешивание продолжают в течение 50 мин до тех пор, пока не прекратится выделение газа. Добавляют N-(2-аминоэтил)пиперазин (40 мл) и продолжают перемешивание в течение 1 ч 15 мин. Слои разделяют и органический слой промывают водной лимонной кислотой (1 М, 3,8 л) и насыщенным водным бикарбонатом натрия (2 л), сушат (MgSO4), фильтруют и концентрируют в вакууме с образованием указанного в заглавии соединения в виде желтого масла (1,6 кг). ТСХ (эфир) Rf 0,5. Промежуточное соединение 2. третБутиловый эфир бензилоксикарбонил-(4,4 диэтокси-бутил)-карбаминовой кислоты. Раствор ди-трет-бутилдикарбоната (138 мл) в этилацетате (150 мл) добавляют по каплям к перемешиваемой смеси промежуточного соединения 1 (84 мл), триэтиламина (42 мл) и 4 диметиламинопиридина (37 г) в этилацетате (150 мл). Перемешивание в атмосфере азота при комнатной температуре продолжают в течение 19 ч. Реакционную смесь охлаждают в ледяной бане и смешивают с холодной разбавленной соляной кислотой (2 М, 250 мл), которую добавляют по каплям, поддерживая внутреннюю температуру ниже 25 С. Слои разделяют, и органический слой промывают разбавленной соляной кислотой(1 М, 200 мл) и водой (200 мл), сушат (MgSО 4),фильтруют и концентрируют в вакууме с образованием указанного в заголовке соединения в виде оранжевого масла (144,81 г). ТСХ (1:1 эфир:гексан) Rf 0,45. Промежуточное соединение 3. третБутиловый эфир бензилоксикарбонил-(3 формил-пропил)-карбаминовой кислоты. Пиридиния п-толуолсульфонат (7,5 г) добавляют к перемешиваемому раствору промежуточного соединения 2 (144,78 г) в смеси ацетон(400 мл)/вода (100 мл). Полученную смесь нагревают до 50 С и продолжают перемешивание в течение 5,5 ч. Ацетон удаляют в вакууме, а вод 32 ный остаток обрабатывают эфиром (1 л). Слои разделяют, и органический слой промывают водой (200 мл), сушат (MgSО 4), фильтруют и концентрируют в вакууме с образованием указанного в заголовке соединения в виде оранжевого масла (110 г). ТСХ (1:1 эфир:гексан) Rf 0,3. Промежуточное соединение 4. Метиловый эфир 6-(бензилоксикарбонил-трет-бутоксикарбониламино)-4-гидрокси-гекс-2-еновой кислоты. Раствор промежуточного соединения 3 (520 г) в сухом ацетонитриле (1 л) добавляют по каплям к перемешиваемому раствору 2 фенилсульфинилацетата (267,5 г) и пиперидина(160 мл) в сухом ацетонитриле (2 л) в атмосфере азота. Перемешивание в атмосфере азота при комнатной температуре продолжают в течение 15 ч, а затем смесь концентрируют в вакууме с получением коричневого масла. Масло распределяют между этилацетатом (3 л) и разбавленной соляной кислотой (1 н., 2 х 1,5 л), и органический слой промывают водой (1 л) и насыщенным рассолом (500 мл), сушат (MgSО 4) и концентрируют в вакууме с получением коричневого масла(889,4 г). Масло очищают колоночной хроматографией на силикагеле, используя смесь гексан:изопропилацетат от 9:1 до 1:1 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла (273,5 г). ТСХ (1:1 этилацетат:гексан) Rf 0,41. Промежуточное соединение 5. Метиловый эфир 6-(бензилоксикарбонил-трет-бутоксикарбониламино)-4-(1,3-диоксо-1,3-дигидроизоиндол-2 ил)-гекс-2 Е-еновой кислоты. Раствор диэтилазодикарбоксилата (105 мл) в сухом тетрагидрофуране (95 мл) добавляют по каплям (2 ч) к перемешиваемой смеси трифенилфосфина (173 г), фталимида (97 г) и промежуточного соединения 4 (254,7 г) в сухом тетрагидрофуране (1,1 л) в атмосфере азота при 4-6 С. Перемешивание при 4 С продолжают в течение 2 ч, затем смесь оставляют нагреваться до комнатной температуры (4 ч) и выдерживают в течение ночи в атмосфере азота. Смесь концентрируют в вакууме, и остаток растирают с третбутилметиловым эфиром (1 л) и охлаждают в бане с ледяной водой (5 С). Выпавший в осадок трифенилфосфиноксид отфильтровывают, промывают охлажденным льдом третбутилметиловым эфиром (2 х 200 мл) и отбрасывают. Фильтрат концентрируют в вакууме с получением оранжевого масла (428,06 г), которое очищают колоночной хроматографией на силикагеле (Merck 9385; 9 кг, 28 х 32,5 см), используя смесь гексан:этилацетат (2:1) в качестве элюента,с получением не совсем белого твердого вещества в вязком желтом масле (281,63 г). Его растирают со смесью этилацетат/гексан (1:1) (1,2 л), и твердое вещество отфильтровывают и отбрасывают. Фильтрат концентрируют в вакууме с получением указанного в заголовке соединения в виде вязкого желтого масла (270,2 г). ТСХ (1:2 этилацетат:гексан) Rf 0,29. Промежуточное соединение 6. Метиловый эфир 6-бензилоксикарбониламино-4-(1,3-диоксо 1,3-дигидро-изоиндол-2-ил)-гекс-2 Е-еновой кислоты. Трифторуксусную кислоту (148 мл, 1,92 М) добавляют по каплям (10 мин) к перемешиваемому раствору промежуточного соединения 5(251,5 г) в сухом дихлорметане (2,6 л) при 5 С в атмосфере азота. Перемешивание продолжают в течение 2 ч, несмотря на то, что ТСХ указывает на завершение реакции. Смесь охлаждают путем медленного прибавления (приблизительно 20 мин) водного карбоната натрия (1 М, 750 мл) и продолжают перемешивание до тех пор пока не прекратится выделение пузырьков. Слои разделяют, и органический слой промывают насыщенным водным бикарбонатом натрия (750 мл) и рассолом (500 мл), сушат (MgSO4), фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде вязкой желтой смолы (204,3 г). ТСХ (2:3 этилацетат:гексан) Rf 0,24. Промежуточное соединение 7. Бензиловый эфир транс-3-(1,3-диоксо-1,3-дигидроизоиндол 2-ил)-2-метоксикарбонилметилпирролидин-1 карбоновой кислоты. Гидрид натрия (4,3 г 60%-ного в минеральном масле) добавляют к перемешиваемому холодному (4 С) раствору промежуточного соединения 6 (182,5 г) в сухом тетрагидрофуране (2,8 л) в атмосфере азота. Через 1 ч ТСХ указывает на преобладание исходного материала, так что снова добавляют гидрид натрия (4,3 г 60%-ного,107,5 ммоль), и перемешивание в атмосфере азота при 4 С продолжают в течение 2 ч. Однако методом ТСХ никакой реакции не обнаруживают, так что смесь оставляют нагреваться до 10 С(30 мин), и перемешивание продолжают в течение 1 ч. ТСХ указывает на некоторую реакцию,так что снова добавляют гидрид натрия (2,15 г 60%-ного), и перемешивание продолжают в течение дополнительного 1 ч при 10 С, после чего ТСХ указывает на завершение реакции. Реакционную смесь охлаждают путем прибавления водного рассола (2:3, 1,6 л), сначала по каплям,до тех пор пока не прекратится выделение пузырьков газа, затем быстро. Слои разделяют, и водный слой экстрагируют этилацетатом (2 х 1 л). Органические растворы объединяют, промывают насыщенным рассолом (1 л), сушат (MgSО 4, в течение ночи), фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде вязкого желтого масла (159,91 г). ТСХ (2:3 этилацетат:гексан) Rf 0,26. Промежуточное соединение 8. Бензиловый эфир транс-3-амино-2-метоксикарбонилметилпирролидин-1-карбоновой кислоты. Гидразингидрат (22 мл 55%-ного) добавляют к перемешиваемому раствору промежуточного соединения 7 (150,2 г) в этаноле (700 мл) в 34 атмосфере азота. Полученную смесь перемешивают и нагревают с обратным холодильником в атмосфере азота в течение 3 ч и оставляют охлаждаться в течение ночи. Нерастворимое твердое вещество отфильтровывают, промывают этанолом (160 мл) и отбрасывают. Фильтрат концентрируют в вакууме, и остаток распределяют между этилацетатом (800 мл) и разбавленной соляной кислотой (1 М, 500 мл), отфильтровывая некоторое количество твердого вещества, которое промывают разбавленной соляной кислотой (1 М,300 мл) перед тем, как отбросить. Для повторной экстракции этилацетатного раствора используют водную промывку. Водные кислые экстракты объединяют, промывают этилацетатом (400 мл),нейтрализуют до приблизительно рН 8 водным гидроксидом натрия (2 М, 350 мл) и водным карбонатом натрия (1 М, 100 мл), затем экстрагируют этилацетатом (4 х 500 мл).Эти экстракты объединяют, промывают насыщенным рассолом (300 мл), сушат (MgSO4, в течение ночи), фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде желтого масла (62,5 г). ТСХ (9:1 этилацетат:метанол) Rf полоса от 0,25 до 0,09. Промежуточное соединение 9. Бензиловый эфир транс-3-трет-бутоксикарбониламино-2 метоксикарбонилметил-пирролидин-1-карбоновой кислоты. Раствор ди-трет-бутилдикарбоната (69 г) в сухом ацетонитриле (500 мл) добавляют по каплям (30 мин) к перемешиваемому раствору промежуточного соединения 8 (80,77 г) и триэтиламина (44 мл) в сухом ацетонитриле (950 мл) в атмосфере азота. Перемешивание при комнатной температуре продолжают в течение 5,5 ч, затем смесь выдерживают в течение ночи при комнатной температуре в атмосфере азота. Смесь концентрируют в вакууме, и остаток (141,7 г) распределяют между разбавленной соляной кислотой (1 М, 650 мл) и этилацетатом (1,3 л). Водный слой повторно экстрагируют этилацетатом (650 мл). Органические экстракты объединяют, промывают насыщенным рассолом (500 мл), сушат(MgSО 4), фильтруют и концентрируют в вакууме с получением красно-коричневого масла (120,5 г). Масло очищают фильтровальной колоночной хроматографией на силикагеле (Merck 9385; 1,2 кг, 11 х 18 см), используя смесь гексан:этилацетат(2:1) в качестве элюента, с получением указанного в заголовке соединения в виде бледно-желтого масла (98,23 г), которое при стоянии кристаллизуется в не совсем белое твердое вещество (90,85 г). Его растирают со смесью эфир:гексан (1:4)(250 мл) с получением указанного в заголовке соединения в виде белого твердого вещества ниламино-2-(1R-метоксикарбонил-бут-3-енил)пирролидин-1-карбоновой кислоты. Раствор литийбис(триметилсилил)амида в тетрагидрофуране (1 М, 80 мл) добавляют по каплям (65 мин) к перемешиваемому раствору промежуточного соединения 9 (9,81 г) в смеси сухого тетрагидрофурана (54 мл) и 1,3-диметил 3,4,5,6-тетрагидро-2(1 Н)-пиримидинона (120 мл) при -711 С (внутренняя) в атмосфере азота. После перемешивания в течение 1 ч при температуре ниже -70 С добавляют аллилйодид (2,8 мл) при -711 С (5 мин), и полученную смесь перемешивают при температуре ниже -70 С в течение 2 ч. Реакционную смесь охлаждают путем прибавления по каплям насыщенного водного хлорида аммония (20 мл) и оставляют нагреваться до 0 С, снова добавляют водный хлорид аммония (20 мл), и полученную смесь экстрагируют этилацетатом (4 х 100 мл). Органические экстракты объединяют и концентрируют в вакууме с получением желтого масла, которое распределяют между толуолом (200 мл) и водой(100 мл). Органическую фазу промывают водой(2 х 80 мл) и насыщенным рассолом (80 мл), сушат (Na2SО 4), фильтруют и концентрируют в вакууме с получением оранжевого масла (15,96 г). Его очищают колоночной флэшхроматографией на силикагеле (Меrсk 9385; 700 г, 13 х 14 см), используя смесь гексан:этилацетат(7:3) в качестве элюента, с получением указанного в заголовке соединения в виде бесцветного масла (7,7 г). ТСХ (3:7 этилацетат:гексан) Rf 0,24. Промежуточное соединение 11. Бензиловый эфир отн-(2R,3S)-3-трет-бутоксикарбониламино-2-(1R-карбокси-бут-3-енил)-пирролидин-1-карбоновой кислоты. Раствор гидроксида калия (45 г) в воде (400 мл) добавляют к перемешиваемому раствору промежуточного соединения 10 (32,17 г) в этаноле (400 мл). Полученную смесь перемешивают при 55 С в атмосфере азота в течение 5 ч. Этанол удаляют в вакууме, и полученную смесь подкисляют до приблизительно рН 2 разбавленной соляной кислотой (2 М, 400 мл). Смесь экстрагируют этилацетатом (3 х 500 мл), экстракты объединяют, сушат (МgSO4), фильтруют и концентрируют в вакууме с получением бесцветной пены(29 г). ТСХ (3:7 этилацетат:гексан) Rf полоса от 0,30 до 0,12. Промежуточное соединение 12. Гидрохлорид бензилового эфира отн-(2R,3S)-3-амино-2(1R-карбокси-бут-3-енил)-пирролидин-1-карбоновой кислоты. Промежуточное соединение 11 (29 г) растворяют в растворе хлороводорода в диоксане(4 М, 300 мл), и смесь перемешивают при комнатной температуре в атмосфере азота в течение 3 ч. Растворитель удаляют в вакууме, и остаток(25,56 г) растирают с эфиром (2 х 80 мл) с получением указанного в заголовке соединения в ви 36 де белого твердого вещества (22,03 г) с т.пл.158159 С. Промежуточное соединение 13. Бензиловый эфир отн-(3 аS,6R,6 аR)-6-аллил-5-оксогексагидропирроло[3,2-b]пиррол-1-карбоновой кислоты. Йодид 2-хлор-1-метилпиридиния (3 г) добавляют одной порцией к перемешиваемому раствору промежуточного соединения 12 (2,73 г) иN,N-диизопропилэтиламина (1,3 мл) в сухом дихлорметане (1,25 л) при комнатной температуре в атмосфере азота. Через 1 ч снова добавляютN,N-диизопропилэтиламин (2,6 мл), и перемешивание продолжают в течение 4 ч, затем смесь выдерживают в течение 16 ч. Раствор промывают разбавленной соляной кислотой (0,1 М, 2 х 75 мл) и водой (75 мл), сушат (Na2SO4), фильтруют и концентрируют в вакууме в присутствии силикагеля (5 г). В колонке с диоксидом кремния(3:1) с получением желтого твердого вещества,которое растирают с эфиром (20 мл+10 мл) с получением указанного в заголовке соединения в виде твердого вещества бледно-кремового цвета(200 мл) гидрируют при одной атмосфере и комнатной температуре над гидроксидом палладия(2,0 г) и активированными ситами 4 (3,5 г). Через 8 ч катализатор фильтруют на гифло (гифло(hyflo и промывают этилацетатом (10 мл). Фильтрат концентрируют в вакууме с получением, после добавления и удаления в вакууме эфира (10 мл), указанного в заголовке соединения в виде бледно-коричневой пены (985 мг). ТСХ (3:7 метанол:этилацетат) Rf 0,49. Промежуточное соединение 26. отн(3R,3 аR,6 аS)-1-Метансульфонил-3-пропилгексагидропирроло[3,2-b]пиррол-2-он. Соединение примера 6 (517 мг) гидрируют над 20%-ным влажным гидроксидом палладия на угле (60 мг) в этилацетате (50 мл) в течение 4 ч. Катализатор удаляют фильтрацией, а фильтрат концентрируют с получением указанного в заголовке соединения в виде белого твердого вещества (323 мг). ТСХ (95:5 дихлорметан: метанол) Rf 0,27. Промежуточное соединение 27. Гидрохлорид 3-морфолин-4-ил-пропан-1-сульфонилхлорида. Тионилхлорид (10 мл) добавляют к 4 морфолинпропансульфоновой кислоте (4,4 г), а затем добавляют диметилформамид (0,2 мл). Смесь нагревают с обратным холодильником в атмосфере азота в течение 5 ч. Тионилхлорид удаляют в вакууме, и остаток растирают с ацетонитрилом и фильтруют с получением белого твердого вещества. Его сушат при 80 С в вакуу 37 ме с получением указанного в заголовке соединения в виде белого твердого вещества (2,7 г). Найдено: С 31.9; Н 5.9, N 5.1. С 7 Н 14 СlNО 3SНСl требует: С 31.8; Н 5.7; N 5.3%. Промежуточное соединение 34. отн(3R,3 аR,6 аS)-3-Пропил-гексагидропирроло[3,2b]пиррол-2-он. Промежуточное соединение 13 (0,305 г) в тетрагидрофуране (15 мл) добавляют к предварительно гидрированной суспензии 5% палладия на угле (0,235 г) в тетрагидрофуране (5 мл), и смесь перемешивают в атмосфере Н 2 в течение 2,25 ч. Раствор фильтруют через гифло (hyflo),затем концентрируют в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (104 мг), т.пл.97-100 С. ТСХ (7:3 этилацетат:гексан) Rf 0,17 полоса. Промежуточное соединение 36. 5-м-Толил 1 Н-тетразол. Трибутилоловоазид (3,6 г) и 3-метилбензонитрил (0,7 г) нагревают при 160 С в течение 2,5 ч. Смесь охлаждают и распределяют между 2 н. раствором гидроксида натрия (80 мл), водой (30 мл) и диэтиловым эфиром (50 мл). Эфирный слой удаляют, а водный промывают диэтиловым эфиром (3 х 30 мл). Водную фазу подкисляют концентрированной соляной кислотой и экстрагируют этилацетатом (3 х 30 мл). Высушенные(MgSO4) органические экстракты концентрируют в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества(0,25 г) и тритилхлорид (22,1 г) растворяют в сухом дихлорметане (130 мл) и перемешивают при комнатной температуре в атмосфере N2 в течение 48 ч. Смесь фильтруют и разбавляют дихлорметаном (100 мл). Раствор промывают 2 М гидроксидом натрия (2 х 150 мл) и насыщенным раствором сульфата меди (100 мл). Полученный осадок удаляют фильтрацией. Фильтрат промывают рассолом (100 мл), сушат (MgSO4) и концентрируют в вакууме с получением указанного в заголовке соединения в виде бледнокоричневого твердого вещества (26,0 г). ТСХ на диоксиде кремния (4:1 гексан:Et2O)Rf 0,5. Промежуточное соединение 38. 5-(3 Бромметил-фенил)-2-тритил-2 Н-тетразол. Смесь промежуточного соединения 37 (2,0 г), N-бромсукцинимида (1,1 г) и азоизобутиронитрила (87 мг) в сухом четыреххлористом углероде (25 мл) нагревают с обратным холодильником в течение 3 ч. Смесь охлаждают, разбавляют дихлорметаном (100 мл) и фильтрацией удаляют сукцинимид. Органический слой промывают водой (2 х 100 мл), сушат (MgSO4) и концентри 38 руют в вакууме с получением указанного в заголовке соединения в виде не совсем белой пены(2,6 г). ТСХ на диоксиде кремния (4:1 гексан:Еt2 О)(300 мл) перемешивают при комнатной температуре в течение 24 ч. Раствор вливают в 10%-ный раствор хлорида лития (250 мл) и добавляют этилацетат (300 мл). Водный слой экстрагируют этилацетатом (2 х 150 мл), и объединенные органические экстракты сушат (MgSO4). Растворитель удаляют в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (6,6 г). ТСХ на диоксиде кремния (4:1 гексан:Et2 О)Rf 0,44. Промежуточное соединение 40. 5-(3 Хлорметил-фенил)-1 Н-тетразол. Промежуточное соединение 39 (6,5 г) в смеси этанола (300 мл), дихлорметана (50 мл) и концентрированной соляной кислоты (7 мл) перемешивают при комнатной температуре в течение 4 ч. Полученный раствор концентрируют в вакууме и добавляют воду (20 мл). Смесь распределяют между эфиром (200 мл) и 2 н. раствором карбоната натрия. Водный слой промывают эфиром (2 х 250 мл), подкисляют концентрированной соляной кислотой, а затем экстрагируют этилацетатом (3 х 200 мл). Объединенные экстракты сушат (MgSО 4), и растворитель удаляют в вакууме с получением указанного в заголовке соединения в виде розового твердого соединения(1,1 г) в метаноле (5 мл) и этаноле (4 мл). Суспензию нагревают с обратным холодильником в течение 20 ч. Охлажденный раствор концентрируют в вакууме, и остаток растирают со смесью эфир:этилацетат (приблизительно 3:1) с получением указанного в заголовке соединения в виде белого твердого вещества (1,3 г). Т.пл более 250 С. Промежуточное соединение 42. [3-(1 НТетразол-5-ил)-фенил]-метансульфонилхлорид. Суспензию промежуточного соединения 41(1,3 г) в смеси лед/вода(20 мл)/уксусная кислота(4 мл) охлаждают до температуры ниже 10 С. Через перемешиваемую смесь быстро, за 40 мин,пропускают хлор, поддерживая температуру ниже 10 С. Добавляют этилацетат (200 мл) и воду(200 мл). Водный слой экстрагируют этилацетатом (2 х 100 мл). Объединенные органические экстракты промывают 5%-ным раствором мета 39 бисульфита натрия (2 х 100 мл) и сушат (MgSO4). Растворитель удаляют в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (0,6 г). Масс-спектр: MNH4+ (рассчитано) 276,MNH4+ (наблюдается) 276. Промежуточное соединение 77. Дигидрохлорид метилового эфира 2,4-диаминомасляной кислоты. К дигидрохлориду D,L-диаминомасляной кислоты (350 г) в метаноле (1,6 л) при 0 С добавляют тионилхлорид (200 мл) за 0,5 ч. После нагревания с обратным холодильником в течение 3 ч растворитель удаляют в вакууме, и остаток растирают с толуолом (650 мл) с получением указанного в заголовке соединения в виде белого твердого вещества (385 г). Масс-спектр свободного основания М+(70 мл) и Dowex 2 х 8-400 меш (16,4 мл) перемешивают в течение 1 ч. Смолу затем фильтруют, и фильтрат концентрируют в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (0,40 г). ТСХ (18:3 этилацетат: метанол) Rf 0,07. Промежуточное соединение 79. 2,2,2 Трифтор-N-(2-оксо-пирролидин-3-ил)-ацетамид. Промежуточное соединение 78 (181 г), метилтрифторацетат (218 мл) и метанол (2,6 л) суспендируют в течение 2 ч. Затем растворитель удаляют в вакууме с получением указанного в заголовке соединения в виде твердого вещества кремового цвета (355 г). Масс-спектрMNH4 (рассчитано) 214. Промежуточное соединение 80. Бензиловый эфир 2-оксо-3-(2,2,2-трифторацетиламино)пирролидин-1-карбоновой кислоты. К промежуточному соединению 79 (3,5 г) и тетрагидрофурану (100 мл) при -70 С добавляют литийгексаметилдисилазид (20 мл). Через 0,25 ч добавляют бензилхлорформиат (2,8 мл). Смесь нагревают до комнатной температуры в течение 1 ч и добавляют 1 М соляную кислоту (25 мл). После экстракции этилацетатом (3 х 25 мл) объединенные экстракты промывают 2%-ным раствором аммиака, 2 М соляной кислотой, рассолом и сушат (MgSO4). После удаления растворителя белое твердое вещество перекристаллизовывают из смеси этилацетат:гексан 5:1 с получением указанного в заголовке соединения (4,2 г). ТСХ (18:2 этилацетат:метанол) Rf 0,7. Промежуточное соединение 81. Бензиловый эфир 2-этокси-3-(2,2,2-трифторацетиламино)-пирролидин-1-карбоновой кислоты. К промежуточному соединению 80 (34 г) в этаноле (1070 мл) при -5 С добавляют боргидрид натрия (9,86 г). Затем по каплям добавляют 4 М раствор хлороводорода в 1,4-диоксане (20 мл). 40 Периодически добавляют дополнительные порции 4 М хлороводорода в 1,4-диоксане (2 х 5 мл,1 х 10 мл) и боргидрида натрия (2 г). Через 3 ч добавляют концентрированную серную кислоту(11 мл), и смесь нагревают до комнатной температуры в течение 2 ч. Затем добавляют насыщенный водный бикарбонат натрия (300 мл), а этанол и диоксан удаляют в вакууме. Остаток разбавляют водой (500 мл) и экстрагируют этилацетатом (3 х 500 мл). Объединенные экстракты промывают рассолом и сушат (МgSO4). Растворитель удаляют в вакууме, и остаток очищают флэш-хроматографией на силикагеле 9385,элюируя эфиром, с получением указанного в заголовке соединения (21 г). Масс-спектр MNH4+ (найдено) 378, MNH4+(рассчитано) 378. Промежуточное соединение 82. Бензиловый эфир транс-2-(1-этоксикарбонил-2-метилпропил)-3-(2,2,2-трифтор-ацетиламино)-пирролидин-1-карбоновой кислоты. Промежуточное соединение 81 (10 г), этилтриметилсилилизопропилкетенацеталь (11 мл) и дихлорметан (250 мл) охлаждают до 5C и за 0,25 ч добавляют эфир в виде бортрифториддиэфирата (17 мл). Через 1 ч добавляют дополнительное количество эфира в виде бортрифторидэфирата (3,4 мл) и кетенацеталя (11 мл). Через дополнительный 1 ч добавляют 1 М соляную кислоту (200 мл), и органический слой отделяют и промывают рассолом и сушат (MgSО 4). Удаление растворителя в вакууме приводит к указанному в заголовке соединению (16,7 г). ТСХ (2:1 эфир:циклогексан) Rf 0,18 и 0,27. Промежуточное соединение 83. Бензиловый эфир транс-3-амино-2-(1-этоксикарбонил-2 метилпропил)-пирролидин-1-карбоновой кислоты. Промежуточное соединение 82 (31 г), карбонат калия (71 г), воду (930 мл) и этанол (930 мл) нагревают при 60 С в течение 3 ч. Этанол удаляют в вакууме, и водный остаток экстрагируют этилацетатом (3 х 300 мл). Объединенные экстракты промывают рассолом и сушат(MgSО 4) и концентрируют в вакууме с получением указанного в заголовке соединения в виде коричневого масла (17,5 г). Масс-спектр MH+ (найдено) 349, МН+ (рассчитано) 349. Промежуточное соединение 84. Бензиловый эфир отн-(3R,3 аR,6 аS)-6-изопропил-5-оксогексагидропирроло[3,2-b]пиррол-1-карбоновой кислоты. Промежуточное соединение 83 (17,5 г) в тетрагидрофуране (1,800 мл) охлаждают до -5 С и за 0,5 ч добавляют 1 М третбутилмагнийхлорид в тетрагидрофуране (204 мл). Через 2 ч добавляют 1 М соляную кислоту(250 мл) и рассол (300 мл), и затем экстрагируют этилацетатом (250 мл). После концентрирования в вакууме до половины объема экстракты промывают рассолом и сушат (MgSO4). Удаление растворителя в вакууме с последующим растиранием с диэтиловым эфиром (60 мл) приводит к белому твердому веществу. Его перекристаллизовывают из этилацетата с получением указанного в заголовке соединения (3,4 г). Масс-спектр МН+ (найдено) 303, МН+ (рассчитано) 303. Промежуточное соединение 85. Бензиловый эфир отн-(3R,3 аR,6 аS)-6-изопропил-4 метансульфонил-5-оксо-гексагидропирроло[3,2b]пиррол-1-карбоновой кислоты. К перемешиваемому раствору промежуточного соединения 84 (15,01 г) в безводном тетрагидрофуране (950 мл) при -74 С в атмосфере азота добавляют по каплям 1,0 М литийгексаметилдисилазид в тетрагидрофуране (69,5 мл). После перемешивания при -74 С в течение 10 мин смесь оставляют нагреваться до 0 С за 45 мин,затем выдерживают при этой температуре в течение 20 мин. Затем смесь охлаждают до -76 С,обрабатывают метансульфонилхлоридом (9,61 мл) и оставляют перемешиваться при этой температуре в течение 1,5 ч. Смесь затем нагревают до -50 С, охлаждают смешиванием с насыщенным раствором хлорида аммония (480 мл) и оставляют нагреваться до комнатной температуры. Смесь распределяют между водой (300 мл) и этилацетатом (750 мл), водный слой экстрагируют дополнительным количеством этилацетата(750 мл), затем объединенные экстракты промывают рассолом (450 мл), сушат (Na2SО 4) и концентрируют в вакууме до твердого вещества кремового цвета. Очистка колоночной флэшхроматографией на диоксиде кремния (Merck 9385) с использованием смеси этилацетат: циклогексан (1:3, 1:2, 1:1 затем 3:1) в качестве элюента приводит к указанному в заголовке соединению в виде белого кристаллического твердого вещества (13,65 г). ТСХ (дихлорметан) Rf 0,22. Масс-спектр MNH4+ (найдено) 398, MNH4+(рассчитано) 398. Промежуточное соединение 86. отн(3R,3 аR,6 аS)-3-Изопропил-1-метан-сульфонилгексагидропирроло[3,2-b]пиррол-2-он. Суспензию промежуточного соединения 85(13,63 г) в этилацетате (900 мл) добавляют к 20%-ному гидроксиду палладия (влажному) на угле (3,16 г) и полученную черную суспензию интенсивно перемешивают в атмосфере водорода при комнатной температуре в течение 90 мин. Затем смесь фильтруют через Harborlite J2 и концентрируют в вакууме с получением указанного в заголовке соединения в виде тонкого белого порошка (8,63 г). ТСХ (1:9 метанол:дихлорметан) Rf 0,50. Масс-спектр МН+ (найдено) 247, MH+ (рассчитано) 247. Промежуточное соединение 87. отн-4-(4 Метансульфонил-5-оксо-6R-пропил-гексагидро(3 аS,6 аR)-пирроло[3,2-b]пиррол-1-карбонил)бензальдегид. 42 К перемешиваемому раствору промежуточного соединения 26 (100 мг) в ацетонитриле (10 мл) добавляют 4-карбоксибензальдегид (121 мг),1-гидроксибензотриазол (109 мг), затем гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (156 мг). Полученную смесь перемешивают при комнатной температуре в течение 4 ч. Ацетонитрил удаляют в вакууме с получением желтого масла. Его растворяют в дихлорметане(50 мл) и экстрагируют насыщенным водным раствором бикарбоната натрия (50 мл). Водный слой затем экстрагируют дихлорметаном (2 х 15 мл). Объединенный дихлорметановый экстракт сушат (Na2SO4), фильтруют и концентрируют в вакууме с получением неочищенной желтой/белой пены, содержащей указанное в заголовке соединение. Неочищенную смесь очищают флэш-хроматографией (SiO2, Merck 9385), элюируя смесью 1% MeOH:DCM. Полученные фракции концентрируют в вакууме с получением указанного в заголовке соединения в виде бесцветной пены (131 мг). ТСХ (1:9 метанол:дихлорметан) Rf 0,77. Масс-спектр МН+ (найдено) 379, МН+ (рассчитано) 379. Промежуточное соединение 88. отн(3R,3 аR,6aS)-1-Метансульфонил-3-пропил-4 ундец-10-еноил-гексагидропирроло[3,2-b] пиррол-2-он. К перемешиваемому раствору промежуточного соединения 26 (900 мг) и N,Nдиизопропилэтиламина (1,91 мл) в сухом дихлорметане (10 мл) в атмосфере азота добавляют 10-ундеценовую кислоту (682 мг) в сухом дихлорметане (5 мл), а затем гексафторфосфат бром-трис-пирролидин-фосфония (1,87 г). Смесь перемешивают в течение 2 ч перед тем как распределить между дихлорметаном (100 мл) и 8%ным водным раствором бикарбоната натрия (100 мл). Фазы разделяют, затем водную фазу экстрагируют дихлорметаном (100 мл), объединенные органические фазы сушат (MgSO4), и растворитель выпаривают в вакууме, получая желтую смолу. Смолу очищают флэш-хроматографией,элюируя диэтиловым эфиром, и растворитель удаляют в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (1,31 г). Т.пл.= 62-64,6 С. ТСХ (SiO2, диэтиловый эфир) Rf 0,43. Промежуточное соединение 89. отн-10-(4 Метансульфонил-5-оксо-6R-пропил-гексагидроотн-(3 аS,6 аR)-пирроло[3,2-b]пиррол-1-ил)-10 оксодеканаль. Перемешиваемый раствор промежуточного соединения 88 (1,28 г) в сухом дихлорметане (45 мл) охлаждают до -78 С. Через раствор пропускают сухой озон до тех пор пока сохраняется темно-синий цвет. Через раствор в течение 5 мин барботируют кислород, а затем в течение 5 мин азот. Добавляют трифенилфосфин (1,63 г), и раствор перемешивают в атмосфере азота в течение ночи. Растворитель удаляют в вакууме, а остаток очищают флэш-хроматографией, элюируя диэтиловым эфиром, с получением указанного в заголовке соединения в виде белого твердого вещества (850 мг). ТСХ (SiО 2, диэтиловый эфир) Rf =0,31. Промежуточное соединение 90. Данное промежуточное соединение получают способом,подобным способу получения промежуточного соединения 89, из промежуточного соединения 26. отн-4-(4-Метансульфонил-5-оксо-6Rпропил-гексагидро-(ЗаS,6 аR)-пирроло[3,2-b]пиррол-1-ил)-6-оксо-гексаналь. ТСХ (4:1 эфир:этилацетат) Rf 0,18 (промежуточное соединение 90) Промежуточное соединение 92. отн(3R,3 аR,6 аS)-4-Акрилоил-1-метансульфонил-3 пропил-гексагидропирроло[3,2-b]пиррол-2-он. Раствор 3-бромпропионилхлорида (140 мг) в дихлорметане (1 мл) добавляют по каплям к перемешиваемому раствору промежуточного соединения 26 (158 мг) и триэтиламина (202 мг) в дихлорметане (15 мл). Смесь перемешивают при комнатной температуре в течение 4,5 ч, промывают 8%-ным бикарбонатом натрия (15 мл),0,5 М соляной кислотой (15 мл) и водой (10 мл),сушат (Nа 2SO4), фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения (161 мг) в виде белого порошка. Т.пл.177-181 С. Масс-спектр МН+ (найдено) = 301, МН+C13H20N2O45 требует: С 50.2; Н 6.9; N 9.0; S 10.3%. Промежуточное соединение 95. (1-Этокси 3-метил-бут-1-енилокси)-триизопропилсилан. Тетрагидрофуран (100 мл) и 1,3-диметил 3,4,5,6-тетрагидро-2-(1 Н)-пиримидинон (140 мл) перемешивают при -20 С и добавляют литийбис(триметилсилил)амид (1 М в тетрагидрофуране, 100 мл). Смесь охлаждают до -70 С, добавляют этиловый эфир изовалериановой кислоты-70 С. Добавляют триизопропилсилилтрифторметансульфонат, и смесь оставляют перемешиваться при -75 С в течение 0,5 ч перед ее нагреванием до комнатной температуры и перемешиванием в течение 3 ч. Реакционную смесь охлаждают смешиванием с водным бикарбонатом натрия (8%, 150 мл) и экстрагируют гексаном(1000 мл). Гексановый экстракт промывают водой (4 х 500 мл), сушат (МgSO4), фильтруют и концентрируют в вакууме, получая неочищенное желтое масло, содержащее указанное в заголовке соединение. Очистка вакуумной молекулярной перегонкой (2,0 х 10-2 мбар, 68-80 С) приводит к указанному в заголовке соединению в виде бесцветного масла (15,69 г). 44 Температура кипения при 2,0 х 10-2 мбар находится в интервале 68-80 С. Промежуточное соединение 96. 2R-(2,2,2 Трифторацетиламино)-сукцинаминовая кислота. К перемешиваемой суспензииDАспарагина (37,9 г, измельченного в порошок и высушенного при 110 С в течение 48 ч) в метаноле (144 мл, высушенном над ситами 3 в течение 5 ч) в атмосфере азота добавляют триэтиламин (40,2 мл), а затем метилтрифторацетат (36 мл). Полученную смесь оставляют перемешиваться в течение 48 ч. К реакционной смеси добавляют сухой метанол (145 мл), затем смолуDowex 50 (H+ форма, 115 г, высушенная при 56 С в течение 24 ч). Полученную смесь перемешивают в течение 10 мин, фильтруют, и растворитель удаляют в вакууме с получением неочищенного белого твердого вещества, содержащего указанное в заголовке соединение. Этот неочищенный продукт объединяют с неочищенным продуктом из подобного эксперимента и перекристаллизовывают из горячей воды, получая указанное в заголовке соединение в виде белого кристаллического твердого вещества (106 г). Масс-спектрMNH4 (рассчитано) 246. Промежуточное соединение 97. Метиловый эфир 2R-(2,2,2-трифторацетиламино)-сукцинаминовой кислоты. Перемешиваемый раствор промежуточного соединения 96 (95,14 г) в метаноле (1150 мл, высушенном над молекулярными ситами 3) охлаждают до -70 С. Медленно добавляют ацетилхлорид (162 мл), поддерживая температуру реакции ниже -60 С. Реакционную смесь оставляют нагреваться до -20 С и затем выдерживают при этой температуре в течение 48 ч. Растворитель удаляют в вакууме с получением прозрачного и бесцветного масла, содержащего указанное в заголовке соединение. Его растирают с диэтиловым эфиром, и полученное белое твердое вещество перекристаллизовывают из кипящей воды,получая указанное в заголовке соединение в виде белого кристаллического твердого вещества(42 г). Масс-спектр МН+ (найдено) 243, МH+ (рассчитано) 243. Промежуточное соединение 98. Метиловый эфир 3-циано-2R-(2,2,2-трифторацетиламино)пропионовой кислоты,К перемешиваемой суспензии промежуточного соединения 97 (3,0 г) в дихлорметане (20 мл) добавляют пиридин (4,92 мл) и птолуолсульфонилхлорид (4,92 г). Снова добавляют дихлорметан (15 мл), и коричневый раствор оставляют перемешиваться при комнатной температуре в течение 48 ч. Реакционную смесь разбавляют дихлорметаном (25 мл), промывают 1 М водной Н 3 РO4 (74 мл), сушат (Na2SO4),фильтруют, и растворитель удаляют в вакууме с получением неочищенного коричневого твердо 45 го вещества (3,57 г), содержащего указанное в заголовке соединение. Неочищенную смесь очищают флэш-хроматографией (SiO2, Merck 9385), элюируя смесью этилацетат:циклогексан(сначала 1:3, затем 1:2,5). Элюент выпаривают в вакууме с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (1,62 г). ТСХ (1:1 этилацетат:циклогексан) Rf 0,5. Масс-спектр MNH4+ (найдено) 242, MNH4+(рассчитано) 242. Промежуточное соединение 99. 2,2,2 Трифтор-N-(2-оксо-пирролидин-3R-ил)-ацетамид. Раствор промежуточного соединения 98(200 мг) в этаноле (10 мл) перемешивают в атмосфере водорода с 5% родием на оксиде алюминия (1,00 г) в течение 3 ч. Катализатор удаляют фильтрацией, а фильтрат концентрируют в вакууме получая неочищенную смолу, содержащую указанное в заголовке соединение. Смесь очищают флэш-хроматографией (SiO2, Merck 9385), элюируя ацетонитрилом. Элюент выпаривают в вакууме, получая указанное в заголовке соединение в виде белого твердого вещества (40 мг). ТСХ (ацетонитрил) Rf 0,63. Масс-спектр MNH4+ (найдено) 214, MNH4+(рассчитано) 214. Промежуточное соединение 100. Бензиловый эфир 2-оксо-3R-(2,2,2-трифтор-ацетиламино)пирролидин-1-карбоновой кислоты. К перемешиваемому раствору промежуточного соединения 99 (1,04 г) в тетрагидрофуране,охлажденному до -70 С, добавляют нбутиллитий (1,6 М в гексане, 3,31 мл). Через 5 мин добавляют бензилхлорформиат (833 мкл), и реакционную смесь оставляют нагреваться до комнатной температуры. Через 2,5 ч реакционную смесь разбавляют этилацетатом (100 мл) и промывают 1 М соляной кислотой (2 х 150 мл). Объединенные органические экстракты сушат(MgSO4), фильтруют и концентрируют в вакууме с получением неочищенного оранжевого/белого твердого вещества, которое очищают растиранием в порошок с диэтиловым эфиром, получая указанное в заголовке соединение в виде белого твердого вещества (1,25 г). Масс-спектр MNH4+ (найдено) 348, MNH4+(рассчитано) 348. Хиральная HPLC (Chiracel AD, элюент этанол:гептан 15:85, объемная скорость потока = 1 мл/мин). Время удерживания R энантиомера = 10,08 мин (71,8%). Время удерживания S энантиомера = 12,50 мин (28,2%). Промежуточное соединение 100 (альтернативный синтез). Бензиловый эфир 2-оксо-3R(2,2,2-трифторацетиламино)пирролидин-1-карбоновой кислоты. Промежуточное соединение 155 (195,5 г) суспендируют в дихлорметане (1500 мл) и добавляют метанол (600 мл). Добавляют метил 46 трифторацетат (410 г), а затем N-метилморфолин(97 г). Реакционную смесь оставляют перемешиваться при комнатной температуре в течение 18 ч. Реакционную смесь разбавляют дихлорметаном (500 мл) и добавляют насыщенный хлорид аммония (1000 мл). Добавляют раствор разбавленной соляной кислоты (2N, 250 мл), и смесь интенсивно перемешивают в течение 5 мин и затем оставляют разделяться. Органический слой отделяют, а водный экстрагируют дихлорметаном (500 мл). Органические экстракты объединяют и промывают разбавленной HCl (2N, 1000 мл), рассолом (1000 мл), сушат (Na2SО 4) и концентрируют. Остаток растирают со смесью эфир:циклогексан (1:1, 1000 мл), и твердое вещество отфильтровывают с получением указанного в заголовке соединения в виде бледно-розового твердого вещества (197,9 г). ТСХ (эфир) Rf = 0,46. Масс-спектр MNH4+ (найдено) 348, MNH4+(рассчитано) 348. Промежуточное соединение 101. Бензиловый эфир 2-этокси-3R-(2,2,2-трифторацетиламино)-пирролидин-1-карбоновой кислоты. Промежуточное соединение 100 (100 мг) растворяют в сухом тетрагидрофуране (1 мл),охлаждают до -20 С и добавляют боргидрид лития (2,0 М в THF, 0,15 мл). Через 0,5 ч добавляют этанол (1 мл), а затем концентрированную H2SO4(33 мкл), и полученный перемешиваемый раствор оставляют при комнатной температуре на 3,5 ч. Устанавливают величину рН реакционной смеси, равную 8-9, путем добавления насыщенного водного бикарбоната натрия, и органические растворители удаляют в вакууме. Полученный остаток распределяют между этилацетатом(20 мл) и водой (10 мл), и водную фазу экстрагируют дополнительным количеством этилацетата(10 мл). Объединенные органические слои сушат(Na2SO4), фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение в виде прозрачного масла (101 мг), которое используют без дополнительной очистки. Масс-спектр MNH4+(найдено) 378, MNH4+(рассчитано) 378. Промежуточное соединение 101 (альтернативный синтез). Бензиловый эфир 2-этокси-3R(2,2,2-трифтор-ацетиламино)-пирролидин-1 карбоновой кислоты. Раствор промежуточного соединения 100(214,8 г) в сухом THF (1200 мл) перемешивают и охлаждают до -30 С. Добавляют боргидрид лития (2,0 М в THF, 336 мл) (после первоначального увеличения температуры до -12 С температуру поддерживают ниже -17 С до окончания прибавления). Перед тем как к смеси добавить этанол (760 мл), поддерживая температуру ниже 19 С, смесь перемешивают при -20 С в течение 90 мин. Охлажденную смесь концентрированной серной кислоты (75 мл) и этанола (215 мл) медленно добавляют к смеси, поддерживая внутреннюю температуру ниже -18 С. Охлаждающую баню удаляют, и реакционную смесь оставляют перемешиваться в течение 90 мин, после чего внутренняя температура увеличивается до +15 С. Перед удалением летучих веществ в вакууме к смеси в течение 35 мин осторожно добавляют насыщенный раствор бикарбоната натрия (1600 мл). Остаточную водную фазу экстрагируют этилацетатом (1000 мл + 2 х 800 мл), объединенные экстракты промывают рассолом (800 мл), сушат (Na2SO4) в течение ночи, и растворитель удаляют в вакууме с получением указанного в заголовке соединения (211,6 г) в виде оранжевого масла. ТСХ (4:1 CH2Cl2:Et2O) Rf = 0,64 и 0,43. Промежуточное соединение 102. Бензиловый эфир (2S,3R)-2-(отн-1S-этоксикарбонил-2 метил-пропил)-3-(2,2,2-трифторацетиламино)пирролидин-1-карбоновой кислоты. Промежуточное соединение 101 (90 мг),промежуточное соединение 95 (0,22 г) и дихлорметан охлаждают до 5 С и добавляют эфир в виде бортрифториддиэфирата (0,15 г). Через 55 мин реакционную смесь охлаждают смешиванием с 2 М водным бикарбонатом натрия (15 мл) и разбавляют дихлорметаном (10 мл). Водный слой отделяют, и органический слой промывают насыщенным водным раствором хлорида натрия(10 мл). Органический экстракт сушат (MgSО 4),фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение в виде бесцветного масла (106 мг). Масс-спектр МН+ (найдено) 445, MH+ (рассчитано) 445. Промежуточное соединение 102 (альтернативный синтез). Бензиловый эфир (2S,3R)-2(отн-1S-этоксикарбонил-2-метил-пропил)-3(2,2,2-трифторацетиламино)-пирролидин-1 карбоновой кислоты. Промежуточное соединение 101 (97,9 г),(Z)-(1-этокси-3-метил-бут-1-енилоксил-триизопропилсилан) (233 г) и дихлорметан (600 мл) охлаждают до 5 С в атмосфере азота и в течение 15 мин добавляют бортрифторидиэтилэфират (200 мл). После дополнительных 15 мин добавляют 2 М карбонат натрия (750 мл), поддерживая температуру ниже 20 С. Реакционную смесь фильтруют через гифло, и твердый материал промывают дихлорметаном (2 х 200 мл). После добавления промывных вод к двухфазной смеси водный слой отделяют и экстрагируют дихлорметаном(2 х 400 мл). Объединенные экстракты промывают рассолом (2 х 250 мл), сушат (MgSO4) и концентрируют в вакууме с образованием указанного в заголовке соединения, загрязненного некоторым количеством промежуточного соединения 103 48 Промежуточное соединение 103. Бензиловый эфир (2S,3R)-3-амино-2-(1-этоксикарбонил 2-метил-пропил)-пирролидин-1-карбоновой кислоты. Промежуточное соединение 102 (97 мг),карбонат калия (300 мг), этанол (2 мл) и воду (2 мл) нагревают с обратным холодильником в течение 2,25 ч. Этанол и воду выпаривают в вакууме, и остаток распределяют между этилацетатом (10 мл) и водой (10 мл). Водный экстрат доводят до рН 9-10 путем добавления 2 М водного раствора гидроксида натрия и экстрагируют диэтиловым эфиром (3 х 20 мл). Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде прозрачного масла (56 мг). Промежуточное соединение 103 (Альтернативный синтез). Бензиловый эфир (2S,3R)-3 амино-2-(1-этоксикарбонил-2-метил-пропил)пирролидин-1-карбоновой кислоты. Промежуточное соединение 102 (загрязненное некоторым количеством промежуточного соединения 103) (153 г), карбонат калия (183,3 г),этанол (1000 мл) и воду (1000 мл) нагревают с обратным холодильником в течение 5 ч. Органический слой затем отделяют и концентрируют в вакууме. Остаток, водный слой и рассол (200 мл) экстрагируют эфиром (2 х 500 мл, +250 мл), и объединенные экстракты экстрагируют 1 М соляной кислотой (3 х 500 мл). Объединенные кислые экстракты доводят до рН 8 твердым гидрокарбонатом натрия (150 г) и экстрагируют дихлорметаном (600 мл, +3 х 300 мл). Объединенные дихлорметановые экстракты сушат (MgSO4) и концентрируют в вакууме с получением указанного в заголовке соединения (87,9 г). ТСХ на(0,4 мл). Через 3 ч реакционную смесь охлаждают смешиванием с насыщенным раствором хлорида аммония (1 мл). Водный слой отделяют и экстрагируют этилацетатом (4 мл). Объединенные органические экстракты выпаривают в вакууме. Остаток распределяют между дихлорметаном (10 мл) и 2 М соляной кислотой (10 мл). Водную фазу отделяют и экстрагируют дихлорметаном (3 х 5 мл). Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют в вакууме с образованием неочищенного белого твердого вещества, содержащего указанное в заголовке соединение. Очистка флэш 49 хроматографией (SiO2, Merck 9385) с элюированием смесью этилацетат:циклогексан (1:1) приводит к указанному в заголовке соединению в виде белого твердого вещества (16 мг). ТСХ (2:1 этилацетат:циклогексан) Rf 0,38. Хиральная HPLC (колонка chiracel AD, система элюента этанол:гептан 10:90, объемная скорость потока 1 мл/мин). Время удерживания SSR лактама = 9,92 мин (73,6%). Время удерживания(800 мл),N,N,N',N'тетраметилэтилендиамину (800 мл) при 0 С в атмосфере азота добавляют 1 М третбутилмагнийхлорид в тетрагидрофуране (750 мл) в течение 40 мин. После 1 дополнительного часа добавляют насыщенный раствор хлорида аммония (500 мл), и водный слой отделяют и экстрагируют этилацетатом (250 мл). Затем объединенные органические экстракты концентрируют в вакууме. К остатку добавляют 1 М соляную кислоту (1000 мл) и экстрагируют этилацетатом(3 х 500 мл). Объединенные экстракты промывают рассолом (250 мл), сушат (MgSO4) и концентрируют в вакууме с образованием коричневого твердого вещества (63,4 г). Его перекристаллизовывают из этилацетата получая указанное в заголовке соединение (29,5 г). ТСХ на SiO2 (19:1 этилацетат: метанол) Rf 0,64. Масс-спектр МН+ (найдено) = 303, МН+(рассчитано) = 303. Промежуточные соединения 104 и 111. Рацемат промежуточного соединения 84(1,40 г) разделяют на его энантиомеры хиральной HPLC (2 х дюймовая Merck колонка с твердой фазой chiralpak AD, система элюента 15% этанол/гептан, объемная скорость потока 50 мл/мин) с образованием: промежуточного соединения 104. Бензилового эфира (3S,3 аS,6 аR)-6-изопропил-5-оксо-гексагидро-пирроло[3,2-b]пиррол-1 карбоновой кислоты (510 мг). Хиральная HPLC (chiracel AD, система элюента этанол:гептан 10:90, объемная скорость потока 1 мл/мин). Время удерживания = 9,0 мин,98,9% е.е. промежуточного соединения 111. Бензилового эфира(3R,3 аR,6 аS)-6 изопропил-5-оксо-гексагидропирроло[3,2-b] пиррол-1-карбоновой кислоты (495 мг) Хиральная HPLC (система такая, как для промежуточного соединения 104). Время удерживания =11,3 мин, 97,8% е.е. Промежуточное соединение 112. Этиловый эфир (Е)-4-пиперидин-1-ил-2-еновой кислоты. Смесь этил-4-бромкротоната (193 мг), пиперидина (94 мг) и карбоната калия (276 мг) в 50 ацетонитриле (10 мл) перемешивают и нагревают с обратным холодильником в течение 3 ч. Реакционную смесь охлаждают, и растворитель удаляют в вакууме. Остаток распределяют между водой (2 х 15 мл) и этилацетатом (20 мл). Органические экстракты сушат (Na2SO4), фильтруют и концентрируют в вакууме с образованием указанного в заголовке соединения в виде оранжевого масла (157 мг). ТСХ на диоксиде кремния (100:8:1 смесь дихлорметана, этанола и аммиака (S.G. = 0,88(рассчитано) = 198. Промежуточное соединение 113. Гидрохлорид (Е)-4-пиперидин-1-ил-бут-2-еновой кислоты. Раствор промежуточного соединения 112(592 мг) в диоксане (18 мл) и 2 М соляную кислоту (10 мл) перемешивают и нагревают с обратным холодильником в течение 5,5 ч. Реакционную смесь охлаждают и растворители удаляют в вакууме, используя толуол для удаления последних следов воды путем азеотропной перегонки. Остаточное полутвердое вещество в течение 1,5 ч перетирают с эфиром (2 х 50 мл), а затем в течение 30 мин перетирают с этилацетатом (50 мл); причем после каждого перетирания растворители декантируют. Остаток от последнего перетирания сушат в вакууме с образованием указанного в заголовке соединения в виде порошка кремового цвета (569 мг). ТСХ на диоксиде кремния (100:8:1 смесь дихлорметана, этанола и аммиака (S.G. = 0,88(рассчитано) = 170. Промежуточное соединение 114. отн(3R,3 аR,6 аS)-4-(4-Хлор-бут-2 Е-еноил)-1-метансульфонил-3-пропил-гексагидропирроло[3,2-b] пиррол-2-он. Раствор промежуточного соединения 26 (40 мг) в сухом тетрагидрофуране (1 мл) добавляют к перемешиваемому раствору промежуточного соединения 116 (50 мг), 1-гидроксибензотриазола (43 мг) и гидрохлорида 1-(3 диметиламинопропил)-3-этилкарбодиимида (61 мг) в сухом тетрагидрофуране (2,5 мл) и диметилформамиде (0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2,5 ч и затем распределяют между 4%-ным бикарбонатом натрия (15 мл) и этилацетатом(2 х 20 мл). Объединенные органические экстракты промывают водой (2 х 15 мл), сушат (Na2SО 4),фильтруют и концентрируют; при этом остается смола. Смолу очищают колоночной флэшхроматографией на диоксиде кремния, элюируя смесью этилацетата и циклогексана (4:3) с образованием указанного в заголовке соединения в виде порошка кремового цвета (25 мг). ТСХ на диоксиде кремния (1:1 смесь циклогексана и этилацетата) Rf 0,22.(рассчитано) = 349. Промежуточное соединение 115. отн(3R,3 аR,6 аS)-4-[3-(4-Метансульфонил-5-оксо-6 пропил-гексагидропирроло[3,2-b]пиррол-1-ил)-3 оксо-проп-2 Е-енил]-бензальдегид. Раствор промежуточного соединения 26 (60 мг) в сухом диметилформамиде (0,8 мл) добавляют к перемешиваемому раствору 4 формилкоричной кислоты (56 мг), 1-гидроксибензотриазола (44 мг) и гидрохлорида 1-(3 диметиламинопропил)-3-этилкарбодиимида (62 мг) в сухом диметилформамиде (2,7 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч, затем распределяют между 8%-ным бикарбонатом натрия (15 мл) и этилацетатом (20 мл). Этилацетатную фазу отделяют, промывают водой (2 х 15 мл), сушат(Na2SО 4), фильтруют и упаривают с образованием твердого вещества. Твердое вещество перетирают с эфиром (10 мл) в течение 10 мин. Эфир декантируют. Остаток сушат в вакууме с образованием указанного в заголовке соединения в виде желтого порошка (79 мг). Температура плавления 183-188 С. Масс-спектр МH+ (найдено) = 405, МН+ (рассчитано) = 405. Промежуточное соединение 116. 4-Хлорбут-2 Е-еновая кислота. Раствор этил-4-бромкротоната (3,58 г) и моногидрата гидроксида лития (0,83 г) в воде (30 мл) и тетрагидрофуране (50 мл) перемешивают при комнатной температуре в течение 5,5 часов,подкисляют (до рН 1-2) 2 М соляной кислотой(13 мл) и экстрагируют этилацетатом (2 х 50 мл). Объединенные органические экстракты промывают водой (40 мл), сушат (Na2SO4), фильтруют и концентрируют с образованием вязкого масла. Масло перетирают с дихлорметаном (10 мл) в течение 5 мин. Раствор декантируют и концентрируют; при этом остается масло. Масло перетирают с диэтиловым эфиром (15 мл) в течение 10 мин. Раствор декантируют и концентрируют с образованием полутвердого вещества. Очистка колоночной флэш-хроматографией на диоксиде кремния с элюированием смесью циклогексана и этилацетата (3:2) приводит к получению указанного в заголовке соединения в виде воскообразного белого твердого вещества (0,62 мг). ТСХ на диоксиде кремния (1:1 смесь циклогексана и этилацетата) Rf 0,5. Промежуточное соединение 117. отн(3R,3 аR,6 аS)-4-(4-Хлор-бут-2 Е-еноил)-3 изопропил-1-метансульфонил-гексагидропирроло[3,2-b]пиррол-2-он. Раствор промежуточного соединения 86(5 мл) и сухом тетрагидрофуране (20 мл) перемешивают при комнатной температуре в течение 6 ч, затем выдерживают в течение дополнитель 52 ных 16 ч. Реакционную смесь распределяют между этилацетатом (2 х 75 мл) и 8%-ным бикарбонатом натрия (80 мл). Объединенные этилацетатные экстракты промывают 0,5 М соляной кислотой (2 х 60 мл) и водой (60 мл), сушат (Na2SO4) и упаривают с образованием полутвердого вещества, которое очищают колоночной флэшхроматографией на диоксиде кремния, используя смесь циклогексана и этилацетата (сначала 2:1,постепенно увеличивая концентрацию этилацетата до смеси 1:1) с образованием указанного в заголовке соединения в виде белого порошка(328 мг). ТСХ на диоксиде кремния (1:1 смесь циклогексана и этилацетата) Rf 0,3. Масс-спектр МН+ (найдено) = 349, МН+(Также в результате эксперимента выделяют промежуточное соединение 118). Промежуточное соединение 118. отн(3R,3 аR,6 аS)-4-(4-Хлор-бут-3Z-еноил)-3-изопропил-1-метансульфонил-гексагидропирроло[3,2-b] пиррол-2-он. Промежуточное соединение 118 выделяют как второй компонент в результате очистки колоночной флэш-хроматографией промежуточного соединения 117 (см. выше). Указанное в заголовке соединение выделяют в виде белого порошка (284 мг). Температура плавления 165-167 С. ТСХ на диоксиде кремния (1:1 смесь циклогексана и этилацетата) Rf = 0,55. Масс-спектр МН+ (найдено) 349, МН+ (рассчитано) 349. Промежуточное соединение 119. Данное промежуточное соединение получают способом,подобным способу получения промежуточного соединения 112. Этиловый эфир (Е)-4-азепин-1-ил-бут-2 еновой кислоты. Масс-спектр МН+ (найдено) 212, МН+ (рассчитано) 212. Промежуточное соединение 120. Данное промежуточное соединение получают способом,подобным способу получения в промежуточном соединении 113, из промежуточного соединения 119.(3 аR,6S,6 аS)-6-изопропил-4 метансульфонил-5-оксо-гексагидропирроло[3,2b]пиррол-1-карбоновой кислоты. К промежуточному соединению 104 (0,46 г) в сухом тетрагидрофуране (30 мл) при -70 С в атмосфере азота добавляют 1 М литийгексаметилдисилазид в тетрагидрофуране (2,0 мл). Раствор нагревают до 0 С в течение 15 мин, а затем, после добавления метансульфонилхлорида (0,30 мл), снова охлаждают до -70 С. Через 1,5 часа добавляют насыщенный водный хлорид аммония (30 мл), и смесь экстрагируют этилацетатом (3 х 5 мл). Объединенные экстракты промывают рассолом (2 х 25 мл), сушат (МgSO4) и в вакууме удаляют растворитель. Флэшхроматография остатка на диоксиде кремния смесью этилацетат:гексан 1:1 приводит к указанному в заголовке соединению в виде белого твердого вещества (0,34 г). ТСХ (SiO2, 1:1 этилацетат:циклогексан) Rf 0,4. Масс-спектр MNH4+ (найдено) 398, MNH4+(3S,3 аS,6 аR)-3-Изопропил-1-метансульфонилгексагидропирроло[3,2-b]пиррол-2-он. Промежуточное соединение 121 (0,31 г),10%-ный гидроксид палладия на угле (0,24 г),1,4-диоксан (25 мл) и этилацетат (25 мл) перемешивают в атмосфере водорода в течение 3 ч. Катализатор затем удаляют фильтрацией через гифло (hyflo), и фильтрат концентрируют в вакууме, получая указанное в заголовке соединение в виде бледно-желтого твердого вещества(3 аS,6R,6 аR)-6-изопропил-4 метансульфонил-5-оксо-гексагидропирроло[3,2b]пиррол-1-карбоновой кислоты. К промежуточному соединению 111 (0,46 г) в сухом тетрагидрофуране (30 мл) при -75 С в атмосфере азота добавляют 1 М литийгексаметилдисилазид в тетрагидрофуране (2,0 мл). Раствор перемешивают в течение 5 мин перед тем как нагревать до 0 С в течение 25 мин, а затем,после добавления метансульфонилхлорида (0,30 мл), снова охлаждают до -75 С. Через 4,5 ч добавляют насыщенный водный хлорид аммония(5 мл), и смесь оставляют нагреваться до комнатной температуры. Добавляют воду (15 мл), и смесь экстрагируют этилацетатом (3 х 20 мл). Объединенные экстракты промывают водой (10 мл), рассолом (15 мл), сушат (MgSO4) и в вакууме удаляют растворитель. Флэш-хроматография остатка на диоксиде кремния смесью этилацетат:гексан 1:1 приводит к указанному в заголовке соединению в виде белого твердого вещества(3R,3 аR,6 аS)-3-Изопропил-1-метансульфонилгексагидропирроло[3,2-b]пиррол-2-он. Промежуточное соединение 123 (0,37 г),10%-ный гидроксид палладия на угле (0,11 г) и этилацетат (50 мл) смешивают в атмосфере водорода в течение 5 ч. Катализатор затем удаляют 54 фильтрацией через гифло (hyflo), и отжатый осадок промывают этилацетатом (3 х 20 мл) и горячим этилацетатом (40 мл). Объединенные фильтраты концентрируют в вакууме, получая указанное в заголовке соединение в виде белого кристаллического твердого вещества (0,23 г). ТСХ (SiO2, этилацетат) Rf 0,07. Масс-спектр МН+ (найдено) 247, МН+ (рассчитано) 247. Промежуточное соединение 132. Данное промежуточное соединение получают способом, подобным способу получения в промежуточном соединении 115, из промежуточного соединения 86. отн-4-[3-(6R-Изопропил-4-метансульфонил-5-оксо-гексагидро-(3 аS,6 аR)-пирроло[3,2b]пиррол-1-ил)-3-оксо-(Е)-пропенил]бензальдегид. Температура плавления = 201-204 С. Массспектр МН+ (найдено) 405, MH+ (рассчитано) 405. Промежуточное соединение 133. отн(3R,3 аR,6 аS)-4-(3-Пиперидин-1-ил-пропионил)3-пропил-гексагидропирроло[3,2-b]пиррол-2-он. К перемешиваемому раствору промежуточного соединения 34 (1,213 г) и бром-триспирролидино-фосфония гексафторфосфата (3,7 г) в сухом дихлорметане (50 мл) в атмосфере азота добавляют пиперидинпропионовую кислоту (1,15 г) и N,N-диизопропилэтиламин (3,8 г). Смесь перемешивают в течение 20 ч перед тем как удалить в вакууме растворитель, получая желтое/серое кристаллическое твердое вещество. Твердое вещество очищают колоночной флэшхроматографией, элюируя смесью дихлорметан:этанол:0,88 аммиак 50:8:1 до тех пор пока элюируются неполярные примеси, а после этого смесью СН 2 Сl2:ЕtOН:0,88NН 3 25:8:1. Требуемые фракции объединяют, и растворитель удаляют в вакууме с получением указанного в заголовке соединения в виде белой хрустящей пены, выход= 2,214 г. ТСХ (пластинка SiO2, 50:8:1 СН 2 Сl2: ЕtOН:0,88NН 3) Rf 0,13. Масс-спектр МН+ (найдено) 308, МH+ (рассчитано) 308. Промежуточное соединение 134. Данное промежуточное соединение получают способом, подобным способу получения в промежуточном соединении 133, из промежуточного соединения 34. отн-(3R,3 аR,6 аS)-4-(6-Пиперидин-1-илгексаноил)-3-пропил-гексагидропирроло[3,2-b] пиррол-2-он. Т.пл.78-79,5 С. Промежуточное соединение 135. Данное промежуточное соединение получают способом, подобным способу получения в примере 8, из промежуточного соединения 34. отн-(3R,3 аR,6 аS)-4-(3-Пиперидин-1-илпропан-1-сульфонил)-3-пропил-гексагидропирроло[3,2-b]пиррол-2-он. ТСХ (7:1 дихлорметан: метанол) Rf 0,19. Промежуточное соединение 136. отн-4-(6RИзопропил-4-метансульфонил-5-оксогексагидро(3 аS,6 аR)-пирроло[3,2-b]пиррол-1-карбонил)бензальдегид. Перед перемешиванием при 22 С в течение 22 ч к перемешиваемому раствору промежуточного соединения 86 (100 мг) в ацетонитриле (5 мл) в атмосфере азота добавляют гидрохлорид 1(3-диметиламинопропил)-3-этилкарбодиимида(156 мг), 1-гидроксибензотриазол (110 мг) и 4 карбоксибензальдегид (79 мг). Растворитель удаляют из смеси в вакууме, и смолистый остаток распределяют между 2 н. Na2CO3 (15 мл) и дихлорметаном (15 мл). Органическую фазу отделяют, промывают 2 н. Na2CO3 (10 мл), водой (10 мл), насыщенным рассолом (10 мл), сушат(MgSO4), фильтруют и в вакууме, и растворитель удаляют с получением желтой смолы. Смолу очищают колоночной флэш-хроматографией,используя Merck 9385, диоксид кремния и элюируя смесью 2%МеОН/СН 2 Сl2. Требуемые фракции объединяют, и растворитель удаляют в вакууме с получением указанного в заголовке соединения в виде белой пены (148 мг). ТСХ (пластинка диоксида кремния, 9:1CH2Cl2:MeOH) Rf 0,60, проявлено УФ, КМnO4. Масс-спектр МН+ (найдено) 379, МН+ (рассчитано) 379. Промежуточное соединение 137. Данное промежуточное соединение получают способом, подобным способу получения в промежуточном соединении 87, из промежуточного соединения 86. отн-3-(6R-Изопропил-4-метансульфонил-5 оксо-гексагидро-(3 аS,6 аR)-пирроло[3,2b]пиррол-1-карбонил)-бензальдегид ТСХ (дихлорметан: метанол; 19:1) Rf 0,3. Промежуточное соединение 138. Упомянутое выше промежуточное соединение получают способом, подобным способу получения в примере 173, из промежуточного соединения 136. трет-Бутиловый эфир отн-4-[4-(6Rизопропил-4-метансульфонил-5-оксо-гексагидро-(3 аS,6 аR)-пирроло[3,2-b]пиррол-1-карбонил)бензил]-пиперазин-1-карбоновой кислоты. ТСХ (дихлорметан:метанол; 9:1) Rf 0,46. Промежуточное соединение 139. отн(3R,3 аR,6 аS)-4-(4-Бромметил-бензолсульфонил)1-метансульфонил-3-пропил-гексагидропирроло[3,2-b]пиррол-2-он. Промежуточное соединение 26 (246 мг) растворяют в ацетонитриле (10 мл) и обрабатывают карбонатом калия (414 мг), добавляют 4(бромметил)бензолсульфонилхлорид (403 г), и смесь оставляют перемешиваться при комнатной температуре в течение 2 ч. Смесь разбавляют дихлорметаном, и раствор промывают водой,рассолом и сушат (MgSO4) и концентрируют в вакууме с получением белого твердого вещества. Его растирают с ацетонитрилом и фильтруют с 56 получением указанного в заголовке соединения в виде белого твердого вещества (181 мг). Масс-спектр MNH4+ (найдено) = 498,MNH4+ (рассчитано) = 498. ТСХ (этилацетат:гексан; 1:2) Rf 0,23. Промежуточное соединение 140. Данное промежуточное соединение получают способом, подобным способу получения в промежуточном соединении 139, из промежуточного соединения 86. отн-(3R,3 аR,6 аS)-4-(4-Бромметил-бензолсульфонил)-3-изопропил-1-метансульфонилгексагидропирроло[3,2-b]пиррол-2-он. ТСХ (дихлорметан:этилацетат; 14:1) Rf 0,5. Масс-спектр МH+ (найдено) = 497/498, МH+(рассчитано) = 497/498. Промежуточное соединение 141. отн(3R,3 аR,6 аS)-4-(4-Бромметил-бензоил)-3 изопропил-1-метансульфонил-гексагидропирроло[3,2-b]пиррол-2-он. Промежуточное соединение 86 (200 мг) растворяют в дихлорметане (10 мл) и обрабатывают бикарбонатом натрия (204 мг), а затем 4(бромметил)бензоилхлоридом (227 мг). Реакционную смесь оставляют перемешиваться в течение ночи. Смесь вливают в воду и экстрагируют этилацетатом. Объединенные органические экстракты промывают разбавленной HCl, рассолом,сушат (MgSO4) и концентрируют с получением желтой смолы. Смолу затем подвергают хроматографии на диоксиде кремния, элюируя смесью этилацетат:гексан; 1:1 с получением указанного в заголовке соединения в виде белого твердого вещества (287 мг). Масс-спектр МН+ (найдено) = 444,+ МН (рассчитано) = 444. Промежуточное соединение 142. Данное промежуточное соединение получают способом, подобным способу получения в промежуточном соединении 87, из промежуточного соединения 86. отн-5-(6R-Изопропил-4-метансульфонил-5 оксо-гексагидро-(3 аS,6 аR)-пирроло[3,2b]пиррол-1-карбонил)-фуран-2-карбальдегид. Масс-спектр MNH4+ (найдено) = 386,MNH4+ (рассчитано) = 386. Промежуточное соединение 143. Данное промежуточное соединение получают способом, подобным способу получения в промежуточном соединении 115, из промежуточного соединения 86. трет-Бутиловый эфир отн-4-[4-(6R-изопропил-4-метансульфонил-5-оксо-гексагидро(3 аS,6 аR)-пирроло[3,2-b]пиррол-1-ил)-4-оксобутил]-пиперидин-1-карбоновой кислоты. ТСХ (циклогексан:этилацетат; 1:1) Rf 0,27. Масс-спектр МН+ (найдено) = 500,+(1,6 М, 26 мл) добавляют при перемешивании к раствору диизопропиламина (6,2 мл) в тетрагидрофуране (8 мл) при температуре ниже -25 С в атмосфере азота. Через 30 мин смесь охлаждают до -75 С и по каплям добавляют этилциклопропилацетат (4,5 г), сохраняя температуру ниже 65 С. Затем температуру смеси в течение 3 ч поддерживают ниже -75 С перед тем как добавить хлортриметилсилан (3,8 мл) при температуре ниже -65 С. Реакционную смесь оставляют нагреваться до температуры окружающей среды и затем упаривают в вакууме до сухого состояния. Остаток превращают в шлам в гексане и фильтруют. Фильтрат упаривают до оранжевого масла, которое перегоняют в вакууме с получением указанного в заголовке соединения (4,0 г) в виде прозрачной подвижной жидкости. Т.кип. 80-82C, Зх 10-2 бар. Масс-спектр МН+ (найдено) = 201, MH+(рассчитано) = 201. Промежуточное соединение 145. Бензиловый эфир транс-2-(циклопропил-этоксикарбонилметил)-3-(2,2,2-трифторацетиламино)пирролидин-1-карбоновой кислоты. Раствор промежуточного соединения 144(2,5 г) в дихлорметане (16 мл) добавляют при 0 С при перемешивании к раствору промежуточного соединения 81 (2,0 г) в дихлорметане (16 мл) в атмосфере азота. Затем по каплям добавляют бортрифтордиэтилэфират (4 мл), и реакционную смесь перемешивают в течение дополнительного 1 ч. Реакционную смесь охлаждают смешиванием с 1 М соляной кислотой (10 мл). Водную фазу отделяют и экстрагируют дихлорметаном (2 х 20 мл). Объединенные органические экстракты промывают рассолом, сушат (MgSO4) и упаривают с получением указанного в заголовке соединения в виде желтого масла (3,1 г), которое используют неочищенным на следующей подготовительной стадии. Промежуточное соединение 146. Бензиловый эфир транс-3-амино-2-(циклопропилэтоксикарбонилметил)-пирролидин-1 карбоновой кислоты. Смесь неочищенного промежуточного соединения 145 (3,1 г) в водном карбонате калия(40 мл) нагревают с обратным холодильником в течение 16 ч. Смесь охлаждают, и органический слой отделяют и упаривают с получением масла. Масло распределяют между 1 М соляной кислотой (25 мл) и эфиром (50 мл). Органическую фазу экстрагируют 1 М соляной кислотой (3 х 25 мл). Объединенные водные растворы промывают эфиром (25 мл) и увеличивают их основность до рН 9 путем постепенного прибавления, при перемешивании, твердого карбоната натрия. Смесь затем экстрагируют этилацетатом (3 х 75 мл). Объединенные экстракты промывают рассолом 58 получением указанного в заголовке соединения в виде вязкого желтого масла (1,3 г). Масс-спектр МН+ (найдено) = 347, MH+(рассчитано) = 347. Промежуточное соединение 147. Бензиловый эфир отн-(3 аS,6R,6 аS)-6-циклопропил-5 оксо-гексагидропирроло[3,2-b]пиррол-1-карбоновой кислоты. Раствор трет-бутилмагнийхлорида в тетрагидрофуране (1,0 М, 11,25 л) добавляют по каплям в атмосфере азота к раствору промежуточного соединения 146 (1,2 г) в смеси N,N,N',N'тетраметилендиамина (13 мл) и тетрагидрофурана (13 мл) при 4-5 С. Через 2 ч охлаждение прекращают и дают возможность температуре реакции подняться до температуры окружающей среды. При комнатной температуре в течение 4 ч добавляют по каплям второе количество (3 мл) трет-бутилмагнийхлорида. После дополнительных 2 ч добавляют насыщенный водный хлорид аммония (1 мл), а затем реакционную смесь подкисляют до рН 1-2 соляной кислотой. Смесь экстрагируют этилацетатом (3 х 30 мл). Объединенные органические экстракты промывают рассолом (20 мл), сушат (MgSO4) и упаривают до желтой пасты, которую растирают с этилацетатом с получением тонко измельченного белого твердого вещества (0,3 г), содержащего указанное в заголовке соединение. Т.пл.141-149 С. Очистка колоночной флэш-хроматографией с использованием смеси этилацетат:гексан (2:1) в качестве элюента приводит к указанному в заголовке соединению (0,2 г) в виде твердой пены. Промежуточное соединение 148. Бензиловый эфир отн-(3 аS,6R,6 аS)-6-циклопропил-4 метансульфонил-5-оксо-гексагидропирроло[3,2b]пиррол-1-карбоновой кислоты. Раствор литийгексаметилдисилазида в тетрагидрофуране (1,0 М, 0,1 мл) добавляют по каплям при -75 С к перемешиваемому раствору промежуточного соединения 147 (0,25 г) в тетрагидрофуране (16 мл) в атмосфере азота. Реакционную смесь перемешивают при -75 С в течение 5 мин, а затем около 0 С в течение 25 мин перед тем как охладить до -75 С. Добавляют по каплям метансульфонилхлорид (0,24 г), и реакционную смесь затем перемешивают около -75 С в течение 1,5 ч. Через 2 ч последовательно добавляют насыщенный водный хлорид аммония (1,5 мл) и воду (30 мл). Смесь экстрагируют этилацетатом(3 х 25 мл), и объединенные экстракты промывают рассолом (15 мл), сушат (MgSO4) и упаривают в вакууме до прозрачной пленки. Пленку очищают колоночной флэш-хроматогафией, используя смесь этилацетата и гексана (1:2) в качестве элюента, с получением указанного в заголовке соединения в виде белого твердого вещества (0,21 г). Т.пл.144-149,5 С. Промежуточное соединение 149. отн(3R,3 аR,6 аS)-6-Циклопропил-1-метансульфонилгексагидропирроло[3,2-b]пиррол-2-он. Раствор промежуточного соединения 148(0,21 г) в этилацетате (25 мл) добавляют к предварительно восстановленному влажному 20%ному гидроксиду палладия на угле (катализатору Пиарлмана) в этилацетате (20 мл). Смесь интенсивно перемешивают при комнатной температуре в атмосфере водорода в течение 1,5 ч (поглощение водорода 17 мл). Катализатор отфильтровывают, и фильтрат упаривают с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (0,13 г). Т.пл.137-144 С. Масс-спектр МН+ (найдено) = 245, МH+(1000 мл) и 1,25 М NaOH (1330 мл) перемешивают и охлаждают до 6 С перед тем как одной порцией добавить раствор ди-трет-бутилкарбоната (384 г) в 1,4-диоксане (300 мл). Охлаждающую баню удаляют, и реакционную смесь перемешивают в течение 3,5 ч. 1,4-Диоксан удаляют из смеси в вакууме перед тем как добавить этилацетат (1000 мл), а затем 1 М KHSO4 (1700 мл). После смешивания и разделения фаз водную фазу далее экстрагируют этилацетатом (600 мл). Объединенные органические фазы промывают водой (600 мл), рассолом (100 мл), сушат(рассчитано) = 250. Промежуточное соединение 151. третБутиловый эфир (1R-карбамоил-3-метилсульфанил-пропил)-карбаминовой кислоты. Промежуточное соединение 150 (425 г) растворяют в N,N-диметилформамиде (700 мл) и добавляют пиридин (63,2 мл). Ди-третбутилдикарбонат (402,2 г) добавляют порциями,и смесь перемешивают в течение 10 мин при комнатной температуре. Гидрокарбонат аммония(145,7 г) добавляют, и смесь перемешивают при комнатной температуре в течение 18 ч. К смеси добавляют воду (1000 мл), а затем этилацетат(1000 мл) и рассол (250 мл). Смесь интенсивно перемешивают и оставляют разделяться. Водную фазу экстрагируют этилацетатом (2 х 600 мл). Объединенные органические фазы промывают водой (1000 мл), разбавленной серной кислотой(2 х 750 мл) [приготовленной из 38 мл концентрированной серной кислоты и 1600 мл воды], водой(3 х 750 мл) и рассолом (1000 мл). Раствор сушат над сульфатом натрия, и растворитель удаляют в вакууме, при этом остается белое твердое вещество. Это твердое вещество растирают с диэтиловым эфиром (1200 мл), отфильтровывают и сушат в вакууме с получением указанного в за 60 головке соединения в виде белого порошка (265 г). ТСХ (SiO2, этилацетатциклогексан; 1:1) Rf 0,25. Масс-спектр МН+ (найдено) = 249, МН+(рассчитано) = 249. Промежуточное соединение 152. Бензиловый эфир (2R-трет-бутоксикарбониламино-4 метилсульфанилбутирил)-карбаминовой кислоты. н-Бутиллитий в смеси гексанов (2,5 М, 992 мл) постепенно добавляют к перемешиваемому охлаждаемому раствору промежуточного соединения 151 (308 г) в тетрагидрофуране (2000 мл) с такой скоростью, чтобы поддерживать температуру между -65 и -72 С. Через 1 ч 20 мин постепенно, за 45 мин, добавляют раствор бензилхлорформиата (211 г) в тетрагидрофуране (200 мл), поддерживая температуру ниже -60 С. Реакционную смесь снова охлаждают ниже -70 С и поддерживают эту температуру в течение 1,5 ч. Реакционную смесь смешивают с насыщенным водным хлоридом аммония (1000 мл). Температура возрастает до -40 С и ее оставляют постепенно увеличиваться до +10 С. Органический слой отделяют, и водный слой экстрагируют этилацетатом (3 х 50 мл). Объединенные органические экстракты промывают рассолом (3 х 500 мл), сушат (Na2SO4) и упаривают в вакууме с получением указанного в заголовке соединения в виде прозрачного бледно-желтого вязкого масла(560 г). Это вещество используют без дополнительной очистки. Масс-спектр MNH4+ (найдено) = 400,MNH4+ (рассчитано) = 400. Промежуточное соединение 153. Йодид (4 бензилоксикарбониламино-3R-трет-бутоксикарбониламино-4-оксо-бутил)-диметилсульфония. Метилйодид (875 г) добавляют при перемешивании в атмосфере азота к раствору промежуточного соединения 152 (558 г) в ацетоне (875 мл) при комнатной температуре. Реакционную смесь перемешивают в темноте в течение 3 дней и затем охлаждают в ледяной бане в течение 4 ч. Полученную бледно-желтую кристаллическую суспензию фильтруют, и фильтр промывают охлажденной (0 С) смесью ацетон:эфир (1:9; 1000 мл). Полученное белое твердое вещество сушат с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества(559 г). Т.пл.121-126 С. Промежуточное соединение 154. Бензиловый эфир (R)-3-трет-бутоксикарбониламино-2 оксо-пирролидин-1-карбоновой кислоты. Промежуточное соединение 153 (510 г) растворяют в ацетонитриле (2600 мл). Добавляют молекулярные сита 4 (измельченные в порошок, 55 г), а затем смолу Dowex 2 Х 8-400 (гидроксидная форма, 640 г). Смесь интенсивно перемешивают в течение 3,5 ч. Через 3,5 ч добавляют смолу (60 г), а через 5 ч - дополнительное
МПК / Метки
МПК: A61P 11/00, C07D 487/04, A61K 31/407
Метки: качестве, производные, ингибиторов, нейтрофильной, пирролопирролона, эластазы
Код ссылки
<a href="https://eas.patents.su/30-1437-proizvodnye-pirrolopirrolona-v-kachestve-ingibitorov-nejjtrofilnojj-elastazy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пирролопирролона в качестве ингибиторов нейтрофильной эластазы</a>
Предыдущий патент: Антагонисты рецептора il-8
Следующий патент: Способ изготовления горчичника, линия для его изготовления, горчичник, выполненный данным способом, и способ его упаковки
Случайный патент: Газификация горючих органических материалов


































