Макроциклические ингибиторы вируса гепатита с
Номер патента: 14188
Опубликовано: 29.10.2010
Авторы: Сальберг Свен Кристер, Росенквист Оса Анника Кристина, Де Кок Херман Аугустинус, Симмен Кеннет Алан, Вехлинг Хорст Юрген, Валльберг Ханс Кристиан, Рабуассон Пьер Жан-Мари Бернар, Ху Лили, Бельфраге Анна Карин Гертруд Линнеа, Канберг Пиа Сесилия, Линдстрем Матс Стефан, Классон Бьерн Олоф, Нильссон Карл Магнус, Линдквист Карин Карлотта, Самуэльссон Бенгт Бертил
Формула / Реферат
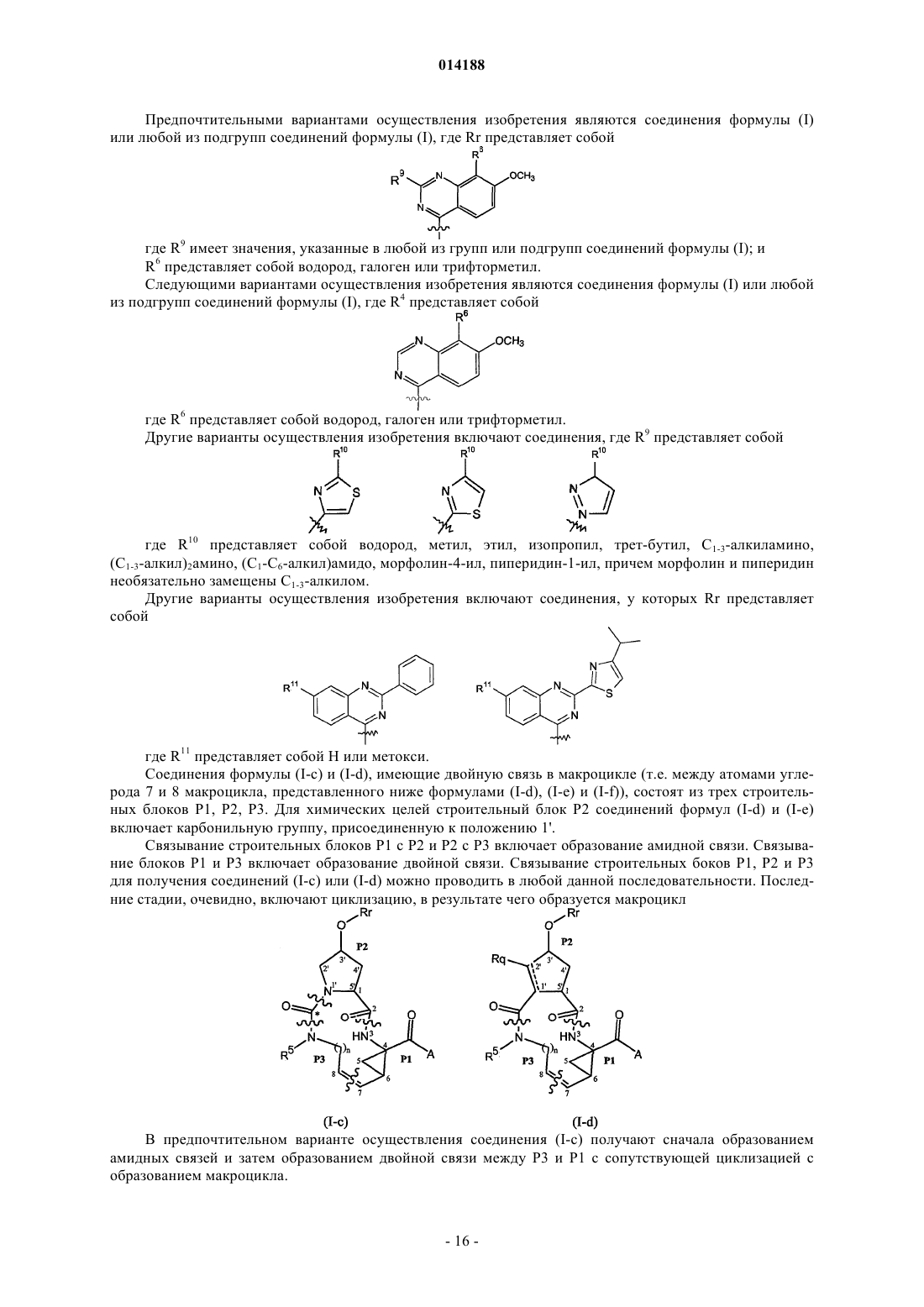
1. Соединение формулы (I)

и его N-оксиды, соли и стереоизомеры,
где А представляет собой OR1, NHS(=O)pR2; где
R1 представляет собой водород, C1-C6-алкил;
R2 представляет собой C3-C7-циклоалкил, причем указанный C3-C7-циклоалкил необязательно замещен 1-3 заместителями, независимо выбранными из C1-C6-алкила;
р независимо равно 2;
n равно 3, 4, 5 или 6;
---- означает необязательную двойную связь;
L представляет собой N или CRz;
Rz представляет собой Н;
Rq представляет собой Н;
R5 представляет собой водород, C1-C6-алкил, причем указанный C1-C6-алкил необязательно замещен 1-3 заместителями, выбранными из арила, причем указанный арил необязательно замещен 1-3 заместителями, независимо выбранными из C1-C6-алкокси;
Rr представляет собой хиназолинил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C6-алкила, C1-C6-алкокси, арила, пиридинила, пиразолила, тиазолила, пирролидинила, морфолинила, пиперазинила, амино, моно- или ди-C1-C6-алкиламино, причем указанный арил необязательно замещен 1-3 заместителями, независимо выбранными из C1-C6-алкокси, нитрила, галогена; причем указанные пиридинил, пиразолил, тиазолил, пирролидинил, морфолинил, пиперазинил независимо выбраны из C1-C6-алкила.
2. Соединение по п.1, содержащее структурный фрагмент

3. Соединение по п.1, где n равно 4 или 5.
4. Соединение по п.3, где связь -----, соседняя с циклопропильным остатком, является двойной связью.
5. Соединение по п.1, где R5 представляет собой водород или метил.
6. Соединение по п.1, где А представляет собой -ОН или -NHS(=O)2-циклопропил.
7. Соединение по п.1, где А представляет собой NHS(=O)2-C1-C6-алкилзамещенный циклопропил.
8. Соединение по п.1, имеющее формулу
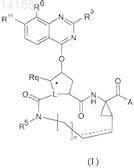
где n, A, L, Rq и R5имеют значения, указанные в п.1;
R6 представляет собой водород, C1-C6-алкил, C1-C6-алкокси, арил, пиридинил, пиразолил, тиазолил, пирролидинил, морфолинил, пиперазинил;
R9 представляет собой водород, C1-C6-алкил, C1-C6-алкокси, NRaRb, арил, который необязательно замещен R10, где R10 представляет собой C1-C6-алкокси или галоген; пиридинил, пиразолил, тиазолил, пирролидинил, морфолинил, пиперазинил, где указанные пиридинил, пиразолил, тиазолил, пирролидинил, морфолинил, пиперазинил необязательно замещены R10; R10 представляет собой C1-C6-алкил;
Ra и Rb представляют собой водород или C1-C6-алкил;
R11 представляет собой водород или C1-C6-алкокси.
9. Соединение по п.8, где R6 представляет собой C1-C3-алкил.
10. Соединение по п.8, где R11 представляет собой водород или метокси.
11. Соединение по п.8, где R9 представляет собой фенил или пиридинил, пиразолил, тиазолил, пирролидинил, морфолинил, пиперазинил, причем любой из них необязательно замещен одним или двумя R10, где
R10 в качестве заместителя фенила представляет собой водород, C1-C6-алкокси или галоген;
R10 в качестве заместителя пиридинила, пиразолила, тиазолила, пирролидинила, морфолинила, пиперазинила представляет собой C1-C6-алкил.
12. Соединение по п.11, где R9 представляет собой фенил, пиридил, тиазолил или пиразолил, каждый из которых необязательно замещен R10, как указано.
13. Соединение по п.12, где R10 представляет собой водород, фтор, дифтор, метил, этил, изопропил, трет-бутил, C1-C6-алкокси.
14. Соединение по п.13, где R10 представляет собой водород, фтор или метокси.
15. Соединение по п.12, где R9 выбран из

16. Соединение по п.12, где R9 выбран из

17. Соединение, имеющее формулу
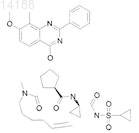
18. Соединение, имеющее формулу
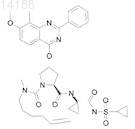
19. Соединение, имеющее формулу
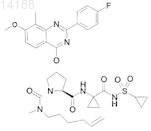
20. Соединение, имеющее формулу
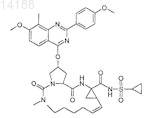
21. Соединение, имеющее формулу
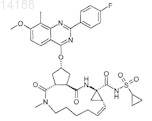
22. Соединение, имеющее формулу
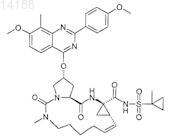
23. Соединение, имеющее формулу
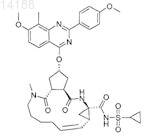
24. Соединение, имеющее формулу
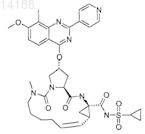
25. Фармацевтическая композиция, включающая соединение по любому из пп.1-24 и фармацевтически приемлемый носитель.
26. Фармацевтическая композиция по п.25, включающая дополнительное противовирусное средство против HCV, выбранное из ингибиторов полимеразы на основе нуклеозидных аналогов, ингибиторов протеазы, рибавирина и интерферона.
27. Применение соединения по любому из пп.1-24 в терапии.
28. Применение соединения по любому из пп.1-24 для получения лекарственного средства для профилактики или лечения флавивирусных инфекций, включая HCV.
29. Способ лечения или профилактики флавивирусной инфекции, такой как HCV, включающий введение эффективного количества соединения по любому из пп.1-24 индивидууму, пораженному такой инфекцией или имеющему риск поражения такой инфекцией.
Текст
МАКРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ВИРУСА ГЕПАТИТА С Изобретение относится к соединениям формулы (I) и их N-оксидам, солям и стереоизомерам, в которых А представляет собой OR1, NHS(=O)pR2; где R1 представляет собой водород, C1-C6-алкил, C0-C3 алкиленкарбоциклил, C0-C3-алкиленгетероциклил; R2 представляет собой C1-C6-алкил, C0-C3 алкиленкарбоциклил, C0-C3-алкиленгетероциклил; р независимо равно 1 или 2; n равно 3, 4, 5 или 6; означает необязательную двойную связь; L представляет собой N или CRz; Rz представляет собой Н или образует двойную связь с отмеченным звездочкой атомом углерода; Rq представляет собой Н или, когда L представляет собой CRz, Rq может быть также C1-C6-алкилом; Rr представляет собой хиназолинил,необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из C1-C6-алкила, C1-C6-алкокси, гидроксила, галогена, галоген-C1-C6-алкила, амино, моно- или диалкиламино, моно- или диалкиламинокарбонила, C1-C6-алкилкарбониламино, C0-C3-алкиленкарбоциклила иC3-C7-циклоалкил; R6 представляет собой водород, C1-C6-алкил, C1-C6-алкокси, C0-C3-алкиленкарбоциклил,C0-C3-алкиленгетероциклил, гидрокси, бром, хлор или фтор, применяемым при лечении или профилактике флавивирусных инфекций, таких как HCV Рабуассон Пьер Жан-Мари Бернар, Де Кок Херман Аугустинус, Ху Лили, Симмен Кеннет Алан (BE), Линдквист Карин Карлотта,Линдстрем Матс Стефан, Бельфраге Анна Карин Гертруд Линнеа, Вехлинг Хорст Юрген, Нильссон Карл Магнус, Самуэльссон Бенгт Бертил, Росенквист Оса Анника Кристина, Сальберг Свен Кристер, Валльберг Ханс Кристиан, Канберг Пиа Сесилия, Классон Бьерн Олоф (SE) 014188 Настоящее изобретение относится к макроциклическим соединениям, обладающим ингибирующей активностью в отношении репликации вируса гепатита С (HCV). Оно также относится к композициям,включающим эти соединения в качестве активных ингредиентов, а также способам получения этих соединений и композиций. Вирус гепатита С является основной причиной хронического заболевания печени во всем мире и становится предметом глубоких медицинских исследований. HCV является членом семейства вирусовFlaviviridae рода hepacivirus и близко связан с родом flavivirus, который включает ряд вирусов, участвующих в заболевании человека, таких как вирус денге и вирус желтой лихорадки, и с семейством пестивирусов животных, которые включают вирус бычьей вирусной диареи (BVDV). HCV является вирусом одноцепочечной (+)-РНК с геномом, имеющим приблизительно 9600 оснований. Геном включает как 5'-, так и 3'-нетранслируемые области, которые образуют вторичные структуры РНК, и центральную открытую рамку считывания, которая кодирует один полипротеин приблизительно с 3010-3030 аминокислотами. Полипротеин состоит из десяти генных продуктов, которые образуются из полипротеинапредшественника в результате ряда со- и послетрансляционных эндопротеолитических расщеплений,опосредуемых как протеазами хозяина, так и вирусными протеазами. Вирусные структурные белки включают коровий нуклеокапсидный белок и два оболочечных гликопротеина Е 1 и Е 2. Неструктурные(NS) белки включают белки с некоторыми существенными вирусными ферментативными функциями(геликазы, полимеразы, протеазы), а также белки неизвестной функции. Репликация вирусного генома опосредуется РНК-зависимой РНК-полимеразой, кодированной геном неструктурного белка 5b (NS5B). Обнаружено, что, помимо полимеразной функции, дополнительные функции вирусной геликазы и протеазы, присущие бифункциональному белку NS3, являются существенными для репликации РНК HCV. Помимо сериновой протеазы NS3, HCV кодирует также металлопротеиназу в области NS2. После начальной острой инфекции у основной части инфицированных индивидуумов развивается хронический гепатит, поскольку HCV реплицируется преимущественно в гепатоцитах, но не является непосредственно цитопатическим. В частности, оказывается, что отсутствие сильной реакции Т-лимфоцитов и высокая склонность вируса к мутации стимулируют высокую степень хронической инфекции. Хронический гепатит может развиться в фиброз печени, приводящий к циррозу, последней стадии заболевания печени, и НСС (гепатоклеточной карциноме), что является основной причиной трансплантации печени. Имеется 6 основных генотипов HCV и более чем 50 подтипов, которые различно распределены по географическим зонам. Тип 1 HCV является преобладающим генотипом в Европе и США. Экстенсивная генетическая гетерогенность HCV имеет важное диагностическое и клиническое значение, возможно, это объясняет трудности в разработке вакцины и отсутствие реакции на терапию. Передача инфекции HCV может иметь место посредством контактирования с инфицированной кровью или продуктами крови, например после переливания крови или внутривенного введения лекарственного средства. Введение диагностических тестов, применяемых при проведении скрининга крови, привело к понижающей тенденции в частоте инфицирования HCV после переливания крови. Однако при наличии медленного развития заболевания печени до конечной стадии существующие инфекции будут продолжать представлять собой серьезное медицинское и экономическое бремя в течение десятилетий. Современные терапевтические методы лечения HCV основаны на применении (пэгилированного) интерферона-альфа (IFN-) в комбинации с рибавирином. Эта комбинированная терапия дает стойко поддерживаемую вирологическую реакцию более чем у 40% пациентов, инфицированных вирусами генотипа 1, и приблизительно у 80% пациентов, инфицированных генотипами 2 и 3. Помимо ограниченной эффективности для HCV типа 1, эта комбинированная терапия имеет значительные побочные действия и плохо переносится многими пациентами. Основные побочные действия включают подобные гриппу симптомы, гематологические аномалии и невропсихиатрические симптомы. Поэтому существует потребность в более эффективных, пригодных и лучше переносимых методах лечения. За последнее время привлекли внимание два пептидомиметических ингибитора протеазы HCV в качестве клинических кандидатов, а именно BILN-2061, описанный в WO 00/59929, и VX-950, описанный в WO 03/87092. Ряд аналогичных ингибиторов протеазы HCV был описан в научной и патентной литературе. Стало уже очевидным, что в результате продолжительного введения BILN-2061 или VX-950 происходит отбор мутантов HCV, которые являются резистентными к соответствующему лекарственному средству, так называемые ускользнувшие от лекарственного средства мутанты. Эти ускользнувшие от лекарственного средства мутанты имеют характеристические мутации в геноме протеазы HCV, а именноD168V, D168A и/или A156S. Соответственно этому требуются дополнительные лекарственные средства с другими профилями резистентности для обеспечения не поддающихся лечению пациентов выбором лечения, и возможно, что комбинированная терапия с несколькими лекарственными средствами будет нормой в будущем даже для первичного лечения. Опыт работы с лекарственными средствами против HIV, в частности ингибиторами протеазы HIV,дополнительно показал, что субоптимальная фармакокинетика и комплексные схемы приема лекарственных средств быстро приводят к неумышленному нарушению больным схемы приема лекарственного средства. Это, в свою очередь, означает, что 24-часовая наименьшая концентрация (минимальная кон-1 014188 центрация в плазме) для соответствующих лекарственных средств в схеме лекарственного лечения HIV часто опускается ниже пороговой величины IC50 или ED90 в течение больших периодов дня. Считается,что 24-часовой промежуток наименьшего уровня, по меньшей мере, IC50 и более реально IC90 или ED90,является существенным для замедления развития ускользнувших от лекарственного средства мутантов. Достижение необходимой фармакокинетики и метаболизма лекарственного средства, которое позволяет достичь таких наименьших уровней, обеспечивает строгие требования для разработки лекарственного средства. Устойчивая пептидомиметическая природа ингибиторов протеазы HCV с множественными пептидными связями предшествующего уровня техники ставит фармакокинетические барьеры для эффективных схем приема лекарственных средств. Существует потребность в ингибиторах HCV, которые могут преодолевать недостатки современной терапии HCV, такие как побочные действия, ограниченная эффективность, появление резистентности и недостаточной совместимости. Настоящее изобретение относится к ингибиторам репликации HCV, которые проявляют по меньшей мере одно улучшенное свойство по сравнению с соединениями известного уровня техники. В частности, ингибиторы настоящего изобретения превосходят в одном или нескольких следующих фармакологических родственных свойствах, т.е. активности, пониженной цитотоксичности, улучшенной фармакокинетике, улучшенном профиле резистентности, приемлемой дозе и загрузке таблеток. Кроме того, соединения настоящего изобретения имеют относительно низкую молекулярную массу и обычно легко синтезируются из исходных веществ, которые являются коммерчески доступными или легко доступными посредством известных в данной области синтетических методик. Настоящее изобретение относится к ингибиторам репликации HCV, которые можно представить соединениями формулы (I)Rz представляет собой Н или образует двойную связь с отмеченным звездочкой атомом углерода;Rr представляет собой хиназолинил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран изR5 представляет собой водород, C1-C6-алкил, C1-C6-алкокси-C1-C6-алкил или C3-C7-циклолкил; и каждый C1-C6-алкил, C0-C3-алкиленкарбоциклил или C0-C3-алкиленгетероциклил необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, оксо, нитрила,азидо, нитро, C1-C6-алкила, C0-C3-алкиленкарбоциклила, C0-C3-алкиленгетероциклила, NH2C(=O)-,Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y-(C=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb иY независимо представляет собой связь или C1-C3-алкилен;Ra представляет собой независимо Н, C1-C6-алкокси, C1-C3-алкил; илиRb представляет собой независимо Н, C1-C6-алкил, C1-C6-алкокси, C0-C3-алкиленкарбоциклил илиRa и Rb вместе с атомом азота, к которому они присоединены, образуют гетероциклильную группу. Изобретение далее относится к способам получения соединений формулы (I), их пролекарств,N-оксидов, аддитивных солей, четвертичных аминов, комплексов металлов и стереохимически изомерных форм, их промежуточных соединений и применению промежуточных соединений при получении соединения формулы (I).-2 014188 Изобретение относится к соединениям формулы (I) per se, их пролекарствам, N-оксидам, аддитивным солям, четвертичным аминам, комплексам металлов и стереохимически изомерным формам для применения в качестве лекарственного средства. Изобретение далее относится к фармацевтическим композициям, включающим вышеуказанные соединения, для введения субъекту, страдающему инфекциейHCV. Фармацевтические композиции могут включать комбинации вышеуказанных соединений с другими анти-HCV-агентами. Изобретение относится также к применению соединения формулы (I) или его пролекарства,N-оксида, аддитивной соли, четвертичного амина, комплекса металла или стереохимически изомерной формы для изготовления лекарственного средства для ингибирования репликации HCV. Или изобретение относится к способу ингибирования репликации HCV у теплокровного животного, причем указанный способ включает введение эффективного количества соединения формулы (I) или его пролекарства,N-оксида, аддитивной соли, четвертичного амина, комплекса металла или стереохимически изомерной формы. Изобретение далее предлагает соединения формулы I, представленные формулой (It) и их N-оксиды, соли и стереоизомеры,где Xt представляет собой N, СН, и когда Xt имеет двойную связь, он представляет собой С;Rt2 представляет собой водород и, когда Xt представляет собой С или СН, Rt2 может также быть С 1-6-алкилом;Rt4 представляет собой хиназолинил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-6-алкила, C1-6-алкокси, гидрокси, галогена, полигалоген-С 1-6-алкила,полигалоген-C1-6-алкокси, амино, моно- или ди-C1-6-алкиламино, моно- или ди-C1-6-алкиламинокарбонила, C1-6-алкилкарбониламино, арила и Het;n равно 3, 4, 5 или 6; где каждая пунктирная линияпредставляет собой необязательную двойную связь;Rt6 представляет собой арил, Het, С 3-7-циклоалкил, необязательно замещенный С 1-6-алкилом, или С 1-6-алкил, необязательно замещенный С 3-7-циклоалкилом, арилом или Het; каждый арил, как группа или часть группы, представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбоксила, C1-6-алкила,C1-6-алкокси, C1-6-алкокси-C1-6-алкила, C1-6-алкилкарбонила, амино, моно- или ди-C1-6-алкил амино,азидо, меркапто, полигалоген-C1-6-алкила, полигалоген-C1-6-алкокси, циклопропила, пирролидинила, пиперидинила, пиперазинила, 4-C1-6-алкилпиперазинила, 4-C1-6-алкилкарбонилпиперазинила и морфолинила; и каждый Het, как группа или часть группы, представляет собой 5- или 6-членное насыщенное, частично ненасыщенное или полностью ненасыщенное гетероциклическое кольцо, содержащее 1-4 гетероатома, каждый из которых независимо выбран из атомов азота, кислорода и серы, и необязательно замещенное 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, гидрокси, нитро, циано, карбоксила, C1-6-алкила, С 1-6-алкокси, C1-6-алкокси-C1-6-алкила,C1-6-алкилкарбонила, амино, моно- или ди-C1-6-алкиламино, азидо, меркапто, полигалоген-C1-6-алкила,полигалоген-C1-6-алкокси,циклопропила,пирролидинила,пиперидинила,пиперазинила,4-C1-6-алкилпиперазинила, 4-C1-6-алкилкарбонилпиперазинила и морфолинила. Должно быть очевидно, что в альтернативном варианте осуществления изобретения в непосредственно вышеприведенном абзаце Rt1 в широком смысле соответствует A; Rt2 в широком смысле соответствует Rq; Rt3 в широком смысле соответствует R5; X в широком смысле соответствует L; арил в широком смысле включает C0-C3-алкиленкарбоциклил, где C0-C3-алкилен отсутствует (т.е. является связью); иHet в широком смысле включает C0-C3-алкиленгетероциклил, где C0-C3-алкилен отсутствует (т.е. является связью). Предпочтения, указанные ниже для формулы (I), применяют даже для соответствующих значений в формуле (It) и ссылки на формулу (I) должны истолковываться как включающие соответствующие соединения формулы (It).-3 014188 Применяемые в описании выше и ниже по тексту термины имеют нижеследующие определения,если не оговорено особо. Термин "галоген" является родовым для фтора, хлора, брома и йода. Термин "галоген-C1-6-алкил", как группа или часть группы, например галоген-C1-6-алкокси, определяется как моно- или полигалогензамещенный C1-6-алкил, в частности C1-6-алкил, замещенный 1, 2, 3, 4,5, 6 или большим числом атомов галогена, такой как метил или этил с одним или большим числом атомов фтора, например дифторметил, трифторметил, трифторэтил. Предпочтительным является трифторметил. Включены также перфтор-C1-6-алкильные группы, которые являются C1-6-алкильными группами,у которых все атомы водорода заменены атомами фтора, например пентафторэтил. В случае, когда более чем один атом галогена присоединен к алкильной группе в определении полигалоген-C1-6-алкил, атомы галогена могут быть одинаковыми или разными. Применяемый здесь термин "С 1-4-алкил", как группа или часть группы, означает насыщенные углеводородные радикалы с неразветвленной или разветвленной цепью, имеющие 1-4 атома углерода, такие как, например, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил; C1-6-алкил включает С 1-4-алкильные радикалы и более высокие его гомологи, имеющие 5 или 6 атомов углерода, такие как,например, 1-пентил, 2-пентил, 3-пентил, 1-гексил, 2-гексил, 2-метил-1-бутил, 2-метил-1-пентил, 2-этил-1 бутил, 3-метил-2-пентил и т.п. Интересным среди C1-6-алкилов является С 1-4-алкил. Термин "С 2-6-алкенил", в качестве группы или части группы, означает углеводородные радикалы с неразветвленной или разветвленной цепью, имеющие насыщенные углерод-углеродные связи и по меньшей мере одну двойную связь и имеющие 2-6 атомов углерода, такие как, например, этенил (или винил),1-пропенил, 2-пропенил (или аллил), 1-бутенил, 2-бутенил, 3-бутенил, 2-метил-2-пропенил, 2-пентенил,3-пентенил, 2-гексенил, 3-гексенил, 4-гексенил, 2-метил-2-бутенил, 2-метил-2-пентенил и т.п. Интересным среди С 2-6-алкенилов является С 2-4-алкенил. Термин "С 2-6-алкинил", в качестве группы или части группы, означает углеводородные радикалы с неразветвленной или разветвленной цепью, имеющие насыщенные углерод-углеродные связи и по меньшей мере одну тройную связь и имеющие 2-6 атомов углерода, такие как, например, этинил, 1-пропинил,2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 2-пентинил, 3-пентинил, 2-гексинил, 3-гексинил и т.п. Интересным среди С 2-6-алкинилов является С 2-4-алкинил."С 3-7-Циклоалкил" является родовым термином для циклопропила, циклобутила, циклопентила,циклогексила и циклогептила."С 0-3-Алкилен" означает связь (С 0) или двухвалентные насыщенные углеводородные радикалы с неразветвленной или разветвленной цепью, имеющие 1-3 атома углерода, такие как, например, метилен,этилен, 1,3-пропандиил, 1,2-пропандиил и т.п., особенно метилен."C1-6-Алкокси" означает С 1-6-алкилокси, у которого C1-6-алкил имеет значения, указанные выше. Применяемый здесь выше термин "(=O)" или "оксо" образует карбонильную часть, которая присоединена к атому углерода, сульфоксидную часть, которая присоединена к атому серы, и сульфонильную часть, когда два из указанных терминов присоединены к атому серы. Всякий раз, когда кольцо или система колец замещена оксогруппой, атом углерода, с которым связана оксо, является насыщенным атомом углерода. Термин "амино", если в контексте не подразумевается другое, включает NH2, NH-C1-C6-алкил или N(C1-C6-алкил)2, где в определениях амино каждый С 1-6-алкил представляет собой особенноC1-C3-алкильные варианты, или насыщенные циклические амины, такие как пирролидинил, пиперидинил, пиперазинил, 4-C1-C6-алкилпиперазинил, такой как 4-метилпиперазинил, 4-C1-C6-алкилкарбонилпиперазинил и морфолинил. Термин "амидо" включает С(=O)NH2 и алкиламидо, такой как С(=O)NHC1-C6-алкил, С(=O)N(C1-C6 алкил)2, особенно C(=O)NH-C1-C3-алкил, С(=O)N(C1-C3-алкил)2 или -NH(С=O)C1-C6-алкил, например-NHC(=O)СНС(СН 3)3, включая -NH(С=O)C1-C3-алкил. Имеется в виду, что термин "C0-C3-алкиленарил", применяемый здесь, включает арильную часть,такую как фенил, нафтил или фенил, конденсированную с C3-C7-циклоалкилом (например, инданил), где арил связан непосредственно (т.е. С 0) или через промежуточную метильную, этильную или пропильную группу, как указано выше для C1-C3-алкилена. Если не оговорено особо, арил и/или его конденсированная с циклоалкилом часть необязательно замещена 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси, C1-C6-алкила, C1-C6-алкокси, C1-C6-алкокси-C1-C6-алкила, C1-C6-алканоила,амино, азидо, оксо, меркапто, нитро, C0-C3-алкиленкарбоциклила, C0-C3-алкиленгетероциклила,причем понятно, что гетероциклическая и карбоциклическая части в C0-C3-алкиленкарбоциклильном илиC0-C3-алкиленгетероциклильном заместителе могут быть сами замещены, как указано здесь, но обычно не дополнительным C0-C3-алкиленкарбоциклилом или C0-C3-алкиленгетероциклилом. "Арил" имеет соответствующее значение, т.е. когда C0-C3-алкильная связь отсутствует. Имеется в виду, что термин "C0-C3-алкилен-C3-C7-циклоалкил", применяемый здесь, включаетC3-C7-циклоалкильную группу, такую как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил, который связан непосредственно (т.е. С 0-алкил) или через промежуточную метильную,этильную, пропильную или изопропильную группу, как указано выше для C1-C3-алкилена. Циклоалкиль-4 014188 ная группа может содержать ненасыщенную связь. Если не оговорено особо, циклоалкильная часть необязательно замещена 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси,C1-C6-алкила, C1-C6-алкокси, C1-C6-алкокси-C1-C6-алкила, C1-C6-алканоила, амино, азидо, оксо, меркапто,нитро, C0-C3-алкилкарбоциклила, C0-C3-алкилгетероциклила, причем понятно, что гетероциклическая и карбоциклическая части в C0-C3-алкиленкарбоциклильном или C0-C3-алкиленгетероциклильном заместителе могут быть сами замещены, как указано здесь, но обычно не дополнительнымC0-C3-алкиларил и C0-C3-алкил-C3-C7-циклоалкил. Если не оговорено особо, указанная арильная или циклоалкильная группа необязательно замещена 1-3 заместителями, выбранными из галогена, гидрокси,нитро, циано, карбокси, C1-C6-алкила, C1-C6-алкокси, C1-C6-алкокси-C1-C6-алкила, C1-C6-алканоила, амино, азидо, оксо, меркапто, нитро, C0-C3-алкилкарбоциклила и/или C0-C3-алкилгетероциклила,причем понятно, что гетероциклическая и карбоциклическая части в C0-C3-алкиленкарбоциклильном илиC0-C3-алкиленгетероциклильном заместителе могут быть сами замещены, как указано здесь, но обычно не дополнительным C0-C3-алкиленкарбоциклилом или C0-C3-алкиленгетероциклилом. "Карбоциклил" имеет соответствующее значение, т.е. когда C0-C3-алкильная связь отсутствует. Имеется в виду, что термин "C0-C3-алкиленгетероциклил", применяемый здесь, включает моноциклическое, насыщенное или ненасыщенное, содержащее гетероатом кольцо, такое как пиперидинил, морфолинил, пиперазинил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазинолил, изотиазинолил,тиазолил, оксадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, фуранил, тиенил, пиридил, пиримидил, пиридазинил, или любая из таких групп, конденсированная с фенильным кольцом, такая как хинолинил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазинолил, бензизотиазинолил, бензотиазолил, бензоксадиазолил, бензо-1,2,3-триазолил, бензо-1,2,4-триазолил, бензотетразолил, бензофуранил, бензотиенил, бензопиридил, бензопиримидил, бензопиридазинил, бензопиразолил и т.д., это кольцо связано непосредственно, т.е. (С 0), или через промежуточную метильную, этильную, пропильную или изопропильную группу, как указано выше для C1-C3-алкилена. Любые такие ненасыщенные кольца,имеющие ароматический характер, могут здесь называться гетероарилом. Если не оговорено особо, указанное гетерокольцо и/или его конденсированная фенильная часть необязательно замещено 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси, C1-C6-алкила, C1-C6-алкокси,C1-C6-алкокси-C1-C6-алкила, C1-C6-алканоила, амино, азидо, оксо, меркапто, нитро, C0-C3-алкилкарбоциклила, C0-C3-алкилгетероциклила. "Гетероциклил" и "гетероарил" имеют соответствующее значение,т.е. когда C0-C3-алкильная связь отсутствует. Обычно гетероциклильная и карбоциклильная части в объеме указанных выше определений являются, таким образом, моноциклическим кольцом с 5 или особенно 6 атомами кольца, или бициклической структурой колец, включающей 6-членное кольцо, конденсированное с 4-, 5- или 6-членным кольцом. Типичные подобные группы включают C3-C8-циклоалкил, фенил, бензил, тетрагидронафтил, инденил, инданил, гетероциклил, такой как азепанил, азоканил, пирролидинил, пиперидинил, морфолинил,тиоморфолинил, пиперазинил, индолинил, пиранил, тетрагидропиранил, тетрагидротиопиранил, тиопиранил, фуранил, тетрагидрофуранил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, имидазолил,пиридинил, пиримидинил, пиразинил, пиридазинил, тетразолил, пиразолил, индолил, бензофуранил, бензотиенил, бензимидазолил, бензтиазолил, бензоксазолил, бензизоксазолил, хинолинил, тетрагидрохинолинил, изохинолинил, тетрагидроизохинолинил, хиназолинил, тетрагидрохиназолинил и хиноксалинил,любой из которых может быть необязательно замещен, как здесь указано. Насыщенная гетероциклильная часть, таким образом, включает такие радикалы, как пирролинил,пирролидинил, пиразолинил, пиразолидинил, пиперидинил, морфолинил, тиоморфолинил, пиранил, тиопиранил, пиперазинил, индолинил, азетидинил, тетрагидропиранил, тетрагидротиопиранил, тетрагидрофуранил, гексагидропиримидинил, гексагидропиридазинил, 1,4,5,6-тетрагидропиримидиниламин,дигидрооксазолил, 1,2-тиазинанил-1,1-диоксид, 1,2,6-тиадиазинанил-1,1-диоксид, изотиазолидинил-1,1 диоксид и имидазолидинил-2,4-дион, тогда как ненасыщенный гетероцикл включает радикалы ароматической природы, такие как фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил,изоксазолил, изотиазолил, оксадиазолил, триазолил, тетразолил, тиадиазолил, пиридинил, пиридазинил,пиримидинил, пиразинил, индолизинил, индолил, изоиндолил. В каждом случае гетероцикл может быть конденсирован с фенильным кольцом с образованием бициклической системы колец. Радикал Het представляет собой гетероцикл, как указывается в данном описании и формуле изобретения. Примеры Het включают, например, пирролидинил, пиперидинил, морфолинил, тиоморфолинил,пиперазинил, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазинолил, изотиазинолил,тиазолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил (включая 1,2,3-триазолил, 1,2,4 триазолил), тетразолил, фуранил, тиенил, пиридил, пиримидил, пиридазинил, пиразолил, триазинил и т.п. Интересными среди радикалов Het являются радикалы, которые являются ненасыщенными, в особенности радикалы, имеющие ароматическую природу. Кроме того, интересными являются радикалыHet, имеющие один или два атома азота.-5 014188 Каждый из радикалов Het, указанных выше, может быть необязательно замещен заместителями такого типа и в таком количестве, как указано в определениях соединений формулы (I), (It) или любой из подгрупп соединений формулы (I). Некоторые из радикалов Het, указанных в этом и следующем абзаце,могут быть замещены 1, 2 или 3 гидроксизаместителями. Такие гидроксизамещенные кольца могут быть в виде их таутомерных форм, имеющих кетогруппы. Например, 3-гидроксипиридизиновая часть может быть в ее таутомерной форме 2 Н-пиридазин-3-она. Следует отметить, что расположение радикалов в любой части молекулы, указанной в определениях, может быть в любом месте, если эта часть является химически стабильной. Радикалы, применяемые в определениях символов, включают все возможные изомеры, если не оговорено особо. Например, пиридил включает 2-пиридил, 3-пиридил и 4-пиридил; пентил включает 1-пентил, 2-пентил и 3-пентил. Когда любой символ встречается более чем один раз в любой составной части, каждое определение является независимым. Имеется в виду, что всякий раз применяемый в дальнейшем термин "соединения формулы (I)" или"настоящие соединения" или аналогичные термины включают соединения формулы (I), их пролекарства,N-оксиды, аддитивные соли, четвертичные амины, комплексы металлов и стереохимически изомерные формы. Один вариант осуществления включает соединения формулы (I) или любую подгруппу соединений формулы (I), указанных здесь, а также их N-оксиды, соли, так же как возможные стереоизомерные формы. Другой вариант осуществления включает соединения формулы (I) или любую подгруппу соединений формулы (I), указанных здесь, а также их соли, так же как возможные стереоизомерные формы. Соединения формулы (I) имеют несколько хиральных центров и существуют в виде стереохимически изомерных форм. Термин "стереохимически изомерные формы", применяемый здесь, означает все возможные соединения, построенные из таких же атомов, связанных такой же последовательностью связей, но имеющих разные трехмерные структуры, которые не являются взаимозаменяемыми и в которых могут находиться соединения формулы (I). Что касается случаев, в которых (R) или (S) применяют для обозначения абсолютной конфигурации хирального атома в заместителе, вводят обозначение, принимая во внимание все соединение, а не отдельный заместитель. Если не указано или не обозначено особо, химическое обозначение соединения включает смесь всех возможных стереохимически изомерных форм, которые может иметь указанное соединение. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Предполагается, что все стереохимически изомерные формы соединений настоящего изобретения как в чистой форме, так и в форме смеси друг с другом включены в объем настоящего изобретения. Чистые стереоизомерные формы соединений и промежуточных соединений, как указано здесь, определяют как изомеры, по существу, не содержащие другие энантиомерные или диастереомерные формы одной и той же основной молекулярной структуры указанных соединений или промежуточных соединений. В частности, термин "стереоизомерно чистый" относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток по меньшей мере 80% (т.е. минимум 90% одного изомера и максимум 10% другого возможного изомера) и вплоть до стереоизомерного избытка 100% (т.е. 100% одного изомера и отсутствие другого), более определенно соединения или промежуточные соединения, имеющие стереоизомерные избыток от 90 до 100%, даже более определенно имеющие стереоизомерный избыток от 94 до 100% и наиболее определенно имеющие стереоизомерный избыток от 97 до 100%. Термины "энантиомерно чистый" и "диастереоизомерно чистый" следует понимать аналогичным образом, но к тому же как имеющие отношение к энантиомерному избытку и диастереомерному избытку соответственно рассматриваемой смеси. Чистые стереоизомерные формы соединений и промежуточных соединений данного изобретения можно получить с помощью известных в данной области методик. Например, энантиомеры можно отделить друг от друга селективной кристаллизацией их диастереоизомерных солей с оптически активными кислотами или основаниями. Примерами их являются винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота и камфорсульфоновая кислота. В альтернативном случае энантиомеры можно разделить хроматографическими методиками с применением хиральных неподвижных фаз. Указанные чистые стереохимически изомерные формы можно также получить из соответствующих чистых стереохимически изомерных форм подходящих исходных веществ при условии, что реакция протекает стереоспецифически. Если требуется определенный стереоизомер, указанное соединение предпочтительно будет синтезировано стереоспецифическими методами получения. Эти методы будут преимущественно применять энантиомерно чистые исходные вещества. Диастереомерные рацематы соединений формулы (I) можно разделять общепринятыми методами. Подходящими методами физического разделения, которые можно преимущественно применять, являются, например, селективная кристаллизация и хроматография, например колоночная хроматография.-6 014188 Для некоторых соединений формулы (I), их пролекарств, N-оксидов, солей, сольватов, четвертичных аминов или комплексов металлов и промежуточных соединений, применяемых при их получении,абсолютную стереохимическую конфигурацию экспериментально не определяли. Специалист в данной области способен определить абсолютную конфигурацию таких соединений с применением методов,известных в данной области, таких как, например, дифракция рентгеновских лучей. Предполагается, что настоящее изобретение включает также все изотопы атомов, присутствующих в настоящих соединениях. Изотопы включают атомы, имеющие одинаковый атомный номер, но разные массовые числа. В качестве общего примера и без ограничения, изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14. Термин "пролекарство", применяемый на протяжении всего данного текста, означает фармакологически приемлемые производные, такие как сложные эфиры, амиды и фосфаты, так что образовавшийсяin vivo продукт биотрансформации производного является активным лекарственным средством, определяемым в соединениях формулы (I). Публикация Goodman and Gilman (The Pharmacological Basis ofTherapeutics, 8th ed, McGraw-Hill, Int. Ed. 1992, Biotransformation of Drugs, p. 13-15), описывающая в общем пролекарства, таким образом, включена сюда в виде ссылки. Пролекарства предпочтительно обладают превосходной растворимостью в воде, повышенной биологической доступностью и легко метаболизируются в активные ингибиторы in vivo. Пролекарства соединения настоящего изобретения можно получить модификацией функциональных групп, присутствующих в соединении, таким путем, чтобы модификации расщеплялись либо обычной манипуляцией, либо in vivo с образованием исходного соединения. Предпочтительными являются пролекарства в виде фармацевтически приемлемых сложных эфиров, которые способны гидролизоваться in vivo и которые получают из соединений формулы (I), имеющих гидроксильные или карбоксильные группы. Гидролизуемым in vivo сложным эфиром является сложный эфир, который гидролизуется в теле человека или животного с образованием исходной кислоты или спирта. Подходящие фармацевтически приемлемые сложные эфиры карбоксигруппы включают C1-6-алкоксиметиловые сложные эфиры, например метоксиметиловый эфир, C1-6-алканоилоксиметиловые сложные эфиры, например пивалоилоксиметиловый, фталидиловые сложные эфиры, С 3-8-циклоалкоксикарбонилоксиС 1-6-алкиловые сложные эфиры, например 1-циклогексилкарбонилоксиэтиловый эфир; 1,3-диоксолен-2-онилметиловые сложные эфиры, например 5-метил-1,3-диоксолен-2-онилметиловый эфир; и C1-6-алкоксикарбонилоксиэтиловые сложные эфиры,например 1-метоксикарбонилоксиэтиловый эфир, который может быть образован у любой карбоксигруппы в соединениях данного изобретения. Гидролизуемый in vivo сложный эфир соединения формулы (I), содержащего гидроксигруппу,включает неорганические сложные эфиры, такие как фосфатные эфиры и -ацилоксиалкиловые простые эфиры, и родственные соединения, которые в результате гидролиза in vivo сложного эфира распадаются с образованием исходной гидроксигруппы. Примеры-ацилоксиалкиловых простых эфиров включают ацетоксиметоксии 2,2-диметилпропионилоксиметоксисоединения. Группы, образующие гидролизуемые in vivo сложные эфиры для гидрокси, включают алканоил, бензоил, фенилацетил и замещенный бензоил и фенилацетил,алкоксикарбонил (образует алкилкарбонатные эфиры), диалкилкарбамоил и N-(диалкиламиноэтил)-Nалкилкарбамоил (образуют карбаматы), диалкиламиноацетил и карбоксиацетил. Примеры заместителей бензоила включают морфолино и пиперазино, где атом азота кольца связан через метиленовую группу с 3- или 4-положением кольца бензоила. Для терапевтического применения солями соединений формулы (I) являются соли, у которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, могут также найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, независимо от того, являются ли они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения. Имеется в виду, что фармацевтически приемлемые кислотно- и основно-аддитивные соли, указываемые выше, включают формы терапевтически активных нетоксичных кислотно- и основноаддитивных солей, которые способны образовывать соединения формулы (I). Фармацевтически приемлемые кислотно-аддитивные соли можно подходящим образом получать обработкой формы основания такой подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например хлористо-водородную или бромисто-водородную кислоту,серную, азотную, фосфорную и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная (т.е. гидроксибутандиовая кислота), винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памоевая и подобные кислоты.-7 014188 И наоборот, указанные формы солей можно превратить обработкой подходящим основанием в форму свободного основания. Соединения формулы (I), содержащие кислотную группу, можно также превратить в их нетоксичные формы солей металлов или формы аддитивных солей аминов обработкой подходящими органическими и неорганическими основаниями. Подходящие формы солей с основаниями включают, например,аммониевые соли, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия,магния, кальция и т.п., соли с органическими основаниями, например соли бензатина, N-метил-Dглюкамина, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Термин "аддитивная соль", применяемый выше, включает также сольваты, которые способны образовывать соединения формулы (I), а также их соли. Такими сольватами являются, например, гидраты,алкоголяты и т.п. Термин "четвертичный амин", применяемый здесь ранее, означает четвертичные аммониевые соли,которые соединения формулы (I) способны образовывать реакцией между основным атомом азота соединения формулы (I) и подходящим кватернизирующим агентом, таким как, например, необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, например метилйодид или бензилйодид. Можно также применять другие реагенты с легко уходящими группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин имеет положительно заряженный атом азота. Фармацевтически приемлемые противоионы включают хлор, бром, йод, трифторацетат и ацетат. Выбранный противоион можно ввести с применением ионообменных смол. Имеется в виду, что N-оксидные формы настоящих соединений включают соединения формулы (I),у которых один или несколько атомов азота окислены в так называемый N-оксид. Должно быть понятно, что соединения формулы (I) обладают свойствами связывания, хелатирования, образования комплекса металла и поэтому могут существовать в виде комплексов металлов или хелатов металлов. Предполагается, что такие металлированные производные соединений формулы (I) включены в объем настоящего изобретения. Некоторые из соединений формулы (I) могут существовать также в их таутомерной форме. Такие формы, хотя и не указаны непосредственно в указанной выше формуле, предполагается, что они включены в объем настоящего изобретения. Как указано выше, соединения формулы (I) имеют несколько асимметричных центров. Чтобы более рационально указать каждый из этих асимметричных центров, можно применять систему нумерации, как указано на следующей структурной формуле: Асимметричные центры присутствуют в положениях 1, 4 и 6 макроцикла, а также у атома углерода 3' в 5-членном кольце, у атома углерода 2', когда заместитель Rq представляет собой C1-6-алкил, и у атома углерода 1', когда L представляет собой СН. Каждый из этих асимметричных центров может быть в его R- или S-конфигурации. Стереохимия в положении 1 предпочтительно соответствует стереохимии конфигурацииL-аминокислоты, т.е. стереохимии L-пролина. Когда L представляет собой СН, 2 карбонила, присутствующие у кольца циклопентана, предпочтительно находятся в трансположении относительно друг друга, как показано ниже.-8 014188 Структура формулы (I) включает циклопропильную группу, как представлено ниже на фрагменте Р 1 где C7 представляет собой атом углерода в положении 7 и атомы углерода в положениях 4 и 6 являются асимметричными атомами углерода кольца циклопропана. Несмотря на другие возможные асимметричные центры у других сегментов соединений изобретения, присутствие этих двух асимметричных центров означает, что соединения могут существовать в виде смеси диастереомеров, таких как диастереомеры соединений формулы (I), где атом углерода в положении 7 имеет либо син-конфигурацию к карбонилу, либо син-конфигурацию к амиду, как показано ниже син-конфигурация C7 к амиду син-конфигурация C7 к карбонилу Структура формулы (I) может включать также остаток пролина (когда L представляет собой N). Предпочтительными являются соединения формулы (I), где заместитель в положении 1 (или 5') и заместитель -O-Rr (в положении 3') находятся в трансконфигурации. Особенно интересными являются соединения формулы (I), где положение 1 имеет конфигурацию, соответствующую конфигурации L-пролина,и заместитель -O-Rr находится в трансконфигурации относительно положения 1. Соединения формулы(I) предпочтительно имеют стереохимию, показанную ниже на структурах формул (I-а) и (I-b): Один вариант осуществления настоящего изобретения относится к соединениям формулы (I) или формулы (I-а), или любой подгруппе соединений формулы (I), где соблюдается одно или несколько из следующих условий:(b) L представляет собой атом азота;(c) двойная связь присутствует между атомами углерода 7 и 8. Один вариант осуществления настоящего изобретения относится к соединениям формулы (I) или формулы (I-а), (I-b) или любой подгруппе соединений формулы (I), где соблюдается одно или несколько из следующих условий:(c) двойная связь присутствует между атомами углерода 7 и 8. Один вариант осуществления настоящего изобретения включает соединения, включающие следующий структурный фрагмент:-9 014188 Конкретными подгруппами соединений формулы (I) являются соединения, представленные следующими структурными формулами: Среди соединений формул (I-c) и (I-d) соединения, имеющие стереохимическую конфигурацию соединений формул (I-а) и (I-b) соответственно, являются особенно интересными. Двойная связь между атомами углерода 7 и 8 в соединениях формулы (I) или в любой подгруппе соединений формулы (I) может иметь цис- или трансконфигурацию. Двойная связь между атомами углерода 7 и 8 предпочтительно имеет цис-конфигурацию, как показано на формулах (I-c) и (I-d). Двойная связь между атомами углерода 7 и 8 в соединениях формулы (I) или в любой подгруппе соединений формулы (I) может иметь цис- или трансконфигурацию. Двойная связь между атомами углерода 7 и 8 предпочтительно имеет цис-конфигурацию, как показано на формулах (I-c) и (I-d). В формулах (I-а)-(I-d), где в подходящих случаях A, L, n, Rr, Rq, R5 имеют значения, указанные для соединений формулы (I) или любой из указанных здесь подгрупп соединений формулы (I). Должно быть понятно, что указанные выше подгруппы соединений формул (I-a)-(I-d), а также любой другой указанной здесь подгруппы включают также любые пролекарства, N-оксиды, аддитивные соли, четвертичные амины, комплексы металлов и стереохимически изомерные формы таких соединений. Когда n=2, часть -СН 2-, заключенная в скобки со знаком n, соответствует этандиилу в соединениях формулы (I) или в любой подгруппе соединений формулы (I). Когда n=3, часть -СН 2-, заключенная в скобки со знаком n, соответствует пропандиилу в соединениях формулы (I) или в любой подгруппе соединений формулы (I). Когда n=4, часть -СН 2-, заключенная в скобки со знаком n, соответствует бутандиилу в соединениях формулы (I) или в любой подгруппе соединений формулы (I). Когда n=5, часть -СН 2-, заключенная в скобки со знаком n, соответствует пентандиилу в соединениях формулы (I) или в любой подгруппе соединений формулы (I). Когда n=6, часть -СН 2-, заключенная в скобки со знаком n, соответствует гександиилу в соединениях формулы (I) или в любой подгруппе соединений формулы (I). Особыми подгруппами соединений формулы (I) являются те соединения, у которых n=4 или 5. Вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где:(a) А представляет собой -OR1, в особенности когда R1 представляет собой С 1-6-алкил, такой как метил, этил или трет-бутил и наиболее предпочтительно когда R1 представляет собой водород; илиC1-C6-алкилом или арилом, например когда R2 представляет собой метил, циклопропил или фенил. Например, R2 может быть 1-метилциклопропилом. Следующими вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где:(a) Rq представляет собой водород, L представляет собой СН или N;(b) Rq представляет собой метил, L представляет собой С и пунктирная линия представляет собой двойную связь. Следующими вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где(c) R5 представляет собой C1-C6-алкокси-C1-C6-алкил или С 3-7-циклоалкил. Предпочтительными вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где R5 представляет собой водород или C1-C6-алкил,более предпочтительно водород или метил.- 10014188 Вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), у которых Rr представляет собой хиназолин-4-ил. Обычно Rr представляет собой хиназолин-4-ил, необязательно моно-, ди- или тризамещенный, например, C1-C6-алкилом, C1-C6 алкокси, гидрокси, галогеном, трифторметилом, моно- или ди-C1-C6-алкиламино, моно- или ди-C1-C6 алкиламинокарбонилом, арилом, гетероарилом или гетероциклилом, где арил, гетероарил или гетероциклил, каждый независимо необязательно замещен галогеном, C1-C6-алкилом, C1-C6-алкокси, полигалоген-C1-C6-алкокси, амино, моно- или ди-C1-C6-алкиламино, циклопропилом, пирролидинилом, пиперидинилом, пиперазинилом, N-метилпиперазинилом или морфолинилом. Хиназолиновые варианты осуществления Rr включают радикал (f-1) где R9, R6 и R11 имеют значения, указанные для заместителей Rr или Rt4, где особенноR9 представляет собой C3-C7-циклоалкил, арил или Het, любой из которых необязательно замещен 1, 2 или 3 (в особенности одним) R10; где R10 представляет собой водород, C1-C6-алкил, C3-C7 циклоалкил, арил, Het (предпочтительно моно- или дизамещенный C1-C6-алкилом), пирролидинил, пиперидинил, пиперазинил, 4-метилпилеразинил, тиоморфолинил или морфолинил, аминокарбонил, моноили ди-C1-C6-алкиламинокарбонил; где пиперидинил, морфолинил или тиоморфолинил может быть необязательно замещен одним или двумя C1-C6-алкильными радикалами, или R9 представляет собой C1-C6 алкокси;R11 представляет собой водород или C1-C6-алкокси. Предпочтительные варианты осуществления R9 для хиназолинов включают арил или Het, особенно когда R9 представляет собой фенил, пиридил, тиазолил, оксазолил или пиразолил, любой из которых необязательно замещен 1, 2 или 3 (особенно одним) указываемыми R10. В следующем альтернативном варианте осуществления R9 представляет собой алкокси, особенно этокси и изопропокси. Варианты осуществления R10 для хиназолинов включают водород, метил, этил, изопропил,трет-бутил, алкокси, такой как метокси, галоген (включая дигалоген, такой как дифтор), пирролидинил,пиперидинил, пиперазинил, 4-C1-C6-алкилпиперазинил (например, 4-метилпиперазинил), тиоморфолинил или морфолинил, C1-C6-алкиламино, (C1-C6-алкил)2 амино, аминокарбонил, моно- или ди-C1-C6-алкиламинокарбонил или C3-C7-циклоалкил (особенно циклопропил). Предпочтительные варианты осуществления R9 для хиназолинов включают фенил, замещенный одной или двумя группами R10, такими как водород, метил, этил, изопропил, трет-бутил, алкокси,такой как метокси, насыщенный моноциклический амино, C1-C6-алкиламино, (C1-C6-алкил)2 амино илиC1-C6-алкиламидо или галоген (в частности, фтор), особенно когда R6 представляет собой водород, метил или бром. Предпочтительно заместитель фенила находится в пара-положении. Особенно предпочтительными структурами для R3 согласно данному варианту осуществления являются фенил, п-метоксифенил и п-фторфенил. Дополнительные конфигурации для R9 в хиназолильном радикале, указанном для (f-1) или (f-1-a),включают любой из радикалов где R10 имеет указанные выше значения или, в частности, представляет собой водород, C1-C6-алкилR9 для хиназолинов может включать где R10 представляет собой C1-C6-алкил (такой как метил, этил, изопропил, трет-бутил),C1-C6-алкиламино, (C1-C6-алкил)2 амино, С 1-С 6 алкиламидо, морфолинил, тиоморфолинил или пиперидин 1-ил, причем морфолин или пиперидин необязательно замещен одним или двумя C1-C6-алкильными группами. Варианты осуществления R6 для хиназолинов включают C1-C6-алкил, в частности метил, галоген(например, бром, хлор, фтор), особенно бром. Варианты осуществления R11 для хиназолинов включают водород, C1-C6-алкилокси (в частности,метокси). Определенными вариантами осуществления соединений формулы (I) или любых других из подгрупп соединений формулы (I) являются соединения, где Rr представляет собой где R10, R10' и R11 имеют значения, указанные выше, в частности R11 представляет собой водород или C1-C6-алкокси (например, метокси) и R10 и R10' представляют собой водород, метокси или галоген,такой как фтор или дифтор. Подходящими являются соединения, где R10 или R10', в случае когда они не являются водородом, находятся в пара-положении кольца фенила. Следующими предпочтительными структурами являются соединения формулы (I) или любой другой из подгрупп соединений формулы (I), где Rr представляет собой где R10, R10' и R11 имеют значения, указанные выше, в частности R11 представляет собой водород или C1-C6-алкокси (например, метокси) и R10 и R10' представляют собой водород, метокси или галоген,такой как фтор или дифтор. Подходящими являются соединения, когда R10 или R10' находятся в параположении кольца фенила. Особенно предпочтительными соединениями данного варианта осуществления являются соединения, где Rr соответствует формуле (f-4), (f-5) или (f-6) Соединения изобретения получают так, как в общем описано ниже и подробно описано в экспериментальной части. Подходящим промежуточным соединением для соединений формулы (I), где Rr представляет собой 8-метилзамещенное хиназолинилпроизводное, является тризамещенный анилин формулы (II) причем указанное производное анилина является следующим аспектом настоящего изобретения.- 12014188 Следующими промежуточными соединениями, пригодными для получения соединений формулы(I), являются хиназолинилпроизводные, имеющие общую формулу (III) где X представляет собой ОН или уходящую группу, такую как галогенид, подобный хлориду, бромиду или йодиду,или производное сульфоновой кислоты, такое как тозилат, трифлат, мезилат или т.п. Предпочтительно X представляет собой ОН, R6, R9 и R11 имеют значения, указанные выше для соединений формул (f-1) и (f-1-a). Соединения (III) и (IIIa) являются новыми соединениями и образуют следующий аспект настоящего изобретения. Различные варианты осуществления, описанные выше для хиназолинильной части, применяют также для соединений формул (III) и (IIIa). Предпочтительные варианты осуществления R9 для соединений формул (III) и (IIIa) включают пиридил и фенил, необязательно замещенные одним или двумя группами R10, такими как водород,метил, этил, изопропил, трет-бутил, насыщенный моноциклический амино, C1-C6-алкиламино,(C1-C6-алкил)2 амино или C3-C6-алкиламидо или галоген (в частности, фтор), особенно, когда R6 представляет собой водород, метил или бром. Заместитель предпочтительно находится в пара-положении фенильного кольца. Предпочтительным значением для R9 является парафторфенил. Определенными вариантами осуществления соединений формулы (III) являются соединения,имеющие структуру, указанную в формулах (III-2) и (III-3): где X, R10, R10' и R11 имеют значения, указанные выше, в частности R11 представляет собой водород или C1-C6-алкокси (например, метокси) и R10 или R10' представляют собой водород, метокси или галоген,такой как фтор или дифтор. В подходящем случае R10 или R10' находятся в пара-положении фенильного кольца. Следующими предпочтительными структурами для соединений формулы (III) являются структуры согласно формулам (III-2-Me) и (III-3-Me): где X, R10, R10' и R11 имеют значения, указанные выше, в частности R11 представляет собой водород или C1-C6-алкокси (например, метокси) и R10 или R10' представляют собой водород, метокси или галоген,такой как фтор или дифтор. В подходящем случае R10 или R10' находятся в пара-положении фенильного кольца.- 13014188 Особенно предпочтительными соединениями формулы (III) являются соединения, имеющие формулу (III-4) или (III-5): где X имеет значения, описанные выше. Вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где Rr представляет собой хиназолин-4-ил, необязательно моно-, ди- или тризамещенный метилом, этилом, изопропилом, трет-бутилом (или т-бутилом), метокси, трифторметилом,трифторметокси, фтором, хлором, бромом, моно- или ди-C1-C6-алкиламино, моно- или ди-C1-C6 алкиламинокарбонилом, фенилом, метоксифенилом, цианофенилом, галогенфенилом, лиридилом, C1-C4 алкиллиридилом, пиримидинилом, морфолинилом, пиперазинилом, C1-C4-алкилпиперазинилом, пирролидинилом, пиразолилом, C1-C4-алкилпиразолилом, тиазолилом, C1-C4-алкилтиазолилом, циклопропилтиазолилом или моно- или ди C1-C4-алкиламинотиазолилом. Вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где Rr представляет собой где R9 представляет собой водород, галоген, C1-C6-алкил, C1-C6-алкокси, моно- или ди-C1-C6 алкиламино, амино, арил, гетероарил или гетероциклил, причем каждый указанный арил или гетероарил или гетероциклил независимо необязательно замещен одним или двумя C1-C6-алкилами, C1-C6-алкокси,полигалоген-C1-C6-алкокси, атомами галогена, амино, моно- или ди-С 1-С 6-алкиламино; и каждый из R6 и R11' независимо представляет собой водород, C1-C6-алкил, C1-C6-алкокси, моно- или ди-C1-C6-алкиламино, моно- или ди-C1-C6-алкиламинокарбонил, гидрокси, галоген, трифторметил, арил,гетероарил или гетероциклил; причем каждый указанный арил, гетероарил или гетероциклил независимо необязательно замещен C1-C6-алкилом, C1-C6-алкокси, полигалоген-C1-C6-алкокси, амино, насыщенным циклическим амино, моно- или ди-C1-C6-алкиламино. Вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где R9 выбран из группы, состоящей из где R10, каждый независимо, представляет собой водород, галоген, C1-C6-алкил, амино, насыщенный циклический амино или моно- или ди C1-C6-алкиламино. Вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где Rr представляет собой где R6 и R11 независимо представляют собой водород, C1-C6-алкил, C1-C6-алкокси, моно- или ди-C1-C6-алкиламино, моно- или ди-C1-C6-алкиламинокарбонил, гидрокси, галоген, трифторметил, арил,гетероарил или гетероциклил иR10 независимо представляет собой водород, C1-C6-алкил, C1-C6-алкокси или галоген. Следующими вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где Rr представляет собой где R6 и R11 независимо представляют собой водород, C1-C6-алкил, C1-C6-алкокси, моно- или ди-C1-C6-алкиламино, моно- или ди-C1-C6-алкиламинокарбонил, гидрокси, галоген, трифторметил, арилR10 представляет собой водород, C3-C6-алкил, C1-C6-алкокси или галоген. Вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где Rr представляет собой где R6 и R11 независимо представляют собой водород, C1-C6-алкил, C1-C6-алкокси, моно- или ди-C1-C6-алкиламино, моно- или ди-C1-C6-алкиламинокарбонил, гидрокси, галоген, трифторметил;R4b предпочтительно представляет собой C1-C6-алкокси, наиболее предпочтительно метокси иR10 представляет собой водород, C1-C6-алкил, амино, моно- или ди-C1-C6-алкиламино, пирролидинил, пиперидинил, пиперазинил, N-метилпиперазинил или морфолинил. Вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где Rr представляет собой где R6 и R11 независимо представляют собой водород, C1-C6-алкил, C1-C6-алкокси, моно- или ди-C1-C6-алкиламино, моно- или ди-C1-C6-алкиламинокарбонил, гидрокси, галоген, трифторметил;R4b предпочтительно представляет собой C1-C6-алкокси, наиболее предпочтительно метокси, галоген или С 1-3 алкил иR10 представляет собой водород, C1-C6-алкил, амино, моно- или ди-C1-C6-алкиламино, пирролидинил, пиперидинил, пиперазинил, N-метилпиперазинил или морфолинил. Вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где Rr представляет собой где R6 и R11 независимо представляют собой водород, C1-C6-алкил, C1-C6-алкокси, моно- или ди-C1-C6-алкиламино, моно- или ди-C1-C6-алкиламинокарбонил, гидрокси, галоген, трифторметил;R4b предпочтительно представляет собой C1-C6-алкокси, наиболее предпочтительно метокси, галоген или C1-C3-алкил иR10 представляет собой водород, C1-C6-алкил, амино, моно- или ди-C1-C6-алкиламино, пирролидинил, пиперидинил, пиперазинил, N-метилпиперазинил или морфолинил. Вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где Rr представляет собой где R6 и R11 независимо представляют собой водород, C1-C6-алкил, C1-C6-алкокси, моно- или ди-C1-C6-алкиламино, моно- или ди-C1-C6-алкиламинокарбонил, гидрокси, галоген, трифторметил;R4b предпочтительно представляет собой C1-C6-алкокси, наиболее предпочтительно метокси, галоген или C1-C3-алкил и- 15014188 Предпочтительными вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где Rr представляет собой где R9 имеет значения, указанные в любой из групп или подгрупп соединений формулы (I); иR6 представляет собой водород, галоген или трифторметил. Следующими вариантами осуществления изобретения являются соединения формулы (I) или любой из подгрупп соединений формулы (I), где R4 представляет собой где R6 представляет собой водород, галоген или трифторметил. Другие варианты осуществления изобретения включают соединения, где R9 представляет собой где R10 представляет собой водород, метил, этил, изопропил, трет-бутил, С 1-3-алкиламино,(С 1-3-алкил)2 амино, (C1-C6-алкил)амидо, морфолин-4-ил, пиперидин-1-ил, причем морфолин и пиперидин необязательно замещены С 1-3-алкилом. Другие варианты осуществления изобретения включают соединения, у которых Rr представляет собой где R11 представляет собой Н или метокси. Соединения формулы (I-c) и (I-d), имеющие двойную связь в макроцикле (т.е. между атомами углерода 7 и 8 макроцикла, представленного ниже формулами (I-d), (I-е) и (I-f, состоят из трех строительных блоков P1, P2, Р 3. Для химических целей строительный блок Р 2 соединений формул (I-d) и (I-е) включает карбонильную группу, присоединенную к положению 1'. Связывание строительных блоков Р 1 с Р 2 и Р 2 с Р 3 включает образование амидной связи. Связывание блоков Р 1 и Р 3 включает образование двойной связи. Связывание строительных боков P1, P2 и Р 3 для получения соединений (I-c) или (I-d) можно проводить в любой данной последовательности. Последние стадии, очевидно, включают циклизацию, в результате чего образуется макроцикл В предпочтительном варианте осуществления соединения (I-c) получают сначала образованием амидных связей и затем образованием двойной связи между Р 3 и Р 1 с сопутствующей циклизацией с образованием макроцикла.- 16014188 В альтернативном случае, в соединении формулы (I-c) образуют первую амидную связь между строительными блоками Р 2 и Р 1 с последующим связыванием строительного блока Р 3 и затем образованием амидной связи между Р 3 и Р 2 с одновременным замыканием цикла. Еще одной альтернативной синтетической методологией является образование амидной связи между строительными блоками Р 2 и Р 3 с последующим связыванием строительного блока Р 1 с Р 3 и образованием последней амидной связи между Р 1 и Р 2 с одновременным замыканием цикла. Следует отметить, что в соединениях формулы (I-c) образование амидной связи между блоками Р 2 и Р 3 можно выполнить в двух разных положениях остатка мочевины. Первая амидная связь включает атом азота кольца пирролидина и соседний карбонил (отмеченный звездочкой). Альтернативное образование второй амидной связи включает реакцию отмеченного звездочкой карбонила с группой -NHR3. Оба образования амидных связей между строительными блоками Р 2 и Р 3 являются осуществимыми. Соединения формулы (I-d) можно получить связыванием Р 1 с Р 2 или, наоборот, с последующим образованием второй амидной связи между строительными блоками Р 3 и Р 2 с одновременной циклизацией с образованием макроцикла. В альтернативном случае, в соединении формулы (I-d) строительный блок P1-Р 3 можно также синтезировать перед его связыванием со строительным блоком Р 2. Этот строительный блок P1-Р 3 можно синтезировать реакцией метатезиса, реакцией Виттига или т.п. с последующим образованием двух амидных связей со строительным блоком Р 2 и одновременной циклизацией. Можно сначала получить отдельные строительные блоки и затем связать их друг с другом или, в альтернативном случае, предшественники строительных блоков можно связать друг с другом и модифицировать на последней стадии для получения требуемой молекулярной композиции. Функциональные группы в каждом из строительных блоков можно защитить, чтобы избежать побочных реакций. Образование амидных связей можно проводить с применением стандартных методик, таких как методика, применяемая для конденсации аминокислот в синтезе пептидов. Последняя включает дегидратационную конденсацию карбоксильной группы одного реагента с аминогруппой другого реагента с образованием соединяющей амидной связи. Образование амидной связи можно проводить реакцией исходных соединений в присутствии конденсирующего агента или превращением карбоксильной функциональной группы в активную форму, такую как активированный эфир или ацилхлорид. Общие описания таких реакций конденсации и применяемых в них реагентов можно найти в обычных руководствах по химии пептидов, например в руководстве М. Bodanszky, Peptide Chemistry, 2nd rev ed., Springer-Verlag,Berlin, Germany, (1993), далее просто называемом Bodanszky, содержание которого, таким образом,включено в качестве ссылки. Примеры реакций конденсации с образованием амидной связи включают азидный метод, метод с применением смешанных ангидридов угольной и карбоновой кислоты (изобутилхлорформиата), метод с применением карбодиимидов (дициклогексилкарбодиимида, диизопропилкарбодиимида или водорастворимого карбодиимида, такого как N-этил-N'-[(3-диметиламино)пропил]карбодиимида, метод с применением активированных эфировN-гидроксиянтарной кислоты), метод с применением реагента Вудварда К., метод с применением карбонилдиимидазола, методы с применением фосфорных реагентов или окисления-восстановления. Некоторые из этих методов можно улучшить добавлением подходящих катализаторов, например в методе карбодиимидов добавлением 1-гидроксибензотриазола или 4-DMAP. Следующими конденсирующими агентами являются гексафторфосфат (бензотриазол-1-илокси)-трис-(диметиламино)фосфония как таковой либо в присутствии 1-гидроксибензотриазола или 4-DMAP или тетрафторборат 2-(1 Н-бензотриазол-1 ил)-N,N,N',N'-тетраметилурония или гексафторфосфат 0-(7-азабензотриазол-1-ил)-N,N,N',N'тетраметилурония. Эти реакции конденсации можно проводить либо в растворе (жидкой фазе), либо в твердой фазе. Реакцию конденсации предпочтительно проводят в инертном растворителе, таком как галогенированные углеводороды, например дихлорметан, хлороформ, диполярных апротонных растворителях, таких как ацетонитрил, диметилформамид, диметилацетамид, простых эфирах, таких как тетрагидрофуран. Во многих случаях реакции конденсации проводят в присутствии подходящего основания, такого как третичный амин, например, триэтиламин, диизопропилэтиламин (DIPEA), N-метилморфолин,N-метилпирролидин или 4-DMAP. Температура реакции может быть между 0 и 50 С и время реакции может быть в диапазоне между 15 мин и 24 ч. Функциональные группы в строительных блоках, которые связывают друг с другом, могут быть защищены, чтобы избежать образования нежелательных связей. Подходящие защитные группы, которые можно применять, перечислены, например, в руководствах Greene, Protective Groups in OrganicChemistry, John WileySons, New York (1981) and The Peptides: Analysis, Synthesis, Biology, vol. 3,Academic Press, New York (1981), далее просто называемые Greene, содержания которых, таким образом,включено в качестве ссылки.- 17014188 Карбоксильные группы могут быть защищены в виде эфира, который можно отщепить с образованием карбоновой кислоты. Защитные группы, которые можно применять, включают 1) алкиловые эфиры, такие как метиловый, триметилсилиловый и трет-бутиловый; 2) аралкиловые эфиры, такие как бензиловый и замещенный бензиловый; или 3) эфиры, которые можно расщепить слабым основанием или мягким восстановительным способом, такие как трихлорэтиловый и фенациловый эфиры. Аминогруппы можно защитить различными N-защитными группами, такими как 1) ацильные группы, такие как формил, трифторацетил, фталил и п-толуолсульфонил; 2) ароматические карбаматные группы, такие как бензилоксикарбонил (Cbz или Z) и замещенные бензилоксикарбонилы и 9-флуоренилметилоксикарбонил (Fmoc); 3) алифатические карбаматные группы, такие как третбутилоксикарбонил (Boc), этоксикарбонил, диизопропилметоксикарбонил и аллилоксикарбонил; 4) циклические алкилкарбаматные группы, такие как циклопентилоксикарбонил и адамантилоксикарбонил; 5) алкильные группы, такие как трифенилметил и бензил; 6) триалкилсилил, такой как триметилсилил; и 7) тиолсодержащие группы, такие как фенилтиокарбонил и дитиасукциноил. Представляющими интерес аминозащитными группами являются Boc и Fmoc.-Аминозащитную группу предпочтительно отщепляют перед следующей стадией конденсации. Когда применяют группу Boc, выбирают методы с участием трифторуксусной кислоты, неразбавленной или в дихлорметане, или HCl в диоксане или в этилацетате. Образовавшуюся аммониевую соль затем нейтрализуют либо перед конденсацией, либо in situ основными растворами, такими как водные буферы или третичные амины в дихлорметане, или ацетонитриле, или диметилформамиде. Когда применяют группу Fmoc, выбранными реагентами являются пиперидин или замещенный пиперидин в диметилформамиде, но можно применять любой вторичный амин. Снятие защиты можно проводить при температуре между 0 С и комнатной температурой, обычно приблизительно при 20-22 С. Другие функциональные группы, которые могут создавать помехи в реакциях во время синтетической процедуры, например во время реакций конденсации строительных блоков, можно также защитить. Например, гидроксигруппы можно защитить такими защитными группами, как группы, перечисленные,например, в Greene, Protective Groups in Organic Chemistry, John WileySons, New York (1981). Гидроксизащитные группы включают замещенные простые метиловые эфиры, например метоксиметиловые,бензилоксиметиловые, 2-метоксиэтоксиметиловые, 2-(триметилсилил)этоксиметиловые, трет-бутиловые,и другие низшие простые алкиловые эфиры, такие как изопропиловые, этиловые и особенно метиловые,бензиловые и трифенилметиловые; тетрагидропираниловые простые эфиры; замещенные этиловые эфиры, например 2,2,2-трихлорэтиловый; силиловые простые эфиры, например триметилсилиловый, третбутилдиметилсилиловый и трет-бутилдифенилсилиловый; и сложные эфиры, полученные реакцией гидроксигруппы с карбоновой кислотой, например ацетат, пропионат, бензоат и т.п. Далее аминогруппы можно защитить защитными группами, которые можно отщепить селективно. Например, когда Boc применяют в качестве -аминозащитной группы, подходящими являются следующие защитные группы боковой цепи: п-толуолсульфонильную (тозильную) часть можно применять для защиты дополнительных аминогрупп; бензиловые (Bn) простые эфиры можно применять для защиты гидроксигрупп и бензиловые сложные эфиры можно применять для защиты дополнительных карбоксильных групп. Или, когда Fmoc выбирают для защиты -аминогруппы, обычно приемлемыми являются защитные группы на основе трет-бутила. Например, Boc можно применять для дополнительных аминогрупп; трет-бутиловые простые эфиры для гидроксигрупп и трет-бутиловые сложные эфиры для дополнительных карбоксильных групп. Любую из защитных групп можно удалить на любой стадии методики синтеза, но предпочтительно защитные группы любой из функциональных групп, не принимающих участие в стадиях реакции, удаляют после завершения построения макроцикла. Удаление защитных групп можно проводить любым способом, определяемым выбором защитных групп, такие способы хорошо известны специалисту в данной области. Строительные блоки P1, P2 и Р 3 для соединения (I-c) и (I-d) можно получить исходя из известных в данной области промежуточных соединений. Ряд таких синтезов описывается ниже более подробно. Синтез строительных блоков Р 2. Строительные блоки Р 2 содержат либо пирролидиновую, циклопентановую, либо циклопентеновую часть, замещенную группой -Q-Rr. Группу Rr можно связать с любым из этих колец на любой подходящей стадии синтеза соединений согласно настоящему изобретению. Одним подходом является сначала связывание группы Rr с подходящим кольцом и последующее присоединение других требуемых строительных блоков, т.е. Р 1 и Р 3, с последующим образованием макроцикла. Другим походом является связывание строительного блока Р 2, не имеющего заместитель Rr, и блока Р 1 и присоединение группы Rr либо до, либо после образования макроцикла.- 18014188 Синтез и введение заместителя в Р 2. Требуемую хиназолиновую группу в циклическую структуру Р 2 можно ввести различными методами на любой подходящей стадии синтеза. На схеме 1 в качестве примера указано введение заместителя в Р 2 посредством реакции Мицунобу. Mitsunobu, 1981, Synthesis, January, 1-28; Rano et al., Tetrahedron Обработка подходящей циклической гидроксизамещенной структуры Р 2 (1 а) требуемым хиназолинолом (1b) в присутствии трифенилфосфина и активирующего агента, подобного диэтилазодикарбоксилату (DEAD), диизопропилазодикарбоксилату (DIAD) или т.п., дает алкилированное соединение (1 с). Гидроксигруппу циклической структуры (1 а) можно в альтернативном случае превратить в любую другую подходящую уходящую группу, такую как производное сульфоновой кислоты, подобное тозилату,мезилату или трифлату или т.п., для этого ее подвергают в подходящих условиях сульфонилированию,подобному обработке ангидридом или галогенангидридом требуемой кислоты в растворителе, подобном пиридину, или применяют требуемую сульфоновую кислоту и трифенилфосфин в присутствии DEAD в растворителе, подобном толуолу, или гидроксигруппу можно превратить в галогенид обработкой спирта подходящим галогенирующим агентом, например, бромид можно получить применением такого реагента, как трибромид фосфора или т.п. Образованную уходящую группу можно затем заменить требуемым хиназолинолом для получения алкилированного производного (1 с). В альтернативном случае, можно применять противоположную стратегию, в которой гидроксисоединение (1 а) применяют в качестве нуклеофила и обрабатывают его основанием, таким как гидрид натрия или трет-бутоксид калия или т.п., в растворителе, подобном диметилформамиду (ДМФ), с последующей реакцией образовавшегося алкоксида с алкилирующим агентом Q-Lg, где Lg представляет собой подходящую уходящую группу, такую как галогенид, подобный хлориду, бромиду или йодиду, или производное сульфоновой кислоты, или т.п., и Q представляет собой производное хиназолина, получая при этом требуемое замещенное производное. Пример, в котором применяют производное пролина, описан Е.М. Smith et al. in J. Med Chem.(1988), 31, 875-885. Должно быть очевидно, что вышеуказанные методы введения хиназолиновой группы в циклическую структуру Р 2 можно проводить на любой подходящей стадии синтеза соединений согласно настоящему изобретению. Например, заместитель R8 можно ввести в подходящую циклическую структуру перед введением других компонентов соединения или циклическую структуру с защищенной гидроксигруппой можно применять на всем протяжении синтеза, и хиназолиновую группу можно ввести как последнюю стадию синтеза. Например, синтез замещенных производных хиназолина показан на схеме 2. Схема 2 Превращение нитрозамещенного производного бензойной кислоты (2 а) в соответствующий бензамид, например выдерживанием кислоты в условиях реакции Вильсмайера с последующим восстановлением нитрогруппы в условиях, подобных каталитическому гидрированию над никелем Ренея, дает соответствующий амин (2 с). Полученный амин можно затем связать с гетероциклической карбоновой кислотой (2d) в условиях пептидной конденсации, таких как присутствие HOBt и EDAC или любых других подходящих конденсирующих агентов, хорошо известных в данной области. Замыкание цикла и дегидратацию можно затем выполнить обработкой основанием, таким как гидрокарбонат натрия, которая дает- 19014188 производное хиназолина (2f). Производное хиназолина (2f) можно связать с гидроксигруппой структуры Р 2 реакцией Мицунобу, как описано выше, или гидроксигруппу хиназолина можно заменить подходящей уходящей группой, такой как галогенид, подобный хлориду, бромиду или йодиду, обработкой хиназолина (2f) подходящим галогенирующим агентом, например фосфорилхлоридом или т.п. Производные 8-метилхизолина можно также получить из альтернативной тризамещенной промежуточной кислоты или амида, полученного, как показано на схеме 2 А. Схема 2 А Конденсация этилпропионилацетата и этоксиметиленмалононитрила в присутствии подходящего основания, предпочтительно этоксида, такого как этоксид натрия, например в этаноле, дает тетразамещенное производное бензойной кислоты (2 Аа). Гидролиз этилового сложного эфира, выполняемого обработкой основанием, таким как гидроксид лития, с последующей стадией декарбоксилирования, достигаемой нагреванием полученной кислоты, дает затем тризамещенное производное фенола (2Ab). Алкилирование функциональной гидроксигруппы с применением, например, метилйодида в присутствии основания, такого как карбонат калия или т.п., дает соответствующее алкоксипроизводное (2 Ас). Тризамещенный амид (2Ad) можно затем получить вместе с соответствующей кислотой (2 Ае) гидролизом цианогруппы, проводимым нагреванием раствора цианопроизводного, например, в воде и этаноле в присутствии основания, подобного гидроксиду натрия. Амид (2Ad) можно затем подвергнуть реакции с требуемой кислотой в условиях пептидной конденсации, как описано на схеме 2, с получением 8-метилзамещенного хиназолинола и, если нужно, подвергнуть дополнительной реакции для получения соответствующего 4-галогенпроизводного. Кислоту (2 Ае), полученную по схеме 2 А, можно также применять для получения 8-метилзамещенных производных хиназолина, которое показано на схеме 2 В. Схема 2 В Защиту кислотной функциональной группы кислоты (2 Ае), например в виде метилового эфира,можно выполнить выдерживанием кислоты в условиях алкилирования, таких как обработка метилйодидом в присутствии основания, такого как карбонат калия. Функциональную аминогруппу полученного производного сложного эфира можно затем связать с требуемой кислотой с применением любой подходящей методики пептидной конденсации, такой как применение хлорангидрида кислоты в присутствии основания, такого как триэтиламин или т.п., с получением при этом амида (2Bb). Гидролиз метилового эфира обработкой основанием, подобным гидроксиду лития, с последующим нагреванием полученной кислоты в присутствии формамида дает хиназолинол (2 Вс). Как описано выше, хиназолинол можно далее подвергнуть реакции с получением соответствующего 4-галогенпроизводного. По схеме 2 можно применять различные карбоновые кислоты общей структуры (2d). Эти кислоты являются либо коммерчески доступными, либо описанными в литературе. Пример получения производных 2-(замещенный)аминокарбоксиаминотиазола по методикеR представляет собой C1-C6-алкил или Н. Тиомочевину (3 с) с различными алкильными заместителями R' и R можно получить реакцией подходящего амина (3 а) с трет-бутилизотиоцианатом в присутствии основания, подобного диизопропилэтиламину, в растворителе, подобном дихлорметану, с последующим удалением трет-бутильной группы в кислотных условиях. В альтернативном случае, тиомочевину (3 с) можно получить реакцией амина (3 а) с тиокарбонилдиимидазолом и затем с насыщенным раствором аммиака в метаноле. Последующая конденсация полученного производного тиомочевины (3 с) с 3-бромпировиноградной кислотой дает кислоту(3d). 4-Замещенные тиазол-2-карбоновые кислоты, которые применяют в реакции с амином 2 с на схеме 2, можно получить, как показано на схеме 4. Схема 4 Конденсация этилтиооксамата (4 а) с требуемым -бромкетоном (4b) с последующим гидролизом сложного эфира, выполняемым обработкой основанием, таким как гидроксид лития, дает тиазолкарбоновую кислоту (4d). -Бромкетоны (4b) являются коммерчески доступными или их можно получить-бромированием соответствующего кетона по известным методикам. Синтез и введение строительных блоков Р 1. Аминокислоты, применяемые для получения фрагментов Р 1, являются либо коммерчески доступными, либо описанными в литературе, см., например, WO 00/09543 и WO 00/59929. На схеме 5 показан пример получения производного сульфонамида, который применяют в качестве фрагмента Р 1. Схема 5 Сульфонамидную группу можно ввести в подходящим образом защищенную аминокислоту (6 а) обработкой аминокислоты конденсирующим агентом, например N,N'-карбонилдиимидазолом (CDI) или т.п., в растворителе, подобном ТГФ, с последующей реакцией с требуемым сульфонамидом (5b) в присутствии сильного основания, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). В альтернативном случае, аминокислоту можно обработать требуемым сульфонамидом (5b) в присутствии основания, подобного диизопропилэтиламину, с последующей обработкой конденсирующим агентом, подобным РуВОР, для осуществления введения сульфонамидной группы. Аминозащитную группу удаляют стандартными методами и продукт затем связывают с частью Р 2 или ее предшественником. Строительные блоки Р 1 для получения соединений согласно общей формуле (I), где А представляет собой сложный эфир, можно получить, например, реакцией аминокислоты (5 а) с подходящим амином или спиртом в стандартных условиях образования сложного эфира. Общий пример связывания строительного блока Р 1 с кислотной функциональной группой структуры Р 2 показан на схеме 7. Схема 7- 21014188 где Q представляет собой производное хиназолина или гидроксизащитную группу; А' представляет собой защищенную карбоновую кислоту или замещенный амид. Конденсация строительного блока P1 (7b), полученного, как описано выше, с кислотной функциональной группой части Р 2 с применением стандартных методов для образования амидной связи, подобных применению конденсирующего агента, как HATU, в присутствии основания, такого как диизопропиламин, в растворителе, подобном диметилформамиду, дает амид (7 с). В альтернативном случае, сульфонамидную группу можно ввести на более поздней стадии синтеза,например в последней стадии. В этом случае А' на схеме 7 представляет собой подходящим образом защищенную карбоновую кислоту, например ее метиловый эфир, и подходящим образом освобожденную от защитной группы карбоновую кислоту, например водным гидроксидом лития, перед сочетанием сульфонамидной группы. Введение связанной посредством мочевины -ненасыщенной алкильной цепи с гетероциклической структурой Р 2. Алкильную цепь, связанную через функциональную мочевинную группу со структурой Р 2, можно ввести, как показано на схеме 10. Схема 10 где Q представляет собой производное хиназолина или гидроксизащитную группу;Rx представляет собой -ненасыщенную 5-8-членную алкильную цепь; А' представляет собой защищенную карбоновую кислоту или замещенный амид. Реакция производного гидразина (10 а) с формилирующим агентом, таким как п-нитрофенилхлорформиат, карбонилдиимидазол, фосген или т.п., в присутствии основания, подобного гидрокарбонату натрия, с последующим присоединением строительного блока Р 2 дает производное мочевины (10 с). Подходящие алкениламины, которые применяют по схеме 10, можно получить, например, алкилированием требуемого трет-бутилкарбамата, общий пример получения показан на схеме 11. Схема 11 где n равно 1, 2, 3 или 4. Реакция требуемого амина, R5-NH2, с трет-бутилдикарбонатом дает Boc-защищенный амин (11 а). Алкилирование полученного карбамата -ненасыщенным алкилирующим агентом (11b), таким как алкенилгалогенид, например -бромид или -хлорид, с последующим удалением Boc-группы с применением стандартных условий, таких как обработка раствором TFA в растворителе, подобном дихлорметану, дает свободный амин (11 с). Группу А или Rt1 можно связать со строительным блоком Р 1 на любой стадии синтеза, например до или после циклизации или до или после циклизации и восстановления, как описано здесь ранее. Соединения формулы (I), где А или Rt1 представляют собой -NHSO2R2, причем эти соединения представлены формулой (I-k-1), можно получить связыванием группы А или Rt1 с Р 1 образованием амидной связи между этими частями. Аналогично этому соединения формулы (I), у которых А или Rt1 представляют собой-OR1, т.е. соединения (I-k-2), можно получить связыванием группы А или Rt1 с Р 1 образованием сложноэфирной связи. В одном варианте осуществления группы -OR1 вводят на последней стадии синтеза соединений формулы (I), как показано на нижеследующих схемах реакций, где G представляет собой группу Промежуточное соединение (2 а) можно связать с амином (2b) реакцией образования амида, например любой из методик для образования амидной связи, описанных ниже. В частности, (2 а) можно обработать конденсирующим агентом, например N,N'-карбонилдиимидазолом (CDI), EEDQ, IIDQ, EDCI или гексафторфосфатом бензотриазол-1-илокситриспирролидинофосфония (коммерчески доступен какPyBOP), в растворителе, таком как простой эфир, например ТГФ, или галогенированный углеводород,например дихлорметан, хлороформ, дихлорметан, и подвергнуть реакции с требуемым сульфонамидом(2b) предпочтительно после реакции (2 а) с конденсирующим агентом. Реакции (2 а) с (2b) предпочтительно проводят в присутствии основания, например триалкиламина, такого как триэтиламин или диизопропилэтиламин, или 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU). Промежуточное соединение (2 а) можно также превратить в активированную форму, например активированную форму общей формулы G-CO-Z,где Z представляет собой галоген или остаток активированного эфира, например Z представляет собой арилоксигруппу, такую как фенокси, п-нитрофенокси, пентафторфенокси, трихлорфенокси, пентахлорфенокси и т.п.; или Z может быть остатком смешанного ангидрида. В одном варианте осуществленияG-CO-Z является хлорангидридом кислоты (G-CO-C1) или смешанным ангидридом кислот(G-CO-O-CO-R или G-CO-O-CO-OR, причем R в последнем соединении является, например, С 1-4 алкилом,таким как метил, этил, пропил, изопропил, бутил, трет-бутил, изобутил или бензил). Активированную форму G-CO-Z подвергают реакции с сульфонамидом (2b). Активация карбоновой кислоты в (2 а), как описано в указанных выше реакциях, может привести к реакции внутренней циклизации с образованием промежуточного азалактона формулы где L, Rr, Rq, R5, n имеют значения, указанные выше, и где стереогенные центры могут иметь стереохимическую конфигурацию, как описано выше, например как в (I-а) или (I-b). Промежуточные соединения (2 а-1) можно выделить из реакционной смеси с применением общепринятой методологии, и выделенное промежуточное соединение (2 а-1) затем подвергают реакции с (2b) или реакционную смесь, содержащую (2 а-1), можно подвергнуть дополнительной реакции с (2b) без выделения (2 а-1). В одном варианте осуществления, где реакцию с конденсирующим агентом проводят в несмешиваемом с водой растворителе, реакционную смесь, содержащую (2 а-1), можно промыть водой или слабоосновной водой для удаления всех водорастворимых побочных продуктов. Таким образом, полученный промытый раствор можно затем подвергнуть реакции с (2b) без дополнительных стадий очистки. С другой стороны, выделение промежуточных соединений (2 а-1) может обеспечить некоторые преимущества в том отношении, что выделенный продукт после необязательной дополнительной очистки можно подвергнуть реакции с (2b), которая дает меньше побочных продуктов и позволяет проводить более легкую обработку продукта реакции. Промежуточный продукт (2 а) можно связать со спиртом (2 с) реакцией образования сложного эфира. Например, (2 а) и (2 с) подвергают реакции друг с другом с удалением воды либо физическим методом, например азеотропным удалением воды, либо химическим методом с применением обезвоживающего агента. Промежуточное соединение (2 а) можно также превратить в активированную формуG-CO-Z, такую как активированные формы, указанные выше, и затем подвергнуть реакции со спиртом(2 с). Реакции получения сложных эфиров предпочтительно проводят в присутствии основания, такого как карбонат или гидрокарбонат щелочного металла, например гидрокарбоната натрия или калия, или третичного амина, такого как амины, указанные здесь в отношении реакций получения амидов, в частности триалкиламина, например триэтиламина. Растворители, которые можно применять в реакциях получения сложных эфиров, включают простые эфиры, такие как ТГФ; галогенированные углеводороды, такие как дихлорметан, CH2Cl2; углеводороды, такие как толуол; полярные апротонные растворители, такие как ДМФ, ДМСО, DMA, и подобные растворители. Синтез соединений, содержащих карбоциклическое звено Р 2. Типичный путь получения соединений, содержащих насыщенную карбоциклическую структуру Р 2,т.е. соединений, у которых L представляет собой СН в общей формуле 1, показан на схеме 14. Схема 14 где Rx представляет собой -ненасыщенную 5-8-членную алкильную цепь; А' представляет собой защищенную карбоновую кислоту, замещенный амид. Насыщенную циклоалкильную структуру(1992), 1127-1129, восстановлением кетогруппы восстанавливающим агентом, подобным борогидриду натрия, в растворителе, подобном метанолу, с последующим гидролизом сложных эфиров и, наконец,замыканием цикла в уксусном ангидриде в присутствии пиридина. Полученную бициклическую кислоту(14b) можно затем связать с функциональной аминогруппой требуемого производного гидразина (14 с) с применением общепринятых условий пептидной конденсации, подобных применению HATU, и диизопропиламина в растворителе, подобном диметилформамиду, с получением (14d). Раскрытие цикла лактона (14d), например, гидроксидом лития дает кислоту (14 е), которую затем можно связать с аминогруппой строительного блока Р 1 или предшественника требуемого фрагмента P1 (14f) с применением обычных условий пептидной конденсации. Введение R8-группы карбоцикла можно затем выполнить, например, реакцией Мицунобу с применением подходящего спирта, как описано выше, или любым другим подходящим предварительно описанным методом. На схеме 15 показан альтернативный путь получения соединений формулы I, включающих насыщенную структуру Р 2, где строительные блоки вводят в обратном порядке, т.е. фрагмент Р 1 вводят перед введением остатка гидразина. Схема 15 где Q представляет собой производное хиназолина;Rx представляет собой -ненасыщенную 5-8-членную алкильную цепь; А' представляет собой защищенную карбоновую кислоту, замещенный амид. Защита кислотной группы (15 а), например в виде трет-бутилового эфира, обработкой ди-третбутилдикарбонатом в присутствии основания, подобного диметиламинопиридину и триэтиламину, в растворителе, подобном дихлорметану, дает сложный эфир (15b). Раскрытие кольца лактона с применением,например, гидроксида лития и последующее присоединение строительного блока Р 1 (15 с), как описано на схеме 12 или непосредственно через аминогруппу фрагмента Р 1, дает (15d). Введение R8-группы, как описано выше, с последующим удалением защитной группы кислоты выдерживанием сложного эфира в- 24014188 кислотных условиях, подобных трифторуксусной кислоте, и обработкой триэтилсиланом в растворителе,подобном метиленхлориду, и, наконец, присоединением остатка гидразина (15 е) с применением условий реакции пептидной конденсации, как описано выше, дает производное гидразида (15f). Ненасыщенную структуру Р 2, пригодную для получения соединений формулы (I), можно получить,как показано на схеме 16. Схема 16 Реакция бромирования-элиминирования 3,4-бис-(метоксикарбонил)циклопентанона (15 а), как описано Dolby et al. in J. Org. Chem. 36 (1971), 1277-1285, с последующим восстановлением функциональной кетогруппы восстанавливающим агентом, подобным боргидриду натрия, дает ненасыщенное гидроксисоединение (15b). Селективный гидролиз сложного эфира с применением, например, гидроксида лития в растворителе, подобном смеси диоксана и воды, дает гидроксизамещенное производное сложного моноэфира (15 с). Структуру Р 2, где Rq не является водородом, например представляет собой метил, можно получить,как показано на схеме 17. Схема 17 Окисление коммерчески доступного 3-метил-3-бутен-1-ола (17 а) с применением агента окисления,подобного хлорхромату пиридиния, с последующей обработкой ацетилхлоридом, бромом и метанолом дает сложный -бромэфир (17 с). Полученный эфир (17 с) можно затем подвергнуть реакции с енолятом(17 е), полученным, например, обработкой соответствующего сложного трет-бутилового эфира основанием, таким как диизопропиламидом лития, в растворителе, подобном тетрагидрофурану, с получением при этом алкилированного соединения (17f). трет-Бутиловый сложный эфир (17 е) можно получить обработкой соответствующей коммерчески доступной кислоты (17d) ди-трет-бутилдикарбонатом в присутствии основания, подобного диметиламинопиридину. Циклизация (17f) реакцией метатезиса олефинов,проведенная, как описано выше, дает производное циклопентена (17 д). Стереоселективное эпоксидирование (17g) можно проводить применением метода асимметричного эпоксидирования Якобсена для получения эпоксида (17h). Наконец, добавление основания, подобного DBN (1,5-диазабицикло[4.3.0]нон-5 ену), дает спирт (17i). Двойную связь соединения (17i) можно необязательно восстановить, например,каталитическим гидрированием с применением катализатора, подобного палладию на угле, для получения соответствующего насыщенного соединения. Полученные циклические структуры можно затем применять, как описано выше, для завершения синтеза соединений формулы 1. Пример показан на схеме 18. где Q представляет собой производное хиназолина;Rx представляет собой -ненасыщенную 5-8-членную алкильную цепь; А' представляет собой защищенную карбоновую кислоту, замещенный амид. Аминогруппу строительного блока Р 1 или его подходящего предшественника (18b) можно связать с кислотной группой производного циклопентена (18 а) с применением стандартных условий конденсирования с образованием амидной связи, таких как применение HATU, в присутствии основания, подобного диизопропилфениламину или т.п., с последующим введением группы хиназолина, например, в условиях реакции Мицунобу, как описано выше, для получения (18d). Гидролиз оставшейся группы сложного эфира и затем связывание продукта с подходящим -ненасыщенным амином (18 е) с образованием амида и необязательное последующее превращение части Р 1 дают циклопентенсодержащие соединения (18f) согласно общей формуле (I). Макроциклизация. Макроцикл, присутствующий в соединениях изобретения, обычно получают реакцией метатезиса олефинов (макроциклизация). Хиназолиновую группу циклической структуры Р 2 можно ввести любой из ранее описанных стратегий до или после образования макроцикла. Типичный путь получения макроциклических производных мочевины показан на схеме 19. Схема 19 где Q представляет собой производное хиназолина или гидроксизащитную группу;n равно 1, 2, 3 или 4. Соединение (19 а), полученное, как описано выше, с применением этилового эфира винилциклопропилглицина в качестве части Р 1, можно превратить в макроциклическое соединение (19b) проведением реакции метатезиса олефинов. Для проведения реакции метатезиса можно применять катализатор на основе Ru, такой как катализатор, описанный Miller, S.J., Blackwell, H.E.; Grubbs, R.H. J. Am. Chem. Soc. 118, (1996), 9606-9614, Kingsbury, J.S., Harrity, J.P.A., Bonitatebus, P.J., Hoveyda, A.H., J. Am. Chem. Soc. 121, (1999), 791-799 and Huang et al., J. Am. Chem. Soc. 121, (1999), 2674-2678. Должно быть также понятно, что для этой реакции можно применять катализаторы, содержащие другие переходные металлы, такие как Mo. Двойную связь необязательно восстанавливают с применением стандартных методов гидрирования, хорошо известных в данной области, таким образом получая соответствующее насыщенное макроциклическое соединение. Макроциклизацию, описанную на схеме 19, можно также применять для соединений, включающих насыщенную или ненасыщенную карбоциклическую структуру Р 2, в качестве примера указанную на схеме 20. где Q представляет собой производное хиназолина или гидроксизащитную группу;n равно 1, 2, 3 или 4. Связывание производного гидразина (20b) со строительным блоком Р 2-Р 1 (21 а), полученным, как описано на схеме 13 или 14, с применением стандартных условий пептидной конденсации, таких как применение HATU, в присутствии подходящего основания, например диизопропиламина, дает промежуточное соединение (20 с). Замыкание цикла (20 с) реакцией метатезиса олефинов, как описано на схеме 18,дает макроциклическое соединение (20d). Когда промежуточные соединения в описанных выше схемах содержат функциональную группу(ы), их подходящим образом защищают, когда требуется, и затем освобождают от защитной группы методами, известными специалистам в данной области. Экстенсивное описание методов см., например, в цитированной выше публикации Bodanzky или Greene. Синтез строительных блоков Р 3. Строительные блоки Р 3 можно синтезировать согласно методологиям, известным специалисту в данной области. Одна из этих методологий показана на схеме 28, и в ней применяют моноацилированные амины, такие как трифторацетамид или Boc-защищенный амин. Схема 28LG представляет собой уходящую группу, такую как галоген. Моноацилированные амины (18 а) обрабатывают сильным основанием, таким как гидрид натрия, и затем подвергают реакции с галоген-C3-C6-алкенилом (28b) с образованием соответствующего защищенного амина (28 с). Снятие защиты у (28 с) дает строительный блок Р 3 или (28d). Снятие защиты будет зависеть от функциональной группы R, так, если R представляет собой трет-бутокси, снятие защиты у соответствующего Вос-защищенного амина можно выполнить кислотной обработкой, например трифторуксусной кислотой. В альтернативном случае, когда R представляет собой, например, трифторметил,удаление группы R выполняют основанием, например гидроксидом натрия. На схеме 29 в качестве примера указывается еще один метод получения строительного блока Р 3. Схема 29n имеет значения, указанные в настоящем изобретении. Синтез Габриэля первичных С 3-6-алкениламинов, который можно проводить обработкой фталимида(29 а) основанием, таким как гидроксид калия, и галоген-С 3-6-алкенилом (29b) с последующим гидролизом промежуточного N-алкилимида дает первичный С 3-6-алкениламин (29 с).- 27014188 Связывание подходящего строительного блока Р 3 с частью Р 2-Р 1 можно выполнить образованием амидной связи, как объясняется здесь. Получение макроцикла. Получение макроцикла можно проводить посредством реакции метатезиса олефинов в присутствии подходящего металлического катализатора, такого как, например, катализатор на основе Ru, описанныйChem. Soc. 121, (1999), 2674-2678, например катализатор Hoveyda-Grubbs. Для получения макроцикла в больших масштабах можно применять стабильные на воздухе рутениевые катализаторы, такие как бис-(трициклогексилфосфин)-3-фенил-1 Н-инден-1-илиденрутенийхлоридM1) или бис-(трициклогексилфосфин)[(фенилтио)метилен]рутений(IV)-дихлорид. Для данной реакции можно также применять другие катализаторы, содержащие другие переходные металлы, такие как Мо. Реакции метатезиса можно проводить в подходящем растворителе, таком как, например, простые эфиры, например ТГФ, диоксан; галогенированные углеводороды, например дихлорметан, CHCl3,1,2-дихлорэтан и т.п., углеводороды, например толуол. В предпочтительном варианте осуществления реакцию метатезиса проводят в толуоле. Эти реакции проводят при повышенных температурах в атмосфере азота. Двойную связь необязательно восстанавливают стандартными методами гидрирования, хорошо известными в данной области, например водородом, в присутствии в качестве катализатора благородного металла, такого как Pd или Pt. Ряд определенных путей синтеза для получения соединений формулы (I) или конкретных подгрупп соединений формулы (I) указываются на схемах 30-33 до некоторой степени более подробно. Схема 30 Соединения настоящего изобретения можно синтезировать, как показано на схеме 30, из соединений формул А, В и F. Лактон А связывают с С 3-6-алкениламином формулы В в присутствии конденсирующего агента для синтеза пептидов, такого как HATU или EDCI/HOAt, в присутствии основания, такого как DIPEA, с образованием соединения формулы С. Последующее размыкание цикла лактона и связывание с этиловым эфиром 1-(амино)-2-(винил)циклопропанкарбоновой кислоты в присутствии конденсирующего агента для синтеза пептидов, такого как HATU или EDCI/HOAt, в присутствии основания,такого как DIPEA, дает соединение формулы Е. Соединения Е можно связывать с хиназолином формулыF с применением реакции типа Мицунобу. Образовавшийся диолефин G можно подвергнуть замыканию цикла с применением катализатора метатезиса олефинов, такого как катализаторы Hoveyda-Grubbs или бис-(трициклогексилфосфин)[(фенилтио)метилен]рутений(IV)-дихлорид, бис-(трициклогексилфосфин)3-фенил-1 Н-инден-1-илиденрутений(IV)дихлорид (неолист M1), в подходящем растворителе, таком как 1,2-дихлорэтан, дихлорметан или толуол, с получением соединения формулы Н, которое можно гидролизовать в соответствующую кислоту формулы (I). Кислоту формулы (I) сочетают с R6SO2NH2 в присутствии конденсирующего агента для синтеза пептидов, такого как CDI или EDAC, и в присутствии основа- 28014188 ния, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) или DMAP, получая при этом соединение формулы J. Схема 31 По схеме 31 соединение формулы K подвергают реакции с хлорхиназолином L в присутствии основания, такого как NaH или tBuOK, с получением соединения формулы М. Образовавшуюся кислоту М можно обработать этиловым эфиром 1-(амино)-2-(винил)циклопропанкарбоновой кислоты или соответствующим тозилатом в присутствии конденсирующего агента для синтеза пептидов, такого как HATU или EDCI/HOAt, и в присутствии основания, такого как DIPEA, с получением продукта формулы N. Удаление защитной группы Boc у соединения формулы N можно осуществить обработкой кислотой, такой как TFA, в растворителе, таком как метиленхлорид, с получением свободного амина формулы О. Затем мочевину формулы Р можно получить из соединения формулы О обработкой фосгеном или эквивалентом фосгена и амином формулы В в присутствии основания, такого как NaHCO3. Образовавшийся диолефин Р можно подвергнуть замыканию цикла с применением катализатора метатезиса олефинов,такого как катализаторы Hoveyda-Grubbs или бис-(трициклогексилфосфин)[(фенилтио)метилен]рутений(IV)-дихлорид, бис-(трициклогексилфосфин)-3-фенил-1 Н-инден-1-илиденрутений(IV)-дихлорид(неолист M1), в подходящем растворителе, таком как 1,2-дихлорэтан, дихлорметан или толуол, с получением соединения формулы Q, которое можно гидролизовать в соответствующую кислоту формулы R. Кислоту формулы R сочетают с R6SO2NH2 в присутствии конденсирующего агента для синтеза пептидов,такого как CDI или EDAC, и в присутствии основания, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен(DBU) или DMAP, получая при этом соединение формулы S. Альтернативный метод синтеза соединения формулы Q показан ниже на схеме 32. Схема 32
МПК / Метки
МПК: A61K 31/517, C07D 417/04, C07D 239/72, A61P 31/12
Метки: макроциклические, вируса, гепатита, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-14188-makrociklicheskie-ingibitory-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Макроциклические ингибиторы вируса гепатита с</a>
Предыдущий патент: Таблетка содержащая гранулированный пантопразол
Следующий патент: Применение флибансерина для лечения расстройств полового влечения в предклимактерический период
Случайный патент: Уплотнительный прокладочный материал (варианты)