Производные пиразоло[3, 4-d]азепина как антагонисты н3-рецепторов гистамина
Формула / Реферат
1. Соединение формулы (Ia) или его фармацевтически приемлемая соль или сольват
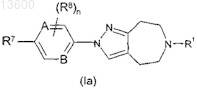
где
R1 представляет собой -C1-6алкил, -С3-7циклоалкил или -СН2-С3-7циклоалкил;
А и В независимо представляют собой СН или N;
R7 представляет собой водород, гидрокси, галоген, циано, нитро, C1-6алкил, галогенС1-6алкил, -О-галогенС1-6 алкил, -O-C1-6алкил, -NR4aR5a, -CONR4aR5a, -NR4aCOR5a, -SO2R4a, -NR4aSO2R5a или -SO2NR4aR5a,
где R4a и R5a независимо представляют собой водород или C1-6алкил, или где NR4aR5a может представлять собой содержащую азот группу гетероциклила, которая может необязательно быть замещена 1, 2 или 3 заместителями, независимо выбранными из =O и C1-3алкила;
R8 представляет собой гидрокси, галоген, циано, нитро, C1-6алкил, галогенС1-6алкил, -О-галогенС1-6алкил или -O-C1-6алкил; и
n представляет собой 0 или 1;
где термин «содержащий азот гетероциклил» означает 4-7-членное моноциклическое кольцо, которое является насыщенным или частично ненасыщенным, где моноциклическое кольцо содержит по меньшей мере один атом азота и другие 1-3 гетероатома, выбираемые из кислорода, азота и серы.
2. Соединение по п.1, где А представляет собой N и В представляет собой СН или А и В оба представляют собой СН.
3. Соединение по п.1 или 2, где R7 представляет собой -NR4aR5a или -CONR4aR5a, где R4a и R5a независимо представляют собой водород или C1-6алкил, или где NR4aR5a представляет собой содержащую азот группу гетероциклила, которая может необязательно быть замещена 1, 2 или 3 заместителями, независимо выбранными из =O и C1-3алкила.
4. Соединение по пп.1, 2 или 3, где R4a и R5a независимо представляют собой водород или C1-3алкил.
5. Соединение по пп.1-3 или 4, где n представляет собой 0.
6. Соединение по п.1, которое представляет собой
N,N-диметил-4-[6-(2-метилпропил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил]бензамид,
N,N-диметил-4-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил]бензамид,
4-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил)-N,N-диметилбензамид,
4-(6-циклопентил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил)-N,N-диметилбензамид,
N-метил-4-[6-(2-метилпропил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил]бензамид,
N-метил-4-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил]бензамид,
4-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил)-N-метилбензамид,
4-(6-циклопентил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил)-N-метилбензамид,
3-{4-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил]фенил}-1,3-оксазолидин-2-он,
1-метил-3-{4-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил]фенил}-2-имидазолидинон,
1-метил-3-{4-[6-(2-метилпропил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил]фенил}-2-имидазолидинон,
1-[5-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил)-2-пиридинил]-2-пирролидинон,
1-[4-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)фенил]-2-пирролидинон,
1-{4-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил]фенил}-2-пирролидинон,
6-(1-метилэтил)-2-[4-(3-метил-1,2,4-оксадиазол-5-ил)фенил]-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин,
4-[6-(2-метилпропил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил]бензамид,
4-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил]бензамид,
1-[4-(6-этил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил)фенил]-2-пирролидинон,
1-{4-[6-(циклопропилметил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)-ил]фенил}-2-пирролидинон,
1-{4-[6-(2-метилпропил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил]фенил}-2-пирролидинон,
2-[4-(3-метил-1,2,4-оксадиазол-5-ил)фенил]-6-(2-метилпропил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин,
1-[4-(6-цикогексил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)фенил]-2-пирролидинон,
4-(6-циклопентил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)бензамид,
1-[4-(6-циклопентил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)фенил]-2-пирролидинон,
6-циклобутил-2-[4-(3-метил-1,2,4-оксадиазол-5-ил)фенил]-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин,
4-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)бензамид,
6-циклопентил-2-[4-(3-метил-1,2,4-оксадиазол-5-ил)фенил]-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин,
6-циклобутил-2-[4-(метилсульфонил)фенил]-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин,
N-[4-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)фенил]метансульфонамид,
3-[4-(6-циклопентил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)фенил]-1,3-оксалидин-2-он,
1-[4-(6-циклопентил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)фенил]-3-метил-2-имидазолидинон,
4-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)бензонитрил,
4-[6-(2-метилпропил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил]бензонитрил,
4-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил]бензонитрил,
2-(4-бромфенил)-6-циклобутил-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин,
1-[4-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)фенил]-3-метил-2-имидазолидинон,
3-[4-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)фенил]-1,3-оксазолидин-2-он,
3-[4-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)фенил]-1-метил-2,4-имидазолидиндион,
6-циклобутил-2-[4-(4-морфолинил)фенил]-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин,
6-циклобутил-2-[4-(1-пиперидинил)фенил]-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин,
6-циклобутил-2-[4-(1-пирролидинил)фенил]-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин,
3-{4-[6-(2-метилпропил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил]фенил}-1,3-оксазолидин-2-он,
1-{5-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил]-2-пиридинил}-2-пирролидинон,
6-циклобутил-2-фенил-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин;
или их фармацевтически приемлемую соль.
7. Соединение по п.1, которое представляет собой N-метил-4-[6-(2-метилпропил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил]бензамид
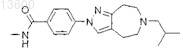
или его фармацевтически приемлемую соль.
8. Соединение по п.1, которое представляет собой N-метил-4-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил]бензамид
![]()
или его фармацевтически приемлемую соль.
9. Соединение, которое представляет собой 6-циклобутил-2-[1-(6-метил-3-пиридинидил)-4-пиперидинил]-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин
![]()
или 4-[(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4Н)ил)метил]бензонитрил
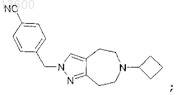
или его фармацевтически приемлемую соль.
10. Фармацевтическая композиция, содержащая соединение формулы (Ia) по любому из пп.1-9 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или вспомогательное вещество.
11. Применение соединения формулы (Ia) или его фармацевтически приемлемой соли по любому из пп.1-9 при производстве лекарственного средства для лечения когнитивных расстройств при болезни Альцгеймера и родственных нейродегенеративных расстройствах.
12. Применение соединения формулы (Ia) или его фармацевтически приемлемой соли по любому из пп.1-9 при производстве лекарственного препарата для лечения болезни Альцгеймера, деменции, возрастной дисфункции памяти, легкого когнитивного нарушения, когнитивного расстройства, эпилепсии, боли неврологического происхождения, болезни Паркинсона, недостатка сна, связанного с болезнью Паркинсона, шизофрении, синдрома дефицита внимания с гиперактивностью или депрессии.
13. Применение по п.12, где лекарственное средство предназначено для лечения когнитивного расстройства при шизофрении.
14. Фармацевтическая композиция для применения при лечении болезни Альцгеймера, деменции, возрастной дисфункции памяти, легкого когнитивного нарушения, когнитивного расстройства, эпилепсии, боли неврологического происхождения, болезни Паркинсона, недостатка сна, связанного с болезнью Паркинсона, шизофрении, синдрома дефицита внимания с гиперактивностью или депрессии, которая содержит соединение формулы (Ia) по любому из пп.1-9 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Текст
013600 Настоящее изобретение относится к новым производным пиразола, обладающим фармакологической активностью, способам их получения, содержащим их композициям и их применению при лечении неврологических и психических расстройств. В WO 2004/05639 (Glaxo Group Ltd.) описан ряд производных бензазепинов и их применение при лечении неврологических расстройств. В WO 2004/013144 (Pharmacia Italia S.P.A.) раскрыт ряд бициклопиразолов, которые, как заявляют, являются полезными при лечении заболеваний, связанных с нарушением регулирования протеинкиназ. В WO 2004008837 и WO 200013508 (Ishihara Sangyo Kaisha Ltd.) раскрыты производные бензола, которые, как заявляют, являются полезными в качестве гербицидов. В JP 2001220390 описаны производные пиразола, которые полезны в качестве ингибиторов кальциевых каналов и продукции IL-2. Н 3-рецептор гистамина преимущественно экспрессируется в центральной нервной системе (ЦНС) млекопитающих с минимальной экспрессией в периферических тканях, за исключением некоторых симпатических нервов (Leurs et al., 1998, Trends Pharmacol. Sci. 19, 177-183). Активация Н 3-рецепторов селективными агонистами или гистамином приводит к ингибированию секреции нейромедиатора рядом различных популяций нервных клеток, включая гистаминергические и холинергические нейроны(Schlicker et al., 1994, Fundam. Clin. Pharmacol., 8, 128-137). Кроме того, исследования in vitro и in vivo показали, что Н 3-антагонисты могут способствовать секреции нейромедиатора в областях головного мозга, таких как кора головного мозга и гиппокамп, необходимого для познания (Onodera et al., 1998, вThe Histamine H3 receptor, ed. Leurs and Timmerman, pp. 255-267, Elsevier Science B.V.). Более того, ряд сообщений в литературе демонстрирует повышение когнитивных свойств, обусловленных антагонистами Н 3, (например, тиоперамид, клобенпропит, ципроксифан и GT-2331) на моделях грызунов, включая пять задач выбора, распознавание объекта, приподнятый крестообразный лабиринт, восприимчивость новой задачи и пассивное избегание (Giovanni et al., 1999, Behav. Brain Res. 104, 147-155). Указанные данные предполагают, что новые антагонисты и/или обратные агонисты Н 3, как, например, настоящих серий, могут быть полезны при лечении когнитивных поражений при неврологических заболеваниях,таких как болезнь Альцгеймера и родственные нейродегенеративные расстройства. В первом аспекте настоящее изобретение обеспечивает соединение формулы (I) или его фармацевтически приемлемую сольR1 представляет собой -C1-6 алкил, -С 3-7 циклоалкил или -СН 2-С 3-7 циклоалкил, где указанные циклоалкильные группы могут необязательно быть замещены С 1-3 алкилом;X представляет собой связи или -СН 2-,R2 представляет собой -арил, -арил-арил, -арил-гетероарил, -арил-гетероциклил, -гетероарил, гетероарил-арил, -гетероарил-гетероарил, -гетероарил-гетероциклил, -гетероциклил, -гетероциклил-арил, гетероциклил-гетероарил или -гетероциклил-гетероциклил; где указанные арильные, гетероарильные или гетероциклильные группы R2 могут необязательно быть замещены одним или более заместителями (например 1, 2 или 3), которые могут быть одинаковыми или различными и которые могут быть выбраны из группы, состоящей из галогена, гидрокси, циано,нитро, =O, C1-6 алкила, галогенС 1-6 алкила, -O-галогенС 1-6 алкила, -О-С 1-6 алкила, -С 1-6 алкил-О-С 1-6 алкила,-CO2R4, -COR4, -C1-6 алкил-COR4, -SR4, -SO2R4, -SOR4, -OSO2R4, -C1-6 алкил-SO2R4, -С 1-6 алкил-NR4SO2R5,-C1-6 алкил-SO2NR4R5, -NR4R5, -C1-6 алкил-NR4R5, -С 3-8 циклоалкил-NR4R5, -CONR4R5, -NR4COR5, -С 1-6 алкил-NR4COR5, -С 1-6 алкил-CONR4R5, -NR4SO2R5, -OCONR4R5, -NR4CO2R5, -NR6CONR4R5 или-SO2NR4R5 (где R4, R5 и R6 независимо представляют собой водород, C1-6 алкил или где -NR4R5 могут представлять собой содержащую азот группу гетероцикла); и где R4, R5 и R6 могут быть необязательно замещены одним или более заместителями (например, 1, 2 или 3), которые могут быть одинаковыми или различными и которые могут быть выбраны из группы,состоящей из галогена, гидрокси, циано, амино, нитро и =O; или его сольваты. В одном аспекте R1 представляет собой -С 3-7 циклоалкил, где циклоалкильная группа может необязательно быть замещена C1-3 алкилом. Используемый здесь термин Сх-уалкил как группа или часть группы относится к линейной или разветвленной насыщенной углеводородной группе, содержащей от х до у атомов углерода. Примеры C1-6 алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, нпентил, изопентил, неопентил или гексил и тому подобное. Используемый здесь термин Сх-уциклоалкил относится к насыщенному моноциклическому углеводородному кольцу с х-у атомами углерода. Примеры С 3-7 циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Используемый здесь термин галоген относится к атому фтора, хлора, брома или иода.-1 013600 Используемый здесь термин галогенСх-уалкил относится к Сх-уалкильной группе, такой как определена здесь, где по меньшей мере один атом водорода замещен на галоген. Примеры галоген С 16 алкильных групп включают фторэтил, трифторметил или трифторэтил и тому подобное. Используемый здесь термин арил относится к С 6-12 моноциклическому или бициклическому углеводородному кольцу, где по меньшей мере одно кольцо является ароматическим. Примеры таких групп включают фенил, нафтил или тетрагидронафталенил и тому подобное. В одном осуществлении изобретения термин арил относится к С 6-12 моноциклическому ароматическому кольцу, в частности фенилу. Используемый здесь термин гетероарил относится к 5-6-членному моноциклическому ароматическому или слитому 8-10-членному бициклическому ароматическому кольцу, где моноциклическое или бициклическое кольцо содержит 1-4 гетероатома, выбранные из кислорода, азота и серы. Примеры таких моноциклических ароматических колец включают тиенил, фурил, фуразанил, пирролил, триазолил, тетразолил, имидазолил, оксазолил, тиазолил, оксадиазолил, изотиазолил, изоксазолил, тиадиазолил, пиранил, пиразолил, пиримидил, пиридазинил, пиразинил, пиридил, триазинил, тетразинил и тому подобное. Примеры таких слитых ароматических колец включают хинолинил, изохинолинил, хиназолинил, хиноксалинил, птеридинил, циннолинил, фталазинил, нафтиридинил, индолил, изоиндолил, азаиндолил, индолизинил, индазолил, пуринил, пирролопиридинил, фуропиридинил, бензофуранил, изобензофуранил,бензотиенил, бензоимидазолил, бензоксазолил, бензоизоксазолил, бензотиазолил, бензоизотиазолил, бензоксадиазолил, бензотиадиазолил и тому подобное. В одном осуществлении изобретения термин гетероарил относится к 5-6-членному моноциклическому ароматическому кольцу, которое содержит 1-4 гетероатома, выбранные из кислорода, азота и серы. Более конкретно, термин гетероарил относится к 5-6-членному моноциклическому ароматическому кольцу, которое содержит по меньшей мере один атом азота и другие 1-3 гетероатома выбирают из кислорода, азота и серы. Термин гетероциклил относится к 4-7-членному моноциклическому кольцу или конденсированному 8-12-членному бициклическому кольцу, которое может быть насыщенным или частично ненасыщенным, где моноциклическое или бициклическое кольцо содержит 1-4 гетероатома, выбранные из кислорода, азота и серы. Примеры таких моноциклических колец включают пирролидинил, азетидинил,пиразолидинил, оксазолидинил, имидазолидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, гидантоинил, валеролактамил, оксиранил, оксетанил, диоксоланил, диоксанил,оксатиоланил, оксатианил, дитианил, дигидрофуранил, тетрагидрофуранил, дигидропиранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил, диазепанил, азепанил и тому подобное. Примеры таких бициклических колец включают индолинил,изоиндолинил, бензопиранил, хинуклидинил, 2,3,4,5-тетрагидро-1 Н-3-бензазепин, тетрагидроизохинолинил и тому подобное. В случае одного осуществления изобретения термин гетероциклил относится к 4-7-членному кольцу, которое может быть насыщенным или частично ненасыщенным, где моноциклическое кольцо содержит 1-4 гетероатома, выбранные из кислорода, азота и серы. Более конкретно, термин гетероциклил относится к содержащей азот группе гетероциклила. Термин содержащий азот гетероциклил относится к 4-7-членному моноциклическому кольцу, которое может быть насыщенным или частично ненасыщенным, где моноциклическое кольцо содержит по меньшей мере один атом азота и другие 1-3 гетероатома выбирают из кислорода, азота и серы. Примеры содержащих азот групп гетероциклила включают пирролидинил, азетидинил, пиразолидинил, оксазолидинил, имидазолидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, гидантоинил, валеролактамил, тетрагидропиридинил, тетрагидропиримидинил, диазепанил, азепанил и тому подобное. В случае одного осуществления изобретения R1 представляет собой -С 3-7 циклоалкил (например,циклобутил, циклопентил или циклогексил), где циклоалкильная группа необязательно замещена C1-3 алкилом. В более конкретном варианте осуществления изобретения R1 представляет собой незамещенный -С 3-7 циклоалкил (например, циклобутил, циклопентил или циклогексил), в частности, незамещенный циклобутил. В случае альтернативного варианта осуществления изобретения R1 представляет собой -C1-6 алкил(например этил, 1-метилэтил, 2-метилпропил), в частности, 1-метилэтил или 2-метилпропил. В случае другого варианта осуществления изобретения R1 представляет собой -СН 2-С 3-7 циклоалкил(например циклопропилметил), где циклоалкильная группа необязательно замещена С 1-3 алкилом. Более конкретно, R1 представляет собой незамещенный -СН 2-С 3-7 циклоалкил, в частности циклопропилметил. В случае другого варианта осуществления изобретения X представляет собой связь или -СН 2-. Более конкретно, X представляет собой связь. В одном варианте осуществления изобретения R2 представляет собой -арил, -арил-гетероциклил,-арил-гетероарил, -гетероарил-гетероциклил и -гетероциклил-гетероарил. В случае более конкретного варианта осуществления изобретения арильные, гетероарильные и гетероциклильные группы R2 могут необязательно быть замещены одним или более заместителями (например 1, 2 или 3),которые могут быть одинаковыми или различными и которые могут быть выбраны из группы, состоящей из галогена, гидрокси, циано, нитро, =O, C1-6 алкила, галогенС 1-6 алкила, -O-галогенС 1-6 алкила, -O-С 1-6 алкила, -SO2R4,-CONR4R5, -NR4COR5, -NR4SO2R5 или -SO2NR4R5. Даже более конкретно, заместители у групп арила, гете-2 013600 роарила или гетероциклила R2 выбирают из галогена, гидрокси, циано, нитро, =O, C1-6 алкила, -O-C1-6 алкила, галогенС 1-6 алкила, -О-галогенС 1-6 алкила и -CONR4R5. В одном варианте осуществления изобретения R4, R5 и R6 независимо выбирают из водорода и C1-6 алкила. В случае более конкретного варианта осуществления изобретения R4, R5 и R6 независимо выбирают из водорода и C1-3 алкила. В других осуществлениях изобретения R2 представляет собой -арил (например фенил), необязательно замещенный одним или более заместителями (например 1, 2 или 3), такими как -CONR4R5 (например -CONH2, -CONHMe, -CONMe2), -SO2R4 (например, -SO2Me), -NR4SO2R5 (например, -NHSO2Me),циано или галоген (например, бром);-арил-гетероциклил (например, фенилпирролидинил, фенилоксазолидинил, фенилимидазолидинил,фенилморфолинил, фенилпиперидинил), необязательно замещенный по группе гетероциклила одним или более заместителями (например, 1, 2 или 3), такими как группы =O и C1-6 алкил (например, метил);-арил-гетероарил (например фенилоксадиазолил), необязательно замещенный одним или более заместителями (например, 1, 2 или 3), такими как -C1-6 алкил (например, метил);-гетероарил-гетероциклил (например пиридинил-пирролидинил), необязательно замещенный по группе гетероциклила одним или более заместителями (например 1, 2 или 3), такими как группы =O; или-гетероциклил-гетероарил (например липеридинил-пиридинил), необязательно замещенный одним или более заместителями (например 1, 2 или 3) , такими как -C1-6 алкил (например, метил). В вариантах осуществления изобретения, где R2 представляет собой -арил-гетероциклил или-гетероарил-гетероциклил и группа гетероциклила представляет собой содержащую азот группу гетероциклила, группа гетероциклила может быть связана с арилом или гетероарилом через атом азота. В более конкретном варианте осуществления изобретения R2 представляет собой-арил (например фенил), необязательно замещенный одним или более заместителями (например 1, 2 или 3), такими как -CONR4R5 (например -CONH2, -CONHMe, -CONMe2), -SO2R4 (например, -SO2Me),-NR4SO2R5 (например, -NHSO2Me) , циано или галоген (например бром);-арил-гетероциклил (например, фенилпирролидин-1-ил, фенил-1,3-оксазолидин-3-ил, фенилимидазолидин-3-ил, фенил-морфолин-4-ил, фенилпиперидин-1-ил), необязательно замещенный по группе гетероциклила одним или более (например 1, 2 или 3) заместителями, такими как группы =O (например -фенил-1-пирролидин-2-он, -фенил-3-(1,3-оксазолидин-2-он), -фенил-3-имидазолидин-2-он,-фенил-3-имидазолидин-2,4-дион) и -C1-6 алкил (например, метил);-арил-гетероарил (например фенил-1,2,4-оксадиазол-5-ил), необязательно замещенный одним или более заместителями (например 1, 2 или 3), такими как -C1-6 алкил (например, метил);-гетероарил-гетероциклил (например, 2-(пирролидин-1-ил)пиридин-5-ил), необязательно замещенный по группе гетероциклила одним или более заместителями (например 1, 2 или 3), такими как группы-гетероциклил-гетероарил (например 1-(пиридин-3-ил)-пиперидин-4-ил), необязательно замещенный одним или более заместителями (например 1, 2 или 3), такими как -С 1-6 алкил (например, метил). Более конкретно, R2 представляет собой-арил (например фенил), необязательно замещенный одним или более заместителями (например 1, 2 или 3), такими как -CONR4R5 (например -CONH2, -CONHMe, -CONMe2), -SO2R4 (например, -SO2Me),NR4SO2R5 (например -NHSO2Me) , циано или галоген (например, бром);-арил-гетероциклил (например, фенилпирролидин-1-ил, фенил-1,3-оксазолидин-3-ил, фенилимидазолидин-3-ил, фенилморфолин-4-ил, фенилпиперидин-1-ил), необязательно замещенный по группе гетероциклила одним или более (например, 1, 2 или 3) заместителями, такими как группы =O (например-гетероарил-гетероциклил (например 2-(пирролидин-1-ил)пиридин-5-ил), необязательно замещенный по группе гетероциклила одним или более заместителями (например, 1, 2 или 3), такими как группы-арил-гетероциклил (например, фенилпирролидин-1-ил, фенил-1,3-оксазолидин-3-ил, фенилимидазолидин-3-ил, фенилморфилин-4-ил, фенилпиперидин-1-ил), необязательно замещенный по группе гетероциклила одним или более (например, 1, 2 или 3) заместителями, такими как группы =O (например,-фенил-1-пирролидин-2-он, -фенил-3-(1,3-оксазолидин-2-он), -фенил-3-имидазолидин-2-он, -фенил-3 имидазолидин-2,4-дион) и C1-6 алкил (например, метил); или-гетероарил-гетероциклил (например 2-(пирролидин-1-ил)пиридин-5-ил), необязательно замещенный по группе гетероциклила одним или более заместителями (например, 1, 2 или 3), такими как группы=O (например 2-(N-пирролидин-2-он)пиридин-5-ил). В одном аспекте настоящее изобретение обеспечивает соединение формулы (I) или его фармацевтически приемлемую соль или сольват, гдеR1 представляет собой -C1-6 алкил, -С 3-7 циклоалкил или -СН 2-С 3-7 циклоалкил, где указанные циклоалкильные группы могут необязательно быть замещены C1-3 алкилом;X представляет собой связь или -СН 2-,R2 представляет собой -арил, -арил-гетероарил, арил-гетероарил, гетероарил-гетероциклил и-гетероциклил-гетероарил; где указанные группы арила, гетероарила и гетероциклила R2 могут необязательно быть замещены одним или более заместителями (например, 1, 2 или 3), которые могут быть одинаковыми или различными и которые могут быть выбраны из группы, состоящей из галогена, гидрокси, циано, нитро, =O, C1-6 алкила, галогенС 1-6 алкила, -О-галогенС 1-6 алкила, -O-C1-6 алкила, -SO2R4, -CONR4R5, -NR4COR5,-NR4SO2R5 или -SO2NR4R5; и где R4 и R5 независимо выбирают из водорода и C1-6 алкила. В одном варианте осуществления указанного аспекта изобретения R1 представляет собой -С 3-7 циклоалкил (например, циклобутил, циклопентил или циклогексил), в частности ненасыщенный циклобутил. В случае альтернативного варианта осуществления изобретения R1 представляет собой -C1-6 алкил(например, этил, 1-метилэтил, 2-метилпропил), в частности 1-метилэтил или 2-метилпропил. В случае другого варианта осуществления указанного аспекта изобретения R1 представляет собой-СН 2-С 3-7 циклоалкил, в частности, циклопропилметил. В случае одного варианта осуществления указанного аспекта группы арила, гетероарила и гетероциклила R2 могут быть необязательно замещены одним или более заместителями (например, 1, 2 или 3),которые могут быть одинаковыми или различными и которые могут быть выбраны из группы, состоящей из галогена, гидрокси, циано, нитро, =O, С 1-6 алкила, -O-С 1-6 алкила, галогенС 1-6 алкила, -O-галогенС 1-6 алкила и -CONR4R5. В случае одного варианта осуществления указанного аспекта R4, R5 и R6 независимо выбирают из водорода и C1-6 алкила. В другом варианте осуществления указанного аспекта R2 представляет собой-арил (например, фенил), необязательно замещенный одним или более заместителями (например 1,2 или 3), такими как -CONR4R5 (например, -CONH2, -CONHMe, -CONMe2), -SO2R4 (например, -SO2Me), NR4SO2R5 (например, -NHSO2Me), циано или галоген (например, бром);-арил-гетероциклил (например, фенилпирролидинил, фенилоксазолидинил, фенилимидазолидинил,фенилморфолинил, фенилпиперидинил), необязательно замещенный по группе гетероциклила одним или более (например 1, 2 или 3) заместителями, такими как группы =O и C1-6 алкил (например, метил);-арил-гетероарил (например фенилоксадиазолил), необязательно замещенный одним или более заместителями (например, 1, 2 или 3), такими как -C1-6 алкил (например, метил);-гетероарил-гетероциклил (например пиридинил-пирролидинил), необязательно замещенный по группе гетероциклила одним или более заместителями (например, 1, 2 или 3), такими как группы =O; или-гетероциклил-гетероарил (например пиперидинил-пиридинил), необязательно замещенный одним или более заместителями (например, 1, 2 или 3), такими как -C1-6 алкил (например, метил). В случае вариантов осуществления, где R2 представляет собой -арил-гетероциклил или -гетероарилгетероциклил и группа гетероциклила представляет собой содержащую азот группу гетероциклила,группа гетероциклила может быть связана с арилом или гетероарилом через атом азота. В более конкретном варианте осуществления указанного аспекта R2 представляет собой-арил (например, фенил), необязательно замещенный одним или более заместителями (например 1,2 или 3), такими как -CONR4R5 (например, -CONH2, -CONHMe, -CONMe2), -SO2R4 (например, -SO2Me),NR4SO2R5 (например, -NHSO2Me), циано или галоген (например, бром);-арил-гетероциклил (например, фенилпирролидин-1-ил, фенил-1,3-оксазолидин-3-ил, фенилимидазолидин-3-ил, фенилморфолин-4-ил, фенилпиперидин-1-ил), необязательно замещенный по группе гетероциклила одним или более (например, 1, 2 или 3) заместителями, такими как группы =O (например,-фенил-1-пирролидин-2-он, -фенил-3-(1,3-оксазолидин-2-он), -фенил-3-имидазолидин-2-он, -фенил-3 имидазолидин-2,4-дион) и -C1-6 алкил (например, метил);-арил-гетероарил (например, фенил-1,2,4-оксадиазол-5-ил), необязательно замещенный одним или более заместителями (например, 1, 2 или 3), такими как -C1-6 алкил (например, метил);-гетероарил-гетероциклил (например, 2-(пирролидин-1-ил)пиридин-5-ил), необязательно замещенный по группе гетероциклила одним или более заместителями (например 1, 2 или 3), такими как группы-гетероциклил-гетероарил (например 1-(пиридин-3-ил)пиперидин-4-ил), необязательно замещенный одним или более заместителями (например, 1, 2 или 3), такими как -C1-6 алкил (например, метил). Более конкретно, R2 представляет собой -арил (например, фенил), необязательно замещенный одним или более заместителями (например, 1, 2 или 3), такими как -CONR4R5 (например, -CONH2,-CONHMe, -CONMe2), -SO2R4 (например, -SO2Me), NR4SO2R5 (например, -NHSO2Me), циано или галоген-арил-гетероциклил (например, фенилпирролидин-1-ил, фенил-1,3-оксазолидин-3-ил, фенилимидазолидин-3-ил, фенилморфолин-4-ил, фенилпиперидин-1-ил), необязательно замещенный по группе гетероциклила одним или более (например 1, 2 или 3) заместителями, такими как группы =O (например -4 013600 фенил-1-пирролидин-2-он, -фенил-3-(1,3-оксазолидин-2-он), -фенил-3-имидазолидин-2-он, -фенил-3 имидазолидин-2,4-дион) и -С 1-6 алкил (например, метил); или-гетероарил-гетероциклил (например 2-(пирролидин-1-ил)пиридин-5-ил), необязательно замещенный по группе гетероциклила одним или более заместителями (например, 1, 2 или 3), такими как группы-арил-гетероциклил (например, фенилпирролидин-1-ил, фенил-1,3-оксазолидин-3-ил, фенилимидазолидин-3-ил, фенилморфолин-4-ил, фенилпиперидин-1-ил), необязательно замещенный по группе гетероциклила одним или более (например 1, 2 или 3) заместителями, такими как группы =O (например фенил-1-пирролидин-2-он, -фенил-3-(1,3-оксазолидин-2-он), -фенил-3-имидазолидин-2-он, -фенил-3 имидазолидин-2,4-дион) и -C1-6 алкил (например, метил); или-гетероарил-гетероциклил (например 2-(пирролидин-1-ил)пиридин-5-ил), необязательно замещенный по группе гетероциклила одним или более заместителями (например, 1, 2 или 3), такими как группы=O (например 2-(N-пирролидин-2-он)пиридин-5-ил). В случае более конкретного аспекта настоящее изобретение обеспечивает соединение формулы (I) или его фармацевтически приемлемую соль или сольват, гдеR2 представляет собой -арил, -арил-гетероциклил, -арил-гетероарил, -гетероарил-гетероциклил и гетероциклил-гетероарил; где указанные группы арила, гетероарила и гетероциклила R2 могут необязательно быть замещены одним или более заместителями (например, 1, 2 или 3), которые могут быть одинаковыми или различными и которые могут быть выбраны из группы, состоящей из галогена, гидрокси, циано, нитро, =O, C1-6 алкила, галогенС 1-6 алкила, -O-галогенС 1-6 алкила, -O-C1-6 алкила, -SO2R4, -CONR4R5, -NR4COR5, NR4SO2R5 или -SO2NR4R5; и где R4 и R5 независимо выбирают из водорода и C1-6 алкила. В случае другого аспекта настоящее изобретение обеспечивает соединение формулы (I) или его фармацевтически приемлемую соль или сольват, гдеR1 представляет собой незамещенный -С 3-7 циклоалкил;R2 представляет собой -арил, -арил-арил, -арил-гетероарил, -арил-гетероциклил, -гетероарил,-гетероарил-арил, -гетероарил-гетероарил, -гетероарил-гетероциклил, -гетероциклил, -гетероциклиларил, -гетероциклил-гетероарил или -гетероциклил-гетероциклил; где указанные группы арила, гетероарила и гетероциклила R2 могут необязательно быть замещены одним или более заместителями (например 1, 2 или 3), которые могут быть одинаковыми или различными и которые могут быть выбраны из группы, состоящей из галогена, гидрокси, циано, нитро, =O, C1-6 алкила, C1-6 алкокси, C1-6 галогенС 1-6 алкила, галогенС 1-6 алкокси и -CONR4R5; и где R4 и R5 независимо выбирают из водорода и С 1-3 алкила. В случае другого аспекта настоящее изобретение обеспечивает соединение формулы (Ia) или его фармацевтически приемлемую соль или сольватR1 представляет собой -C1-6 алкил, -С 3-7 циклоалкил или -СН 2-С 3-7 циклоалкил; А и В независимо представляют собой СН или N;R7 представляет собой водород, гидрокси, галоген, циано, нитро, C1-6 алкил, галогенС 1-6 алкил, -ОгалогенС 1-6 алкил, -O-С 1-6 алкил, -NR4aR5a, -CONR4aR5a, -NR4aCOR5a, -SO2R4a, -NR4aSO2R5a или -SO2NR4aR5a,где R4a и R5a независимо представляют собой водород или C1-6 алкил, или где NR4aR5a может представлять собой содержащую азот группу гетероциклила, которая может необязательно быть замещена одним или более (например, 1, 2 или 3) заместителями, независимо выбранными из =O и C1-3 алкила;n представляет собой 0 или 1. В одном варианте осуществления изобретения R представляет собой -С 3-7 циклоалкил (например,циклобутил, циклопентил или циклогексил), в частности ненасыщенный циклобутил. В случае альтернативного варианта осуществления изобретения R1 представляет собой -С 1-6 алкил-5 013600 В случае альтернативного варианта осуществления изобретения R1 представляет собой -СН 2-С 37 циклоалкил, в частности, циклопропилметил. В одном варианте осуществления изобретения А представляет собой N и В представляет собой CH. В случае другого варианта осуществления изобретения А и В - оба представляют собой СН. В одном варианте осуществления изобретения R7 представляет собой водород, галоген, циано, C1-6 алкил, галогенС 1-6 алкил, -O-галогенС 1-6 алкил, -O-С 1-6 алкил, -NR4aR5a, -CONR4aR5a, -SO2R4a или-NR4aSO2R5a, где R4a и R5a независимо представляют собой водород или C1-6 алкил или где NR4aR5a представляет собой содержащую азот группу гетероциклила, которая может необязательно быть замещена одним или более (например, 1, 2 или 3) заместителями, независимо выбранными из =O и C1-3 алкила. В случае более конкретного варианта осуществления изобретения R7 представляет собой -NR4aR5a или -CONR4aR5a, где R4a и R5a независимо представляют собой водород или C1-6 алкил или где NR4aR5a представляет собой содержащую азот группу гетероциклила, которая может необязательно быть замещена одним или более (например, 1, 2 или 3) заместителями, независимо выбранными из =O и C13 алкила. В случае более конкретного варианта осуществления изобретения R4a и R5a независимо представляют собой водород или C1-3 алкил. В другом конкретном варианте осуществления изобретения NR4aR5a представляет собой содержащую азот группу гетероциклила, которая может необязательно быть замещена одним или более (например, 1, 2 или 3) заместителями, независимо выбранными из =O и C1-3 алкила. В еще более конкретном варианте осуществления изобретения R7 представляет собой содержащую азот группу гетероциклила (например, NR4aR5a), например группу пирролидинила, имидазолидинила,оксазолидинила, пиперидинила, морфолинила, необязательно замещенную одним или более (например,1, 2 или 3) заместителями, независимо выбранными из =O и С 1-3 алкила. Наиболее конкретно, R7 представляет собой пирролидинил, имидазолидинил или оксазолидинил,необязательно замещенный одним или более (например, 1, 2 или 3) заместителями, независимо выбранными из =O и С 1-3 алкила (например, -N-пирролидин-2-он, -N-оксазолидин-2-он или 3-метилимидазолидин-2-он). В одном варианте осуществления изобретения n представляет собой 0. Соединения в соответствии с изобретением включают примеры Е 1-Е 46, представленные ниже, или их фармацевтически приемлемые соли или сольваты. Более конкретно, соединения в соответствии с изобретением включают: 1-[5-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)-2-пиридинил]-2 пирролидинон; 1-[4-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)фенил]-2-пирролидинон; 1-4-[6-метилэтил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]фенил-2-пирролидинон; 1-[4-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)фенил]-3-метил-2 имидазолидинон или 3-[4-(6-циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)фенил]-1,3-оксазолидин-2-он,или их фармацевтически приемлемую соль или сольват. В силу их потенциального применения в медицине соли соединений формулы (I) предпочтительно являются фармацевтически приемлемыми. Фармацевтически приемлемые соли присоединения кислоты могут быть получены при реакции соединения формулы (I) с подходящей неорганической или органической кислотой (такой как бромоводородная, хлороводородная, серная, азотная, фосфорная, янтарная, малеиновая, муравьиная, уксусная, пропионовая, фумаровая, лимонная, винная, молочная, бензойная, салициловая, глутаминовая, аспарагиновая, п-толуолсульфоновая, бензолсульфоновая, метансульфоновая, этансульфоновая, нафталенсульфоновая, такая как 2-нафталенсульфоновая или гексановая кислота), необязательно в подходящем растворителе, таком как органический растворитель, с получением соли, которая может быть выделена путем кристаллизации и фильтрования. Фармацевтически приемлемые соли присоединения кислоты соединения формулы (I) могут содержать или представлять собой, например, соль гидробромид, гидрохлорид,сульфат, нитрат, фосфат, сукцинат, малеат, формиат, ацетат, пропионат, фумарат, цитрат, тартрат, лактат, бензоат, салицилат, глутамат, аспартат, п-толуолсульфонат, бензолсульфонат, метансульфонат, этансульфонат, нафталенсульфонат (например, 2-нафталенсульфонат) или гексаноат. Соединения свободные основания могут быть превращены в соответствующие гидрохлоридные соли путем обработки в метаноле или дихлорметане раствором хлороводорода в диэтиловом эфире с последующим упариванием растворителей. В объем изобретения также включены все возможные стехиометрические и нестехиометрические формы солей соединений формулы (I), включая гидраты и сольваты. Некоторые соединения формулы (I) способны существовать в виде стереоизомеров. Понятно, что изобретение также охватывает все геометрические и оптические изомеры указанных соединений и их смеси, включая рацематы. Различные стереоизомерные формы могут быть разделены одна от другой методами, известными из области техники (например, разделение с помощью хиральной ВЭЖХ), или лю-6 013600 бой данный изомер может быть получен с помощью стереоспецифического или асимметрического синтеза. Изобретение также охватывает любые таутомерные формы и их смеси. Настоящее изобретение также обеспечивает способ получения соединения формулы (I) или его фармацевтически приемлемой соли, где способ включает:(а) взаимодействие соединения формулы (II) где X и R2 определены выше, с соединением формулы R1'=O, где R1' представляет собой С 1-6 алкил,С 3-7 циклоалкил или -СН-С 3-7 циклоалкил, где циклоалкильные группы могут необязательно быть замещены C1-3 алкилом; или(b) взаимодействие соединения формулы (II) где X и R2 определены выше, с соединением формулы R1-L2, где R1 определен выше, и где L2 является подходящей уходящей группой, такой как галоген (например, иод); или(с) взаимодействие соединения формулы (VI)(d) взаимодействие соединения формулы (VI) где R1 определен выше, с соединением формулы R2-X-L1, где R2 определен выше, где X представляет собой связь, и где L1 является подходящей уходящей группой, такой как галоген (например, бром); или(е) взаимодействие соединения формулы (VI) где R1 определен выше, с соединением формулы R2-X-L1, где R2 определен выше, где X представляет собой -СН 2- и где L является подходящей уходящей группой, такой как галоген (например бром); или(f) снятие защитных групп соединения формулы (I), которое является защищенным; или(g) интерконверсию одного соединения формулы (I) в другое. Процесс (а) обычно включает применение восстановительных условий (таких как обработка боргидридом, например триацетоксиборгидридом натрия), необязательно в присутствии кислоты, такой как уксусная кислота, в подходящем растворителе, таком как дихлорметан, при подходящей температуре,такой как комнатная температура. Процесс (b) имеет место в подходящем растворителе, таком как этанол, необязательно в присутствии основания, такого как карбонат калия, при подходящей температуре, такой как температура кипения. Процесс (с) обычно включает применение соли меди, такой как ацетат меди(II), в подходящем растворителе, таком как дихлорметан, при подходящей температуре, например комнатной температуре, необязательно в присутствии молекулярных сит и необязательно в присутствии основания, например пиридина. Если R2 представляет собой группу арила, арил-арила, арил-гетероарила, арил-гетероциклила, гетероарила, гетероарил-арила, гетероарил-гетероарила или гетероарил-гетероциклила, процесс (d) обычно включает использование подходящей каталитической системы, например иодида меди(I) с диаминовым лигандом, таким как транс-1,2-диаминоциклогексан, в присутствии подходящего основания, например фосфата калия, в подходящем растворителе, например диоксане, при подходящей температуре, такой как-7 013600 нагревание при кипении. Если R2 представляет собой группу гетероциклила, гетероциклил-арила, гетероциклил-гетероарила или гетероциклил-гетероциклила, процесс (d) обычно включает применение основания, такого как гидрид натрия, в подходящем растворителе, таком как диметилформамид, при подходящей температуре, такой как нагревание при 60-70 С. Процесс (е) обычно включает применение основания, такого как гидрид натрия, в подходящем растворителе, таком как диметилформамид, при подходящей температуре, такой как нагревание при 6070 С. В случае процесса (f), примеры защитных групп и способы их удаления могут быть найдены у T.W.Greene Protective Groups in Organic Synthesis (J. Wiley and Sons, 1991). Подходящие защитные группы амина включают сульфонил (например, тозил), ацил (например, ацетил, 2',2',2'-трихлорэтоксикарбонил,бензилоксикарбонил или трет-бутоксикарбонил) и арилалкил (например бензил), которые могут быть удалены путем гидролиза (например, используя кислоту, такую как хлороводородная кислота в диоксане или трифторуксусная кислота в дихлорметане) или восстановительно (например, гидрогенолиз бензильной группы или восстановительное удаление 2',2',2'-трихлорэтоксикарбонильной группы с применением цинка в уксусной кислоте) в зависимости от ситуации. Другие подходящие защитные группы амина включают трифторацетил (-COCF3), который может быть удален катализируемым основанием гидролизом, или связанную с твердофазным полимером бензильную группу, как, например, связанную с полимером Меррифильда 2,6-диметоксибензильную группу (линкер Эллмана), которые могут быть удалены путем катализируемого кислотой гидролиза, например трифторуксусной кислотой. Процесс (g) может осуществляться с применением обычных методов интерконверсии, таких как эпимеризация, окисление, восстановление, алкилирование, нуклеофильное или электрофильное ароматическое замещение, гидролиз сложного эфира или нитрила, формирование амидной связи или опосредованные металлами реакции сочетания. Примеры опосредованных переходными металлами реакций сочетания, применяемых в качестве методов интерконверсии, включают следующие: катализируемые палладием реакции сочетания между органическими электрофилами, такими как арилгалогениды, и металлоорганическими реагентами, например бороновыми кислотами (реакции кросс-сочетания Сузуки); катализируемые палладием реакции аминирования и амидирования между органическими электрофилами, такими как арилгалогениды, и нуклеофилами, такими как амины и амиды; катализируемые медью реакции амидирования между органическими электрофилами (такими как арилгалогениды) и нуклеофилами, такими как амиды; опосредованные медью реакции сочетания между фенолами и бороновыми кислотами. Соединения формулы (II), где R2 является группой арила, арил-арила, арил-гетероарила, арилгетероциклила, гетероарила, гетероарил-арила, гетероарил-гетероарила или гетероарил-гетероциклила иX является связью, может быть получено по следующей схеме: где Р 1 представляет собой подходящую защитную группу, такую как бензил, X представляет собой связь, и L1 представляет собой подходящую уходящую группу, например бром. Когда Р 1 представляет собой бензил, стадия (i) включает взаимодействие соединения формулы (VII) с бензальдегидом. Реакция обычно включает применение восстановительных условий (таких как обра-8 013600 ботка боргидридом, например триацетоксиборгидридом натрия), необязательно в присутствии основания(например, триэтиламина) в подходящем растворителе, таком как дихлорметан, при подходящей температуре, такой как между 0 С и комнатной температурой. Стадия (ii) обычно имеет место а присутствии хлорокиси фосфора и диметилформамида при подходящей температуре, такой как между 0 С и комнатная температура. Стадия (iii) обычно включает реакцию циклизации с гидразином (например, гидразингидратом) в подходящем растворителе, например этаноле, при подходящей температуре, например кипении, с необязательным добавлением каталитических количеств кислоты, такой как водная хлороводородная кислота. Следует принимать во внимание, что до реакции циклизации соединение формулы (II) может подвергаться реакции с гидроксиламина хлоргидратом в подходящем растворителе, таком как этанол, при подходящей температуре, такой как комнатная температура, с образованием соответствующего оксима. Стадия (iv) обычно включает применение подходящей каталитической системы, например иодида меди(I) с диаминовым лигандом, таким как транс-1,2-диаминоциклогексан, в присутствии подходящего основания, например фосфата калия, в подходящем растворителе, например диоксане, при подходящей температуре, например, нагревание до кипения, как описано в процессе (d). Стадия (v) представляет собой реакцию удаления защитных групп. Когда Р 1 представляет собой бензил, стадия (v) может осуществляться с применением подходящего катализатора, например палладия на угле, в подходящем растворителе, таком как этанол, под давлением водорода, например одной атмосфере водорода. Когда Р 1 представляет собой 1,1-диметилэтилкарбоксилат, соединение формулы (IV) может, альтернативно, быть получено по следующей схеме: Стадия (i) обычно включает реакцию диизопропиламида лития и этилформиата в подходящем растворителе, таком как тетрагидрофуран, при подходящей температуре, такой как комнатная температура,с последующей реакцией циклизации с гидразином (например, гидразингидратом) необязательно в присутствии кислоты, в подходящем растворителе, таком как этанол, при подходящей температуре, например кипении. Соединения формулы (II) могут быть получены из соединений формулы (IV), полученных с применением указанной защитной группы. Однако, как будет очевидно квалифицированному читателю, когда Р 1 представляет собой 1,1-диметилэтилкарбоксилат, реакция снятия защитной группы может осуществляться при обработке трифторуксусной кислотой в дихлорметане или 4M. HCl в диоксане при подходящей температуре, такой как комнатная температура. Соединения формулы (V), где R2 является группой арила, арил-арила, арил-гетероарила, арилгетероциклила, гетероарила, гетероарил-арила, гетероарил-гетероарила или гетероарил-гетероциклила иX является связью, может быть получено по следующей схеме: где Р 1 представляет собой подходящую защитную группу, такую как бензил, и группа R2-X-B(OH)2 представляет собой арил или гетероарилбороновую кислоту (например, X представляет собой связь). Стадия (i) обычно включает применение соли меди, такой как ацетат меди(II), в подходящем растворителе, таком как дихлорметан, при подходящей температуре, например комнатной температуре, необязательно в присутствии молекулярных сит и необязательно в присутствии основания, например пиридина, как описано ранее для процесса (с). Соединения формулы (II), где R2 представляет собой группу гетероциклила, гетероциклил-арила,гетероциклил-гетероарила или гетероциклил-гетероциклила, и X представляет собой связь, могут быть получены как описано ранее, используя соединения формулы (V), где R2 представляет собой группу гетероциклила, гетероциклил-арила, гетероциклил-гетероарила или гетероциклил-гетероциклила, и X представляет собой связь. Соединения формулы (V), где R2 представляет собой группу гетероциклила, гетероциклил-арила,гетероциклил-гетероарила или гетероциклил-гетероциклила и X представляет собой связь, могут быть получены по следующей схеме: где Р 1 представляет собой подходящую защитную группу, такую как бензил, X представляет собой связь, и L1 представляет собой уходящую группу, такую как бром. Стадия (i) обычно включает применение основания, такого как гидрид натрия, в подходящем растворителе, таком как диметилформамид, при подходящей температуре, например при нагревании при 6070 С, как описано в процессе (d). Соединения формулы (II), где R2 является группой арила, арил-арила, арил-гетероарила, арилгетероциклила, гетероарила, гетероарил-арила, гетероарил-гетероарила или гетероарил-гетероциклила иX является -СН 2-, могут быть получены, как описано ранее, используя соединения формулы (V), где R2 является группой -арила, -арил-арила, -арил-гетероарила, -арил-гетероциклила, -гетероарила,-гетероарил-арила, -гетероарил-гетероарила, -гетероарил-гетероциклила, -гетероциклила, -гетероциклиларила, -гетероциклил-гетероарила или -гетероциклил-гетероциклила, и X является группой СН 2-. Соединения формулы (V) , где R2 является группой -арила, -арил-арила, -арил-гетероарила, -арилгетероциклила, -гетероарила, -гетероарил-арила, -гетероарил-гетероарила, -гетероарил-гетероциклила,-гетероциклила, -гетероциклил-арила, -гетероциклил-гетероарила или -гетероциклил-гетероциклила и X является группой -СН 2-, могут быть получены по следующей схеме: где Р 1 представляет собой подходящую защитную группу, такую как бензил, X представляет собой-СН 2-, и L1 представляет собой уходящую группу, например бром. Стадия (i) обычно включает применение основания, такого как гидрид натрия, в подходящем растворителе, таком как диметилформамид, при подходящей температуре, например при нагревании при 6070 С, как описано в процессе (е). Соединения формулы (V), где R2 и X определены ранее, могут, альтернативно, быть получены по следующей схеме: где Р 1 представляет собой подходящую защитную группу, такую как 1,1-диметилэтилкарбоксилат,где R2 и X определены ранее, и где -OTf представляет собой трифлатную группу. Когда R2-X-HN-NH2 представляет собой гидрохлоридную соль, стадия (i) обычно включает применение основания, такого как триэтиламин, в подходящем растворителе, таком как трет-бутанол, и подходящей температуре, например при кипении. Стадия (ii) включает реакцию с диизопропилэтиламином и 1,1,1-трифтор-N-фенил-N[(трифторметил)сульфонил]метансульфонамидом в подходящем растворителе, таком как дихлорметан,при подходящей температуре, например при кипении. Стадия (iii) включает обработку основанием (например, триэтиламином) в присутствии подходящего катализатора, такого как палладий на угле, в подходящем растворителе, таком как смесь этилацетата и метанола, при подходящей температуре, такой как комнатная температура, под давлением водорода, например одной атмосфере водорода. Соединения формулы (VI) могут быть получены по следующей схеме, где Р 1 представляет собой подходящую защитную группу, такую как бензил: Стадия (i) является реакцией удаления защитной группы. Когда Р 1 является бензилом, стадия (i) может осуществляться с применением подходящего катализатора, например палладия на угле, в подходящем растворителе, таком как этанол, под давлением водорода, например одной атмосфере водорода. Стадия (ii) может проводиться, как описано ранее в случае процесса (а). Соединения формулы (VII) и (XI) могут быть получены, как описано в Synthetic Communications,1992, 22(9), 1249-58. Соединения формулы (III) могут быть получены в соответствии с DE3105858. Соединения формулы (X), R1'=O, R1-L2, R2-X-B(OH)2 (где X представляет собой связь), R2-X-L1 (гдеX представляет собой связь или -СН 2-) и R2-X-HN-NH2 (где X и R2 определены ранее) либо являются коммерчески доступными, либо могут быть получены из коммерчески доступных соединений с применением стандартной методологии. Соединения формулы (I) и их фармацевтически приемлемые соли обладают аффинитетом и являются антагонистами и/или обратными агонистами рецептора гистамина Н 3 и, как полагают, имеют потенциальное применение при лечении неврологических заболеваний, включая болезнь Альцгеймера, деменцию (включая деменцию с тельцами Леви и васкулярную деменцию), возрастную дисфункцию памяти, легкое когнитивное нарушение, когнитивное расстройство, эпилепсию, боль неврологического происхождения, включая невралгию, неврит и боль в спине и боль при воспалительном процессе, включая остеоартрит, ревматоидный артрит, боль при остром воспалительном процессе и боль в спине, мигрень,болезнь Паркинсона, рассеянный склероз, инсульт и нарушение сна (включая нарколепсию и недостаток сна, связанный с болезнью Паркинсона); психические расстройства, включая шизофрению (в частности,когнитивное расстройство при шизофрении), синдром дефицита внимания с гиперактивностью, депрессию, беспокойство и пристрастие; и другие заболевания, включая ожирение и желудочно-кишечные расстройства. Следует также принять во внимание, что соединения формулы (I), как ожидают, являются селективными по отношению к гистаминовым рецепторам Н 3 по сравнению с другими подтипами гистаминовых рецепторов, таких как рецептор гистамина H1. В общем, соединения по изобретению могут быть по меньшей мере в 10 раз более селективными для Н 3 относительно H1, например по меньшей мере в 100 раз более селективными. Таким образом, изобретение также обеспечивает соединение формулы (I) или его фармацевтически приемлемую соль для применения в качестве терапевтического вещества при лечении или профилактике упомянутых выше расстройств, в частности, когнитивных расстройств при заболеваниях, таких как болезнь Альцгеймера и родственные нейродегенеративные расстройства. Изобретение дополнительно обеспечивает способ лечения или профилактики упомянутых выше расстройств у млекопитающих, включая человека, который включает введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом аспекте изобретение обеспечивает применение соединения формулы (I) или его фармацевтически приемлемой соли при производстве лекарственного средства для применения при лечении упомянутых выше расстройств. В случае использования в терапии соединения формулы (I) обычно составляют в стандартные фармацевтические композиции. Такие композиции могут быть получены с применением стандартных методов. Таким образом, настоящее изобретение дополнительно обеспечивает фармацевтическую композицию для применения при лечении упомянутых ранее расстройств, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Настоящее изобретение дополнительно обеспечивает фармацевтическую композицию, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.- 11013600 Соединения формулы (I) могут применяться в комбинации с другими терапевтическими агентами,например лекарственными средствами, как утверждают, полезными в качестве либо модифицирующей,либо симптоматической терапии болезни Альцгеймера. Подходящими примерами таких других терапевтических агентов могут быть агенты, о которых известно, что они модифицируют холинергическую передачу, такие как антагонисты 5-НТ 6, М 1-агонисты мускарина, M2-антагонисты мускарина или ингибиторы ацетилхолинэстеразы. Когда соединения применяются в комбинации с другими терапевтическими агентами, соединения могут быть введены либо последовательно, либо одновременно любым удобным способом. Таким образом, изобретение обеспечивает, в дополнительном аспекте, комбинацию, содержащую соединение формулы (I) или его фармацевтически приемлемое производное вместе с дополнительным терапевтическим агентом или агентами. Упоминаемые выше комбинации могут удобно быть предоставлены для применения в виде фармацевтических рецептур, и таким образом фармацевтические рецептуры, содержащие комбинации, как определено ранее, вместе с фармацевтически приемлемым носителем или наполнителем, составляют дополнительный аспект изобретения. Индивидуальные компоненты таких комбинаций могут быть введены либо последовательно, либо одновременно в отдельных или комбинированных фармацевтических рецептурах. Когда соединение формулы (I) или его фармацевтически приемлемое производное используют в комбинации со вторым терапевтическим агентом, активным в отношении того же состояния заболевания, доза каждого соединения может отличаться от таковой в случае, когда соединение применяется отдельно. Подходящие дозы могут быть легко оценены специалистом в области техники. Фармацевтическая композиция по изобретению, которая может быть получена путем смешивания,соответственно при температуре окружающей среды и атмосферном давлении, обычно является подходящей для перорального, парентерального или ректального введения и, по существу, может быть в форме таблеток, капсул, жидких пероральных препаратов, порошков, гранул, пастилок, восстановленных порошков, инъецируемых или инфузионных растворов или суспензий, или суппозиториев. В большинстве случаев предпочтительным является пероральное введение композиций. Таблетки и капсулы для перорального введения могут быть в виде единичной дозы и могут содержать традиционные вспомогательные вещества, такие как связующие агенты, наполнители, смазывающие вещества при таблетировании, дезинтеграторы и приемлемые увлажняющие агенты. Таблетки могут быть покрыты в соответствии с методами, хорошо известными в обычной фармацевтической практике. Пероральные жидкие препараты могут быть в виде, например, водной или масляной суспензии,растворов, эмульсий, сиропов или эликсиров, или могут быть в виде сухого продукта для разведения в воде или другом подходящем носителе перед применением. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, эмульгирующие агенты, неводные носители(которые могут включать пищевые масла), консерванты и, если необходимо, традиционные ароматизаторы или консерванты. В случае парентерального введения жидкие стандартные лекарственные формы получают, используя соединение по изобретению или его фармацевтически приемлемую соль и стерильный носитель. Соединение, в зависимости от носителя и концентрации, может быть либо суспендировано, либо растворено в носителе. При получении растворов соединение может быть растворено для инъекции и стерилизовано с помощью фильтра перед заполнением подходящего флакона или ампулы и закупориванием. Преимущественно, вспомогательное вещество, такое как местные анестетики, консерванты и буферные агенты растворяют в носителе. Для увеличения стабильности композиция может быть заморожена после заполнения флакона и вода может быть удалена в вакууме. Парентеральные суспензии получают, по существу, аналогичным образом, за исключением того, что соединение суспендируют в носителе вместо растворения и стерилизация не может сопровождаться фильтрованием. Соединение может быть стерилизовано путем контактирования с этиленоксидом перед суспендированием в стерильном носителе. Преимущественно, поверхностно-активное вещество или увлажняющий агент включают в композицию для облегчения однородного распределения соединения. Композиция может содержать от 0,1 до 99 мас.%, предпочтительно от 10 до 60 мас.% активного вещества, в зависимости от способа введения. Доза соединения, используемая при лечении вышеупомянутых расстройств, будет варьировать обычным образом в соответствии с тяжестью расстройства, массы пациента и других подобных факторов. Однако в соответствии с общими показателями подходящая единичная доза может составлять 0,05-1000 мг, более приемлемо 0,1-200 мг и еще более приемлемо 1,0-200 мг. В одном аспекте подходящая единичная доза может составлять 0,1-50 мг. Такие единичные дозы могут вводиться более одного дня, например два или три дня. Такая терапия может продолжаться в течение нескольких недель или месяцев. Последующие Описания и Примеры иллюстрируют получение соединений по изобретению. Описание 1. 1-(Фенилметил)гексагидро-4 Н-азепин-4-он гидрохлорид (D1) Метод А. Гексагидро-4 Н-азепин-4-он гидрохлорид (10 г, 66,9 ммоль, может быть получен, как описано в Syn- 12013600thetic Communications, 1992, 22(9), 1249-58) суспендировали в дихлорметане (100 мл) и добавляли триэтиламин (9,31 мл, 66,9 ммоль), за которым следовал бензальдегид (68 мл, 0,699 ммоль). Смесь перемешивали под аргоном при комнатной температуре в течение 30 мин, затем охлаждали на льду, во время добавления порциями триацетоксиборгидрид натрия (17 г, 80 ммоль). Смесь перемешивали и позволяли нагреться до комнатной температуры, затем перемешивали в течение 2 ч. Добавляли 2 М раствор гидроксида натрия (80 мл), слои разделяли и водный слой экстрагировали дихлорметаном (2). Объединенные органические экстракты упаривали до половины объема, затем экстрагировали 2 М хлороводородной кислотой (2100 мл) . Водный слой подщелачивали с помощью 50% раствора гидроксида натрия и экстрагировали дихлорметаном (2). Объединенные органические экстракты сушили над сульфатом магния и упаривали, давая указанное в заголовке соединение (D1). 1(1 Н, ушир.с). Метод В. Суспензию гексагидро-4 Н-азепин-4-он гидрохлорида (5 г, 33,4 ммоль, может быть получен, как описано в Synthetic Communications, 1992, 22(9), 1249-58) в дихлорметане (50 мл) обрабатывали бензальдегидом (34 мл, 33,4 ммоль) и триэтиламином (4,66 мл, 33,4 ммоль) и оставляли перемешиваться при комнатной температуре приблизительно 10 мин. Добавляли триацетоксиборгидрид натрия (10,6 г, 50,1 ммоль) и смесь перемешивали при комнатной температуре в течение 4 ч. После указанного времени реакцию гасили 2 М раствором NaOH (50 мл) и экстрагировали дихлорметаном (2200 мл), промывали насыщенным раствором соли, сушили над сульфатом магния, упаривали и очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью 2 М аммиака в метаноле и дихлорметана (0-4%). Соль НС 1 получали, используя 1,1 эквивалента 1 М HCl в диэтиловом эфире, давая указанное в заголовке соединение (D1). МС (ЭС+) т/е 204 [M+Н]+. Описание 2. 1-(Фенилметил)гексагидро-4 Н-азепин-4-он (D2) Гексагидро-4 Н-азепин-4-он гидрохлорид (10 г, 66,9 ммоль, может быть получен, как описано в Synthetic Communications, 1992, 22(9), 1249-58) суспендировали в дихлорметане (100 мл) и добавляли триэтиламин (9,31 мл, 66,9 ммоль), за которым следовал бензальдегид (68 мл, 0,699 ммоль). Смесь перемешивали под аргоном при комнатной температуре в течение 30 мин, затем охлаждали на льду, во время добавления порциями триацетоксиборгидрид натрия (17 г, 80 ммоль). Смесь перемешивали и позволяли нагреться до комнатной температуры, затем перемешивали в течение 2 ч. Добавляли 2 М раствор гидроксида натрия (80 мл), слои разделяли и водный слой экстрагировали дихлорметаном (2). Объединенные органические экстракты упаривали до половины объема, затем экстрагировали 2 М хлороводородной кислотой (2x100 мл). Водный слой подщелачивали с помощью 50% раствора гидроксида натрия и экстрагировали дихлорметаном (2). Объединенные органические экстракты сушили над сульфатом магния и упаривали, давая указанное в заголовке соединение (D2). 1 Н ЯМР (CDCl3)1,82-1,88 (2 Н, м), 2,52-2,55 (2 Н, м), 2,59-2,62 (2 Н, м), 2,71-2,76 (4 Н, м), 3,65 (1 Н,с), 7,23-7,33 (5 Н, м). Описание 3. 5-Хлор-1-(фенилметил)-2,3,6,7-тетрагидро-1 Н-азепин-4-карбальдегид (D3) Метод А. Добавляли к дихлорметану (90 мл) под аргоном диметилформамид (6,4 мл, 8 3,5 ммоль) и охлаждали до 0 С. По каплям добавляли хлорокись фосфора (6,24 мл, 67,05 ммоль) и перемешивали смесь при 0 С в течение 2 ч. К указанной выше смеси добавляли порциями 1-(фенилметил)гексагидро-4 Н-азепин-4 он гидрохлорид (может быть получен, как описано в описании 1, 10 г, 41,72 ммоль) при 0 С в течение 10 мин. Смесь перемешивали при 0 С в течение 45 мин, затем позволяли нагреться до комнатной температуры и перемешивали в течение ночи. Реакцию порциями выливали в ацетат натрия (100 г) в воде (800 мл). Полученную смесь доводили до рН 10 с помощью 2 М раствора гидроксида натрия, затем разделяли. Водный слой экстрагировали дихлорметаном (2) и объединенные органические экстракты промывали насыщенным раствором соли, сушили над сульфатом магния и упаривали с получением указанного в заголовке соединения, которое может использоваться без дополнительной очистки (D3). МС (ES+) m/е 250, 252 [М+Н]+. Метод В. Добавляли к дихлорметану (140 мл) под аргоном диметилформамид (10,11 мл, 132 ммоль) и охлаждали до 0 С. По каплям добавляли хлорокись фосфора (9,87 мл, 106 ммоль) и перемешивали смесь при 0 С в течение 2 ч. 1-(Фенилметил)гексагидро-4 Н-азепин-4-он (может быть получен, как описано в описании 2, 13,4 г, 65,95 ммоль) растворяли в дихлорметане (40 мл) и добавляли по каплям в течение 10 мин к указанной выше смеси при 0 С. Смесь перемешивали при 0 С в течение 45 мин, затем нагревали до комнатной температуры и перемешивали в течение ночи. Реакцию порциями выливали в ацетат натрия(130 г) в воде (1 л). Полученную смесь доводили до рН 10 с помощью 2 М раствора гидроксида натрия,- 13013600 затем разделяли. Водный слой экстрагировали дихлорметаном (2) и объединенные органические экстракты промывали насыщенным раствором соли, сушили над сульфатом магния и упаривали с получением указанного в заголовке соединения, которое может использоваться без дополнительной очистки(D3). МС (ES+) m/е 250, 252 [М+Н]+. Метод С. К раствору диметилформамида (385 мкл, 5 ммоль) в безводном дихлорметане (6 мл) на ледяной бане медленно добавляли хлорокись фосфора (374 мкл, 4 ммоль). Полученную смесь оставляли перемешиваться на ледяной бане в течение 3 ч. Затем добавляли по каплям 1-(фенилметил)гексагидро-4 Н-азепин 4-он гидрохлорид (может быть получен, как описано в описании 1, 600 мг, 2,5 ммоль) и затем реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи. На следующий день смесь медленно добавляли в интенсивно перемешиваемую смесь ацетата натрия (6 г, 73,2 моль) в ледяной воде (60 мл) . Полученную смесь доводили до рН 10 с помощью 2 М NaOH и экстрагировали дихлорметаном (360 мл). Органический слой объединяли и промывали NaHCO3 и насыщенным раствором соли, сушили над MgSO4 и упаривали. Результирующая неочищенная смесь указанного в заголовке соединения может использоваться без дополнительной очистки (D3). МС (ES+) m/е 250 [M+Н]+. Описание 4. Оксим 5-хлор-1-(фенилметил)-2,3,6,7-тетрагидро-1 Н-азепин-4-карбальдегида (D4) Раствор 5-хлор-1-(фенилметил)-2,3,6,7-тетрагидро-1 Н-азепин-4-карбальдегида (может быть получен, как описано в описании 3, 11,6 г, 46,5 ммоль) в этаноле перемешивали с гидроксиламина гидрохлоридом (3,23 г, 46,5 ммоль) при комнатной температуре в течение 72 ч. Этанол удаляли упариванием и остаток распределяли между этилацетатом и насыщенным раствором бикарбоната натрия. Этилацетат промывали водой и насыщенным раствором соли, затем сушили и упаривали, давая указанное в заголовке соединение (D4); МС (ES+) m/е 265 и 267 [М+Н]+. Описание 5. 6-(Фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин (D5) Метод А. К раствору 5-хлор-1-(фенилметил)-2,3,6,7-тетрагидро-1 Н-азепин-4-карбальдегида (может быть получен, как описано в описании 3, 10,4 г, 41,8 ммоль) в этаноле (30 мл) добавляли каталитическое количество 2 М хлороводородной кислоты (5 капель), затем гидразингидрат (2,43 мл, 50,2 ммоль). Полученную смесь нагревали до кипения в течение 48 ч и концентрировали в вакууме. Полученную неочищенную смесь разбавляли водой, подщелачивали с помощью насыщенного раствора бикарбоната натрия и экстрагировали в этилацетат. Экстракты объединяли, промывали насыщенным раствором соли, сушили над сульфатом магния и концентрировали в вакууме. Продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 2M аммиака в метаноле/дихлорметана (2-4%), давая указанное в заголовке соединение (D5). МС (ES+) m/е 288 [M+Н]+. Метод В: 5-Хлор-1-(фенилметил)-2,3,6,7-тетрагидро-1 Н-азепин-4-карбальдегид (может быть получен, как описано в описании 3, предположительно 41,72 ммоль), гидразингидрат (2,23 мл, 4 5,89 ммоль) и 2M хлороводородную кислоту (5 капель) перемешивали в этаноле (100 мл) и нагревали до кипения в течение 76 ч. Растворитель упаривали и остаток распределяли между этилацетатом и водой и подщелачивали путем добавления бикарбоната натрия. Водную фазу экстрагировали этилацетатом и объединенные органические слои промывали насыщенным раствором соли, сушили над сульфатом магния и упаривали. Остаток очищали с помощью флеш-хроматографии, элюируя 2-4% 2 М аммиака в метанол/дихлорметан с получением указанного в заголовке соединения (D5). МС (ES+) т/е 228 [М+Н]+. Метод С. К суспензии оксима 5-хлор-1-(фенилметил)-2,3,6,7-тетрагидро-1 Н-азепин-4-карбальдегида (может быть получен, как описано в описании 4, 400 мг, 1,51 ммоль) в этаноле (8 мл) и 2 М хлороводородной кислоты (4 капли) добавляли гидразингидрат (8 мл). Полученную суспензию нагревали до кипения в течение двух дней. Смесь охлаждали до комнатной температуры и обрабатывали избытком ацетона. Экстрагировали 2100 мл этилацетата. Водный слой подщелачивали с помощью бикарбоната натрия и повторно экстрагировали этилацетатом. Объединенные экстракты сушили, упаривали и растворяли в дихлорметане и наносили на два 10 г SCX-картриджа, элюируя метанолом, затем 2 М аммиака в метаноле. Основные фракции объединяли, упаривали и очищали с помощью колоночной хроматографии, элюируя смесью 2 М аммиака в метаноле и дихлорметаном (0-5%), что давало указанное в заголовке соединение(D5). МС (ES+) m/е 228 [М+Н]+. Метод D. К суспензии оксима 5-хлор-1-(фенилметил)-2,3,6,7-тетрагидро-1 Н-азепин-4-карбальдегида (может быть получен, как описано в описании 4, 200 мг, 0,76 ммоль) в этаноле (2 мл) и хлороводородной кислоты (1 капля) добавляли гидразингидрат (2 мл). Полученную суспензию нагревали до кипения в течение 15 мин и затем в течение ночи. Добавляли дополнительные 2 мл гидразингидрата и кипячение продолжали в течение 1 ч. Позволяли реакционной смеси охладиться, гасили ацетоном, промывали водой и повторно экстрагировали этилацетатом (350 мл). Объединенные экстракты сушили над сульфатом магния и очищали с помощью колоночной хроматографии, элюируя смесью 2 М аммиака в метаноле и дихлор- 14013600 метаном (0-3%), что давало продукт (D5). 1H-ЯМР (MeOD)2,68-2,70 (2 Н, м), 2,78 (4 Н, м), 2,84-2,87 (2 Н, м), 3,80 (2 Н, с), 7,23-7,27 (2 Н, м),7,31-7,34 (2H, м), 7,38-7,40 (2H, м). Метод Е. Раствор 5-хлор-1-(фенилметил)-2,3,6,7-тетрагидро-1 Н-азепин-4-карбальдегида (может быть получен, как описано в описании 3, 10,41 г, 41,8 ммоль) в этаноле (30 мл) и хлороводородной кислоте (5 капель) обрабатывали гидразингидратом (2,43 мл, 50,2 ммоль) и нагревали до кипения в течение ночи. Реакционную смесь упаривали с получением вязкого масла, которое перерастворяли в этаноле (30 мл) и нагревали до кипения в течение 27 ч. После охлаждения до комнатной температуры смесь упаривали,растворяли в воде и этилацетате, подщелачивали с помощью бикарбоната натрия и экстрагировали этилацетатом (3150 мл), Объединенные экстракты промывали насыщенным раствором соли, сушили над сульфатом магния, упаривали и очищали с помощью колоночной хроматографии, элюируя смесью 2 М аммиака в метаноле и дихлорметана (2-4%), что давало продукт (D5). МС (ES+) m/е 228 [М+Н]+. Метод F. Раствор 5-хлор-1-(фенилметил)-2, 3, 6, 7-тетрагидро-1 Н-азепин-4-карбальдегида (может быть получен, как описано в описании 3, 1,7 3 г, 6,95 ммоль) в этаноле (10 мл) обрабатывали гидразингидратом(0,37 мл, 7,64 ммоль) и нагревали до кипения в течение 18 ч и затем дополнительно в течение 2 дней. После охлаждения до комнатной температуры смесь фильтровали и фильтрат упаривали и растворяли в воде. Доводили рН до 8 с помощью бикарбоната натрия с последующей экстракцией этилацетатом. Объединенные экстракты сушили над сульфатом магния, упаривали и очищали с помощью колоночной хроматографии, элюируя смесью 2M аммиака в метаноле и дихлорметана (2-4%), что давало продукт (D5). МС (ES+) m/е 228 [M+Н]+. Метод G. К раствору 5-хлор-1-(фенилметил)-2,3,6,7-тетрагидро-1 Н-азепин-4-карбальдегида (может быть получен, как описано в описании 3, 500 мг, 0,2 ммоль) в этаноле (5 мл) и 2 М HCl (3 капли) медленно добавляли гидразингидрат (106 мкл, 2,2 ммоль). Полученную смесь кипятили под аргоном в течение ночи. На следующий день смесь упаривали досуха, растворяли в 40 мл воды, доводили до рН 8, используя бикарбонат натрия, и экстрагировали 350 мл этилацетата. Органические слои объединяли, затем промывали насыщенным раствором соли и сушили над MgSO4 и упаривали. Полученный сырой остаток очищали с помощью хроматографии на силикагеле, что давало продукт (D5); МС (ES+) m/е 228 [М+Н]+; и 7(фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-с]азепин в виде смеси (85:15). Описание 6. 2,4,5,6,7,8-Гексагидропиразоло[3,4-d]азепина гидрохлорид (D6) 6-(Фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин (может быть получен, как описано в описании 5, 5,52 г, 24,29 ммоль) растворяли в этаноле (70 мл) под аргоном и добавляли 2M хлороводородную кислоту (12,2 мл, 24,4 ммоль), затем 50% влажный катализатор 10% палладий на угле (1 г). Смесь перемешивали в атмосфере водорода в течение 18 ч. Катализатор отфильтровывали и фильтрат упаривали с получением указанного в заголовке соединения (D6); MC (ES+) m/е [М+Н]+. Описание 7. 2,4,5,6,7,8-Гексагидропиразоло[3,4-d]азепин (D7) Метод А. 6-(Фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин (может быть получен, как описано в описании 5, 390 мг, 1,72 ммоль) растворяли в этаноле (8 мл), обрабатывали палладием (100 мг, 10% на угольной пасте) и реакционную смесь перемешивали при комнатной температуре под водородом (атмосферное давление) в течение 18 ч. Смесь фильтровали через целит и фильтрат упаривали при пониженном давлении, что давало указанное в заголовке соединение (D7). МС (ES+) m/е 138 [М+Н]+. Метод В. 6-(Фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин (может быть получен, как описано в описании 5, 2,8 г, 12,3 ммоль) растворяли в этаноле, обрабатывали палладием на угле (10% паста, 718 мг,1,23 ммоль) и гидрогенировали при атмосферном давлении и комнатной температуре в течение 42 ч. Смесь фильтровали через целит и упаривали при пониженном давлении, что давало продукт (D7); MC(ES+) m/е 138 [М+Н]+. Метод С. 1,1-Диметилэтил-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилат (может быть получен,как описано в описании 9, 1,4 г, 5,9 ммоль) в дихлорметане (2 мл) обрабатывали трифторуксусной кислотой (2 мл). После 1 ч смесь упаривали, растворяли в метаноле и наносили на SCX ионообменный картридж, и промывали метанолом и затем 2 М раствором аммиака в метаноле. Содержащие аммиак фракции затем объединяли и упаривали, и полученный остаток хроматографировали на силикагеле, элюируя смесью 1:99, увеличивая до 20:80, 2 М аммиака в метаноле и дихлорметана, чтобы получить указанное в заголовке соединение (D7); МС (ES+): [М+Н]+ при m/z 138,12. Описание 8. 1,1-Диметилэтил-4-формил-5-оксогексагидро-1 Н-азепин-1-карбоксилат (D3) 1,1-Диметилэтил-4-оксогексагидро-1H-азепин-1-карбоксилат (коммерчески доступный, например,из Magic Chemicals, 2,0 г, 9,4 ммоль) в тетрагидрофуране при -78 С обрабатывали 2M раствором диизо- 15013600 пропиламидом лития (4,7 мл, 9,4 ммоль) в тетрагидрофуране. После 20 мин добавляли чистый этилформиат (0,7 г, 9,4 ммоль) и позволяли реакционной смеси нагреться до комнатной температуры. После 2 ч реакцию гасили, выливали в воду и экстрагировали несколько раз зтилацетатом. Объединенные органические слои затем сушили и упаривали в вакууме, чтобы получить указанное в заголовке соединение,которое может использоваться без дополнительной очистки (D8). Описание 9. 1,1-Диметилэтил-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6 (2 Н)-карбоксилат (D9) Метод А. 2,4,5,6,7,8-Гексагидропиразоло[3,4-d]азепина гидрохлорид (может быть получен, как описано в описании 6, 4,1 г, 23,58 ммоль) суспендировали в 1:1 тетрагидрофуране и диметилформамиде (100 мл) и охлаждали до 0 С. Добавляли триэтиламин (6,6 мл, 47,16 мл), затем ди-трет-бутилдикарбонат (5,14 г,23,58 ммоль). Смесь перемешивали и позволяли нагреться до комнатной температуры в течение 2 ч, затем упаривали. Остаток растворяли в диэтиловом эфире и промывали водой (3). Органический слой сушили над сульфатом магния и упаривали. Остаток очищали с помощью флеш-хроматографии, элюируя 2-4% 2 М аммиака в метанол/дихлорметан, что давало указанное в заголовке соединение (D9). МС(ES+) m/е 182 [M+tBu]+. Метод В. 2,4,5,6,7,8-Гексагидропиразоло[3,4-d]азепин (может быть получен, как описано в описании 7, 250 мг, 1,82 ммоль) суспендировали в тетрагидрофуране (5 мл), обрабатывали триэтиламином (0,25 мл, 1,82 ммоль) и бис (1,1-диметилэтил)дикарбонатом (397 мг, 1,82 ммоль) и полученную смесь перемешивали при комнатной температуре под аргоном в течение 2 ч. Растворитель удаляли при пониженном давлении и продукт очищали хроматографией на силикагеле, элюируя смесью 2 М аммиака в метанол/дихлорметан(2-5%), что давало указанное в заголовке соединение (D9). MC (ES+) т/е 182 [M+tBu]+. Метод С. Раствор 2,4,5,6,7,8-Гексагидропиразоло[3,4-d]азепина (может быть получен, как описано в описании 7, 800 мг, 5,84 ммоль) в тетрагидрофуране (10 мл) обрабатывали триэтиламином (815 мкл, 5,84 ммоль) и бис(1,1-диметилэтил)дикарбонатом (1,27 г, 5,84 ммоль), затем перемешивали при комнатной температуре под аргоном в течение 2 ч. После удаления растворителя в вакууме остаток очищали хроматографией на силикагеле, элюируя смесью 2 М аммиака в метанол/дихлорметан (0-10%), что давало указанное в заголовке соединение (D9). МС (ES+) m/е 238 [М+Н]+. Метод D. 1,1-Диметилэтил 4-формил-5-оксогексагидро-1 Н-азепин-1-карбоксилат (может быть получен, как описано в описании 8, неочищенное вещество, приблизительно 9,4 ммоль) в этаноле (20 мл) обрабатывали гидразингидратом (1,4 г, 30 ммоль) . Смесь нагревали до кипения в течение 2 ч перед охлаждением до комнатной температуры и упариванием в вакууме. Сырой продукт затем очищали на силикагеле, элюируя этмлацетатом, что давало указанное в заголовке соединение (D9); MC (ES+): [М+Н]+ при m/z 238,18. Описание 10. 1,1-Диметилэтил 2-(4-циаиофенил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилат (D10) 1,1-Диметилэтил 4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилат (может быть получен,как описано в описании 9, 1,80 г, 7,58 ммоль), 4-цианофенилбороновую кислоту (2,23 г, 15,16 ммоль,коммерчески доступна от, например, Aldrich), ацетат меди(II) (4,15 г, 22,76 ммоль), пиридин (1,21 мл,15,16 ммоль) и порошкообразные 4 молекулярные сита (5,33 г) перемешивали в дихлорметане (80 мл) при комнатной температуре на воздухе в течение 40 ч. Смесь фильтровали через слой Кизельгура (Kieselguhr) и фильтрат упаривали. Остаток растворяли в этилацетате и раствор промывали 5% раствором бикарбоната натрия (3), сушили над сульфатом магния и упаривали. Остаток очищали с помощью флеш-хроматографии, элюируя 10-40% этилацетата в н-пентане, получая указанное в заголовке соединение (D10); MC (ES+) m/е 339 [M+Н]+. Описание 11. 4-(5,6,7,8-Тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)бензонитрил (D11) 1,1-Диметилэтил 2-(4-цианофенил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилат(может быть получен, как описано в описании 10, 150 мг, 0,443 ммоль) растворяли в 1,4-диоксане (1 мл) и добавляли 4M хлороводород в 1,4-диоксане (3 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли метанол и смесь очищали на 10 г SCX-колонке, элюируя первоначально метанолом, затем 2M аммиаком в метаноле. Упаривание основных фракций давало указанное в заголовке соединение (D11). МС (ES+) m/е 239 [М+Н]+. Описание 12. 1,1-Диметилэтил 2-(4-бромфенил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилат (D12) Метод А. 1,1-Диметилэтил 4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилат (может быть получен,как описано в описании 9, 964 мг, 4,06 ммоль), 4-бромфенилбороновую кислоту (1,64 г, 8,12 ммоль, коммерчески доступна от, например, Aldrich), ацетат меди(II) (2,22 г, 12,18 ммоль), пиридин (0,646 мл, 8,12 ммоль) и порошкообразные 4 молекулярные сита (2,85 г) перемешивали в дихлорметане (40 мл) при комнатной температуре на воздухе в течение 64 ч. Смесь фильтровали через слой Кизельгура(Kieselgu.hr) и фильтрат упаривали. Остаток растворяли в этилацетате и раствор промывали 5% раствором бикарбоната натрия (х 2), сушили над сульфатом магния и упаривали. Остаток очищали с помощью флеш-хроматографии, элюируя 10-30% этилацетата в н-пентане, получая указанное в заголовке соединение (D12). МС (ES+) т/е 392, 394 [M+Н]+. Метод В. 1,1-Диметилэтил 4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилат (может быть получен,как описано в описании 9, 254 мг, 1,07 ммоль), (4-бромфенил)бороновую кислоту (431 мг, 2,14 ммоль,коммерчески доступна от, например, Aldrich), ацетат меди (58 3 мг, 3,21 ммоль), пиридин (0,17 мл, 2,14 ммоль) и молекулярные сита 4 (0,75 г) добавляли вместе в дихлорметан (10 мл) и полученную смесь перемешивали при комнатной температуре на воздухе в течение 18 ч. Смесь нагревали при 40 С в течение 7 ч. Позволяли смеси охладиться до комнатной температуры и перемешивали в течение 18 ч. Смесь фильтровали через целит и растворитель упаривали. Остаток растворяли в этилацетате и промывали насыщенным раствором бикарбоната натрия. Слой этилацетата отделяли, сушили над сульфатом магния и упаривали. Продукт очищали с помощью колоночной хроматографии, элюируя смесью этилацетат/пентан (1:9-1:4), получая указанное в заголовке соединение (D12). МС (ES+) m/е 392, 394 [М+Н]+. Метод С. Раствор 1,1-диметилэтил 4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилата (может быть получен, как описано в описании 9, 900 мг, 3,8 ммоль), 4-бромфенилбороновой кислоты (1,5 г, 7,6 ммоль,коммерчески доступна от, например, Aldrich), ацетата меди (2,06 г, 11,4 ммоль), молекулярные сита (4,3,5 г) и пиридин (614 мкл, 7,6 ммоль) в дихлорметане (50 мл) перемешивали при комнатной температуре на воздухе в течение 60 ч. Смесь затем фильтровали через слой целита, промывая метанолом. Растворитель упаривали в вакууме. Остаток растворяли в этилацетате и промывали 5% водным раствором гидрокарбоната натрия (2) и насыщенным раствором соли, затем сушили над сульфатом магния и упаривали в вакууме. Полученный остаток очищали с помощью хроматографии на силикагеле, элюируя смесью 2 М аммиака в метанол/дихлорметан (0-5%), с последующей дополнительной хроматографией на силикагеле. элюируя смесью этилацетата в гексане (10-20%), что давало указанное в заголовке соединение (D12). MC(ES+) m/е 336 и 338 [M+tBu]+. Описание 13. 1-(5-Бром-2-пиридинил)-2-пирролидинон (D13) Метод А. К раствору 2-пирролидинона (797 мкл, 10,4 ммоль) в диметилформамиде (10 мл) при 0 С добавляли порциями гидрид натрия (60 мас.% в масле, 416 мг, 10,4 ммоль). Реакционной смеси позволяли перемешиваться при комнатной температуре в течение 30 мин перед добавлением раствора 5-бром-2 хлорпиридина (1,00 г, 5,20 ммоль) в диметилформамиде (2 мл). Полученной смеси позволяли нагреваться до комнатной температуры в течение 18 ч, затем нагревали до 50 С в течение 1 ч и затем при 80 С дополнительно в течение 1,5 ч. Добавляли метанол и воду и смесь экстрагировали дихлорметаном, сушили над сульфатом магния и концентрировали в вакууме. Продукт очищали с помощью хроматографии на силикагеле, элюируя смесью этилацетата и пентана (0-50%), что давало указанное в заголовке соединение (D13). МС (ES+) m/е 241 и 243 [M+Н]+. Метод В. К раствору пирролидинона (0,797 мкл, 10,4 ммоль) в диметилформамиде (10 мл) при 0 С добавляли порциями гидрид натрия (60 мас.% в масле, 416 мг, 10,4 ммоль). Полученной смеси позволяли перемешиваться при 0 С в течение 30 мин. Добавляли раствор 5-бром-2-хлорпиридина (1,00 г, 5,20 ммоль) в диметилформамиде (2 мл), и полученной смеси позволяли нагреваться до комнатной температуры в течение ночи. Затем смесь нагревали при 50 С в течение 1 ч и при 80 С в течение 1,5 ч. После охлаждения до комнатной температуры смесь гасили метанолом и водой, экстрагировали дихлорметаном (3100 мл) и сушили над сульфатом магния. Неочищенную смесь очищали с помощью колоночной хроматографии,элюируя смесью этилацетата и пентана (0-50%), что давало продукт (D13). MC (ES + ) m/е 241 и 243[M+Н]+. Описание 14. 2-(4-Бромфенил)-6-(фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин (D14) Метод А. Смесь 6-(фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепина (может быть получен, как описано в описании 5, 500 мг, 2,20 ммоль), 4-(бромфенил) бороновой кислоты (885 мг, 4,40 ммоль, коммерчески доступна от, например, Aldrich), ацетата меди (1,19 г, 6,60 ммоль), пиридина (0,36 мл, 4,40 ммоль) и молекулярных сит (1,5 г) в дихлорметане (20 мл) оставляли перемешиваться при комнатной температуре в открытой колбе в течение 48 ч, затем дополнительно в течение 4 дней. Реакционную смесь фильтровали через слой целита, промывая дихлорметаном и метанолом. Фильтрат упаривали, перерастворяли в метаноле и пропускали через 10 г SCX-картридж, элюируя метанолом, затем 2 М раствором аммиака в метаноле. Неочищенную смесь очищали с помощью обращенно-фазовой хроматографии, элюируя смесью ацетонитрила и воды (5-100%), чтобы получить продукт (D14); МС (ES+) m/е 382 и 384 [М+Н]+.- 17013600 Метод В. 6-(Фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин (может быть получен, как описано в описании 5, 50 мг, 0,22 ммоль), 4-бромфенилбороновая кислота (88 мг, 0,44 ммоль, коммерчески доступна от, например, Aldrich), ацетат меди(II) (120 мг, 0,66 ммоль), пиридин (36 мкл, 0,44 ммоль) и молекулярные сита 4 (150 г) перемешивали при комнатной температуре на воздухе в течение 72 ч. Полученную сырую смесь загружали в 1 г предварительно уравновешенный ионообменный картридж (SCX),элюируя метанолом и 2 М аммиаком в метаноле. Основные фракции упаривали и полученный неочищенный остаток очищали обращенно-фазовой хроматографией, чтобы получить соль формиат. Данный продукт загружали в 1 г предварительно уравновешенный ионообменный картридж (SCX) и элюировали метанолом и 2 М аммиаком в метаноле. Основные фракции объединяли и упаривали, чтобы получить указанный в заголовке продукт (D14); МС (ES+) m/е 382/384 [М+Н]+. Описание 15. 2-(6-Бром-3-пиридинил)-6-(фенилметил)-2,4,5,6,7,8-гексагидропиразоло [3,4-d]азепин(D15) Смесь 6-(фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепина (может быть получен, как описано в описании 5, 200 мг, 0,88 ммоль), (6-бром-3-пиридинил)бороновой кислоты (355 мг, 1,76 ммоль),ацетата меди (478 мг, 2,64 ммоль), пиридина (0,142 мл, 1,76 ммоль) и молекулярных сит (600 мг) в дихлорметане (10 мл) оставляли перемешиваться при комнатной температуре в открытой колбе в течение 240 ч. Реакционную смесь фильтровали через слой целита, промывая дихлорметаном и метанолом. Фильтрат упаривали, перерастворяли в метаноле и пропускали через 10 г SCX-картридж, элюируя метанолом, затем 2M раствором аммиака в метаноле. Основные фракции объединяли, упаривали и очищали с помощью колоночной хроматографии, элюируя смесью 2M аммиака в метаноле и дихлорметана (0-10%). Нечистый продукт повторно очищали с помощью обращенно-фазовой хроматографии, элюируя смесью ацетонитрила и воды (5-100% и 3-60%), чтобы получить продукт (D15); МС (ES+) m/е 383 и 385 [М+Н]+. Описание 16. 1-5-[6-(Фенилметил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]-2 пиридинил-2-пирролидинон (D16) Метод А. Смесь 6-(фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепина (может быть получен, как описано в описании 5, 40,0 мг, 0,18 ммоль), 1-(5-бром-2-пиридинил)-2-пирролидинона (может быть получен,как описано в описании 13, 48,0 мг, 0,20 ммоль), иодида меди(I) (10,0 мг, 0,05 ммоль), транс-1,2 диаминоциклогексана (6 мкл, 0,05 ммоль) и K3PO4 (137 мг, 0,65 ммоль) суспендировали в диоксане (3 мл) и нагревали, под аргоном, при 140 С в течение 18 ч. Неочищенную смесь разбавляли метанолом,наносили на SCX-картридж (Varian bond-elute, 5 г) и промывали метанолом, затем смесью 2 М аммиак/метанол. Основные фракции объединяли, упаривали и очищали дополнительно с помощью хроматографии на силикагеле, элюируя смесью 2 М аммиака в метанол/дихлорметан (0-5%), чтобы получить указанное в заголовке соединение (D16); МС (ES+) m/е 388 [M+Н]+. Метод В. Смесь 6-(фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепина (может быть получен, как описано в описании 5, 40,0 мг, 0,18 ммоль), 1-(5-бром-2-пиридинил)-2-пирролидинона (может быть получен,как описано в описании 13, 48,0 мг, 0,20 ммоль), иодида меди (10,0 мг, 0,05 ммоль), (1R,2R)-1,2 циклогександиамина (6,00 мкл, 0,05 ммоль) и фосфата калия (137 мг, 0,65 ммоль) в диоксане (3 мл) нагревали до кипения в течение ночи, и затем охлаждали в течение двух дней. Смесь разбавляли метанолом и пропускали через 5 г SCX-картриджа, элюируя метанолом, затем смесью 2 М раствором аммиака в метаноле. Основные фракции объединяли, упаривали и очищали с помощью колоночной хроматографии,элюируя смесью 2M аммиака в метаноле и дихлорметана (0-5%), что давало продукт (D16); МС (ES+)m/е 388 [М+Н]+. Метод С. Смесь 2-(6-бром-3-пиридинил)-6-(фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепина (может быть получен, как описано в описании 15, 40 мг, 0,10 ммоль), 2-пирролидинона (15 мкл, 0,20 ммоль),карбоната калия (41 мг, 0,30 ммоль), иодида меди(I) (6 мг, 0,03 ммоль), N,N'-диметил-1,2-этандиамина (4 мкл, 0,03 ммоль) в диоксане (4 мл) и нагревали до кипения в течение 24 ч. Снова добавляли то же количество 2-пирролидинона, иодида меди(I) и N,N'-диметил-1,2-этандиамина и нагревали смесь до кипения в течение 2 ч. После упаривания растворителя в вакууме остаток очищали с помощью SCX-картриджа, с последующей хроматографией на силикагеле, элюируя смесью 2 М аммиак в метанол/дихлорметан (010%). Колонку повторяли, элюируя смесью 2 М аммиака в метанол/дихлорметан (0-7,5%), чтобы получить указанное в заголовке соединение (D16); MC (ES+) m/е 388 [М+Н]+. Описание 17. 1,1-Диметилэтил 2-(6-бром-3-пиридинил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин 6(2 Н)-карбоксилат (D17) Смесь 1,1-диметилэтил 4,5,7,8-тетрагидропиразоло [3,4-d]азепин-6(2 Н)-карбоксилата (может быть получен, как описано в описании 9, 207 мг, 0,87 ммоль), (6-бром-3-пиридинил) бороновой кислоты (204 мг, 1,74 ммоль), ацетата меди (472 мг, 2,61 ммоль), пиридина (140 мкл, 1,74 ммоль) и молекулярных сит(4, 750 мг) в дихлорметане (10 мл) перемешивали на воздухе в течение 8 дней. Сырую смесь затем фильтровали через слой целита и промывали дихлорметаном или аммиаком. После упаривания в вакууме- 18013600 остаток очищали с помощью SCX-картриджа, элюируя сначала метанолом, затем 2 М аммиака в метаноле. Метанольные фракции, содержащие продукт, объединяли и упаривали в вакууме. Остаток затем очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексан в этилацетате(10:1-1:1), что давало указанное в заголовке соединение (D17). МС (ЕС+) m/е 393 и 395 [М+Н]+. Описание 18. 1,1-Диметилэтил 2-[6-(2-оксо-1-пирролидинил)-3-пиридинил]-4,5,7,8-тетрагидропиразоло[3,4d]азепин-6(2 Н)-карбоксилат (D18) Смесь 1,1-диметилэтил 2-(6-бром-3-пиридинил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилата (может быть получен, как описано в описании 17, 73 мг, 0,19 ммоль), CuI (11 мг, 0,06 ммоль), K2CO3 (92 мг, 0,67 ммоль), диоксана (3,7 мл), N,N'-диметил-1,2-этандиамина (0,006 мл, 0,06 ммоль) и 2-пирролидинона (0,028 мл, 0,37 ммоль) смешивали вместе и нагревали под аргоном до кипения в течение 10 мин и оставляли при этой температуре в течение 12,5 ч. После дополнительных 1,5 ч добавляли еще CuI (0,3 экв.), K2CO3 (3,6 экв.), N,N'-диметил-1,2-этандиамин (0,3 экв.) и 2-пирролидинон(2 экв.) и нагревали смесь до кипения в течение дополнительных 2,75 ч. Затем смесь охлаждали и оставляли на 77 ч при комнатной температуре. Затем смесь уменьшали в объеме в вакууме и очищали с помощью хроматографии на силикагеле, элюируя гексан: этилацетат 10:1 7:15:13:11:1, чтобы получить указанное в заголовке соединение (D18). MC (ES+) m/е 398 [М+Н]+. Описание 19. 1-[5-(5,6,7,8-Тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)-2-пиридинил]-2 пирролидинон (D19) Метод А. 1-5-[6-(Фенилметил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]-2-пиридинил-2 пирролидинон (может быть получен, как описано в описании 16, 38,0 мг, 0,10 ммоль) растворяли в этаноле (3 мл). Добавляли палладий (5,0 мг, 10% на угольной пасте) и реакционную смесь перемешивали при комнатной температуре под водородом (атмосферное давление) в течение 12 ч. Смесь фильтровали через целит и фильтрат концентрировали в вакууме. Продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 2 М аммиак в метанол/дихлорметан (0-5%), что давало указанное в заголовке соединение (D19). МС (ES+) m/е 298 [М+Н]+. Метод В. К раствору 1-5-[6-(фенилметил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]-2-пиридинил 2-пирролидинона (может быть получен, как описано в описании 16, 38,0 мг, 0,10 ммоль) в этаноле (3 мл) добавляли палладий на угле (10% 1:1 паста, 5,00 мг) и полученную смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Смесь затем фильтровали, упаривали и очищали с помощью колоночной хроматографии, элюируя смесью 2 М аммиака в метаноле и дихлорметана (0-5%),что давало продукт (D19). МС (ES+) m/е 298 [М+Н]+. Метод С. Раствор 1-5-[6-(фенилметил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]-2-пиридинил-2 пирролидинона (может быть получен, как описано в описании 16, 145 мг, 0,37 ммоль) и палладия на угле(15 мг) в этаноле (5 мл) перемешивали при комнатной температуре в атмосфере водорода в течение 18 ч. Затем смесь фильтровали через слой целита, промывая этанолом. Растворитель упаривали в вакууме,полученный остаток очищали с помощью SCX-картриджа, с последующей хроматографией на силикагеле, элюируя смесью 2 М аммиак в метанол/дихлорметан (0-5%), что давало указанное в заголовке соединение (D19). МС (ES+) m/е 298 [М+Н]+. Метод D. Раствор 1,1-диметилэтил 2-[6-(2-оксо-1-пирролидинил)-3-пиридинил]-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилата (может быть получен, как описано в описании 18, 51 мг, 0,13 ммоль) в дихлорметане (4 мл) обрабатывали трифторуксусной кислотой (2 мл) и перемешивали при комнатной температуре в течение 1 ч 50 мин. Затем смесь разбавляли метанолом (около 5 мл) и очищали с помощью SCX, элюируя метанолом и затем метанолом/аммиаком (2M). Соответствующие фракции объединяли и упаривали, что давало указанное в заголовке соединение (D19). МС (ES+) m/е 298 [М+Н]+. Описание 20. 1-4-[6-(Фенилметил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2 (4 Н) -ил] фенил-2 пирролидинон (D20) Метод А. Смесь 6-(фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепина (может быть получен, как описано в описании 5, 40,0 мг, 0,18 ммоль), 1-(4-бромфенил)-2-пирролидинона (48,0 мг, 0,20 ммоль), иодида меди(I) (10,0 мг, 0,05 ммоль), транс-1,2-диаминоциклогексана (6 мкл, 0,05 ммоль) и K3PO4 (137 мг, 0,65 ммоль) суспендировали в диоксане (3 мл) и нагревали, под аргоном, при 140 С в течение 18 ч. Неочищенную смесь разбавляли метанолом, наносили на SCX-картридж (Varian bond-elute, 10 г) и промывали метанолом, затем смесью 2 М аммиак/метанол. Основные фракции объединяли, упаривали и очищали дополнительно с помощью хроматографии на силикагеле, элюируя смесью 2 М аммиака в метанол/дихлорметан (0-3%), что давало указанное в заголовке соединение (D20). MC (ES+) m/е 387 [М+Н]+. Метод В. 1-4-[6-(Фенилметил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]фенил-2-пирролидинон(D20) может быть получен из 6-(фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепина (40,0 мг, 0,18 ммоль, может быть получен, как описано в описании 5), используя аналогичный процесс, который описан в описании 16, заменяя 1-(5-бром-2-пиридинил)-2-пирролидинон на 1-(4-бромфенил)-2 пирролидинон. MC (ES+) m/е 387 [M+Н]+. Метод С. Смесь 2-(4-бромфенил)-6-(фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепина (может быть получен, как описано в описании 14, 140 мг, 0,37 ммоль), пирролидинона (56,0 мкл, 0,74 ммоль), карбоната калия (184 мг, 1,33 ммоль), иодида меди (21,0 мг, 0,11 ммоль) и N,N'-диметил-1,2-этандиамина (12,0 мкл, 0,11 ммоль) в безводном диоксане (6 мл) нагревали до кипения в течение ночи. Добавляли дополнительную порцию пирролидинона (56,0 мкл, 0,74 ммоль), карбоната калия (184 мг, 1,33 ммоль), иодида меди (21,0 мг, 0,11 ммоль) и N,N'-диметил-1,2-этандиамина (12,0 мкл, 0,11 ммоль) и продолжали нагревать до кипения в течение 24 ч. После охлаждения до комнатной температуры смесь пропускали через 10 г SCX-картриджа, элюируя метанолом и затем 2 М раствором аммиака в метаноле. Очистку осуществляли с помощью колоночной хроматографии, элюируя смесью 2M аммиака в метаноле и дихлорметана (04%), что давало продукт (D20). МС (ES+) m/е 387 [М+Н]+. Описание 21. 1,1-Диметилэтаил 2-[4-(2-оксо-1-пирролидинил)фенил]-4,5,7,8 тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилат (D21) Метод А. Смесь 1,1-диметилэтил 2-(4-бромфенил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилата (может быть получен, как описано в описании 12, 222 мг, 0,57 ммоль), 2-пирролидинона(96 мг, 0,09 мл, 1,13 ммоль), трис(дибензилиденацетон)дипалладия(O) (26 мг, 0,029 ммоль), (9,9 диметил-9 Н-ксантен-4,5-диил) бис(дифенилфосфана) (49 мг, 0,086 ммоль) и карбоната цезия (279 мг,0,86 ммоль) суспендировали в диоксане (7 мл) и нагревали под аргоном до кипения в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали этилацетатом(3). Объединенные органические слои промывали водой (2), сушили над сульфатом магния и упаривали растворитель в вакууме. Неочищенный продукт затирали в гексане и фильтровали, а затем очищали дополнительно с помощью хроматографии . на силикагеле, элюируя смесью метанола в дихлорметане (03%), что давало указанное в заголовке соединение (D21). МС (ES+) m/е 341 [M-tBu]+. Метод В. Смесь 1,1-диметилэтил 2-(4-бромфенил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилата (может быть получен, как описано в описании 12, 179 мг, 0,46 ммоль), K2CO3 (227 мг, 1,64 ммоль), Cul (26 мг, 0,14 ммоль), N,N'-диметил-1,2-этандиамина (0,015 мл, 0,14 ммоль) и 2 пирролидинона (0,070 мл, 0,91 ммоль) в диоксане (9 мл) нагревали до кипения в течение 15 мин и затем оставляли при этой температуре на ночь. После дополнительных 1,5 ч добавляли еще K2CO3 (3,6 экв.),CuI (0,3 экв.), N,N'-диметил-1,2-этандиамин (0,3 экв.) и 2-пирролидинон (2 экв.) (реакцию охлаждали до добавления реагентов) и полученную смесь перемешивали при кипении под аргоном в течение дополнительных 3,5 ч и затем в течение дополнительных 2,5 ч. Добавляли еще диоксан (5 мл) вместо потерянного и смесь оставляли при кипении под аргоном в течение дополнительного 1 ч. Добавляли еще K2CO3(3,6 экв.), CuI (0,3 экв.), 2-пирролидинон (2 экв.) и N,N'-диметил-1,2-этандиамин (0,3 экв.) и смесь оставляли перемешиваться при кипении под аргоном на ночь. После 16,5 ч добавляли еще диоксан (4 мл) и позволяли смеси охладиться до комнатной температуры. Растворитель затем удаляли, остаток обрабатывали дихлорметаном (25 мл) и смесь фильтровали через целит, промывая дополнительно дихлорметаном. Фильтрат затем упаривали и остаток очищали с помощью хроматографии на силикагеле, элюируя дихлорметаномдихлорметан:метанол 50:125:1. Частично очищенный остаток затем затирали с гексан:этилацетат 10:1, что давало указанное в заголовке соединение (D21). МС (ES+) m/е 397 [М+Н]+. Описание 22. 1-[4-(5,6,7,8-Тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)фенил]-2-пирролидинон(может быть получен, как описано в описании 20, 23,0 мг, 0,0 6 ммоль) растворяли в этаноле (3 мл). Добавляли палладий (5,0 мг, 10% на угольной пасте) и реакционную смесь перемешивали при комнатной температуре под водородом (атмосферное давление) в течение 12 ч. Смесь фильтровали через целит и фильтрат концентрировали в вакууме. Продукт очищали с помощью хроматографии на силикагеле,элюируя смесью 2M аммиак в метанол/дихлорметан (0-10%), что давало указанное в заголовке соединение (D22). МС (ES+) m/е 297 [M+Н]+. Метод В. 1-[4-(5,6,7,8-Тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]фенил]-2-пирролидинон (D22) может быть получен из 1-4-[6-(фенилметил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]фенил-2 пирролидинона (может быть получен, как описано в описании 20, 23,0 мг, 0,06 ммоль), используя аналогичный процесс, который описан в описании 19; МС (ES+) m/е 297 [М+Н]+.(20 мл) перемешивали при комнатной температуре в атмосфере водорода в течение 72 ч. Затем смесь фильтровали через целит и упаривали, что давало неочищенный продукт, который очищали с помощью колоночной хроматографии, элюируя смесью 2 М аммиака в метаноле и дихлорметана (0-10%), что давало продукт (D22). MC (ES+) m/е 297 [М+Н]+. Метод D. К раствору 1,1-диметилэтил 2-[4-(2-оксо-1-пирролидинил)фенил]-4,5,7,8-тетрагидропиразоло[3,4d]азепин-6(2 Н)-карбоксилата (может быть получен, как описано в описании 21, 189 мг, 0,48 ммоль) в дихлорметане (12 мл) добавляли трифторуксусную кислоту (6 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 ч и затем разбавляли метанолом. Реакцию очищали с помощью SCX,элюируя метанолом и затем 2 М аммиак/метанол. Основные фракции объединяли и растворитель упаривали в вакууме, что давало указанное в заголовке соединение (D22). МС (ES+) m/е 297 [M+Н]+. Метод Е. Раствор 1,1-диметилэтил 2-[4-(2-оксо-1-пирролидинил)фенил]-4,5,7,8-тетрагидропиразоло[3,4d]азепин-6(2 Н)-карбоксилата (может быть получен, как описано в описании 21, 132 мг, 0,33 ммоль) вDCM (5 мл) обрабатывали TFA (2,5 мл) и смесь перемешивали при комнатной температуре в течение 1,5 ч. Затем смесь разбавляли метанолом (5 мл) и пропускали через SCX-картридж, элюируя метанолом и затем МеОН/NH3 (2 М), что давало указанное в заголовке соединение (D22). МС (ES+) m/е 297 [М+Н]+. Описание 23. 4-[6-[(1,1-Диметилэтил)окси]карбонил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин 2(4 Н)-ил]бензойная кислота (D23) К 1,1-диметилэтил 2-(4-цианофенил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилату(может быть получен, как описано в описании 10, 7 50 мг, 2,22 ммоль) в этаноле (7,5 мл) добавляли 10% раствор гидроксида натрия (7,5 мл) и реакцию нагревали до кипения под аргоном в течение 5 ч. Добавляли 10% раствор гидроксида натрия (10 мл) и продолжали перемешивание при кипении, под аргоном, в течение ночи. Реакцию охлаждали до комнатной температуры и растворитель частично удаляли в вакууме. Полученный неочищенный продукт растворяли в воде и подкисляли 5 н. хлороводородной кислотой. Добавляли этилацетат и продукт экстрагировали в этилацетат (3). Объединенные органические фракции сушили над сульфатом магния и растворитель упаривали в вакууме, что давало указанное в заголовке соединение (D23). МС (ES+) m/е 356 [M+Н]-. Описание 24. 1,1-Диметилэтил 2-4-[(метиламино)карбонил]фенил-4,5,7,8 тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилат (D24) К суспензии 4-[6-[(1,1-диметилэтил)окси]карбонил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин 2(4 Н)-ил]бензойной кислоты (может быть получена, как описано в описании 23, 185 мг, 0,52 ммоль) в дихлорметане (10 мл) добавляли 1,1'-(оксометандиил)бис-1 Н-имидазол (168 мг, 1,04 ммоль) и реакцию перемешивали при комнатной температуре под аргоном в течение ночи. Добавляли метиламин (64 мг,2,07 ммоль) и продолжали перемешивание под аргоном при комнатной температуре в течение 4 ч. Полученную неочищенную смесь разбавляли водой и экстрагировали дихлорметаном (2). Объединенные органические фракции промывали водой (1), сушили над сульфатом магния и растворитель упаривали в вакууме, что давало указанное в заголовке соединение (D24). МС (ES+) m/е 371 [М+Н]+. Описание 25. N-Метил-4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)бензамид (D25) Раствор 1,1-диметилэтил 2-4-[(метиламино)карбонил]фенил-4,5,7,8-тетрагидропиразоло[3,4d]азепин-6(2 Н)-карбоксилат (184 мг, 0,50 ммоль, может быть получен, как описано в описании 24) в дихлорметане (2 мл) обрабатывали трифторуксусной кислотой (2 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Смесь разбавляли метанолом и пропускали через SCX-картридж, элюируя метанолом и затем 2 М раствором аммиака в метаноле. Основные фракции объединяли и упаривали, что давало указанное в заголовке соединение (D25). МС (ES+) m/е 271 [М+Н]+. Описание 26. 1,1-Диметилэтил 2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]-4,5,7,8 тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилат (D26) Смесь 1,1-диметилэтил 2-(4-бромфенил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилата (150 мг, 0,38 ммоль может быть получен, как описано в описании 12), 1,3-оксазолидин-2 она (100 мг, 1,15 ммоль), трис(дибензилиденацетон)дипалладия(0) (18,0 мг, 0,02 ммоль), (9,9-диметил 4,5-бис(дифенилфосфино)ксантена (35,0 мг, 0,06 ммоль) и карбоната цезия (195 мг, 0,60 ммоль) в диоксане (4 мл) нагревали до кипения под аргоном в течение 3 ч и затем - микроволновым излучением в течение 2 ч при 150 С. Смесь разбавляли этилацетатом, фильтровали через целит и промывали 220 мл водой. Объединенные слои этилацетата сушили над сульфатом магния, фильтровали и упаривали. Неочищенный продукт очищали с помощью хроматографии, элюируя смесью этилацетат/пентан (50-100%),что давало продукт (D26). МС (ES+) m/е 399 [М+Н]+.(71 мг, 0,82 ммоль), карбоната калия (170 мг, 1,23 ммоль), иодида меди(I) (24 мг, 0,12 ммоль) и N,N'диметил-1,2-этандиамина (13 мкл, 0,12 ммоль) в диоксане (10 мл) нагревали до кипения в течение ночи. Добавляли снова то же количество 2-оксазолидинона, иодида меди(I) и N,N'-диметил-1,2-этандиамина и смесь нагревали в течение 6 ч. Реакционную смесь переносили в микроволновую пробирку, снова добавляли то же количество 2-оксазолидинона, иодида меди(I) и N,N'-диметил-1,2-этандиамина и смесь нагревали при 100 С с помощью микроволнового излучения в течение 1 ч. Снова добавляли то же количество 2-оксазолидинона, иодида меди(I) и N,N'-диметил-1,2-этандиамина и смесь нагревали при 100 С с помощью микроволнового излучения в течение дополнительных 2 ч. Неочищенную смесь фильтровали через слой целита, промывая метанолом. Растворитель упаривали в вакууме, остаток переносили в этилацетат, промывали водой и насыщенным раствором соли, затем сушили над сульфатом магния. После удаления растворителя в вакууме остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью 50% этилацетата в гексане, что давало продукт (D26). MC (ES+) m/e 343 [M-tH]+. Описание 27. 3-[4-(5,6,7,8-Тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)фенил]-1,3-оксазолидин-2-он(D27) Метод А. Раствор 1,1-диметилэтил 2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]-4,5,7,8-тетрагидропиразоло[3,4d]азепин-6(2 Н)-карбоксилата (40,0 мг, 0,10 ммоль может быть получен, как описано в описании 26) в дихлорметане (1 мл) обрабатывали трифторуксусной кислотой (1 мл) и перемешивали при комнатной температуре в течение 1 ч. Смесь разбавляли метанолом и пропускали через SCX-картридж, элюируя метанолом и затем 2 М раствором аммиака в метаноле. Основные фракции объединяли и упаривали, что давало указанное в заголовке соединение (D27). МС (ES+) m/е 299 [М+Н]+. Метод В. К раствору 1,1-диметилэтил 2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилата (может быть получен, как описано в описании 26, 104 мг, 0,26 ммоль) в диоксане (1 мл) добавляли 4 М хлороводородную кислоту в диоксане (2 мл). Полученную смесь перемешивали при комнатной температуре под аргоном в течение 20 ч. Реакционную смесь разбавляли метанолом и очищали с помощью SCX, элюируя метанолом и затем 2 М аммиак/метанол. Основные фракции объединяли и упаривали в вакууме, что давало указанное в заголовке соединение (D27). МС(ES+) m/е 299 [М+Н]+. Описание 28. 1,1-Диметилэтил 2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]-4,5,7,8 тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилат (D28) Метод А. Смесь 1,1-диметилэтил 2-(4-бромфенил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилата (150 мг, 0,38 ммоль, может быть получен, как описано в описании 12), 1-метил-2 имидазолидинона (115 мг, 1,15 ммоль), трис(дибензилиденацетон)дипалладия(0) (18,0 мг, 0,02 ммоль),(9,9-диметил-4,5-бис(дифенилфосфино)ксантена (35,0 мг, 0,06 ммоль) и карбоната цезия (195 мг, 0,60 ммоль) в диоксане (4 мл) нагревали до кипения под аргоном в течение 3 ч. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом, фильтровали через целит и промывали 220 мл водой. Объединенные слои этилацетата сушили над сульфатом магния, фильтровали и упаривали. Неочищенный продукт очищали с помощью хроматографии, элюируя смесью этилацетат/пентан (50-100%), что давало продукт (D28). МС (ЕС+) m/е 412 [М+Н]+. Метод В: Смесь 1,1-диметилэтил 2-(4-бромфенил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилата (может быть получен, как описано в описании 12, 80 мг, 0,20 ммоль), 1-метил-2 имидазолидинона (20 мг, 0,40 ммоль), трис(дибензилиденацетон)дипалладия(0) (9 мг, 0,01 ммоль), (9,9 диметил-9 Н-ксантен-4,5-диил)бис(дифенилфосфана) (17 мг, 0,03 ммоль) и карбоната цезия (98 мг, 0,3 ммоль) суспендировали в диоксане (4 мл) нагревали до кипения под аргоном в течение 18 ч. Добавляли дополнительные 2 экв. 1-метил-2-имидазолидинона, 0,05 экв. трис(дибензилиденацетон)дипалладия(0),0,15 экв. (9,9-диметил-9 Н-ксантен-4,5-диил)бис(дифенилфосфана) и 1,5 экв. карбоната цезия в диоксане(2 мл) и оставляли реакцию кипеть в течение 4 ч под аргоном. Реакцию охлаждали до комнатной температуры, разбавляли водой и экстрагировали этилацетатом (3). Объединенные органические слои промывали водой (2), насыщенным раствором соли (1), сушили над сульфатом магния и растворитель упаривали в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетата в гексане (0-30%), что давало указанное в заголовке соединение- 22013600 Описание 29. 1-Метил-3-[4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)фенил]-2 имидазолидинон (D29) Метод А. Раствор 1,1-диметилэтил 2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилата (122 мг, 0,30 ммоль, может быть получен, как описано в описании 28) в дихлорметане (1 мл) обрабатывали трифторуксусной кислотой (1 мл) и перемешивали при комнатной температуре в течение 1 ч. Смесь разбавляли метанолом и пропускали через SCX картридж,элюируя метанолом и затем 2 М раствором аммиака в метаноле. Основные фракции объединяли и упаривали, что давало указанное в заголовке соединение (D29). МС (ES+) m/e 312 [М+Н]+. Метод В. К раствору 1,1-диметилэтил 2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]-4,5,7,8 тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилата (может быть получен, как описано в описании 28,47 мг, 0,11 ммоль) в диоксане (1 мл) добавляли 4 М хлороводородную кислоту в диоксане (2 мл). Полученную смесь перемешивали при комнатной температуре под аргоном в течение 5 ч. Реакционную смесь разбавляли метанолом и затем очищали с помощью SCX, элюируя метанолом и затем 2 М аммиак/метанол. Основные фракции объединяли и упаривали в вакууме, что давало указанное в заголовке соединение (D29). MC (ES+) m/e 312 [М+Н]+. Описание 30. (1Z)-N-гидроксиэтанимидамид (D30) Смесь ацетонитрила (1,7 мл, 32,9 ммоль) и 50% водного раствора гидроксиламина (2,5 мл, 37,9 ммоль) в этаноле (5 мл) нагревали до кипения в течение 4,5 ч. Растворитель упаривали, что давало белое кристаллическое твердое вещество, которое затирали с диэтиловым эфиром, фильтровали и сушили в вакуумной печи, что давало продукт (D30). 1 Н ЯМР (d6-ДМСО)1,62 (3 Н, с), 5,34 (2 Н, ушир.с), 8,65 (1 Н, с). Описание 31. 6-Циклобутил-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин (D31) Метод А. К суспензии 2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепина (может быть получен, как описано в описании 7, 100 мг, 0,73 ммоль) в дихлорметане (5 мл) добавляли циклобутанон (55 мкл, 0,7 3 ммоль), затем уксусную кислоту (1 капля) и триацетоксиборгидрид натрия (18 6 мг, 0,88 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч, затем разбавляли ее метанолом и очищали с помощью SCXкартриджа, что давало указанное в заголовке соединение (D31). MC (ES+) m/е 192 [М+Н]+. Метод В. 2,4,5,6,7,8-Гексагидропиразоло[3,4-d]азепин (может быть получен, как описано в описании 7, 0,13,0,95 ммоль) в дихлорметане (3 мл) обрабатывали циклобутаноном (0,08 г, 1,13 ммоль) и каталитическим количеством уксусной кислоты. После 10 мин реакцию затем обрабатывали триацетоксиборгидридом натрия (0,42 г, 1,9 ммоль) и перемешивали в течение 2 ч. Реакционную смесь затем разбавляли метанолом и очищали с помощью ионообменного SCX-картриджа и промывали метанолом и затем 2 М раствором аммиака в метаноле. Содержащие аммиак фракции затем объединяли и упаривали, и полученный неочищенный продукт (D31) мог быть использован без дальнейшей очистки. МС (ES+): [М+Н]+ при m/z 192,16. Описание 32. 1,1-Диметилэтил 2-[4-(метилсульфонил)фенил]-4,5,7,8-тетрагидропиразоло[3,4d]азепин-6(2 Н)-карбоксилат (D32) Раствор 1,1-диметилэтил 4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилата (может быть получен, как описано в описании 9, 75 мг, 0,32 ммоль), [4-(метилсульфонил)фенил]бороновой кислоты(128 мг, 0,64 ммоль), ацетата меди (116 мг, 0,64 ммоль), молекулярных сит (4, 0,2 г) и пиридина (52 мкл, 0,64 ммоль) в дихлорметане (2,5 мл) перемешивали на воздухе при комнатной температуре в течение 60 ч. Смесь затем разбавляли метанолом, фильтровали через слой целита, промывая метанолом. Растворитель упаривали в вакууме. Остаток переносили в этилацетат и промывали водой и 5% водным раствором гидрокарбоната натрия, затем сушили над сульфатом магния и упаривали в вакууме. Полученный остаток очищали с помощью MDAP, что давало указанное в заголовке соединение (D32). МС (ES+) m/е 392 [М+Н]+. Описание 33. 1,1-Диметилэтил 2-[4-(1-пиперидинил)фенил]-4,5,7,8-тетрагидропиразоло[3,4d]азепин-6(2 Н)-карбоксилат (D33) Раствор 1,1-диметилэтил 2-(4-бромфенил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилата (может быть получен, как описано в описании 12, 150 мг, 0,38 ммоль), пиперидина (76 мкл,0,76 ммоль), [2'-(дициклогексилфосфанил)-2-бифенилил]диметиламина (24 мг, 0,06 ммоль),трис(дибензилиденацетон)дипалладия(0) (174 мг, 0,20 ммоль) и трет-бутоксида натрия (73 мг, 0,76 ммоль) в диоксане (4,5 мл) нагревали до 120 С в микроволновой печи (нормальное поглощение) в течение 30 мин. Реакционную смесь разбавляли метанолом и затем очищали с помощью SCX, элюируя метанолом и затем 2 М аммиак/метанол. Объединяли основные фракции и упаривали растворитель в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетат в гексане (0-50%), что давало указанное в заголовке соединение. МС (ES+) m/е 397 [М+Н]+.- 23013600 Описание 34. 1,1-Диметилэтил 2-[4-(3-метил-1,2,4-оксадиазол-5-ил)фенил]-4,5,7,8 тетрагидропиразоло[3,4-d]азепин-6 (2 Н)-карбоксилат (D34) К суспензии 4-[6-[(1,1-диметилэтил)окси]карбонил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин 2(4 Н)-ил]бензойной кислоты (может быть получен, как описано в описании 23, 185 мг, 0,52 ммоль) в дихлорметане (10 мл) добавляли 1,1'-(оксометандиил)бис-1 Н-имидазол (168 мг, 1,04 ммоль) и реакцию перемешивали при комнатной температуре под аргоном в течение ночи. Растворитель удаляли в вакууме. Добавляли толуол (5 мл) и затем (1Z)-N-гидроксиэтанимидамид (может быть получен, как описано в описании 30, 116 мг, 1,56 ммоль) и реакционную смесь нагревали до кипения под аргоном в течение ночи. Добавляли дополнительные 2 экв. 1,1'-(оксометандиил)бис-1 Н-имидазола и продолжали перемешивание дополнительно 40 мин. Добавляли 3 экв. (1Z)-N-гидроксиэтанимидамида и продолжали перемешивание дополнительно 3 ч. Реакцию охлаждали до комнатной температуры и растворитель упаривали в вакууме. Полученную неочищенную смесь разводили дихлорметаном и водой и экстрагировали дихлорметаном (2). Объединенные органические фракции промывали водой (1), сушили над сульфатом магния и растворитель упаривали в вакууме, что давало указанное в заголовке соединение (D34). MC (ES+)m/е 340 [M-tBu]+. Описание 35. 2-[4-(3-Метил-1,2,4-оксадиазол-5-ил)фенил]-2,4,5,6,7,8-гексагидропиразоло[3,4d]азепин (D35) К раствору 1,1-диметилэтил 2-[4-(3-метил-1,2,4-оксадиазол-5-ил)фенил]-4,5,7,8 тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилата (может быть получен, как описано в описании 34,159 мг, 0,40 ммоль) в дихлорметане (12 мл) добавляли трифторуксусную кислоту (6 мл). Полученную смесь перемешивали при комнатной температуре в течение 30 мин и затем разбавляли метанолом. Реакцию очищали с помощью SCX, элюируя метанолом и затем 2 М аммиак/метанол. Основные фракции объединяли и растворитель упаривали в вакууме, что давало указанное в заголовке соединение (D35). МС (ES+) m/е 296 [М+Н]+. Описание 36. 1,1-Диметилэтил 2-[4-(аминокарбонил)фенил]-4,5,7,8-тетрагидропиразоло[3,4d]азепин-6(2 Н)-карбоксилат (D36) К суспензии 4-[6-[(1,1-диметилэтил)окси]карбонил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин 2(4 Н)-ил]бензойной кислоты (может быть получена, как описано в описании 23, 185 мг, 0,52 ммоль) в дихлорметане (10 мл) добавляли 1,1'-(оксометандиил)бис-1 Н-имидазол (168 мг, 1,04 ммоль) и реакцию перемешивали при комнатной температуре под аргоном в течение ночи. Добавляли аммиак (0,88 M, 35 мг, 2,07 ммоль) и продолжали перемешивание под аргоном при комнатной температуре в течение 4 ч. Полученную неочищенную смесь разбавляли водой и экстрагировали дихлорметаном (2). Объединенные органические фракции промывали водой (1), сушили над сульфатом магния и растворитель упаривали в вакууме, что давало указанное в заголовке соединение (D36). MC (ES+) m/е 301 [M-tBu]+. Описание 37. 4-(5,6,7,8-Тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)бензамид (D37) К раствору 1,1-диметилэтил 2-[4-(аминокарбонил)фенил]-4,5,7,8-тетрагидропиразоло[3,4-d]азепин 6(2 Н)-карбоксилата (может быть получен, как описано в описании 36, 167 мг, 0,47 ммоль) в дихлорметане (14 мл) добавляли трифторуксусную кислоту (7 мл). Полученную смесь перемешивали при комнатной температуре под аргоном в течение 2 ч и затем разбавляли метанолом. Реакцию очищали с помощью SCX, элюируя метанолом и затем 2 М аммиак/метанол. Основные фракции объединяли и растворитель упаривали в вакууме, что давало указанное в заголовке соединение(D37). МС (ES+) m/е 257 [М+Н]+. Описание 38. 2-[4-(3-Метилсульфонил)фенил]-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин (D38) К раствору 1,1-диметилэтил 2-[4-(метилсульфонил)фенил]-4,5,7,8-тетрагидропиразоло[3,4d]азепин-6(2H)-карбоксилата (может быть получен, как описано в описании 32, 10 мг, 0,03 ммоль) в диоксане (1 мл) добавляли 4 М хлороводородную кислоту в диоксане (2 мл). Полученную смесь перемешивали при комнатной температуре под аргоном в течение ночи. Реакционную смесь разбавляли метанолом и очищали с помощью SCX, элюируя метанолом и затем 2 М аммиак/метанол. Основные фракции объединяли и упаривали в вакууме, что давало указанное в заголовке соединение (D38). MC (ES+) m/е 292[М+Н]+. Описание 39. 1,1-Диметилэтил 2-4-[(метилсульфонил)амино]фенил-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилам (D39) К 4-[(метилсульфонил)амино]фенилбороновой кислоте (коммерчески доступна от, например,Combi-Blocks, 127 мг, 0,29 ммоль) в дихлорметане (3 мл) добавляли ацетат меди(II) (107 мг, 0,59 ммоль) и молекулярные сита 4 (190 мг) и реакцию перемешивали при комнатной температуре с доступом воздуха в течение 10 мин. Добавляли 1,1-диметилэтил-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилат (может быть получен, как описано в описании 9, 70 мг, 0,29 ммоль) и реакцию перемешивали при комнатной температуре с доступом воздуха в течение ночи. Реакционную смесь разбавляли метанолом и фильтровали через слой целита, промывая метанолом. Растворитель упаривали в вакууме. Добавляли этилацетат и воду, и продукт экстрагировали этилацетатом (3), промывали водой (1), затем насыщенным раствором бикарбоната натрия (1) и затем сушили над сульфатом магния. Растворитель- 24013600 упаривали в вакууме. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетата в гексане (0-50%). Необходимые фракции объединяли и растворитель упаривали в вакууме. Полученный неочищенный продукт очищали дополнительно путем автоматического разделения по массе (Mass Directed Autopreparation), что давало указанное в заголовке соединение (D39). МС (ES+) m/е 407 [М+Н]+. Описание 40. N-[4-(5,6,7,8-Тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)фенил]метансульфонамид(D40) К раствору 1,1-диметилэтил 2-4-[(метилсульфонил)амино]фенил-4,5,7,8-тетрагидропиразоло[3,4d]азепин-6(2 Н)-карбоксилата (может быть получен, как описано в описании 39, 16 мг, 0,039 ммоль) в диоксане (1 мл) добавляли 4 М хлороводородную кислоту в диоксане (2 мл). Полученную смесь перемешивали при комнатной температуре под аргоном в течение ночи. Реакционную смесь разбавляли метанолом и очищали с помощью SCX, элюируя метанолом и затем 2 М аммиак/метанол. Основные фракции объединяли и упаривали в вакууме, что давало указанное в заголовке соединение (D40). MC (ES+) m/е 307 [М+Н]+. Описание 41. 1,1-Диметилэтил 2-4-[(диметиламино)карбонил]фенил-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилат (D41) К суспензии 4-[6-[(1,1-диметилэтил)окси]карбонил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин 2(4 Н)-ил]бензойной кислоты (может быть получена, как описано в описании 23, 185 мг, 0,52 ммоль) в дихлорметане (10 мл) добавляли 1,1'-(оксометандиил)бис-1 Н-имидазол (168 мг, 1,04 ммоль), и реакцию перемешивали при комнатной температуре под аргоном в течение ночи. Добавляли диметиламин (93 мг,2,07 ммоль) и продолжали перемешивание под аргоном при комнатной температуре в течение 4 ч. Полученную неочищенную смесь разбавляли водой и экстрагировали дихлорметаном (2). Объединенные органические фракции промывали водой (1), сушили над сульфатом магния и растворитель упаривали в вакууме, что давало указанное в заголовке соединение (D41). МС (ES+) m/е 385 [М+Н]+. Описание 42. N,N-Диметил 4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)бензамид (D42) К раствору 1,1-диметилэтил 2-4-[(диметиламино)карбонил]фенил-4,5,7,8 тетрагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилата (может быть получен, как описано в описании 41,194 мг, 0,50 ммоль) в дихлорметане (14 мл) добавляли трифторуксусную кислоту (7 мл). Полученную смесь перемешивали при комнатной температуре под аргоном в течение 2 ч и затем разбавляли метанолом. Реакцию очищали с помощью SCX, элюируя метанолом и затем 2 М аммиак/метанол. Основные фракции объединяли и растворитель упаривали в вакууме. Полученный неочищенный продукт очищали дополнительно с помощью колоночной хроматографии на силикагеле, элюируя смесью 2 М аммиака в метанол/дихлорметан, что давало указанное в заголовке соединение (D42). MC (ES+) m/e 285 [М+Н]+. Описание 43. 2-[4-(1-Пиперидинил)фенил]-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин (D43) К раствору 1,1-диметилэтил 2-[4-(1-пиперидинил)фенил]-4,5,7,8-тетрагидропиразоло[3,4-d]азепин 6(2 Н)-карбоксилата (может быть получен, как описано в описании 33, 70 мг, 0,18 ммоль) в диоксане (1 мл) добавляли 4 М хлороводородную кислоту в диоксане (2 мл). Полученную смесь перемешивали при комнатной температуре под аргоном в течение ночи. Реакционную смесь разбавляли метанолом и очищали с помощью SCX, элюируя метанолом и затем 2 М аммиак/метанол. Основные фракции объединяли и растворитель упаривали в вакууме, что давало указанное в заголовке соединение (D43). MC (ES+) m/e 297 [М+Н]+. Описание 44. 1,1-Диметилэтил 2-[4-(1-пирролидинил)фенил]-4,5,7,8-тетрагидропиразоло[3,4d]азепин-6(2 Н)-карбоксилат (D44) Смесь 1,1-диметилэтил 2-(4-бромфенил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилата (может быть получен, как описано в описании 12, 200 мг, 0,51 ммоль), пирролидина (73 мкл, 1,02 ммоль), трис(дибензилиденацетон)дипалладия(0) (234 мг, 0,26 ммоль), [2'(дициклогексилфосфанил)-2-бифенилил]диметиламина (30 мг, 0,08 ммоль) и трет-бутоксида натрия (98 мг, 1,02 ммоль) в диоксане (4 мл) нагревали до 120 С в микроволновой печи (нормальное поглощение) в течение 30 мин. Реакционную смесь разбавляли метанолом и затем очищали с помощью SCX, элюируя метанолом и затем 2 М аммиак/метанол. Объединяли основные фракции и упаривали растворитель в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетата в гексане (0-40%), что давало указанное в заголовке соединение (D44). MC (ES+) m/e 383 [М+Н]+. Описание 45. 2-[4-(1-Пирролидинил)фенил]-2,4,5,6,7,8-тексагидропиразоло[3,4-d]азепин (D45) К раствору 1,1-диметилэтил 2-[4-(1-пирролидинил)фенил]-4,5,7,8-тетрагидропиразоло[3,4-d]азепин 6(2 Н)-карбоксилата (может быть получен, как описано в описании 44, 79 мг, 0,21 ммоль) в диоксане (3 мл) добавляли 4 М хлороводородную кислоту в диоксане (2 мл). Полученную смесь перемешивали при комнатной температуре под аргоном в течение ночи. Реакционную смесь разбавляли метанолом и затем очищали с помощью SCX, элюируя метанолом и затем 2 М аммиак/метанол. Основные фракции объединяли и растворитель упаривали в вакууме, что давало указанное в заголовке соединение (D45). MC (ES+)- 25013600 Описание 46. 2-Фенил-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин (D46) Раствор 2-(4-бромфенил)-6-(фенилметил)-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепина (может быть получен, как описано в описании 14, 49 мг, 0,13 ммоль) в этаноле (5 мл) с палладием (10% Pd/C паста) в качестве катализатора (10 мг) перемешивали в атмосфере водорода в течение ночи. На следующий день полученную смесь фильтровали через целит, что давало указанное в заголовке соединение, которое может быть использовано без дополнительной очистки (D46). МС (ES+) m/е 214 [М+Н]+. Описание 47. 1,1-Диметилэтил 3-оксо-2-[1-(фенилметил)-4-пиперидинил]-3,3 а,4,5,7,8 гексагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилат (D47) Смесь 4-гидразино-1-(фенилметил)пиперидин дигидрохлорида (коммерчески доступен от, например, Aurora Screening Library, 2,68 г, 9,63 ммоль) и трет-бутанола (60 мл) добавляли к 1-(1,1 диметилэтил)-4-этил-5-оксогексагидро-1 Н-азепин-1,4-дикарбоксилату (может быть получен, как описано в Synthetic Communication, 1992, 22(9), 1249-58, 2,50 г, 8,76 ммоль) с последующим добавлением триэтиламина (7,33 мл, 52,59 ммоль), и полученную суспензию нагревали до кипения приблизительно 10 мин под аргоном. Полученный прозрачный желтый раствор оставляли при данной температуре на 65 ч. Затем смесь охлаждали до комнатной температуры в течение 2 ч и упаривали в вакууме с получением твердого остатка кремового цвета. Очистка с помощью колоночной хроматографии на силикагеле, элюируя дихлорметаном:метанолом 50:125:110:1, давала продукт, что, когда распределяя между водой и дихлорметаном (100 мл каждого) слои отделяли и органический слой промывали дополнительно водой (100 мл), затем насыщенным раствором соли (100 мл) и затем сушили (Na2SO4), фильтровали и упаривали,приводило к указанному в заголовке соединению (D47). МС (ES+) m/е 427 [М+Н]+. Описание 48. 1,1-Диметилэтил 2-[1-(фенилметил)-4-пиперидинил]-3-[(трифторметил)сульфонил]окси-3,3 а,4,5,7,8-гексагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилат (D48) Раствор 1,1-диметилэтил 3-оксо-2-[1-(фенилметил)-4-пиперидинил]-3,3 а,4,5,7,8-гексагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилата может быть получен, как описано в описании 47, 278 мг, 0,65 ммоль) в дихлорметане (8 мл) обрабатывали диизопропилэтиламином (0,36 мл, 2,07 ммоль), после 1,1,1 трифтор-N-фенил-N-[(трифторметил)сульфонил]метансульфонамидом (373 мг, 1,04 ммоль) и полученный раствор нагревали до кипения в течение 5 мин и затем оставляли при этой температуре под аргоном на 22,5 ч. Затем смесь охлаждали в течение 3,5 ч и затем упаривали в вакууме. Очистка с помощью колоночной хроматографии на силикагеле, элюируя гексан:этилацетат 10:17:15:13:11:1, давала указанное в заголовке соединение (D48). МС (ES+) m/е 559 [М+Н]+. Описание 49. 1,1-Диметилэтил 2-(4-пиперидинил)-4,5,7,8-тетрагидропиразоло[3,4-d]азепин-6(2 Н)карбоксилат (D49) Смесь 1,1-диметилэтил 2-[1-(фенилметил)-4-пиперидинил]-3-[(трифторметил)сульфонил]окси 3,3 а,4,5,7,8-гексагидропиразоло[3,4-d]азепин-6(2 Н)-карбоксилата (может быть получен, как описано в описании 48, 355 мг, 0,64 ммоль) в этилацетате (9 мл) и метаноле (3 мл) обрабатывали триэтиламином(0,443 мл, 3,18 ммоль) и затем Pd(OH)2/C (20% мас./мас., 70 мг) и полученную смесь перемешивали в атмосфере Н 2 в течение 18,5 ч. Затем смесь фильтровали через кизельгур и упаривали в вакууме. Очистка путем автоматического разделения по массе давала указанное в заголовке соединение (D49). MC (ES+)(39 мг, 0,041 ммоль) и диоксан (2 мл) смешивали и нагревали до кипения под аргоном и оставляли при данной температуре на 14 ч. После дополнительных 1,5 ч добавляли еще 5-бром-2-метилпиридин (1,5 экв.), ацетат палладия (0,1 экв.), (+/-) BINAP (0,2 экв.) и трет-бутоксид натрия (2 экв.) и смесь перемешивали при кипении под аргоном в течение дополнительных 7 ч, затем смесь оставляли остывать на 45 мин и затем разбавляли метанолом и очищали с помощью SCX, элюируя метанолом, затем 2 М метанол/NH3. Дополнительно очищали с помощью (SPE(Si, элюируя дихлорметан:метанол 50:125:110:1. Дальнейшая очистка путем автоматического разделения по массе давала указанное в заголовке соединение Раствор N,N-диметил 4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)бензамида (24,0 мг,0,085 ммоль) (может быть получен, как описано в описании 42) в дихлорметане (2 мл) обрабатывали 2 метилпропаналом (16,0 мкл, 0,17 ммоль) и уксусной кислотой (1 капля) и перемешивали при комнатной температуре. Добавляли триацетоксиборгидрид натрия (36,0 мг, 0,17 ммоль) и смесь перемешивали при- 26013600 комнатной температуре приблизительно 50 ч. Смесь разбавляли метанолом и пропускали через SCXкартридж, элюируя метанолом и затем 2 М раствором аммиака в метаноле. Основные фракции объединяли и упаривали, что давало указанное в заголовке соединение (E1). MC (ES+) m/е 357 [М+NH3]+. Пример 2. N,N-Диметил 4-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)ил]бензамид (Е 2)N,N-Диметил 4-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]бензамид (Е 2) может быть получен из N,N-диметил-4-(5,6,7,8-тетрагидропиразоло [3,4-d]азепин-2(4 Н)-ил)бензамида(Е 3) может быть получен из N,N-диметил-4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)бензамида(Е 4) может быть получен из N,N-диметил-4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)бензамида Раствор N-Метил-4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)бензамида (может быть получен, как описано в описании 25, 30,0 мг, 0,11 ммоль) в дихлорметане (3 мл) обрабатывали 2 метилпропаналом (20,0 мкл, 0,22 ммоль) и уксусной кислотой (1 капля) и перемешивали при комнатной температуре. Добавляли триацетоксиборгидрид натрия (47,0 мг, 0,22 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли метанолом и пропускали через SCX-картридж,элюируя метанолом и затем 2M раствором аммиака в метаноле. Основные фракции объединяли и упаривали, что давало указанное в заголовке соединение (Е 5). МС (ES+) m/е 327 [M+NH3]+. Пример 6. N-Метил-4-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]бензамидN-Метил-4-[6-(1-метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]бензамид (Е 6) может быть получен из N-метил-4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)бензамида (может быть получен, как описано в описании 25, 30,0 мг, 0,11 ммоль), используя аналогичный процесс, который описан в примере 5, заменяя 2-метилпропанал ацетоном. MC (ES+) m/е 313 [M+Н]+. Пример 7. 4-(6-Циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)-N-метилбензамид 4-(6-Циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)-N-метилбензамид (Е 7) может быть получен из N-метил-4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)бензамида (может быть 4-(6-Циклопентил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)-N-метилбензамид (Е 8) может быть получен из N-метил-4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)бензамида (может быть получен, как описано в описании 25, 30,0 мг, 0,11 ммоль), используя аналогичный процесс, который описан в примере 5, заменяя 2-метилпропанал циклопентаноном. МС (ES+) m/е 339 [М+Н]+. Пример 9. 3-4-[6-(1-Метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4H)-ил]фенил-1,3-оксазолидин 2-он (Е 9) Раствор 3-[4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)фенил]-1,3-оксазолидин-2-она (25,0 мг, 0,08 ммоль, может быть получен, как описано в описании 27) в дихлорметане (3 мл) обрабатывали ацетоном (25,0 мкл, 0,34 ммоль) и уксусной кислотой (1 капля) и перемешивали при комнатной температуре. Добавляли триацетоксиборгидрид натрия (72,0 мг, 0,34 ммоль) и смесь перемешивали в течение 3 ч и ночи. Смесь разбавляли метанолом и пропускали через SCX-картридж, элюируя метанолом и затем 2 М раствором аммиака в метаноле. Основные фракции объединяли и упаривали, что давало указанное в заголовке соединение (Е 9). МС (ES+) m/е 341 [М+Н]+. Пример 10. 1-Метил-3-4-[6-(1-метилэтил)-5,6,7,6-тетрагидропиразоло[3,4-d]азепин-2(4 Н)ил]фенил-2-имидазолидинон (Е 10) Раствор 1-метил-3-[4-(5,6,7,8-тетрагидропиразоло [3,4-d]азепин-2(4 Н)-ил)фенил]-2-имидазолидинона (может быть получен, как описано в описании 29, 44,0 мг, 0,14 ммоль) в дихлорметане (3 мл) обрабатывали ацетоном (41 мкл, 0,56 ммоль) и уксусной кислотой (1 капля) и перемешивали при комнатной температуре. Добавляли триацетоксиборгидрид натрия (60,0 мг, 0,28 ммоль) и смесь перемешивали в течение 3 ч и ночи и добавляли дополнительную порцию ацетона и триацетоксиборгидрид натрия. Смесь разбавляли метанолом и пропускали через SCX-картридж, элюируя метанолом и затем 2M раствором аммиака в метаноле. Основные фракции объединяли и упаривали, что давало указанное в заголовке соединение (Е 10). МС (ES+) m/е 354 [М+Н]+. Пример 11. 1-Метил-3-4-[6-(2-метилпропил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)ил]фенил-2-имидазолидинон (Е 11) 1-Метил-3-4-[6-(2-метилпропил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]фенил-2 имидазолидинон (Е 11) может быть получен из 1-метил-3-[4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин 2(4 Н)-ил)фенил]-2-имидазолидинон (может быть получен, как описано в описании 29, 44,0 мг, 0,14 ммоль), используя аналогичный процесс, который описан в примере 10, заменяя ацетон 2 метилпропаналом. МС (ES+) m/е 368 [М+Н]+. Пример 12. 1-[5-(6-Циклобутил-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)-2-пиридинил]-2 пирролидинон (Е 12) Метод А. К раствору 1-[5-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)-2-пиридинил]-2-пирролидинона (может быть получен, как описано в описании 19, 12,0 мг, 0,04 ммоль) в дихлорметане (2 мл) и уксусной кислоте (2 капли) добавляли циклобутанон (5,0 мкл, 0,06 ммоль). Полученную смесь оставляли перемешиваться при комнатной температуре в течение 10 мин. Затем добавляли триацетоксиборгидрид натрия (13,0 мг, 0,06 ммоль) и смесь перемешивали в течение 1 ч. Реакционную смесь разбавляли мета- 28013600 нолом и применяли SCX-картридж (Varian bond-elute, 5 г), промывали метанолом и затем 2 М аммиак/метанол. Основные фракции объединяли, упаривали и дополнительно очищали с помощью хроматографии на силикагеле, элюируя смесью 2 М аммиака в метанол/дихлорметан (0-3%), что давало указанное в заголовке соединение (Е 12). МС (ES+) m/е 352 [М+Н]+. Метод В. К раствору 1-[5-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)-2-пиридинил]-2-пирролидинона (может быть получен, как описано в описании 19, 12,0 мг, 0,04 ммоль) в дихлорметане (2 мл) и уксусной кислоте (2 капли) добавляли циклобутанон (5,00 мкл, 0,06 ммоль), затем триацетоксиборгидрид натрия (13,0 мг, 0,06 ммоль) и смесь перемешивали в течение 1 ч. Полученную смесь оставляли перемешиваться при комнатной температуре в течение 1 ч, разбавляли метанолом и пропускали через 5 г SCXкартридж, элюируя метанолом, затем 2 М раствором аммиака в метаноле. Основные фракции объединяли, упаривали и очищали с помощью хроматографии, элюируя смесью 2 М аммиака в метаноле и дихлорметана (0-3%), что давало продукт (Е 12). МС (ES+) m/е 352 [М+Н]+. Метод С. К раствору 1-[5-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)-2-пиридинил]-2-пирролидинона (может быть получен, как описано в описании 19, 11 мг, 0,04 ммоль) в дихлорметане (3 мл) добавляли циклобутанон (6 мкл, 0,08 ммоль), затем уксусную кислоту (2 капли) и триацетоксиборгидрид натрия (17 мг, 0,08 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч, затем разбавляли метанолом и очищали с помощью SCX-картриджа, что давало указанное в заголовке соединение Метод А. К раствору 1-[4-(5,6,7,8-тетрагидропиразоло [3,4-d]азепин-2(4 Н)-ил)фенил]-2-пирролидинона (может быть получен, как описано в описании 22, 10,0 мг, 0,03 ммоль) в дихлорметане (2 мл) и уксусной кислоте (2 капли) добавляли циклобутанон (4,0 мкл, 0,05 ммоль). Полученную смесь оставляли перемешиваться при комнатной температуре в течение 10 мин. Затем добавляли триацетоксиборгидрид натрия(11,0 мг, 0,05 ммоль) и перемешивание продолжали в течение 1 ч. Реакционную смесь разбавляли метанолом и применяли SCX-картридж (Varian bond-elute, 5 г), промывали метанолом и затем смесью 2 М аммиак/метанол. Основные фракции объединяли, упаривали и дополнительно очищали с помощью хроматографии на силикагеле, элюируя смесью 2 М аммиака в метанол/дихлорметан (0-3%), что давало указанное в заголовке соединение (Е 13). МС (ES+) m/е 351 [М+Н]+. Метод В. К раствору 1-[4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)фенил]-2-пирролидинона (может быть получен, как описано в описании 22, 32,0 мг, 0,11 ммоль) в дихлорметане (2 мл) и уксусной кислоте (2 капли), добавляли циклобутанон (12,0 мкл, 0,16 ммоль), затем приблизительно через 10 мин добавляли триацетоксиборгидрид натрия (34,0 мг, 0,16 ммоль). Смесь оставляли перемешиваться при комнатной температуре в течение 30 мин перед добавлением дополнительной порции циклобутанона(12,0 мкл, 0,16 ммоль) и триацетоксиборгидрида натрия (34,0 мг, 0,16 ммоль). После перемешивания при комнатной температуре в течение 30 мин реакцию гасили метанолом и пропускали через 2 г SCXкартриджа, элюируя метанолом, затем 2 М раствором аммиака в метаноле. Основные фракции объединяли и упаривали, что давало продукт (Е 13). МС (ES+) m/е 351 [М+Н]+. Метод С. Смесь 1-[4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)фенил]-2-пирролидинона (может быть получен, как описано в описании 22, 65 мг, 0,22 ммоль) в дихлорметане (4 мл) обрабатывали циклобутаноном (0,033 мл, 0,44 ммоль), затем триацетоксиборгидридом натрия (93 мг, 0,44 ммоль). Полученную смесь затем перемешивали под аргоном в течение 14,25 ч. Затем смесь разбавляли метанолом (5 мл) и очищали с помощью SCX, элюируя метанолом и затем - аммиак/метанол (2 М). Соответствующие фракции объединяли, упаривали и затирали с диэтиловым эфиром, что давало продукт (Е 13). Пример 14. 1-4-[6-(1-Метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]фенил-2 пирролидинон (Е 14) К раствору 1-[4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)фенил]-2-пирролидинона (может быть получен, как описано в описании 22, 45 мг, 0,15 ммоль) в дихлорметане (3 мл) добавляли ацетон (17 мг, 0,30 ммоль) и уксусную кислоту (2 капли). Полученную смесь перемешивали при комнатной- 29013600 температуре под аргоном в течение 20 мин. Добавляли триацетоксиборгидрид натрия (64 мг, 0,30 ммоль) и продолжали перемешивание в течение 22 ч. Добавляли дополнительные 2 экв. ацетона (17 мг, 0,30 ммоль) и после 20 мин добавляли дополнительные 2 экв. триацетоксиборгидрида натрия (64 мг, 0,30 ммоль) и продолжали перемешивание в течение 3 ч. Полученную неочищенную смесь разбавляли метанолом и очищали с помощью SCX, элюируя метанолом и затем - 2 М аммиак/метанол. Основные фракции объединяли и растворитель упаривали в вакууме. Неочищенный продукт затирали в эфире, фильтровали, затем затирали с этилацетатом, что давало указанное в заголовке соединение (Е 14). МС (ES+) m/е 339 [М+Н]+. Пример 15. 6-(1-Метилэтил)-2-[4-(3-метил-1,2,4-оксадиазол-5-ил)фенил]-2,4,5,6,7,8-гексагидропиразоло[3,4-d]азепин (Е 15) К раствору 2-[4-(3-метил-1,2,4-оксадиазол-5-ил)фенил]-2,4,5,6,7,8-гексагидропиразоло[3,4d]азепина (может быть получен, как описано в описании 35, 31 мг, 0,10 ммоль) в дихлорметане (4 мл) добавляли ацетон (24 мг, 0,42 ммоль) и уксусную кислоту (3 капли). Полученную смесь перемешивали при комнатной температуре под аргоном в течение 20 мин. Добавляли триацетоксиборгидрид натрия (89 мг, 0,42 ммоль) и продолжали перемешивание в течение ночи. Полученную неочищенную смесь разбавляли метанолом и очищали с помощью SCX, элюируя метанолом и затем - 2 М аммиак/метанол. Основные фракции объединяли и растворитель упаривали в вакууме. Неочищенный продукт очищали дополнительно с помощью колоночной хроматографии на силикагеле, элюируя смесью 2 М аммиака в метанол/дихлорметан (0-1%). Полученный неочищенный продукт очищали дополнительно с помощью колоночной хроматографии на силикагеле, элюируя смесью 2M аммиака в метанол/дихлорметан (0-1%), что давало указанное в заголовке соединение (Е 15). MC (ES+) m/е 338 [M+Н]+. Пример 16. 4-[6-(2-Метилпропил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил]бензамид К раствору 4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4H)-ил)бензамида (может быть получен,как описано в описании 37, 31 мг, 0,12 ммоль) в дихлорметане (3 мл) добавляли 2-метилпропаналь (17 мг, 0,24 ммоль) и уксусную кислоту (2 капли). Полученную смесь перемешивали при комнатной температуре под аргоном в течение 20 мин. Добавляли триацетоксиборгидрид натрия (51 мг, 0,24 ммоль) и перемешивание продолжали в течение 2 ч. Полученную неочищенную смесь разбавляли метанолом и затем очищали с помощью SCX, элюируя метанолом и затем - 2M аммиак/метанол. Основные фракции объединяли и растворитель упаривали в вакууме, что давало указанное в заголовке соединение (Е 16). МС (ES+) m/е 313 [М+Н]+. Пример 17. 4-[6-(1-Метилэтил)-5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4H)-ил]бензамид (Е 17) К раствору 4-(5,6,7,8-тетрагидропиразоло[3,4-d]азепин-2(4 Н)-ил)бензамида (может быть получен,как описано в описании 37, 31 мг, 0,12 ммоль) в дихлорметане (3 мл) добавляли ацетон (14 мг, 0,24 ммоль) и уксусную кислоту (2 капли). Полученную смесь перемешивали при комнатной температуре под аргоном в течение 20 мин. Добавляли триацетоксиборгидрид натрия (51 мг, 0,2 4 ммоль) и перемешивание продолжали в течение 2 ч. Добавляли дополнительные 6 экв. ацетона и перемешивание продолжали в течение двух дней. Добавляли метанол и неочищенную смесь очищали с помощью SCX, элюируя метанолом и затем 2 М аммиак/метанол. Основные фракции объединяли и растворитель упаривали в вакууме. Неочищенный продукт затирали с эфиром и фильтровали, что давало указанное в заголовке соединение (Е 17). МС (ES+) m/е 299
МПК / Метки
МПК: A61K 31/55, A61P 25/28, C07D 487/04
Метки: 4-d]азепина, производные, н3-рецепторов, антагонисты, гистамина, пиразоло[3
Код ссылки
<a href="https://eas.patents.su/30-13600-proizvodnye-pirazolo3-4-dazepina-kak-antagonisty-n3-receptorov-gistamina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиразоло[3, 4-d]азепина как антагонисты н3-рецепторов гистамина</a>


































