Соединения и способы лечения дислипидемии
Номер патента: 12585
Опубликовано: 30.10.2009
Авторы: Чэнь Синьчао, Филдз Тодд, Херр Роберт Джейсон, Мартин Де Ла Нава Эва Мария, Партасарати Сараванан, Эскрибано Ана Мария, Мэнтло Натан Брайан, Матео -Эрранс Ана Исабель, Ванг Сяодун, Сиоффи Кристофер Лоуренс, Фернандес Мария Кармен, Динн Шон Ричард
Формула / Реферат
1. Соединение формулы I
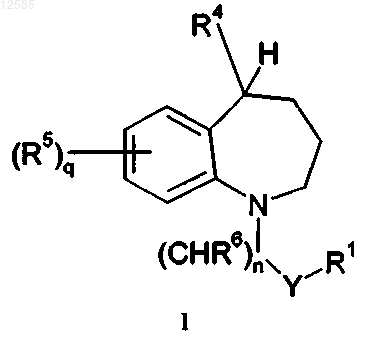
где n обозначает 0, 1, 2 или 3;
q обозначает 0, 1, 2, 3 или 4;
Y представляет собой связь или С=O;
R1 выбран из группы, которая включает арил, С3-С8циклоалкил или С0-С6алкилCOOR11, где каждый циклоалкил и арил необязательно замещены С0-С6алкилCOOR11;
R4 представляет собой группу формулы -NR4aR4b;
где R4a представляет собой тетразолил, необязательно замещенный от 1 до 3 группами C1-С6алкила; и
R4b представляет собой бензил, необязательно замещенный 1-3 группами, независимо выбранными из группы, которая включает C1-С6алкил или C1-С6галоалкил;
R5 выбран из группы, которая включает водород, C1-С6алкил или C1-С6галоалкил, где любые две группы R5 могут быть объединены, образуя необязательно замещенное 5- или 6-членное кольцо, конденсированное с фенильным кольцом (А-кольцо), к которому они присоединены, где 5- или 6-членное конденсированное кольцо является насыщенным, частично ненасыщенным или полностью ненасыщенным и необязательно содержит О;
R6 представляет собой водород;
R11 представляет собой водород или C1-С6алкил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где q обозначает 2.
3. Соединение по п.1 или его фармацевтически приемлемая соль, где n обозначает 0 и R1 представляет собой С3-С8циклоалкил.
4. Соединение по п.1, где р обозначает 1, n обозначает 0 и где каждый циклоалкил замещен СООН, или его фармацевтически приемлемая соль.
5. Соединение по п.1 или его фармацевтически приемлемая соль, где R4b представляет собой 3,5-бис-трифторметилбензил и R4a представляет собой
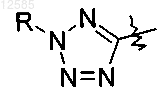
где каждый R представляет собой водород или C1-С6алкил.
6. Соединение, выбранное из группы, которая включает
(S)-(3,5-бис-трифторметилбензил)-(1-циклопентилметил-7-метил-8-трифторметил-2,3,4,5-тетрагидро-1Н-бензо[b]азепин-5-ил)-(2-метил-2Н-тетразол-5-ил)амин,
изопропиловый эфир 5-[(3,5-бис-трифторметилбензил)-(1Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты,
этиловый эфир (S)-5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты,
изопропиловый эфир (S)-5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты,
трет-бутиловый эфир (S)-5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты,
1-этилпропиловый эфир (S)-5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты,
циклопентиловый эфир (S)-5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты,
(S)-(3,5-бис-трифторметилбензил)-(1-этил-7-метил-8-трифторметил-2,3,4,5-тетрагидро-1Н-бензо[b] азепин-5-ил)-(2-метил-2Н-тетразол-5-ил)амин,
(4-{5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-илметил}циклогексил)уксусную кислоту,
(S)-5-{5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-ил}-3,3-диметилпентановую кислоту,
(+/-)-изопропил-6-[(3,5-бис-трифторметилбензил)-(1Н-тетразол-5-ил)амино]-2,3,6,7,8,9-гексагидро-1Н-10-аза-циклогепта[е]инден-10-карбоксилат,
изопропиловый эфир (+/-)-9-[(3,5-бис-трифторметилбензил)-(2Н-тетразол-5-ил)амино]-2,3,6,7,8,9-гексагидро-1Н-5-азациклогепта[f]инден-5-карбоновой кислоты,
изопропиловый эфир (+/-)-9-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-2,3,6,7,8,9-гексагидро-1Н-5-азациклогепта[f]инден-5-карбоновой кислоты,
(+/-)-изопропил 5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-9-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилат,
(S)-изопропил 5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-8,9-диметил-2,3, 4,5-тетрагидробензо[b]азепин-1-карбоксилат,
трет-бутиловый эфир (S)-9-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-2,3, 6,7,8,9-гексагидро-1Н-5-азациклогепта[f]инден-5-карбоновой кислоты,
(S)-(3,5-бис-трифторметилбензил)-(5-циклопентилметил-3,5,6,7,8,9-гексагидро-1Н-2-окса-5-азациклогепта[f]инден-9-ил)-(2-метил-2Н-тетразол-5-ил)амин,
изопропиловый эфир 5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-2,3,4,5, 7,8,9,10-октагидронафто[2,3-b]азепин-1-карбоновой кислоты,
изопропиловый эфир (R)-9-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-2,3,6,7,8,9-гексагидро-1Н-5-азациклогепта[f]инден-5-карбоновой кислоты,
изопропиловый эфир (S)-9-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-2,3,6,7,8,9-гексагидро-1Н-5-азациклогепта[f]инден-5-карбоновой кислоты,
метиловый эфир (S)-4-{5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-илметил}бензойной кислоты,
(S)-4-{5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-илметил}бензойную кислоту,
метиловый эфир (S)-3-{5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-илметил}бензойной кислоты,
(S)-3-{5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-илметил}бензойную кислоту,
(S)-(3,5-бис-трифторметилбензил)-(1-циклопропилметил-7-метил-8-трифторметил-2,3,4,5-тетрагидро-1Н-бензо[b]азепин-5-ил)-(2-метил-2Н-тетразол-5-ил)амин,
(S)-4-{5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-этил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-илметил}бензойную кислоту,
(S)-5-{9-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-1,3,6,7,8,9-гексагидро-2-окса-5-азациклогепта[f]инден-5-илметил}тиофен-2-карбоновую кислоту,
(S)-(4-{9-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-1,3,6,7,8,9-гексагидро-2-окса-5-азациклогепта[f]инден-5-илметил}циклогексил)уксусную кислоту,
(S)-5-{5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-2,3,4,5,7,8,9,10-октагидронафто[2,3-b]азепин-1-ил}-3,3-диметилпентановую кислоту,
(S)-(3,5-бис-трифторметилбензил)-(1-циклопентилметил-1-метил-2,3,4,5,7,8,9,10-октагидро-1Н-нафто[2,3-b]азепин-5-ил)-(2-метил-2Н-тетразол-5-ил)амин,
этиловый эфир (S)-5-{5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-илметил}-2-метилпропионовой кислоты,
(S)-3-{5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-ил}-2-метилпропионовую кислоту,
(S)-{5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-ил}уксусную кислоту,
2-{5-[(3,5-бис-трифторметилбензил)-(2-метил-2Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-ил}этиловый эфир (S)-уксусной кислоты,
и их фармацевтически приемлемую соль.
7. Фармацевтическая композиция, содержащая соединение по п.1 и по меньшей мере один из следующего: носитель, разбавитель и эксципиент.
8. Применение соединения по п.1 для изготовления лекарства для лечения атеросклероза у млекопитающих, включающее введение эффективной дозы соединения формулы I или его фармацевтически приемлемой соли млекопитающему.
9. Применение соединения по п.1 для изготовления лекарства для лечения дислипидемии у млекопитающих, включающее введение эффективной дозы соединения формулы I или его фармацевтически приемлемой соли пациенту, который в этом нуждается.
10. Применение соединения по п.1 для изготовления лекарства для лечения сердечно-сосудистых заболеваний у млекопитающих, включающее введение эффективной дозы соединения формулы I или его фармацевтически приемлемой соли пациенту, который в этом нуждается.
11. Применение соединения по п.1 или его фармацевтически приемлемой соли в терапии.
12. Применение соединения по п.9 для лечения низких уровней холестерина высокой плотности HDL в плазме.
Текст
012585 Область изобретения Данное изобретение относится к областям лекарственной органической химии, фармакологии и медицины. Кроме того, данное изобретение относится к группе соединений и к способам лечения патологических состояний, вызванных дислипидемией. Предпосылки создания изобретения Коронарное заболевание сердца (CHD) - одна из основных причин заболеваемости и смертности во всем мире. Несмотря на попытки ослабления таких факторов риска, как ожирение, курение, недостаток тренировок и лечение дислипидемии изменением рациона питания или лекарственной терапией, CHD остается самой распространенной причиной смерти в США. Более 50% всех смертных случаев, вызванных CHD, происходят из-за атеросклеротического коронарного сердечного заболевания, лежащего в ее основе. Дислипидемия - главный фактор риска для CHD. Низкие уровни холестеринового липопротеина высокой плотности (HDL) в плазме с нормальными или повышенными уровнями холестерина низкой плотности (LDL) - существенный фактор риска развития атеросклероза и связанного с ним коронарного заболевания артерий у людей. Действительно, несколько исследований профилей липопротеина пациентов с CHD показали, что около 50% пациентов с CHD имеют уровни холестерина, которые могут считаться находящимися в нормальном диапазоне (200 мг/дл). Более того, эти исследования обнаружили низкий уровень холестерина HDL приблизительно у 40% пациентов с нормохолестеринемической CHD по сравнению с общим населением, о чем сообщалось в Обзоре исследований национального здоровья и питания. Так как низкие уровни холестерина HDL увеличивают риск атеросклероза, то методы повышения холестерина HDL в плазме будут терапевтически эффективны для лечения сердечно-сосудистых заболеваний, включая, но, не ограничиваясь, атеросклероз, CHD, инсульт и болезнь сосудов периферических. Протеин, который переносит эфир холестерина (СЕТР)-74 KD гликопротеин, облегчающий обмен эфиров холестерина в HDL на триглицериды в обогащенных триглицеридом липопротеинах (A. R. Tall etal., (1999) 1999 George Lyman Duss Memorial Lecture: Lipid transfer proteins, HDL metabolism and atherogenesis. Arterio. Thromb. Vasc. Biol. 20:1185-1188). Конечным результатом активности СЕТР является снижение холестерина HDL и увеличение холестерина LDL. Это влияние на профиль липопротеина, как полагают, является проатерогенным, особенно в объектах, липидный профиль которых представляет собой увеличенный риск для CHD. Ниацин может значительно увеличить HDL, но имеет серьезные проблемы с переносимостью, которые снимают приемлемость. Фибраты и ингибиторы редуктазы HMG СоА только умеренно (10-12%) повышают холестерин HDL. В результате, существует значительная неудовлетворенная медицинская потребность в агенте, имеющем хорошую переносимость, который может значительно повысить уровни HDL в плазме, полностью останавливая или замедляя, таким образом, прогресс развития атеросклероза. СЕТР проявляется во многих тканях и секретируется в плазме, где он связывается с HDL (X.C. JiangChem. 266:4631-4639). Люди и обезьяны, которые проявляют СЕТР, имеют относительно низкий холестерин HDL, тогда как мыши и крысы не проявляют СЕТР и переносят почти весь свой холестерин вHDL. Более того, трансгенное проявление СЕТР у мышей приводит к значительно уменьшенным уровням холестерина HDL и развитию тяжелого атеросклероза, по сравнению с мышами из контрольной группы (K.R. Marotti et. al., (1993) Severe atherosclerosis in transgenic mice expressing simian cholesteryl ester transfer protein. Nature: 364, 73-75). Экспрессия человеческого СЕТР у чувствительных к соли Dahl крыс с повышенным давлением привела к спонтанной комбинированной гиперлипидемии, коронарному заболеванию сердца и уменьшило выживаемость (V.L.M. Herrera et. al., (1999) Spontaneous combined hyperlipidemia, coronary heart disease and decreased survival in Dahl salt-sensitive hypertensive rats transgenicfor human cholesteryl ester transfer protein. Nature Medicine: 5, 1383-1389). Антитела, непосредственно введенные в плазму или сгенерированные посредством инъекции вакцины, могут эффективно ингибировать активность СЕТР у хомяков и кроликов, что приводит к повышенному холестерину HDL (С. W. Rittershaus, (1999. Индуцированные вакциной антитела ингибируют активность СЕТР in vivo и уменьшают аортальные поражения в модели атеросклероза кролика. Более того, была показана антиатерогенность нейтрализации антитела СЕТР у кроликов (Arterio. Thromb. Vasc,Biol. 20, 2106-2112; G.F. Evans et al., (1994) Inhibition of cholesteryl ester transfer protein in normocholesterolemic and hypercholesterolemic hamsters: effects on HDL subspecies, quantity, and apolipoprotein distribution. J. Lipid Research. 35, 1634-1645). Однако антитело и/или лечение вакциной в настоящее время не являются жизнеспособным выбором для лечения больших популяций пациентов, нуждающихся в лечении дислипидемии и вызванных ею или связанных с ней проявлений болезненных состояний. Было несколько сообщений об ингибиторах малой молекулы СЕТР. Barret et al. (J. Am. Chem. Soc,188, 7863, (1996 и Kuo et al. (J. Am. Chem. Soc, 117, 10629, (1995 описывают циклопропан-содержащие ингибиторы СЕТР. Pietzonka et al. (Biorg. Med. Chem. Lett. 6, 1951 (1996 описывают фосфанатсодержащие аналоги в качестве ингибиторов СЕТР. Coval et al. (Bioorg. Med. Chem. Lett. 5, 605, (1995 описывают относящийся к сексвитерпинам Wiedendiol-A и -В в качестве ингибиторов СЕТР. Японская-1 012585 патентная заявка 10287662-А описывает полициклические, не содержащие аминов, полигидроксильные природные соединения, обладающие ингибирующими свойствами СЕТР. Lee et al. (J. Antibiotics, 49,693-96 (1996) описывают ингибиторы СЕТР, полученные из грибов поражающих насекомых. Busch et al.Zillversmit (J. Lipid Res., 35, 836-47 (1982 описывают, что п-хлорртутьфенилсульфонат, п-гидроксиртутьбензоат и этилртутьтиосалицилат ингибируют СЕТР. Connoly et al. (Biochem. Biophys. Res. Comm. 223, 42-47 (1996) описывают другие модификации реагентов цистеина в качестве ингибиторов СЕТР. Xiaet al. описывают 1,3,5-триазины в качестве ингибиторов СЕТР Bioorg. Med. Chem. Lett., 6, 919-22(1996. Bisgaier et al. (Lipids, 29, 811-8 (1994 описывают в качестве ингибиторов СЕТР 4-фенил-5 тридецил-4 Н-1,2,4-триазол-тиол. Oomura et al. в японской патентной заявке 10287662 в качестве ингибиторов СЕТР описывают непептидные тетрациклические и гексациклические фенолы. В патенте США 6586448 В 1 описаны 4-карбоксамино-2-замещенные-1,2,3,4-тетрагидрохинолины следующей структуры: где R1, R2, R3, R4, R5, R6, R7 и R8 определены в описании. Аналогичным образом, в патентных заявках РСТ, WO 03/063868 А 1, WO 00/17164, WO 00/17165 и WO 00/17166 по-разному описаны композиции, способы получения и способы применения соединений тетрагидрохинолина, которые в большинстве своем относятся к соединениям, описанным в патенте США 6586448 В 1, из которого они выделены. В европейской патентной заявке 818448 Schmidt et al. описывают производные тетрагидрохинолина в качестве ингибиторов протеина, который переносит эфиры холестерила. В европейской патентной заявке 818197, Schmek et al. описывают пиридины с конденсированными гетероциклами в качестве ингибиторов протеина, который переносит эфиры холестерила. Brandes et al. в немецкой патентной заявке 19627430 описывают бициклические конденсированные производные пиридина в качестве ингибиторов протеина, который переносит эфиры холестерила. В патенте США 6207671 Schmidt et al. описывают замещенные соединения пиридина в качестве ингибиторов СЕТР. В патентной заявке РСТ WO 03/028727 Muller-gliemann et al. и WO 98/39299 Gielen et al. описывают производные хинолина в качестве ингибиторов протеина, который переносит эфиры холестерила. Несмотря на вышеупомянутые описания, остается большая потребность, особенно для западного общества, в эффективных соединениях, пригодных для лечения состояний, вызванных, связанных с или обостренных дислипидемией. Краткое описание изобретения В данном изобретении представлено соединение формулы IY представляет собой связь или С=О;R1 выбран из группы, которая включает арил, С 3-С 8 циклоалкил или С 0-С 6 алкилCOOR11, где каждый циклоалкил и арил необязательно замещены С 0-С 6 алкилCOOR11;R4 представляет собой группу формулы -NR4aR4b; гдеR4a представляет собой тетразолил, необязательно замещенный от 1 до 3 группами C1-С 6 алкила; иR4b представляет собой бензил, необязательно замещенный 1-3 группами, независимо выбранными из группы, которая включает C1-С 6 алкил или C1-С 6 галоалкил;R5 выбран из группы, которая включает: водород, С 1-С 6 алкил или C1-С 6 галоалкил, где любые две группы R5 могут быть объединены, образуя необязательно замещенное 5- или 6-членное кольцо, конденсированное с фенильным кольцом (А-кольцо), к которому они присоединены, где 5- или 6-членное конденсированное кольцо является насыщенным, частично ненасыщенным или полностью ненасыщенным и необязательно содержит О;R11 представляет собой водород или С 1-С 6 алкил; и его фармацевтически приемлемые соли.-2 012585 В данном изобретении также раскрыто применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарства для лечения дислипидемии у млекопитающих, включающее введение эффективной дозы соединения формулы I или его фармацевтически приемлемой соли пациенту, который в этом нуждается. В данном изобретении также раскрыто применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарства для лечения сердечно-сосудистых заболеваний у млекопитающих, включающее введение эффективной дозы соединения формулы I или его фармацевтически приемлемой соли пациенту, который в этом нуждается. В данном изобретении также раскрыто применение соединения формулы I или его фармацевтически приемлемой соли в терапии. В данном изобретении также раскрыто применение соединения формулы I или его фармацевтически приемлемой соли для лечения низких уровней холестерина высокой плотности HDL- в плазме. Детальное описание изобретения В данном изобретении приводятся новые соединения формулы I, полезные для модулирования активности СЕТР. Фраза "заболевания" или "заболевания, связанные с аномальной активностью СЕТР " или "заболевания, опосредованные активностью СЕТР" относится к патологическим состояниям, в которых имеется склонность к атеросклерозу и/или другим сердечно-сосудистым заболеваниям из-за дислипидемии и/или других факторов риска и, поэтому, на них благотворно влияет понижающая регуляция или модулирование активности СЕТР. Эти заболевания включают, но не ограничиваются, гиперлипидемию и ее осложнения, такие, как атеросклероз, CHD, повышенное кровяное давление, CHF, инсульт, гипертонию, гипертриглицеридемию, диабет, ожирение, воспалительные заболевания, включая, но не ограничиваясь, дерматит, артрит и боль, и заболевания центральной нервной системы, включая, но не ограничиваясь, слабоумие, такие когнитивные расстройства, как болезнь Альцгеймера. Термин "лечение" имеет свое обычное значение, которое включает предупреждение, приостановление, улучшение, прекращение, ограничение, замедление или обратный прогресс, или уменьшение тяжести патологического симптома, связанного с или являющегося результатом модулирования активности СЕТР, особенно в том, что относится к повышению уровней HDL в плазме, или понижению уровнейLDL-холестерина, или повышению соотношения HDL/LDL или контролированию атеросклероза, гиперлипидемии и/или гиперхолестеринемии. Вообще специалист в данной области техники знает, что для всех стабильных молекул валентность должна быть сохранена (заполнена). Поэтому подразумевается, что специалист в данной области техники, исходя из общих знаний, дополняет атомами водорода до необходимой валентности все структуры,включая формулу I, если специально не указано иначе. Общие химические термины, использующиеся в описании соединений, описанных в данной заявке,имеют свои обычные значения. Например, термин "C1-6 алкил" или " (C1-C6)алкил" или "C1-С 6 алкил" относится к неразветвленной или к разветвленной алифатической цепи, состоящей из 1-6 атомов углерода,включая, но не ограничиваясь, метил, этил, пропил, изопропил, н-бутил, трет-бутил, пентил и гексил. Если не заявлено другое, то термин "алкил" означает C1-С 6 алкил. Аналогично, термин "С 0-С 6 алкил" подразумевает алкильную группу, как указано, где, когда применяется термин С 0, алкильная группа не присутствует, а оставшиеся группы присоединены непосредственно к основе. Термин "алкенил" и "алкинил", например, С 2-С 6 алкенильная группа или С 2-С 6 алкинильная группа,как используется в данной заявке, означают, что соответствующие группы могут включать 1, 2 или 3 двойных связи или тройных связи, соответственно. Если в группе присутствует более чем одна двойная или тройная связь, двойные и тройные связи могут быть спряженными или не спряженными. В данном изобретении также предполагается, что термин С 1-С 6 алкил или С 2-С 6 алкенил или аналогичные термины также включают указанный алкил или алкенил или подобную группу, которая может быть хиральной, регио- или стереоизомерной. Такие хиральные или регио- или стереоизомерные группы также включены в объем данного изобретения. Термин "алкиларил" относится к алкильной группе, замещенной арильной группой. Например, C1 С 6 алкиларил указывает на то, что арильная группа присоединена к C1-С 6 алкильной группе, и что полученный С 1-С 6 алкиларил присоединен к основе через алкильную группу. Термин "замещенный фенил" или "необязательно замещенный фенил" относится к фенильной группе, имеющей один или более заместителей, выбранных из группы, которая включает C1-С 6 алкил, С 1 С 6 алкокси, гидрокси, -COOR7, С 0-С 6 алкил-NR7R8, нитро, хлор, фтор, бром, йод, C1-С 6 галоалкил, C1-С 6 галоалкоксиалкил, С 0-С 6 алкилгетероциклил. Термины "необязательно замещенное 5-7-членное карбоциклическое" или "необязательно замещенное 5-7-членное гетероциклическое кольцо", написанные вместе или отдельно, или в простом или в сложноподчиненных предложениях, означают карбоциклическое или гетероциклическое 5-7-членное кольцо, которое необязательно замещено 1-3 группами, независимо выбранными из группы, которая включает гидрокси, галоген, C1-С 6 галоалкил, С 3-С 8 циклоалкил, C1-С 6 алкиларил, C1-С 6 алкилгетероциклил, арил, гетероциклил, С 0-С 3 алкилциано, нитро, C1-С 6 алкил, С 2-С 6 алкенил, C1-С 6 алкокси, арилокси,-3 012585-OC2-С 6 алкенил, -OC1-С 6 галоалкил, С 0-С 6 алкил-NR7R8, С 0-С 6 алкил-COR7, С 0-С 6 алкил-CO2R7, С 0-С 6 алкилCONR7R8, CONR7SO2R8, -NR7SO2R8, NR7COR8, -N=CR7R8, OCONR7R8, -S(O)0-2R7, -SO2NR7R8, C0C5CH2OH, -OC1-С 6 алкилгетероциклил и -OC1-С 6 алкиларил. Термин "необязательно замещенный", в общем, означает, что основная группа может быть замещена, где возможно, 1-3 группами, независимо выбранными из группы, которая включает: гидрокси, галоген, C1-С 6 галоалкил, С 3-С 8 циклоалкил, C1-С 6 алкиларил, C1-С 6 алкилгетероциклил, арил, гетероциклил, С 0 С 3 алкилциано, нитро, C1-С 6 алкил, С 2-С 6 алкенил C1-С 6 алкокси, арилокси, -ОС 2-С 6 алкенил, -OC1 С 6 галоалкил,С 0-С 6 алкил-NR7R8,С 0-С 6 алкил-COR7,С 0-С 6 алкил-CO2R7,С 0-С 6 алкил-CONR7R8,7 8 7 8 7 8 7 8 7 8 7 7 8CONR SO2R , -NR SO2R , -NR COR , -N=CR R , -OCONR R , -S(O)0-2R , -SO2NR R , C0-C5CH2OH, -OC1 С 6 алкилгетероциклил и -OC1-С 6 алкиларил. Где заявлена или раскрыта необязательно замещенная группа,нужно заметить, что как замещенная, так и незамещенная версии основной группы включены в объем изобретения, если только не указано иначе. Термин "арил" относится к замещенному или незамещенному ароматическому или гетероароматическому или гетероциклическому радикалу (гетероариларильные группы отнесены к этому термину). Примеры арильных групп включают, но не ограничиваются, нафтил, хинолил, тетрагидрохинолил, индазолил, пиримидинил, триазинил, пиразин, пиридазинил, пиперидил, пирролидинил, пиперазинил, морфолинил, тетрагидрофуранил, пиранил, тетразолил, имидазолил, 1,2,3-триазолил, 1,2,4-триазолил, оксадиазолил, тиадиазолил, тиазолил, оксазолил, изоксазолил, изотиазолил, пиразолил, имидазопиридин,бензимидазолил, триазолонил, имидазолонил, имидазолидинонил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил,1-пирролил, 2-пирролил, 3-пирролил, фенил, 2-пиридил, 3-пиридил, 4-пиридил, 1-нафтил, 2-нафтил, 2 бензофурил, 3-бензофурил, 4-бензофурил, 5-бензофурил, 6-бензофурил, 7-бензофурил, 2-бензотиенил, 3 бензотиенил, 4-бензотиенил, 5-бензотиенил, 6-бензотиенил, 7-бензотиенил, 1-индолил, 2-индолил, 3 индолил, 4-индолил, 5-индолил, 6-индолил, тетразол, имидазол, изоксазол, пиразол, 7-индолил и их изомеры. Как используется в данной заявке, термин арил также включает бензильную группу. Термин "карбоцикл", как используется в данной заявке, относится к циклической группе, содержащей только углерод и соответствующее количество атомов водорода. Термин включает такие группы,как циклоалкил, циклоалкен, циклоалкилен, нафтил, фенил и т.п. Термин "гетероцикл", "гетероциклил" или "гетероциклический" относится к 5-, 6- или 7-членному насыщенному, частично ненасыщенному или ароматическому моноциклическому или конденсированному бициклическому кольцу, содержащему 1-5 гетероатомов, выбранных из N, S или О, где указанный гетероцикл необязательно замещен при атоме (атомах) углерода или азота, если не указано иначе. Наиболее предпочтительные гетероциклические группы включают пиролидинил, пиперидинил, гексаметиленимино, морфолино, тиоморфолино, бензтиофен, индолил, хинолил, изохинолил, тетразолил и пиридинил. Как следствие, следует понимать, что термин "алкилгетероциклический" или "алкилгетероцикл" означает, что алкильная группа присоединена к гетероциклу и точкой присоединения является алкильная группа. Термин "галоалкил", как используется в данной заявке, относится к алкилу (как указано выше), замещенному одним или больше атомами галогена, выбранными из F, Br, Cl и I. Термин "галоалкоксиалкил", как используется в данной заявке, включает, например, трифторметокси, пентафторэтокси, трифторэтокси (OCH2CF3) и т.п. Термин "пролекарства" описывает производные соединений согласно изобретению, которые имеют химически или метаболически разщепляемые группы и становятся, путем сольволиза или при физиологических состояниях, соединениями, которые описываются в данном изобретении, которые являются фармацевтически активными in vivo. Производные соединений согласно данному изобретению имеют активность как в кислотной, так и в основной формах, но форма кислотной производной часто предлагает преимущества, связанные с растворимостью, совместимостью с тканями или отсроченным высвобождением в организме млекопитающего (см. Bundgard, H., Design of Prodruqs, pp.7-9, 21-24, Elsevier, Amsterdam 1985). Пролекарства включают кислотные производные, такие как эфиры, полученные реакцией исходного кислотного соединения с подходящим спиртом, или амиды, полученные реакцией исходного кислотного соединения с подходящим амином. Простые алифатические эфиры (например, метил, этил,пропил, изопропил, бутил, втор-бутил, трет-бутил) или ароматические эфиры, полученные из кислотных групп, входящих в структуру соединений согласно данному изобретению, являются предпочтительными пролекарствами. Другие предпочтительные эфиры включают морфолиноэтилокси, диэтилгликоламид и диэтиламинокарбонилметокси. В некоторых случаях желательно приготовить пролекарства типа двойного эфира, такие как (ацилокси)алкиловые эфиры или алкоксикарбонил)окси)алкиловые эфиры. Как используется в данной заявке, термин "защитная группа" относится к группе, маскирующей реакционноспособные места в молекуле, для увеличения реакционной способности другой группы или для того, чтобы обеспечить реакцию на другом требуемом фрагменте или фрагментах, после чего защитная группа может быть удалена. Защитные группы обычно используются для защиты или маскировки группы, включая, но не ограничиваясь, -О, -NH и -СООН. Подходящие защитные группы известны специалисту в данной области техники и описаны в Protecting groups in Organic Synthesis, 3rd edition, Greene, T. W.;-4 012585 Как используется в данной заявке, термин сольват относится к форме соединения согласно изобретению, в которой кристалл или кристаллы соединения, которое описывается в данном изобретении,были образованы из стехиометрического или нестехиометрического количества соединения формулы I и молекул растворителя. Типичные растворители включают, без ограничения, например, воду, метанол,этанол, ацетон и диметилформамид. Когда растворитель представляет собой воду, необязательно может использоваться термин "гидрат". В тех случаях, когда соединение согласно данному изобретению имеет кислотные или основные функциональные группы, могут быть образованы различные соли, которые улучшают растворимость в воде и/или являются более физиологически подходящими, чем исходное соединение. Типичные представители фармацевтически приемлемых солей включают, но не ограничиваются, соли щелочных и щелочноземельных металлов, таких как литий, натрий, калий, кальций, магний, алюминий и т.п. Соли легко получают из свободной кислоты обработкой кислоты в растворе основанием или пропуская кислоту через ионообменную смолу. Включенные в определение фармацевтически приемлемых, соли являются относительно нетоксичными, неорганическими и органическими основными или кислотными аддитивными солями соединений согласно данному изобретению. Основные аддитивные соли включают, например, катионы аммония,четвертичного аммония и амина, полученные из азотистых оснований, имеющих достаточную основность, чтобы образовать соли с соединениями согласно данному изобретению (см., например, S. M.Berge, et al., "Pharmaceutical Salts," J. Phar. Sci., 66:1-19 (1977. Кроме того, основная группа (группы) соединения данного изобретения может реагировать с подходящими органическими или неорганическими кислотами, образуя соли типа ацетата, бензолсульфоната, бензоата, бикарбоната, бисульфата, битартрата, бората, гидробромида, камсилата, карбоната, клавуланата, цитрата, хлорида, эдетата, эдизилата,эстолата, эзилата, фторида, фумарата, глюцептата, глюконата, глутамата, гликолиларсанилата, гексилрезорцината, гидрохлорида, гидроксинафтоата, гидройодида, изотионата, лактата, лактобионата, лауреата,малеата, манделата, мезилата, метилбромида, метилнитрата, метилсульфата, муката, напзилата, нитрата,олеата, оксалата, пальмитата, пантотената, фосфата, полигалактуроната, салицилата, стеарата, субацетата, сукцината, танната, тартрата, тозилата, трифторацетата, трифторметансульфоната и валерата. Предпочтительные соли для целей данного изобретения включают гидрохлоридную соль, гидробромидную соль, бисульфатную соль, соль метансульфоновой кислоты, соль п-толуолсульфоновой кислоты, битартрат, ацетат и цитрат. Соединение, которое описывается в данном изобретении, проиллюстрированное формулой I, может встречаться в виде любого из его позиционных изомеров, стереохимических изомеров или региоизомеров, все из них включены в объем данного изобретения. Некоторые соединения, которые описаны в данном изобретении, могут иметь один или более хиральных центров, и таким образом, могут существовать в оптически активных формах. Аналогично, если соединения содержат алкенильную или алкениленовую группу, то существует возможность цис- или транс-изомерных форм соединений. R- и S-изомеры и их смеси, включая рацемические смеси, а также смеси энантиомеров или цис- и транс-изомеров, рассмотрены в данном изобретении. В замещающей группе, такой как алкильная группа, могут присутствовать дополнительные асимметричные атомы углерода. Имеется в виду, что все такие изомеры, а также их смеси включены в объем данного изобретения. Если желателен определенный стереоизомер, то его можно синтезировать с помощью способов, хорошо известных из уровня техники, путем использования стереоспецифических реакций и исходных веществ,которые содержат асимметричные центры и уже разделены. Альтернативно, желательные стереоизомеры могут быть получены способами, в которых получают смеси стереоизомеров, и последующего разделения по известным методикам. Например, рацемическая смесь может реагировать с единственным энантиомером некоторого другого соединения, то есть с хиральным разделяющим агентом. Это переводит рацемическую форму в смесь стереоизомеров и диастереоизомеров, потому что они имеют различные точки плавления, различные точки кипения и различную растворимость и могут быть отделены обычными средствами, такими как кристаллизация. Предпочтительные осуществления изобретения Соединение формулы IY представляет собой связь или С=O;-5 012585 циклоалкил и арил необязательно замещены С 0-С 6 алкилCOOR11;R4 представляет собой группу формулы -NR4aR4b; гдеR4a представляет собой тетразолил, необязательно замещенный от 1 до 3 группами С 1-С 6 алкила; иR4b представляет собой бензил, необязательно замещенный 1-3 группами, независимо выбранными из группы, которая включает C1-С 6 алкил или C1-С 6 галоалкил;R5 выбран из группы, которая включает: водород, C1-С 6 алкил или C1-С 6 галоалкил, где любые две группы R5 могут быть объединены, образуя необязательно замещенное 5- или 6-членное кольцо, конденсированное с фенильным кольцом (А-кольцо), к которому они присоединены, где 5- или 6-членное конденсированное кольцо является насыщенным, частично ненасыщенным или полностью ненасыщенным и необязательно содержит О;R11 представляет собой водород или С 1-С 6 алкил.(S)-4-5-[(3,5-бис-трифторметилбензил)-(2-метил-2H-тетразол-5-ил)амино]-7-этил-8-трифторметил 2,3,4,5-тетрагидробензо[b]азепин-1-илметилбензойную кислоту,(S)-5-9-[(3,5-бис-трифторметилбензил)-(2-метил-2H-тетразол-5-ил)амино]-1,3,6,7,8,9-гексагидро-2 окса-5-азациклогепта[f]инден-5-илметилтиофен-2-карбоновую кислоту,(S)-(4-9-[(3,5-бис-трифторметилбензил)-(2-метил-2H-тетразол-5-ил)амино]-1,3,6,7,8,9-гексагидро 2-окса-5-азациклогепта[f]инден-5-илметилциклогексил)уксусную кислоту,(S)-5-5-[(3,5-бис-трифторметилбензил)-(2-метил-2 Н-тетразол-5-ил)амино]-2,3,4,5,7,8,9,10-октагидронафто[2,3-b]азепин-1-ил-3,3-диметилпентановую кислоту,(S)-(3,5-бис-трифторметилбензил)-(1-циклопентилметил-1-метил-2,3,4,5,7,8,9,10-октагидро-1 Ннафто[2,3-b]азепин-5-ил)-(2-метил-2 Н-тетразол-5-ил)амин,этиловый эфир (S)-5-5-[(3,5-бис-трифторметилбензил)-(2-метил-2 Н-тетразол-5-ил)амино]-7-метил 8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-илметил-2-метилпропионовой кислоты,(S)-3-5-[(3,5-бис-трифторметилбензил)-(2-метил-2H-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-ил-2-метилпропионовую кислоту,(S)-5-[(3,5-бис-трифторметилбензил)-(2-метил-2H-тетразол-5-ил)амино]-7-метил-8-трифторметил 2,3,4,5-тетрагидробензо[b]азепин-1-илуксусную кислоту,2-5-[(3,5-бис-трифторметилбензил)-(2-метил-2H-тетразол-5-ил)амино]-7-метил-8-трифторметил 2,3,4,5-тетрагидробензо[b]азепин-1-илэтиловый эфир (S)-уксусной кислоты,и их фармацевтически приемлемые соли. Геометрические изомеры, связанные с двойными связями, и оптические изомеры, связанные с асимметричными атомами углерода соединений формулы I, также рассматриваются в рамках данного изобретения как полезные при лечении заболеваний, связанных с модулированием СЕТР. Синтез соединений согласно данному изобретению Соединения согласно настоящему изобретению могут быть синтезированы, как проиллюстрировано на схемах, примерах и методиках ниже. Антранилатные промежуточные соединения формулы 1 могут быть синтезированы химически, например, по следующим маршрутам синтеза, приведенным на схемах ниже. Однако последующее обсуждение не предназначено для того, чтобы каким-либо образом ограничить рамки данного изобретения, поскольку специалист в данной области техники способен экстраполировать без чрезмерного экспериментирования, исходя из схем и примеров в данной заявке, другие конкретные соединения в рамках данного изобретения. Многие реактивы и исходные вещества могут быть легко получены от коммерческих поставщиков или легко доступны специалисту в данной области техники. Другие реактивы и исходные вещества могут быть получены в соответствии с методиками, которые выбраны из стандартных методик органической химии и химии гетероциклов, методик, которые аналогичны синтезам известных подобных реактивов или исходных веществ, и методик, описанных в получениях и примерах ниже, включая любые новые методики. Такие известные методики включают, но не ограничиваются, этерификацию карбоновой кислоты, гидролиз нитрила до карбоновой кислоты, и последующую этерификацию. R, R1, R2, R3, R4, R5, R6 и т.д., используемые в данном разделе для иллюстрации различных способов синтеза соединений согласно данному изобретению и/или для иллюстрации изменения заместителей в положении, не обязательно синонимичны в рамках или по значениям аналогичным группам, которые используются в родовой структуре для соединений формулы I. Однако группы в конечных соединениях на схемах, которые находятся в аналогичных положениях, распространены в рамках и значениях по сравнению с группами, занимающими аналогичные положения, как определено для родовой структуры соединений формулы I. Схема 1 получения промежуточного соединения На схеме 1 получения промежуточного соединения нуклеофильное ароматическое замещение происходит с помощью методов, известных из уровня техники (Wells, K. M. et al. Tetrahedron Letters, 1996,37(36), 6439-6442). Подходяще замещенный амин растворяют в подходящем растворителе, таком какDMF или DMSO, с основанием, таким как карбонат цезия, и подходяще замещенным бензонитрилом или фторбензоатом (R6=CN или CO2R3). Реакция проходит при от 0 С до повышенных температур (вплоть до или около 150 С) в чем-нибудь в течение от 10 мин до нескольких дней в зависимости от стабильности исходных веществ и/или условий реакции. Продукт структуры 4 (R6=CN) или 1 (R6=CO2R3) потом-7 012585 может быть выделен с помощью стандартной водной обработки, с последующим использованием нормально-фазовых хроматографических методов или методов перекристаллизации, которые обычно используются в уровне техники. Схема 2 получения промежуточного соединения На схеме 2 получения промежуточного соединения, N-арильное соединение происходит с помощью методов, известных из уровня техники (Hartwig, J. F. et al. Angew. Chem., Int. Ed. Engl. 1998, 37, 20462067). Подходяще замещенный амин растворяют в подходящем растворителе, таком как DMF, с основанием, таким как карбонат цезия или трет-бутоксид натрия, с подходяще замещенным бензонитрилом или галоалкилбензоатом (R6=CN или CO2R3), и подходящим комплексом катализатора, таким как ацетат палладия и дифенилфосфиноферроцен. Реакция проходит при от 0 С до повышенных температур в чемнибудь в течение от 10 мин до нескольких дней в зависимости от стабильности исходных веществ. Продукт структуры 4 (R6=CN) или 1 (R6=CO2R3) потом может быть выделен с помощью стандартной водной обработки, с последующим использованием нормально-фазовых хроматографических методов или методов перекристаллизации, которые обычно используются в уровне техники. Схема 3 получения промежуточного соединения На схеме 3 получения промежуточного соединения, карбонилирование происходит с помощью методов, известных из уровня техники (Heck, Palladium Reagents in Organic Synthesis; Academic Press: NewYork, 1985, pp.348-358). Подходяще замещенный арилбромид растворяют в подходящем растворителе,таком как DMF, с основанием, таким как карбонат цезия или трет-бутоксид натрия, с подходящим комплексом катализатора, таким как ацетат палладия и дифенилфосфиноферроцен, подходящим спиртом(R3-OH) и насыщают монооксидом углерода. Реакция проходит при от 0 С до повышенных температур(вплоть до или около 150 С) в чем-нибудь в течение от 10 мин до нескольких дней в зависимости от стабильности исходных веществ и/или условий реакции. Продукт структуры 1 потом может быть выделен с помощью стандартной водной обработки, с последующим использованием нормально-фазовых хроматографических методов или методов перекристаллизации, которые обычно используются в уровне техники. Схема 4 получения промежуточного соединения На схеме 4 получения промежуточного соединения ароматическое карбоксилирование происходит с помощью методов, известных из уровня техники (Boger, D. L. et al., Journal of Organic Chemistry, 1994,59(17), 4943-4949, Volpin et al., Organomet. Reactions, 1975, 5, 313-386). Подходяще замещенный арилбромид растворяют в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран, с алкиллитием, таким как н-бутил литий или трет-бутил литий, или стружками магния. Полученный анион гасят подходящим источником диоксида углерода, таким как сухой лед или диметилкарбонат. Реакция проходит при от приблизительно -78 С до приблизительно комнатной температуры в чем-нибудь в течение от приблизительно 5 мин до нескольких часов в зависимости от стабильности исходных веществ. Продукт структуры 1 потом может быть выделен с помощью стандартной водной обработки, с последующим использованием нормально-фазовых хроматографических методов или методов перекристаллизации, которые обычно используются в уровне техники. На схеме синтеза 5 показано получение соединений формулы I. Например, замещенные ариламино эфиры 1, которые являются или коммерчески доступными, или получены, как описано в литературе или на схемах 1-4, могут быть защищены тозилхлоридом, изопропил хлорформиатом или другой подходящей защитной группой с получением 54. Соединение 54, в свою очередь, может быть алкилировано подходяще замещенными или незамещенными 3-бромэтилэфирами 55, таким образом получая 56. Конденсацией-циклизацией Дикманна промежуточного соединения 56 получают N-защищенный бензазепинон 57,который подвергают кислотному гидролизу и декарбоксилированию, получая производные кетона 58. Снятием защитной группы, если необходимо, кислотой (например РРА (полифосфорная кислота, TMSI(триметилсилилйодид) или HCl получают промежуточное соединение 59. N-ацилирование 59 обработкой подходяще замещенным арилом или алкилхлорформиатом в присутствии органического основания, такого как пиридин, предоставляет карбаматы структуры 64. Альтернативно, обработка 59 хлорангидридом кислоты или подходящим активированным эфиром предоставляет соединения формулы 64. Промежуточный бензазепин-5-оны может быть восстановлен восстановителем, таким как боргидрид натрия, в подходящем растворителе, таком как тетрагидрофуран или метанол, получая бензиловый спирт 65, как показано на схеме 5. Схема 6 Соединения формулы I могут быть получены, как показано на схемах 6 и 7, в которых используется химия восстановительного аминирования. Образование основания Шиффа бензазепин-5-онов 64 с гетероциклическим амином с последующей обработкой восстановителем, таким как боргидрид натрия, в подходящем растворителе, таком как тетрагидрофуран или метанол, предоставляет аддукты гетероциклического амина. При дальнейшем проведении реакции с активированным бензильным реагентом в присутствии основания или используя реакцию замещения по типу Митцунобу получают соответствующий продукт, соединение согласно изобретению. Альтернативно бензазепин-5-оны (64) могут быть восстановлены до соответствующего карбинольного промежуточного соединения восстановителем, таким как боргидрид натрия, в подходящем растворителе, таком как тетрагидрофуран или метанол. Эти аддукты могут быть непосредственно превращены, получая продукты дизамещенного амина, используя протокол Митцунобу, или изначально превращены в активированные образцы, такие как мезилат, тозилат или-9 012585 бромид, и замещены бензиламином, замещенным гетероциклом, получая продукты тризамещенного амина, как показано на схеме 6. Предпочтительная группа для потенциальных гетероциклических R-A заместителей была описана выше. Схема 7 Обратная методика образования дизамещенного амина показана на схеме 7. Образованием основания Шиффа бензазепин-5-онов (64) с бензиловым амином с последующей обработкой восстановителем,таким как боргидрид натрия, в подходящем растворителе, таком как тетрагидрофуран или метанол, получают аддукт дизамещенного бензилового амина 69. Дальнейшее проведение реакции с активированным гетероциклическим реагентом в присутствии основания (или альтернативно, образование основания Шиффа с гетероароматическим альдегидом с последующим восстановлением) обеспечивает вторичный маршрут получения продуктов дизамещенного амина 67. Схема 8 Соединения формулы I также могут быть получены превращением присоединенной функциональности, как показано на схеме 8. Продукты дизамещенного амина, такие как 68, в которых компонент R-A соответствует химически активной функциональности, такой как циано, карбоксилат или подобная группа, могут быть преобразованы в гетероциклические компоненты, такие как 71, на промежуточных стадиях синтеза или в конце синтеза. Также, порядок N-замещения может быть изменен, как показано выше. Методики для превращения присоединенных функциональностей, где R-A соответствует химически активной функциональности, такой как нитрил, карбоксилат и т.д., известны специалисту в данной области техники и могут быть найдены в учебниках по общей органической химии и/или химии гетероциклов,таких как, но, не ограничиваясь, Comprehensive Organic Transformations, 2nd, ed., by Richard Larock, WileyVCH, Publishers, New York. На схеме 8 а показано несколько примеров реакций превращения, чтобы проиллюстрировать взаимопревращения функциональностей, в качестве средств получения соединений согласно изобретению. Детальные методики описаны в примерах, известны специалисту в данной области техники или легко доступны из справочных источников специалисту в данной области техники. Схема 9 Соединения формулы I также могут быть получены, как показано на схемах 9 и 10, в которых промежуточные бензазепин-5-он преобразовывают в аддукты бензилового амина. Это может быть достигнуто с помощью целого ряда методов, включая восстановительное аминирование с заменителем первичного амина (таким как гидроксиламин, гидразин, хлорид аммония, бензофенонимин, среди других), получая первичный амин, как показано на схеме 9, или они могут быть включены в порядок построения кольца, как показано на схеме 10 ниже, с помощью химии, известной специалисту в данной области техники (Hadden, М.; Nieuwenhuyzen, М.; Potts, D.; Stevenson, P. J.; Thompson, N. Tetrahedron 2001, 57, 5615;Crousse, В.; Begue, J.-P.; Bonnet-Delpon, D. J Org Chem 2000, 65, 5009). Образованием основания Шиффа с помощью обработки амина бензальдегидом с последующей обработкой восстановителем, таким как боргидрид натрия, в подходящем растворителе, таком как тетрагидрофуран или метанол, получают аддукты бензилового амина (или альтернативно, замещением активированного бензилового субстрата, такого как мезилат, тозилат или бромид, получают продукт бензиламина). После этого следует обработка активированным гетероарильным (гетероциклическим арильным) субстратом, таким как мезилат, тозилат или бромид, в присутствии основания с получением дибензиловых продуктов, как показано на схеме 9. В обратном способе, образованием основания Шиффа бензазепин-5-аминов с гетероароматическим альдегидом, с последующей обработкой восстановителем, таким как боргидрид натрия, в подходящем растворителе, таком как тетрагидрофуран или метанол (или альтернативно, замещением подходяще активированного гетероарильного субстрата, такого как мезилат, тозилат или бромид) получают аддукт бензилового гетероароматического амина. Потом проводят обработку активированным бензиловым субстратом, таким как мезилат, тозилат или бромид, в присутствии основания, с получением дибензиловых продуктов, как показано на схеме 9. Схема 10 На схеме 10, соединение 64 может быть обработано основанием, таким как гидрид натрия или диизопропиламид лития или бис(триметилсилил)амид лития, в растворителе, таком как DMF или тетрагидрофуран. Алкилированием подходяще замещенным галогенидом или мезилатом или тозилатом может быть получено соединение 79, в котором R3a и R3b может быть одинаковыми или различными. 79 превращают в 67, как описано, например, выше на схеме 9. Схема 11 Как показано на схеме 11, соединение 73d может быть гидролизировано до соответствующего амина 80, и может быть потом ацилировано, используя стандартные методики, известные или определенные специалистом в данной области техники с получением 73d. Или альтернативно, 80 может быть обработано трифосгеном или трихлорметил-хлорформиатом с получением 81. Из соединения 81 можно получить соединение 73d с помощью реакции с подходящими спиртами. Также, соединение 80 может быть алкилировано с помощью методов, известными из уровня техники, таких как обработка 80 основанием и алкилгалогенидом, тозилатом или подобным, с получением 82. Альтернативно, соединение 82 может быть получено, используя условия восстановительного аминирования. Как показано на схеме 12, тетразол 83 может быть алкилирован подходящим защищенным аминоспиртом в условиях по Митцунобу или подходящим защищенным аминоалкилбромидом, йодидом, мезилатом или подобным, в присутствии основания, с получением защищенного аминоалкилтетразола 84. Удалением защитной группы Р 1, используя методы, хорошо известные из уровня техники, может быть получено соединение 85. Альтернативно, тетразол 83 может быть алкилирован подходящим алкилцианобромидом или подходящим акрилонитрилом в условиях реакции Михаэля. Цианопроизводное 86 потом может быть восстановлено до соответствующего амина 85. Тетразол 83 может быть алкилирован,используя подходящий спирт в условиях по Митцунобу, или подходящим алкил галогенидом или подобным в присутствии основания, с получением 87. Удалением Р 1 (защитной группы), используя методы,хорошо известные из уровня техники, может быть получено соединение 88. Альтернативно, гидроксиалкилтетразол 88 может быть получен алкилированием 83 соответствующим галогенидом в присутствии основания. Схема 14 Как показано на схеме 14, соединение 89 может быть окислено до соединения 90 оксидом рутения в присутствии периодата натрия. Соединение 90 может быть превращено в 91, как описано, например, на- 13012585 схеме 9. Депротектированием трет-бутоксикарбонильной группы с помощью методов, хорошо известных из уровня техники, можно получить амид 92. Алкилированием 92 подходящим алкилгалогенидом или тозилатом или подобным в присутствии основания можно получить соединение 93. Схема 15 Как показано на схеме 15, йодоарильное производное 94 может быть превращено в кетон 95 с помощью реакции литиевого обмена, с последующим добавлением амида Вайнреба. Затем превращением соединения 95 в альдегид 96 и окислением до соответствующей карбоновой кислоты может быть получено соединение 97. Гидролизом аминозащитной группы и реакцией восстановительного аминирования может быть получено соединение 99, которое может быть циклизировано в соединение 100. Окончательно соединение 93 может быть получено, как описано на схеме 14. Анализ Данные протоколы анализов и их результат(ы), демонстрирующие применимость и эффективность соединений и/или способов согласно данному изобретению, приведены для иллюстрации и не предназначены для какого-либо ограничения. Анализ ингибитора СЕТР in vitro: анализ SPA Для тестирования способности соединений согласно данному изобретению ингибировать перенос изотопно-меченых эфиров холестерина от HDL к LDL был использован сцинтилляционный анализ близости (SPA) in vitro. Этот анализ позволяет проследить ингибирование переноса эфиров [3 Н]холестерина от HDL (Amersham) к биотинилированному LDL (Amersham) с помощью источника СЕТР. Источником СЕТР в этом анализе может быть СЕТР, произведенный клетками AV-12, созданными для проявления человеческого СЕТР. После 30-минутной инкубации, при которой изотопно-меченые эфиры холестерина переносились в буфер на основе HEPES-NaCl, реакция была остановлена, и биотинилированный LDL был связан с стрептавидином/сцинтиллянтом, покрытым гранулами SPA (Amersham). Затем радиоактивный сигнал был измерен на 96-лунковом сцинтилляционном счетчике TopCounter Packard с полностью открытыми табличными установками. Уменьшение радиоактивного сигнала от LDL относительно стандарта указывает на способность соединений ингибировать активность СЕТР. Предпочтительные соединения согласно изобретению, исследованные в соответствии с этим протоколом анализа, проявляют ингибирование СЕТР при концентрациях менее чем 100 микромолярная. Альтернативно, в этом анализе могут использоваться другие источники СЕТР для переноса меченных изотопом эфиров холестерина. Например, в этом анализе в качестве источника СЕТР могут использоваться эндогенный СЕТР из человеческой плазмы, СЕТР от мышей, которые выражают человеческий СЕТР, эндогенный СЕТР от хомяков. В этом анализе могут использоваться буферы, другие, чем буфер на основе HEPES-NaCl, например,в качестве буфера могут использоваться человеческая плазма, плазма мыши или Трис-буфер, который имеет высокое содержание альбумина. Специалист в данной области техники понимает, что могут использоваться другие источники радиоактивности, чтобы проследить активность СЕТР в этом анализе. Дополнительно, в этом анализе может применяться изотопно-меченый LDL. Анализ активности СЕТР in vivo Для оценки активности соединений in vivo могут быть использованы сирийские золотистые хомяки,которые проявляют эндогенный СЕТР. Тестовые соединения вводят перорально в выбранных средствах- 14012585 на водной или масляной основе в течение до одной недели. Кровь/плазма берут в разное время после приема, в пределах от 4 до 48 ч. Активность СЕТР может быть определена методом, аналогичным описанному выше для анализа активности СЕТР in vitro, за исключением того, что в анализе в качестве источника СЕТР используют плазму животных, которых подвергают лечению. Для проверки соединений, которые описываются в данном изобретении, также может быть использована порода трансгенных мышей, которые проявляют человеческий СЕТР (Taconic, Germantown, NY). Тестовые соединения могут быть введены перорально в выбранных средствах на водной или масляной основе в течение до одной недели. Кровь/плазма берут в разное время после приема, в пределах от 4 до 48 ч. Активность СЕТР может быть определена методом, аналогичным описанному для анализа активности СЕТР in vitro, за исключением того, что в анализе в качестве источника СЕТР используют плазму животных, которых подвергают лечению. Альтернативно, для проверки соединений, которые описываются в данном изобретении, может быть использована порода трансгенных мышей, которые проявляют как человеческий СЕТР, так и человеческий аполипопротеин А-1 (Taconic, Germantown, NY). Тестовые соединения могут быть введены перорально в выбранных средствах на водной или масляной основе в течение до одной недели. Кровь/плазма берут в разное время после приема, в пределах от 4 до 48 ч. Активность СЕТР может быть определена методом, аналогичным описанному для анализа активности СЕТР in vitro, за исключением того, что в анализе в качестве источника СЕТР используют плазму животных, которых подвергают лечению. Анализ плазмы липидов in vivo Активность соединений, которые описываются в данном изобретении, может быть определена invivo с помощью сравнения уровня повышения холестерина HDL относительно контрольного, по данному количеству соединения в СЕТР-содержащих видах животных. Для тестирования соединений, которые описываются в данном изобретении, может быть использована порода трансгенных мышей, которые проявляют как человеческий СЕТР, так и человеческий аполипопротеин А-1 (Taconic, Germantown, NY). Тестовые соединения вводят животным однократно перорально в выбранных средствах на водной или масляной основе. Кровь берут в разное время после приема, в пределах от 4 до 24 ч. Крови дают свернуться и сыворотку получают центрифугированием. Уровни холестерина HDL в сыворотке могут быть определены с помощью известных методик, используя HDL-C плюс реактивы (Roche/Hitachi,Indianapolis, IN) при помощи клинического химического анализатора (Roche/Hitachi, Indianapolis, IN). Дополнительные липиды сыворотки могут быть проанализированы при помощи ферментативных методов. Липиды во фракциях VLDL, LDL и HDL анализируют при помощи ферментативных методов после осаждения или молекулярно-ситовой хроматографии. Примеры повышения уровней холестерина HDL за 8 ч просуммированы в табл. 1. Таблица 1. Повышение уровней холестерина HDL за 8 ч Эффективность соединений согласно изобретению in vivo также может быть определена, используя сирийских золотистых хомяков. Соединения могут быть протестированы на хомяках, имеющих повышенный уровень холестерина, что было достигнуто их диетой, имеющей высокое содержание жиров и холестерина в течение, как минимум, двух недель, или на хомяках, имеющих нормальный уровень холестерина, которых кормили в течение двух недель нормальной едой. Тестовые соединения могут быть введены перорально в выбранных средствах на водной или масляной основе в течение до 1 недели. Сыворотка из животных может быть получена и липиды могут быть проанализированы при помощи ферментативных методов. Липиды во фракциях VLDL, LDL и HDL могут быть проанализированы при помощи известных ферментативных методов после осаждения или молекулярно-ситовой хроматографии. Альтернативно, для проверки эффективности соединений, которые описываются в данном изобретении, может быть использована порода трансгенных мышей, которые проявляют человеческий СЕТР(Taconic, Germantown, NY). hCETP мыши могут иметь повышенный уровень холестерина, путем кормления едой с высоким содержанием жиров, такой как TD 88051, как описано Nishina и др. (J Lipid Res., 31,859-869 (1990 в течение по крайней мере двух недель перед началом изучения. Тестовые соединения могут быть введены животным перорально в течение до 1 недели в выбранных средствах на водной или масляной основе. Сыворотка может быть получена из животных. Липиды из сыворотки могут быть проанализированы при помощи ферментативных методов. Липиды во фракциях VLDL, LDL и HDL анализируют при помощи ферментативных методов после осаждения или молекулярно-ситовой хроматографии. Способ лечения Термин "эффективное количество", как используется в данной заявке, означает количество соединения согласно данному изобретению, то есть формулы I, которое способно облегчить симптомы различных патологических состояний, приведенных в данной заявке. Определенная доза соединения, которая вводится в соответствии с данным изобретением, будет, конечно, определяться условиями каждого конкретного случая, включая, например, но, не ограничиваясь: вводимое соединение, способ введения,состояние пациента и патологическое состояние, которое лечат. Типичная ежедневная доза будет содержать нетоксичный уровень дозировки от приблизительно 0,01 мг до приблизительно 1000 мг/день соединения согласно данному изобретению. Предпочтительные ежедневные дозы в общем случае будут составлять от приблизительно 1 мг до приблизительно 250 мг/день. Соединения согласно данному изобретению могут быть введены различными способами, включая- 16012585 пероральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и интраназальный. Эти соединения, предпочтительно, составлены в препараты до введения, выбор которых осуществляет лечащий врач. Таким образом, другим аспектом данного изобретения является фармацевтическая композиция, которая содержит эффективное количество соединения формулы I или его фармацевтически приемлемой соли, пролекарства, энантиомера или его пролекарства, и фармацевтически приемлемый носитель, разбавитель или наполнитель. Общее содержание активных ингредиентов в таких композициях составляет от 0,1 до 99,9% от массы препарата. Термин "фармацевтически приемлемый", как используется в данной заявке, означает, что носитель,разбавитель, наполнители и соль должны быть совместимы с другими ингредиентами композиции, и не причинять вред их реципиенту. Фармацевтические композиции согласно данному изобретению могут быть получены в соответствии с методиками, известными из уровня техники, используя хорошо известные и легко доступные ингредиенты. Например, соединения формулы I могут быть составлены в препараты с обычными наполнителями, разбавителями или носителями, и сформированы в таблетки, капсулы, суспензии, порошки и т.п. Неограничивающие примеры наполнителей, разбавителей и носителей, которые являются подходящими для таких композиций, включают следующее: наполнители и расширители, такие как крахмал, сахар,маннит и кремниевые производные; связующие агенты, такие как карбоксиметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон; увлажняющие агенты, такие как глицерин; агенты дезинтеграции, такие как карбонат кальция и бикарбонат натрия; агенты задержки растворения, такие как парафин; ускорители всасывания, такие как соединения четвертичного аммония; поверхностно-активные агенты, такие как цетиловый спирт, моностеарат глицерина; адсорбционные носители, такие как каолин и бентонит; и смазывающие вещества, такие как тальк, стеарат кальция и магния,и твердые полиэтилгликоли. Соединения также могут быть составлены в виде эликсиров или растворов для удобства перорального введения или в виде растворов, подходящих для парентерального введения, например, внутримышечного, подкожного или внутривенного. Дополнительно, соединения могут быть составлены в формах с замедленным высвобождением дозировок и т.п. Композиции могут быть также сделаны таким образом,чтобы высвобождать только активный ингредиент или предпочтительно в специфическом физиологическом местоположении, возможно в течение времени. Покрытия, оболочки и защитные основы могут быть сделаны, например, из полимерных веществ или восков. Соединения формулы I, вообще, будут вводиться в удобных композициях, которые определит лечащий врач. Примеры композиций, приведенные ниже, являются только иллюстративными и не предназначены для ограничения объема данного изобретения. Композиции Соединения согласно изобретению могут быть составлены в препараты, следуя одному или больше примеров композиций, методик, протоколов или диапазонам смешивания, приведенным ниже. В приведенных ниже композициях, термин "Активный ингредиент", как используется в данной заявке, означает соединение формулы I, его соль, рацемат, энантиомер, диастереомер, смесь диастереомеров, пролекарство, или комбинацию соединения формулы I и других эффективных агентов, полезных для лечения или предотвращения дислипидемии, атеросклероза или других связанных с ними болезненных состояний и симптомов. Композиция 1. Желатиновые капсулы Твердые желатиновые капсулы могут быть изготовлены, используя следующее: Вышеуказанная композиция может быть изменена в соответствии с предусмотренными рациональными вариациями. Композиция 2. Таблетки. Таблеточная композиция, где каждая таблетка содержит 2,5-1000 мг активного ингредиента, может быть получена следующим образом: Ингредиенты смешивают и прессуют, чтобы сформировать таблетки. Композиция 3. Таблетки. Альтернативно, таблетки, каждая из которых содержит 25-1000 мг активного ингредиента, могут быть получены следующим образом: Активный ингредиент, крахмал и целлюлозу пропускают через сита с размером ячейки 45(США) и тщательно перемешивают. Раствор поливинилпирролидона смешивают с полученными в результате порошками. Полученную смесь затем пропускают сквозь сита с размером ячейки 14 (США). Гранулы, полученные таким образом, сушат при 50-60 С и пропускают сквозь сита с размером ячейки 18 (США). Натрий карбоксиметил крахмал, стеарат магния и тальк, предварительно пропускают сквозь сита с размером ячейки 60 (США), а затем добавили к гранулам, которые после смешивания, уплотняют на устройстве для производства таблеток, чтобы получить таблетки. Композиция 4. Суспензии. Суспензия, каждая из которых содержит 0,1-1000 мг лекарства на дозу 5 мл, может быть получена следующим образом: Активный ингредиент пропускают сквозь сита с размером ячейки 45 (США) и потом смешивают с натрий карбоксиметил целлюлозой и сиропом, чтобы сформировать однородную пасту. Раствор бензойной кислоты, ароматизатор и краситель растворяют в небольшом количестве воды и добавляют, перемешивая, к пасте. Затем добавляют количество воды, достаточное для получения суспензия требуемого объема (или концентрации). Композиция 5. Аэрозоль.- 18012585 Может быть приготовлен раствор аэрозоля, следующим образом: Активный ингредиент смешивают с этанолом, и смесь добавляют к порции пропелланта 22, охлаждают до приблизительно 30 С, и переносят в заполняющее устройство. Требуемое количество затем помещают в контейнер из нержавеющей стали и разбавляют пропеллантом. После этого на контейнер помещают клапанные устройства. Композиция 6. Внутривенный раствор. Раствор, подходящий для внутривенного введения, может быть получен следующим образом: Раствор вышеупомянутых компонентов может быть введен пациенту внутривенно со скоростью приблизительно 1 мл/мин или как предписано врачом. Примеры Соединения согласно изобретению могут быть получены по одному или большему количеству примеров и методик, описанных ниже. Пример 1. Синтез (+/-)-изопропил 5-[(3,5-бис-трифторметилбензил)-(2-метил-2 Н-тетразол-5-ил) амино]-7-бром-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилат. Изопропилхлорформиат (36,9 мл, 36,9 ммоль, 1,0 М в толуоле) по каплям добавляют к раствору метил 2-амино-5-бромбензоата (5,0 г, 24,6 ммоль) и пиридина (80,0 мл, 36,9 ммоль) в дихлорметане (80 мл) при комнатной температуре в атмосфере азота и перемешивают в течение 1,5 ч. Реакционную смесь выливают в воду (100 мл) и слои разделяют. Водный слой экстрагируют дихлорметаном (240 мл) и органические экстракты объединяют и промывают 2 н. соляной кислотой, насыщенным гидрокарбонатом натрия и солевым раствором (по 80 мл каждого). Органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель удаляют при пониженном давлении, получая указанное в заголовке соединение в виде твердого вещества бледно-желтого цвета (6,68 г, 86%). 1 Н ЯМР (CDCl3)1,31 (д, J=6,3 Гц, 6 Н), 3,92 (с, 3 Н), 5,03 (с, J=6,3 Гц, 1 Н), 7,61 (дд, J=1,9, 8,5 Гц, 1 Н), 8,11 (д, J=1,9 Гц, 1 Н), 8,40 (д, J=8,5 Гц, 1 Н), 10,31 (ушир.с, 1 Н). ESI MC m/z 316 [C12H14BrNO4+H]+. Стадия 2. Получение метил 5-бром-2-[изопропоксикарбонил-(3-метоксикарбонилпропил)амино] бензоата. Суспензию метил 5-бром-2-изопропоксикарбониламинбензоата (10,0 г, 31,6 ммоль), метил 4- 19012585 бромбутирата (22,9 г, 126 ммоль) и карбоната цезия (41,6 г, 126 ммоль) в N,N-диметилформамиде (150 мл) нагревают в токе азота при 80 С в течение 24 ч. Смесь охлаждают до комнатной температуры и выливают в воду (200 мл). Экстрагируют этилацетатом (3100 мл) и органические экстракты промывают водой (3100 мл) и солевым раствором (100 мл). Органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель удаляют при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя гексаны/этилацетат (60:40), получая указанное в заголовке соединение в виде бесцветного масла (11,8 г, 89%). 1 Н ЯМР (CDCl3, 300 МГц)1,05-1,07 (м, 4 Н), 1,30-1,32 (м, 2 Н), 1,89-1,94(100 мл) добавляют к суспензии трет-бутоксида калия (6,31 г, 56,2 ммоль) в толуоле (100 мл) при 70 С в атмосфере азота за период 30 мин. Через 15 мин смесь охлаждают до комнатной температуры и суспензию выливают в ледяную воду (500 мл). рН раствора доводят до рН=3 2 н. соляной кислотой (25 мл) и слои разделяют. Водный слой экстрагируют этилацетатом (3200 мл) и органические экстракты объединяют. Органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель удаляют при пониженном давлении, получая (+/-)-1-изопропил-4-метил-7-бром-5-оксо-2,3,4,5-тетрагидробензо[b]азепин-1,4-дикарбоксилат в виде масла оранжевого цвета (10,5 г, 98% неочищенного). (+/-)-1 Изопропил-4-метил-7-бром-5-оксо-2,3,4,5-тетрагидробензо[b]азепин-1,4-дикарбоксилат (10,5 г, 27,3 ммоль) растворяют в ледяной уксусной кислоте (100 мл) и добавляют воду (10 мл), потом добавляют концентрированную соляную кислоту (35 мл) и полученный раствор выдерживают при кипении с обратным холодильником в течение 1 ч. Смесь охлаждают до комнатной температуры и выливают в ледяную воду (500 мл). Доводят рН=8 гидроксидом калия (85 г) в воде (200 мл) и смесь экстрагируют этилацетатом (3150 мл), и органические экстракты объединяют. Органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель удаляют при пониженном давлении. Неочищенное вещество(12,0 г) растворяют в дихлорметане (30 мл) и охлаждают до 0 С. К раствору добавляют пиридин (2,0 мл,25,5 ммоль), потом добавляют по каплям 1,0 М раствор изопропилхлорформиата в толуоле (19,1 мл, 19,1 ммоль) и перемешивают в течение 1,5 ч. Реакционную смесь выливают в воду (100 мл) и слои разделяют. Водный слой экстрагируют дихлорметаном (240 мл) и органические экстракты объединяют и промывают 2 н. соляной кислотой, насыщенным гидрокарбонатом натрия и солевым раствором (по 80 мл каждого). Органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель удаляют при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя гексаны/этилацетат(60:40), получая указанное в заголовке соединение в виде твердого вещества желтого цвета (3,5 г, 40% за три стадии). 1 Н ЯМР (CDCl3, 300 МГц)1,30 (д, J=6,2 Гц, 6 Н), 2,09-2,21 (м, 2 Н), 2,75-2,79 (м, 2 Н), 3,753,80 (м, 2 Н), 5,05 (с, J=6,2 Гц, 1 Н), 7,38 (м, 1 Н), 7,61 (дд, J=1,9, 8,5 Гц, 1 Н), 7,67 (м, 1 Н), 7,98 (д, J=8,5 Гц,1 Н); ESI MC m/z 326 [C14H16BrNO3+H]+. Стадия 4. Получение (+/-)-изопропил 5-(3,5-бис-трифторметилбензиламино)-7-бром-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата. 3,5-Бис(трифторметил)бензиламин (3,23 г, 13,31 ммоль) добавляют к раствору изопропил 7-бром-5 оксо-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата (3,10 г, 9,50 ммоль) в безводном тетрагидрофуране (30 мл) при комнатной температуре в атмосфере азота, потом добавляют изопропоксид титана (3,69 мл, 12,35 ммоль) и перемешивают раствор в течение 16 ч. Раствор разбавляют метанолом (30 мл) и медленно добавляют боргидрид натрия (0,539 г, 14,25 ммоль) в течение 15 мин, затем перемешивают при комнатной температуре в течение 3,5 ч. Реакцию гасят добавлением 2 н. NaOH (50 мл) и водой (50 мл) и перемешивают в течение 30 мин. Смесь фильтруют и твердые вещества промывают этилацетатом/этанолом (4:1, 3100 мл). Фильтрат отделяют и органический слой промывают 2 н. NaOH, 2 н. соляной кислотой и солевым раствором (по 50 мл каждого). Органический слой сушат над безводным суль- 20012585 фатом натрия, фильтруют и растворитель удаляют при пониженном давлении, получая указанное в заголовке соединение в виде масла оранжевого цвета (5,08 г, 96%), которое имеет достаточную чистоту для использования на последующей стадии синтеза без дополнительного очищения. Стадия 5. Получение (+/-)-изопропил 5-[(3,5-бис-трифторметилбензил)цианоамино]-7-бром-2,3,4,5 тетрагидробензо[b]азепин-1-карбоксилата. Раствор 1-цианоимидазола в N,N-диметилацетамиде добавляют к раствору изопропил 5-(3,5-бистрифторметилбензиламино)-7-бром-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата в N,N-диметилацетамиде при комнатной температуре в токе азота и нагревают смесь до 100 С. Охлажденную смесь выливают в воду и экстрагируют метиленхлоридом. Органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель удаляют при пониженном давлении. Остаток хроматографируют на силикагеле, получая указанное в заголовке соединение. Стадия 6. Получение (+/-)-изопропил 5-[(3,5-бис-трифторметилбензил)-(2 Н-тетразол-5-ил)амино]-7 бром-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата. Раствор (+/-)-изопропил 5-[(3,5-бис-трифторметилбензил)цианоамино]-7-бром-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата в безводном N,N-диметилформамиде добавляют по каплям к перемешанной суспензии азида натрия и хлорида аммония в безводном N,N-диметилформамиде и полученную желтую смесь нагревают при 110 С в токе азота. Охлажденную смесь разбавляют водой и 2 н. NaOH и промывают диэтиловым эфиром. Подкисляют 5 н. HCl, осадок собирают и промывают водой, получая указанное в заголовке соединение. Стадия 7. Получение (+/-)-изопропил 5-[(3,5-бис-трифторметилбензил)-(2-метил-2 Н-тетразол-5 ил)амино]-7-бром-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата. Три-н-бутилфосфин добавляют к раствору (+/-)-изопропил 5-[(3,5-бис-трифторметилбензил)-(2 Нтетразол-5-ил)амино]-7-бром-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата, метанола и 1,1'-(азокарбонил)дипиперидина (ADDP) в толуоле при 0 С в токе азота и нагревают до комнатной температуры. Смесь разбавляют этилацетатом, промывают 2 н. HCl и солевым раствором и сушат над сульфатом натрия. Растворители удаляют при пониженном давлении и остаток очищают с помощью флэшколоночной хроматографии на силикагеле, получая указанное в заголовке соединение. Пример 2. Синтез (+/-)-изопропил 5-[(3,5-бис-трифторметилбензил)-(3-метилизотиазол-5-ил)амино]-7-бром-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата.- 21012585 Изопропоксид титана добавляют к перемешиваемому раствору 5-амино-3-метилизотиазола гидрохлорида и изопропил 7-бром-5-оксо-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата (пример 1, стадия 3) в безводном тетрагидрофуране при комнатной температуре в токе азота. Через соответствующее время перемешивания, раствор разбавляют метанолом и медленно добавляют боргидрид натрия, и перемешивают при комнатной температуре. Через соответствующее время перемешивания, реакционную смесь разбавляют добавлением 2 н. NaOH и воды и перемешивают в течение 30 мин. Твердые вещества отделяют вакуумным фильтрованием и твердые вещества промывают этилацетатом/этанолом (4:1). Фильтрат отделяют и органический слой промывают 2 н NaOH, 2 н соляной кислотой и солевом раствором. Органический слой сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении,получая указанное в заголовке соединение. Стадия 2. Получение (+/-)-изопропил 5-[(3,5-бис-трифторметилбензил)-(3-метилизотиазол-5 ил)амино]-7-бром-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата. Гидрид натрия добавляют к перемешиваемому раствору изопропил 7-бром-5-(3-метилизотиазол-5 иламино)-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата в безводном тетрагидрофуране при комнатной температуре в токе азота. Через соответствующее время при перемешивании, смесь обрабатывают 3,5-бис(трифторметил)бензилбромидом и перемешивание продолжают в течение требуемого времени. Смесь разбавляют этилацетатом, промывают водой и солевым раствором и сушат над сульфатом натрия. Растворители удаляют при пониженном давлении и остаток очищают с помощью флэш-колоночной хроматографии на силикагеле, получая указанное в заголовке соединение. Пример 3. Синтез (S)-(3,5-бис-трифторметилбензил)-(1-циклопентилметил-7-метил-8-трифторметил-2,3,4,5-тетрагидро-1 Н-бензо[b]азепин-5-ил)-(2-метил-2 Н-тетразол-5-ил)амина. Концентрированную серную кислоту (120 мл) по каплям добавляют к раствору 2-нитро-4-трифторметилбензойной кислоты (200 г, 850 ммоль) в метаноле (2 л) при комнатной температуре в токе азота и смесь нагревают при кипении с обратным холодильником в течение 48 ч. Раствор охлаждают до комнатной температуры и большую часть растворителя удаляют выпариванием при 45 С при пониженном давлении. Мутный остаток выливают на смесь лед/воду (2 л) и экстрагируют этилацетатом (21 л). Объединенные органические экстракты промывают солевым раствором (1 л), сушат над безводным сульфатом магния, фильтруют и растворитель удаляют при пониженном давлении, получая указанное в заголовке соединение в виде масла желтого цвета (212,2 г, 99%). 1H ЯМР (300 МГц, CDCl3)8,21 (с, 1 Н), 7,95 (д,J=1,13 Гц, 1 Н), 7,90 (с, 1 Н), 3,97 (с, 3 Н). Стадия 2. Получение метил 2-амино-4-трифторметилбензоата. Раствор метил 2-нитро-4-трифторметилбензоата (106 г, 425 ммоль) в этилацетате (2,2 л) добавляют к суспензии 10% палладия на угле (11,0 г) в этилацетате (200 мл) и суспензию перемешивают при комнатной температуре в атмосфере водорода при 60 фунт/дюйм 2 в течение 3 ч. Суспензию фильтруют через подушку Целит и подушку промывают дополнительным количеством этилацетата. Растворители удаляют при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя изогексан/этилацетат (9:1), получая указанное в заголовке соединение в виде кристаллического твердого вещества белого цвета (84 г, 95%). 1 Н ЯМР (300 МГц, CD3OD)7,93 (д, J=8,48 Гц, 1 Н),- 22012585 7,06 (с, 1 Н), 6,78 (с, 1 Н), 4,86 (с, 3 Н), 3,89 (с, 3 Н). Стадия 3. Получение метил 2-амино-5-йодо-4-трифторметилбензоата. Раствор метил 2-амино-4-трифторметилбензоата (178 г, 812 ммоль) в этаноле (3,3 л) добавляют к суспензии йода (206,1 г, 812 ммоль) и сульфата серебра(II) (253 г, 812 ммоль) в этаноле (5 л) при комнатной температуре в атмосфере азота и перемешивают в течение 2 ч. Суспензию фильтруют через подушку Целит, подушку промывают дополнительным количеством этанола (2 л) и растворители с объединенных фильтратов удаляют при пониженном давлении при 40 С. Остаток растворяют в этилацетате (7,5 л) и промывают насыщенным раствором бикарбоната натрия (31,5 л), водой (31,5 л) и солевым раствором (2 л). Органическую фазу сушат над безводным сульфатом магния, фильтруют и растворитель удаляют при пониженном давлении, получая указанное в заголовке соединение в виде кристаллического твердого вещества бледно-коричневого цвета (276,0 г, 99%). 1H ЯМР (300 МГц, CDCl3)8,39 (1 Н, с),6,99 (1H, с), 5,93 (2H, с), 3,90 (3 Н, с). Стадия 4. Получение метил 2-амино-5-метил-4-трифторметилбензоата. Фторид цезия (184,3 г, 1,21 моль), метилбороновую кислоту (63,7 г, 1,05 моль, 3 мол. эквив.) и хлорид бис(дифенилфосфиноферроцен)палладия(II) (27,83 г, 35,1 ммоль) добавляют к раствору метил 2 амино-5-йодо-4-трифторметилбензоата (121 г, 351 ммоль) в безводном 1,4-диоксане (2,5 л) при комнатной температуре в атмосфере азота и смесь нагревают при 80 С в течение 3 ч. Смесь оставляют охлаждаться до комнатной температуры, затем разделяют между этилацетатом (2,5 л) и водой (2,5 л) и фильтруют через подушку Целит, чтобы исключить мелкую черную суспензию. Водную фазу экстрагируют этилацетатом (2100 мл) и объединенные органические экстракты промывают солевым раствором (1 л). Сушат над безводным сульфатом магния, фильтруют и растворитель удаляют при пониженном давлении при 45 С, получая масло красного цвета. Остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя изогексан/этилацетат (9:1), получая указанное в заголовке соединение в виде кристаллического твердого вещества бледно-желтого цвета (75,25 г, 92%). 1H ЯМР (300 МГц, CDCl3)7,73 Изопропилхлорформиат (900 мл, 900 ммоль, 1 М в толуоле) добавляют по каплям к раствору метил 2-амино-5-метил-4-трифторметилбензоата (200 г, 858 ммоль) и пиридина (170 мл, 2,14 моль) в безводном дихлорметане (2 л) при 0-5 С в атмосфере азота, поддерживая при добавлении температуру реакции ниже 5 С. Раствору/суспензии позволяют нагреваться до комнатной температуры и перемешивают в течение 2 ч добавляя 1 М HCl (2 л) и смесь перемешивают в течение 10 мин. Органическую фазу собирают и промывают солевым раствором (1 л), сушат над безводным сульфатом магния, фильтруют и растворители удаляют при пониженном давлении при 45 С, получая указанное в заголовке соединение в виде кристаллического твердого вещества желтого цвета (283 г, 99%). 1H ЯМР (300 МГц, CDCl3)10,25 (с, 1 Н),8,80 (с, 1H), 7,88 (с, 1 Н), 4,97-5,09 (м, 1 Н), 3,95 (с, 3 Н), 2,43 (д, J=1,32 Гц, 3 Н), 1,27-1,35 (м, 6 Н). Стадия 6. Получение метил 2-N-изопропоксикарбонил-N-(3-метоксикарбонилпропил)амино-5 метил-4-трифторметилбензоата. Карбонат цезия (504 г, 1,55 моль, 2,5 мол. эквив.) и метил 4-бромбутират (100 мл, 800 ммоль) добавляют к раствору метил 2-(N-изопропоксикарбонил)амино-5-метил-4-трифторметилбензоата (204 г,618 ммоль) в безводном N,N-диметилформамиде (2,4 л) при комнатной температуре в атмосфере азота и суспензию нагревают при 55 С в течение 2,5 ч. Охлажденную смесь выливают в смесь лед/вода (7,5 л) и перемешивают в течение 1 ч. Суспензию фильтруют и фильтровальную подушку промывают водой (31- 23012585 л) и сушат на фильтре при пониженном давлении. Сушат при 40 С в вакууме, получая указанное в заголовке соединение в виде твердого вещества кремового цвета (261,3 г, 96%). 1 Н ЯМР (300 МГц, ДМСО-d6) при 80 С 7,84 (с, 1 Н), 7,57 (с, 1 Н), 3,76-3,84 (м, 3 Н), 3,52-3,65 (м, 5 Н), 2,33 (т, J=7,25 Гц, 2 Н), 1,72-1,83 Раствор метил 2-N-изопропоксикарбонил-N-(3-метоксикарбонилпропил)амино-5-метил-4-трифторметилбензоата (130 г, 310 ммоль) в тетрагидрофуране (3,7 л) добавляют к раствору трет-бутоксида калия (618 мл, 618 ммоль, 1M в тетрагидрофуране) в тетрагидрофуране (3,7 л) при комнатной температуре в атмосфере азота в течение 2 ч. Перемешивают в течение 1 ч и смесь подкисляют до нейтрального рН 1M HCl (600 мл). Экстрагируют дихлорметаном (24 л) и объединенные органические экстракты промывают солевым раствором (31 л). Сушат над безводным сульфатом магния, фильтруют и растворители удаляют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя изогексан/этилацетат (9:1), получая указанное в заголовке соединение в виде твердого вещества бледно-желтого цвета (99,7 г, 83%). ЖХ/МС m/z 410 (M+Na)+. Стадия 8. Получение изопропил 7-метил-5-оксо-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин 1-карбоксилата.(500 мл) при комнатной температуре в атмосфере азота и перемешиваемую смесь нагревают при 87-88 С в течение 24 ч. Смесь оставляют охлаждаться до комнатной температуры с перемешиванием и суспензию фильтруют. Собранные твердые вещества промывают водой и сушат на фильтре при пониженном давлении. Сушат в вакууме при 45 С, получая указанное в заголовке соединение в виде твердого вещества кремового цвета (145,4 г, 87%). 1H ЯМР (400 МГц, CDCl3)7,74 (с, 2 Н), 5,03-5,09 (м, 1 Н), 3,79 (т,J=6,24 Гц, 2 Н), 2,77 (т, J=6,72 Гц, 2 Н), 2,49 (д, J=1,47 Гц, 3 Н), 2,10-2,20 (м, J=6,72, 6,72, 6,72, 6,72 Гц, 2 Н),1,27 (д, J=3,91 Гц, 6 Н). Стадия 9. Получение 7-метил-8-трифторметил-1,2,3,4-тетрагидробензо[b]азепин-5-она. Дегазированную смесь изопропил 7-метил-5-оксо-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата (6,68 г, 20,28 ммоль) и хлорида натрия (37,5 г) в воде (7 мл) и диметилсульфоксида(180 мл) нагревают при кипении с обратным холодильником в атмосфере азота в течение 5 ч. Охлажденную смесь разбавляют водой (500 мл) и экстрагируют этилацетатом (2300 мл). Объединенные органические экстракты промывают солевым раствором (200 мл), сушат над безводным сульфатом натрия и фильтруют. Растворители удаляют при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя этилацетат/гексаны (1:4), получая указанное в заголовке соединение в виде твердого вещества желтого цвета (3,94 г, 80%). ESI MC m/z 242 (М-Н)-. Стадия 10. Получение трет-бутил 7-метил-5-оксо-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата.[b]азепин-5-она (2,48 г, 10,19 ммоль) в дихлорметане (50 мл) в атмосфере азота при 0 С и смесь нагревают до комнатной температуры. Смесь перемешивают в течение 24 ч и разбавляют дихлорметаном (50 мл). Смесь промывают 2 н. HCl (220 мл) и солевым раствором (20 мл) и сушат над безводным сульфатом натрия и фильтруют. Растворители удаляют при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя этилацетат/гексаны (1:3), получая указанное в заголовке соединение в виде твердого вещества не совсем белого цвета (2,20 г, 63%). ESI MC m/z (243 Раствор комплекса борандиметилсульфоксида (3,8 мл, 7,58 ммоль, 2 М в тетрагидрофуране) добавляют по каплям к раствору (S)-2-метил-CBS-оксазаборолидина (9,5 мл, 9,48 ммоль, 1 М в толуоле) в дихлорметане (20 мл) при -30 С в атмосфере азота. Смесь перемешивают в течение 30 мин и по каплям добавляют раствор трет-бутил 7-метил-5-оксо-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата (2,17 г, 6,32 ммоль) в дихлорметане (20 мл) и смесь медленно нагревают до 0 С. Смесь выливают в метанол (200 мл) при -20 С и смесь медленно нагревают при перемешивании до комнатной температуры в течение 1 ч. Растворители удаляют при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя этилацетат/гексаны (1:2), получая указанное в заголовке соединение в виде бесцветного масла (1,65 г, 76%). APCI MC m/z 345 (М+Н)+. Стадия 12. Получение (S)-трет-бутил 5-азидо-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо Смесь (R)-трет-бутил 5-гидрокси-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1 карбоксилата (1,60 г, 4,65 ммоль), дифенилфосфорилазида (DPPA, 1,4 мл, 6,50 ммоль) и DBU (1,0 мл,6,50 ммоль) в толуоле (20 мл) выдерживают при 65 С в токе азота в течение 12 ч. К охлажденной смеси добавляют силикагель и растворители удаляют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии, элюируя этилацетат/гексан (1:2), получая указанное в заголовке соединение в виде бесцветного масла (1,45 г, 85%). APCI MC m/z 356 (M-N2)-. Стадия 13. Получение (S)-трет-бутил 5-амино-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо Смесь (S)-трет-бутил 5-азидо-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата (1,44 г, 3,89 ммоль) и 5% палладия на угле (0,15 г, 50% влажности) в метаноле (50 мл) встряхивают под 20 фунт/дюйм 2 водорода в колбе Парра при комнатной температуре в течение 12 ч. Смесь фильтруют через Целит и растворители удаляют при пониженном давлении, получая указанное в заголовке соединение в виде бесцветного масла (1,30 г, 99%), которое используется на следующей стадии без дальнейшей очистки. APCI MC m/z 344 (М+Н)+. Стадия 14. Получение (S)-трет-бутил 5-(3,5-бис-трифторметилбензиламино)-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата.- 25012585 3,5-Бис-трифторметилбензальдегид (909 мг, 3,75 ммоль) добавляют к раствору (S)-трет-бутил 5 амино-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата (1,29 г, 3,75 ммоль) в метаноле (20 мл) при комнатной температуре в токе азота и перемешивают в течение 2 ч. Добавляют боргидрид натрия (283 мг, 7,5 ммоль) и смесь перемешивают в течение 2 ч. Растворители удаляют при пониженном давлении и остаток разбавляют дихлорметаном (50 мл) и водой (50 мл). Органический слой собирают и водный слой экстрагируют дихлорметаном (330 мл). Объединенные органические экстракты промывают водой (20 мл) и солевым раствором (20 мл) и сушат над безводным сульфатом натрия. Фильтруют и растворители удаляют при пониженном давлении, получая указанное в заголовке соединение в виде амбрового масла (2,09 г, 98%), которое используют на следующей стадии без очистки. APCI Бромциан (1,21 мл, 6,04 ммоль, 5 М раствор в ацетонитриле) добавляют к раствору (S)-трет-бутил 5(3,5-бис-трифторметилбензиламино)-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата (2,30 г, 4,03 ммоль) и диизопропилэтиламина (1,05 мл, 6,04 ммоль) в тетрагидрофуране (50 мл) при комнатной температуре в токе азота и смесь выдерживают при 50 С в течение 12 ч. К охлажденной смеси добавляют силикагель и растворители удаляют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя этилацетат/гексаны (2:3), получая указанное в заголовке соединение в виде бесцветного масла (2,10 г, 99%), которое используют на следующей стадии без дальнейшей очистки: APCI MC m/z 496 (М+Н-Вос)+. Стадия 16. Получение (S)-трет-бутил 5-[(3,5-бис-трифторметилбензил)-(2 Н-тетразол-5-ил)амино]-7 метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата.(S)-трет-бутил 5-[(3,5-бис-трифторметилбензил)цианоамино]-7-метил-8-трифторметил 2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата (2,0 г, 3,36 ммоль), гидрохлорида триэтиламина (694 мг, 5,04 ммоль) и азид натрия (328 мг, 5,04 ммоль) в безводном толуоле (20 мл) выдерживают при кипении с обратным холодильником в токе азота в течение 12 ч. Охлажденную смесь разбавляют этилацетатом (100 мл) и промывают 2 н. HCl (250 мл), водой (50 мл) и солевым раствором (50 мл) и сушат над безводным сульфатом натрия. Фильтруют и растворитель удаляют при пониженном давлении, получая указанное в заголовке соединение в виде пены не совсем белого цвета (2,12 г, 99%), которую используют на следующей стадии без очистки. ESI MC m/z 637 (М-Н)-. Стадия 17. Получение (S)-трет-бутил 5-[(3,5-бис-трифторметилбензил)-(2-метил-2 Н-тетразол-5 ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата. Диизопропилазодикарбоксилат (0,56 мл, 3,94 ммоль) добавляют к раствору (S)-трет-бутил 5-[(3,5 бис-трифторметилбензил)-(2 Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b] азепин-1-карбоксилата (2,10 г, 3,29 ммоль) и трифенилфосфина (1,03 г, 3,94 ммоль) в метаноле (0,20 мл,4,94 ммоль) и толуоле (30 мл) при 0 С в токе азота. Смесь нагревают до комнатной температуры и перемешивают в течение 12 ч. Добавляют силикагель, растворители удаляют при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя этилацетат/гексаны(1:3), получая указанное в заголовке соединение в виде бесцветного масла (2,04 г, 95%). APCI MC m/z 653 (М+Н)+. Стадия 18. Получение (S)-(3,5-бис-трифторметилбензил)-(2-метил-2H-тетразол-5-ил)-(7-метил-8- 26012585 трифторметил-2,3,4,5-тетрагидро-1 Н-бензо[b]азепин-5-ил)амина. Трифторуксусную кислоту (10 мл) добавляют к раствору (S)-трет-бутил 5-[(3,5-бистрифторметилбензил)-(2-метил-2 Н-тетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоксилата (2,04 г, 3,13 ммоль) в метиленхлориде (50 мл) при 0 С в токе азота. Смесь нагревают до комнатной температуры, перемешивают в течение 8 ч и выливают смесь в насыщенный водный раствор бикарбоната натрия (200 мл). Смесь экстрагируют метиленхлоридом (200 мл) и объединенные органические экстракты промывают солевым раствором (50 мл), сушат над безводным сульфатом натрия и фильтруют. Растворитель удаляют при пониженном давлении, получая указанное в заголовке соединение в виде бесцветного масла (1,73 г, 99%), которое используют на следующей стадии без очистки. APCI MC m/z 553 (М+Н)+. Стадия 19. Получение Циклопентанкарбоксальдегид (462 мг, 4,71 ммоль) добавляют к раствору (S)-(3,5-бис-трифторметилбензил)-(2-метил-2 Н-тетразол-5-ил)-(7-метил-8-трифторметил-2,3,4,5-тетрагидро-1 Н-бензо[b]азепин-5-ил)амина (520 мг, 0,941 ммоль) в уксусной кислоте (1 мл) и 1,2-дихлорэтане (10 мл) при комнатной температуре в токе азота и перемешивают в течение 1 ч. Добавляют триацетоксиборгидрид натрия(998 мг, 4,71 ммоль) и перемешивают в течение 5 мин. Смесь разбавляют метиленхлоридом (30 мл) и промывают насыщенным водным раствором бикарбоната натрия (210 мл). Объединенные водные промывания экстрагируют метиленхлоридом (20 мл) и объединенные органические экстракты промывают солевым раствором (20 мл) и сушат над безводным сульфатом натрия. Растворители удаляют при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя с этилацетат/гексаны (1:2), получая указанное в заголовке соединение в виде бесцветного масла (420 мг,70%). APCI MC m/z 635 (M+Н)+. Альтернативное получение метил 2-(N-изопропоксикарбонил)амино-5-метил-4-трифторметилбензоата. Раствор монохлорида йода (27,8 г, 171 ммоль) в дихлорметане (180 мл) добавляют к раствору 4 метил-3-трифторметиланилина (25,0 г, 143 ммоль) и бикарбоната натрия (14,4 г, 171 ммоль) в метаноле(180 мл) и дихлорметане (730 мл) при комнатной температуре в токе азота. Смесь перемешивают в течение 3 ч и охлажденную смесь разбавляют водным метабисульфитом натрия (500 мл). Органическую фазу собирают и водную фазу экстрагируют метиленхлоридом (200 мл). Объединенные органические экстракты промывают солевым раствором (250 мл), сушат над безводным сульфатом натрия и фильтруют. Растворитель удаляют при пониженном давлении, получая коричневое масло, которое кристаллизуется при стоянии, получая указанное в заголовке соединение в виде игольчатых кристаллов коричневого цвета (44,4 г, 99%), которые используют на следующей стадии без очистки. APCI MC m/z 302 (М+Н)+. Стадия 2. Получение изопропил (2-йодо-4-метил-5-трифторметилфенил)карбамата.- 27012585 Раствор изопропилхлорформиата (99,6 мл, 99,6 ммоль, 1M в толуоле) добавляют по каплям к раствору 2-йодо-4-метил-5-трифторметилфениламина (27,26 г, 90,55 ммоль) и пиридина (14,6 мл, 181,1 ммоль) в дихлорметане (350 мл) при 5 С в атмосфере азота и смесь нагревают до комнатной температуры. Перемешивают в течение 3 ч и смесь промывают 2 н. HCl (100 мл) и солевым раствором (100 мл). Сушат над безводным сульфатом натрия, фильтруют и растворитель удаляют при пониженном давлении,получая указанное в заголовке соединение в виде твердого вещества желто-коричневого цвета (33,59 г,96%), которое используют на следующей стадии без очистки. APCI MC m/z 388 (М+Н)+. Стадия 3. Получение метил 2-(N-изопропоксикарбонил)амино-5-метил-4-трифторметилбензоата. Тетракис(трифенилфосфин)палладий(0) (8,53 г, 7,4 ммоль) добавляют к раствору изопропил (2 йодо-4-метил-5-трифторметилфенил)карбамата (28,59 г, 73,8 ммоль) и триэтиламина (10,3 мл, 73,8 ммоль) в метаноле (75 мл) и ацетонитриле (150 мл) при комнатной температуре в токе азота при перемешивании в реакционной колбе Парра и наполняют до 20 фунт/дюйм 2 монооксидом углерода. Смесь нагревают до 60 С и смесь перемешивают в течение 18 ч, периодически заполняя колбу до 20-30 фунт/дюйм 2 монооксидом углерода. К охлажденной смеси добавляют силикагель и растворители удаляют при пониженном давлении. Остаток очищают, используя колоночную хроматографию на силикагеле,элюируя этилацетат/гексаны (1:9), получая указанное в заголовке соединение в виде твердого вещества оранжевого цвета (19,80 г, 84%) : APCI MC m/z 320 (М+Н)+. Пример 4. Синтез этилового эфира 5-[(3,5-бис-трифторметилбензил)-(1 Н-тетразол-5-ил)амино]-7 метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты.[b]азепин-1-карбоновой кислоты (0,18 г, 0,24 ммоль). После перемешивания в течение 1-2 ч, реакцию нейтрализуют карбонатом натрия. Органическую фазу промывают водой (5 мл) и солевым раствором (5 мл). Органические вещества сушат над сульфатом натрия и фильтруют. Неочищенное вещество хроматографируют, элюируя этилацетат/гексан (20-60%), получая указанное в заголовке соединение (0,13 г, 85%) в виде масла. МС (ES+): 539 (M+Н).- 28012585 Стадия 3. Получение этилового эфира 5-[(3,5-бис-трифторметилбензил)-(1 Н-тетразол-5-ил)амино]7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты. Этилхлорформиат (0,24 ммоль) и пиридин (0,24 ммоль) в дихлорметане (5 мл) добавляют к раствору (3,5-бис-трифторметилбензил)-(7-метил-8-трифторметил-2,3,4,5-тетрагидро-1 Н-бензо[b]азепин-5-ил)(1 Н-тетразол-5-ил)амина (0,045 г, 0,08 ммоль). После перемешивания в течение 14 ч, реакционную смесь промывают 5% HCl (3 мл), водой (3 мл) и солевом раствором (3 мл). Органическую часть сушат над сульфатом натрия и фильтруют. Неочищенный продукт хроматографируют, элюируя этилацетат/гексан Дополнительные соединения могут быть получены, следуя методикам, описанным в примере 4, заменяя этилхлорформиат на подходящий реагент. Пример 15. Синтез этилового эфира (S)-5-[(3,5-бис-трифторметилбензил)-(2-метил-2 Н-тетразол-5 ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты. Этилхлорформиат (0,0223 мл, 0,233 ммоль) добавляют по каплям к раствору (S)-(3,5-бистрифторметилбензил)-(2-метил-2 Н-тетразол-5-ил)-(7-метил-8-трифторметил-2,3,4,5-тетрагидро-1 Н-бензо[b]азепин-5-ил)амина (0,0430 г, 0,0778 ммоль) (пример 3, стадия 18) и пиридина (0,0190 мл, 0,233 ммоль) в дихлорметане (1 мл) при комнатной температуре в атмосфере азота и перемешивают в течение 2 ч. Реакционную смесь разбавляют этилацетатом (10 мл) и промывают 1,0 н соляной кислотой (10 мл) и водой(310 мл). Органический слой сушат над безводным сульфатом натрия, фильтруют и растворитель удаляют при пониженном давлении. Остаток очищают, используя колоночную хроматографию на силикагеле, элюируя этилацетат/гексаны (0-20%), получая указанное в заголовке соединение (0,0320 г, 65%). МС(ES+): 625 (М+Н). Пример 16. Синтез изопропилового эфира (S)-5-[(3,5-бис-трифторметилбензил)-(2-метил-2 Нтетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты. Указанное в заголовке соединение получают, по существу, следуя методикам, описанным в примере 15, заменяя этилхлорформиат на изопропилхлорформиат. МС (ES+): 639 (М+Н). Пример 17. Синтез трет-бутилового эфира (S)-5-[(3,5-бис-трифторметилбензил)-(2-метил-2 Нтетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты. Пентан-3-ол (0,117 мл, 1,08 ммоль) и диизопропилэтиламин (0,189 мл, 1,08 ммоль) в дихлорметане при 0 С смешивают с 20% фосгена в толуоле (0,480 мл, 0,905 ммоль). Смесь перемешивают при 0 С в течение 10 мин, а затем нагревают до комнатной температуры в течение часа. Добавляют раствор (S)(3,5-бис-трифторметилбензил)-(2-метил-2 Н-тетразол-5-ил)-(7-метил-8-трифторметил-2,3,4,5-тетрагидро 1 Н-бензо[b]азепин-5-ил)амина (0,100 мг, 0,181 ммоль) (пример 3, стадия 18 в дихлорметане (1,00 мл), с последующим добавлением пиридина (0,0730 мл, 0,905 ммоль). Смесь удерживают при комнатной температуре в течение ночи. Смесь разбавляют дихлорметаном (5,05 мл), промывают 1 н. соляной кислотой(5,00 мл) и водой (35,00 мл), сушат над Na2SO4 и концентрируют. Очищают с помощью хроматографии на силикагеле (градиент элюента, 0-25% этилацетата в гексане), получая указанное в заголовке соединение (0,0710 г, 59%). МС (ES+): 667 (М+Н). Пример 19. Синтез циклопентилового эфира (S)-5-[(3,5-бис-трифторметилбензил)-(2-метил-2 Нтетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты. Указанное в заголовке соединение может быть получено, следуя методикам, описанным в примере 18, заменяя пентан-3-ол на циклобутанол. Пример 20. Синтез циклопентилового эфира (S)-5-[(3,5-бис-трифторметилбензил)-(2-метил-2 Нтетразол-5-ил)амино]-7-метил-8-трифторметил-2,3,4,5-тетрагидробензо[b]азепин-1-карбоновой кислоты.
МПК / Метки
МПК: C07D 405/14, C07D 403/14, C07D 409/14, C07D 417/12, A61K 31/55, C07D 491/04, C07D 401/14, C07D 403/12, C07D 413/12, C07D 417/14, C07D 401/12
Метки: соединения, способы, дислипидемии, лечения
Код ссылки
<a href="https://eas.patents.su/30-12585-soedineniya-i-sposoby-lecheniya-dislipidemii.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения и способы лечения дислипидемии</a>
Предыдущий патент: Производные n-гидроксиамида и их применение
Следующий патент: Rage – слитые белки и способы их применения
Случайный патент: Новые хинолиновые производные












