Потенциаторы рецепторов глутамата
Номер патента: 11867
Опубликовано: 30.06.2009
Авторы: Айкер Томас Дэниел, Кортес Гиллермо С., Мармсатер Фредерик Пер, Магнус Николас Эндрю, Шкерянтц Джеффри Майкл, Нобельсдорф Джеймс Аллен, Грендайк Тодд Майкл, Хилевич Альберт, Танг Тони Пайзал
Формула / Реферат
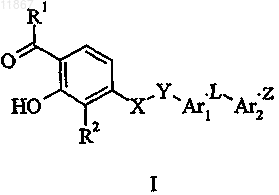
1. Соединение формулы I
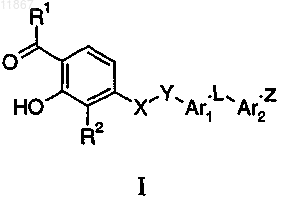
где R1 представляет собой метил или этил;
R2 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, фтора, хлора, йода, фенила, 4-фторфенила, трифторметила, циано, 2-тиофенила, 3-тиофенила, 2-тиазолила, 2-пиридинила, 3-пиридинила и 4-пиридинила;
X выбран из группы, состоящей из О, S, SO2, NH и NCH3;
Y представляет собой метилен;
Ar1 представляет собой фенилен или 1,2,4-оксадиазол-3,5-диил;
Ar2 выбран из группы, состоящей из фенилена, фторфенилена, метоксифенилена и пиридиндиила;
L выбран из группы, состоящей из CH2, CHCH3, CH(OH), CH(F), CHN3, CH(OCH3), CHNH2, CHNH(C=O)CH3, CHNH(SO2)CH3, C=O и CH=CH2;
Z выбран из группы, состоящей из (CH2)nCOOH,
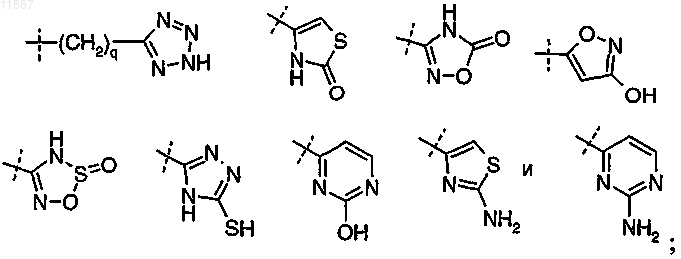
n равно 0 и
q равно 0.
2. Соединение по п.1, которое выбрано из группы, состоящей из (+)-3-{[4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]гидроксиметил}бензойной кислоты (изомер 1) и (-)-3-{[4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]гидроксиметил}бензойной кислоты (изомер 2).
3. Соединение по п.1, которое представляет собой 3-{[4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]-(S)-гидроксиметил}бензойную кислоту.
4. Фармацевтическая композиция, содержащая соединение по любому из пп.1-3 и фармацевтически приемлемый носитель, разбавитель или эксципиент.
5. Применение соединения по любому из пп.1-3 в качестве лекарственного средства.
6. Применение соединения по любому из пп.1-3 для производства лекарственного средства для лечения мигрени.
7. Способ получения соединения формулы I или его фармацевтически приемлемой соли, где R1, R2, X, Y, Ar1, L и Ar2 являются такими, как определено в п.1, a Z представляет собой тетразолил,
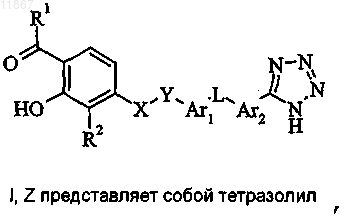
включающий стадию циклоприсоединения соединения формулы II, в котором R10 представляет собой циано, с азидным реагентом;

причем, если необходимо получить фармацевтически приемлемую соль соединения формулы I, ее получают реакцией кислоты формулы I с физиологически приемлемым основанием или реакцией основного соединения формулы I с физиологически приемлемой кислотой либо с помощью другой традиционной методики.
8. Способ получения соединения формулы I или его фармацевтически приемлемой соли, где R1, R2, X, Y, Ar1, L и Ar2 являются такими, как определено в п.1, a Z представляет собой COOH,
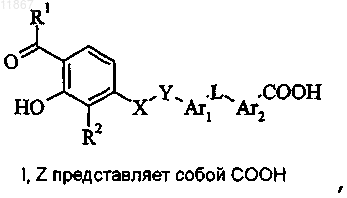
включающий стадию гидролиза соединения формулы II, в котором R10 представляет собой COOR14 и R14 выбран из группы, состоящей из С1-С5-алкила, фенила и бензила;
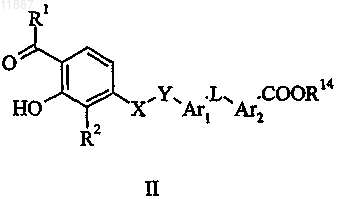
причем, если необходимо получить фармацевтически приемлемую соль соединения формулы I, ее получают реакцией кислоты формулы I с физиологически приемлемым основанием или реакцией основного соединения формулы I с физиологически приемлемой кислотой либо с помощью другой традиционной методики.
9. Способ получения соединения формулы I или его фармацевтически приемлемой соли, где R1, R2, X, Y, Ar1, L и Ar2 являются такими, как определено в п.1, a Z представляет собой COOH,
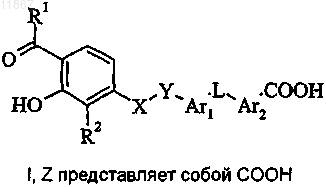
включающий стадию гидролиза соединения формулы II, в котором R10 представляет собой циано;
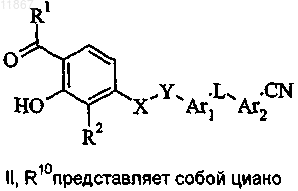
причем, если необходимо получить фармацевтически приемлемую соль соединения формулы I, ее получают реакцией кислоты формулы I с физиологически приемлемым основанием или реакцией основного соединения формулы I с физиологически приемлемой кислотой либо с помощью другой традиционной методики.
10. Способ получения соединения формулы I или его фармацевтически приемлемой соли
где R1, R2, X, Y, Ar1, L и Ar2 являются такими, как определено в п.1, Z представляет собой
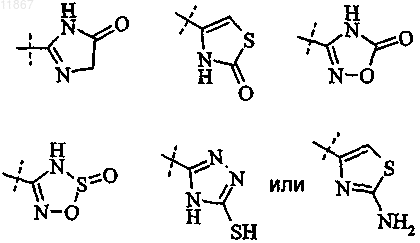
включающий стадию циклоконденсации соединения формулы II, в котором R10 представляет собой ацилгалогенид, такой как ацилхлорид;
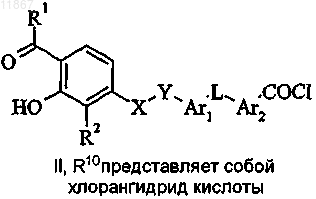
причем, если необходимо получить фармацевтически приемлемую соль соединения формулы I, ее получают реакцией кислоты формулы I с физиологически приемлемым основанием или реакцией основного соединения формулы I с физиологически приемлемой кислотой либо с помощью другой традиционной методики.
11. Соединение формулы II

где R1, R2, X, Y, Ar1, Ar2 и L являются такими, как определено в п.1; R10 представляет собой CN или COOR14, которое отличается тем, что R14 выбран из группы, состоящей из С1-С5-алкила, фенила и бензила.
12. Соединение по п.11, в котором R14 представляет собой метил.
13. Способ получения 3-{[4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]-(S)-гидроксиметил}бензойной кислоты или ее фармацевтически приемлемой соли, включающий:
(i) алкилирование 2,4-дигидрокси-3-пропилацетофенона 3-[4-(метансульфонилоксиметилфенил)-(S)-ацетоксиметил]бензонитрилом в присутствии калия карбоната с получением 3-{[4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]-(S)-ацетоксиметил}бензонитрила;
(ii) гидролиз 3-{[4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]-(S)-ацетоксиметил}бензонитрила в присутствии калия гидроксида, где после реакции гидролиза осуществляют подкисление хлористо-водородной кислотой с получением 3-{[4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]-(S)-гидроксиметил}бензойной кислоты;
причем, если необходимо получить фармацевтически приемлемую соль 3-{[4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]-(S)-гидроксиметил}бензойной кислоты, ее получают реакцией 3-{[4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]-(S)-гидроксиметил}бензойной кислоты с физиологически приемлемым основанием или с помощью другой традиционной методики.
14. Способ по п.13, где исходный 3-[(4-метансульфонилоксиметилфенил)-(S)-ацетоксиметил]бензонитрил получают с использованием способа, включающего:
(i) энантиоселективное арилирование 3-цианобензальдегида 2,4,6-трис-[4-(трет-бутилдиметилсиланилоксиметил)фенил]циклотрибороксаном в присутствии диалкилцинка и хирального катализатора, причем диалкилцинк представляет собой диэтилцинк и хиральный катализатор представляет собой (R)-(-)-2-пиперидин-1,1,2-трифенил этанол, с получением 3-{[4-(трет-бутилдиметилсиланилоксиметил)фенил]-(S)-гидроксиметил}бензонитрила;
(ii) ацилирование 3-{[4-(трет-бутилдиметилсиланилоксиметил)фенил]-(S)-гидроксиметил}бензонитрила с помощью ангидрида уксусной кислоты с последующим гидролизом 4-(трет-бутилдиметилсиланильной) группы хлористо-водородной кислотой с получением 3-[4-(гидроксиметилфенил)-(S)-ацетоксиметил]бензонитрила;
(iii) сульфонирование 3-[4-(гидроксиметилфенил)-(S)-ацетоксиметил]бензонитрила метансульфонилхлоридом с получением 3-[4-(метансульфонилоксиметилфенил)-(S)-ацетоксиметил]бензонитрила.
15. Соединение, представляющее собой 3-[4-(гидроксиметилфенил)-(S)-ацетоксиметил]бензонитрил.
Текст
011867 Заявка на данный патент испрашивает приоритет согласно предварительной заявке США сер.60/630060, поданной 22 ноября 2004 г. Данное изобретение предлагает соединение формулы I, фармацевтические композиции на его основе, способы их применения, а также способы получения указанных соединений и их промежуточные соединения. Предпосылки изобретения Возбуждающая аминокислота L-глутамат (в данном описании называется просто глутаматом) опосредует через множество своих рецепторов большую часть передачи возбуждающих нервных импульсов в центральной нервной системе (ЦНС) млекопитающих и принимает участие в многочисленных проводящих путях периферической нервной системы (ПНС). Возбуждающие аминокислоты, в том числе глутамат, имеют огромное физиологическое значение, поскольку они принимают участие в различных неврологических, физиологических и психологических процессах, таких как синаптическая пластичность,контроль двигательных функций, дыхание, регулирование деятельности сердечно-сосудистой системы,чувственное восприятие и эмоциональные реакции. Глутамат оказывает свое действие с помощью как минимум двух различных классов рецепторов. Один класс состоит из ионотропных рецепторов глутамата (iGlu), которые действуют как управляемые лигандами ионные каналы. Считается, что посредством активации рецепторов iGlu глутамат регулирует быструю нейронную передачу в пределах синапса двух контактирующих нейронов в ЦНС. Второй распространенный тип рецепторов представляет собой связанный с G-белком или вторичным мессенджером"метаботропный" рецептор глутамата (mGlu). По-видимому, оба типа рецепторов не только опосредуют нормальную синаптическую передачу вдоль проводящих путей возбуждающего сигнала, но также принимают участие в модификации синаптического контакта в процессе развития и в течение жизни.Research Reviews, 15, 41 (1990). Рецепторы mGlu принадлежат к классу С семейства рецепторов, связанных с G-белком (GPCR). Данное семейство рецепторов GPCR, в том числе воспринимающие кальций рецепторы, рецепторыGABAB и сенсорные рецепторы, являются уникальными в том смысле, что эффекторы связываются с аминоконцевой частью рецепторного белка, передающего сигнал через трансмембранные сегменты во внутриклеточный матрикс с помощью взаимодействия рецептор/G-белок. Ozawa, Kamiya and Tsuzuski,Prog. Neurobio., 54, 581 (1998). Было продемонстрировано, что рецепторы имеют как пре-, так и постсинаптическое расположение, где они могут регулировать высвобождение нейромедиатора, глутамата или других нейромедиаторов, или могут модулировать постсинаптическую реакцию на нейромедиаторы соответственно. В настоящее время восемь рецепторов mGlu положительно идентифицированы, клонированы и их последовательности описаны. Дополнительно их подразделяют на основе гомологии их аминокислотной последовательности, способности влиять на определенные механизмы преобразования сигнала, а также их известных фармакологических свойств. Ozawa, Kamiya and Tsuzuski, Prog. Neurobio., 54, 581 (1998). Например, известно, что группа I рецепторов mGlu, которая включает mGlu1 и mGlu5, активирует фосфолипазу С (PLC) с помощью Gq-белков, что приводит к интенсификации гидролиза фосфоинозитидов и мобилизации внутриклеточного кальция. Существует несколько соединений, для которых описана способность активировать рецепторы mGlu группы I, в том числе DHPG, (+/-)-3,5-дигидроксифенилглицин.(1992). группа II рецепторов mGlu состоит из двух различных рецепторов, mGlu2 и mGlu3. Оба рецептора отрицательно связаны с аденилатциклазой путем активации Gi-белка. Указанные рецепторы могут активироваться селективным соединением группы,таким как(1S,2S,5R,6S)-2-аминобицикло[3.1.0]гексан-2,6-дикарбоксилат. Monn, et al., J. Med. Chem., 40, 528 (1997); Schoepp, et al., Neuropharmacol., 36, 1 (1997). Подобным образом, рецепторы mGlu группы III, в том числе mGlu4, mGlu6,mGlu7 и mGlu8, отрицательно связаны с аденилатциклазой с помощью Gi и мощно активируются LAP4 (L-(+)-2-амино-4-фосфономасляная кислота). Schoepp, Neurochem. Int., 24, 439 (1994). Следует отметить, что многие из существующих фармакологических инструментов не идеальны,поскольку они перекрестно воздействуют не только на рецепторы в пределах группы рецепторов mGlu,но часто также проявляют некоторую активность в отношении рецепторов mGlu, относящихся к другим группам. Например, считается, что такие соединения, как 1S,3R-ACPD, (1S,3R)-1-аминоциклопентантранс-1,3-дикарбоновая кислота, активируют все рецепторы mGlu групп I, II и III, в зависимости от используемой дозы, тогда как другие соединения, такие как 1S,3S-ACPD, (1S,3S)-1-аминоциклопентантранс-1,3-дикарбоновая кислота, более избирательно действуют на рецепторы группы II (mGlu2/3), чем на рецепторы группы I (mGlu1/5) или группы III (mGlu4/6/7/8). Schoepp, Neurochem. Int., 24, 439 (1994). На сегодняшний день известно очень мало примеров веществ, избирательно действующих на рецепторыmGlu. Schoepp, Jane and Monn, Neuropharmacol., 38, 1431 (1999). Становится все более очевидным, что существует связь между модулированием рецепторов возбуждающих аминокислот, включая глутаматергическую систему, путем изменений в высвобождении глу-1 011867 тамата или изменений в активации постсинаптических рецепторов, и различными неврологическими,психиатрическими и нейровоспалительными заболеваниями. Например, Monaghan, Bridges and Cotman,Ann. Rev. Pharmacol. Toxicol., 29, 365-402 (1989); Schoepp and Sacann, Neurobio. Aging, 15, 261-263 (1994);Meldrum and Garthwaite, Tr. Pharmacol. Sci., 11, 379-387 (1990). Медицинские последствия такой дисфункции глутамата делают важной терапевтической целью ослабление указанных неврологических процессов. Лейкотриены представляют собой мощные медиаторы местного действия, которые играют важную роль в воспалительных и аллергических реакциях, включая артрит, астму, псориаз и тромботические заболевания. Лейкотриены представляют собой эйкозаноиды с неразветвленной цепью, которые образуются в результате окисления арахидоновой кислоты липоксигеназами в некоторых видах клеток, включая эозинофилы, нейтрофилы, тучные клетки, лейкоциты и макрофаги. В настоящее время существуют два отнесенных к классу А рецептора GPCR для цистеинил-лейкотриенов (CysLT1 и CysLT2), которые активируются лейкотриенами LTC4, LTD4 и LTE4, опосредуя их провоспалительное действие. Каждый из рецепторов CysLT демонстрирует собственное распределение в тканях и связь с биологическими реакциями. Кроме того, лейкотриен LTD4 обладает более высокой аффинностью к рецептору CysLT1, чем другие лейкотриены. Back, M. Life Sciences 71, 611-622, (2002). Лейкотриены, особенно LTD4 и его рецептор CysLT1, принимают участие в патогенезе заболеваний дыхательных путей и аллергических заболеваний, таких как астма, способствуя сужению бронхов, секреции слизи и миграции эозинофилов. Таким образом, показана важная роль лейкотриенов в патогенезе астмы. Строгое доказательство роли лейкотриенов в развитии астмы было получено в ходе нескольких базисных клинических испытаний, где пероральное введение антагонистов рецепторов LTD4 обеспечивало очевидное терапевтическое воздействие у больных астмой. Указанные эффекты включали уменьшение потребности в классических средствах для лечения астмы, таких как кортикостероиды. Kemp, J.P., Amer. J. Resp. Megi. 2, 139-156, (2003). Многочисленные исследования подтверждают важную роль лейкотриенов также в аллергических расстройствах. Так, после провокации антигеном наблюдалось значительное повышение концентрации лейкотриенов в выделяемой из носа жидкости у больных аллергическим ринитом как в ранней, так и в поздней фазе. P.S. Creticos, S.P. Peters, N.F. Adkinson, R.M. Naclerio, E.C. Hayes, P.S. Norman, L.M. Lichtenstein. - N. Eng. J. Med. 310:1626 (1984). Кроме того, лечение клинически эффективными антигистаминными средствами, такими как азеластин, продемонстрировало уменьшение образования цистеиниллейкотриенов, показывая корреляционную взаимосвязь между симптомами аллергической реакции и степенью образования лейкотриенов и, следовательно, активацией рецептора CysLT. U. AchterrathTuckermann, Th. Simmet, W. Luck, I. Szelenyi, B. A. Peskar, Agents and Actions 24:217, 1988; Shin, M.H.,F.M. Baroody, D. Proud, A. Kagey-Sobotka, L.M. Lichtenstein, M. Naclerio, Clin. Exp. Allergy 22:289, 1992. Патент США 6194432 B1 раскрывает способ применения лекарственных средств - антагонистов лейкотриена для профилактики и лечения первичной рецидивирующей головной боли, включая мигренозную головную боль. Патент США 5977177 раскрывает некоторые производные замещенного фенила, которые являются модуляторами эндотелина и, таким образом, пригодны для лечения ряда состояний, в том числе астмы. Патент США 4853398 раскрывает некоторые производные бензола, которые являются селективными антагонистами лейкотриенов и, таким образом, пригодны для лечения аллергических расстройств,таких как астма. Европейская патентная заявкаЕР 28063 А 1 и патентная заявка ВеликобританииGB 2058785 раскрывают некоторые производные фенола, которые являются антагонистами веществ, вызывающих замедленную анафилактическую реакцию, и, таким образом, пригодны для лечения астмы, сенной лихорадки и кожных реакций.Brown, F.J. et al. J. Med. Chem. 32, p. 807-826 (1989) раскрывают некоторые производные гидроксиацетофенона, которые являются антагонистами лейкотриенов и, таким образом, имеют значение в лечении астмы. Опубликованная Международная патентная заявка WO 2001056990 А 2 и патент США 6800651 В 2 раскрывают некоторые производные пиридина, которые являются потенциаторами функции метаботропных рецепторов глутамата, в частности, потенциаторами функции рецептора mGlu2 и, таким образом, пригодны для лечения различных состояний, в том числе тревожности и мигренозной головной боли. Опубликованная Международная патентная заявка WO 2004018386 и Pinkerton, А.В. et al. Bioorg.Med. Chem. Lett., 14, p. 5329-5332 (2004) раскрывают некоторые производные ацетофенона, которые являются потенциаторами функции рецепторов глутамата, в частности, потенциаторами функции рецептора mGlu2 и, таким образом, пригодны для лечения различных состояний, в том числе тревожности, шизофрении и мигренозной головной боли. В недавно опубликованной работе Pinkerton, А.В. et al. Bioorg. Med. Chem. Lett., 14, p. 5867-5872(2004) раскрывают некоторые производные 4-тиопиридилацетофенона, которые являются потенциаторами функции рецепторов глутамата, в частности, потенциаторами функции рецептора mGlu2 и, таким об-2 011867 разом, могут быть пригодны для лечения расстройств ЦНС, в том числе тревожности, шизофрении и эпилепсии. Данное изобретение предлагает соединения формулы I, которые являются потенциаторами рецептора mGlu2 и антагонистами рецептора CysLT1. Таким образом, соединения формулы I могут обеспечить средства для лечения расстройств, связанных с глутаматом или лейкотриенами. Кроме того, ожидается,что при расстройствах, включающих глутаматный или лейкотриеновый компонент в возникновении,развитии и/или симптомах, соединения формулы I будут обеспечивать эффективное лечение для пациента. Медицинские последствия такой дисфункции глутамата делают ослабление указанных неврологических процессов важной терапевтической мишенью. Краткое описание изобретения Данное изобретение предлагает соединение формулы IAr1 и Ar2 независимо выбраны из группы, состоящей из фенилена, замещенного фенилена, тиофендиила, замещенного тиофендиила, тиазолдиила, замещенного тиазолдиила, фурандиила, замещенного фурандиила, пиридиндиила, замещенного пиридиндиила, оксазолдиила, замещенного оксазолдиила, изотиазолдиила, замещенного изотиазолдиила, изоксазолдиила, замещенного изоксазолдиила, пиримидиндиила, замещенного пиримидиндиила, пиридазиндиила, замещенного пиридазиндиила и 1,2,4 оксадиазол-3,5-диила;G и J независимо выбраны из группы, состоящей из связи и С 1-C3-алкандиила;R3 независимо представляет собой водород или С 1-С 5-алкил;n и q независимо равны 0, 1, 2 или 3; и его фармацевтически приемлемые соли. В другом варианте данное изобретение предлагает соединение формулы I, где Z выбран из группы,состоящей из (CH2)nCOOH,-3 011867 Данное изобретение также предлагает новые фармацевтические композиции, которые включают соединение формулы I и фармацевтически приемлемый разбавитель. Поскольку соединения формулы I являются потенциаторами функции рецептора mGlu2, соединения формулы I пригодны для лечения различных неврологических и психиатрических расстройств, связанных с дисфункцией глутамата, в том числе острых неврологических и психиатрических расстройств,таких как церебральные дефициты после хирургического вмешательства для шунтирования коронарной артерии и трансплантации, удар, ишемия мозга, травма спинного мозга, травма головы, перинатальная гипоксия, остановка сердца, повреждение нейронов вследствие гипогликемии, деменция (в том числе деменция, вызванная СПИДом), болезнь Альцгеймера, хорея Хантингтона, амиотрофный латеральный склероз, рассеянный склероз, повреждение глаз, ретинопатия, когнитивные расстройства, болезнь Паркинсона идиопатического и медикаментозного генеза, мышечные спазмы и расстройства, связанные со спастичностью мышц, в том числе различные виды тремора, эпилепсия, судороги, мигрень (в том числе мигренозная головная боль), недержание мочи, привыкание к психотропным и наркотическим веществам, абстинентный синдром (в том числе, вызванный отменой таких веществ, как опиаты, никотин, табачные продукты, спирт, бензодиазепины, кокаин, седативные, снотворные средства и т.д.), психоз, шизофрения, тревожность (в том числе генерализованное тревожное расстройство, паническое расстройство и обсессивно-компульсивное расстройство), расстройства настроения (в том числе депрессия, мания,биполярные расстройства), невралгия тройничного нерва, ухудшение слуха, звон в ушах, дегенерация желтого пятна, рвота, отек мозга, боль (в том числе состояния острой и хронической боли, тяжелая боль,устойчивая боль, боль невропатического генеза и боль после травм), поздняя дискинезия, расстройства сна (в том числе нарколепсия), расстройство дефицита внимания/гиперактивности и расстройство поведения. В другом варианте данное изобретение предлагает способы лечения неврологических и психиатрических расстройств, связанных с дисфункцией глутамата, которые включают введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I. Таким образом, данное изобретение предлагает применение соединения формулы I или фармацевтической композиции на его основе для лечения неврологических и психиатрических расстройств, связанных с дисфункцией глутамата. Из перечисленных выше расстройств, особенно важным является лечение мигрени, тревожности,шизофрении и эпилепсии. В предпочтительном варианте данное изобретение предлагает способ лечения мигрени, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I. В другом предпочтительном варианте данное изобретение предлагает способ лечения тревожности,который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I. Особенно предпочтительные тревожные расстройства представляют собой генерализованное тревожное расстройство, паническое расстройство и обсессивно-компульсивное расстройство. В другом предпочтительном варианте данное изобретение предлагает способ лечения шизофрении,который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I. Еще в одном предпочтительном варианте данное изобретение предлагает применение соединения формулы I для производства лекарственного средства для лечения неврологических и психиатрических расстройств, связанных с дисфункцией глутамата. Еще в одном предпочтительном варианте данное изобретение предлагает применение соединения формулы I в качестве лекарственного средства. Еще в одном предпочтительном варианте данное изобретение предлагает применение соединения формулы I для производства лекарственного средства для лечения мигрени. Еще в одном предпочтительном варианте данное изобретение предлагает фармацевтическую композицию для лечения неврологических и психиатрических расстройств, связанных с дисфункцией глутамата, содержащую в качестве активного ингредиента соединение формулы I. Еще в одном предпочтительном варианте данное изобретение предлагает способ лечения эпилепсии, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I. Поскольку такие потенциаторы, в том числе, соединения формулы I, положительно модулируют реакцию метаботропного рецептора на глутамат, предпочтительно, чтобы в указанных способах использовался эндогенный глутамат. Поскольку такие потенциаторы положительно модулируют реакцию метаботропного рецептора на агонисты глутамата, понятно, что данное изобретение охватывает лечение неврологических и психиатрических расстройств, связанных с дисфункцией глутамата, путем введения эффективного количества потенциатора метаботропного рецептора глутамата, в том числе соединений формулы I, в комбинации с потенцирующим количеством агониста метаботропного рецептора глутамата. Такая комбинация может-4 011867 быть предпочтительной, поскольку она может увеличивать активность и селективность агониста метаботропных рецепторов глутамата, в частности потенциатора рецепторов mGlu2. Поскольку многие соединения формулы I являются антагонистами рецептора CysLT1, многие из соединений формулы I пригодны для лечения разнообразных расстройств, опосредованных одним или больше лейкотриенов, таких как воспалительные и аллергические расстройства, связанные с опосредованием лейкотриенами, включая синдром воспаленного кишечника, воспалительное заболевание кишечника, артрит, астму, псориаз и тромботические заболевания. В другом варианте данное изобретение предлагает способы лечения разнообразных расстройств,опосредованных одним или больше лейкотриенов, которые включают введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I. Таким образом, данное изобретение предлагает применение соединения формулы I или фармацевтической композиции на его основе для лечения воспалительных и аллергических расстройств, связанных с опосредованием лейкотриеном. В предпочтительном варианте данное изобретение предлагает способ лечения астмы, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I. В другом варианте данное изобретение предлагает способ получения соединения формулы I или его фармацевтически приемлемой соли. Подробное описание изобретения Данное изобретение предлагает способы потенцирования метаботропных рецепторов глутамата,особенно рецепторов mGlu2. В данном способе вводят эффективное количество потенциатора 2 метаботропных рецепторов глутамата, в том числе соединения формулы I, которое положительно модулирует влияние глутамата или агонистов глутамата на соответствующий рецептор. Перед тем, как более подробно описать данное изобретение, следует подчеркнуть, что изобретение в самом широком смысле не ограничивается конкретными вариантами, описанными в данном патенте,поскольку вариации конкретных вариантов, описанных в данном описании, находятся в рамках заявленного изобретения. Таким образом, пригодными соединениями по данному изобретению являются такие, которые представляют потенциаторы метаботропных рецепторов глутамата, конкретно, такие, которые потенцируют действие глутамата и агонистов глутамата на метаботропные рецепторы глутамата mGlu2 и, даже более конкретно, такие, которые потенцируют действие глутамата и агонистов глутамата на рецепторыmGlu2. Структура пригодных соединений варьирует, и до тех пор, пока они обладают описанными выше свойствами, они являются подходящими для применения в соответствии с данным изобретением. Предпочтительные соединения включают, не ограничиваясь ими, раскрытые в данном описании. Соединения формулы I потенцируют функцию рецепторов глутамата. Конкретно, соединения формулы I представляют собой потенциаторы рецептора mGlu2. Соединения по данному изобретению также включают соединения, которые являются модуляторами рецепторов лейкотриена, конкретно, такие, которые являются антагонистами рецептора CysLT1. В данном описании следующие термины имеют следующие указанные значения. Термин "С 1-С 5-алкил" обозначает неразветвленную или разветвленную алкильную цепь, содержащую от одного до пяти атомов углерода, и включает метил, этил, пропил, изопропил, бутил, изобутил,втор-бутил, трет-бутил, пентил и т.п. Конкретные значения "С 1-С 5-алкил" представляют собой метил,этил, н-пропил и изопропил. Термин "алкил" обозначает одновалентный алифатический углеводород. В рамках термина "алкил" находится термин "С 1-C3-алкил". Термин "С 1-C3-алкил" обозначает неразветвленную или разветвленную алкильную цепь, содержащую от одного до трех атомов углерода, и включает метил, этил, пропил, изопропил и т.п. Термин "замещенный С 1-С 5-алкил" обозначает неразветвленную или разветвленную алкильную цепь, содержащую от одного до пяти атомов углерода, и включает метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил и пентил, содержащие от 1 до 3 заместителей, выбранных из группы, состоящей из гидрокси, галогена, азидо, алкокси, ацилокси, карбокси, алкоксикарбонил, амидо, замещенный амидо, амино, ациламино, сульфониламидо, сульфонамид, фенил, замещенный фенил, фенокси, замещенный фенокси, бензилокси, замещенный бензилокси, пиридил, замещенный пиридил, тиенил и замещенный тиенил. Термин "С 1-С 5-алкандиил" обозначает неразветвленную или разветвленную двухвалентную алкильную цепь, содержащую от одного до пяти атомов углерода, и включает метилен и этан-1,1-диил. Термин "замещенный С 1-С 5-алкандиил" обозначает неразветвленную или разветвленную двухвалентную алкильную цепь, содержащую от одного до пяти атомов углерода, и включает метилен, который содержит заместитель, выбранный из группы, состоящей из гидроксила, фтора, азидо, метокси, амино,ацетиламино и метилсульфонамида. Конкретные значения "замещенного С 1-С 5-алкандиила" представляют собой CH(OH), CH(F), CHN3, CH(OCH3), CHNH2, CHNH(C=O)CH3, CHNH(SO2)CH3. Термин "С 1-C3-алкандиил" обозначает неразветвленную или разветвленную двухвалентную алкильную цепь, содержащую от одного до трех атомов углерода, и включает метилен.-5 011867 Термин "замещенный С 1-C3-алкандиил" обозначает неразветвленную или разветвленную алкильную цепь, содержащую от одного до трех атомов углерода, и включает метилен, который содержит 1 или 2 заместителя, выбранных из группы, состоящей из гидрокси, галогена, азидо, алкокси, ацилокси, карбокси, алкоксикарбонила, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, фенила, замещенного фенила, пиридила, замещенного пиридила, тиенила и замещенного тиенила. Термин "галоген или гало" обозначает хлор, фтор, бром или йод. Термин "С 1-C3-фторалкил" обозначает алкильную цепь, содержащую от одного до трех атомов углерода, которая замещена одним или больше атомов фтора, и включает фторметил, дифторметил, трифторметил, 2,2,2-трифторэтил, 3,3,3-трифторпропил и т.п. Конкретное значение "С 1-C3-фторалкил" представляет собой трифторметил. Термин "алкокси" обозначает неразветвленную или разветвленную алкильную цепь, которая присоединена к атому кислорода. В рамках термина "алкокси" находится термин "С 1-С 4-алкокси". Термин "С 1-С 4-алкокси" обозначает неразветвленную или разветвленную алкильную цепь, содержащую от одного до четырех атомов углерода, которая присоединена к атому кислорода и включает метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси и т.п. Термин "замещенный алкокси" обозначает неразветвленную или разветвленную алкильную цепь,которая присоединена к атому кислорода, содержащую от 1 до 3 заместителей. В рамках термина "замещенный алкокси" находится термин "замещенный С 1-С 4-алкокси". Термин "замещенный С 1-С 4-алкокси" обозначает неразветвленную или разветвленную алкильную цепь, содержащую от одного до четырех атомов углерода, которая присоединена к атому кислорода и включает метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси и т.п., содержащую от 1 до 3 заместителей, выбранных из группы, состоящей из гидрокси, галогена, алкокси, карбокси, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, фенила и замещенного фенила; и если один или больше заместителей представляет собой гидрокси, галоген, алкокси, амино, ациламино и сульфонамид, то эти заместители не присоединены к тому же атому углерода,что и атом кислорода алкоксигруппы. Термин "C3-С 7-циклоалкил" обозначает насыщенную циклическую алкильную группу, которая содержит от трех до семи атомов углерода и включает циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Термин "С 4-С 8-циклоалкилалкил" обозначает насыщенную циклическую алкильную группу, которая содержит от трех до семи атомов углерода, связанных с точкой замещения двухвалентным незамещенным насыщенным углеводородным радикалом с неразветвленной или разветвленной цепью, который содержит, как минимум, 1 атом углерода и включает циклопропилметил, циклопропил-2-пропил, циклобутилэтил, циклопентилметил, циклогексилметил, циклогептилметил и т.п. Термины "фенил и замещенный фенил" или "фенилен и замещенный фенилен" обозначают, соответственно, одновалентный или двухвалентный радикал формулы где Ra представляет собой от 1 до 3 групп, независимо выбранные из группы, состоящей из водорода,гидрокси, алкила, замещенного алкила, циклоалкила, алкокси, замещенного алкокси, галогена, карбокси,алкоксикарбонила, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, циано, нитро, фенила и замещенного фенила. Конкретные значения Ra представляют собой водород, метокси и фтор. Термины "тиофенил и замещенный тиофенил" или "тиофендиил и замещенный тиофендиил" обозначают, соответственно, одновалентный или двухвалентный радикал формулы где Rb представляет собой 1 или 2 группы, независимо выбранные из группы, состоящей из водорода,алкила, замещенного алкила, циклоалкила, алкокси, замещенного алкокси, галогена, карбокси, алкоксикарбонила, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, циано, нитро, фенила и замещенного фенила. Конкретное значение Rb представляет собой водород. Термины "пиридинил и замещенный пиридинил" или "пиридиндиил и замещенный пиридиндиил" обозначают, соответственно, одновалентный или двухвалентный радикал формулы где Rc представляет собой от 1 до 3 групп, независимо выбранных из группы, состоящей из водорода,гидрокси, алкила, замещенного алкила, циклоалкила, алкокси, замещенного алкокси, галогена, карбокси,алкоксикарбонила, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, циано, нитро, фенила и замещенного фенила. Конкретное значение Rc представляет собой водород.-6 011867 Термины "тиазолил и замещенный тиазолил" или "тиазолдиил и замещенный тиазолдиил" обозначают, соответственно, одновалентный или двухвалентный радикал формулы где Rd представляет собой 1 или 2 группы, независимо выбранные из группы, состоящей из водорода,алкила, замещенного алкила, циклоалкила, алкокси, замещенного алкокси, галогена, карбокси, алкоксикарбонила, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, циано, нитро, фенила и замещенного фенила. Конкретное значение Rd представляет собой водород. Термины "фуранил и замещенный фуранил" или "фурандиил и замещенный фурандиил" обозначают, соответственно, одновалентный или двухвалентный радикал формулы где Re представляет собой 1 или 2 группы, независимо выбранные из группы, состоящей из водорода,алкила, замещенного алкила, циклоалкила, алкокси, замещенного алкокси, галогена, карбокси, алкоксикарбонил, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, циано, нитро,фенила и замещенного фенила. Конкретное значение Re представляет собой водород. Термины "изотиазолил и замещенный изотиазолил" или "изотиазолдиил и замещенный изотиазолдиил" обозначают, соответственно, одновалентный или двухвалентный радикал формулы где Rf представляет собой 1 или 2 группы, независимо выбранные из группы, состоящей из водорода,алкила, замещенного алкила, циклоалкила, алкокси, замещенного алкокси, галогена, карбокси, алкоксикарбонила, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, циано, нитро, фенила и замещенного фенила. Конкретное значение Rf представляет собой водород. Термины "изоксазолил и замещенный изоксазолил" или "изоксазолдиил и замещенный изоксазолдиил" обозначают, соответственно, одновалентный или двухвалентный радикал формулы где Rg представляет собой 1 или 2 группы, независимо выбранные из группы, состоящей из водорода,алкила, замещенного алкила, циклоалкила, алкокси, замещенного алкокси, галогена, карбокси, алкоксикарбонила, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, циано, нитро, фенила и замещенного фенила. Конкретное значение Rg представляет собой водород. Термины "1,2,4-оксадиазолил и замещенный 1,2,4-оксадиазолил" или "1,2,4-оксадиазол-3,5-диил" обозначают, соответственно, одновалентный радикал или двухвалентный (без Rh) радикал формулы где Rh независимо выбран из группы, состоящей из водорода, алкила, замещенного алкила, циклоалкила,алкокси, замещенного алкокси, галогена, карбокси, алкоксикарбонила, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, циано, нитро, фенила и замещенного фенила. Конкретное значение Rh представляет собой водород. Термины "пиримидинил и замещенный пиримидинил" или "пиримидиндиил и замещенный пиримидиндиил" обозначают, соответственно, одновалентный или двухвалентный радикал формулы где Ri представляет собой от 1 до 3 групп, независимо выбранных из группы, состоящей из водорода,гидрокси, алкила, замещенного алкила, циклоалкила, алкокси, замещенного алкокси, галогена, карбокси,алкоксикарбонила, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, циано, нитро, фенила и замещенного фенила. Конкретное значение Ri представляет собой водород. Термины "пиридазинил и замещенный пиридазинил" или "пиридазиндиил и замещенный пиридазиндиил" обозначают, соответственно, одновалентный или двухвалентный радикал формулы где Rj представляет собой от 1 до 3 групп, независимо выбранных из группы, состоящей из водорода,гидрокси, алкила, замещенного алкила, циклоалкила, алкокси, замещенного алкокси, галогена, карбокси,алкоксикарбонила, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, циано, нитро, фенила и замещенного фенила. Конкретное значение Rj представляет собой водород. Термины "оксазолил и замещенный оксазолил" или "оксазолдиил и замещенный оксазолдиил" обозначают, соответственно, одновалентный или двухвалентный радикал формулы где Rl представляет собой 1 или 2 группы, независимо выбранные из группы, состоящей из водорода,алкила, замещенного алкила, циклоалкила, алкокси, замещенного алкокси, галогена, карбокси, алкоксикарбонила, амидо, замещенного амидо, амино, ациламино, сульфониламидо, сульфонамида, циано, нитро, фенила и замещенного фенила. Конкретное значение Rl представляет собой водород. Термин "карбокси" обозначает радикал формулы где Rk выбран из группы, состоящей из алкила, замещенного алкила, фенила и замещенного фенила. Конкретные значения Rk представляют собой метил и этил. Термин "амидо" обозначает радикал формулы где Rm выбран из группы, состоящей из алкила, и Rn выбран из группы, состоящей из водорода, алкила,фенила и замещенного фенила. Конкретное значение Rm представляет собой метил. Конкретные значения Rn представляют собой водород и метил. Термин "ациламино" обозначает радикал формулы где Rp выбран из группы, состоящей из алкила, фенила и замещенного фенила, и Rp' выбран из группы,состоящей из водорода и алкила. Конкретное значение Rp представляет собой метил. Конкретные значения Rp' представляют собой водород и метил. Термин "сульфонамид" обозначает радикал формулы где Rq выбран из группы, состоящей из алкила, фенила и замещенного фенила. Конкретное значение Rq представляет собой метил. Для специалиста в данной области будет очевидно, что соединения формулы I могут существовать в виде таутомеров. Если существуют таутомерные формы, каждая таутомерная форма, а также их смеси охватываются данным изобретением. Если в данном изобретении приводится ссылка на одну из конкретных таутомерных форм соединений формулы I, следует понимать, что изобретение охватывает все таутомерные формы и их смеси. Например, если группа Z представляет собой тетразолил, соединение формулы I существует в виде таутомера I и таутомера II. Понятно, что любая ссылка на соединение формулы I, где группа Z является тетразолилом в виде таутомера I, охватывает таутомер II, также как и смеси таутомера I и таутомера II. Следует понимать, что соединения по данному изобретению могут существовать в виде стереоизомеров. Все энантиомеры, диастереомеры и их смеси охватываются настоящим изобретением. Если в данном изобретении указаны конкретные стереохимические соединения обозначения Кана-ИнгольдаПрелога (R)- и (S)-, а также цис- и транс- обозначения относительной стереохимии используются для указания на конкретные изомеры и относительную стереохимию. Известные виды оптического вращения обозначаются (+) и (-) для правовращающих и левовращающих соединений, соответственно. Если хиральное соединение разделено на энантиомеры, но абсолютные конфигурации не определены, изомеры обозначают как изомер 1, изомер 2 и т.д. Конкретные стереоизомеры могут быть получены с помощью стереоспецифического синтеза с использованием исходных материалов в виде чистых энантиомеров или обогащенных энантиомеров. Конкретные стереоизомеры исходных материалов или соединений формулы I могут быть разделены с помощью хорошо известных в данной области техник, таких как описанные в Stereochemistry of Organic Compounds, E.I. Eliel and S.H. Wilen (Wiley 1994) и Enantiomers, Racemates, and Resolutions, J. Jacques, A. Collet, and S.H. Wilen (Wiley 1991), в том числе хроматографии на хиральных неподвижных фазах, ферментного разделения или фракционированной кристаллизации, а также хроматографирования диастереоизомеров, полученных для этой цели, таких как диастереомерные соли. Хотя данное изобретение охватывает все энантиомеры, диастереомеры и их смеси, предпочтительными вариантами являются отдельные энантиомеры и отдельные диастереомеры. Термины Ar1 и Ar2 обозначают 5- или 6-членные арильные или гетероциклические кольца, независимо выбранные из группы, состоящей из фенилена, замещенного фенилена, тиофендиила, замещенного тиофендиила, тиазолдиила, замещенного тиазолдиила, фурандиила, замещенного фурандиила,пиридиндиила, замещенного пиридиндиила, оксазолдиила, замещенного оксазолдиила, изотиазолдиила,замещенного изотиазолдиила, изоксазолдиила, замещенного изоксазолдиила, пиримидиндиила, замещенного пиримидиндиила, пиридазиндиила, замещенного пиридазиндиила и 1,2,4-оксадиазол-3,5-диила. Следует понимать, что Ar1 и Ar2, которые представляют собой, как минимум, бирадикал, могут быть присоединены в региоизомерном положении 1-2, 1-3 или 1-4, в зависимости от природы кольца, а также от количества и расположения заместителей. Также следует понимать, что данное изобретение охватывает все возможные региоизомерные комбинации присоединения Ar1 и Ar2. Например, если Ar1 представляет собой фенилен, то существуют три возможных региоизомера, обозначенные как 1-2 (орто или о-), 1-3 (мета или м-) и 1-4 (пара или п-), все из которых охватываются данным изобретением для соединения формулы I, где Ar1 представляет собой фенилен. Термин "фармацевтически приемлемая соль" обозначает аддитивную соль, которая существует в виде соединения с кислотной и/или основной частью соединения формулы I. Такие соли включают фармацевтически приемлемые соли, перечисленные в Handbook of Pharmaceutical Salts: Properties, Selectionand Use, P.H. Stahl and C.G. Wermuth (Eds.), Wiley-VCH, New York, 2002, которые известны специалисту в данной области. Фармацевтически приемлемые соли, которые являются кислотно-аддитивными, образуются, если соединение формулы I и описанные здесь промежуточные соединения, содержащие основную функциональную группу, реагируют с фармацевтически приемлемой кислотой. Фармацевтически-9 011867 приемлемые кислоты, которые обычно применяются для образования кислотно-аддитивных солей,включают неорганические кислоты, такие как хлористо-водородная, бромисто-водородная, азотная, серная или фосфорная кислоты, а также органические кислоты, такие как уксусная, лимонная, эзиловая (esylic), фумаровая, гликолевая, глюкуроновая, глутаровая, молочная, малеиновая, яблочная, миндальная,мезиловая, нападизиловая, щавелевая, янтарная, винная, салициловая, о-ацетоксибензойная или птолуолсульфоновая. Фармацевтически приемлемые основно-аддитивные соли образуются, когда соединение формулы I и описанные в данном описании промежуточные соединения, содержащие кислотную функциональную группу, реагируют с фармацевтически приемлемым основанием. Фармацевтически приемлемые основания, которые обычно используют для образования основно-аддитивных солей, включают органические основания, такие как аммиак, аргинин, бенетамин, бензатин, бензиламин, бетаин,бутиламин, холин, дициклогексиламин, диэтаноламин, диэтиламин, этилендиамин, глюкозамин имидазол, лизин, пиперазин, прокаин, а также неорганические основания, такие как кальция, калия, натрия и цинка гидроксид, карбонат или бикарбонат и т.п. Кроме фармацевтически приемлемых солей изобретение охватывает другие соли. Они могут служить промежуточными соединениями в ходе очистки соединений или в ходе получения других, например, фармацевтически приемлемых кислотно-аддитивных солей, или пригодны с точки зрения идентификации, описания или очистки. Термин "защитная группа или Pg" в данном описании обозначает группы, предназначенные для блокирования или защиты функциональной группы от нежелательных реакций в ходе процедуры синтеза. В случае аминной или гидроксильной функциональной группы используют подходящую защитную группу, выбор которой будет зависеть от условий последующих реакций, где необходима защита. Например, может быть желательным использовать защиту для нескольких функциональных групп, таких как амино и гидроксил, и независимо контролировать их защиту и снятие защиты. Широко применяемые защитные группы для амино и гидроксила раскрыты в Protective Groups In Organic Synthesis, T.W. Greeneand P.G.M. Wuts 3rd Ed. (John WileySons, New York (1999. Подходящие для аминогруппы защитные группы включают ацильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил,2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, о-нитрофеноксиацетил, альфахлорбутирил, бензоил, 4-хлорбензоил, 4-бромбензоил, 4-нитробензоил и т.п.; сульфонильные группы,такие как бензолсульфонил, п-толуолсульфонил и т.п., карбаматобразующие группы, такие как бензилоксикарбонил,п-хлорбензилоксикарбонил,п-метоксибензилоксикарбонил,п-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, п-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил,3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил,2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(п-бифенилил)-1 метилэтоксикарбонил, альфа,альфа-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутилоксикарбонил, диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил,метоксикарбонил, аллилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, флуоренил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил,циклогексилоксикарбонил, фенилтиокарбонил и т.п.; алкильные группы, такие как бензил, трифенилметил, бензилоксиметил и т.п.; и силильные группы, такие как триметилсилил и т.п. Предпочтительные подходящие защитные группы для амино представляют собой ацетил, метилоксикарбонил, бензоил, пивалоил, аллилоксикарбонил, трет-бутилацетил, бензил, трет-бутилоксикарбонил (Boc) и бензилоксикарбонил (Cbz). Подходящие защитные группы для гидроксила включают эфиры, такие как метоксиметил,1-этоксиэтил, трет-бутил, аллил, бензил, тетрагидропиранил и т.п.; силиловые эфиры, такие как триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилдиметилсилил и т.п.; эфиры, такие как формиат,ацетат, пивалоат, бензоат и т.п.; и сульфонаты, такие как мезилат, бензилсульфонат, тозилат и т.п. Предпочтительные подходящие защитные группы для гидроксила представляют собой ацетил, триметилсилил, триизопропилсилил, трет-бутилдиметилсилил и бензил. Как и в случае любой группы фармацевтически активных соединений, некоторые группы являются предпочтительными с точки зрения конечного применения. Предпочтительные варианты соединения формулы I по данному изобретению приведены ниже. Соединения, в которых R1 представляет собой C3-С 7-циклоалкил или С 4-С 8-циклоалкилалкил, являются предпочтительными. Соединения, в которых R1 представляет собой С 1-С 5-алкил, являются более предпочтительными. Соединения, в которых R1 представляет собой метил, являются даже более предпочтительными. Соединения, в которых R2 представляет собой фенил, замещенный фенил, тиофенил, замещенный тиофенил, тиазолил, замещенный тиазолил, пиридинил или замещенный пиридинил, являются предпочтительными. Соединения, в которых R2 представляет собой С 1-С 5-алкил, галоген или С 1-C3-фторалкил,являются более предпочтительными. Соединения, в которых R2 представляет собой метил, пропил, трифторметил или хлор, являются даже более предпочтительными. Соединения, в которых X представляет собой S(O)m, где m равно 0, 1 или 2, являются предпочтительными. Соединения, в которых X представляет собой О, являются более предпочтительными. Соединения, в которых Y представляет собой С 1-C3-алкандиил, являются предпочтительными. Со- 10011867 единения, в которых Y представляет собой метилен, являются более предпочтительными. Соединения, в которых Ar1 представляет собой фенилен, являются предпочтительными. Соединения, в которых Ar1 и Ar2 независимо представляют собой фенилен или пиридиндиил, являются предпочтительными. Соединения, в которых Ar1 представляет собой замещенный фенилен, 1,2,4-оксадиазол-3,5-диил или замещенный пиридиндиил, являются предпочтительными. Соединения, в которых Ar1 представляет собой фенилен или пиридиндиил, присоединенные в любом из положений 1-3, являются более предпочтительными. Соединения, в которых Ar1 представляет собой фенилен или пиридиндиил, причем каждое из колец присоединено в положении 1-4, являются даже более предпочтительными. Соединения, в которых Ar2 представляет собой фенилен, являются предпочтительными. Соединения, в которых Ar2 представляет собой замещенный фенилен или замещенный пиридиндиил, являются предпочтительными. Соединения, в которых Ar2 представляет собой фенилен или пиридиндиил, являются более предпочтительными. Соединения, в которых Ar2 представляет собой пиридиндиил,присоединенный в положении 1-4 или 1-3, являются даже более предпочтительными. Соединения, в которых Ar1 и Ar2 независимо представляют собой фенилен или пиридиндиил, являются предпочтительными. Соединения, в которых Ar1 представляет собой фенилен, являются предпочтительными. Соединения, в которых Ar2 представляет собой пиридиндиил, являются предпочтительными. Соединения, в которых Ar2 присоединен в положении 1-4, являются предпочтительными. Соединения, в которых Ar2 присоединен в положении 1-3, являются предпочтительными. Соединения, в которых Ar1 присоединен в положении 1-3 или 1-4, являются предпочтительными. Соединения, в которых L представляет собой С 1-С 5-алкандиил, замещенный С 1-С 5-алкандиил или С(=W), где W представляет собой CH2 или O, являются предпочтительными. Соединения, в которых L представляет собой -CH(OH)-, -CH(F)- или -CH2-, являются более предпочтительными. Соединения, в которых Z представляет собой являются даже более предпочтительными. Соединение формулы I, как описано выше, гдеR1 представляет собой метил или этил;Ar1 представляет собой фенилен или 1,2,4-оксадиазол-3,5-диил;q представляет собой 0,является предпочтительным. Соединение формулы I, выбранное из группы, состоящей из (+)-3-[4-(4-ацетил-3-гидрокси-2 пропилфеноксиметил)фенил]гидроксиметилбензойной кислоты (изомер 1) и (-)-3-[4-(4-ацетил-3 гидрокси-2-пропилфеноксиметил)фенил]гидроксиметилбензойной кислоты (изомер 2), является предпочтительным. Соединение формулы I, которое представляет собой 3-[4-(4-ацетил-3-гидрокси-2 пропилфеноксиметил)фенил]-(S)-гидроксиметилбензойную кислоту, является более предпочтительным. Дальнейшие варианты изобретения включают способ получения соединения формулы I или его фармацевтически приемлемой соли, который включает:(А) для соединения формулы I, где Z представляет собой тетразолил, циклоприсоединение соединения формулы II, где R10 представляет собой циано, с использованием азидного реагента;(В) для соединения формулы I, где Z представляет собой COOH, гидролиз соединения формулы II, где R10 представляет собой COOR14 и R14 выбран из группы, состоящей из С 1-С 5-алкила, фенила и бензила;(С) для соединения формулы I, где Z представляет собой COOH, гидролиз соединения формулы II, где R10 представляет собой циано; и(D) для соединения формулы I циклоконденсацию соединения формулы II, где R10 представляет собой ацилхлорид кислоты причем, если необходимо получить фармацевтически приемлемую соль соединения формулы I, ее получают реакцией кислоты формулы I с физиологически приемлемым основанием, или реакцией основного соединения формулы I с физиологически приемлемой кислотой, или с помощью другой традиционной методики. Еще один вариант данного изобретения предлагает промежуточные соединения, пригодные для получения соединения формулы I. Более конкретно, данное изобретение предлагает соединение формулы IIR10 представляет собой CN или COOR14, где R14 выбран из группы, состоящей из С 1-С 5-алкила, фенила и бензила. Конкретное значение R14 представляет собой метил. Еще один вариант данного изобретения предлагает способ получения 3-[4-(4-ацетил-3-гидрокси-2 пропилфеноксиметил)фенил]-(S)-гидроксиметилбензойной кислоты или ее фармацевтически приемлемой соли, который включает:(i) алкилирование 2,4-дигидрокси-3-пропилацетофенона с использованием 3-[4-(метансульфонилоксиметилфенил)-(S)-ацетоксиметил]бензонитрила в присутствии карбоната калия с получением 3[4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]-(S)-ацетоксиметилбензонитрила;(ii) гидролиз 3-[4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]-(S)-ацетоксиметилбензонитрила в присутствии гидроксида калия, где после реакции гидролиза осуществляют подкисление хлористо-водородной кислотой с получением 3-[4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил](S)-гидроксиметилбензойной кислоты; причем, если необходимо получить фармацевтически приемлемую соль 3-[4-(4-ацетил-3-гидрокси- 13011867 2-пропилфеноксиметил)фенил]-(S)-гидроксиметилбензойной кислоты, ее получают реакцией 3-[4-(4 ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]-(S)-гидроксиметилбензойной кислоты с физиологически приемлемым основанием или с помощью другой традиционной методики. Еще один вариант данного изобретения предлагает способ получения вышеупомянутого исходного 3-[4-(метансульфонилоксиметилфенил)-(S)-ацетоксиметил]бензонитрила, который включает:(i) энантиоселективное арилирование 3-цианобензальдегида 2,4,6-трис-[4-(трет-бутилдиметилсиланилоксиметил)фенил]циклотрибороксаном в присутствии диалкилцинка и хирального катализатора,где диалкилцинк представляет собой диэтилцинк; и хиральный катализатор представляет собой (R)-(-)-2 пиперидин-1,1,2-трифенил этанол, с получением 3-[4-(трет-бутилдиметилсиланилоксиметил)фенил](S)-гидроксиметилбензонитрила;(iii) сульфонирование 3-[4-(гидроксиметилфенил)-(S)-ацетоксиметил]бензонитрила метансульфонилхлоридом с получением 3-[4-(метансульфонилоксиметилфенил)-(S)-ацетоксиметил]бензонитрила. Еще один вариант данного изобретения предлагает промежуточные соединения, пригодные для получения соединения формулы I. Более конкретно, данное изобретение предлагает соединение, которое представляет собой 3-[4-(гидроксиметилфенил)-(S)-ацетоксиметил]бензонитрил. Соединения по данному изобретению могут быть получены по способу, аналогичному известным из уровня техники для получения структурно подобных соединений, или по новому способу, описанному в данном изобретении. Такие способы, пригодные для получения соединения формулы I, как определено выше, предложены как дополнительные признаки изобретения и проиллюстрированы следующими методиками, где, если не указано иное, значения общих радикалов являются такими, как определено выше,и все реагенты хорошо известны в данной области. В общем, соединение формулы I может быть получено из соединения формулы II, где R10 представляет собой предшественник группы Z (схема реакции А, стадия а). Более конкретно, соединение формулы II, где R10 представляет собой эфир или нитрил карбоновой кислоты, реагирует с подходящим основанием, таким как калия гидроксид, в подходящем растворителе, таком как вода, с образованием соединения формулы I, где Z представляет собой карбоновую кислоту. Дополнительно, соединение формулыII, где R1 представляет собой циано, реагирует с азидным реагентом с образованием соединения формулы I, где Z представляет собой тетразолил. Азидные реагенты включают HN3, где HN3 образуется в результате реакции натрия азида и протонной кислоты, такой как триэтиламина гидрохлорид или аммония хлорид. Реакцию традиционно проводят в таком растворителе, как смеси воды и органического сорастворителя, где органический сорастворитель представляет собой спирт, такой как изопропиловый спирт,или третичный амид, такой как N-метилпирролидинон. Другие примеры азидных реагентов включают азидные комплексы переходных металлов, например, таких как образуются в результате реакции цинка бромида и натрия азида, а также триалкилсилилазидов, таких как триметилсилилазид. Соединение формулы II, где R10 представляет собой галогенангидрид кислоты, реагирует в ходе одной или больше стадий с агентами циклоконденсации с образованием соединения формулы I, где Z представляет собой Соединение формулы II может быть получено из соединения формулы III (схема реакции А, стадияb) или, альтернативно, из соединения формулы V (схема реакции А, стадия с). Более конкретно, на стадии b соединение формулы III, где X представляет собой О, реагирует в условиях Мицунобу с соединением формулы IV, где R11 представляет собой ОН, в присутствии фосфинорганического соединения, такого как трибутилфосфин, и подходящего азодикарбонильного реагента, такого как 1,1'(азодикарбонил)дипиперидин, с образованием соединения формулы II. Подходящие растворители включают толуол и дихлорметан. На стадии b соединение формулы II также можно получить реакцией соединения формулы III, где X представляет собой О, S, NH, с соединением формулы IV, где R11 представляет собой уходящую группу, в присутствии подходящего основания, такого как карбонат цезия, и подходящего растворителя, такого как ацетон. Подходящие уходящие группы включают галогениды, такие как иодид, а также сульфонатные эфиры, такие как метансульфонатный эфир. Альтернативно, соединение формулы II может быть получено из соединения формулы V (схема реакции А, стадия с), где R12 представляет собой подходящий предшественник группы L. Соединение формулы III, где R2 представляет собой галоген, фенил, замещенный фенил, тиофенил,замещенный тиофенил и т.п., может быть получено из соединения формулы VII (схема реакции В). Более конкретно, соединение формулы VII, где X представляет собой О, вступает в реакцию в подходящих для галогенирования условиях с образованием соединения формулы III, где X представляет собой О, и R2 представляет собой галоген, такой как хлор, бром или йод. Соединение формулы III, где X представляет собой O и R2 представляет собой галоген, такой как хлор, бром или йод, реагирует с бороновой кислотой фенила, замещенного фенила, тиофенила, замещенного тиофенила и т.п. в присутствии катализатора на основе переходного металла, такого как Pd(dppf)2Cl2, и основания, такого как гидроксид цезия, с образованием соединения формулы III, где R2 представляет собой соответствующий фенил, замещенный фенил,тиофенил, замещенный тиофенил и т.п. Реакцию традиционно осуществляют в растворителе, таком как смеси тетрагидрофурана и воды. Схема реакции В Соединение формулы III, где X представляет собой S, может быть получено из соединения формулы III, где X представляет собой О. Более конкретно, соединение формулы III, где X представляет собой О, реагирует с диметилтиокарбамоилхлоридом в подходящем растворителе, таком как дихлорметан. Полученный тиокарбамат нагревают в подходящем растворителе, таком как додекан, и обрабатывают натрия гидроксидом с получением соединения формулы III, где X представляет собой S. Соединение формулы III также можно получить из соединения формулы IX, где группа Pg представляет собой подходящую защитную группу (схема реакции С). Более конкретно, на стадии a соединение формулы IX, где R2 представляет собой галоген, такой как йод или бром, и Pg представляет собой метил, реагирует с бороновой кислотой фенила, замещенного фенила, тиофенила, замещенного тиофенила и т.п. в присутствии катализатора на основе переходного металла, такого как Pd(dppf)2Cl2, и основания, такого как гидроксид цезия, с образованием соединения формулы IX, где R2 представляет собой фенил, замещенный фенил, тиофенил, замещенный тиофенил и т.п. и Pg представляет собой метил. Реакцию традиционно осуществляют в растворителе, таком как смесь тетрагидрофурана и воды. Далее, на- 15011867 стадии a соединение формулы IX, где R2 представляет собой фенил, замещенный фенил, тиофенил, замещенный тиофенил и т.п. реагирует с R1 галогенангидридом кислоты, таким как хлорангидрид уксусной кислоты, и кислотой Льюиса, такой как алюминия хлорид, в подходящем растворителе с образованием соединения формулы VIII, где R1 представляет собой метил и R2 представляет собой фенил, замещенный фенил, тиофенил, замещенный тиофенил и т.п. Подходящие растворители включают дихлорметан. На стадии b соединение формулы VIII, где группа Pg представляет собой метил, реагирует с агентами для снятия защиты, такими как пиридина гидрохлорид, в присутствии микроволнового излучения с образованием соединения формулы III, где R2 представляет собой фенил, замещенный фенил, тиофенил,замещенный тиофенил и т.п. Схема реакции С Дополнительно, на схеме реакции С соединение формулы III, где R2 представляет собой С 1-C3 фторалкил, может быть получено из соединения формулы IX, где R2 представляет собой галоген. Более конкретно, соединение формулы IX, где R2 представляет собой йод, X представляет собой O и Pg представляет собой подходящую защитную группу, такую как бензил, реагирует с алкиловым эфиром дифторфторсульфонилуксусной кислоты в присутствии гексаметилфосфорамида и катализатора на основе переходного металла, такого как меди иодид, в подходящем растворителе, с образованием соединения формулы IX, где R2 представляет собой трифторметил, X представляет собой O и Pg представляет собой бензил. Подходящие растворители включают диметилформамид. На стадии c соединение формулы IX,где R2 представляет собой трифторметил, X представляет собой O и Pg представляет собой бензил, реагирует с N-бромсукцинимидом в подходящем растворителе, таком как диметилформамид, с образованием соединения формулы X. На стадии d соединение формулы X реагирует с трибутил-(1 этоксивинил)станнаном с использованием катализатора на основе переходного металла, такого как тетракис(трифенилфосфин)палладий, в растворителе, таком как диоксан, с последующим кислотным гидролизом с образованием соединения формулы VIII, где R1 представляет собой метил, R2 представляет собой трифторметил, X представляет собой O и Pg представляет собой бензил. На стадии b соединение формулы VIII, где R1 представляет собой метил, R2 представляет собой трифторметил, X представляет собой O и Pg представляет собой бензил, реагирует с катализатором на основе переходного металла, таким как палладия гидроксид, в присутствии эффективного источника водорода, такого как циклогексен,с образованием соединения формулы III, где R1 представляет собой метил, R2 представляет собой трифторметил и X представляет собой О. Подходящие растворители включают этанол. На схеме реакции D соединение формулы IIa, где Pg1 представляет собой подходящую гидроксильную защитную группу, может быть получено из соединения формулы IVf, где Pg1 является таким же. Более конкретно, на стадии a соединение формулы XVII, где Pg представляет собой триалкилсилил, такой как трет-бутилдиметилсилил, реагирует с магнием в подходящем растворителе, таком как тетрагидрофуран. Полученный реактив Гриньяра XVII реагирует с соединением формулы XVIII в подходящем растворителе, таком как тетрагидрофуран, с образованием соединения формулы XIX, где Pg представляет собой трет-бутилдиметилсилил и R10 представляет собой подходящий предшественник группы Z, такой как циано. На стадии b соединение формулы XIX, где Pg представляет собой трет-бутилдиметилсилил, реагирует со вторым защитным агентом, таким как 3,4-дигидро-2 Н-пиран, с использованием подходящего катализатора, такого как пиридиний-паратолуолсульфонат, с образованием соединения формулы XIXa,где Pg представляет собой трет-бутилдиметилсилил и Pg1 представляет собой тетрагидро-2 Н-пиран. Реакцию традиционно осуществляют в таком растворителе, как дихлорметан. Может использоваться дополнительное количество второго защитного агента, такого как ангидрид уксусной кислоты, в присутствии основания, такого как триэтиламин, с получением соединения формулы XIXa, где Pg представляет собой трет-бутилдиметилсилил и Pg1 представляет собой ацетил. На стадии c соединение формулы XIXa реагирует с агентом для удаления защитной группы Pg без удаления защитной группы Pg1. Более конкретно, на стадии c соединение формулы XIXa, где Pg представляет собой трет-бутилдиметилсилил и Pg1 представляет собой тетрагидро-2 Н-пиран, реагирует с тетрабутиламмония фторидом в подходящем растворителе, таком как тетрагидрофуран, с образованием соединения формулы IVf, где Pg1 представляет собой тетрагидро-2 Н-пиран. Альтернативно, соединение формулы XIXa, где Pg представляет собой третбутилдиметилсилил и Pg1 представляет собой ацетил, реагирует с кислотой, такой как кислота хлористоводородная при приблизительно комнатной температуре с образованием соединения формулы IVf, гдеPg1 представляет собой ацетил. На схеме реакции Е соединения формулы Ia и Ib могут быть получены из соединения формулы IIa,где Pg1 представляет собой подходящую защитную группу. Более конкретно, на стадии a соединение формулы IIa, где R10 представляет собой подходящий предшественник группы Z, такой как нитрил, реагирует с источником азида, таким как натрия азид, в присутствии подходящей кислоты Льюиса, такой как цинка бромид, с образованием соединения формулы Ia, где Z представляет собой тетразолил. Реакцию традиционно осуществляют в таком растворителе, как вода и изопропиловый спирт. На стадии b соединение формулы Ia реагирует с восстановителями, такими как триэтилсилан, в присутствии подходящей кислоты Льюиса, такой как диэтилэфират трифторида бора, с образованием соединения формулыIb, где Z представляет собой тетразолил. Реакцию традиционно осуществляют в таком растворителе, как дихлорметан. Схема реакции Е- 17011867 На схеме реакции F соединения IIc и IId могут быть получены из соединения формулы IIa, где Pg1 представляет собой подходящую защитную группу. Более конкретно, на стадии a соединение формулыIIa реагирует с подходящей кислотой, такой как п-толуолсульфоновая кислота, с образованием соединения формулы IIb. Реакцию традиционно осуществляют в таком растворителе, как метанол. На стадии b соединение формулы IIb реагирует с галогенирующим агентом, таким как диэтиламиносеры трифторид,в таком растворителе, как дихлорметан, с образованием соединения формулы IIc. Схема реакции F На стадии c соединение формулы IIb реагирует с окислителем, таким как периодинан Десс-Мартина(1,1,1-триацетокси-1,1-дигидро-1,2-бензиодоксол-3(Н)-он), в подходящем растворителе, таком как дихлорметан, с образованием соединения формулы IId. На схеме реакции G соединение IIf, где R2 представляет собой фенил, замещенный фенил, тиофенил, замещенный тиофенил, тиазолил, замещенный тиазолил, фуранил, замещенный фуранил, пиридинил, замещенный пиридинил, оксазолил, замещенный оксазолил, изотиазолил, замещенный изотиазолил,изоксазолил, замещенный изоксазолил, 1,2,4-оксадиазолил, пиримидинил, замещенный пиримидинил или замещенный 1,2,4-оксадиазолил, может быть получено из соединения, где R2 представляет собой подходящую для сочетания группу, такую как галоген, такой как йод. Более конкретно, на стадии a соединение формулы XXI, где R14 представляет собой подходящую для сочетания группу, такую как галоген, например, бром, реагирует с соединением формулы XX в присутствии подходящего катализатора на основе переходного металла, такого как тетракистрифенилфосфинпалладий (0), и подходящего основания, такого как водный натрия карбонат, с получением соединения формулы IVg, где R11 представляет собой гидроксил. Реакцию традиционно осуществляют в таком растворителе, как толуол. На стадии b соединение формулы IVg, где R11 представляет собой подходящую для сочетания группу, такую как гидроксил или галоген, например, йод, реагирует с соединением формулы IIIa, как описано на схеме А для соединения формулы II, с образованием соединения формулы IIe. На стадии c соединение формулы IIe реагирует с триалкилстаннанильным производным фенила,замещенного фенила, тиофенила, замещенного тиофенила, тиазолила, замещенного тиазолила, фуранила,замещенного фуранила, пиридинила, замещенного пиридинила, оксазолила, замещенного оксазолила,изотиазолила, замещенного изотиазолила, изоксазолила, замещенного изоксазолила, 1,2,4-оксадиазолила,пиримидинила, замещенного пиримидинила или замещенного 1,2,4-оксадиазолила в присутствии подходящего катализатора на основе переходного металла, такого как тетракистрифенилфосфинпалладий (0), с получением соединения формулы IIf, где R2 представляет собой фенил, замещенный фенил, тиофенил,замещенный тиофенил, тиазолил, замещенный тиазолил, фуранил, замещенный фуранил, пиридинил,замещенный пиридинил, оксазолил, замещенный оксазолил, изотиазолил, замещенный изотиазолил, изоксазолил, замещенный изоксазолил, 1,2,4-оксадиазолил, пиримидинил, замещенный пиримидинил или замещенный 1,2,4-оксадиазолил. Реакцию традиционно осуществляют в таком растворителе, как толуол. На схеме реакции Н соединение формулы IVh, где Ar1 представляет собой гетероциклическое кольцо, такое как 1,2,4-оксадиазол-3,5-диил, может быть получено путем конденсации двух гетероциклических предшественников. Более конкретно, на стадии a ангидрид хлоруксусной кислоты формулы XXII реагирует с N-гидроксифенилацетамидом формулы XXIII в условиях удаления воды с получением соединения формулы IVh, где Ar1 представляет собой 1,2,4-оксадиазол-3,5-диил. Реакцию традиционно осуществляют в таком растворителе, как толуол. Соединение IVh затем может подвергаться сочетанию с соединением формулы III, как описано на стадии b схемы А, с получением соединения формулы IIg, гдеAr1 представляет собой гетероциклическое кольцо, такое как 1,2,4-оксадиазол-3,5-диил, и R10 представляет собой галоген, такой как иодид. Соединение формулы IIg, где Ar1 представляет собой гетероциклическое кольцо, такое как 1,2,4-оксадиазол-3,5-диил, и R10 представляет собой иодид, далее может быть превращено в соединение формулы I, где Ar1 представляет собой гетероциклическое кольцо, такое как 1,2,4-оксадиазол-3,5-диил, и Z представляет собой карбоновую кислоту, путем карбонилирования с использованием соответствующего катализатора на основе переходного металла, такого как(CH3CN)2PdCl2, в присутствии монооксида углерода. Подходящим для такого превращения растворителем является вода. Схема реакции Н- 19011867 На схеме реакции I соединение формулы XXVII, где Ar1 представляет собой гетероциклическое кольцо, такое как 1,2,4-оксадиазол-3,5-диил, может быть получено путем конденсации двух гетероциклических предшественников. Более конкретно, карбоновая кислота формулы XXV реагирует с соответствующим образом замещенным N-гидроксиацетамидом формулы XXVI в условиях удаления воды, как показано на стадии a, с получением соединения формулы XXVII, где Ar1 представляет собой 1,2,4 оксадиазол-3,5-диил. Соединение XXVII (R11 = OPg) далее может быть превращено в соединение формулы XXVII, где R11 представляет собой гидроксил, и подвергнуто сочетанию с соединением формулы III,как описано на стадии b схемы А, с получением соединения формулы IIh, где Ar1 представляет собой гетероциклическое кольцо, такое как 1,2,4-оксадиазол-3,5-диил, и R10 представляет собой эфир. Схема реакции I На схеме реакции J, стадия с, энантиомерное соединение формулы XIXb может быть получено разделением рацемического соединения формулы XIX с помощью традиционных методик, в том числе хроматографического разделения с использованием хиральной неподвижной фазы. Альтернативно, на стадии b энантиомерное соединение формулы XIXb может быть получено арилированием энантиоселективного соединения формулы XVIII с использованием соединения формулы XXX. Более конкретно, на стадии a соединение формулы XVII, где Pg представляет собой гидроксильную защитную группу, такую как трет-бутилдиметилсилил, вступает в реакцию в условиях борирования, где условия борирования включают триалкилборат, такой как триизопропилборат, и алкиллитий, такой как н-гексиллитий, с получением тримера бората формулы XXX. Реакцию традиционно осуществляют в подходящем растворителе,таком как толуол. Также в пределах соединения формулы XXX находятся соответствующие димерные и мономерные формы арилбороновой кислоты. На стадии b энантиомерное соединение формулы XIXb получают арилированием альдегида формулы XVIII тримером бората формулы XXX в присутствии хирального катализатора и диалкилцинка. Более конкретно, соединение формулы XXX реагирует с диалкилцинком в течение 12-18 ч в подходящем растворителе, таком как толуол, при температуре от 20 до 80 С. Температура от 40 до 80 С является предпочтительной, тогда как температура 60 С является более предпочтительной. Соединения диалкилцинка, такие как диметилцинк и диизопропилцинк, являются предпочтительными, тогда как диэтилцинк является более предпочтительным. После реакции с диалкилцинком реакционную смесь охлаждают до температуры от 10 до -20 С, причем температура -10 С является предпочтительной, и добавляют хиральный катализатор, предпочтительно в подходящем растворителе, таком как толуол. Предпочтительные хиральные катализаторы включают хиральные аминоспирты,такие как 1-[(R)-[метил[(1R)-1-фенилэтил]амино]-1-нафталенилметил]-2-нафталенол, [(S)-1-нафталенил(1S)-1-фенилэтил]амино]метил]-2-нафталенол и [(S)-[метил[(1S)-1-фенилэтил]амино]фенилметил]-2 нафталенол, тогда как (R)-(-)-2-пиперидин-1,1,2-трифенилэтанол является более предпочтительным. Реакцию проводят в течение 15-90 мин, причем предпочтительной является длительность 30 мин. Добавляют соединение формулы XVIII, где R10 представляет собой циано, и реакцию проводят в течение 2-6 ч,причем предпочтительной является длительность 4 ч. Реакцию гасят и реакционную смесь обрабатывают с помощью стандартных техник экстракции с получением энантиомерного соединения формулы XIXb,где Pg представляет собой защитную группу гидроксила, такую как трет-бутилдиметилсилил, и R10 представляет собой подходящий предшественник группы Z, такой как циано. Соединения по данному изобретению могут вводиться отдельно или в форме фармацевтической композиции, т.е. в комбинации с фармацевтически приемлемыми носителями или эксципиентами, пропорция и природа которых определяются растворимостью и химическими свойствами выбранного соединения, выбранным способом введения и обычной фармацевтической практикой. Соединения по данному изобретению, хотя и являются эффективными сами по себе, могут быть введены в фармацевтическую композицию и могут вводиться в форме их фармацевтически приемлемых солей, с целью обеспечения стабильности, удобства кристаллизации, повышения растворимости и т.п. На практике соединения формулы I обычно вводятся в форме фармацевтических композиций, т.е. в комбинации с фармацевтически приемлемыми носителями или разбавителями, пропорция и природа которых определяются химическими свойствами выбранного соединения, выбранным способом введения и обычной фармацевтической практикой. Таким образом, данное изобретение предлагает фармацевтические композиции, которые содержат соединение формулы I и фармацевтически приемлемый носитель, разбавитель или эксципиент. Соединения формулы I могут вводиться многими способами. Для осуществления лечения пациента,страдающего от описанного выше расстройства, соединение формулы I может вводиться в любой форме или любым способом, который делает соединение в достаточной степени биодоступным, в том числе перорально и парентерально. Например, соединения формулы I могут вводиться орально, в виде ингаляций, подкожно, внутримышечно, внутривенно, трансдермально, интраназально, ректально, в глаза, местно, сублингвально, буккально и т.п. Оральное введение в целом является предпочтительным для лечения неврологических и психиатрических расстройств, описанных в данном описании. Специалист в области приготовления препаративных форм может легко выбрать подходящую форму и способ введения на основе конкретных характеристик выбранного соединения, заболевания или состояния, которое подлежит лечению, стадии расстройства или состояния и других обстоятельств,имеющих отношение к делу (Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co.(1990. Фармацевтические композиции по данному изобретению получают по способам, хорошо известным в фармацевтической области. Носитель или эксципиент могут представлять собой твердый, полутвердый или жидкий материал, который может служить растворителем или средой для активного ингредиента. Подходящие носители или эксципиенты хорошо известны из уровня техники. Фармацевтическая композиция может быть адаптирована для орального, ингаляционного, парентерального или местного применения и может вводиться пациенту в форме таблеток, капсул, аэрозолей, форм для ингаляций, суппозиториев, раствора, суспензий и т.п. Соединения по данному изобретению могут вводиться орально, например, с инертным разбавителем или в виде капсул или в виде прессованных таблеток. Для орального терапевтического применения соединения могут быть введены в препаративные формы вместе с эксципиентами и применяться в форме таблеток, капсул, пилюль, эликсиров, суспензий, сиропов, облаток, жевательной резинки и т.п. Указанные препараты должны содержать по крайней мере 4% соединения по данному изобретению, как активного ингредиента, но его содержание может варьировать в зависимости от конкретной препаративной формы и традиционно может находиться в интервале от 4 до приблизительно 70 мас.%. Количество соединения, присутствующее в композициях, будет таким, чтобы обеспечить подходящую дозу. Специалист в данной области может определить предпочтительные композиции и препараты в соответствии с данным изобретением.- 21011867 Таблетки, пилюли, капсулы и т.п. могут также содержать одно или больше из следующих вспомогательных веществ: связующие агенты, такие как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиенты, такие как крахмал или лактоза, дезинтегранты, такие как альгиновая кислота, примогель, кукурузный крахмал и т.п.; лубриканты, такие как магния стеарат или стеротекс; глиданты, такие как коллоидный кремния диоксид; а также могут быть добавлены подсластители, такие как сахарин или сахароза, или ароматизаторы, такие как мята перечная, метилсалицилат или апельсиновый ароматизатор. Если единичная дозированная форма представляет собой капсулу, она может содержать в дополнение к материалам вышеперечисленных типов жидкий носитель, такой как полиэтиленгликоль или жирное масло. Другие единичные дозированные формы могут содержать различные другие материалы, которые модифицируют физическую форму дозированной единицы, например, такие как покрытие. Таким образом, на таблетки или пилюли может быть нанесено покрытие из сахара, шеллака или других покрывающих веществ. Сироп может содержать, кроме соединений по настоящему изобретению, сахарозу как подсластитель и некоторые консерванты, красители или вещества, придающие цвет,а также ароматизаторы. Материалы, которые используются в приготовлении различных указанных композиций, должны быть чистыми с фармацевтической точки зрения и нетоксичными в используемых количествах. С целью парентерального терапевтического введения соединения по данному изобретению могут быть введены в раствор или суспензию. Указанные препараты типично содержат по крайней мере 0,1% соединения по изобретению, но его количество может варьировать в интервале от 0,1 до приблизительно 90 мас.%. Количество соединения формулы I, присутствующее в таких композициях, будет таким, чтобы обеспечить подходящую дозу. Растворы или суспензии также могут включать одно или больше следующих вспомогательных веществ: стерильные разбавители, такие как вода для инъекций, солевой раствор,нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или натрия бисульфит; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферирующие вещества, такие как ацетаты, цитраты или фосфаты, а также агенты для коррекции осмотичности, такие как глюкоза или натрия хлорид. Парентеральный препарат может быть помещен в ампулы, одноразовые шприцы или многодозовые флаконы, изготовленные из стекла или полимерных материалов. Предпочтительные композиции и препараты могут быть определены специалистом в данной области. Соединения по данному изобретению могут применяться местно, и в таком случае носитель может соответствующим образом включать раствор, основу мази или геля. Основа, например, может включать одно или больше из следующего: вазелин, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, а также эмульгаторы и стабилизаторы. Препаративные формы для местного применения могут содержать концентрацию соединения формулы I или его фармацевтической соли от приблизительно 0,1 до приблизительно 10% мас./об. (масса на единицу объема). Соединения формулы I представляют собой потенциаторы функции метаботропного рецептора глутамата (mGlu), конкретно, они представляют собой потенциаторы рецепторов mGlu2. Таким образом,соединения формулы I усиливают реакцию рецептора mGlu2 на глутамат или агонист глутамата, усиливая функцию рецепторов. Поведение потенциаторов формулы I на рецепторах mGlu2 показано в примере А, который является подходящим для идентификации потенциаторов, пригодных для воплощения данного изобретения. Таким образом, ожидается, что потенциаторы по данному изобретению будут пригодны для лечения различных неврологических и психиатрических расстройств, связанных с дисфункцией глутамата, которые описаны как такие, которые подлежат лечению, а также других, которые могут поддаваться лечению с помощью таких потенциаторов, как будет понятно специалисту в данной области. Пример А. Потенцирование вызванного глутаматом повышения внутриклеточного содержания кальция на линии клеток, экспрессирующих mGlu2. Линии клеток, экспрессирующие рецепторы mGlu2, получали, как было описано раньше (Desai,Burnett, Mayne, Schoepp, Mol. Pharmacol. 48, 648-657, 1995) и культивировали в модифицированной по способу Дульбекко среде Игла (DMEM) с 5%диализной фетальной сыворотки теленка, 1 мМ глутамина,1 мМ натрия пирувата, 50 мкл/мл генетицина G418 и 0,2 мг/мл гигромицина В. Конфлюентные культуры пересевали еженедельно. Полученные клетки называли клетками RGT (переносчик глутамата крыс) и сотрансфицировали переносчиком глутамата/аспартата GLAST. Клеточную линию RGT, экспрессирующую рецепторы mGlu2, стабильно трансфицировали разнородным G-белком, Gальфа 15, для изменения сигнального пути к рецептору mGlu2 на такой, который может быть легко измерен по высвобождению внутриклеточного кальция. Таким образом, внутриклеточные уровни кальция контролировали перед добавлением лекарств и после него с помощью флуорометрического устройства для считывания планшет(Fluorometric Imaging Plate Reader, FLIPR, Molecular Devices). Следующие буферы использовали в качестве аналитического буфера: 10 мМ KCl, 138 мМ NaCl, 5 мМ CaCl2, 1 мМ MgCl2, 4 мМ NaH2PO4, 10 мМ глюкозы, 10 мМ HEPES, pH 7,4. Клетки, которые были помещены на планшет на 48 ч раньше с плотностью 30-40000 клеток на ячейку в 96-ячейковом планшете, нагружали чувствительным к кальцию красителем в течение 90 мин при 25 С. Fluo-3 (2 мМ в ДМСО, Molecular Probes) смешивали с равным объемом- 22011867 10% плуроновой кислоты в ДМСО и разбавляли до концентрации 8 мкМ в описанном выше буфере, содержащем 10% фетальной сыворотки теленка, для получения буфера нагрузки. После нагружения клеток буфер удаляли и заменяли буфером для анализа для добавления лекарственного средства и контроля на FLIPR. Сигнал, полученный в результате добавления соединений формулы (I), и субмаксимальные концентрации агониста рецепторов глутамата (например, 1 мкМ глутамата) определяли для каждой ячейки по разнице максимальная высота пика флуоресценции минус базовая флуоресценция и результаты выражали как процент от сигнала, зарегистрированного для максимальной реакции на глутамат (30 мкМ глутамат, обычно приблизительно 30-50000 относительных единиц флуоресценции). Далее к полученной кривой доза-% реакции применяли апроксимацию кривой методом наименьших квадратов с четырех параметрическим уравнением для определения итоговых значений ЕС 50. Иллюстративные соединения формулы I типично осуществляют потенцирование рецепторов mGlu2 со значениями ЕС 50 меньше 12,5 мкМ. Более конкретно, соединения из примеров 47, 65, 81, 82, 83 и 84 осуществляют потенцирование рецепторов mGlu2 со значениями ЕС 50 меньше чем 100 нМ. Соединения формулы I представляют собой модуляторы функции рецепторов лейкотриена, конкретно, они являются антагонистами рецепторов лейкотриена. Таким образом, соединения формулы I демонстрируют антагонизм по отношению к рецептору цистеинил-лейкотриена D4 (LTD4). Антагонизм по отношению к рецептору цистеинил-лейкотриена D4 (LTD4) соединений формулы I показан в примере В, который является подходящим для идентификации антагонистов, пригодных для осуществления данного изобретения. Таким образом, антагонисты лейкотриена по данному изобретению пригодны для лечения различных воспалительных и аллергических расстройств, опосредованных лейкотриенами и описанных как такие, которые поддаются лечению в соответствии с данным изобретением, а также других расстройств, которые могут поддаваться лечению такими антагонистами, что будет понятно специалисту в данной области. Пример В. Антагонизм по отношению к вызванному цистеинил-лейкотриеном D4 (LTD4) повышению внутриклеточного содержания кальция в линии клеток, экспрессирующих рецептор цистеиниллейкотриена 1 (CysLT1). Линии клеток, экспрессирующие рецептор CysLT1 человека [AV12-664 (АТСС-9595)], получали и культивировали в среде для культивирования: DMEM с 5% диализной фетальной сыворотки теленка,1 мМ глутамина и 1 мМ натрия пирувата. Конфлюэнтные культуры пересевали еженедельно. Внутриклеточные уровни кальция в клетках, экспрессирующих CysLT1, контролировали при добавлении LTD4 с предварительным контактом с соединениями, которые подлежали тестированию в качестве антагонистов, или без такого контакта, с помощью флуорометрического устройства для считывания планшет(Fluorometric Imaging Plate Reader, FLIPR, Molecular Devices). Следующие буферы использовали в качестве аналитического буфера: буферный солевой раствор Хенкса без фенолового красного (GIBCO) с 10 мМ HEPES, pH 7,4. Клетки, которые были помещены на планшет на 48 ч раньше с плотностью 2025000 клеток на ячейку в 96-ячейковом планшете, нагружали чувствительным к кальцию красителем в течение 90 мин при 25 С. Fluo-3 (2 мМ в ДМСО, Molecular Probes) смешивали с равным объемом 10% плуроновой кислоты в ДМСО и разбавляли до концентрации 8 мкМ в описанном выше буфере, содержащем 10% фетальной сыворотки теленка, для получения буфера нагрузки. После нагружения клеток буфер удаляли и заменяли буфером анализа для добавления лекарственного средства и контроля наFLIPR в течение нескольких мин. Сигнал, полученный в результате добавления 6 нМ LTD4 (дает приблизительно 90% от максимального сигнала при концентрации 25 нМ LTD4), определяли для каждой ячейки по разнице максимальная высота пика флуоресценции минус базовая флуоресценция и результаты выражали как процент от сигнала, зарегистрированного в отсутствие предварительной обработки исследуемым соединением(ями). Далее к полученной кривой доза-% реакции применяли апроксимацию кривой методом наименьших квадратов с четырехпараметрическим уравнением для определения итоговых значений IC50. Иллюстративные соединения формулы I типично осуществляют антагонизм по отношению к рецепторам CysLT1 со значениями IC50 меньше чем 12,5 мкМ. Более конкретно, соединения из примеров 47, 60, 65, 81, 82, 83 и 84 осуществляют антагонизм по отношению к рецепторам CysLT1 со значениямиIC50 меньше чем 750 нМ. В одном варианте данное изобретение предлагает способы лечения неврологических и психиатрических расстройств, связанных с дисфункцией глутамата, которые включают введение пациенту, нуждающемуся в таком лечении, эффективного количества потенциатора 2 метаботропных рецепторов глутамата. Конкретно, данное изобретение предлагает способ лечения неврологических и психиатрических расстройств, связанных с дисфункцией глутамата, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества потенциатора рецептора mGlu2 и/или антагониста рецептораCysLT1, т.е. данное изобретение предлагает способы с использованием эффективного количества потенциатора рецепторов mGlu2 и/или антагониста рецептора CysLT1. В другом предпочтительном варианте данное изобретение предлагает способ лечения мигрени, ко- 23011867 торый включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I. В другом предпочтительном варианте данное изобретение предлагает способ лечения тревожности,который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I. Особенно предпочтительные тревожные расстройства представляют собой генерализованное тревожное расстройство, паническое расстройство и обсессивно-компульсивное расстройство. В другом предпочтительном варианте данное изобретение предлагает способ лечения шизофрении,который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I. Еще в одном предпочтительном варианте данное изобретение предлагает способ лечения эпилепсии, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I. Поскольку соединения формулы I усиливают нормальную физиологическую функцию рецепторовmGlu, соединения формулы I пригодны для лечения различных неврологических и психиатрических расстройств, связанных с дисфункцией глутамата, в том числе острых неврологических и психиатрических расстройств, таких как церебральные дефициты после хирургического вмешательства для шунтирования коронарной артерии и трансплантации, удар, ишемия мозга, травма спинного мозга, травма головы, перинатальная гипоксия, остановка сердца, повреждение нейронов вследствие гипогликемии, деменция (в том числе деменция, вызванная СПИДом), болезнь Альцгеймера, хорея Хантингтона, амиотрофный латеральный склероз, рассеянный склероз, повреждение глаз, ретинопатия, когнитивные расстройства, болезнь Паркинсона идиопатического и медикаментозного генеза, мышечные спазмы и расстройства, связанные со спастичностью мышц, (в том числе различные виды тремора), припадки, эпилепсия, судороги,мигрень (в том числе мигренозная головная боль), недержание мочи, привыкание к психотропным и наркотическим веществам, абстинентный синдром (в том числе, связанный с отменой таких веществ, как опиаты, никотин, табачные продукты, спирт, бензодиазепины, кокаин, седативные, снотворные средства и т.д.), психоз, шизофрения, тревожность (в том числе генерализованное тревожное расстройство, паническое расстройство и обсессивно-компульсивное расстройство), расстройства настроения (в том числе депрессия, мания, биполярные расстройства), невралгия тройничного нерва, ухудшение слуха, звон в ушах, дегенерация желтого пятна, рвота, отек мозга, боль (в том числе состояния острой и хронической боли, тяжелая боль, устойчивая боль, боль невропатического генеза и боль после травм), поздняя дискинезия, расстройства сна (в том числе нарколепсия), расстройство дефицита внимания/гиперактивности и расстройство поведения. В настоящее время четвертое издание Diagnostic and Statistical Manual of Mental Disorders (DSMIV) (1994, American Psychiatric Association, Washington, D.C.) предоставляет диагностический инструмент для идентификации многих расстройств, описанных в данном описании. Специалист в данной области будет понимать, что существуют альтернативные номенклатуры, нозологии и системы классификации неврологических и психиатрических расстройств, описанных в данном изобретении, и что такие системы учитывают прогресс медицинской науки. Соединения формулы I потенцируют реакцию рецептора mGlu, конкретно, реакцию рецептораmGlu2, на глутамат и агонисты глутамата. Такие агонисты легко можно распознать, и некоторые из них описаны в уровне техники. Schoepp, D.D., Jane, D.E., Monn, J.A., Neuropharmacology 38: 1431-1476,(1999). Таким образом, в более конкретном варианте следует понимать, что данное изобретение охватывает способ потенцирования воздействия агониста рецептора глутамата на рецепторы mGlu группы II, который включает введение пациенту, нуждающемуся в такой потенциации, эффективного количества потенциатора mGlu2, конкретно, соединения формулы I, в комбинации с потенцирующим количеством агониста рецептора mGlu. Такая комбинация может быть предпочтительной с той точки зрения, что она может повышать активность и селективность агониста mGlu. В данном описании термин "пациент" обозначает теплокровное животное, такое как млекопитающее, которое страдает одним или больше неврологических и психиатрических расстройств, связанных с дисфункцией глутамата. Следует понимать, что морские свинки, собаки, коты, крысы, мыши, лошади,крупный рогатый скот, овцы и люди, особенно люди, представляют собой примеры животных в пределах значения данного термина. Также следует понимать, что данное изобретение конкретно связано с потенцированием метаботропных рецепторов глутамата млекопитающих. Также понятно, что специалист в данной области может воздействовать на неврологические и психиатрические расстройства путем лечения пациента, который на данный момент страдает расстройствами, или путем профилактического лечения пациента, который страдает расстройствами, эффективным количеством соединения формулы I. Таким образом, термин лечение предназначен для обозначения всех процессов, где может наблюдаться замедление, прерывание, остановка или контроль прогресса описанных здесь неврологических и психиатрических расстройств, но не обязательно указывает на полное устранение всех симптомов расстройства, а также подразумевает включение профилактического лечения- 24011867 таких неврологических и психиатрических расстройств. В данном описании термин "эффективное количество" соединения формулы I означает количество,т.е. дозу, которая является эффективной при лечении описанных здесь неврологических и психиатрических расстройств. Медицинский работник, который осуществляет диагностику, как специалист в данной области, может легко определить эффективное количество путем применения традиционных техник, а также путем наблюдения за результатами, полученными при аналогичных обстоятельствах. В ходе определения эффективного количества, т.е. дозы соединения формулы I, медицинский работник, который осуществляет диагностику, рассматривает множество факторов, в том числе, не ограничиваясь ими, соединение формулы I, которое будет вводиться; сопутствующее введение агониста mGlu, если он применяется; вид млекопитающего; его размеры, возраст и общее состояние здоровья; конкретное расстройство, которое имеет место; степень распространенности или тяжести расстройства; индивидуальная реакция пациента; способ введения; показатели биодоступности вводимого препарата; выбранную схему введения; сопутствующее использование других медикаментов; а также другие обстоятельства, имеющие отношение к делу. Ожидается, что эффективное количество соединения формулы I будет варьировать в интервале от приблизительно 0,01 до приблизительно 100 миллиграмм на килограмм массы тела в день (мг/кг/день). Предпочтительные количества могут быть определены специалистом в данной области. В данном описании термин потенцирующее количество обозначает количество агониста mGlu,т.е. дозу агониста, эффективную в лечении неврологических и психиатрических расстройств, описанных в данном изобретении, при введении в комбинации с эффективным количеством соединения формулы I. Ожидается, что потенцирующее количество будет меньше, чем количество, необходимое для получения такого же эффекта при введении агониста mGlu без эффективного количества соединения формулы I. Медицинский работник, который осуществляет диагностику, как специалист в данной области, может легко определить эффективное количество путем применения традиционных техник, а также путем наблюдения за результатами, полученными при аналогичных обстоятельствах. В ходе определения эффективного количества, т.е. дозы агониста mGlu для введения в комбинации с соединением формулы I,медицинский работник, который осуществляет диагностику, рассматривает множество факторов, в том числе, не ограничиваясь ими, агонист mGlu, который будет вводиться, включая его мощность и селективность; соединение формулы I, которое будет одновременно вводиться; вид млекопитающего; его размеры, возраст и общее состояние здоровья; конкретное расстройство, которое имеет место; степень распространения или тяжести расстройства; индивидуальная реакция пациента; способы введения; показатели биодоступности вводимого препарата; выбранную схему введения; сопутствующее использование других медикаментов; а также другие обстоятельства, имеющие отношение к делу. Ожидается, что потенцирующее количество агониста mGlu для введения в комбинации с эффективным количеством соединения формулы I будет варьировать от приблизительно 0,1 до приблизительно 100 мг/кг/день и ожидается, что оно будет меньше, чем количество, необходимое для получения такого же эффекта при введении без эффективного количества соединения формулы I. Предпочтительные количества агониста mGlu для сопутствующего введения способен определить специалист в данной области. Из неврологических и психиатрических расстройств, связанных с дисфункцией глутамата, которые подлежат лечению в соответствии с данным изобретением, особенно предпочтительным является лечение мигрени, тревожности, шизофрении и эпилепсии. Особенно предпочтительные тревожные расстройства представляют собой генерализованное тревожное расстройство, паническое расстройство и обсессивно-компульсивное расстройство. Таким образом, в предпочтительном варианте данное изобретение предлагает способ лечения мигрени, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I или фармацевтической композиции на его основе. В одном из доступных источников диагностических инструментов, Dorland's Medical Dictionary(23rd Ed., 1982, W.B. Saunders Company, Philidelphia, PA), мигрень определяется как симптомокомплекс периодических головных болей, обычно в височной области и односторонние, часто сопровождающихся раздражительностью, тошнотой, рвотой, запором или диареей и фотофобией. В данном описании термин"мигрень" включает такие периодические головные боли, в височной области и односторонние, сопровождающиеся раздражительностью, тошнотой, рвотой, запором или диареей, фотофобией и другими сопутствующими симптомами. Специалист в данной области будет понимать, что существуют альтернативные номенклатуры, нозологии и системы классификации неврологических и психиатрических расстройств, в том числе мигрени и, что такие системы развиваются с учетом прогресса медицинской науки. В другом предпочтительном варианте данное изобретение предлагает способ лечения тревожности,который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I или фармацевтической композиции на его основе. В настоящее время четвертое издание Diagnostic and Statistical Manual of Mental Disorders (DSMIV) (1994, Американская Психиатрическая Ассоциация, Вашингтон, округ Колумбия) предоставляет диагностический инструмент, в том числе для тревожных и родственных расстройств. Такие расстрой- 25011867 ства включают следующее: паническое расстройство с агорафобией или без нее, агорафобия без панического расстройства в анамнезе, специфическая фобия, социальная фобия, обсессивно-компульсивное расстройство, расстройство, вызванное посттравматическим стрессом, острое стрессовое расстройство,генерализованное тревожное расстройство, тревожное расстройство в результате общего медицинского состояния, вызванное специфическими веществами тревожное расстройство, а также тревожное расстройство, не отнесенное к вышеперечисленным категориям. В данном описании термин "тревожность" включает лечение таких тревожных расстройств и родственного расстройства, как описано в DSM-IV. Специалист в данной области будет понимать, что существуют альтернативные номенклатуры, нозологии и системы классификации неврологических и психиатрических расстройств, в том числе тревожности и, что такие системы развиваются с учетом прогресса медицинской науки. Таким образом, термин"тревожность" предназначен для включения подобных расстройств, которые описаны в других диагностических источниках. Описан целый ряд доклинических лабораторных моделей мигрени и тревожности на животных. Одна из широко используемых моделей мигрени представляет собой модель дуральной экстравазации,которая была описана Phebus et al., Life Sci., 61(21), 2117-2126 (1997) и может использоваться для оценки соединений по настоящему изобретению. Пример С. Модель дуральной экстравазации белков плазмы (РРЕ) на животных. Осуществляли анестезию самцов крыс Harlan Sprague-Dawley (250-350 г) с помощью натрия пентобарбитала (65 мг/кг, внутрибрюшинно) и помещали животных в стереотаксический каркас (David KopfInstruments) с набором резцов 2,5 мм. После сагиттального рассечения скальпа по средней линии две пары двусторонних отверстий были просверлены в черепе (3,2 мм назад, 1,8 и 3,8 мм вбок, все координаты по отношению к брегме). Пары стимулирующих электродов из нержавеющей стали, изолированные за исключением концов (Rhodes Medical Systems, Inc.), вводили через отверстия в черепе в оба полушария на глубину 9,2 мм. В бедренную вену вводили дозу исследуемого соединения (в/в) в дозируемом объеме 1 мл/кг. Приблизительно через 8 мин после в/в инъекции также внутривенно вводили дозу 20 мг/кг флуоресцеина изотиоцианата-альбумина бычьей сыворотки (FITC-BSA). FITC-BSA действует как маркер экстравазации белка. Точно через 10 мин после инъекции исследуемого соединения, левый тригеминальный ганглий стимулировали в течение 5 мин при интенсивности тока 1,0 мА (5 Гц, длительность 5 мс) с помощью модели стимулятора S48 Grass Instrument Stimulator с модулем фотоэлектрической изоляции PSIU6(Grass-Telefactor). Альтернативно, крысам, которые голодали в течение ночи, перорально вводили через зонд исследуемое соединение в объеме 2 мл/кг. Приблизительно через 50 мин осуществляли анестезию животных и помещали их в стереотаксические каркасы, как описано выше. Точно через 58 мин после перорального введения дозы животным вводили дозу FITC-BSA (20 мг/кг, в/в). Точно через час после введения пероральной дозы животных стимулировали, как описано выше. Через 5 мин после стимуляции животных умерщвляли обезглавливанием с использованием 40 мл солевого раствора. Верхнюю часть черепа удаляли для упрощения извлечения мозговых оболочек. Образцы оболочек извлекали из обоих полушарий, промывали водой, и равномерно распределяли по предметным стеклам. Сразу после высыхания ткани погружали в раствор 70% глицерин/вода. Для определения количества FITC-BSA в каждом образце использовали флуоресцентный микроскоп (Zeiss), оборудованный решетчатым монохроматором и спектрофотометром. Использовали возбуждающее излучение с длиной волны приблизительно 490 нм и определяли интенсивность излучения на длине волны 535 нм. Микроскоп оборудован движущимся столиком и соединен с персональным компьютером. Это облегчает контроль компьютером движения столика, где измеряется флуоресценция на 25 точках (шаги по 500 мм) каждого образца мозговых оболочек. С помощью компьютера определяли среднее значение и стандартное отклонение для измеряемых значений. Экстравазация, вызванная электрической стимуляцией тригеминального ганглия, представляет собой ипсилатеральный эффект (т.е. возникает только на той стороне твердой мозговой оболочки, где производилась стимуляция тригеминального ганглия). Это позволяет использование другой (не стимулированной) половины твердой мозговой оболочки в качестве контроля. Рассчитано соотношение объема дуральной экстравазации со стороны стимуляции и объема экстравазации на стороне, где не производилась стимуляция. Контрольным животным вводили только солевой раствор, с получением соотношения приблизительно 2,0. В противоположность этому соединение, которое эффективно предупреждает дуральную экстравазацию со стороны, где производилась стимуляция, будет давать соотношение приблизительно 1,0. Соединения из примеров 60, 65, 83 и 84 воздействуют на дуральную экстравазацию со значениямиID100 0,1 мг/кг перорально. Модель потенцированной страхом реакции вздрагивания широко используется как модель тревожности и может использоваться для оценки соединений по настоящему изобретению. Davis, Psychopharmacol., 62, 1 (1979); Davis, Behav. Neurosci., 100, 814 (1986); Davis, Tr. Pharmacol. Sci., 13, 35 (1992).- 26011867 Пример D. Модель потенцированной страхом реакции вздрагивания. Самцов крыс Sprague-Dawley массой 325-400 г покупали у Harlan Sprague-Dawley, Inc. (Cumberland,IN) и давали животным возможность акклиматизироваться в течение недели перед проведением исследования. Крыс содержали по отдельности со свободным доступом к пище и воде в комнате для животных с 12-часовым циклом света/темноты со светлым периодом от 6:00 утра до 6:00 вечера. Готовили суспензию исследуемого соединения формулы I в смеси 5% этанола, 0,5% CMC, 0,5% Твина 80 и 99% воды. 2S-2-Амино-2-(1S,2S-2-карбоксициклопропан-1-ил)-3-(ксант-9-ил)пропионовую кислоту разводили в стерильной воде. Контрольные крысы получали соответствующий растворитель. Модель потенцированного страхом вздрагивания проводили в течение 3 дней подряд. Все 3 дня начинались с периода адаптации длительностью 5 мин, после которого начинали исследование. В 1-й день(начальное вздрагивание) после периода адаптации животные получали 30 сеансов звукового шума интенсивностью 120 децибел. Среднюю амплитуду вздрагивания (Vmax) использовали для распределения животных на группы со сходными средними значениями перед началом выработки условного рефлекса. Второй день состоял из выработки у животных условного рефлекса. Каждое животное получало шок 0,5 мА в течение 500 мс, которому предшествовал показ света длительностью 5 с, который оставался включенным на время шока. Проводили 10 сеансов показа света и шока. На 3-й день проводили исследование, в ходе которого до испытания вводили лекарственное средство. Через 24 ч после выработки условного рефлекса проводили серии исследований вздрагивания. 10 сеансов акустического вздрагивания(120 децибел), не связанных со светом, проводили в начале серии испытания. Далее следовали 20 случайных сеансов только шума и 20 случайных эпизодов шума с предварительным показом света. За исключением первых 10 сеансов, получали среднее значение амплитуды вздрагивания для каждого животного. Данные представляли как разницу между светом+шумом и только шумом. Разницу в амплитуде реакции вздрагивания анализировали с помощью программного обеспечения для статистической обработки JMP с использованием одностороннего анализа Anova (дисперсионный анализ, t-тест). Различия между группами считали значимыми при р 0,05. В другом предпочтительном варианте данное изобретение предлагает способ лечения эпилепсии,который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I или фармацевтической композиции на его основе. В настоящее время описаны несколько видов и подвидов припадков, связанных с эпилепсией, в том числе идиопатические, симптоматические и криптогенные. Такие эпилептические припадки могут быть очаговыми (частичными) или генерализованными. Они также могут быть простыми или комплексными. Эпилепсия описана в уровне техники, например, Epilepsy: A comprehensive textbook. Ed. by Jerome Engel,Jr. and Timothy A. Pedley. (Lippincott-Raven, Philadelphia, 1997). В настоящее время Международная классификация заболеваний, девятая редакция (ICD-9) предлагает диагностический инструмент, в том числе для эпилепсии и родственных расстройств. Такие расстройства включают генерализованную не судорожную эпилепсию, генерализованную судорожную эпилепсию, малый эпилептический припадок, развернутый эпилептический припадок, частичную эпилепсию с нарушением сознания, частичную эпилепсию без нарушения сознания, спазмы новорожденных, эпилепсию парциальную непрерывную, другие формы эпилепсии, неклассифицированную эпилепсию, без дополнительного уточнения. В данном описании термин "эпилепсия" включает все эти виды и подвиды. Специалист в данной области будет понимать, что существуют альтернативные номенклатуры, нозологии и системы классификации неврологических и психиатрических расстройств, в том числе эпилепсии и, что такие системы развиваются с учетом прогресса медицинской науки. Различные модели индуцированного электрошока широко применяются как модель припадочных расстройств. Пример Е. Вызванные электрошоком припадки. Электрическая стимуляция электродами на роговицах мыши может вызывать тонические судороги разгибателя задних конечностей. Блокада тонических судорог разгибателя, вызванных электрошоком,считается показательной для лекарственных средств, которые блокируют распространение припадка и могут эффективно предупреждать различные виды припадков у людей, включая эпилептические припадки. Носитель или дозу исследуемого препарата вводили группам, состоящим из 5-10 мышей. Через 30 мин вызывали электрошок (10 мА, длительность 0,2 с) с помощью трансроговичных электродов. Регистрировали количество мышей в каждой группе, у которых возникали тонические судороги разгибателя. Данные регистрировали как процент мышей, защищенных от судорог. Данное изобретение дополнительно проиллюстрировано следующими примерами и подготовительными примерами (получениями). Указанные примеры и подготовительные примеры приведены исключительно с иллюстративной целью и не предназначены для ограничения изобретения каким-либо способом. Химическая номенклатура, используемая в примерах и подготовительных примерах, происходит из одной или больше стандартных конвенций. Специалисту в данной области будут понятны значения химических названий, произведенных с использованием двух или больше конвенций.- 27011867 Термины, используемые в примерах и подготовительных примерах, имеют обычные значения, если не указано другое. Например, "C" обозначает градусы Цельсия; "N" ("н") обозначает нормальный или нормальность; "М" обозначает молярный или молярность; "моль" обозначает моль или моли; "ммоль" обозначает миллимоль или миллимоли; "мкмоль" обозначает микромоль или микромоли; "кг" обозначает килограмм или килограммы; "г" обозначает грамм или граммы; "мкг" обозначает микрограмм или микрограммы; "мг" обозначает миллиграмм или миллиграммы; "мкл" обозначает микролитр или микролитры; "мл" обозначает миллилитр или миллилитры; "л" обозначает литр или литры; "Ткип" обозначает температуру кипения; "Тпл" обозначает температуру плавления; "солевой раствор" обозначает насыщенный водный раствор натрия хлорида; "ч" обозначает ч или часы; "мин" обозначает минуту или минуты;"МС" обозначает масс-спектрометрию; "ЯМР" обозначает спектроскопию ядерного магнитного резонанса; "ТФУ" обозначает трифторуксусную кислоту; "CH2Cl2" или "ДХМ" обозначает дихлорметан; "ДХЭ" обозначает дихлорэтан; "MeOH" обозначает метанол; "NH4OH" обозначает концентрированный водный раствор аммиака; "HCl" обозначает хлористый водород; "MTBE" обозначает трет-бутилметиловый эфир;"DSC" обозначает дифференциальную сканирующую калориметрию; "DMEM" обозначает модифицированную по способу Дульбекко среду Игла. Химические сдвиги приведены ви спектры ЯМР получают вCDCl3, если не указано иное. Получение 1. Синтез 2-фтор-3-метоксифенола. Смесь 2-фторанизола (1,8 л, 15,85 моль), пентаметилдиэтилентриамина (3,6 мл, 17,45 ммоль) и тетрагидрофурана (10 мл) перемешивают при -78 С. По каплям добавляют 2,5 М раствор н-бутиллития в гексане (7 мл, 17,45 ммоль) и полученный раствор перемешивают при -78 С в течение 2 ч. Добавляют триметилборат (2 мл, 17,45 ммоль) и реакционную смесь нагревают до комнатной температуры и перемешивают в течение 1 ч. Добавляют уксусную кислоту (1,4 мл, 23,8 ммоль) с последующим добавлением 30% водного раствора пероксида водорода (1,8 мл, 17,45 ммоль) и полученную смесь быстро перемешивают в течение 18 ч при комнатной температуре. Реакционную смесь разбавляют водой и экстрагируют этилацетатом (350 мл). Объединенные экстракты сушат над сульфатом магния, фильтруют и упаривают приблизительно до 10 мл объема. Полученную смесь очищают хроматографией на диоксиде кремния,элюируя с градиентом от гексана до смеси гексан/этилацетат (8:1) с получением названного в заголовке соединения (1,65 г, 73%) в виде бесцветного масла. МС ES 141 М-1. Получение 2. Синтез 1-(3-фтор-2,4-дигидроксифенил)этанона. Раствор 2-фтор-3-метоксифенола (0,5 г, 3,53 ммоль) и дихлорметана перемешивают при -78 С. Медленно добавляют 1 М раствор бора трибромида в дихлорметане (3,9 мл, 3,9 ммоль) и смесь перемешивают в течение 10 мин в холодном состоянии, затем нагревают до 0 С и перемешивают в течение 1 ч. Реакцию гасят с помощью льда и перемешивают при комнатной температуре в течение ночи. Продукт экстрагируют этилацетатом (250 мл), сушат над сульфатом магния, фильтруют и упаривают. Полученный остаток объединяют с бора трифторида диэтилэфиратом (1,3 мл, 10,3 ммоль) и уксусной кислотой(0,2 мл, 3,28 ммоль), после чего нагревают до кипения с обратным холодильником в течение 8 ч. Смесь охлаждают до комнатной температуры, разбавляют водой (50 мл) и экстрагируют этилацетатом(350 мл). Объединенные экстракты сушат над сульфатом магния, фильтруют и упаривают до объема приблизительно 10 мл. Полученную смесь разбавляют гексаном (50 мл), охлаждают до 0 С и фильтруют с получением названного в заголовке соединения (310 мг, 58%) в виде рыжеватого твердого вещества. МС ES 171 М+1. Получение 3. Синтез 1-(3-хлор-2,4-дигидроксифенил)этанона. Раствор 2,4-дигидроксиацетофенона (6 г, 39,4 ммоль), водный 1 М раствор натрия гидроксида(41,4 мл, 41,4 ммоль) и воду (200 мл) перемешивают при комнатной температуре. Добавляют водный 1,6 М раствор натрия гипохлорита (32 мл) на протяжении периода 1 ч. Полученный раствор темнокоричневого цвета перемешивают в течение 18 ч при комнатной температуре. pH реакционной смеси доводят до 2-3 с помощью концентрированной водной хлористо-водородной кислоты. Полученную суспензию фильтруют и промывают водой (4100 мл). Отфильтрованное твердое вещество сушат под вакуумом при температуре 45 С в течение 2,5 дней с получением названного в заголовке соединения (4,8 г,65%) в виде коричневого твердого вещества. ЖХМС 1 187 М+. Получение 4. Синтез 1-(3-хлор-2,4-дигидроксифенил)пропан-1-она. Названное в заголовке соединение получают по способу, сходному со способом получения 1-(3 хлор-2,4-дигидроксифенил)этанона (получение 3) с использованием 2,4-дигидроксипропиофенона с получением 4,5 г, 37% практически белого твердого вещества. ЖХМС 1 201 М+. Получение 5. Синтез (4-бромбензилокси)триизопропилсилана. Перемешивают раствор 4-бромбензилового спирта (50 г, 267,3 ммоль), 1,8-диазабицикло[5.4.0]ундек-7-ен (DBU, 48 мл, 320,8 ммоль) и дихлорметана (600 мл) на бане, содержащей воду со льдом. Добавляют триизопропилсилилхлорид (63 мл, 294 ммоль) на протяжении 10 мин через воронку для добавления и перемешивают реакционную смесь на протяжении 20 ч при комнатной температуре. Смесь промывают водой (2600 мл), сушат над безводным сульфатом магния, фильтруют и упаривают.- 28011867 Остаточный продукт очищают хроматографией на диоксиде кремния, элюируя смесью гексан/этилацетатH ЯМР (300 МГц, CDCl3)7,47-7,50 (м, 2 Н), 7,28-7,30 (м, 2 Н), 4,81 (с), 1,11-1,24 (м, 21 Н). Получение 6. Синтез (3-бромбензилокси)триизопропилсилана. Названное в заголовке соединение получают по способу, по существу сходному со способом, описанным в получении 5, с использованием 3-бромбензилового спирта с получением бесцветного масла,100%. 1H ЯМР (CDCl3)7,54 (с, 1 Н), 7,20-7,42 (м, 3H), 4,84 (с, 2 Н), 0,99-1,27 (м, 21 Н). Получение 7. Синтез 3-[гидрокси-(4-триизопропилсиланилоксиметилфенил)метил]бензонитрила. Перемешивают раствор (4-бромбензилокси)триизопропилсилана (72 г, 209,7 ммоль) и тетрагидрофурана (500 мл) при -78 С. Добавляют 1,6 М раствор н-бутиллития в гексане (143 мл) на протяжении 10 мин. После добавления дают реакционной смеси нагреться до -20 С и перемешивают в течение 5 мин. Реакционную смесь снова охлаждают до -78 С. В другой колбе раствор 3-цианобензальдегида (25 г,190,6 ммоль) и тетрагидрофурана (250 мл) перемешивают при -78 С. Добавляют раствор аниона лития к раствору альдегида через канюлю большого диаметра с такой скоростью, чтобы внутренняя температура альдегида не повышалась выше -50 С. По окончании добавления реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Реакционную смесь разбавляют насыщенным водным раствором аммония хлорида (500 мл) и этилацетата (200 мл). Фракции разделяют и водную фракцию экстрагируют этилацетатом (3100 мл). Органические фракции объединяют, сушат над безводным сульфатом магния, фильтруют и упаривают. Остаток очищают с помощью хроматографии на силикагеле, элюируя с градиентом от гексана до смеси гексан/этилацетат (9:1) с получением названного в заголовке соединения(12 г, 30,3 ммоль), 3,4-дигидро-2 Н-пирана (3,6 мл, 39,4 ммоль) и дихлорметана (250 мл) при комнатной температуре. Добавляют пиридиния п-толуолсульфонат (0,8 г, 3,03 ммоль) и перемешивают полученную смесь 18 ч при комнатной температуре. Реакционную смесь разбавляют водным насыщенным раствором натрия гидрокарбоната (100 мл) и фракции разделяют. Водную фракцию промывают дихлорметаном(250 мл), органические фракции объединяют, сушат с помощью магния сульфата, фильтруют и упаривают. Остаток очищают хроматографией на диоксиде кремния, элюируя с градиентом от гексана до смеси гексан/этилацетат (8:2) с получением названного в заголовке соединения (14,6 г, 100%) в виде бесцветного масла. ЖХМС (m/z) 478 М-1. Следующие соединения получают по способу, по существу сходному со способом, описанным в получении 8. Получение 11. Синтез 3-[(4-гидроксиметилфенил)-(тетрагидропиран-2-илокси)метил]бензонитрила. Добавляют 1 М раствор тетрабутиламмония фторида в тетрагидрофуране (37 мл, 37 ммоль) к раствору 3-[(тетрагидропиран-2-илокси)-(4-триизопропилсиланилоксиметилфенил)метил]бензонитрила(14,6 г, 30,4 ммоль) в тетрагидрофуране (50 мл), перемешивают при комнатной температуре, одновременно добавляя 1 М раствор тетрабутиламмония фторида в тетрагидрофуране (37 мл, 37 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь упаривают,разбавляют водой (200 мл) и экстрагируют этилацетатом (2100 мл). Экстракты объединяют, сушат над сульфатом магния, фильтруют и упаривают. Остаток очищают хроматографией на диоксиде кремния,элюируя с градиентом от смеси гексан/этилацетат (9:1) до смеси гексан/этилацетат (1:1) с получением названного в заголовке соединения (8,0 г, 82%) в виде бесцветного густого масла. ЖХМС (m/z) 323 М+1. Следующие соединения получают по способу, по существу сходному со способом, описанным в получении 11. Получение 14. Синтез 3-4-(4-ацетил-3-гидрокси-2-пропилфеноксиметил)фенил]-(тетрагидропиран-2-илокси)метил]бензонитрила. Раствор 1-(2,4-дигидрокси-3-пропилфенил)этанона (1,75 г, 9 ммоль), 3-[(4-гидроксиметилфенил)(тетрагидропиран-2-илокси)метил]бензонитрила (2,9 г, 9 ммоль), толуола (10 мл) и дихлорметана (10 мл) перемешивают при -20 С. Добавляют 1,1'-(азодикарбонил)дипиперидин (4,5 г, 18 ммоль) с последующим добавлением трибутилфосфина (4,5 мл, 18 ммоль) и полученный раствор желтого цвета перемешивают при комнатной температуре в течение ночи. Полученную густую реакционную смесь упаривают и разбавляют эфиром (50 мл). Суспензию охлаждают до 0 С при перемешивании в течение 30 мин. Реакционную смесь фильтруют, упаривают и очищают хроматографией на диоксиде кремния, элюируя смесью гексан/(гексан/дихлорметан/этилацетат, 5:4:1) (1:1) с получением названного в заголовке соединения (3 г,67%) в виде густого масла оранжевого цвета. ЖХМС (m/z) 498 М-1. Следующие соединения получают по способу, по существу сходному со способом, описанным в получении 14.
МПК / Метки
МПК: A61P 25/00, A61P 37/08, C07D 213/79, C07D 257/04, C07D 401/04, C07D 213/70, A61K 31/4427
Метки: глутамата, потенциаторы, рецепторов
Код ссылки
<a href="https://eas.patents.su/30-11867-potenciatory-receptorov-glutamata.html" rel="bookmark" title="База патентов Евразийского Союза">Потенциаторы рецепторов глутамата</a>












