Амидное пролекарство гемцитабина, композиции на его основе и его применение
Формула / Реферат
1. Соединение формулы
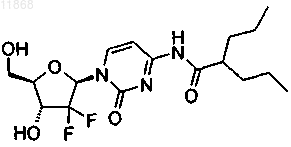
2. Соединение, которое представляет собой сокристалл 1-(2,2-дифтор-2-дезокси-b-D-рибофуранозил)-4-(2-пропил-1-оксопентил)аминопиримидин-2-она п-толуолсульфоновой кислоты.
3. Соединение по п.2, которое представляет собой сокристалл (2:1:1) 1-(2,2-дифтор-2-дезокси-b-D-рибофуранозил)-4-(2-пропил-1-оксопентил)аминопиримидин-2-она п-толуолсульфоновой кислоты гидрата.
4. Фармацевтическая композиция, включающая соединение по пп.1-3 и фармацевтически приемлемое вспомогательное вещество.
5. Фармацевтическая композиция по п.4, отличающаяся тем, что на композицию нанесено кишечно-растворимое покрытие.
6. Способ лечения чувствительных новообразований у млекопитающего, отличающийся тем, что включает введение млекопитающему, которое нуждается в таком лечении, терапевтически эффективного количества соединения по пп.1-3.
7. Способ по п.6, отличающийся тем, что чувствительное новообразование выбрано из группы, состоящей из лимфомы Т-клеток, саркомы мягких тканей, рака поджелудочной железы, рака молочной железы, лимфомы Ходжкинса, неходжкинской лимфомы, немелкоклеточного рака легкого, рака яичника и рака мочевого пузыря.
8. Применение соединения по пп.1-3 для производства лекарственного средства для лечения чувствительных новообразований.
9. Применение соединения по пп.1, 2 или 3 в качестве фармацевтического средства.
10. Применение соединения по пп.1, 2 или 3 в приготовлении лекарственного средства для лечения лимфомы Т-клеток, саркомы мягких тканей, рака поджелудочной железы, рака молочной железы, лимфомы Ходжкинса, неходжкинской лимфомы, немелкоклеточного рака легкого, рака яичника и рака мочевого пузыря.
Текст
011868 Данное изобретение относится к новому пролекарству гемцитабина, которое может вводиться перорально и в существенной мере интактным проходить сквозь кишечный тракт в портальный кровоток(кровоток воротной вены), обладая менее выраженной токсичностью для желудочно-кишечного тракта и лучшей биодоступностью, в сравнении с исходным лекарственным средством, а также сохраняя эффективность исходного лекарственного средства, но в более низких дозах. Гемцитабина гидрохлорид (2',2'-дифтор-2'-дезоксицитидина гидрохлорид) представляет собой противоопухолевый агент с доказанной противовирусной активностью, который в настоящее время производится и представлен на рынке под торговым названием Гемзар; в виде порошка, лиофилизированного для лечения различных видов рака. Гемзар, способ его получения и способы его применения описаны в патенте США 5464826 и патенте США 4808614. Гемзар в настоящее время зарегистрирован для лечения рака поджелудочной железы, рака молочной железы и немелкоклеточного рака легких (NSCLC),а также проходит рассмотрение в качестве средства для лечения рака яичника. Кроме того, Гемзар может использоваться в лечении гепатита С (HCV), а также как модулятор иммунной функции (см. патент США 6555518). Гемзар в настоящее время вводится путем внутривенной инфузии в дозе приблизительно 1000-1250 мг/м 2 в течение 30 мин, один раз в неделю на протяжении периода до 7 недель с последующей неделей отдыха от лечения. Применение гемцитабина внутрь может быть ограничено его низкой биодоступностью при пероральном введении, что представляет собой результат пресистемного метаболизма. Shipley L.A et. al.,"Metabolism and disposition of gemcitabine, and oncolytic deoxycytidine analog, in mice, rats, and dogs". DrugMetabolismDisposition. 20(6): 849-55, 1992. Кроме того, при приеме внутрь гемцитабин способствует возникновению побочных эффектов в виде повреждений кишечника, которые ограничивают применяемую дозу и характеризуются умеренной или выраженной утратой эпителия слизистой оболочки (атрофическая энтеропатия) по всей длине кишечного тракта у мышей, которым вводили однократно перорально(через зонд) дозу гемцитабина 167, 333 или 500 мг/кг. Horton N.D. et. al., "Toxicity of single-dose oral gemcitabine in mice", American Association for Cancer Research, Poster Presentation, Orlando, FL, March 27-31,2004. В ходе проведенных ранее исследований на мышах сравнимый системный контакт при внутривенном введении не приводил к смерти или токсичности для желудочно-кишечного тракта. Способы получения пролекарств и лекарственных форм гемцитабина с пролонгированным высвобождением активного ингредиента хорошо известны из уровня техники. Примеры таких пролекарств и препаратов с пролонгированным высвобождением активного ингредиента можно найти в WO 04/0412303Gemcitabine Prodrugs, Pharmaceutical Compositions and Uses Thereof", Gallop et al.; WO 98/32762 "Gemcitabine Derivatives", Myhren, Finn, et al.; WO 02/09768 "Therapeutic polyesters and polyamides", Uhrich, Kathryn E.; WO 02/76476 "Prodrugs of anticancer agents based on substituted aromatic acids", Greenwald, Richard В., et al.; WO 02/65988, "Terminally-branched polymeric linkers and polymeric conjugates as prodrug", Choe,Yun Hwang, et al. Амидные производные гемцитабина описаны в уровне техники как полезные промежуточные соединения в синтезе гемцитабина, см., например, Britton, et al., патент США 5420266 и Grindey, et al.,патент США 5464826, а также полезны в качестве фрагментов пролекарств для введения гемцитабина,см. например, Gallop, et al., WO 04/041203. Таким образом, продолжает существовать потребность в пролекарстве гемцитабина, которое сделает возможным пероральное введение, будет проходить в неизменном виде (без значительного разложения) через кишечный тракт и доставлять гемцитабин к поврежденной области с приемлемой эффективностью и безопасностью. Неожиданно авторы обнаружили новое амидное производное гемцитабина с лучшими характеристиками, которое пересекает энтероцит в значительной мере интактным; гидролизуется до гемцитабина без значительной аккумуляции дезоксидифторуридина (dFdU), преобладающего метаболита гемцитабина в печени, обладает меньшей токсичностью, чем гемцитабин при пероральном введении, а также сохраняет приемлемые профили безопасности и эффективности при пероральном введении. Краткое описание изобретения Данное изобретение предлагает соединение формулы I Другой аспект изобретения предлагает новые фармацевтические композиции, содержащие соединение формулы I и одно или больше фармацевтически приемлемых вспомогательных веществ. Данное изобретение также предлагает применение соединения формулы I для лечения чувствитель-1 011868 ных новообразований у млекопитающего, нуждающегося в таком лечении. Данное изобретение предлагает применение соединения формулы I для лечения чувствительных вирусных инфекций у млекопитающего, нуждающегося в таком лечении. Данное изобретение также предлагает применение соединения формулы I для производства медикамента для лечения чувствительных новообразований или вирусных инфекций. Кроме того, данное изобретение также предлагает способ получения соединения формулы I. Подробное описание изобретения Используемые в данном описании термины имеют следующие значения. Термин "млекопитающее" употребляется для обозначения любого теплокровного позвоночного животного из класса млекопитающие, наиболее предпочтительно человека, которое характеризуется наличием волосяного покрова на коже и, в случае женской особи, вырабатывающих молоко грудных желез для вскармливания молодняка. Термин "фармацевтически приемлемое вспомогательное вещество" обозначает фармацевтически приемлемый носитель, раствор или добавку в рецептуре для улучшения характеристик препарата. Такие вспомогательные вещества должны быть совместимы с другими ингредиентами препаратами, должны быть безвредными для реципиента препаратами и хорошо известны специалисту в данной области, см.,например, Remingtons Pharmaceutical Sciences, 19th Edition, Mack Publishing Company, 1995. Термин "сокристалл" подразумевает физическое соединение двух или больше молекул, которое обязано своей стабильностью нековалентным связям. Один или больше компонентов такого молекулярного комплекса обеспечивает устойчивую структуру в кристаллической решетке. В некоторых случаях,молекулы соединения-гостя включены в кристаллическую решетку как безводные формы или сольваты,см., например, "Crystal Engineering of the Composition of Pharmaceutical Phases. Do Pharmaceutical Cocrystals Represent a New Path to Improved Medicines" Almarasson, O., et al., The Royal Society of Chemistry,1889-1896, 2004. Предпочтительные сокристаллы включают п-толуолсульфоновую кислоту и бензолсульфоновую кислоту. Термин "фармацевтически приемлемый сокристалл" означает сокристалл, совместимый с другими ингредиентами препарата, а также безвредный для реципиента соответствующий препарат. Термин "чувствительное новообразование" обозначает аномальный рост ткани у млекопитающих,который поддается лечению пероральным введением соединения формулы I. Поскольку такое пролекарство будет гидролизоваться до гемцитабина, ожидается, что введение пролекарства будет оказывать широкий спектр действия в отношении большого числа разнообразных типов опухолей как солидных, так и несолидных. Предпочтительно, чувствительные новообразования включают лимфому Т-клеток, саркому мягких тканей, рак поджелудочной железы, рак молочной железы, лимфому Ходжкинса, неходжкинскую лимфому, немелкоклеточный рак легкого, рак яичника и рак мочевого пузыря. Соединения по изобретению пригодны для лечения вирусных инфекций, конкретно, гепатита С(HCV). Термин "терапевтически эффективное количество" подразумевает количество соединения/композиции, которое вызывает желательную биологическую или медицинскую реакцию ткани, системы или млекопитающего, т.е. которую стремится получить исследователь, врач или клиницист. Гемцитабин содержит три функциональные группы, поддающиеся дериватизации, -3'- и 5'гидроксильные группы и N4-аминогруппу. Соединение формулы I может быть получено путем использования подходящих защитных групп для блокирования 3'- и 5'-гидроксильных функциональных групп с последующим ацилированием N4-аминогруппы. Типичные защитные группы хорошо известны и признаны в уровне техники (Protecting Groups in Organic Synthesis, 3rd edition Theodora Greene, Peter Wuts(Wiley-Interscience) 1999). Ацилирование N4-аминогруппы может быть достигнуто реакцией с ацилхлоридом (галогенангидридом кислоты) или ангидридом кислоты, или реакцией с карбоновой кислотой в присутствии реактива для сочетания, такого как "N,N-дициклогексилкарбодиимид (ДЦК), N-этил-N'-(3 диметиламинопропил)карбодиимид (ЭДК), 1,1-карбонилдиимидазол (КДИ) или другие подобные реактивы, хорошо известные специалисту в области органической химии. Альтернативно соединение формулы I может быть получено без применения защитных групп. В таком случае будут образованы смеси моно-, ди- и три-аддуктов и целевой продукт может быть выделен из смеси. Следующие примеры дополнительно иллюстрируют синтез соединений по изобретению. Все исходные материалы и реактивы хорошо известны и признаны в данной области, они легко доступны или могут быть получены по способам, приведенным в данном описании. Например, способ получения гемцитабина (2',2'-дифтор-2'-дезоксицитидин) раскрыт в патенте США 4808614. Пример 1. 1-(2,2-Дифтор-2-дезоксиD-рибофуранозил)-4-(2-пропил-1-оксопентил)аминопиримидин-2-он. Растворяют 2',2'-дифтор-2'-дезоксицитидин (10,0 г, 38,0 ммоль) в безводном пиридине (100 мл) и охлаждают до 0 С, перемешивая в атмосфере азота. По каплям добавляют хлортриметилсилан (24,0 мл,190,0 ммоль), поддерживая внутреннюю температуру на уровне 5 С. Продолжают перемешивание при 0 С в течение 2 ч. В отдельной колбе растворяют 2-пропилпентановую кислоту (6,0 г, 41,8 ммоль) в безводном ацетонитриле (100 мл). Маленькими порциями добавляют 1,1-карбонилдиимидазол (6,8 г, 41,8 ммоль) на протяжении 30 мин и перемешивают в течение 2 ч. По каплям добавляют полученный раствор в ацетонитриле к раствору в пиридине при 0 С и дают реакционной смеси нагреться до температуры окружающей среды. Нагревают реакционную смесь до 45 С, выдерживая при этой температуре в течение ночи, затем охлаждают до 30-35 С, добавляют 100 мл абсолютного этанола и нагревают до 45 С, выдерживая при этой температуре в течение 30 мин. Добавляют 50 мл воды и нагревают до 45 С, выдерживая при этой температуре в течение 5 ч, после чего охлаждают до температуры окружающей среды и упаривают в вакууме. Сырой остаток разделяют между этилацетатом и водой. Подкисляют до рН 2 с помощью фосфорной кислоты и отделяют органическую фракцию. Осуществляют обратную экстракцию водной фракции с помощью дополнительного количества этилацетата. Объединяют органические растворы, промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлорида натрия, сушат над сульфатом магния и упаривают в вакууме. Очищают хроматографией на силикагеле (120 г), элюируя с градиентом от 30 до 60% этилацетата в метиленхлориде. Выделяют целевой продукт в виде белой поддающейся дроблению пены (11,2 г, выход 77%). МС (ионизация электрораспылением): отношение массы к заряду 390,3=[М+Н]+ МС (ионизация электрораспылением): отношение массы к заряду 388,3=[М-Н]+ 1 Н ЯМР (400 МГц, ДМСО-d6)0,83 (т, 6 Н), 1,15-1,36 (м, 6 Н), 1,46-1,55 (м, 2 Н), 2,60 (дддд, 1 Н, J = 14,4, 9,6, 5,6, 5,6 Гц), (ддд, 1 Н, J=12,6, 6,2, 3,6 Гц), 3,77-3,81 (м, 1 Н), 3,87 (дт, 1 Н, J=8,4, 3,0 Гц), 4,12-4,22(м, 1 Н), 5,27 (т, 1 Н, J=5,6 Гц), 6,15 (т, 1 Н, J=7,4 Гц), 6,29 (д, 1 Н, J=6,4 Гц), 7,31 (д, 1 Н, J=7,2 Гц), 8,23 (д,1 Н, J=8,0 Гц), 11,03 (с, 1 Н). Пример 2. 1-(2,2-Дифтор-2-дезоксиD-рибофуранозил)-4-(2-пропил-1-оксопентил)аминопиримидин-2-она п-толуолсульфоновой кислоты гидрата сокристалл (2:1:1). Растворяют 0,709 г (1,82 ммоль) соединения из примера 1 в 9 мл метанола. В отдельной колбе готовят запасной водный 0,25 М раствор п-толуолсульфоновой кислоты. По каплям добавляют 3,6 мл (0,9 ммоль) водного раствора. Добавляют 5 мл воды и перемешивают смесь при комнатной температуре(30 мин) до тех пор, пока происходит выпадение осадка. Отделяют осадок твердого вещества вакуумной фильтрацией и дают высохнуть на воздухе. Анализ состава сокристалла Готовят растворы с известной концентрацией п-толуолсульфоновой кислоты, гемцитабина и соединения из примера 1. Анализируют образец сокристалла п-толуолсульфоновой кислоты из примера 1 для определения состава композиции. Для соотношения N-(2-пропилпентаноил)-2',2'-дифтор-2'-дезоксицитидин/п-толуолсульфоновая кислота/вода 2:1:1 был определен % толуолсульфоновой кислоты. Рассчитано: 17,8% п-толуолсульфоновой кислоты. Найдено: 19,1% п-толуолсульфоновой кислоты. ВЭЖХ: Колонка: Waters Atlantis dC18, 3,0 мкм, внутренний диаметр 4,6150 мм Температура колонки 50 С Длина волны в УФ области: 248 нм 1. Подвижная фаза-3 011868 Пример 3. 1-(2,2-Дифтор-2-дезоксиD-рибофуранозил)-4-(2-пропил-1-оксопентил)аминопиримидин-2-она бензолсульфоновой кислоты сокристалл (1:1). К 5 мл этилацетата добавляют 550 мг соединения из примера 1. Смесь нагревают до приблизительно 55 С. Добавляют один молярный эквивалент бензолсульфоновой кислоты в виде раствора. Добавляют дополнительное количество этилацетата (10 мл), при необходимости обрабатывая ультразвуком для разрушения осадка. Суспензии дают остыть до комнатной температуры и твердое вещество отделяют вакуумной фильтрацией. Выделенное твердое вещество сушат на воздухе. Т.пл.: 171 С. Соединение формулы I и его сольваты являются перорально доступными и обычно вводятся перорально, и такое пероральное введение является предпочтительным. Фармацевтические композиции получают способом, хорошо известным в фармацевтической области. Носитель или вспомогательное вещество может представлять собой твердый, полутвердый или жидкий материал, который может служить носителем или средой для активного ингредиента. Подходящие носители или вспомогательные вещества хорошо известны из уровня техники. Фармацевтическая композиция может быть приспособлена для перорального, ингаляционного, парентерального или местного применения и может вводиться пациенту в форме таблеток, капсул, аэрозолей, лекарственных форм для ингаляций, суппозиториев, растворов, суспензий и т.п. Соединения по данному изобретению могут вводиться перорально, например, с инертным разбавителем или в форме капсул или спрессованными в таблетки. С целью перорального терапевтического введения соединения могут быть соединены со вспомогательными веществами и могут применяться в форме таблеток, пастилок, капсул, эликсиров, суспензий,сиропов, облаток, жевательных резинок и т.п. Указанные препараты предпочтительно содержат как минимум 1% соединения по данному изобретению, как активный ингредиент, но его содержание может варьировать в зависимости от конкретной лекарственной формы и традиционно может составлять от 1 до приблизительно 90 мас.% стандартной лекарственной формы. Количество соединения, присутствующее в композициях, является таким, что будет обеспечена подходящая дозировка. Предпочтительные композиции и препараты по данному изобретению могут быть определены по способам, хорошо известным специалисту в данной области. Таблетки, пилюли, капсулы, пастилки и т.п. также могут содержать одно или больше из следующих вспомогательных веществ: связывающие агенты, такие как повидон, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза или желатин; вспомогательные вещества или разбавители, такие как крахмал, лактоза, микрокристаллическая целлюлоза или дикальция фосфат, дезинтеграторы, такие как кроскармеллоза, кросповидон, натрий крахмал гликолят, кукурузный крахмал и т.п.; смазывающие вещества, такие как стеарат магния, стеариновая кислота, тальк или гидрогенизированное растительное масло; вещества, улучшающие скольжение, такие как коллоидный кремния диоксид; увлажняющие вещества,такие как натрия лаурилсульфат и полисорбат 80; а также могут быть добавлены подсластители, такие как сахароза, аспартам или сахарин, или ароматизаторы, такие как мята перечная, метилсалицилат или ароматизатор апельсина. Если стандартная лекарственная форма представляет собой капсулу, она может содержать, кроме материалов вышеперечисленного типа, жидкий носитель, такой как полиэтиленгликоль или жирное масло. Другие стандартные лекарственные формы могут содержать различные другие материалы, которые модифицируют физическое состояние стандартной лекарственной формы, например различные виды покрытия. Предпочтительно, лекарственная форма покрыта кишечно-растворимым покрытием. Таким образом, таблетки или пилюли могут быть покрыты сахаром, гидроксипропилметилцеллюлозой, полиметакрилатом или другими покрывающими веществами. Сиропы могут содержать, кроме соединений по настоящему изобретению, сахарозу как подсластитель и некоторые консерванты, красители и вещества, придающие цвет, а также ароматизаторы. Материалы, используемые в приготовлении указанных различных композиций, должны быть чистыми с фармацевтической точки зрения и нетоксичными в используемых количествах. Соединения формулы I в целом эффективны в широком интервале доз. Например, суточные дозы в виде одного или нескольких приемов обычно находятся в пределах интервала от приблизительно 15 до приблизительно 200 мг/сутки, более предпочтительно приблизительно 85 мг/сутки. В некоторых случаях более чем достаточными могут быть уровни доз ниже нижнего предела указанного выше интервала, тогда как в других случаях более высокие дозы могут применяться без опасных побочных эффектов и, таким образом, указанный выше интервал доз не предназначен для ограничения изобретения каким-либо способом. Будет понятно, что фактически введенное количество соединения будет определять врач в свете сопутствующих обстоятельств, в том числе состояния, которое подлежит лечению, выбранного способа введения, фактического вводимого соединения или соединений, возраста, массы тела и реакции конкретного пациента, а также тяжести симптомов больного. Анализ химической стабильности при различных значениях рН. Химическую стабильность при различных значениях рН оценивали с использованием полуавтоматической техники ВЭЖХ. Готовили образцы соединения формулы I с концентрацией 100 мкг/мл в пяти буферах, представляющих интервал рН, который встречается на протяжении желудочно-кишечного тракта (рН 1-8). Образцы загружали в ВЭЖХ аутосемплер и инкубировали при 40 С. Образцы повторно вводили на колонку ВЭЖХ с интервалами времени до 24 ч, причем на колонке ВЭЖХ соединение фор-4 011868 мулы I отделялось от гемцитабина. Область пика соединения формулы I с течением времени контролировали детектированием в УФ области и сравнивали с начальными значениями площади пика для определения стабильности. По прохождении четырех часов в интервале рН 1-8 менее 25% соединения из примера 1 разлагалось до гемцитабина. Фармакокинетический анализ. Фармакокинетика у мышей. Фармакокинетические профили гемцитабина и соединения формулы I оценивали у самцов мышейCD-1 после перорального введения в дозах, выбранных таким образом, что они содержали приблизительно 10 мг/кг гемцитабина. Распределенных в группы животных (n=3 в каждой временной точке для каждого соединения) забивали через 0,08, 0,25, 0,5, 1, 2 и 6 ч после введения дозы и образцы системной крови отбирали в обработанные ЭДТА пробирки, содержащие тетрагидроуридин (конечная концентрация в крови 0,5 мМ) для ингибирования дальнейшего метаболизма до гемцитабина. Дополнительно 3 животных забивали по прохождении 0,08 ч для забора крови из портальной вены печени. Плазму отделяли центрифугированием и замораживали до проведения анализа. Концентрации гемцитабина и пролекарств в плазме определяли с помощью анализа ЖХ/МС/МС. Фармакокинетические параметры рассчитывали с использованием программного обеспечения WinNonlin (Pharsight Corp., Mountain View, CA). Фармакокинетические параметры каждого пролекарства сравнивали с параметрами, определенными в результате перорального введения гемцитабина гидрохлорида в исследовании со сходным дизайном. После перорального введения мышам CD-1 соединение из примера 1 экстенсивно гидролизовалосьin vivo с высвобождением гемцитабина. Контакт плазмы с гемцитабином увеличивался у мышей CD-1 при введении соединения из примера 1 по сравнению с непосредственным пероральным введением гемцитабина гидрохлорида. Абсорбцию интактного пролекарства верифицировали по относительно высоким концентрациям соединения из примера 1 в плазме портальной системы печени через 0,08 ч после перорального введения. Анализ фармакокинетики у яванских макак. Фармакокинетические профили гемцитабина и соединения формулы I оценивали после перорального и внутривенного введения в исследовании с перекрестным дизайном на яванских макаках. Дозы соединений для введения выбирали таким образом, чтобы они содержали приблизительно 10 мг/кг гемцитабина. Образцы крови отбирали в обработанные ЭДТА пробирки, содержащие тетрагидроуридин(конечная концентрация в крови 0,5 мМ) при определенных интервалах времени до 48 ч. Животным предварительно вводили ранитидин (внутривенно, 5 мг/кг) в периоды перорального введения исследуемого соединения. Плазму отделяли центрифугированием и замораживали до проведения анализа. Концентрации гемцитабина и соединения формулы I в плазме определяли с помощью анализа ЖХ/МС/МС. Фармакокинетические параметры рассчитывали с использованием программного обеспеченияWinNonlin (Pharsight Corp., Mountain View, CA). После внутривенного введения яванским макакам соединение из примера 1 экстенсивно гидролизовалось in vivo с высвобождением гемцитабина. Системный контакт с гемцитабином при пероральном введении яванским макакам при введении соединения из примера 1 увеличивался приблизительно в 5 раз по сравнению с непосредственным пероральным введением гемцитабина гидрохлорида. Анализ гидролиза. Анализ гомогенатов тонкого кишечника. Для определения устойчивости соединения формулы I к ферментному гидролизу в кишечнике готовили сырые гомогенаты эпителиальных клеток тонкого кишечника из срезов, полученных из верхних отделов тонкого кишечника мышей CD-1, гончих собак, яванских макак и человека. Гомогенаты тканей мышей и собак готовили из свежесобранной ткани, гомогенаты тканей макак и человека получали из предварительно замороженных тканей. Клетки осторожно соскабливали с кишечных сегментов, объединяли и гомогенизировали в 50 мМ ацетатном буфере с использованием Polytron (PT-10-85). Концентрацию белка определяли стандартными спектрофотометрическими методами. Приготовленные гомогенаты хранили при -70 С до использования. Значения скорости гидролиза соединения формулы I в гомогенатах тонкого кишечника (SIH) определяли путем инкубирования соединения формулы I (100 мкМ) с SIH (общая концентрация белка 2,5-5 мг/мл) в ацетате при рН 7,5 на протяжении периода до 6 ч. Концентрацию высвободившегося в результате гидролиза гемцитабина определяли анализом ЖХ/МС после того, как реакционную смесь заливали ацетонитрилом. Значения скорости гидролиза рассчитывали по прохождении 30 мин в скрининговых экспериментах и, начиная с наклона линейной части кривой зависимости гидролиза от времени, - в описательных исследованиях соединения формулы I. Соединение из примера 1 демонстрировало низкую скорость гидролиза в анализах на гомогенате тонкого кишечника. Гидролиз был наиболее медленным в гомогенатах макак и человека, где менее 3% от общего количества соединения превращалось в гемцитабин после 6 ч инкубирования. Анализ гидролиза во фракциях S9 печени. Гидролиз соединения формулы I ферментами печени проводили с помощью количественного опре-5 011868 деления гидролиза в печени. Гомогенаты печени получали из печени мышей CD-1, гончих собак, яванских макак и человека. Ткань печени разрезали с использованием ножниц на маленькие куски, после чего гомогенизировали в 50 мМ ацетатном буфере с использованием Polytron (PT-10-85) в течение 1 мин. Пост-митохондриальные фракции (S9) получали из каждого образца с помощью ультрацентрифугирования (9000g при 4 С) в течение 10 мин. Фракции S9 печени мыши, собаки и макаки готовили из свежесобранной ткани, а фракции S9 печени человека готовили из предварительно замороженной ткани. После центрифугирования супернатант собирали и концентрацию белка определяли стандартными спектрофотометрическими методами. Подготовленные фракции S9 хранили при -70 С до использования. Значения скорости гидролиза соединения формулы I в S9 печени определяли путем инкубирования соединения (10 мкМ) с S9 (общий белок 2 мг/мл) в буферизованном фосфатом солевом растворе при рН 8,0 в течение периода до 6 ч. Концентрацию гемцитабина, высвобожденного в результате гидролиза, определяли с помощью анализа ЖХ/МС после того, как реакционную смесь заливали ацетонитрилом. Значения скорости гидролиза рассчитывали по прохождении 30 мин в скрининговых экспериментах и, начиная с наклона линейной части кривой зависимости гидролиза от времени - в описательных исследованиях соединения формулы I. Соединение из примера 1 гидролизовалось в S9 печени всех исследованных видов. Гидролиз был наиболее быстрым в гомогенатах макак и человека, где приблизительно 35% от общего количества соединения превращалось в гемцитабин после 6 ч инкубирования. Анализ токсичности. 4-дневный скрининг на мышах. Для оценки токсичности соединения формулы I при пероральном ежедневном введении самкам мышей CD-a в течение 4 дней профили токсичности соединения формулы I для желудочно-кишечного тракта сравнивали с предыдущими результатами токсичности для желудочно-кишечного тракта при пероральном введении гемцитабина в дозе 8 мг/кг в ходе 4-дневного исследования на мышах. Самкам мышей CD-1 в возрасте 5-8 недель вводили перорально дозы соединения формулы I через желудочный зонд. Уровень доз выбирали таким образом, чтобы обеспечить молярный эквивалент 8 мг/кг гемцитабина. Для доз использовали объем разведения 10 мл/кг и вводили один раз в день на протяжении 4 дней подряд. Вскрытие проводили приблизительно через 5-8 ч после введения 4-й дозы. Оценивали клинические признаки, результаты анализов клинической химии, развернутую патологию и ограниченную гистопатологию (подвздошная кишка, тощая кишка и печень). Наблюдалось значительное снижение выраженности атрофических изменений кишечника или энтеропатии, которые наблюдались после введения мышам эквивалентной дозы соединения из примера 1 по сравнению с гемцитабина гидрохлоридом. 14-Дневное исследование на мышах. 14-Дневное исследование на мышах проводили для оценки побочных эффектов соединения формулы I у мышей после 14 дней перорального введения через зонд, а также для определения концентраций соединения формулы I и его метаболитов - гемцитабина гидрохлорида и дезоксидифторуридина - в плазме после введения 1 или 14 доз. Самцам и самкам мышей CD-1 в возрасте 9-12 недель вводили перорально соединение формулы I через желудочный зонд. Выбирали интервал доз и пытались определить максимальную переносимую дозу и ограничивающую дозы токсичность. Для доз использовали объем разведения 10 мл/кг и вводили один раз в день. Оценивали клинические признаки, массу тела, потребление пищи, гематологию, клиническую химию, концентрацию соединения формулы I и его метаболитов - гемцитабина гидрохлорида и дезоксидифторуридина - в плазме, а также патологию (включая развернутую патологию, массу органов и гистопатологию). На основе молярных эквивалентов введение соединения из примера 1 сопровождается менее выраженной энтеропатией, чем введение гемцитабина гидрохлорида, причем системный контакт с гемцитабина гидрохлоридом является приблизительно вдвое более высоким. 7-Дневное исследование на собаках. Для оценки профиля токсичности соединения формулы I при введении гончим собакам на протяжении 7 дней, а также для определения концентрации соединения формулы I и его метаболитов - гемцитабина гидрохлорида и дезоксидифторуридина - в плазме после введения 1 или 7 дозы проводили 7 дневное исследование на собаках. Самцам и самкам гончих собак в возрасте 6-48 месяцев вводили перорально через капсулу соединение формулы I. Выбирали интервал доз и пытались определить максимальную переносимую дозу и ограничивающую дозы токсичность. Для доз использовали объем разведения 1 мл/кг и вводили один раз в день. Оценивали клинические признаки, массу тела, потребление пищи, температуру тела, гематологию(в том числе коагуляцию), клиническую химию, анализ мочи, концентрацию соединения из примера I и его метаболитов - гемцитабина гидрохлорида и дезоксидифторуридина - в плазме, а также патологию-6 011868 токсичности, включая токсичность для желудочно-кишечного тракта, согласуются с ранее описанными для парентерального введения гемцитабина. Таким образом, ни один из указанных видов токсичности не был уникальным для способа введения лекарственного средства. Анализ in vivo. Клетки опухоли ободочной кишки НСТ-116 выращивали in vitro в стандартных условиях культуры ткани, собирали, промывали и 5106 клеток (суспензия 1:1 в Matrigel, Collaborative Biomedical Products,Inc.), вводили инъекционно подкожно в боковую часть спины самок голых мышей (Charles River, CD1nu/nu, 24-27 г, получивших дозу облучения 450 Рад в пределах 24 ч от момента имплантации). Опухолям позволяли расти до 100 мм 3 до начала лечения. Растворитель вводили контрольной группе, соединение формулы I или гемцитабина гидрохлорид вводили исследуемым животным в различных дозах перорально через желудочный зонд (объем разведения 10 мл/кг) в моменты времени, показанные для отдельных экспериментов. Соединения вводили ежедневно в течение 14 дней, через день до общего количества семь доз или каждый третий день до общего количества четыре дозы. Для схемы ежедневного введения соединение формулы I вводили в 100 мМ буфере натрия фосфата, рН 6,0, а для схем введения через день и каждый третий день - в растворе, содержащем 1% натрийкарбоксиметилцеллюлозы, 0,5% натрия лаурилсульфата, 0,05% Antifoam 150 и 0,085% повидона. Гемцитабина гидрохлорид для перорального введения вводили в физиологическом солевом растворе. Размер опухоли определяли путем измерений в тысячных долях дюйма, объем опухоли (мм 3) оценивали на основе формулы lw20,536, где l представляет собой больший и w представляет собой меньший перпендикулярный диаметр. Все данные (размеры опухоли и масса животного) получали дважды в неделю с началом лечения и анализировали с использованием компьютерной системы измерения опухоли. Противоопухолевую эффективность, которую наблюдали для соединения из примера 1, сравнивали с данными, полученными с эквивалентной дозой гемцитабина гидрохлорида. Лечение животных соединением из примера 1 приводило к менее выраженной общей токсичности в сравнении с животными, которые получали эквивалентное количество гемцитабина гидрохлорида. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы 2. Соединение, которое представляет собой сокристалл 1-(2,2-дифтор-2-дезоксиDрибофуранозил)-4-(2-пропил-1-оксопентил)аминопиримидин-2-она п-толуолсульфоновой кислоты. 3. Соединение по п.2, которое представляет собой сокристалл (2:1:1) 1-(2,2-дифтор-2-дезоксиDрибофуранозил)-4-(2-пропил-1-оксопентил)аминопиримидин-2-она п-толуолсульфоновой кислоты гидрата. 4. Фармацевтическая композиция, включающая соединение по пп.1-3 и фармацевтически приемлемое вспомогательное вещество. 5. Фармацевтическая композиция по п.4, отличающаяся тем, что на композицию нанесено кишечнорастворимое покрытие. 6. Способ лечения чувствительных новообразований у млекопитающего, отличающийся тем, что включает введение млекопитающему, которое нуждается в таком лечении, терапевтически эффективного количества соединения по пп.1-3. 7. Способ по п.6, отличающийся тем, что чувствительное новообразование выбрано из группы, состоящей из лимфомы Т-клеток, саркомы мягких тканей, рака поджелудочной железы, рака молочной железы, лимфомы Ходжкинса, неходжкинской лимфомы, немелкоклеточного рака легкого, рака яичника и рака мочевого пузыря. 8. Применение соединения по пп.1-3 для производства лекарственного средства для лечения чувствительных новообразований. 9. Применение соединения по пп.1, 2 или 3 в качестве фармацевтического средства. 10. Применение соединения по пп.1, 2 или 3 в приготовлении лекарственного средства для лечения лимфомы Т-клеток, саркомы мягких тканей, рака поджелудочной железы, рака молочной железы, лимфомы Ходжкинса, неходжкинской лимфомы, немелкоклеточного рака легкого, рака яичника и рака мочевого пузыря.
МПК / Метки
МПК: C07H 19/073
Метки: амидное, гемцитабина, композиции, пролекарство, применение, основе
Код ссылки
<a href="https://eas.patents.su/8-11868-amidnoe-prolekarstvo-gemcitabina-kompozicii-na-ego-osnove-i-ego-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Амидное пролекарство гемцитабина, композиции на его основе и его применение</a>
Предыдущий патент: Потенциаторы рецепторов глутамата
Следующий патент: Способ формирования рекомендательного списка следов с использованием базы данных, база данных и способ ее формирования
Случайный патент: Химико-биологический способ удаления сероводорода из газа












