Антагонисты метаботропных рецепторов глутамата
Номер патента: 7464
Опубликовано: 27.10.2006
Авторы: Купа Софи, Мабир Доминик Жан-Пьер, Лезаж Анн Симон Жозефин, Вене Марк Гастон, Понселе Алан Филипп
Формула / Реферат
1. Соединение формулы
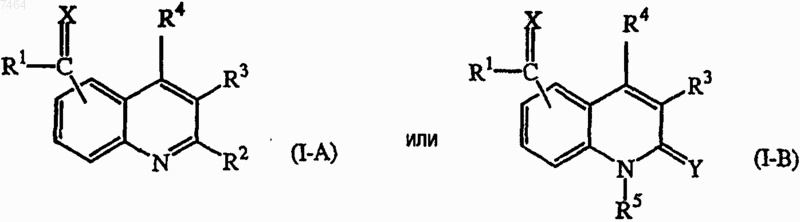
его N-оксид, фармацевтически приемлемая аддитивная соль и стереохимически изомерная форма,
где X представляет собой О; C(R6)2, где R6 означает водород, или N-R7, где R7 означает амино или гидрокси;
R1 представляет собой C1-6алкил; арил; тиенил; хинолинил; циклоС3-12алкил; (циклоС3-12алкил)C1-6алкил, где циклоС3-12алкильная часть может необязательно содержать двойную связь, и один атом углерода в циклоС3-12алкильной части может быть замещен атомом кислорода или группой NR8, где R8 означает бензил или C1-6алкилоксикарбонил; причем один или несколько атомов водорода в C1-6алкильной части или циклоС3-12алкильной части могут быть необязательно замещены C1-6алкилом, гидрокси, галогенС1-6aлкилом, C1-6алкилокси, арилС1-6алкилокси, арилом, галогеном, моно- или ди(C1-6алкил)амино, пиперазинилом, пиридинилом, морфолинилом, тиенилом и двухвалентным радикалом формулы -O- или -O-СН2-СН2-O-;
или радикал формулы (а-1)
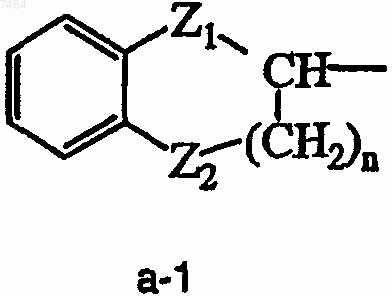
где Z1 означает прямую ковалентную связь, О или СН2;
Z2 означает прямую ковалентную связь, О или СН2;
n является целым числом, равным 0, 1, 2 или 3;
и каждый атом водорода в фенильном кольце может быть необязательно замещен галогеном, гидрокси, C1-6алкилокси;
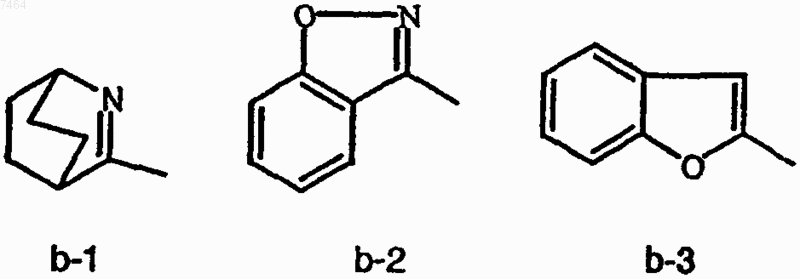
либо X и R1 вместе с атомом углерода, к которому присоединены X и R1, могут образовывать радикал формулы (b-1), (b-2) или (b-3)
группа -C(=X)R1 присоединена или в 6 положение, или в 7;
R2 представляет собой водород; галоген; циано; C1-6алкил; C1-6алкилокси; C1-6алкилтио; C1-6алкил-карбонил; C1-6алкилоксикарбонил; С1-6алкилкарбонилоксиС1-6алкил; С2-6aлкенил; С2-6алкинил; гидроксиС2-6aлкинил; три(C1-6алкил)силанС2-6aлкинил; амино; моно- или ди(C1-6алкил)амино; моно- или ди(С1-6алкилоксиС1-6алкил)амино; моно- или ди(С1-6алкилтиоС1-6алкил)амино; арил; арилС1-6алкил; арилС2-6aлкинил; С1-6алкилоксиС1-6алкиламиноС1-6алкил; аминокарбонил, необязательно замещенный C1-6алкилом, C1-6алкилоксиС1-6алкилом, С1-6алкилоксикарбонилС1-6алкилом или пиридинилС1-6алкилом;
гетероцикл, выбранный из тиенила, фуранила, тиазолила или пиперидинила;
радикал -NH-C(=O)R9, где R9 означает C1-6алкил, необязательно замещенный циклоС3-12алкилом, C1-6алкилокси, арилом, арилокси, тиенилом, пиридинилом, моно- или ди(C1-6алкил)амино, C1-6алкилтио, бензилтио, пиридинилтио или пиримидинилтио; циклоС3-12алкил; циклогексенил; амино; арилциклоС3-12алкиламино; моно- или ди(С1-6алкил)амино; моно- или ди(С1-6алкилоксикарбонилС1-6алкил)амино; моно- или ди(C1-6алкилоксикарбонил)амино; моно- или ди(С2-6алкенил)амино; моно- или ди(арилС1-6алкил)амино; моно- или диариламино; арилС2-6алкенил; фуранилС2-6алкенил; пиперидинил; индолил; фурил; бензофурил; тетрагидрофурил; инденил; адамантил; пиридинил; пиразинил; арил;
сульфонамид -NH-SO2-R10, где R10 представляет собой C1-6алкил, моно- или полигалогенС1-6алкил, арилС1-6алкил, арил или изоксазолил;
R3 и R4, каждый независимо, представляют собой водород; C1-6алкил; С1-6алкилоксиС1-6алкил, C1-6алкилоксикарбонил; морфолинилС1-6алкил или пиперидинилС1-6алкил; либо
R2 и R3, взятые вместе, могут образовывать группу -R2-R3, которая представляет собой двухвалентный радикал формулы -(СН2)3-, -(СН2)4-, -(CH2)5-, -Z4-CH=CH, -CH2-Z4-CH2-CH2-, -CH2-CH2-CH2-Z4- или -CH2-CH2-Z4-, где Z4 означает О, S или NR11, где R11 означает C1-6алкил или бензил, причем каждый двухвалентный радикал необязательно замещен C1-6алкилом;
либо R3 и R4, взятые вместе, могут образовывать двухалентный радикал формулы -СН=СН-СН=СН- или -СН2-СН2-СН2-СН2-;
R5 представляет собой водород, арилС1-6алкил; C1-6алкилоксикарбонилС1-6алкил или C1-6алкил, необязательно замещенный радикалом C(=O)NRxRy, где Rx и Ry независимо означают водород, циклоС3-12алкил, С2-6алкинил или C1-6алкил, необязательно замещенный C1-6алкилокси, C1-6алкилокси-карбонилом, пиридинилом или пирролилом;
Y представляет собой О или S;
либо Y и R5, взятые вместе, могут образовывать группу =Y-R5-, которая является радикалом формулы
| -CH=N-N= | (с-1); |
| -N=N-N= | (с-2) или |
| -N-CH=CH- | (с-3); |
и когда группа R1-C(=X) присоединена в положение 6, атомы в положениях 7 и 8 могут быть замещены R15 и R16, где один или оба R15 и R16 означают C1-6алкил, либо R15 и R16, взятые вместе, могут образовывать двухвалентный радикал формулы -СН=СН-СН=СН-; и
арил представляет собой фенил или нафтил, необязательно замещенный одним или несколькими заместителями, выбираемыми из группы, включающей галоген, C1-6алкил, C1-6алкилокси, фенилокси, C1-6алкилтио, полигалогенС1-6алкил, моно- или ди(C1-6алкил)амино; циано, -CO-R12 и -СО-OR13, где каждый R12 и R13 независимо представляет собой C1-6алкил.
2. Соединение по п.1, отличающееся тем, что
X представляет собой О;
R1 представляет собой C1-6алкил; циклоС3-12алкил или (циклоС3-12алкил)C1-6алкил, где один или несколько атомов водорода в C1-6алкильной части или циклоС3-12алкильной части могут необязательно быть замещены C1-6алкилокси, галогеном, арилом или тиенилом;
группа -C(=X)-R1 присоединена или в положение 6 или 7;
R2 представляет собой водород; галоген; C1-6алкил или амино;
R3 и R4 независимо представляют собой водород или C1-6алкил; либо
R2 и R3, взятые вместе, могут образовывать группу -R2-R3-, которая является двухвалентным радикалом формулы -Z4-CH2-CH2-CH2- или -Z4-СН2-СН2-, где Z4 означает О или NR11, где R11 означает C1-6алкил, причем каждый двухвалентный радикал необязательно замещен C1-6алкилом;
либо R3 ш R4, взятые вместе, могут образовывать двухвалентный радикал формулы -СН2-СН2-СН2-СН2-;
R5 представляет собой водород;
Y представляет собой О и
арил представляет собой фенил, необязательно замещенный галогеном.
3. Соединение по п.1, отличающееся тем, что
X представляет собой О;
R1 представляет собой C1-6алкил; циклоС3-12алкил или (циклоС3-12алкил)C1-6алкил, где один или несколько атомов водорода в C1-6алкильной части или циклоС3-12алкильной части могут быть необязательно замещены C1-6алкилокси, арилом, галогеном или тиенилом;
R2 представляет собой водород; галоген; C1-6алкил или амино;
R3 и R4 независимо представляют собой водород или C1-6алкил; либо
R2 и R3, взятые вместе, могут образовывать группу -R2-R3-, которая является двухвалентным радикалом формулы -Z4-CH2-CH2-CH2- или -Z4-CH2-CH2-, где Z4 означает О или NR11, где R11 означает C1-6алкил, причем каждый двухвалентный радикал необязательно замещен C1-6алкилом;
либо R3 и R4, взятые вместе, могут образовывать двухвалентный радикал формулы -СН2-СН2-СН2-СН2-;
R5 представляет собой водород;
Y представляет собой О; и
арил представляет собой фенил, необязательно замещенный галогеном.
4. Соединение по п.1, отличающееся тем, что часть R1-C(=X) присоединена к хинолиновой или хинолиноновой части в положении 6.
5. Соединение по п.1, предназначенное для использования в качестве лекарственного средства.
6. Применение соединения по пп.1-4 для получения лекарственного средства для лечения или профилактики вызываемых глутаматом заболеваний центральной нервной системы.
7. Применение по п.6, отличающееся тем, что вызываемое глутаматом заболевание центральной нервной системы представляет собой привыкание к наркотическим средствам или абстиненцию (зависимость, толерантность к опиатам, синдром отмены опиатов), гипоксию, нарушения, обусловленные кислородной недостаточностью и ишемией (ишемический инсульт, остановка сердца), болевой синдром (боли, связанные с заболеваниями нервной системы или воспалительными заболеваниями, гипералгезия), гипогликемию, заболевания, связанные с поражением нервных клеток, травму головного мозга, травму головы, травму спинного мозга, миелопатию, старческое слабоумие, состояние страха, шизофрению, депрессию, расстройство познавательной способности, амнезию, биполярные нарушения, нарушения проводимости, болезнь Альцгеймера, сосудистое слабоумие, смешанное слабоумие (вследствие болезни Альцгеймера и поражения сосудисной системы), соматическое заболевание Леви, делирий или спутанность сознания, болезнь Паркинсона, болезнь Хантингтона, синдром Дауна, эпилепсию, патологическое старение, боковой амиотрофический склероз, рассеянный склероз, СПИД (синдром приобретенного иммунодефицита) и СПИД-ассоциированный комплекс.
8. Фармацевтическая композиция для лечения или профилактики вызываемых глутаматом заболеваний, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по пп.1-4 в качестве активного ингредиента.
9. Способ получения композиции по п.8, отличающийся тем, что фармацевтически приемлемый носитель однородно смешивают с терапевтически эффективным количеством соединения по пп.1-4.
10. Способ получения соединения формулы (I-A) или (I-B) по п.1, отличающийся тем, что промежуточное соединение формулы (II) окисляют в присутствии приемлемого окислителя

где R1 имеет значения, указанные в п.1, и Q представляет собой хинолиновую или хинолиноновую часть соединения формулы (I-А) или (I-B); при желании, соединения формулы (I-A) или (I-В) преобразуют друг в друга, выполняя превращения, хорошо известные в данной области; далее, при желании, соединение формулы (I-A) или (I-B) преобразуют в терапевтически активную нетоксичную кислотно-аддитивную соль, производя обработку кислотой, или, наоборот, кислотно-аддитивную соль преобразуют в свободное основание, производя обработку щелочью; и, при желании, получают стехиометрически изомерные формы, четвертичные амины или N-оксиды указанных соединений.
11. Способ получения соединения формулы (I-A) или (I-B) по п.1, отличающийся тем, что промежуточное соединение формулы (III) подвергают взаимодействию с промежуточным соединением формулы (IV)
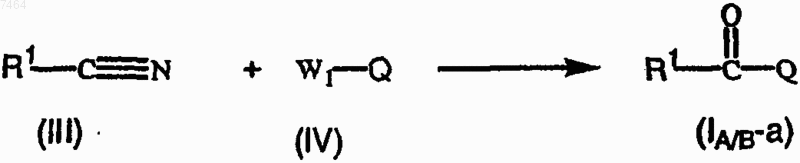
где R1 имеет значения, указанные в п.1, Q представляет собой хинолиновую или хинолиноновую часть соединения формулы (I-A) или (I-B) и W1 означает приемлемую удаляемую группу;
при желании, соединение формулы (I-A) или (I-B) преобразуют в терапевтически активную нетоксичную кислотно-аддитивную соль, производя обработку кислотой, или, наоборот, кислотно-аддитивную соль преобразуют в свободное основание, производя обработку щелочью; и, при желании, получают стехиометрически изомерные формы, четвертичные амины или N-оксиды указанных соединений.
12. Способ получения соединения формулы (I-A) или (I-B) по п.1, отличающийся тем, что промежуточное соединение формулы (V) подвергают взаимодействию с промежуточным соединением формулы (IV)
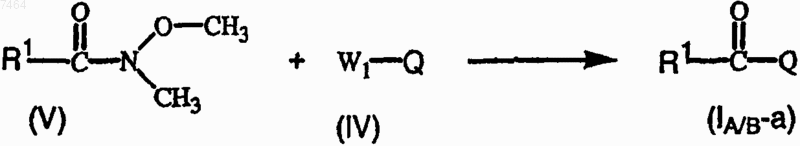
где R1 имеет значения, указанные в п.1, Q представляет собой хинолиновую или хинолиноновую часть соединения формулы (I-A) или (I-B) и W1 означает приемлемую удаляемую группу;
при желании, соединение формулы (I-A) или (I-B) преобразуют в терапевтически активную нетоксичную кислотно-аддитивную соль, производя обработку кислотой, или, наоборот, кислотно-аддитивную соль преобразуют в свободное основание, производя обработку щелочью; и, при желании, получают стехиометрически изомерные формы, четвертичные амины или N-оксиды указанных соединений.
13. Способ получения соединения формулы (I-A) или (I-B) по п.1, отличающийся тем, что промежуточное соединение формулы (VI) подвергают взаимодействию с промежуточным соединением формулы (VII) в присутствии приемлемой кислоты
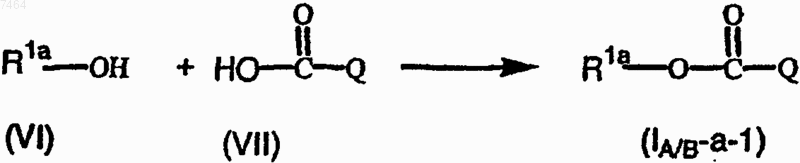
где R1a имеет значения, указанные для R1 в п.1, при условии, что R1 присоединен к карбонильной части атомом кислорода, и Q представляет собой хинолиновую или хинолиноновую часть соединения формулы (I-A) или (I-B);
при желании, соединение формулы (I-A) или (I-B) преобразуют в терапевтически активную нетоксичную кислотно-аддитивную соль, производя обработку кислотой, или, наоборот, кислотно-аддитивную соль преобразуют в свободное основание, производя обработку щелочью; и, при желании, получают стехиометрически изомерные формы, четвертичные амины или N-оксиды указанных соединений.
14. Способ получения соединения формулы (I-A) или (I-B) по п.1, отличающийся тем, промежуточное соединение формулы (VIII) подвергают воздействию приемлемой кислоты
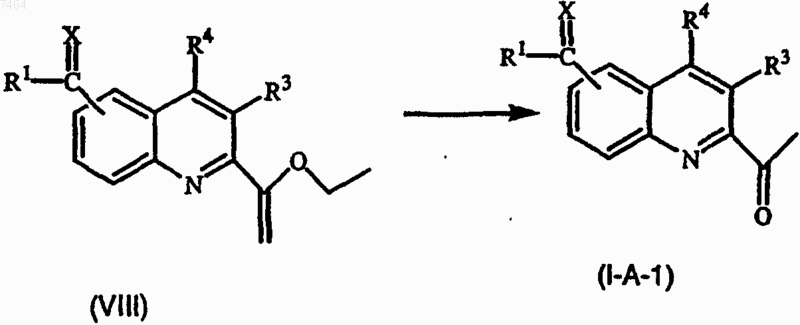
где R1, X, R3 и R4 имеют значения, указанные в п.1;
при желании, соединения формулы (I-A) или (I-B) превращают друг в друга, выполняя превращения, хорошо известные в данной области; далее, при желании, соединения формулы (I-A) или (I-B) превращают в терапевтически активную нетоксичную кислотно-аддитивную соль, производя обработку кислотой, или, наоборот, кислотно-аддитивную соль превращают в свободное основание, производя обработку щелочью; и, при желании, получают стереохимически изомерные формы, четвертичные амины или N-оксиды указанных соединений.
Текст
007464 Настоящее изобретение относится к производным хинолина и хинолинона, обладающим антагонистической активностью в отношении метаботропных рецепторов глутамата, и к способу их получения; данное изобретение далее относится к композициям, содержащим указанные вещества, а также к применению указанных производных в качестве лекарственного средства. Нейротрансмиттер глутамат считается главным возбуждающим нейротрансмиттером в центральной нервной системе млекопитающего. Связывание указанного нейротрансмиттера с метаботропными рецепторами глутамата (mGluR), которые образуют подсемейство связанных с G-белком рецепторов и включают 8 отдельных подтипов рецепторов mGluR, в частности mGluR1-mGluR8, активирует разные внутриклеточные системы вторичных мессенджеров. Рецепторы mGluR можно разделить на 3 группы с учетом гомологии аминокислотных последовательностей, системы вторичных мессенджеров, используемых рецепторами, и фармакологических характеристик. Рецепторы mGluR группы I, включающие рецепторыmGluR подтипов 1 и 5, связываются с фосфолипазой С, и их активация вызывает мобилизацию внутриклеточных ионов кальция. Рецепторы mGluR группы II (mGluR2 и 3) и рецепторы mGluR группы III(mGluR4, 6, 7 и 8) связываются с аденилциклазой, и их активация ведет к уменьшению количества вторичного мессенджера сАМР и вследствие этого к подавлению активности нейронов. Лечение антагонистами рецепторов mGluR группы I уменьшает в пресинапсе высвобождение нейротрансмиттера глутамата и снижает опосредованное глутаматом возбуждение нейронов под действием постсинаптических механизмов. Поскольку считается, что разные патофизиологические процессы и заболевания, поражающие центральную нервную систему, обусловлены возбуждением нейронов центральной нервной системы,вызываемым избытком глутамата, антагонисты рецепторов mGluR группы I могут быть терапевтически эффективными при лечении заболеваний центральной нервной системы. В заявке на патент WO 99/26927 описаны ангатонисты рецепторов mGluR группы I, предназначенные для лечения неврологических заболеваний и нарушений, которые наряду с прочими соединениями включают соединения с хинолиновой структурой. В заявке на патент WO 99/03822 описаны бициклические лиганды метаботропных рецепторов глутамата, ни один из которых не имеет хинолиновой или хинолиноновой структуры. Настоящее изобретение относится к соединениям формулы их N-оксиду, фармацевтически приемлемой аддитивной соли, четвертичному амину и стереохимически изомерной форме, гдеX представляет собой О; C(R6)2, где R6 означает водород, арил или C1-6 алкил, необязательной замещенный амино, моно- или ди(С 1-6 алкил)амино; S или N-R7, где R7 означает амино или гидрокси;C1-6 алкил, где циклоС 3-12 алкильная часть может необязательно содержать двойную связь, и один атом углерода в циклоС 3-12 алкильной части может быть замещен атомом кислорода или группой NR8, где R8 означает водород, бензил или C1-6 алкилоксикарбонил; причем один или несколько атомов водорода вC1-6 алкильной части или циклоС 3-12 алкильной части могут быть необязательно замещены C1-6 алкилом,гидроксиС 1-6 алкилом, галогенС 1-6 алкилом, аминоС 1-6 алкилом, гидрокси, C1-6 алкилокси, арилС 1-6 алкилокси, галогеном, C1-6 алкилоксикарбонилом, арилом, амино, моно- или ди(C1-6 алкил)амино, C1-6 алкилоксикарбониламино, галогеном, пиперазинилом, пиридинилом, морфолинилом, тиенилом и двухвалентным радикалом формулы -О-, -О-СН 2-O или -О-СН 2-СН 2-О-; или радикал формулы (а-1) где Z1 означает прямую ковалентную связь, О, NH или СН 2;Z2 означает прямую ковалентную связь, О, NH или СН 2;n является целым числом, равным 0, 1, 2 или 3; и каждый атом водорода в фенильном кольце может быть необязательно замещен галогеном, гидрокси, С 1-6 алкилом, С 1-6 алкилокси или гидроксиС 1-6 алкилом; либо X и R1 вместе с атомом углерода, к которому присоединены X и R1, могут образовывать радикал формулы (b-1), (b-2) или (b-3);C1-6 алкилом, C1-6 алкилоксиС 1-6 алкилом, С 1-6 алкилоксикарбонилС 1-6 алкилом или пиридинилС 1-6 алкилом; гетероцикл, выбранный из тиенила, фуранила, пирролила, тиазолила, оксазолила, имидазолила,изотиазолила, изоксазолила, пиразолила, пиридила, пиразинила, пиридазинила, пиримидинила, пиперидинила и пиперазинила, необязательно N-замещенного С 1-6 алкилоксиС 1-6 алкилом, морфолинилом, тиоморфолинилом, диоксанилом или дитианилом; радикал -NH-C(=O)R9, где R9 означает С 1-6 алкил, необязательно замещенный циклоС 3-12 алкилом,C1-6 алкилокси, C1-6 алкилоксикарбонилом, арилом, арилокси, тиенилом, пиридинилом, моно- или ди(C1-6 алкил)амино, C1-6 алкилтио, бензилтио, пиридинилтио или пиримидинилтио; циклоС 3-12 алкил; циклогексенил; амино; арилциклоС 3-12 алкиламино; моно- или ди(C1-6 алкил)амино; моно- или ди(С 1-6 алкилоксикарбонилС 1-6 алкил)амино; моно- или ди(С 1-6 алкилоксикарбонил)амино; моно- или ди(С 2-6 алкенил)амино; моно- или ди(арилС 1-6 алкил)амино; моно- или диариламино; арилС 2-6 алкенил; фуранилС 2-6 алкенил; пиперидинил; пиперазинил; индолил; фурил; бензофурил; тетрагидрофурил; инденил; адамантил; пиридинил; пиразинил; арил; арилС 1-6 алкилтио или радикал формулы (а-1); сульфонамид -NH-SO2-R10, где R10 представляет собой C1-6 алкил, моно- или полигалогенС 1-6 алкил,арилС 1-6 алкил, арилС 2-6 алкенил, арил, хинолинил, изоксазолил или ди(C1-6 алкил)амино;R3 и R4 независимо представляют собой водород; галоген; гидрокси; циано; C1-6 алкил; C1-6 алкилокси; С 1-6 алкилоксиС 1-6 алкил; C1-6 алкилкарбонил; C1-6 алкилоксикарбонил; С 2-6 алкенил; гидрокси С 2-6 алкенил; С 2-6 алкинил; гидроксиС 2-6 алкинил; три(C1-6 алкил)силанС 2-6 алкинил; амино; моно- или ди(C1-6 алкил)амино; моно- или ди(С 1-6 алкилоксиС 1-6 алкил)амино; моно- или ди(С 1-6 алкилтиоС 1-6 алкил) амино; арил; морфолинилС 1-6 алкил или пиперидинилС 1-6 алкил; либоR2 и R3, взятые вместе, могут образовывать группу -R2-R3, которая представляет собой двухвалентный радикал формулы -(СН 2)3-, -(СН 2)4-, -(СН 2)5-, -(СН 2)6-, -СН=СН-СН=СН-, -Z4-CH=CH-, -СН=СН-Z4-,-Z4-СН 2-СН 2-СН 2-, -СН 2-Z4-СН 2-СН 2-, -СН 2-СН 2-Z4-СН 2-, -СН 2-СН 2-CH2-Z4-, -Z4-CH2-CH2-, -CH2-Z4-CH2 или -CH2-CH2-Z4-, где Z4 означает О, S, SO2 или NR11, где R11 означает водород, C1-6 алкил, бензил или С 1-6 алкилоксикарбонил, причем каждый двухвалентный радикал необязательно замещен C1-6 алкилом; либо R3 и R4, взятые вместе, могут образовывать двухвалентный радикал формулы -СН=СНСН=СН- или -СН 2-СН 2-СН 2-СН 2-;R5 представляет собой водород; циклоС 3-12 алкил; пиперидинил; оксотиенил; тетрагидротиенил; арилС 1-6 алкил; C1-6 алкилоксиС 1-6 алкил; С 1-6 алкилоксикарбонилС 1-6 алкил или C1-6 алкил, необязательно замещенный радикалом C(=O)NRxRy, где Rx и Ry независимо означают водород, циклоС 3-12 алкил, С 2-6 алкинил или C1-6 алкил, необязательно замещенный циано, C1-6 алкилокси, C1-6 алкилоксикарбонилом, фуранилом, пирролидинилом, бензилтио, пиридинилом, пирролилом или тиенилом;Y представляет собой О или S; либо Y и R5, взятые вместе, могут образовывать группу =Y-R5-, которая является радикалом формулы-N-CH=CH(с-3); арил представляет собой фенил или нафтил, необязательно замещенный одним или несколькими заместителями, выбираемыми из группы, включающей галоген, гидрокси, C1-6 алкил, C1-6 алкилокси, фенилокси, нитро, амино, тио, C1-6 алкилтио, галогенС 1-6 алкил, полигалогенС 1-6 алкил, полигалогенС 1-6 алкилокси,гидроксиС 1-6 алкил, С 1-6 алкилоксиС 1-6 алкил, аминоС 1-6 алкил, моно- или ди(С 1-6 алкил)амино; моно- или ди(C1-6 алкил)аминоС 1-6 алкил, циано, -СО-R12, -CO-OR13, -NR13SO2R12, -SO2-NR13R14, -NR13C(О)R12, -С(O)NR13R14,-SOR12, -SO2R12, где каждый R12, R13 и R14 независимо означают C1-6 алкил; циклоС 3-6 алкил; фенил; фенил,замещенный галогеном, гидрокси, C1-6 алкилом, C1-6 алкилокси, галогенС 1-6 алкилом, полигалогенС 1-6 алкилом, фуранилом, тиенилом, пирролилом, имидазолилом, тиазолилом или оксазолилом; и когда часть R1-C(=X) присоединена не в положении 7 или 8, а в другом положении, тогда атомы в указанных положениях 7 и 8 могут быть замещены R15 и R16, где один или оба R15 и R16 означают C1-6 алкил, C1-6 алкилокси либо R15 и R16, вместе взятые, могут образовывать двухвалентный радикал формулы-СН=СН-СН=СН-. В приведенных выше и ниже определениях термин "C1-6 алкил", обозначающий группу или часть группы, представляет собой насыщенные углеводородные радикалы с прямой и разветвленной цепью,-2 007464 имеющие от 1 до 6 атомов углерода, такие как, например, метил, этил, пропил, бутил, пентил или гексил; термин "С 2-6 алкенил", обозначающий группу или часть группы, представляет собой углеводородные радикалы с прямой и разветвленной цепью, имеющие от 2 до 6 атомов углерода и двойную связь, такие как этенил, пропенил, бутенил, пентенил, гексенил, 3-метилбутенил и тому подобные; термин "С 2-6 алкинил",обозначающий группу или часть группы, представляет собой углеводородные радикалы с прямой или разветвленной цепью, имеющие от 2 до 6 атомов углерода и тройную связь, такие как этинил, пропинил,бутинил, пентинил, гексинил, 3-метилбутинил и тому подобные; термин "циклоС 3-6 алкил" означает моноциклические алкильные кольцевые структуры, такие как циклопропил, циклобутил, циклопентил и циклогексил; термин "циклоС 3-12 алкил" означает моно-, би- или трициклические алкильные кольцевые структуры и является общим, например, для циклопропила, циклобутила, циклопентила, циклогексила,циклогептила, циклооктила, норборнанила, адамантила. Термин "галоген" является общим для фтора, хлора, брома и иода. В приведенных выше и ниже определениях термин "полигалогенС 1-6 алкил", обозначающий группу или часть группы, представляет собой моно- или полигалогензамещенный C1-6 алкил, в частности метил с одним или несколькими атомами фтора, например дифторметил или трифторметил. В случае присоединения к алкильной группе нескольких атомов галогенов в пределах определения полигалогенС 1-6 алкила указанные атомы могут иметь одинаковые или разные значения. Когда любая переменная группа, например, арил, встречается в любой структуре несколько раз, каждое определение такой группы является независимым. Изображение любой связи в кольцевой структуре означает, что соответствующий заместитель может быть присоединен к любому атому указанной кольцевой структуры. Например, это означает, что часть R1-C(=X) может быть присоединена к хинолиновой или хинолиноновой части в положении 5, 6, 7,8, а также в положении 3 или положении 4. Для терапевтичевского применения пригодны соли соединений формулы (I-A) и (I-B), содержащие фармацевтически приемлемый противоион. Однако фармацевтически неприемлемые соли кислот и оснований могут также найти применение, например, в процессе получения или очистки фармацевтически приемлемого соединения. Все соли как фармацевтически приемлемые, так и неприемлемые, входят в объем настоящего изобретения. Вышеуказанные фармацевтически приемлемые аддитивные соли включают терапевтичевски активные нетоксичные кислотно-аддитивные соли, которые могут образовывать соединения формулы (I-A) и(I-B). Указанные соли можно получить, обрабатывая основание соответствующими кислотами, такими как неорганические кислоты, например галогенводородные кислоты, в частности хлористо-водородная,бромисто-водородная и подобные кислоты; серная кислота; азотная кислота; фосфорная кислота и тому подобные; или органические кислоты, например уксусная, пропановая, гидроксиуксусная, 2-гидроксипропановая, 2-оксопропановая, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная,2-гидрокси-1,2,3-пропантрикарбоновая, метансульфоновая, этансульфоновая, бензолсульфоновая, 4-метилбензолсульфоновая, циклогексансульфаминовая, 2-гидроксибензойная, 4-амино-2-гидроксибензойная и подобные кислоты. Соль можно преобразовать в свободное основание, производя обработку щелочью. Соединения формулы (I-A) и (I-B), содержащие кислотные протоны, можно преобразовать в терапевтически активные нетоксичные аддитивные соли металла или амина, производя обработку соответствующими органическими или неорганическими основаниями. Приемлемые соли основания включают,например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия,калия, магния, кальция и тому подобные, соли с органическими основаниями, например первичными,вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, бензатин, N-метилD-глюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол, соли гидрабамина и соли с аминокислотами,такими как, например, аргинин, лизин и тому подобные. Соль можно преобразовать в свободную кислоту, производя обработку кислотой. Термин "аддитивная соль" означает также гидраты и аддитивные продукты растворителя, которые могут образовывать соединения формулы (I-A) и (I-B). Примерами таких соединений являются, например, гидраты, алкоголяты и тому подобные. Термин "четвертичный амин" в приведенном выше определении означает соли четвертичного аммония, которые могут образовывать соединения формулы (I-A) и (I-B) в результате взаимодействия между основным атомом азота соединения формулы (I-A) и (I-B) и соответствующим кватернизующим агентом, таким как, например, необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, например, метилиодид или бензилиодид. Можно также использовать другие реагенты с приемлемыми удаляемыми группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин имеет положительно заряженный атом азота. Фармацевтически приемлемые противоионы включают хлор, бром, иод, трифторацетат и ацетат. Выбранный про-3 007464 тивоион можно ввести при помощи ионообменных смол. Следует отметить, что некоторые соединения формулы (I-A) и (I-B), их N-оксиды, соли, четвертичные амины и стереохимически изомерные формы могут иметь один или несколько центров хиральности и существовать в виде стереохимически изомерных форм. Термин "стереохимически изомерные формы" в приведенном выше определении означает все возможные стереоизомерные формы, которые могут иметь соединения формулы (I-A) и (I-B), их N-оксиды,соли, четвертичные амины или физиологически функциональные производные. За исключением особо оговоренных случаев химическое название соединений означает смесь всех возможных стереоизомерных форм, причем указанные смеси включают все диастереомеры и энантиомеры основной молекулярной структуры, а также по существу свободные отдельные изомерные формы соединений формулы (I-A) и (IB), их N-оксидов, солей, сольватов или четвертичных аминов, т.е. ассоциированных менее чем с 10%,предпочтительно менее чем с 5%, предпочтительнее менее чем с 2% и наиболее предпочтительно менее чем с 1% других изомеров. Все стереохимически изомерные формы соединений формулы (I-A) и (I-B) входят в объем настоящего изобретения. То же самое относится к описанным промежуточным соединениям, используемым для получения конечных продуктов формулы (I-A) и (I-B). Термины "цис" и "транс" использованы в данном описании изобретения в соответствии с химической номенклатурой, приведенной в "Chemical Abstracts". У некоторых соединений формулы (I-A) и (I-B) и промежуточных соединений, используемых для их получения, не определена абсолютная стереохимическая конфигурация. В таким случаях первая выделенная стереоизомерная форма обозначена как "А" и вторая форма обозначена как "В" без дальнейшей ссылки на действительную стереохимическую конфигурацию. Однако указанные стереоизомерные формы "А" и "В" можно совершенно точно охарактеризовать на основании физико-химических свойств, в частности, оптическое вращение в случае "А" и "В" отражает энантиомерную взаимосвязь. Специалист в данной области может определить абсолютную конфигурацию таких соединений при помощи известных методов, таких как, например, дифракция рентгеновских лучей. Если "А" и "В" представляют собой смеси стереоизомеров, их можно разделить, при этом первые выделенные фракции обозначают "А 1" и "В 1" и вторые фракции обозначают "А 2" и "В 2" без дальнейшей ссылки на действительную стереохимическую конфигурацию.N-оксиды соединений по настоящему изобретению представляют собой соединения формулы (I-A) и (I-B), в которых один или несколько атомов азота окислены в так называемый N-оксид. Некоторые соединения формулы (I-A) и (I-B) могут также существовать в таутомерной форме. Такие формы, хотя и не нашли точного отображения в приведенной выше формуле, также входят в объем настоящего изобретения. В приведенном ниже определении термин "соединения формулы (I-A) и (I-B)" также включает ихN-оксиды, соли, четвертичные амины и стереохимически изомерные формы. Особый интерес представляют собой стереохимически чистые соединения формулы (I-А) и (I-B). Интересную группу соединений составляют соединения формулы (I-A) и (I-B), в которыхX представляет собой О; C(R6)2, где R6 означает водород или арил; или N-R7, где R7 означает амино или гидрокси;C1-6 алкил, где циклоС 3-12 алкильная часть может необязательно содержать двойную связь, и один атом углерода в циклоС 3-12 алкильной части может быть замещен атомом кислорода или группой NR8, где R8 означает бензил или C1-6 алкилоксикарбонил; причем один или несколько атомов водорода в C1-6 алкильной части или циклоС 3-12 алкильной части могут быть необязательно замещены C1-6 алкилом, галогенС 1-6 алкилом, гидрокси, C1-6 алкилокси, арилС 1-6 алкилокси, галогеном, арилом, моно- или ди(С 1-6 алкил)амино, C1-6 алкилоксикарбониламино, галогеном, пиперазинилом, пиридинилом, морфолинилом,тиенилом и двухвалентным радикалом формулы -О- или -О-СН 2-СН 2-О-; или радикал формулы (а-1) где Z1 означает прямую ковалентную связь, О или СН 2;Z2 означает прямую ковалентную связь, О или СН 2;n является целым числом, равным 0, 1 или 2; и каждый атом водорода в фенильном кольце может быть необязательно замещен галогеном или гидрокси; либо X и R1 вместе с атомом углерода, к которому присоединены X и R1, могут образовывать радикал формулы (b-1), (b-2) или (b-3);R2 представляет собой водород; галоген; циано; C1-6 алкил; C1-6 алкилокси; C1-6 алкилтио; С 1-6 алкилкарбонил; C1-6 алкилоксикарбонил; С 2-6 алкенил; гидроксиС 2-6 алкенил; С 2-6 алкинил; гидроксиС 2-6 алкинил; три(C1-6 алкил)силанС 2-6 алкинил; амино; моно- или ди(С 1-6 алкил)амино; моно- или ди(С 1-6 алкилоксиС 1-6 алкил)амино; моно- или ди(С 1-6 алкилтиоС 1-6 алкил)амино; арил; арилС 1-6 алкил; арилС 2-6 алкинил; С 1-6 алкилоксиС 1-6 алкиламиноС 1-6 алкил; аминокарбонил, необязательно замещенный C1-6 алкилоксикарбонилС 1-6 алкилом; гетероцикл, выбранный из тиенила, фуранила, тиазолила и пиперидинила, необязательно Nзамещенного морфолинилом или тиоморфолинилом; радикал -NH-C(=O)R9, где R9 означает C1-6 алкил, необязательно замещенный циклоС 3-12 алкилом, C1-6 алкилокси, C1-6 алкилоксикарбонилом, арилом, арилокси, тиенилом, пиридинилом, моно- или ди(C1-6 алкил)амино, C1-6 алкилтио, бензилтио, пиридинилтио или пиримидинилтио; циклоС 3-12 алкил; циклогексенил; амино; арилциклоС 3-12 алкиламино; моно- или ди(C1-6 алкил)амино; моно- или ди(С 1-6 алкилоксикарбонилС 1-6 алкил)амино; моно- или ди(С 1-6 алкилоксикарбонил)амино; моно- или ди(С 2-6 алкенил)амино; моно- или ди(арилС 1-6 алкил)амино; моно- или диариламино; арилС 2-6 алкенил; фуранилС 2-6 алкенил; пиперидинил; пиперазинил; индолил; фурил; бензофурил; тетрагидрофурил; инденил; адамантил; пиридинил; пиразинил; арил или радикал формулы (а-1); сульфонамид -NH-SO2-R10, где R10 представляет собой C1-6 алкил, моно- или полигалогенС 1-6 алкил,арилС 1-6 алкил или арил;R3 и R4 независимо представляют собой водород; C1-6 алкил; C1-6 алкилоксиС 1-6 алкил; C1-6 алкилоксикарбонил; либоR2 и R3, взятые вместе, могут образовывать группу -R2-R3, которая представляет двухвалентный радикал формулы -(СН 2)4-, (СН 2)5-, -Z4-CH=CH-, -Z4-CH2-CH2-CH2- или -Z4-CH2-CH2-, где Z4 означает О, S,SО 2 или NR11, где R11 означает водород, С 1-6 алкил, бензил или C1-6 алкилоксикарбонил, причем каждый двухвалентный радикал необязательно замещен С 1-6 алкилом; либо R3 и R4, взятые вместе, могут образовывать двухвалентный радикал формулы -СН=СНСН=СН- или -СН 2-СН 2-СН 2-СН 2-;R5 представляет собой водород; пиперидинил; оксотиенил; тетрагидротиенил; арилС 1-6 алкил; С 1-6 алкилоксикарбонилС 1-6 алкил или С 1-6 алкил, необязательно замещенный радикалом C(=O)NRxRy, где Rx иY представляет собой О или S; либо Y и R5, взятые вместе, могут образовывать группу =Y-R5-, которая является радикалом формулы(с-2); арил представляет собой фенил или нафтил, необязательно замещенный одним или несколькими заместителями, выбираемыми из галогена, C1-6 алкилокси, фенилокси, моно- или ди(С 1-6 алкил)амино и циано; и когда часть R1-C(=X) присоединена не в положении 7 или 8, а в другом положении, тогда атомы в указанных положениях 7 и 8 могут быть замещены R15 и R16, где один или оба R15 и R16 означают C1-6 алкил либо R15 и R16, вместе взятые, могут образовывать двухвалентный радикал формулы -СН=СНСН=СН-. Другую наиболее интересную группу соединений составляют соединения формулы (I-A) и (I-B), в которых X представляет собой О;R1 представляет собой С 1-6 алкил; циклоС 3-12 алкил или (циклоС 3-12 алкил)C1-6 алкил, где один или несколько атомов водорода в С 1-6 алкильной части или циклоС 3-12 алкильной части могут быть необязательно замещены C1-6 алкилокси, арилом, галогеном или тиенилом;R3 и R4 независимо представляют собой водород или C1-6 алкил; либоR2 и R3, взятые вместе, могут образовывать группу -R2-R3-, которая является двухвалентным радикалом формулы -Z4-СН 2-СН 2-СН 2- или -Z4-CH2-CH2-, где Z4 означает О или NR11, где R11 означает C1-6 алкил, причем каждый двухвалентный радикал необязательно замещен C1-6 алкилом; либо R3 и R4, взятые вместе, могут образовывать двухвалентный радикал формулы -СН 2-СН 2-СН 2-СН 2-;Y представляет собой О; и арил представляет собой фенил, необязательно замещенный галогеном.-5 007464 Еще одну интересную группу соединений составляют соединения формулы (I-A) и (I-B), в которых часть R1-C(=X) присоединена к хинолиновой или хинолиноновой части в положении 6. Чтобы упростить структурное представление некоторых соединений по настоящему изобретению и промежуточных соединений, используемых в описанных ниже способах получения, хинолиновая или хинолиноновая часть далее будет обозначена символом Q. Соединения формулы (I-A) и (I-B), выраженные формулой (IА/В-а), в которых X представляет собой О, можно получить окислением промежуточного соединения формулы (II) в присутствии приемлемого окислителя, такого как перманганат калия, и приемлемого межфазного катализатора, такого как трис(диокса-3,6-гептил)амин, в приемлемом реакционно-инертном растворителе, таком как, например,дихлорметан. Соединения формулы (IА/B-а) можно также получить в результате взаимодействия промежуточного соединения формулы (III) с промежуточным соединением формулы (IV), где W1 представляет собой атом галогена, например, брома, в присутствии бутиллития и приемлемого реакционно-инертного растворителя, такого как, например, тетрагидрофуран. Альтернативно соединения формулы (IА/B-а) можно также получить в результате взаимодействия промежуточного соединения (V) с промежуточным соединением формулы (IV) в присутствии бутиллития и приемлемого реакционно-инертного растворителя, такого как, например, тетрагидрофуран. Соединения формулы (IА/B-а), выраженные формулой (IА/B-а-1), в которых заместитель R1 присоединен к карбонильной части атомом кислорода и представляет собой O-R1a, можно получить в результате взаимодействия промежуточного соединения формулы (VI) с промежуточным соединением формулы(VII) в присутствии приемлемой кислоты, такой как серная кислота. Соединения формулы (I-A), выраженные формулой (I-A-1), в которых R2 представляет собой метилкарбонил, можно получить в результате взаимодействия промежуточного соединения формулы (VIII) в присутствии приемлемой кислоты, такой как хлористо-водородная кислота, и приемлемого реакционно-инертного растворителя, такого как, например, тетрагидрофуран. Соединения формулы (I) можно также преобразовать друг в друга, выполняя превращения, известные в данной области. Соединения формулы (I-A), в которых R2 означает атом галогена, такой как атом хлора, можно преобразовать в соединение формулы (I-A), где R2 является атомом другого галогена, такого как фтор или иод, в результате взаимодействия с приемлемым галогенирующим агентом, таким как, например, фторид калия или иодид натрия, в присутствии приемлемого реакционно-инертного растворителя, например,диметилсульфоксида или ацетонитрила, и необязательно в присутствии ацетилхлорида. Соединения формулы (I-A), выраженные формулой (I-A-2), в которых R2 представляет собой при-6 007464 емлемую удаляемую группу, такую как атом галогена, например хлора или иода, обозначенную символом W2, можно преобразовать в соединение формулы (I-A), выраженное формулой (I-A-3), в котором R2 означает циано, в результате взаимодействия с приемлемым вводящим цианогруппу агентом, таким как,например, триметилсиланкарбонитрил, в присутствии приемлемого основания, такого как N,N-диэтилэтанамин, и приемлемого катализатора, такого как, например, тетракис(трифенилфосфин)палладий. Соединения формулы (I-A-2) можно также преобразовать в соединение формулы (I-A-4) в результате взаимодействия с С 2-6 алкинилтри(C1-6 алкил)силаном в присутствии CuI, приемлемого основания, такого как, например, N,N-диэтилэтанамин, и приемлемого катализатора, такого как, например, тетракис(трифенилфосфин)палладий. Соединения формулы (I-A-4) можно, в свою очередь, преобразовать в соединение формулы (I-A-5) в результате взаимодействия с фторидом калия в присутствии приемлемой кислоты, такой как уксусная кислота, или в результате взаимодействия с приемлемым основанием, таким как гидроксид калия, в присутствии приемлемого реакционно-инертного растворителя, такого как спирт,например метанол и тому подобные. Соединения формулы (I-A-2) можно также преобразовать в соединение формулы (I-A-6) в результате взаимодействия с промежуточным соединением формулы (IX) в присутствии CuI, приемлемого основания, такого как, например, N,N-диэтилэтанамин, и приемлемого катализатора, такого как тетракис(трифенилфосфин)палладий. Соединения формулы (I-A-2) можно также преобразовать в соединение, выраженное формулой (IA-8), в котором R2 представляет собой C1-6 алкил, в присутствии приемлемого алкилирующего агента,такого как, например, Sn(C1-6 алкил)4, или в соединение, выраженное формулой (I-A-9), в котором R2 представляет собой С 2-6 алкенил, в присутствии приемлемого алкенилирующего агента, такого как, например Sn(С 2-6 алкенил)(C1-6 алкил)3, причем обе реакции выполняют в присутствии приемлемого катализатора, такого как, например, тетракис(трифенилфосфин)палладий, и реакционно-инертного растворителя, такого как, например, толуол или диоксан. Соединения формулы (I-A-2) можно также преобразовать в соединение формулы (I-A-7), где Z означает О или S, в результате взаимодействия с промежуточным соединением формулы (X) необязательно в присутствии приемлемого основания, такого как дикалийкарбонат, и реакционно-инертного растворителя, такого как N,N-диметилформамид. Соединения формулы (I-A-2) можно также преобразовать в соединение формулы (I-A), выраженное формулой (I-A-10), в котором R2 представляет собой C1-6 алкилоксикарбонил, и в соединение формулы (IA), выраженное формулой (I-A-11), в котором R2 представляет собой водород, в результате взаимодействия с приемлемым спиртом формулы C1-6 алкилОН и СО в присутствии приемлемого катализатора, такого как, например, ацетат палладия(II), трифенилфосфин, приемлемого основания, такого как дикалийкарбонат, и реакционно-инертного растворителя, такого как N,N-диметилформамид. Соединения формулы (I-A-11) можно также получить в результате взаимодействия соединения формулы (I-A-2) с Zn в присутствии приемлемой кислоты, такой как уксусная кислота. Соединения формулы (I-A-2) можно также преобразовать в соединение формулы (I-A), выраженное формулой (I-A-12), в котором R2 представляет собой аминокарбонил, замещенный C1-6 алкилоксикарбонилС 1-6 алкилом, в результате взаимодействия с промежуточным соединением формулы Н 2NС 1-6 алкил-С(=O)-O-C1-6 алкил в присутствии СО, приемлемого катализатора, такого как тетракис(трифенилфосфин)палладий, приемлемого основания, такого как, например, N,N-диэтилэтанамин, и приемлемого реакционно-инертного растворителя, такого как, например, толуол. Соединения формулы (I-A-2) можно также преобразовать в соединение формулы (I-A), выраженное формулой (I-A-13), в котором R2 представляет собой арил или гетероцикл, выбранный из группы, приведенной выше в определении R2, и обозначен символом R2a, в результате взаимодействия с промежуточным соединением формулы (XI), (XII) или (XIII) в присутствии приемлемого катализатора, такого как,например, тетракис(трифенилфосфин)палладий, и приемлемого реакционно-инертного ратворителя, такого как, например, диоксан. Соединения формулы (I-A-2) можно также преобразовать в соединение формулы (I-B), выраженное формулой (I-B-1) или (I-B-2), в котором Y и R5, вместе взятые, образуют радикал формулы (b-1) или (b2), в результате взаимодействия с гидразинкарбоксальдегидом или азидом натрия в приемлемом реакци-8 007464 онно-инертном растворителе, таком как спирт, например бутанол или N,N-диметилформамид. Соединения формулы (I-A-11) можно преобразовать в соответствующий N-оксид, выраженный формулой (I-A-14), в результате взаимодействия с приемлемым пероксидом, таким как 3-хлорбензолкарбопероксовая кислота, в приемлемом реакционно-инертном растворителе, таком как, например, метиленхлорид. Указанное соединение формулы (I-A-14) можно далее преобразовать в соединение формулы (I-B),выраженное формулой (I-B-3), в котором R5 представляет собой водород, в результате взаимодействия с 4-метилбензолсульфонилхлоридом в присутствии приемлемого основания, такого как, например, дикалийкарбонат, и приемлемого реакционно-инертного растворителя, такого как, например, метиленхлорид. Соединения формулы (I-B-3) можно также получить из соединения формулы (I-A), выраженного формулой (I-A-15), в котором R2 представляет собой C1-6 алкилокси, в результате взаимодействия с приемлемой кислотой, такой как хлористо-водородная кислота, в присутствии приемлемого реакционноинертного растворителя, такого как, например, тетрагидрофуран. Соединения формулы (I-B-3) можно преобразовать в соединение формулы (I-B), выраженное формулой (I-B-4), в котором R5 представляет собой C1-6 алкил, в результате взаимодействия с соответствующим алкилирующим агентом, таким как, например, промежуточное соединение формулы (XIV), в котором W3 означает приемлемую удаляемую группу, такую как атом галогена, например иода, в присутствии трет-бутоксида калия и приемлемого реакционно-инертного растворителя, такого как, например, тетрагидрофуран. Соединения формулы (I-B-3) можно также преобразовать в соединение формулы (I-B), выраженное-9 007464 формулой (I-B-5), в котором R5 представляет собой C1-6 алкилоксикарбонилС 1-6 алкил или арилС 1-6 алкил и обозначен символом R5a, в результате взаимодействия с промежуточным соединением формулы (XV),где W4 представляет собой приемлемую удаляемую группу, такую как атом галогена, например, брома,хлора и тому подобного, в присутствии приемлемого основания, такого как, например, гидрид натрия, и приемлемого реакционно-инертного растворителя, такого как, например, N,N-диметилформамид. Соединения формулы (I-A-2) можно также преобразовать в соединение формулы (I-B), выраженное формулой (I-B-6), в котором R5 означает водород и Y означает S, в результате взаимодействия с H2NC(=S)-NH2 в присутствии приемлемого основания, такого как гидроксид калия, и приемлемого реакционно-инертного растворителя, такого как спирт, например, этанол, или вода. Соединения формулы (I-B6) можно далее преобразовать в соединение формулы (I-A), выраженное формулой (I-A-16), в котором R2 означает C1-6 алкилтио, в результате взаимодействия с приемлемым C1-6 алкилгалогенидом, таким как,например, C1-6 алкилиодид, в присутствии приемлемого основания, такого как дикалийкарбонат, и приемлемого растворителя, такого как, например, ацетон. Соединения формулы (IА/B-а) можно преобразовать в соединение формулы (I-A) или (I-B), выраженное формулой (IA/B-b), в котором X означает N-R7, в результате взаимодействия с промежуточным соединением формулы (XVI) необязательно в присутствии приемлемого основания такого как, например,N,N-диэтилэтанамин, и в присутствии приемлемого реакционно-инертного растворителя, такого как спирт, например этанол. Как уже было указано в способе получения вышеописанных соединений формулы (I-A-13), соединения формулы (I) можно также преобразовать в соответствующие N-оксиды хорошо известными способами превращения трехвалентного азота в его N-оксид. Указанную реакцию N-окисления обычно выполняют в результате взаимодействия исходного вещества формулы (I) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать перкислоты, такие как, например, бензолкарбопероксовая кислота или галогензамещенная бензолкарбопероксовая кислота, например, 3-хлорбензолкарбопероксовая кислота, пероксоалкановые кислоты, например пероксоуксусная кислота, алкилгидропероксиды, например, трет-бутилгидропероксид. Приемлемыми растворителями являются, например, вода, низшие алканолы, например этанол и тому подобные, углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Некоторые промежуточные соединения и исходные вещества, используемые в описанных выше реакциях, можно приобрести коммерческим путем или синтезировать способами, описанными в научной литературе. Промежуточные соединения формулы (II) можно получить в результате взаимодействия промежуточного соединения формулы (XVII) с промежуточным соединением формулы (XVIII), в котором W5 представляет собой приемлемую удаляемую группу, такую как атом галогена, например, хлора, брома и тому подобного, в присутствии магния, диэтилового эфира и приемлемого реакционно-инертного растворителя, такого как диэтиловый эфир. Промежуточные соединения формулы (XVII) можно получить окислением промежуточного соединения формулы (XIX) в присутствии приемлемого окислителя, такого как МnО 2, и приемлемого реакционно-инертного растворителя, такого как метиленхлорид. Промежуточные соединения формулы (XIX) можно получить восстановлением промежуточного соединения формулы (XX) в присутствии приемлемого восстановителя, такого как алюмогидрид лития,и приемлемого реакционно-инертного растворителя, такого как тетрагидрофуран. Промежуточные соединения формулы (XX), выраженные формулой (ХХ-а), в которых Q представляет собой хинолиновую часть, необязательно замещенную в положении 3 С 1-6 алкилом, и карбонильная часть находится в положении 6, можно получить в результате взаимодействия промежуточного соединения формулы (XXI) с промежуточным соединением формулы (XXII) в присутствии 3-нитробензолсульфоната натрия, приемлемой кислоты, такой как серная кислота, и приемлемого спирта, например метанола, этанола, пропанола, бутанола и тому подобного. Альтернативно промежуточные соединения формулы (II) можно также получить в результате взаимодействия промежуточного соединения формулы (XXIII) с промежуточным соединением формулы(XXIV), в котором W6 означает приемлемую удаляемую группу, такую как атом галогена, например брома, хлора и тому подобного, в присутствии приемлемого агента, такого как бутиллитий, и приемлемого реакционно-инертного растворителя, такого как тетрагидрофуран. Промежуточные соединения формулы (XXIII) можно получить окислением промежуточного соединения формулы (XXV) по методу Моффетта-Пфициера или Сверна (использование аддуктов диметилсульфоксида с осушителями, например, DCC, Ac2O, SO3, P4O10, СOСl2 или Сl-СO-СOСl) в инертном растворителе, таком как метиленхлорид. Промежуточные соединения формулы (XXV) можно получить восстановлением промежуточного соединения формулы (XXVI) в присутствии приемлемого восстановителя, такого как, например, алюмогидрид лития, и приемлемого реакционно-инертного растворителя, такого как бензол. Промежуточные соединения формулы (XXVI) можно получить из промежуточного соединения формулы (XXVII) этерификацией в присутствии приемлемого спирта, такого как метанол, этанол, пропанол, бутанол и тому подобные, и приемлемой кислоты, такой как серная кислота.- 11007464 Промежуточные соединения формулы (XXVII), выраженные формулой (XXVII-a), в которых R1 представляет собой радикал формулы (а-1), где Z1 означает О, Z2 означает СН 2 и n равно 1, можно получить восстановлением промежуточного соединения формулы (XXVIII) в присутствии приемлемого восстановителя, такого как водород, приемлемого катализатора, такого как палладий на угле, и приемлемой кислоты, такой как уксусная кислота. Когда R1 в промежуточном соединении формулы (XXVII) представляет собой необязательно замещенную фенильную часть, указанный радикал можно также преобразовать в необязательно замещенную циклогексильную часть восстановлением в присутствии приемлемого восстановителя, такого родий на Al2O3, и приемлемого реакционно-инертного растворителя, такого как тетрагидрофуран. Промежуточные соединения формулы (IV), выраженные формулой (IV-a), в которых Q представляет собой хинолиновую часть, замещенную в положении 2 галогеном, например, хлором, можно получить в результате взаимодействия промежуточного соединения формулы (IV), выраженного формулой (IV-b),в котором Q представляет собой хинолиноновую часть и R5 означает водород, в присутствии POCl3. Промежуточные соединения формулы (IV-a), выраженные формулой (IV-a-1), в которых R4 означает водород, можно также получить в результате взаимодействия промежуточного соединения формулы Промежуточные соединения формулы (XXIX) можно получить в результате взаимодействия промежуточного соединения формулы (XXX) с промежуточным соединением формулы (XXXI), в которомW7 представляет собой приемлемую удаляемую группу, такую как атом галогена, например, хлора, в присутствии приемлемого основания, такого как, например, N,N-диэтилэтанамин, и приемлемого реакционно-инертного растворителя, такого как метиленхлорид. Промежуточные соединения формулы (IV-a) можно преобразовать в промежуточное соединение формулы (IV-c) в результате взаимодействия с промежуточным соединением формулы (XXXII) в присутствии приемлемого реакционно-инертного растворителя, такого как спирт, например метанол и тому подобный. Промежуточные соединения формулы (IV-a) можно также преобразовать в промежуточное соединение формулы (IV-d-1) в результате взаимодействия с приемлемым амином формулы (XXXIII-а) , где Z3 и Z4 независимо означают водород, C1-6 алкил, C1-6 алкилоксиС 1-6 алкил, C1-6 алкилтиоС 1-6 алкил, или в промежуточное соединение формулы (IV-d-2) в результате взаимодействия с приемлемым амином формулы(XXXIII-b) , где Z3 и Z4, вместе взятые, образуют гетероцикл, указанный выше в определении R2, при условии, что данный гетероцикл содержит по крайней мере один атом азота, в присутствии приемлемого основания, такого как, например, дикалийкарбонат, и реакционно-инертного растворителя, такого как Промежуточные соединения формулы (IV-a), выраженные формулой (IV-a-2), в которых R3 представляет собой СН 2-СН 2-СН 2-Сl, можно также преобразовать в промежуточное соединение формулы(IV), выраженное формулой (IV-e-1), в котором R2 и R3, вместе взятые, образуют двухвалентный радикал формулы -O-СН 2-СН 2-СН 2-, в результате взаимодействия с приемлемой кислотой, такой как хлористоводородная кислота или тому подобная. Промежуточные соединения формулы (IV-a-2) можно также преобразовать в промежуточное соединение формулы (IV), выраженное формулой (IV-е-2), в котором R2 и R3, вместе взятые, образуют двухвалентный радикал формулы -S-CH2-CH2-CH2-, в результате взаимодействия с H2N-C(=S)-NH2 в присутствии приемлемого реакционно-инертного растворителя, такого как спирт, например этанол. Промежуточные соединения формулы (V) можно получить в результате взаимодействия промежуточного соединения формулы (XXVII) с промежуточным соединением формулы CH3-NH-O-CH3 в присутствии 1,1'-карбонилдиимидазола и приемлемого реакционно-инертного растворителя, такого как метиленхлорид. Промежуточные соединения формулы (VII), выраженные формулой (VII-а), в которых Q представляет собой хинолиновую часть, в частности хинолиновую часть, где R2 означает этил, R3 означает метил и R4 означает водород и карбоксильная часть находится в положении 6, можно получить в результате взаимодействия промежуточного соединения формулы (XXXIV) в присутствии приемлемого альдегида,такого как СН 3-СН 2-СН(=O), (СН 2 О)n, ZnCl2, FeCl3, и приемлемого реакционно-инертного растворителя,такого как спирт, например этанол. Промежуточные соединения формулы (VIII) можно получить в результате взаимодействия проме- 13007464 жуточного соединения формулы (XXXV) с промежуточным соединением формулы (XXXVI) в присутствии приемлемого катализатора, такого как, например, тетракис(трифенилфосфин)палладий, и приемлемого реакционно-инертного растворителя, такого как, например, диоксан. Можно разработать и другие способы получения, некоторые из которых описаны далее в данной заявке в виде примеров. Чистые стереоизомерные формы целевых и промежуточных соединений по данному изобретению можно получить хорошо известными способами. Диастереомеры можно разделить физическими методами разделения, такими как селективная кристаллизация и хроматографические методы, например жидкостная хроматография с использованием хиральных стационарных фаз. Энантиомеры можно отделить друг от друга селективной кристаллизацией их диастереомерных солей оптически активными кислотами. Альтернативно энантиомеры можно разделить хроматографическими методами с использованием хиральных стационарных фаз. Указанные чистые стереоизомерные формы можно также выделить из соответствующих чистых стереоизомерных форм исходных веществ при условии выполнения стереоселективной или стереоспецифической реакции. При необходимости получения конкретного стереоизомера указанное соединение предпочтительно синтезируют стереоселективными или стереоспецифическими методами получения. При выполнении указанных способов используют хирально чистые исходные вещества. Стереоизомерные формы соединений формулы (I) входят в объем настоящего изобретения. Стереоизомер соединения формулы (I-A) или (I-B), в частности, цис-форму можно преобразовать в другой стереоизомер, например в соответствующую транс-форму в результате взаимодействия данного соединения с приемлемой кислотой, такой как хлористо-водородная кислота, в присутствии приемлемого реакционно-инертного растворителя, такого как, например, тетрагидрофуран. Соединения формулы (I-A) и (I-B), их N-оксиды, фармацевтически приемлемые аддитивные соли,четвертичные амины и стереохимически изомерные формы проявляют антагонистическую активность в отношении рецепторов mGluR, особенно в отношении mGluR группы I. Рецепторы mGluR группы I, подвергающиеся антагонистическому воздействию соединений по настоящему изобретению, являются рецепторами mGluR1. Антагонистическую активность соединений по настоящему изобретению в отношении mGluR1 можно продемонстрировать при помощи испытаний, позволяющих определить трансдукцию сигналов рецепторами mGluR1 клонированных крыс в клетках яичника китайского хомячка (СНО) и рефлекторную реакцию при охлаждении у крыс с лигированием Беннета, как это описано ниже. Благодаря антагонистической активности в отношении рецепторов mGluR, в частности антагонистической активности в отношении mGluR группы I и более конкретно антагонистической активности в отношении mGluR1, соединения формулы (I-A) или (I-В), их N-оксиды, фармацевтически приемлемые аддитивные соли, четвертичные амины и стереохимически изомерные формы пригодны для лечения или профилактики вызываемых глутаматом заболеваний центральной нервной системы. Заболевания, которые, как установлено, возникают под действием глутамина, включают привыкание к наркотическим средствам или абстиненцию (зависимость, толерантность к опиатам, синдром отмены опиатов), гипоксию, нарушения, обусловленные кислородной недостаточностью и ишемией (ишемический инсульт, остановка сердца), болевой синдром (боли, связанные с заболеваниями нервной системы или воспалительными заболеваниями, гипералгезия), гипогликемию, заболевания, связанные с поражением нервных клеток, травму головного мозга, травму головы, травму спинного мозга, миелопатию, старческое слабоумие,состояние страха, шизофрению, депрессию, расстройство познавательной способности, амнезию, биполярные нарушения, нарушения проводимости, болезнь Альцгеймера, сосудистое слабоумие, смешанное слабоумие (вследствие болезни Альцгеймера и поражения сосудисной системы), соматическое заболевание Леви, делирий или спутанность сознания, болезнь Паркинсона, болезнь Хантингтона, синдром Дауна, эпилепсию, патологическое старение, боковой амиотрофический склероз, рассеянный склероз, СПИД(синдром приобретенного иммунодефицита) и СПИД-ассоциированный комплекс. С учетом эффективности соединений формулы (I-A) и (I-B) разработан способ лечения теплокровных животных, включая человека, страдающих вызываемыми глутаматом заболеваниями центральной нервной системы. Указанный способ включает введение теплокровным животным, в том числе человеку,предпочтительно пероральное введение эффективного количества соединения формулы (I-A) или (I-B),его N-оксида, фармацевтически приемлемой аддитивной соли, четвертичного амина или возможной стереоизомерной формы. С учетом вышеописанных фармакологических свойств соединения формулы (I-A) и (I-B) или лю- 14007464 бую их подгруппу, N-оксиды, фармацевтически приемлемые аддитивной соли, четвертичные амины или стереохимически изомерные формы можно использовать в качестве лекарственного средства. В частности, соединение формулы (I-A) и (I-B) можно использовать для получения лекарственного средства для лечения или профилактики вызываемых глутаматом заболеваний центральной нервной системы. Более конкретно, соединения по настоящему изобретению можно использовать в качестве нейрозащитных средств, аналгетиков или противосудорожных средств. Настоящее изобретение относится также к композициям для лечения или профилактики вызываемых глутаматом заболеваний центральной нервной системы, которые содержат терапевтически эффективное количество соединения формулы (I-A) или (I-B) и фармацевтически приемлемый носитель или разбавитель. Поэтому соединения по настоящему изобретению или любые их подгруппы могут быть использованы для изготовления разных фармацевтических форм. В качестве приемлемых композиций можно привести все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по данному изобретению терапевтически эффективное количество определенного соединения в виде основания или аддитивной соли, используемого в качестве активного ингредиента, объединяют с достижением однородной смеси с фармацевтически приемлемым носителем, который может быть различным в зависимости от формы препарата, предназначенного для введения. Указанные фармацевтические композиции предпочтительно являются дозированными лекарственными формами, предназначенными для перорального, ректального, местного, чрескожного или парентерального введения. Например, для получения композиций в виде пероральной дозированной формы можно использовать любые фармацевтические среды, такие как, например, вода, гликоли, масла,спирты и тому подобные, обычно применяемые для изготовления жидких препаратов для перорального введения, таких как суспензии, сиропы, эмульсии, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связывающие вещества, дезинтеграторы и тому подобные, обычно применяемые для изготовления порошков, пилюль, капсул и таблеток. Благодаря простоте введения таблетки и капсулы являются наиболее предпочтительными дозированными лекарственными формами для перорального введения, и в этом случае обычно используют твердые фармацевтические носители. В случае композиций для парентерального введения весьма значительную часть носителя обычно составляет стерильная вода, которая может включать другие ингредиенты, например, вещества,улучшающие растворимость. Например, можно получить инъекционные растворы, в которых носитель представляет собой физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Можно также получить инъекционные суспензии, при изготовлении которых используют соответствующие жидкие носители, суспендирующие агенты и тому подобные. Кроме того, к лекарственным средствам по настоящему изобретению относятся твердые препараты, из которых непосредственно перед использованием получают жидкие препараты. В качестве композиций для местного применения можно привести все композиции, обычно применяемые для местного введения лекарственных средств, например, кремы, гели, повязки, шампуни, настойки, пасты, мази, бальзамы, порошки и тому подобные. В композициях, пригодных для чрескожного введения, носитель необязательно включает усиливающее проникновение вещество и/или приемлемое смачивающее вещество, необязательно в сочетании с небольшими количествами приемлемых добавок любого типа, которые не оказывают значительного вреднего воздействия на кожу. Указанные добавки могут облегчать нанесение на кожу и/или способствовать получению требуемых композиций. Описанные композиции можно вводить разными способами, например, в виде чрескожных пластырей, наклеек и мазей. Особенно желательно получать вышеуказанные фармацевтические композиции в виде дозированных лекарственных форм, которые облегчают введение лекарственного средства и обеспечивают равномерность дозирования. Термин "дозированная лекарственная форма" в значении, используемом в данном описании изобретения и формуле изобретения, относится к физически раздельным формам, пригодным для использования в качестве унифицированных доз, содержащих заранее определенное количество активного ингредиента, необходимое для достижения требуемого лечебного действия в сочетании с требуемым фармацевтическим носителем. Примерами таких дозированных лекарственных форм являются таблетки (включая рифленые таблетки или таблетки с покрытием), капсулы, пилюли, суппозитории, пакетики с порошком, облатки, инъекционные растворы или суспензии, лекарственные средства, расфасованные в количестве чайной ложки, лекарственные средства, расфасованные в количестве столовой ложки, и тому подобные, а также лекарственные средства в виде нескольких одноразовых доз, разделенных между собой. Величина терапевтически эффективной дозы или частота введения зависят от используемого соединения формулы (I-A) или (I-B), характера заболевания, подлежащего лечению, тяжести заболевания, возраста, массы тела, пола, режима питания или воздержания от пищи и общего физического состояния конкретного пациента, а также от других лекарственных средств, принимаемых нуждающимся субъектом, и хорошо известны специалистам в данной области. Кроме того, очевидно, что указанная терапевтически эффективная доза, или эффективная суточная доза, может быть уменьшена или увеличена в зависимости от реакции нуждающегося субъекта и/или в зависимости от суждения лечащего врача, предписывающего- 15007464 соединения по настоящему изобретению. Требуемую дозу при желании можно вводить в виде двух, трех,четырех или большего числа дробных доз через соответствующие промежутки времени в течение суток. Указанные дробные дозы могут быть получены в виде дозированных лекарственных форм. Нижеследующие примеры предназначены для иллюстрации настоящего изобретения. Экспериментальная часть В приведенных ниже примерах "ДМФ" означает N,N-диметилформамид, "DIPE" означает диизопропиловый эфир, "ДМСО" означает диметилсульфоксид, "ВНТ" означает 2,6-бис(1,1-диметилэтил)-4 метилфенол и "ТГФ" означает тетрагидрофуран. Получение промежуточных соединений Пример А 1. Получение соединения Смесь 4-(1-метилэтокси)бензойной кислоты (0,083 моль) и 5% раствора Rh/Аl2 О 3 (10 г) в ТГФ (220 мл) гидрируют при 50 С (под давление Н 2, равного 3 бар) в течение одной ночи. Смесь фильтруют через целит, промывают ТГФ и упаривают. Выход: 16 г промежуточного соединения 1 (100%). Пример А 2. Получение 2-этил-3-метил-6-хинолинкарбоновой кислоты (промежуточное соединение 2). Смесь 4-аминобензойной кислоты (0,299 моль) в этаноле (250 мл) перемешивают при комнатной температуре. Добавляют ZnCl2 (0,0367 моль) и (СН 2 О)n (10 г). Затем порциями добавляют FeCl36H2O(0,5 моль) и температуру повышают до 60-65 С. Пропанол (30 мл) добавляют по каплям в течение 2 ч. Смесь нагревают с обратным холодильником в течение 2 ч и выдерживают при комнатной температуре в течение 12 ч. Затем смесь выливают в воду и фильтруют через целит. Фильтрат подкисляют до рН=7,добавляя 6 н. раствор НСl, и смесь упаривают досуха. Остаток используют без дальнейшей очистки. Выход: 56,1 г 2-этил-3-метил-6-хинолинкарбоновой кислоты (промежуточное соединение 2). Пример A3. Получение соединения Пентаноилхлорид (0,2784 моль) добавляют при 5 С к смеси 4-бромбензоламина (0,232 моль) и N,Nдиэтилэтанамина (0,2784 моль) в CH2Cl2 (400 мл). Смесь перемешивают при комнатной температуре в течение ночи, выливают в воду и экстрагируют CH2Cl2. Органический слой отделяют, промывают концентрированным раствором NH4OH и водой, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (60 г) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Остаток (35 г,63%) поглощают СН 2 Сl2. Органический слой отделяют, промывают 10% раствором K2 СO3 и водой, сушат (MgSO4), фильтруют и выпаривают растворитель. Выход: 30 г промежуточного соединения (3) Смесь 6-бром-2(1 Н)-хинолинона (0,089 моль) в РОСl3 (55 мл) перемешивают при 60 С в течение ночи, затем при 100 С в течение 3 ч и выпаривают растворитель. Остаток поглощают CH2Cl2, выливают в смесь воды со льдом, подщелачивают концентрированным NH4OH, фильтруют через целит и экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Выход: 14,5 г промежуточного соединения (4) (67%). Пример А 5. а). Получение соединения ДМФ (37 мл) по каплям добавляют к РOСl3 (108 мл) при 10 С в потоке N2. Закончив добавление,смесь оставляют нагреваться до комнатной температуры. Затем порциями добавляют N-(4-бромфенил)бутанамид (0,33 моль). Смесь перемешивают при 85 С в течение ночи, оставляют охлаждаться до комнатной температуры и выливают на лед (экзотермическая реакция). Осадок отфильтровывают, промывают небольшим количеством воды и сушат (в вакууме). Остаток промывают EtOAc/диэтиловым эфиром и сушат. Выход: 44,2 г промежуточного соединения (5) (50%). Смесь промежуточного соединения (5) (0,162 моль) в метаноле (600 мл) и 35% раствора соли натрия в метаноле (154 мл) перемешивают и нагревают с обратным холодильником в течение ночи. Смесь- 16007464 выливают на лед. Осадок отфильтровывают, промывают небольшим количеством воды и поглощаютCH2Cl2. Добавляют 10% раствор K2 СО 3 и смесь экстрагируют СН 2 Сl2. Органический слой отделяют,промывают водой, сушат (MgSO4), фильтруют и выпаривают растворитель. Выход: 31,9 г промежуточного соединения (6) (74%). Пример А 6. Получение соединения 1,1'-Карбонил-бис-1 Н-имидазол (0,074 моль) добавляют порциями к смеси 4-метоксициклогексанкарбоновой кислоты (0,063 моль) в CH2Cl2 (200 мл). Смесь перемешивают при комнатной температуре в течение 1 ч. Затем добавляют N-метоксиметанамин (0,074 моль). Смесь перемешивают при комнатной температуре в течение ночи, выливают в Н 2 О и экстрагируют CH2Cl2. Органический слой отделяют,промывают несколько раз Н 2 О, сушат (MgSO4), фильтруют и выпаривают растворитель. Выход: 12,6 г промежуточного соединения 7. Пример А 7.a). Смесь 6-фтор-4-оксо-4 Н-1-бензопиран-2-карбоновой кислоты (0,30 мл) в уксусной кислоте (400 мл) гидрируют, используя Pd/C (3 г) в качестве катализатора. После поглощения Н 2 (3 экв.) катализатор отфильтровывают. Фильтрат упаривают. Остаток перемешивают в петролейном эфире. Осадок отфильтровывают и сушат (в вакууме; 70 С). Продукт перекристаллизовывают из CHCl3/CH3OH, осадок отфильтровывают и сушат (в вакууме; 80 С и в высоком вакууме; 85 С). Выход: 8,8 г 6-фтор-3,4-дигидро 2 Н-1-бензопиран-2-карбоновой кислоты (промежуточное соединение 8) (15,0%).b). Смесь промежуточного соединения (8) (0,255 моль) в этаноле (400 мл) и H2SO4 (5 мл) перемешивают и нагревают с обратным холодильником в течение 8 ч. Растворитель выпаривают досуха. Остаток растворяют в CH2Cl2. Органический слой отделяют, промывают 10% раствором K2 СО 3, сушатc). Реакцию выполняют в атмосфере N2. Смесь 3,4 М раствора 70 мас.% бис(2-метоксиэтокси)алюмогидрида натрия в метилбензоле (0,44 моль) и бензола (150 мл) (при температуре кипения с обратным холодильником) в течение 1 ч по каплям добавляют к кипящей с обратным холодильником смеси промежуточного соединения 9 (0,22 моль) и бензола (600 мл). Смесь перемешивают в течение 2,5 ч при температуре кипения с обратным холодильником и охлаждают до 15 С. Реакционную смесь разлагают,добавляя по каплям этанол (30 мл) и воду (10 мл). Затем полученную смесь выливают в смесь воды со льдом и подкисляют концентрированной хлористо-водородной кислотой. Реакционную смесь экстрагируют диэтиловым эфиром (500 мл). Отделенный органический слой промывают водой, сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографией на колонках с силикагелем (элюент: СНСl3). Требуемую фракцию собирают и элюент выпаривают. Выход: 34 г 6-фтор-3,4-дигидро-2 Н-1-бензопиран-2-метанола (промежуточное соединение 10) (85%).d). Реакцию выполняют в атмосфере N2. К перемешиваемой и охлаждаемой (-60 С; на бане со смесью 2-пропанона и СО 2) смеси этандиоилдихлорида (0,1 моль) в CH2Cl2 (350 мл) добавляют сульфинилбис[метан] (30 мл) в течение 10 мин. Полученную смесь перемешивают в течение 10 мин и добавляют смесь промежуточного соединения 10 в CH2Cl2 (90 мл) в течение 5 мин. Реакционную смесь перемешивают в течение 15 мин и добавляют N,N-диэтилэтанамин (125 мл). Смесь нагревают до комнатной температуры и выливают в воду. Продукт экстрагируют CH2Cl2. Органический слой промывают водой, НСl(1 М раствор), водой, NаНСО 3 (10%) и водой, сушат и упаривают. Остаток растворяют в диэтиловом эфире, промывают водой, сушат, фильтруют и упаривают. Полученный остаток очищают хроматографией на колонках с силикагелем (элюент: СНСl3). Требуемую фракцию собирают и элюент выпаривают. Выход: 21,6 г 6-фтор-3,4-дигидро-2 Н-1-бензопиран-2-карбоксальдегида (промежуточное соединение 11). 1,6 М раствор н-бутиллития (0,056 моль) медленно добавляют при -70 С к раствору промежуточного соединения (5) (0,046 моль) в ТГФ (100 мл). Смесь перемешивают при -70 С в течение 30 мин. Медленно добавляют суспензию промежуточного соединения 11 (0,056 моль) в ТГФ (100 мл). Полученную смесь перемешивают при -70 С в течение 1 ч, затем доводят до комнатной температуры, выливают в Н 2 О и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (21 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc(80/10); 15-35 мкМ). Чистые фракции собирают и растворитель выпаривают. Выход: 9,5 г промежуточного соединения 12 (55%). Пример А 8. а). Получение соединений Смесь промежуточного соединения (5) (0,1127 моль), 2-метоксиэтанамина (0,2254 моль) и К 2 СO3(0,2254 моль) в ДМФ (500 мл) перемешивают при 120 С в течение 15 ч и охлаждают. Растворитель выпаривают. Остаток поглощают CH2Cl2 и Н 2 О. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают досуха. Остаток (33,53 г) очищают хроматографией на колонках с силикагелем (элюент: CH2Cl2/CH3OH (99,5/0,5), 15-40 мкМ). Собирают две фракции и выпаривают их растворители. Выход: 5,7 г промежуточного соединения 14 (38%) и промежуточного соединения 13 (34%). Смесь промежуточного соединения (5) (0,0751 моль), тиоморфолина (0,0891 моль) и К 2 СО 3 (0,15 моль) в ДМФ (200 мл) перемешивают при 120 С в течение 12 ч. Растворитель выпаривают досуха. Остаток поглощают CH2Cl2 и Н 2 О. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (26 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/ЕtOАс(80/20), 20-45 мкМ). Собирают две фракции и выпаривают их растворители. Обе фракции объединяют. Выход: 9,4 г промежуточного соединения 15 (37%), т.п. 82 С. Пример А 9.(0,118 моль) в 70% растворе H2SO4 (230 мл), смесь перемешивают и нагревают с обратным холодильником. Затем по каплям добавляют 2-метилдиацетат 2-пропен-1,1-диола (0,216 моль) и смесь нагревают с обратным холодильником в течение 4 ч. Добавляют этанол (200 мл) и смесь перемешивают при 80 С в течение 48 ч. Смесь упаривают, остаток выливают в смесь воды со льдом и NH4OH и экстрагируютCH2Cl2. Органический слой сушат (MgSO4) и упаривают. Остаток очищают хроматографией на колонках с силикагелем (элюент: CH2Cl2/2-пропанол (99/1. Чистые фракции собирают и упаривают. Выход: 21 г этил-3-метил-6-хинолинкарбоксилата (промежуточное соединение 16) (45%).b). Раствор промежуточного соединения 16 (0,098 моль) в ТГФ (270 мл) добавляют при 0 С к раствору LiAlH4 (0,098 моль) в ТГФ в атмосфере N2. Закончив вышеуказанное добавление, добавляют воду(10 мл). Осадок отфильтровывают и промывают CH2Cl2. Органический слой сушат (MgSO4), отфильтровывают и упаривают. Продукт используют без дальнейшей очистки. Выход: 16,71 г 3-метил-6-хинолинметанола (промежуточное соединение 17).c). МnО 2 (0,237 моль) добавляют к раствору промежуточного соединения 17 (0,096 моль) в CH2Cl2(200 мл) и смесь перемешивают при комнатной температуре в течение 12 ч. Реакционную смесь фильтруют через целит и фильтрат снова перемешивают с МnО 2 (20 г) в течение 12 ч. Затем снова добавляют МnО 2 (10 г). Смесь перемешивают в течение 12 ч. Полученную смесь фильтруют через целит и упаривают. Продукт используют без дальнейшей очистки. Выход: 11,71 г 3-метил-6-хинолинкарбоксальдегидаd). Раствор бромциклогексила (0,14 моль) в 1,1'-оксибисэтане (50 мл) и стружки Мg (50 мл) добавляют при 10 С к смеси ТГФ (0,14 моль) в 1,1'-оксибисэтане (10 мл). Затем при 5 С осторожно добавляют раствор промежуточного соединения 18 (0,07 моль), содержащий стружки Мg (100 мл), реакционную смесь выливают в смесь воды со льдом и экстрагируют EtOAc. Выход: 11,34 г циклогексил-3-метил-6-хинолинметанола (63%) (промежуточное соединение 19). Пример А 10. Получение соединения(0,000151 моль) в 1,4-диоксане (5 мл) перемешивают при 80 С в течение 3 ч. Затем добавляют воду. Смесь экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Продукт используют без дальнейшей очистки. Выход: 1,4 г промежуточного соединения 20. Пример A11. Получение соединения Смесь соединения (45) (полученного способом по примеру В 6) (0,00125 моль) в 3 н. растворе NaOH(5 мл) и iPrOH (1,7 мл) перемешивают при комнатной температуре в течение ночи, выливают в Н 2O, подкисляют 3 н. раствором НСl и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток поглощают диэтиловым эфиром. Осадок отфильтровывают и сушат. Выход: 0,26 г промежуточного соединения 23 (56%) (т.п. 232 С). Пример А 12. а). Получение соединений Смесь 5-бром-1 Н-индол-2,3-диона (0,221 моль) в 3 н. растворе NaOH (500 мл) перемешивают при 80 С в течение 30 мин, доводят до комнатной температуры и добавляют 2-пентанон (0,221 моль). Смесь перемешивают, нагревают с обратным холодильником в течение 30 мин и подкисляют АсОН до рН=5. Осадок фильтруют, промывают водой и сушат. Выход: 52,3 г промежуточного соединения 24 и промежуточного соединения 25. (Общий выход: 80%). 1,6 М Раствор H-BuLi (0,0816 моль) добавляют по каплям при -78 С к суспензии промежуточного соединения 25 (0,034 моль) и промежуточного соединения 26 (0,034 моль) в ТГФ (300 мл) в потоке N2. Смесь перемешивают при -78 С в течение 30 мин. Затем по каплям добавляют 1,6 М раствор H-BuLi(0,0816 моль). Смесь перемешивают в течение 1 ч. Медленно добавляют смесь промежуточного соединения 9 (0,102 моль) в ТГФ (250 мл). Реакционную смесь перемешивают при температуре от -78 до -20 С,выливают в 3 н. раствор НСl в Н 2O и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают досуха. Выход: 20,89 г промежуточного соединения 26 и промежуточного соединения 27 (86%). Пример А 13. а). Получение соединения 4-Амино-3-метоксибензойную кислоту (0,054 моль) добавляют порциями при комнатной температуре к раствору 3-хлор-2-этил-2-бутеналя (0,065 моль) в АсОН (100 мл). Смесь перемешивают, нагревают с обратным холодильником в течение 8 ч и упаривают досуха. Остаток поглощают CH2Cl2, добавляют воду и раствор подщелачивают Et3N. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток кристаллизуют из 2-пропанона. Осадок отфильтровывают и сушат. Выход: 2,5 г промежуточного соединения 26 (18%).CDI (0,012 моль) добавляют при комнатной температуре к раствору промежуточного соединения 26(0,011 моль) в СН 2 Сl2 (30 мл). Смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют метоксиаминометил (0,012 моль) и смесь перемешивают при комнатной температуре в течение 8 ч. Добавляют Н 2 О. Осадок отфильтровывают. Фильтрат экстрагируют CH2Cl2. Органический слой отделяют,сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток кристаллизуют из диэтилового эфира. 4-Бромбензоламин (0,034 моль) добавляют при комнатной температуре к раствору 3-хлор-2-этил-2 бутаналя (0,041 моль) в АсОН (60 мл). Смесь перемешивают и нагревают с обратным холодильником в течение 8 ч, доводят до комнатной температуры и упаривают досуха. Продукт кристаллизуют из EtOAc. Осадок фильтруют, промывают 10% раствором К 2 СО 3 и поглощают CH2Cl2. Органический слой отделяют,сушат (MgSO4), фильтруют и выпаривают растворитель. Выход: 4,6 г промежуточного соединения 28 (54%). Пример А 15. а). Получение соединения Раствор KОН (0,326 моль) в Н 2 О (150 мл) медленно добавляют при 5 С к раствору 1,3-циклогександиона (0,268 моль) в Н 2 О (150 мл). При этом температура должна быть ниже 12 С. Затем порциями добавляют KI (2 г) и 2-бром-1-(4-нитрофенил)этанон (0,294 моль). Смесь перемешивают при комнатной температуре в течение 48 ч. Осадок фильтруют, промывают Н 2 О и диэтиловым эфиром и сушат. Выход: 63 г (85%). Часть указанной фракции (1 г) кристаллизуют из EtOH. Осадок отфильтровывают и сушат. Выход: 0,5 г промежуточного соединения 29 (42%) (т.п. 100 С). Смесь промежуточного соединения 29 (0,145 моль) в H2SO4 (40 мл) перемешивают при комнатной температуре в течение 1 ч, выливают на лед, подщелачивают NH4OH и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток кристаллизуют из EtOH. Осадок отфильтровывают и сушат. Выход: 31 г (58%). Часть указанной фракции (1 г) кристаллизуют из EtOH. Осадок отфильтровывают и сушат. Выход: 0,7 г промежуточного соединения 30 (58%) (т.п. 200 С). с). Получение соединения Смесь промежуточного соединения 30 (0,039 моль), Ni Ренея (10 г) в EtOH (100 мл) гидрируют при комнатной температуре под давлением 3 бар в течение 1 ч. Смесь фильтруют через целит и промывают(9,5 г) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 4,6 г (52%). Фильтрат упаривают. Остаток (2,7 г) очищают хроматографией на колонках с силикагелем (элюент: СН 2 Сl2/СН 3 ОН (99/1), 15-40 мкМ). Собирают две фракции и выпаривают растворитель. Выход: 1,6 г фракции F1 и 1,2 г фракции F2. F2 кристаллизуют из EtOH. Осадок отфильтровывают и сушат. Выход: 0,24 г промежуточного соединения 31 (2%) (т.п. 202 С). Промежуточное соединение 30 (0,02 моль) добавляют при комнатной температуре к раствору 3 хлор-3-этил-2-бутеналя (0,04 моль) в АсОН (50 мл). Смесь перемешивают и нагревают с обратным холодильником в течение 4 ч. Растворитель выпаривают досуха. Остаток кристаллизуют из EtOAc. Осадок отфильтровывают и сушат. Остаток поглощают СН 2 Сl2. Смесь подщелачивают 10% раствором К 2 СО 3 и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток кристаллизуют из EtOH. Осадок отфильтровывают и сушат. Выход: 2,5 г промежуточного соединения 32 (40%). Пример А 16. Получение соединения Смесь 2-(4-нитрофенил)-1-фенилэтанона (0,083 моль) и Ni Ренея (20 г) в EtOH (200 мл) гидрируют при комнатной температуре в течение 1 ч под давлением 3 бара, фильтруют через целит, промываютCH2Cl2/CH3OH и сушат. Выход: 17,5 г промежуточного соединения 33 (97%). В. Получение конечных соединений Пример В 1. Получение соединения РОСl3 (0,024 моль) медленно добавляют при 5 С к ДМФ (0,024 моль). Смесь перемешивают при комнатной температуре в течение 30 мин и охлаждают до 5 С. Медленно добавляют этиловый эфир 3 оксобутановой кислоты (0,024 моль). Смесь перемешивают при 5 С в течение 30 мин. Затем порциями добавляют 1-(4-аминофенил)-2-фенилэтанон (0,024 моль). Смесь перемешивают при 90 С в течение 3 ч и растворяют в CH2Cl2. Добавляют смесь воды со льдом. Полученную смесь подщелачивают NH4OH и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток кристаллизуют из 2-пропанона/диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,9 г соединения 306 (11%) (т.п. 136 С). Пример В 2. Получение соединенияKMnO4 (10 г) добавляют порциями при комнатной температуре к раствору соединения(полученного способом по примеру А 7.е) (0,022 моль) в трис(диокса-3,6-гептил)амине (1 мл) и CH2Cl2(100 мл). Смесь перемешивают при комнатной температуре в течение 8 ч, фильтруют через целит, промывают CH2Cl2 и сушат. Остаток (6 г, 100%) кристаллизуют из диэтилового эфира/петролейного эфира. Осадок отфильтровывают и сушат. Выход: 2 г соединения (2) (33%), т.п. 82 С. Пример В 3. а). Получение соединения 1,6 М раствор н-BuLi (0,07 моль) медленно добавляют при -70 С к раствору промежуточного соединения (5) (0,058 моль) в ТГФ (150 мл). Смесь перемешивают при -70 С в течение 30 мин. Затем медленно добавляют раствор 2,3-дигидро-1 Н-инден-2-карбонитрила (0,07 моль) в ТГФ (100 мл). Смесь перемешивают при -70 С в течение 1 ч, медленно доводят до комнатной температуры, гидролизуют Н 2O и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (22 г) очищают хроматографией на колонках с силикагелем (элюент: СН 2 Сl2/циклогексан(от 80/20 до 100), 15-35 мкМ). Чистые фракции собирают и растворитель выпаривают. Вторую фракцию кристаллизуют из 2-пропанона/диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,11 г соединения (3). Фильтрат концентрируют. Выход: 0,55 г соединения (3), т.п. 145 С. 1,6 М раствор H-BuLi (0,022 моль) медленно добавляют при -70 С к раствору промежуточного соединения (5) (0,018 моль) в ТГФ (50 мл). Смесь перемешивают при -70 С в течение 1 ч, доводят до -40 С и охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 7 (0,018 моль) в ТГФ(40 мл). Смесь перемешивают при -70 С в течение 1 ч, доводят до -20 С, гидролизуют Н 2 О и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (6,5 г) очищают хроматографией на колонках с силикагелем (элюент: толуол/EtOAc (90/10), 15-40- 21007464 мкМ). Собирают две фракции (F1 и F2) и выпаривают растворитель. F1 (2,4 г) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 1,8 г соединения (4) (29%), т.п. 123 С. F2 (0,9 г) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,2 г соединения (5) 1,6 М раствор н-BuLi в гексане (0,107 моль) по каплям добавляют при -78 С в потоке N2 к смеси промежуточного соединения (6) (0,089 моль) в ТГФ. Смесь перемешивают при -78 С в течение 1 ч. Добавляют смесь промежуточного соединения 7 (150 мл) при -78 С в потоке N2. Смесь перемешивают при-78 С в течение 2 ч, доводят до 0 С, выливают в Н 2O и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), преобразовывают и выпаривают растворитель. Остаток (31 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (85/15), 20-45 мкМ). Собирают две чистые фракции и выпаривают их растворители. Выход: 11 г соединения (7) (38%) и 8,2 г соединения (8) (28%). Раствор хлорметилбензола (0,0069 моль) в диэтиловом эфире (8 мл) медленно добавляют к суспензии Мg (0,0069 моль) в небольшом количестве диэтилового эфира. Смесь перемешивают при комнатной температуре в течение 30 мин (до исчезновения Мg) и охлаждают до 5 С. Затем медленно добавляют раствор промежуточного соединения 27 (0,0027 моль) в ТГФ (8 мл). Смесь перемешивают при 5 С в течение 15 мин, затем при комнатной температуре в течение 2 ч, выливают в Н 2 О и фильтруют через целит. Осадок промывают EtOAc. Фильтрат экстрагируют EtOAc. Органический слой отделяют, сушат(MgSO4), фильтруют и выпаривают растворитель. Остаток (1 г) очищают хроматографией на колонках с кромазилом (элюент: от СН 2 Сl2 (100) до СН 2 Сl2/СН 3 ОН (99/1), 15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Остаток (0,5 г, 56%) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,14 г соединения 503 (15%). Пример В 4. Примеры модификаций концевых групп. а). Получение соединения(полученного способом по примеру В 3.с) (0,018 моль) в 3 н. растворе НСl (60 мл) и ТГФ (60 мл) перемешивают при 60 С в течение ночи. Смесь подщелачивают 10% раствором К 2 СО 3 и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривют растворитель. Выход: 4,6 г соединения (156) (82%).(полученного способом по примеру В 3.с) (0,0122 моль) в 3 н. растворе НСl (40 мл) и ТГФ (40 мл) пере- 22007464 мешивают и нагревают с обратным холодильником в течение ночи, выливают в воду, подщелачивают 10% раствором К 2 СО 3 и экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (40/60), 15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Выход: 2 г соединения (9) (52%); т.п. 226 С. с). Получение соединений(5 мл) перемешивают при 140 С в течение 48 ч. Добавляют Н 2 О. Смесь экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (1 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (60/40); 15-40 мкМ). Собирают две фракции и выпаривают растворитель. Затем обе фракции по отдельности кристаллизуют из пентана. Осадок отфильтровывают и сушат. Выход: 0,05 г соединения (10) (9%, т.п. 115 С) и 0,057 г соединения Смесь соединения (4) (0,0015 моль) в 2-(метилтио)этанамине (2 мл) перемешивают при 120 С в течение 8 ч. Добавляют 10% раствор К 2 СО 3. Смесь экстрагируют CH2Cl2. Органический слой отделяют,сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (2,2 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (70/30), 15-40 мкМ). Собирают две фракции и выпаривают растворитель. Первую фракцию кристаллизуют из диэтилового эфира/петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,08 г соединения (12) (14%), т.п. 120 С. Вторую фракцию кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,18 г соединения (13) Смесь соединения (4) (0,001507 моль), этинилтриметилсилана (0,003013 моль), CuI (0,000151 моль) и Pd(PPh3)4 (0,000151 моль) в N,N-диэтилэтанамине (5 мл) перемешивают при 100 С в течение 24 ч. Добавляют воду. Смесь фильтруют через целит, промывают EtOAc и фильтрат экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (1,3 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAс (85/15), 15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Остаток (0,3 г) кристаллизуют из пентана. Осадок отфильтровывают и сушат. Выход: 0,11 г соединения (14) (18%), т.п. 114 С. Смесь соединения (14) (0,013 моль) и KF (0,038 моль) в уксусной кислоте (50 мл) перемешивают при комнатной температуре в течение 2 ч. Добавляют Н 2 О и смесь экстрагируют диэтиловым эфиром. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (4,4 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (70/30), 15-40 мкМ). Собирают одну фракцию и выпаривают растворитель. Полученную фракцию (3 г, 73%) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 2,45 г соединения (15) (60%), т.п. 132 С.(полученных способом по примеру В 7.а) (0,0056 моль) в КОН [1 М раствор, Н 2 О] (10 мл) и метаноле (30 мл) перемешивают при комнатной температуре в течение 1 ч, выливают в воду и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (2,2 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (от 85/15 до 70/30), 15-40 мкМ). Собирают две фракции и выпаривают растворитель. Первую фракцию кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,2 г соединения (15) (11%), т.п. 133 С. Вторую фракцию кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,3 г соединения (17) (16%),т.п. 128 С.CuI (0,000121 моль) в N,N-диэтилэтанамине (5 мл) перемешивают при 100 С в течение 2 ч. Добавляют воду. Смесь фильтруют через целит, промывают EtOAc и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (0,7 г) очищают хроматографией на колонках с силикагелем (элюент: СН 2 Сl2/СН 3 ОН (98/2), 15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из петролейного эфира и диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,1 г соединения (18) (23%), т.п. 113 С. Смесь соединения (4) (0,006027 моль) и KF (0,024108 моль) в ДМСО (20 мл) перемешивают при 140 С. Растворитель выпаривают досуха. Остаток отверждают в воде и диэтиловом эфире. Смесь экстрагируют диэтиловым эфиром. Органический слой отделяют, промывают диэтиловым эфиром и насыщенным раствором NaCl, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (1,7 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (85/15), 15-40 мкМ). Собирают три фракции и выпаривают их растворители. Первую фракцию кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,21 г соединения (19) (11%), т.п. 92 С. Вторую фракцию кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,33 г соединения (20) (17%), т.п. 114 С.CH3CN (10 мл) перемешивают и нагревают с обратным холодильником в течение 1 ч. Добавляют 10% раствор К 2 СО 3. Смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (1 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (80/20), 15-40 мкМ). Собирают две фракции и выпаривают их растворители. Первую фракцию кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,12 г соединения (21), т.п. 110 С.(0,00009 моль) в N,N-диэтилэтанамине (5 мл) перемешивают при 100 С в течение 2 ч. Добавляют воду. Смесь экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (0,4 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (80/20),15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Остаток (0,18 г, 62%) кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,13 г соединения (22) (45%), т.п. 138 С.(0,012054 моль) в СО (газ) и метаноле (40 мл) перемешивают при 90 С в течение 8 ч под давлением СО, равном 5 бар. Добавляют Н 2 О. Смесь экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4),фильтруют и выпаривают растворитель. Остаток (6 г) очищают хроматографией на колонках с силикагелем(элюент: CH2Cl2/CH3OH (от 100/0 до 98/2), 15-35 мкМ). Собирают четыре фракции (F1-F4) и выпаривают растворитель. Выход: 0,13 г фракции (цис) F1; 0,02 г фракции F2 (цис, соединение 25); 0,055 г фракцииF3 (транс, 3%) и 0,11 г фракции F4 (транс, соединение 26). F1 кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,03 г соединения (23) (1%), т.п. 91 С. F3 кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,035 г соединения (24) (1%), т.п. 99 С. Смесь соединения (4) (0,009 моль) и Zn (0,027 моль) в уксусной кислоте (30 мл) перемешивают при 60 С в течение 4 ч, фильтруют через целит, промывают СН 2 Сl2, упаривают досуха, растворяют в CH2Cl2 и промывают 10% раствором К 2 СО 3. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (4 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (75/25), 15-40 мкМ). Собирают одну фракцию и выпаривают растворитель. Полученную фракцию (1 г, 37%) кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: соединение (25), т.п. 88 С. Смесь соединения (4) (0,001502 моль), Sn(CH3)4 (0,003004 моль) и Pd(PPh3)4 (0,00015 моль) в метилбензоле (5 мл) перемешивают и нагревают с обратным холодильником в течение 3 ч. Добавляют 10% раствор К 2 СО 3. Смесь экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (0,7 г) очищают хроматографией на колонке с силикагелем (элюент: циклогексан/EtOAc (85/15), 15-40 мкМ). Собирают две фракции (F1 и F2) и выпаривают их растворители. Выход: 0,27 г (F1, исходное вещество) и 0,14 г (F2). F2 кристаллизуют из пентана и петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,08 г соединения (27) (17%), т.п. 110 С. о). Получение соединения(0,000151 моль) в диоксане (5 мл) перемешивают при 80 С в течение 8 ч. Добавляют воду. Смесь фильтруют через целит, промывают EtOAc и экстрагируют EtOAc. Органический слой отделяют, сушат(MgSO4), фильтруют и выпаривают растворитель. Остаток (0,65 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (90/10), 15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,07 г соединения (28) (14%), т.п. 108 С. р). Получение соединения(0,000151 моль) в диоксане (5 мл) перемешивают при 80 С в течение 8 ч. Добавляют воду. Смесь экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (1,4 г) очищают хроматографией на колонках с силикагелем (элюент: CH2Cl2/EtOAc (96/4), 15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Остаток (0,38 г) кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,16 г соединения (29) (28%), т.п. 112 С.(0,0001507 моль) в диоксане (5 мл) перемешивают при 80 С в течение 8 ч. Добавляют 10% раствор К 2 СО 3. Смесь экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (1,7 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc(85/15), 15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Остаток (0,65 г) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,35 г соединения (30) (61%), т.п. 142 С. Смесь соединения (4) (0,0015 моль), 3-тиенилбороновой кислоты (0,00226 моль), Рd(РРh3)4 (0,00015 моль) и диоксана перемешивают и нагревают с обратным холодильником в течение 24 ч. Добавляют 10% раствор К 2 СО 3. Смесь экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (0,8 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (80/20), 15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Остаток(0,4 г, 70%) кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,39 г соединения (31) (68%), т.п. 113 С. Смесь соединения (4) (0,003 моль), моногидрохлорида метилового эфира глицина (0,0066 моль) иPd(PPh)4 (0,0003 моль) в Et3N (2 мл) и толуоле (10 мл) перемешивают при 100 С под давлением СО, равном 5 бар, в течение 8 ч, фильтруют через целит, промывают CH2Cl2 и упаривают. Остаток (2 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (80/20), 75-35 мкМ). Собирают- 26007464 одну фракцию и выпаривают растворитель. Полученную фракцию (1 г, 80%) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,46 г соединения (32) (37%).CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на колонках с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH (95/5/0,1), 15-40 мкМ). Собирают две фракции (F1 и F2) и выпаривают их растворители. Выход: 0,3 г фракции F1 и 0,3 г фракции F2. F1 кристаллизуют из CH3CN и диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,102 г соединения (33), т.п. 224 С. F2 кристаллизуют из СН 3 СN и диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,2 г соединения (34), т.п. 185 С. Смесь соединения 4 (0,015 моль) и NаN3 (0,045 моль) в ДМФ (50 мл) перемешивают при 140 С в течение 2 ч. Добавляют 10% раствор К 2 СО 3 и смесь экстрагируют EtOAc. Органический слой отделяют,сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (6 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (60/40), 15-40 мкМ). Собирают первую фракцию и выпаривают растворитель. Остаток кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 1,26 г соединения (35) (24%), т.п. 160 С. Смесь соединения (4) (0,009 моль) и тиомочевины (0,0099 моль) в этиловом спирте (30 мл) перемешивают и нагревают с обратным холодильником в течение 12 ч, после чего медленно добавляют раствор КОН (0,0149 моль) в Н 2 О (5 мл). Смесь перемешивают и нагревают с обратным холодильником в течение 1 ч, выливают в воду и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на колонках с силикагелем (циклогексан/EtOAc (70/30), 15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Выход: 1,1 г фракции F1 (37%) и 0,4 г фракции F2 (13%). F1 кристаллизуют из 2-пропанона. Осадок отфильтровывают и сушат. Выход: соединение (36). F2 кристаллизуют из 2-пропанона. Осадок отфильтровывают и сушат. Выход: соединение (37).CH3I (0,0034 моль) медленно добавляют при комнатной температуре к раствору соединения (36)(0,0015 моль), соединения (37) (0,0015 моль) и К 2 СO3 (0,0034 моль) в ацетоне (15 мл). Смесь перемешивают при комнатной температуре в течение 8 ч. Добавляют воду и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (1,2 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (85/15), 15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Выход: 0,6 г фракции F1 (57%) и 0,18 г фракции F2(17%). F1 кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,28 г соединения (38) (27%). F2 кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,065 г соединения (39) (6%). х). Получение соединения(полученного способом по примеру В 3b) (0,0014 моль) в 3 н. растворе НСl (5 мл) и ТГФ (5 мл) перемешивают и нагревают с обратным холодильником в течение выходных дней в конце недели, затем выливают в Н 2 О, подщелачивают К 2 СО 3 и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4),фильтруют и выпаривают растворитель. Выход: 0,5 г фракции F. Полученную фракцию F кристаллизуют из 2-пропанона. Осадок отфильтровывают и сушат. Выход: 0,35 г соединения (40) (74%). Смесь соединения (5) (0,045 моль), ацетамида (0,90013 моль) и K2 СО 3 (0,225 моль) перемешивают и нагревают с обратным холодильником при 200 С в течение 2 ч, охлаждают до комнатной температуры,выливают в смесь СН 2 Сl2 с водой и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают досуха. Остаток (14,4 г) кристаллизуют из СН 3 ОН. Осадок отфильтровывают и сушат. Фильтрат упаривают. Остаток (11,27 г) очищают хроматографией на колонках с силикагелем (элюент: CH2Cl2/CH3OH/NH4OH (96/4/0,1), 15-35 мкМ). Чистые фракции собирают и растворитель выпаривают. Выход: 4,2 г соединения (188) (65%). Смесь соединения (188) (0,00032 моль), бензойной кислоты (1,5 экв., 0,00048 моль), 1-этил-3-(3'-диметиламинопропил)карбодиимида НСl (1:1) (1,5 экв., 0,00048 моль), N-гидроксибензотриазола (1,5 экв.,0,00048 моль) и Et3N (1 экв., 0,00032 моль) в CH2Cl2 (2 мл) перемешивают при комнатной температуре в течение 15 ч. Затем выпаривают растворитель. Остаток очищают ВЭЖХ, фракции продукта собирают и растворитель выпаривают. Выход: 0,066 г соединения (205) (49,50%). аа). Получение соединения Смесь промежуточного соединения 20 (0,001507 моль) в 3 н. растворе НСl (10 мл) и ТГФ (10 мл) перемешивают при комнатной температуре в течение 8 ч, подщелачивают 10% раствором K2 СО 3 и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (1,2 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc(85/15), 15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Остаток (0,4 г) кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,3 г соединения (6) (58%), т.п. 108 С. Смесь соединения 213 (полученного способом по примеру В 4) (0,00305 моль) и CH3ONa (30% в СН 3 ОН) (0,00916 моль) в СН 3OН (25 мл) перемешивают и нагревают с обратным холодильником в течение 15 ч, затем охлаждают до комнатной температуры, выливают в Н 2 О и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают досуха. Остаток (1,1 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (40/60), 15-40 мкМ).- 28007464 Собирают две фракции и выпаривают растворитель. Выход: 0,3 г фракции F1 и 0,5 г фракции F2 (50%).F2 кристаллизуют из диэтилового эфира/петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,26 г. F1 кристаллизуют из пентана. Осадок отфильтровывают и сушат. Выход: 0,19 г. Полученную фракцию очищают хроматографией на колонках с силикагелем (элюент: CH2Cl2/CH3OH (98/2), 15-40 мкМ). Чистые фракции собирают и растворитель выпаривают. Выход: 0,11 г. Полученную фракцию очищают хроматографией на колонках с кромазилом (элюент: СН 3 ОН/Н 2 О (70/30. Чистые фракции собирают и растворитель выпаривают. Выход: 0,09 г (9%). Полученную фракцию кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,08 г соединения 419 (8%). Пример В 5. Получение соединений(0,0019 моль) и трет-ВuОК (0,00456 моль) в ТГФ (30 мл) в потоке N2. Смесь перемешивают при комнатной температуре в течение ночи, выливают в Н 2O и экстрагируют СН 2 Сl2. Органический слой отделяют,сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на колонках с силикагелем (элюент: циклогексан/ EtOAc (65/35), 15-40 мкМ). Собирают две фракции и выпаривают растворитель. Выход: 0,35 г соединения (42) (30%, т.п. 125 С) и 0,35 г соединения 43 (30%, т.п. 116 С). Пример В 6. а). Получение соединений(0,01068 моль). Смесь перемешивают при комнатной температуре в течение 1 ч, гидролизуют водой и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (60/40),15-40 мкМ). Требуемые фракции (F1-F4) собирают и растворитель выпаривают. Выход: 0,11 г фракцииF1; 0,13 г фракции F2; 0,75 г фракции F3 и 0,8 г фракции F4. F3 кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: соединение (44), т.п. 152 С. F4 кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: соединение (45), т.п. 147 С. Бромметилбензол (0,007 моль) по каплям добавляют при 0 С в потоке N2 к раствору соединения (8) и соединения (9) (0,0064 моль) и 60% раствору NaH (0,007 моль) в ДМФ (40 мл). Смесь перемешивают при комнатной температуре в течение 1 ч, гидролизуют водой и экстрагируют EtOAc. Органический слой отделяют, промывают водой, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (70/30), 15-40 мкМ). Требуемые фракции (F1-F4) собирают и растворитель выпаривают. Выход: 0,15 г фракции F1, 0,1 г фракции F2, 0,6 г фракции F3 (23%) и 0,8 г фракции F4. F3 кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,13 г соединения (46), т.п. 137 С. F4 кристаллизуют из DIPE и петролейного эфира. Осадок отфильтровывают и сушат. Выход: соединение (47), т.п. 130 С. Пример В 7. а). 3-Хлорбензолкарбопероксовую кислоту (0,088 моль) добавляют при 0 С к раствору соединения(48) (полученного способом по примеру В 2) (0,044 моль) в CH2Cl2 (200 мл) и смесь перемешивают при комнатной температуре в течение 12 ч. Смесь промывают 10% раствором K2 СO3. Органический слой сушат (MgSO4), отфильтровывают и упаривают. Остаток перекристаллизовывают из (С 2 Н 5)2 О. Выход: 8,2 г 1-оксида циклогексил-(3-метил-6-хинолинил)метанона (соединение 49) (69%).- 29007464 моль) в K2 СO3 (400 мл) и СН 2 Сl2 (400 мл) и смесь перемешивают при комнатной температуре в течение 1 ч. Смесь экстрагируют СН 2 Сl2. Органический слой сушат (MgSO4), отфильтровывают и упаривают. Остаток перекристаллизовывают из (С 2 Н 5)2O. Выход: 6,64 г 6-(циклогексилкарбонил)-3-метил-2(1 Н)хинолинона (соединение 50) (85%), т.п. 256,1 С. Пример В 8. а). Получение соединений Смесь соединения (7) (0,0229 моль), гидроксиламина (0,0252 моль) и N,N-диэтилэтанамина (0,0252 моль) в этаноле (100 мл) перемешивают и нагревают с обратным холодильником в течение 6 ч, выливают в воду и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток кристаллизуют из CH3CN. Осадок отфильтровывают и сушат. Остаток очищают хроматографией на колонках с силикагелем (элюент: CH2Cl2/EtOAc (80/20), 15-40 мкМ). Собирают две фракции и выпаривают растворитель. Выход: 2,8 г соединения (44) (36%, т.п. 133 С) и 3 г соединения Гидразин (0,41 моль) добавляют при комнатной температуре к раствору соединения (7) (0,015 моль) в этаноле (75 мл). Смесь перемешивают и нагревают с обратным холодильником в течение 1 ночи, выливают в воду и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на колонках с силикагелем (элюент:CH2Cl2/CH3OH/NH4OH (98/2/0,1. Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,8 г соединения (53) Выполняют способ получения соединений 400, 401, 402, 403, 404 и 405. Смесь промежуточного соединения 21 (полученного способом по примеру A11) (0,000269 моль), гидрохлорида амантадинаCH2Cl3 (2 мл) перемешивают при комнатной температуре в течение 12 ч. Растворитель выпаривают. Остаток очищают ВЭЖХ. Фракции продукта собирают и растворитель выпаривают. Выход: 0,063 г соединения 520 (46,37%). Пример В 10. Получение соединения Смесь промежуточного соединения 27 (0,0026 моль) и промежуточного соединения 26 (0,0026 моль) в EtOH (380 мл) и концентрированной H2SO4 (19 мл) перемешивают и нагревают с обратным холодильником в течение 15 ч, охлаждают до комнатной температуры, выливают в смесь воды со льдом,подщелачивают К 2 СО 3 и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (17,9 г) очищают хроматографией на колонках с силикагелем (элюент: циклогексан/EtOAc (80/20), 15-35 мкМ). Чистые фракции собирают и растворитель выпаривают. Выход: 0,85 г фракции F1, 1,1 г фракции F2 и 11,5 г фракции F3. Фракции F1 и F2 по отдельности кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат. Выход: 0,34 г соединения 233. Пример В 11. Получение соединения
МПК / Метки
МПК: C07D 405/04, C07D 215/14, C07D 215/36, C07D 215/48, C07D 215/22, C07F 7/10, C07D 215/18, C07D 409/12, C07D 409/04, C07D 215/38, C07D 471/04
Метки: глутамата, рецепторов, антагонисты, метаботропных
Код ссылки
<a href="https://eas.patents.su/30-7464-antagonisty-metabotropnyh-receptorov-glutamata.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты метаботропных рецепторов глутамата</a>
Предыдущий патент: Кристаллический 2, 5-дион-3-(1-метил-1н-индол-3-ил) -4-[1-(пиридин -2- илметил)пиперидин-4-ил] -1н-индол-3-ил-1н-пирролмоногидрохлорид
Следующий патент: Процедура получения клеточных линий в безбелковых средах и клеточные линии, полученные этим способом
Случайный патент: Каталитический реактор












