3- или 4-монозамещённые производные фенола и тиофенола, полезные в качестве н3-лигандов
Номер патента: 11161
Опубликовано: 27.02.2009
Авторы: Лортиуа Эдвиж, Серрадель-Сиви Дельфин, Вернь Фабрис, Кронин Эндрю Майкл, Бернарделли Патрик, Джакобелли Генри, Руссо Фиона, Дени Алексис, Кемп Марк Ян, Дентон Стефен Мартин
Формула / Реферат
1. Соединение формулы (1)
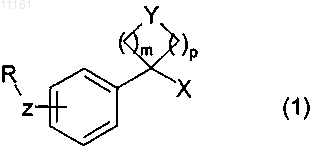
или его фармацевтически приемлемая соль и/или сольват (включая гидрат), где
заместитель формулы -Z-R находится в мета- или пара-положении фенильной группы;
X выбирают из -CN, -CH2OH, -СН2-О-(C1-C4)алкила, -С(О)ОН, -С(О)О-(C1-C4)алкила, -CH2-NR1R2,
-C(O)NR3R4, -CH2-O-het2, -СН2-het1 и het1, где группа het1 в обеих группах -СН2-het1 и het1 необязательно замещена одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (С1-С4)алкила, -S-(C1-С4)алкила и (C1-C4)алкоксигруппы;
R1 означает водород или (C1-C4)алкил, необязательно замещенный (С3-С6)циклоалкилом;
R2 выбирают из группы, состоящей из
водорода,
(C1-С6)алкила, необязательно замещенного одним или двумя заместителями, независимо выбранными из (С3-С6)циклоалкила, гидрокси, -S-(C1-C4)алкила, -О-(C1-C4)алкила, -SO2-(C1-C4)алкила, -SO-(C1-C4)алкила, галогена, het1, аминогруппы, (C1-C4)алкиламиногруппы, [(C1-C4)алкил]2аминогруппы и фенила, где указанный фенил необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, гидрокси, цианогруппы, (C1-C4)алкила и (C1-C4)алкоксигруппы,
(С3-С6)циклоалкила,
het2, необязательно замещенного одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (C1-C4)алкила, NH2 и (С1-С4)алкоксигруппы,
-SO2-R5, где R5 выбирают из группы, состоящей из (C1-C4)алкила, аминогруппы, (C1-C4)алкиламиногруппы, [(C1-C4)алкил]2аминогруппы, фенила и -(C1-C4)алкилфенила, где указанный фенил необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (С1-С4)алкила и (C1-C4)алкоксигруппы, и
-C(O)-R6, где R6 выбирают из группы, состоящей из (С1-С4)алкила, аминогруппы, (C1-C4)алкиламиногруппы, [(С1-С4)алкил]2аминогруппы, фенила и -(C1-C4)алкилфенила, где указанный фенил необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (С1-С4)алкила и (С1-С4)алкоксигруппы;
или R1 и R2 вместе с атомом азота, с которым они связаны, образуют 3-, 4-, 5-, 6- или 7-членный насыщенный гетероцикл, где один атом углерода может быть заменен N, О, S, SO или SO2 и где указанный насыщенный гетероцикл необязательно замещен одной или двумя группами, независимо выбранными из гидрокси, галогена, =O, (С1-С4)алкила, -(C1-C4)алкил(С3-С6)циклоалкила, (C1-С4)алкоксигруппы, гидрокси(C1-C4)алкила, (C1-C4)алкокси(C1-C4)алкила, -SO2-(C1-C4)алкила, -С(О)-(C1-C4)алкила, [(C1-C4)алкил]2аминогруппы, аминогруппы, (С1-С4)алкиламиногруппы, -C(O)NH2, С(О)О-(C1-C4)алкила и пирролидинона;
R3 и R4, каждый независимо, выбирают из водорода, (С3-С6)циклоалкила и (C1-C4)алкила, где указанные (С3-С6)циклоалкил и (C1-C4)алкил необязательно замещены аминогруппой, (C1-C4)алкиламиногруппой, [(C1-C4)алкил]2аминогруппой или (С3-С6)циклоалкилом, или
R3 и R4 вместе с атомом азота, с которым они связаны, образуют 4-, 5-, 6- или 7-членный насыщенный гетероцикл, где один атом углерода может быть заменен N или О и где указанный насыщенный гетероцикл необязательно замещен (C1-C4)алкилом, [(C1-C4)алкил]2аминогруппой, аминогруппой, (C1-C4)алкиламиногруппой или -С(О)-(C1-C4)алкилом, где указанный -С(О)-(C1-C4)алкил необязательно замещен метокси- или этоксигруппой;
Y выбирают из СН2, СН(ОН), О, С=O и N, где указанный N замещен Н, (C1-C4)алкилом, С(О)-(C1-C4)алкилом или (C1-C4)алкокси(С1-С4)алкилом;
Z выбирают из О, S, SO и SO2;
m и p, оба, означают целые числа, которые независимо равны 1, 2 или 3, при условии, что сумма (m+p) равна или меньше чем 4, так что кольцо, образованное
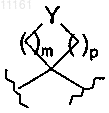
представляет собой 4-, 5- или 6-членное кольцо; и
R означает или группу формулы
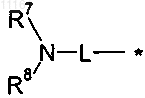
где * означает место присоединения к Z,
L означает (С2-С6)алкилен с линейной или разветвленной цепью,
R7 и R8, каждый независимо, выбирают из водорода, (C1-С6)алкила, (С3-С6)циклоалкила, гидрокси(C1-С6)алкила или
R7 и R8 вместе с атомом азота, с которым они связаны, образуют 4-, 5-, 6- или 7-членный насыщенный гетероцикл, где один атом углерода необязательно заменен N, О, S, SO или SO2 и где указанный насыщенный гетероцикл необязательно замещен одной или двумя группами, независимо выбранными из (C1-С4)алкила, (C1-C4)алкоксигруппы, (С1-С4)алкокси(C1-C4)алкила, гидрокси(C1-C4)алкила, гидрокси, С(О)О-(C1-C4)алкила, -С(О)-(C1-C4)алкил-NH2, -C(O)NH2, галогена, аминогруппы, (C1-C4)алкиламиногруппы и [(C1-C4)алкил]2аминогруппы;
или R означает группу формулы
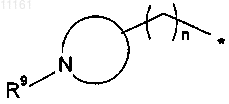
где * означает место присоединения к Z,
N-содержащим кольцом является 4-7-членный насыщенный гетероцикл,
n означает целое число, равное 0, 1 или 2, и
R9 означает заместитель, выбранный из водорода, (C1-C4)алкила, гидрокси(C1-С6)алкила и (С3-С6)циклоалкила;
het1 выбирают из моноциклических или бициклических гетероароматических групп с 5-10 членами в кольце, которые содержат 1, 2, 3 или 4 гетероатома, выбранных из азота, кислорода и серы, и
het2 выбирают из моноциклических или бициклических гетероароматических групп с 5-10 членами в кольце, которые содержат 1, 2, 3 или 4 гетероатома, выбранных из азота, кислорода и серы.
2. Соединение формулы (1) по п.1, где X выбирают из -СН2-NR1R2, -C(O)NR3R4, -СН2-het1 и het1, где het1 необязательно один раз или дважды замещен (C1-C4)алкилом, где R1, R2, R3, R4 и het1 имеют указанные в п.1 значения.
3. Соединение формулы (1) по п.2, где X означает -СН2-het1 или het1, и het1 выбирают из 5- или 6-членной моноциклической гетероароматической группы или 9-членной бициклической гетероароматической группы, где каждая гетероароматическая группа содержит 1-3 атома азота или 1-2 атома азота и 1 атом кислорода, или 1 атом азота и 1 атом серы и каждая гетероароматическая группа необязательно один раз или дважды замещена (C1-C4)алкилом.
4. Соединение формулы (1) по п.3, где X означает тиазолил, бензимидазолилметил, пиридинил, оксазолил, имидазопиридинилметил, пиримидинил, имидазолил, имидазолилметил или триазолилметил, где указанные тиазолил, бензимидазолилметил, пиридинил, оксазолил, имидазопиридинилметил, пиримидинил, имидазолил, имидазолилметил и триазолилметил, каждый, необязательно замещен одной метильной группой.
5. Соединение формулы (1) по п.1 или 2, где R1 означает водород, метил или этил.
6. Соединение формулы (1) по пп.1, 2 или 5, где R2 выбирают из группы, состоящей из
водорода,
(C1-С6)алкила, необязательно замещенного одним или двумя заместителями, независимо выбранными из -S-(С1-С4)алкила, -О-(C1-С4)алкила, -SO2-(С1-С4) алкила и фенила, где указанный фенил необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, гидрокси, цианогруппы, (C1-C4)алкила и (С1-С4)алкоксигруппы,
(С3-С6)циклоалкила,
het2, необязательно замещенного одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (C1-C4)алкила и (С1-С4)алкоксигруппы, где het2 имеет указанное в п.1 значение,
-SO2-R5, где R5 выбирают из группы, состоящей из (С1-С4)алкила, [(C1-C4)алкил]2аминогруппы, фенила и -(С1-С4)алкилфенила, где указанный фенил необязательно замещен одним заместителем, независимо выбранным из галогена и цианогруппы, и
-C(O)-R6, где R6 выбирают из группы, состоящей из (С1-С4)алкила, [(C1-C4)алкил]2аминогруппы, аминогруппы и -(C1-C4)алкилфенила, где указанный фенил необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (С1-С4)алкила и (С1-С4)алкоксигруппы.
7. Соединение формулы (1) по п.6, где R2 выбирают из группы, состоящей из
(C1-С3)алкила, необязательно замещенного -О-(C1-С3)алкилом,
(С3-С5)циклоалкила,
het2, где het2 выбирают из группы, состоящей из 5- или 6-членных моноциклических гетероароматических групп, содержащих 1-2 атома азота или 1 атом азота и 1 атом кислорода, или 1 атом азота и 1 атом серы, где указанный het2 необязательно замещен (С1-С4)алкилом,
-SO2-R5, где R5 означает (C1-C4)алкил и
-C(O)-R6, где R6 означает (C1-C4)алкил.
8. Соединение формулы (1) по п.7, где R2 означает (C1-С3)алкил, необязательно замещенный метоксигруппой.
9. Соединение формулы (1) по п.7, где R2 означает het2, где het2 выбирают из группы, состоящей из 5- или 6-членных моноциклических гетероароматических групп, содержащих 1 или 2 атома азота.
10. Соединение формулы (1) по п.9, где R2 означает пиридазинил.
11. Соединение формулы (1) по п.1 или 2, где R1 и R2 вместе с атомом азота, с которым они связаны, образуют 4-, 5-, 6- или 7-членный насыщенный гетероцикл, где один атом углерода может быть заменен N, О, S, SO или SO2 и где указанный насыщенный гетероцикл необязательно замещен одной или двумя группами, независимо выбранными из гидрокси, галогена, =O, (C1-C4)алкила, -(C1-C4)алкил(С3-С6)циклоалкила, (C1-C4)алкоксигруппы, гидрокси(C1-C4)алкила, (C1-C4)алкокси(C1-C4)алкила, -SO2-(C1-C4)алкила, -С(О)-(C1-C4)алкила, [(C1-C4)алкил]2аминогруппы, -C(O)NH2, -С(О)О-(C1-C4)алкила и пирролидинона.
12. Соединение формулы (1) по п.11, где R1 и R2 вместе с атомом азота, с которым они связаны, образуют морфолинильную группу.
13. Соединение формулы (1) по п.1 или 2, где R3 и R4, каждый независимо, выбирают из водорода и (C1-C4)алкила или R3 и R4 вместе с атомом азота, с которым они связаны, образуют 4-, 5- или 6-членный насыщенный гетероцикл, где один атом углерода может быть заменен N или О и где указанный насыщенный гетероцикл необязательно замещен (C1-C4)алкилом.
14. Соединение формулы (1) по п.13, где R3 и R4 независимо выбирают из водорода, метила и этила или R3 и R4 вместе с атомом азота, с которым они связаны, образуют пирролидинильное, пиперидинильное, пиперазинильное или азетидинильное кольцо, где каждое пирролидинильное, пиперидинильное, пиперазинильное и азетидинильное кольцо необязательно замещено метилом.
15. Соединение формулы (1) по любому из пп.1-14, где Y выбирают из СН2, СН(ОН), О и С=O.
16. Соединение формулы (1) по п.15, где Y означает О.
17. Соединение формулы (1) по любому из пп.1-16, где Z означает О.
18. Соединение формулы (1) по любому из пп.1-17, где m и p, оба, означают 2.
19. Соединение формулы (1) по любому из пп.1-18, где R означает группу формулы
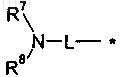
где * означает место присоединения к Z,
L означает (С2-С5)алкилен и
R7 и R8, каждый независимо, выбирают из водорода, (C1-С6)алкила, (С3-С6)циклоалкила, гидрокси(С1-С6)алкила или
R7 и R8 вместе с атомом азота, с которым они связаны, образуют 4-, 5-, 6- или 7-членный насыщенный гетероцикл, где один атом углерода необязательно заменен N, О, S, SO или SO2 и где указанный насыщенный гетероцикл необязательно замещен одной или двумя группами, независимо выбранными из (C1-C4)алкила, (C1-С4)алкоксигруппы, (C1-C4)алкокси(C1-C4)алкила, гидрокси(С1-С4)алкила, гидрокси, С(О)О-(C1-C4)алкила, -С(О)-(C1-C4)алкил-NH2, -C(O)NH2 и галогена.
20. Соединение формулы (1) по п.19, где R7 и R8 вместе с атомом азота, с которым они связаны, образуют морфолинильную или оксазепанильную группу.
21. Соединение формулы (1) по п.19, где R7 и R8 вместе с атомом азота, с которым они связаны, образуют 4-, 5- или 6-членный насыщенный гетероцикл, необязательно замещенный одной или двумя (С1-С4)алкильными группами.
22. Соединение формулы (1) по п.21, где насыщенным гетероциклом является пирролидинильная группа, необязательно замещенная одной или двумя метильными группами.
23. Соединение формулы (1) по п.19, где R7 и R8 означают (C1-С3)алкил.
24. Соединение формулы (1) по любому из пп.19-23, где L означает пропилен.
25. Соединение формулы (1) по любому из пп.1-18, где R означает груяяу формулы
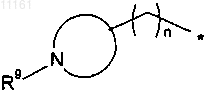
где * означает место присоединения к Z,
N-содержащим кольцом является 4- или 6-членный насыщенный гетероцикл,
n означает целое число, равное 0 или 1, и
R9 означает заместитель, выбранный из водорода, (C1-C4)алкила и (С3-С6)циклоалкила.
26. Соединение формулы (1) по п.25, где R9 означает изопропил или циклобутил.
27. Фармацевтическая композиция, содержащая соединение формулы (1) или его фармацевтически приемлемую соль и/или сольват по любому из пп.1-26, вместе с фармацевтически приемлемым эксципиентом.
28. Соединение формулы (1) по любому из пп.1-26 или его фармацевтически приемлемая соль и/или сольват для применения в качестве лекарственного средства.
29. Применение соединения формулы (1) по любому из пп.1-27 или его фармацевтически приемлемой соли и/или сольвата для получения лекарственного средства для лечения заболевания, для которого показан Н3-лиганд.
30. Применение соединения формулы (1) по п.29 для получения лекарственного средства для лечения нарушений сна, мигрени, дискинезии, вызываемого стрессом страха, психотических расстройств, эпилепсии, вызываемых дефицитом познавательной способности заболеваний, таких как болезнь Альцгеймера или легкое ухудшение познавательной способности, депрессии, эмоциональных расстройств, шизофрении, связанных с боязнью расстройств, расстройства, связанного с гиперактивностью при дефиците внимания (ADHD), ожирения, головокружения, вертиго, эпилепсии, болезни движения, воспалительных заболеваний, респираторного дистресс-синдрома у взрослых, острого респираторного дистресс-синдрома, бронхита, хронического бронхита, хронической обструктивной болезни легких, кистозного фиброза, астмы, эмфиземы, ринита, хронического синусита, аллергии, вызываемых аллергией ответных реакций дыхательных путей, аллергического ринита, вирусного ринита, неаллергического ринита, длящегося круглый год или сезонного ринита, назального застоя, аллергического застоя, мужской половой дисфункции или женской половой дисфункции.
31. Способ лечения млекопитающего, включая человека, страдающего от заболевания, для которого показан Н3-лиганд, включающий введение указанному млекопитающему эффективного количества соединения формулы (1) по любому из пп.1-26 или его фармацевтически приемлемой соли и/или сольвата, или включающей его композиции.
32. Комбинация соединения формулы (1) по любому из пп.1-26 и другого фармакологически активного агента.
33. Комбинация по п.32, где другим фармакологически активным агентом является антагонист рецептора гистамина H1.
Текст
011161 Настоящее изобретение относится к 3- или 4-монозамещенным производным фенола и тиофенола общей формулы (1) где R, X, Y, Z, m и p имеют нижеуказанные значения, и к способам получения таких производных, используемым для их получения промежуточным продуктам, содержащим такие производные композициям и применению таких производных. Рецепторы гистамина Н 3 обнаружены в пресинаптических окончаниях периферических нервов, где они модулируют автономную нейротрансмиссию и множество конечных ответных реакций органов под контролем автономной нервной системы. Они также представляют собой гетерорецепторы, модулирующие высвобождение многочисленных других нейротрансмиттеров, таких как допамин, глутамат, норадреналин, серотонин, GABA, ацетилхолин, некоторые пептиды и котрансмиттеры. Недавно обнаружены многочисленные лиганды рецептора гистамина Н 3. Обзор современного прогресса в отношении исследования и патентования представлен в Expert Opin. Ther. Patents (2003) 13(6). Примеры лигандов рецептора гистамина Н 3 могут быть найдены в международных заявках WO 02/76925,WO 00/06254, WO 02/12190, WO 02/12214 и WO 02/06223. Полагают, что лиганды Н 3-рецептора полезны для лечения многих заболеваний, включая как расстройства центральной нервной системы, так и воспалительные заболевания. Примерами заболеваний,где, как полагают, пригодно лечение с помощью Н 3-лигандов, являются воспалительное кишечное заболевание, болезнь Крона, неспецифический язвенный колит, нарушения сна, мигрень, дискинезия, вызываемый стрессом страх, психотические расстройства, эпилепсия, вызываемые дефицитом познавательной способности заболевания, такие как болезнь Альцгеймера или легкое ухудшение познавательной способности, депрессия, эмоциональные расстройства, шизофрения, связанные с боязнью расстройства, расстройство, связанное с гиперактивностью при дефиците внимания (ADHD), ожирение, головокружение,эпилепсия, болезнь движения, вертиго, респираторные заболевания, такие как респираторный дистресссиндром у взрослых, острый респираторный дистресс-синдром, бронхит, хронический бронхит, хроническая обструктивная болезнь легких, кистозный фиброз, астма, эмфизема, ринит, хронический синусит,аллергия, вызываемые аллергией ответные реакции дыхательных путей, аллергический ринит, вирусный ринит, неаллергический ринит, длящийся круглый год или сезонный ринит, назальный застой и аллергический застой. Хотя Н 3-лиганды известны, все еще существует потребность в обнаружении новых Н 3-лигандов,которые являются подходящими кандидатами в качестве лекарственного средства. В особенности,предпочтительные соединения должны потенциально связываться с рецептором гистамина Н 3, одновременно проявляя незначительную аффинность в отношении других рецепторов. Они должны хорошо абсорбироваться из желудочно-кишечного тракта, быть метаболически стабильными и обладать благоприятными фармакокинетическими свойствами. Они должны быть нетоксичны и проявлять незначительные побочные эффекты. Согласно данному контексту настоящее изобретение относится к новым замещенным производным фенола и тиофенола общей формулы (1) или их фармацевтически приемлемым солям и/или сольватам, где заместитель формулы -Z-R находится в мета- или пара-положении фенильной группы;X выбирают из -CN, -CH2OH, -CH2-O-(C1-C4)алкила, -С(О)ОН, -С(O)O-(С 1-С 4)алкила, -CH2-NR1R2,-C(O)NR3R4, -CH2-O-het2, -CH2-het1 и het1, где группа het1 в обеих группах -СН 2-het1 и het1 необязательно замещена одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (C1C4)алкила, -S-(C1-C4)алкила и (C1-C4)алкоксигруппы;R1 означает водород или (C1-C4)алкил, необязательно замещенный (С 3-С 6)циклоалкилом;R2 выбирают из группы, состоящей из водорода,(C1-С 6)алкила, необязательно замещенного одним или двумя заместителями, независимо выбранными из (С 3-С 6)циклоалкила, гидрокси, -S-(C1-C4)алкила, -О-(C1-C4)алкила, -SO2-(C1-C4)алкила, -SO-(C1C4)алкила, галогена, het1, аминогруппы, (C1-C4)алкиламиногруппы, [(C1-C4)алкил]2 аминогруппы и фенила, где указанный фенил необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, гидрокси, цианогруппы, (C1-C4)алкила и (C1-C4)алкоксигруппы,(С 3-С 6)циклоалкила,-1 011161het2, необязательно замещенного одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (C1-C4)алкила, NH2 и (C1-C4)алкоксигруппы,-SO2-R5, где R5 выбирают из группы, состоящей из (C1-C4)алкила, аминогруппы, (C1C4)алкиламиногруппы, [(C1-C4)алкил]2 аминогруппы, фенила и -(C1-C4)алкилфенила, где указанный фенил необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (C1-C4)алкила и (C1-C4) алкоксигруппы, и-C(O)-R6, где R6 выбирают из группы, состоящей из (C1-C4)алкила, аминогруппы, (C1C4)алкиламиногруппы, [(C1-C4)алкил]2 аминогруппы, фенила и -(C1-C4)алкилфенила, где указанный фенил необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (C1-C4)алкила и (C1-C4)алкоксигруппы; или R1 и R2 вместе с атомом азота, с которым они связаны, образуют 3-, 4-, 5-, 6- или 7-членный насыщенный гетероцикл, где один атом углерода может быть заменен N, О, S, SO или SO2 и где указанный насыщенный гетероцикл необязательно замещен одной или двумя группами, независимо выбранными из гидрокси, галогена, =O, (C1-C4)алкила, -(C1-C4)алкил(С 3-С 6)циклоалкила, (С 1-С 4)алкоксигруппы, гидрокси(C1-C4)алкила, (С 1-С 4)алкокси(С 1-С 4)алкила, -SO2-(C1-C4)алкила, -С(О)-(C1-C4)алкила, [(C1C4)алкил]2 аминогруппы, аминогруппы, (C1-C4)алкиламиногруппы, -C(O)NH2, С(О)О-(С 1-С 4)алкила и пирролидинона;R3 и R4 вместе с атомом азота, с которым они связаны, образуют 4-, 5-, 6- или 7-членный насыщенный гетероцикл, где один атом углерода может быть заменен N или О и где указанный насыщенный гетероцикл необязательно замещен (C1-C4)алкилом, [(C1-C4)алкил]2 аминогруппой, аминогруппой, (C1C4)алкиламиногруппой или -С(О)-(С 1-С 4)алкилом, где указанный -С(О)-(С 1-С 4)алкил необязательно замещен метокси- или этоксигруппой;Y выбирают из СН 2, СН(ОН), О, С=O и N, где указанный N замещен Н, (C1-C4)алкилом, С(О)-(C1C4)алкилом или (С 1-С 4)алкокси(С 1-С 4)алкилом;m и p, оба, означают целые числа, которые независимо равны 1, 2 или 3, при условии, что сумма(m+p) равна или меньше чем 4, так что кольцо, образованноеR означает или группу формулы гдеозначает место присоединения к Z;L означает (С 2-С 6)алкилен с линейной или разветвленной цепью; иR7 и R8 вместе с атомом азота, с которым они связаны, образуют 4-, 5-, 6- или 7-членный насыщенный гетероцикл, где один атом углерода необязательно заменен N, О, S, SO или SO2 и где указанный насыщенный гетероцикл необязательно замещен одной или двумя группами, независимо выбранными из гдеозначает место присоединения к Z;het1 выбирают из моноциклических или бициклических гетероароматических групп с 5-10 членами в кольце, которые содержат 1, 2, 3 или 4 гетероатома, выбранных из азота, кислорода и серы, иhet2 выбирают из моноциклических или бициклических гетероароматических групп с 5-10 членами-2 011161 в кольце, которые содержат 1, 2, 3 или 4 гетероатома, выбранных из азота, кислорода и серы. Обнаружено, что указанные соединения являются лигандами Н 3 и, таким образом, особенно полезны для лечения Н 3-связанных заболеваний, таких как неврологические нарушения, или воспалительных,респираторных и аллергических заболеваний, нарушений и состояний. В настоящем описании используют следующие определения, если не указано иное. Термин галоген означает атом галогена, выбранный из группы, состоящей из фтора, хлора, брома и йода. Термин (C1-Cx)алкил означает насыщенную, углеводородную группу с линейной или разветвленной цепью с количеством атомов углерода от 1 до х и включает, например, (когда х=4) метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил и, далее (когда х=6), пентил, изопентил, нпентил и гексил. Это также имеет значение в том случае, если алкильная группа несет заместители или является заместителем другой группы, как, например, в -S-(С 1-С 4)алкиле, -О-(С 1-С 4)алкиле, -SO2-(C1C4)алкиле, -SO-(C1-C4)алкиле, -СН 2-О-(С 1-С 4)алкиле, -С(О)О-(С 1-С 4)алкиле, (С 1-С 4)алкиламиногруппе,[(C1-C4)алкил]2 аминогруппе, -(C1-C4)алкилфениле, -(С 1-С 4)алкил(С 3-С 6)циклоалкиле, гидрокси(С 1 С 4)алкиле, (C1-C4)алкокси(C1-C4)алкиле, -С(О)-(C1-C4)алкиле. Термин (C1-C4)алкокси означает алкоксигруппы с линейной или разветвленной цепью и включает, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и третбутокси. Термин (С 2-С 6)алкилен означает двухвалентный радикал, производный алкана с линейной или разветвленной цепью с количеством атомов углерода от 2 до 6. Примерами (С 2-С 6)алкиленовых радикалов являются метилен, этилен (1,2-этилен или 1,1-этилен), триметилен (1,3-пропилен), тетраметилен (1,4 бутилен), пентаметилен и гексаметилен. Гидрокси(С 1-С 4)алкильными радикалами являются замещенные гидроксигруппой алкильные радикалы. Они могут содержать 1 или несколько гидроксизаместителей, если не указано иное. Примерами подходящих гидрокси(С 1-С 4)алкильных радикалов являются гидроксиметил, 1-гидроксиэтил или 2 гидроксиэтил. Термин (С 3-С 6)циклоалкил означает насыщенную моноциклическую карбоциклическую группу с 3-6 атомами углерода и включает, например, циклопропил, циклобутил, циклопентил и циклогексил. В случае, когда (C1-Cx)алкильные радикалы замещены галогеном, такой радикал может содержать 1 или несколько атомов галогена, если не указано иное. Указанным галогеном предпочтительно является фтор, хлор, бром или йод, в особенности фтор или хлор. Например, в замещенном фтором алкильном радикале метильная группа может находиться в виде дифторметильной или трифторметильной группы. Термин насыщенный гетероцикл означает насыщенную моноциклическую группу с 4-7 членами в кольце, которая содержит 1 атом азота и необязательно другой гетероатом, выбранный из азота, кислорода и серы. Примерами насыщенных гетероциклов являются азетидинил, пирролидинил, пиперидинил,морфолинил, пиперазинил, оксазепанил и азепанил.het1 и het2 представляют собой моноциклические или бициклические гетероароматические группы с 5-10 членами в кольце, которые содержат 1, 2, 3 или 4 гетероатома, выбранных из азота, кислорода и серы. В частности, гетероароматическая группа содержит или (а) 1-4 атома азота, (b) один атом кислорода или один атом серы, или (с) 1 атом кислорода или 1 атом серы и 1 или 2 атома азота, het2 предпочтительно связан с атомом углерода, что означает, что группа связана с соседним атомом через атом углерода кольца, het1 может быть связан с атомом углерода или атомом азота. Гетероарильная группа может быть незамещенной, монозамещенной или дизамещенной, как указано выше в определении X и R2 для общей формулы (1) настоящего изобретения. Примеры гетероарильных групп включают, но не ограничиваются ими, тиофенил, фуранил, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиранил, пиридинил, пиразинил, пиримидинил,пиридазинил, триазинил, тиадиазинил, изобензофуранил, бензофуранил, хроменил, индолизинил, изоиндолил, индолил, индазолил, пуринил, хинолинил, изохинолил, циннолинил, фталазинил, нафтиридинил,хиназолинил, хиноксалинил, бензоксазолил, бензотиазолил, бензимидазолил, бензофуранил, бензотиофенил, пирролопиразинил, пирролопиридинил и имидазопиридинил. Предпочтительные значения дляhet1 и het2 будут представлены ниже. В общей формуле (1) согласно настоящему изобретению, когда радикал моно- или полизамещен,указанный(ные) заместитель(ли) может(могут) находиться в любом желаемом положении(ниях), если не указано иное. Также, когда радикал полизамещен, указанные заместители могут быть одинаковыми или различными, если не указано иное. Согласно предпочтительному аспекту изобретения X выбирают из -CN, -СН 2 ОН, -С(О)ОН,-СН 2-NR1R2, -C(O)NR3R4, -СН 2-het1 и het1, где het1 в обеих группах -СН 2-het1 и het1 необязательно один раз или дважды замещен (С 1-С 4)алкилом, более предпочтительно X выбирают из -CH2-NR1R2,-C(O)NR3R4, -СН 2-het1 и het1, где het1 в обеих группах -СН 2-het1 и het1 необязательно один раз или дважды замещен (С 1-С 4)алкилом, где R1, R2, R3, R4 и het1 имеют указанные значения.het1 предпочтительно выбирают из 5- или 6-членной моноциклической гетероароматической группы или 9-членной бициклической гетероароматической группы, где каждая гетероароматическая группа-3 011161 содержит 1-3 атома азота или 1-2 атома азота и 1 атом кислорода, или 1 атом азота и 1 атом серы и каждая гетероароматическая группа необязательно один раз или дважды замещена (C1-C4)алкилом и, предпочтительно, необязательно один раз или дважды замещена (C1-C2)алкилом. Более предпочтительно X означает тиазолил, бензимидазолилметил, пиридинил, оксазолил, имидазопиридинилметил, пиримидинил, имидазолил, имидазолилметил или триазолилметил, где указанные тиазолил, бензимидазолилметил, пиридинил, оксазолил, имидазопиридинилметил, пиримидинил, имидазолил, имидазолилметил и триазолилметил, каждый, необязательно замещен одной метильной группой.R2 предпочтительно выбирают из группы, состоящей из водорода,(C1-С 6)алкила, необязательно замещенного одним или двумя заместителями, независимо выбранными из -S-(C1-C4)алкила, -O-(C1-C4)алкила, -SO2-(C1-C4)алкила и фенила, где указанный фенил необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, гидрокси, цианогруппы, (C1-C4)алкила и (С 1-С 4)алкоксигруппы,(С 3-С 6) циклоалкила,het2, необязательно замещенного одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (С 1-С 4)алкила и (C1-C4)алкоксигруппы, где het2 имеет указанные выше значения,-SO2-R5, где R5 выбирают из группы, состоящей из (С 1-С 4)алкила, [(С 1-С 4)алкил]2 аминогруппы, фенила и -(C1-C4)алкилфенила, где указанный фенил необязательно замещен одним заместителем, независимо выбранным из галогена и цианогруппы, и-С(О)-R6, где R6 выбирают из группы, состоящей из (С 1-С 4)алкила, [(C1-C4)алкил]2 аминогруппы,аминогруппы и -(C1-C4)алкилфенила, где указанный фенил необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (C1-C4)алкила и (C1-C4)алкоксигруппы. Более предпочтительно, R2 выбирают из группы, состоящей из(C1-С 3)алкила, необязательно замещенного -О-(C1-С 3)алкилом,(С 3-С 5) циклоалкила,het2, где het2 выбирают из группы, состоящей из 5- или 6-членных моноциклических гетероароматических кольцевых систем, содержащих 1-2 атома азота или 1 атом азота и 1 атом кислорода, или 1 атом азота и 1 атом серы, где указанный het2 необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (С 1-С 4)алкила и (C1-C4)алкоксигруппы, предпочтительно(C1-C4)алкилом,-SO2-R5, где R5 выбирают из группы, состоящей из (С 1-С 4)алкила, [(С 1-С 4)алкил]2 аминогруппы, фенила и -(С 1-С 4)алкилфенила, где указанный фенил необязательно замещен одним заместителем, независимо выбранным из галогена и цианогруппы, и где R5 означает предпочтительно (C1-C4)алкил,-C(O)-R6, где R6 выбирают из группы, состоящей из (C1-C4)алкила, [(C1-C4)алкил]2 аминогруппы,аминогруппы и -(C1-C4)алкилфенила, где указанный фенил необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, цианогруппы, (C1-C4)алкила и (C1-C4)алкоксигруппы,и где R6 означает предпочтительно (С 1-С 4)алкил. Согласно другому аспекту изобретения R2 предпочтительно означает (C1-С 3)алкил, необязательно замещенный метоксигруппой.het2 предпочтительно выбирают из группы, состоящей из 5- или 6-членных моноциклических гетероароматических кольцевых систем, содержащих 1 или 2 атома азота. Согласно следующему аспекту изобретения R2 предпочтительно означает пиридазинил. Согласно дальнейшему предпочтительному аспекту изобретения R1 и R2 вместе с атомом азота, с которым они связаны, образуют 4-, 5-, 6- или 7-членный насыщенный гетероцикл, где один атом углерода может быть заменен N, О, S, SO или SO2 и где указанный насыщенный гетероцикл необязательно замещен одной или двумя группами, независимо выбранными из гидрокси, галогена, =O, (C1-C4)алкила,-(С 1-С 4)алкил(С 3-С 6)циклоалкила, (С 1-С 4)алкоксигруппы, гидрокси(С 1-С 4)алкила, (С 1-С 4)алкокси(С 1 С 4)алкила, -SO2-(C1-C4)алкила, -С(O)-(С 1-С 4)алкила, [(C1-C4)алкил]2 аминогруппы, -C(O)NH2, С(О)О-(С 1 С 4)алкила и пирролидинона, более предпочтительно R1 и R2 вместе с атомом азота, с которым они связаны, образуют 5- или 6-членный насыщенный гетероцикл, выбранный из-4 011161 необязательно замещенный одной или двумя группами, независимо выбранными из гидрокси, фтора,гидроксиметила, метоксиметила, SO2-(C1-C4)алкила, -С(О)-(С 1-С 4)алкила, -CONH2 и пирролидинона. Еще более предпочтительно R1 и R2 вместе с атомом азота, с которым они связаны, образуют морфолинил. Предпочтительно R3 и R4, каждый независимо, выбирают из водорода и (С 1-С 4)алкила или R3 и R4 вместе с атомом азота, с которым они связаны, образуют 4-, 5- или 6-членный насыщенный гетероцикл,где один атом углерода может быть заменен N или О и где указанный насыщенный гетероцикл необязательно замещен (С 1-С 4)алкилом. Более предпочтительно R3 и R4 независимо выбирают из водорода, метила и этила или R3 и R4 вместе с атомом азота, с которым они связаны, образуют пирролидинильное, пиперидинильное, пиперазинильное или азетидинильное кольцо (где каждое пирролидинильное, пиперидинильное, пиперазинильное и азетидинильное кольцо необязательно замещено метилом). Предпочтительно Y выбирают из СН 2, СН(ОН), О и С=O, более предпочтительно Y означает О. Предпочтительно Z означает О. Предпочтительно m равен 1 или 2 и p равен 2, более предпочтительно m и p, оба, равны 2. Согласно одному предпочтительному аспекту изобретения R представляет собой группу формулы гдеозначает место присоединения к Z, L означает (С 2-С 5)алкилен и R7 и R8, каждый независимо, выбирают из водорода, (C1-С 6)алкила, (С 3-С 6)циклоалкила, гидрокси(C1-С 6)алкила или R7 и R8 вместе с атомом азота, с которым они связаны, образуют 4-, 5-, 6- или 7-членный насыщенный гетероцикл, где один атом углерода необязательно заменен N, О, S, SO или SO2 и где указанный насыщенный гетероцикл необязательно замещен одной или двумя группами, независимо выбранными из (C1-C4)алкила, (C1C4)алкоксигруппы, (C1-C4)алкокси(С 1-С 4)алкила, гидрокси(C1-C4)алкила, гидрокси, -С(О)О-(C1C4)алкила, -С(О)-(C1-C4)алкил-NH2, -C(O)NH2 и галогена. Примерами 4-, 5-, 6- или 7-членного насыщенного гетероцикла являются Еще более предпочтительно R7 и R8 вместе с атомом азота, с которым они связаны, образуют морфолинил или оксазепанил. Согласно другому предпочтительному аспекту R7 и R8 вместе с атомом азота, с которым они связаны, образуют 4-, 5- или 6-членный насыщенный гетероцикл, необязательно замещенный одной или двумя (С 1-С 4)алкильными группами, предпочтительно метилом. Согласно другому более предпочтительному аспекту насыщенным гетероциклом является пирролидинил, необязательно замещенный одной или двумя метильными группами. Предпочтительно L означает пропилен. Согласно другому предпочтительному аспекту изобретения R означает группу формулы гдеозначает место присоединения к Z, N-содержащим кольцом является 4- или 6-членный насыщенный гетероцикл, n означает целое число, равное 0 или 1, и R9 означает заместитель, выбранный из водорода, (C1-C4)алкила и (С 3-С 6)циклоалкила. Предпочтительно R9 означает изопропил или циклобутил. Когда одна из групп в соединении формулы (1) замещена галогеном, обычно фтором или хлором, в особенности предпочтительным является фтор. Особенно предпочтительные соединения изобретения включают соединения, где каждую переменную в формуле (1) выбирают из подходящих и/или предпочтительных групп для каждой переменной. Еще более предпочтительные соединения изобретения включают соединения, где каждую переменную в формуле (1) выбирают из более предпочтительных или в высшей степени предпочтительных-5 011161 групп для каждой переменной. Согласно особому аспекту изобретения следующие соединения исключены из изобретения: соединения формулы (1), где Y означает О, Z означает О, R означает группу формулы где R10 означает водород или (C1-C4)алкил, R11 означает (C1-C4)алкокси, гидрокси или N-C1-C4)алкил)2 иCH2NR1R2, где R1 означает водород или (C1-C4)алкил и R2 означает или водород, (C1-C4)алкил (необязательно замещенный фенилом), или -С(О)-(С 1-С 4)алкил. Согласно другому воплощению настоящего изобретения предусматривается соединение формулыN2-4-[4-(3-пирролидин-1-илпропокси)фенил]тетрагидропиран-4-илметилпиридин-2,3-диамин. Особенно предпочтительными являются соединения формулы (1), как описано в разделе примеров ниже. Там, где в примерах получают солевую форму, соединение настоящего изобретения включает форму свободного основания, как, например,4-[4-(3-пирролидин-1-илпропокси)фенил]тетрагидропиран-4-илметиламин; 4-[4-(3-пиперидин-1-илпропокси)фенил]тетрагидропиран-4-илметиламин и диметил 4-[4-(3-пиперидин-1-илпропокси)фенил]тетрагидропиран-4-илметиламин. В другом воплощении настоящего изобретения особенно предпочтительными примерами являются 4-[4-(1-изопропилпиперидин-4-илокси)фенил]тетрагидропиран-4-илметилдиметиламин; диметил 4-[4-(4-пирролидин-1-илбутокси)фенил]тетрагидропиран-4-илметиламин; 4-[4-(3-пирролидин-1-илпропокси)фенил]тетрагидропиран-4-илметиламин; диметил 4-[4-(3-пирролидин-1-илпропокси)фенил]тетрагидропиран-4-илметиламин; 4-[4-(3-пиперидин-1-илпропокси)фенил]тетрагидропиран-4-илметиламин; диметил 4-[4-(3-пиперидин-1-илпропокси)фенил]тетрагидропиран-4-илметиламин; 1-метил-4-4-[4-(3-пирролидин-1-илпропокси)фенил]тетрагидропиран-4-илметилпиперазин;N,N-диметил-1-(4-4-[3-(4-метил-1,4-диазепан-1-ил)пропокси]фенилтетрагидро-2 Н-пиран-4 ил)метанамин; 1-(4-[4-(3-пирролидин-1-илпропокси)фенил]тетрагидро-2 Н-пиран-4-илметил)-1 Н-имидазо[4,5b]пиридин; 4-(4-[4-(3-азетидин-1-илпропокси)фенил]тетрагидро-2 Н-пиран-4-илметил)морфолин; 2-4-[4-(3-пирролидин-1-илпропокси)фенил]тетрагидро-2 Н-пиран-4-ил-1 Н-имидазол; 4-(3-4-[4-(пиперазин-1-илкарбонил)тетрагидро-2 Н-пиран-4-ил]феноксипропил)-1,4-оксазепан; 4-[3-(4-4-[(4-метилпиперазин-1-ил)карбонил]тетрагидро-2 Н-пиран-4-илфенокси)пропил]-1,4 оксазепан; 4-4-[4-(3-пирролидин-1-илпропокси)фенил]тетрагидро-2 Н-пиран-4-илпиримидин; 4-метил-1-(4-[4-(3-пирролидин-1-илпропокси)фенил]тетрагидро-2 Н-пиран-4-илметил)-1 Нимидазол; 4-4-[4-(3-пирролидин-1-илпропокси)фенил]тетрагидро-2 Н-пиран-4-ил-1 Н-имидазол; 4-[4-(4-3-[этил(метил)амино]пропоксифенил)тетрагидро-2 Н-пиран-4-илметил]морфолин. Другим воплощением изобретения является промежуточный продукт, как описано в данном патенте. Фармацевтически приемлемые соли соединений формулы (1) включают их аддитивные соли кислот и оснований. Подходящие аддитивные соли кислот получают из кислот, которые дают нетоксичные соли. Примеры включают соли, такие как ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисуль- 10011161 фат/сульфат, борат, камзилат, цитрат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидроиодид/иодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напзилат, никотинат, нитрат,оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, сахарат, стеарат, сукцинат,тартрат, тозилат и трифторацетат. Подходящие соли оснований получают из оснований, которые дают нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Также могут быть получены полусоли кислот и оснований, например, полусульфатные и полукальциевые соли. По поводу обзора в отношении подходящих солей см. Stahl и Wermuth Hadbook of PharmaceuticalSalts: Proreties, Selection and Use (Wiley-VCH, Weinheim, Германия, 2002). Фармацевтически приемлемые соли соединений формулы (1) могут быть получены одним или более из трех способов:(i) взаимодействием соединения формулы (1) с желаемой кислотой или основанием;(ii) путем удаления кислотной или основной лабильной защитной группы из подходящего предшественника соединения формулы (1) или путем раскрытия кольца подходящего циклического предшественника, например лактона или лактама, используя желаемую кислоту или основание; или(iii) путем превращения одной соли соединения формулы (1) в другую взаимодействием с подходящей кислотой или основанием или с помощью подходящей ионообменной колонки. Все три реакции обычно осуществляют в растворе. Полученную соль можно осаждать и собирать фильтрованием или можно выделить путем выпаривания растворителя. Степень ионизации полученной соли может изменяться от полностью ионизированной до почти неионизированной. Соединения согласно данному изобретению могут существовать как в несольватированной, так и в сольватированной формах. Термин сольват используют в данном описании для описания молекулярного комплекса, содержащего соединение настоящего изобретения и стехиометрическое количество одной или более молекул фармацевтически приемлемого растворителя, например этанола. Термин гидрат употребляют, когда указанным растворителем является вода. В объем настоящего изобретения входят комплексы, такие как клатраты, комплексы включения лекарственное средство-хозяин, где, в отличие от указанных сольватов, лекарственное средство и хозяин находятся в стехиометрических или нестехиометрических количествах. Также входят комплексы лекарственного средства, содержащего два или более органических и/или неорганических компонентов,которые могут находиться в стехиометрических или нестехиометрических количествах. Полученные комплексы могут быть ионизированными, частично ионизированными или неионизированными. В отношении обзора таких комплексов, см. Haleblian, J. Pharm. Sci., 64(8), 1269-1288 (август, 1975). В дальнейшем, все ссылки на соединения формулы (1) включают ссылки на их соли, сольваты и комплексы и на сольваты и комплексы их солей. Соединения изобретения включают соединения формулы (1), как указано выше, включая все их полиморфы и кристаллические формы, их пролекарства и изомеры (включая оптические, геометрические и таутомерные изомеры), как указано в дальнейшем, и изотопно-меченые соединения формулы (1). Как указано, так называемые пролекарства соединений формулы (1) также входят в объем настоящего изобретения. Так, некоторые производные соединений формулы (1), которые могут обладать незначительной фармакологической активностью или нет, когда их вводят в организм или наносят на тело, могут превращаться в соединения формулы (1), имеющие желаемую активность, например, за счет гидролитического расщепления. Такие производные относят к пролекарствам. Дальнейшую информацию по применению пролекарств можно найти в "Prodrugs as Novel Delivery Systems", том 14, ACS Symposium Series (T. Higuchi and W. Stella) и "Bioreversible Carriers in Drug Design", Pergamon Press, 1987(ред. Е.В. Roche, American Pharmaceutical Association). Пролекарства настоящего изобретения могут быть получены, например, путем замены соответствующих функциональных групп, имеющихся в соединениях формулы (1), некоторыми остатками, известными специалисту в данной области, в виде проостатков, как описано, например, в "Design ofProdrugs", H. Bundgaard (Elsevier, 1985). Некоторые примеры пролекарств настоящего изобретения включают:(i) когда соединение формулы (1) содержит функциональную группу карбоновой кислоты (-СООН),его сложный эфир, например, соединение, где атом водорода в функциональной группе карбоновой кислоты соединения формулы (1) заменен (C1-C8)алкилом;(ii) когда соединение формулы (1) содержит спиртовую функциональную группу (-ОН), его простой эфир, например, соединение, где атом водорода в спиртовой функциональной группе соединения формулы (1) заменен (C1-С 6)алканоилоксиметилом; и(iii) когда соединение формулы (1) содержит функциональную первичную или вторичную аминогруппу (-NH2 или -NHR, где RH), его амид, например, соединение, где, в зависимости от случая, один или оба атома водорода функциональной аминогруппы соединения формулы (1) заменен(ы) (С 1- 11011161 С 10)алканоилом. Дальнейшие примеры групп-заместителей, в соответствии с представленными выше примерами и примерами других типов пролекарств, можно найти в вышеприведенных ссылках. Кроме того, некоторые соединения формулы (1) сами по себе могут действовать в качестве пролекарств других соединений формулы (1). Также, в объем настоящего изобретения входят метаболиты соединений формулы (1), т.е. соединения, образующиеся in vivo после введения лекарственного средства. Некоторые примеры метаболитов согласно данному изобретению включают:(i) когда соединение формулы (1) содержит метильную группу, его гидроксиметильное производное (-СН 3-СН 2 ОН);(ii) когда соединение формулы (1) содержит алкоксигруппу, его гидроксипроизводное (-OR-ОН);(iii) когда соединение формулы (1) содержит третичную аминогруппу, его вторичное аминопроизводное (-NRaRb-NHRa или -NHRb);(iv) когда соединение формулы (1) содержит вторичную аминогруппу, его первичное аминопроизводное (-NHRa-NH2);(v) когда соединение формулы (1) содержит фенильный остаток, его фенольное производное(vi) когда соединение формулы (1) содержит амидную группу, его карбоксильное производное(-CONRcRdCOOH). Соединения формулы (1), содержащие один или более асимметрических атомов углерода, могут существовать в виде двух или более стереоизомеров. Когда структурные изомеры взаимопревращаемы за счет низкого энергетического барьера, может иметь место таутомерная изомерия (таутомерия). Она может принимать форму протонной таутомерии в соединениях формулы (1), содержащих, например,имино-, кето- или оксимную группу, или так называемой валентной таутомерии в соединениях, которые содержат ароматический остаток. Отсюда следует, что одно соединение может проявлять более чем один тип изомерии. В объем настоящего изобретения входят все стереоизомеры, геометрические изомеры и таутомерные формы соединений формулы (1), включая соединения, проявляющие более чем один тип изомерии,и смеси одного или более из них. Также входят аддитивные соли кислот или оснований, где противоион оптически активен, например d-лактат или l-лизин, или является рацемическим, например dl-тартрат илиdl-аргинин. Стандартные способы получения/выделения отдельных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного), используя, например, хиральную высокоэффективную жидкостную хроматографию(ВЭЖХ). Альтернативно, рацемат (или рацемический предшественник) может быть подвергнут взаимодействию с подходящим оптически активным соединением, например, со спиртом, или, в случае, где соединение формулы (1) содержит кислотный или основной остаток, с кислотой или основанием, такой (таким),как винная кислота или 1-фенилэтиламин. Полученную диастереомерную смесь можно разделять хроматографией и/или фракционной кристаллизацией и один или оба из диастереоизомеров превращать в соответствующий(ие) чистый(е) энантиомер(ы) способом, хорошо известным квалифицированному специалисту. Хиральные соединения настоящего изобретения (и их хиральные предшественники) можно получать в энантиомерно-обогащенной форме, используя хроматографию, обычно ВЭЖХ, на асимметрической смоле с подвижной фазой, состоящей из углеводорода, обычно гептана или гексана, содержащей 050 об.% изопропанола, обычно 2-20 об.% и 0-5 об.% алкиламина, обычно 0,1 об.% диэтиламина. Концентрирование элюата приводит к обогащенной смеси. Стереоизомерные конгломераты можно разделять с помощью стандартных методов, хорошо известных специалисту в данной области, см., например, E.L. Eliel "Stereochemistry of Organic Compounds"(Wiley, Нью-Йорк, 1994). Настоящее изобретение включают все фармацевтически приемлемые изотопно-меченые соединения формулы (1), где один или более атомов заменены атомами, имеющими одинаковое атомное число,но атомная масса или массовое число отличны от атомной массы или массового числа, которые преобладают в природе. Примеры изотопов, подходящих для включения в соединения настоящего изобретения, включают изотопы водорода, такие как 2 Н и 3 Н, углерода, такие как 11C, 13 С и 14 С, хлора, такой как 36Cl, фтора, такой как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15 О, 17 О и 18 О, фосфора, такой как 32 Р, и серы, такой как 35S. Некоторые изотопно-меченые соединения формулы (1), например, включающие радиоактивный изотоп, полезны при исследованиях по распределению лекарственных средств и/или субстратов в тканях. Радиоактивные изотопы тритий, т.е. 3 Н, и углерод-14, т.е. 14 С, особенно пригодны для этой цели ввиду их- 12011161 легкого внедрения и быстрого способа определения. Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может давать некоторые терапевтические преимущества, получаемые вследствие большей метаболической стабильности, например,увеличенный in vivo период полураспада или уменьшенные потребности в дозировке, и, следовательно,это может быть предпочтительным в некоторых случаях. Замещение изотопами с эмиссией позитронов, такими как 11 С, 18F, 15O и 13N, может быть пригодным при исследованиях с использованием позитронной эмиссионной топографии (ПЭТ) для оценки связанности рецептора с субстратом. Изотопно-меченые соединения формулы (1) обычно могут быть получены с помощью стандартных методик, известных специалисту в данной области, или способами, аналогично указанным в сопроводительных примерах и получениях, используя подходящие изотопно-меченые реагенты вместо немеченых реагентов, применяемых ранее. Фармацевтически приемлемые сольваты настоящего изобретения включают сольваты, где растворитель кристаллизации может быть изотопно замещен, например, D2O, d6-ацетон, d6-ДМСО. Производные фенола и тиофенола формулы (1) могут быть получены при использовании обычных методик, таких как проиллюстрированные ниже способы, где R, X, Y, Z, m, p, R1, R2, R3, R4, R5, R6, R7, R8 и R9 имеют указанные значения, если не указано иное. Соединения формулы (1), где X означает -CH2NR1R2, могут быть получены из соединений формулы используя стандартные способы взаимопревращения функциональных групп, известные специалисту в данной области, как описано, например, в руководстве R.C. Larock Comprehensive Organic Transformations, первое издание, 1989, VCH Publishers Inc. Такие способы включают: 1) восстановительное алкилирование с помощью альдегидов или кетонов при использовании восстановителя (как, например, муравьиная кислота или NaHB(ОАс)3) в подходящем растворителе (как, например, дихлорметан, тетрагидрофуран), необязательно с добавлением уксусной кислоты, при температуре от комнатной (около 20 С) до температуры кипения с обратным холодильником; 2) алкилирование с помощью алкилгалогенидов и основания (как, например, карбонат калия, третбутилат калия) в подходящем растворителе (как, например, ацетонитрил, тетрагидрофуран) при температуре от комнатной (около 20 С) до температуры кипения с обратным холодильником; 3) сульфонилирование с помощью сульфонилхлорида и основания (как, например, триэтиламин, Nэтилдиизопропиламин) в подходящем растворителе (как, например, дихлорметан) при температуре от комнатной до температуры кипения с обратным холодильником; 4) гетероарилирование с помощью галогенгетероароматической или гетероароматической сульфокислоты и основания (как, например, карбонат калия) в подходящем растворителе (как, например, ацетонитрил) при температуре от комнатной (около 20 С) до температуры кипения с обратным холодильником. Альтернативно, эта реакция может быть осуществлена под воздействием микроволнового облучения, альтернативно, используя N-этилдиизопропиламин в качестве основания, необязательно в подходящем растворителе (как, например, N-метилпирролидон, ацетонитрил); 5) образование мочевины с помощью диалкилкарбамоихлорида или цианатной соли, необязательно в присутствии основания (как, например, триэтиламин) или кислоты (как, например, уксусная кислота) в подходящем растворителе (как, например, дихлорметан или вода) при температуре от комнатной до температуры кипения с обратным холодильником; 6) образование сульфонилмочевины с помощью диалкилсульфамоилхлорида и основания (как, например, триэтиламин) в подходящем растворителе (как, например, дихлорметан) при температуре от комнатной до температуры кипения с обратным холодильником; 7) ацилирование с помощью активированной кислоты (как, например, хлорангидрид или ангидрид уксусной кислоты) и основания (как, например, триэтиламин) в подходящем растворителе (как, например, дихлорметан) при температуре от комнатной до температуры кипения с обратным холодильником; 8) катализируемое палладием перекрестное сочетание с галогенгетероароматическим соединением,используя подходящий источник палладия (как, например, трис(дибензилиденацетон)палладий(0, необязательно в присутствии хелатирующего лиганда (как, например, BINAP) и в присутствии подходящего основания (как, например, трет-бутилат натрия) в растворителе (как, например, толуол) при температуре от комнатной до температуры кипения с обратным холодильником. Эти превращения могут быть осуществлены последовательно с получением соединений, где R1 и R2 имеют указанные выше значения. Соединения формулы (2) могут быть получены восстановлением соответствующих цианопроизвод- 13011161 ных формулы (3) с помощью подходящего восстановителя (как, например, LiAlH4 или газообразный водород в присутствии катализатора, такого как PtO2) в подходящем растворителе (как, например, диэтиловый эфир/дихлорметан, тетрагидрофуран или изопропанол) при температуре от комнатной до температуры кипения с обратным холодильником. Соединения вышеприведенной формулы (3) фактически соответствуют соединениям формулы (1),где X означает CN-группу. Соединения формулы (3), где Z означает О, могут быть получены алкилированием соответствующих гидроксипроизводных формулы (4) с помощью производного формулы R-RLG, где RLG означает уходящую группу, такую как галоген, мезилат или тозилат, в присутствии основания (как, например, карбонат калия) и необязательно в присутствии добавки (как, например, иодид калия) в подходящем растворителе (как, например, диметилформамид) при температуре от комнатной до температуры кипения с обратным холодильником. Когда R означает группу формулы как указано выше, тогда производное формулы R-RLG может быть получено алкилированием соответствующего аминопроизводного формулы NHR7R8 с помощью производного формулы RLG-L-RLG и основания (как, например, NaOH, Na2CO3, K2CO3, Cs2CO3), необязательно в присутствии добавки (как, например, иодид калия), в подходящем растворителе (как, например, N,N-диметилформамид, ацетонитрил,ацетонитрил/H2O), при температуре от комнатной до температуры кипения с обратным холодильником. Аминопроизводное формулы NHR7R8 является или коммерчески доступным, или его получают при использовании способов, известных специалисту в данной области. Когда R означает группу формулы как указано выше, тогда производное формулы R-RLG является или коммерчески доступным, или может быть получено при использовании указанных в литературе способов, хорошо известных специалисту в данной области. Соединения формулы (4) могут быть получены путем снятия защиты с соответствующих производных формулы (5), где Z означает О где Rp означает защитную группу (как, например, метил, удаляемый с помощью BBr3 в дихлорметане при температуре от 0 С до комнатной температуры). Соединения формулы (5) являются или коммерчески доступными, или могут быть получены двойным алкилированием соединений формулы (6) где Rp имеет указанные выше значения, с помощью соединений формулы (7) где RLG имеет указанные выше значения, и основания (как, например, NaH), необязательно в присутствии добавки (как, например, иодид калия) в подходящем растворителе (как, например, N,Nдиметилформамид, N-метилпирролидинон) при температуре от комнатной до температуры кипения с обратным холодильником. Соединения формул (6) и (7), каждое, является или коммерчески доступным, или его получают при- 14011161 использовании указанных в литературе способов, хорошо известных специалисту в данной области. Соединения формулы (3), где Z означает S, могут быть получены из соединений формулы (5), где Z означает S и Rp означает метил, перегруппировкой Pummerer, с последующим алкилированием полученного промежуточного продукта с помощью производного формулы R-RLG. Реакцию завершают обработкой соединения формулы (5) подходящим окислителем (как, например, м-СРВА) в подходящем растворителе (как, например, дихлорметан) при температуре 0 С, получая соответствующий сульфид. Обработка промежуточного продукта ангидридом трифторуксусной кислоты в присутствии подходящего основания (как, например, 2,6-лутидин) в подходящем растворителе (как, например, ацетонитрил) при температуре около -15 С, с последующим взаимодействием с R-RLG в присутствии основания (как, например, триэтиламин, карбонат калия) в подходящем растворителе (как, например, N,N-диметилформамид) при температуре от 0 С до комнатной температуры приводит к соединению формулы (3). Альтернативно, соединения формулы (3), где Z означает О, могут быть получены алкилированием соединений формулы (4) с помощью спиртового производного формулы ROH, который является или коммерчески доступным, или его получают при использовании указанных в литературе способов, хорошо известных специалисту в данной области, используя реагенты Митцунобу, такие как PPh3 и DIAD, в подходящем растворителе (как, например, тетрагидрофуран (ТГФ при температуре от 0 С до температуры кипения с обратным холодильником. Специалистам в данной области понятно, что для получения соединений формулы (1) альтернативным или более подходящим образом, отдельные стадии способа, указанные в данном разделе, могут быть осуществлены в различном порядке. Например, соединения формулы (1), где Z означает О и X означает -CH2NR1R2, могут быть получены алкилированием соединений формулы (8) с помощью производного формулы R-RLG или ROH, как указано выше, используя условия, аналогично указанным в случае получения соединений формулы (3). Соединения формулы (8) могут быть получены путем снятия защиты с соединений формулы (9) где Rp имеет указанные выше значения, используя соответствующие условия для защитной группы и природы R1 и R2 (например, используя NaSMe в диметилформамиде при температуре 130 С, когда Rp означает метил и R1 и R2 означают (C1-C4)алкил). Соединения формулы (9) могут быть получены из соответствующих аминопроизводных формулы используя условия, аналогично указанным для получения соединений формулы (1) из соединений формулы (2). Соединения формулы (10) могут быть получены из соединений формулы (5), где Z означает О, используя условия восстановления, аналогично указанным для получения соединений формулы (2) из соединений формулы (3). Дальнейшим примером осуществления отдельных стадий способа, описанных в данном разделе, в другом порядке для получения соединений формулы (1) альтернативным или более подходящим образом, является получение соединений формулы (1), где Z означает О, двойным алкилированием соединений формулы (11) с помощью соединений вышеприведенной формулы (7), используя условия, аналогично указанным для получения соединений формулы (5) из соединений формулы (6). Соединения формулы (11) могут быть получены из соответствующих гидроксипроизводных формулы (12)- 15011161 используя условия, аналогично указанным для получения соединений формулы (3) из соединений формулы (4). Соединения формулы (12) являются или коммерчески доступными, или их получают, используя указанные в литературе способы, хорошо известные специалисту в данной области. Примером осуществления отдельных стадий способа, описанных в данном разделе, в другом порядке для получения соединений формулы (1), где Z означает О и R означает группу формулы является получение таких соединений взаимодействием соединений формулы (13) где RLG имеет указанные выше значения, с аминопроизводными формулы NHR7R8, используя условия,аналогично описанным выше для получения R-RLG. Альтернативно, такое же превращение может быть осуществлено путем нагревания соединений формулы (13) с аминопроизводными формулы NHR7R8 и основанием (как, например, диизопропилэтиламин) в подходящем растворителе (как, например, N-метилпирролидон) при температуре 150-200 С в течение 5-10 мин, используя микроволновую печь. Альтернативно, соединения формулы (1), где Z означает О, X означает -CH2NR1R2 и R1 и R2 означают водород или необязательно замещенный (С 1-С 4)алкил или вместе с атомом азота, с которым они связаны, образуют необязательно замещенный 4-, 5- или 6-членный насыщенный гетероцикл, где атом углерода может быть заменен N, О, S, SO или SO2, могут быть получены восстановительным аминированием соединений формулы (14) с помощью аминопроизводного формулы HNR1R2 и восстановителя (например, NaHB(ОАс)3), необязательно в присутствии кислоты Льюиса (например, Ti(О-изопропил)4) в подходящем растворителе (как,например, этанол) при температуре от 0 С до температуры кипения с обратным холодильником. Соединения формулы (14) могут быть получены восстановлением соединений формулы (3), где Z означает О, с помощью восстановителя (как, например, диизобутилалюминийгидрид) в подходящем растворителе (как, например, толуол) при температуре от -78 С до комнатной температуры (около 20 С). Альтернативно, соединения формулы (14) могут быть получены окислением соединений формулы(1), где Z означает О и X означает -СН 2 ОН, используя окислитель (например, пиридинийхлорформиат) в подходящем растворителе (как, например, дихлорметан) при температуре от 0 С до температуры кипения с обратным холодильником. Соединения формулы (1), где X означает -СН 2 ОН, могут быть получены восстановлением соединений формулы (1), где X означает -С(О)-О-(C1-C4)алкил, с помощью восстановителя (например, LiAlH4) в подходящем растворителе (как, например, тетрагидрофуран) при температуре от -78 С до температуры кипения с обратным холодильником. Соединения формулы (1), где X означает -С(O)-O-(С 1-С 4)алкил, могут быть получены этерификацией соединений формулы (1), где X означает СООН, используя стандартные методики, хорошо известные специалисту в данной области. Например, этерификация может быть осуществлена при использовании реагента, способного активировать карбоновую кислоту (как, например, тионилхлорид) и НО-(С 1 С 4)алкил, необязательно в присутствии дополнительного растворителя (как, например, дихлорметан) при температуре от 0 С до температуры кипения с обратным холодильником. Соединения формулы (1), где X означает С(О)ОН, могут быть получены гидролизом соединений вышеприведенной формулы (3) с помощью неорганической кислоты (как, например, концентрированная соляная кислота), необязательно в присутствии подходящего сорастворителя (как, например, диоксан) при температуре от 0 С до температуры кипения с обратным холодильником. Соединения формулы (1), где m и p, оба, равны 2, Z означает О и Y означает СН(ОН), могут быть получены восстановлением соединений формулы (1), где m и p, оба, равны 2 и Y означает С=O, с помощью восстановителя (например, LiAlH4) в подходящем растворителе (как, например, диэтиловый эфир) при температуре от 0 С до температуры кипения с обратным холодильником. Соединения формулы (1), где m и p, оба, равны 2, Z означает О и Y означает С=O, могут быть получены обработкой соединений формулы (15) хлоридом натрия в подходящем растворителе (например, диметилсульфоксид/вода) при температуре от 100 С до температуры кипения с обратным холодильником. Соединения формулы (15) могут быть получены обработкой соединений формулы (16) с помощью основания (например, NaH) в подходящем растворителе (как, например, 1,2-диметоксиэтан) при температуре от комнатной до температуры кипения с обратным холодильником. Соединения формулы (16) могут быть получены алкилированием соединений вышеприведенной формулы (11) с помощью метилакрилата и основания (как, например, гидроксид бензилтриметиламмония) в подходящем растворителе (например, метанол/ацетонитрил) при температуре от комнатной до температуры кипения с обратным холодильником. Соединения формулы (1), где X означает -CONH2, могут быть получены обработкой соединений вышеприведенной формулы (3) с помощью полифосфорной кислоты или комплекса трифторид борауксусная кислота при температуре от комнатной до 100 С. Соединения формулы (1), где X означает -CONR3R4, могут быть получены взаимодействием соединений формулы (1), где X означает СООН, последовательно с реагентом, способным активировать карбоновую кислоту (как, например, тионилхлорид) и затем с аминопроизводным формулы HNR3R4, в подходящем растворителе (как, например, дихлорметан) при температуре от 0 С до температуры кипения с обратным холодильником. Альтернативно, кислота может быть обработана амином формулы HNR3R4 в присутствии связующего агента (как, например, TBTU, гексафторфосфат O-бензотриазол-1-ил-N,N,N',N'тетраметилурония, гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида), необязательно в присутствии подходящей добавки (как, например, 1-гидроксибензотриазол) и основания (как, например,триэтиламин), в подходящем растворителе (как, например, дихлорметан, N,N-диметилформамид) при комнатной температуре. Соединения формулы (1), где X означает CH2NR1R2, могут быть получены восстановлением соединений формулы (1), где X означает -CONR3R4 и NR1R2, равносильные NR3R4, с помощью восстановителя(например, литийалюминийгидрид) в подходящем растворителе (как, например, тетрагидрофуран, диэтиловый эфир) при температуре от комнатной до 50 С. Соединения формулы (1), где X означает -СН 2-О-(С 1-С 4)алкил, могут быть получены алкилированием соединений формулы (1), где X означает -СН 2-ОН, с помощью производного формулы RLG-(C1C4)алкил, где RLG имеет указанные выше значения, и основания (например, NaH) в подходящем растворителе (как, например, диметилформамид) при температуре от комнатной до температуры кипения с обратным холодильником. Соединения формулы (1), где X означает -CH2-O-het2, могут быть получены алкилированием соединений формулы (1), где X означает -СН 2-ОН, с помощью производного формулы RLGhet2, путем катализируемого палладием сочетания с галогенгетероароматическим соединением, используя подходящий источник палладия (например, трис(дибензилиденацетон)палладий(0, необязательно в присутствии хелатирующего лиганда (например, BINAP) и в присутствии подходящего основания (как, например,трет-бутилат натрия) в растворителе (как, например, толуол) при температуре от комнатной до температуры кипения с обратным холодильником. Соединения формулы (1), где X означает het1, могут быть получены из соединений формулы (1), гдеX означает СООН, или, альтернативно, из соединений формулы (3) или (14), используя способы, известные специалисту в данной области, такие как описано в обычных руководствах по гетероциклическим соединениям, таких как J.A. Joule и K. Mills Heterocyclic Chemistry, 4-е издание, Blackwell publishing,2000, или Comprehensive Heterocyclic chemistry, том I и II, Pergamon Press. Например, соединения формулы (1), где X необязательно замещен 2-тиазолилом и Z означает О,могут быть получены обработкой соединений формулы (17)- 17011161 с помощью подходящего реагента (как, например, диметилацеталь бромацетальдегида, хлорацетон) иHCl в подходящем растворителе (как, например, этанол) при температуре кипения с обратным холодильником. Соединения формулы (17) могут быть получены взаимодействием соединений формулы (3), где Z означает О, с диэтилдитиофосфатом и водой при температуре 60 С. Соединения формулы (1), где X означает -СН 2-het1 и где указанный het1 связан с N, могут быть получены из соединений формулы (1), где X означает -CH2-NH2, используя способы, известные специалисту в данной области, такие как описано в общих руководствах по гетероциклическим соединениям, таких как J.A. Joule K. и Mills Heterocyclic Chemistry, 4-е издание, Blackwell publishing, 2000, или Comprehensive Heterocyclic chemistry, том I и II, Pergamon Press. Соединения формулы (1), где X означает -СН 2-het1 и где указанный het1 связан с С, могут быть получены из соединений формулы (1), где X означает -СООН, двухстадийным способом СН 2 гомологизации, используя синтез Arndt-Eistert (J. March Advanced Organic Chemistry, 4-е издание,Wiley-Interscience publication, 1992), с последующими стандартными способами получения гетероцикла из карбоновой кислоты, известными специалисту в данной области. Соединения формулы (1) и их предшественники, которые содержат сульфидную группу, могут быть окислены до соответствующих сульфоксидов или сульфонов, используя стандартные способы, хорошо известные специалисту в данной области, например, как описано R.C. Larock в ComprehensiveOrganic Transformations, 1-е издание, 1989, VCH Publishers Inc. Специалисту в данной области понятно, что некоторые соединения формулы (1) могут быть превращены в альтернативные соединения формулы (1), используя стандартные химические превращения. Примеры такого превращения включают ацилирование и сульфирование аминогрупп (например, см. примеры 166, 229, 230), реакции восстановительного аминирования (например, см. примеры 167, 168),алкилирование (например, см. пример 228) или гидрирование атомов галогенов (например, см. примеры 202, 203). Специалисту в данной области понятно, что в ходе осуществления вышеуказанных способов может оказаться необходимой защита функциональных групп промежуточных соединений защитными группами. Такие функциональные группы включают гидрокси, аминогруппу и группу карбоновой кислоты. Подходящие защитные группы для гидрокси включают триалкилсилил и диарилалкилсилил (например,трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), алкил (например, метил или метоксиэтил) и тетрагидропиранил. Подходящие защитные группы для аминогруппы включают третбутоксикарбонил, 9-флуоренилметоксикарбонил или бензилоксикарбонил. Подходящие защитные группы для группы карбоновой кислоты включают (C1-C4)алкильные или бензильные сложные эфиры. Защиту и снятие защиты с функциональных групп можно осуществлять до или после любой из описанных выше реакционных стадий. Введение и удаление защитных групп полностью описано в Protective Groups in Organic Chemistry под ред. J.W.F. McOmie, Plenum Press (1973); T.W. Greene and P.G.M. Wutz Protective Groups in OrganicSynthesis, 2-е издание, Wiley-Interscience Publication (1991) и P.J. Kocienski Protecting Groups, Thieme,1994. Соединения формулы (1), а также промежуточные продукты для их получения, могут быть очищены в соответствии с различными, хорошо известными методами, такими как перекристаллизация и хроматография. Соединения формулы (1), их фармацевтически приемлемые соли и/или производные формы представляют собой полезные фармацевтически активные соединения, которые подходят для терапии и профилактики многочисленных нарушений, в которые вовлечен рецептор гистамина Н 3, или в случае которых может эффективно индуцироваться агонизм или антагонизм этого рецептора. Соединения настоящего изобретения, предназначенные для фармацевтического применения, могут быть введены в виде кристаллических или аморфных продуктов. Они могут быть получены, например, в виде плотных слоев, порошков или пленок с помощью методов, таких как осаждение, кристаллизация,сушка вымораживанием, распылительная сушка или сушка выпариванием. Для этой цели можно использовать индукционную или радиационную сушку. Их можно вводить отдельно или в сочетании с одним или несколькими другими соединениями настоящего изобретения или в сочетании с одним или несколькими другими лекарственными средствами(или в виде их любого сочетания). Как правило, их вводят в виде готовой дозированной формы в сочетании с одним или более фармацевтически приемлемыми эксципиентами. Термин эксципиент используется в данном описании для описания любого ингредиента, другого, чем соединение(я) изобретения. Выбор эксципиента в большой степени зависит от факторов, таких как конкретный способ введения, влияние эксципиента на растворимость и стабильность и тип дозированной формы. Согласно другому аспекту изобретения предусматривается фармацевтическая композиция, содержащая соединение формулы (1) или его фармацевтически приемлемую соль и/или сольват, как указанные выше, вместе с фармацевтически приемлемым эксципиентом.- 18011161 Фармацевтические композиции, подходящие для введения соединений настоящего изобретения, и способы их получения легко понятны специалисту в данной области. Такие композиции и способы их получения можно найти, например, в Remington's Pharmaceutical Sciences, 19-е издание (Mack Publishing Company, 1995). Соединения изобретения можно вводить перорально. Пероральное введение может включать глотание, так, что соединение поступает в желудочно-кишечный тракт, или можно применять буккальное или подъязычное введение, при котором соединение поступает в кровоток непосредственно из полости рта. Готовые лекарственные формы, подходящие для перорального введения, включают твердые готовые лекарственные формы, такие как таблетки; капсулы, содержащие частицы, жидкости или порошки; лепешки (включая наполненные жидкостью), жевательные резинки, мульти- и нано-частицы, гели, твердый раствор, липосомы, пленки, овули, спреи, и жидкие готовые лекарственные формы. Жидкие готовые лекарственные формы включают суспензии, растворы, сиропы и эликсиры. Такие готовые лекарственные формы можно применять в качестве наполнителей в мягких или твердых капсулах и обычно включают носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или пригодное масло, и один или более эмульгаторов и/или суспендирующих агентов. Жидкие готовые лекарственные формы также можно получать путем разведения твердой формы, например,из саше. Соединения изобретения также можно применять в виде быстрорастворяющихся, быстродезинтегрирующихся дозированных форм, таких как описано Liang and Chen в Expert Opinion in Therapeutic Patents, 11(6), 981-986 (2001). В случае таблеточных дозированных форм, в зависимости от дозы, лекарственное средство может составлять от 1 до 80 мас.%, в расчете на дозированную форму, более конкретно от 5 до 60 мас.%, в расчете на дозированную форму. В дополнение к лекарственному средству, таблетки обычно содержат дезинтегрант. Примеры дезинтегрантов включают натрийкрахмалгликолят, натрийкарбоксиметилцеллюлозу, кальцийкарбоксиметилцеллюлозу, натрийкроскармеллозу, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, замещенную низшим алкилом гидроксипропилцеллюлозу, крахмал, предварительно желатинированный крахмал и альгинат натрия. Как правило, дезинтегрант содержится в количестве от 1 до 25 мас.%, предпочтительно от 5 до 20 мас.%, в расчете на дозированную форму. Связующие вещества обычно используют с целью придания когезивных свойств при получении таблетки. Подходящие связующие вещества включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, предварительно желатинированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, получаемый при распылительной сушке моногидрат, безводная и тому подобное), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат двухосновного фосфата кальция. Таблетки также могут необязательно содержать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, и придающие скольжение агенты (глиданты), такие как диоксид кремния и тальк. Если присутствуют, поверхностно-активные вещества могут содержаться в количестве от 0,2 до 5 мас.%, в расчете на таблетку, и придающие скольжение агенты могут содержаться в количестве от 0,2 до 1 мас.%, в расчете на таблетку. Таблетки также обычно содержат лубриканты, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Лубриканты обычно содержатся в количестве от 0,25 до 10 мас.%, предпочтительно от 0,5 до 3 мас.%, в расчете на таблетку. Другие возможные ингредиенты включают антиоксиданты, красители, ароматизаторы, консерванты и маскирующие вкус агенты. Конкретные таблетки содержат вплоть до примерно 80% лекарственного средства, примерно от 10 до примерно 90 мас.% связующего вещества, примерно от 0 до примерно 85 мас.% разбавителя, примерно от 2 до примерно 10 мас.% дезинтегрирующего агента и примерно от 0,25 до примерно 10 мас.% лубриканта. Таблеточные смеси могут быть подвергнуты прессованию непосредственно или с помощью валика для придания формы таблеткам. Таблеточные смеси или порции смесей могут быть подвергнуты, альтернативно, влажной и сухой грануляции или термогрануляции, затвердеванию из расплава или экструзии перед таблетированием. Конечная готовая лекарственная форма может содержать один или более слоев и может быть с нанесенным покрытием или без него; она может быть даже инкапсулирована. Готовые лекарственные формы в виде таблеток рассмотрены Н. Lieberman и L. Lachman в Pharmaceutical Dosage Forms: Tablets, том 1 (Marcel Dekker, Нью-Йорк, 1980). Потребляемые пероральные пленки для использования в медицине человека или ветеринарии являются обычно гибкими водорастворимыми или набухающими в воде тонкопленочными дозированными формами, которые могут быть быстро растворяющимися или прилипающими к слизистой оболочке и обычно содержат соединение формулы (1), пленкообразующий полимер, связующее вещество, раствори- 19011161 тель, увлажнитель, пластификатор, стабилизатор или эмульгатор, модифицирующий вязкость агент и растворитель. Некоторые компоненты такой готовой дозированной формы могут выполнять более чем одну функцию. Соединение формулы (1) может быть растворимым в воде или нерастворимым. Водорастворимое соединение обычно составляет от 1 до 80 мас.%, более конкретно от 20 до 50 мас.%, в расчете на растворенное вещество. Менее растворимые соединения могут составлять гораздо большую долю композиции,обычно вплоть до 88 мас.%, в расчете на растворенное вещество. Альтернативно, соединение формулы(1) может быть в форме гранул из множества микрочастиц. Пленкообразующий полимер может быть выбран из природных полисахаридов, белков или синтетических гидроколлоидов, и обычно содержится в пределах от 0,01 до 99 мас.%, более конкретно в пределах от 30 до 80 мас.%. Другие возможные ингредиенты включают антиоксиданты, красители, ароматизаторы и интенсификаторы вкуса и аромата, консерванты, стимулирующие слюноотделение агенты, хладагенты, сорастворители (включая масла), мягчители, наполнители, противовспенивающие вещества, поверхностноактивные вещества и маскирующие вкус агенты. Пленки настоящего изобретения обычно получают путем испарительной сушки тонких водных пленок, нанесенных на отслаивающийся материал-носитель или бумагу. Этого можно достигать за счет печной или туннельной сушки, обычно в комбинированной камере для сушки и нанесения покрытий,или путем сушки вымораживанием или вакуумной сушки. Твердые готовые лекарственные формы для перорального введения можно получать с немедленным и/или модифицированным высвобождением. Готовые лекарственные формы с модифицированным высвобождением включают замедленное, пролонгированное, импульсное, контролируемое, целенаправленное и программируемое высвобождение. Полезные готовые лекарственные формы с модифицированным высвобождением для целей настоящего изобретения описаны в патенте США 6106864. Подробности в отношении других пригодных способов высвобождения, таких как высокоэнергетические дисперсионные и осмотические, и с нанесенным покрытием частицы, приведены Verma и др. в Pharmaceutical Technology On-line, 25(2), 1-14 (2001). Использование жевательной резинки для достижения контролируемого высвобождения описано в международной заявке WO 00/35298. Соединения настоящего изобретения также можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие способы для парентерального введения включают внутривенный, внутриартериальный, внутрибрюшинный, интратекальный, внутрижелудочковый, интрауретральный, внутригрудинный,внутричерепной, внутримышечный и подкожный способы введения. Подходящие устройства для парентерального введения включают иголочные (включая микроиголочные) шприцы, безыголочные шприцы и приспособления для инфузии. Парентеральные готовые лекарственные формы обычно представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферирующие агенты (предпочтительно, до pH 3-9), но, для некоторых применений, они могут быть более пригодным образом приготовлены в виде стерильного неводного раствора или в виде сухой формы, используемой в сочетании с подходящим разбавителем, таким как стерильная непирогенная вода. Получение парентеральных готовых лекарственных форм в стерильных условиях, например, путем лиофилизации, можно без труда осуществлять, используя стандартные фармацевтические способы, хорошо известные специалисту в данной области. Растворимость соединений формулы (1), используемых для получения парентеральных растворов,можно увеличивать путем использования подходящих способов получения готовых лекарственных форм, таких как включение повышающих растворимость агентов. Могут быть получены готовые лекарственные формы для парентерального введения с немедленным и/или модифицированным высвобождением. Готовые лекарственные формы с модифицированным высвобождением включают замедленное, пролонгированное, импульсное, контролируемое, целенаправленное и программируемое высвобождение. Таким образом, соединения изобретения могут быть использованы для получения готовой лекарственной формы в твердом, полутвердом виде или в виде тиксотропной жидкости для введения как имплантирумое депо, обеспечивающее модифицированное высвобождение активного соединения. Примеры таких готовых лекарственных форм включают покрытые лекарственным средством стенты и микросферы поли(dl-молочная-гликолевая)кислоты (PGLA). Соединения настоящего изобретения также можно вводить местно через кожу или слизистую оболочку, т.е. дермально или трансдермально. Конкретные готовые лекарственные формы для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, кожные пластыри, облатки, имплантаты, тампоны, волокна, бинты и микроэмульсии. Также можно использовать липосомы. Конкретные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Можно включать усиливающие пенетрацию агенты - см., например, Finnin и Morgan, J. Pharm. Sci., 88(10), 955-958 (октябрь, 1999).- 20011161 Другие способы местного введения включают доставку путем электропорации, ионофореза, фонофореза, сонофореза и с помощью микроигольной или безыгольной (например, Powderject, Bioject и т.д.) инъекции. Могут быть получены готовые лекарственные формы для местного введения с немедленным и/или модифицированным высвобождением. Готовые лекарственные формы с модифицированным высвобождением включают замедленное, пролонгированное, импульсное, контролируемое, целенаправленное и программируемое высвобождение. Соединения настоящего изобретения также можно вводить интраназально или путем ингаляции,обычно в форме сухого порошка (или отдельно, в виде смеси, например, сухой смеси с лактозой, или в виде смешанной составной частицы, например, смешанной с фосфолипидами, такими как фосфатидилхолин) из ингалятора с сухим порошком или в виде аэрозольного спрея из емкости под давлением, насоса, разбрызгивателя, пульверизатора (предпочтительно, пульверизатора с использованием электрогидродинамики для получения густого тумана) или распылителя, с использованием или без подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Для интраназального применения, порошок может содержать биоадгезивный агент, например, хитозан или циклодекстрин. Емкость под давлением, насос, разбрызгиватель, пульверизатор или распылитель содержит раствор или суспензию соединения(й) настоящего изобретения, включающий(ую), например, этанол, водный этанол или подходящий альтернативный агент для диспергирования, растворения или пролонгированного высвобождения активного вещества, пропеллент(ы) в качестве растворителя и необязательно поверхностно-активное вещество, такое как сорбитантриолеат, олеиновая кислота или олигомолочная кислота. Перед применением в готовой лекарственной форме в виде сухого порошка или суспензии, лекарственный продукт тонко измельчают до размера, подходящего для введения путем ингаляции (обычно,менее чем 5 микрон). Это может быть достигнуто с помощью любого подходящего способа измельчения,такого как при использовании спиральной струйной мельницы, струйной мельницы с псевдоожиженным слоем, сверхкритической флюидизированной обработки до образования наночастиц, гомогенизации под высоким давлением или распылительной сушки. Могут быть получены капсулы (изготовляемые, например, из желатина или гидроксипропилметилцеллюлозы), пузыри и гильзы в целях использования в ингаляторе или инсуффляторе для вмещения порошковой смеси из соединения изобретения, подходящего порошкообразного основания, такого как лактоза или крахмал, и соответствующего модификатора, такого как 1-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, предпочтительно, последней. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящая готовая лекарственная форма в виде раствора для применения в пульверизаторе с использованием электрогидродинамики для получения густого тумана может содержать от 1 мкг до 20 мг соединения настоящего изобретения на воздействие и объем воздействия может изменяться от 1 до 100 мкл. Конкретная готовая лекарственная форма может содержать соединение формулы (1), пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые могут быть использованы вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Подходящие ароматизаторы, такие как ментол и левоментол, или подсластители, такие как сахарин или натрийсахарин, можно добавлять к готовым лекарственным формам настоящего изобретения, предназначенным для введения путем ингаляции/интраназального введения. Могут быть получены готовые лекарственные формы для введения путем ингаляции/интраназального введения с немедленным и/или модифицированным высвобождением, используя,например, PGLA. Готовые лекарственные формы с модифицированным высвобождением включают замедленное, пролонгированное, импульсное, контролируемое, целенаправленное и программируемое высвобождение. В случае ингаляторов с сухим порошком и аэрозолей, дозатор устанавливают посредством клапана,который высвобождает отмеренное количество. Дозаторы настоящего изобретения обычно приспособлены для введения отмеренной дозы или впрыска, содержащей(го) от 1 до 4000 мкг соединения формулы(1). Общая суточная доза обычно находится в пределах от 1 мкг до 20 мг, которую можно вводить в виде отдельной дозы или обычно в виде разделенных доз в течение суток. Соединения настоящего изобретения могут быть введены ректально или вагинально, например, в виде суппозитория, пессария или клизмы. Традиционной основой суппозитория является масло какао, но можно использовать в качестве соответствующих различные альтернативы. Можно получать готовые лекарственные формы для ректального/вагинального введения с немедленным и/или модифицированным высвобождением. Готовые лекарственные формы с модифицированным высвобождением включают замедленное, пролонгированное, импульсное, контролируемое, целенаправленное и программируемое высвобождение. Соединения настоящего изобретения также можно вводить непосредственно в глаз или в ухо,обычно в форме капель микронизированной суспензии или раствора в изотоническом, с установленным значением pH, стерильном физиологическом растворе. Другие готовые лекарственные формы, подходя- 21011161 щие для глазного и ушного введения, включают мази, биоразлагаемые (например, абсорбируемые гелевые губки, коллаген) и не являющиеся биоразлагаемыми (например, силикон) имплантаты, облатки, линзы и корпускулярные или везикулярные системы, такие как ниосомы или липосомы. Полимер, такой как сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер,например, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например, гелановая камедь, может быть включен вместе с консервантом,таким как бензальконийхлорид. Такие готовые лекарственные формы также можно вводить путем ионофореза. Можно получать готовые лекарственные формы для глазного/ушного введения с немедленным и/или модифицированным высвобождением. Готовые лекарственные формы с модифицированным высвобождением включают замедленное, пролонгированное, импульсное, контролируемое, целенаправленное или программируемое высвобождение. Соединения настоящего изобретения можно комбинировать с растворимыми макромолекулярными веществами, такими как циклодекстрин и его подходящие производные или содержащие полиэтиленгликоль полимеры, для улучшения их растворимости, скорости растворения, маскировки вкуса, биодоступности и/или устойчивости для использования при любом из вышеуказанных способов введения. Обнаружено, что комплексы лекарственного средства с циклодекстрином, например, обычно являются полезными для большинства дозированных форм и путей введения. Можно использовать как комплексы включения, так и комплексы невключения. В качестве альтернативы прямому комплексообразованию с лекарственным средством, можно использовать циклодекстрин в виде вспомогательной добавки,т.е. в виде носителя, разбавителя или солюбилизатора. Наиболее обычно используемыми для этих целей являются альфа-, бета- и гамма-циклодекстрины, примеры которых можно найти в международных заявках WO 91/11172, WO 94/02518 и WO 98/55148. Поскольку может быть желательным введение комбинации активных соединений, например, для цели лечения конкретного заболевания или состояния, в объем настоящего изобретения входит набор, в котором две или несколько фармацевтических композиций, по меньшей мере, одна из которых содержит соединение настоящего изобретения, подходящим образом комбинированы в виде набора, подходящего для совместного введения композиций. Таким образом, набор настоящего изобретения содержит две или несколько отдельных фармацевтических композиций, по меньшей мере одна из которых содержит соединение формулы (1) настоящего изобретения, и средства для раздельного сохранения вышеуказанных композиций, такие как контейнер,сосуд с перегородкой или разделенный пакет из фольги. Примером такого набора является обычная прозрачная упаковка, используемая для упаковки таблеток, капсул и подобного. Набор согласно данному изобретению особенно подходит для введения различных дозированных форм, например, перорально и парентерально, для введения отдельных композиций при различных интервалах дозировки или для титрования отдельных композиций друг против друга. Для соответствия условиям, набор обычно содержит инструкции в отношении введения и может быть снабжен так называемой памяткой. Для введения пациентам-людям, общая суточная доза соединений настоящего изобретения обычно находится в пределах от 0,001 до 2000 мг, в зависимости, конечно, от способа введения. Например, для перорального введения может быть необходима общая суточная доза от 1 до 2000 мг, в то время как для внутривенной суточной дозы может требоваться только от 0,01 до 100 мг. Общую суточную дозу можно вводить в виде одной дозы или в виде разделенных доз и можно, на усмотрение врача, выходить за пределы указанного конкретного диапазона. Эти дозы основаны на применении для обычного субъекта-человека, имеющего массу тела около 60-70 кг. Компетентный врач без труда способен определить дозы для субъектов, чья масса тела выходит за объем этого диапазона, таких как дети и пожилые люди. Для исключения сомнения, рекомендации, указанные в данном описании в отношении лечения,включают рекомендации для восстановительного, паллиативного и профилактического лечения. В соответствии с другим воплощением настоящего изобретения, соединения формулы (1) или их фармацевтически приемлемые соли, производные формы или композиции, также можно использовать в виде комбинации с одним или более дополнительными терапевтическими агентами для совместного введения пациенту с целью достижения некоторого, особенно желаемого терапевтического конечного результата. Вторым и более дополнительными терапевтическими агентами также может быть соединение формулы (1) или его фармацевтически приемлемая соль, производные формы или композиции, или один или более лигандов рецептора гистамина Н 3, известных в данной области. Более конкретно, второй и несколько терапевтических агентов выбирают из другого класса терапевтических агентов. Как используется в данном описании, под терминами совместное введение, совместно вводимый и в комбинации с, в отношении соединений формулы (1) и одного или нескольких других терапевтических агентов, подразумевают, что они означают, относятся к и включают следующее: одновременное введение такой комбинации соединения(й) формулы (1) и терапевтического(их) агента(ов) пациенту, нуждающемуся в лечении, когда такие компоненты используют вместе в виде од- 22011161 ной дозированной формы, которая высвобождает указанные компоненты, по существу, в одно и то же время для указанного пациента; по существу, одновременное введение такой комбинации соединения(й) формулы (1) и терапевтического(их) агента(ов) пациенту, нуждающемуся в лечении, когда такие компоненты используют отдельно один от другого в виде раздельных дозированных форм, которые вводят, по существу, в одно и то же время указанному пациенту, вследствие чего указанные компоненты высвобождаются, по существу, в одно и то же время для указанного пациента; последовательное введение такой комбинации соединения(й) формулы (1) и терапевтического(их) агента(ов) пациенту, нуждающемуся в лечении, когда такие компоненты используют отдельно один от другого в виде раздельных дозированных форм, которые вводят через последовательные промежутки времени указанному пациенту, со значительным временным интервалом между каждым введением,вследствие чего указанные компоненты высвобождаются, по существу, через различные периоды времени для указанного пациента; и последовательное введение такой комбинации соединения(й) формулы (1) и терапевтического(их) агента(ов) пациенту, нуждающемуся в лечении, когда такие компоненты используют вместе в виде одной дозированной формы, которая высвобождает указанные компоненты контролируемым образом,вследствие чего они одновременно, последовательно и/или частично совпадающим образом вводятся в течение одного и того же времени и/или в различные периоды времени указанному пациенту; где каждую часть можно вводить или одним и тем же или различными путями. Подходящие примеры других терапевтических агентов, которые могут быть использованы в комбинации с соединением(ями) формулы (1) или их фармацевтически приемлемыми солями, производными формами или композициями, включают, но не ограничиваются ими: антагонисты рецептора гистамина H1, например лоратидин, деслоратидин, фексофенадин и цетризин,антагонисты рецептора гистамина Н 4,антагонисты рецептора гистамина Н 2,антагонисты лейкотриена, включая антагонисты LTB4, LTC4, LTD4 и LTE4, в особенности, монтелукаст,ингибиторы фосфодиэстеразы, такие как ингибиторы PDE4 или ингибиторы PDE5,ингибиторы обратного поглощения нейротрансмиттера, например, флуоксетин, сертралин, пароксетин, ципразидон,ингибиторы 5-липоксигеназы (5-LO) или антагонисты активирующего 5-липоксигеназу белка(FLAP),вазоконстрикторные симпатомиметические агенты - агонисты 1- и 2-адренорецепторов для применения в качестве противоотечного средства,антагонисты мускаринового М 3-рецептора или антихолинергические агенты,агонисты 2-адренорецептора,теофиллин,хромогликат натрия,ингибиторы СОХ-1 (NSAID) и селективные ингибиторы СОХ-2,вводимые перорально или путем ингаляции глюкокортикостероиды,моноклональные антитела, активные против эндогенных воспалительных веществ,агенты против фактора некроза опухоли (анти-TNF-),ингибиторы адгезивной молекулы, включая VLA-4-антагонисты,антагонисты кинин-B1- и В 2-рецептора,иммунодепрессивные средства,ингибиторы матриксных металлопротеиназ (ММР),антагонисты рецептора тахикинина NK1, NK2 и NK3,ингибиторы эластазы,агонисты аденозин-А 2 а-рецептора,ингибиторы урокиназы,соединения, воздействующие на рецепторы допамина, например D2-агонисты,модуляторы NFk-пути, например IKK-ингибиторы,агенты, которые могут быть классифицированы как муколитические или противокашлевые,антибиотики,модуляторы цитокинных сигнальных путей, такие как ингибиторы р 38 МАР-киназы, syk-киназы или JAK-киназы,ингибиторы HDAC (гистондезацетилаза) и ингибиторы PI3-киназы. Согласно настоящему изобретению предпочтительны комбинации соединений формулы (1) с: антагонистами рецептора гистамина H1, как, например, лоратидин, деслоратидин, фексофенадин и- 23011161 цетризин,антагонистами рецептора гистамина Н 4,антагонистами рецептора гистамина Н 2,антагонистами лейкотриена, включая антагонисты LTB4, LTC4, LTD4 и LTE4, в частности, монтелукаст,ингибиторами фосфодиэстеразы PDE4,ингибиторами обратного поглощения нейротрансмиттера, как, например, флуоксетин, сертралин,пароксетин, ципразидон. Соединения формулы (1) обладают способностью взаимодействовать с Н 3-рецептором и, таким образом, имеют широкий диапазон терапевтических применений, как, далее, описано ниже, поскольку Н 3 рецептор играет существенную роль в физиологии всех млекопитающих. Согласно настоящему изобретению подразумевают, что Н 3-лиганды включают антагонисты, агонисты и инверсные агонисты Н 3 рецептора. Согласно предпочтительным показаниям в отношении лечения, в соответствии с настоящим изобретением, полагают, что в высшей степени подходящими являются Н 3-антагонисты. Согласно другому аспекту изобретения предусматривается соединение формулы (1), как указанно в данном описании, или его фармацевтически приемлемая соль и/или сольват для применения в качестве лекарственного средства. Дальнейший аспект настоящего изобретения относится к соединениям формулы (1) или их фармацевтически приемлемым солям, производным формам или композициям, для применения при лечении заболеваний, нарушений и состояний, в которые вовлечен Н 3-рецептор. Более конкретно, настоящее изобретение также относится к соединениям формулы (1) или их фармацевтически приемлемым солям, производным формам или композициям, для применения при лечении заболеваний, нарушений и состояний,выбранных из группы, состоящей из заболеваний центральной нервной системы: нарушения сна, мигрень, дискинезия, вызываемый стрессом страх, психотические расстройства, эпилепсия, вызываемые дефицитом познавательной способности заболевания, такие как болезнь Альцгеймера или легкое ухудшение познавательной способности, депрессия, эмоциональные расстройства, шизофрения, связанные с боязнью расстройства, расстройство, связанное с гиперактивностью при дефиците внимания (ADHD), ожирение, головокружение, вертиго, эпилепсия, болезнь движения; воспалительных заболеваний; респираторных заболеваний (респираторный дистресс-синдром взрослых, острый респираторный дистресс-синдром, бронхит, хронический бронхит, хроническая обструктивная болезнь легких, кистозный фиброз, астма, эмфизема, ринит, хронический синусит), аллергии, вызываемых аллергией ответных реакций дыхательных путей, аллергического ринита, вирусного ринита, неаллергического ринита, длящегося круглый год или сезонного ринита, назального застоя, аллергического застоя; женской половой дисфункции, включая гипофункциональное нарушение сексуального желания,нарушение полового возбуждения, оргастическое расстройство и сексуальное болевое нарушение; мужской половой дисфункции, включая нарушения желания у мужчин, эректильную мужскую дисфункицю, оргастические расстройства у мужчин, такие как преждевременная эякуляция; кардиальных дисфункций, таких как миокардиальная ишемия и аритмия; заболеваний желудочно-кишечного тракта, таких как воспалительное кишечное заболевание, болезнь Крона и язвенный колит; раковых заболеваний; гипотензии; боли и гиперфункциональных состояний мочевого пузыря. Соединения формулы (1) настоящего изобретения особенно полезны для лечения аллергии, вызываемых аллергией ответных реакций дыхательных путей, аллергического ринита, вирусного ринита, неаллергического ринита, длящегося круглый год или сезонного ринита, назального застоя, аллергического застоя. Еще дальнейший аспект настоящего изобретения также относится к применению соединений формулы (1) или их фармацевтически приемлемых солей, производных форм или композиций, для получения лекарственного средства, включающего Н 3-лиганд. В частности, настоящее изобретение относится к применению соединений формулы (1) или их фармацевтически приемлемых солей, производных форм или композиций для получения лекарственного средства для лечения Н 3-опосредованных заболеваний и/или состояний, в частности, заболеваний и/или состояний, перечисленных выше. Другой аспект настоящего изобретения относится к применению соединения формулы (1) или его фармацевтически приемлемой соли, производной формы или композиции, для получения лекарственного средства для лечения женской половой дисфункции, включая гипофункциональное нарушение сексуального желания, нарушение полового возбуждения, оргастическое расстройство и сексуальное болевое нарушение, или лечения мужской половой дисфункции, включая нарушения желания у мужчин, эректильную мужскую дисфункцию или оргастические расстройства у мужчин, такие как преждевременная- 24011161 эякуляция. Следовательно, настоящее изобретение относится к особенно представляющему интерес способу лечения млекопитающего, включая человека, с помощью эффективного количества соединения формулы(1) или его фармацевтически приемлемой соли, производной формы или композиции. Более конкретно,настоящее изобретение относится к особенно представляющему интерес способу лечения Н 3 опосредованных заболеваний и/или состояний млекопитающего, включая человека, в частности, заболеваний и/или состояний, перечисленных выше, включающему введение указанному млекопитающему эффективного количества соединения формулы (1), его фармацевтически приемлемых солей и/или производных форм. Примеры Следующие примеры иллюстрируют получение производных фенола и тиофенола формулы (1). Аббревиатура Промежуточный продукт 1. 4-(4-Метоксифенил)тетрагидро-2 Н-пиран-4-карбонитрил. 4-Метоксифенилацетонитрил (10 г, 67,9 ммоль) в диметилформамиде (50 мл) медленно добавляют к суспензии NaH (5,04 г, 150 ммоль) в диметилформамиде (50 мл) при температуре 0 С в атмосфере N2. Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 30 мин. Реакционную смесь охлаждают до температуры 0 С и в течение 80 мин по каплям добавляют бис-(2-хлорэтиловый)эфир (10,7 г, 74,7 ммоль) в диметилформамиде (100 мл). Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 1 ч. Реакцию гасят водой(200 мл) и смесь экстрагируют этилацетатом (3 раза по 300 мл). Объединенные органические экстракты промывают водой (2 раза по 200 мл), насыщенным раствором соли (200 мл), сушат над MgSO4, фильтруют, промывают этилацетатом и концентрируют в вакууме, получая указанное в заголовке соединение(17,2 г, выход: 100%). Промежуточный продукт 2. 4-(4-Гидроксифенил)тетрагидропиран-4-карбонитрил. Трибромид бора (1 М раствор в дихлорметане, 262 мл) добавляют к раствору 4-(4 метоксифенил)тетрагидро-2 Н-пиран-4-карбонитрила (14,7 г, 67,9 ммоль) в дихлорметане (294 мл) при температуре 0 С в атмосфере N2, поддерживая температуру ниже 5 С. Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 48 ч. Смесь охлаждают до температуры от -10 до 0 С смесью ацетона с сухим льдом и реакцию гасят насыщенным водным раствором бикарбоната натрия (294 мл). Смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 1 ч. Смесь разделяют и водную фазу экстрагируют дихлорметаном (3 раза по 250 мл). Объединенные органические экстракты сушат над MgSO4, фильтруют, промывают дихлорметаном и концентрируют в вакууме, получая указанное в заголовке соединение (10,8 г, выход: 78%). Промежуточный продукт 3. 4-(4-Диметиламинометилтетрагидропиран-4-ил)фенол. Стадия 1. К перемешиваемой суспензии LiAlH4 (79 г, 2,08 моль, 5 экв.) в ТГФ (900 мл), при температуре от 0 до 5 С в атмосфере азота, добавляют в течение 25 мин 4-(4-метоксифенил)тетрагидро-2 Н-пиран-4 карбонитрил (90 г, 0,414 моль) в ТГФ (900 мл), поддерживая температуру от 5 до 10 С. Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают до завершения реакции. По каплям добавляют гидроксид натрия (2 н., 850 мл), полученное твердое вещество отфильтровывают и промывают ТГФ (2 раза по 800 мл), органическую фазу концентрируют в вакууме при температуре 40 С. Остаток растворяют в этилацетате (300 мл) и сушат над MgSO4, фильтруют и концентрируют в вакууме при температуре 40 С, получая [4-(4-метоксифенил)тетрагидро-2 Н-пиран-4-ил]метиламин в виде светло-желтого масла (92 г, выход количественный). Стадия 2. В раствор [4-(4-метоксифенил)тетрагидро-2 Н-пиран-4-ил]метиламина (60 г, 0,271 моль) в воде(444 мл) и уксусной кислоте (213 мл) вводят формальдегид (37 мас.%, раствор в воде, 408 мл) и смесь охлаждают до температуры 0-5 С. Порциями добавляют триацетоксиборгидрид натрия (345 г,1,626 моль, 6 экв.), поддерживая температуру ниже 12 С. Смесь перемешивают при комнатной температуре до завершения реакции. Медленно добавляют гидроксид натрия (2 М раствор, 1000 мл) и смесь экстрагируют дихлорметаном (4 раза по 250 мл). Органические экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме при температуре 30 С, получая [4-(4-метоксифенил)тетрагидро-2 Н-пиран-4 ил]метилдиметиламин в виде желтого масла (53,5 г, выход: 80%). Стадия 3. К суспензии тиометилата натрия (49,2 г, 0,702 моль, 5 экв.) в диметилформамиде (140 мл) добавляют [4-(4-метоксифенил)тетрагидро-2 Н-пиран-4-ил]метилдиметиламин (35 г, 0,140 моль) и полученную смесь нагревают при температуре 130 С. По завершению реакции, оставляют охлаждаться до комнатной температуры и добавляют водный насыщенный раствор NH4Cl (525 мл). Полученную смесь экстрагируют этилацетатом (3 раза по 500 мл), сушат над MgSO4, фильтруют и концентрируют в вакууме при температуре 35 С, получая 4-(4-диметиламинометилтетрагидропиран-4-ил)фенол (промежуточный продукт 3) в виде желтого твердого вещества (35,7 г, выход: 108%), содержащий остаточное количество диметилформамида и этилацетата.- 26011161 Промежуточный продукт 4. 3-4-[(Диметиламино)метил]тетрагидропиран-4-илфенол. Стадия 1. 3-Метоксифенилацетонитрил (10 г, 67,9 ммоль) в диметилформамиде медленно добавляют к суспензии NaH (5,04 г, 150 ммоль) в диметилформамиде (50 мл) при температуре 0 С в атмосфере N2. Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 30 мин. Реакционную смесь охлаждают до температуры 0 С и в течение 80 мин по каплям добавляют бис-(2 хлорэтиловый)эфир (10,7 г, 74,7 ммоль) в диметилформамиде (100 мл). Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 1 ч. Реакцию гасят водой (500 мл) и смесь экстрагируют этилацетатом (3 раза по 100 мл). Объединенные органические экстракты промывают насыщенным раствором соли (3 раза по 50 мл), сушат над MgSO4, фильтруют, промывают этилацетатом и концентрируют в вакууме. Неочищенную смесь очищают колоночной хроматографией, элюируя гептаном, увеличивая полярность до смеси гептан:этилацетат (90:1), получая 4-(3-метоксифенил)тетрагидропиран-4-карбонитрил (4,1 г, выход: 28%). Стадия 2. К перемешиваемой суспензии LiAlH4 (3,7 г, 96,7 ммоль) в диэтиловом эфире (100 мл), охлажденной до температуры 0 С, по каплям добавляют раствор 4-(3-метоксифенил)тетрагидропиран-4-карбонитрила(4,2 г, 19,3 ммоль) в диэтиловом эфире (100 мл). После перемешивания при комнатной температуре в течение 30 мин, реакционную смесь кипятят с обратным холодильником в течение следующих 15 мин. Смесь охлаждают до температуры 10 С и по каплям последовательно добавляют воду, гидроксид натрия(15% мас./об. в воде, 0,48 мл) и снова воду. После перемешивания в течение 15 мин при комнатной температуре смесь фильтруют через диатомовую землю и концентрируют. Остаток очищают флэшхроматографией(0,535 мл, 9,2 ммоль), триацетоксиборгидрида натрия (0,974 г, 4,6 ммоль), 37%-ного раствора формальдегида в воде (0,55 мл) и дихлорметана (40 мл) перемешивают в течение 72 ч при комнатной температуре. Органическую фазу промывают два раза водой. К водной фазе добавляют концентрированный раствор NaOH (pH 12) и смесь экстрагируют два раза дихлорметаном. Органические экстракты сушат надNa2SO4, фильтруют и концентрируют в вакууме, получая N-[4-(3-метоксифенил)тетрагидропиран-4 ил]метил-N,N-диметиламин в виде масла (0,35 г, 61%). Стадия 4. К суспензии тиометоксида натрия (0,42 г, 6 ммоль) в диметилформамиде (1,2 мл) добавляют N-[4(3-метоксифенил)тетрагидропиран-4-ил]метил-N,N-диметиламин (0,3 г, 1,2 ммоль) и полученную смесь нагревают при температуре 65 С в течение 7 ч, оставляют охлаждаться до комнатной температуры и реакцию гасят насыщенным водным раствором NH4Cl (6 мл). Смесь экстрагируют дихлорметаном, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 0,25 г неочищенного продукта. Смесь неочищенного продукта и HBr (3 мл) кипятят с обратным холодильником в течение 1 ч. После охлаждения добавляют воду для гашения реакции и смесь подщелачивают NaHCO3 и экстрагируют дихлорметаном. Органические экстракты сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают флэшхроматографиейNH3,получая 3-4-[(диметиламино)метил]тетрагидропиран-4-илфенол (0,100 г, выход: 35,5%). Общая методика А синтеза хлоридов (R-RLG, где RLG означает хлор). Амин (1 экв.) вводят в реакционную колбу с последующим добавлением ацетона (3 объема или 20 объемов), 5 М раствора NaOH (1,2 экв.) и 1-бром-3-хлорпропана (1,5 экв. или 3 экв.). Реакционную смесь перемешивают в течение ночи при комнатной температуре. Фазы разделяют и ацетонный слой концентрируют в вакууме. Водный слой подкисляют 2 М раствором HCl до pH 1 (примерно 10 объемов). Концентрат разбавляют ТВМЕ (30 объемов) и промывают водой (15 объемов). Водную фазу экстрагируют ТВМЕ (2 раза по 15 мл). Объединенные ТВМЕ-экстракты промывают 2 М раствором HCl (15 мл) и объединяют с первой кислой фазой. Объединенные кислые слои промывают ТВМЕ (15 объемов) и подщелачивают до pH 14 4 М раствором NaOH (примерно 40 мл). Водную фазу экстрагируют ТВМЕ (3 раза по 30 мл). Объединенные органические слои сушат над MgSO4, фильтруют, промывают ТВМЕ (5 объемом) и концентрируют в вакууме, получая требующийся хлорид. Общая методика В. 4-(4-Диметиламинометилтетрагидропиран-4-ил)фенол (500 мг, 2,13 ммоль), хлорид (378 мг,- 27011161 2,13 ммоль), диметилформамид (10 мл), воду (17 мл) и K2CO3 (1,18 г, 8,52 ммоль) нагревают до температуры 130 С. Охлаждают до комнатной температуры, добавляют воду (40 мл), экстрагируют этилацетатом(3 раза по 25 мл) и объединенные органические экстракты промывают водой (2 раза по 25 мл). Органические слои сушат над MgSO4, фильтруют и концентрируют в вакууме при температуре 35 С. Очистка неочищенного продукта хроматографией на силикагеле, при элюировании смесью (4% MeOH, 1% NH3 в(24,4 г, 0,15 моль) перемешивают вместе в атмосфере азота в течение 8 ч. Органический слой отделяют и концентрируют в вакууме. Неочищенный продукт очищают вакуумной перегонкой (температура кипения составляет 90 С при давлении 30 мбар), получая указанное в заголовке соединение (11,7 г, выход 57%) в виде бесцветного масла. Пример 1. Диметил 4-[3-(3-пирролидин-1-илпропокси)фенил]тетрагидропиран-4-илметиламин Алкилирование 3-[4-(диметиламино)метилтетрагидро-2 Н-пиран-4-ил]фенола (0,1 г, 0,425 ммоль) с помощью 1-(3-хлорпропил)пирролидина (0,125 г, 0,85 ммоль) в соответствии с общей методикой В приводит, после очистки флэш-хроматографией, к получению желаемого соединения (0,030 г, выход 20%). 1 Н ЯМР (400 МГц, CDCl3)7,27-7,18 (м, 1 Н), 6,92-6,84 (м, 2 Н), 6,75 (дд, 1 Н), 4,05 (т, 2 Н), 3,8-3,7 (м,2 Н), 3,55 (т, 2 Н), 2,65 (т, 2 Н), 2,6-2,5 (м, 4 Н), 2,4 (с, 2 Н), 2,15-1,85 (м, 6 Н), 2,0 (с, 6 Н), 1,85-1,75 (м, 4 Н). Промежуточный продукт 6. 1-(3-Хлорпропил)-2(R),5(R)-транс-диметилпирролидин. 2(R),5(R)-транс-Диметилпирролидин (0,75 г, 7,56 ммоль), ацетон (15 мл, 20 об.), 5 М раствор NaOH 4-(4-Диметиламинометилтетрагидропиран-4-ил)фенол (330 мг, 1,43 ммоль), 1-(3-хлорпропил)-2,5 трансдиметилпирролидин (221 мг, 1,26 ммоль), ДМФА (7,6 мл) и K2CO3 (790 мг, 5,72 ммоль) подвергают взаимодействию в соответствии с общей методикой В. Выделенный продукт подвергают хроматографии на диоксиде кремния, элюируя смесью DCM:MeOH:NH3 (95:4:1), с получением указанного в заголовке соединения в виде желтого масла (180 мг, выход 34%). 1 Н ЯМР (400 МГц, CDCl3)7,20 (д, 2 Н), 6,87 (д, 2 Н), 4,08-3,95 (м, 2 Н), 3,79-3,70 (м, 2 Н), 3,59-3,49 4-(4-Диметиламинометилтетрагидропиран-4-ил)фенол (500 мг, 2,13 ммоль), 1-(3-хлорпропил)-2 метилпирролидин (344 мг, 2,13 ммоль), ДМФА (10 мл) и K2CO3 (1,18 г, 8,52 ммоль) подвергают взаимодействию в соответствии с общей методикой В. Выделенный продукт подвергают хроматографии на диоксиде кремния, элюируя смесью DCM:MeOH:NH3 (95:4:1), с получением указанного в заголовке соединения в виде желтого масла (120 мг, выход 16%). 1 Н ЯМР (400 МГц, CDCl3)7,20 (д, 2 Н), 6,87 (д, 2 Н), 4,08-3,96 (м, 2 Н), 3,75 (дт, 2 Н), 3,55 (тд, 2 Н),3,18 (тд, 1 Н), 2,98 (м, 1 Н), 2,40 (с, 2 Н), 2,29 (м, 1 Н), 2,20 (м, 1 Н), 2,16-1,62 (м, 10 Н), 1,96 (с, 6 Н), 1,42 (м,1 Н), 1,09 (д, 3 Н). Промежуточный продукт 8. 1-(3-Хлорпропил)-2,6-цис-диметилпиперидин. Стадия 1. 2,6-цис-Диметилпиперидин (1,0 г, 8,83 ммоль), K2CO3 (1,52 г, 1,25 экв.) и 3-бромпропанол (6,14 г,44,2 ммоль, 4 об.) подвергают взаимодействию при температуре 100 С в течение 2 ч. Реакционную смесь оставляют охлаждаться до комнатной температуры, разбавляют дихлорметаном (20 мл) и гасят 2 М раствором HCl (20 мл). Водный слой экстрагируют дихлорметаном (2 раза по 20 мл) и подщелачивают доpH 14 2 М раствором NaOH (15 мл). Водный слой экстрагируют дихлорметаном (3 раза по 20 мл). Объединенные дихлорметановые слои сушат над MgSO4, фильтруют, промывают дихлорметаном и концентрируют в вакууме, получая 1-(пропан-1'-ол)-2,6-цис-диметилпиперидин (1,22 г, выход 81%) в виде бледно-желтого масла. Стадия 2. 1-(Пропан-1'-ол)-2,6-цис-диметилпиперидин (1,22 г, 7,12 ммоль) растворяют в дихлорметане(24 мл) и охлаждают до температуры 0-5 С в атмосфере азота. По каплям добавляют тионилхлорид (1,04 мл, 14,25 ммоль). Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 30 мин. Реакцию гасят 2 М раствором HCl (25 мл). Водный слой экстрагируют дихлорметаном (25 мл) и подщелачивают до pH 14 5 М раствором NaOH (25 мл). Водный слой экстрагируют ТВМЕ(3 раза по 25 мл). Объединенные органические слои сушат над MgSO4, фильтруют, промывают ТВМЕ и концентрируют в вакууме, получая указанное в заголовке соединение (1,26 г, выход 93%) в виде желтого масла. Пример 4. 4-(4-Диметиламинометилтетрагидропиран-4-ил)фенол (500 мг, 2,13 ммоль), 1-(3-хлорпропил)-2,6 цис-диметилпиперидин (410 мг, 2,13 ммоль), ДМФА (10 мл) и K2CO3 (1,18 г, 8,52 ммоль) подвергают взаимодействию в соответствии с общей методикой В. Выделенный продукт подвергают хроматографии на диоксиде кремния, элюируя смесью DCM:MeOH:NH3 (95:4:1), с получением указанного в заголовке соединения в виде желтого масла (280 мг, выход 33,9%). 1 Н ЯМР (400 МГц, CDCl3)7,20 (д, 2 Н), 6,85 (д, 2 Н), 3,93 (т, 2 Н), 3,75 (дт, 2 Н), 3,55 (тд, 2 Н), 2,95 (т,2 Н), 2,51-2,36 (м, 2 Н), 2,40 (с, 2 Н), 2,14-2,04 (м, 2 Н), 1,96 (с, 6 Н), 1,93-1,82 (м, 4 Н), 1,74-1,51 (м, 3 Н), 1,411,21 (м, 3 Н), 1,13 (д, 6 Н). Промежуточный продукт 9. 4-(3-Хлорпропил)тиоморфолин. Тиоморфолин (5 г, 49 ммоль), ацетон (15 мл, 3 об.), 5 М раствор NaOH (11,8 мл) и 1-бром-3 хлорпропан (11,6 г, 73,5 ммоль, 1,5 экв.) подвергают взаимодействию в соответствии с общей методикой А, получая указанное в заголовке соединение (8,5 г, выход 96%) в виде бледно-желтого масла. Пример 5. Диметил 4-[4-(3-тиоморфолин-4-илпропокси)фенил]тетрагидропиран-4-илметиламин 4-(4-Диметиламинометилтетрагидропиран-4-ил)фенол (1000 мг, 4,25 ммоль), 4-(3-хлорпропил)тиоморфолин (764 мг, 2,13 ммоль), ДМФА (20 мл) и K2CO3 (2,34 г, 17 ммоль) подвергают взаимодействию в соответствии с общей методикой В. Выделенный продукт подвергают хроматографии на диоксиде кремния, элюируя смесью DCM:MeOH:NH3 (95:5:1), с получением указанного в заголовке соединения Диметил 4-[4-(3-тиоморфолин-4-илпропокси)фенил]тетрагидропиран-4-илметиламин (300 мг,0,792 ммоль) и ТФУК (0,99 мл) охлаждают до температуры 0-5 С и добавляют трифторнадуксусную кислоту (4 М, 0,77 мл) [4 М раствор получают добавлением 27,5%-ного Н 2 О 2 (0,94 мл) к ТФУК (1,56 мл)] и реакционную смесь перемешивают в течение 6 ч при температуре 0-5 С. Смесь разбавляют дихлорметаном (6 мл), подщелачивают раствором NaOH (2M, 8 мл) и экстрагируют дихлорметаном (2 раза по 20 мл). Дихлорметановые экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме при температуре 35 С. Очистка хроматографией на диоксиде кремния, при элюировании смесью DCM:MeOH:NH3(96:4:1), приводит к получению указанного в заголовке соединения (200 мг, выход 61%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3)7,21 (д, 2 Н), 6,86 (д, 2 Н), 4,01 (т, 2 Н), 3,75 (дт, 2 Н), 3,55 (тд, 2 Н), 3,153,02 (м, 2 Н), 2,93-2,79 (м, 4 Н), 2,72 (дт, 2 Н), 2,64 (т, 2 Н), 2,40 (с, 2 Н), 2,16-1,82 (м, 6 Н), 1, 97 (с, 6 Н). Пример 7. Диметил 4-[4-(3-тиоморфолин-4-илпропокси)фенил]тетрагидропиран-4-илметиламин (300 мг,0,792 ммоль) и ТФУК (0,99 мл) охлаждают до температуры 0-5 С, добавляют трифторнадуксусную кислоту (4 М, 0,77 мл) и реакционную смесь выдерживают при нагревании до комнатной температуры в течение ночи. Смесь разбавляют дихлорметаном (6 мл), подщелачивают раствором NaOH (2M, 8 мл) и экстрагируют дихлорметаном (2 раза по 20 мл). Дихлорметановые экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме при температуре 35 С. Очистка хроматографией на диоксиде кремния,при элюировании смесью DCM:MeOH:NH3 (96:4:1), приводит к получению указанного в заголовке соединения (151 мг, выход 4 6%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3)7,22 (д, 2 Н), 6,85 (д, 2 Н), 4,01 (т, 2 Н), 3,75 (дт, 2 Н), 3,55 (тд, 2 Н), 3,102,97 (м, 8 Н), 2,72 (т, 2 Н), 2,40 (с, 2 Н), 2,14-1,82 (м, 6 Н), 1,97 (с, 6 Н). Промежуточный продукт 10. 1-(3-Хлорпропил)пиперидин-4-ол. 4-Гидроксипиперидин (3 г, 30 ммоль), ацетон (60 мл, 20 об.), 5 М раствор NaOH (7,2 мл) и 1-бром-3 хлорпропан (14,2 г, 90 ммоль, 3 экв.) подвергают взаимодействию в соответствии с общей методикой А,получая указанное в заголовке соединение (1,5 г, выход 28%) в виде бледно-желтого масла.
МПК / Метки
МПК: A61K 31/55, C07D 405/14, A61P 25/06, C07D 295/12, C07D 405/06, C07D 309/08, C07D 309/06, C07D 405/12, C07D 405/04
Метки: полезные, тиофенола, производные, н3-лигандов, фенола, 4-монозамещённые, качестве
Код ссылки
<a href="https://eas.patents.su/30-11161-3-ili-4-monozameshhyonnye-proizvodnye-fenola-i-tiofenola-poleznye-v-kachestve-n3-ligandov.html" rel="bookmark" title="База патентов Евразийского Союза">3- или 4-монозамещённые производные фенола и тиофенола, полезные в качестве н3-лигандов</a>
Предыдущий патент: Композиция для трансдермальной доставки гормонов без необходимости использования агентов, усиливающих проникновение, и ее применения
Следующий патент: Способ борьбы с сорняками
Случайный патент: Растягивающийся зажим












