Ингибиторы сетр
Номер патента: 11130
Опубликовано: 30.12.2008
Авторы: Дэн Сяолин, Тэйлор Гейл Э., Али Амджад, Хант Джулиан А., Курайши Назя, Смит Камерон Дж., Наполитано Джоанн М., Лу Чжицзянь, Томпсон Кристофер Ф., Синклер Питер Дж.
Формула / Реферат
1. Соединение, выбранное из группы, состоящей из соединений, имеющих формулы If, Ig и Ih, или его фармацевтически приемлемая соль
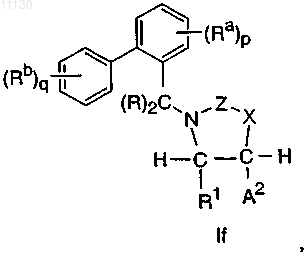
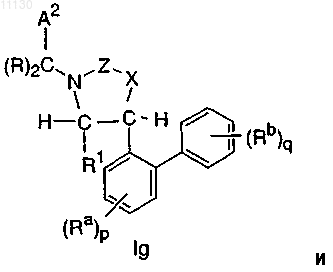
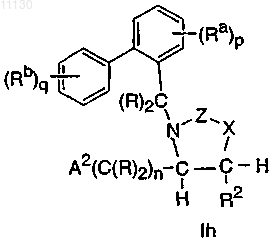
где A2 выбирают из группы, состоящей из фенила, циклогексила и пиридила, где A2 необязательно замещен 1-2 замещающими группами, независимо выбранными из галогена, -CH3, -CF3 и -CN;
каждый R независимо выбирают из группы, состоящей из H и -CH3;
каждый Ra независимо выбирают из группы, состоящей из -CF3 и Cl;
каждый Rb независимо выбирают из группы, состоящей из -C1-C3алкила, -OCH3 и F;
каждый R1 и R2 независимо выбирают из группы, состоящей из H и -C1-C2алкила;
X выбирают из группы, состоящей из -O-, -NH-, -N(CH3)- и -CH2-;
Z выбирают из группы, состоящей из -C(=O)-, -S(O)2- и -C(=N-CN)-;
n равно 0 или 1;
p равно 1 и
q равно 2 или 3.
2. Соединение по п.1, имеющее формулу Ii, или его фармацевтически приемлемая соль
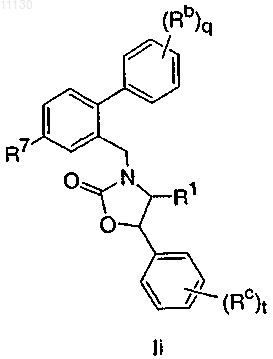
где R7 выбирают из группы, состоящей из Cl и -CF3;
Rc выбирают из группы, состоящей из галогена, -CH3, -CF3 и -CN; и
t представляет собой целое число от 0 до 2.
3. Соединение по п.1, имеющее формулу Ij, или его фармацевтически приемлемая соль
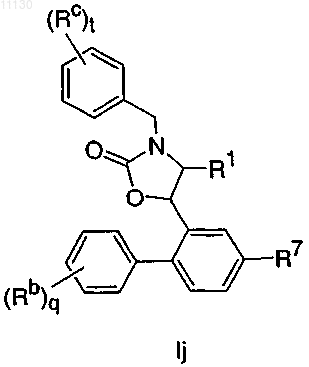
где R7 выбирают из группы, состоящей из Cl и -CF3;
Rc выбирают из группы, состоящей из галогена, -CH3, -CF3 и -CN; и
t представляет собой целое число от 0 до 2.
4. Применение соединения по п.1 или его фармацевтически приемлемой соли для получения лекарственного средства для повышения HDL-C у нуждающегося в этом пациента.
5. Применение соединения по п.1 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения атеросклероза.
6. Фармацевтическая композиция, включающая соединение по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
7. Соединение по п.1, выбранное из следующих соединений или их фармацевтически приемлемых солей:
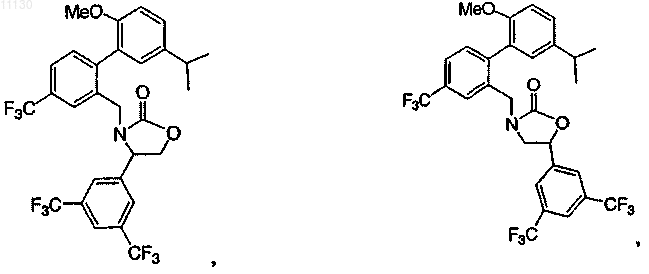
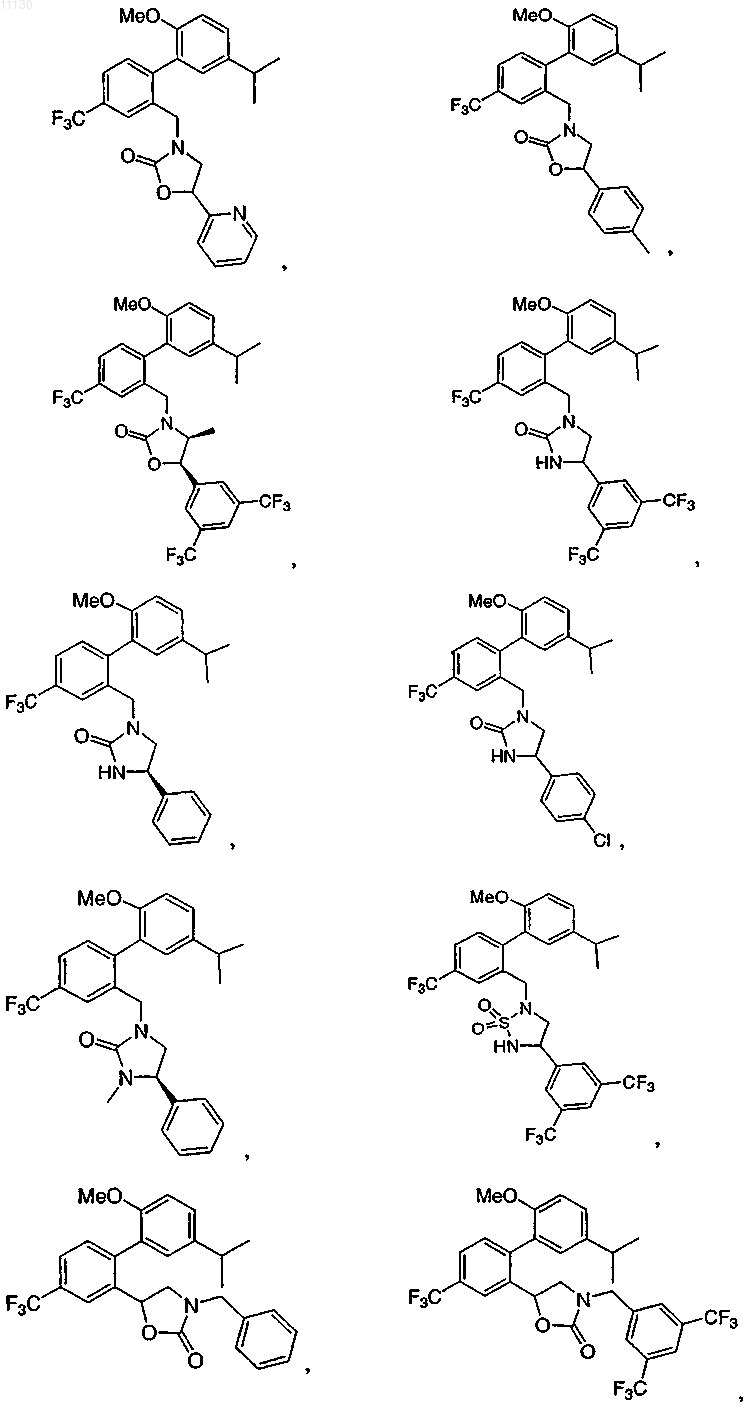
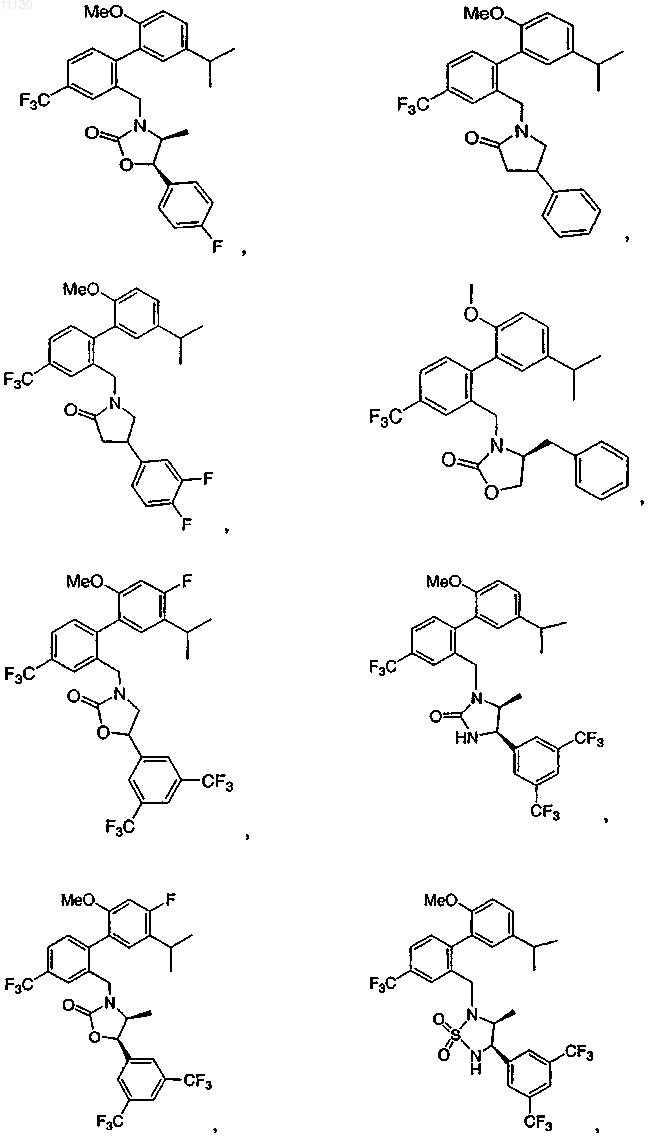

8. Соединение по п.1 или его фармацевтически приемлемая соль
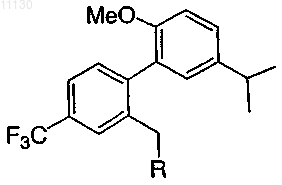
где R выбирают из группы, состоящей из
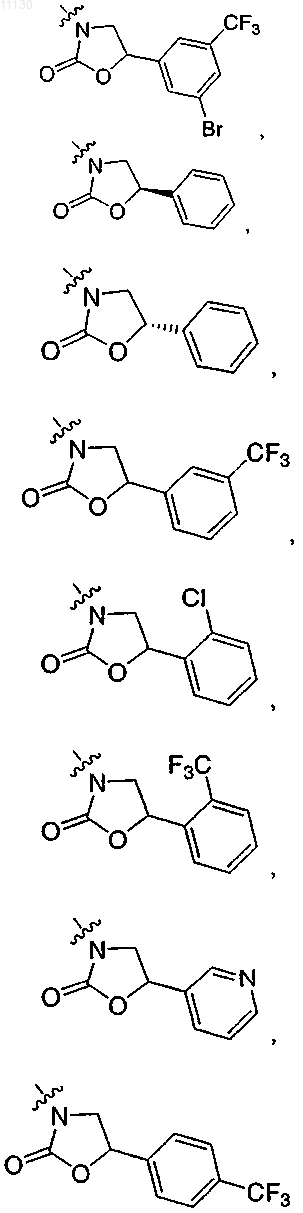

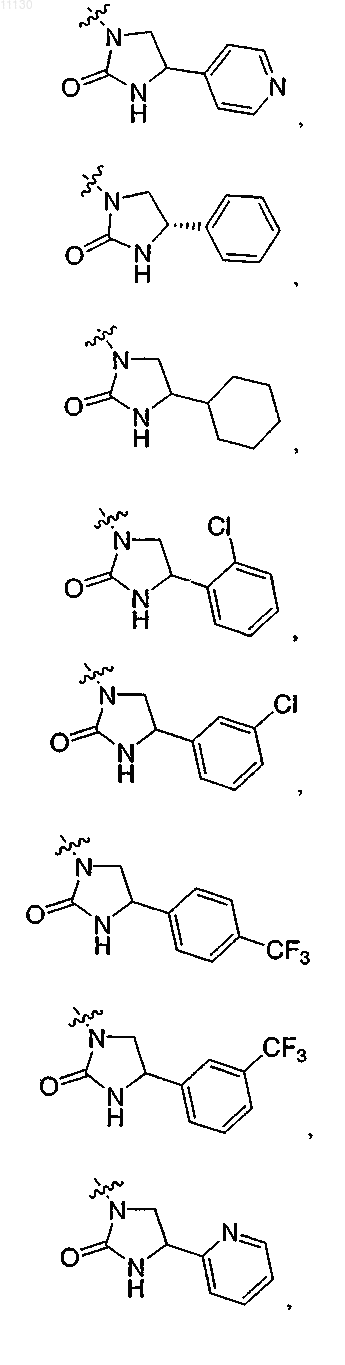
9. Соединение по п.1 или его фармацевтически приемлемая соль
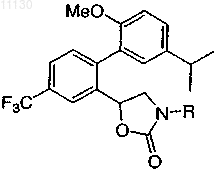
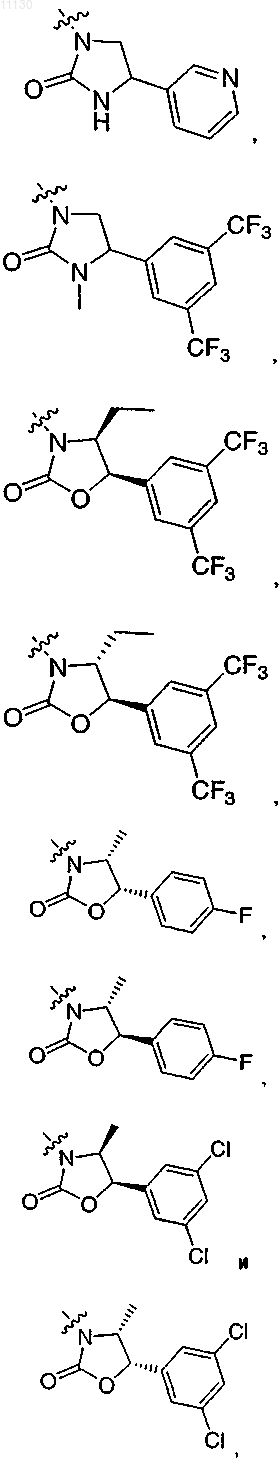
где R выбирают из группы, состоящей из
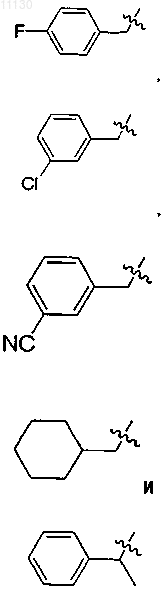
10. Соединение по п.1 или его фармацевтически приемлемая соль
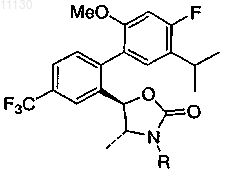
где R выбирают из группы, состоящей из
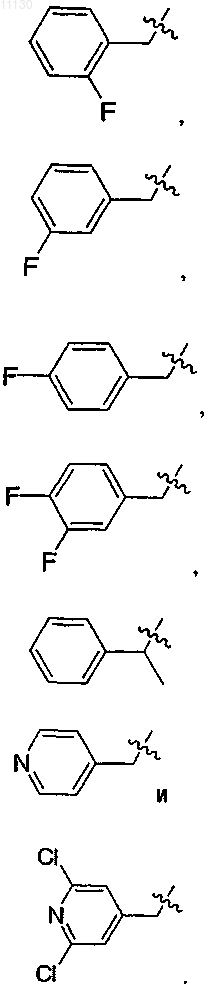
11. Соединение по п.7 или его фармацевтически приемлемая соль
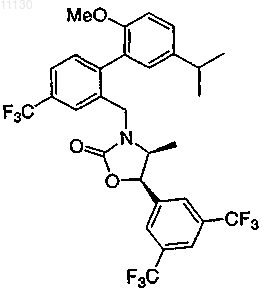
12. Соединение по п.7 или его фармацевтически приемлемая соль
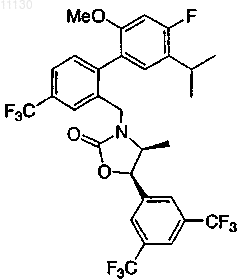
13. Соединение по п.7 или его фармацевтически приемлемая соль
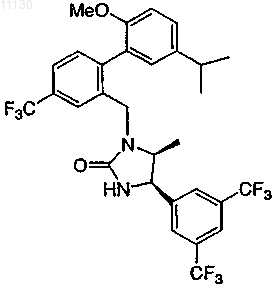
14. Соединение по п.7 или его фармацевтически приемлемая соль
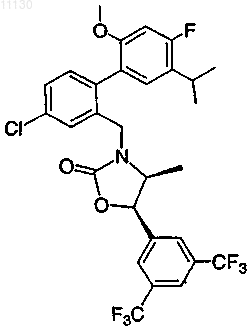
15. Соединение по п.7 или его фармацевтически приемлемая соль

Текст
011130 Область изобретения Данное изобретение относится к классу химических соединений, которые ингибируют белок переноса сложного эфира холестерина (CETP) и, следовательно, могут найти применение для лечения и профилактики атеросклероза. Предпосылки создания изобретения Атеросклероз и его клинические последствия, коронарная болезнь сердца (CHD), инсульт и заболевания периферических сосудов, несомненно, представляют собой огромное бремя для системы здравоохранения промышленно развитого мира. Только в Соединенных Штатах Америки диагноз CHD был поставлен приблизительно 13 млн пациентам и каждый год более полумиллиона смертей связано с CHD. Кроме того, ожидается, что данные потери будут расти в следующей четверти века, как продолжает расти распространение ожирения и диабета. Давно известно, что у млекопитающих изменения профилей липопротеина в системе кровообращения коррелируют с риском появления атеросклероза и CHD. Клинический успех ингибиторов HMG-CoA редуктазы, особенно статинов, для снижения коронарных приступов основан на снижении в системе кровообращения липопротеина низкой плотности-холестерина (LDL-C), уровень которого прямо коррелирует с повышенным риском атеросклероза. Позднее эпидемиологические исследования показали обратное взаимоотношение между липопротеином высокой плотности-холестерином (HDL-C) и атеросклерозом, что привело к заключению, что низкие сывороточные уровни HDL-C связаны с повышенным риском возникновения CHD. Метаболический контроль уровней липопротеина представляет собой сложный и динамический процесс, включающий множество факторов. Одним важным метаболическим контролем в организме человека является белок переноса сложного эфира холестерина (CETP), гликопротеина плазмы крови,который катализирует движение сложных эфиров холестерина из HDL в apoB-содержащие липопротеины, в частности VLDL (см. Hesler, C.B., et al. (1987), Purification and characterization of human plasma cholesteryl ester transfer protein. J. Biol. Chem. 262(5), 2275-2282). В физиологических условиях чистая реакция представляет собой гетерообмен, в котором CETP переносит триглицерид к HDL от apoBлипопротеинов и транспортирует сложный эфир холестерина от HDL к apoB-липопротеину. У человека CETP играет роль обратимого транспорта холестерина, процесса, посредством которого холестерин возвращается в печень из периферических тканей. Примечательно, что многие животные не обладают CETP, включая животных, имеющих высокие уровни HDL, и, как известно, резистентных к коронарной болезни сердца, таких как грызуны (см. Guyard-Dangremont, V., et al., (1998), Phospholipidand cholesteryl ester transfer activities in plasma from 14 vertebrate species. Relation to atherogenesis susceptibility, Comp. Biochem. Physiol. В Biochem. Mol. Biol. 120(3), 517-525). Были проведены многочисленные эпидемиологические исследования, коррелирующие влияние природных вариаций в активности СЕРТ по отношению к риску коронарной болезни сердца, включая исследования небольшого числа известных нулевых мутаций человека (см. Hirano, K.-I., Yamashita, S. and Matsuzawa, Y. (2000), Pros and cons ofinhibiting cholesteryl ester transfer protein, Curr. Opin. Lipidol. 11(6), 589-596). Данные исследования четко продемонстрировали обратную корреляцию между концентрацией HDL-C в плазме крови и активностью СЕРТ (см. Inazu, A., et al. (2000) Cholesteryl ester transfer protein and atherosclerosis, Curr. Opin. Lipidol. 11(4), 389-396), что привело к появлению гипотезы, что фармакологическое ингибирование активности СЕРТ-липидного переноса может оказаться благоприятным для людей за счет повышения уровнейHDL-C при понижении уровней LDL. Несмотря на значительный терапевтический успех, который представляют статины, такие как симвастатин (ZOCOR), при лечении и профилактике атеросклероза и последующих случаев атеросклеротического заболевания статины позволяют достичь снижения риска приблизительно на одну треть. В настоящее время доступно несколько фармакологических методов лечения, которые положительно повышают уровни HDL-C в системе кровообращения. Некоторые статины и другие фибраты дают возможность ограниченного прироста HDL-C. Недостатком ниацина, который обеспечивает более эффективное лечение для повышения уровней HDL-C, что было подтверждено клинически, является неодобрение пациентов, что связано с побочными действиями, такими как приливы крови. Агент, который безопасно и эффективно повышает уровни HDL холестерина, может быть решением важной, но все еще не удовлетворенной потребности медицины, предлагая средства фармакологической терапии, которые могут значительно улучшить профили липидов в системе кровообращения за счет механизма, который будет комплементарен существующим методам лечения. Новые классы химических соединений, которые ингибируют CETP, исследуются в нескольких фармацевтических компаниях или находятся на стадии клинических испытаний. В настоящее время на рынке не имеется ингибиторов CETP. Необходимы новые соединения для того, чтобы можно было бы выявить одно или несколько фармацевтических соединений, которые были бы безопасными и эффективными. Описанные в данном изобретении соединения представляют собой очень сильные ингибиторы-1 011130 Краткое изложение сущности изобретения Соединения, имеющие формулу I, включая фармацевтически приемлемые соли соединений, представляют собой ингибиторы CETP, проявляющие описанные далее полезные свойства-C1-C5 алкила, необязательно замещенного 1-11 галогенами; Каждый R независимо выбирают из группы, состоящей из H, -C1-C5 алкила и галогена, где-C1-C5 алкил необязательно является замещенным 1-11 галогенами; каждый из R1 и R6 независимо выбирают из H, -C1-C5 алкила, галогена и -(C(R)2)nA2, где -C1-C5 алкил необязательно является замещенным 1-11 галогенами;R2 выбирают из группы, состоящей из H, -C1-C5 алкила, галогена, A1 и -(C(R)2)nA2, где -C1-C5 алкил необязательно является замещенным 1-11 галогенами; где один из B и R2 представляет собой A1 и один из B, R1, R2 и R6 представляет собой A2 или-(C(R)2)nA2; так что соединение формулы I включает одну группу A1 и одну группу A2;(a) ароматического кольца, выбранного из фенила и нафтила;(b) фенильного конца, конденсированного с 5-7-членным неароматическим циклоалкильным кольцом, которое необязательно включает 1-2 двойные связи;(c) 5-6-членного гетероциклического кольца, содержащего 1-4 гетероатома, независимо выбранных из N, S, О и -N(O)-, и необязательно также включает 1-3 двойные связи и карбонильную группу, где место присоединения A3 к фенильному кольцу, к которому присоединен A3, представляет собой атом углерода; и(d) бензогетероциклического кольца, включающего фенильное кольцо, конденсированное с 5-6-членным гетероциклическим кольцом, имеющим 1-2 гетероатома, независимо выбранных из О, N иS, и необязательно также имеющего 1-2 двойные связи (в дополнение в двойной связи конденсированного фенильного кольца), где место присоединения A3 к фенильному кольцу, к которому присоединен A3,представляет собой атом углерода;(a) ароматического кольца, выбранного из фенила и нафтила;(b) фенильного конца, конденсированного с 5-7-членным неароматическим циклоалкильным кольцом, которое необязательно включает 1-2 двойные связи;(c) 5-6-членного гетероциклического кольца, содержащего 1-4 гетероатома, независимо выбранных из N, S, О и -N(O)-, и необязательно также включающего 1-3 двойные связи и карбонильную группу;(d) бензогетероциклического кольца, включающего фенильное кольцо, конденсированное с 5-6-членным гетероциклическим кольцом, имеющим 1-2 гетероатома, независимо выбранных из O, N иS, и необязательно также имеющего 1-2 двойные связи (в дополнение в двойной связи конденсированного фенильного кольца);(e) -C3-C8 циклоалкильного кольца, необязательно имеющего 1-3 двойные связи; где каждый из A3 и A2 необязательно замещен 1-5 замещающими группами, независимо выбранными из Ra; каждый Ra независимо выбирают из группы, состоящей из -C1-C6 алкила, -C2-C6 алкенила,-C2-C6 алкинила, -C3-C8 циклоалкила, необязательно имеющего 1-3 двойные связи, -OC1-C6 алкила,-OC2-C6 алкенила, -OC2-C6 алкинила, -OC3-C8 циклоалкила, необязательно имеющего 1-3 двойные связи,-C(=O)C1-C6 алкила, -C(=О)C3-C8 циклоалкила, -C(=О)H, -CO2H, -CO2C1-C6 алкила, -C(=O)SC1-C6 алкила,-NR3R4, -C(=O)NR3R4, -NR3C(=O)OC1-C6 алкила, -NR3C(=O)NR3R4, -S(O)xC1-C6 алкила, -S(O)yNR3R4,-NR3S(O)yNR3R4, галогена, -CN, -NO2 и 5-6-членного гетероциклического кольца, содержащего 1-4 гетероатома, независимо выбранных из N, S и O, указанное гетероциклическое кольцо также необязательно содержит карбонильную группу и также необязательно включает 1-3 двойные связи, где место присоединения указанного гетероциклического кольца к присоединяемому кольцу представляет собой атом-2 011130 углерода, где указанное гетероциклическое кольцо необязательно замещено 1-5 замещающими группами, независимо выбранными из галогена, -C1-C3 алкила и -OC1-C3 алкила, где -C1-C3 алкил и -OC1-C3 алкил необязательно замещены 1-7 галогенами; где для соединений, в которых Ra выбирают из группы, состоящей из -C1-C6 алкила,-C2-C6 алкенила, -C2-C6 алкинила, -C3-C8 циклоалкила, необязательно имеющего 1-3 двойные связи,-OC1-C6 алкила, -OC2-C6 алкенила, -OC2-C6 алкинила, -OC3-C8 циклоалкила, необязательно имеющего 1-3 двойные связи, -C(=O)C1-C6 алкила, -C(=O)C3-C8 циклоалкила, -CO2C1-C6 алкила, -C(=O)SC1-C6 алкила,-NR3C(=O)OC1-C6 алкила и -S(O)xC1-C6 алкила; Ra необязательно замещен 1-15 галогенами и необязательно также замещен 1-3 замещающими группами, независимо выбранными из:(а) -OH,(b) -CN,(с) -NR3R4,(d) -C3-C8 циклоалкила, необязательно имеющего 1-3 двойные связи и необязательно замещенного 1-15 галогенами,(е) -OC1-C4 алкила, необязательно замещенного 1-9 галогенами и также необязательно замещенного 1-2 замещающими группами, независимо выбранными из -OC1-C2 алкила,(f) -OC3-C8 циклоалкила, необязательно имеющего 1-3 двойные связи и необязательно замещенного 1-15 галогенами,(g) -CO2H,(h) -C(=O)CH3 и(i) -CO2C1-C4 алкила, который необязательно замещен 1-9 галогенами; при условии, что когда B представляет собой A1, X и Y представляют собой -CH2-, Z представляет собой -C(=O)-, R2 представляет собой A2, и A2 представляет собой фенил, который имеет заместитель Ra в 4-положении, где Ra представляет собой -OC1-C6 алкил, который необязательно замещен 1-11 галогенами, то не имеется других заместителей Ra в A2, где эти Ra выбирают из -OC1-C6 алкила, -OC2-C6 алкенила,-OC2-C6 алкинила и -OC3-C8 циклоалкила, необязательно имеющего 1-3 двойные связи;p представляет собой целое число от 0 до 4;x равно 0, 1 или 2; у равен 1 или 2; каждый из R3 и R4 независимо выбирают из H, -C1-C5 алкила, -C(=O)C1-C5 алкила и-S(O)yC1-C5 алкила, где -C1-C5 алкил во всех случаях необязательно замещен 1-11 галогенами; иR5 выбирают из группы, состоящей из H, -OH, -C1-C5 алкила и галогена, где -C1-C5 алкил необязательно замещен 1-11 галогенами. Подробное описание изобретения Многие соединения данного изобретения или их фармацевтически приемлемые соли имеют структуру, соответствующую формуле Ia Многие соединения данного изобретения или их фармацевтически приемлемые соли имеют структуру формулы Ib-3 011130 Многие другие соединения или их фармацевтически приемлемые соли имеют структуру формулы Ic Другие соединения данного изобретения или их фармацевтически приемлемые соли имеют структуру формулы Id Во многих соединениях формул I, Ia, Ib, Ic и Id и их фармацевтически приемлемых соляхA3 представляет собой фенил, который необязательно является замещенным 1-4 замещающими группами Ra, где Ra независимо выбирают из -C1-C5 алкила, -OC1-C3 алкила, -CO2C1-C3 алкила, -CO2H, галогена, -NR3R4, -C(=O)C1-C3 алкила, -C(=O)H, -C(=O)NR3R4, -SC1-C3 алкила, -C2-C3 алкенила, -CN, -NO2 и 1,2,4-оксадиазолила, где -C1-C3 алкил и -C1-C5 алкил во всех случаях необязательно замещены 1-6 заместителями, независимо выбранными из 1-5 галогенов и одной -OH группы; и -C2-C3 алкенил необязательно замещен 1-3 галогенами. Во многих соединениях формул I, Ia, Ib, Ic и Id и их фармацевтически приемлемых соляхA2 выбирают из группы, состоящей из фенила, циклогексила и гетероциклического 5-6-членного кольца, включающего 1-2 гетероатома, независимо выбранного из O, N, S и -N(O)-, и также необязательно включающего 1-3 двойные связи, где A2 необязательно замещен 1-2 замещающими группами, независимо выбранными из -C1-C4 алкила, -OC1-C3 алкила, -NO2, -CN, -S(O)xC1-C3 алкила, -NHS(O)2C1-C3 алкила,-NR3R4, -NR3C(=O)R4, -C2-C3 алкенила, -C(=O)NR3R4, галогена и пиридила, где C1-C3 алкил, C1-C4 алкил иC2-C3 алкенил во всех случаях необязательно замещены 1-3 галогенами, при условии, что для соединений формулы Ia, когда X и Y представляют собой CH2, Z представляет собой -(C=O)-, n равно 0 и A2 представляет собой фенил, тогда число содержащихся в A2 групп Ra, которые выбирают из -OC1-C3 алкила,равно 0 или 1. Во многих соединениях формул I, Ia, Ib, Ic и Id и их фармацевтически приемлемых солях каждый изR3 и R4 независимо выбирают из H и -C1-C3 алкила. Во многих соединениях формул I, Ia, Ib, Ic и Id и их фармацевтически приемлемых солях p равно 0-2. В подгруппах соединений формулы I, включая их фармацевтически приемлемые соли, A1 представляет собой где каждый из R7 и R8 независимо выбирают из группы, состоящей из H, галогена, -NR3R4,-C1-C3 алкила, -OC1-C3 алкила, -CN, -NO2 и пиридила; во всех случаях C1-C3 алкил необязательно замещен 1-3 галогенами. В подгруппах соединений формулы I, включая их фармацевтически приемлемые соли, A2 выбирают из группы, состоящей из фенила, пиридила и циклогексила, где A2 необязательно замещен 1-2 заместителями, независимо выбранными из -C1-C4 алкила, -OC1-C4 алкила, -NO2, -CN и галогена, где C1-C4 алкил во всех случаях необязательно замещен 1-3 галогенами, при условии, что для соединений формулы Ia,если X и Y представляют собой CH2, Z представляет собой -(C=O)- и A2 представляет собой фенил, то число содержащихся в A2 групп Ra, которые выбирают из -OC1-C4 алкила, необязательно замещенного 1-3 галогенами, равно 0 или 1. В других подгруппах A2 необязательно замещен 1-2 замещающими группами, независимо выбранными из галогена, -C1-C4 алкила и -CN, где -C1-C4 алкил необязательно замещен 1-3 галогенами. Во многих вариантах осуществления изобретения, как описано выше, включая их фармацевтически приемлемые соли где R7 выбирают из H, галогена, -NR3R4, -C1-C3 алкила, -OC1-C3 алкила, -CN, -NO2 и пиридила; во всех случаях C1-C3 алкил необязательно замещен 1-3 галогенами; иR8 выбирают из группы, состоящей из H, галогена, -CH3, -CF3, -OCH3 и -OCF3. Во многих предпочтительных вариантах осуществления изобретения A3 представляет собой фенил,который замещен 1-3 заместителями, независимо выбранными из C1-C4 алкила, OC1-C4 алкила, -CN, Cl, F,-C(=O)CH3, -CH=CH2, -CO2H, -CO2CH3, -S-CH3, -S(O)CH3, -S(O)2CH3 и -C(=O)NR3R4, где C1-C4 алкил и-OC1-C4 алкил необязательно замещены 1-5 F заместителями и необязательно также замещены одной группой -OH. В других вариантах осуществления A3 представляет собой фенил, который замещен 1-3 заместителями, независимо выбранными из группы, состоящей из Cl, F, -C1-C4 алкила и -OC1-C4 алкила, где-C1-C4 алкил и -OC1-C4 алкил необязательно замещены 1-5 F. Предпочтительная подгруппа соединений, включая их фармацевтически приемлемые соли, имеет структуру формулы IeZ выбирают из группы, состоящей из -C(=O)-, -S(O)2- и -C(=N-R9)-, где R9 выбирают из группы, состоящей из H, -CN и C1-C5 алкила, необязательно замещенного 1-11 галогенами; каждый R независимо выбирают из группы, состоящей из H и -CH3;R1 выбирают из группы, состоящей из H, -C1-C5 алкила и -(C(R)2)nA2, где -C1-C5 алкил необязательно замещен 1-11 галогенами;R2 выбирают из группы, состоящей из H, -C1-C5 алкила, A1 и -(C(R)2)nA2, где -C1-C5 алкил необязательно замещен 1-11 галогенами; когда один из B и R2 представляет собой A1 и один из B, R1 и R2 представляет собой A2 или-(C(R)2)nA2; так что соединение формулы Ie включает одну группу A1 и одну группу A2;A2 выбирают из группы, состоящей из фенила, циклогексила и пиридила, где A2 необязательно замещен 1-2 замещающими группами, независимо выбранными из галогена, -C1-C4 алкила и -CN, где-C1-C4 алкил необязательно замещен 1-3 галогенами; каждый Ra независимо выбирают из группы, состоящей из -C1-C3 алкила и галогена, где -C1-C3 алкил необязательно замещен 1-3 галогенами; каждый Rb независимо выбирают из группы, состоящей из Cl, F, -C1-C4 алкила и -OC1-C4 алкила, где-C1-C4 алкил и -OC1-C4 алкил необязательно замещены 1-5 F;p представляет собой целое число от 0 до 2; иq представляет собой целое число от 0 до 3. Подгруппы соединений, имеющих формулу Ie, включают соединения формул If, Ig и Ih и их фармацевтически приемлемые соли-5 011130 В соединениях формул If, Ig и Ih каждый из R1 и R2 независимо выбирают из H и -C1-C5 алкила, где-C1-C5 алкил необязательно замещен 1-11 галогенами. В подгруппах описанных выше соединений A2 может быть выбран из группы, состоящей из фенила,циклогексила и пиридила, где A2 необязательно замещен 1-2 замещающими группами, независимо выбранными из галогена, -CH3, -CF3 и -CN. В подгруппах описанных выше соединений каждый Ra независимо выбирают из группы, состоящей из -CF3 и Cl. В подгруппах описанных выше соединений каждый Rb независимо выбирают из группы, состоящей из -C1-C3 алкила, -OCH3 и F. В подгруппах описанных выше соединений каждый R1 и R2 независимо выбирают из группы, состоящей из H и -C1-C2 алкила. В подгруппах описанных выше соединений X выбирают из -O-, -NH-, -N(CH3)- и -CH2-. В подгруппах описанных выше соединений Z выбирают из группы, состоящей из -C(=O)-, -S(O)2- и-C(=N-CN)-. В подгруппах описанных выше соединений n равно 0 или 1. В подгруппах описанных выше соединений р равно 1. В подгруппах описанных выше соединений q равно 2 или 3. Подгруппа определенных ранее соединений включает соединения, имеющие формулу Ii, и их фармацевтически приемлемые солиt представляет собой целое число от 0 до 2. Другие группы являются такими, как определено ранее. Подгруппа определенных ранее соединений включает соединения, имеющие формулу Ij, или их фармацевтически приемлемые солиt представляет собой целое число от 0 до 2. Другие группы являются такими, как определено ранее. Определения.Ac представляет собой ацетил, который представляет собой CH3C(=O)-. Термин алкил означает насыщенные углеродные цепи, которые могут быть линейными или разветвленными либо их комбинацией, если углеродная цепь не определена по-другому. Другие группы, имеющие приставку алк, такие как алкокси и алканоил, также могут быть линейными или разветвленными либо их комбинацией, если углеродная цепь не определена по-другому. Примеры алкильных групп включают в себя метил, этил, пропил, изопропил, бутил, втор- и трет-бутил,пентил, гексил, гептил, октил, нонил и т.п. Алкиленовые группы представляют собой алкильные группы, которые являются дифункциональными, а не монофункциональными. Например, метил представляет собой алкильную группу и метилен (-CH2-) представляет собой соответствующую алкиленовую группу. Термин алкенил означает углеродные цепи, которые содержат по крайней мере одну двойную связь углерод-углерод и которые могут быть линейными или разветвленными либо их комбинациями.-6 011130 Примеры алкенила включают винил, аллил, изопропенил, пентенил, гексенил, гептенил, 1-пропенил,2-бутенил, 2-метил-2-бутенил и т.п. Термин алкинил означает углеродные цепи, которые содержат по крайней мере одну тройную связь углерод-углерод, и которые могут быть линейными или разветвленными или их комбинациями. Примеры алкинила включают этинил, пропаргил, 3-метил-1-пентинил, 2-гептинил и т.п. Термин циклоалкил означает насыщенное карбоциклическое кольцо, имеющее от 3 до 8 атомов углерода, если не указано другого (например, циклоалкил может быть определен, как имеющий одну или несколько двойных связей). Термин также включает циклоалкильное кольцо, конденсированное с арильной группой. Примеры циклоалкила включают в себя циклопропил, циклопентил, циклогексил, циклогептил и т.п. Термин циклоалкенил означает неароматическое карбоциклическое кольцо, имеющее одну или несколько двойных связей. Термин арил (и арилен), когда он используется для описания заместителя или группы в структуре, означает моноциклическое или бициклическое соединение, в котором кольца являются ароматическими и которое содержит только кольцевые атомы углерода. Термин арил также может относиться к арильной группе, которая является конденсированной с циклоалкилом или гетероциклом. Предпочтительные арилы представляют собой фенил и нафтил. Фенил обычно представляет собой наиболее предпочтительную арильную группу.EDC представляет собой 1-этил-3-(3-диметиламинопропил)карбодиимид. Термины гетероциклил, гетероцикл и гетероциклический означают полностью или частично насыщенное или ароматическое 5-6-членное кольцо, содержащее 1-4 гетероатома, независимо выбранных из N, S и O, если не указано другого. Бензогетероцикл представляет собой фенильное кольцо, конденсированное с 5-6-членным гетероциклическим кольцом, имеющим 1-2 гетероатома, каждый из которых представляет собой O, N или S,где гетероциклическое кольцо может быть насыщенным или ненасыщенным. Примеры включают индол,бензофуран, 2,3-дигидробензофуран и хинолин.Me представляет собой метил. Амин Вейнреба представляет собой N,O-диметилгидроксиламин. Подразумевается, что термин композиция, как в случае фармацевтической композиции, охватывает продукт, включающий активный(е) ингредиент(ы) и инертный ингредиент, который составляет носитель, а также любой продукт, который возникает, прямо или косвенно, при объединении, комплексообразовании, или агрегации двух или более ингредиентов, или при диссоциации одного или более ингредиентов, или в результате других типов реакций, или взаимодействий одного или нескольких ингредиентов. Соответственно, фармацевтические композиции по настоящему изобретению охватывают любую композицию, полученную смешиванием соединения по настоящему изобретению и фармацевтически приемлемого носителя. Заместитель тетразол означает замещающую группу 2H-тетразол-5-ил и ее таутомеры. Оптические изомеры-диастереомеры-геометрические изомеры-таутомеры. Соединения формулы I могут содержать один или более асимметрических центров и могут существовать в виде рацематов, рацемических смесей, отдельных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. Подразумевается, что настоящее изобретение охватывает все такие изомерные формы соединений формулы I. Если структуры изображены в стереохимическом представлении, то они также включают другие стереохимические структуры, такие как энантиомеры, другие диастереоизомеры (где возможны диастереоизомеры) и смеси энантиомеров и/или диастереомеров, включая рацемические смеси. Некоторые описанные здесь соединения могут содержать олефиновые двойные связи, и, если не указано другого, подразумевается, что они включают как E, так и Z геометрические изомеры. Некоторые описанные здесь соединения могут существовать в виде таутомеров. Примером является кетон и его енольная форма, что известно как кетоенольная таутомерия. Соединения формулы I охватывают индивидуальные таутомеры, а также их смеси. Соединения формулы I, имеющие один или более асимметрических центров, могут быть разделены на диастереоизомеры, энантиомеры и т.п., методами, хорошо известными в данной области. Альтернативно, энантиомеры и другие соединения с хиральными центрами могут быть синтезированы путем стереоспецифического синтеза с использованием оптически чистых исходных веществ и/или реагентов известной конфигурации. Некоторые из бифенильных и биарильных соединений в данном описании наблюдаются в спектре ЯМР в виде смеси атропоизомеров (ротамеры). Соединения по настоящему изобретению охватывают индивидуальные атропоизомеры, а также их смеси. Соли.-7 011130 Термин фармацевтически приемлемые соли относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований и кислот, включая неорганические или органические основания и неорганические или органические кислоты. Соли, полученные из неорганических оснований, включают соли алюминия, аммония, кальция, меди, двухвалентного железа, трехвалентного железа, лития, магния,трехвалентного марганца, двухвалентного марганца, калия, натрия, цинка и т.п. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия. Соли в твердом виде могут существовать в виде более чем одной кристаллической структуры и также могут быть в виде гидратов. Соли,полученные из фармацевтически приемлемых органических и нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и ионообменных смол, таких как аргинин, бетаин, каффеин, холин,N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин,этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабрамин,изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и т.п. Когда соединения по настоящему изобретению являются основными, соли могут быть получены из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Такие кислоты включают уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную,этансульфоновую, фумаровую, глюконовую, глутаминовую, бромисто-водородную, хлористоводородную, изетионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, слизевую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную, винную, п-толуолсульфоновую кислоту и т.п. Особенно предпочтительными являются лимонная, бромисто-водородная, хлористоводородная, малеиновая, фосфорная, серная и винная кислоты. Следует понимать, что, как использовано в данном описании, подразумевается, что ссылки на соединения формулы I также включают ссылки на их фармацевтически приемлемые соли. Метаболиты-пролекарства. Терапевтически активные метаболиты, когда сами метаболиты попадают в объем заявленного изобретения, также представляют собой соединения по настоящему изобретению. Пролекарства, которые представляют собой соединения, которые превращаются в заявленные соединения при введении пациенту или после введения пациенту, также представляют собой соединения по настоящему изобретению. Применения. Соединения по настоящему изобретению представляют собой сильные ингибиторы CETP. Следовательно, они могут использоваться при лечении заболеваний и состояний, которые поддаются лечению ингибиторами CETP. Один аспект настоящего изобретения относится к способу лечения или снижения риска развития заболевания или состояния, которое поддается лечению или профилактике посредством ингибированияCETP, путем введения терапевтически эффективного количества соединения по данному изобретению пациенту, нуждающемуся в лечении. Пациент представляет собой человека или млекопитающее и наиболее часто человека. Термин терапевтически эффективное количество представляет собой количество соединения, которое является эффективным для получения желаемого клинического результата при лечении конкретного заболевания. Заболевания или состояния, которые можно лечить с помощью соединений по данному изобретению, или риск развития которых у пациента может снизиться в результате лечения соединениями по данному изобретению, включают атеросклероз, периферические сосудистые заболевания, дислипидемию, гипербеталипопротеинемию, гипоальфалипопротеинемию, гиперхолестеринемию, гипертриглицеридемию, наследственную гиперхолистеринемию, сердечно-сосудистые нарушения, стенокардию, ишемическую болезнь, ишемическую болезнь сердца, инсульт, инфаркт миокарда, реперфузионное повреждение, ангиопластический рестеноз, гипертензию, сосудистые осложнения при диабете, ожирение и эндотоксемию. Ожидается, что соединения по данному изобретению будут особенно эффективны для повышенияLDL-C могут быть благоприятными для лечения атеросклероза, снижения или изменения в обратную сторону процесса развития атеросклероза, снижения риска развития атеросклероза или предотвращения возникновения атеросклероза. Введение и диапазоны дозировки. Для обеспечения млекопитающего, особенно человека, эффективной дозой соединения по настоящему изобретению можно использовать любой подходящий путь введения. Например, можно использовать пероральный, ректальный, наружный, парентеральный, глазной, легочный, назальный и т.п. пути введения. Препаративные лекарственные формы включают таблетки, пилюли, дисперсии, суспензии,растворы, капсулы, кремы, мази, аэрозоли и т.п. Предпочтительно соединения формулы I вводят перорально.-8 011130 Эффективная дозировка используемого активного ингредиента может изменяться в зависимости от конкретного используемого соединения, способа введения, состояния, подвергаемого лечению, и тяжести состояния, подвергаемого лечению. Такие дозировки легко могут быть установлены специалистом в данной области. При лечении заболеваний, для которых предназначены соединения формулы I, общие удовлетворительные результаты получают в том случае, когда соединения по настоящему изобретению вводят в суточной дозе от примерно 0,01 до примерно 100 мг/кг веса тела животного или человека, предпочтительно вводимой в виде разовой суточной дозы, или в виде разделенных доз от 2 до 6 раз в день, или в виде формы с замедленным высвобождением. В случае взрослого человека весом 70 кг общая суточная доза обычно будет составлять примерно от 0,5 до примерно 500 мг. Для особенно сильного соединения дозировка для взрослого человека может быть всего лишь 0,1 мг. Режим дозировки можно регулировать в данном диапазоне или даже за пределами данного диапазона для обеспечения оптимальной терапевтической ответной реакции. Пероральное введение обычно осуществляют с использованием таблеток. Примеры дозировки в таблетках составляют 0,5, 1, 2, 5, 10, 25, 50, 100, 250 и 500 мг. Другие пероральные формы также могут иметь такую же дозировку (например, капсулы). Фармацевтические композиции. Другой аспект настоящего изобретения составляют фармацевтические композиции, которые включают соединение формулы I и фармацевтически приемлемый носитель. Фармацевтические композиции по настоящему изобретению включают соединение формулы I или его фармацевтически приемлемую соль в качестве активного ингредиента, а также фармацевтически приемлемый носитель и необязательно другие лекарственные ингредиенты. Термин фармацевтически приемлемые соли относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические основания или кислоты и органические основания или кислоты. Фармацевтическая композиция также может включать пролекарство или его фармацевтически приемлемую соль, если вводят пролекарство. Фармацевтическая композиция также может состоять, по существу, из соединения формулы I и фармацевтически приемлемого носителя без других лекарственных ингредиентов. Композиции включают композиции, подходящие для перорального, ректального, наружного, парентерального (включая подкожное, внутримышечное и внутривенное), глазного (офтальмологического),легочного (назальная или буккальная ингаляция) или назального введения, хотя наиболее подходящий путь введения в любом конкретном случае будет зависеть от природы и тяжести состояния, подвергаемого лечению, и от природы активного ингредиента. Они могут быть удобным образом существовать в виде единичных препаративных лекарственных форм и быть получены любым из способов, хорошо известных в области фармацевтики. При практическом использовании соединения формулы I можно объединять в виде однородной смеси активного ингредиента с фармацевтическим носителем в соответствии с обычными методами фармацевтического компаундирования. Носитель может принимать множество видов в зависимости от формы препарата, требуемой для введения, например перорального или парентерального (включая внутривенное). При получении композиций для пероральных препаративных лекарственных форм можно использовать любую из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты, ароматизаторы, консерванты, красители и т.п., в случае пероральных жидких препаратов, таких как,например, суспензии, эликсиры и растворы, или носители, такие как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие агенты, смазочные вещества, связующие вещества, дезинтегрирующие агенты и т.п. в случае пероральных твердых препаратов, таких как, например, порошки,твердые и мягкие капсулы и таблетки, где твердые пероральные препараты более предпочтительны по сравнению с жидкими препаратами. Благодаря легкости введения, таблетки и капсулы представляют собой наиболее предпочтительные пероральные стандартные дозированные лекарственные формы, в которых очевидно используются твердые фармацевтические носители. При желании таблетки могут быть покрыты оболочкой с помощью стандартных водных или неводных способов. Такие композиции и препараты должны содержать по меньшей мере 0,1% активного соединения. Процент активного соединения в данных композициях может, конечно, изменяться и предпочтительно составляет от примерно 2 до примерно 6% по весу от стандартной формы. Количество активного соединения в таких терапевтически используемых композициях является таким, что получают эффективную дозировку. Активные соединения также можно вводить внутриназально, например, в виде жидких капель или спрея. Таблетки, пилюли, капсулы и т.п. могут также содержать связующее вещество, такое как трагакантовая камедь, аравийская камедь, кукурузный крахмал или желатин; эксципиенты, такие как дикальцийфосфат; дезинтегрирующий агент, такой как кукурузный крахмал, картофельный крахмал, альгиновая кислота;-9 011130 смазочное вещество, такое как стеарат магния; и подсластитель, такой как сахароза, лактоза или сахарин. Когда единичная препаративная лекарственная форма представляет собой капсулу, она может содержать, в дополнение к материалам вышеуказанного типа, жидкий носитель, такой как жирное масло. Различные другие материалы могут присутствовать в качестве оболочки или для модификации физических свойств единичной препаративной лекарственной формы. Например, таблетка может быть покрыта шеллаком, сахаром или и тем, и другим. Сироп или эликсир могут содержать, в дополнение к активному ингредиенту, сахарозу в качестве подсластителя, метил и пропилпрабены в качестве консервантов, краситель и ароматизатор, такой как вишневый или апельсиновый ароматизатор. Соединения формулы I также можно вводить парентерально. Растворы или суспензии данных активных соединений могут быть получены в воде, подходящим образом смешанной с поверхностноактивным веществом, таким как гидроксипропилцеллюлоза. Дисперсии также могут быть получены в глицерине, жидких полиэтиленгликолях и их смесях в маслах. При обычных условиях хранения и использования данные препараты содержат консервант для предотвращения роста микроорганизмов. Фармацевтические формы, подходящие для применения в виде инъекций, включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления для немедленного применения стерильных растворов или дисперсий для инъекций. Во всех случаях форма должна быть стерильной и должна быть жидкой в такой степени, чтобы имелась возможность легкого введения шприцом. Она должна быть стабильной в условиях изготовления и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или среду для дисперсии, содержащую, например, воду, этанол, многоатомный спирт (например,глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их подходящие смеси и растительные масла. Комбинированная терапия. Соединения по изобретению (например, имеющие формулы I и Ia-Ij) можно использовать в сочетании с другими лекарственными средствами, которые также можно использовать для лечения или облегчения протекания заболеваний или состояний, для которых используются соединения формулы I. Такие другие лекарственные средства можно вводить с использованием пути введения и в количестве, обычно используемых для этих целей, одновременно или последовательно вместе с соединением формулы I. Терапевтические соединения, которые можно вводить вместе с соединениями по данному изобретению, включают соединения, которые можно использовать для улучшения липидного профиля пациента (т.е. повышения HDL-C и понижения LDL-C). Предпочтительными соединениями являются статины,включая симвастатин, ловастатин, розувастатин, правастатин, флувастатин, аторвастатин, ривастатин,итавастатин и ZD-4522. Анализ CETP. Непрерывный анализ in vitro для определения IC50 с целью выявления соединений, которые являются ингибиторами CETP, был осуществлен на основе модификации способа, описанного Epps и другими с использованием BODIPY -CE в качестве липидного донора сложного эфира холестерина. См. Epps etPhys. Lipids. 77, 51-63. Частицы, использованные в данном анализе, создавали из следующих источников: синтетические частицы доноры HDL, содержащие DOPC (Диолеоил Фосфатидил Холин) BODIPY-CE (MolecularProbes C-3927), триолеин (триглицерид) и apoHDL, по существу, создавали посредством зондовой обработки ультразвуком, как описано Epps et al., но с добавлением не способной к диффузии молекулыгасителя, дабцилдицетиламида для снижения фоновой флуоресценции. Дабцилдицетиламид получали путем нагревания дабцил н-сукцинимида с дицетиламином в ДМФ при 95C в течение ночи в присутствии в качестве катализатора диизопропиламина. Природные липопротеины крови человека использовали в качестве акцепторных частиц. Частицы, имеющие плотность менее 1,063 г/мл, собирали путем ультрацентрифугирования. Данные частицы включают VLDL, IDL и LDL. Концентрации частиц выражали в исчислении на концентрацию белка, определенную анализом BCA (Pierce, США). Частицы хранили при 4C до использования. Анализы проводили в черных 96-луночных планшетах Dynex Microfluor 2 с U-дном (каталожный 7205). Получали коктейль для анализа, содержащий CETP, буфер IX CETP (50 мМ Tris, pH 7,4,100 мМ NaCl, 1 мМ EDTA) и половину конечной концентрации акцепторных частиц и 100 мкл коктейля для анализа добавляли в каждую лунку планшета. Тестируемые соединения в ДМСО добавляли в объеме 3 мкл. Содержимое планшетов перемешивали с использованием встряхивающего устройства для планшетов и затем инкубировали при 25C в течение 1 ч. Готовили второй коктейль для анализа, содержащий донорные частицы, оставшиеся акцепторные частицы и буфер IX CETP. В реакционные лунки для начала анализа добавляли 47 мкл второго коктейля для анализа. Анализы проводили при 25C в конечном объеме 150 мкл. Конечные концентрации вещества составляли 5 нг/мкл донорных частиц,30 нг/мкл акцепторных частиц (каждая выражена по содержанию белка), буфер IX CETP, 0,8 нМ рекомбинантного CETP человека (экспрессированного в клетках CHO и частично очищенного) и до 2%- 10011130 ДМСО, когда использовались тестируемые соединения. Анализы проводили на флуоресцентном планшетном ридере (Molecular Devices Spectramax GeminiXS), установленном на 45-минутный кинетический проход при 25C, который считывал показания для каждого образца каждые 45 с при Ex=480 нм, Em=511 нм, с отсекающим фильтром при 495 нм, с установкой электронной лампы фотоумножителя на среднее значение, калибровкой и при 6 считываниях/лунку. Данные оценивали путем получения первоначальной скорости, выраженной в относительных единицах флуоресценции в секунду, для псевдолинейной части кривой, часто 0-500 или 1000 с. Сравнение скоростей для образцов с ингибиторами относительно образцов без ингибиторов (только ДМСО) в качестве положительного контроля давало процент ингибирования. График процента ингибирования относительно логарифма концентрации ингибитора, удовлетворяющий сигмоидальному 4-параметровому уравнению, использовали для расчета IC50. Примеры Следующие схемы и примеры приведены для того, чтобы изобретение было более полно оценено и понятно. Исходные вещества получают с использованием известных способов или так, как показано ниже. Примеры не следует рассматривать как ограничивающие изобретение каким-либо образом. Объем изобретения определяет прилагаемая формула изобретения. Соединения по изобретению имеют величину IC50, измеренную с помощью описанного выше метода анализа, менее или равную 50 мкМ. Схема 1 Промежуточные соединения 1-2, 1-3, 1-4, 1-5 и 1-6, использованные в настоящем изобретении, могут быть куплены в готовом виде или получены, как показано на схеме 1. Подходящим образом замещенный 2-галогенанилин 1-1, где Ra и p являются такими, как определено в формуле изобретения, и где галоген предпочтительно представляет собой йод или бром, обрабатывают CuCN в ДМФ при повышенной температуре, получая соответствующий 2-цианоанилин. Альтернативно, нитрил может быть получен обработкой соединения 1-1 KCN и CuI в присутствии соли палладия (II) или в присутствии некоторых комплексов меди или никеля (см.: Smith, M.B. и March, J. March's Advanced Organic Chemistry, 5th Ed.,John WileySons, New York, p. 867 (2001) и процитированные там ссылки). Йодиды 1-3 получают обработкой 1-2 изоамилнитритом, н-пентилнитритом, трет-бутилнитритом или т.п. соединениями в присутствии дийодметана (см., например, Smith et al., J. Org. Chem. 55, 2543, (1990) и процитированные там ссылки) или в отсутствие растворителя или в растворителе, таком как ТГФ или ацетонитрил. Альтернативно,йодид может быть получен с помощью первоначального образования соли диазония с использованием изоамилнитрита, н-пентилнитрита, трет-бутилнитрита, нитрита натрия, азотистой кислоты или т.п. с последующим нагреванием в присутствии йода или соли йода, такой как йодид меди, йодид натрия, йодид калия, йодид тетрабутиламмония или т.п. Восстановление 1-3 с использованием DIBAL в дихлорметане дает альдегид 1-4. Восстановление альдегида 1-4 боргидридом натрия, или т.п. в метаноле или этаноле,или т.п., дает спирт 1-5. Обработка 1-5 четырехбромистым углеродом и трифенилфосфином в таких растворителях как дихлорметан, дихлорэтан или т.п. дает бромистый бензил 1-6 (см.: Smith, M.B. и March, J. Промежуточные соединения 2-2 и 2-3 по настоящему изобретению, где Ra, p и A3 являются такими,- 11011130 как определено в формуле изобретения, могут быть получены, как показано на схеме 2. 2-Цианойодбензолы могут быть закуплены в готовом виде или получены в соответствии со способами,показанными на схеме 1. Соединения 2-2 получают реакциями Сузуки или Стилле. Или их вариациями с использованием катализируемого палладием кросс-сочетания йодида 2-1 с подходящим образом замещенными арил- или гетероарилбороновой кислотой, сложным эфиром бороновой кислоты или триалкилоловом, как описано Miyaua et al., Chem. Rev. 95, 2457 (1995) и процитированных там ссылках и как описано Smith, M.B. и March, J. March's Advanced Organic Chemistry, 5th Ed., John WileySons, NewYork, p. 868-869 (2001) и процитированных там ссылках. Восстановление нитрита 2-2 проводят с использованием литийалюминийгидрида в диэтиловом эфире, получая 2-аминометиланилин 2-3. Альтернативно, нитрил можно восстановить с использованием палладия-на-угле или никеля Ренея в атмосфере водорода в метаноле, этаноле или т.п. Другие способы восстановления нитрильной группы в аминометильную можно найти в Smith, M.B. и March, J. March's Advanced Organic Chemistry, 5th Ed., John Соединения 3-4 по настоящему изобретению, где R, Ra, p, A2, A3 и n являются такими, как определено в формуле изобретения, могут быть получены в соответствии со способом, показанным на схеме 3. Бензиламины 3-1 могут быть закуплены в готовом виде или получены в соответствии со способами, показанными на схеме 2. Взаимодействие 3-1 с подходящим образом замещенным алкилацетатом, содержащим уходящую группу в положении 2, приводит к вторичному амину 3-2. Алкилацетаты могут быть закуплены в готовом виде или получены с использованием известных способов. Предпочтительная уходящая группа представляет собой бром или йод, но также может представлять собой мезилат, тозилат или т.п., а растворитель может представлять собой дихлорметан, дихлорэтан, тетрагидрофуран, диметоксиэтан или т.п. Реакцию можно проводить в присутствии или в отсутствие основания, такого как триэтиламин, диизопропилэтиламин, N-метилморфолин или т.п. Восстановление сложноэфирной функциональной группы в 3-2 приводит к аминоспирту 3-3. Предпочтительным восстановителем является LiAlH4 в таком растворителе, как простой эфир, тетрагидрофуран, диметоксиэтан, диоксан или т.п. Другие способы восстановления сложного эфира можно найти в Smith, M.B. и March, J. March's Advanced OrganicChemistry, 5th Ed., John WileySons, New York, p. 1551. Аминоспирт 3-3 можно подвергнуть циклизации в оксазолидинон 3-4 с использованием фосгена (Y=Cl) или эквивалента фосгена, такого как трифосген (Y=OCCl3), или карбонилдиимидазола (Y=имидазол), или т.п., в таком растворителе, как дихлорметан, дихлорэтан, тетрагидрофуран, диметоксиэтан или т.п., в присутствии основания, такого как триэтиламин, диизопропилэтиламин, N-метилморфолин или т.п. Энантиочистые продукты могут быть получены с помощью хиральной хроматографии. Соединения 4-3 по настоящему изобретению, где R, Ra, p, A2, A3 и n являются такими, как определено в формуле изобретения, могут быть получены в соответствии со способом, показанным на схеме 4. Подходящим образом замещенный бензиламин 4-1 может быть подвергнут взаимодействию с подходящим образом замещенным оксираном с образованием аминоспирта 4-2. Оксираны могут быть закуплены в готовом виде или получены из соответствующего альдегида и илида серы, как описано в March's Advanced Organic Chemistry, 5th Ed., John WileySons, New York, p. 1247. Альтернативно, эпоксид может быть получен эпоксидированием олефина, циклизацией галогенгидрина или 1,2-диола или другими способами, описанными в March's Advanced Organic Chemistry, 5th Ed., John WileySons, New York,p. 1051. Предпочтительным растворителем для данной реакции является изопропанол. Альтернативно,раскрытие эпоксида может быть проведено в таком растворителе, как ацетонитрил или т.п., с добавлением в качестве катализатора кислоты Льюиса, такой как Yb(OTf)3 или т.п. Аминоспирт 4-2 может быть подвергнут циклизации в оксазолидинон 4-3 с использованием фосгена (Y=Cl) или эквивалента фосгена,такого как трифосген (Y=OCCl3), или карбонилдиимидазол (Y=имидазол) или т.п., в растворителе, таком как дихлорметан, дихлорэтан, тетрагидрофуран, диметоксиэтан или т.п., в присутствии основания, такого как триэтиламин, диизопропилэтиламин, N-метилморфолин или т.п. Альтернативно, аминоспирт 4-2 может быть преобразован в подходящий карбамат при обработке такими реагентами, как дибензилкарбонат или бензилхлорформиат, в присутствии оснований, таких как триэтиламин, диизопропилэтиламин или т.п., в растворителях, таких как дихлорметан, дихлорэтан, тетрагидрофуран, диметоксиэтан или т.п. Карбаматы затем могут быть преобразованы в оксазолидиноны 4-3 при обработке основаниями, такими как гексаметилдисилазид лития, натрия или калия, в растворителях, таких как тетрагидрофуран, диметоксиэтан или т.п. Энантиочистые продукты могут быть получены с помощью хиральной хроматографии. Схема 5- 13011130 Соединения 5-5 по настоящему изобретению, где R, Ra, p, A2, A3 и n являются такими, как определено в формуле изобретения, могут быть получены в соответствии со способом, показанным на схеме 5. Подходящим образом замещенный аминоспирт 5-1 может быть получен, как показано на схеме 4, и предпочтительно защищен в виде карбамата, такого как трет-бутилкарбамат (BOC) или бензилкарбамат(Cbz). Другие карбаматные и альтернативные защитные группы азота можно найти в Protective Groupsin Organic Synthesis, 3rd Ed. John WileySons, New York, p. 494. Введение защитной группы азота с использованием групп BOC или Cbz может быть проведено при взаимодействии 5-1 с ди-трет-бутилдикарбонатом или дибензилкарбонатом в подходящем растворителе, таком как дихлорметан, дихлорэтан, тетрагидрофуран, диметоксиэтан или т.п. Спирт 5-2 может быть преобразован в азид 5-3 при реакции с метансульфонилхлоридом в дихлорметане, дихлорэтане, тетрагирофуране, диметоксиэтане или т.п., в присутствии подходящего основания, такого как триэтиламин, диизопропилэтиламин,N-метилморфолин или т.п. Альтернативно, спирт может быть преобразован в альтернативную уходящую группу, такую как тозилат, йодид, бромид или т.п. Мезилат затем замещают с помощью источника азида,такого как NaN3, LiN3, Bu4NN3 или т.п., в подходящем растворителе, таком как ДМФ, DMPU или т.п. Азид 5-3 также может быть получен при обработке спирта 5-2 дифенилфосфорилазидом, диэтилазодикарбоксилатом и трифенилфосфином в ТГФ. Азид 5-3 можно восстановить гидрированием над металлическим катализатором, таким как Pt2O или Pd/C или т.п., в подходящем растворителе, таком как EtOAc,ТГФ, EtOH или т.п. После восстановления и удаления защитной группы получают диамин 5-4. Для защитной группы BOC предпочтительным способом удаления защитной группы является обработка ТФУК/CH2Cl2, для защитной группы CBZ гидрирование над металлическим катализатором, таким какPt2O или Pd/C или т.п., в подходящем растворителе, таком как EtOAc, ТГФ, EtOH или т.п. является предпочтительным способом удаления защитной группы. Диамины 5-4 подвергают циклизации в имидазолидиноны 5-5 с использованием фосгена (Y=Cl) или эквивалента фосгена, такого как трифосген (Y=OCCl3) или карбонилдиимидазол (Y=имидазол) или т.п., в растворителе, таком как дихлорметан, дихлорэтан,тетрагидрофуран, диметоксиэтан или т.п., и основания, такого как триэтиламин, диизопропилэтиламин,N-метилморфолин или т.п. Энантиочистые продукты могут быть получены посредством хиральной хроматографии. Схема 6 Соединения 6-4 по настоящему изобретению, где R, Ra, p, A2, A3 и n являются такими, как определено в формуле изобретения, могут быть получены в соответствии со способом, показанным на схеме 6. Обработка 6-1 замещенным подходящим образом аминоальдегидом, который может быть закуплен уже в готовом виде или получен известными способами, в присутствии восстановителя, такого как боргидрид натрия, цианоборгидрид натрия, триацетоксиборгидрид натрия или т.п., в метаноле, этаноле, дихлорэтане, тетрагидрофуране или т.п. или в соответствии со способами, описанными в Smith, M.B. и March, J.March's Advanced Organic Chemistry, 5th Ed., John WileySons, New York, p. 1187-1189 (2001) и процитированных там ссылках, приводит к 6-2. Предпочтительными условиями для данного превращения является использование цианоборгидрида натрия в метаноле с использованием каталитического количества уксусной кислоты. Снятие защитных групп в 6-2 приводит к 6-3. Для защитной группы BOC предпочтительным способом удаления защитной группы является обработка ТФУК/CH2Cl2. Диамины 6-3 затем подвергают циклизации в имидазолидиноны 6-4 с использованием фосгена (Y=Cl) или эквивалента фосгена, такого как трифосген (Y=OCCl3), или карбонилдиимидазола (Y=имидазол) или т.п., в растворителе, таком как дихлорметан, дихлорэтан, тетрагидрофуран, диметоксиэтан или т.п., с использованием основания, такого как триэтиламин, диизопропилэтиламин, N-метилморфолин или т.п. Энантиочистые продукты могут быть получены посредством хиральной хроматографии. Соединения 7-5 по настоящему изобретению, где R, Ra, p, A2, A3 и n являются такими, как определено в формуле изобретения, могут быть получены в соответствии со способом, показанным на схеме 7. Обработка амина 7-1, полученного, как описано на схеме 4, подходящим дикарбонатом или хлорформиатом приводит к 7-2. Продукт 7-2 может быть преобразован в азид при взаимодействии с метансульфонилхлоридом в дихлорметане, дихлорэтане, тетрагидрофуране, диметоксиэтане или т.п., в присутствии подходящего основания, такого как триэтиламин, диизопропилэтиламин, N-метилморфолин или т.п. Альтернативно, спирт может быть преобразован в альтернативную уходящую группу, такую как тозилат,йодид, бромид или т.п. Мезилат затем замещают с помощью источника азида, такого как NaN3, LiN3,Bu4NN3 или т.п., в подходящем растворителе, таком как ДМФ, DMPU или т.п. Азид 7-3 также может быть получен при обработке спирта 5-2 дифенилфосфорилазидом, диэтилазодикарбоксилатом и трифенилфосфином в ТГФ. Азид 7-3 можно восстановить в амин 7-4 с использованием H2 над Pt2O в ТГФ в качестве растворителя, когда R4 представляет собой бензил. Циклизацию 7-4 в имидазолидиноны 7-5 осуществляют при использовании подходящего основания, такого как диизопропиламид лития или бис-(триметилсилил)амид лития, натрия или калия, или т.п., в подходящем растворителе, таком как ТГФ,диметоксиэтан, ДМФ, DMA или т.п. Энантиочистые продукты могут быть получены посредством хиральной хроматографии. Схема 8 Соединения 8-1 (полученные, как описано на схемах 5, 6 и 7), где R, Ra, p, A2, A3 и n являются такими, как определено в формуле изобретения, могут быть преобразованы в 8-2 при обработке подходящим алкилирующим агентом, таким как алкилгалогенид, алкилтозилат, алкилмезилат или т.п. (например,йодистым метилом) в подходящем растворителе, таком как ТГФ, диметоксиэтан, ДМФ, DMA или т.п., в присутствии подходящего основания, такого как диизопропиламид лития или бис-(триметилсилил)амид лития, натрия или калия, или т.п. Используемые в настоящем изобретении промежуточные соединения 9-3 и 9-4, где Ra, p и A3 являются такими, как определено в формуле изобретения, могут быть получены, как показано на схеме 9. Подходящим образом замещенный бензилнитрил 9-1, полученный как показано на схеме 2, может быть подвергнут нагреванию с основанием, таким как гидроксид натрия или гидроксид калия или т.п., в подходящем водном спирте, таком как этанол, пропанол или т.п., давая подходящим образом замещенную бензойную кислоту 9-2 (см. Smith, M.B. и March, J. March's Advanced Organic Chemistry, 5th Ed., JohnWileySons, New York, p. 1179-1180 (2001) и процитированные там ссылки). Бензойная кислота 9-2 может быть восстановлена до бензиловых спиртов 9-3 с использованием восстановителей, таких как боран,в растворителях, таких как тетрагидрофуран или т.п. (Smith, M.B. и March, J. March's Advanced OrganicChemistry, 5th Ed., John WileySons, New York, p. 1549 (2001) и процитированные там ссылки). Альтернативно, 9-2 может быть превращен в сложный эфир известными способами, включая обработку триметилсилилдиазометаном, и полученный сложный эфир может быть восстановлен в спирт 9-3 с использованием LiAlH4 или т.п. Промежуточные соединения 9-3 могут быть преобразованы в бензилбромиды 9-4 с использованием таких реагентов как трифенилфосфин и четырехбромистый углерод, в растворителях,таких как дихлорметан, дихлорэтан или т.п. (см. Smith, M.B. и March, J. March's Advanced Organic Chemistry, 5th Ed., John WileySons, New York, p. 518-519 (2001) и процитированные там ссылки). Схема 10 Промежуточные соединения 10-4 по настоящему изобретению, где R, R1, A2, p и n являются такими,как определено в формуле изобретения, могут быть получены, как показано на схеме 10, из подходящим образом замещенного бензальдегида 10-1 путем конденсации с нитроалканом с образованием замещенного нитроспирта 10-2. Данную реакцию можно катализировать водными основаниями, такими как гидроксид натрия или т.п., в растворителях, таких как этанол, метанол или т.п. Нитроспирты 10-2 могут быть восстановлены до аминоспиртов 10-3 с использованием восстановителей, таких как никель Ренея,палладий-на-активированном угле или оксид платины, в присутствии газообразного водорода и водной кислоты в спиртовых растворителях, таких как метанол, этанол или т.п. (см. Langer, O., et al., Bioorg.Med. Chem., 2001, 9, 677-694). Аминоспирты 10-3 могут быть подвергнуты циклизации в оксазолидиноны 10-4 с использованием таких реагентов, как фосген (Y=Cl), трифосген (Y=OCCl3) или карбонилдимидазол (Y=имидазол), в присутствии оснований, таких как триэтиламин, диизопропилэтиламин или т.п., в растворителях, таких как дихлорметан, дихлорэтан, тетрагидрофуран, диметоксиэтан или т.п. Промежуточные соединения 11-4 по настоящему изобретению, где R, R1, A2, р и n являются такими,как определено в формуле изобретения, могут быть получены, как показано на схеме 11. ОбработкаN-карбамоил-(N-метокси-N-метил)амида аминокислоты 11-1, который может быть закуплен в готовом виде или получен известными способами, реактивом Гриньяра или другим металлоорганическим реагентом, таким как литийорганическое соединение, приводит к соответствующему кетону 11-2. Восстановление кетона боргидридом натрия или боргидридом цинка в спиртовых растворителях или ТГФ, или т.п.,или с использованием других восстановителей, таких как фенилдиметилсилан в ТГФ, приводит к спирту 11-3, который может быть подвергнут циклизации в оксазолидинон 11-4 путем обработки основанием,таким как KOH, в растворителях, таких как MeOH, EtOH или т.п., и ТГФ, диоксане, диметоксиэтане или т.п. Схема 12 Соединения 12-3 по настоящему изобретению, где R, R1, Ra, A2, A3, р и n являются такими, как определено в формуле изобретения, могут быть получены, как показано на схеме 12. Оксазолидиноны 12-2, полученные как показано на схемах 10 и 11, могут быть подвергнуты алкилированию бромистыми бензилами 12-1, которые получают, как показано на схеме 9, с использованием оснований, таких как гексаметилдисилазид натрия или гидрид натрия, в растворителях, таких как тетрагидрофуран, диметоксиэтан, диэтиловый эфир, диметилформамид, диметилацетамид или т.п., приводя к продуктам 12-3. Схема 13 Соединения 13-4 по настоящему изобретению, где R, R1, Ra, A2, A3, р и n являются такими, как определено в формуле изобретения, могут быть получены, как показано на схеме 13. Оксазолидиноны 13-2,полученные как показано на схемах 10 и 11, могут быть подвергнуты алкилированию бромистыми бензилами 13-1, которые получают, как показано на схеме 1, с использованием оснований, таких как гексаметилдисилазид натрия или гидрид натрия, в растворителях, таких как тетрагидрофуран, диметоксиэтан,диэтиловый эфир или т.п., приводя к продуктам 13-3. Соединения 13-4 затем получают посредством ре- 17011130 акций Сузуки или Стилле или их вариаций с использованием катализируемого палладием кросссочетания йодида 13-3 с подходящим образом замещенной арил- или гетероарилбороновой кислотой,сложным эфиром бороновой кислоты или триалкилоловом, как описано в публикации Miyaua et al.,Chem. Rev. 95, 2457 (1995) и процитированных там ссылках, и как описано в Smith, M.B. и March, J. Соединения 14-5 по настоящему изобретению, где R, Ra, A2, A3, р и n являются такими, как определено в формуле изобретения, могут быть получены, как показано на схеме 14. Бензиловые спирты 14-1 могут быть в готовом виде или получены в соответствии со способом, показанным на схеме 9. Взаимодействие 14-1 с периодинаном Десс-Мартина приводит к соответствующим бензальдегидам 14-2. Также можно использовать другие способы окисления первичной гидроксильной группы в альдегид, например,условия окисления по Сверну, перрутенат тетрапропиламмония, хлорхромат пиридиния, комплекс триоксид серы-пиридин или т.п. 2-Амино-1-фенилэтанолы 14-3 могут быть получены из 14-2 через соответствующий силилированный циангидрин, образующийся при обработке триметилсилилцианидом и каталитическим количеством йодида цинка с последующим восстановлением литийалюминийгидридом или подобным восстановителем. Альтернативно, 2-амино-1-фенилэтанолы 14-3 могут быть получены из 14-2 через соответствующий циангидрин, полученный при обработке цианидом калия с последующим восстановлением. 2-Амино-1-фенилэтанолы 14-3 могут быть подвергнуты циклизации в оксазолидиноны 14-4 с использованием реагентов, таких как фосген (Y=Cl) или трифосген (Y=OCCl3), или карбонилдиимидазол (Y=имидазол) в присутствии основания, такого как триэтиламин, диизопропилэтиламин или т.п., в растворителях, таких как дихлорметан, дихлорэтан, тетрагидрофуран, диметоксиэтан или т.п. Оксазолидиноны 14-4 могут быть подвергнуты алкилированию алкил-, гетероалкил-, арил- или гетероарилбромидами с использованием оснований, таких как гексаметилдисилазид натрия или гидрид натрия, в растворителях, таких как тетрагидрофуран, диметоксиэтан, диэтиловый эфир или т.п., с получением продуктов 14-5. Энантиочистые продукты могут быть получены посредством хиральной хроматографии. Соединения 15-6 по настоящему изобретению, где R, R1, Ra, A2, A3, р и n являются такими, как определено в формуле изобретения, могут быть получены, как показано на схеме 15. Альдегиды 15-1 могут быть закуплены в готовом виде или получены в соответствии со способом, показанным на схеме 1. Конденсация 15-1 с нитроалканом приводит к замещенным нитроспиртам 15-2. Данную реакцию можно катализировать водными основаниями, такими как гидроксид натрия или т.п., в растворителях, таких как этанол, метанол или т.п. Нитроспирты 15-2 могут быть восстановлены до аминоспиртов 15-3 такими восстановителями, как никель Ренея, палладий на активированном угле или оксид платины в присутствии газообразного водорода и водной кислоты в спиртовых растворителях, таких как метанол, этанол или т.п.(см. Langer, O., et al. Bioorg. Med. Chem., 2001, 9, 677-694). Аминоспирты 15-3 могут быть подвергнуты циклизации в оксазолидиноны 15-4 с использованием таких реагентов, как фосген (Y=Cl), трифосген(Y=OCCl3) или карбонилдиимидазол (Y=имидазол) в присутствии оснований, таких как триэтиламин,диизопропилэтиламин или т.п., в растворителях, таких как дихлорметан, дихлорэтан, тетрагидрофуран,диметоксиэтан или т.п. Оксазолидиноны 15-5 затем получают реакциями Сузуки или Стилле или их вариациями с использованием катализируемого палладием кросс-сочетания йодидов 15-4 с подходящим образом замещенными арил- или гетероарилбороновыми кислотами, сложными эфирами бороновых кислот или соединениями триалкилолова, как описано в публикации Miyaua et al., Chem. Rev. 95, 2457(1995) и процитированных там ссылках, и как описано в Smith, M.B. и March, J. March's Advanced Organic Chemistry, 5th Ed., John WileySons, New York, p. 868-869 (2001) и процитированных там ссылках. Оксазолидиноны 15-5 могут быть подвергнуты алкилированию алкил-, гетероалкил-, арил- или гетероарилбромидами с использованием оснований, таких как гексаметилдисилазид натрия или гидрид натрия, в растворителях, таких как тетрагидрофуран, диметоксиэтан, диэтиловый эфир или т.п., с получением продуктов 15-6. Энантиочистые продукты могут быть получены посредством хиральной хроматографии. Соединения 16-5 по настоящему изобретению, где R, R1, Ra, A2, A3, р и n являются такими, как определено в формуле изобретения, могут быть получены, как показано на схеме 16. Альдегиды 16-1 могут быть закуплены в готовом виде или получены в соответствии со способом, показанным на схеме 1. Конденсация 16-1 с хиральными N-ацилоксазолидинонами приводит к альдольным аддуктам 16-2,как описано в публикации Evans, D.A. et al., J. Am. Chem. Soc., 2002, 124, 392-3. ХиральныеN-ацилоксазолидиноны могут быть закуплены в готовом виде или получены, как описано Ager, D.J.;Allen, D.A.; Schaad, D.R. Synthesis 1996, 1283-5. Соединения 16-2 могут быть подвергнуты гидролизу с получением соответствующих кислот и затем обработаны дифенилфосфоразидатом и триалкиламином в качестве основания для осуществления перегруппировки Курциуса, приводящей к хиральным оксазолидинонам 16-3. Оксазолидиноны 16-4 получают реакциями Сузуки или Стилле или их вариациями с использованием катализируемого палладием кросс-сочетания йодидов 16-3 с подходящим образом замещенными арил- или гетероарилбороновыми кислотами, сложными эфирами бороновых кислот или соединениями триалкилолова, как описано в публикации Miyaua et al., Chem. Rev. 95, 2457 (1995) и процитированных там ссылках и как описано в Smith, M.B. и March, J. March's Advanced Organic Chemistry,5th Ed., John WileySons, New York, p. 868-869 (2001) и процитированных там ссылках. Оксазолидиноны 16-4 могут быть подвергнуты алкилированию алкил-, гетероалкил-, арил- или гетероарилбромидами с использованием оснований, таких как гексаметилдисилазид натрия или гидрид натрия, в растворителях,таких как тетрагидрофуран, диметоксиэтан, диэтиловый эфир или т.п., с получением продуктов 16-5. Альтернативно, оксазолидиноны 16-3 алкилируют подходящими бромидами, получая соединения 16-6,которые подвергают реакции Сузуки или Стилле, или их вариациям с подходящим образом замещенными арил- или гетероарилбороновыми кислотами, сложными эфирами бороновых кислот или соединениями триалкилолова, получая продукты 16-5. Пример 1. 2-Амино-5-(трифторметил)бензонитрил В 2-литровую колбу загружали 100 г (0,348 моль) 4-амино-3-йодбензотрифторида, 40 г CuCN и 750 мл ДМФ. Смесь нагревали и затем выдерживали при кипении с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали и выливали в 3 л воды, содержащей 300 мл концентрированного гидроксида аммония. К смеси добавляли 1 л CH2Cl2. Смесь затем фильтровали через целит. Слои разделяли,и водный слой опять экстрагировали CH2Cl2. Органические экстракты объединяли, и растворитель удаляли при пониженном давлении. Остаток растворяли в 1,5 л простого эфира и полученный раствор промывали 1 н. гидроксидом аммония, водным раствором бисульфита натрия, 1 н. водным раствором HCl и насыщенным раствором соли. Раствор сушили над безводным MgSO4 и фильтровали через слой силикагеля, содержащего наверху слой MgSO4. Слой промывали 5 л простого эфира. Эфирные растворы объединяли и концентрировали до объема 750 мл и оставляли при комнатной температуре. Через 2 дня образовавшееся твердое вещество собирали, промывали гексаном и сушили при пониженном давлении, получая 2-амино-5-(трифторметил)бензонитрил.(150 мл) при 35C добавляли по каплям трет-бутилнитрит (21 мл). Реакционную смесь поддерживали при температуре 30-35C во время добавления. Реакционную смесь выдерживали в течение 30 мин и затем нагревали при 60C в течение 30 мин. Реакционную смесь охлаждали, разбавляли простым эфиром и промывали 2 водой, 2 водным раствором бисульфита натрия, водой и затем насыщенным раствором соли. Раствор сушили над безводным MgSO4, фильтровали через слой силикагеля и затем концентрировали, получая 100 г красного масла. Продукт очищали хроматографией на силикагеле, элюируя последовательно гексаном, смесью гексаны/CH2Cl2 в соотношении 3:1 и смесью гексаны/CH2Cl2 в соотношении 1:1, получая 2-йод-5-(трифторметил)бензонитрил. 1Na2CO3 (6,8 мл), этанол (9,6 мл) и воду (10 мл). Раствор дегазировали азотом в течение 2 мин. ДобавлялиPd(PPh3)4 (774 мг, 0,67 ммоль) и раствор опять дегазировали азотом в течение 2 мин. Раствор разделяли на две равные порции и загружали в две пробирки объемом 40 мл для микроволнового облучения. Каждую пробирку дегазировали азотом в течение 1 мин, герметично укупоривали и помещали в микроволновой реактор. Мощность устанавливали на 200 Вт до тех пор, пока температура не достигала 150C и затем температуру поддерживали равной 150C в течение 10 мин. Пробирки затем охлаждали до комнатной температуры, содержимое объединяли, выливали в H2O (50 мл) и экстрагировали EtOAc (100 мл). Органический слой промывали насыщенным раствором соли (50 мл), сушили над Na2SO4, фильтровали и концентрировали. Очистка флэш-хроматографией с использованием смеси 15% CH2Cl2/гексаны давала 5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-карбонитрил в виде светло-желтого масла. 5'-Изопропил-2'-метокси-4-(трифторметил)бифенил-2-карбонитрил (996,2 мг, 3,12 ммоль) растворяли в Et2O (33 мл) и охлаждали до 0C. LAH (12,49 мл 1 М раствора в Et2O, 12,49 ммоль) добавляли по каплям с помощью шприца. После перемешивания при 0C в течение 10 мин реакционную смесь нагревали до комнатной температуры и перемешивали при комнатной температуре в течение 6 ч. Реакцию затем гасили путем медленного добавления по каплям 1,5 мл H2O (интенсивное выделение газа),затем 1,5 мл 30% NaOH, затем 3,0 мл H2O. Полученный желатинообразный осадок промывали 520 млCH2Cl2; органические фазы сушили над Na2SO4, фильтровали и концентрировали. Очистка остатка с помощью флэш-хроматографии с использованием 2% MeOH/CH2Cl2, содержащего 0,1% Et3N, давала 1-[5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метанамин.(1,06 мл 2 М раствора в гексанах, 2,12 ммоль). Через 10 мин реакцию гасили несколькими каплями HOAc(добавлять до исчезновения желтого окрашивания). Реакционную смесь концентрировали и очищали флэш-хроматографией с использованием смеси от 10 до 80% EtOAc/гексаны, получая метил[3,5-бис(трифторметил)фенил](гидрокси)ацетат. 1(10 мл). Раствор охлаждали до 0C и добавляли CBr4 (659 мг, 1,986 ммоль) с последующим добавлениемPPh3 (521 мг, 1,986 ммоль). Через 1 ч реакционную смесь нагревали до комнатной температуры и перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь фильтровали через короткий слой силикагеля с использованием CH2Cl2. Фильтрат концентрировали и остаток очищали флэш-хроматографией с использованием 5% EtOAc/гексанах, получая метилC. Метил[3,5-бис-(трифторметил)фенил]([5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метиламино)ацетат. В колбу, содержащую метил[3,5-бис-(трифторметил)фенил](бром)ацетат (237,7 мг, 0,651 ммоль),добавляли 1-[5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метанамин (102,1 мг, 0,316 ммоль) в CH2Cl2 (4 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч и затем разбавляли EtOAc (50 мл). Органический раствор промывали водой и насыщенным раствором соли (по 15 мл каждого). Органический экстракт сушили над Na2SO4, фильтровали и концентрировали. Очистка остатка с помощью флэш-хроматографии (от 5 до 15% EtOAc/гексаны) давала метил[3,5-бис(трифторметил)фенил]([5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метиламино)ацетат.D. 2-[3,5-бис-(Трифторметил)фенил]-2-([5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метиламино)этанол. Раствор метил[3,5-бис-(трифторметил)фенил]([5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метиламино)ацетата (13,2 мг, 0,0217 ммоль) растворяли в Et2O (1,5 мл) и охлаждали до 0C. LAH (108,5 мкл 1 М раствора в LAH, 0,1085 ммоль) добавляли по каплям с помощью шприца. Реакционную смесь нагревали до комнатной температуры и перемешивали при комнатной температуре в течение 1 ч. Реакцию затем гасили, добавляя H2O (100 мкл), затем 1 н. NaOH (100 мкл), после чего H2O(300 мкл). Желатинообразный осадок промывали несколько раз CH2Cl2. Органические промывные воды фильтровали через слой силикагеля с использованием 2% MeOH/CH2Cl2 и фильтрат концентрировали. Очистка остатка с помощью препаративной тонкослойной хроматографии с использованием 25%(19 мкл, 0,107 ммоль). После перемешивания в течение 5 мин реакционную смесь выливали в воду (1 мл) и смесь экстрагировали EtOAc (20 мл). Органический экстракт промывали H2O, насыщенным растворомNaHCO3 и насыщенным раствором соли (по 5 мл каждого). Органический слой затем сушили надNa2SO4, фильтровали и концентрировали. Остаток очищали препаративной тонкослойной хроматографией, получая 4-[3,5-бис-(трифторметил)фенил]-3-[5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2 ил]метил-1,3-оксазолидин-2-он. Стадия A. 2-[3,5-бис-(Трифторметил)фенил]оксиран. В сухую колбу помещали NaH (1,09 г 60% NaH, 27,27 ммоль). Добавляли ДМСО (90 мл) с последующим добавлением йодида триметилсульфоксония (7,0 г, 31,82 ммоль). Реакционную смесь перемешивали в течение 5 мин и затем добавляли 3,5-бис-(трифторметил)бензальдегид (1,5 мл, 9,09 ммоль) в виде раствора в ДМСО (15 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем выливали в смесь лед/вода (300 мл). Смесь экстрагировали пентанами (3150 мл). Экстракты в пентанах объединяли и фильтровали через короткий слой силикагеля с использованием раствора 10%(300 мг,0,929 ммоль) и 2-[3,5-бис-(трифторметил)фенил]оксирана (297 мг, 1,161 ммоль) в 2-пропаноле (9 мл) нагревали при кипении с обратным холодильником в течение 15 ч и затем охлаждали до комнатной температуры. Раствор концентрировали, и очистка остатка с помощью флэш-хроматографии с использованием от 10 до 80% EtOAc/гексаны давала 1-[3,5-бис-(трифторметил)фенил]-2-([5'-изопропил-2'-метокси 4-(трифторметил)бифенил-2-ил]метиламино)этанол.(67 мкл, 0,386 ммоль), затем трифосген (8,2 мг, 0,0276 ммоль). Реакционную смесь перемешивали при 0C в течение 30 мин. Реакционную смесь затем выливали в насыщенный раствор NaHCO3 (15 мл) и смесь экстрагировали EtOAc (50 мл). Органический слой промывали насыщенным раствором солиH ЯМР (CD2Cl2, 500 МГц) (присутствие атропоизомеров в соотношении 1:1 приводило к удвоению некоторых пиков):7,90 (с, 1H), 7,77 (с, 2H), 7,57-7,62 (м, 2H), 7,37 (д, J=8,0 Гц, 1H), 7,27 (м, 1H), 6,98 (с,1H), 6,93 (дд, J=8,4, 3,2 Гц, 1H), 5,42-5,53 (м, 1H), 4,15-4,59 (м, 2H), 3,72 и 3,73 (2 с, 3H), 3,05-3,65 (м, 2H),2,88 (м, 1H), 1,19-1,23 (м, 6H). 2 энантиомера могут быть разделены с помощью хиральной ВЭЖХ с использованием 15%(300 мг,0,929 ммоль) и 2-оксиран-2-илпиридина (640 мг) [получен взаимодействием 2-пиридинкарбоксальдегида с NaH и йодидом триметилсульфоксония в ДМСО] в 2-пропаноле (9 мл) нагревали при кипении с обратным холодильником в течение 5 ч и затем охлаждали до комнатной температуры. Раствор концентрировали, и остаток очищали флэш-хроматографией с использованием смеси, содержащей от 50 до 100%EtOAc/гексаны, содержащей 0,5% Et3N, получая 2-([5'-изопропил-2'-метокси-4-(трифторметил)бифенил 2-ил]метиламино)-1-пиридин-2-илэтанол. Анализ методом ЖХ/МС показал, что целевой продукт загрязнен несколькими минорными примесями. Данное вещество использовали в следующей реакции без дополнительной очистки или анализа. Стадия B. Бензил(2-гидрокси-2-пиридин-2-илэтил)[5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метилкарбамат. Раствор (PhCH2OCO)2O (103 мг, 0,360 ммоль) в безводном CH2Cl2 (2 мл) добавляли с помощью канюли к перемешиваемому раствору 2-([5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2 ил]метиламино)-1-пиридин-2-илэтанола (160 мг, 0,360 ммоль) в безводном CH2Cl2 (10 мл) при комнатной температуре в атмосфере N2. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре и концентрировали в вакууме, получая неочищенный продукт. Его очищали с использованием флэш-хроматографии (Si, 25160 мм, градиент 0-50% EtOAc в гексанах), получая бензил(2-гидрокси-2 пиридин-2-илэтил)[5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метилкарбамат.Rf=0,63 (50% EtOAc/гексаны). ЖХ/МС: вычислено = 579,25; найдено = 579,2 (М+1)+. Стадия C. 3-[5'-Изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метил-5-пиридин-2-ил-1,3 оксазолидин-2-он. Раствор бис-(триметилсилил)амида калия (464 мкл 0,5 М раствора в толуоле, 0,232 ммоль) добавляли по каплям к перемешиваемому раствору бензил(2-гидрокси-2-пиридин-2-илэтил)[5'-изопропил-2'метокси-4-(трифторметил)бифенил-2-ил]метилкарбамата (134,3 мг, 0,232 ммоль) в безводном ТГФ(10 мл) при комнатной температуре в атмосфере N2. После перемешивания при комнатной температуре в течение 1 ч реакцию гасили насыщенным раствором NH4Cl (10 мл) и экстрагировали EtOAc (320 мл). Объединенные экстракты сушили (Na2SO4) и концентрировали в вакууме, получая неочищенный продукт. Его очищали с использованием флэш-хроматографии (Si, 25160 мм, градиент 0-70% EtOAc в гексанах), получая 3-[5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метил-5-пиридин-2-ил-1,3 оксазолидин-2-он.(300 Вт, 130C, 4 ч) в запаянной ампуле. Реакционную смесь концентрировали в вакууме для удаленияi-PrOH. Полученную водную суспензию разбавляли водой (50 мл) и экстрагировали EtOAc (50 мл). Органический экстракт сушили (Na2SO4) и концентрировали в вакууме, получая 5'-изопропил-2'-метокси-4(трифторметил)бифенил-2-карбоксамид. Водный слой подкисляли концентрированной HCl и экстрагировали EtOAc (350 мл). Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме, получая 5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-карбоновую кислоту в виде бесцветного твердого вещества. 1 Раствор борана в ТГФ (1 М, 859 мкл, 0,859 ммоль) добавляли по каплям к перемешиваемому раствору 5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-карбоновой кислоты и 5'-изопропил-2'метокси-4-(трифторметил)бифенил-2-карбоксамида (3:1, 96,8 мг, 0,286 ммоль) в безводном ТГФ при комнатной температуре в атмосфере N2. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч и осторожно гасили водой (10 мл). Смесь экстрагировали EtOAc (320 мл) и объединенные экстракты промывали насыщенным раствором соли, сушили (Na2SO4) и концентрировали в вакууме, получая неочищенный продукт. Его очищали с использованием флэш-хроматографии (Si, 125160 мм, градиент 0-30% EtOAc в гексанах), получая [5'-изопропил-2-метокси-4-(трифторметил)бифенил-2 ил]метанол в виде бесцветного масла.CBr4 (112 мг, 0,211 ммоль) и Ph3P (55 мг, 0,211 ммоль) добавляли последовательно к перемешиваемому раствору [5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метанола (57,1 мг, 0,176 ммоль) в безводном CH2Cl2 (1 мл) при 0C в атмосфере N2. Раствор перемешивали при комнатной температуре в течение 1 ч и реакционную смесь концентрировали в вакууме, получая неочищенный продукт. Его очищали с использованием флэш-хроматографии (Si, 12160 мм, градиент 0-20% EtOAc в гексанах), получая 2-(бромметил)-5'-изопропил-2'-метокси-4-(трифторметил)бифенил в виде бесцветного масла.(мас./об.) (8,54 мл, 2,84 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре, затем распределяли между водой (50 мл) и EtOAc (50 мл). Водный слой экстрагировали EtOAc(250 мл) и объединенные органические экстракты промывали насыщенным NaHCO3 (50 мл) и насыщенным раствором соли (50 мл), сушили (Na2SO4) и концентрировали в вакууме, получая 1-(4-метилфенил)-2-нитроэтанол в виде бесцветного масла. 1 Суспензию 10% Pd/C (24 мг) в растворе 1-(4-метилфенил)-2-нитроэтанола (50 мг, 0,276 ммоль) в абсолютном EtOH (1 мл) перемешивали в течение ночи при комнатной температуре под давлением 15 фт/кв.дюйм H2. Реакционную смесь фильтровали через слой целита и фильтрат концентрировали в вакууме, получая 2-амино-1-(4-метилфенил)этанол в виде масла. ЖХ/МС: вычислено = 152,10; найдено = 152 (М+1)+. 1 Диизопропилэтиламин (181 мг, 244 мкл, 1,40 ммоль) и трифосген (138 мг, 0,466 ммоль) добавляли последовательно к перемешиваемому раствору 2-амино-1-(4-метилфенил)этанола (35,2 мг, 0,233 ммоль) в безводном CH2Cl2 (22 мл) при 0C в атмосфере N2. Реакционную смесь перемешивали при 0C в течение 1 ч, затем концентрировали в вакууме до объема примерно 5 мл. Смесь разбавляли водой (50 мл) и экстрагировали EtOAc (350 мл). Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме, получая неочищенный продукт. Продукт очищали с использованием флэшхроматографии (Si, 12160 мм, градиент 0-80% EtOAc в гексанах), получая 5-(4-метилфенил)-1,3 оксазолидин-2-он.(1 мл) при комнатной температуре в атмосфере N2. Реакционную смесь перемешивали в течение 30 мин и добавляли с помощью канюли раствор 2-(бромметил)-5'-изопропил-2'-метокси-4-(трифторметил)бифенила (19,0 мг, 0,107 ммоль) в безводном ТГФ (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Реакцию гасили насыщенным раствором NH4Cl (10 мл) и экстрагировали EtOAc (320 мл). Объединенные органические экстракты промывали насыщенным раствором соли (10 мл), сушили (Na2SO4) и концентрировали в вакууме, получая неочищенный продукт. Его очищали с использованием флэш-хроматографии (Si, 12160 мм, градиент 0-80% EtOAc в гексанах), получая 3-[5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метил-5-(4-метилфенил)-1,3-оксазолидин 2-он в виде бесцветного масла.(мас./об.) (1,73 мл, 4,34 ммоль), перемешивали в течение 1 ч и обрабатывали 2% водной уксусной кислотой (мас./об.) (13,0 мл, 4,32 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре, затем распределяли между водой (50 мл) и EtOAc (50 мл). Водный слой экстрагировали EtOAc(250 мл) и объединенные органические экстракты промывали насыщенным NaHCO3 (50 мл) и насыщенным раствором соли (50 мл), сушили (Na2SO4) и концентрировали в вакууме, получая смесь трео- и эритро-1-[3,5-бис-(трифторметил)фенил]-2-нитропропан-1-ол в соотношении 1,5:1 в виде бесцветного масла. 1 Суспензию никеля Ренея (50 мг) в растворе смеси трео- и эритро-1-[3,5-бис-(трифторметил)фенил]2-нитропропан-1-ола в соотношении 1,5:1 (50 мг, 0,158 ммоль) в 30% (об./об.) водной HCO2H (0,75 мл) иMeOH (10 мл) перемешивали в течение ночи при комнатной температуре под давлением 15 фунт/кв.дюйм H2. Реакционную смесь фильтровали через слой целита и фильтрат концентрировали в вакууме для удаления MeOH. Водную суспензию доводили до pH 9-10 с использованием 28% водногоNH4OH, разбавляли водой (20 мл) и экстрагировали EtOAc (320 мл). Объединенные экстракты промывали насыщенным раствором соли (10 мл), сушили (Na2SO4) и концентрировали в вакууме, получая смесь трео- и эритро-2-амино-1-[3,5-бис-(трифторметил)фенил]пропан-1-ола в виде бесцветного твердого вещества. ЖХ/МС: вычислено = 288,08; найдено = 288,1 (М+1)+. 1(39,1 мг, 0,136 ммоль) в безводном CH2Cl2 (10 мл) при 0C в атмосфере N2. Реакционную смесь перемешивали при 0C в течение 1 ч, затем концентрировали в вакууме до объема примерно 5 мл. Смесь разбавляли водой (50 мл) и экстрагировали EtOAc (350 мл). Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме, получая неочищенный продукт. Его очищали с использованием флэш-хроматографии (Si, 12160 мм, градиент 0-70% EtOAc в гексанах), получая трео-5-[3,5-бис-(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он (17,5 мг) и эритро-5-[3,5-бис- 27011130(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он (14,4 мг) в виде бесцветных твердых веществ. Трео-диастереоизомер: Rf=0,63 (50% EtOAc/гексаны). ЖХ/МС: вычислено = 314,06; найдено = 314,1 (М+1)+. 1H ЯМР (CDCl3, 600 МГц):7,90 (ушир.с, 1H), 7,83 (ушир.с, 2H), 6,71 (ушир.с, 1H), 5,17 (д,J=7,0 Гц, 1H), 3,86 (ушир.п, J=6,2 Гц, 1H), 1,48 (д, J=6,2 Гц, 1H). Данное соединение разделяли на составляющие его энантиомеры (4R,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он и (4S,5S)-5-[3,5-бис-(трифторметил)фенил]-4 метил-1,3-оксазолидин-2-он с использованием хиральной ВЭЖХ (колонка AS, 20250 мм, 20% i-PrOH в гептане). Эритродиастереоизомер: Rf=0,38 (50% EtOAc/гексаны). ЖХ/МС: вычислено = 314,06; найдено = 314,1 (М+1)+. 1(ушир.с, 1H), 4,31 (ушир.п, J=7,0 Гц, 1H), 0,84 (д, J=6, 6 Гц, 1H). Данное соединение разделяли на составляющие его энантиомеры (4S,5R)-5-[3,5-бис(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он и (4R,5S)-5-[3,5-бис-(трифторметил)фенил]-4 метил-1,3-оксазолидин-2-он с использованием хиральной ВЭЖХ (колонка AS, 20250 мм, 15% i-PrOH в гептане). Хиральный синтез (4S,5R)-5-[3,5-бис-(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-она. Данное промежуточное соединение может быть непосредственно получено из хирального исходного вещества CBZ-L-аланина с использованием показанного далее 3-стадийного пути. Соединение(4R,5S)-5-[3,5-бис-(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-он может быть получен аналогичным путем, исходя из CBZ-D-аланина. Стадия 1(3,4 кг, 3 6,2 моль) и ТГФ (32 л) загружали в чистую колбу в атмосфере азота. Смесь охлаждали до 010C и затем медленно добавляли DIPEA (12,4 л) при температуре ниже 20C. Затем медленно добавлялиEDC-HCl (7 кг, 36,2 моль) при легком охлаждении до 15-25C. Суспензию оставляли на ночь при 2025C. Затем смесь охлаждали до 0-10C и медленно добавляли 3 н. HCl (13 л). Затем добавляли IPAC(45,5 л) и слои разделяли. Органический слой промывали один раз HCl (13 л) и дважды 8% NaHCO3(13 л). Органический слой затем концентрировали в вакууме до объема 20 л при 50C. Прозрачный раствор медленно охлаждали до комнатной температуры, давая возможность кристаллизации продукта. Затем медленно добавляли гептан (70 л). Суспензию фильтровали, промывали гептаном (18 л) и сушили при комнатной температуре на фильтровальном круге. Продукт получали с ee99,9%, измеренным с помощью хиральной ВЭЖХ. Стадия 2 Амид Вейнреба со стадии 1 (6 кг, 22,5 моль) и 3,5-бис-(трифторметил)бромбензол (4,85 л,28,1 моль) растворяли в безводном ТГФ (24 л). Раствор продували азотом для удаления перегнанного кислорода. Раствор охлаждали до -10C и медленно добавляли iso-PrMgCl в ТГФ (56,4 моль) (2 ч) к реакционной смеси с помощью капельной воронки, поддерживая реакционную температуру 5C. Раствор оставляли нагреваться до 20C и выдерживали в течение ночи при 20C. Реакционную смесь затем охлаждали до -10C в атмосфере азота и медленно гасили в течение 2 ч в 5 н. HCl (14 л), поддерживая температуру при 0-5C. Добавляли MTBE (60 л) и двухфазную смесь выдерживали в течение 5 мин. После нагревания до 20-25C смеси давали возможность прийти в норму в течение 30 мин и затем слои разделяли. Органический слой дважды промывали водой (12 л). Органический слой переносили в вакууме через 1-микронный PTFE фильтр в перегонную колбу и затем концентрировали в вакууме до 12 л (внутренняя температура 40C). Добавляли гептан и отгонку продолжали в вакууме при 40-55C до конечного объема 40 л. Раствор охлаждали до 35-37C, вносили затравку для кристаллизации (0,5%, 30 г) и затем выдерживали в течение 30 мин, давая возможность- 28011130 вырасти полному слою затравочных кристаллов. Суспензию охлаждали до 10C в течение 2-3 ч. Затем суспензию фильтровали, промывали охлажденным до 5C гептантом (18 л) и оставляли сушиться на фильтровальном круге с использованием непрерывного движения вакуум/азот в течение ночи. Высохшее твердое вещество получали с 99,9 ee %. Если оптическая чистота является недостаточной, амид может быть перекристаллизован из линейного гептана. Стадия 3 ТФУК (9 л) добавляли в 100-литровый реактор Буши в инертной атмосфере и охлаждали до -5C. Продукт кетона со стадии 2 (5,50 кг, 13,1 моль) добавляли в виде твердого вещества с последующим ополаскиванием с использованием ТФУК (2 л). Раствор охлаждали до -5C и перемешивали до тех пор,пока твердое вещество не растворялось. Медленно добавляли силан (2,18 кг, 15,7 моль) в течение 1 ч (в виде двух порций), поддерживая температуру при 0C. Реакционную смесь выдерживали при температуре от -2 до -6C в течение 15-20 ч, в данный момент времени по данным жидкостной хроматографии(ЖХ) оставалось 2% кетона. Получали 50% (вес./вес.) раствор KOH путем медленного добавления 13,6 кг шариков KOH (87 вес.%) к 10 л воды при поддержании высоко экзотермического растворения при температуре 30C. Раствор хранили в холодильнике. Реакционную смесь гасили 2 л 50% (вес./вес.) раствора KOH при интенсивном перемешивании и охлаждении при выдерживании температуры при 20C. Добавляли холодный ТГФ (16,5 л, предварительно хранился в холодильнике) с последующим медленным добавлением оставшегося раствора KOH(13,7 л) с последующим ополаскиванием 2 л воды при поддержании температуры 20C. После завершения добавления KOH реакционную смесь выдерживали при комнатной температуре. Реакцию гасили через 3 ч с использованием 27,5 л IPAC (изопропилацетат) и 20 л 20% (вес./об.) водный NaCl. Водный и органический слои отделяли. Органический слой промывали 26 л 20% (вес./об.), водныйNaCl, затем 36 л воды, затем 31 л 0,5 н. HCl и, наконец, 32 л воды. Органический слой концентрировали до 10 л. Добавляли гептан (20 л), что приводило к образованию кристаллов. Органический слой концентрировали до 10 л. Опять добавляли гептан (20 л) и органический слой концентрировали до 10 л. Добавляли гептан (22 л) и суспензию выдерживали при комнатной температуре. Твердое вещество отфильтровывали и промывали 24 л гептана. Получали твердый продукт (98,8% чистота, 99,95% ee по данным ЖХ). Твердое вещество затем повторно растворяли в 12,5 л MeOH (эндотермический процесс). При комнатной температуре добавляли 3 л воды и смесь выдерживали до начала кристаллизации. Добавляли воду (9,5 л) в течение 60 мин при комнатной температуре. После выдерживания в течение 60 мин суспензию фильтровали и твердое вещество промывали 5 л смеси MeOH/вода (1/1,5), 5 л смесиMeOH/вода (1/4) и затем 4 л воды. Твердый продукт сушили при 50C в вакууме (99,9% чистота по данным ЖХ, 99,95% ee). ВЭЖХ метод анализа, использованный на стадии 3. Колонка Ace-C8 250 4,6 мм. A: MeCN; B: 0,1% H3PO4 в H2O. Градиент: 5A: 95B при 0 мин до 95A:5B при 9 мин; выдерживание 95A:5B до 13 мин; возвращение к 5A:95B 13-15 мин. Условия: 35C, 1,5 мл/мин, 210 нм. Пример 18. Эритро-5-[3,5-бис-(трифторметил)фенил]-3-[5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метил-4-метил-1,3-оксазолидин-2-он бис-(Триметилсилил)амид натрия (172 мкл 1 М раствора в ТГФ, 0,172 ммоль) добавляли к перемешиваемому раствору эритро-5-[3,5-бис-(трифторметил)фенил]-4-метил-1,3-оксазолидин-2-она (50 мг,0,129 ммоль) в безводном ТГФ (1 мл) при комнатной температуре в атмосфере N2. Реакционную смесь перемешивали в течение 15 мин и добавляли через канюлю раствор 2-(бромметил)-5'-изопропил-2'метокси-4-(трифторметил)бифенила (27,0 мг, 0,0861 ммоль) в безводном ТГФ (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Реакцию гасили насыщенным растворомNH4Cl (10 мл) и экстрагировали EtOAc (320 мл). Объединенные органические экстракты промывали- 29011130 насыщенным раствором соли (10 мл), сушили (Na2SO4) и концентрировали в вакууме, получая неочищенный продукт. Его очищали с использованием флэш-хроматографии (Si, 12160 мм, градиент 0-40%H ЯМР (бензол-d6, 600 МГц, смесь атропоизомеров в соотношении 1:1)7,94 (с, 0,5H), 7,72 (с,0,5H), 7,64 (с, 0,5H), 7,63 (с, 0,5H), 7,39-7,34 (м, 3H), 7,12-7,04 (м, 2H), 6,95 (д, J=2,1 Гц, 0,5H), 6,86 (д,J=1,7 Гц, 0,5H), 6,64 (д, J=8,5 Гц, 0,5H), 6,56 (д, J=8,5 Гц, 0,5H), 4,99 (д, J=15,9 Гц, 0,5H), 4,93 (д,J=15,9 Гц, 0,5H), 4,73 (д, J=7,9 Гц, 0,5H), 4,61 (д, J=7,9 Гц, 0,5H), 3,88 (д, J=15,9 Гц, 0,5H), 3,82 (д,J=15,9 Гц, 0,5H), 3,35 (с, 1,5H), 3,24 (с, 1,5H), 3,05 (с, J=6,9 Гц, 0,5H), 3,01 (с, J=6,9 Гц, 0,5H), 2,75 (м, 1H),1,19 (дд, J=6,9, 2,7 Гц, 3H), 1,17 (дд, J=10,9, 6,9 Гц, 3H), -0,18 (д, J=6,4 Гц, 1,5H), -0,33 (т, J=6,4 Гц, 1,5H). Данное соединение разделяли на составляющие его энантиомеры (4R,5S)-5-[3,5-бис(трифторметил)фенил]-3-[5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метил-4-метил-1,3 оксазолидин-2-он и (4S,5R)-5-[3,5-бис-(трифторметил)фенил]-3-[5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метил-4-метил-1,3-оксазолидин-2-он с использованием хиральной ВЭЖХ (колонка Стадия A. трет-Бутил 2-[3,5-бис-(трифторметил)фенил]-2-гидроксиэтил[5'-изопропил-2'-метокси 4-(трифторметил)бифенил-2-ил]метилкарбамат. К раствору 1-[3,5-бис-(трифторметил)фенил]-2-([5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метиламино)этанола (пример 6, стадия B, 325,0 мг, 0,561 ммоль) в CH2Cl2 (15 мл) добавляли BOC2O (122 мг, 0,561 ммоль) и DIPEA (98 мкл, 0,561 ммоль). Реакционную смесь перемешивали при комнатной температуре. Через 5 ч дополнительно добавляли BOC2O (50 мг, 0,229 ммоль) и DIPEA(50 мкл, 0,287 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 48 ч. Реакционную смесь затем концентрировали до 2 мл, разбавляли гексаном (8 мл) и очищали флэшхроматографией с использованием от 10 до 20% EtOAc/гексаны, получая трет-бутил 2-[3,5-бис(трифторметил)фенил]-2-гидроксиэтил[5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2 ил]метилкарбамат.H ЯМР (CD2Cl2, 500 МГц):7,78 (с, 1H), 7,54-7,67 (м, 4H), 7,23-7,33 (м, 2H), 6,90-6,95 (м, 2H), 3,154,82 (м, 9H), 2,87 (м, 1H), 1,19-1,43 (м, 15H). Стадия B. 1-[3,5-бис-(Трифторметил)фенил]-2-трет-бутоксикарбонил)[5'-изопропил-2'-метокси-4(трифторметил)бифенил-2-ил]метиламино)этилметансульфонат. К раствору трет-бутил 2-[3,5-бис-(трифторметил)фенил]-2-гидроксиэтил[5'-изопропил-2'метокси-4-(трифторметил)бифенил-2-ил]метилкарбамата (350,1 мг, 0,516 ммоль) в CH2Cl2 (15 мл) добавляли DIPEA (450 мкл, 2,58 ммоль). Раствор охлаждали до 0C и добавляли MsCl (100 мкл,1,29 ммоль). После перемешивания в течение 45 мин при 0C реакционную смесь разбавляли EtOAc(100 мл) и промывали насыщенным раствором NaHCO3 (25 мл), насыщенным раствором соли (25 мл), 1 н.HCl (25 мл) и насыщенным раствором соли (225 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток пропускали через короткий слой силикагеля с использованием 25%EtOAc/гексаны и концентрировали. Продукт 1-[3,5-бис-(трифторметил)фенил]-2-трет-бутоксикарбонил)[5'-изопропил-2'-метокси-4-(трифторметил)бифенил-2-ил]метиламино)этилметансульфонат сразу же использовали в следующей реакции без дополнительного охарактеризовывания.Rf=0,33 (25% EtOAc/гексаны). Стадия C. трет-Бутил 2-азидо-2-[3,5-бис-(трифторметил)фенил]этил[5'-изопропил-2'-метокси-4(трифторметил)бифенил-2-ил]метилкарбамат. 1-[3,5-бис-(Трифторметил)фенил]-2-трет-бутоксикарбонил)[5'-изопропил-2'-метокси-4(трифторметил)бифенил-2-ил]метиламино)этилметансульфонат, полученный в предыдущей реакции,растворяли в DMPU (15 мл) и обрабатывали NaN3 (140 мг, 2,15 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 ч и затем разбавляли EtOAc (75 мл). Раствор промывали H2O
МПК / Метки
МПК: A61K 31/433, A61K 31/4015, C07D 207/26, C07D 233/24, C07D 263/22, C07D 285/10, C07D 413/06, A61K 31/4166, C07D 263/20, C07D 401/04, C07D 413/04
Метки: ингибиторы, сетр
Код ссылки
<a href="https://eas.patents.su/30-11130-ingibitory-setr.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы сетр</a>
Предыдущий патент: Способ получения высококачественного ароматического поликарбоната
Следующий патент: Скважинная расширяемая изоляция
Случайный патент: Способ металлообработки с применением смазки