Пирролзамещенные 2-индолиноны (варианты), фармацевтическая композиция (варианты), способ модулирования каталитической активности протеинкиназы, способ лечения или профилактики нарушения в организме, связанного с протеинкиназой
Формула / Реферат
1. Пирролзамещенный 2-индолинон, представленный общей формулой
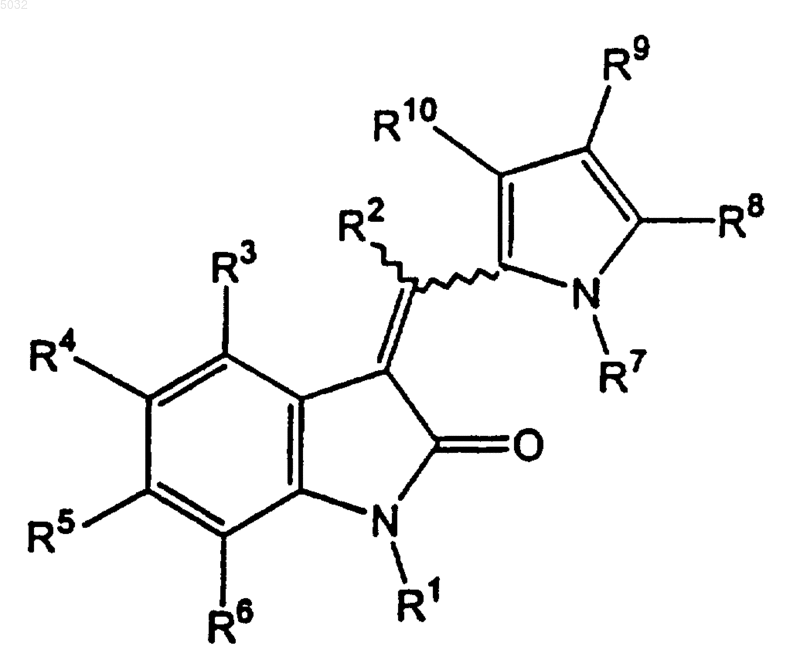
где R1, R2 и R7 означают водород;
R3, R4, R5 и R6 независимо выбраны из группы, включающей водород, гидрокси, галоген, незамещенный C1-C4алкил, C1-C4алкил, замещенный карбоновой кислотой, незамещенный C1-C4алкокси, группу карбоновой кислоты, незамещенный арил, арил, замещенный по меньшей мере одной группой незамещенного C1-C4алкилалкокси, и морфолино;
R8 означает незамещенный C1-C4алкил,
R9 означает -(CH2)(CH2)C(=O)OH и
R10 означает незамещенный C1-C4алкил.
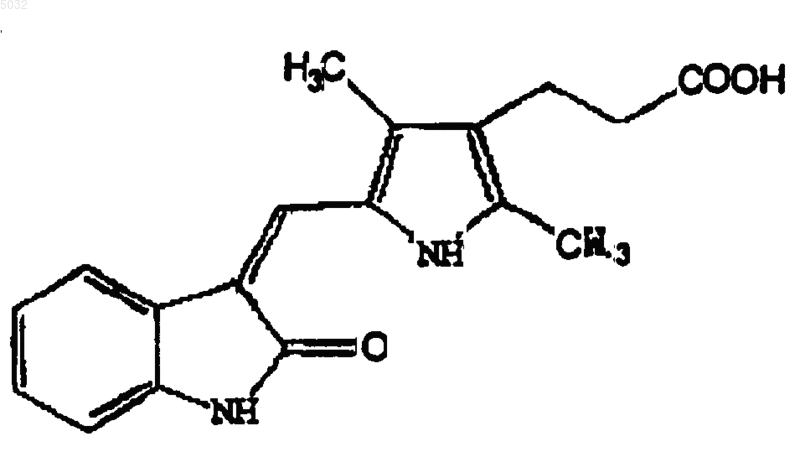
2. 3-[2,4-Диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1H-пиррол-3-ил]пропионовая кислота формулы
3. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по п.1, его соль или пролекарство и физиологически приемлемый носитель или наполнитель.
4. Способ модулирования каталитической активности протеинкиназы, отличающийся тем, что осуществляют контактирование упомянутой протеинкиназы с соединением по п.1, его солью или пролекарством.
5. Способ по п.4, отличающийся тем, что упомянутую протеинкиназу выбирают из группы, включающей рецепторную тирозинкиназу, нерецепторную тирозинкиназу и серинтреонинкиназу.
6. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по п.2, его соль или пролекарство и физиологически приемлемый носитель или наполнитель.
7. Способ лечения или профилактики нарушения в организме, связанного с протеинкиназой, отличающийся тем, что в организм вводят терапевтически эффективное количество соединения по п.1 или 2, их соли или пролекарства.
8. Способ по п.7, отличающийся тем, что в упомянутый организм вводят терапевтически эффективное количество 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1H-пиррол-3-ил]пропионовой кислоты.
9. Способ по п.7, отличающийся тем, что нарушение, связанное с упомянутой протеинкиназой, выбирают из группы, включающей нарушение, связанное с рецепторной тирозинкиназой, нарушение, связанное с нерецепторной тирозинкиназой, и нарушение, связанное с серинтреонинкиназой.
10. Способ по п.7, отличающийся тем, что нарушение, связанное с упомянутой протеинкиназой, выбирают из группы, включающей нарушение, связанное с EGFR, нарушение, связанное с PDGFR, нарушение, связанное с IGFG, и нарушение, связанное с flk.
11. Способ по п.7, отличающийся тем, что нарушением, связанным с упомянутой протеинкиназой, является онкологическое заболевание, которое выбирают из группы, включающей плоскоклеточный рак, астроцитому, саркому Капоши, глиобластому, рак легких, рак мочевого пузыря, рак головы и шеи, меланому, рак яичников, рак предстательной железы, рак молочной железы, мелкоклеточный рак легких, глиому, колоректальный рак, рак мочеполовой системы и рак желудочно-кишечного тракта.
12. Способ по п.7, отличающийся тем, что нарушение, связанное с упомянутой протеинкиназой, выбирают из группы, включающей диабет, аутоиммунное заболевание, гиперпролиферацию, рестеноз, фиброз, псориаз, остеоартрит, ревматоидный артрит, ангиогенез, воспалительный процесс, иммунологическое нарушение и сердечно-сосудистое нарушение.
13. Способ по п.7, отличающийся тем, что упомянутым организмом является млекопитающее.
14. Соединение, выбранное из группы, состоящей из
3-[5-(5-хлор-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-ил]пропионовой кислоты,
3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1H-пиррол-3-ил]пропионовой кислоты,
3-[5-(5-бром-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-ил]пропионовой кислоты,
3-[5-(5-иод-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-ил]пропионовой кислоты,
3-[2,4-диметил-5-(4-метил-2-оксо-1,2-дигидроиндол-3-илиденметил)-1H-пиррол-3-ил]пропионовой кислоты,
3-[2,4-диметил-5-(5-метил-2-оксо-1,2-дигидроиндол-3-илиденметил)-1H-пиррол-3-ил]пропионовой кислоты,
3-[5-(6-гидрокси-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-ил]пропионовой кислоты,
3-[5-(6-метокси-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-ил]пропионовой кислоты,
3-{5-[6-(3-метоксифенил)-2-оксо-1,2-дигидроиндол-3-илиденметил]-2,4-диметил-1H-пиррол-3-ил}пропионовой кислоты,
3-{5-[6-(3-этоксифенил)-2-оксо-1,2-дигидроиндол-3-илиденметил]-2,4-диметил-1H-пиррол-3-ил}пропионовой кислоты,
3-[2,4-диметил-5-(2-оксо-6-фенил-1,2-дигидроиндол-3-илиденметил)-1H-пиррол-3-ил]пропионовой кислоты,
3-{5-[6-(4-метоксифенил)-2-оксо-1,2-дигидроиндол-3-илиденметил]-2,4-диметил-1H-пиррол-3-ил}пропионовой кислоты,
3-{5-[6-(2-метоксифенил)-2-оксо-1,2-дигидроиндол-3-илиденметил]-2,4-диметил-1H-пиррол-3-ил}пропионовой кислоты,
3-[2,4-диметил-5-(6-морфолин-4-ил-2-оксо-1,2-дигидроиндол-3-илиденметил)-1H-пиррол-3-ил]пропионовой кислоты,
3-[5-хлор-4-метил-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-ил]пропионовой кислоты.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение в основном относится к органической химии, биохимии, фармакологии и медицине. Более конкретно, изобретение относится к новым соединениям пирролзамещенного 2-индолинона, их физиологически приемлемым солям и пролекарствам, которые модулируют активность протеинкиназ (ПК) и,следовательно, как ожидается, проявляют лечебное действие по отношению к отклонениям в организме, связанным с аномальной активностью ПК. Приоритет настоящей заявки испрашивается на основании предварительной заявки на выдачу патента США No 60/087310, поданной 29 мая 1998 г., и предварительной заявки на выдачу патента США No 60/116106, поданной 15 января 1999 г., обе заявки включены в описание в качестве ссылок. Уровень техники В данном разделе представлена информация только о предпосылках создания изобретения, причем данную информацию не следует рассматривать как предшествующий уровень техники настоящего изобретения. ПК являются ферментами, катализирующими фосфорилирование гидроксильных групп остатков тирозина, серина и треонина в белках. Такая простая на первый взгляд активность имеет глубокие последствия: рост, дифференциация и пролиферация клеток, то есть практически все аспекты функционирования клеток так или иначе зависят от активности ПК. Более того, аномальная активность ПК связана с широким спектром нарушений в организме от совместимых с жизнью заболеваний, таких как псориаз, до чрезвычайно опасных заболеваний,таких как глиобластома (рак мозга). Обычно ПК разделяют на два класса: тирозинкиназы (ТК) и серин-треонинкиназы (СТК). Одним из основных аспектов активности ТК является ее взаимосвязь с рецепторами ростовых факторов - белками, расположенными на поверхности клеток. При связывании с лигандом рецепторы ростового фактора превращаются в активную форму, которая взаимодействует с белками, расположенными с внутренней стороны клеточной мембраны. В результате происходит фосфорилирование остатков тирозина рецептора и других белков, а также образование внутри клеток комплексов с рядом цитоплазматических сигнальных молекул, которые в свою очередь воздействуют на множественный клеточный ответ, такой как деление клеток (пролиферация), дифференциация клеток, рост клеток,влияние результата метаболизма на внеклеточное микроокружение и т.п. Более подробная информация приведена в статье Schlessinger и 2 включая любые фигуры, как полностью изложено в данном описании. Рецепторы факторов роста, обладающие активностью ТК, известны как рецепторные ТК(РТК). К таким рецепторам относится многочисленное семейство трансмембранных рецепторов с разнообразной биологической активностью. В настоящее время идентифицировано по крайней мере девятнадцать (19) различных подсемейств РТК. Примером таких подсемейств является подсемейство, названное РТК "HER",включающее рецептор эпителиального фактора роста (EGFR), HER2, HER3 и HER4. Указанные РТК состоят из внеклеточного гликозилированного лиганд-связывающего домена, трансмембранного домена и внутриклеточного цитоплазматического каталитического домена, который может фосфорилировать остатки тирозина в белках. Другое подсемейство РТК включает рецептор инсулина (IR), рецептор инсулиноподобного фактора роста I (IGF-1R) и рецепторIGF-II с образованием гетеротетрамера, состоящего из двух полностью внеклеточных гликозилированных субъединици двух субъединиц ,которые пересекают клеточную мембрану и содержат домен ТК. К третьему подсемейству РТК относится группа рецепторов фактора роста тромбоцитов(PDGFR), которая включает PDGFR, PDGFR,CSFIR, c-kit и c-fms. Эти рецепторы состоят из гликозилированных внеклеточных доменов,содержащих вариабельное число иммуноглобулинподобных петель, и из внутриклеточного домена, в котором последовательность тирозинкиназного домена включает другие (неродственные) аминокислотные фрагменты. Другой группой, которую иногда из-за схожести с подклассом PDGFR относят к вышеупомянутому подклассу, является подсемейство рецепторных киназ из эмбриональной печени(рецепторные киназы flk). Предполагают, что упомянутая группа рецепторов состоитиз киназ,включающих киназный домен рецептора flk-1(KDR/FLK-1), flk-1R, flk-4 и fms-подобную тирозинкиназу-1 (flt-1). К другим членам семейства рецепторных ТК, являющихся рецепторами факторов роста,относится подгруппа рецепторов фактора роста фибробластов (FGF). Эта группа включает четыре рецептора, FGFR1-4, и семь лигандов,FGF1-7. Согласно предварительным данным рецепторы состоят из гликозилированных внеклеточных доменов, содержащих вариабельное число иммуноглобулинподобных петель, и из внутриклеточного домена, в котором последовательность тирозинкиназы прерывается фрагментами других неродственных аминокислот. 3 Еще одним членом семейства рецепторных ТК, являющихся рецепторами факторов роста,является подгруппа рецепторов фактора роста эндотелия сосудов (VEGR). По строению VEGF аналогичен димерному гликопротеину PDGF, но характеризуется другими биологическими функциями и специфичностью в отношении клеток-мишеней in vivo. В частности, в настоящее время считают, что VEGF играет существенную роль при васкулогенезе, а также при ангиогенезе. Более полная номенклатура известных подсемейств РТК представлена Plowman с соавт. в статье DNP, 7(6):334-339 (1994), которая включена в данное описание в качестве ссылки,включая любые фигуры. Кроме семейства РТК существует также семейство целиком и полностью внутриклеточных РТК, названных "нерецепторные ТК" или"клеточные ТК". Последнее название, сокращенно КТК, будет использовано в данном тексте описания. КТК не содержат внеклеточного и трансмембранного доменов. В настоящее время идентифицировано более 24 КТК, включающих 11 подсемейств (Src, Frk, Btk, Csk, Abl, Zap70, Fes,Fps, Fak, Jak и Ack). До настоящего времени подсемейство Src является самым многочисленным семейством КТК и включает Src, Yes, Fyn,Lyn, Lck, Blk, Hck, Fgr и Yrk. Более подробное описание КТК можно найти в статье Bolen, Oncogene, 8:2025-2031 (1993), которая включена в данное описание в качестве ссылки, включая любые фигуры. Серин-треонинкиназы, СТК, аналогично КТК являются преимущественно внутриклеточными, хотя известно несколько рецепторных киназ типа СТК. СТК является наиболее распространенной цитозольной киназой, то есть киназой, выполняющей функцию в данной части цитоплазмы, а не в цитоплазматических органеллах и цитоскелете. Цитозолем называется область внутри клетки, в которой происходит большая часть промежуточной метаболитической и биосинтетической активности, опосредованной клеткой, например, именно в цитозоле происходит синтез белков на рибосомах. Все РТК, КТК и СТК принимают участие в развитии многочисленных патологических процессов, включая, главным образом, рак. К другим патологическим состояниям, связанным с ТК, относятся, без ограничения перечисленным,псориаз, цирроз печени, диабет, ангиогенез,рестеноз, глазные заболевания, ревматоидный артрит и другие воспалительные процессы, иммунологические заболевания, такие как аутоиммунное заболевание, сердечно-сосудистые заболевания, такие как атеросклероз и ряд почечных нарушений. Что касается онкологических заболеваний,в настоящее время существуют две основные гипотезы, объясняющие взаимосвязь избыточ 005032 4 ной пролиферации клеток, которая приводит к развитию опухоли, с функциями, известными как регулируемые протеинкиназами. Так, например, предполагают, что рост злокачественных клеток является результатом нарушения механизмов, контролирующих процессы деления клеток и/или дифференциации. Показано,что белковые продукты ряда прото-онкогенов вовлечены в пути передачи сигналов, регулирующих рост и дифференциацию клеток. Указанные белковые продукты прото-онкогенов включают внеклеточные факторы роста, трансмембранные рецепторы факторов роста ТК(РТК), цитоплазматические ТК (КТК) и цитозольные СТК, описанные выше. С точки зрения очевидной взаимосвязи между регулируемой ПК клеточной активностью и широким спектром разнообразных нарушений у человека, нет ничего удивительного в том, что были предприняты многочисленные попытки найти способ модулирования активности ПК. К некоторым из них относятся подходы с использованием биомиметиков, то есть больших молекул, созданных по образцу молекул,вовлеченных в реальные клеточные процессы(например, мутантные лиганды (заявка на выдачу патента США No 4966849); растворимые рецепторы и антитела (заявка No WO 94/10202,статья Kendall и Thomas, Proc. Nat'l Acad. Sci.,90:10705-09 (1994), статья Kim с соавт. Nature,362:841-844 (1993; лиганды РНК (статьиWO 91/15495; WO 94/14808; патент США No 5330992; статья Mariani с соавт., Proc. Am. Assoc. Cancer Res 35:2268 (1994. Кроме вышеперечисленных исследований были предприняты попытки идентифицировать небольшие молекулы, действующие как ингибиторы ПК. Например, в качестве ингибиторов ТК описаны соединения бис-моноциклических,бициклических и гетероциклических арильных производных (заявка РСТ WO 92/20642), производные виниленазаиндола (заявка РСТ WO 94/14808) и соединения 1-циклопропил-4 пиридилхинолонов (патент США No 5330992). В качестве ингибиторов ТК, используемых при лечении опухолевых заболеваний, описаны соединения стирола (патент США No 5217999),стирилзамещенные пиридильные соединения(патент США No 5302606), производные хиназолина (заявка на выдачу европейского патентаNo 0566266 А 1), селениндолы и селениды (заявка РСТ WO 94/03427), трициклические полигидроксильные соединения (заявка РСТ WO 92/21660) и производные бензилфосфоновой кислоты (заявка РСТ WO 91/15495). Сущность изобретения Предпринятые авторами настоящего изобретения попытки идентифицировать небольшие органические молекулы, модулирующие активность ПК, и которые, следовательно, можно использовать для лечения и профилактики нарушений, включающих аномальную активность ПК, привели к открытию семейства новых соединений пирролзамещенных 2-индолинонов,обладающих способностью модулировать активность ПК и, следовательно, можно предположить, что такие соединения обладают лечебным действием в отношении нарушений, связанных с аномальной активностью ПК. Указанные соединения являются предметом настоящего изобретения. Таким образом, настоящее изобретение в основном относится к новым пирролзамещенным 2-индолинонам, которые модулируют активность РТК, КТК и СТК. Кроме того, настоящее изобретение относится к получению и использованию фармацевтических композиций описанных соединений, их физиологически приемлемых солей и пролекарств для лечения или профилактики вызванных ПК нарушений,таких как (представленных в качестве примера и без ограничения перечисленным) опухолевые заболевания, диабет, цирроз печени, сердечнососудистые заболевания, такие как атеросклероз, ангиогенез, иммунологические заболевания, такие как аутоиммунные заболевания, и заболевания почек. Использованные в данном описании взаимозаменяемые термины "2-индолинон", "индолин-2-он" и "2-оксиндол" означают молекулу формулы композиции заключается в облегчении введения соединения в организм. Термин "пролекарство" означает агент, который превращается в исходное лекарство invivo. Пролекарства часто используются, так как в некоторых случаях введение в виде пролекарства является более простым способом по сравнению с введением в виде исходного лекарства. Например, пролекарства могут быть биодоступными при оральном введении в отличии от исходного лекарства. Пролекарство в составе фармацевтической композиции может обладать более высокой растворимостью по сравнению с исходным лекарством. Примером пролекарства,без ограничения перечисленным, может быть соединение по настоящему изобретению, которое вводят в виде сложного эфира (пролекарства) с целью облегчения прохождения соединения через клеточную мембрану, где растворимость в воде оказывает отрицательное воздействие на подвижность, однако затем при прохождении внутрь клетки, где растворимость в воде является положительным свойством, соединение подвергается метаболитическому гидролизу с образованием карбоновой кислоты, то есть активного соединения. Другим примером пролекарства может быть короткий полипептид, например, без ограничения перечисленным, полипептид, состоящий из 2-10 аминокислотных остатков, присоединенный посредством концевой аминогруппы к соединению по настоящему изобретению,причем полипептид гидролизуется или происходит его метаболитическое превращение in"физиологически приемлемый носитель" означает носитель или разбавитель, который не вызывает значительного раздражения организма и не воздействует отрицательно на биологическую активность и свойства введенного соединения. Термин "наполнитель" означает инертное вещество, которое добавляют в фармацевтическую композицию для дальнейшего облегчения введения соединения. Примеры наполнителей,без ограничения перечисленным, включают карбонат кальция, фосфат кальция, различные типы сахаров и крахмалов, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли. 1. ХИМИЯ А. Общие структурные признаки Одним объектом настоящего изобретения являются пирролзамещенные 2-индолиноны, Взаимозаменяемые термины "пирролзамещенный 2-индолинон" и "3-пирролиденил-2 индолинон", использованные в данном описании, означают химическое соединение общей формулы 1. Термин "фармацевтическая композиция" означает смесь одного или более описанных в данном описании соединений, или его физиологически приемлемых солей, или его пролекарств с другими химическими компонентами, такими как физиологически приемлемые носители и наполнители. Назначение фармацевтической 7 которые, кроме того, что могут по выбору содержать заместители в обоих пиррольном и индолинольном остатках, должны содержать в качестве заместителей пиррольного остатка один или более углеводородных цепей, которые в свою очередь замещены по крайней мере одной полярной группой. Физиологически приемлемые соли и пролекарства заявленных соединений также включены в область настоящего изобретения. Термин "углеводородная цепь" означает алкильную, алкенильную или алкинильную группы, как определено в данном описании. Термин "полярная" группа означает группу, в которой ядра атомов ковалентно связаны друг с другом с образованием группы, в которой электронная плотность в области ковалентной связи (связей) распределена неравномерно, в результате электронная плотность вокруг одного атома более плотная по сравнению с другим атомом и таким образом атом с одной стороны данной ковалентной связи имеет относительный отрицательный заряд, а атом с другой стороны ковалентной связи имеет относительно положительный заряд; т.е. в молекуле образуются отрицательный и положительный полюса. Примеры полярных групп включают, без ограничения перечисленным, гидрокси, алкокси, карбокси,нитро, циано, амино, аммоний, амидо, уреидо,сульфонамидо, сульфинил, сульфонил, фосфоно, морфолино, пиперазинил и тетразоло. Не будучи связанными какой-либо определенной теорией, заявители в настоящее время полагают, что полярные группы могут взаимодействовать с аминокислотными остатками в активном центре ПТК посредством электронных взаимодействий, например (без ограничения перечисленным), с помощью водородных связей, Ван-дер-Ваальсовых сил и/или ионных связей (но не ковалентного связывания). Такие взаимодействия способствуют связыванию молекул по настоящему изобретению с активным центром достаточно прочно, чтобы препятствовать проникновению или предотвратить проникновение природного субстата в активный центр. Полярные группы могут также определять селективность действия данных соединений, т.е. одна полярная группа может иметь большее сродство к связывающему домену ПТК, чем другие полярные группы, и таким образом соединение, содержащее первую определенную полярную группу, будет более эффективным, чем соединения, содержащие другие полярные группы. Таким образом, одним объектом настоящего изобретения являются соединения со следующей химической структурой: где R1 выбирают из группы, включающей водород, алкил, алкенил, алкинил, циклоалкил, арил,гидрокси, алкокси, С-карбокси, О-карбокси,ацетил, С-амидо, С-тиоамидо, сульфонил и тригалогенметансульфонил,R2 выбирают из группы, включающей водород, галоген, алкил, циклоалкил, арил, гетероарил или гетероалициклическую группу,R3, R4, R5 и R6 независимо выбирают из группы, включающей водород, алкил, тригалогеналкил, циклоалкил, алкенил, алкинил, арил,гетероарил, гетероалициклическую группу, гидрокси, алкокси, арилокси, меркапто, алкилтио,арилтио, сульфинил, сульфонил, S-сульфонамидо, N-сульфонамидо, тригалогенметансульфонамидо, карбонил, С-карбокси, О-карбокси,С-амидо, N-амидо, циано, нитро, галоген, Окарбамил, N-карбамил, О-тиокарбамил, Nтиокарбамил, амино и -NR11R12,R11 и R12 независимо выбирают из группы,включающей водород, алкил, циклоалкил, арил,карбонил, ацетил, сульфонил, трифторметансульфонил и конденсированные пяти- или шестичленные гетероалициклические кольца,R3 и R4, R4 и R5 или R5 и R6 могут быть объединены с образованием шестичленного арильного кольца, метилендиокси группы или этилендиокси группы,R7 выбирают из группы, включающей водород, алкил, циклоалкил, алкенил, алкинил,арил, гетероарил, гетероалициклическую группу, гидрокси, алкокси, арилокси, карбонил, ацетил, С-амидо, С-тиоамидо, амидино, Скарбокси, О-карбокси, сульфонил и тригалогенметансульфонил,R8, R9 и R10 независимо выбирают из группы, включающей водород, алкил, тригалогеналкил, циклоалкил, алкенил, алкинил, арил, гетероарил, гетероалициклическую группу, гидрокси, алкокси, арилокси, меркапто, алкилтио,арилтио, сульфинил, сульфонил, S-сульфонамидо, N-сульфонамидо, карбонил, С-карбокси, О-карбокси, циано, нитро, галоген, Окарбамил, N-карбамил, О-тиокарбамил, Nтиокарбамил, С-амидо, N-амидо, амино и-NR11R12, при условии, что по крайней мере один из заместителей R8, R9 или R10 означают группу, представленную формулой -(alk1Z. 9 Термин "алкил", использованный в данном описании, означает насыщенный алифатический углеводород, включающий неразветвленные и разветвленные цепи. Предпочтительная алкильная группа содержит от 1 до 20 атомов углерода(где численный интервал, например, "1-20", использованный в данном контексте, означает, что группа, в данном случае алкильная группа, может содержать 1 атом углерода, 2 атома углерода, 3 атома углерода и т.д. до 20 атомов углерода включительно). Более предпочтительная алкильная группа имеет среднюю длину и содержит от 1 до 10 атомов углерода. Наиболее предпочтительная алкильная группа означает низший алкил, содержащий от 1 до 4 атомов углерода. Алкильная группа может быть замещенной или незамещенной. Если алкильная группа содержит заместители, то один или более заместителей предпочтительно выбирают индивидуально из группы, включающей циклоалкил,арил, гетероарил, гетероалициклическую группу, гидрокси, алкокси, арилокси, меркапто, алкилтио, арилтио, циано, галоген, карбонил, тиокарбонил, О-карбамил, N-карбамил, О-тиокарбамил, N-тиокарбамил, С-амидо, N-амидо, Скарбокси, О-карбокси, нитро, силил, амино и-NR11R12, где R11 и R12 определены выше. Термин "циклоалкил" означает моноциклические или сопряженные кольца, состоящие только из атомов углерода (т.е. кольца, которые содержат общую пару соседних атомов углерода), где одно или более колец не содержат полностью сопряженную -электронную систему. Примеры циклоалкильных групп, без ограничения перечисленным, включают циклопропан,циклобутан, циклопентан, циклопентен, циклогексан, адамантан, циклогексадиен, циклогептан и циклогептатриен. Циклоалкильная группа может быть замещенной или незамещенной. Если циклоалкильная группа содержит заместители, то один или более заместителей предпочтительно выбирают индивидуально из группы,включающей алкил, арил, гетероарил, гетероалициклическую группу, гидрокси, алкокси, арилокси, меркапто, алкилтио, арилтио, циано, галоген, карбонил, тиокарбонил, С-карбокси, Окарбокси, О-карбамил, N-карбамил, С-амидо, Nамидо, нитро, амино и -NR11R12, где R11 и R12 определены выше. Термин "алкенил" означает алкильную группу, как определено в данном описании, содержащую по крайней мере 2 атома углерода и по крайней мере одну углерод-углеродную двойную связь. Термин "алкинил" означает алкильную группу, как определено в данном описании, содержащую по крайней мере 2 атома углерода и по крайней мере одну углерод-углеродную тройную связь. Термин "арил" означает моноциклические или сопряженные полициклические кольца, состоящие только из атомов углерода (т.е. кольца, 005032 10 которые содержат общую пару соседних атомов углерода), содержащие полностью сопряженную -электронную систему. Примеры арильных групп, без ограничения перечисленным,включают фенил, нафталинил и антраценил. Арильная группа может быть замещенной или незамещенной. Если арильная группа содержит заместители, то в качестве заместителей предпочтительно выбирают один или более заместителей из группы, включающей галоген, тригалогенметил, алкил, гидрокси, алкокси, арилокси,меркапто, алкилтио, арилтио, циано, нитро, карбонил, тиокарбонил, С-карбокси, О-карбокси,О-карбамил, N-карбамил, О-тиокарбамил, Nтиокарбамил, С-амидо, N-амидо, сульфинил,сульфонил, амино и -NR11R12, где R11 и R12 определены выше. Термин "гетероарил" означает моноциклические или сопряженные кольца, (например,кольца, которые содержат общую пару соседних атомов углерода), содержащие в кольце(ах) один или более атомов, которые выбирают из группы, включающей азот, кислород и серу и,кроме того, содержащие полностью сопряженную -электронную систему. Примеры гетероарильных групп, без ограничения перечисленным, включают пиррол, фуран, тиофен, имидазол, оксазол, тиазол, пиразол, пиридин, пиримидин, хинолин, изохинолин, пурин и карбазол. Гетероарильная группа может быть замещенной или незамещенной. Если гетероарильная группа содержит заместители, то в качестве заместителей предпочтительно выбирают один или более заместителей из группы, включающей алкил,циклоалкил, галоген, тригалогенметил, гидрокси, алкокси, арилокси, меркапто, алкилтио,арилтио, циано, нитро, карбонил, тиокарбонил,сульфонамидо, С-карбокси, О-карбокси, сульфинил, сульфонил, О-карбамил, N-карбамил, Отиокарбамил, N-тиокарбамил, С-амидо, Nамидо, амино и -NR11R12, где R11 и R12 определены выше. Термин "гетероалициклическая группа" означает моноциклические или сопряженные кольца, содержащие в кольце(ах) один или более атомов, которые выбирают из группы,включающей азот, кислород и серу. Данные кольца могут также содержать одну или более двойных связей. Однако данные кольца не содержат полностью сопряженную -электронную систему. Гетероалициклическая группа может быть замещенной или незамещенной. Если гетероалициклическая группа содержит заместители, то в качестве заместителей предпочтительно выбирают один или более заместителей из группы, включающей алкил, циклоалкил,галоген, тригалогенметил, гидрокси, алкокси,арилокси, меркапто, алкилтио, арилтио, циано,нитро, карбонил, тиокарбонил, С-карбокси, Окарбокси, О-карбамил, N-карбамил, О-тиокарбамил, N-тиокарбамил, сульфинил, сульфо 11 нил, С-амидо, N-амидо, амино и -NR11R12, гдеR11 и R12 определены выше. Термин "гидрокси" означает -ОН группу. Термин "алкокси" означает -О-алкил и -Оциклоалкил, как определено в данном описании. Термин "арилокси" означает -О-арил и -Огетероарил, как определено в данном описании. Термин "меркапто" означает -SH группу. Термин "алкилтио" означает -S-алкил и -Sциклоалкил, как определено в данном описании. Термин "арилтио" означает -S-арил и -Sгетероарил, как определено в данном описании. Термин "карбонил" означает -C(=O)-R" группу, где R" выбирают из группы, включающей водород, алкил, циклоалкил, арил, гетероарил (соединенный через циклический атом углерода) и гетероалициклическую группу (соединенную через циклический атом углерода),как определено в данном описании. Термин "альдегид" означает карбонильную группу, в которой R" означает водород. Термин "тиокарбонил" означает -C(=S)-R" группу, в которой R" определен в данном описании. Термин "С-карбокси" означает -C(=O)O-R" группу, в которой R" определен в данном описании. Термин "О-карбокси" означает -OC(=O)R" группу, в которой R" определен в данном описании. Термин-C(=O)O-R" группу, в которой R" определен в данном описании, при условии, что R" не означает водород. Термин "ацетил" означает -С(=О)СН 3 группу. Термин "карбоновая кислота" означает Скарбокси группу, в которой R" означает водород. Термин "галоген" означает фтор, хлор,бром или иод. Термин "тригалогенметил" означает -СХ 3 группу, в которой X означает галоген, как определено в данном описании. Термин "тригалогенметансульфонил" означает X3CS(=O)2- группу, где Х определен выше. Термин "циано" означает -CN группу. Термин "сульфинил" означает -S(=O)-R" группу, где R", определенный выше, может также означать гидроксигруппу. Термин "сульфонил" означает -S(=O)2R" группу, где R", определенный выше, может также означать гидроксигруппу. Термин-ОСН 2 О- группу, где два атома кислорода присоединены к соседним атомам углерода. Термин-ОСН 2 СН 2 О- группу, где два атома кислорода присоединены к соседним атомам углерода.R12OC(=S)NR11- группу, в которой R11 и R12 определены выше. Термин "амино" означает -NR11R12 группу,в которой оба R11 и R12 означают водород. Термин "С-амидо" означает -C(=O)NR11R12 группу, в которой R11 и R12 определены выше. Термин "N-амидо" означает R12C(=O)NR11 группу, в которой R11 и R12 определены выше. Термин "аммоний" означает -+NHR11R12 группу, где R11 и R12 независимо выбирают из группы, включающей алкил, циклоалкил, арил и гетероарил. Термин-NR11C(=O)NR12R13 группу, где R11 и R12 опеределены в данном описании, и R13 имеет одинаковое значение с R11 и R12. Термин 13 Б. Предпочтительные структурные признаки Предпочтительным признаком настоящего изобретения является соединение, в котором R1 означает водород. Предпочтительным признаком настоящего изобретения также является соединение, в котором R2 означает водород. Предпочтительным признаком настоящего изобретения также является соединение, в котором R7 означает водород. Предпочтительным признаком настоящего изобретения также является соединение, в котором все три приведенные выше ограничения действительны в одной молекуле, т.е. в соединении по настоящему изобретению R1, R2 и R7 означают водород. Предпочтительным признаком настоящего изобретения также является соединение, в котором R3, R4, R5 и R6 выбирают из группы, включающей водород, незамещенный низший алкил,низший алкил, имеющий заместители, которые выбирают из группы, включающей гидрокси,галоген, С-карбокси, имеющий заместители,которые выбирают из группы, включающей водород и незамещенный низший алкил, амино или -NR11R12; незамещенный низший алкилалкокси, низший алкокси, замещенный одним или более галогенами, низший алкокси, имеющий заместители, включающие незамещенный арил или арил, имеющий один или более заместителей, которые независимо выбирают из группы,включающей незамещенный низший алкил,гидрокси, незамещенный низший алкилалкокси,галоген, амино, незамещенный низший алкил Sсульфонамидо или NR11R12, незамещенный арил или арил, имеющий один или более заместителей, которые независимо выбирают из группы,включающей незамещенный низший алкил, незамещенный низший алкилалкокси, низший алкокси, замещенный одним или более галогенами, низший алкокси, имеющий заместитель,который выбирают из группы, включающей незамещенный арил или арил, имеющий один или более заместителей, которые независимо выбирают из группы, включающей незамещенный низший алкил, гидрокси, незамещенный низший алкилалкокси, галоген, амино, незамещенный низший алкил S-сульфонамидо илиNR11R12, гидрокси, амино, незамещенный низший алкилсульфонамидо, С-карбокси, имеющий заместители, которые выбирают из группы,включающей водород или незамещенный низший алкил, морфолино, -NR11R12, тригалогенметил, арил, арил, имеющий один или более заместителей, которые независимо выбирают из группы, включающей гидрокси, галоген, тригалогенметил, амино, -NR11R12, сульфонамидо, Скарбокси, имеющий заместитель, который выбирают из группы, включающей водород или незамещенный низший алкил, незамещенный низший алкил или низший алкил, имеющий за 005032 14 меститель, который выбирают из группы, включающей гидрокси, галоген, С-карбокси, имеющий заместитель, который выбирают из группы,включающей водород или незамещенный низший алкил, амино или -NR11R12, незамещенную гетероалициклическую группу, гетероалициклическую группу, имеющую один или более заместителей, которые независимо выбирают из группы, включающей галоген, гидрокси, незамещенный низший алкил, незамещенный низший алкилкарбонил, гидрокси, незамещенный низший алкилалкокси или алкокси, замещенный одним или более галогенами, незамещенный арилокси, арилокси, имеющий один или более заместителей, которые независимо выбирают из группы, включающей незамещенный низший алкил, тригалогенметил, галоген, гидрокси,амино или -NR11R12, меркапто, незамещенный низший алкилалкилтио, незамещенный арилтио,арилтио, имеющий один или более заместителей, которые выбирают из группы, включающей галоген, гидрокси, амино или -NR11R12, Скарбокси, имеющий заместитель, который выбирают из группы, включающей водород и незамещенный низший алкил, незамещенный низший алкил О-карбокси, незамещенный низший алкил S-сульфонамидо, нитро, незамещенный низший алкил С-амидо, незамещенный низший алкил N-амидо, амино и -NR11R12. В других предпочтительных вариантах воплощения настоящего изобретения R3, R4, R5 иR6 независимо выбирают из группы, включающей водород, галоген, незамещенный низший алкил, низший алкил, имеющий один или более заместителей, которые выбирают из группы,включающей гидрокси, галоген, С-карбокси,имеющий заместитель, который выбирают из группы, включающей водород или незамещенный низший алкил, амино или -NR11R12, незамещенный низший алкилалкокси, низший алкилалкокси, замещенный одним или более галогенами, незамещенный арилокси, арилокси,имеющий один или более заместителей, которые независимо выбирают из группы, включающей незамещенный низший алкил, низший алкил, замещенный одним или более галогеном,гидрокси, незамещенный низший алкилалкокси,галоген, амино или -NR11R12, S-сульфонамидо,где R11 и R12 независимо выбирают из группы,включающей водород и незамещенный низший алкил, незамещенный арил, арил, имеющий один или более заместителей, которые независимо выбирают из группы, включающей галоген, незамещенный низший алкил, низший алкил, замещенный одним или более галогеном,незамещенный низший алкилалкокси, амино или -NR11R12, незамещенный гетероарил, гетероарил, имеющий один или более заместителей,которые независимо выбирают из группы,включающей незамещенный низший алкил,низший алкил, замещенный одним или более галогеном, незамещенный низший алкилалкок 15 си, гидрокси, галоген, амино или -NR11R12, незамещенную гетероалициклическую группу,гетероалициклическую группу, имеющую один или более заместителей, которые независимо выбирают из группы, включающей галоген,гидрокси, незамещенный низший алкил, низший алкил, замещенный одним или более галогеном,незамещенный низший алкилалкокси, амино или -NR11R12, незамещенный низший алкил Окарбокси, С-амидо, где R11 и R12 независимо выбирают из группы, включающей водород,незамещенный низший алкил и незамещенный арил, и N-амидо, где R11 и R12 независимо выбирают из группы, включающей водород, незамещенный низший алкил и незамещенный арил. Предпочтительными признаками настоящего изобретения также являются соединения, в которых один из заместителей R8, R9 и R10 означает -(alk1)Z, в то время, как два оставшихся заместителя независимо выбирают из группы,включающей водород, гидрокси, незамещенный низший алкил, незамещенный низший алкенил,незамещенный низший алкинил, незамещенный низший алкилалкокси, низший алкокси, замещенный одним или более галогенами, незамещенный арилалкокси, амино, -NR11R12, галоген,С-карбокси, имеющий заместители, которые выбирают из группы, включающей водород или незамещенный низший алкил, незамещенный низший алкил О-карбокси, незамещенный низший алкил С-амидо, незамещенный низший алкил N-амидо, ацетил, незамещенный низший алкил S-сульфонамидо, незамещенный арил или арил, имеющий заместитель, который выбирают из группы, включающей галоген, гидрокси, незамещенный низший алкилалкокси, алкокси,замещенный одним или более галогеном, Скарбокси, имеющий заместитель, который выбирают из группы, включающей водород или незамещенный низший алкил, незамещенный низший алкил O-карбокси, амино, незамещенный низший алкил S-сульфонамидо и -NR11R12. Предпочтительными признаками настоящего изобретения также являются соединения, в которых R8 и R10 выбирают из группы, включающей водород и незамещенный низший алкил. Предпочтительным признаком настоящего изобретения также является соединение, в котором alk1 означает незамещенный низший алкил. Другим предпочтительным признаком настоящего изобретения также являются соединения, в которых Z выбирают из группы, включающей гидрокси, амино, -NR11R12, четвертичный аммоний, С-карбокси, имеющий заместитель, который выбирают из группы, включающей водород или незамещенный низший алкил,С-амидо, имеющий заместители, которые выбирают из группы, включающей водород и незамещенный низший алкил, морфолино, пиперидинил, тетразоло и фосфонил. 16 Другим предпочтительным признаком настоящего изобретения также являются соединения, в которых alk1 означает незамещенный низший (С 2-С 4)алкил и Z означает карбоновую кислоту. Предпочтительным признаком настоящего изобретения также является соединение, в котором R9 означает alk1Z. Предпочтительным признаком настоящего изобретения также является соединение, в котором R11 и R12 независимо выбирают из группы,включающей водород, незамещенный низший алкил, гидрокси, незамещенный низший алкилалкокси, незамещенный низший алкилкарбонил,незамещенный низший алкил О-карбокси и ацетил. В другом предпочтительном варианте настоящего изобретения R1, R2, R3, R4, R5, R6 и R7 означают водород, R8 и R10 означают метил и R9 означает -СН 2 СН 2 С(=О)ОН. В другом предпочтительном варианте настоящего изобретения R1, R2, R3, R4, R5, R6, R7 иR8 означают водород, R10 означает метил и R9 означает -СН 2 СН 2 С(=О)ОН. В еще одном предпочтительном варианте настоящего изобретения R7 выбирают из группы, включающей водород, незамещенный низший алкил и низший алкил, имеющий заместитель, который выбирают из группы, включающей незамещенный циклоалкил, незамещенный арил и арил, имеющий заместитель, который выбирают из группы, включающей гидрокси,незамещенный низший алкилалкокси и галоген. В предпочтительном варианте настоящего изобретения Z выбирают из группы, включающей -C(=O)NR13R14, где R13 и R14 независимо выбирают из группы, включающей водород,незамещенный низший алкил, низший алкил,имеющий заместитель, который выбирают из группы, включающей амино и -NR11R12, незамещенный арил, арил, имеющий один или более заместителей, которые выбирают из группы,включающей галоген, гидрокси, незамещенный низший алкилалкокси и тригалогенметил, незамещенный гетероарил, незамещенную гетероалициклическую группу и конденсированную пяти- или шестичленную незамещенную гетероалициклическую группу и -NR11R12, где R11 иR12 независимо выбирают из группы, включающей незамещенный низший алкил и конденсированный пяти- или шестичленный незамещенный гетероалициклический цикл. В еще одном предпочтительном варианте воплощения настоящего изобретения R7 выбирают из группы, включающей незамещенный низший алкил, низший алкил, имеющий один или более заместителей, которые выбирают из группы, включающей незамещенный циклоалкил, незамещенный арил, арил, имеющий один или более заместителей, которые независимо выбирают из группы, включающей галоген и незамещенный низший алкилалкокси и незаме 17 щенный низший алкилкарбоксиалкил, и Z выбирают из группы, включающей незамещенный С-карбокси и незамещенный низший алкил Скарбокси. Наконец, в предпочтительном варианте настоящего изобретения R3, R4, R5 и R6 независимо выбирают из группы, включающей водород,галоген, незамещенный низший алкил, низший алкил, замещенный одной или более гидрокси группами, незамещенный низший алкокси, незамещенный арил, арил, замещенный одной или более незамещенными низшими алкокси группами и -S(O)2NR11R12, R5 означает водород, R6 означает -NR11R12, a R11 и R12 независимо выбирают из группы, включающей водород, незамещенный низший алкил и конденсированный пяти- или шестичленный незамещенный гетероалициклический цикл. Описанные в данном описании соединения могут существовать в виде таутомеров или изомеров. Например, описанные соединения могут существовать в Е или Z конфигурациях относительно двойной связи между остатком 2 индолинона и остатком пиррола, или они могут быть получены в виде смеси изомеров Е и Z. В объем притязаний настоящего изобретения включены любые таутомерные или структурные изомерные формы и их смеси, которые моделируют активность РТК, КТК и/или СТК, причем объем притязаний изобретения не ограничен до какой-либо одной таутомерной или структурной изомерной формы. 2. СИНТЕЗ/КОМБИНАТОРНЫЕ БИБЛИОТЕКИ Дополнительным аспектом настоящего изобретения является комбинаторная библиотека, включающая по крайней мере десять производных 3-пирролидинил-2-индолинона, которые могут быть получены по реакции оксиндолов формулы 2 с альдегидами формулы 3. где R1-R10 определены выше. Термин "комбинаторная библиотека", использованный в данном описании, означает все соединения, полученные при взаимодействии каждого соединения из множества одного измерения с соединением из каждого множества другого измерения, которые находятся в многомерной совокупности множеств соединений. В контексте настоящего изобретения множество является двумерным и одно измерение означает все оксиндолы по настоящему изобретению, а второе измерение означает все альдегиды по настоящему изобретению. Каждый оксиндол может взаимодействовать с каждым и любым 18 альдегидом с образованием производного 3 пирролидинил-2-индолинона. Все производные 3-пирролидинил-2-индолинона, которые получают указанным способом, включены в объем притязаний настоящего изобретения. В объем притязаний настоящего изобретения включены также меньшие комбинаторные библиотеки соединений, которые получены по реакции некоторых оксиндолов со всеми альдегидами, всех оксиндолов с некоторыми альдегидами, или некоторых оксиндолов с некоторыми альдегидами. Оксиндол из упомянутой выше комбинаторной библиотеки предпочтительно выбирают из группы, включающей оксиндол и замещенные оксиндолы, такие как, без ограничения перечисленным, 6-бромоксиндол, 5-гидроксиоксиндол, 5-метоксиоксиндол, 6-метоксиоксиндол,5-фениламиносульфонилоксиндол, 4-[2-(2-изопропилфенокси)этил]оксиндол, 4-[2-(3-изопропилфенокси)этил]оксиндол, 4-[2-(4-изопропилфенокси)этил]оксиндол, 5-фтороксиндол, 6 фтороксиндол, 7-фтороксиндол, 6-трифторметилоксиндол, 5-хлороксиндол, 6-хлороксиндол,индол-4-карбоновая кислота, 5-бромоксиндол,6-(N-ацетамидо)оксиндол, 4-метилоксиндол, 5 метилоксиндол, 4-метил-5-хлороксиндол, 5 этилоксиндол, 6-гидроксиоксиндол, 5-ацетилоксиндол, оксиндол-5-карбоновая кислота, 5-метоксиоксиндол, 6-метоксиоксиндол, 5-аминооксиндол, 6-аминооксиндол, 4-(2-N-морфолиноэтил)оксиндол, 7-азаоксиндол, трет-бутиловый эфир оксиндол-4-карбаминовой кислоты, третбутиловый эфир оксиндол-6-карбаминовой кислоты, 4-(2-карбоксиэтил)оксиндол, 4-н-бутилоксиндол, 4,5-диметоксиоксиндол, 6-(метансульфонамидо)оксиндол, 6-(бензамидо)оксиндол, 5-этоксиоксиндол, 6-фенилоксиндол, 6-(2 метоксифен-1-ил)оксиндол, 6-(3-метоксифен-1 ил)оксиндол, 6-(4-метоксифен-1-ил)оксиндол, 5 аминосульфонилоксиндол, 5-изопропиламиносульфонилоксиндол, диметиламиносульфонилоксиндол, 5-(N-морфолиносульфонил)оксиндол и 4-(2-гидроксиэтил)оксиндол. Альдегид из вышеупомянутой комбинаторной библиотеки предпочтительно выбирают из группы, включающей, без ограничения перечисленным, 3-(5-формил-2,4-диметил-1 Н-пиррол-3-ил)пропионовую кислоту, 3-(5-формил-4 метил-1 Н-пиррол-3-ил)пропионовую кислоту, 3(1-бензил-5-формил-2,4-диметил-1 Н-пиррол-3 ил)пропионовую кислоту, 3-(5-формил-1-метоксикарбонилметил-2,4-диметил-1 Н-пиррол-3-ил) пропионовую кислоту, 3-(5-формил-1,2,4-триметил-1 Н-пиррол-3-ил)пропионовую кислоту,метиловый эфир 3-[5-формил-1-(3-метоксибензил)-2,4-диметил-1 Н-пиррол-3-ил]пропионовой кислоты, метиловый эфир 3-(1-циклогексилметил-5-формил-2,4-диметил-1 Н-пиррол 3-ил)пропионовой кислоты, метиловый эфир 3[1-(2,2-диметилпропил)-5-формил-2,4-диметил 1 Н-пиррол-3-ил]пропионовой кислоты, 1,3,5 19 триметил-4-(3-морфолин-4-ил-3-оксопропил)1 Н-пиррол-2-карбальдегид, 3-(5-формил-1,2,4 триметил-1 Н-пиррол-3-ил)-N-(2-морфолин-4 илэтил)пропионамид, 3-(5-формил-1,2,4-триметил-1 Н-пиррол-3-ил)-N-фенилпропионамид,1,3,5-триметил-4-(3-оксо-3-пиперидин-1-илпропил)-1 Н-пиррол-2-карбальдегид,1,3,5-триметил-4-(3-оксо-3-пирролидин-1-ил-пропил)-1 Нпиррол-2-карбальдегид, 3-(5-формил-1,2,4-триметил-1 Н-пиррол-3-ил)-N-(4-метоксифенил) пропионамид,N-(4-фторфенил)-3-(5-формил 1,2,4-триметил-1 Н-пиррол-3-ил)пропионамид,3-(5-формил-1,2,4-триметил-1 Н-пиррол-3-ил)-N(4-трифторметилфенил)пропионамид, 3-[5-формил-1-(3-метоксибензил)-2,4-диметил-1 Н-пиррол-3-ил]пропионовую кислоту, 3-(1-циклогексилметил-5-формил-2,4-диметил-1 Н-пиррол 3-ил)пропионовую кислоту, метиловый эфир 3[1-(3-фторбензил)-5-формил-2,4-диметил-1 Нпиррол-3-ил]пропионовой кислоты, 3-(1-бензил 5-формил-2,4-диметил-1 Н-пиррол-3-ил)пропионовую кислоту, метиловый эфир 3-[1-(4-фторбензил)-5-формил-2,4-диметил-1 Н-пиррол-3-ил] пропионовой кислоты, 3-[1-(4-фторбензил)-5 формил-2,4-диметил-1 Н-пиррол-3-ил]пропионовую кислоту, 3-[1-(3-фторбензил)-5-формил 2,4-диметил-1 Н-пиррол-3-ил]пропионовую кислоту,3,5-диметил-4-(3-морфолин-4-илпропил)-1 Н-пиррол-2-карбальдегид, 4-(3-диметиламинопропил)-3,5-диметил-1 Н-пиррол-2-карбальдегид, 5-формил-2,4-диметил-1 Н-пиррол-3 карбоновую кислоту, 3,5-диметил-4-(4-метилпиперазин-1-карбонил)-1 Н-пиррол-2-карбальдегид и (2-диметиламиноэтил)амид 5-формил-2,4 диметил-1 Н-пиррол-3-карбоновой кислоты. Другим аспектом воплощения настоящего изобретения является способ синтеза 3-пирролидинил-2-индолинона формулы 1, включающий реакцию оксиндола формулы 2 с альдегидом формулы 3 в растворителе, предпочтительно в присутствии основания. Примерами оксиндолов формулы 2, которые могут взаимодействовать с альдегидом формулы 3 с образованием 3-пирролидинил-2 индолинонов формулы 1, являются оксиндол и замещенные оксиндолы, такие как, без ограничения перечисленным, 6-бромоксиндол, 5-гидроксиоксиндол, 5-метоксиоксиндол, 6-метоксиоксиндол, 5-фениламиносульфонилоксиндол, 4[2-(2-изопропилфенокси)этил]оксиндол, 4-[2-(3 изопропилфенокси)этил]оксиндол,4-[2-(4-изопропилфенокси)этил]оксиндол,5-фтороксиндол, 6-фтороксиндол, 7-фтороксиндол, 6-трифторметилоксиндол, 5-хлороксиндол, 6-хлороксиндол, индол-4-карбоновая кислота, 5-бромоксиндол, 6-(N-ацетамидо)оксиндол, 4-метилоксиндол, 5-метилоксиндол, 4-метил-5-хлороксиндол, 5-этилоксиндол, 6-гидроксиоксиндол, 5 ацетилоксиндол, оксиндол-5-карбоновая кислота, 5-метоксиоксиндол, 6-метоксиоксиндол, 5 аминооксиндол, 6-аминооксиндол, 4-(2-N-морфолиноэтил)оксиндол, 7-азаоксиндол, трет 005032 20 бутиловый эфир оксиндол-4-карбаминовой кислоты, трет-бутиловый эфир оксиндол-6-карбаминовой кислоты, 4-(2-карбоксиэтил)оксиндол, 4-н-бутилоксиндол, 4,5-диметоксиоксиндол, 6-(метансульфонамидо)оксиндол, 6-(бензамидо)оксиндол, 5-этоксиоксиндол, 6-фенилоксиндол, 6-(2-метоксифен-1-ил)оксиндол, 6-(3 метоксифен-1-ил)оксиндол,6-(4-метоксифен-1 ил)оксиндол, 5-аминосульфонилоксиндол, 5 изопропиламиносульфонилоксиндол, диметиламиносульфонилоксиндол,5-(N-морфолиносульфонил)оксиндол и 4-(2-гидроксиэтил) оксиндол. Примерами альдегидов структуры 3, которые могут взаимодействовать с оксиндолами структуры 2, являются, без ограничения перечисленным, 3-(5-формил-2,4-диметил-1 Н-пиррол-3-ил)пропионовая кислота, 3-(5-формил-4 метил-1 Н-пиррол-3-ил)пропионовая кислота, 3(1-бензил-5-формил-2,4-диметил-1 Н-пиррол-3 ил)пропионовая кислота, 3-(5-формил-1-метоксикарбонилметил-2,4-диметил-1 Н-пиррол-3 ил)пропионовая кислота, 3-(5-формил-1,2,4 триметил-1 Н-пиррол-3-ил)пропионовая кислота,метиловый эфир 3-[5-формил-1-(3 метоксибензил)-2,4-диметил-1 Н-пиррол-3-ил] пропионовой кислоты, метиловый эфир 3-(1 циклогексилметил-5-формил-2,4-диметил-1 Нпиррол-3-ил)пропионовой кислоты, метиловый эфир 3-[1-(2,2-диметилпропил)-5-формил-2,4 диметил-1 Н-пиррол-3-ил]пропионовой кислоты,1,3,5-триметил-4-(3-морфолин-4-ил-3-оксопропил)-1 Н-пиррол-2-карбальдегид, 3-(5-формил 1,2,4-триметил-1 Н-пиррол-3-ил)-N-(2-морфолин-4-илэтил)пропионамид, 3-(5-формил-1,2,4 триметил-1 Н-пиррол-3-ил)-N-фенилпропионамид, 1,3,5-триметил-4-(3-оксо-3-пиперидин-1 илпропил)-1 Н-пиррол-2-карбальдегид,1,3,5 триметил-4-(3-оксо-3-пирролидин-1-илпропил)1 Н-пиррол-2-карбальдегид, 3-(5-формил-1,2,4 триметил-1 Н-пиррол-3-ил)-N-(4-метоксифенил) пропионамид,N-(4-фторфенил)-3-(5-формил 1,2,4-триметил-1 Н-пиррол-3-ил)пропионамид,3-(5-формил-1,2,4-триметил-1 Н-пиррол-3-ил)-N(4-трифторметилфенил)пропионамид, 3-[5-формил-1-(3-метоксибензил)-2,4-диметил-1 Н-пиррол-3-ил]пропионовая кислота, 3-(1-циклогексилметил-5-формил-2,4-диметил-1 Н-пиррол 3-ил)пропионовая кислота, метиловый эфир 3[1-(3-фторбензил)-5-формил-2,4-диметил-1 Нпиррол-3-ил]пропионовой кислоты, 3-(1-бензил 5-формил-2,4-диметил-1 Н-пиррол-3-ил)пропионовая кислота, метиловый эфир 3-[1-(4-фторбензил)-5-формил-2,4-диметил-1 Н-пиррол-3-ил] пропионовой кислоты, 3-[1-(4-фторбензил)-5 формил-2,4-диметил-1 Н-пиррол-3-ил]пропионовая кислота, 3-[1-(3-фторбензил)-5-формил-2,4 диметил-1 Н-пиррол-3-ил]пропионовая кислота,3,5-диметил-4-(3-морфолин-4-илпропил)-1 Нпиррол-2-карбальдегид, 4-(3-диметиламинопропил)-3,5-диметил-1 Н-пиррол-2-карбальдегид, 5 формил-2,4-диметил-1 Н-пиррол-3-карбоновая 21 кислота, 3,5-диметил-4-(4-метилпиперазин-1-карбонил)-1 Н-пиррол-2-карбальдегид и (2-диметиламиоэтил)амид 5-формил-2,4-диметил-1 Н-пиррол-3-карбоновой кислоты. Реакцию можно проводить в присутствии основания. Основание может быть органическим или неорганическим. Предпочтительными органическими основаниями являются азотистые основания. Примеры органических азотистых оснований включают, без ограничения перечисленным, диизопропиламин, триметиламин, триэтиламин, анилин, пиридин, 1,8 диазабицикло[5.4.1]ундек-7-ен, пирролидин и пиперидин. Примерами неорганических оснований являются, без ограничения перечисленным, гидроксиды, фосфаты, карбонаты, бикарбонаты,бисульфаты и амиды аммония, щелочных и щелочно-земельных металлов. Щелочные металлы включают литий, натрий и калий, а щелочноземельные металлы включают кальций, магний и барий. Если растворителем является протонный растворитель, такой как вода или спирт, в предпочтительном варианте воплощения настоящего изобретения основанием является неорганическое основание щелочного или щелочноземельного металла, предпочтительно гидроксид щелочного или щелочно-земельного металла. На основании общеизвестных принципов органического синтеза и приведенных в данном контексте описаний специалистам в данной области техники будет представляться очевидным выбор наиболее подходящего основания для данной реакции. Растворитель, в котором проводят реакцию, может быть протонным или апротонным растворителем, предпочтительно протонным растворителем. Термин "протонный растворитель" означает растворитель, содержащий атом(ы) водорода, ковалентно связанные с атомами кислорода или азота, при этом атомы водорода являются достаточно кислотными и способными, таким образом, образовывать водородные связи с растворенным веществом. Примеры апротонных растворителей включают, без ограничения перечисленным,воду и спирты. Апротонный растворитель может быть полярным или неполярным, но в любом случае не содержит кислотных атомов водорода и, следовательно, не способен образовывать водородные связи с растворенными веществами. Примерами неполярных апротонных растворителей, без ограничения перечисленным, являются пентан,гексан, бензол, толуол, хлористый метилен и четыреххлористый углерод. Примерами полярных апротонных растворителей являются хлороформ, тетрагидрофуран, диметилсульфоксид и диметилформамид. 22 В предпочтительном варианте воплощения изобретения используют протонный растворитель, предпочтительно воду или спирт, такой как этанол. Реакцию проводят при температуре выше комнатной температуры. В основном, температурный дипазон составляет от приблизительно 30 до приблизительно 150 С, предпочтительно от приблизительно 80 до приблизительно 100 С,наиболее предпочтительно от приблизительно 75 до приблизительно 85 С, что приблизительно равно температуре кипения этанола. Термин"приблизительно" означает, что температурный диапазон предпочтительно составляет 10 градусов Цельсия от указанной величины, более предпочтительно 5 градусов Цельсия, наиболее предпочтительно 2 градуса Цельсия. Таким образом, например, "приблизительно 75 С" означает 7510 С, предпочтительно 755 С и наиболее предпочтительно 752 С. 3. БИОХИМИЯ/ФАРМАКОТЕРАПИЯ Другим объектом настоящего изобретения является способ модуляции каталитической активности ПК путем контактирования ПК с соединением по настоящему изобретению или его физиологически приемлемой солью или пролекарством. Используемый в данном тексте термин"ПК" означает рецепторную тирозиновую протеинкиназу (РТК), нерецепторную или "клеточную" тирозинкиназу(КТК) и серинтреонинкиназу (СТК). Термин "способ" означает способ, средство, методы и методики, используемые для достижения поставленной цели, включающие, без ограничения перечисленным, такие способы,средства, методы и методики, которые либо известны специалистами в области химии, фармацевтики, биологии, биохимии и медицины, либо легко могут быть созданы на основе известных способов, средств, методов и методик. Используемый в данном тексте термин"модуляция" или "модулирование" означает изменение каталитической активности РТК,КТК и СТК. Прежде всего модулирование означает активирование каталитической активности РТК, КТК и СТК, предпочтительно активирование или ингибирование каталитической активности РТК, КТК и СТК, в зависимости от концентрации соединения или соли, воздействию которой подвергаются РТК, КТК и СТК, более предпочтительно ингибирование каталитической активности РТК, КТК и СТК. Используемый в данном тексте термин"каталитическая активность" означает скорость фосфорилирования тирозина при прямом или опосредованном действии РТК и/или КТК или фосфорилирования серина и треонина при прямом или опосредованном действии СТК. Используемый в данном тексте термин"контактирование" означает осуществление взаимодействия соединения по изобретению с 23 ПК таким образом, чтобы соединение могло воздействовать на каталитическую активность ПК непосредственно, т.е. взаимодействуя с самой киназой, или опосредованно, т.е. взаимодействуя с другой молекулой, от которой зависит каталитическая активность киназы. Такое"контактирование" можно проводить "in vitro",т.е. в пробирке, в чашке Петри и т.п. Контактирование в пробирке может включать только соединение и исследуемую ПК или целые клетки. Клетки можно культивировать или выращивать в чашках для культивирования клеток (планшетах) и вводить в контакт с соединением, присутствующем в среде. В связи с этим способность конкретного соединения воздействовать на патологическое состояние, связанное с ПК (т.е. величину его IС 50, которая будет определена ниже), можно определить до проведения исследований in vivo на более сложных живых организмах. Для испытания на клетках вне организма известно множество способов осуществления контактирования ПК с соединениями, хорошо известных специалистам в данной области техники, включая, без ограничения перечисленным, микроинъекцию непосредственно в клетку и множество способов с использованием трансмембранных переносчиков. Кроме того, другой аспект настоящего изобретения заключается в том, что модуляцию каталитической активности ПК соединениями по настоящему изобретению можно проводитьin vitro и in vivo. Термин "in vitro" означает методики, проводимые в искусственной среде, такие как, без ограничения перечисленным, эксперименты в пробирке или в культуральной среде. Используемый в данном тексте термин "invivo" означает методики, выполняемые на живом организме, таком как, без ограничения перечисленным, мышь, крыса или кролик. Другой аспект настоящего изобретения состоит в том, что ПК, каталитическая активность которой модулируется соединением по изобретению, выбирают из группы, включающей РТК,КТК и СТК. Другой аспект данного изобретения заключается в том, что рецептор ПК, каталитическая активность которой модулируется соединением по изобретению, выбирают из группы,включающей EGF, HER2, HER3, HER4, IR, IGF1R, IRR, PDGFR, PDGFR, CSFIR, C-Kit, Cfms, Flk-1R, Flk4, KDR/Flk-1, Flt-1, FGFR-1R,FGFR-2R, FGFR-3R и FGFR-4R. В дополнение к этому, следующий аспект настоящего изобретения заключается в том, что клеточную тирозинкиназу, каталитическая активность которой модулируется соединением по изобретению, выбирают из группы, включающей Src, Frk, Btk, Csk, Abl, Zap70, Fes, Fps, Fak,Jak, Ack, Yes, Fyn, Lyn, Lck, Blk, Hck, Fgr и Yrk. Другой аспект настоящего изобретения состоит в том, что серин-треонинпротеинкиназу, 005032 24 каталитическая активность которой модулируется соединением по изобретению, выбирают из группы, включающей CDK2 и Raf. Следующим объектом настоящего изобретения является фармацевтическая композиция,содержащая соединение по настоящему изобретению и фармацевтически приемлемый носитель. Такая фармацевтическая композиция может также содержать наполнители. Еще одним объектом настоящего изобретения является способ лечения или профилактики заболеваний, связанных с ПК, включающий введение в организм терапевтически эффективного количества соединения, соли или пролекарства, которое представляет собой 3 пирролиденил-2-индолинон по настоящему изобретению. Используемые в данном тексте термины"нарушение, связанное с ПК", "нарушение, вызванное ПК" и "аномальная активность ПК" означают состояние организма, для которого характерна необычная, т.е. низкая или в основном,более высокая, каталитическая активность ПК,причем конкретная ПК может быть РТК, КТК или СТК. Необычная каталитическая активность может быть обусловлена следующими причинами: (1) экспрессией ПК клеткой, которая в норме не экспрессирует ПК, (2) повышенной экспрессией ПК, ведущей к нежелательной клеточной пролиферации, дифференциации и/или росту, (3) снижением экспрессии ПК, ведущей к нежелательному снижению клеточной пролиферации, дифференциации и/или росту. Гиперактивность ПК означает или амплификацию гена,кодирующего конкретную ПК, или продуцирование ПК с уровнем активности, который коррелирует с клеточной пролиферацией, дифференциацией и/или нарушением роста (т.е. с увеличением уровня ПК возрастает степень проявления (серьезность) одного или нескольких симптомов нарушения функционирования клетки). Гипоактивность дает обратный эффект, когда проявление одного или нескольких симптомов нарушения функционирования клетки возрастает по мере понижения активности ПК. Используемые в данном тексте термины"предупреждать" и "профилактика" означают,прежде всего, способ защиты организма от возникновения нарушения, связанного с ПК, в начальной стадии этого нарушения. Используемые в данном тексте термины"лечить" и "лечение" означают, прежде всего,способ облегчения симптомов или устранение вызванных ПК нарушений функционирования клеток и/или сопутствующих симптомов. В отношении опухолевых заболеваний этот термин означает, что способ позволяет продлить предполагаемую продолжительность жизни человека, пораженного раком, или несколько смягчить один или несколько симптомов болезни. Термин "организм" означает любое живое существо, включая по крайней мере одну клет 25 ку. Живой организм может быть простым, например, таким как одна эукариотическая клетка,или сложным, таким как организм млекопитающего, включая человека. Используемый в данном тексте термин"терапевтически эффективное количество" означает количество введенного в организм соединения, которое в некоторой степени ослабляет один или несколько симптомов заболевания, подлежащего лечению. В отношении лечения опухолей, терапевтически эффективное количество означает количество соединения, которое приводит к следующим результатам: (1) уменьшает размер опухоли, (2) подавляет (т.е. в некоторой степени замедляет, предпочтительно останавливает) метастазирование, (3) подавляет(т.е. в некторой степени замедляет, предпочтительно останавливает) рост опухоли, (4) в некоторой степени ослабляет (или предпочтительно устраняет) один или несколько симптомов, связанных с опухолью. Аспект настоящего изобретения заключается в том, что вышеупомянутое нарушение,связанное с ПК, выбирают из группы, включающей нарушение, связанное с рецептором протеинтирозинкиназы, нарушение, связанное с клеточной тирозинкиназой, и нарушение, связанное с серин-треонинкиназой. Еще один аспект настоящего изобретения заключается в том, что вышеупомянутое нарушение, связанное с ПК, выбирают из группы,включающей нарушение, связанное с EGFR,нарушение, связанное PDGFR, и нарушение,связанное с IGFR и flk. Другой аспект настоящего изобретения заключается в том, что вышеупомянутое нарушение, связанное с протеинкиназой, является онкологическим заболеванием, которое выбирают из группы, включающей плоскоклеточную карциному, саркомы, такие как саркома Капоши,астроцитому, глиобластому, рак легкого, рак мочевого пузыря, рак прямой кишки, рак желудочно-кишечного тракта, рак головы и шеи, меланому, рак яичника, рак предстательной железы, рак молочной железы, мелкоклеточный рак легких и глиому. Еще один аспект настоящего изобретения заключается в том, что вышеупомянутое нарушение, связанное с протеинкиназой, выбирают из группы, включающей сахарный диабет, гиперпролиферацию, болезнь Гиппеля-Линдау(цереброретинальный ангиоматоз), рестеноз,фиброз, псориаз, остеоартрит, ревматоидный артрит, воспалительные процессы и ангиогенез. Другими нарушениями, которые могут подлежать лечению или профилактике с помощью соединений по настоящему изобретению,являются иммунологические заболевания, такие как аутоиммунные (СПИД) и сердечнососудистые заболевания, такие как атеросклероз. 26 Аспект настоящего изобретения заключается в том, что химическое соединение, модулирующее каталитическую активность ПК, можно идентифицировать путем контактирования клеток, экспрессирующих упомянутую ПК, с соединением, солью или пролекарством, которое представляет собой 3-пирролиденил-2-индолинон, и путем последующего мониторинга его воздействия на упомянутые клетки. Термин "мониторинг" означает наблюдение или обнаружение результата контактирования соединения с клеткой, экспрессирующей конкретную ПК. Наблюдаемый или обнаруженный эффект может представлять собой изменение клеточного фенотипа, каталитической активности ПК или изменение взаимодействия ПК с природным связывающимся партнером (лигандом). Способы наблюдения или обнаружения таких явлений хорошо известны специалистам. Последний аспект настоящего изобретения заключается в том, что вышепомянутый эффект выбирают из следующих результатов: изменение или отсутствие изменений клеточного фенотипа, изменение или отсуствие изменений каталитической активности упомянутой ПК или изменение или отсутствие изменений во взаимодействии вышеупомянутой ПК с природным связывающимся партнером."Клеточный фенотип" означает внешние признаки клетки или ткани или биологические функции клетки или ткани. Примеры клеточного фенотипа включают, без ограничения перечисленным, размер клетки, клеточный рост,клеточную пролиферацию, дифференциацию клеток, выживание клеток, апоптоз, поглощение и использование питательных веществ. Такие характеристики фенотипа могут быть определены по методикам, известным в данной области техники."Природный связывающийся партнер" (лиганд) означает полипептид, который связывается с конкретной ПК в клетке. Природные лиганды могут выполнять (определенную) функцию в процессе передачи сигнала, опосредованном ПК. Изменение взаимодействия природного лиганда с ПК может проявляться непосредственно, как увеличение или уменьшение концентрации комплекса ПК/природный лиганд и как наблюдаемое изменение способности ПК опосредовать передачу сигнала. Кроме того, аспект настоящего изобретения заключается в том, что описанное соединение или его соль или пролекарство может быть использовано совместно с другими химиотерапевтическими агентами для лечения вышеупомянутых заболеваний и нарушений. Например,соединение, соль или пролекарство по настоящему изобретению могут быть использованы в сочетании с алкилирующими агентами, таким как фторурацил (5-ФУ), одним или в сочетании с лейковорином; или с другими алкилирующими агентами, такими как, без ограничения пере 27 численным, другие пиримидиновые аналоги,например УФТ, капецитабин, гемцитабин и цитарабин; алкилсульфонатами, например бусульфаном (применяющимся при лечении хронического гранулоцитарного лейкоза), импросульфаном и пипосульфаном; азиридинами, такими как бензодепа, карбоквон, метуредепа и уредепа; этилениминами и метилмеламинами,такими как алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; (азотистыми) горчичными маслами, такими как, хлорамбуцил (применяющийся при лечении хронического лимфолейкоза, первичной макроглобулинемии и неХоджкинской лимфомы), циклофосфамид (применяющийся при лечении болезни Ходжкина,множественной миеломы, нейробластомы, рака молочной железы, рака яичника, рака легких,аденосаркомы почки (опухоли Вильмса) и рабдомиосаркомы), эстрамустин, ифосфамид, новембрихин, преднимустин и урациловое горчичное масло (применяющееся при лечении первичного тромбоцитоза, не-Ходжкинской лимфомы, болезни Ходжкина и рака яичника); триазинами, такими как, дакарбазин (применяющийся при лечении саркомы мягких тканей). Аналогичным образом, можно ожидать,что соединение, соль или пролекарство по изобретению будет проявлять лечебное действие в сочетании с другими химиотерапевтическими агентами, являющимися антиметаболитами,такими как, без ограничения перечисленным,аналоги фолиевой кислоты, например метотрексат (применяющийся при лечении острого лимфолейкоза,хориокарциномы,микозногрибкового рака молочной железы, рака головы и шеи и остеогенной саркомы) и птероптерин; аналоги пурина, такие как меркаптопурин и тиогуанин, которые находят применение при лечении острого гранулоцитарного лейкоза,острого лимфолейкоза и хронического гранулоцитарного лейкоза. Можно также ожидать, что соединение,соль или пролекарство по изобретению будет эффективным в сочетании с химиотерапевтическими агентами на основе природных продуктов, таких как, без ограничения перечисленным,алкалоиды барвинка розового, например, винбластин (применяющийся при лечении рака молочной железы и рака яичка), винкристин и виндезин; эпиподофилотоксины, например этопозид и тенипозид, каждый из которых применяется при лечении рака яичка и саркомы Капоши; химиотерапевтические антибиотики, например даунорубицин, доксорубицин, эпирубицин, митомицин (применяющийся при лечении рака желудка, шейки матки, толстой кишки,молочной железы, мочевого пузыря и поджелудочной железы), дактиномицин, темозоломид,пликамицин, блеомицин (применяющийся при лечении рака кожи, пищевода и мочеполового 28 тракта), и ферментативные химиотерапевтические агенты, такие как L-аспарагиназа. Кроме того, можно ожидать, что соединение, соль или пролекарство по изобретению будут проявлять лечебное действие в сочетании с координационными комплексами платины(цисплатин и др.); замещенными производными мочевины, такими как гидроксимочевина; производными метилгидразина, например прокарбазином; адренокортикоидными супрессантами,например митотаном, аминоглютетимидом; гормонами и антагонистами гормонов, такими как адренокортикостероиды (например, преднизолон), прогестины (например, гидроксипрогестерон/капроат); эстрогенами (например, диэтилстилбестеролом); антиэстрогенами, таким как, тамоксифен; андрогенами, например тестостерон пропионатом; и ингибиторами ароматазы, такими как, анастрозол. Наконец, можно ожидать, что соединение по изобретению окажется особенно эффективным в сочетании с митоксантроном или паклитакселом при лечении солидных злокачественных опухолей или лейкозов, таких как, без ограничения перечисленным, острый миелоидный лейкоз (нелимфоцитарный). Предпочтительным соединением по настоящему изобретению, которое, как ожидается,будет проявлять лечебное действие в сочетании с одним или несколькими вышеуказанными химиотерапевтическими агентами, является 3-[2,4 диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1 Н-пиррол-3-ил]пропионовая кислота. Перечень фигур чертежей На фиг. 1 представлен результат исследования ингибирующей активности соединений по изобретению in vivo. На фиг. 2 продемонстрирована биологическая эффективность соединений по изобретению in vivo при введении оральным способом. Сведения, подтверждающие возможность осуществления изобретения 1. Краткое описание таблиц В табл. 1 приведена структура и биологическая активность некоторых типичных соединений по настоящему изобретению. Номера соединений соответствуют номерам примеров,представленных в разделе "Примеры", т.е. синтез соединения 1 в табл. 1 описан в примере 1. Биоиспытания подробно описаны ниже. Результаты представлены в виде IC50, концентрации исследуемого соединения в микромолях (мкМ),которая вызывает 50%-ное изменение активности соответствующей ТК по сравнению с активностью ТК в контроле, не содержащем анализируемого соединения. Более конкретно, полученные результаты представлены в виде концентрации исследуемого соединения, необходимой для 50%-ного подавления активности соответствующей ТК. Соединения, приведенные в табл. 1, даны только в качестве примеров и не могут рассматриваться, как ограничивающие объем притязаний настоящего изобретения. Таблица 1 отношении отношении отношении отношении отношении отношении отношении отношенииBrdU-EGFr, IC50 (мМ) В табл. 2 приведены структуры ряда других соединений по настоящему изобретению. Как и в табл. 1, номера соединений соответствуют номерам соответствующих примеров. Представленное выше общее описание биологических исследований относится также к результатам биологических испытаний, представленных в табл. 2. 2. Показания/заболевания-мишени ПК, каталитическая активность которых модулируется соединениями по настоящему изобретению, включают протеиновые тирозинкиназы (ТК) двух типов, а именно рецепторные тирозинкиназы (РТК) и клеточные тирозинкиназы (КТК) и серин-треонинкиназы (СТК). Перенос сигнала, опосредованный РТК, инициируется путем внеклеточного взаимодействия клетки со специфическим ростовым фактором (лигандом) с последующей димеризацией рецептора,временной стимуляцией активного центра ТК на внутренней стороне мембраны и фосфорилированием. Благодаря этому участки связывания становятся доступными для соединений, локализованных в цитоплазме и принимающих участие во внутриклеточной передаче сигнала, что способствует образованию комплексов с целым спектром цитоплазматических сигнальных молекул, которые содействуют формированию соответствующего клеточного ответа (например, деления клетки, метаболическим изменениям во внеклеточной микросреде и т.п.). См. статью Schlessinger и Ullrich, Neuron, 9: 303-391(1992). Установлено, что участки фосфорилирования тирозина у рецепторов ростовых факторов обладают высокой специфичностью связыванияSH2 домена (гомологичного src) сигнальных молекул. См. статьи Fantl с соавт., Cell, 69: 413423 (1992), Songyang с соавт., Mol. Cell. Biol.,14: 2777-2785 (1994), Songyang с соавт., Cell, 72: 767-778 (1993), Koch с соавт., Science, 252: 668678 (1991). Идентифицировано несколько внутриклеточных белков, являющихся субстратами РТК. Эти белки подразделяются на две основные группы: (1) субстраты, содержащие каталитический домен, (2) субстраты, лишенные каталитического домена, но выполняющие функции посредника и ассоциированные с каталитически активными молекулами (субъединицами). См. статью Songyang с соавт., Cell, 72: 767-778 33 рецепторами и SH2 доменами, содержащимися в соответствующих субстратах, определяется аминокислотными остатками, соседними с остатком тирозина, подлежащего фосфорилированию. Различие в сродстве связывания SH2 доменов и аминокислотными последовательностями в конкретных рецепторах, включающими остаток фосфотирозина, коррелирует с наблюдаемыми различиями в профилях фосфорилирования. См. статью Songyang с соавт., Cell, 72: 767-778 (1993). Эти данные свидетельствуют о том, что функция каждой РТК зависит не только от характера экспрессии и доступности лиганда,но также от схемы путей последовательной передачи сигнала, которая активируется данным рецептором. Таким образом, фосфорилирование представляет собой ключевую регуляторную стадию, которая определяет селективность сигнального пути, выбранного рецепторами конкретного ростового фактора, а также рецепторами фактора дифференциации. СТК, содержащиеся преимущественно в цитозоле, воздействуют на внутреннюю биохимию клетки часто в виде периферического ответа на события с участием РТК. Предполагают,что СТК участвует в сигнальном процессе, который инициирует синтез ДНК и последующий митоз, ведущий к клеточной пролиферации. Таким образом, перенос сигнала с участием ПК, наряду с прочими событиями, приводит к клеточной пролиферации, дифференциации,росту и изменению метаболизма. Аномальная пролиферация клеток может повлечь за собой множество нарушений и заболеваний, включая развитие неоплазии, такой как карцинома, саркома, гиобластома и гемангиома, нарушений,таких как лейкоз, псориаз, атеросклероз, артрит,диабетическая ретинопатия, и прочие нарушения, связанные с неконтролируемым ангиогенезом и/или васкулогенезом. Для воплощения настоящего изобретения на практике не обязательно знать подробный механизм ингибирования ПКсоединениями по настоящему изобретению. Однако, не вдаваясь в детали какого-либо механизма или теории, авторы полагают, что соединения взаимодействуют с аминокислотными остатками в каталитическом домене ПК. ПК обычно имеют двудольную структуру, причем установлено, что АТФ связывается в щели между двумя долями, где локализованы наиболее консервативные аминокислотные остатки ПК. Считается, что ингибиторы ПК связываются за счет нековалентных взаимодействий, таких как водородные связи, силы Ван-дер-Ваальса и ионные взаимодействия,именно в этом ключевом участке, где с ПК связывается вышеупомянутый АТФ. Более конкретно, следует полагать, что 2-индолиноновый фрагмент соединений по настоящему изобретению связывается в участке, обычно занятом адениновым циклом АТФ. В таком случае специфичность конкретной молекулы для данной 34 ПК может быть обусловлена дополнительным взаимодействием между различными заместителями, содержащимися в 2-индолиноновом фрагменте, и аминокислотными доменами, специфичными для данной ПК. Таким образом,различные индолиноновые заместители могут способствовать предпочтительному связыванию с данной ПК. Возможность выбирать соединения, активные к различным участкам связывания АТФ (или другого нуклеотида), позволяет использовать соединения по настоящему изобретению для воздействия на любой белок, содержащий такие участки связывания. Таким образом, описанные в тексте соединения пригодны как для анализа таких белков in vitro, так и для проявления in vivo терапевтического действия за счет взаимодействия с такими белками. С другой стороны, ПК, активность которой модулируется при контакте с соединением по настоящему изобретению, является тирозинкиназой (ТК), прежде всего рецепторной ПК(РПК). РПК, каталитическая активность которых модулируется соединением по настоящему изобретению или его солью, включают, без ограничения перечисленным, EGF, HER2, HER3,HER4, IR, IGF-1R, IRR, PDGFR, PDGFR,CSFIR, C-Kit, C-fms, Flk-1R, Flk4, KDR/Flk-1,Flt-1, FGFR-1R, FGFR-2R, FGFR-3R и FGFR-4R. Протеиновые тирозинкиназы, каталитическая активность которых модулируется при контакте с соединением по изобретению, или его солью, или пролекарством, могут быть также нерецепторными или клеточными тирозинкиназами (КТК). Таким образом, КТК, каталитическая активность которых модулируется при контакте с соединением или его солью по настоящему изобретению, включают, без ограничения перечисленным, Src, Frk, Btk, Csk, Abl,ZAP70, Fes, Fps, Fak, Jak, Ack, Yes, Fyn, Lyn,Lck, Blk, Hck, Fgr и Yrk. Еще одной группой ПК, каталитическая активность которых модулируется при контакте с соединением по настоящему изобретению, являются серинтреонинкиназы (СТК), такие как, без ограничения перечисленным, CDK2 и Raf. С другой стороны, настоящее изобретение относится к способу лечения или профилактике нарушений, связанных с ПК, заключающемуся во введении в организм терапевтически эффективного количества соединения по настоящему изобретению или его соли или пролекарства. Кроме того, аспект настоящего изобретения заключается в том, что фармацевтическая композиция, содержащая соединение по настоящему изобретению или его соль, или пролекарство, вводится в организм с целью профилактики или лечения нарушений, связанных с ПК. Следовательно, настоящее изобретение направлено на соединения, которые модулируют передачу сигнала, опосредованную ПК, посредством воздействия на ферментативную ак 35 тивность РТК, КТК и/или СТК, тем самым препятствуя сигналу, передаваемому такими белками. Прежде всего, настоящее изобретение направлено на соединения, которые модулируют пути передачи сигнала, опосредованные РТК, КТК и/или СТК, используемые в качестве терапевтического подхода для лечения многих видов солидных опухолей, включая, без ограничения перечисленным, карциномы; саркомы,включая саркому Капоши, эритробластому, глиобластому, менингиому, астроцитому, меланому и миобластому. Кроме того, настоящее изобретение относится к лечению или профилактике несолидных опухолей, таких как лейкоз. Показания могут включать, без ограничения перечисленным, рак мозга, рак мочевого пузыря, рак яичника, рак желудка, рак поджелудочной железы, рак прямой кишки, рак крови, рак легких,рак костной ткани. Другие примеры нарушений, связанных с аномальной активностью ПК, в случае которых описанные в тексте соединения могут быть использованы для профилактики, лечения и обследования, включают, без ограничения перечисленным, нарушения, связанные с клеточной пролиферацией, фиброзные нарушения и метаболические нарушения. Клеточные пролиферативные нарушения,для профилактики, лечения и обследования которых могут быть использованы соединения по настоящему изобретению, включают онкологические заболевания, пролиферативные нарушения кровеносных сосудов и мезангиальные клеточные пролиферативные нарушения. Пролиферативные нарушения кровеносных сосудов означают расстройства, связанные с аномальным васкулогенезом (образование кровеносных сосудов) и ангиогенезом (распространение кровеносных сосудов). Васкулогенез и ангиогенез играют центральную роль во многих нормальных физиологических процессах,таких как эмбриональное развитие, образование желтого тела, заживление ран и регенерация органов, кроме того, они играют центральную роль в развитии онкологического заболевания, в процессе которого они приводят к образованию новых капилляров, необходимых для выживания опухоли. Другие примеры пролиферативных нарушений кровеносных сосудов включают артрит, при котором растущие капиллярные кровеносные сосуды внедряются в сустав и разрушают хрящевую ткань, и глазные болезни,подобные диабетической ретинопатии, при которых растущие капилляры внедряются в сетчатую оболочку стекловидного тела, кровоточат и вызывают слепоту. Установлено, что две близкие в структурном отношении РТК связывают VEGF с высоким сродством: fms-подобный тирозиновый рецептор-1 (fit-1) (см. статьи Shibuya с соавт., Oncogen, 5: 519-524 (1990); De Vries c coaвт., Science, 255:989-991 (1992 и рецептор KDR/FLK 005032 36 1, известный также кaк VEGF-R2. В литературе описано, что фактор роста эндотелия сосудов(VEGF) является специфическим митогеном эндотелиальных клеток, обладающим свойством стимулировать рост клеток эндотелия in vitro. См. статьи Ferrara и Henzel, Biochem. Biophys.Res. Comm 161:851-858 (1989); Vaisman с соавт., J. Biol. Сhem., 265:19461-19566 (1990). Информация, приведенная в заявках на выдачу патента США 08/193829, 08/038596 и 07/975750, определенно свидетельствует о том,что VEGF не только отвечает за пролиферацию эндотелиальных клеток, но, кроме того, является основным регулятором ангиогенеза в норме и при патологии. См. статьи Klagsburn и Soker,Current Biology. 3(10):699-702 (1993): Houck с соавт. J. Biol. Chem., 267:26031-26037 (1992). Нормальный васкулогенез и ангиогенез играют центральную роль во многих физиологических процессах, таких как, эмбриональное развитие, заживление ран, регенерация органов и репродуктивные процессы, например образование фолликула в желтом теле во время овуляции и рост плаценты после беременности. См. статью Folkman и Shing, J. Biol. Chem., 267(16): 10931-10934 (1992). Неконтролируемый васкулогенез и/или ангиогенез связаны с заболеваниями, такими как диабет, а также злокачественными солидными опухолями, которые для своего роста нуждаются в васкуляризации. См. статьи Klagsburn и Soker, Current Biology,3(10):699-702 (1993); Folkman, J. Natl. CancerJ. Med., 324:1-5(1991). Предполагаемая роль VEGF в пролиферации эндотелиальных клеток и миграции в процессе ангиогенеза и васкулогенеза свидетельствует о центральной роли рецептора KDR/FLK-1 в этих процессах. Неконтролируемый ангиогенез может быть причиной таких заболеваний,как сахарный диабет (см. доклад Folkman с соавт. in XIth Congress of Thrombosis and Haemostasis (11-ый Конгресс по тромбозу и гемостазу),под ред. Verstraeta с соавт., Leuven University(1971). Рецепторы, с которыми специфически связывается VEGF, представляют собой важную и эффективную терапевтическую мишень для регуляции и модулирования васкулогенеза и/или ангиогенеза и множества серьезных заболеваний, которые обусловлены аномальным ростом клеток, вызванным такими процессами. См. статью Plowman с соавт., DNР, 7(6):334339 (1994). Прежде всего, высокоспецифичная роль рецепторов KDR/FLK-1 в неоваскуляризации позволяет считать их предпочтительной мишенью для терапевтических подходов к лечению онкологических заболеваний и других болезней, связанных с неконтролируемым образованием кровеносных сосудов. 37 Таким образом, один аспект настоящего изобретения относится к соединениям, способным регулировать и/или модулировать передачу сигнала, опосредованнуюТК, включая передачу сигнала рецептором KDR/FLK-1, с целью ингибирования или индуцирования ангиогенеза и/или васкулогенеза, т.е. к соединениям, которые ингибируют, предотвращают процесс передачи сигнала (или препятствуют передаче сигнала), опосредованный рецептором KDR/FLK-1 при активации лигандами, такими как VEGF. Хотя считается, что соединения по настоящему изобретению взаимодействуют с рецептором или другим компонентом, включенным в цепь передачи сигнала, опосредованную ТК, возможно также, что эти соединения непосредственно воздействуют на опухолевые клетки, образующиеся при неконтролируемом ангиогенезе. Хотя соответственные рецепторы, относящиеся к общей группе "flk-1", человека и мыши имеют различные названия, сами рецепторы во многих отношениях взаимозаменяемы. У рецептора мыши, Flk-1, и его соответствующего аналога в организме человека, KDR, гомология аминокислотной последовательности внутриклеточного домена составляет 93,4%. Аналогичным образом, рецептор мыши, Flk-1, связывает VEGF человека с таким же сродством, что и VEGF мыши, и соответственно активируется лигандом любого вида. См. статьи Мillauer с соавт., Cell. 72:835-846 (1993); Quinn с соавт.,Proc. Natl. Acad. Sci. USA. 90:7533-7537 (1993). Кроме того, Flk-1 связывается и следовательно фосфорилирует остатки тирозина в субстратах РТК человека (например, PLC- или р 85) при совместной экспрессии в клетках линии 293(фибробласты печени эмбриона человека). Следовательно, модели, разработанные с использованием рецептора FLK-1, можно непосредственно использовать для изучения KDR рецептора. Например, данные, полученные при использовании мышиного рецептора FLK-1 в методиках, с помощью которых идентифицированы соединения, регулирующие путь передачи сигнала в организме мыши, могут быть непосредственно использованы для идентификации соединений, способных осуществлять регуляцию пути передачи сигнала в организме человека, т.е. соединений, регулирующих активность,связанную с KDR рецептором. Таким образом,химические соединения, идентифицированные как ингибиторы KDR/FLK-1 in vitro, могут быть исследованы на соответствующих моделях invivo. Установлено, что обе модели животных для испытаний in vivo, мыши и крысы, вполне пригодны для изучения клинических возможностей агентов, воздействующих на путь передачи сигнала, индуцированный KDR/FLK-1. Таким образом, с одной стороны, настоящее изобретение направлено на соединения,которые регулируют, модулируют и/или ингибируют васкулогенез и/или ангиогенез путем 38 воздействия на ферментативную активность рецептора KDR/FLK-1 и препятствуя передаче сигнала, передаваемого KDR/FLK-1. С другой стороны, настоящее изобретение направлено на соединения, которые регулируют, модулируют и/или ингибируют путь передачи сигнала, опосредованный KDR/FLK-1, в качестве терапевтического подхода к лечению многих видов солидных опухолей, включая, без ограничения перечисленным, глиобластому, меланому и саркому Капоши, а также карциномы яичника, легких, молочной железы, предстательной железы,поджелудочной железы, толстой кишки и эпидермои-да (кисты кожи). Кроме того, имеющиеся данные свитедельствуют о том, что введение соединений, которые ингибируют путь передачи сигнала, опосредованный KDR/FLK-1, также может быть использовано при лечении гемангиомы, рестеноза и диабетической ретинопатии. Еще один аспект настоящего изобретения относится к ингибированию васкулогенеза и ангиогенеза по другим путям, опосредованным рецепторами, включая путь с участием рецептора flt-1. Рецепторная тирозинкиназа (РТК), принимающая участие в передаче сигнала, инициируется посредством внеклеточного взаимодействия со специфическим ростовым фактором (лигандом) с последующей димеризацией рецептора, временной стимуляцией собственной тирозинкиназной активности и автофосфорилирования. При этом образуются участки связывания для молекул, обеспечивающих внутриклеточную передачу сигнала, которые приводят к образованию комплексов с рядом цитоплазмаческих сигнальных молекул, что приводит к соответствующему клеточному ответу, например клеточному делению и метаболическим изменениям во внеклеточной микросреде. См. статьюSchlessinger и Ullrich, Neuron, 9:1-20 (1992). Близкая гомология внутриклеточных участков KDR/FLK-1 и рецептора PDGF- (гомология 50,3%) и/или близкого по строению рецептора flt-1 указывает на индукцию перекрывающихся путей передачи сигнала. Например, в случае рецептора PDGF- показано, что члены семейства src (см. статью Twamley с соавт.,Proc. Natl. Acad. Sci. USA, 90:7696-7700 (1993,фосфатидилинозит-3'-киназа (см. статью Нu с соавт., Mol. Cell. Biol., 12:981-990 (1992, фосфолипаза с (см. статью Kashishian и Cooper,Mol. Cell. Biol 4:49-51 (1993, ras-ГРФазаактивирующий белок (см. статью Kashishian с соавт., ЕМВО J., 11:1373-1382 (1992, PTPID/syp (см. статью Kazlauskas с соавт., Proc.(см. статью Arvidsson с соавт., Mol. Cell. Biol.,14:6715-6726 (1994, и регуляторные субъединицы Shc и Nck (см. статью Nishimura с соавт.,Mol. Cell. Biol., 13:6889-6896 (1993 связываются в областях, включающих различные участ 39 ки автофосфорилирования. Общие сведения см. в статье Claesson-Welsh, Prog. Growth FactorRes., 5:37-54 (1994). Таким образом, можно предположить, что пути передачи сигнала, активируемые KDR/FLK-1, включают путь, опосредованный ras (см. статью Rozakis с соавт.Nature. 360:689-692 (1992) и пути, опосредованные киназами PI-3', src и рlс. Каждый из этих путей может играть центральную роль в ангиогенном и/или васкулогенном воздействииKDR/FLK-1 на клетки эндотелия. Следовательно, еще один аспект настоящего изобретения относится к применению описанных в данном тексте органических соединений для модулирования ангиогенеза и васкулогенеза, поскольку такие процессы контролируются указанными путями. Способы по настоящему изобретению могут быть использованы для лечения и профилактики нарушений противоположной этиологии, связанных с сжатием, сокращением или смыканием стенок кровеносных сосудов, таких как рестеноз. Фиброзные нарушения означают аномальное формирование внеклеточного матрикса. Примеры фиброзных нарушений включают цирроз печени и пролиферативные нарушения мезангиальных клеток. Цирроз печени характеризуется ростом компонентов внеклеточного матрикса, приводящим к образованию рубца. Гипертрофированный внеклеточный матрикс,приводящий к образованию печеночного рубца,может быть также вызван вирусной инфекцией,такой как вирус гепатита. В развитии цирроза печени центральная роль, по-видимому, принадлежит жировым клеткам. Другим примером фиброзных нарушений является атеросклероз. Пролиферативные нарушения мезангиальных клеток означают нарушения, вызванные аномальной пролиферацией мезангиальных клеток. Такие заболевания включают различные почечные болезни человека, такие как гломерулонефрит, диабетическая нефропатия и злокачественный нефросклероз, а также такие нарушения, как тромботические микроангиопатические синдромы, отторжение трансплантата и гломерулопатии. В поддержании пролиферации мезангиальных клеток принимает участие РТКPDGFR. См. статью Floege с соавт., Kidney International. 43:47S-54S (1993). Многие онкологические заболевания являются нарушениями, вызванными пролиферацией клеток, и, как отмечалось выше, ПК непосредственно связаны с нарушениями пролиферации клеток. Таким образом, вполне естественно, что ПК, такие например, как члены семейства РТК имеют непосредственную связь с развитием онкологических заболеваний. Некоторые из этих рецепторов, например, EGFR (см. статьи Tuzi с соавт., Вr. J. Cancer. 63:227-233Science. 244:707-712 (1989 и PDGF-R (см. статью Kumabe с соавт., Oncogen. 7:627-633 (1992 характеризуются повышенной экспрессией во многих опухолях и/или устойчиво активированы в аутокринных петлях. Действительно, показано, что эти рецепторы характеризуются повышенной экспрессией при большинстве обычных и острых онкологических заболеваний (см. статьи Akbasak и Suner-Akbasak с соавт., J. Neurol. Sci., 111:119-133 (1992); Dickson с соавт.,Cancer Treatment Res., 61:249-273 (1992); Korc с соавт., J. Clin. Invest., 90:1352-1360 (1992) и аутокринных петлях (см. статьи Lee и Donoghue, J.IGF-IR, кроме включения в процессы парентерального питания и диабета второго типа,также ассоциирован с некоторыми типами онкологических заболеваний. Например, для некоторых типов опухолей IGF-I выступает в роли аутокринного стимулятора роста, например для клеток карциномы молочной железы (см. статью Arteaga с соавт., J. Clin. Invest., 84:14181423 (1989 и мелкоклеточного рака легких (см. статью Macauley с соавт., Cancer Res., 50:25112517 (1990. Кроме того, IGF-I, в полной мере участвующий в процессе нормального роста и дифференциации (клеток) нервной системы, повидимому, является также аутокринным стимулятором глиомы человека. См. статью SandbergNordgvist с соавт., Cancer Res., 53:2475-2478(1993. Важное значение IGF-IR и его лигандов для клеточной пролиферации подтверждается тем, что рост многих типов клеток в культуре(фибробласты, эпителиальные клетки, клетки гладких мышц, Т-лимфоциты, миелоидные клетки, хондроциты и остеобласты (стволовые клетки костного мозга стимулируются к росту посредством IGF-I. См. статью Goldring иBaserga сообщает, что IGF-IR играет центральную роль в механизме трансформации и поэтому может быть предпочтительной мишенью для 41 терапевтического воздействия на широкий спектр злокачественных опухолей. См. статьиCTK связывают со многими типами онкологических заболеваний, особенно рака молочной железы (см. статью Саnсе с соавт., Int. J.Cancer 54:571-577(1993). Взаимосвязь аномальной активности ПК со многими заболеваниям не ограничивается онкологическими заболеваниями. Например,РТК связана с такими болезнями, как псориаз,сахарный диабет, эндометриоз, ангиогенез, развитие атеросклеротических бляшек, болезнь Альцгеймера, болезнь Гиппеля-Линдау, эпидермальная гиперпролиферация, нейродегенеративные болезни, возрастная дегенерация желтого пятна и гемангиомы. Например, EGFR участвует в корнеальном и дермальном ранозаживлении. Дефекты в рецепторе инсулина и IGF-1R связывают с сахарным диабетом типа-II. Более сложная корреляция между специфическими РТК и их терапевтическими показаниями описана в статье Plowman с соавт. DNР 7:334339 (1994). Как отмечалось ранее, в передаче пролиферативного и метаболического сигнала наряду с РТК принимают участие и СТК, включающие,без ограничения перечисленным, src, abl, fps,yes, fyn, lyn, lck, blk, hck, fgr и yrk (см. обзорBolen с соавт., FASEB J. 6:3403-3409 (1992). Таким образом, можно ожидать, и это уже установлено, что они связаны со многими нарушениями, опосредованными ПК, и к которым относится настоящее изобретение. Например, установлено, что мутированный src (v-src) является онкобелком (pp60v-src) в организме цыпленка. Более того, его внутриклеточный гомолог, прото-онкоген pp60c-src переносит онкогенные сигналы многих рецепторов. ГиперэкспрессияEGFR или HER2/neu в опухолях приводит к конститутивной активации pp60c-src, наличие которого характерно для злокачественных клеток, но который отсутствует в нормальных клетках. С другой стороны, мыши с недостаточной экспресией c-src имеют фенотип с мраморной болезнью (врожденный системный остеопороз), что свидетельствует о ключевой роли csrc в функционировании остеокластов и возможной его роли в связанных с ним нарушениях. Аналогичным образом, Zap70 принимает участие в передаче сигналов в Т-клетках, которые имеют отношение к аутоиммунным заболеваниям. СТК ассоциированы с воспалительными процессами, аутоиммунным заболеванием, иммунными реакциями и гиперпролиферативными нарушениями, такими как рестеноз, фиброз,псориаз, остеоартрит и ревматоидный артрит. 42 ПК также принимают участие в имплантации эмбриона. Таким образом, соединения по настоящему изобретению могут быть эффективно использованы для предотвращения имплантации эмбриона и благодаря этому могут применяться в качестве средств контроля за рождаемостью. Наконец, в настоящее время предполагают,что РТК и СТК принимают участие в процессах гипериммунных нарушений. Другим аспектом настоящего изобретения является способ идентификации химическогосоединения, которое модулирует каталитическую активность одной или нескольких вышеуказанных ПК. Способ включает контактирование клеток, экспрессирующих необходимую ПК, с соединением по настоящему изобретению или его солью или пролекарством) и анализ клеток на наличие какого-либо воздействия со стороны исследуемого соединения. Результатом может быть любое изменение или отсутствие изменения клеточного фенотипа, наблюдаемое невооруженным глазом или с помощью соответствующего оборудования. Регистрируемое изменение или отсутствие изменения клеточного фенотипа может быть, например, без ограничения перечисленным, изменением или отсутствием изменения каталитической активности ПК в клетках или изменением или отсутствием изменений при взаимодействии ПК с природным партнером (лигандом). Примеры действия ряда типичных соединений по настоящему изобретению на ряд РТК приведены в табл. 1 и 2 и в разделе "Биологические исследования", см. ниже. Любые описанные соединения и результаты не могут рассматриваться, как ограничивающие объем притязаний настоящего изобретения. 3. Фармацевтические композиции и их применение Соединение по настоящему изобретению,его пролекарство или физиологически приемлемую соль соединения или пролекарства можно вводить пациенту отдельно или в составе фармацевтических композиций, в которых вышеупомянутые материалы смешаны с подходящими носителями или наполнителями. Методики получения и введения лекарственных средств можно найти в последнем издании книги"Remington's Pharmacological Sciences" (Фармакологические науки Ремингтона), Mack Publishing Co., Easton, PA. Способы введения лекарственных средств Используемые в данном тексте термины"вводить" или "введение" означают доставку соединения, соли или пролекарства по настоящему изобретению или фармацетической композиции, содержащей соединение, соль или пролекарство по настоящему изобретению, в организм с целью профилактики или лечения нарушения, связанного с ПК. 43 Подходящие способы введения включают,без ограничения перечисленным, пероральное,ректальное, чрезслизистое или кишечное введение или внутримышечные, подкожные, интрамедуллярные, интратекальные (подоболочечные, внутриоболочечные), прямые интравентрикулярные (внутрижелудочковые), внутривенные, интравитреальные, внутрибрюшинные,интраназальные или внутриглазные инъекции. Предпочтительными являются пероральный и парентеральный способы введения. В альтернативном варианте предпочтительным способом введения соединения является не системный, а местный способ, например инъекция соединения непосредственно в солидную опухоль, часто в виде композиции пролонгированного или длительного действия. Кроме того, лекарственное средство можно вводить в лекарственной форме целевого назначения, например в виде липосомы, покрытой антителами, специфичными к опухоли. Липосомы будут доставлены к мишени и поглощены опухолью. Композиции и их состав Фармацевтические композиции по настоящему изобретению могут быть получены способами, известными в данной области техники, например, путем обычного смешивания,растворения, гранулирования, дражирования,растирания в порошок, эмульгирования, капсулирования, включения или лиофилизации. Фармацевтические композиции для применения по настоящему изобретению можно получить с помощью общепринятых способов с использованием одного или более физиологически приемлемых носителей, включая наполнители и вспомогательные средства, которые облегчают переработку активных соединений в лекарственные препараты, используемые в фармацевтике. Состав композиции зависит от требуемого способа введения. Для инъекций соединения по изобретению получают в виде водных растворов, предпочтительно в физиологически совместимых буферных растворах, таких как раствор Хенкса, раствор Рингера или физиологический раствор. Для чрезслизистого введения в композицию вводят смачивающие реагенты, способствующие преодолению биологического барьера. Такие смачивающие реагенты обычно известны в данной области техники. Для перорального введения в композицию активные соединения смешиваютсфармацевтически приемлемыми носителями, хорошо известными специалистам. Такие носители позволяют получить соединения по изобретению в виде следующих лекарственных форм, предназначенных для приема внутрь: таблетки, пилюли, лепешки, драже, капсулы, растворы, гели,сиропы, вязкие суспензии, суспензии и т.п Фармацевтические композиции для перорального применения могут быть получены с исполь 005032 44 зованием твердого наполнителя, по выбору с измельчением полученной смеси и обработкой смеси гранул после добавления при необходимости других вспомогательных материалов для получения таблеток или ядер драже. Подходящими наполнителями являются, прежде всего,носители, такие как сахара, включая лактозу,сахарозу, маннит или сорбит, производные целлюлозы (крахмалы), такие как кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, и прочие материалы, такие как желатин, камедь трагаканта, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы,и/или поливинилпирролидон (ПВП). При необходимости могут быть добавлены дезинтегрирующие агенты, такие как сшитый поливинилпирролидон, агар или альгиновая кислота. Кроме того, можно использовать соль, такую как альгинат натрия. Ядра драже покрывают подходящей глазурью. Для этой цели используют концентрированные растворы сахаров, которые по выбору содержат гуммиарабик, тальк, поливинилпирролидон, карбополовый гель, полиэтиленгликоль,и/или диоксид титана, растворы лака и пригодные органические растворители или смеси растворителей. С целью идентификации или маркировки различных комбинаций доз активного компонента в глазурь таблеток или драже могут быть добавлены красители или пигменты. Фармацевтические композиции для перорального применения включают прессованные капсулы из желатина, а также мягкие заплавленные капсулы из желатина и пластификатора,такого как глицерин или сорбит. Прессованные капсулы могут содержать активные компоненты в смеси с наполнителем, таким как лактоза, связующим компонентом, таким как крахмал,и/или замасливателем, таким как тальк или стеарат магния и, по выбору, стабилизаторами. В мягких капсулах активные компоненты могут быть растворены или суспендированы в подходящих жидкостях, таких как нелетучие масла,жидкий парафин или жидкие полиэтиленгликоли. Кроме того, в эти композиции могут быть добавлены стабилизаторы. Для введения путем ингаляции соединения по настоящему изобретению можно вводить в форме аэрозоля с использованием герметичной упаковки или с использованием распылительной насадки и подходящего газа-вытеснителя,например, без ограничения перечисленным, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана или диоксида углерода. В случае герметичного аэрозоля дозировку можно регулировать с помощью клапана для доставки отмеренного количества лекарственного средства. Капсулы и картриджи, например, из желатина для использования в ингаляторе или в инсуффляторе могут содержать порошок активного соединения в смеси с подходящим порошко 45 образным наполнителем, таким как лактоза или крахмал. Кроме того, активные соединения могут быть получены в виде композиций для парентерального введения, например, путем струйной инъекции или непрерывного вливания. Композиции для инъекции могут быть представлены в форме стандартной дозировки, например, в ампулах или в упаковке на несколько доз, с добавлением консервантов. Композиции могут быть в виде суспензий, растворов и эмульсий в масляных или водных носителях, могут содержать композиционные материалы, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Фармацевтические композиции для парентерального введения включают водные растворы водорастворимой формы активного соединения, такой как, без ограничения перечисленным,его соль. Кроме того, суспензии активных соединений могут быть получены в липофильном носителе. Подходящие липофильные носители включают нелетучие масла, такие как кунжутное масло, синтетические эфиры жирных кислот, такие как этиловый эфир олеиновой кислоты, и триглицериды или материалы, такие как липосомы. Водные суспензии для инъекций могут содержать вещества, которые увеличивают вязкость суспензии, такие как натриевая соль карбоксиметилцеллюлозы, сорбит или декстран. По выбору суспензия может также содержать подходящие стабилизаторы и/или агенты, которые увеличивают растворимость соединений,что позволяет получать высококонцентрированные растворы. В альтернативном варианте активный комопонент может быть получен в порошкообразной форме для смешивания с подходящим носителем, например стерильной апирогенной водой. Соединения могут быть также получены в виде ректальных композициий, таких как суппозитории или удерживающие клизмы, с использованием общепринятых суппозиторных материалов, таких как кокосовое масло или другие глицериды. Кроме вышеописанных композиций соединения могут быть получены в виде препаратов пролонгированного действия. Такие долгодействующие композиции имплантируют (например, подкожно или внутримышечно) или вводят внутримышечной инъекцией. Для такого способа введения соединение по изобретению может быть получено в составе смеси с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в фармакологически приемлемом масле), с ионообменными смолами или в виде труднорастворимого производного, такого как, без ограничения перечисленным, труднорастворимая соль. 46 Примером фармацевтического носителя для гидрофобных соединений по изобретению является система сорастворителей, включающая бензиловый спирт, неполярное поверхностноактивное вещество (ПАВ), водорастворимый органический полимер и водную фазу, такая как система на основе VPD. Система VPD включает раствор следующего состава: 3 мас/об.% бензилового спирта, 8 мас/об.% неполярного ПАВ полисорбат 80, 65 мас/об.% полиэтиленгликоля 300 и абсолютный этанол (до 100 об.%). Система на основе VPD (VPD:D5W) включает раствор VPD, разбавленный в соотношении 1:1 5%-ным раствором декстрозы в воде. Эта система сорастворителей хорошо растворяет гидрофобные соединения и при системном введении обладает низкой токсичностью. Естественно соотношения компонентов в такой системе сорастворителей могут заметно варьировать без изменения растворяющей способности и токсичности. Кроме того, может быть изменена природа отдельных компонентов: например,вместо полисорбата 80 можно использовать другие малотоксичные неполярные ПАВ, можно варьировать фракционный состав полиэтиленгликоля, использовать вместо полиэтиленгликоля другие биосовместимые полимеры, например поливинилпирролидон, вместо декстрозы использовать другие сахара или полисахариды. В альтернативном варианте можно использовать другие системы доставки гидрофобных фармацевтически приемлемых соединений. Общеизвестными примерами систем доставки гидрофобных соединений являются такие носители, как липосомы и эмульсии. Кроме того,могут быть также использованы некоторые органические растворители, такие как диметилсульфоксид, хотя в большинстве случаев обладают более высокой токсичностью. Кроме того, для доставки соединения могут быть использованы системы пролонгированного действия, такие как полупроницаемые матриксы из твердых гидрофобных полимеров,содержащие терапевтический агент. Множество материалов пролонгированного действия хорошо известны специалистам в данной области техники. В зависимости от своей химической природы капсулы пролонгированного действия могут высвобождать активные соединения в течение периода от нескольких недель до более 100 дней. В зависимости от химической природы и биологической активности терапевтического агента могут быть использованы дополнительные методы стабилизации белков. Описанные в тексте фармацевтические композиции могут также включать подходящие жидкие или гелевые носители или наполнители. Примеры таких носителей или наполнителей включают, без ограничения перечисленным,карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, же 47 латин и полимеры, такие как полиэтиленгликоли. Многие из соединений по изобретению,модулирующие ПК, могут быть получены в виде физиологически приемлемых солей, причем заявленное соединение может иметь положительный или отрицательный заряд. Примеры солей, где соединение имеет положительный заряд (образует катион), включают, без ограничения преречисленным, соли четвертичного аммония (определенного в данном описании),такие как гидрохлорид, сульфат, карбонат, лактат, тартрат, малеат, сукцинат, причем атом азота в группе четвертичного аммония, взаимодействующей с соответствующей кислотой, является атомом азота в соединении по изобретению. Соли, в которых соединение по изобретению имеет отрицательный заряд (образует анион),включают, без ограничения преречисленным,соли натрия, калия, кальция и магния, образованные при взаимодействии карбоксильной группы соединения по изобретению ссоответствующим основанием (например, гидроксидом натрия (NaOH), гидроксидом калия (KОН), гидроксидом кальция (Са(ОН)2) и т.п.). Дозировка Фармацевтические композиции, подходящие для применения по настоящему изобретению, включают композиции, в которых активные компоненты присутствуют в количестве,достаточном для достижения поставленной цели, т.е. модулирования активности ПК или лечения или профилактики нарушения, связанного с ПК. Более подробно, терапевтически эффективное количество означает количество соединения, которое обеспечивает эффективную профилактику и смягчение или снижение интенсивности симптомов болезни или продлевает жизнь пациента, подлежащего лечению. Определение терапевтически эффективного количества полностью соответствует квалификации специалиста в данной области техники,особенно в свете информации, детально изложенной в данном тексте. Прежде всего, для любого соединения, используемого в способах по изобретению, терапевтически эффективное количество или доза могут быть определены путем испытания на клеточной культуре. Затем может быть определена дозировка для испытаний на модельных животных, обеспечивающая создание циркулирующей концентрации, включающей величинуIС 50, найденную при испытании на клеточной культуре (т.е. концентрации исследуемого соединения, при которой наблюдается ингибирование активности ПК на 50%). Затем полученные данные можно использовать для более точного определения дозы для введения человеку. Токсичность и терапевтическую эффективность соединений, описанных в данном тексте, определяют с использованием обычных 48 фармацевтических методов в экспериментах на клеточных культурах или на подопытных животных, т.е. путем определения IС 50 и LD50 (оба параметра определены в данном тексте) для исследуемых соединений. Данные, полученные при испытаниях на клеточной культуре и на подопытных животных, используются для определения диапазона доз для введения человеку. Дозы могут варьироваться в зависимости от применяемой формы лекарственного средства и способа введения. Точный состав композиции,способ введения и доза определяются лечащим врачом в соответствии с состоянием больного.Basis of Therapeutics (Фармакологические основы применения терапевтических средств), гл. 1,стр.1 (1975. Количество доз и интервал между введениями подбирается индивидуально с целью создания в плазме крови такого уровня активных соединений, который является достаточным для поддержания эффектов модулирования киназы. Эти уровни в плазме носят название минимально эффективные концентрации (МЭК). МЭК будут варьировать для каждого соединения, но их можно определить по результатам испытанийin vitro, т.е. по результатам испытаний, описанных в данном тексте. МЭК означает концентрацию, необходимую для ингибирования киназной активности на 50-90%. Дозировки, необходимые для достижения МЭК, зависят от индивидуальных характеристик и способа введения. Концентрация в плазме может быть определена методом ВЭЖХ (высокоэффективной жидкостной хроматографии) или с помощью биоиспытаний. Интервалы между дозами (время введения) также определяют, исходя из величины МЭК. Соединения следует вводить по такой схеме,которая обеспечивает поддержание уровня в плазме, превышающего МЭК на 10-90%, предпочтительно на 30-90%, наиболее предпочтительно на 50-90%. В случае местного введения или избирательного поглощения эффективная местная концентрация лекарственного средства может быть не связана с концентрацией в плазме и для определения точной дозы и интервалов введения следует использовать другие методики, известные специалистам в данной области техники. Количество введенной композиции естественно зависит от пациента, подлежащего лечению, от степени тяжести заболевания, способа введения, заключения лечащего врача и т.п. Упаковка При необходимости композиции могут представлять собой упаковку или дозирующее устройство, такое как набор, утвержденный Управлением по контролю за продуктами и лекарствами (FDA), которые могут содержать одну или более лекарственных форм-доз, содер 49 жащих активный компонент. Для упаковки могут быть использованы, например, металлическая фольга или полимерная пленка, например,для упаковки в виде блистера. К упаковке или дозирующему устройству может прилагаться инструкция по применению лекарственного средства. К упаковке или дозирующему устройству может также прилагаться информация, нанесенная на упаковку и составленная в форме,установленной правительственной организацией по контролю за производством, использованием и продажей фармацевтических средств,причем эта информация должна соответствовать нормам, установленным для форм композиций для введения человеку или для ветеринарного назначения, утвержденным соответствующей организацией. При составлении такой информации можно, например, использовать маркировку, утвержденную Управлением по контролю за продуктами и лекарствами для назначения лекарств, или лист-вкладыш, также утвержденный указанной организацией. Могут быть получены также композиции, содержащие соединение по настоящему изобретению и совместимый фармацевтический носитель и помещенные в соответствующую упаковку с этикеткой, содержащей инструкции по применению для лечения определенных заболеваний. Подходящие заболевания, обозначенные на этикетке, могут включать онкологические заболевания, ингибирование ангиогенеза, фиброз, диабет и т.п. 4. СИНТЕЗ Соединения по настоящему изобретению,а также предшественники 2-оксиндолы и альдегиды могут быть легко получены с помощью способов, хорошо известных в данной области химии. Компетентным специалистам в данной области техники представляется очевидным, что другие пути синтеза для получения данных соединений по настоящему изобретению также являются пригодными, и что следующие примеры представлены для иллюстрации способа, но не для его ограничения. А. Общие методы синтеза. Для получения соединений по настоящему изобретению можно использовать следующую общую методологию. Соответственно замещенный 2-оксиндол(1,2 экв.) и пиперидин (0,1 эквив.) смешивают в этаноле (1-2 мл/ммоль 2-оксиндола) и затем смесь нагревают при 90 С в течение от 3 до 5 ч. После охлаждения реакционную смесь концентрируют и подкисляют до рН 3. Образующийся осадок отфильтровывают, промывают водой до рН 7 и затем холодным этанолом, этилацетатом и/или гексаном и сушат в вакууме, при этом получают требуемое соединение. Данный продукт может быть по выбору дополнительно очищен с помощью хроматографии. 50 Б. 2-Оксиндолы. В данном разделе представлены примеры синтеза с использованием промежуточных производных 2-оксиндола для получения соединений по настоящему изобретению. Указанные 2 оксиндолы образуют заявленные соединения по настоящему изобретению по реакции с соответственно замещенным пирролальдегидом с использованием вышеописанных общих методов синтеза или методов, описанных в разделе В ниже. Следует понимать, что представленные ниже методы синтеза необходимо рассматривать как примеры подходов к синтезу и как примеры синтеза оксиндолов, представленных для иллюстрации. 5-Амино-2-оксиндол 5-Нитро-2-оксиндол (6,3 г) гидрируют в метаноле над 10% палладием на угле, при этом получают 3,0 г (выход 60%) требуемого соединения в виде твердого вещества белого цвета. 5-Бром-2-оксиндол 2-Оксиндол (1,3 г) в 20 мл ацетонитрила охлаждают до -10 С и медленно добавляют 2,0 г N-бромсукцинимида при перемешивании. Реакционную смесь перемешивают в течение 1 ч при -10 С и 2 ч при 0 С. Осадок собирают, промывают водой и сушат, при этом получают 1,9 г(выход 90%) требуемого соединения. 4-Метил-2-оксиндол Диэтилоксалат (30 мл) в 20 мл сухого простого эфира при перемешивании добавляют к 19 г этоксида калия, суспендированного в 50 мл сухого простого эфира. Полученную смесь охлаждают на ледяной бане и медленно добавляют 20 мл 3-нитро-о-ксилола в 20 мл сухого простого эфира. Полученную вязкую смесь темнокрасного цвета нагревают с обратным холодильником в течение 0,5 ч, концентрируют в виде твердого вещества темно-красного цвета и обрабатывают 10% раствором гидроксида натрия до тех пор, пока почти все твердое вещество не растворится. Смесь темно-красного цвета обрабатывают 30% пероксидом водорода до изменения цвета с красного на желтый. В другом варианте полученную смесь обрабатывают 10% гидроксидом натрия и 30% пероксидом водорода до исчезновения темно-красного окрашивания. Полученное твердое вещество отфильтровывают и фильтрат подкисляют 6 н. соляной кислотой. Полученный осадок собирают фильтрованием в вакууме, промывают водой и сушат в вакууме, при этом получают 9,8 г (выход 45%) 2-метил-6-нитрофенилуксусной кислоты в виде твердого вещества грязно-белого цвета. Твердое вещество гидрируют в метаноле над 10% палладием на угле, при этом получают 9,04 г требуемого соединения в виде твердого вещества белого цвета. 7-Бром-5-хлор-2-оксиндол 5-Хлор-2-оксиндол (16,8 г) и 19,6 г Nбромсукцинимида суспендируют в 140 мл ацетонитрила и нагревают с обратным холодильни 51 ком в течение 3 ч. По данным тонкослойной хроматографии (силикагель, этилацетат) после 2 ч нагревания с обратным холодильником в смеси присутствуют 5-хлор-2-оксиндол или Nбромсукцинимид (Rf=0,8), продукт (Rf=0,85) и второй продукт (Rf=0,9), соотношение которых не изменяется после дополнительного нагревания с обратным холодильником в течение 1 ч. Полученную смесь охлаждают до 10 С, осадок собирают фильтрованием в вакууме, промывают 25 мл этанола и сушат в вакууме на воронке в течение 20 мин, при этом получают 14,1 г влажного продукта (выход 56%). Полученное твердое вещество суспендируют в 200 мл денатурата и полученную суспензию промывают путем перемешивания и нагревания с обратным холодильником в течение 10 мин. Полученную смесь охлаждают на ледяной бане до 10 С. Твердый продукт собирают фильтрованием в вакууме,промывают 25 мл этанола и сушат в вакууме при 40 С, при этом получают 12,7 г (выход 51%) 7-бром-5-хлор-2-оксиндола. 5-Фтор-2-оксиндол 5-Фторизатин (8,2 г) растворяют в 50 мл гидрата гидразина и нагревают с обратным холодильником в течение 1 ч. Затем реакционную смесь выливают в ледяную воду. Отфильтрованный затем осадок промывают водой и сушат в вакуум-сушильном шкафу, при этом получают требуемое соединение. 5-Нитро-2-оксиндол 2-Оксиндол (6,5 г) растворяют в 25 мл концентрированной серной кислоты и смесь выдерживают при (-10)-(-15)С в течение периода, необходимого для добавления по каплям 2,1 мл дымящей азотной кислоты. После добавления азотной кислоты реакционную смесь перемешивают при 0 С в течение 0,5 ч и выливают в ледяную воду. Полученный осадок собирают фильтрованием, промывают водой и кристаллизуют из 50% уксусной кислоты. Затем полученный кристаллический продукт отфильтровывают, промывают водой и сушат в вакууме,при этом получают 6,3 г (70%) 5-нитро-2 оксиндола. 5-Иод-2-оксиндол 2-Оксиндол (82,9 г) суспендируют в 630 мл уксусной кислоты при механическом перемешивании и полученную смесь охлаждают до 10 С на ледяной бане. Твердый Nиодсукцинимид (175 г) добавляют порциями в течение 10 мин. После завершения добавления полученную смесь перемешивают в течение 1 ч при 10 С. При этом суспензия твердого вещества, которое находится в реакционной смеси,загустевает. Полученное твердое вещество собирают фильтрованием в вакууме, промывают 100 мл 50% раствора уксусной кислоты в воде и затем 200 мл воды и сушат в вакууме на воронке в течение 20 мин. Полученный продукт сушат в вакууме, при этом получают 93,5 г (36%) 5-иод 005032 52 2-оксиндола, содержащего около 5% 2 оксиндола согласно данным протонного ЯМР. 5-Метил-2-оксинол 5-Метилизатин (15,0 г) и 60 мл гидрата гидразина нагревают при 140-160 С в течение 4 ч. Данные тонкослойной хроматографии (этилацетат/гексан 1:2, силикагель) указывают на отсутствие исходного вещества. Полученную реакционную смесь охлаждают до комнатной температуры, выливают в 300 мл ледяной воды и подкисляют 6 н. соляной кислотой до рН 2. После выдерживания при комнатной температуре в течение 2 дней осадок собирают фильтрованием в вакууме, промывают водой и сушат в вакууме, при этом получают 6,5 г (выход 47%) 5-метил-2-оксиндола. 5-Бром-4-метилоксиндол и 5,7-дибром-4 метилоксиндол 4-Метил-2-оксиндол (5 г) в 40 мл ацетонитрила обрабатывают 7,26 г N-бромсукцинимида и перемешивают при комнатной температуре в течение 4 ч. Данные тонкослойной хроматографии (этилацетат/гексан 1:2, силикагель) указывают на присутствие смеси 5-бром(Rf=0,3) и 5,7-дибром- (Rf=0,5) производных. К полученной смеси добавляют дополнительные 7,26 г N-бромсукцинимида при перемешивании в течение дополнительных 4 ч. Твердое вещество собирают фильтрованием в вакууме, промывают 20 мл ацетонитрила и сушат, при этом получают смесь 1:1 моно- и дибромпроизводных. Фильтрат концентрируют и очищают хроматографией на силикагеле (этилацетат/гексан 1:2),при этом получают 1,67 г 5-бром-4-метил-2 оксиндола в виде твердого вещества бежевого цвета. Оставшуюся смесь 1:1 твердых соединений перекристаллизовывают дважды из ледяной уксусной кислоты, при этом получают 3,2 г 5,7 дибром-4-метил-2-оксиндола в виде твердого вещества светло-оранжевого цвета. Полученные фильтраты очищают хроматографией, как описано выше, при этом получают 0,6 г 5-бром-4 метил-2-оксиндола и 0,5 г 5,7-дибром-4-метил 2-оксиндола. 6-Фтор-2-оксиндол Гидрид натрия (2,6 г) и 14,5 г диметилмалоната перемешивают при нагревании при 100 С в 160 мл ДМСО в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры, добавляют 7,95 г 2,5-дифторнитробензола и полученную смесь перемешивают в течение 30 мин. Затем смесь нагревают при 100 С в течение 1 ч, охлаждают до комнатной температуры и выливают в 400 мл насыщенного раствора хлорида аммония. Полученную смесь экстрагируют 200 мл этилацетата и органический слой промывают солевым раствором, сушат над безводным сульфатом натрия и концентрируют в вакууме. Остаток кристаллизуют из метанола,при этом получают 24,4 г (выход 80%) диметил 4-фтор-2-нитрофенилмалоната в виде твердого вещества белого цвета, Rf=0,2 по данным тон 53 кослойной хроматографии (этилацетат/гексан 1:6, силикагель). Фильтрат концентрируют и очищают хроматографией на колонке с силикагелем (этилацетат/гексан 1:8), при этом получают дополнительные 5,03 г диметил-4-фтор-2 нитрофенилмалоната, суммарный выход составляет 29,5 г (96%). Диметил-4-фтор-2-нитрофенилмалонат(5,0 г) кипятят с обратным холодильником в 20 мл 6 н. соляной кислоты в течение 24 ч. Реакционную смесь охлаждают и твердое вещество белого цвета собирают фильтрованием в вакууме, промывают водой и сушат, при этом получают 3,3 г (выход 87%) 4-фтор-2-нитрофенилуксусной кислоты, Rf=0,6 по данным тонкослойной хроматографии (этилацетат/гексан 1:2, силикагель). 4-Фтор-2-нитрофенилуксусную кислоту(3,3 г), растворенную в 15 мл уксусной кислоты,гидрируют над 0,45 г 10% палладия на угле в атмосфере Н 2 при давлениии 41,37 кПа (60 psi) в течение 2 ч. Катализатор удаляют фильтрованием и промывают 15 мл метанола. Объединенные фильтраты концентрируют и растворяют в воде. Осадок собирают фильтрованием в вакууме,промывают водой и сушат, при этом получают 1,6 г (выход 70%) 6-фтор-2-оксиндола, Rf=0,24 по данным тонкослойной хроматографии. Фильтрат концентрируют, при этом получают твердое вещество пурпурного цвета, ЯМР спектр которого совпадает со спектром первой порции. После хроматографирования твердого вещества пурпурного цвета (этилацетат/гексан 1:2, силикагель) получают вторую порцию 6 фтор-2-оксиндола в виде твердого вещества белого цвета. 5-Аминосульфонил-2-оксиндол В колбу объемом 100 мл, содержащую 27 мл хлорсульфоновой кислоты, медленно добавляют 13,3 г 2-оксиндола. Во время добавления температуру реакционной смеси поддерживают ниже 30 С. После завершения добавления реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч, нагревают при 68 С в течение 1 ч, охлаждают и выливают в воду. Осадок промывают водой и сушат в вакуум-сушильном шкафу, при этом получают 11,0 г 5-хлорсульфонил-2-оксиндола (выход 50%),который используют без дополнительной очистки. 5-Хлорсульфонил-2-оксиндол (2,1 г) добавляют к 10 мл гидроксида аммония в 10 мл этанола и перемешивают при комнатной температуре в течение ночи. Смесь концентрируют и твердое вещество собирают фильтрованием в вакууме, при этом получают 0,4 г (выход 20%) требуемого соединения в виде твердого вещества грязно-белого цвета. 5-Метиламиносульфонил-2-оксиндол Суспензию 3,38 г 5-хлорсульфонил-2 оксиндола в 10 мл 2 М метиламина в тетрагидрофуране перемешивают при комнатной темпе 005032 54 ратуре в течение 4 ч, после чего образуется твердое вещество белого цвета. Осадок собирают фильтрованием в вакууме, дважды промывают 5 мл воды и сушат в вакууме при 40 С в течение ночи, при этом получают 3,0 г (выход 88%) 5-метиламиносульфонил-2-оксиндола. 5-(4-Трифторметилфениламиносульфонил)-2-оксиндол Суспензию 2,1 г 5-хлорсульфонил-2-оксиндола, 1,6 г 4-трифторметиланилина и 1,4 г пиридина в 20 мл дихлорметана перемешивают при комнатной температуре в течение 4 ч. Полученный осадок собирают фильтрованием в вакууме, промывают дважды 5 мл воды и сушат в вакууме при 40 С в течение ночи, при этом получают 2,4 г неочищенного продукта, содержащего некоторые примеси поданным тонкослойной хроматографии. Неочищенный продукт очищают хроматографией на силикагеле, в качестве элюента используют смесь этилацетат/гексан (1:2), при этом получают 1,2 г (выход 37%) 5-(4-трифторметилфениламиносульфонил)-2-оксиндола. 5-(Морфолиносульфонил)-2-оксиндол Суспензию 2,3 г 5-хлорсульфонил-2 оксиндола и 2,2 г морфолина в 50 мл дихлорметана перемешивают при комнатной температуре в течение 3 ч. Белый осадок собирают фильтрованием в вакууме, промывают этилацетатом и гексаном и сушат в вакууме при 40 С в течение ночи, при этом получают 2,1 г (выход 74%) 5(морфолиносульфонил)-2-оксиндола. 6-Трифторметил-2-оксиндол ДМСО (330 мл) добавляют к 7,9 г гидрида натрия, затем по каплям добавляют 43,6 г диэтилоксалата. Смесь нагревают при 100 С в течение 1,0 ч и охлаждают до комнатной температуры. Добавляют 2-нитро-4-трифторметилтолуол (31,3 г), реакционную смесь перемешивают в течение 30 мин при комнатной температуре и затем нагревают при 100 С в течение 1 ч. Реакционную смесь охлаждают и выливают в смесь насыщенного водного раствора хлорида аммония, этилацетата и гексана. Органический слой промывают насыщенным раствором хлорида аммония, водой и солевым раствором, сушат и концентрируют, при этом получают диметиловый эфир 2-(2-нитро-4-трифторметилфенил)малоновой кислоты. Сложный диэфир растворяют в смеси 6,4 г хлорида лития и 2,7 мл воды в 100 мл ДМСО и нагревают при 100 С в течение 3 ч. Реакционную смесь охлаждают и выливают в смесь этилацетата и солевого раствора. Органический слой промывают солевым раствором, сушат над сульфатом натрия, концентрируют и очищают хроматографией на силикагеле (10% этилацетата в гексане). Фракции, содержащие продукт,упаривают, при этом получают 25,7 г метилового эфира 2-нитро-4-трифторметилфенилуксусной кислоты. 55 Метиловый эфир 2-нитро-4-трифторметилфенилуксусной кислоты (26 мг) гидрируют над 10% палладием на угле и затем нагревают при 100 С в течение 3 ч. Катализатор удаляют фильтрованием и растворитель упаривают, при этом получают требуемое соединение. 5-(2-Хлорэтил)оксиндол 5-Хлорацетил-2-оксиндол (4,18 г) в 30 мл трифторуксусной кислоты на ледяной бане обрабатывают 4,65 г триэтилсилана и перемешивают при комнатной температуре в течение 3 ч. Смесь выливают в 150 мл воды и осадок собирают фильтрованием в вакууме, промывают 50 мл воды и сушат, при этом получают 2,53 г (выход 65%) 5-(2-хлорэтил)-2-оксиндола в виде твердого вещества красно-коричневого цвета. 5-Метоксикарбонил-2-оксиндол 5-Иод-2-оксиндол (17 г) кипятят с обратным холодильником с 2 г диацетата палладия,18,2 г триэтиламина, 150 мл метанола, 15 мл ДМСО и 2,6 г 1,3-бис(дифенилфосфино)пропан(DPPP) в атмосфере, насыщенной монооксидом углерода. Через 24 ч реакционную смесь фильтруют для удаления катализатора и фильтрат концентрируют. Концентрат хроматографируют на силикагеле (30% этилацетата в гексане). Фракции, содержащие продукт, концентрируют и выдерживают в течение определенного периода. Полученный осадок собирают фильтрованием в вакууме, при этом получают 0,8 г (7%) требуемого соединения в виде твердого вещества грязно-белого цвета. 4-Карбокси-2-оксиндол Раствор триметилсилилдиазометана в гексане (2 М) добавляют по каплям к раствору 2,01 г 2-хлор-3-карбоксинитробензола в 20 мл метанола при комнатной температуре до прекращения выделения газа. Избыток триметилсилилдиазометана гасят уксусной кислотой. Реакционную смесь сушат на роторном испарителе и остаток сушат в вакуум-сушильном шкафу в течение ночи. Полученный 2-хлор-3-метоксикарбонилнитробензол в дальнейшем используют без дополнительной очистки. Диметилмалонат (6,0 мл) добавляют к ледяной суспензии 2,1 г гидрида натрия в 15 мл ДМСО. Затем реакционную смесь перемешивают при 100 С в течение 1 ч и затем охлаждают до комнатной температуры. 2-Хлор-3 метоксикарбонилнитробензол (2,15 г) добавляют к вышеуказанной смеси одной порцией и смесь нагревают при 100 С в течение 1,5 ч. Затем реакционную смесь охлаждают до комнатной температуры, выливают в ледяную воду,подкисляют до рН 5 и экстрагируют этилацетатом. Органический слой промывают солевым раствором, сушат над безводным сульфатом натрия и концентрируют, при этом получают 3,0 г диметилового эфира 2-метоксикарбонил-6 нитрофенилмалоновой кислоты. Диметиловый эфир 2-метоксикарбонил-6 нитрофенилмалоновой кислоты (3,0 г) кипятят с 56 обратным холодильником в 50 мл 6 н. соляной кислоты в течение ночи. Смесь концентрируют досуха и кипятят с обратным холодильником в течение 2 ч с 1,1 г хлорида олова (II) в 20 мл этанола. Смесь фильтруют через целит, концентрируют и хроматографируют на силикагеле(этилацетат/гексан/уксусная кислота), при этом получают 0,65 г (выход 37%) 4-карбокси-2-оксиндола в виде твердого вещества белого цвета. 5-Карбокси-2-оксиндол 2-Оксиндол (6,7 г) добавляют при перемешивании к суспензии 23 г хлорида алюминия в 30 мл дихлорэтана на ледяной бане. Медленно добавляют хлорацетилхлорид (11,3 г) и при этом наблюдают выделение хлористого водорода. Через 10 мин перемешивания реакционную смесь нагревают при 40-50 С в течение 1,5 ч. Данные тонкослойной хроматографии (этилацетат, силикагель) указывают на отсутствие исходного вещества. Смесь охлаждают до комнатной температуры и выливают в ледяную воду. Осадок собирают фильтрованием в вакууме,промывают водой и сушат в вакууме, при этом получают 10,3 г (98%) 5-хлорацетил-2-оксиндола в виде твердого вещества грязно-белого цвета. Суспензию 9,3 г 5-хлорацетил-2-оксиндола перемешивают в 90 мл пиридина при 80-90 С в течение 3 ч, затем охлаждают до комнатной температуры. Осадок собирают фильтрованием в вакууме и промывают 20 мл этанола. Твердое вещество растворяют в 90 мл 2,5 н. гидроксида натрия и перемешивают при 70-80 С в течение 3 ч. Смесь охлаждают до комнатной температуры и подкисляют 0,5 н. соляной кислотой до рН 2. Осадок собирают фильтрованием в вакууме и тщательно промывают водой, при этом получают неочищенный продукт 5-карбокси-2 оксиндол в виде твердого вещества темнокоричневого цвета. В течение ночи в фильтрате образуется 2 г 5-карбокси-2-оксиндола в виде твердого вещества желтого цвета. Неочищенный темно-коричневый продукт растворяют в горячем метаноле, нерастворимую фракцию удаляют фильтрованием и фильтрат концентрируют, при этом получают 5,6 г 5-карбокси-2 оксиндола в виде твердого вещества коричневого цвета. Суммарный выход составляет 97%. 5 Карбоксиэтил-2-оксиндол 5-Цианоэтил-2-оксиндол (4,02 г) в 10 мл воды, содержащей 25 мл концентрированной соляной кислоты, кипятят с обратным холодильником в течение 4 ч. Смесь охлаждают,добавляют воду и полученное твердое вещество собирают фильтрованием в вакууме, промывают водой и сушат, при этом получают 1,9 г (44%) требуемого вещества в виде твердого вещества желтого цвета. 5-Иод-4-метил-2-оксиндол К 2 г 4-метил-2-оксиндола в 40 мл ледяной уксусной кислоты на ледяной бане добавляют 3,67 г N-иодсукцинимида. Смесь перемешивают 57 в течение 1 ч, разбавляют 100 мл 50% водного раствора уксусной кислоты и фильтруют. Полученное твердое вещество белого цвета сушат в высоком вакууме, при этом получают 3,27 г(выход 88%) требуемого соединения в виде твердого вещества грязно-белого цвета. 5-Хлор-4-метил-2-оксиндол Суспензию 3,0 г 4-метил-2-оксиндола перемешивают в 50 мл ацетонитрила при комнатной температуре, при этом добавляют порциями 3,3 г N-хлорсукцинимида. Затем добавляют трифторуксусную кислоту (1 мл). Суспензию перемешивают при комнатной температуре в течение 3 дней, при этом твердое вещество постоянно присутствует в смеси. Твердое вещество белого цвета собирают фильтрованием в вакууме, промывают небольшим количеством холодного ацетона и сушат в течение ночи в вакуум-сушильном шкафу при 40 С, при этом получают 2,5 г (68%) 5-хлор-4-метил-2-оксиндола. 5-Бутил-2-оксиндол Триэтилсилан (2,3 г) добавляют к 2 г 4 бутаноил-2-оксиндола в 20 м трифторуксусной кислоты при комнатной температуре и раствор перемешивают в течение 3 ч. Реакционную смесь выливают в ледяную воду, при этом получают масло красного цвета, которое затвердевает npи хранении. Твердое вещество собирают фильтрованием в вакууме, промывают водой и гексаном и сушат, при этом получают 1,7 г (выход 91%) требуемого соединения в виде твердого вещества грязно-белого цвета. 5-Этил-2-оксиндол К 5-ацетил-2-оксиндолу (2 г) в 15 мл трифторуксусной кислоты на ледяной бане медленно добавляют 1,8 г триэтилсилана; затем реакционную смесь перемешивают при комнатной температуре в течение 5 ч. Добавляют 1 мл триэтилсилана и перемешивание продолжают в течение ночи. Реакционную смесь выливают в ледяную воду и полученный осадок собирают фильтрованием в вакууме, промывают избытком воды и сушат в вакууме, при этом получают 1,3 г (выход 71%) требуемого соединения в виде твердого вещества желтого цвета. 5-(Морфолин-4-илэтил)-2-оксиндол 5-Хлорэтил-2-оксиндол (2,3 г), 1,2 мл морфолина и 1,2 мл диизопропилэтиламина нагревают в течение ночи при 100 С в 10 мл ДМСО. Смесь охлаждают, выливают в воду и экстрагируют этилацетатом. Органический слой промывают солевым раствором, сушат и упаривают. Остаток хроматографируют на силикагеле (5% метанола в хлороформе), при этом получают 0,9 г (31%) требуемого соединения в виде твердого вещества белого цвета. 5-(4-Метоксикарбонилбензамидо)-2-оксиндол Смесь 82,0 мг 5-амино-2-оксиндола и 131,0 мг 4-метоксикарбонилбензоилхлорида в пиридине перемешивают при комнатной температуре в течение 3 ч и выливают в ледяную воду. 58 Осадок фильтруют, промывают водой и сушат в вакуум-сушильном шкафу, при этом получают 138,0 мг 5-(4-метоксикарбонилбензамидо)-2-оксиндола (выход 81%). 5-(4-Карбоксибензамидо)-2-оксиндол 5-(4-Метоксикарбонилбензамидо)-2-оксиндол (0,9 г) и 0,4 г гидроксида натрия в 25 мл метанола кипятят с обратным холодильником в течение 3 ч. Смесь концентрируют, добавляют воду и смесь подкисляют 6 н. соляной кислотой. Осадок собирают фильтрованием в вакууме, при этом получают 0,75 г (87%) требуемого соединения в виде твердого вещества белого цвета. 5-Метокси-2-оксиндол Хлораль гидрат (9,6 г) растворяют в 200 мл воды, содержащей 83 г сульфата натрия. Раствор нагревают до 60 С, добавляют раствор 11,4 г гидрохлорида гидроксиламина в 50 мл воды и смесь выдерживают при 60 С. В отдельной колбе 6,4 г 4-анизидина и 4,3 мл концентрированной соляной кислоты в 80 мл воды нагревают до 80 С. Первый раствор добавляют ко второму и смесь кипятят с обратным холодильником в течение 2 мин, после чего раствор медленно охлаждают до комнатной температуры и затем охлаждают на ледяной бане. Осадок желтокоричневого цвета собирают фильтрованием в вакууме, промывают водой и сушат в вакууме,при этом получают 8,6 г (выход 85%) N-(2 гидроксиминоацетил)анизидина. Концентрированную серную кислоту (45 мл), содержащую 5 мл воды, нагревают до 60 С и в смесь одной порцией добавляют 8,6 г N-(2 гидроксиминоацетил)анизидина. Перемешиваемую смесь нагревают до 93 С в течение 10 мин и затем охлаждают до комнатной температуры. Смесь выливают в 500 г льда и трижды экстрагируют этилацетатом. Объединенные экстракты сушат над безводным сульфатом натрия и концентрируют, при этом получают 5,1 г (выход 65%) 5-метоксиизатина в виде твердого вещества темно-красного цвета. 5-Метоксиизатин (5,0 г) и 30 мл гидрата гидразина нагревают с обратным холодильником в течение 15 мин. Реакционную смесь охлаждают до комнатной температуры и добавляют 50 мл воды. Смесь трижды экстрагируют 25 мл этилацетата, органические слои объединяют, сушат над безводным сульфатом натрия и концентрируют, при этом получают твердое вещество желтого цвета. Твердое вещество перемешивают в этилацетате и 1,1 г нерастворимого вещества удаляют фильтрованием в вакууме и сохраняют. Показано, что полученное вещество является 2-гидразинокарбонилметил-4-анизидином. Фильтрат концентрируют и хроматографируют на силикагеле, в качестве элюента используют смесь этилацетат/гексан (1:1), при этом получают 0,7 г 5 метокси-2-оксиндола в виде твердого вещества желтого цвета. 1,1 г 2-гидразинокарбонилметил 4-анизидина кипятят с обратным холодильником в течение 1 ч в 20 мл 1 н. гидроксида на 59 трия. Смесь охлаждают, подкисляют до рН 2 концентрированной соляной кислотой и трижды экстрагируют 25 мл этилацетата. Органические экстракты объединяют, промывают солевым раствором, сушат над безводным сульфатом натрия и концентрируют, при этом получают 0,8 г 5-метокси-2-оксиндола в виде твердого вещества желтого цвета. Суммарный выход составляет 1,5 г или 33%. 1 Н ЯМР (360 МГц, ДMCO-d6):10,13 (s,1H, NH-1), 6,84 (s, 1H, Н-4), 6,72 (d, J=8,68 Гц,1 Н, Н-6), 6,69 (d, J=8,68 Гц, 1 Н, Н-7), 3,68 (s, 3 Н,ОСН 3-5), 3,41 (s, 2 Н, СН 2-3); МС m/z (относительная интенсивность, %) 163 ([М+1]+, 100). 7-Азаоксиндол 3,3-Дибром-7-азаоксиндол (2,9 г) растворяют в смеси 20 мл уксусной кислоты и 30 мл ацетонитрила. К раствору добавляют 6,5 г цинковой пыли. Смесь перемешивают в течение 2 ч при комнатной температуре. Твердое вещество отфильтровывают от смеси и растворитель упаривают. Остаток суспендируют этилацетатом. Раствор этилацетата, содержащий нерастворимое твердое вещество, пропускают через короткую колонку с силикагелем. Полученный раствор этилацетата упаривают и остаток сушат в вакууме, при этом получают 1,8 г (выход 91%) ацетата 7-азаоксиндола. 5-Диметиламиносульфонил-2-оксиндол Суспензию 2,3 г 5-хлорсульфонил-2 оксиндола в 10 мл 2 М диметиламина в метаноле перемешивают при комнатной температуре в течение 4 ч, при этом наблюдается образование твердого вещества белого цвета. Осадок собирают фильтрованием в вакууме, промывают 5 мл 1 н. гидроксида натрия и 5 мл 1 н. соляной кислоты и сушат в вакууме при 40 С в течение ночи, при этом получают 1,9 г (выход 79%) 5 диметиламиносульфонил-2-оксиндола. 6-Фенил-2-оксиндол Диметилмалонат (10 мл) в 25 мл ДМСО по каплям добавляют к 3,5 г гидрида натрия, суспендированного в 25 мл ДМСО и смесь нагревают при 100 С в течение 10 мин. Смесь охлаждают до комнатной температуры и добавляют 4,7 г 4-фтор-3-нитробифенила в 25 мл ДМСО. Смесь нагревают при 100 С в течение 2 ч, охлаждают и гасят 300 мл насыщенного раствора хлорида аммония. Смесь экстрагируют трижды этилацетатом и объединенные органические слои промывают водой и солевым раствором и упаривают, при этом получают неочищенный диметиловый эфир 3-нитробифенил-4-малоновой кислоты в виде масла желтого цвета. Неочищенный диметиловый эфир 3-нитробифенил-4-малоновой кислоты кипятят с обратным холодильником в 30 мл 6 н. соляной кислоты в течение 24 ч. Осадок собирают фильтрованием, промывают водой и сушат, при этом получают 4,5 г 3-нитробифенил-4-уксусной кислоты в виде твердого вещества кремового цвета. 60 Порошок железа (2,6 г) добавляют одной порцией к 4,5 г 3-нитробифенил-4-уксусной кислоты в 40 мл уксусной кислоты. Смесь кипятят с обратным холодильником в течение 2 ч,концентрируют досуха и обрабатывают этилацетатом. Твердые вещества удаляют фильтрованием и фильтрат промывают дважды 1 н. соляной кислотой и солевым раствором, сушат над безводным сульфатом натрия. Фильтрат концентрируют и при этом получают 3,4 г (выход 93%) 6-фенил-2-оксиндола в виде твердого вещества светло-коричневого цвета. 6-(2-Метоксифенил)-2-оксиндол Тетракис(трифенилфосфин)палладий (1 г) добавляют к смеси 5 г 2-метоксифенилборной кислоты, 6,6 г 5-бром-2-фторнитробензола и 30 мл 2 М раствора карбоната натрия в 50 мл толуола и в 50 мл этанола. Смесь кипятят с обратным холодильником в течение 2 ч, концентрируют и остаток дважды экстрагируют этилацетатом. Слой этилацетата промывают водой и солевым раствором, затем сушат и концентрируют, при этом получают масло темно-зеленого цвета, которое затвердевает при хранении в неочищенный 4-фтор-2'-метокси-3-нитробифенил. Диметилмалонат (14 мл) по каплям добавляют к 2,9 г гидрида натрия, суспендированного в 50 мл ДМСО. Смесь нагревают при 100 С в течение 15 мин. Смесь охлаждают до комнатной температуры. Затем добавляют неочищенный 4 фтор-2'-метокси-3-нитробифенил в 60 мл ДМСО и смесь нагревают при 100 С в течение 2 ч. Реакционную смесь охлаждают и гасят 300 мл насыщенного раствора хлорида аммония, смесь экстрагируют дважды этилацетатом. Экстракты объединяют, промывают насыщенным раствором хлорида аммония, водой и солевым раствором, сушат над безводным сульфатом натрия и концентрируют, при этом получают неочищенный диметиловый эфир 2'-метокси-3-нитробифенил-4-малоновой кислоты в виде масла желтого цвета. Неочищенный диметиловый эфир 2'-метокси-3-нитробифенил-4-малоновой кислоты нагревают при 100 С в 50 мл 6 н. соляной кислоты в течение 24 ч и охлаждают. Осадок собирают фильтрованием, промывают водой и гексаном, сушат, при этом получают 9,8 г 2'метокси-3-нитробифенил-4-уксусной кислоты в виде твердого вещества желто-коричневого цвета. Порошок железа (5 г) добавляют одной порцией к 9,8 г 2'-метокси-3-нитробифенил-4 уксусной кислоты в 50 мл ледяной уксусной кислоты и нагревают до 100 С в течение 3 ч. Реакционную смесь концентрируют досуха, обрабатывают ультразвуком в этилацетате и фильтруют для удаления нерастворимых веществ. Фильтрат дважды промывают 1 н. соляной кислотой, водой и солевым раствором, сушат над безводным сульфатом натрия и концен
МПК / Метки
МПК: C07D 209/34, A61P 35/00, A61K 31/404
Метки: фармацевтическая, пирролзамещенные, организме, модулирования, активности, каталитической, нарушения, связанного, лечения, профилактики, протеинкиназы, 2-индолиноны, способ, композиция, протеинкиназой, варианты
Код ссылки
<a href="https://eas.patents.su/30-5032-pirrolzameshhennye-2-indolinony-varianty-farmacevticheskaya-kompoziciya-varianty-sposob-modulirovaniya-kataliticheskojj-aktivnosti-proteinkinazy-sposob-lecheniya-ili-profilaktiki-n.html" rel="bookmark" title="База патентов Евразийского Союза">Пирролзамещенные 2-индолиноны (варианты), фармацевтическая композиция (варианты), способ модулирования каталитической активности протеинкиназы, способ лечения или профилактики нарушения в организме, связанного с протеинкиназой</a>
Предыдущий патент: Замещенные полициклические арил- и гетероарилпиразиноны, которые могут использоваться при селективном ингибировании системы свертывания крови
Следующий патент: Моторное топливо для дизельных, газотурбинных и турбореактивных двигателей и способ его получения
Случайный патент: Способ получения жидкого топлива и система для получения жидкого топлива












