3-фенилзамещенный пиридоиндолон, его получение и терапевтическое применение
Номер патента: 10833
Опубликовано: 30.12.2008
Авторы: Казелла Пьер, Дерок Жан-Мари, Вермут Камилл Жорж, Жегам Самир, Мюно Иветт, Кьяпетти Паола, Бурри Бернар
Формула / Реферат
1. Соединение формулы
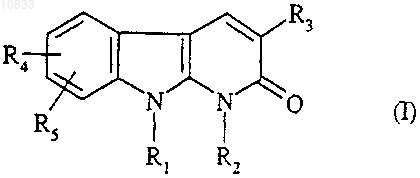
где R1 представляет собой атом водорода, (C1-C4)алкильную группу или группу (CH2)nOH,
(CH2)n-O-тетрагидропиран-2-ил, (CH2)nNR'6R'7, (CH2)nCN, (CH2)nCO2(C1-C4)alk или (CH2)nCONR6R7;
R2 представляет собой атом водорода или (C1-C4)алкильную группу;
или R1 и R2 вместе образуют группу (CH2)3;
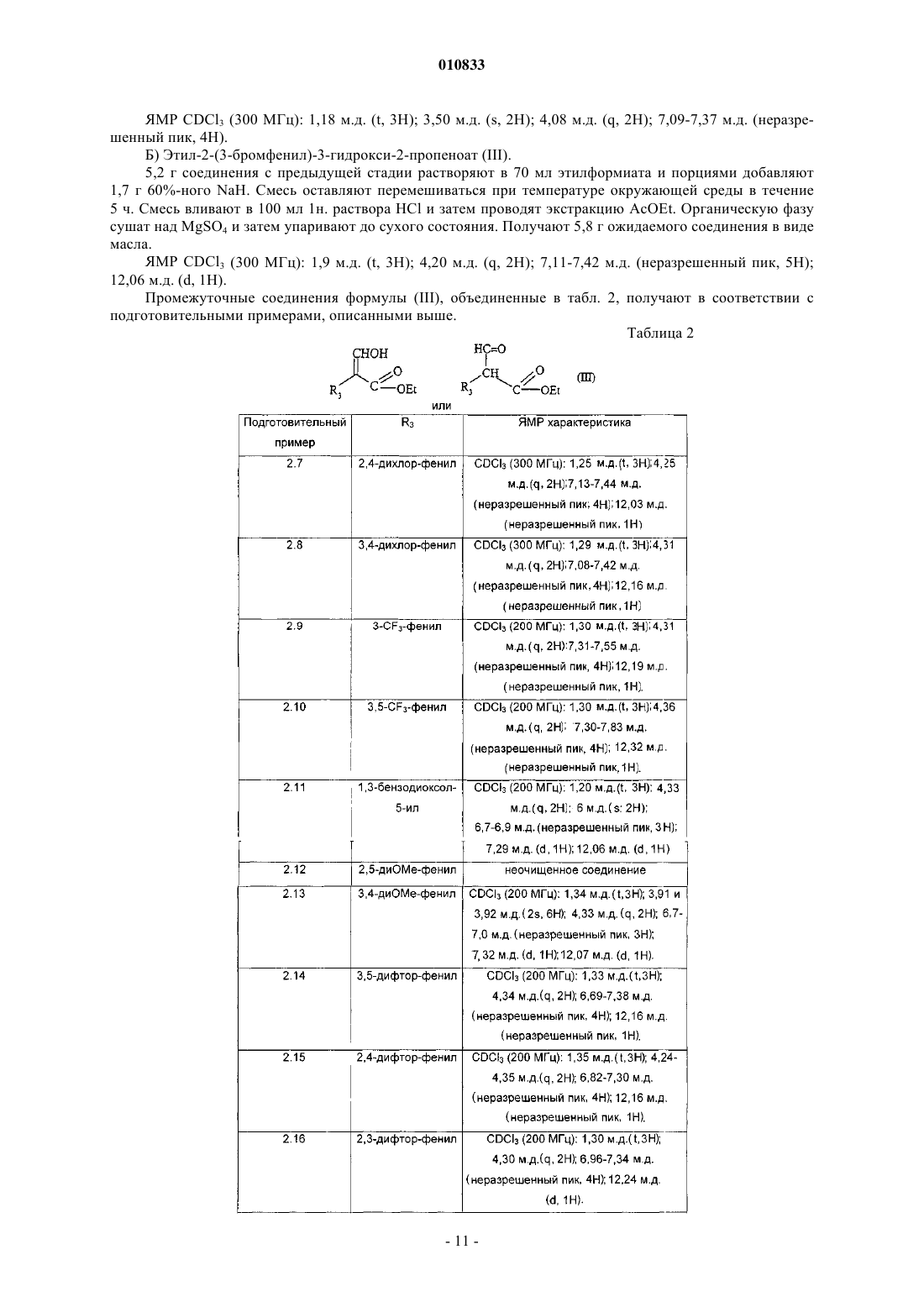
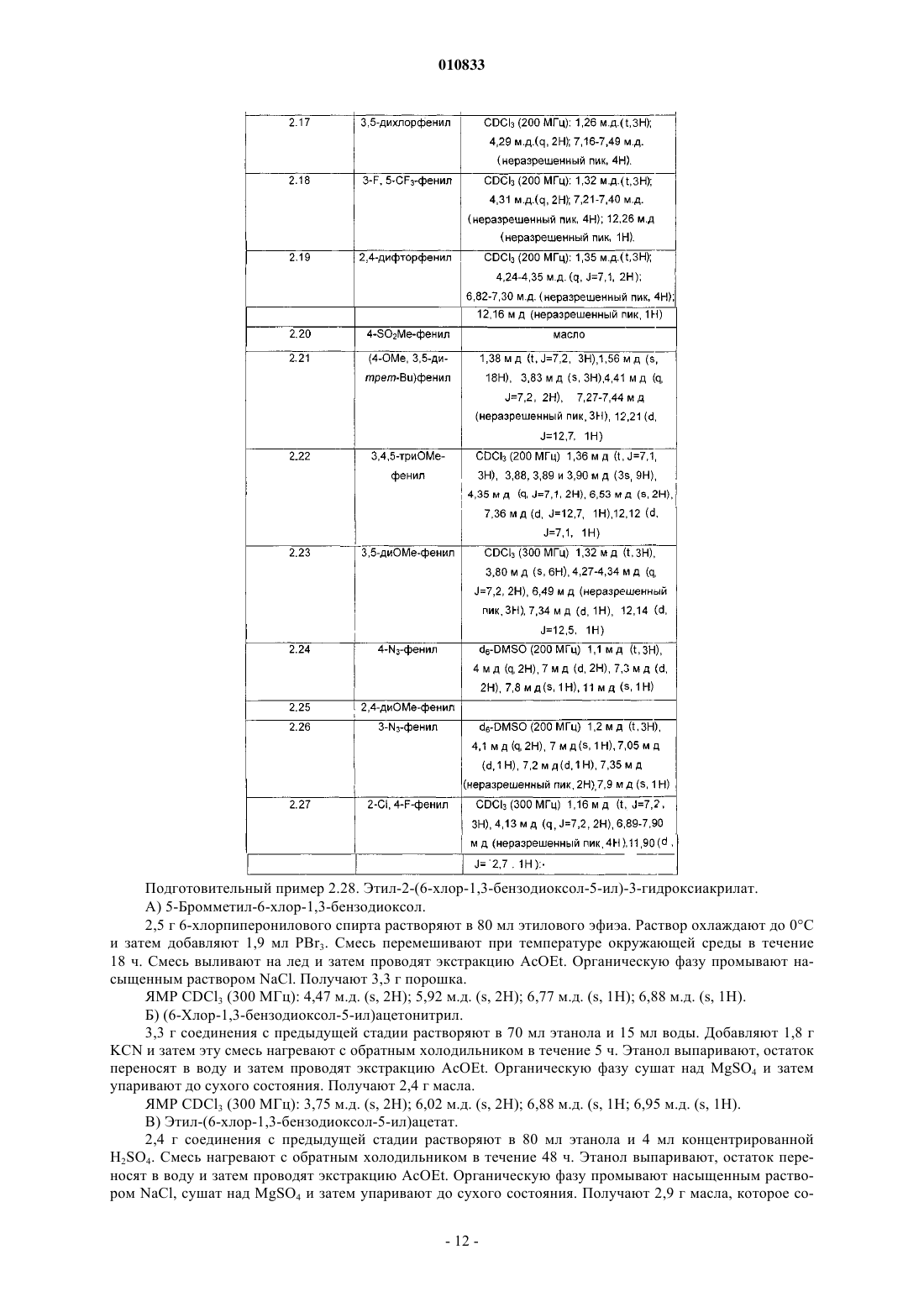
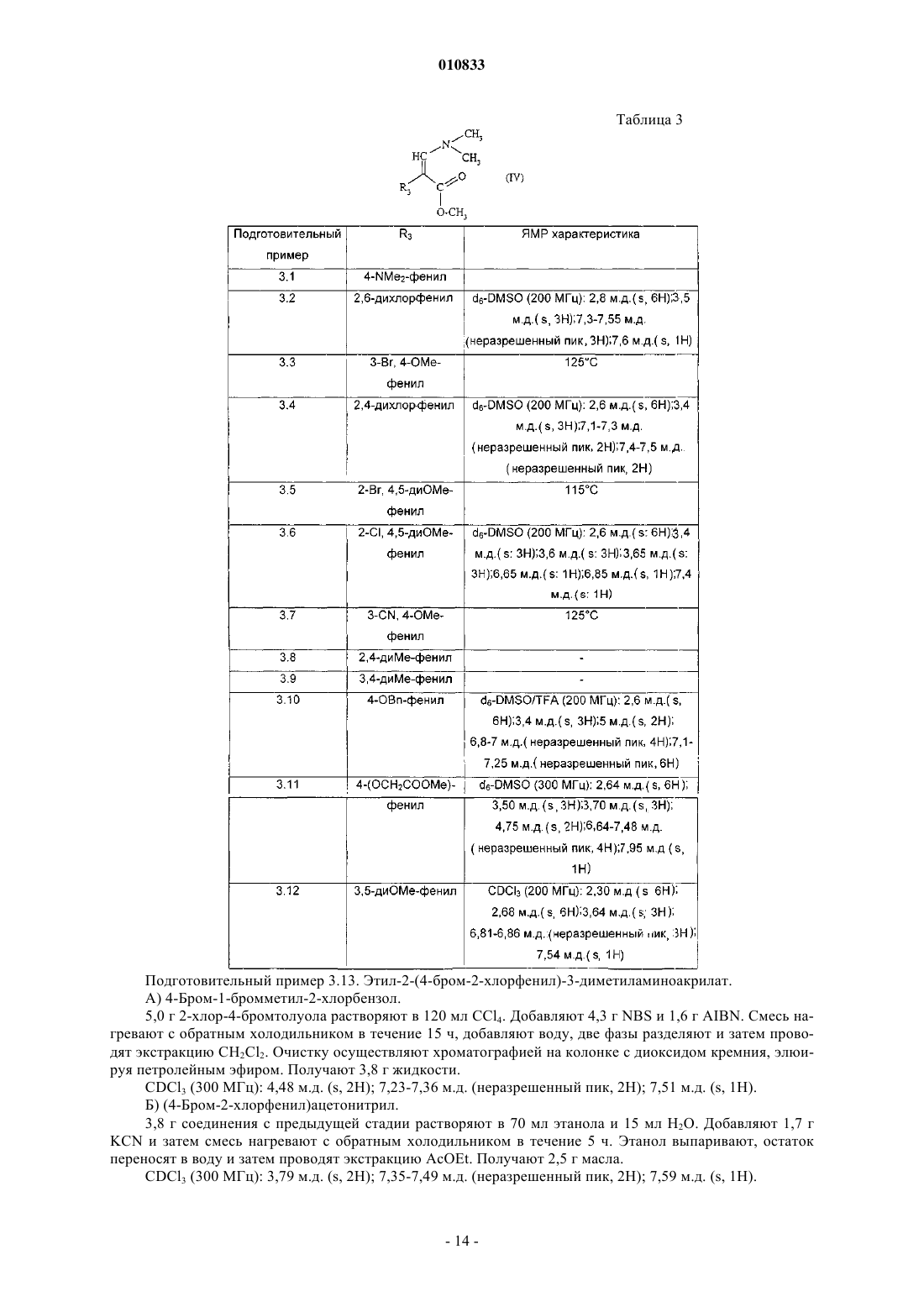
R3 представляет собой фенил, монозамещенный гидроксильной, гидроксиметильной, карбоксильной, (C1-C4)алканоильной, азидо, (C1-C4)алкоксикарбонильной, гидроксииминометильной, (C1-C4)алкилсульфонильной, трифторметильной, тиольной, (C1-C4)алкилтио или цианогруппой или группой (CH2)mNR'7R10, CONR6R8 или O(CH2)nR9; фенил, замещенный одинаковыми или разными заместителями в количестве от 2 до 5, выбранными из атома галогена, (C1-C4)алкильной, трифторметильной,
гидроксильной, гидроксиметильной, (C1-C4)алкокси, карбоксильной, (C1-C4)алканоильной, азидо,
(C1-C4)алкоксикарбонильной, гидроксииминометильной, тиольной, (C1-C4)алкилтио ипи
(C1-C4)алкилсульфонильной группы, или фенильной, или цианогруппы, ипи группы (CH2)mNR'7R10, CONR6R8 или O(CH2)nR9;
или R3 представляет собой бензодиоксолильную группу, которая не замещена или замещена в фенильной части атомом галогена;
R4 и R5, одинаковые или разные, каждый независимо, представляет собой атом водорода или галогена, или гидроксильную, (C1-C4)алкильнуо, трифторметильную, фенильную, циано, (C1-C4)алкокси,
(C1-C4)алкоксикарбонильную или (C1-C4)алкилсульфонильную группу, или группу O-(CH2)nNR6R7 или (CH2)nNR6R7;
R6 представляет собой водород или (C1-C4)алкильную группу;
R7 представляет собой водород или (C1-C4)алкильную группу;
или R6 и R7 вместе с атомом азота, с которым они связаны, образуют гетероциклический радикал, выбранный из пиперидила, морфолинила, пирролидинила, пиперазинила или 4-метилпиперазин-1-ила;
R'6 представляет собой водород или (C1-C4)алкильную группу;
R'7 представляет собой водород или (C1-C4)алкильную группу;
или R'6 и R'7 вместе с атомом азота, с которым они связаны, образуют гетероциклический радикал, выбранный из морфолинила или пирролидинила;
R8 представляет собой водород, (C1-C4)алкильную группу или группу -(CH2)nNR6R7;
или R6 и R8 вместе с атомом азота, с которым они связаны, образуют гетероциклический радикал, выбранный из пиперидила, морфолинила, пирролидинила, пиперазинила или 4-метилпиперазин-1-ила;
R9 представляет собой фенильный радикал или амино, морфолин-4-ил, циано или
(C1-C4)алкоксикарбонильную группу;
R10 представляет собой R'6 или фенильную, пиридильную или пиримидинильную группу или группу (CH2)nNR'6R'7;
или R'7 и R10 вместе с атомом азота, с которым они связаны, образуют гетероциклический радикал, выбранный из пиперазинила или 4-метилпиперазин-2-ила;
n равно 1, 2 или 3;
m равно 0 или 1;
Alk представляет собой алкил;
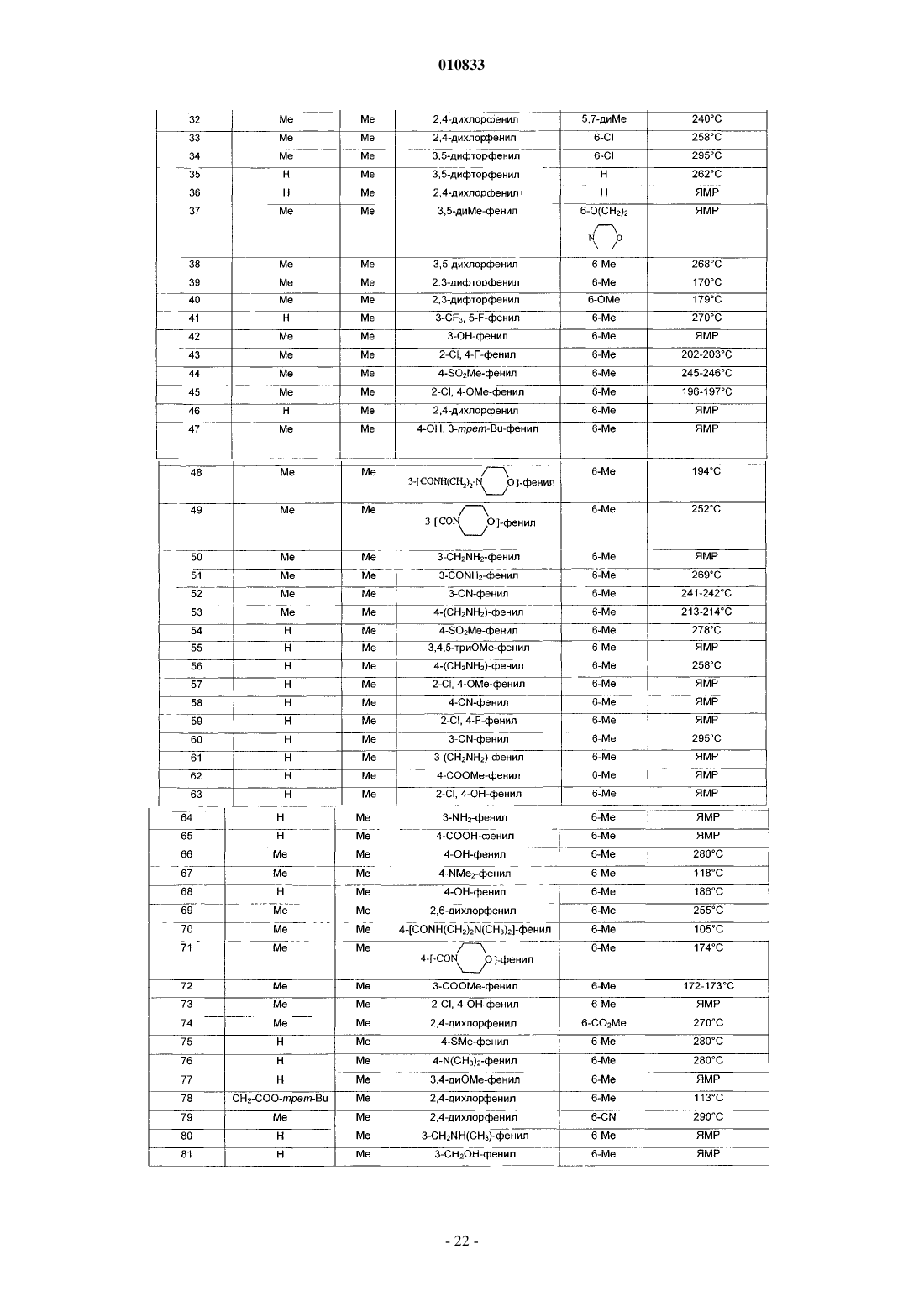
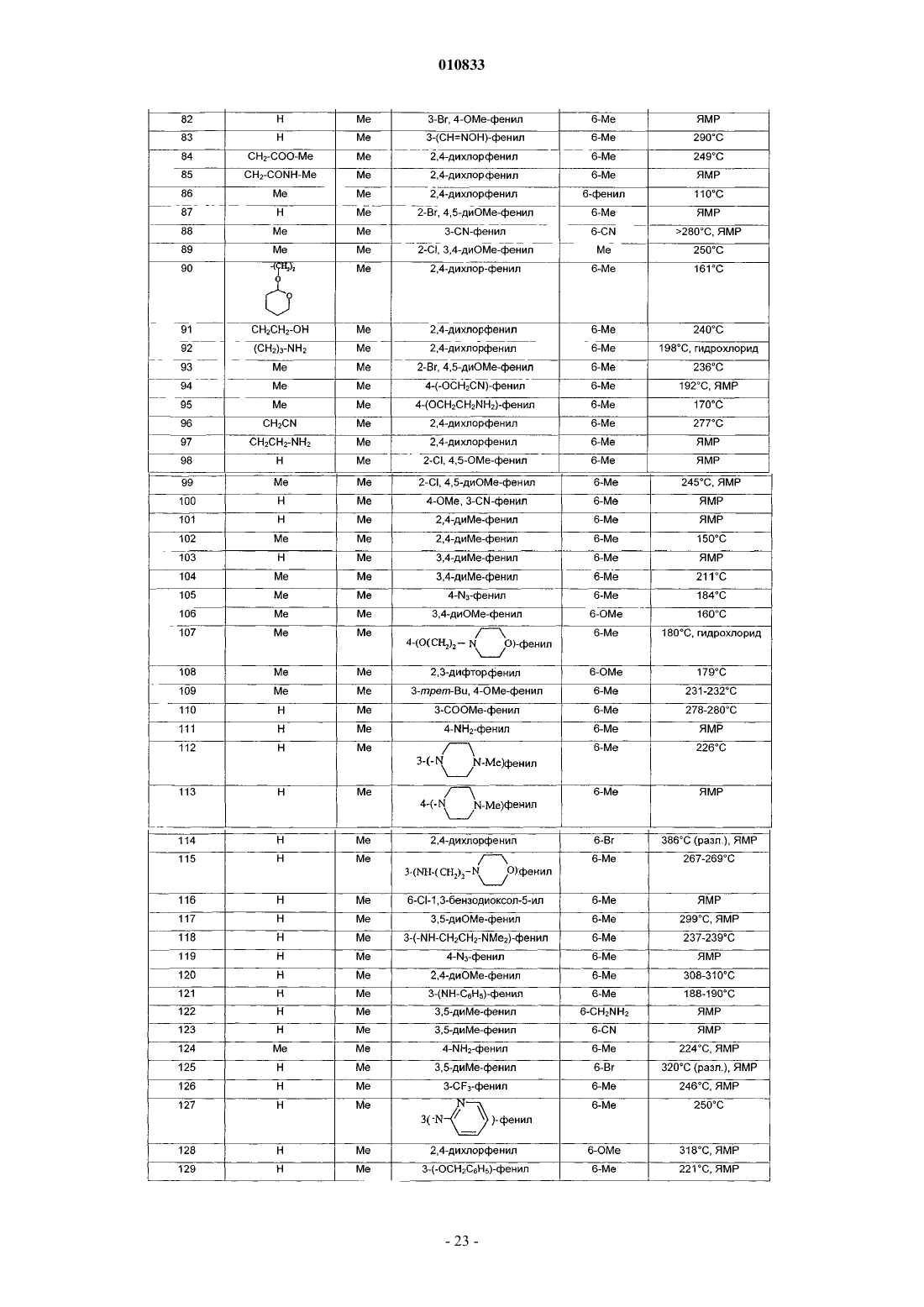
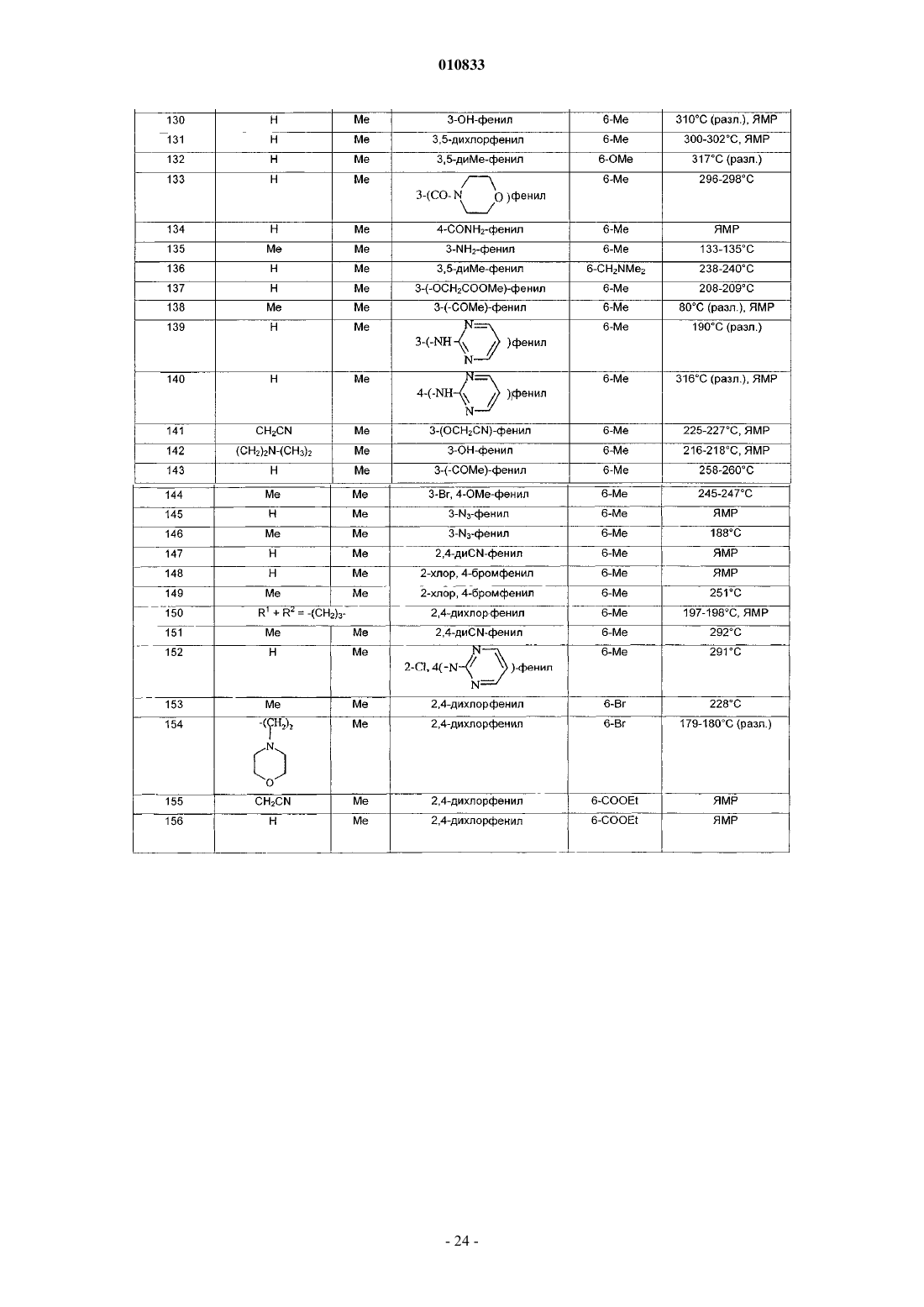
в форме основания или в форме соли присоединения кислоты и в форме гидрата или сольвата.
2. Соединение формулы (I) по п.1, отличающееся тем, что
R1 представляет собой атом водорода или метильную, цианометильную, (C1-C4)алкоксикарбонилметильную, аминометильную, аминоэтильную, аминопропильную или пирролидиноэтильную группу;
и/или R2 представляет собой метильную группу;
и/или R1 и R2 вместе образуют группу (CH2)3;
и/или R3 представляет собой фенил, монозамещенный гидроксильной, (C1-C4)алкоксикарбонильной, метилсульфонильной, трифторметильной, метилтио, цианометокси, аминоэтокси, ацетильной, гидроксиметильной, циано, амино, азидо, аминометильной или гидроксииминометильной группой или группой (CH2)mNR'7R10, где R'7 представляет собой атом водорода или метил,R10 представляет собой атом водорода или фенильную, пиридильную или пиримидинильную группу, или R'7 и R10 вместе с атомом азота, с которым они связаны, образуют пиперазин-1-ильную или 4-метилпиперазин-1-ильную группу, и m равно 0 или 1; или R3 представляет собой фенил, замещенный 2 или 3 одинаковыми или разными заместителями, выбранными из атома галогена, метильной, метокси, метилтио, трифторметильной, гидроксильной, (C1-C4)алкоксикарбонильной, метилсульфонильной, цианометокси, аминоэтокси, ацетильной, гидроксиметильной, циано, амино, азидо, аминометильной или гидроксииминометильной группы, или группы (CH2)mNR'7R10, где R'7 представляет собой атом водорода или метил, R10 представляет собой атом водорода или фенильную, пиридильную или пиримидинильную группу, или R'7 и R10 вместе с атомом азота, с которым они связаны, образуют пиперазин-1-ильную или 4-метилпиперазин-1-ильную группу, и m равно 0 или 1; или R3 представляет собой бензодиоксолильную группу, которая не замещена или замещена в фенильной части атомом галогена;
и/или R4 представляет собой атом галогена или метильную, метокси или (C1-C4)алкоксикарбонильную группу;
и/или R5 представляет собой атом водорода или метильную группу;
в форме основания или в форме соли присоединения кислоты и в форме гидрата или сольвата.
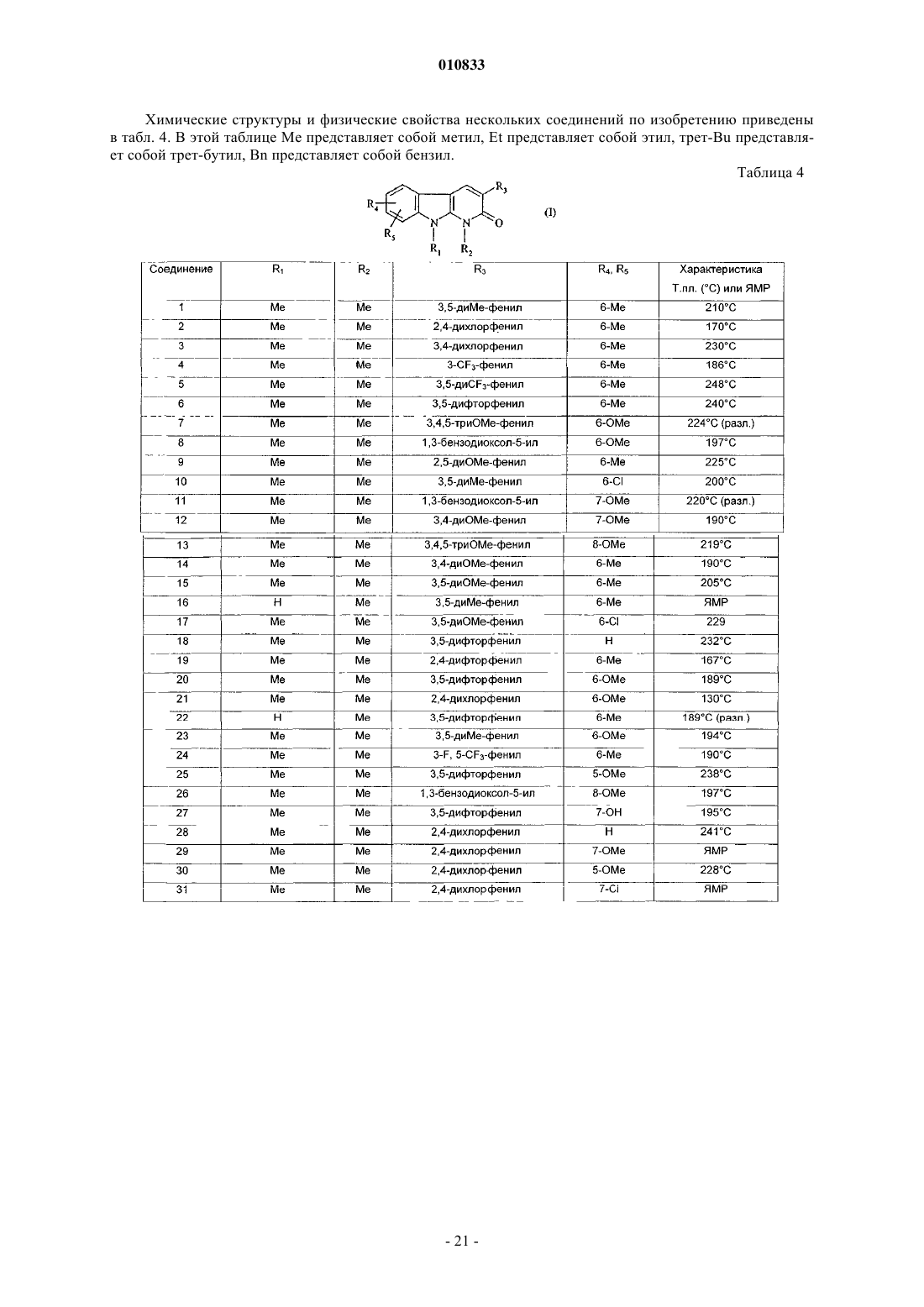
3. Соединение формулы (I) по п.1, выбранное из
3-(2,4-диметоксифенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-карбоновой кислоты;
3-(2,4-диметоксифенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
3-(3-гидроксиметилфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
3-(2,4-дихлорфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
3-(1,6-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-3-ил)бензонитрила;
3-(4-аминофенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
3-(6-хлор-1,3-бензодиоксол-5-ил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
1,6-диметил-1,9-дигидро-3-(фениламинофенил)-2H-пиридо[2,3-b]индол-2-она;
6-бром-3-(3,5-диметилфенил)-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
1,6-диметил-3-(3-(трифторметил)фенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
1,6-диметил-3-(3-(пиридин-2-иламино)фенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
1,6-диметил-3-(3-(пиримидин-2-иламино)фенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
3-(3-ацетилфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
2-(2,4-дихлорфенил)-9-метил-5,6-дигидро-3H,4H-3а,6а-диазафлуорантен-3-она;
метил-9-(цианометил)-3-(2,4-дихлорфенил)-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-карбоксилата;
в форме основания или в форме соли присоединения кислоты и в форме гидрата или сольвата.
4. Способ получения соединения формулы (I) по одному из пп.1-3, отличающийся тем, что
2-аминоиндол формулы
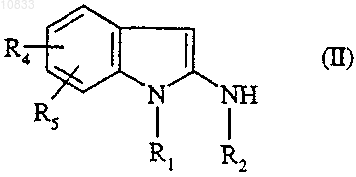
где R1, R2, R4 и R5 являются такими, как определено для соединения формулы (I),
подвергают взаимодействию со сложным эфиром формулы
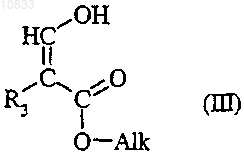
где R3 является таким, как определено для соединения формулы (I), и Alk представляет собой
C1-C4алкил.
5. Способ получения соединения формулы (I) по одному из пп.1-3, отличающийся тем, что аминоиндол формулы
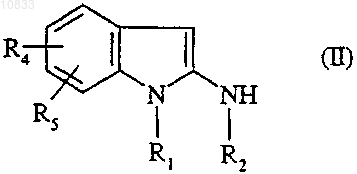
где R1, R2, R4 и R5 являются такими, как определено для соединения формулы (I),
подвергают взаимодействию со сложным эфиром формулы
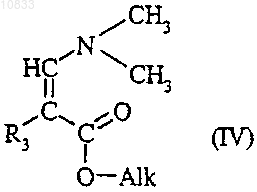
где R3 является таким, как определено для соединения формулы (I), и Alk представляет собой
C1-C4алкил.
6. Лекарство, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-3, или соль присоединения фармацевтически приемлемой кислоты к этому соединению, или также гидрат или сольват соединения формулы (I).
7. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-3 или фармацевтически приемлемую соль, гидрат или сольват этого соединения и по меньшей мере один фармацевтически приемлемый эксципиент.
8. Применение соединения формулы (I) по любому из пп.1-3 для изготовления лекарства, предназначенного для лечения и предупреждения заболеваний, вызванных или осложненных пролиферацией опухолевых клеток.
Текст
010833 Настоящее изобретение относится к производным пиридоиндолона, замещенным по положению 3 фенилом, к их получению и применению в терапии. В патенте Франции 9708409 описаны соединения формулы где x представляет собой атом водорода или хлора либо метильную или метоксигруппу;r1 представляет собой атом водорода либо метильную или этильную группу;r2 представляет собой метильную или этильную группу илиr1 и r2 вместе образуют группу (CH2)3;r3 представляет собой либо, с одной стороны, фенильную группу, возможно замещенную атомом галогена или метильной или метоксигруппой, либо, с другой стороны, тиенильную группу. В описании этого патента упомянуто, что соединения формулы (A), обладающие аффинностью по отношению к омега-модуляторным сайтам, связанным с GABAA-рецепторами (рецепторами гаммааминомасляной кислоты типа А), можно применять в лечении состояний, относящихся к расстройствамGABA-ергической передачи, связанных с подтипами GABAA-рецепторов, таких как тревога, расстройства сна, эпилепсия и подобные. Объектом настоящего изобретения являются соединения, обладающие противораковой активностью, соответствующие формуле где R1 представляет собой атом водорода, (C1-C4)алкильную группу или группу (CH2)nOH,(CH2)n-O-тетрагидропиран-2-ил, (CH2)nNR'6R'7, (CH2)nCN, (CH2)nCO2(C1-C4)alk или (CH2)nCONR6R7;R2 представляет собой атом водорода или (C1-C4)алкильную группу илиR1 и R2 вместе образуют группу (CH2)3;R3 представляет собой фенил, монозамещенный гидроксильной, гидроксиметильной, карбоксильной, (C1-C4)алканоильной, азидо, (C1-C4)алкоксикарбонильной, гидроксииминометильной, (C1-C4)алкилсульфонильной, трифторметильной, тиольной, (C1-C4)алкилтио или цианогруппой или группой(CH2)mNR'7R10, CONR6R8 или O(CH2)nR9; фенил, замещенный одинаковыми или разными заместителями в количестве от 2 до 5, выбранными из атома галогена, (C1-C4)алкильной, трифторметильной,гидроксильной, гидроксиметильной, (C1-C4)алкокси, карбоксильной, (C1-C4)алканоильной, азидо,(C1-C4)алкоксикарбонильной,гидроксииминометильной,тиольной,(C1-C4)алкилтио илиR3 представляет собой бензодиоксолильную группу, которая не замещена или замещена в фенильной части атомом галогена;R4 и R5 одинаковые или разные и каждый независимо представляет собой атом водорода или галогена, или гидроксильную, (C1-C4)алкильную, трифторметильную, фенильную, циано, (C1-C4)алкокси,(C1-C4)алкоксикарбонильную или (C1-C4)алкилсульфонильную группу или группу O-(CH2)nNR6R7 илиR6 представляет собой водород или (C1-C4)алкильную группу;R7 представляет собой водород или (C1-C4)алкильную группу илиR'6 представляет собой водород или (C1-C4)алкильную группу;R'7 представляет собой водород или (C1-C4)алкильную группу илиR'6 и R'7 вместе с атомом азота, с которым они связаны, образуют гетероциклический радикал, выбранный из морфолинила или пирролидинила;R8 представляет собой водород, (C1-C4)алкильную группу или группу -(CH2)nNR6R7 илиR9 представляет собой фенильный радикал либо амино, морфолин-4-ил, циано илиR10 представляет собой R'6 или фенильную, пиридильную или пиримидинильную группу, или группу (CH2)nNR'6R'7 илиR'7 и R10 вместе с атомом азота, с которым они связаны, образуют гетероциклический радикал, выбранный из пиперазинила или 4-метилпиперазин-2-ила;Alk представляет собой алкил. Соединения формулы (I) могут существовать в форме оснований или солей присоединения кислот. Такие соли присоединения кислот являются частью данного изобретения. Такие соли преимущественно получают с фармацевтически приемлемыми кислотами, но соли других полезных кислот, например, для очистки или выделения соединений формулы (I) также являются частью данного изобретения. Соединения формулы (I) также могут существовать в форме гидратов или сольватов, а именно в форме ассоциаций или комбинаций с одной или более молекулами воды или с растворителем. Такие гидраты и сольваты также являются частью данного изобретения. В контексте настоящего изобретения подразумевается следующее: атом галогена означает: фтор, хлор, бром или йод;(C1-C4)алкильная группа означает насыщенную, линейную или разветвленную, алифатическую группу, содержащую от 1 до 4 атомов углерода. В качестве примера могут быть упомянуты метильная,этильная, пропильная, изобутильная, бутильная, изобутильная и трет-бутильная группы;(C1-C4)алкоксигруппа означает радикал O-алкил, где алкильная группа является такой, как определено выше. Конкретно, объектом настоящего изобретения являются соединения формулы (I), гдеR1 представляет собой атом водорода, (C1-C4)алкильную группу либо группу (CH2)nCO2(C1-C4)alk или (CH2)nCONR6R7;R2 представляет собой атом водорода или (C1-C4)алкильную группу;R3 представляет собой фенил, монозамещенный гидроксильной, гидроксиметильной, карбоксильной, (C1-C4)алкоксикарбонильной, гидроксииминометильной, (C1-C4)алкилсульфонильной, трифторметильной, тиольной, (C1-C4)алкилтио или цианогруппой либо группой (CH2)mNR6R7 или CONR6R8; фенил,замещенный одинаковыми или различными заместителями в количестве от 2 до 5, выбранными из атома галогена или (C1-C4)алкильной, трифторметильной, гидроксильной, гидроксиметильной, (C1-C4)алкокси,карбоксильной, (C1-C4)алкоксикарбонильной, гидроксииминометильной, тиольной, (C1-C4)алкилтио,(C1-C4)алкилсульфонильной или цианогруппы, либо группы (CH2)mNR6R7 или CONR6R8; или R3 представляет собой бензодиоксолильную группу;R4 и R5 являются одинаковыми или разными и каждый независимо представляет собой атом водорода или галогена или гидроксильную, (C1-C4)алкильную, трифторметильную, циано, (C1-C4)алкокси или(C1-C4)алкоксикарбонильную группу или группу O-(CH2)nNR6R7;R6 представляет собой водород или (C1-C4)алкильную группу;R7 представляет собой водород или (C1-C4)алкильную группу илиR8 представляет собой водород, (C1-C4)алкильную группу или группу -(CH2)nNR6R7 илиalk представляет собой алкил. Среди соединений формулы (I), являющихся объектами изобретения, можно упомянуть предпочтительные соединения, которые определяются следующим образом:R1 представляет собой атом водорода или метильную, цианометильную, (C1-C4)алкоксикарбонилметильную, аминометильную, аминоэтильную, аминопропильную или пирролидиноэтильную группу; и/илиR2 представляет собой метильную группу; и/илиR1 и R2 вместе образуют группу (CH2)3; и/илиR3 представляет собой фенил, монозамещенный гидроксильной, (C1-C4)алкоксикарбонильной, метилсульфонильной, трифторметильной, метилтио, цианометокси, аминоэтокси, ацетильной, гидроксиметильной, циано, амино, азидо, аминометильной или гидроксииминометильной группой или группой(CH2)mNR'7R10, где R'7 представляет собой атом водорода или метил, R10 представляет собой атом водорода или фенильную, пиридильную или пиримидинильную группу, или R'7 и R10 вместе с атомом азота, с которым они связаны, образуют пиперазин-1-ильную или 4-метилпиперазин-1-ильную группу и m равно 0 или 1; илиR3 представляет собой фенил, замещенный двумя или тремя одинаковыми или разными заместителями, выбранными из атома галогена, метильной, метокси, метилтио, трифторметильной, гидроксильной, (C1-C4)алкоксикарбонильной, метилсульфонильной, цианометокси, аминоэтокси, ацетильной, гидроксиметильной, циано, амино, азидо, аминометильной или гидроксииминометильной группы или группы (CH2)mNR'7R10, где R'7 представляет собой атом водорода или метил, R10 представляет собой атом водорода или фенильную, пиридильную или пиримидинильную группу, или R'7 и R10 вместе с атомом азо-2 010833 та, с которым они связаны, образуют пиперазин-1-ильную или 4-метилпиперазин-1-ильную группу, и m равно 0 или 1; илиR3 представляет собой бензодиоксолильную группу, которая является незамещенной или замещенной в фенильной части атомом галогена; и/илиR4 представляет собой атом галогена или метильную, метокси или (C1-C4)алкоксикарбонильную группу; и/илиR5 представляет собой атом водорода или метильную группу. Особенно предпочтение отдается следующим соединениям: 3-(2,4-диметоксифенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-карбоновой кислоте; 3-(2,4-диметоксифенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-ону; 3-(3-гидроксиметилфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-ону; 3-(2,4-дихлорфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-ону; 3-(1,6-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-3-ил)бензонитрилу; 3-(4-аминофенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-ону; 3-(6-хлор-1,3-бензодиоксол-5-ил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-ону; 1,6-диметил-1,9-дигидро-3-(фениламинофенил)-2H-пиридо[2,3-b]индол-2-ону; 6-бром-3-(3,5-диметилфенил)-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-ону; 1,6-диметил-3-(3-(трифторметил)фенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-ону; 1,6-диметил-3-(3-(пиридин-2-иламино)фенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-ону; 1,6-диметил-3-(3-(пиримидин-2-иламино)фенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-ону; 3-(3-ацетилфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-ону; 2-(2,4-дихлорфенил)-9-метил-5,6-дигидро-3H,4H-3 а,6 а-диазафлуорантен-3-ону; метил-9-(цианометил)-3-(2,4-дихлорфенил)-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6 карбоксилату и их солям присоединения, их сольватам и их гидратам. Ниже подразумевается, что защитная группа Gp или G'p означает группу, которая дает возможность, во-первых, защитить реакционноспособную функциональную группу, такую как гидроксил или амин, во время синтеза и, во-вторых, в конце синтеза восстановить реакционноспособную функциональную группу в исходном виде. Примеры защитных групп и способы защиты и удаления защиты приведены в "Protective Groups in Organic Synthesis", Green et al., 2nd Edition John WileySons Inc., New York). Ниже под термином "уходящая группа" подразумевается группа, которая легко отщепляется от молекулы путем разрыва гетеролитической связи с уходом электронной пары. Таким образом, эту группу можно легко заменить другой группой, например, во время реакции замещения. Такими уходящими группами являются, например, галогены или активированная гидроксильная группа, такая как мезильная,тозильная, трифлатная, ацетильная и подобные. Примеры уходящих групп и ссылки на их получение приведены в "Advances in Organic Chemistry", J. March, 3rd Edition, Wiley Interscience, p. 310-316. В соответствии с данным изобретением соединения общей формулы (I) могут быть получены следующим ниже способом. Данный способ отличается тем, что 2-аминоиндол формулы где R1, R2, R4 и R5 являются такими, как определено для соединения формулы (I),подвергают взаимодействию со сложным эфиром формулы где R3 является таким, как определено для соединения формулы (I), и Alk представляет собойC1-C4 алкил. Реакцию проводят в полярном и предпочтительно основном растворителе, например в пиридине,при температуре от температуры окружающей среды до температуры дефлегмации растворителя. Обычно также является возможным получение, в соответствии со способом по изобретению, соединения формулы-3 010833 где заместители R'1, R'2, R'3, R'4 и R'5 являются предшественниками заместителей R1, R2, R3, R4 и R5,как они определены для соединения формулы (I), и затем, используя способы, известные специалистам в данной области техники, преобразовать эти заместители с целью получения заместителей R1, R2, R3, R4 иR5, нужных для соединения формулы (I). Соединение формулы (I), где R1 и/или R2 представляют собой алкильную группу, получают из соединения формулы (I), где R1 или R2 представляет собой водород, воздействуя алкилйодидом в присутствии NaH. Соединения формулы (I), где заместитель R1 представляет собой группу -(CH2)nCO2(C1-C4)alk или-(CH2)nCONR6R7, получают из соответствующих соединений формулы (I)', где R1=H, a R2, R3, R4 и R5 имеют те же значения. Например, соединение формулы (I), где R1=H, может быть замещено группой (CH2)CN путем взаимодействия с соединением формулы Br(CH2)nCN в присутствии гидрида натрия. Кроме того, для получения соединения формулы (I), где R1 представляет собой группу(CH2)nNR'6R'7, бромированное соединение формулы Br(CH2)nNR'6R'7 можно подвергать взаимодействию с соединением формулы (I), где R1=H. В более общем случае, для получения соединения формулы (I), где R1 представляет собой группу(CH2)nNR'6R'7, соединение формулы X(CH2)nNGp, где X представляет собой уходящую группу, такую как, например, атом брома или мезильная или тозильная группа, и Gp представляет собой защитную группу для атома азота, можно подвергать взаимодействию с соединением формулы (I), где R1=H; после снятия защиты с атома азота можно, когда это приемлемо, алкилировать образовавшийся амин, используя способы, известные специалисту в данной области техники. Для получения соединения формулы (I), где R1 представляет собой группу (CH2)nOH, соединение формулы X(CH2)nO-G'p, где X представляет собой уходящую группу и G'p представляет собой защитную группу для атома кислорода, можно подвергать взаимодействию с соединением формулы (I), где R1=H, и затем полученное таким образом соединение для удаления защитной группы можно обработать способами, известными специалисту в данной области техники. Для получения соединения формулы (I), где заместители R3 и/или R4, и/или R5 содержат гидроксиметильную, гидроксииминометильную, алкиламинометильную или диалкиламинометильную группу,соответствующее соединение формулы (I), имеющее заместитель R3 и/или R4, и/или R5, содержащий цианогруппу, превращают способами, известными специалисту в данной области техники. Для получения соединения формулы (I), где заместители R3 и/или R4, и/или R5 содержат гидроксильную группу, можно получить сначала аналогичное соединение формулы (I), где заместители R3 и/или R4, и/или R5 содержат защищенную гидроксильную группу, и затем, на следующей стадии, превратить эту группу в гидроксильную способами, известными квалифицированному специалисту. В качестве защитной группы для гидроксила можно использовать, например, бензил, бензоил или (C1-C4)алкил. Соединения формулы (I), где R4 и/или R5 представляют собой атом Br или заместитель(и) в фенильной группе R3 представляет(ют) собой один (или несколько) атом(ов) брома, можно использовать в качестве предшественников для получения других соединений по изобретению, например соединений,имеющих аминные заместители, такие как (CH2)nNR6R7 или (CH2)mNR'7R10, с использованием реакций,известных специалисту в данной области техники. Соединения, имеющие бромированный заместитель, также используют для получения соединений,имеющих алкоксикарбонильный заместитель. Аминоиндолы формулы (II) могут быть получены способами, подобными описанным в Khim.Ther., 1992, 27. (9), 908-918; Chem. Heterocycl. Compd. (Engl. Transl.), 1970, 6, 338-343; Tetrahedron, 1971,27, 775-785; Pharm. Chem. J. (Engl. Transl.), 1990, 24 (11), 810-812; Tetrahedron Lett., 1996, 37 (28), 49314932. Некоторые сложные эфиры формулы (III) известны и могут быть получены способами, подобными описанным в J. Org. Chem., 1984, 49 (22), 4287-4290; J. Am. Chem. Soc., 1974, 96 (7), 2121; Tetrahedron,1970, 26 (2), 715-719; Synth. Commun., 2000, 30 (8), 1401-1411; Zhongguo Yaowu Huaxue Zazhi, 2000, 10(1), 9-12, 25; JP 19680131, EP 260832, EP 178826, WO 97-46577, DE 3221915. Соединения по изобретению также могут быть получены способом, отличающимся тем, что аминоиндол формулы где R1, R2, R4 и R5 являются такими, как определено для соединения формулы (I),-4 010833 подвергают взаимодействию со сложным эфиром формулы где R3 является таким, как определено для соединения формулы (I) и Alk представляет собойC1-C4 алкил. Реакцию проводят в протонном и полярном растворителе, предпочтительно в кислой среде, при температуре от температуры окружающей среды до температуры дефлегмации растворителя. Соединение формулы (IV) получают, используя диметокси-N,N-диметилметанамин (V), способом,аналогичным описанному в J. Org. Chenm., 1982, 47, 2846-2851, или используя реагент Бредерека (третбутокси-бис-(диметиламино)метан) в соответствии с J. Org. Chem., 1982, 15, 2846-2851 и в соответствии со следующей схемой реакций: Если не указано иного, спектры протонного ядерного магнитного резонанса (ЯМР) регистрируют вd6-DMSO; стандарт помещают в d6-DMSO, сигнал которого находится в 2,50 м.д. (миллионных долях) относительно тетраметилсилана. Сигналы, наблюдаемые при ЯМР-спектроскопии, отображают следующим образом:mt: мультиплет. Получение некоторых соединений в соответствии с изобретением описано в следующих примерах. Эти примеры не являются ограничивающими и служат только для иллюстрации настоящего изобретения. Номера соединений в примерах соответствуют номерам в табл. 1, в которой показаны химические структуры и физические свойства некоторых соединений по изобретению. В подготовительных примерах и примерах, которые приведены ниже, используются следующие сокращения:-5 010833 Получение соединений формулы (II) Соединения формулы (II) могут существовать в двух таутомерных формах Подготовительный пример 1.1. N,1,5-Триметил-1H-индол-2-амина гидрохлорид. А) N'-(4-Метилфенил)ацетогидразид. 104,8 г 1-(4-метилфенил)гидразина гидрохлорида суспендируют в 525 мл изопропилацетата, добавляют раствор 104,8 г карбоната калия в 300 мл воды и затем смесь перемешивают до исчезновения твердого вещества. Добавляют 77,4 г уксусного ангидрида, поддерживая температуру ниже 20C и затем смесь оставляют перемешиваться при 20C. Наблюдается образование осадка, который исчезает, когда смесь нагревают приблизительно при 55-60C. Органическую фазу промывают два раза 200 мл воды и затем охлаждают при 0-5C в течение ночи. Образовавшийся продукт отделяют фильтрацией и затем два раза промывают 100 мл MTBE. ЯМР CDCl3 (300 МГц): 2,02 м.д. (s, 3H); 2,29 м.д. (s, 3H); 6,14 м.д. (d, 1H); 6,73 м.д. (d, 2H); 7,03 м.д.(d, 2H); 7,72 м.д. (s, 1H). Б) N,N'-Диметил-N'-(4-метилфенил)ацетогидразин. 60 г гидразина с предыдущей стадии и 11,8 г тетрабутиламмония бромида суспендируют в 240 мл толуола и добавляют 292 г 50%-ного раствора NaOH в воде, а затем 155,6 г метилйодида. Затем добавляют 83 г гранулированного гидроксида натрия, после чего нагревают реакционную среду при 80C в течение 6 ч. Смесь охлаждают до 30-35C и затем добавляют 500 мл воды. Органическую фазу три раза промывают 100 мл воды. Органическую фазу сушат азеотропной перегонкой воды при пониженном давлении. ЯМР CDCl3 (300 МГц): 2,15 м.д. (s, 3H); 2,31 м.д. (s, 3H); 2,95 м.д. (s, 3H); 3,10 м.д. (s, 3H); 6,63 м.д.B) N,1,5-Триметил-1H-индол-2-амина гидрохлорид. Продукт, полученный на предыдущей стадии, растворяют в толуопе, добавляют 61,5 г оксихлорида фосфора и смесь нагревают при 80C в течение 2 ч. При 80C добавляют 100 мл этилацетата и затем среду охлаждают до температуры окружающей среды. Осадок отфильтровывают и затем два раза промывают 50 мл этилацетата, т.пл. (температура плавления)=222C. ЯМР d6-DMSO (200 МГц): 2,36 м.д. (s, 3H); 3,11 м.д. (s, 3H); 3,49 м.д. (s, 3H); 4,29 м.д. (s, 1H); 7,257,35 м.д. (неразрешенный пик, 3H); 10,07 м.д. (неразрешенный пик, 1H). Подготовительный пример 1.2. N,5-Диметил-1H-индол-2-амина дигидрохлорид. А) N'-(4-Метилфенил)ацетогидразид. Другой способ получения данного соединения описан ниже. 5 г 1-(4-метилфенил)гидразина гидрохлорида растворяют в воде и затем добавляют триэтиламин до нейтрализации соли. Проводят экстракцию AcOEt и затем экстракт упаривают до сухого состояния. Образовавшийся осадок растворяют в 30 мл эфира и затем по каплям добавляют раствор 4,6 мл уксусного ангидрида в 30 мл эфира. Смесь перемешивают при 0C в течение 15 мин и затем отфильтровывают образовавшийся осадок с получением 3 г ожидаемого соединения. ЯМР CDCl3 (300 МГц): 2,02 м.д. (s, 3H); 2,29 м.д. (s, 3H); 6,14 м.д. (d, 1H); 6,73 м.д. (d, 2H); 7,03 м.д.(d, 2H); 7,72 м.д. (s, 1H). Б) N-Метил-N'-(4-метилфенил)ацетогидразид. 0,8 г 60%-ного NaH суспендируют в 30 мл DMF. По каплям при 0C добавляют 3,2 г гидразина, полученного на предыдущей стадии, в 20 мл DMF. После прекращения выделения газа добавляют 1,8 мл метилйодида и смесь перемешивают при температуре окружающей среды в течение 1 ч. Смесь вливают в насыщенный раствор NH4Cl и затем проводят экстракцию AcOEt. Несколько раз промывают насыщенным раствором NaCl и затем упаривают до сухого состояния. Остаток очищают хроматографией на колонке с диоксидом кремния, элюируя смесью AcOEt/гептан (25/75; об./об.), затем (50/50; об./об.) с получением 1,0 г ожидаемого соединения в виде белого порошка. ЯМР CDCl3 (200 МГц): 2,21 м.д. (s, 3H); 2,32 м.д. (s, 3H); 3,15 м.д. (s, 3H); 5,88 м.д. (s, 1H); 6,64 м.д.(d, 2H); 7,12 м.д. (d, 2H). В) N,5-Диметил-1H-индол-2-амина дигидрохлорид. 1 г соединения с предыдущей стадии растворяют в 20 мл POCl3 и затем смесь нагревают при 100C в течение 2 ч. Реакционную смесь охлаждают и затем добавляют эфир. Образовавшийся осадок отфильтровывают и промывают эфиром с получением 1,3 г ожидаемого соединения. ЯМР d6-DMSO (300 МГц): 2,31 м.д. (s, 3H); 3,05 м.д. (s, 3H); 4,14 м.д. (s, 2H); 7,07-7,23 м.д. (неразрешенный пик, 3H); 10,51 м.д. (s, 1H); 12,37 м.д. (d, 1H).-6 010833 Подготовительный пример 1.3. N,1-Диметил-5-метокси-1H-индол-2-амина гидрохлорид. А) N'-(4-Метоксифенил)ацетогидразид. 10 г 4-метоксифенилгидразина гидрохлорида растворяют в воде и затем добавляют триэтиламин до нейтрализации соли. Проводят экстракцию AcOEt и затем экстракт упаривают до сухого состояния с получением 8 г осадка, состоящего из 4-метоксифенилгидразина. Это соединение растворяют в 30 мл эфира и затем по каплям добавляют раствор 13 мл уксусного ангидрида в 30 мл эфира. Смесь перемешивают при 0C в течение 15 мин и затем образовавшийся осадок отфильтровывают с получением 7,4 г ожидаемого соединения. ЯМР CDCl3 (200 МГц): 2,06 м.д. (s, 3H); 3,75 м.д. (s, 3H); 5,65 и 6,03 м.д. (2s: 2H); 6,6-6,9 м.д. (неразрешенный пик, 4H). Б) N,N'-Диметил-N'-(4-метоксифенил)ацетогидразид. 4,3 г 60%-ного NaH суспендируют в 30 мл DMA. По каплям добавляют 7,4 г соединения с предыдущей стадии, растворенного в 20 мл DMA. После прекращения выделения газа добавляют 10,0 мл йодметана. Смесь перемешивают при температуре окружающей среды в течение 1 ч. Смесь вливают в насыщенный раствор NH4Cl и затем проводят экстракцию AcOEt. Органическую фазу несколько раз промывают насыщенным раствором NaCl и затем упаривают до сухого состояния. Полученный остаток растирают в петролейном эфире с получением 8,0 г ожидаемого соединения в виде масла. ЯМР CDCl3 (200 МГц): 2,19 м.д. (s, 3H); 2,93 м.д. (s, 3H); 3,08 м.д. (s, 3H); 3,80 м.д. (s, 3H); 6,68 м.д.(d, 2H); 6,89 м.д. (d, 2H). В) N,1-Диметил-5-метокси-1H-индол-2-амина гидрохлорид. 8,0 г соединения с предыдущей стадии растворяют в 30 мл POCl3 и затем смесь нагревают при 80C в течение 2 ч. Реакционную смесь охлаждают и затем добавляют эфир. Образовавшийся коричневый осадок отфильтровывают и промывают эфиром с получением 5,3 г ожидаемого соединения, т.пл.=222C. ЯМР d6-DMSO (300 МГц): 3,06 м.д. (s, 3H); 3,48 м.д. (s, 3H); 3,76 м.д. (s, 3H); 4,26 м.д. (s, 2H); 6,967,00 м.д. (dd, 1H); 7,14 м.д. (d, 1H); 7,24 м.д. (d, 1H); 10,08 м.д. (s, 1H). Подготовительный пример 1.4. N,1-Диметил-5-хлор-1H-индол-2-амина гидрохлорид. А) N'-(4-Хлорфенил)ацетогидразид. 12,5 г 4-хлорфенилгидразина гидрохлорида растворяют в 100 мл воды и затем добавляют триэтиламин до нейтрализации соли. Проводят экстракцию AcOEt и затем экстракт упаривают до сухого состояния. Основание растворяют в 100 мл эфира, раствор охлаждают до 0C и затем по каплям добавляют 15 мл уксусного ангидрида. Смесь перемешивают при 0C в течение 15 мин. Образовавшийся белый осадок отфильтровывают и затем промывают эфиром с получением 12,8 г ожидаемого соединения в виде белого порошка. ЯМР CDCl3 (200 МГц): 2,09 м.д. (s, 3H); 6,68-6,86 м.д. (неразрешенный пик, 2H); 7,12-7,30 м.д. (неразрешенный пик, 2H). Б) N,N'-Диметил-N'-(4-хлорфенил)ацетогидразид. 7,2 г 60%-ного NaH суспендируют в 30 мл DMA. По каплям добавляют 12,8 г гидразина с предыдущей стадии, растворенного в 50 мл DMA, и смесь перемешивают при температуре окружающей среды до прекращения выделения газа. Добавляют 17 мл йодметана и смесь перемешивают при температуре окружающей среды в течение 1 ч. Смесь вливают в насыщенный раствор NH4Cl и затем проводят экстракцию AcOEt. Органическую фазу промывают насыщенным раствором NaCl. Полученный остаток растирают с петролейным эфиром с получением 10 г ожидаемого соединения в кристаллической форме. ЯМР CDCl3 (200 МГц): 2,10 м.д. (s, 3H); 2,95 м.д. (s, 3H); 3,10 м.д. (s, 3H); 6,62 м.д. (d, 2H); 7,24 м.д.(d, 2H). В) N,1-Диметил-5-хлор-1H-индол-2-амина гидрохлорид. 10 г соединения с предыдущей стадии растворяют в 50 мл POCl3. Смесь нагревают с обратным холодильником в течение 2 ч. Реакционную среду охлаждают, добавляют эфир и затем полученный продукт отфильтровывают Осадок несколько раз промывают эфиром с получением 9,6 г ожидаемого соединения в виде порошка. ЯМР d6-DMSO (300 МГц): 3,08 м.д. (s, 3H); 3,52 м.д. (s, 3H); 4,31 м.д. (s, 2H); 7,34 м.д. (d, 1H); 7,48 м.д. (d, 1H); 7,60 м.д. (s, 1H); 10,61 м.д. (s, 1H). Подготовительный пример 1.5. Метил-1-метил-2-(метиламино)-1H-индол-5-карбоксилат.A) Метил-4-(2-ацетилгидразино)бензоат. 5,5 г метил-4-гидразинобензоата растворяют в 38,2 мл AcOH, содержащей 2,4 г ацетата натрия, и смесь нагревают при 80C в течение 18 ч. Неорганическое вещество отфильтровывают, затем фильтрат упаривают и остаток переносят в минимальное количество Et2O. Смесь фильтруют с получением 7,97 г ожидаемого соединения. Б) Метил-4-(2-ацетил-1,2-диметилгидразино)бензоат. 2,95 г 95%-ного NaH суспендируют в 90 мл DMF, по каплям добавляют 8,135 г соединения с предыдущей стадии, растворенного в минимальном количестве DMF, и затем через несколько минут по каплям добавляют 9,75 мл метилйодида. Смесь перемешивают при температуре окружающей среды в тече-7 010833 ние 1 ч. Среду вливают в насыщенный раствор NH4Cl и проводят экстракцию AcOEt. Органическую фазу промывают NaCl, сушат и упаривают с получением 5,4 г ожидаемого соединения.B) Метил-1-метил-2-(метиламино)-1H-индол-5-карбоксилат. Перемешивают 5,4 г соединения с предыдущей стадии и 62 мл оксихлорида фосфора и смесь нагревают при 80C в течение 2,5 ч. Среду упаривают и остаток переносят в AcOEt. Образовавшееся твердое вещество отфильтровывают, промывают AcOEt и сушат с получением 4 г ожидаемого соединения. ЯМР MeOD (250 МГц): 3,2 м.д. (s, 3H); 3,6 м.д. (s, 3H); 3,9 м.д. (s, 3H); 7,3-7,4 м.д. (неразрешенный пик, 2H); 8,1-8,2 м.д. (неразрешенный пик, 2H). Соединения формулы (II), объединенные в табл. 1, получают в соответствии с описанным выше. Таблица 1 ЯМР 1,13 d6-DMSO (300 МГц): 3,08 м.д. (d, 3H); 3,52 м.д. (s, 3H); 7,34 м.д. (d, 1H); 7,48 м.д. (d, 1H); 7,60 м.д. (s, 1H); 10,61 м.д. (s, 1H). Подготовительный пример 1.17. Этил-2-(метилимино)индолин-5-карбоксилата гидрохлорид. А) Этил-4-гидразинобензоат. 5,0 г 4-фенилгидразиновой кислоты растворяют в 70 мл этанола и 3 мл концентрированной H2SO4. Смесь нагревают с обратным холодильником в течение 5 ч, этанол выпаривают, остаток затем переносят в насыщенный раствор K2CO3, после чего проводят экстракцию AcOEt. Получают 5,9 г ожидаемого соединения в виде порошка. ЯМР CDCl3 (300 МГц): 1,38 м.д. (t, 3H); 3,65 м.д. (s, 2H); 4,34 м.д. (q: 2H); 5,57 м.д. (s, 1H); 6,80 м.д.(d, 2H); 7,93 м.д. (d, 2H). Б) Этил-4-(N'-ацетилгидразино)бензоат. 5,9 г соединения с предыдущей стадии растворяют в 50 мл уксусной кислоты и добавляют 3,0 г ацетата натрия. Смесь нагревают при 80C в течение 16 ч. Уксусную кислоту выпаривают, остаток переносят в воду и затем проводят экстракцию CH2Cl2. Органическую фазу сушат над MgSO4 и затем упаривают до сухого состояния. Получают 4,2 г порошка. ЯМР CDCl3 (300 МГц): 1,36 м.д. (t, 3H); 2,04 м.д. (s, 3H); 4,32 м.д. (q, 2H); 6,63 м.д. (s, 1H); 6,73 м.д.(d, J=8,8, 2H); 7,88 м.д. (d, 2H); 8,00 м.д. (s, 1H). В) Этил-4-(N'-ацетил-N'-метилгидразино)бензоат. 0,72 г 60%-ного NaH суспендируют в 20 мл DMF. Смесь охлаждают до 0C и затем добавляют 4,0 г соединения с предыдущей стадии, растворенного в 20 мл DMA. Смесь перемешивают при 0C в течение 15 мин, затем добавляют 1,7 мл йодметана и смесь перемешивают при 0C в течение 30 мин. Смесь вливают в насыщенный раствор NH4Cl и экстрагируют AcOEt. Органическую фазу промывают насыщенным раствором NaCl, сушат над MgSO4 и затем адсорбируют на диоксид кремния. Очистку осуществляют хроматографией на колонке с диоксидом кремния, элюируя смесью AcOEt/петролейный эфир (об./об.; 50/50). Получают 1,8 г масла. ЯМР CDCl3 (300 МГц): 1,38 м.д. (t, 3H); 2,15 м.д. (s, 3H); 3,17 м.д. (s, 3H); 4,35 м.д. (q, J=7,1, 2H); 6,10 м.д. (s, 1H); 6,71 м.д. (d, J=8,8, 2H); 7,99 м.д. (d, 2H).-8 010833 Г) Этил-2-(метилимино)индолин-5-карбоксилата гидрохлорид. 1,5 г соединения с предыдущей стадии растворяют в 10 мл POCl3. Смесь нагревают при 80C в течение 2 ч. Реакционную среду охлаждают, добавляют эфир и образовавшийся осадок растирают и отфильтровывают. Его промывают эфиром. Получают 1,4 г порошка. ЯМР CDCl3 (300 МГц): 1,31 м.д. (t, J=7,1, 3H); 3,07 м.д. (d, J=4,7, 3H); 4,25 м.д. (s, 2H); 4,31 м.д. (q,2H); 7,58 м.д. (d, J=8,8, 1H); 7,99 м.д. (неразрешенный пик, 2H); 10,97 м.д. (s, 1H); 12,81 м.д. (s, 1H). Подготовительный пример 1.18. 5-Бром-N-метил-1H-индол-2-амина гидрохлорид.A) N'-(4-Бромфенил)формогидразид. 10,0 г 4-бромфенилгидразина гидрохлорида растворяют в 30 мл воды. Добавляют 6,2 г K2CO3 и 36 мл метилфомиата и затем смесь нагревают с обратным холодильником в течение 1 ч, а потом при температуре окружающей среды в течение 12 ч. Образовавшийся осадок отфильтровывают и промывают смесью изопропанол/петролейный эфир (об./об.; 50/50). Получают 10,5 г ожидаемого продукта. ЯМР CDCl3 (300 МГц): 6,73-6,77 м.д. (неразрешенный пик, 2H); 7,34-7,41 м.д. (неразрешенный пик,2H); 8,33 м.д. (неразрешенный пик, 1H). Б) N'-(4-Бромфенил)-N-метилацетогидразид. Раствор 80 мл LAH в THF нагревают до температуры дефлегмации. Добавляют 10,5 г соединения с предыдущей стадии в виде суспензии в 60 мл THF. Смесь нагревают с обратным холодильником в течение 15 ч. Реакционную среду охлаждают и затем по каплям добавляют 2,3 мл воды, затем 9,0 мл 1 н.NaOH, а затем снова 10 мл H2O. Соли отфильтровывают через Celite, промывают AcOEt и затем упаривают до сухого состояния. Остаток переносят в 80 мл AcOEt, затем добавляют 17 г K2CO3, растворенного в 80 мл воды, а потом 4,0 мл уксусного ангидрида. Смесь перемешивают при температуре окружающей среды в течение 1 ч. Две фазы разделяют и органическую фазу сушат над MgSO4 и затем упаривают до сухого состояния. Добавляют петролейный эфир и затем отфильтровывают образовавшиеся кристаллы. Получают 9,0 г ожидаемого продукта. ЯМР CDCl3 (300 МГц): 2,15 м.д. (s, 3H); 3,13 м.д. (s, 3H); 6,57-6,62 м.д. (неразрешенный пик, 2H); 7,32-7,40 м.д. (неразрешенный пик, 2H).B) 5-Бром-N-метил-1H-индол-2-амина гидрохлорид. 9,0 г гидразина, полученного на предыдущей стадии, растворяют в 50 мл POCl3 и затем смесь нагревают при 80C в течение 2 ч. Реакционную среду охлаждают и затем добавляют эфир. Образовавшийся осадок отфильтровывают и промывают эфиром. Получают 8,2 г порошка. ЯМР CDCl3 (300 МГц): 4,31 м.д. (s, 3H); 7,14-7,87 м.д. (неразрешенный пик, 4H); 10,70 м.д. (неразрешенный пик, 1H); 12,62 м.д. (s, 1H). Подготовительный пример 1.19. 8-Метил-1,2,3,4-тетрагидропиримидо[1,2-а]индол.A) 1-(4-Метилфенил)пиразолидин-3-он. 10 г паратолилгидразина гидрохлорида растворяют в 100 мл безводного CH2Cl2. Раствор охлаждают до 0C и добавляют 19 мл DBU, а затем 6,5 мг 3-бромпропионилхлорида. Смесь перемешивают при температуре окружающей среды в течение 1 ч. Реакционную среду вливают в воду, проводят экстракциюCH2Cl2, а затем осуществляют очистку хроматографией на колонке с диоксидом кремния, элюируя смесью AcOEt/петролейный эфир (об./об.; 50/50). Получают 1,3 г кристаллов. ЯМР CDCl3 (300 МГц): 2,35 м.д. (s, 3H); 2,54 м.д. (t, J=7,9, 2H); 3,89 м.д. (q, J=7,9, 2H); 6,93-7,16 м.д.(неразрешенный пик, 4H); 8,22 м.д. (s, 1H). Б) 1-Ацетил-2-(4-метилфенил)пиразолидин. 1.3 г соединения с предыдущей стадии, растворенного в 20 мл безводного THF, добавляют к 9,6 мл 1 М раствора LAH в THF. Смесь нагревают с обратным холодильником в течение 18 ч. Смесь охлаждают до температуры окружающей среды, затем добавляют 2 мл воды и 7 мл 1 н. раствора гидроксида натрия,а затем соли отфильтровывают через Celite. Фильтрат упаривают и остаток переносят в 20 мл AcOEt. Добавляют 2,6 г K2CO3, 5 мл H2O и затем 0,6 мл уксусного ангидрида. Смесь перемешивают при температуре окружающей среды в течение 1 ч. Две фазы разделяют, органическую фазу сушат над MgSO4 и затем упаривают до сухого состояния. Получают 1,4 г масла. ЯМР CDCl3 (300 МГц): 1,93-2,05 м.д. (неразрешенный пик, 2H); 2,07 м.д (s, 3H); 2,30 м.д. (s, 3H); 3,50 м.д. (неразрешенный пик, 4H); 6,83-7,11 м.д. (неразрешенный пик, 4H).B) 8-Метил-1,2,3,4-тетрагидропиримидо[1,2-а]индол. 1,4 г соединения с предыдущей стадии растворяют в 10 мл POCl3. Смесь нагревают при 80C в течение 1 ч 30 мин. Реакционную среду охлаждают, добавляют эфир, затем образовавшийся осадок отфильтровывают и промывают эфиром. Получают 1,4 г ожидаемого соединения в виде порошка ЯМР d6-DMSO (300 МГц): 2,06-2,14 м.д. (неразрешенный пик, 2H); 2,33 м.д. (s, 3H); 3,50 м.д. (неразрешенный пик, 2H); 3,84-3,88 м.д. (неразрешенный пик, 2H); 4,15 м.д. (s, 2H); 7,15-7,29 м.д. (неразрешенный пик, 3H); 10,84 м.д. (s, 1H).-9 010833 Получение промежуточных соединений формул (III) и (IV). Подготовительный пример 2.1. Метил-2-(3,5-дифторфенил)-3-диметиламино-пропеноат (IV). А) Метил-(3,5-дифторфенил)ацетат. При 0C готовят раствор, содержащий 25 мл ацетилхлорида в 250 мл метанола, затем при температуре окружающей среды в этом растворе растворяют 25,5 г 3,5-дифторфенилуксусной кислоты и раствор оставляют перемешиваться при температуре окружающей среды. Протекание реакции контролируют при помощи тонкослойной хроматографии. После исчезновения исходного вещества среду упаривают при пониженном давлении и затем остаток растворяют в 250 мл MTBE. Органическую фазу три раза промывают 100 мл воды, сушат над MgSO4 и затем упаривают при пониженном давлении до сухого состояния. Получают 26,9 г ожидаемого соединения. Б) Метил-2-(3,5-дифторфенил)-3-диметиламино-пропеноат. 26,9 г соединения с предыдущей стадии растворяют в 61 мл диметокси-N,N-диметилметанамина. Смесь нагревают при 135-140C и отгоняют образовавшийся метанол (12 г). Растворитель выпаривают при пониженном давлении и остаток переносят в 250 мл MTBE. Органическую фазу три раза промывают 50 мл воды, затем сушат над MgSO4 и упаривают до сухого состояния. Остаток перекристаллизовывают из метилциклогексана. Образовавшийся продукт отфильтровывают и затем два раза промывают 25 мл метилциклогексана с получением 28 г ожидаемого соединения, т.пл.=97C. Подготовительный пример 2.2. Этил-2-(3,5-дифторфенил)-3-гидрокси-2-пропеноат (III). А) Этил-3,5-дифторфенилацетат. 5 г 3,5-дифторфенилуксусной кислоты растворяют в 50 мл этанола и 3 мл концентрированнойH2SO4 и смесь нагревают с обратным холодильником в течение 2 ч. Смесь упаривают до сухого состояния, затем проводят нейтрализацию насыщенным раствором K2CO3, затем проводят экстракцию AcOEt и органическую фазу упаривают с получением 5,0 г ожидаемого соединения в виде бесцветной жидкости. ЯМР CDCl3 (200 МГц): 1,27 м.д. (t, 3H); 3,59 м.д. (s, 2H); 4,18 м.д. (q, 2H); 6,68-6,85 м.д. (неразрешенный пик, 3H). Б) Этил-2-(3,5-дифторфенил)-3-гидрокси-2-пропеноат. 5,0 г этил-3,5-дифторфенилацетат растворяют в 50 мл этилформиата. Порциями добавляют 2,0 г 60%-ного NaH. Смесь вливают в 1 н. раствор HCl и затем проводят экстракцию AcOEt. Остаток растирают в петролейном эфире, оставшийся белый осадок отфильтровывают и затем фильтрат упаривают с получением 3,3 г ожидаемого соединения в виде жидкости. ЯМР CDCl3 (200 МГц): 1,33 м.д. (t, 3H); 4,34 м.д. (q, 2H); 6,69-7,38 м.д. (неразрешенный пик, 4H); 12,16 м.д. (неразрешенный пик, 1H). Подготовительный пример 2.3. Этил-2-(3,5-диметилфенил)-3-гидрокси-2-пропеноат (III). 10 мл этил-2-(3,5-диметилфенил)ацетата растворяют в 80 мл этилформиата. Порциями добавляют 5,0 г 50%-ного NaH и затем смесь перемешивают при температуре окружающей среды в течение 12 ч. Смесь вливают в 1 н. раствор HCl и затем проводят экстракцию AcOEt. Органическую фазу упаривают с получением ожидаемого соединения, используемого как есть на следующей стадии. Подготовительный пример 2.4. Этил-2-(4-метоксифенил)-3-гидроксипропеноат (III). 8,9 мл этилового эфира п-метоксифенилацетата растворяют в 80 мл этилформиата. Порциями добавляют 4,6 г 50%-ного NaH и затем смесь перемешивают при температуре окружающей среды в течение 12 ч. Смесь вливают в 1 н. раствор HCl и затем проводят экстракцию AcOEt. Очистку осуществляют хроматографией на колонке с диоксидом кремния, элюируя смесью AcOEt / гептан (05/95; об./об.) с получением 4,0 г ожидаемого соединения в виде жидкости. ЯМР CDCl3 (200 МГц): 1,30 м.д. (t, 3H); 3,83 м.д. (s, 3H); 4,29 м.д. (q, 2H); 6,89-7,21 м.д. (неразрешенный пик, 5H). Подготовительный пример 2.5. Метил-2-[4-(бензилокси)фенил]-3-диметиламино-пропеноат (IV). 200 мкл тетраметилэтилендиамина добавляют к 5 г метил-2-[4-(бензилокси)фенил]ацетата в 5,2 мл диметокси-N,N-диметилметанамина и смесь перемешивают при 130C в течение 3 ч. После охлаждения до температуры окружающей среды добавляют этилацетат и 60 мл хлорида аммония, смесь перемешивают в течение 5 мин, органическую фазу отделяют и водную фазу два раза экстрагируют этилацетатом. После выпаривания растворителя при пониженном давлении с последующей обработкой активированным углем и после промывания твердого вещества пентаном получают 4,16 г ожидаемого соединения ЯМР CDCl3 (200 МГц): 2,66 м.д. (s, 3H); 3,62 м.д. (s, 3H); 5,45 м.д. (s, 2H); 6,91 м.д. (d, 2H); 7,14 м.д.H2SO4 и затем смесь нагревают с обратным холодильником в течение 2 ч. Этанол выпаривают, проводят нейтрализацию насыщенным раствором K2CO3 и затем проводят экстракцию AcOEt. Органическую фазу сушат над MgSO4. Получают 5,2 г ожидаемого соединения в виде жидкости.- 10010833 ЯМР CDCl3 (300 МГц): 1,18 м.д. (t, 3H); 3,50 м.д. (s, 2H); 4,08 м.д. (q, 2H); 7,09-7,37 м.д. (неразрешенный пик, 4H). Б) Этил-2-(3-бромфенил)-3-гидрокси-2-пропеноат (III). 5,2 г соединения с предыдущей стадии растворяют в 70 мл этилформиата и порциями добавляют 1,7 г 60%-ного NaH. Смесь оставляют перемешиваться при температуре окружающей среды в течение 5 ч. Смесь вливают в 100 мл 1 н. раствора HCl и затем проводят экстракцию AcOEt. Органическую фазу сушат над MgSO4 и затем упаривают до сухого состояния. Получают 5,8 г ожидаемого соединения в виде масла. ЯМР CDCl3 (300 МГц): 1,9 м.д. (t, 3H); 4,20 м.д. (q, 2H); 7,11-7,42 м.д. (неразрешенный пик, 5H); 12,06 м.д. (d, 1H). Промежуточные соединения формулы (III), объединенные в табл. 2, получают в соответствии с подготовительными примерами, описанными выше. Таблица 2A) 5-Бромметил-6-хлор-1,3-бензодиоксол. 2,5 г 6-хлорпиперонилового спирта растворяют в 80 мл этилового эфиэа. Раствор охлаждают до 0C и затем добавляют 1,9 мл PBr3. Смесь перемешивают при температуре окружающей среды в течение 18 ч. Смесь выливают на лед и затем проводят экстракцию AcOEt. Органическую фазу промывают насыщенным раствором NaCl. Получают 3,3 г порошка. ЯМР CDCl3 (300 МГц): 4,47 м.д. (s, 2H); 5,92 м.д. (s, 2H); 6,77 м.д. (s, 1H); 6,88 м.д. (s, 1H). Б) (6-Хлор-1,3-бензодиоксол-5-ил)ацетонитрил. 3,3 г соединения с предыдущей стадии растворяют в 70 мл этанола и 15 мл воды. Добавляют 1,8 гKCN и затем эту смесь нагревают с обратным холодильником в течение 5 ч. Этанол выпаривают, остаток переносят в воду и затем проводят экстракцию AcOEt. Органическую фазу сушат над MgSO4 и затем упаривают до сухого состояния. Получают 2,4 г масла. ЯМР CDCl3 (300 МГц): 3,75 м.д. (s, 2H); 6,02 м.д. (s, 2H); 6,88 м.д. (s, 1H; 6,95 м.д. (s, 1H).B) Этил-(6-хлор-1,3-бензодиоксол-5-ил)ацетат. 2,4 г соединения с предыдущей стадии растворяют в 80 мл этанола и 4 мл концентрированнойH2SO4. Смесь нагревают с обратным холодильником в течение 48 ч. Этанол выпаривают, остаток переносят в воду и затем проводят экстракцию AcOEt. Органическую фазу промывают насыщенным раствором NaCl, сушат над MgSO4 и затем упаривают до сухого состояния. Получают 2,9 г масла, которое со- 12010833 держит приблизительно 20% исходного вещества. ЯМР CDCl3 (300 МГц): 1,26 м.д. (t, J=6,9, 3H); 3,68 м.д. (s, 2H); 4,15-4,23 м.д. (q, J=6,9, 2H); 5,98 м.д.(s, 2H); 6,77 м.д. (s, 1H); 6,87 м.д. (s, 1H). Г) Этил-2-(6-хлор-1,3-бензодиоксол-5-ил)-3-гидроксиакрилат. 2,9 г соединения с предыдущей стадии растворяют в 60 мл этилформиата. Добавляют 1,0 г 60%-ного NaH и затем смесь перемешивают при температуре окружающей среды в течение 5 ч. Смесь вливают в 100 мл 1 н. раствора HCl и затем проводят экстракцию AcOEt. Органическую фазу сушат надMgSO4 и упаривают до сухого состояния. Получают 3,2 г масла, которое далее используется как есть. Подготовительный пример 2.29. Этил-2-(3-гидроксифенил)-3-диметиламиноакрилат.A) Метил-(3-гидроксифенил)ацетат. 10 г 3-гидроксифенилуксусной кислоты растворяют в 60 мл метанола и 2,5 мл серной кислоты. Раствор нагревают с обратным холодильником в течение 2 ч. Смесь возвращают к температуре окружающей среды и выпаривают метанол. Остаток переносят в насыщенный раствор K2CO3. Проводят экстракциюAcOEt. Органическую фазу сушат над MgSO4, фильтруют и упаривают до сухого состояния. Получают 11,1 г масла. ЯМР d6-DMSO (300 МГц): 3,57 м.д. (s, 3H); 3,61 м.д. (s, 2H); 6,66 м.д. (неразрешенный пик, 3H); 7,09 м.д. (неразрешенный пик, 1H); 9,42 м.д. (s, 1H). Б) Этил-(3-бензилоксифенил)ацетат. 3 г соединения с предыдущей стадии растворяют в 13 мл этанола. Добавляют 3,75 г K2CO3, 3,12 мл бензилхлорида и на кончике шпателя н-Bu4NI. Смесь нагревают с обратным холодильником в течение 6 ч. Смесь возвращают к температуре окружающей среды, фильтруют через K2CO3 и упаривают до сухого состояния. Остаток переносят в AcOEt и органическую фазу промывают водой. Получают 5 г масла. ЯМР d6-DMSO (300 МГц): 1,19 м.д. (t, 3H); 3,64 м.д. (s, 2H); 5,08 м.д. (s, 2H); 6,85-6,98 м.д. (неразрешенный пик, 2H); 7,22-7,51 м.д. (неразрешенный пик, 7H).B) Этил-2-(3-гидроксифенил)-3-диметиламиноакрилат. 5 г соединения с предыдущей стадии растворяют в 8 мл диметилформамида диметилацеталя(DMFDMA). Раствор нагревают при 135C в течение 24 ч, добавляя 1 мл DMFDMA через приблизительно каждые 3 ч. Смесь упаривают до сухого состояния. Получают 6 г масла. Промежуточные соединения формулы (IV), объединенные в табл. 3, получают в соответствии с подготовительным примером 2.1.A) 4-Бром-1-бромметил-2-хлорбензол. 5,0 г 2-хлор-4-бромтолуола растворяют в 120 мл CCl4. Добавляют 4,3 г NBS и 1,6 г AIBN. Смесь нагревают с обратным холодильником в течение 15 ч, добавляют воду, две фазы разделяют и затем проводят экстракцию CH2Cl2. Очистку осуществляют хроматографией на колонке с диоксидом кремния, элюируя петролейным эфиром. Получают 3,8 г жидкости.CDCl3 (300 МГц): 4,48 м.д. (s, 2H); 7,23-7,36 м.д. (неразрешенный пик, 2H); 7,51 м.д. (s, 1H). Б) (4-Бром-2-хлорфенил)ацетонитрил. 3,8 г соединения с предыдущей стадии растворяют в 70 мл этанола и 15 мл H2O. Добавляют 1,7 гKCN и затем смесь нагревают с обратным холодильником в течение 5 ч. Этанол выпаривают, остаток переносят в воду и затем проводят экстракцию AcOEt. Получают 2,5 г масла.B) Этил-(4-бром-2-хлорфенил)ацетат. 2,5 г соединения с предыдущей стадии растворяют в 80 мл этанола и 4 мл концентрированнойH2SO4. Раствор нагревают с обратным холодильником в течение четырех дней. Этанол выпаривают, остаток переносят в насыщенный раствор K2CO3, органическую фазу сушат над MgSO4 и затем упаривают до сухого состояния. Получают 2,5 г жидкости.CDCl3 (300 МГц): 1,28 м.д. (t, J=7,1, 3H); 3,73 м.д. (s, 2H); 4,18 м.д. (q, J=7,1, 2H); 7,18 м.д. (неразрешенный пик, 1H); 7,38 м.д. (неразрешенный пик, 1H);7,56 м.д. (s, 1H). Г) Этил-2-(4-бром-2-хлорфенил)-3-диметиламиноакрилат. 2,8 г соединения с предыдущей стадии растворяют в 3,1 г реагента Бредерека. Раствор нагревают при 100C в течение 15 ч и выпаривают избыточное количество реагента. Получают 2,9 г масла.CDCl3 (300 МГц): 1,18 м.д. (t, J=7,1, 3H); 2,72 м.д. (s, 6H); 4,09 м.д. (q, J=7,1, 2H); 7,15 м.д. (неразрешенный пик, 1H); 7,35 м.д. (неразрешенный пик, 1H); 7,54 м.д. (неразрешенный пик, 1H); 7,60 м.д. (s,1H). Пример 1. Соединение 6. 3-(3,5-Дифторфенил)-1,6,9-триметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 25 г соединения из подготовительного примера 2.1 и 22,5 г соединения из подготовительного примера 1.1 перемешивают в 75 мл уксусной кислоты и смесь нагревают при 40C в течение 24 ч, а потом при 60-65C в течение 4 ч. Реакционную среду охлаждают до температуры окружающей среды и затем вливают в 275 мл воды. Образовавшийся осадок отделяют, промывают 50 мл воды и затем перекристаллизовывают из 250 мл MiBK. Остаточное количество воды удаляют азеотропной перегонкой при атмосферном давлении. Полученный продукт промывают два раза 25 мл MiBK и затем сушат при 40-45C и пониженном давлении в течение 24 ч с получением после кристаллизации из MiBK 20,33 г ожидаемого соединения, т.пл.=240C. ЯМР d6-DMSO (200 МГц): 2,51 м.д. (s, 3H); 4,05 м.д. (s, 6H); 6,69-8,08 м.д. (неразрешенный пик,7H). Пример 2. Соединение 22. 3-(3,5-Дифторфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 1,5 г гидрохлорида из подготовительного примера 1.2 растворяют в 50 мл пиридина. Добавляют 1,9 г соединения из подготовительного примера 2.2 и смесь нагревают при 70C в течение 20 ч. Смесь упаривают до сухого состояния, затем остаток переносят в воду и экстрагируют CH2Cl2. Очистку осуществляют хроматографией на колонке с диоксидом кремния, элюируя смесью AcOEt/гептан (50/50; об./об.) с получением 300 мг ожидаемого соединения в виде порошка, т.пл.=189C (с разложением). ЯМР d6-DMSO (200 МГц): 2,51 м.д. (s, 3H); 3,70 м.д. (s, 3H); 7,04-8,68 м.д. (неразрешенный пик,7H); 11,98 м.д. (s, 1H). Пример 3. Соединение 16. 1,6-Диметил-3-(3,5-диметилфенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 0,8 г соединения из подготовительного примера 1.2 растворяют в 50 мл пиридина. Добавляют 0,8 г соединения из подготовительного примера 2.3 и смесь нагревают при 80C в течение 20 ч. Смесь упаривают до сухого состояния и затем остаток переносят в воду и экстрагируют CH2Cl2. Очистку осуществляют хроматографией на колонке с диоксидом кремния, элюируя смесью AcOEt/гептан (50/50; об./об.) с получением, после перекристаллизации из изопропанола, 500 мг ожидаемого соединения. ЯМР d6-DMSO (200 МГц): 2,23 м.д. (s, 6H); 2,49 м.д. (s, 3H); 3,73 м.д. (s, 3H); 6,84-8,08 м.д. (неразрешенный пик, 7H); 9,98 м.д. (s, 1H). Пример 4. Соединение 20. 6-Метокси-1,9-диметил-3-(3,5-дифторфенил)-1,9-дигидро-2H-пиридо[2,3-b]индол 2-он. 2,5 г соединения из подготовительного примера 1.3 растворяют в 70 мл пиридина. Добавляют 3,3 г соединения из подготовительного примера 2.2 и смесь нагревают при 100C в течение 20 ч. Смесь упаривают до сухого состояния и затем остаток переносят в воду и AcOEt. Оставшийся осадок отфильтровывают. Проводят перекристаллизацию из изопропилового спирта с получением 1,35 г ожидаемого соединения, т.пл.=189C. ЯМР CDCl3 (200 МГц): 3,91 м.д. (s, 3H); 4,04 м.д. (s, 6H); 6,68-8,05 м д. (неразрешенный пик, 7H). Пример 5. Соединение 1. 3-(3,5-Диметилфенил)-1,6,9-триметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Это соединение получают из соединений подготовительных примеров 1.1 и 2.3, т.пл.=210C. ЯМР CDCl3 (200 МГц): 2,42 м.д. (s, 6H); 2,54 м.д. (s, 3H); 4,07 м.д. (s, 6H); 7,00-8,08 м.д. (неразрешенный пик, 7H). Пример 6. Соединение 2. 3-(2,4-Дихлорфенил)-1,6,9-триметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Это соединение получают из соединений подготовительных примеров 1.1 и 2.7, т.пл.=170C.- 15010833 ЯМР CDCl3 (300 МГц): 2,51 м.д. (s, 3H); 4,09 м.д. (s, 3H); 4,11 м.д. (s, 3H); 7,15-8,00 м.д. (неразрешенный пик, 7H). Пример 7. Соединение 21. 3-(2,4-Дихлорфенил)-6-метокси-1,9-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2 он. Это соединение получают из соединений подготовительных примеров 1.3 и 2.7, т.пл.=130C. ЯМР CDCl3 (300 МГц): 3,90 м.д. (s, 3H); 4,07 м.д. (s, 3H); 4,09 м.д. (s, 3H); 6,93-7,98 м.д. (неразрешенный пик, 7H). Пример 8. Соединение 32. 3-(2,4-Дихлорфенил)-1,5,7,9-тетраметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Это соединение получают из соединений подготовительных примеров 1.11 и 2.7, т.пл.=204C. ЯМР CDCl3 (300 МГц): 2,51 м.д. (s, 3H); 2,68 м.д. (s, 3H); 4,10 м.д. (s, 6H); 6,91 м.д. (s, 1H); 7,05 м.д.(s, 1H); 7,31 м.д. (dd, 1H); 7,44 м.д. (d, 1H); 7,52 м.д. (d, 1H); 8,11 м.д. (s, 1H). Пример 9. Соединение 66. 3-(4-Гидроксифенил)-1,6,9-триметил-1,9-дигидро-2H-пиридо[2,3-b]индолон. А) 3-(4-Метоксифенил)-1,6,9-триметил-1,9-дигидро-2H-пиридо[2,3-b]индолон. 2,0 г гидрохлорида, полученного в подготовительном примере 1.1, растворяют в 50 мл пиридина. Добавляют 2,1 г формилового эфира, полученного в подготовительном примере 2.4, и смесь нагревают при 80C в течение 20 ч. Смесь упаривают до сухого состояния, затем проводят экстракцию CH2Cl2 и промывают водой. Очистку осуществляют хроматографией на колонке с диоксидом кремния, элюируя смесью AcOEt/гептан/CH2Cl2 (50/50/50; об./об./об.) с получением 0,5 г ожидаемого соединения в виде порошка. ЯМР d6-DMSO (200 МГц): 2,50 м.д. (s, 3H); 3,86 м.д. (s, 3H); 4,05 м.д. (s, 6H); 6,96-8,04 м.д. (неразрешенный пик, 8H). Б) 3-(4-Гидроксифенил)-1,6,9-триметил-1,9-дигидро-2H-пиридо[2,3-b]индолон. 18 мл BBr3 в растворе DCM добавляют при перемешивании и при -78C к 5,36 г соединения с предыдущей стадии, растворенного в 60 мл DCM. Смесь оставляют возвращаться к температуре окружающей среды. Затем эту смесь перемешивают при этой температуре в течение 24 ч. Реакционную среду разбавляют смесью DCM и MeOH. Раствор упаривают при пониженном давлении. Неочищенный продукт переносят в DCM, адсорбируют на 16 г диоксида кремния и хроматографируют на колонке с диоксидом кремния, элюируя смесью DCM/MeOH (97/3; об./об.), затем от (95/5; об./об.) до (50/50; об./об.). Таким образом твердое вещество выделяют и суспендируют в смеси DCM/MeOH. Полученную суспензию охлаждают и фильтруют. Затем собирают осадок. Таким образом выделяют 4 г ожидаемого соединения, содержащего 4% исходного вещества, т.пл. 280C. ЯМР d6-DMSO (200 МГц): 2,30 м.д. (s, 3H); 3,9 м.д. (s, 3H); 4 м.д. (s, 3H); 6,6 м.д. (d, 2H); 7 м.д. (d,1H); 7,3 м.д. (d, 1H); 7,5 м.д. (d, 2H); 7,6 м.д. (s, 1H); 8,1 м.д. (s, 1H). Пример 10. Соединение 68. 1,6-Диметил-3-(4-гидроксифенил)-1,9-дигидро-2H-пиридо[2,3-b]индолон. А) 1,6-Диметил-3-(4-бензилоксифенил)-1,9-дигидро-2H-пиридо[2,3-b]индолон. 1 г N,5-диметил-1H-индол-2-амина (подготовительный пример 1.2) перемешивают с 1,4 г соединения из подготовительного примера 2.5 и 10 мл уксусной кислоты и затем смесь нагревают при 100C в течение 18 ч. Смесь упаривают до сухого состояния под вакуумом и затем остаток переносят в 20 млCH2Cl2 и 5 мл H2O. pH доводят до 7 при помощи 1 н. NaOH при перемешивании, затем отстаиванием разделяют два слоя и органическую фазу промывают NaCl, потом сушат и упаривают до сухого состояния. Остаток переносят в 10 мл Et2O, фильтруют и затем органическую фазу промывают и сушат. Б) 1,6-Диметил-3-(4-гидроксифенил)-1,9-дигидро-2H-пиридо[2,3-b]индолон. Перемешивают 0,800 г соединения с предыдущей стадии и 50 мл TFA. Смесь нагревают при 75C в течение 1 ч 30 мин. Под вакуумом упаривают смесь до сухого состояния и затем остаток переносят в 15 мл Et2O и сушат, т.пл.=186C. ЯМР d6-DMSO (300 МГц): 2,6 м.д. (s, 3H); 3,8 м.д. (s, 3H); 6,8 м.д. (d, 2H); 7,1 м.д. (d, 1H); 7,4 м.д.(d, 1H); 7,6 м.д. (d, 2H); 7,8 м.д. (s, 1H); 8,2 м.д. (s, 1H); 11,9 м.д. (s, 1H). Пример 11. Соединение 52. 4-(1,6,9-Триметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-3-ил)бензонитрил. А) 3-(3-Бромфенил)-1,6,9-триметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 2,5 г соединения из подготовительного примера 1.1 растворяют в 40 мл уксусной кислоты и 60 мл пиридина; добавляют 3,5 г соединения из подготовительного примера 2.6 и затем смесь нагревают при 100C в течение 15 ч. Реакционную среду вливают в 200 мл воды и образовавшийся осадок отфильтровывают. Осадок переносят в CH2Cl2 и затем промывают насыщенным раствором NaCl, сушат над MgSO4 и упаривают до сухого состояния. Осадок переносят в смесь AcOEt/циклогексан (20/8; об./об.) и затем фильтруют. Получают 20 г ожидаемого соединения, т.пл.=215-216C.- 16010833 Б) 4-(1,6,9-Триметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-3-ил)-бензонитрил. 3 г соединения, полученного на предыдущей стадии, растворяют в 50 мл 1-метил-2-пирролидинона,добавляют 1,4 г CuCN и смесь затем нагревают при 200C в течение 4 ч. Реакционную среду вливают в 100 мл CH2Cl2 и затем отфильтровывают образовавшийся осадок. Фильтрат промывают 1 н. растворомHCl и затем сушат над MgSO4. Полученный продукт очищают хроматографией на диоксиде кремния,элюирование осуществляют смесью AcOEt/CH2Cl2 (50/50; об./об.) и затем AcOEt/MeOH/NH3 (90/10/1; об./об./об.). 2,2 г ожидаемого соединения собирают в виде порошка. ЯМР CDCl3 (300 МГц): 2,52 м.д. (s, 3H); 4,09 м.д. (s, 3H); 4,12 м.д. (s, 3H); 7,16 м.д. (неразрешенный пик, 8H). Пример 12. Соединение 53. 3-(4-(Аминометил)фенил)-1,6,9-триметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 50 мг гидроксида натрия растворяют в 11 мл этанола, добавляют 0,2 г соединения, полученного в предыдущем примере, потом приблизительно 100 мг никеля Ренея и смесь гидрируют в течение 24 ч при давлении 50 фунт/кв.дюйм (345 кПа). Катализатор отфильтровывают через Celite, осуществляют промывку метанолом и упаривают до сухого состояния. Остаток переносят в 1 н. раствор HCl и затем примеси экстрагируют этилацетатом. Раствор подщелачивают до pH 9 раствором K2CO3 и затем проводят экстракцию AcOEt с получением 90 мг ожидаемого соединения в виде порошка. ЯМР CDCl3 (300 МГц): 2,51 м.д. (s, 3H); 3,91 м.д. (s, 2H); 4,08 м.д. (s, 6H); 7,13-8,09 м.д. (неразрешенный пик, 8H). Пример 13. Соединение 84. Метил-(3-(2,4-дихлорфенил)-1,6-диметил-2-оксо-1,2-дигидро-9H-пиридо[2,3b]индол-9-ил)ацетат. 1 г 3-(2,4-дихлорфенил)-1,6-диметил-1,9-дигидро[2,3-b]индол-2-она (соединение 46) растворяют в 10 мл DMF, добавляют 0,143 г 95%-ного NaH и после перемешивания в течение 30 мин добавляют 0,4 мл метилбромацетата. После перемешивания в течение 1 ч при температуре окружающей среды реакционную смесь упаривают, затем остаток переносят в CH2Cl2, промывают раствором NaHCO3 и потом раствором NaCl. Органическую фазу сушат и затем упаривают с получением 0,98 г ожидаемого продукта. Пример 14. Соединение 85. 2-(3-(2,4-Дихлорфенил)-1,6-диметил-2-оксо-1,2-дигидро-9H-пиридо[2,3-b]индол-9 ил)-N-метилацетамид. Перемешивают 0,3 г сложного эфира, полученного в предыдущем примере, и 30 мл 33%-ного метиламина в EtOH. После перемешивания при температуре окружающей среды в течение 5 ч реакционную среду упаривают, остаток переносят в Et2O, затем фильтруют и сушат с получением 0,260 г ожидаемого соединения. Пример 15. Соединение 81. 3-(3-Гидроксиметилфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. А) 3-(1,6-Диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-3-ил)бензальдегид. Перемешивают 450 мг 3-(3-цианофенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она,10 мл AcOH, 20 мл пиридина, 2,6 г гипофосфита натрия и 434 мг никеля Ренея и затем смесь нагревают при 60C в течение 4 ч. Реакционную среду фильтруют и фильтрат упаривают; остаток переносят в 50 мл смеси AcOEt/CH2Cl2 (1:1; об./об.) и органическую фазу промывают водой, сушат и упаривают с получением ожидаемого соединения, т.пл.=280C. Б) 3-(3-Гидроксиметилфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 280 мг соединения, полученного на стадии А, помещают в 10 мл CH2Cl2 и добавляют минимально возможное количество AcOH для растворения соединения, 375 г NaBH(OAc)3, затем смесь оставляют перемешиваться при температуре окружающей среды в течение 18 ч. Реакционную среду упаривают,остаток переносят в AcOEt и затем фильтруют с получением 200 мг ожидаемого соединения. Пример 16. Соединение 80. 1,6-Диметил-3-(3-метиламино)метил)-фенил)-1,9-дигидро-2H-пиридо[2,3-b]индол 2-он. 280 мг соединения со стадии А предыдущего примера помещают в 10 мл CH2Cl2, добавляют минимально возможное количество AcOH для растворения соединения и затем 375 г NaBH(OAc)3 и 0,064 мл метиламина. После перемешивания при температуре окружающей среды в течение 18 ч проводят экстракцию три раза 10 мл воды и затем водную фазу экстрагируют AcOEt. После упаривания получают 15 мг ожидаемого соединения. Пример 17. Соединение 83. Оксим 3-(1,6-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-3-ил)бензальдегида. 210 мг соединения из примера 15, стадия А, растворяют в 5 мл MeOH, добавляют 46 мг гидроксиламина гидрохлорида, растворенного в минимальном количестве воды, и смесь оставляют перемешиваться при температуре окружающей среды в течение 2 ч. Смесь упаривают до сухого состояния и затем остаток хроматографируют на диоксиде кремния, элюируя смесью AcOEt/CH2Cl2 (2/8; об./об.). Получают- 17010833 74 мг ожидаемого соединения. Пример 18. Соединение 110. 1,6-Диметил-3-(3-метоксикарбонилфенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. А) 3-(3-Бромфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Это соединение получают обычными способами при взаимодействии N,1,5-триметил-1H-индол-2 амина с этил-2-(3-бромфенил)-3-гидроксипропеноатом. ЯМР d6-DMSO (200 МГц): 2,42 м.д. (s, 3H); 3,69 м.д. (s, 3H); 7,04 м.д. (d, 1H); 7,35 м.д. (d, 1H); 7,057,08 м.д. (неразрешенный пик, 5H); 8,30 м.д. (s, 1H); 11,91 м.д. (s, 1H). Б) 1,6-Диметил-3-(3-метоксикарбонилфенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 500 мг соединения с предыдущей стадии и 140 мг 1,3-бис-(дифенилфосфино)пропана растворяют в 20 мл безводного MeOH. Добавляют 1,9 мл 99,9%-ного триэтиламина, 15 мл безводного DMSO, а затем 60 мг Pd(OAc)2. В реакционную среду в течение 20 мин барботируют CO и среду нагревают при 75C в течение ночи в атмосфере CO. Среду оставляют возвращаться к температуре окружающей среды. Реакционную среду вливают в 200 мл воды и затем экстрагируют EtOAc. Органическую фазу сушат надMgSO4, фильтруют и упаривают до сухого состояния. Остаток очищают на колонке с диоксидом кремния, элюируя смесью AcOEt/петролейный эфир (об./об.; 75/25). Полученный остаток растирают со смесью AcOEt/петролейный эфир. Получают 260 мг порошка. ЯМР d6-DMSO (300 МГц): 2,43 м.д. (s, 3H); 3,70 м.д. (s, 3H); 3,88 м д. (s, 3H); 7,05 м.д. (неразрешенный пик, 1H); 7,35 м.д. (d, J=8, 1H); 7,54 м.д. (неразрешенный пик, 1H); 7,74 м.д. (неразрешенный пик,1H); 7,86 м.д. (неразрешенный пик, 1H); 8,02 м.д. (неразрешенный пик, 1H); 8,43 м.д. (неразрешенный пик, 1H); 11,94 м.д. (s, 1H). Пример 19. Соединение 111. 3-(4-Аминофенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. А) 3-(4-Бромфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Это соединение получают обычными способами при взаимодействии N,1,5-триметил-1H-индол-2 амина с этил-2-(4-бромфенил)-3-гидроксипропеноатом. ЯМР d6-DMSO (300 МГц): 2,35 м.д. (s, 3H); 3,61 м.д. (s, 3H); 3,97 м.д. (d, 1H); 7,03 м.д. (d, 1H); 7,457,80 м.д. (неразрешенный пик, 5H); 8,32 м.д. (s, 1H); 11,85 м.д. (s, 1H). Б) 3-(4-Аминофенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 10 мл THF дегазируют в течение 10 мин и в атмосфере аргона добавляют 9,2 мг Pd2(dba)3, затем 370 мг соединения с предыдущей стадии, потом 9,4 мг лиганда 2-дициклогексилфосфино-2'-(N,Nдиметиламино)бифенила и наконец 2,2 мл 1 М раствора LiN(TMS)2 в THF. Смесь перемешивают в герметично закрытой пробирке при 90C в течение 20 ч. Реакционную среду охлаждают, затем добавляют 10 мл 1 н. раствора HCl и затем смесь перемешивают при температуре окружающей среды в течение 10 мин. Разделяют две фазы, водную фазу промывают раствором AcOEt и затем подщелачивают насыщенным раствором K2CO3. Образовавшийся осадок отфильтровывают. Получают 90 мг. ЯМР d6-DMSO (300 МГц): 2,40 м.д. (s, 3H); 3,65 м.д. (s, 3H); 4,99 м.д. (s, 2H); 6,57 м.д. (неразрешенный пик, 2H); 6,94 м.д. (d, J=8,1, 1H); 7,29 м.д. (d, J=8,1, 1H); 7,43 м.д. (неразрешенный пик, 2H); 7,60 м.д.(s, 1H); 8,07 м.д. (s, 1H). Пример 20. Соединение 121. 1,6-Диметил-1,9-дигидро-3-(фениламинофенил)-2H-пиридо[2,3-b]индол-2-он. 13 мг Pd2(dba)3, 500 мг соединения со стадии А примера 18, 11 мг лиганда 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенила, 3 мл 1 М раствора LiN(TMS)2 в THF, 127 мг анилина и затем 10 мл безводного диоксана помещают в атмосферу аргона. Смесь перемешивают в герметично закрытой пробирке при 65C в течение 24 ч. Смесь возвращают к температуре окружающей среды и затем добавляют AcOEt. Органическую фазу промывают насыщенным раствором NaCl. Очистку осуществляют на колонке с диоксидом кремния, элюируя смесью AcOEt/петролейный эфир (об./об.; 50/50), затем (об./об.; 75/25). Полученный остаток растирают в эфире. Получают 55 мг ожидаемого соединения в виде осадка,т.пл.=188-190C. ЯМР d6-DMSO (300 МГц): 2,42 м.д. (s, 3H); 3,68 м.д. (s, 3H); 6,77-8,28 м.д. (неразрешенный пик,14H); 12,00 м.д. (s, 1H). Пример 21. Соединение 147. 3-(2,4-Дицианофенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 0,6 г 3-(2-хлор-4-бромфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она растворяют в 15 мл NMP. Добавляют 0,27 г CuCN и затем смесь нагревают с обратным холодильником в течение 5 ч. Реакционную среду вливают в CH2Cl2 и промывают насыщенным раствором NaCl. Очистку осуществляют хроматографией на колонке с диоксидом кремния, элюируя смесью AcOEt/петролейный эфир(об./об.; 75/25), а затем чистым AcOEt. Для удаления остаточного количества NMP выделенные фракции промывают 1 н. раствором HCl. Получают 50 мг ожидаемого соединения в виде порошка. ЯМР d6-DMSO (300 МГц): 2,27 м.д. (s, 3H); 3,70 м.д. (s, 3H); 7,08 м.д. (d, J=8,1, 1H); 7,38 м.д. (d,J=8,1, 1H); 7,67 м.д. (s, 1H); 7,85 м.д. (d, J=8,2, 1H); 8,15 м.д. (d, J=8,2, 1H); 8,45 м.д. (неразрешенный пик,- 18010833 2H); 12,11 м.д. (s, 1H). Пример 22. Соединение 143. 3-(3-Ацетилфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 400 мг соединения 60 растворяют в 20 мл безводного THF. Реакционную среду охлаждают до 0C и затем порциями добавляют 9,1 мл 1,4 М CH3Li в THF. Смесь оставляют возвращаться к температуре окружающей среды и затем перемешивают в течение 2 ч. Реакционную среду вливают в 1 н. HCl и затем промывают AcOEt. Водную фазу подщелачивают 5 н. NaOH и затем продукт экстрагируют AcOEt. Органическую фазу сушат над MgSO4, фильтруют и упаривают до сухого состояния. Остаток очищают на колонке с диоксидом кремния, элюируя смесью AcOEt/петролейный эфир (об./об.; 80/20), а затем чистымAcOEt. Получают 40 мг ожидаемого соединения, т.пл.=258-260C. ЯМР d6-DMSO (300 МГц): 2,43 м.д. (s, 3H); 2,63 м.д. (s, 3H); 3,70 м.д. (s, 3H); 7,03-8,43 м.д. (неразрешенный пик, 8H); 11,92 м.д. (s, 1H). Пример 23. Соединение 127. 1,6-Диметил-3-(3-(пиридин-2-иламино)фенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 500 мг соединения со стадии А примера 18, 180 мг 2-аминопиридина, 315 мг NaO-трет-Bu, 50 мгPd2(dba)3 и 95 мг Xant phos растворяют в 7 мл диоксана (в герметично закрытой пробирке). Реакционную среду дегазируют в течение 30 мин и затем нагревают при 100C в течение ночи. Смесь возвращают к температуре окружающей среды. После очистки на колонке с диоксидом кремния, элюируя этилацетатом, получают 380 мг порошка. Т.пл.=250-252C. ЯМР d6-DMSO (300 МГц): 2,42 м.д. (s, 3H); 3,70 м.д. (s, 3H); 6,71-8,27 м.д. (неразрешенный пик,12H); 9 м.д. (s, 1H); 11,88 м.д. (s, 1H). Пример 24. Соединение 94. (3-(1,6-Диметил-2-оксо-2,9-дигидро-2H-пиридо[2,3-b]индол-3-ил)фенокси)ацетонитрил. 0,1 г соединения 66 (пример 9) растворяют в 10 мл DMF. Добавляют 90 мл K2CO3 и затем 0,12 мл бромацетонитрила. Смесь нагревают при 90C в течение 48 ч. Реакционную среду вливают в насыщенный раствор NH4Cl, смесь подщелачивают гидроксидом натрия и затем проводят экстракцию AcOEt. Очистку осуществляют посредством хроматографии на колонке с диоксидом кремния, элюируя смесьюAcOEt/петролейный эфир (об./об.; 75/25). Получают 20 мг порошка, т.пл.=195-196C. ЯМР d6-DMSO (300 МГц): 2,73 м.д. (s, 3H); 4,27 м.д. (s, 6H); 5,02 м.д. (s, 2H); 7,09-8,26 м.д. (неразрешенный пик, 8H). Пример 25. Соединение 133. 1,6-Диметил-3-(3-(морфолин-4-илкарбонил)фенил)-1,9-дигидро-2H-пиридо[2,3b]индол-2-он. А) 3-(1,6-Диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-3-ил)бензойная кислота. 200 мг соединения из примера 18 растворяют в 10 мл MeOH. Добавляют 2 мл воды и затем 97 мгLiOHH2O. Смесь нагревают при 80C в течение 20 ч. Смесь оставляют возвращаться к температуре окружающей среды. Выпаривают MeOH, остаток переносят в воду и затем водную фазу промывают AcOEt. Водную фазу подщелачивают 5 н. NaOH и затем экстрагируют AcOEt. Органическую фазу сушат надMgSO4, фильтруют и упаривают до сухого состояния. Полученный осадок растирают в смеси петролейный эфир/AcOEt (2%). Осадок отфильтровывают и сушат. Получают 40 мг порошка. ЯМР d6-DMSO (300 МГц): 2,42 м.д. (s, 3H); 3,70 м.д. (s, 3H); 7,04-8,42 м.д. (неразрешенный пик,8H); 11,93 м.д. (s, 1H); 12,87 м.д. (неразрешенный пик, 1H). Б) 1,6-Диметил-3-(3-(морфолин-4-илкарбонил)фенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 200 мг соединения с предыдущей стадии растворяют в 20 мл CH2Cl2. Добавляют 0,06 мл морфолина, 340 мг BOP и 10 мл DMF. Реакционную смесь перемешивают при температуре окружающей среды в течение приблизительно 2 ч. Реакционную среду вливают в насыщенный раствор NH4C и экстрагируютAcOEt. Осуществляют промывку кислотой/щелочью и затем полученный осадок промывают смесью изоPrOH/петролейный эфир (об./об.; 50/50). Получают 90 мг порошка, т.пл.=296-298C. ЯМР d6-DMSO (300 МГц): 2,42 м.д. (s, 3H); 3,38-3,62 м.д. (s, 8H); 3,69 м.д. (s, 3H); 7,03-8,42 м.д. (неразрешенный пик, 8H); 11,92 м.д. (s, 1H). Пример 26. Соединение 123. 6-Циано-3-(3,5-диметилфенил)-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. А) 6-Бром-3-(3,5-диметилфенил)-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Это соединение получают обычными способами. ЯМР d6-DMSO (300 МГц): 2,31 м.д. (s, 6H); 3,69 м.д. (s, 3H); 6,91 м.д. (s, 1H); 7,28-7,44 м.д. (неразрешенный пик, 4H); 8,15 м.д. (d, 1H); 8,38 м.д. (s, 1H); 12,30 м.д. (s, 1H). Б) 6-Циано-3-(3,5-диметилфенил)-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 2,0 г соединения с предыдущей стадии растворяют в 50 мл N-метилпирролидинона. Добавляют 0,9 г CuCN и затем смесь нагревают при 200C в течение 24 ч. Реакционную среду вливают в CH2Cl2 и затем промывают 1 н. раствором HCl. Продукт адсорбируют на диоксид кремния и очищают хроматографией на колонке, элюируя смесью AcOEt/петролейный эфир (об./об.; 50/50), затем чистым AcOEt, а по- 19010833 том смесью AcOEt/MeOH 2%. Получают 1,2 г порошка. ЯМР d6-DMSO (300 МГц): 2,31 м.д. (s, 6H); 3,70 м.д. (s, 3H); 6,93 м.д. (s, 1H); 7,33 м.д. (s, 2H); 7,58 м.д. (неразрешенный пик, 2H); 8,42 м.д. (неразрешенный пик, 2H); 12,55 м.д. (s, 1H). Пример 27. Соединение 96. (3-(2,4-Дихлорфенил)-1,6-диметил-2-оксо-1,2-дигидро-9H-пиридо[2,3-b]индол-9 ил)ацетонитрил. 600 мг соединения 46 растворяют в 10 мл DMF. Добавляют 42 мг 95%-ного NaH. Смесь перемешивают при температуре окружающей среды в течение 30 мин и затем добавляют 230 мг бромацетонитрила. Смесь перемешивают при температуре окружающей среды в течение 18 ч. Смесь концентрируют до половины объема и осуществляют осаждение, добавляя воду. Получают 200 мг ожидаемого продукта,т.пл.=270C. Пример 28. Соединение 92. 9-(3-Аминопропил)-3-(2,4-дихлорфенил)-1,6-диметил-1,6-диметил-1,9-дигидро-2Hпиридо[2,3-b]индол-2-она гидрохлорид. А) 2-(3-(3-(2,4-Дихлорфенил)-1,6-диметил-2-оксо-1,2-дигидро-9H-пиридо[2,3-b]индол-9 ил)пропил)-1H-изоиндол-1,3(2H)-дион. 0,5 г соединения 46 растворяют в 5 мл DMF, добавляют 107 мг 95%-ного NaH и смесь перемешивают при температуре окружающей среды в течение 10 мин. Добавляют 1,25 г 2-(3-бромпропил)-1Hизоиндол-1,3(2H)диона и смесь перемешивают при температуре окружающей среды в течение 18 ч. Смесь упаривают, остаток переносят в CH2Cl2 и органическую фазу промывают NaCl, а потом H2O. Осуществляют хроматографию на диоксиде кремния, при этом элюирование проводят смесьюCHCl3/MeOH (об./об.; 98/2). Получают 160 мг ожидаемого продукта, т.пл.=249C. Б) 9-(3-Аминопропил)-3-(2,4-дихлорфенил)-1,6-диметил-1,6-диметил-1,9-дигидро-2H-пиридо[2,3b]индол-2-она гидрохлорид. Перемешивают 180 мг соединения с предыдущей стадии, 3,2 мл THF, 5 мл EtOH и 33 мкл гидразина гидрата. Смесь нагревают с обратным холодильником в течение 18 ч; фильтруют и выпаривают HCl фазу. Проводят сушку. Получают 16 мг ожидаемого продукта, т.пл.=198C. Пример 29. Соединение 91. 3-(2,4-Дихлорфенил)-9-(2-гидроксиэтил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3b]индол-2-он. А) 3-(2,4-Дихлорфенил)-1,6-диметил-9-тетрагидро-2H-пиран-2-илокси)этил)-1,9-дигидро-2Hпиридо[2,3-b]индол-2-он. 695 г соединения 46 растворяют в 7 мл DMF. Добавляют 99 мг 95%-ного NaH. Смесь перемешивают при температуре окружающей среды в течение 15 мин. Добавляют 813 мг 2-(2-бромэтокси)тетрагидро-2H-пирана и смесь перемешивают при температуре окружающей среды в течение 18 ч. Смесь упаривают до сухого состояния, остаток переносят в CH2Cl2 и органическую фазу промывают NaCl, а затем H2O. Ее сушат и упаривают. Остаток хроматографируют смесью CHCl3/MeOH(об./об.; 98/2). Получают 390 мг ожидаемого продукта, т.пл.=161C. Б) 3-(2,4-Дихлорфенил)-9-(2-гидроксиэтил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Смешивают 295 мг продукта с предыдущей стадии, 1,21 мг пара-толуолсульфокислоты и 10 мл 95%-ного EtOH. Смесь нагревают с обратным холодильником в течение 8 ч и упаривают до сухого состояния. Твердое вещество промывают NaHCO3, затем H2O и сушат. Получают 198 мг ожидаемого продукта, т.пл.=240C. Пример 30. Соединение 102. 3-(2,4-Диметилфенил)-1,6,9-триметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. 400 мг 3-(2,4-диметилфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она (соединения 101) растворяют в 10 мл DMF. Добавляют 31 мг 95%-ного NaH и смесь перемешивают при температуре окружающей среды в течение 30 мин. Добавляют 380 мкл метилйодида и смесь перемешивают при температуре окружающей среды в течение 18 ч. Смесь упаривают до сухого состояния. Остаток переносят вCH2Cl2 и органическую фазу промывают NaCl, затем водой, сушат и упаривают. Остаток переносят вEt2O, осуществляют фильтрацию и сушку. Получают 300 мг ожидаемого продукта, т.пл.=150C. Пример 31. Соединение 57. 3-(2-Хлор-4-метоксифенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-он. Готовят смесь 10 мл безводного DMF и 0,6 мл безводного метанола и к ней добавляют 0,5 г 60%-ного NaH. После прекращения выделения газа добавляют 0,43 г соединения 59 и затем смесь нагревают при 80C в течение 24 ч. Реакционную среду вливают в насыщенный раствор NH4Cl, затем образовавшийся осадок отфильтровывают и промывают смесью изопропанол/ петролейный эфир (об./об.; 50/50). Получают 0,35 г ожидаемого соединения. ЯМР d6-DMSO (300 МГц): 2,46 м.д. (s, 3H); 3,72 м.д. (s, 3H); 3,87 м.д. (s, 3H); 6,98-7,15 м.д. (неразрешенный пик, 3H); 7,3-7,6 м.д. (неразрешенный пик, 2H); 7,68 м.д. (s, 1H); 8,15 м.д. (s, 1H); 11,95 м.д. (s,1H).- 20010833 Химические структуры и физические свойства нескольких соединений по изобретению приведены в табл. 4. В этой таблице Me представляет собой метил, Et представляет собой этил, трет-Bu представляет собой трет-бутил, Bn представляет собой бензил. Таблица 4(s, 1H). Соединение 114. ЯМР d6-DMSO (300 МГц): 3,69 м.д. (s, 3H); 7,4 м.д. (неразрешенный пик, 4H); 7,67 м.д. (d, 1H); 8,09 м.д. (d, 1H); 8,29 м.д. (s, 1H); 12,28 м.д. (s, 1H). Соединение 116. ЯМР d6-DMSO (300 МГц): 2,41 м.д. (s, 3H); 3,67 м.д. (s, 3H); 6,12 м.д. (s, 2H); 7,02 м.д. (s, 1H); 7,10 м.д. (s, 1H); 7,19 м.д. (s, 1H); 7,36 м.д. (d, 1H); 7,63 м.д. (s, 1H); 8,05 м.д. (s, 1H); 11,92 м.д. (s, 1H). Соединение 117. ЯМР d6-DMSO (300 МГц): 2,42 м.д. (s, 3H); 3,68 м.д. (s, 3H); 3,78 м.д. (s, 6H); 6,418,37 м.д. (неразрешенный пик, 7H); 11,89 м.д. (s, 1H). Соединение 119. ЯМР d6-DMSO (200 МГц): 2,4 м.д. (s, 3H); 3,7 м.д. (s, 3H); 7-7,2 м.д. (неразрешенный пик, 3H); 7,4 м.д. (d, 1H); 7,7 м.д. (s, 1H); 7,8 м.д. (d, 2H); 8,4 м.д. (s, 1H). Соединение 122. ЯМР d6-DMSO (300 МГц): 2,5 м.д. (s, 6H); 3,79 м.д. (s, 3H); 4,03 м.д. (неразрешенный пик, 2H); 6,92-8,28 м.д. (неразрешенный пик, 7H); 12,46 м.д. (s, 1H). Соединение 124. ЯМР d6-DMSO (300 МГц): 2,43 м.д. (s, 3H); 3,98 м.д. (s, 3H); 4,08 м.д. (s, 3H); 7,06- 26010833 7,16 м.д. (неразрешенный пик, 8H). Соединение 125. ЯМР d6-DMSO (300 МГц): 2,31 м.д. (s, 6H); 3,69 м.д. (s, 3H); 6,91 м.д. (s, 1H); 7,287,44 м.д. (неразрешенный пик, 4H); 8,15 м.д. (d, 1H); 3,38 м.д. (s, 1H); 12,30 м.д. (s, 1H). Соединение 126. ЯМР d6-DMSO (300 МГц): 2,43 м.д. (s, 3H); 3,70 м.д. (s, 3H); 7,05-8,88 м.д. (неразрешенный пик, 8H); 11,97 м.д. (s, 1H). Соединение 128. ЯМР d6-DMSO (300 МГц): 3,61 м.д. (s, 3H); 3,78 м.д. (s, 3H); 6,83 м.д. (dd, 1H); 7,33-7,48 м.д. (неразрешенный пик, 4H); 7,66 м.д. (d, 1H); 8,17 м.д. (s, 1H); 11,91 м.д. (s, 1H). Соединение 129. ЯМР d6-DMSO (300 МГц): 2,42 м.д. (s, 3H); 3,69 м.д. (s, 3H); 5,15 м.д. (s, 2H); 6,938,36 м.д. (неразрешенный пик, 13H); 11,88 м.д. (s, 1H). Соединение 130. ЯМР d6-DMSO (300 МГц): 2,42 м.д. (s, 3H); 3,68 м.д. (s, 3H); 6,67 м.д. (dd, 1H); 7,02 м.д. (dd, 1H); 7,03-7,24 м.д. (неразрешенный пик, 3H); 7,34 м.д. (d, 1H); 7,68 м.д. (s, 1H); 8,25 м.д. (s, 1H); 9,26 м.д. (bs, 1H); 11,85 м.д. (bs, 1H). Соединение 131. ЯМР d6-DMSO (300 МГц): 2,43 м.д. (s, 3H); 7,05-8,61 м.д. (неразрешенный пик,7H); 12,00 м.д. (s, 1H). Соединение 134. ЯМР d6-DMSO (300 МГц): 2,43 м.д. (s, 3H); 4,02 м.д. (s, 3H); 7,06 м.д. (dd, 1H); 7,29 м.д. (bs, 1H); 7,35 м.д. (d, 1H); 7,72 м.д. (s, 1H); 7,84-7,94 м.д. (неразрешенный пик, 5H); 8,45 м.д. (s, 1H). Соединение 138. ЯМР d6-DMSO (300 МГц): 1,71 м.д. (s, 3H); 2,44 м.д. (s, 3H); 2,64 м.д. (s, 3H); 4,02 м.д. (s, 3H); 4,20 м.д. (s, 3H); 7,12 м.д. (d, 1H); 7,48-7,56 м.д. (неразрешенный пик, 2H); 7,76 м.д. (неразрешенный пик, 1H); 7 87 м.д. (d, 1H); 8,03 м.д. (d, 1H); 8,35 м.д. (неразрешенный пик, 1H); 8,46 м.д. (s,1H). Соединение 140. ЯМР d6-DMSO (300 МГц): 2,79 м.д. (s, 3H); 3,69 м.д. (s, 3H); 6,83 м.д. (t, 1H); 7,03 м.д. (dd, 1H); 7,34 м.д. (d, 1H); 7,66-7,80 м.д. (неразрешенный пик, 5H); 8,27 м.д. (s, 1H); 8,49 м.д. (d, 1H); 9,63 м.д. (s, 1H); 11 84 м.д. (s, 1H). Соединение 141. ЯМР d6-DMSO (300 МГц): 2,45 м.д. (s, 3H); 4,04 м.д. (s, 3H); 5,22 м.д. (s, 2H); 5,87 м.д. (s, 2H); 7,01-9,31 м.д. (неразрешенный пик, 8H). Соединение 142. ЯМР d6-DMSO (300 МГц): 2,21 м.д. (s, 6H); 2,43 м.д. (s, 3H); 2,64 м.д. (t, 2H); 3,99 м.д. (s, 3H); 4,62 м.д. (t, 2H); 6,67-8,29 м.д. (неразрешенный пик, 8H); 9,27 м.д. (s, 1H). Соединение 145. ЯМР d6-DMSO/TFA (200 МГц): 2,4 м.д. (s, 3H); 3,7 м.д. (s, 3H); 6,9-7,1 м.д. (неразрешенный пик, 2H); 7,3-7,45 м.д. (неразрешенный пик, 3H); 7,5-7,7 м.д. (неразрешенный пик, 2H); 8,35 м.д. (s, 1H). Соединение 148. ЯМР d6-DMSO (300 МГц): 2,40 м.д. (s, 3H); 3,67 м.д. (s, 3H); 7,04 м.д. (d, 1H); 7,35 м.д. (неразрешенный пик, 2H); 7,57 м.д. (dd, 1H); 7,63 м.д. (s, 1H); 7,77 м.д. (d, 1H); 8,12 м.д. (s, 1H); 11,96 м.д. (s, 1H). Соединение 150. ЯМР d6-DMSO (300 МГц): 2,43 м.д. (неразрешенный пик, 2H); 2,51 м.д. (s, 3H); 4,10-4,30 м.д. (неразрешенный пик, 4H); 7,17-8,20 м.д. (неразрешенный пик, 7H). Соединение 155. ЯМР d6-DMSO (300 МГц): 1,36 м.д. (t, J=7,0, 3H); 4,02 м.д. (s, 3H); 4,34 м.д. (q,J=7,0, 2H); 5,97 м.д. (s, 2H); 7,48 м.д. (неразрешенный пик, 2H); 7,70 м.д. (s, 1H); 7,88 м.д. (d, J=8,6, 1H); 7,98 м.д. (dd, J=1,5; J=8,6, 1H); 8,47 м.д. (s, 1H); 8,61 м.д. (s, 1H). Соединение 156. ЯМР d6-DMSO (300 МГц): 1,33 м.д. (t, J=7, 3H); 3,70 м.д. (s, 3H); 4,32 м.д. (q, J=7,2H); 7,41 м.д. (неразрешенный пик, 2H); 7,46 м.д. (d, J=8,5, 1H); 7,67 м.д. (s, 1H); 7,86 м.д. (d, J=8,5, 1H); 8,34 м.д. (s, 1H); 8,53 м.д. (s, 1H); 12,46 м.д. (s, 1H). Соединение 159. ЯМР d6-DMSO (300 МГц): 2,42 м.д. (s, 3H); 3,69 м.д. (s, 3H); 7,05 м.д. (d, J=7,0,1H); 7,21 м.д. (d, J=7,29, 1H); 7,37 м.д. (d, J=8,15, 2H); 7,51 м.д. (d, J=2,6, 1H); 7,54 м.д. (s, 1H); 7,64 м.д. (s,1H); 8,14 м.д. (s, 1H); 8,34 м.д. (d, J=7,22, 2H); 10,71 м.д. (s, 1H); 12,03 м.д. (s, 1H). Соединение 160. ЯМР d6-DMSO (300 МГц): 2,40 м.д. (s, 3H); 3,17 м.д. (неразрешенный пик, 4H); 3,66 м.д. (s, 3H); 3,75 м.д. (неразрешенный пик, 4H); 6 94 м.д. (dd, J=2,45; J=8,60, 1H); 7,03 м.д. (неразрешенный пик, 2H); 7,23 м.д. (d, J=8,51, 1H); 7,34 м.д. (d, J=8,12, 1H); 7,62 м.д. (s, 1H); 8,02 м.д. (s, 1H); 11,87 м.д. (s, 1H). Соединение 166. ЯМР d6-DMSO (300 МГц): 3,73 м.д. (s, 3H); 3,97 м.д. (s, 3H); 7,56 м.д. (d, 1H); 7,63 м.д. (d, 1H); 7,95 м.д. (d, 1H); 8,07 м.д. (неразрешенный пик, 2H); 8,73 м.д. (s, 1H); 8,92 м.д. (s, 1H); 12,57 м.д. (s, 1H). Соединения по изобретению являлись объектом фармакологических клинических испытаний, которые позволяли определить их противораковую активность. Соединения формулы (I) по настоящему изобретению испытывали in vitro на линии раковых клеток молочной железы человека: линии MDA-MB-231, имеющейся в American Type Culture Collection (Американской коллекции типовых культур) (обозначенной HTB26). Антипролиферативное действие оценивают в соответствии с J.M. Derocq et al., FEBS letters, 1998,425, 419-425: уровень включения [3H]тимидина в ДНК обработанных клеток измеряют после инкубирования соединения формулы (I) в течение 96 ч. Ингибирующую концентрацию 50 (IC50) определяют как концентрацию, которая ингибирует пролиферацию клеток на 50%. Соединения по изобретению в основном демонстрируют IC50 менее 10 мкМ по отношению к линии- 27010833 Соединения формулы (I) также испытывали на другой линии раковых клеток молочной железы человека, линии "мультирезистентной к лекарственным средствам" (MDR), называемой MDA-A1. Эта линия описана E. Collomb, C. Dussertand P.M. Martin, Cytometry, 1991, 12 (1), 15-25. Термин "мультирезистентный", который описывает эту линию, означает, что указанная линия в общем случае является не очень чувствительной к общеупотребительным химиотерапевтическим лекарственным средствам, и в частности к антимитотическим агентам природного происхождения, таким как паклитаксел, винкристин или винбластин. Соединения по изобретению в основном демонстрируют IC50 менее 10 мкМ по отношению к мультирезистентной линии MDA-A1. Соединения по изобретению также испытывали in vivo на мышиных моделях ксенотрансплантатов опухолей человека в соответствии со способами, описанными в литературе: Mooberry S.L. et al., Int. J.Cancer, 2003, 104 (4), 512-521; Polin L. et al., Invest. New Drugs, 2002, 20 (1), 13-22; Corbett T.H. et al., Invest. New Drugs, 1999, 17 (1), 17-27. Фрагменты опухолей человека диаметром от 2 до 3 мм подкожно имплантируют мышам линии Balb/C (Iffa-Credo, Lyons, France) с тяжелым комбинированным иммунодефицитом (SCID). Когда масса этих опухолей достигает 50-60 мг, ежедневно или каждые два дня на протяжении всего эксперимента (от 20 до 40 дней) перорально или внутривенно вводят соединения в дозах,варьирующихся от 10 до 300 мг/кг на введение. Массу опухолей W (в мг) рассчитывают по формулеW=(ab2)/2,где а и b, соответственно, представляют собой длину и ширину опухолевого имплантата. Измерение a и b проводят, используя штангенциркуль. Противоопухолевую эффективность оценивают, сравнивая среднюю массу опухолей в группе животных, обработанных испытываемым соединением (T), со средней массой опухолей животных контрольной группы, которым вводили только растворитель соединения (C). Такое измерение, выражаемое в % отношения T/C, проводят, когда C достигает приблизительно 1000 мг. Соединения по изобретению демонстрируют in vivo противоопухолевую активность (отношениеT/C менее 100%), некоторые - очень значительную, с отношением T/C меньше или равным 42%. Таким образом, согласно настоящему изобретению, ясно, что соединения формулы (I) ингибируют пролиферацию опухолевых клеток, включая опухолевые клетки, демонстрирующие мультирезистентность. Таким образом, ясно, что соединения по изобретению обладают противораковой активностью. Таким образом, согласно другим аспектам предметом изобретения являются лекарства, которые содержат соединение формулы (I) или его соль присоединения фармацевтически приемлемой кислоты или также гидрат или сольват соединения формулы (I). Такие лекарства находят применение в терапии, в частности в лечении или защите от болезней, вызванных или осложненных пролиферацией опухолевых клеток. Такие соединения, в качестве ингибиторов пролиферации опухолевых клеток, полезны в лечении солидных опухолей, как первичных, так и метастатических солидных опухолей, карцином и видов рака,в частности рака молочной железы; рака легкого; рака тонкой кишки; рака ободочной кишки и рака прямой кишки; рака дыхательных путей, ротовой части глотки и подглоточника; рака пищевода; рака печени, рака желудка, рака желчных протоков, рака желчного пузыря, рака поджелудочной железы; видов рака мочевыводящих путей, включая почки, уротелий и мочевой пузырь; видов рака женских половых путей, включая рак матки, шейки матки и яичников, хориокарциному и трофобластический рак; видов рака мужских половых путей, включая рак предстательной железы, семенных пузырьков и яичек, опухолей зародышевых клеток; видов рака эндокринных желез, включая рак щитовидной железы, гипофиза и надпочечников; видов рака кожи, включая гемангиомы, меланомы и саркомы, в том числе саркому Капоши; опухолей головного мозга, нервов, глаз и оболочек мозга, включая астроцитомы, глиомы, глиобластомы, ретинобластомы, невриномы, нейробластомы, шванномы и менингиомы; солидных опухолей,являющихся результатом гематопоэтических злокачественных опухолей, в том числе лейкемий, хлором,плазмоцитом, грибовидного микоза, T-клеточной лимфомы или лейкемии, неходжкинской лимфомы,злокачественных гемопатий и миелом. Согласно другим аспектам настоящее изобретение относится к фармацевтическим композициям,содержащим в качестве действующего начала соединение по изобретению. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения по изобретению или фармацевтически приемлемой соли, гидрата или сольвата указанного соединения и по меньшей мере один фармацевтически приемлемый эксципиент. Указанные эксципиенты выбирают в соответствии с фармацевтической формой и желательным способом введения из обычных эксципиентов, которые известны специалисту в данной области техники. В фармацевтических композициях по настоящему изобретению для перорального, подъязычного,подкожного, внутримышечного, внутривенного, местного, локального, интратрахеального, интраназального, трансдермального или ректального введения действующее начало приведенной выше формулы (I) или его возможную соль, сольват или гидрат можно вводить в стандартной форме введения в виде смеси с традиционными фармацевтическими эксципиентами животным и человеку для профилактики или лечения указанных выше расстройств или заболеваний.- 28010833 Подходящие стандартные формы введения включают в себя формы для перорального пути введения, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы и пероральные растворы или суспензии, формы для подъязычного, защечного, интратрахеального, внутриглазного или интраназального введения, для введения путем ингаляции, формы для местного, чрескожного, подкожного, внутримышечного или внутривенного введения, формы для ректального введения и имплантаты. Для местного использования соединения по изобретению можно применять в кремах, гелях, мазях или лосьонах. Соединения указанной выше формулы (I) можно применять в суточных дозах от 0,002 до 2000 мг на килограмм веса тела млекопитающего, которого лечат, предпочтительно в суточных дозах от 0,1 до 300 мг/кг. Для человека доза предпочтительно может меняться от 0,02 до 10000 мг в день, более конкретно от 1 до 3000 мг в зависимости от возраста пациента, которого лечат, или типа лечения: профилактического или радикального. В особых случаях подходящими могут быть более высокие или более низкие дозы; такие дозы не выходят за пределы объема изобретения. Согласно обычной практике дозу, подходящую для каждого пациента, определяет врач в соответствии со способом введения, массой и реакцией указанного пациента. Согласно другим аспектам настоящее изобретение также относится к способу лечения указанных выше патологий, который включает введение пациенту эффективной дозы соединения по изобретению,или одной(ого) из ето фармацевтически приемлемых солей, или его гидратов, или сольватов. Согласно настоящему изобретению соединение или соединения формулы (I) можно вводить в комбинации с одним или более противораковыми действующими началами, в частности противоопухолевыми соединениями, такими как алкилирующие агенты, такие как алкилсульфонаты (бусульфан), дакарбазин, прокарбазин, азотистыми аналогами иприта (хлорметин, мельфалан, хлорамбуцил), циклофосфамидом или ифосфамидом; нитрозомочевинами, такими как кармустин, ломустин, семустин или стрептозоцин; антинеопластическими алкалоидами, такими как винкристин или винбластин; таксанами, такими как паклитаксел или таксотэр; антинеопластическими антибиотиками, такими как актиномицин; интеркалирующими агентами, антинеопластическими антиметаболитами, антагонистами фолатов или метотрексатом; ингибиторами пуринового синтеза; пуриновыми аналогами, такими как меркаптопурин или 6 тиогуанин; ингибиторами пиримидинового синтеза, ингибиторами ароматазы, аналогами капецитабина или пиримидина, такими как фторурацил, гемцитабин, цитарабин и арабинозида цитозин; бреквинаром; ингибиторами топоизомеразы, такими как камптотецин или этопозид; противораковыми гормональными агонистами и антагонистами, включая тамоксифен; ингибиторами киназы, иматинибом; ингибиторами фактора роста; противовоспалительными агентами, такими как полисульфат пентозана, кортикостероиды, преднизон или дексаметазон; антитопоизомеразами, такими как этопозид, антрациклины, включая доксорубицин, блеомицин, митомицин и митрамицин; противораковыми комплексами металлов, платиновыми комплексами, цисплатином, карбоплатином или оксалиплатином; интерфероном-альфа, трифенилтиофосфорамидом или алтретамином; антиангиогенными агентами; талидомидом; иммунотерапевтическими адъювантами или вакцинами. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы где R1 представляет собой атом водорода, (C1-C4)алкильную группу или группу (CH2)nOH,(CH2)n-O-тетрагидропиран-2-ил, (CH2)nNR'6R'7, (CH2)nCN, (CH2)nCO2(C1-C4)alk или (CH2)nCONR6R7;R2 представляет собой атом водорода или (C1-C4)алкильную группу; или R1 и R2 вместе образуют группу (CH2)3;R3 представляет собой фенил, монозамещенный гидроксильной, гидроксиметильной, карбоксильной, (C1-C4)алканоильной, азидо, (C1-C4)алкоксикарбонильной, гидроксииминометильной, (C1-C4)алкилсульфонильной, трифторметильной, тиольной, (C1-C4)алкилтио или цианогруппой или группой(CH2)mNR'7R10, CONR6R8 или O(CH2)nR9; фенил, замещенный одинаковыми или разными заместителями в количестве от 2 до 5, выбранными из атома галогена, (C1-C4)алкильной, трифторметильной,гидроксильной, гидроксиметильной, (C1-C4)алкокси, карбоксильной, (C1-C4)алканоильной, азидо,(C1-C4)алкоксикарбонильной,гидроксииминометильной,тиольной,(C1-C4)алкилтио ипи(C1-C4)алкилсульфонильной группы, или фенильной, или цианогруппы, ипи группы (CH2)mNR'7R10,CONR6R8 или O(CH2)nR9; или R3 представляет собой бензодиоксолильную группу, которая не замещена или замещена в фенильной части атомом галогена;R4 и R5, одинаковые или разные, каждый независимо, представляет собой атом водорода или гало- 29010833 гена, или гидроксильную, (C1-C4)алкильнуо, трифторметильную, фенильную, циано, (C1-C4)алкокси,(C1-C4)алкоксикарбонильную или (C1-C4)алкилсульфонильную группу, или группу O-(CH2)nNR6R7 илиR6 представляет собой водород или (C1-C4)алкильную группу;R7 представляет собой водород или (C1-C4)алкильную группу; или R6 и R7 вместе с атомом азота, с которым они связаны, образуют гетероциклический радикал,выбранный из пиперидила, морфолинила, пирролидинила, пиперазинила или 4-метилпиперазин-1-ила;R'6 представляет собой водород или (C1-C4)алкильную группу;R'7 представляет собой водород или (C1-C4)алкильную группу; или R'6 и R'7 вместе с атомом азота, с которым они связаны, образуют гетероциклический радикал,выбранный из морфолинила или пирролидинила;R8 представляет собой водород, (C1-C4)алкильную группу или группу -(CH2)nNR6R7; или R6 и R8 вместе с атомом азота, с которым они связаны, образуют гетероциклический радикал,выбранный из пиперидила, морфолинила, пирролидинила, пиперазинила или 4-метилпиперазин-1-ила;R9 представляет собой фенильный радикал или амино, морфолин-4-ил, циано илиR10 представляет собой R'6 или фенильную, пиридильную или пиримидинильную группу или группу (CH2)nNR'6R'7; или R'7 и R10 вместе с атомом азота, с которым они связаны, образуют гетероциклический радикал,выбранный из пиперазинила или 4-метилпиперазин-2-ила;Alk представляет собой алкил; в форме основания или в форме соли присоединения кислоты и в форме гидрата или сольвата. 2. Соединение формулы (I) по п.1, отличающееся тем, чтоR1 представляет собой атом водорода или метильную, цианометильную, (C1-C4)алкоксикарбонилметильную, аминометильную, аминоэтильную, аминопропильную или пирролидиноэтильную группу; и/или R2 представляет собой метильную группу; и/или R1 и R2 вместе образуют группу (CH2)3; и/или R3 представляет собой фенил, монозамещенный гидроксильной, (C1-C4)алкоксикарбонильной,метилсульфонильной, трифторметильной, метилтио, цианометокси, аминоэтокси, ацетильной, гидроксиметильной, циано, амино, азидо, аминометильной или гидроксииминометильной группой или группой(CH2)mNR'7R10, где R'7 представляет собой атом водорода или метил, R10 представляет собой атом водорода или фенильную, пиридильную или пиримидинильную группу, или R'7 и R10 вместе с атомом азота, с которым они связаны, образуют пиперазин-1-ильную или 4-метилпиперазин-1-ильную группу, и m равно 0 или 1; или R3 представляет собой фенил, замещенный 2 или 3 одинаковыми или разными заместителями, выбранными из атома галогена, метильной, метокси, метилтио, трифторметильной, гидроксильной,(C1-C4)алкоксикарбонильной, метилсульфонильной, цианометокси, аминоэтокси, ацетильной, гидроксиметильной, циано, амино, азидо, аминометильной или гидроксииминометильной группы, или группы(CH2)mNR'7R10, где R'7 представляет собой атом водорода или метил, R10 представляет собой атом водорода или фенильную, пиридильную или пиримидинильную группу, или R'7 и R10 вместе с атомом азота, с которым они связаны, образуют пиперазин-1-ильную или 4-метилпиперазин-1-ильную группу, и m равно 0 или 1; или R3 представляет собой бензодиоксолильную группу, которая не замещена или замещена в фенильной части атомом галогена; и/или R4 представляет собой атом галогена или метильную, метокси или (C1-C4)алкоксикарбонильную группу; и/или R5 представляет собой атом водорода или метильную группу; в форме основания или в форме соли присоединения кислоты и в форме гидрата или сольвата. 3. Соединение формулы (I) по п.1, выбранное из 3-(2,4-диметоксифенил)-1,9-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-6-карбоновой кислоты; 3-(2,4-диметоксифенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она; 3-(3-гидроксиметилфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она; 3-(2,4-дихлорфенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она; 3-(1,6-диметил-2-оксо-2,9-дигидро-1H-пиридо[2,3-b]индол-3-ил)бензонитрила; 3-(4-аминофенил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она; 3-(6-хлор-1,3-бензодиоксол-5-ил)-1,6-диметил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она; 1,6-диметил-1,9-дигидро-3-(фениламинофенил)-2H-пиридо[2,3-b]индол-2-она; 6-бром-3-(3,5-диметилфенил)-1-метил-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она; 1,6-диметил-3-(3-(трифторметил)фенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она; 1,6-диметил-3-(3-(пиридин-2-иламино)фенил)-1,9-дигидро-2H-пиридо[2,3-b]индол-2-она;
МПК / Метки
МПК: A61K 31/437, C07D 471/16, A61P 35/00, C07D 471/04
Метки: терапевтическое, получение, 3-фенилзамещенный, применение, пиридоиндолон
Код ссылки
<a href="https://eas.patents.su/30-10833-3-fenilzameshhennyjj-piridoindolon-ego-poluchenie-i-terapevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">3-фенилзамещенный пиридоиндолон, его получение и терапевтическое применение</a>