Пиразолы и способы их получения и применения
Номер патента: 10161
Опубликовано: 30.06.2008
Авторы: Чуацюй Клаудио, Петтер Расселл К., Бориак-Сйодин Паула Энн, Шань Фэн, Линг Леона, Ли Вен-Чернг, Картер Мэрибет, Корнебайс Марк, Сингх Джусвиндер, Сунь Лихун, Понтз Тимоти У.
Формула / Реферат
1. Соединение формулы (I)
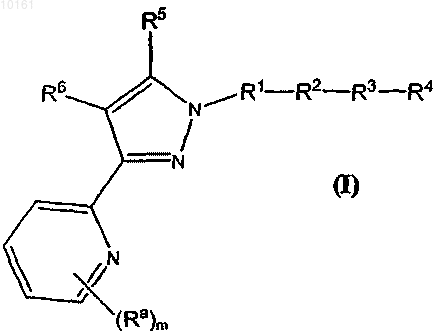
или его N-оксид, или фармацевтически приемлемая соль;
где каждый Ra независимо представляет собой алкил, алкенил, галоген, циклоалкил;
фрагмент -R1-R2-R3-R4 представляет собой водород, группы -S(O)2OH, -S(О)2NH2, необязательно замещенный алкил, необязательно замещенный циклоалкил, где необязательные заместители алкильной и циклоалкильной группы, каждый, представляют собой нитрил, амино, пирролидинил,тетразолил, гидроксил, ацетамидо, метансульфонамид, группы -S(О)2ОН, -СООН, -NHCOOH или их сложноэфирное или амидное производное;
R5 представляет собой водород, незамещенный алкил или галогензамещенный алкил;
R6 представляет собой
(1) 5-6-членный гетероциклил, содержащий в кольце 1-3 гетероатома, выбранных из группы, включающей -O-, -S-, -N= и -NRd-, где Rd представляет собой водород; указанный гетероциклил является замещенным Re и необязательно замещенным одним или двумя Rf; Re представляет собой оксо, алкокси, и Rf представляет собой алкокси, ацил, оксо; или
(2) конденсированный циклический гетероарил, выбранный из группы, включающей
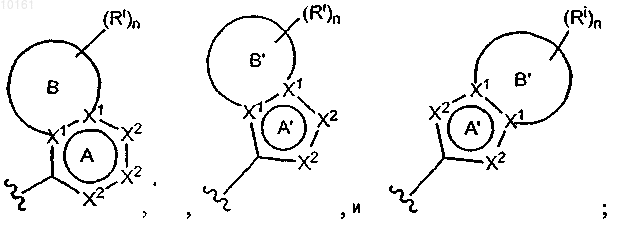
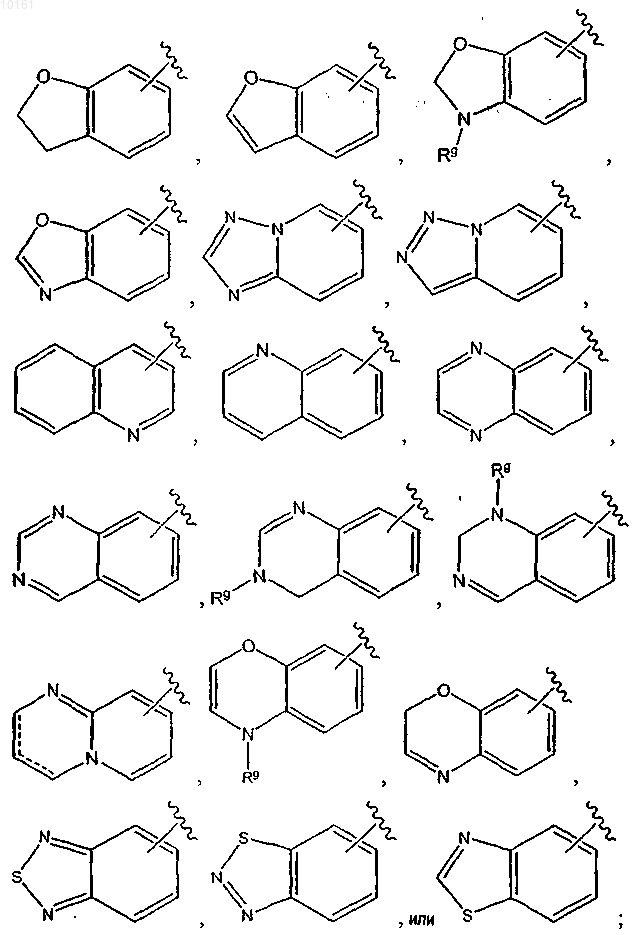
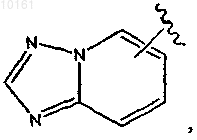
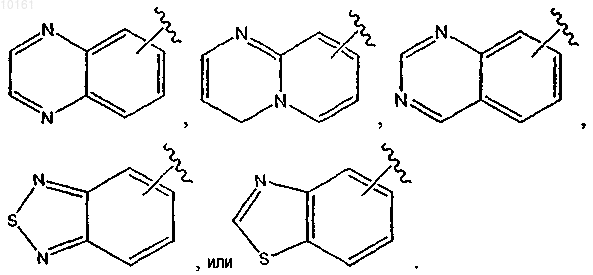
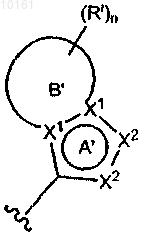
где цикл А представляет собой ароматическое кольцо, содержащее 0-3 гетероатома, и цикл В представляет собой 5-7-членное ароматическое или неароматическое кольцо, содержащее 0-3 гетероатома; при условии, что по меньшей мере один из циклов А и В содержит в кольце один или несколько гетероатомов; цикл А' представляет собой ароматическое кольцо, содержащее 0-3 гетероатома, и цикл В' представляет собой 5-7-членное насыщенное или ненасыщенное кольцо, содержащее 0-3 гетероатома; при условии, что по меньшей мере один из циклов А' и В' содержит в кольце один или несколько гетероатомов; каждый гетероатом в кольце конденсированного циклического гетероарила представляет собой -О-, -S-, -N= или -NRg-; каждый X1 атом независимо представляет собой N или С; каждый X2 независимо представляет собой -O-, -S-, -N=, -NRg- или -CHRh-; где Rg представляет собой водород; каждый из Rh и Ri независимо представляет собой алкил, алкокси, амино, циано, карбокси, аминокарбонил, алкилкарбониламино, арилкарбониламино, морфолинил, тиенил, карбамоил, арил; и n равно 0-2; и
m равно 0-3; при условии, что когда m_2, две соседних группы Ra могут соединяться с образованием 4-8-членного необязательно замещенного циклического фрагмента; при условии, что если R6 представляет собой 2-нафтиридинил, 4-хинолинил, имидазо[1,2-а]пиридил или бензимидазолил, тогда -R1-R2-R3-R4 не является Н, незамещенным алкилом, -СН2-C(О)-N(Н)-алкилом, -СН2-С(О)-N(алкил)2 или бензилом; и при условии, что алкильная группа или алкильный фрагмент содержат от 1 до 8 атомов углерода, алкенильная группа содержит от 2 до 8 атомов углерода, алкинильная группа содержит от 2 до 8 атомов углерода и циклоалкильная группа содержит от 3 до 10 атомов углерода.
2. Соединение по п.1, где R6 представляет собой 5- или 6-членный гетероциклил, содержащий в кольце 1-3-гетероатома, выбранных из группы, включающей -O-, -S-, -N= и -NRd-, где Rd представляет собой водород или алкил.
3. Соеднение по п.2, где R6 представляет собой 6-членный гетероарил, содержащий в кольце 1 или 2 гетероатома, где каждый гетероатом представляет собой -N= или -NRd-.
4. Соединение по п.3, где R6 представляет собой
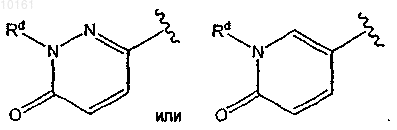
5. Соединение по п.1, где R6 представляет собой
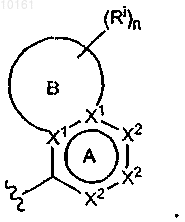
6. Соединение по п.5, где цикл В представляет собой 5-6-членное ароматическое или неароматическое кольцо.
7. Соединение по п.5, где R6 содержит в кольце по меньшей мере два гетероатома.
8. Соединение по п.5, где R6 содержит в кольце по меньшей мере три гетероатома.
9. Соединение по п.7 или 8, где в пара-положении цикла А находится один из указанных гетероатомов кольца или пара-положение цикла А замещено -ORj, -SRj, -O-CO-Rj, -O-SO2-Rj, -N(Rj)2, -NRj-CO-Rj, -NRj-SO2-Rj или -NRj-CO-N(Rj)2, где каждый Rj независимо представляет собой водород, алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероаралкил.
10. Соединение по п.6, где R6представляет собой
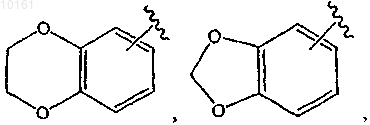
каждый из которых является необязательно замещенным алкилом, алкокси, галогеном, оксо, тиоксо, амино, алкилсульфинилом, циано, карбокси, арилом или гетероарилом, и Rg представляет собой водород, алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероаралкил.
11. Соединение по п.10, где R6 представляет собой
12. Соединение по п.6, где R6 представляет собой
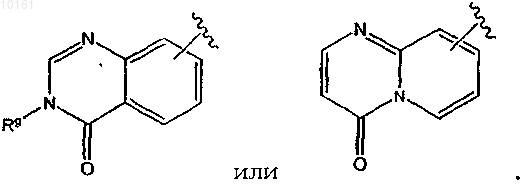
13. Соединение по п.1, где R6 представляет собой
или

14. Соединение по п.13, где цикл В' представляет собой 5-6-членное ароматическое или неароматическое кольцо.
15. Соединение по п.13, где R6 содержит в кольце по меньшей мере два гетероатома.
16. Соединение по п.13, где R6 содержит в кольце по меньшей мере три гетероатома.
17. Соединение по п.14, где R6 представляет собой
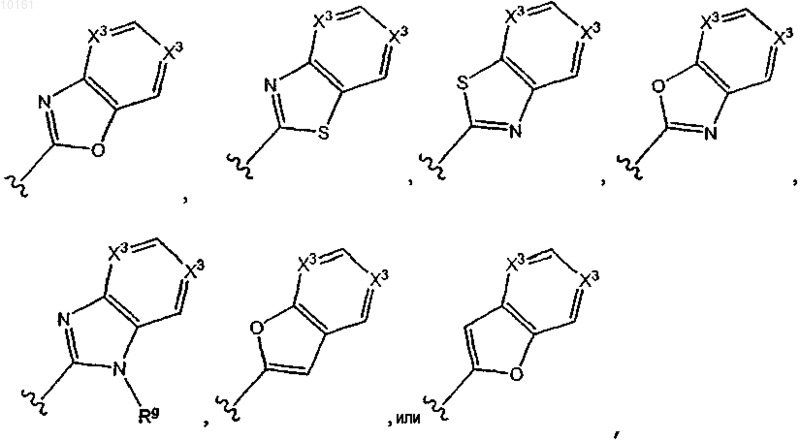
где X3 независимо представляет собой N или С; и каждый из R6 является необязательно замещенным алкилом, алкокси, галогеном, оксо, тиоксо, амино, алкилсульфинилом, цианом, карбокси, арилом или гетероарилом.
18. Соединение по п.1, где фрагмент -R1-R2-R3-R4 представляет собой необязательно замещенный алкил.
19. Соединение по п.18, где фрагмент -R1-R2-R3-R4 представляет собой метил, этил, пропил или изопропил и необязательно замещен нитрилом, амино, пирролидинилом, тетразолилом, гидроксилом, ацетамидо, метансульфонамидо.
20. Соединение по п.1, где фрагмент -R1-R2-R3-R4 представляет собой 2-ацетонитрил, 3-пропилнитрил, 2-аминоэтил, 3-аминоэтил, 3-(диметил)аминопропил, 2-(N-метансульфонамид)этил, 3-(N-метансульфонамид)пропил, 3-(пирролидинил)пропил, 2-(2Н-тетразолил)этил, или 3-(N-ацетамидо)пропил.
21. Соединение по п.1, где фрагмент -R1-R2-R3-R4 представляет собой необязательно замещенный циклоалкил.
22. Соединение по п.21, где фрагмент -R1-R2-R3-R4 представляет собой циклоалкил, необязательно замещенный группами -S(О)2ОН, -COOH, или их сложноэфирным или амидным производным.
23. Соединение по п.22, где фрагмент -R1-R2-R3-R4 представляет собой остаток циклогексилкарбаминотющ кислоты, остаток бензилового эфира циклогексилкарбаминовой кислоты, остаток циклогексилметансульфонамида, остаток бицикло[2.2.2]октанкарбоновой кислоты.
24. Соединение по п.1, где фрагмент -R1-R2-R3-R4 представляет собой остаток сульфоновой кислоты, карбаминовой кислоты, карбоновой кислоты или их сложноэфирное или амидное производное.
25. Соединение по п.24, где фрагмент -R1-R2-R3-R4 представляет собой остаток пропионовой кислоты, или N-сульфоновой кислоты, или диметиламидсульфоновой кислоты.
26. Соединение по п.1, где R5 представляет собой водород, незамещенный алкил или галогензамещенный алкил.
27. Соединение по п.1, где m равно 0, 1 или 2.
28. Соединение по п.1, где Ra является заместителем в положении 6.
29. Соединение по п.1, где каждый Ra независимо представляет собой алкил, алкокси, алкилсульфинил, галоген, амино, аминокарбонил, алкоксикарбонил, циклоалкил или гетероциклоалкил.
30. Соединение, выбранное из группы, включающей
3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропиламин,
N-[3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропил]ацетамид,
N-[3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропил]метансульфонамид,
диметил[3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропил]амин,
4-{3-пиридин-2-ил-1-[2-(1Н-тетразол-5-ил)этил]-1Н-пиразол-4-ил}хинолин,
4-[3-пиридин-2-ил-1-(3-пирролидин-1-илпропил)-1Н-пиразол-4-ил]хинолин,
5-(3-пиридин-2-ил-1Н-пиразол-4-ил)пиридин-2-иламин,
2,4-диметокси-5-(3-пиридин-2-ил-1Н-пиразол-4-ил)пиримидин,
3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропионовая кислота,
5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-1Н-индол,
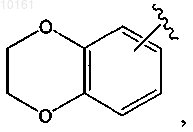
2-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-1Н-пиразол-3-ил]пиридин,
N-гидрокси-3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропионамид,
2-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)этиламин,
N-[2-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)этил]метансульфонамид,
2-метил-4-метилсульфанил-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)пиримидин,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)пиридин,
2-[4-(2,3-дигидробензофуран-5-ил)-1Н-пиразол-3-ил]пиридин,
5-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензо[d]изоксазол,
3-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]пропионитрил,
N-{3-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]пропил}метансульфонамид,
2-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-1Н-пиразол-3-ил]-6-метилпиридин,
[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]ацетонитрил,
N-{2-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]этил}метансульфонамид,
4-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]-2-метилсульфанилпиримидин,
4-(3-пиридин-2-ил-1Н-пиразол-4-ил)-2Н-фталазин-1-он,
1-[5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-2,3-дигидроиндол-1-ил]этанон,
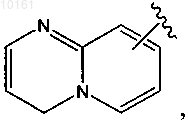
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-[1,2,4]триазоло[1,5-а]пиридин,
3-метил-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-3Н-хиназолин-4-он,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-4H-бензо[1,4]оксазин-3-он,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиноксалин,
3-(4-нитробензил)-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-3Н-хиназолин-4-он,
5-метил-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-[1,2,4]триазоло[1,5-а]пиридин,
4-метил-7-(3-пиридин-2-ил-1Н-пиразол-4-ил)-3,4-дигидро-1Н-бензо[е][1,4]диазепин-2,5-дион,
2,3-диметил-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-3Н-хиназолин-4-он,
6-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]-[1,2,4]триазоло[1,5-а]пиридин,
1-метокси-4-(3-пиридин-2-ил-1Н-пиразол-4-ил)изохинолин,
2-метил-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-[1,2,4]триазоло[1,5-а]пиридин,
4-(3-пиридин-2-ил-1Н-пиразол-4-ил)-2Н-изохинолин-1-он, 2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-трифторметилпиридин,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-винилпиридин,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-пропенилпиридин,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-этилпиридин,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-пропилпиридин,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-циклопропилпиридин,
1-[6-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)пиридин-2-ил]этанол,
4-метокси-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хинолин,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин-4-иламин,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-3Н-хиназолин-4-он,
7-(3-пиридин-2-ил-1Н-пиразол-4-ил)пиридо[1,2-а]пиримидин-4-он,
6-[3-(6-циклопропилпиридин-2-ил)-1Н-пиразол-4-ил][1,2,4]триазоло[1,5-а]пиридин,
3-метил-6-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]-3Н-хиназолин-4-он,
4-(2-{2-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]этокси}этокси)бицикло[2,2,2]октан-1-карбоновая кислота,
метиловый эфир 4-(2-{2-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]этокси}этокси)бицикло[2,2,2]октан-1-карбоновой кислоты,
метиловый эфир 4-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]бицикло[2,2,2] октан-1-карбоновой кислоты,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-изопропилпиридин,
2-(4-бензо[1,3]диоксол-5-ил-5-трифторметил-1Н-пиразол-3-ил)-6-бромпиридин,
6-[3-(5-фтор-6-метилпиридин-2-ил)-1Н-пиразол-4-ил]-[1,2,4]триазоло[1,5-а]пиридин,
6-[3-(6-трифторметилпиридин-2-ил)-1Н-пиразол-4-ил]-[1,2,4]триазоло[1,5-а]пиридин,
6-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]хиноксалин,
6-[3-(6-циклопропилпиридин-2-ил)-1Н-пиразол-4-ил]-3-метил-3Н-хиназолин-4-он,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-[1,2,4]триазоло[1,5-b]пиридазин,
6-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]хинолин,
6-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-3-фтор-2-метилпиридин,
7-метокси-3-метил-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-3Н-хиназолин-4-он,
(4-морфолин-4-илфенил)-[6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин-4-ил]амин,
4-изопропокси-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хинолин-4-иламин,
бензиловый эфир {4-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]циклогексил) карбаминовой кислоты,
4-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]циклогексиламин,
N-{4-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]циклогексил}метансульфонамид,
6-[3-(5-фтор-6-метилпиридин-2-ил)-1Н-пиразол-4-ил]хиноксалин,
7-(3-пиридин-2-ил-1Н-пиразол-4-ил)-[1,2,4]триазоло[1,5-а]пиридин,
1-трет-бутил-3-[6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин-4-ил]карбамид,
5-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензо[1,2,5]тиадиазол,
5-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензо[1,2,5]оксадиазол,
5-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензоксазол,
4-морфолин-4-ил-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин,
6-[3-(6-трифторметилпиридин-2-ил)-1Н-пиразол-4-ил]хиноксалин,
4-(4-метоксифенил)-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин,
5-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил-бензо[1,2,5]тиадиазол,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензотиазол,
3-(3-метоксифенил)-5-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензо[с]изоксазол,
[6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин-4-ил]амид 5-метилтиофен-2-карбоновой кислоты,
5-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]-3-фенилбензо[с]изоксазол,
3-(4-метоксифенил)-5-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензо[с]изоксазол,
3-(4-хлорфенил)-5-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензо[с]изоксазол,
3-(4-этилфенил)-5-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензо[с]изоксазол,
(4-метоксифенил)-[6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин-4-ил]метанон,
5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-3-тиофен-3-илбензо[с]изоксазол,
5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-1Н-индазол-3-карбоновая кислота,
метиламид 5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-1Н-индазол-3-карбоновой кислоты,
диметиламид 5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-1Н-индазол-3-карбонотющ кислоты,
(2,2-диметилпропил)амид 5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-1Н-индазол-3-карбоновой кислоты,
фениламид 5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-1Н-индазол-3-карбоновой кислоты,
морфолин-4-ил-[5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-1Н-индазол-3-ил]метанон,
бензиламид 5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-1Н-индазол-3-карбоновой кислоты и
циклопентиламид 5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-1Н-индазол-3-карбоновой кислоты.
31. Соединение, выбранное из группы, включающей
4-(3-пиридин-2-ил-1Н-пиразол-4-ил)-2Н-изохинолин-1-он,
4-метокси-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хинолин,
7-(3-пиридин-2-ил-1Н-пиразол-4-ил)пиридо[1,2-а]пиримидин-4-он,
6-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]-[1,2,4]триазоло[1,5-а]пиридин,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин-4-иламин,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-3Н-хиназолин-4-он,
6-[3-(6-циклопропилпиридин-2-ил)-1Н-пиразол-4-ил]-[1,2,4]триазоло[1,5-а]пиридин,
3-метил-6-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]-3Н-хиназолин-4-он,
3-метил-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-3Н-хиназолин-4-он,
2-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-1Н-пиразол-3-ил]-6-метилпиридин,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-этилпиридин,
4-(2-{2-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]этокси}этокси)бицикло [2,2,2]октан-1-карбоновая кислота,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-винилпиридин,
метиловый эфир 4-(2-{2-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]этокси} этокси)бицикло[2,2,2]октан-1-карбоновой кислоты,
3-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]пропионитрил,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-циклопропилпиридин,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-пропилпиридин,
N-[2-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)этил]метансульфонамид,
N-{3-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]пропил}метансульфонамид,
3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)-пропионовая кислота,
[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]ацетонитрил,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-4Н-бензо[1,4]оксазин-3-он,
4-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]-2-метилсульфанилпиримидин,
5-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензо[d]изоксазол,
N-{2-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]этил}метансульфонамид,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-трифторметилпиридин,
N-[3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропил]метансульфонамид,
4-{3-пиридин-2-ил-1-[2-(1Н-тетразол-5-ил)этил]-1Н-пиразол-4-ил}хинолин,
метиловый эфир 4-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]бицикло[2,2,2] октан-1-карбоновой кислоты,
4-(3-пиридин-2-ил-1Н-пиразол-4-ил)-2Н-фталазин-1-он,
3-(4-нитробензил)-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-3Н-хиназолин-4-он,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-пропенилпиридин,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-6-изопропилпиридин,
1-[6-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)пиридин-2-ил]этанол,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-[1,2,4]триазоло[1,5-а]пиридин,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиноксалин,
5-метил-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-[1,2,4]триазоло[1,5-а]пиридин,
2-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-1Н-пиразол-3-ил]пиридин,
2-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)пиридин,
2-[4-(2,3-дигидробензофуран-5-ил)-1Н-пиразол-3-ил]пиридин,
2-(4-бензо[1,3]диоксол-5-ил-5-трифторметил-1Н-пиразол-3-ил)-6-бромпиридин,
6-[3-(5-фтор-6-метилпиридин-2-ил)-1Н-пиразол-4-ил]-[1,2,4]триазоло[1,5-а]пиридин,
6-[3-(6-трифторметилпиридин-2-ил)-1Н-пиразол-4-ил]-[1,2,4]триазоло[1,5-а]пиридин,
6-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]хиноксалин,
6-[3-(6-циклопропилпиридин-2-ил)-1Н-пиразол-4-ил]-3-метил-3Н-хиназолин-4-он,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)-[1,2,4]триазоло[1,5-b]пиридазин,
6-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]хинолин,
6-(4-бензо[1,3]диоксол-5-ил-1Н-пиразол-3-ил)-3-фтор-2-метилпиридин,
(4-морфолин-4-илфенил)-[6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин-4-ил]амин,
4-изопропокси-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хинолин-4-иламин,
6-[3-(5-фтор-6-метилпиридин-2-ил)-1Н-пиразол-4-ил]хиноксалин,
7-(3-пиридин-2-ил-1Н-пиразол-4-ил)-[1,2,4]триазоло[1,5-а]пиридин,
1-трет-бутил-3-[6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин-4-ил]карбамид,
5-(3-пиридин-2-ил-1H-пиразол-4-ил)бензо[1,2,5]тиадиазол,
5-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензо[1,2,5]оксадиазол,
5-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензоксазол,
4-морфолин-4-ил-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин,
6-[3-(6-трифторметилпиридин-2-ил)-1Н-пиразол-4-ил]хиноксалин,
4-(4-метоксифенил)-6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин,
5-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]бензо[1,2,5]тиадиазол,
6-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензотиазол,
[6-(3-пиридин-2-ил-1Н-пиразол-4-ил)хиназолин-4-ил]амид 5-метилтиофен-2-карбоновой кислоты,
5-[3-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]-3-фенилбензо[с]изоксазол,
3-(4-этилфенил)-5-(3-пиридин-2-ил-1Н-пиразол-4-ил)бензо[с]изоксазол,
5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-3-тиофен-3-илбензо[с]изоксазол и
метиламид 5-(3-пиридин-2-ил-1Н-пиразол-4-ил)-1Н-индазол-3-карбоновой кислоты.
32. Соединение формулы (I)
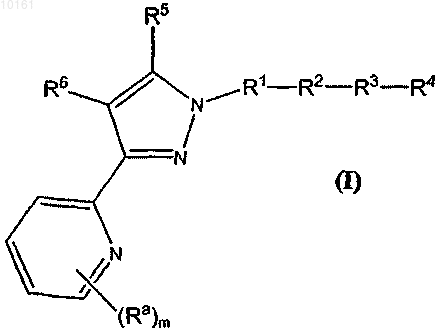
или его N-оксид, или фармацевтически приемлемая соль;
где каждый Ra независимо представляет собой алкил, алкенил, галоген, циклоалкил;
фрагмент -R1-R2-R3-R4 представляет собой водород, группы -S(O)2OH, -S(O)2NH2, необязательно замещенный алкил, необязательно замещенный циклоалкил, где необязательные заместители алкильной и циклоалкильной группы, каждый, представляют собой нитрил, амино, пирролидинил, тетразолил, гидроксил, ацетамидо, метансульфонамид, группы -S(О)2ОН, -СООН, -NHCOOH или их сложноэфирное или амидное производное;
R5 представляет собой водород, незамещенный алкил или галогензамещенный алкил;
R6 представляет собой
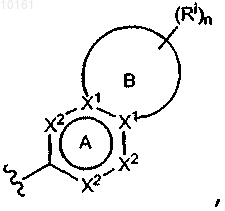
где цикл А представляет собой ароматическое кольцо, содержащее 0-4 гетероатома, и цикл В представляет собой 6-7-членное ароматическое или неароматическое кольцо, содержащее 0-4 гетероатома; при условии, что по меньшей мере один из циклов А и В содержит в кольце один или несколько гетероатомов; каждый гетероатом в кольце конденсированного циклического гетероарила представляет собой -О-, -S-, -N= или -NRg-; каждый X1 атом независимо представляет собой N или С; каждый X2 независимо представляет собой -O-, -S-, -N=, -NRg- или -CHRh-; где Rg представляет собой водород, алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероаралкил; каждый из Rh и Ri независимо представляет собой алкил, алкенил, алкинил, алкокси, ацил, галоген, гидрокси, амино, нитро, оксо, тиоксо, циано, гуанидино, амидино, карбокси, сульфо, меркапто, алкилсульфанил, алкилсульфинил, алкилсульфонил, аминокарбонил, алкилкарбониламино, арилкарбониламино, гетероарилкарбониламино, алкилсульфониламино, арилсульфониламино, гетероарилсульфониламино, алкоксикарбонил, алкилкарбонилокси, карбамид, тиокарбамид, сульфамоил, сульфамид, карбамоил, циклоалкил, циклоалкилокси, циклоалкилсульфанил, циклоалкилкарбонил, гетероциклоалкил, гетероциклоалкилокси, гетероциклоалкилсульфанил, гетероциклоалкилкарбонил, арил, арилокси, арилсульфанил, ароил, гетероарил, гетероарилокси, гетероарилсульфанил или гетероароил; и n равно 0-2; ш m равно 0-3; при условии, что когда m_2, две соседних группы Ra могут соединяться с образованием 4-8-членного необязательно замещенного циклического фрагмента; при условии, что если R6 представляет собой 2-нафтиридинил или 4-хинолинил, тогда -R1-R2-R3-R4 не является Н, незамещенным алкилом, -СН2-C(О)-N(Н)-алкилом, -СН2-C(О)-N(алкил)2 или бензилом; и при условии, что алкильная группа или алкильный фрагмент содержат от 1 до 8 атомов углерода, алкенильная группа содержит от 2 до 8 атомов углерода, алкинильная группа содержит от 2 до 8 атомов углерода и циклоалкильная группа содержит от 3 до 10 атомов углерода.
33. Соединение по п.32, где цикл В представляет собой 6-членное ароматическое или неароматическое кольцо.
34. Соединение по п.32, где R6 представляет собой
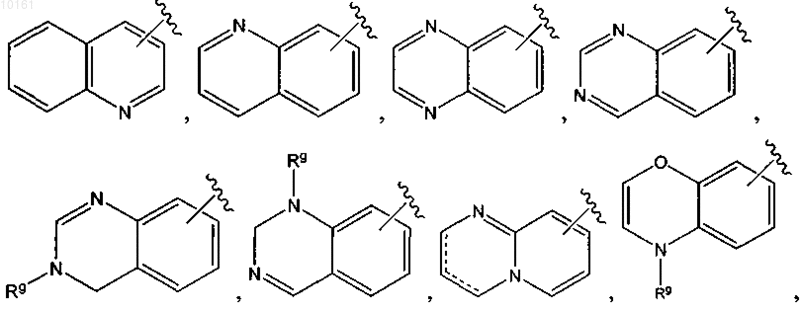
или

каждый из которых является необязательно замещенным алкилом, алкокси, галогеном, оксо, тиоксо, амино, алкилсульфинилом, циано, карбокси, арилом или гетероарилом, и Rg представляет собой водород, алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероаралкил.
35. Соединение по п.34, где R6 представляет собой

или
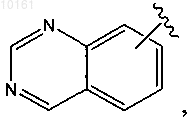
каждый из которых является необязательно замещенным алкилом, алкокси, галогеном, гидрокси, оксо, амино, алкилсульфинилом, циано, карбокси, арилом или гетероарилом.
36. Соединение по п.34, где R6 представляет собой
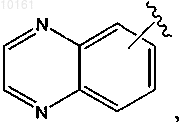
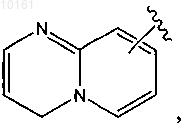
или
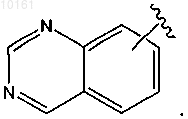
37. Соединение по п.32, где R6 представляет собой
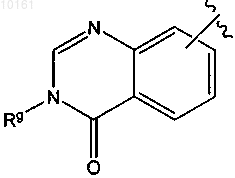
или
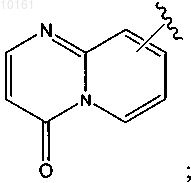
каждый из которых является необязательно замещенным алкилом, алкокси, галогеном, гидрокси, оксо, амино, алкилсульфинилом, циано, карбокси, арилом или гетероарилом.
38. Соединение по п.33, где R6 представляет собой
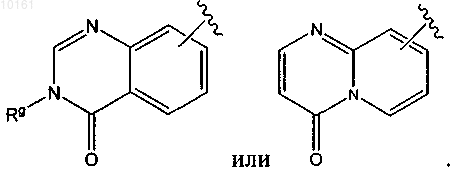
39. Соединение по п.32, где фрагмент -R1-R2-R3-R4 представляет собой метил, этил, пропил или изопропил и необязательно замещен нитрилом, амино, пирролидинилом, тетразолилом, гидроксилом, ацетамидо, метансульфонамидо.
40. Соединение по п.32, где фрагмент -R1-R2-R3-R4 представляет собой 2-ацетонитрил, 3-пропилнитрил, 2-аминоэтил, 3-аминоэтил, 3-(диметил)аминопропил, 2-(N-метансульфонамид)этил, 3-(N-метансульфонамид)пропил, 3-(пирролидинил)пропил, 2-(2Н-тетразолил)этил или 3-(N-ацетамидо)пропил.
41. Соединение по п.32, где фрагмент -R1-R2-R3-R4 представляет собой циклоалкил, необязательно замещенный группами -S(O)2OH или -СООН или их сложноэфирным или амидным производным.
42. Соединение по п.32, где фрагмент -R1-R2-R3-R4 представляет собой остаток циклогексилкарбаминовой кислоты, бензилового эфира циклогексилкарбаминовой кислоты, циклогексилметансульфонамид, остаток бицикло[2.2.2]октанкарбоновой кислоты.
43. Соединение по п.32, где фрагмент -R1-R2-R3-R4 представляет собой остаток сульфоновой кислоты, карбоновой кислоты или их сложноэжфирное или амидное производное.
44. Соединение по п.32, где фрагмент -R1-R2-R3-R4 представляет собой остаток пропионовой кислоты, или N-сульфоновой кислоты, или диметиламидсульфоновой кислоты.
45. Соединение по п.32, где m равно 0, 1 или 2.
46. Соединение по п.32, где Ra является заместителем в положении 6.
47. Соединение формулы (I)
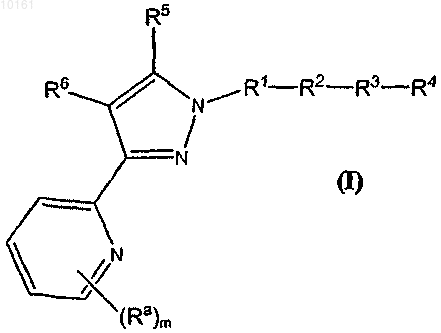
или его N-оксид, или фармацевтически приемлемая соль;
где каждый Ra независимо представляет собой алкил, алкенил, галоген, циклоалкил;
фрагмент -R1-R2-R3-R4 представляет собой водород, группы -S(O)2OH, -S(O)2NH2, необязательно замещенный алкил, необязательно замещенный циклоалкил, где необязательные заместители алкильной и циклоалкильной группы, каждый, представляют собой нитрил, амино, пирролидинил, тетразолил, гидроксил, ацетамидо, метансульфонамид, группы -S(O)2OH, -СООН, -NHCOOH или их сложноэфирное или амидное производное;
R5 представляет собой водород, незамещенный алкил или галогензамещенный алкил;
R6 представляет собой
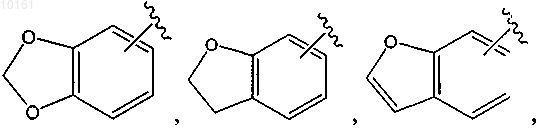
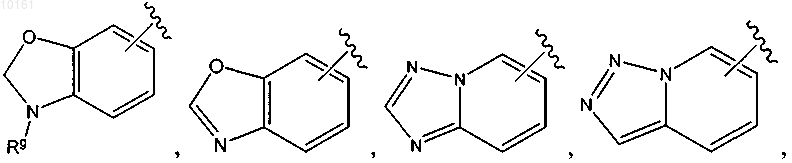
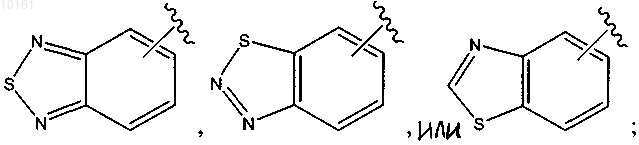
каждый из которых является необязательно замещенным алкилом, алкокси, галогеном, оксо, тиоксо, амино, алкилсульфинилом, циано, карбокси, арилом или гетероарилом, и Rg представляет собой водород, алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероаралкил;
m равно 0-3; при условии, что когда m_2, две соседних группы Ra могут соединяться с образованием 4-8-членного необязательно замещенного циклического фрагмента; при условии, что если R6 представляет собой имидазо[1,2-а]пиридил или бензимидазолил, тогда -R1-R2-R3-R4 не является Н, незамещенным алкилом, -СН2-C(О)-N(Н)-алкилом, -СН2-C(О)-N(алкил)2 или бензилом; и при условии, что алкильная группа или алкильный фрагмент содержат от 1 до 8 атомов углерода, алкенильная группа содержит от 2 до 8 атомов углерода, алкинильная группа содержит от 2 до 8 атомов углерода, и циклоалкильная группа содержит от 3 до 10 атомов углерода.
48. Соединение по п.47, где R6 представляет собой
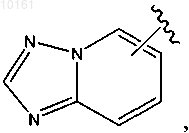
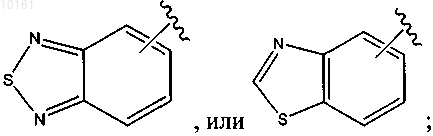
каждый из которых является необязательно замещенным алкилом, алкокси, галогеном, гидрокси, оксо, амино, алкилсульфинилом, циано, карбокси, арилом или гетероарилом.
49. Соединение по п.47, где R6 представляет собой
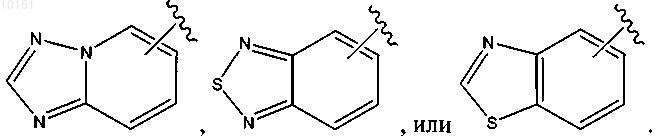
50. Соединение по п.47, где R6 представляет собой
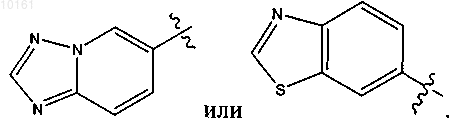
51. Соединение по п.47, где фрагмент -R1-R2-R3-R4 представляет собой метил, этил, пропил или изопропил и необязательно замещен нитрилом, амино, пирролидинилом, тетразолилом, гидроксилом, ацетамидо, метансульфонамидо.
52. Соединение по п.47, где фрагмент -R1-R2-R3-R4 представляет собой 2-ацетонитрил, 3-пропилнитрил, 2-аминоэтил, 3-аминоэтил, 3-(диметил)аминопропил, 2-(N-метансульфонамид)этил, 3-(N-метансульфонамид)пропил, 3-(пирролидинил)пропил, 2-(2Н-тетразолил)этил или 3-(N-ацетамидо)пропил.
53. Соединение по п.47, где фрагмент -R1-R2-R3-R4 представляет сосющ циклоалкил, необязательно замещенный сульфоновой кислотой или карбоновой кислотой или их сложноэфирным или амидным производным.
54. Соединение по п.47, где фрагмент -R1-R2-R3-R4 представляет собой остаток циклогексилкарбаминовой кислоты, бензилового эфира циклогексилкарбаминовой кислоты, циклогексилметансульфонамид, остаток бицикло[2.2.2]октанкарбоновой кислоты.
55. Соединение по п.47, где фрагмент -R1-R2-R3-R4 представляет собой остаток сульфоновой кислоты, карбаминовой кислоты, карбоновой кислоты или их сложноэфирное или амидное производное.
56. Соединение по п.47, где фрагмент -R1-R2-R3-R4 представляет собой остаток пропионовой кислоты, или N-сульфоновой кислоты, или диметиламидсульфоновой кислоты.
57. Соединение по п.47, где m равно 0, 1 или 2.
58. Соединение по п.47, где Ra является заместителем в положении 6.
59. Соединение по п.47, где R4-R3-R2-R1- представляет собой водород.
60. Соединение по п.47, где R5 представляет собой водород, незамещенный метил или трифторметил.
61. Фармацевтическая композиция, включающая соединение по п.1 и фармацевтически приемлемый носитель.
62. Фармацевтическая композиция, включающая соединение по п.30 и фармацевтически приемлемый носитель.
63. Фармацевтическая композиция, включающая соединение по п.31 и фармацевтически приемлемый носитель.
64. Способ ингибирования метаболического пути передачи сигнала TGFb у субъекта, включающий введение указанному субъекту эффективного количества соединения по пп.1, 32 и 47.
65. Способ ингибирования метаболического пути передачи сингала TGFb у субъекта, включающий введение указанному субъекту эффективного количества соединения по п.30.
66. Способ ингибирования метаболического пути передачи сингала TGFb у субъекта, включающий введение указанному субъекту эффективного количества соединения по п.31.
67. Способ ингибирования TGFb рецептора I типа в клетке, включающий стадию контактирования указанной клетки с эффективным количеством соединения по пп.1, 32 и 47.
68. Способ ингибирования TGFb рецептора I типа в клетке, включающий стадию контактирования указанной клетки с эффективным количеством соединения по п.30.
69. Способ ингибирования TGFb рецептора I типа в клетке, включающий стадию контактирования указанной клетки с эффективным количеством соединения по п.31.
70. Способ снижения аккумулирования избыточной внеклеточной матрицы, вызываемого TGFb у субъекта, способ включает введение указанному субъекту эффективного количества соединения по пп.1, 32 и 47.
71. Способ снижения аккумулирования избыточной внеклеточной матрицы, вызываемого TGFb у субъекта, способ включает введение указанному субъекту эффективного количества соединения по п.30.
72. Способ снижения аккумулирования избыточной внеклеточной матрицы, вызываемого TGFb у субъекта, способ включает введение указанному субъекту эффективного количества соединения по п.31.
73. Способ лечения или профилактики фиброзного состояния у субъекта, включающий введение указанному субъекту эффективного количества соединения по пп.1, 32 и 47.
74. Способ лечения или профилактики фиброзного состояния у субъекта, включающий введение указанному субъекту эффективного количества соединения по п.30.
75. Способ лечения или профилактики фиброзного состояния у субъекта, включающий введение указанному субъекту эффективного количества соединения по п.31.
76. Способ по пп.73, 74 или 75, где фиброзное состояние выбрано из группы, включающей склеродермию, волчаночный нефрит, заболевание соединительной ткани, заживление раны, хирургическое рубцевание, повреждение спинного мозга, ЦНС-рубцевание, острое легочное повреждение, идиопатический фиброз легких, хроническое обструктивное легочное заболевание, респираторный дистресс синдром у взрослых, острая травма легкого, поражение легкого, вызванное лекарствами, гломерулонефрит, диабетическую нефропатию, нефропатию, обусловленную гипертензией, фиброз печени или билиарный фиброз, первичный билиарный цирроз, цирроз печени, жировой метаморфоз печени, холангит первичного уплотнения, рестеноз, кардиальный фиброз, офтальмическое рубцевание, фибросклероз, фиброзные злокачественные опухоли, фиброиды, фиброму, фиброаденому, фибросаркому, артериопатию трансплантата и келоид.
77. Способ ингибирования метастазов опухолевых клеток у субъекта, включающий введение указанному субъекту эффективного количества соединения по пп.1, 32 и 47.
78. Способ ингибирования метастазов опухолевых клеток у субъекта, включающий введение указанному субъекту эффективного количества соединения по п.30.
79. Способ ингибирования метастазов опухолевых клеток у субъекта, включающий введение указанному субъекту эффективного количества соединения по п.31.
80. Способ лечения заболевания или расстройства, опосредуемого сверхэкспрессией TGFb, способ включает введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по пп.1, 32 и 47.
81. Способ лечения заболевания или расстройства, опосредуемого сверхэкспрессией TGFb, способ включает введения субъекту, нуждающемуся в таком лечении, эффективного количества соединения по п.30.
82. Способ лечения заболевания или расстройства, опосредуемого сверхэкспрессией TGFb, способ включает введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по п.31.
83. Способ по пп.80, 81 или 82, где указанное заболевания или расстройство выбрано из группы, включающей демиелинизацию нейронов при множественном склерозе, болезнь Альцгеймера, церебральную ангиопатию, карциномы клеток сквамозного эпителия, множественную миелому, меланому, глиому, глиобластомы, лейкемию и карциномы легкого, молочной железы, яичника, шейки, печени, желчных путей, желудочно-кишечного тракта, поджелудочной железы, предстательной железы и головы и шеи.
Текст
010161 Уровень техники данного изобретенияTGF (Transforming Growth Factor- трансформирующий фактор роста) является представителем большого семейства димерных полипептидных факторов роста, которое включает активины, ингибины,костные морфогенетические белки (bone morphogenetic proteins - BMP), факторы роста и дифференциации (growth and differentiation factors - GDF) и муллериан-ингибирующее вещество (mullerian inhibitingsubstance - MIS). TGF существует в трех изоформах (TGF 1, TGF 2 и TGF 3) и присутствует в большинстве клеток вместе с его рецепторами. Каждая изоформа экпрессирована и тканеспецифичным, и регулируемым в процессе развития образом. Каждая TGF-изоформа синтезируется в виде белкапредшественника, который подвергается расщеплению внутриклеточно в С-концевой домен (латентассоциированный пептид - LAP) и N-концевой домен, известный как зрелый или активный TGF. LAP обычно является нековалентно связанным со зрелым TGF перед секрецией из клетки. LAP-TGFкомплекс не может связываться с TGF рецепторами и не является биологически активным. TGF обычно высвобождается (и активируется) из комплекса посредством различных механизмов, включая взаимодействие с тромбоспондином-1 или плазмином. После активации TGF связывается с высоким сродством с рецептором II типа (TGF RII), конститутивно активным серином/треонинкиназой. Лиганд-связанный рецептор II типа форфорилирует TGF рецептор I типа (Alk 5) в области, обогащенной глицином/серином, что позволяет рецептору I типа пополнять и фосфорилировать молекулы, передающие нисходящий сигнал, Smad2 или Smad3 (см., например, Huse, M. et al., Mol. Cell. 8: 671-682 (2001. После этого фосфорилированные Smad2 или Smad3 могут образовывать комплекс с Smad4, и полный гетеро-Smad комплекс транлоцирует в ядро и регулирует транскрипцию различных TGFp-чувствительных генов (см., например, Massague, J. Ann. Rev. Biochem.Med. 67:773 (1998. Активины также являются представителями надсемейства TGF, которые отличаются от TGF тем,что являются гомо- или гетеродимерами активина а или b. Активины передают сигнал аналогичноSmad2 или Smad3. Последующее образование гетеро-Smad комплекса с Smad4 также приводит к активин-индуцированной регуляции генной транскрипции. В самом деле, TGF и родственные факторы, такие как активин, регулируют множество клеточных процессов, например, остановку клеточного цикла в эпителиальных и гематопоэтиновых клетках, контроль пролиферации и дифференциации мезенхимных клеток, пополнение воспалительных клеток, иммуносупрессию, заживление ран и воспроизведение внеклеточной матрицы (см., например, Massague, J.Ann. Rev. Cell. Biol. 6: 594-641 (1990); Roberts, А.В., Sporn M.B. Peptide Growth Factors and Their Receptors, 95: 419-472 Berlin: Springer-Verlag (1990); Roberts, А.В., Sporn M.B. Growth Factors 8:1-9 (1993); Alexandrow, M.G., Moses, H.L. Cancer Res. 55: 1452-1457 (1995. Гиперфункция метаболического пути передачи сигнала TGF является причиной многих расстройств, наблюдающихся у людей (например, избыточное отложение внеклеточной матрицы, аномально высокий уровень воспалительных ответных реакций, фиброзные расстройства и прогрессирующие злокачественные опухоли). Аналогично, передача сигнала активина и сверхэкспрессия активина связаны с патологическими расстройствами, в которые вовлечена аккумуляция внеклеточной матрицы и фиброз (см., например, Matsuse, T. et al., Am. J. Respir.J. Repir. Cell Mol. Biol. 25: 60-68 (2001, кахексия или истощение (см. Matzuk, M.M. et al., Proc. Nat.Acad. Sci. USA 91: 8817-8821 (1994); Coerver, K.A. et al., Mol. Endocrinol. 10: 534-543 (1996); Cipriano,S.C. et al. Endocrinology 141: 2319-27 (2000, заболевания или патологические реакции центральной нервной системы (см. Logan, A. et al. Eur. J. Neurosci. 11: 2367-2374 (1999); Logan, A. et al. Exp. Neurol. 159: 504-510 (1999); Masliah, E. et al., Neurochem. Int. 39: 393-400 (2001); De Groot, C.J.A. et al., J. Neuropathol. Exp. Neurol. 59: 174-187 (1999), John, G.R. et al., Nat Med. 8: 1115-21 (2002 и гипертензия (см.Dahly, A.J. et al., Am. J. Physiol. Regul. Integr. Сотр. Physiol. 283: R757-67 (2002. Исследования также показали, что TGF и активин могут действовать синергично для индуцирования внеклеточной матрицы(см., например, Sugiyama, M. et al., Gastroenterology 114:550-558 (1998. Таким образом, существует потребность в разработке модуляторов (например, антагонистов) компонентов метаболического пути передачи сигнала семейства TGF для профилактики/лечения расстройств, связанных с пороком развития метаболического пути передачи сигнала. Сущность изобретения Основой данного изобретения является открытие того факта, что соединения формулы (I) проявляют неожиданно высокую эффективность в качестве антагонистов рецепторов TGF семейства I типа,Alk 5 и/или Alk 4. Таким образом, соединения формулы (I) могут применяться для профилактики и/или лечения таких заболеваний, как фиброз (например, почечный фиброз, фиброз легких и печеночный фиб-1 010161 роз), прогрессирующие злокачественные опухоли или другие заболевания, для которых желательно снижение активности передачи сигнала семейства TGF. В соответствии с одним аспектом данное изобретение предоставляет соединение формулы (I) Каждый Ra независимо представляет собой алкил, алкенил, алкинил, алкокси, ацил, галоген, гидрокси, амино, нитро, оксо, тиоксо, циано, гуанидино, амидино, карбокси, сульфо, меркапто, алкилсульфанил, алкилсульфинил, алкилсульфонил, аминокарбонил, алкилкарбониламино, арилкарбониламино, гетероарилкарбониламино, алкилсульфониламино, арилсульфониламино, гетероарилсульфониламино, алкоксикарбонил, алкилкарбонилокси, уреидо, тиоуреидо, сульфамоил, сульфамид, карбамоил, циклоалкил, циклоалкилокси, циклоалкилсульфанил, циклоалкилкарбонил, гетероциклоалкил, гетероциклоалкилокси, гетероциклоалкилсульфанил, гетероциклоалкилкарбонил, арил, арилокси, арилсульфанил, ароил,гетероарил, гетероарилокси, гетероарилсульфанил или гетероароил.r1 и r2 независимо представляет собой 2 или 3.R3 представляет собой -C(O)-, -C(O)O-, -OC(O)-, -C(O)-N(Rb)-, -N(Rb)-C(O)-, -O-C(O)-N(Rb)-, -N(Rb)C(O)-O-, -O-S(O)p-N(Rb)-, -N(Rb)-S(O)р-O-, -N(Rb)-C(O)-N(Rc)-, -N(Rb)-S(O)p-N(Rb)-, -C(O)-N(Rb)-S(O)p-,-S(O)p-N(Rb)-C(O)-, -S(O)p-N(Rb)-, -N(Rb)-S(O)p-, -N(Rb)-, -S(O)p-, -O-, -S- или -(C(Rb)(Rcq- или связь. Каждый из Rb и Rc независимо представляет собой водород, гидрокси, алкил, арил, аралкил, гетероциклоалкил, гетероарил или гетероаралкил. р равно 1 или 2; и q равно 1-4.R6 представляет собой (1) 5-6-членный гетероциклил (например, гетероциклоалкил, гетероциклоалкенил или гетероарил), содержащий в кольце 1-3 гетероатома, выбранных из группы, включающей -O-,-S-, -N= и -NRd-, где Rd представляет собой водород, алкил, циклоалкил, циклоалкилалкил, арил, аралкил,гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероаралкил. Данный 5-6-членный гетероциклил должен быть замещенным Re и необязательно замещенным одним или двумя Rf. Re представляет собой оксо, тиоксо, алкокси, алкилсульфинил, -NH2-, -NH(незамещенный алкил) или -N(незамещенный алкил)2, и Rf представляет собой алкил, алкенил, алкинил, алкокси, ацил, галоген, гидрокси, амино, нитро, оксо, тиоксо, циано, гуанидино, амидино, карбокси, сульфо, меркапто, алкилсульфанил, алкилсульфинил, алкилсульфонил, аминокарбонил, алкилкарбониламино, алкилсульфониламино, алкоксикарбонил, алкилкарбонилокси, уреидо, тиоуреидо, сульфамоил, сульфамид, карбамоил, циклоалкил, циклоалкилокси, циклоалкилсульфанил, гетероциклоалкил, гетероциклоалкилокси, гетероциклоалкилсульфанил,арил, арилокси, арилсульфанил, ароил, гетероарил, гетероарилокси, гетероарилсульфанил или гетероароил. Альтернативно, R6 представляет собой (2) конденсированный циклический гетероарил, выбранный из группы, включающей-2 010161 Цикл А представляет собой ароматическое кольцо, содержащее 0-4 гетероатома, и цикл В представляет собой 5-7-членное ароматическое или неароматическое кольцо, содержащее 0-4 гетероатома; при условии, что по меньшей мере один из циклов А и В содержит в кольце один или несколько гетероатомов. Цикл А' представляет собой ароматическое кольцо, содержащее 0-4 гетероатома, и цикл В' представляет собой 5-7-членное ненасыщенное или насыщенное кольцо, содержащее 0-4 гетероатомов; при условии, что по меньшей мере один из циклов А' и В' содержит в кольце один или несколько гетероатомов. Каждый гетероатом в кольце конденсированного циклического гетероарила представляет собой -О-,- S-, -N= или -NRg-. В частности, каждый X1 атом в кольце независимо представляет собой N или C; каждый X2 атом кольца независимо представляет собой -О-, -S-, -N=, -NRg- или -CHRh-. Rg представляет собой водород, алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероаралкил; и каждый из Rh и Ri независимо представляет собой алкил, алкенил, алкинил, алкокси, ацил, галоген, гидрокси, амино, нитро, оксо, тиоксо, циано, гуанидино, амидино,карбокси, сульфо, меркапто, алкилсульфанил, алкилсульфинил, алкилсульфонил, аминокарбонил, алкилкарбониламино, арилкарбониламино, гетероарилкарбониламино, алкилсульфониламино, арилсульфониламино, гетероарилсульфониламино, алкоксикарбонил, алкилкарбонилокси, уреидо, тиоуреидо, сульфамоил, сульфамид, карбамоил, циклоалкил, циклоалкилокси, циклоалкилсульфанил, циклоалкилкарбонил,гетероциклоалкил, гетероциклоалкилокси, гетероциклоалкилсульфанил, гетероциклоалкилкарбонил,арил, арилокси, арилсульфанил, ароил, гетероарил, гетероарилокси, гетероарилсульфанил или гетероароил. n равно 0-2; и m равно 0-3; при условии, что когда m больше или равно 2, две соседних группы Ra могут соединяться, образуя вместе 4-8-членный необязательно замещенный циклический фрагмент. То есть 2-пиридильный цикл может быть конденсированным с 4-8-членным циклическим фрагментом с образованием таких фрагментов, как 7H-[1]пиридинил, 6,7-дигидро-5H-[1]пиридинил, 5,6,7,8 тетрагидрохинолинил,5,7-дигидрофуро[3,4-b]пиридинил или 3,4-дигидро-1H-тиопирано[4,3c]пиридинил. Кроме того, при условии, что если R6 представляет собой замещенный или незамещенный нафтиридинил (например, 2-нафтиридинил), хинолинил (например, 2-хинолинил или 4-хинолинил),имидазо[1,2-а]пиридил или бензимидазолил, тогда -R1-R2-R3-R4 не является H, незамещенным алкилом,группой -CH2-C(O)-N(H)-незамещенный алкил, -CH2-C(O)-N(незамещенный алкил)2 или бензилом. В одном примере осуществления данного изобретения R6 представляет собой 5-6-членный гетероциклил, содержащий в кольце 1-3 гетероатома, выбранных из группы, включающей -O-, -S-, -N= и -NRd-,где Rd представляет собой водород или алкил. Например, R6 может представлять собой 6-членный гетероарил, содержащий в кольце 1 или 2 гетероатома, где каждый гетероатом в кольце представляет собой-N= или -NRd-. Ниже представлены два примера R6 в виде 6-членного гетероарила В другом примере осуществления данного изобретения R6 представляет собой где цикл B может представлять собой 5-6-членное ароматическое или неароматическое кольцо. Некоторыми примерами таких групп являются Данные группы могут быть незамещенными или замещенными (на одном или обоих кольцах) алкилом, алкокси, галогеном, оксо, тиоксо, амино, алкилсульфинилом, циано, карбокси, арилом или гетероарилом, и Rg представляет собой водород, алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероаралкил. Некоторыми предпочтительными примерами R6 являются В еще одном примере осуществления данного изобретения R6 может содержать в кольце два или три гетероатома (такие, как атом кислорода, серы или азота). В пара-положении цикл A может содержать или быть замещенным одним из указанных гетероатомов цикла. Некоторыми примерами R6, где параположение колец A занято гетероатомом кольца, являются В еще одном примере осуществления данного изобретения, пара-положение цикла А замещено-ORj, -SRj, -O-CO-Rj, -O-SO2-Rj, -N(Rj)2, -NRj-CO-Rj, -NRj-SO2-Rj или -NRj-CO-N(Rj)2, где каждый Rj независимо представляет собой водород, алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероаралкил. Некоторые примеры таких R6 групп включают В еще одном примере осуществления R6 представляет собой где цикл B может представлять собой 5-6-членное ароматическое или неароматическое кольцо. Некоторыми примерами такой группы являются где X3 независимо представляет собой N или C (т.е. цикл B может содержать в кольце 0-2 атома азота). Следует подчеркнуть, что каждый R6 является необязательно замещенным алкилом, алкокси, галогеном, оксо, тиоксо, амино, алкилсульфинилом, циано, карбокси, арилом или гетероарилом. Конкретные примеры такой группы R6 представлены ниже В еще одном примере осуществления данного изобретения R1 представляет собой связь, алкилен или -(CH2)2-O-(CH2)2-. В еще одном примере осуществления данного изобретения R2 представляет собой циклоалкил, гетероциклоалкил, арил, гетероарил или связь. В еще одном примере осуществления данного изобретения R3 представляет собой -N(Rb)-C(O)-,b-N(R )-S(O)р-, -C(O)-, -C(O)-O-, -O-C(O)-, -C(O)-N(Rb)-, -S(O)p-, -O-, -S-, -S(O)p-N(Rb)-, -N(Rb)-, -N(Rb)C(O)-O-, -N(Rb)-C(O)-N(Rb)- или связь. В еще одном примере осуществления данного изобретения R4 представляет собой водород, алкил,гетероциклоалкил, арил или гетероарил. В еще одном примере осуществления данного изобретения R1 представляет собой связь или алкилен; R2 представляет собой связь; R3 представляет собой -N(Rb)-C(O)-, -N(Rb)-S(O)р-, -C(O)-, -C(O)-O-,-O-C(O)-, -C(O)-N(Rb)-, -S(O)p-, -O-, -S(O)p-N(Rb)-, -N(Rb)- или связь; и R4 представляет собой водород,алкил, гетероциклоалкил, арил или гетероарил. В другом примере осуществления данного изобретенияR1 представляет собой -(CH2)2-O-(CH2)2-; R2 представляет собой пиперидинил, пиперазинил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, циклогексил, циклопентил, бицикло[2,2,1]гептан, бицикло[2,2,2]октан,бицикло[3,2,1]октан,2-оксабицикло[2,2,2]октан,2-азабицикло[2,2,2]октан,3-азабицикло[3,2,1]октан, кубанил или 1-азабицикло[2,2,2]октан; R3 представляет собой связь; и R4 представляет собой водород, алкил, гетероциклоалкил, арил или гетероарил. В еще одном примере осуществления данного изобретения R1 представляет собой связь; R2 представляет собой пиперидинил, пиперазинил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, циклогексил, циклопентил, бицикло[2,2,1]гептан, бицикло[2,2,2]октан, бицикло[3,2,1]октан, 2-оксабицикло[2,2,2]октан, 2-азабицикло[2,2,2]октан, 3-азабицикло[3,2,1]октан, кубанил или 1-азабицикло[2,2,2]октан; R3 представляет собой-N(Rb)-C(O)-, -N(Rb)-S(O)р-, -C(O)-, -C(O)-O-, -O-C(O)-, -C(O)-N(Rb)-, -S(O)p-, -O-, -S-, -S(O)p-N(Rb)-,-N(Rb)- или связь; и R4 представляет собой водород, алкил, гетероциклоалкил, арил или гетероарил. В еще одном примере осуществления данного изобретения каждый из R1, R2 и R3 представляет собой связь; и R4 представляет собой водород или алкил, замещенный цианогруппой. В еще одном примере осуществления данного изобретения R5 представляет собой водород, незамещенный алкил или галогензамещенный алкил. В еще одном примере осуществления данного изобретения m равно 0, 1 или 2. В другом примере осуществления данного изобретения m равно 0 или 1. В еще одном примере осуществления данного изобретения каждый Ra независимо представляет собой алкил, алкокси, алкилсульфинил, галоген, амино, аминокарбонил, алкоксикарбонил, циклоалкил или гетероциклоалкил. В другом примере осуществления данного изобретения Ra является замещенным в положении 6.-6 010161 В одном примере осуществления данного изобретения R6 представляет собой где цикл В представляет собой 5-6-членное ароматическое или неароматическое кольцо;R5 представляет собой водород, незамещенный алкил или галогензамещенный алкил;R1 представляет собой связь или алкилен; иRa представляет собой алкил, алкокси, алкилсульфинил, галоген, амино, аминокарбонил или алкоксикарбонил; при условии, что если m не равно 0, то по меньшей мере один Ra является замещенным в положении 6. В еще одном примере осуществления данного изобретения в пара-положении цикла А группы R6 находится или пара-положение цикла А группы R6 замещено гетероатомом (например, атомом О, S илиN), или пара-положение цикла А замещено группами -ORj, -SRj, -O-CO-Rj, -O-SO2-Rj, -N(Rj)2, -NRj-CO-Rj,-NRj-SO2-Rj или -NRj-CO-N(Rj)2, где каждый Rj независимо представляет собой водород, алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероаралкил. В еще одном примере осуществления данного изобретения R6 представляет собой Каждая из этих групп является незамещенной или замещенной (в одном или в обоих циклах) алкилом, алкокси, галогеном, гидрокси, оксо, амино, алкилсульфинилом, циано, карбокси, арилом или гетероарилом. R5 представляет собой водород, незамещенный метил или трифторметил. R4 представляет собой водород или алкил. R3 представляет собой -N(Rb)-C(O)-, -N(Rb)-S(O)р-, -C(O)-N(Rb)-, -S(O)p-N(Rb)-,-N(Rb)- или связь. R2 представляет собой циклоалкил или связь. R1 представляет собой связь, алкилен или -(CH2)2-O-(CH2)2-. В одном примере осуществления данного изобретения R5 представляет собой водород и R4-R3-R2-R1-представляет собой водород. Следует отметить, что данное изобретение включает соединения, содержащие любую комбинацию групп, описанных выше.N-оксид-производное или фармацевтически приемлемая соль каждого из соединений формулы (I) также включено в область данного изобретения. Например, атом азота в цикле пиразола или азотсодержащий гетероциклильный заместитель может образовывать оксид в присутствии подходящего окислителя, такого как м-хлорнадбензойная кислота или H2O2. Соединение формулы (I), которое по природе является кислотным (например, содержащее карбоксильную или фенольную гидроксильную группу), может образовывать фармацевтически приемлемую соль, такую как натриевая, калиевая, кальциевая или соль золота (gold salt). В область данного изобретения включены также соли, образованные с фармацевтически приемлемыми аминами, такими как аммиак,алкиламины, гидроксиалкиламины и N-метилгликамин. Соединение формулы (I) может подвергаться-7 010161 обработке кислотой для получения кислотно-аддитивных солей. Примеры таких кислот включают соляную кислоту, бромисто-водородную кислоты, йодисто-водородную кислоты, серную кислоту, метансульфоновую кислоту, фосфорную кислоту, п-бромфенилсульфоновую кислоту, угольную кислоту, янтарную кислоту, лимонную кислоту, бензойную кислоту, оксалиловую кислоту, малоновую кислоту, салициловую кислоту, яблочную кислоту, фумаровую кислоту, аскорбиновую кислоту, магеиновую кислоту, уксусную кислоту и другие минеральные и органические кислоты, хорошо известные квалифицированным специалистам в данной области техники. Кислотно-аддитивные соли могут быть получены обработкой соединения формулы (I) в виде его свободного основания достаточным количеством кислоты(например, соляной кислоты) для получения кислотно-аддитивной соли (например, гидрохлоридной соли). Кислотно-аддитивная соль может снова превращаться в свободное основание обработкой соли подходящим разбавленным водным основным раствором (например, гидроксидом натрия, гидрокарбонатом натрия, карбонатом калия или гидроксидом аммония). Соединения формулы (I) могут быть представлены, например, в форме хиральных соединений, рацемических смесей, оптических активных соединений,чистых диастереомеров или смеси диастереомеров. Соединения формулы (I) проявляют неожиданно высокое сродство к рецепторам I типа семействаTGF, Alk 5 и/или Alk 4, например, со значениями IC50 и Ki менее 10 мкМ в условиях, которые описаны в примере 116 и пример 118, соответственно. Некоторые соединения формулы (I) показывают значениеIC50 и/или Ki менее 1,0 мкМ (или даже менее 0,1 мкМ). Соединения формулы (I) могут также подвергаться модификации введением подходящих функциональных групп для усиления селективных биологических свойств. Такие модификации известны в данной области техники и включают модификации, которые повышают биологическую пенетрацию в данную биологическую систему (например, в кровь, лимфатическую систему, центральную нервную систему), повышают пероральную доступность, повышают растворимость для возможности введения инъекцией, изменения метаболизма и/или изменение скорости выделения. Примеры модификаций включают,но без ограничения, этерификацию с полиэтиленгликолями, получение производных с пиволатами или заместителями жирных кислот, превращение в карбаматы, гидроксилирование ароматических циклов и гетероатом-замещение в ароматических циклах. В соответствии с другим аспектом данное изобретение предоставляет фармацевтическую композицию, включающую соединение формулы (I) (или сочетание двух или нескольких соединений формулы(I и фармацевтически приемлемый носитель. Данное изобретение включает также композицию лекарственного средства, включающую любое из соединений формулы (I), само по себе или в сочетании с подходящим наполнителем. В соответствии с еще одним аспектом, изобретение предоставляет способ ингибирования рецепторов I типа семейства TGF, Alk 5 и/или Alk 4 (например, со значением IC50 менее 10 мкМ; предпочтительно менее 1,0 мкМ; более предпочтительно менее 0,1 мкм) в клетке, включая стадию контактирования клетки с эффективным количеством одного или нескольких соединений формулы (I). Изобретений предоставляет также способ ингибирования TGF и/или метаболического пути передачи сигнала активина в клетку или субъекту (например, млекопитающему, такому как человек), включая стадию контактирования клетки с эффективным количеством одного или нескольких соединений формулы (I) или введение субъекту эффективного количества одного или нескольких соединений формулы (I). Данное изобретение предоставляет также способ лечения или профилактики у субъекта состояния,отличающегося или являющегося результатом повышенного уровня содержания TGF и/или активности активина. Способ включает стадию введения субъекту эффективного количества одного или нескольких соединений формулы (I). Такие состояния включают аккумулирование избытка внеклеточной матрицы; фиброзное состояние (например, склеродерму, люпус-нефрит, заболевание соединительной ткани, заживление ран, хирургическое рубцевание, повреждение спинного мозка, CNS-рубцевание, острое легочное повреждение, идиопатический фиброз легких, хроническую обструктивную болезнь легких, острый респираторный дистресс-синдром взрослых, острое легочное повреждение, повреждение легкого, вызванное лекарственными средствами (drug-induced lung injury), гломерулонефрит, диабетическую нефропатию, нефропатию, обусловленную гипертензией, фиброз печени или билиарный фиброз, цирроз печени, первичный билиарный цирроз, цирроз, обусловленный жировым метаморфозом печени (алкогольный и неалкогольный гиперстеатоз), холангит первичного уплотнения, рестеноз, кардиальный фиброз, офтальмическое рубцевание, фибросклероз, фиброзные злокачественные опухоли, фиброиды, фиброму,фиброаденомы, фибросаркомы, трансплантатную артериопатия и келоиды); TGF-индуцируемый метастаз опухолевых клеток; и карциномы (например, карциномы клеток сквамозного эпителия, множественную миелому, меланому, глиому, глиобластомы, лейкемию и карциномы легкого, молочной железы,яичника, шейки матки, печени, желчных путей, желудочно-кишечного тракта, поджелудочной железы,предстательной железы, головы и шеи); и другие состояния, такие как кахексия, гипертензия, анкилозирующий спондилоартрит, демиелинизация при множественном склерозе, церебральная ангиопатия и болезнь Альцгеймера.-8 010161 Термин алкильная группа, используемый в данном описании, относится к насыщенной алифатической углеводородной группе, содержащей 1-8 (например, 1-6 или 1-4) атомов углерода. Алкильная группа может быть прямой или разветвленной. Примеры алкильной группы включают, но без ограничения, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гептил и 2-этилгексил. Алкильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероарилалкокси, амино, нитро, карбокси, циано, галоген, гидрокси, сульфо, меркапто, алкилсульфанил, алкилсульфинил, алкилсульфонил, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, циклоалкилалкилкарбониламино, арилкарбониламино, аралкилкарбониламино, гетероциклоалкилкарбониламино, гетероциклоалкилалкилкарбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, уреидо, тиоуреидо, сульфамоил, сульфамид, алкоксикарбонил, или алкилкарбонилокси. Термин алкилен относится к двухвалентной алкильной группе, значения которой определены выше. Термин алкенильная группа, используемый в данном описании, относится к алифатической углеводородной группе, которая содержит 2-8 (например, 2-6 или 2-4) атомов углерода и по меньшей мере одну двойную связь. Также как алкильная группа, алкенильная группа может быть прямой или разветвленной. Примеры алкенильной группы включают, но без ограничения, аллил, изопренил, 2-бутенил и 2 гексенил. Алкенильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероарилалкокси, амино, нитро, карбокси, циано, галоген, гидрокси, сульфо, меркапто, алкилсульфанил, алкилсульфинил, алкилсульфонил, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, циклоалкилалкилкарбониламино, арилкарбониламино, аралкилкарбониламино, гетероциклоалкилкарбониламино, гетероциклоалкилалкилкарбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, уреидо, тиоуреидо, сульфамоил, сульфамид, алкоксикарбонил или алкилкарбонилокси. Алкенилен представляет собой двухвалентную алкенильную группу, значения которой определены выше. Термин алкинильная группа, используемый в данном описании, относится к алифатической углеводородной группе, которая содержит 2-8 (например, 2-6 или 2-4) атомов углерода и по меньшей мере одну тройную связь. Алкинильная группа может быть прямой или разветвленной. Примеры алкинильной группы включают, но без ограничения, пропаргил и бутинил. Алкинильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероарилалкокси, амино, нитро, карбокси,циано, галоген, гидрокси, сульфо, меркапто, алкилсульфанил, алкилсульфинил, алкилсульфонил, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, циклоалкил-алкилкарбониламино, арилкарбониламино, аралкилкарбониламино, гетероциклоалкилкарбониламино, гетероциклоалкилалкилкарбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, уреидо, тиоуреидо, сульфамоил,сульфамид, алкоксикарбонил или алкилкарбонилокси. Алкинилен представляет собой двухвалентную алкинильную группу, значения которой определены выше. Термин амино-группа, используемый в данном описании, относится к группе -NRXRY, где каждый из RX и RY независимо представляет собой водород, алкил, циклоалкил, (циклоалкил)алкил, арил,аралкил, гетероциклоалкил, (гетероциклоалкил)алкил, гетероарил или гетероаралкил. Когда аминогруппа не является концевой группой (например, алкилкарбониламино), она соответствует формуле-NRX-RX, значения которой определены выше. Термин арильная группа, используемый в данном описании, относится к фенильной, нафтильной или бензо-конденсированной группе, содержащей 2-3 цикла. Например, бензоконденсированная группа включает фенил, конденсированный с одним или двумя C4-8 карбоциклическими фрагментами, например,1,2,3,4-тетрагидронафтил, инданил или флуоренил. Арил является необязательно замещенным одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил,например, трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, амино, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкил)алкилкарбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкил)алкилкарбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, алкилсульфанил, сульфокси, уреидо, тиоуреидо, сульфамоил, сульфамид, оксо или карбамоил. Термин аралкильная группа относится к алкильной группе (например, C1-4 алкильной группе), которая является замещенной арильной группой. Значения терминов алкил и арил определены выше. Примером аралкильной группы является бензил. Термин циклоалкильная группа, используемый в данном описании, относится к алифатическому карбоциклу, включающему 3-10 (например, 4-8) атомов углерода. Примеры циклоалкильных групп включают циклопропил, циклопентил, циклогексил, циклогептил, адамантил, норборнил, cubyl, октагид-9 010161 роинденил, декагидронафтил, бицикло[3,2,1]октил, бицикло[2,2,2]октил, бицикло[3,3,1]нонил и бицикло[3,2,3]нонил. Термин циклоалкенильная группа, используемый в данном описании, относится к неароматическому карбоциклу, содержащему 3-10 (например, 4-8) атомов углерода и включающему одну или несколько двойных связей. Примеры циклоалкенильных групп включают циклопентенил,1,4-циклогексадиенил, циклогептенил, циклооктенил, гексагидроинденил, октагидронафтил, бицикло[2,2,2]октенил и бицикло[3,3,1]ноненил. А циклоалкильная или циклоалкенильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, например, трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси,гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил,амино, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино,циклоалкилкарбониламино, (циклоалкил)алкилкарбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкил)алкилкарбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, алкилсульфанил, сульфокси, уреидо, тиоуреидо, сульфамоил, сульфамид, оксо или карбамоил. Термин гетероциклоалкильная группа, используемый в данном описании, относится к 3-10-членной (например, 4-8-членному) насыщенной циклической структуре, в кольце которой один или несколько атомов являются гетероатомом, например, атомом N, О или S. Примеры гетероциклоалкильной группы включают пиперидинил, пиперазинил, тетрагидропиранил, тетрагидрофурил, диоксоланил,оксазолидинил, изооксазолидинил, морфолинил, октагидробензофурил, октагидрохроменил, октагидротиохроменил,октагидроиндолил,октагидропиридинил,декагидрохинолинил,октагидробензо[b]тиофенил, 2-окса-бицикло[2,2,2]октил, 1-азабицикло[2,2,2]октил, 3-азабицикло[3,2,1]октил и 2,6-диоксатрицикло [3,3,1,03,7]нонил. Термин гетероциклоалкенильная группа, используемый в данном описании, относится к 3-10-членной (например, 4-8-членной) неароматической циклической структуре, содержащей одну или несколько двойных связей, в кольце которой один или несколько атомов являются гетероатомами, например, N, О или S. Гетероциклоалкильная или гетероциклоалкенильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как алкил (включая карбоксиалкил,гидроксиалкил и галогеналкил, например, трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил,амино, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино,циклоалкилкарбониламино, (циклоалкил)алкилкарбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкил)алкилкарбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, алкилсульфанил, сульфокси, уреидо, тиоуреидо, сульфамоил, сульфамид, оксо или карбамоил. Термин гетероарильная группа, используемый в данном описании, относится к моноциклической,бициклической или трициклической структуре, содержащей в кольце(ах) от 5 до 15 атомов, один или несколько из которых представляет(ют) собой гетероатом(ы), например, атом N, О или S, в которой один или несколько колец бициклической или трициклической структуры является(ются) ароматическим(и). Некоторыми примерами гетероарила являются пиридил, фурил, пирролил, тиенил, тиазолил, оксазолил,имидазолил, индолил, тетразолил, бензофурил, бензтиазолил, ксантен, тиоксантен, фенотиазин, дигидроиндол и бензо[1,3]диоксол. Гетероарил является необязательно замещенным одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, например,трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, амино, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкил)алкилкарбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкил)алкилкарбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, алкилсульфанил, сульфокси, уреидо, тиоуреидо, сульфамоил, сульфамид, оксо или карбамоил. Термин гетероаралкильная группа, который используется в описании, относится к алкильной группе (например, C1-4 алкильная группа), которая является замещенной гетероарильной группой. Термины алкил и гетероарил были определены выше. Термин циклический фрагмент, используемый в данном описании, включает циклоалкил, гетероциклоалкил, циклоалкенил, гетероциклоалкенил, арил или гетероарил, значения которых были определены выше. Термин гетероатом цикла (кольца), используемый в данном описании, относится к атому, отличному от атома углерода в кольце гетероциклоалкила, гетероциклоалкенила или гетероарила, который выбран из группы, включающей атомы кислорода, серы и азота.- 10010161 Термин ацильная группа, используемый в данном описании, относится к формильной группе или группе алкил-C(=O)-, где значение алкила было определено выше. Примерами ацильной группы являются ацетил и пивалоил. Термин карбамоильная группа, используемый в данном описании, относится к группе структуры-COOH и -SO3H соответственно. Термин алкоксигруппа, используемый в данном описании, относится к группе алкил-O-, где алкил принимает значения, определенные выше. Термин сульфоксигруппа, используемый в данном описании, относится к группе -O-SO-RX или-SO-O-RX, где RX принимает значения, определенные выше. Термин галоген или галогеновая группа, используемый в данном описании, относится к фтору,хлору, брому или йоду. Термин сульфамоильная группа, используемый в данном описании, относится к группе структуры -SO2-NRXRY или -NRX -SO2-Rz, где RX, RY и Rz принимают значения, определенные выше. Термин сульфамидная группа, используемый в данном описании, относится к группе структуры-NRX-S(O)2-NRYRZ, где RX, RY и RZ принимают значения, определенные выше. В данном описании термин карбамидная группа относится к группе структуры -NRX-CO-NRYRZ,термин тиокарбамидная группа относится к группе структуры -NRX-CS-NRYRZ, где RX, RY и RZ принимают значения, определенные выше. Термин эффективное количество, используемый в данном описании, относится к количеству, необходимому для обеспечения терапевтического воздействия на подлежащего лечению пациента и обычно определяемому на основе возраста, площади поверхности тела, массы тела и состояния пациента. Взаимосвязь дозировок для животных и людей (из расчета количества миллиграммов на квадратный метр площади поверхности тела) описана в публикации Freireich et al., Cancer Chemother. Rep., 50: 219(1966). Площадь поверхности тела может быть приблизительно определена на основе роста и массы пациента (см., например, Scientific Tables, Geigy Pharmaceuticals, Ardsley, New York, 537 (1970. Термин пациент, используемый в данном описании, относится к млекопитающему, в том числе человеку. Антагонист представляет собой молекулу, которая связывается с рецептором без активации рецептора. Он конкурирует с эндогенным(и) лигандом(ами) или субстратом(ами) связующего(их) сайта(ов) на рецепторе и, следовательно, подавляет способность рецептора преобразовывать сигнал в ответ на эндогенное связывание лиганда. Поскольку соединения формулы (I) являются антагонистами TGF рецептора I типа (Alk 5) и/или активинового рецептора I типа (Alk 4), данные соединения могут применяться для ингибирования последовательностей TGF и/или передачи сигнала активином, таких как продуцирование внеклеточной матрицы (например, коллагена и фибронектина), дифференциация стромальных клеток в миофибробласты и стимулирование миграции воспалительных клеток. Таким образом, соединения формулы (I) ингибируют патологическое воспаление и фиброзные реакции и могут применяться в качестве терапевтических лекарственных средств для лечения и/или профилактики расстройств или заболеваний, для которых желательно снижение TGF и/или активиновой активности (например, фиброзы различных типов или прогрессирующие злокачественные опухоли). За исключением особо оговоренных случаев, все технические и научные термины, используемые в данном описании, имеют значения, известные квалифицированным специалистам, для которых предназначено данное изобретение. Все публикации, заявки на патенты, патенты и другие ссылки, приведенные в описании, введены в данное изобретение в виде ссылок. Кроме того, публикации, способы и примеры являются лишь иллюстративными и не ограничивают область данного изобретения. Другие отличительные признаки и преимущества изобретения будут понятны из следующего далее подробного описания и формулы изобретения. Подробное описание изобретения В целом, изобретение предоставляет соединения формулы (I), которые проявляют неожиданно высокое сродство к семейству TGF рецепторов I типа, Alk 5 и/или Alk 4. Синтез соединений формулы (I). Соединения формулы (I) могут быть получены рядом известных способов из коммерчески доступных или известных исходных веществ. В одном из таких способов, соединения формулы (I) получают в соответствии со схемой 1, представленной ниже. В частности, пиридин формулы (II), который содержит в качестве заместителя 2-(,-ненасыщенный карбонил), может циклизоваться с гидразином с получением пиразольного цикла и получением 2-(пиразол-3-ил)пиридинового промежуточного продукта (III). Следует отметить, что пиридин формулы (II) является коммерчески доступным (Sigma-Aldrich, St. Louis,- 11010161 МО, номер в каталоге 51167-6) или может быть получен известными способами (см., например, публикацию Jameson, D., Guise, L. Tetrahedron Letters, 32(18): 1999-2002). Промежуточный продукт (III) может далее подвергаться замещению в положение 4 пиразольного цикла легко удаляемой группой, такой как йод, взаимодействием с реагентом йодирования (например, N-йодсукцинимидом) для получения 2-(4 йодпиразол-3-ил)пиридина (IV). Йодный заместитель образует идеальную форму для R6-замещений. Например, йодный заместитель может подвергаться превращению в заместитель бороновой кислоты (см. соединение (V) ниже), который далее может взаимодействовать с R6-галогенидом (VI) (например, арилгалогенидом или гетероарилгалогенидом) посредством реакции сочетания Сузуки (Suzuki) для получения соединения формулы (I) (см., например, пример 1 ниже). Могут применяться и другие реакции замещения с получением широкого спектра соединений формулы (I), см., например, посредством взаимодействия между защищенным йодированным соединением (IVa) и фталевым ангидридом для получения ди-кето-промежуточного продукта (VII), который затем может подвергаться реакции циклизации с Rgзамещенным гидразином для получения соединения (I) (см. публикацию J. Med. Chem., 44(16): 2511-2522(2001); а также примеры 3 и 4 ниже). Следует отметить, что пиразольный цикл должен быть правильно защищен (например, N,N-диметиламиносульфонильной группой, введенной в соединение (IVa для исключения нежелательных побочных реакций. Схема 1 Соединения формулы (VI) являются коммерчески доступными или могут быть получены известными способами. Некоторые типичные примеры реакций получения соединения формулы (VI) представлены ниже на схеме 2 (см. также примеры A-I, описанные ниже). Альтернативно, соединение формулы (I) может быть получено через фенилацетилпиридиновое производное (IX), как показано схеме 3 ниже. В частности, пиридинкарбоксальдегидное производное(VIII) подвергается превращению в N, Р ацетальный промежуточный анилин и дифенилфосфит. Полученный промежуточный ацеталь затем подвергается реакции сочетания с альдегидом, замещенным R6, в основных условиях (например, CS2CO3) с получением енамин-промежуточного продукта, который подвергается гидролизу в промежуточный кетон формулы (IX) (см., например, Joumet et al., Tetrahedron Letters, v. 39, p. 1717-1720 (1998. Циклизация промежуточного кетона (IX) с N,N-диметилформамиддиметилацеталем (ДМФА-ДМА) и гидразином приводит к получению пиразольного цикла целевого соединения формулы (I) (см., например, пример 5, описанный ниже). Пиразольный цикл соединения формулы (I) может быть получен также циклизацией промежуточного кетона (IX) с гидразином Другой способ получения промежуточного продукта (IX) представлен на схеме 4 ниже. В качестве ссылки, см., например, WO 02/066462, WO 02/062792 и WO 02/062787. Схема 4- 13010161 Некоторые способы получения соединения формулы (I), где -R1-R2-R3-R4 не является водородом,представлены на схеме 5 ниже. В реакции (A), представленной далее, соединение формулы (I), где 1-положение пиразольного цикла является незамещенным, подвергается реакции замещения с реагентомX-R1-R2-R3-R4, где X представляет собой удаляемую группу, такую как трифторметилсульфонат, тозилат и галогенид, например, Cl, Br или I (см. примеры 6-9). Альтернативно, соединение формулы (I), где 1 положение пиразольного цикла является незамещенным, может подвергаться реакции присоединения с сопряжением в соответствии с реакцией (B), представленной ниже. Квалифицированному специалисту в данной области понятно, что электрофил или акцептор в реакции присоединения обычно содержит двойную связь, связанную с группой, оттягивающей электронную пару, или двойную связь, сопряженную с такими группами, как карбонил, циано- или нитрогруппа (см., например, пример 10 ниже). Схема 5 Группа -R1-R2-R3-R4 может далее подвергаться превращению в другие функциональные группы, как показано на схеме 6 ниже. Например, соединение формулы (I), где группа -R1-R2-R3-R4 представляет собой цианоалкил, может подвергаться восстановлению в аминоалкил, который далее может подвергаться превращению в другие функциональные группы, такие как гетероаралкил, гетероциклоалкилалкил и карбоновая кислота (см. примеры 11-18). Схема 6- 14010161 Заместители на 2-пиридиновом цикле (т.е. Ra) также могут превращаться в другие функциональности. Например, соединение формулы (I), где Ra представляет собой бром (может быть получено с применением бромзамещенного соединения формулы (VIII) (Sigma-Aldrich, St. Louis, MO, может подвергаться превращению в такие функциональности, как алкил, алкенил, циклоалкил и т.п. в соответствии с методикой, описанной в примерах 19-22. Аналогично, заместители R6 фрагмента могут дополнительно превращаться и в другие функциональные группы (см., например, пример 23). Квалифицированному специалисту будет понятно, что для некоторых исходных веществ и промежуточных продуктов перед осуществлением стадий синтеза, описанных выше, могут потребоваться защитные группы. Подходящие защитные группы описаны, например, в публикации Т.W. Greene, Protective Groups in Organic Synthesis, John WileySons, Inc., New York (1981). Применение соединений формулы (I). Как описано выше, гиперактивность передачи сигнала семейства TGF может приводить к избытку отложения внеклеточной матрицы и повышенным воспалительным реакциям, которые затем могут приводить к фиброзу в тканях и органах (например, в легких, почках и печени) и, в конечном итоге, к повреждению органа (см., например, публикации Border, W.A., Ruoslahti E. J. Clin. Invest. 90: 1-7 (1992), иTGF и/или мРНК активина и уровня содержания TGF и/или активина повышены у пациентов, страдающих различными фиброзными расстройствами, например, фиброзными заболеваниями почек, гепатическим фиброзом, как вызванным употреблением алкоголя, так и аутоимунным, миелофиброзом, блеомицин-индуцированным фиброзом легких и идиопатическим фиброзом легких. Повышенное содержание TGF и/или активина было показано при кахексии, демиелинизация нейронов при множественном склерозе, болезни Альцгеймера, церебральной ангиопатии и гипертензии. Следовательно, соединения формулы (I), которые являются антагонистами рецепторов семействаTGF I типа, Alk 5 и/или Alk 4, и ингибируют метаболический путь передачи сигнала TGF и/или активина, могут применяться для лечения и/или профилактики расстройств или заболеваний, проводимых повышенным уровнем активности TGF и/или активина. В данном описании подразумевается, что соединение ингибирует метаболический путь передачи сигнала семейстра TGF, когда оно связывает (например, при значении IC50 менее 10 мкМ; предпочтительно менее 1 мкМ; более предпочтительно менее 0,1 мкМ) рецептор метаболического пути (например, Alk 5 и/или Alk 4), конкурируя тем самым с эндогенным(и) лигандом(ами) или субстратом(амии) сайта(ов) связывания на рецепторе и снижая способность рецептора преобразовывать внеклеточный сигнал в ответ для эндогенного лиганда или субстратного связывания. Указанные выше расстройства или заболевания включают любое(ые) состояние(я), отличающееся(иеся):(а) аномально высоким уровнем содержания TGF и/или активина; и/или(b) избыточным аккумулированием внеклеточной матрицы; и/или(с) повышенным количеством и повышенной синтетической активностью миофибробластов. Данные расстройства или заболевания включают, но без ограничения, фиброзные состояния, такие как склеродермия, идиопатический фиброз легких, гломерулонефрит, диабетическая нефропатия, волчаночный нефрит, нефропатия, обусловленная гипертензией, глазное или корнеальное рубцевание, фиброз печени или билиарный фиброз, острое легочное повреждение, фиброз легких, постинфарктный кардиальный фиброз, фибросклероз, фиброзные злокачественные опухоли, фиброиды, фиброма, фиброаденома и фибросаркома. Другие фиброзные состояния, для которых профилактический курс приема соединений формулы (I) может быть полезен, включают фиброз, вызванный приемом терапевтических средств,фиброз, вызванный химиотерапией, хирургически индуцированное рубцевание, включая хирургические спайки, ламинэктомию и коронарный рестеноз. Установлено также, что повышенная активность TGF проявляется у пациентов с прогрессирующими злокачественными опухолями. Исследования показали, что на последней стадии различных раковых заболеваний и опухолевые клетки, и стромальные клетки внутри опухолей обычно сверхэкспрессируют TGF. Это приводит к стимуляции ангиогенеза и подвижности клеток, подавлению иммунной системы и повышенному взаимодействию опухолевых клеток с внеклеточной матрицей (см., например,Hojo, М. et al., Nature 397: 530-534 (1999. В результате опухолевые клетки становятся более инвазивными и метастазируют в отдаленные органы (см., например, публикации: Maehara, Y. et al., J. Clin. Oncol. 17: 607-614 (1999); и Picon, A. et al., Cancer Epidemiol. Biomarkers Prev. 7: 497-504 (1998. Таким образом,соединения формулы (I), которые являются антагонистами рецептора TGF I типа и метаболического пути передачи сигнала TGF, могут также применяться для лечения и/или профилактики различных раковых заболевания на последней стадии, при которых имеет место сверхэкспрессия TGF. Такие раковые заболевания на последней стадии включают карциномы легких, молочной железы, печени, желчных путей, желудочно-кишечного тракта, головы и шеи, поджелудочной железы, предстательной железы,шейки матки, а также множественную миелому, мелано(бласто)му, глиому и глиобластому.- 15010161 Следует отметить и это важно, что ввиду хронической и в некоторых случаях локализованной природы расстройств или заболеваний, проводимых сверхэкспрессией TGF и/или активина (например,фиброза или злокачественных опухолей), лекарственные средства с молекулами небольших размеров(такие как лекарственное средство, заявленное в данном изобретении) благоприятны для лечения в течение длительного периода. Соединения формулы (I) применимы не только для лечения расстройств или заболеваний, проводимых высокими уровнями содержания TGF и/или повышенной активностью активина, данные соединения могут также применяться для профилактики этих же расстройств или заболеваний. Известно, что полиморфизм, приводящий к повышенному продуцированию TGF и/или активина, был ассоциирован с фиброзом и гипертензией. В самом деле, высокие уровни содержания сывороточного TGF связаны с развитием фиброза у пациента с раком молочной железы, прошедшего курс лучевой терапии, с хроническим заболеванием трансплантат против хозяина, идиопатическим интерстициальным пневмонитом,закупоркой вен у реципиентов трансплантатов и перитонеальным фиброзом у пациентов, подвергающихся непрерывному амбулаторному перитонеальному диализу. Таким образом, уровни содержанияTGF и/или активина в сыворотке крови и TGF и/или мРНК активина в ткани могут определяться количественно и использоваться в качестве диагностических или прогностических маркеров расстройств или заболеваний, проводимых сверхэкспрессией TGF и/или активина, а полиморфизмы в гене TGF, которые детерминируют продуцирование TGF и/или активина, также могут применяться для предсказания восприимчивости к расстройствам или заболеваниям (см., например, Blobe, G.C. et al., N. Engl. J. Meet. 342(18): 1350-1358 (2000); Matsuse, T. et al., Am. J. Respir. Cell Mol. Biol. 13: 17-24 (1995); Inoue, S. et al.,Biochem. Biophys. Res. Comm. 205: 441-448 (1994); Matsuse, T. et al., Am. J. Pathol. 148: 707-713 (1996); DeBleser et al., Hepatology 26: 905-912 (1997); Pawlowski, J.E., et al., J. Clin. Invest. 100: 639-648 (1997); Sugiyama, M. et al., Gastroenterology 114: 550-558 (1998. Введение соединений формулы (I). Как определено выше, эффективное количество представляет собой количество, которое необходимо для обеспечения терапевтического воздействия на пациента, принимающего лечение. Для соединения формулы (I) эффективное количество может находиться в интервале от примерно 1 до примерно 150 мг/кг (например, от примерно 1 г до примерно 100 мг/кг). Квалифицированный специалист поймет,что эффективные дозы будут также изменяться в зависимости от способа введения, используемого наполнителя и возможности совместного применения с другими терапевтическими способами лечения,включая применение других терапевтических лекарственных средств или и/или лучевой терапии. Соединения формулы (I) могут вводиться любым способом, подходящим для введения фармацевтических соединений, включая, но без ограничения, пилюли, таблетки, капсулы, аэрозоли, свечи, жидкие препараты для проглатывания или инъекции или для применения в виде глазных или ушных капель, пищевых добавок и препаратов для местного применения. Фармацевтически приемлемые композиции включают водные растворы активного соединения в изотоническом физиологическом растворе, 5% растворе глюкозы или другом традиционном фармацевтически приемлемом наполнителе. В качестве фармацевтических наполнителей для доставки терапевтических соединений могут использоваться солюбилизирующие агенты, такие как циклодекстрины или другие солюбилизаторы, хорошо известные специалистам данной области. Что касается способа введения, то композиции могут вводиться перорально, назально, чрескожным способом, внутрикожным способом, вагинально, внутриушным способом, внутриглазным способом, щечным способом, ректально, трансмукосально или ингаляцией, имплантацией (например, хирургическим способом) или внутривенным введением. Композиции могут вводиться животному (например, млекопитающему, такому как человек, примат (за исключением человека), лошадь, собака, корова, свинья, овца, коза, кошка, мышь, крыса, морская свинка, кролик, хомяк, песчанка, хорек, а также ящерице, рептилии или птице). Необязательно, соединения формулы (I) могут вводиться в сочетании с одним или несколькими другими средствами, которые ингибируют метаболический путь передачи сигнала TGF или лечат соответствующие патологические расстройства (например, фиброз или прогрессирующие злокачественные опухоли) посредством другого механизма действия. Примеры таких средств включают ингибиторы ангиотензин-превращающего фермента, нестероидные, стероидные противовоспалительные средства и хемотерапевтические средства или лучевая терапия, а также средства, которые противодействуют связыванию лиганда или активации TGF рецепторов, например, антитела анти-TGF, анти-TGF рецепторы или антагонисты TGF рецепторов I типа. Изобретение будет дополнительно описано в приведенных далее примерах, которые не ограничивают область данного изобретения, описанную в формуле изобретения. Синтез соединения формулы (VI) описан в примерах A-I ниже (см. также схему 2, приведенную выше).- 16010161 Пример A. 6-Йод-3-метил-3H-хиназолин-4-он. К раствору 5,0 г (19,0 ммоль) 2-амино-5-йодбензойной кислоты в 200 мл сухого ТГФ при перемешивании одной порцией добавляют 4,6 г (28,5 ммоль, 1,5 экв.) N,N'-карбонилдиимидазола с получением смеси коричневого цвета. Смесь кипятят с обратным холодильником в течение 3 ч и дают ей возможность охладиться до комнатной температуры. После этого к смеси добавляют 19 мл (38 ммоль, 2 экв.) 2,0 М раствора метиламина в ТГФ, что приводит к выделению некоторого количества газа. Полученную смесь кипятят с обратным холодильником при перемешивании в течение 2 ч, затем дают возможность смеси охладиться до комнатной температуры и концентрируют в вакууме до масла темнокрасного/коричневого цвета. Полученное масло растворяют в этилацетате, трижды промывают 1N раствором NaOH, два раза 5% раствором лимонной кислоты, затем насыщенным раствором соли, сушат(Na2SO4), фильтруют и упаривают с получением твердого вещества темно-красного цвета. Полученное твердое вещество растворяют в теплом EtOH и добавляют воду до помутнения раствора. После этого реакционную смесь выдерживают при 0 С в течение ночи, в результате чего в смеси образуется осадок. Осадок собирают вакуумным фильтрованием, промывают водой и сушат на воздухе, получая 2-амино-5 йод-N-метилбензамид. К фильтрату добавляют воду для получения дополнительного осадка, который выделяют аналогичным образом. Общий выход с двух стадий 2-амино-5-йод-N-метилбензамида составляет 4,55 г (16,5 ммоль, 87%), который получают в виде твердого вещества бледно-красного цвета. 1m/z=277 [М+H]+, 246 [M-NHCH3]+. К раствору 2,0 г (7,2 ммоль) 2-амино-5-йод-N-метил-бензамида в 20 мл NMP при перемешивании добавляют 6 мл (избыток) триметил-орто-формиата, получая раствор бледно-коричневого цвета. К полученному раствору добавляют 1,0 мл (каталическое количество) 4 н. HCl в диоксане, после чего в растворе образуется светло-окрашенный осадок. Полученную смесь выдерживают с перемешиванием при 110C в течение ночи, в результате чего реакционная смесь становится прозрачной. Полученный реакционный раствор охлаждают и выливают в 250 мл ледяной воды, наблюдая быстрое образование осадка. Супернатант нейтрализуют насыщенным раствором NaHCO3 (приблизительно 5 мл). Полученное твердое вещество собирают вакуумной фильтрацией, промывают водой и сушат на воздухе, получая 6-йод-3-метил 3H-хиназолин-4-он (1,40 г, 4,9 ммоль, 68%) в виде твердого вещества светло-серого цвета. 1m/z: 287 [М+H]+. Пример B. 6-Йод[1,2,4]триазоло[1,5-а]пиридин. К раствору 1,0 г (4,5 ммоль) 2-амино-5-йодпиридина в 5 мл сухого ДМФА в атмосфере N2 добавляют 5 мл (избыток) ДМФА-диметилацеталя (Sigma-Aldrich, St. Louis, МО; ампулы, 51 мл) и полученный раствор бледно-желтого цвета выдерживают при 80C с перемешиванием в течение 2 ч. Полученному раствору дают возможность охладиться и раствор упаривают в вакууме досуха. Полученный N'-(5 йодпиридин-2-ил)-N,N-диметилформамидин в виде твердого кристаллического вещества желтого цвета используют далее без дополнительной очистки. 1m/z: 276 [М+H]+. К раствору N'-(5-йодпиридин-2-ил)-N,N-диметилформамидина в 8 мл метанола добавляют 0,84 мл(10,4 ммоль) пиридина и полученный раствор при перемешивании в атмосфере азота охлаждают до 0C. К полученному раствору добавляют 0,66 г (5,9 ммоль) гидроксиламин-О-сульфоновую кислоту с получением суспензии бледно-желтого цвета. Полученной суспензии дают нагреться до комнатной температуры, затем ее нагревают до температуры кипения с получением раствора желтого цвета, который кипятят с обратным холодильником в течение 16 ч. После этого полученному раствору дают возможность охладиться до комнатной температуры, в процессе чего начинают образовываться кристаллы. Полученную смесь охлаждают до 0C (ледяная баня), выдерживают при этой температуре в течение 2 ч и кристаллы отфильтровывают. Осадок на фильтре промывают большим количеством воды и сушат на воздухе, получая 0,74 г (3,0 ммоль, 67%) указанного в заголовке соединения в виде очень мелких не совсем белых игольчатых кристаллов. 1H-ЯМР (300 МГц, CDCl3, ): 8,88 (1H, с), 8,28 (1H, с), 7,71 (1H, дд, 1,2 Гц, 9,3 Гц), 7,57 (1H, д,9,3 Гц); m/z: 246 [М+H]+. Пример C. 6-Йод-2-метил[1,2,4]триазоло[1,5-а]пиридин. Указанное в заголовке соединение получают в соответствии с методикой примера B, используя 5 мл- 17010161 ДМФА. Продукт получают (0,5 г, 1,9 ммоль, 22%) в виде очень мелких кристаллов желтоватокоричневого цвета. 1m/z: 260 [М+H]+. Пример D. 6-Бром-5-метил[1,2,4]триазоло[1,5-а]пиридин. Аналогично, указанное в заголовке соединение получают в соответствии с методикой, описанной выше, используя 1 г (5,3 ммоль) 6-амино-3-бром-2-метилпиридина (Sigma-Aldrich, St. Louis, МО) вместо 2-амино-5-йодпиридина. Продукт получают (0,44 г, 2,0 ммоль, 39%) в виде мелких белых кристаллов. 1m/z: 213 [М+H]+. Пример E. 7-Йод-4-метил-3,4-дигидро-1H-бензо[е][1,4]диазепин-2,5-дион. К раствору 1,0 г (3,8 ммоль) 2-амино-5-йодбензойной кислоты в ТГФ при перемешивании добавляют 0,925 г (5,7 ммоль, 1,5 экв.) N,N-карбонилдиимидазола, полученный раствор бледно-желтого цвета кипятят с обратным холодильником в течение 3 ч, затем охлаждают до температуры окружающей среды. К полученному раствору добавляют 0,7 мл (4,0 ммоль) диизопропилэтиламина и 0,875 г (5,7 ммоль) гидрохлорида этилового эфира саркозина. Полученный раствор кипятят с обратным холодильником в течение ночи. Раствор охлаждают и концентрируют в вакууме, остаток растворяют в этилацетате и промывают 1 н. раствором NaOH, затем 5% раствором лимонной кислоты и насыщенным раствором соли. Органический слой сушат Na2SO4, фильтруют и концентрируют с получением масла желтого цвета. Полученный полупродукт, этиловый эфир [(2-амино-5-йодбензоил)метиламино]уксусной кислоты, используют в следующей стадии без дополнительной очистки. 363 [М+H]+, 318 [M-OEt]+, 317 [M(циклизованный продукт)+H]+. К раствору этилового эфира [(2-амино-5-йодбензоил)метиламино]уксусной кислоты в 50 мл этанола добавляют 0,5 г (3,6 ммоль) K2CO3, полученную суспензию нагревают при перемешивании до 85C и выдерживают при данной температуре в течение 1 ч. Полученную смесь оранжевого цвета охлаждают,концентрируют в вакууме и остаток распределяют между 1 н. HCl и CH2Cl2. Органический слой отделяют, сушат Na2SO4, фильтруют и упаривают с получением твердого пенообразного остатка желтого цвета. Остаток переводят во взвесь в небольшом количестве (5 мл) метанола, образующийся твердый осадок фильтруют, промывают минимальным количеством охлажденного на ледяной бане метанола, затем водой и сушат на воздухе, получая 0,52 г (1,6 ммоль, 43%) указанного в заголовке соединения в виде не совсем белого твердого вещества. 1m/z: 317 [М+H]+. Пример F. 6-Йод-4-метоксихиназолин. Суспензию 0,5 г (1,7 ммоль) 4-хлор-6-йодхиназолина (Davos Chemical Corp., Englewood Cliffs, NJ) в 5 мл 0,5 М метоксида натрия в метаноле перемешивают при 70C в герметично закрытой пробирке в течение 2 ч, затем охлаждают для инициирования образования кристаллов. Смесь концентрируют в вакууме. Полученный остаток суспендируют в воде, фильтруют, промывают дополнительным количеством воды и сушат на воздухе, получая 0,4 г (1,4 ммоль, 82%) указанного в заголовке соединения в виде мелких белых игольчатых кристаллов. 1m/z: 287 [М+H]+. Пример G. 6-Йод-4-аминохиназолин. Суспензию 0,5 г (1,7 ммоль) 4-хлор-6-йодхиназолина (Davos Chemical Corp., Englewood Cliffs, NJ) в 10 мл 7 М раствора аммиака в метаноле перемешивают при 70C в герметично закрытой пробирке в течение 90 мин, затем охлаждают для инициирования образования кристаллов. Смесь охлаждают до 0C,фильтруют, промывают охлажденным метанолом, затем петролейным эфиром и сушат на воздухе, получая 0,39 г (1,4 ммоль, 82%) указанного в заголовке соединения в виде твердого белого вещества. 1m/z: 272 [М+H]+. Пример H. 7-Йодпиридо[1,2-а]пиримидин-4-он. К суспензии 2,0 г (9,1 ммоль) 2-амино-5-йодпиридина и 1,44 г (10 ммоль) циклического изопропи- 18010161 лиденового эфира малоновой кислоты в этаноле добавляют 1,0 мл (9,1 ммоль) триметилортоформиата и смесь нагревают при перемешивании до 100C. Полученный раствор бледно-желтого цвета кипятят с отгонкой растворителя, в процессе чего образуется твердый осадок ярко-желтого цвета. Нагрев продолжают в течение 15 мин до тех пор, пока растворитель не перестанет отгоняться, и полученное твердое вещество охлаждают и растворяют в теплом ацетонитриле с получением раствора оранжевого цвета. После охлаждения образуются кристаллы темно-розового цвета. Кристаллы собирают фильтрованием и перекристаллизовывают из ацетонитрила, получая 2,2 г (5,9 ммоль, 64%) 5-[(5-йодпиридин-2 иламино)метилен]-2,2-диметил[1,3]диоксан-4,6-диона в виде смеси игольчатых кристаллов розового цвета и нитеобразных белых кристаллов. 1m/z: 375 [М+H]+. В колбе объемом 100 мл при перемешивании 10 мл простого фенилового эфира нагревают до температуры кипения (используя песчаную баню). К фениловому эфиру одной порцией добавляют 1,0 г(2,7 ммоль) 5-[(5-йодпиридин-2-иламино)метилен]-2,2-диметил[1,3]диоксан-4,6-диона, получая раствор оранжевого цвета. Полученный раствор кипятят с обратным холодильником при перемешивании в течение 15 мин (в процессе чего цвет раствора темнеет). Раствор охлаждают до комнатной температуры и разбавляют примерно 100 мл гексанов с получением кристаллов желтовато-коричневого цвета. Полученные кристаллы собирают фильтрованием и растворяют в теплом 95% этаноле, фильтруют и охлаждают до 0C. Образующиеся кристаллы желтого цвета собирают фильтрованием и сушат на воздухе, получая 90 мг указанного в заголовке соединения. Фильтрат упаривают до твердого остатка желтого цвета, который содержит 95% указанного в заголовке соединения, как показывает анализ ВЭЖХ. Получают всего 320 мг (1,18 ммоль, 44%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1m/z: 273 [М+H]+. В качестве ссылки см., например, патент США 3907798. Пример I. 4-Бром-1-метоксиизоксихинолин. Раствор 0,5 г (2,1 ммоль) 4-бром-1-хлоризоксихинолина в 10 мл (5 ммоль) 0,5 М раствора метоксида натрия в метаноле перемешивают при 70C в течение ночи, затем охлаждают до температуры окружающей среды и разбавляют 30 мл воды, получая обильный белый осадок. Смесь охлаждают до 0C в течение 60 мин, затем фильтруют, осадок промывают водой и сушат на воздухе, получая 0,44 г (1,8 ммоль,88%) указанного в заголовке соединения в виде твердого, воскообразного белого вещества. 1m/z: 239 [М+H]+. Методики синтеза, представленные выше на схемах 1, 3, 5 и 6, применяют при получении соединений, указанных в заголовках приведенных далее примеров. Пример 1. Диметиламид 3-пиридин-2-ил-4-хиноксалин-6-илпиразол-1-сульфоновой кислоты. Синтез указанного в заголовке соединения описан ниже в частях (a)-(e).(a) 2-(1H-Пиразол-3-ил)пиридин. К раствору 10 г (56,7 ммоль) 3-диметиламино-1-пиридин-2-илпропенона в 100 мл абсолютного этанола при перемешивании добавляют 1,96 мл (62,4 ммоль, 1,1 экв.) безводного гидразина с получением раствора бледно-желтого цвета. Раствор кипятят с обратным холодильником при перемешивании в течение ночи, затем упаривают до твердого вещества желтовато-коричневого цвета. Полученный твердый продукт затем кристаллизуют из смеси этилацетат/гексан, получая 8,06 г (55,5 ммоль, 98%) 2-(1Hпиразол-3-ил)пиридина в виде кристаллов желтовато-коричневого цвета. 1(b) 2-(4-Йод-1H-пиразол-3-ил)пиридин. К охлажденному на ледяной бане раствору 3,0 г (20,7 ммоль) 2-(1H-пиразол-3-ил)пиридина в 25 мл сухого ДМФА при перемешивании в течение 10 мин частями добавляют 4,66 г (20,7 ммоль)N-йодсукцинимида (свеже перекристаллизованного из смеси диоксан/эфир). Полученному раствору оранжевого цвета дают нагреться до комнатной температуры, затем перемешивают при 90C в течение ночи, после чего раствор становится темно-оранжевым. Раствор распределяют между CH2Cl2 и насыщенным раствором NaHCO3. Органическую фазу промывают дважды насыщенным NaHCO3, один раз водой, затем насыщенным раствором соли и сушат над Na2SO4. Фильтрат упаривают и полученный остаток перекристаллизовывают дважды из смеси этанол/вода, получая 3,77 г (13,9 ммоль, 67%) 2-(4-йод-1H- 19010161 пиразол-3-ил)пиридина в виде мелких кристаллов бежевого цвета. 1(c) Диметиламид 4-йод-3-пиридин-2-илпиразол-1-сульфоновой кислоты. К раствору 2,46 г (9,1 ммоль) 2-(4-йод-1H-пиразол-3-ил)пиридина в 100 мл CHCl3 при перемешивании добавляют 7,0 мл (50 ммоль, 5,5 экв.) триэтиламина с получением бледно-желтого раствора. Раствор охлаждают до 0C и медленно в течение 10 мин добавляют 4,9 мл (45,4 ммоль, 5 экв.)N,N-диметилсульфамоилхлорида. Полученному раствору желтого цвета дают нагреться до комнатной температуры и кипятят с обратным холодильником при перемешивании в течение ночи. После этого раствор охлаждают, промывают дважды 1 н. раствором NaOH, затем насыщенным раствором соли, сушат,фильтруют и концентрируют. Полученный остаток растворяют примерно в 50 мл смеси этилацетат/гексаны (1:1) и фильтруют через слой силикагеля толщиной 1,5 дюйма. Силикагель промывают дополнительными 200 мл смеси ЕА/гексаны (1:1), получая бледно-оранжевый фильтрат. Фильтрат упаривают, полученный остаток оранжевого цвета перекристаллизовывают из смеси этанол/вода, получая 1,67 г (4,4 ммоль, 49%) диметиламида 4-йод-3-пиридин-2-илпиразол-1-сульфоновой кислоты в виде мелких кристаллов светло-оранжевого цвета. 1(d) 1-(N,N'-Диметил)сульфамоил-3-пиридин-2-илпиразол-4-бороновая кислота. Высушенную в печи колбу объемом 100 мл, содержащую 0,50 г (1,35 ммоль) диметиламида 4-йод 3-пиридин-2-илпиразол-1-сульфоновой кислоты, герметично закрывают мембраной и продувают сухим азотом. Твердое вещество при перемешивании растворяют в 10 мл сухого ТГФ и полученный раствор светло-оранжевого цвета охлаждают до 0C. К полученному раствору медленно с помощью шприца добавляют 1,6 мл (1,6 ммоль, 1,2 экв.) 1,0M раствора бромида изопропилмагния в ТГФ с получением раствора оранжевого цвета. Полученному раствору дают возможность при перемешивании нагреться до комнатной температуры и перемешивание продолжают при комнатной температуре в течение 2 ч, затем переносят в охлажденный на ледяной бане раствор 0,30 мл (2,7 ммоль, 2 экв.) сухого триметилбората в 5 мл сухого ТГФ с получением мутной смеси желтого цвета. Реакционной смеси дают возможность нагреться до комнатной температуры и смесь перемешивают в течение 1 ч, затем гасят 5 мл насыщенного водного раствора NH4Cl с получением двухслойной смеси. К смеси добавляют 15 мл 1 н. раствора NaOH для повышения значения pH водного слоя до примерно 10. Слои разделяют и органический слой экстрагируют один раз 1 н. раствором NaOH. Объединенный органический раствор подкисляют до значения pH примерно 5-6 ледяной уксусной кислотой, что приводит к образованию прозрачного кристаллического осадка. Смесь, содержащую кристаллический осадок, охлаждают до 0C и выдерживают при данной температуре в течение 30 мин, фильтруют, осадок промывают водой и сушат на воздухе, получая 0,27 г(0,9 ммоль, 68%) 1-(N,N-диметил)сульфамоил-3-пиридин-2-илпиразол-4-бороновой кислоты в виде твердого белого вещества. 1(е) Диметиламид 3-пиридин-2-ил-4-хиноксалин-6-илпиразол-1-сульфоновой кислоты. В пробирке высокого давления объединяют 425 мг (1,4 ммоль) 1-(N,N-диметил)сульфамоил-3 пиридин-2-илпиразол-4-бороновую кислоту, 200 мг (0,95 ммоль) 6-бромохиноксалина и 66 мг(0,06 ммоль, 6 моль%) тетракис(трифенилфосфин)палладия (0) и суспендируют смесь в 6 мл этиленгликольдиметилового эфира при перемешивании. К реакционной смеси добавляют 3 мл 1 М раствораNa2CO3, пробирку высокого давления закрывают и нагревают до 85C. Когда температура реакционной смеси достигает желаемого значения, раствор приобретает желтую окраску, полученный раствор перемешивают в течение ночи, затем дают ему возможность охладиться и разбавляют этилацетатом. Органический слой промывают три раза 1 н. раствором NaOH, затем насыщенным раствором соли, сушат(Na2SO4), фильтруют и упаривают до твердого вещества бледно-желтого цвета. Твердый продукт перекристаллизовывают из этанола, получая 260 мг (0,68 ммоль, 72%) диметиламида 3-пиридин-2-ил-4 хиноксалин-6-илпиразол-1-сульфоновой кислоты в виде мелких игольчатых кристаллов бледнооранжевого цвета. 1- 20010161 Пример 2. 6-(3-Пиридин-2-ил-1H-пиразол-4-ил)хиноксалин. В пробирке высокого давления растворяют 100 мг (0,26 ммоль) диметиламида 3-пиридин-2-ил-4 хиноксалин-6-илпиразол-1-сульфоновой кислоты (см. пример 1 выше) в 4 мл (избыток) 0,5M NaOMe вMeOH. После этого пробирку закрывают и перемешивают при 85C в течение ночи. Полученный раствор желтого цвета охлаждают до температуры окружающей среды, нейтрализуют ледяной AcOH и затем очищают препаративной ВЭЖХ с обращенной фазой (H2O/ацетонитрил, не буфер; элюирование с градиентом: AcCN от 5 до 80% в течение 10 мин), получая после лиофилизации 18 мг (0,07 ммоль, 25%) 6-(3-пиридин-2-ил-1H-пиразол-4-ил)хиноксалина в виде белого легкого твердого вещества. 1m/z: 274 [М+H]+. Пример 3. Диметиламид 4-(4-оксо-3,4-дигидрофталазин-1-ил)-3-пиридин-2-илпиразол-1-сульфоновой кислоты. Синтез указанного в заголовке соединения описан в частях (а) и (b) ниже.(см. пример 1, часть (с) выше) в 10 мл ТГФ в сухом N2 охлаждают до 0C при перемешивании и добавляют 0,9 мл (0,9 ммоль) 1,0 М раствора бромида изопропилмагния в ТГФ с получением раствор желтого цвета. Полученный раствор нагревают до температуры окружающей среды и перемешивают в течение 2 ч. Раствор охлаждают до 0C и добавляют раствор 130 мг (0,89 ммоль) фталевого ангидрида в 5 мл ТГФ. Полученный раствор нагревают до температуры окружающей среды и перемешивают в течение 90 мин, затем разбавляют насыщенным раствором гидрокарбоната натрия (50 мл) и промывают один раз этилацетатом. Водный слой подкисляют до значения pH примерно 5 с помощью 1 н. HCl и экстрагируют дважды CH2Cl2. Органические слои объединяют, сушат (Na2SO4), фильтруют и концентрируют до масла желтого цвета, которое кристаллизуется с получением 120 мг (0,30 ммоль, 57%) 2-(1-диметилсульфамоил-3-пиридин-2-ил-1H-пиразол-4-карбонил)бензойной кислоты. Данный продукт используют на следующей стадии без дополнительной очистки. 1(b) Диметиламид 4-(4-оксо-3,4-дигидрофталазин-1-ил)-3-пиридин-2-илпиразол-1-сульфоновой кислоты. В суспензию 120 мг (0,3 ммоль) 2-(1-диметилсульфамоил-3-пиридин-2-ил-1H-пиразол-4-карбонил)бензойной кислоты в 10 мл этанола при перемешивании добавляют 1 мл (избыток) гидразингидрата. Полученный раствор кипятят с обратным холодильником в течение 2 ч, охлаждают и затем упаривают в вакууме, получая твердое вещество розовато-белого цвета, которое суспендируют в теплом этаноле и фильтруют. Фильтрат разбавляют водой с получением мутной смеси. Смесь выдерживают в течение ночи при 4C, в процессе чего образуется кристаллический осадок. Кристаллы собирают фильтрованием,промывают водой и сушат на воздухе, получая 70 мг (0,18 ммоль, 59%) диметиламида 4-(4-оксо-3,4 дигидрофталазин-1-ил)-3-пиридин-2-илпиразол-1-сульфоновой кислоты в виде мелких кристаллов бледно-розового цвета. 1m/z: 397 [М+H]+. Пример 4. 4-(3-Пиридин-2-ил-1H-пиразол-4-ил)-2H-фталазин-1-он. В соответствии с методикой, описанной в примере 2 выше, диметиламид 4-(4-оксо-3,4 дигидрофталазин-1-ил)-3-пиридин-2-илпиразол-1-сульфоновой кислоты (см. пример 3 выше) обрабатывают избытком NaOMe в MeOH, получая указанное в заголовке соединение в виде твердого белого вещества. 1m/z: 290 [М+H]+. Пример 5. 2-(4-Бензо[1,3]диоксол-5-ил-1H-пиразол-3-ил)-6-бромпиридин. Синтез указанного в заголовке соединения описан в частях (a) и (b) ниже.(a) 2-Бензо[1,3]диоксол-5-ил-1-(6-бромпиридин-2-ил)этанон. К раствору 6-бром-2-пиридинкарбоксальдегида (10 г, 53,76 ммоль) в 2-пропаноле добавляют анилин (6 мл, 64,51 ммоль) с последующим добавлением дифенилфосфита (16,5 мл, 86,02 ммоль). Получен- 21010161 ный раствор перемешивают при комнатной температуре в течение ночи. Образовавшийся в растворе осадок собирают, промывают три раза охлажденным 2-пропанолом и сушат, получая дифениловый эфир[(6-бромпиридин-2-ил)фениламинометил]фосфоновой кислоты (N,P-ацеталь) в виде твердого белого вещества (19,15 г, 72%). К раствору N,Р-ацеталя (37 г, 74,60 ммоль) и пипероналя (11,2 г, 74,60 ммоль) в смеси ТГФ (200 мл) и 2-пропанола (200 мл) добавляют карбонат цезия (29 г, 89,52 ммоль). Полученную реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем в реакционную смесь добавляют раствор 3 М HCl и реакционную смесь перемешивают в течение 3 ч. Растворитель выпаривают и полученный остаток экстрагируют EtOAc и водой. Органические экстракты сушат надMgSO4 и упаривают. Полученный остаток перекристаллизовывают из 2-пропанола, получая указанное в заголовке соединение в виде твердого белого вещества (20 г, 84%).(350 мл) добавляют N,N-диметилформамид-диметилацеталь (ДМФА-DMA) (23,2 мл, 272 ммоль). Смесь перемешивают при 60C в течение 3 ч. Растворитель удаляют, полученный остаток растворяют в этаноле(400 мл) и добавляют гидразин (8,9 мл, 409 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 3 ч и концентрируют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле, получая указанное в заголовке соединение (22,5 г, 96%). 1(который получают в соответствии с методикой, описанной в примере 5 выше, используя 6-метил-2 пиридинкарбоксальдегид вместо 6-бром-2-пиридинкарбоксальдегида в качестве исходного вещества в части (a в ТГФ добавляют 2,0 мл (1,0 ммоль) 0,5 М NaOMe в MeOH. Полученную реакционную смесь перемешивают, затем добавляют 0,07 мл (1,0 ммоль) бромацетонитрила и полученный раствор перемешивают при комнатной температуре в течение ночи. Раствор концентрируют с получением остатка, который растворяют в минимальном количестве смеси MeOH/CH2Cl2 (1:1), переносят на диоксид кремния и элюируют 4% MeOH в CH2Cl2, получая 135 мг (0,42 ммоль, 88%) [4-бензо[1,3]диоксол-5-ил-3-(6 метилпиридин-2-ил)пиразол-1-ил]ацетонитрила в виде твердого бесцветного вещества. 1m/z: 319[M+H]+. Пример 7. Метиловый эфир 4-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]бицикло[2,2,2]октан-1-карбоновой кислоты. Синтез указанного в заголовке соединения описан ниже в частях (а)-(с).(5 мл) медленно добавляют раствор (триметилсилил)диазометана в гексане (2,0 М, 1 мл). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре. После этого растворитель удаляют, получая метиловый эфир 4-гидроксибицикло[2,2,2]октан-1-карбоновой кислоты в виде твердого вещества желтого цвета (0,105 г, 99%). 1(b) Метиловый эфир 4-трифторметансульфонилоксибицикло[2,2,2]октан-1-карбоновой кислоты. К раствору метилового эфира 4-гидроксибицикло[2,2,2]октан-1-карбоновой кислоты (0,105 г,0,57 ммоль) и пиридина (0,10 мл, 1,24 ммоль) в дихлорметане (4 мл) медленно при 0C добавляют ангидрид трифторметансульфоновой кислоты (0,10 мл, 0,59 ммоль) и полученную смесь перемешивают в течение 3 ч. Реакционную смесь разбавляют дихлорметаном (50 мл). Дихлорметановый раствор промывают охлажденной HCl (1 М), затем последовательно 10% NaHCO3 и насыщенным раствором соли. Органический слой сушат над Na2SO4 и концентрируют, получая метиловый эфир 4 трифторметансульфонилоксибицикло[2,2,2]октан-1-карбоновой кислоты в виде масла красного цвета(c) Метиловый эфир 4-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]бицикло[2,2,2]октан-1-карбоновой кислоты. К раствору метилового эфира 4-трифторметансульфонилоксибицикло[2,2,2]октан-1-карбоновой кислоты (202 мг, 0,64 ммоль) и DIEA (223 мкл, 1,28 ммоль) в трифтортолуоле (10 мл) добавляют 2-(4 бензо[1,3]диоксол-5-ил-1H-пиразол-3-ил)-6-метилпиридин (268 мг, 0,96 ммоль; см. пример 6 выше). Смесь нагревают до 100C и выдерживают при данной температуре в течение 29 ч, затем охлаждают до комнатной температуры и разбавляют CH2Cl2. Смесь промывают водой и насыщенным раствором соли,сушат над MgSO4 и концентрируют. Полученный остаток очищают препаративной ВЭЖХ, получая указанное в заголовке соединение, метиловый эфир 4-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2- 22010161 ил)пиразол-1-ил]бицикло[2,2,2]октан-1-карбоновой кислоты (10 мг, 4%). 1MC (ESP+) m/z 446,3 (M+1) и изомер указанного в заголовке соединения. Пример 8. Метиловый эфир 4-(2-2-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]этоксиэтокси)бицикло[2,2,2]октан-1-карбоновой кислоты. 2-(4-Бензо[1,3]диоксол-5-ил-1H-пиразол-3-ил)-6-метилпиридин (0,146 г, 0,52 ммоль; см. пример 6 выше) добавляют к раствору метилового эфира 4-трифторметансульфонилоксибицикло[2,2,2]октан-1 карбоновой кислоты (0,11 г, 0,35 ммоль; см. пример 7, части (а) и (b) выше) и диизопропилэтиламина(0,09 г, 0,70 ммоль) в 1,4-диоксане (5 мл). Реакционную смесь перемешивают при 100C в течение 30 ч. После этого растворитель удаляют. Полученный остаток распределяют между этилацетатом и водой. Органический слой промывают насыщенным раствором соли и сушат над Na2SO4. Остаток, полученный после упаривания раствора, очищают препаративной ВЭЖХ, получая указанное в заголовке соединение,метиловый эфир 4-(2-2-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]этоксиэтокси)бицикло[2,2,2]октан-1-карбоновой кислоты (0,05 г, 27%). 1H-ЯМР (300 МГц, метанол-d4, ): 8,26 (т, 1H, J=8,1 Гц), 8,01 (с, 1H), 7,74 (д, 1H, J=7,8 Гц), 7,61 (д,1H, J=8,1 Гц), 6,84 (м, 3H), 6,00 (с, 2H), 4,48 (м, 2H), 3,92 (м, 2H), 3,57 (м, 2H), 3,31 (м, 2H), 2,84 (с, 3H),1,79 (м, 6H), 1,58 (м, 6H). МС (ES +) m/z 534,2 (М+1) и изомер указанного в заголовке соединения. Пример 9. 4-(2-2-[4-Бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]этоксиэтокси)бицикло[2,2,2]октан-1-карбоновая кислота. Раствор метилового эфира 4-(2-2-[4-бензо[1,3]диоксол-5-ил-5-(6-метилпиридин-2-ил)пиразол-1-ил] этоксиэтокси)бицикло[2,2,2]октан-1-карбоновой кислоты (0,02 г, 0,037 ммоль; см. пример 8 выше) в концентрированной соляной кислоте (3 мл) перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь затем гасят концентрированным гидроксидом аммония. Воду удаляют в вакууме,получая твердый белый продукт, который промывают метиленхлоридом и метилхлорид выпаривают. Очистка препаративной ВЭЖХ приводит к получению указанного в заголовке соединения в виде твердого вещества желтого цвета (0,002 г, 11%). 1MC (ESP+) m/z 520,4 (М+1). Пример 10. 3-[4-Бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]пропионитрил. К раствору 250 мг (0,9 ммоль) 2-(4-бензо[1,3]диоксол-5-ил-1H-пиразол-3-ил)-6-метилпиридина (см. пример 6 выше) в EtOH при перемешивании добавляют 0,25 мл 50% водн. раствора KOH, получая осадок розового цвета. К осадку добавляют 0,12 мл (1,8 ммоль) акрилонитрила. Полученный раствор перемешивают в течение ночи, затем фильтруют. Фильтрат концентрируют с получением остатка, который растворяют в минимальном количестве 1:1 MeOH/CH2Cl2, наносят на диоксид кремния и элюируют 4% MeOH вCH2Cl2, получая 160 мг (0,48 ммоль, 54%) 3-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол 1-ил]пропионитрила в виде бесцветного твердого вещества. 1m/z: 333[M+H]+. Пример 11. 3-[4-Бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]пропиламин. К раствору 130 мг (0,39 ммоль) 3-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1 ил]пропионитрила (см. пример 10, выше) в 4 мл EtOH при перемешивании добавляют 2 мл (избыток) 2 М раствора аммиака в EtOH. К полученному раствору добавляют каталитическое количество никеля Ренея,предварительно промытого EtOH. Смесь гидрируют газообразным водородом с давлением 40 фунтов на кв. дюйм при энергичном перемешивании в течение 2 ч, после чего фильтруют через рыхлый слой целита. Фильтрат концентрируют, получая 135 мг (количественный выход) указанного в заголовке соединения в виде бесцветного масла, которое используют далее без дополнительной очистки; m/z 337[M+H]+. Пример 12. 3-(3-Пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропиламин. К раствору 130 мг (0,39 ммоль) 3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропионитрилаEtOH при перемешивании добавляют 2 мл (избыток) 2 М раствора аммиака в EtOH. К полученному раствору добавляют каталитическое количество никеля Ренея, предварительно промытого EtOH. Смесь гид- 23010161 рируют газообразным водородом с давлением 40 фунтов на кв. дюйм при энергичном перемешивании в течение 2 ч, после чего фильтруют через рыхлый слой целита. Фильтрат концентрируют, получая 135 мг(количественный выход) указанного в заголовке соединения в виде бесцветного масла, которое используют далее без дополнительной очистки. 30 мг продукта растворяют в 5 мл CH2Cl2, добавляют 1,0 мл 1MHCl в эфире с получением осадка, осадок собирают фильтрованием и сушат на воздухе, получая указанное в заголовке соединение в виде его гидрохлоридной соли. 1N-3-[4-Бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1-ил]пропилметансульфонамид. К раствору 135 мг (0,39 ммоль) 3-[4-бензо[1,3]диоксол-5-ил-3-(6-метилпиридин-2-ил)пиразол-1 ил]пропиламина (см. пример 11 выше) в CH2Cl2 при перемешивании добавляют 0,14 мл (1,0 ммоль) триэтиламина, затем 0,06 мл (0,8 ммоль) метансульфонилхлорида с получением раствора желтого цвета. Полученный раствор перемешивают при комнатной температуре в течение 2 ч, затем концентрируют,снова растворяют в MeOH и очищают препаративной ВЭЖХ (элюирование с градиентом:H2O/ацетонитрил, не буфер; элюирование с градиентом: AcCN от 5 до 80%, в течение 10 мин), получая 21 мг указанного в заголовке соединения в виде твердого вещества бледно-желтого цвета. 1H-ЯМР (300 МГц, CDCl3, ): 7,97 (д, J=4 Гц, 1H), 7,55 (с, 1H), 7,40 (м, 2H), 7,13 (с, 1H), 6,79 (д, J=8 Гц, 2H), 6,00 (с, 2H), 4,46 (т, J=6 Гц, 2H), 3,20 (м, 5H), 2,96 (с, 3H), 2,36 (т, J=6 Гц, 2H); m/z: 415 [М+H]+. Пример 14. Диметил[3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропил]амин. К раствору 50 мг (0,15 ммоль) 3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропиламина (свободное основание, см. пример 12 выше) в 3 мл метанола при перемешивании добавляют 0,025 мл 37% водного раствора формальдегида и затем каталитическое количество 10% палладия на углероде с получением черной смеси. Полученную смесь помещают в атмосферу газообразного водорода с давлением 50 фунтов на кв. дюйм и перемешивают при комнатной температуре в течение ночи, затем дегазируют и фильтруют через рыхлый слой целита. Фильтрат концентрируют и очищают препаративной ВЭЖХ(элюирование с градиентом: H2O/ацетонитрил, не буфер; AcCN от 5 до 80% AcCN в течение 10 мин),получая 17 мг (0,048 ммоль, 32%) указанного в заголовке соединения в виде бесцветного твердого вещества. 1m/z: 319 [М+H]+. Пример 15. 4-[3-Пиридин-2-ил-1-(3-пирролидин-1-илпропил)-1H-пиразол-4-ил]хинолин, HCl соль. К раствору 50 мг (0,15 ммоль) 3-(3-пиридин-2-ил-4-хинолин-4-ил-пиразол-1-ил)пропиламина (свободное основание, см. пример 12 выше) в 5 мл ТГФ добавляют 138 мг (1 ммоль) K2CO3, затем 0,04 мл(0,32 ммоль) 1,4-дибромбутана с получением бесцветной смеси. Смесь кипятят с обратным холодильником в течение ночи, затем фильтруют, концентрируют и очищают препаративной ВЭЖХ (элюирование с градиентом: H2O/ацетонитрил, не буфер; AcCN от 5% до 80%, в течение 10 мин), получая бесцветное твердое вещество, которое превращают в HCl-соль растворением в 5 мл CH2Cl2 и добавлением 1,2 экв. 1 М HCl в Et2O. После этого полученный раствор упаривают, получая 11 мг указанного в заголовке соединения в виде твердого вещества бледно-желтого цвета. 1m/z: 385 [М+H]+. Пример 16. 4-3-Пиридин-2-ил-1-[2-(2H-тетразол-5-ил)этил]-1H-пиразол-4-илхинолин. К смеси 70 мг (0,20 ммоль) 3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропионитрила (см. пример 12 выше), 30 мг (0,44 ммоль) азида натрия и 24 мг (0,44 ммоль) хлорида аммония в пробирке высокого давления добавляют 3 мл сухого ДМФА. Полученную суспензию перемешивают при 100C в течение ночи, затем охлаждают и концентрируют. Полученный остаток растворяют в 5 мл 1 М водного раствора Na2CO3, промывают дважды CH2Cl2, затем упаривают до половины объема в вакууме и нейтрализуют ледяной AcOH. Полученную смесь очищают препаративной ВЭЖХ (элюирование с градиентом:H2O/ацетонитрил, не буфер; AcCN от 5% до 80%, в течение 10 мин), получая 26 мг (0,07 ммоль, 35%) указанного в заголовке соединения в виде твердого былого вещества, легкого на вид. 1m/z: 369 [М+H]+. Пример 17. 3-(3-Пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропионовая кислота. К раствору 110 мг (0,34 ммоль) 3-(3-пиридин-2-ил-4-хинолин-4-илпиразол-1-ил)пропионитрила (см. пример 12 выше) в 5 мл этанола добавляют 10 мл 5 М водного раствора NaOH с получением мутной смеси. Реакционную смесь перемешивают при 105C в течение ночи, получая бесцветный раствор. Полученную реакционную смесь охлаждают до комнатной температуры и нейтрализуют ледяной уксусной кислотой, что приводит к образованию белого осадка. Осадок собирают и фильтрат экстрагируют дважды 50 мл CH2Cl2. Органические слои объединяют и сушат (Na2SO4), фильтруют и упаривают с получение твердого вещества желтого цвета. Твердый продукт объединяют с осадком и очищают препаративной ВЭЖХ (элюирование с градиентом: H2O/ацетонитрил, не буфер; AcCN от 5 до 80%, в течение 10 мин),получая 25 мг (0,07 ммоль, 21%) указанного в заголовке соединения в виде твердого белого вещества. 1(см. пример 17 выше) в 2 мл ДМФА добавляют 14 мг (0,2 ммоль) гидрохлорида гидроксиламина, 46 мг(0,12 ммоль) гексафторфосфата О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU), затем 0,09 мл (0,5 ммоль) диизопропилэтиламина с получением раствора желтого цвета. Раствор перемешивают при комнатной температуре в течение 2 ч и затем очищают препаративной ВЭЖХ (элюирование с градиентом: H2O/ацетонитрил, не буфер; AcCN от 5 до 80%, в течение 10 мин), получая 2 мг (0,06 ммоль,6%) указанного в заголовке соединения в виде твердого белого вещества. 1m/z: 360 [М+H]+. Пример 19. 2-(4-Бензо[1,3]диоксол-5-ил-1H-пиразол-3-ил)-6-винилпиридин. Синтез указанного в заголовке соединения описан ниже в частях (а) и (b).(a) Диметиламид 4-бензо[1,3]диоксол-5-ил-3-(6-бромпиридин-2-ил)пиразол-1-сульфоновой кислоты. К раствору 2-(4-бензо[1,3]диоксол-5-ил-1H-пиразол-3-ил)-6-бромпиридина (11,8 г, 34 ммоль; см. пример 5 выше) в CH2Cl2 (250 мл) добавляют диметилсульфамоилхлорид (14,7 мл, 136 ммоль), триэтиламин (28,8 мл, 204 ммоль) и DMAP (1,0 г). Смесь перемешивают при 60C в течение 3 дней, после чего растворитель выпаривают. К полученному остатку добавляют этилацетат (150 мл) и нерастворимые твердые вещества собирают фильтрованием. Фильтрат концентрируют и очищают колоночной флэшхроматографией на силикагеле, получая указанное в заголовке соединение в виде твердого вещества желтого цвета (12,1 г, 78%).(b) 2-(4-Бензо[1,3]диоксол-5-ил-1H-пиразол-3-ил)-6-винилпиридин. Смесь диметиламида 4-бензо[1,3]диоксол-5-ил-3-(6-бромпиридин-2-ил)пиразол-1-сульфоновой кислоты (210 мг, 0,47 ммоль), трибутил(винил)олова (295 мг, 0,93 ммоль), тетракис(трифенилфосфино)палладия (27 мг, 0,024 ммоль) в ТГФ (2 мл) выдерживают в герметично закрытой пробирке при 120C в течение ночи. Реакционную смесь охлаждают до комнатной температуры и экстрагируют CH2Cl2 и насыщенным раствором карбоната натрия. Органический слой сушат над MgSO4 и концентрируют. Полученный остаток очищают колоночной хроматографией на силикагеле (элюирование с градиентом: 0-5% EtOAc/CH2Cl2), получая диметиламид 4-бензо[1,3]диоксол-5-ил-3-(6-винилпиридин-2-ил)пиразол 1-сульфоновой кислоты (183 мг, 99%). 100 мг данного диметиламида сульфоновой кислоты (0,25 ммоль) затем растворяют в смеси ТГФ (2 мл) и EtOH (8 мл) и добавляют раствор NaOEt в EtOH (23%, 1 мл). Полученный раствор кипятят с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры и концентрируют. Полученный остаток фильтруют через короткую колонку с силикагелем и промывают ТГФ. Фильтраты концентрируют и снова растворяют в ДМСО. Раствор очищают полупрепаративной ВЭЖХ, получая указанное в заголовке соединение (30 мг, 41%). МС (ESP+) m/z 292,3 (M+1). 1- 25010161 Пример 20. 2-(4-Бензо[1,3]диоксол-5-ил-1H-пиразол-3-ил)-6-этилпиридин. Суспензию 2-(4-бензо[1,3]диоксол-5-ил-1H-пиразол-3-ил)-6-винилпиридина (20 мг, 0,069 ммоль; см. пример 19 выше) и Pd/C (10%, 50 мг) в смеси MeOH (5 мл) и EtOAc (5 мл) перемешивают при комнатной температуре в атмосфере водорода с давлением 1 атмосфера в течение 1 ч. Полученный остаток фильтруют через целит и промывают ТГФ. Фильтрат концентрируют и очищают полупрепаративной ВЭЖХ, получая указанное в заголовке соединение (10 мг, 50%). МС (ESP+) m/z 294,1 (M+l). 1H-ЯМР (300 МГц, MeOH-d4, ): 8,28 (т, 1H), 7,95 (с, 1H), 7,76 (д, 1H), 7,65 (д, 1H), 6,90-6,82 (м, 3H),6,01 (с, 2H), 3,11 (кв., 2H), 1,43 (т, 3H). Пример 21. 2-(4-Бензо[1,3]диоксол-5-ил-1H-пиразол-3-ил)-6-циклопропилпиридин. Раствор бромида циклопропилмагния в ТГФ (0,5 М, 0,5 мл) по каплям добавляют к раствору ZnCl2 в ТГФ (0,5 М, 0,5 мл) при -78C при перемешивании. Полученной суспензии дают возможность нагреться до комнатной температуры и перемешивание продолжают в течение дополнительных 1,5 ч. Затем суспензию переносят в герметичный трубчатый реактор вместе с диметиламидом 4-бензо[1,3]диоксол-5-ил 3-(6-бромпиридин-2-ил)пиразол-1-сульфоновой кислоты (100 мг, 0,22 ммоль; см. пример 19, часть (а) выше) и тетракис(трифенилфосфин)палладием (25 мг, 0,022 ммоль). Смесь перемешивают при 120C в течение 2 ч и дают ей возможность охладиться до комнатной температуры в течение ночи при перемешивании. Полученную реакционную смесь разбавляют EtOAc и промывают насыщенным растворомNH4Cl. Органический слой сушат над MgSO4 и концентрируют. Полученный остаток очищают на колонке с силикагелем (элюирование: 5% EtOAc/CH2Cl2), получая диметиламид 4-бензо[1,3]диоксол-5-ил-3-(6 циклопропилпиридин-2-ил)пиразол-1-сульфоновой кислоты(51 мг,56%). Диметиламид 4-бензо[1,3]диоксол-5-ил-3-(6-циклопропилпиридин-2-ил)пиразол-1-сульфоновой кислоты (50 мг,0,12 ммоль) растворяют в смеси ТГФ (1 мл) и EtOH (4 мл) и добавляют раствор NaOEt в EtOH (23%,1 мл). Полученный раствор кипятят с обратным холодильником в течение 2 ч и затем ему дают возможность охладиться до комнатной температуры и концентрируют. Полученный остаток фильтруют через небольшой слой силикагеля и промывают ТГФ. Фильтрат концентрируют и снова растворяют в ДМСО для очистки полупрепаративной ВЭЖХ, получая указанное в заголовке соединение (10 мг, 27%). МС (ESP+) m/z 306, (M+1). 1(362 мг, 1,87 ммоль) в безводном ДМФА (4 мл) продувают газообразным азотом 3 раза. Затем в реакционную смесь добавляют медный порошок (12 мг, 0,19 ммоль) и полученную смесь перемешивают при 80C в течение 4 ч. Смесь охлаждают до комнатной температуры и экстрагируют диэтиловым эфиром и водой. Эфирный экстракт дважды промывают EDTA (0,5 М, 20 мл) и один раз водой, затем сушат надMgSO4 и концентрируют,получая сырой диметиламид 4-бензо[1,3]диоксол-5-ил-3-(6 трифторметилпиридин-2-ил)пиразол-1-сульфоновой кислоты (160 мг) в виде ярко-желтой пены. Сырой продукт растворяют в EtOH (10 мл) и добавляют раствор NaOEt в EtOH (23%, 1 мл). После этого реакционную смесь кипятят с обратным холодильником в течение ночи, охлаждают до комнатной температуры и концентрируют. Полученный остаток фильтруют через небольшой слой целита и промывают ТГФ. Фильтрат концентрируют, снова растворяют в ДМСО и очищают полупрепаративной ВЭЖХ, получая указанное в заголовке соединение (65 мг, 52% для двух стадий). МС (ESP+) m/z 334,2 (M+1). 1(который получают реакцией сочетания 4-бром-1 метоксиизоксихинолина (соединение, указанное в заголовке примера I, описанного выше) с 1-(N,Nдиметил)сульфамоил-3-пиридин-2-илпиразол-4-бороновой кислоты (соединение, указанное в заголовке примера 1(d) выше) в соответствии с методикой, описанной в примере 1(е) выше) в 5 мл сухого ацетонитрила добавляют 0,37 мл (2,6 ммоль, 20 экв.) йодтриметилсилана с получением раствора оранжевого цвета. Реакционную смесь перемешивают при 70C в течение ночи, затем раствору дают возможность охладиться до комнатной температуры, разбавляют этилацетатом и промывают 10% водн. раствором тиосульфата натрия, водой и насыщенным раствором соли. Полученный раствор сушат (Na2SO4), фильт- 26010161 руют и упаривают, получая указанное в заголовке соединение в виде твердого вещества желтого цвета,которое не требует дополнительной очистки; m/z 396 [М+H]+. Пример 24. 2-(4-бензо[1,3]диоксол-5-ил-5-трифторметил-1H-пиразол-3-ил)-6-бромпиридин. Раствор 2-бензо[1,3]диоксол-5-ил-1-(6-бромпиридин-2-ил)этанона (0,359 ммоль) в безводном ТГФ(5 мл) при комнатной температуре добавляют к взвеси гидрида натрия (0,725 ммоль) в безводном ТГФ (5 мл). Спустя 5 мин добавляют N-трифторацетилимидазол (0,395 ммоль). Смесь выдерживают при комнатной температуре в течение 30 мин, после чего добавляют гидразин (1,5 мл). Спустя еще 30 мин добавляют ледяную уксусную кислоту (10 мл) и реакционную смесь выдерживают при 100C в течение 1 ч. Реакционную смесь концентрируют в вакууме и очищают ВЭЖХ с обращенной фазой (элюирование с градиентом: ацетонитрил-вода), получая твердый продукт, который идентифицируют как 2-(4 бензо[1,3]диоксол-5-ил-5-трифторметил-1H-пиразол-3-ил)-6-бромпиридин. МС (ESP+) 411,9 (М+1). Пример 25. 1-трет-Бутил-3-[6-(3-пиридин-2-ил-1H-пиразол-4-ил)хиназолин-4-ил]карбамид. В высушенную в печи круглодонную колбу объемом 100 мл загружают 500 мг (1,26 ммоль) диметиламида 4-(4-аминохиназолин-6-ил)-3-пиридин-2-илпиразол-1-сульфоновой кислоты (который получают реакцией сочетания 6-йод-4-аминохиназолина (соединение, указанное в заголовке примера G, описанного выше) с 1-(N,N-диметил)сульфамоил-3-пиридин-2-илпиразол-4-бороновой кислоты (соединение,указанное в заголовке пример 1(d) выше) в соответствии с методикой примера 1(е), описанного выше),колбу закрывают каучуковой мембраной и продувают аргоном. В колбу при перемешивании добавляют 15 мл сухого ДМФА с получением бесцветного раствора, затем добавляют 60 мг (1,5 ммоль, 1,2 экв.)NaH (60% мас./мас. в минеральном масле), что приводит к обильному выделению газа и получению смеси желтого цвета. Смесь перемешивают при температуре окружающей среды в течение 30 мин, затем добавляют 145 мкл (1,26 ммоль) трет-бутилизоцианата и полученную смесь перемешивают в течение ночи. Реакционную смесь желтого цвета гасят примерно 0,5 мл ледяной AcOH и бесцветный раствор концентрируют. Остаток обрабатывают H2O с получением твердого вещества светло-коричневого цвета. Твердый продукт собирают фильтрованием, промывают водой и сушат на воздухе, затем перекристаллизовывают из смеси этанол/вода, получая 585 мг (1,18 ммоль, 94%) метиламида 4-[4-(3-третбутилуреидо)хиназолин-6-ил]-3-пиридин-2-илпиразол-1-сульфоновой кислоты в виде твердого вещества желтовато-коричневого цвета. Кристаллы качества, подходящего для рентгенографии, получают из смеси хлороформ/гексан. 1m/z 495 [М+H]+. После этого из диметиламида 4-[4-(3-трет-бутилуреидо)хиназолин-6-ил]-3-пиридин-2-илпиразол-1 сульфоновой кислоты удаляют защиту в соответствии с методикой, описанной в примере 2, получая указанное в заголовке соединение. 1H-ЯМР (400 МГц, CDCl3, ): 10,19 (с, 1H), 9,86 (с, 1H), 8,81 (с, 1H), 8,60 (шир.с, 2H), 7,93 (с, 2H),7,66 (с, 1H), 7,60 (т, J=8 Гц, 1H), 7,43 (д, J=8 Гц, 1H), 7,20 (м, 1H), 1,54 (с, 9H); m/z 388 [М+H]+. Пример 26. 4-Морфолин-4-ил-6-(3-пиридин-2-ил-1H-пиразол-4-ил)хиназолин. К раствору 0,2 г (0,48 ммоль) диметиламида 4-(4-хлор-хиназолин-6-ил)-3-пиридин-2-илпиразол-1 сульфоновой кислоты (который получают реакцией сочетания 4-хлор-6-йодхиназолина (Davos ChemicalCorp., Upper Saddle River, NJ) с 1-(N,N-диметил)сульфамоил-3-пиридин-2-илпиразол-4-бороновой кислотой (соединением, указанным в заголовке примера 1(d) выше) в соответствии с методикой, описанной в примере 1(е) выше) в 4 мл ацетонитрила в пробирке высокого давления добавляют 0,13 мл (1,5 ммоль) морфолина с получением бесцветного раствора. Пробирку закрывают и раствор перемешивают при 85C в течение 3 ч. Реакционную смесь охлаждают, концентрируют и остаток переносят в этилацетат. Смесь промывают 5% раствором лимонной кислоты, затем насыщенным раствором соли, сушат (Na2SO4),фильтруют и концентрируют, получая диметиламид 4-(4-морфолин-4-илхиназолин-6-ил)-3-пиридин-2 илпиразол-1-сульфоновой кислоты (0,14 г, 0,39 ммоль, 70%), который используют в следующей стадии без дополнительной очистки;m/z: 4 66 (M+1)+. После этого из диметиламида 4-(4-морфолин-4-илхиназолин-6-ил)-3-пиридин-2-илпиразол-1 сульфоновой кислоты удаляют защиту в соответствии с методикой, описанной в примере 2, получая указанное в заголовке соединение. 1- 27010161 Пример 27. 4-(4-Метоксифенил)-6-(3-пиридин-2-ил-1H-пиразол-4-ил)хиназолин. К раствору 180 мг (0,43 ммоль) диметиламида 4-(4-хлорхиназолин-6-ил)-3-пиридин-2-илпиразол-1 сульфоновой кислоты (полученному реакцией сочетания 4-хлор-6-йодхиназолина (Davos Chemical Corp.,Upper Saddle River, NJ) с 1-(N,N-диметил)сульфамоил-3-пиридин-2-илпиразол-4-бороновой кислоты (соединение, указанное в заголовке примера 1(d) выше) в соответствии с методикой, описанной в примере 1(е) выше) в 5 мл толуола в пробирке высокого давления добавляют 99 мг (0,65 ммоль, 1,5 экв.) 4 метоксибензолбороновой кислоты, 90 мг (0,65 ммоль) твердого K2CO3 и 25 мг (0,022 ммоль, 5 мол.%) тетракис(трифенилфосфин)палладия(0) с получением раствора желтого цвета. Пробирку продувают аргоном, закрывают и раствор перемешивают при 100C в течение ночи. Полученную смесь охлаждают,разбавляют этилацетатом, промывают 1 н. раствором NaOH, 5% раствором лимонной кислоты, насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют, получая диметиламид 4-[4-(4 метоксифенил)хиназолин-6-ил]-3-пиридин-2-илпиразол-1-сульфоновой кислоты (160 мг, 0,33 ммоль,77%) который используют в следующей стадии без дополнительной очистки;m/z: 487 (M+1)+. После этого из диметиламида 4-[4-(4-метоксифенил)хиназолин-6-ил]-3-пиридин-2-илпиразол-1 сульфоновой кислоты удаляют защиту в соответствии с методикой, описанной в примере 2, получая указанное в заголовке соединение. 1[6-(3-Пиридин-2-ил-1H-пиразол-4-ил)хиназолин-4-ил]амид 5-метилтиофен-2-карбоновой кислоты. К раствору 200 мг (0,5 ммоль) диметиламида 4-(4-аминохиназолин-6-ил)-3-пиридин-2-илпиразол-1 сульфоновой кислоты (полученному реакцией сочетания 6-йод-4-аминохиназолина (соединение, указанное в заголовке примера G, описанного выше) с 1-(N,N-диметил)сульфамоил-3-пиридин-2-илпиразол-4 бороновой кислотой (соединение, указанное в заголовке примера 1(d) выше) в соответствии с методикой,описанной в примере 1(е) выше) в 10 мл CH3CN при перемешивании добавляют 0,28 мл (2,0 ммоль) триэтиламина, затем 97 мг (0,6 ммоль) 5-метилтиофен-2-карбонилхлорида (Oakwood Products, Inc., West Columbia, SC) с получением раствора желтого цвета. Раствор кипятят с обратным холодильником в течение ночи, затем охлаждают, разбавляют этилацетатом, промывают 1 н. раствором NaOH, 5% раствором лимонной кислоты, насыщенным раствором соли. Органическую фазу сушат, фильтруют и концентрируют,получая[6-(1-диметилсульфамоил-3-пиридин-2-ил-1H-пиразол-4-ил)хиназолин-4-ил]амид 5-метилтиофен-2-карбоновой кислоты в виде твердого вещества желтого цвета, который используют в следующей стадии без дополнительной очистки;(4-Метоксифенил)-[6-(3-пиридин-2-ил-1H-пиразол-4-ил)хиназолин-4-ил]метанон. К раствору 500 мг (1,2 ммоль) диметиламида 4-(4-хлорхиназолин-6-ил)-3-пиридин-2-илпиразол-1 сульфоновой кислоты (полученному реакцией сочетания 6-йод-4-хлорхиназолина (соединение, указанное в заголовке примера G выше) с 1-(N,N-диметил)сульфамоил-3-пиридин-2-илпиразол-4-бороновой кислотой (соединение, указанное в заголовке примера 1 (в) выше) в соответствии с методикой, описанной в примере 1(е) выше), 0,16 мл (1,3 ммоль) п-анизальдегида и 53 мг (0,4 ммоль) метансульфоната 1,3 диметилимидазолия (Fluka) в диоксане в атмосфере аргона добавляют 53 мг (1,3 ммоль) 60% диспергсии гидрида натрия в масле с получением смеси желтого цвета. Полученную смесь кипятят с обратным холодильником в течение ночи, затем охлаждают, выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают 1 н. раствором NaOH, 5% раствором лимонной кислоты, затем насыщенным раствором соли и сушат (Na2SO4). Раствор фильтруют и упаривают, получая осадок желтого цвета,который перекристаллизовывают из смеси этанол/вода, получая 276 мг (0,5 ммоль, 45%) диметиламида 4-[4-(4-метоксибензоил)хиназолин-6-ил]-3-пиридин-2-илпиразол-1-сульфоновой кислоты в виде мелких кристаллов бледно-желтого цвета;- 28010161 После этого из диметиламида 4-[4-(4-метоксибензоил)хиназолин-6-ил]-3-пиридин-2-илпиразол-1 сульфоновой кислоты удаляют защиту в соответствии с методикой, описанной в примере 2, получая указанное в заголовке соединение. 1m/z: 408 [М+H]+. Соединения, представленные в приведенной далее таблице, получают в соответствии с методиками,описанными в способах и примерах выше. Данные ЯМР и масс-спектрометрии полученных соединений включены в таблицу ("н/д" означает, что для указанного соединения данные ЯМР не доступны).
МПК / Метки
МПК: A01N 43/40, A61K 31/47, A01N 43/58, A61K 31/501, A01N 43/60, A01N 43/42, A61K 31/4965, A61K 31/497, A61K 31/50, A61K 31/495, A61K 31/44
Метки: получения, способы, применения, пиразолы
Код ссылки
<a href="https://eas.patents.su/30-10161-pirazoly-i-sposoby-ih-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Пиразолы и способы их получения и применения</a>
Предыдущий патент: Новые гетероциклические соединения – ингибиторы hsp90 и способы их получения
Следующий патент: Амидные производные карбоновых кислот
Случайный патент: Способ и устройство для приготовления радиофармацевтических препаратов для инъекций












