Производные имидазола, способы их получения и применения
Формула / Реферат
1. Соединение формулы I, его таутомеры, геометрические изомеры (включая цис и транс, Z и Е изомеры), энантиомеры, диастереоизомеры и их смеси (включая все возможные смеси стереоизомеров), или их фармацевтически приемлемые соли
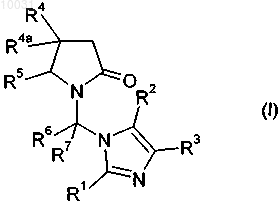
где
R1 означает водород, C1-С10алкил, С3-С8циклоалкил, галоген, гидрокси, C1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, гуанидин, производное по аминогруппе, C1-С10алкилтио, арилтио, С1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил, арилсульфинил, арил или гетероцикл,
R2 означает водород, C1-С10алкил, C1-С10алкокси, амино, галоген, гидрокси, сложноэфирную группу, амидо, нитро, карбамат, циано или арил,
R3 означает водород, C1-С10алкил, C1-С10алкокси, амино, галоген, гидрокси, сложноэфирную группу, амидо, нитро, карбамат, циано или арил,
или R2 и R3 вместе с имидазольным циклом образуют 1Н-бензимидазольный цикл
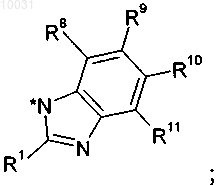
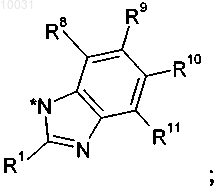
R4 означает водород, C1-С10алкил, C2-С12алкенил, C2-С12алкинил, арил, азидо, C1-С10алкоксикарбониламино, арилсульфонилокси или гетероцикл, R4a означает водород или C1-С10алкил,
или R4 и R4a вместе образуют С3-С8циклоалкил,
R5 означает водород,
или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2Н-индол-2-она
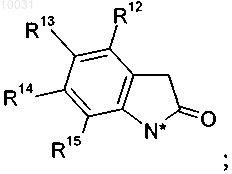
R6 означает водород или C1-С10алкил, замещенный гидрокси или азидо,
R7 означает водород,
или R6 и R7 вместе образуют C3-С6циклоалкил,
R8 означает водород, галоген, нитро, циано, C1-С10алкил или C1-С10алкокси,
R9 означает водород, C1-С10алкил, галоген, гидрокси, C1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, производное по аминогруппе, C1-С10алкилтио, арилтио, C1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил или арилсульфинил,
R10 означает водород, C1-С10алкил, галоген, гидрокси, C1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, производное по аминогруппе, C1-С10алкилтио, арилтио, C1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил или арилсульфинил,
R11 означает водород, галоген, нитро, циано, C1-С10алкил или C1-С10алкокси,
R12 означает водород или галоген,
R13 означает водород, нитро, галоген, гетероцикл, амино, арил, C1-С10алкил, незамещенный или замещенный галогеном, или C1-С10алкокси, незамещенный или замещенный галогеном,
R14 означает водород, C1-С10алкил или галоген,
R15 означает водород, C1-С10алкил или галоген,
при условии, если

то R4 не означает водород,
где "сложноэфирная группа" означает группу формулы -COORc, где Rc означает C1-С10алкил или арил;
"карбамат" означает группу формулы -N(H)C(O)ORj, где Rj означает C1-С10алкил или арил;
"гетероцикл" означает ароматическую или неароматическую одновалентную насыщенную циклическую углеводородную группу, содержащую 3-6 атомов углерода, содержащую в карбоциклическом цикле по меньшей мере один гетероатом, выбранный из О, S и/или N.
2. Соединение формулы I, его таутомеры, геометрические изомеры (включая цис и транс, Z и Е изомеры), энантиомеры, диастереоизомеры и их смеси (включая все возможные смеси стереоизомеров), или их фармацевтически приемлемые соли

где
R1 означает водород, C1-С10алкил, С3-С8циклоалкил, галоген, гидрокси, сложноэфирную группу, амидо, циано, нитро, амино, гуанидин, С1-С10алкилтио, C1-С10алкилсульфонил, C1-С10алкилсульфинил, арил или гетероцикл,
R2 означает водород, C1-С10алкил, галоген, циано, сложноэфирную группу, карбамат или амидо,
R3 означает водород, циано, C1-С10алкил, галоген или сложноэфирную группу,
или R2 и R3 вместе с имидазольным циклом образуют 1Н-бензимидазольный цикл
R4 означает водород, C1-С10алкил, C2-С12алкенил или арил,
R4a означает водород,
R5 означает водород,
или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2Н-индол-2-она
R6 означает водород или C1-С10алкил, замещенный гидрокси или азидо,
R7 означает водород,
или R6 и R7 вместе образуют С3-С6циклоалкил,
R8 означает водород,
R9 означает водород, C1-С10алкил, галоген или C1-С10алкокси,
R10 означает водород, C1-С10алкил, галоген или циано,
R11 означает водород,
R12 означает водород или галоген,
R13 означает водород, галоген, гетероцикл или C1-С10алкил, R14 означает водород, R15 означает водород, при условии, если

то R4 не означает водород,
где "сложноэфирная группа" означает группу формулы -COORc, где Rc означает C1-С10алкил или арил;
"карбамат" означает группу формулы -N(H)C(O)ORj, где Rj означает С1-С10алкил или арил;
"гетероцикл" означает ароматическую или неароматическую одновалентную насыщенную циклическую углеводородную группу, содержащую 3-6 атомов углерода, содержащую в карбоциклическом цикле по меньшей мере один гетероатом, выбранный из О, S и/или N.
3. Соединение по п.2, где R1 означает водород, метил, этил, изопропил, н-пропил, циклопропил, н-бутил, изобутил, трет-бутил, 1-этилпропил, 2,4,4-триметилпентил, гидроксиметил, хлорметил, трифторметил, 2,2,2-трифторэтил, цианометил, 2-(метилтио)этил, хлор, бром, нитро, циано, амино, аминокарбонил, метоксикарбонил, метилтио, метилсульфинил, метилсульфонил, фенил, 2-фурил, 3-фурил, 1Н-пиррол-2-ил, 1-метил-1Н-пиррол-2-ил, 2-тиенил, 1Н-пиразол-3-ил, 1,2,3-тиадиазол-4-ил или 1Н-имидазол-2-ил.
4. Соединение по п.2 или 3, где R2 означает водород, метил, гидроксиметил, (ацетиламино)метил, (пропиониламино)метил, (бензоиламино)метил, [(бензилокси)карбонил]амино, хлор или циано.
5. Соединение по пп.2-4, где R3 означает водород, гидроксиметил, хлор шыш циано.
6. Соединение по пп.2-5, где R4 означает водород, н-пропил, 2,2-дифторвинил, фенил, 3-хлорфенил, 3-фторфенил, 4-хлорфенил, 4-фторфенил, 3,5-дифторфенил, 3,4-дифторфенил, 3-хлор-4-фторфенил, 2,3,4-трифторфенил, 2,4,5-трифторфенил, 2,3,5-трифторфенил, 3,4,5-трифторфенил, 3-азидо-2,4-дифторфенил или 3-азидо-2,4,6-трифторфенил.
7. Соединение по пп.2-6, где R4a, R5 и R7 независимо означают водород.
8. Соединение по пп.2-7, где R6 означает водород или азидометил.
9. Соединение по пп.2-8, где R6 и R7 вместе образуют циклопропил.
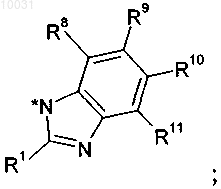
10. Соединение по пп.2-9, где R2 и R3 вместе с имидазольным циклом образуют 1Н-бензимидазольный цикл
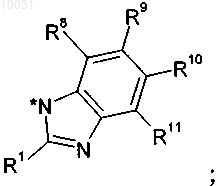
R8 означает водород.
R9 выбирают из группы, включающей водород, метил, хлор, метокси,
R10 выбирают из группы, включающей метил, водород, трифторметил, фтор, циано или метокси,
R11 означает водород.
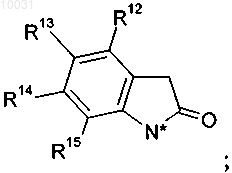
11. Соединение по пп.2-10, где R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2Н-индол-2-она
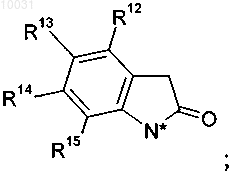
R12 выбирают из группы, включающей водород, хлор, фтор,
R13 выбирают из группы, включающей водород, хлор, бром, метил,
R14 означает водород,
R15 означает водород.
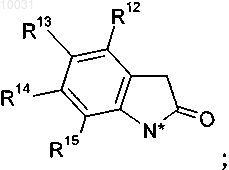
12. Соединение по п.2, где
R1 выбирают из группы, включающей водород, метил, этил, изопропил, н-пропил, н-бутил, метилтио, нитро, циано, амино, хлор или 1Н-пиррол-2-ил,
R2 выбирают из группы, включающей водород, хлор, циано,
R3 выбирают из группы, включающей водород, циано,
или R2 и R3 вместе с имидазольным циклом образуют 1Н-бензимидазольный цикл
R8 означает водород,
R9 означает водород,
R10 выбирают из группы, включающей водород, трифторметил, фтор, циано,
R11 означает водород,
R4 выбирают из группы, включающей водород, н-пропил, 2,2-дифторвинил, фенил, 3-хлорфенил, 3-фторфенил, 4-хлорфенил, 4-фторфенил, 3,5-дифторфенил, 3,4-дифторфенил, 3-хлор-4-фторфенил, 2,3,4-трифторфенил, 2,4,5-трифторфенил, 2,3,5-трифторфенил, 3,4,5-трифторфенил или 3-азидо-2,4-дифторфенил,
R4a означает водород,
R5 означает вoдopoд,
или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2Н-индол-2-она
где
R12 означает водород,
R13 выбирают из группы, включающей метил, хлор, бром,
R14 означает водород,
R15 означает водород, R6 означает водород,
R7 означает водород,
при условии, если группа

то R4 не означает водород.
13. Соединение по п.2, где
R1 выбирают из группы, включающей водород, метил, метилтио, нитро, циано, амино, хлор,
R2 выбирают из группы, включающей водород, хлор, циано,
R3 означает водород,
R4 выбирают из группы, включающей н-пропил, 2,2-дифторвинил, фенил, 3-хлорфенил, 3-фторфенил, 3,5-дифторфенил, 2,3,4-трифторфенил, 2,4,5-трифторфенил, 2,3,5-трифторфенил, 3,4,5-трифторфенил, 3-азидо-2,4-дифторфенил,
R4a означает водород,
R5 означает водород,
или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2Н-индол-2-она
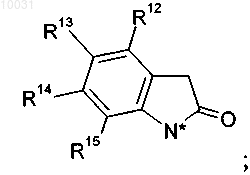
R12 означает водород,
R13 выбирают из группы, включающей хлор, бром или метил,
R14 означает водород,
R15 означает водород,
R6 означает водород,
R7 означает водород.
14. Соединение по п.2, выбранное из группы, включающей 1-(1Н-имидазол-1-илметил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-фенилпирролидин-2-он, 4-(3-азидо-2,4,6-трифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-пропилпирролидин-2-он, (-)-4-(3-азидо-2,4-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, (+)-4-(3-азидо-2,4-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 1-[(2-этил-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2-изопропил-1H-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2-метил-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2-фенил-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 4-пропил-1-[(2-пропил-1Н-имидазол-1-ил)метил]пирролидин-2-он, (+)-1-(1Н-имидазол-1-илметил)-4-пропилпирролидин-2-он, (-)-1-(1Н-имидазол-1-илметил)-4-пропилпирролидин-2-он, 4-(2,2-дифторвинил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(3-хлорфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 1-{[2-(метилтио)-1Н-имидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-{[2-(метилсульфинил)-1Н-имидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-[(2-трет-бутил-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[1-(1Н-имидазол-1-ил)циклопропил]пирролидин-2-он, 1-[(2-метил-1Н-имидазол-1-ил)метил]-4-фенилпирролидин-2-он, 1-{[2-(метилсульфонил)-1Н-имидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1Н-имидазол-2-карбоксамид, 4-(4-фторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-(3,4,5-трифторфенил)пирролидин-2-он, 4-(3-фторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(3,5-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(3,4-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(3-хлор-4-фторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(4-хлорфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-(2,3,4-трифторфенил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-(2,3,5-трифторфенил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-(2,4,5-трифторфенил)пирролидин-2-он, 1-{[2-(гидроксиметил)-1Н-имидазол-1-ил]метил}-4-пропилпирролидин-2-он, метиловый эфир 1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1Н-имидазол-2-карбоновой кислоты, 1-[(2-нитро-1Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-2-карбонитрил, 1-[(2-амино-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2,4-дихлор-1Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-[(5-хлор-1H-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-4-карбонитрил, 1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-карбонитрил, (+)-1-(1Н-имидазол-1-илметил)-4-фенилпирролидин-2-он, (-)-1-(1Н-имидазол-1-илметил)-4-фенилпирролидин-2-он, 1-{[2-оксо-4-(2,3,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-карбонитрил, (-)-1-{[2-оксо-4-(2,3,4-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-карбонитрил, (+)-1-{[2-оксо-4-(2,3,4-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-карбонитрил, (-)-1-{[2-оксо-4-(2,3,4-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-4-карбонитрил, (+)-1-{[2-оксо-4-(2,3,4-трифторфенил)-1-пирролидинил]метил}-1Н-имидазол-4-карбонитрил, (-)-1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-4-карбонитрил, (+)-1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-4-карбонитрил, (+)-1-{[2-оксо-4-(2,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-4-карбонитрил, (-)-1-{[2-оксо-4-(2,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-4-карбонитрил, (-)-1-{[2-оксо-4-(2,3,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-4-карбонитрил, (-)-1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-карбонитрил, 1-{[2-оксо-4-(2,3,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-карбонитрил, 1-{[2-оксо-4-(2,3,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-карбонитрил, 1-[(5-метил-2-фенил-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(5-метил-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(5-фенил-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2-этил-5-метил-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2,5-диметил-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2-хлор-1Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-[2-азидо-1-(1Н-имидазол-1-ил)этил]-4-пропилпирролидин-2-он, 1-[(4-хлор-1Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-[(2-бром-4,5-дихлор-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2-хлор-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, (+)-1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-карбонитрил, 1-{[5-(гидроксиметил)-1Н-имидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-{[4-(гидроксиметил)-1Н-имидазол-1-ил]метил}-4-пропилпирролидин-2-он, бензиловый эфир 1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1Н-имидазол-5-илкарбаминовой кислоты, N-[(1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-ил)метил]ацетамид, N-[(1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-ил)метил]бензамид, N-[(1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-ил)метил]пропанамид, 1-(1Н-бензимидазол-1-илметил)-4-пропилпирролидин-2-он, 1-[(2-метил-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 4-пропил-1-[(2-пропил-1Н-бензимидазол-1-ил)метил]пирролидин-2-он, 1-[(2-изопропил-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 4-пропил-1-{[2-(трифторметил)-1Н-бензимидазол-1-ил]метил}пирролидин-2-он, 1-{[2-(метилтио)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-[(2-амино-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-{[2-(хлорметил)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, {1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1Н-бензимидазол-2-ил}ацетонитрил, 1-[(5-метокси-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(5-метил-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(5,6-диметил-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-{[2-изопропил-5-(трифторметил)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-[(6-хлор-1Н-бензимидазол-1-ил}метил]-4-пропилпирролидин-2-он, 1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-2-пропил-1Н-бензимидазол-5-карбонитрил, 1-{[2-этил-5-(трифторметил)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 4-пропил-1-{[2-(1Н-пиррол-2-ил)-1Н-бензимидазол-1-ил]метил}пирролидин-2-он, 1-[(5-фтор-2-пропил-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-{[6-метил-2-(1Н-пиррол-2-ил)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-[(6-метокси-2-пропил-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 2-бутил-1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1Н-бензимидазол-5-карбонитрил, 1-{[2-[2-(метилтио)этил]-5-(трифторметил)-1Н-бензимидазол-1ил]метил}-4-пропилпирролидин-2-он, 1-[(5-фтор-2-изобутил-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-{[5-фтор-2-(2,4,4-триметилпентил)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 2-циклопропил-1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1Н-бензимидазол-5-карбонитрил, 1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-2-(1Н-пиразол-3-ил)-1Н-бензимидазол-5-карбонитрил, 1-[(2-циклопропил-5-фтор-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(5-фтор-2-изопропил-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-{[2-(3-фурил)-6-метокси-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-[(2-циклопропил-6-метокси-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2-изопропил-6-метокси-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-2-(1,2,3-тиадиазол-4-ил)-1Н-бензимидазол-5-карбонитрил, 1-{[2-(1Н-имидазол-2-ил)-5-(трифторметил)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-{[5-фтор-2-(2,2,2-трифторэтил)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-{[2-(1-этилпропил)-6-метокси-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-{[6-метокси-2-(1-метил-1H-пиррол-2-ил)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-{[2-(2-фурил)-5-(трифторметил)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 4-пропил-1-{[2-тиен-2-ил-5-(трифторметил)-1Н-бензимидазол-1-ил]метил}пирролидин-2-он, 1-{[2-(3-фурил)-5-(трифторметил)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-{[2-циклопропил-5-(трифторметил)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 4-пропил-1-{[2-(1Н-пиррол-2-ил)-5-(трифторметил)-1Н-бензимидазол-1-ил]метил}пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-1,3-дигидро-2Н-индол-2-он, 5-бром-1-(1Н-имидазол-1-илметил)-1,3-дигидро-2Н-индол-2-он, 5-хлор-1-(1Н-имидазол-1-илметил)-1,3-дигидро-2Н-индол-2-он, 4-фтор-1-(1Н-имидазол-1-илметил)-1,3-дигидро-2Н-индол-2-он, 4-хлор-1-(1Н-имидазол-1-илметил)-1,3-дигидро-2Н-индол-2-он, 1-(1Н-имидазол-1-илметил)-5-метил-1,3-дигидро-2Н-индол-2-он, 1-[(2-оксо-2,3-дигидро-1Н-индол-1-ил)метил]-1Н-имидазол-5-карбонитрил и 1-[(5-хлор-2-оксо-2,3-дигидро-1Н-индол-1-ил)метил]-1Н-имидазол-5-карбонитрил.
15. Соединение по п.2, выбранное из группы, включающей 1-(1Н-имидазол-1-илметил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-фенилпирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-пропилпирролидин-2-он, (-)-4-(3-азидо-2,4-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, (+)-4-(3-азидо-2,4-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 1-[(2-этил-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2-изопропил-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2-метил-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 4-пропил-1-[(2-пропил-1Н-имидазол-1-ил)метил]пирролидин-2-он, (+)-1-(1Н-имидазол-1-илметил)-4-пропилпирролидин-2-он, (-)-1-(1Н-имидазол-1-илметил)-4-пропилпирролидин-2-он, 4-(2,2-дифторвинил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(3-хлорфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 1-{[2-(метилтио)-1Н-имидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-[(2-метил-1Н-имидазол-1-ил)метил]-4-фенилпирролидин-2-он, 4-(4-фторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-(3,4,5-трифторфенил)пирролидин-2-он, 4-(3-фторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(3,5-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(3,4-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(3-хлор-4-фторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(4-хлорфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-(2,3,4-трифторфенил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-(2,3,5-трифторфенил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-(2,4,5-трифторфенил)пирролидин-2-он, 1-[(2-нитро-1Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-2-карбонитрил, 1-[(2-амино-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(5-хлор-1Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-4-карбонитрил, 1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-карбонитрил, (+)-1-(1Н-имидазол-1-илметил)-4-фенилпирролидин-2-он, (-)-1-(1Н-имидазол-1-илметил)-4-фенилпирролидин-2-он, (+)-1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-4-карбонитрил, 1-[(2-хлор-1Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-[2-азидо-1-(1Н-имидазол-1-ил)этил]-4-пропилпирролидин-2-он, 1-[(2-хлор-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, (+)-1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-карбонитрил, 1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-2-пропил-1Н-бензимидазол-5-карбонитрил, 1-{[2-этил-5-(трифторметил)-1Н-бензимидазол-1-ил]метил}-4-пропилпирролидин-2-он, 4-пропил-1-{[2-(1Н-пиррол-2-ил)-1Н-бензимидазол-1-ил]метил}пирролидин-2-он, 1-[(5-фтор-2-пропил-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 2-бутил-1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1Н-бензимидазол-5-карбонитршы, 1-[(5-фтор-2-изопропил-1Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-(1Н-имидазол-1-илметил)-1,3-дигидро-2Н-индол-2-он, 5-бром-1-(1Н-имидазол-1-илметил)-1,3-дигидро-2Н-индол-2-он, 5-хлор-1-(1Н-имидазол-1-илметил)-1,3-дигидро-2Н-индол-2-он, 1-(1Н-имидазол-1-илметил)-5-метил-1,3-дигидро-2Н-индол-2-он, 1-[(5-хлор-2-оксо-2,3-дигидро-1Н-индол-1-ил)метил]-1H-имидазол-5-карбонитрил.
16. Соединение по п.2, выбранное из группы, включающей 1-(1Н-имидазол-1-илметил)-4-фенилпирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-пропилпирролидин-2-он, (-)-4-(3-азидо-2,4-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, (+)-4-(3-азидо-2,4-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(2,2-дифторвинил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(3-хлорфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 1-{[2-(метилтио)-1Н-имидазол-1-ил]метил}-4-пропилпирролидин-2-он, 1-[(2-метил-1Н-имидазол-1-ил)метил]-4-фенилпирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-(3,4,5-трифторфенил)пирролидин-2-он, 4-(3-фторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он, 4-(3,5-дифторфенил)-1-(1H-имидазол-1-илметил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-(2,3,4-трифторфенил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-(2,3,5-трифторфенил)пирролидин-2-он, 1-(1Н-имидазол-1-илметил)-4-(2,4,5-трифторфенил)пирролидин-2-он, 1-[(2-нитро-1Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-2-карбонитрил, 1-[(2-амино-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(5-хлор-1Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, (+)-1-(1Н-имидазол-1-илметил)-4-фенилпирролидин-2-он, (-)-1-(1Н-имидазол-1-илметил)-4-фенилпирролидин-2-он, 1-[(2-хлор-1Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-[(2-хлор-1Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, (+)-1-{[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил}-1Н-имидазол-5-карбонитрил, 5-бром-1-(1Н-имидазол-1-илметил)-1,3-дигидро-2Н-индол-2-он, 5-хлор-1-(1Н-имидазол-1-илметил)-1,3-дигидро-2Н-индол-2-он, 1-(1Н-имидазол-1-илметил)-5-метил-1,3-дигидро-2Н-индол-2-он, 1-[(5-хлор-2-оксо-2,3-дигидро-1Н-индол-1-ил)метил]-1Н-имидазол-5-карбонитрил.
17. Соединение по п.2, выбранное из группы, включающей
(-)-4-(3-азидо-2,4-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он,
(+)-4-(3-азидо-2,4-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он,
4-(3-азидо-2,4-дифторфенил)-1-(1Н-имидазол-1-илметил)пирролидин-2-он.
18. Фармацевтическая композиция, содержащая эффективное количество соединения по любому из пп.2-17, в комбинации с фармацевтически приемлемым разбавителем или носителем.
19. Применение соединения по любому из пп.2-17 или фармацевтической композиции по п.18 для получения лекарственного средства, предназначенного для лечения или профилактики эпилепсии, эпилептогенеза, эпилептических припадков, судорог, болезни Паркинсона, дискинезии, индуцированной заместительной терапией допамином, поздней дискинезии, индуцированной приемом нейролептических средств, хореи Гентингтона и других неврологических нарушений, включающих биполярные нарушения, маниакальный синдром, депрессию, тревогу, гиперактивное расстройство в виде потери внимания (ADHD), мигрень, невралгию тройничного нерва и другие виды невралгии, хроническую боль, нейропатическую боль, церебральную ишемию, сердечную аритмию, миотонию, злоупотребление кокаином, инсульт, миоклонию, тремор, наследственный тремор, простой или комплексный тик, синдром Туре, синдром усталых ног и другие нарушения движения, неонатальное церебральное кровотечение, боковой амиотрофический склероз, спастичность и дегенеративные заболевания, бронхиальную астму, астматическое состояние и аллергический бронхит, астматический синдром, повышенную чувствительность бронхов и бронхоспастические синдромы, а также аллергические и вазомоторные риниты и риноконъюнктивиты.
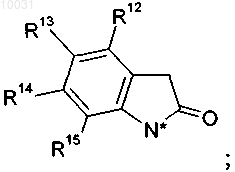
20. Соединение формулы VII

где R6 и R7 вместе образуют С3-С6циклоалкил,
R1 означает водород, C1-С10алкил, С3-С8циклоалкил, галоген, гидрокси, C1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, гуанидин, производное по аминогруппе, C1-С10алкилтио, арилтио, C1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил, арилсульфинил арил или гетероцикл,
R2 означает водород, C1-С10алкил, C1-С10алкокси, амино, галоген, гидрокси, сложноэфирную группу, амидо, нитро, карбамат, циано или арил,
R3 означает водород, C1-С10алкил, C1-С10алкокси, амино, галоген, гидрокси, сложноэфирную группу, амидо, нитро, карбамат, циано или арил,
или R2 и R3 вместе с имидазольным циклом образуют 1Н-бензимидазольный цикл
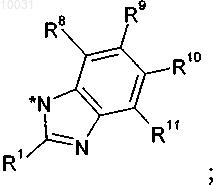
R4 означает водород, C1-С10алкил, С2-С12алкенил, С2-С12алкинил, арил, азидо, C1-С10алкоксикарбониламино, арилсульфонилокси или гетероцикл, R4a означает водород или C1-С10алкил, или R4 и R4a вместе образуют С3-С8циклоалкил,
R5 означает водород,
или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2Н-индол-2-она

R8 означает водород, галоген, нитро, циано, C1-С10алкил или C1-С10алкокси,
R9 означает водород, C1-С10алкил, галоген, гидрокси, C1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, производное по аминогруппе, C1-С10алкилтио, арилтио, C1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил или арилсульфинил,
R10 означает водород, C1-С10алкил, галоген, гидрокси, C1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, производное по аминогруппе, C1-С10алкилтио, арилтио, C1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил или арилсульфинил,
R11 означает водород, галоген, нитро, циано, C1-С10алкил или C1-С10алкокси,
R12 означает водород или галоген,
R13 означает водород, нитро, галоген, гетероцикл, амино, арил, C1-С10алкил, незамещенный или замещенный галогеном, или C1-С10алкокси, незамещенный или замещенный галогеном,
R14 означает водород, C1-С10алкил или галоген,
R15 означает водород, C1-С10алкил или галоген,
где "сложноэфирная группа" означает группу формулы -COORc, где Rc означает C1-С10алкил или арил;
"карбамат" означает группу формулы -N(H)C(O)ORj, где Rj означает С1-С10алкил или арил;
"гетероцикл" означает ароматическую или неароматическую одновалентную насыщенную циклическую углеводородную группу, содержащую 3-6 атомов углерода, содержащую в карбоциклическом цикле по меньшей мере один гетероатом, выбранный из О, S и/или N.
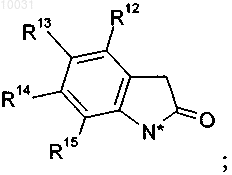
21. Соединение формулы X

где R18 означает C1-С4алкил,
R1 означает водород, C1-С10алкил, С3-С8циклоалкил, галоген, гидрокёш, С1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, гуанидин, производное по аминогруппе, C1-С10алкилтио, арилтио, С1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил, арилсульфинил, арил или гетероцикл,
R2 означает водород, C1-С10алкил, C1-С10алкокси, амино, галоген, гидрокси, сложноэфирную группу, амидо, нитро, карбамат, циано или арил,
R3 означает водород, C1-С10алкил, C1-С10алкокси, амино, галоген, гидрокси, сложноэфирную группу, амидо, нитро, карбамат, циано или арил,
или R2 и R3 вместе с имидазольным циклом образуют 1Н-бензимидазольный цикл

R4 означает водород, C1-С10алкил, С2-С12алкенил, С2-С12алкинил, арил, азидо, C1-С10алкоксикарбониламино, арилсульфонилокси или гетероцикл,
R4a означает водород или C1-С10алкил, или R4 и R4a вместе образуют С3-С8циклоалкил,
R5 означает водород,
или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2Н-индол-2-она
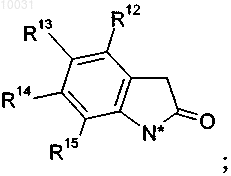
R8 означает водород, галоген, нитро, циано, C1-С10алкил или C1-С10алкокси,
R9 означает водород, C1-С10алкил, галоген, гидрокси, C1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, производное по аминогруппе, C1-С10алкилтио, арилтио, C1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил или арилсульфинил,
R10 означает водород, C1-С10алкил, галоген, гидрокси, C1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, производное по аминогруппе, C1-С10алкилтио, арилтио, C1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил или арилсульфинил,
R11 означает водород, галоген, нитро, циано, C1-С10алкил или C1-С10алкокси,
R12 означает водород или галоген,
R13 означает водород, нитро, галоген, гетероцикл, амино, арил, C1-С10алкил, незамещенный или замещенный галогеном, или C1-С10алкокси, незамещенный или замещенный галогеном,
R14 означает водород, C1-С10алкил или галоген,
R15 означает водород, C1-С10алкил или галоген,
где "сложноэфирная группа" означает группу формулы -COORc, где Rc означает C1-С10алкил или арил;
"карбамат" означает группу формулы -N(H)C(O)ORj, где Rj означает С1-С10алкил или арил;
"гетероцикл" означает ароматическую или неароматическую одновалентную насыщенную циклическую углеводородную группу, содержащую 3-6 атомов углерода, содержащую в карбоциклическом цикле по меньшей мере один гетероатом, выбранный из О, S и/или N.
22. Соединение формулы XI
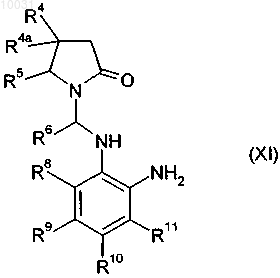
где
R4 означает водород, C1-С10алкил, С2-С12алкенил, С2-С12алкинил, арил, азидо, C1-С10алкоксикарбониламино, арилсульфонилокси или гетероцикл, R4a означает водород или C1-С10алкил, или R4 и R4a вместе образуют С3-С8циклоалкил,
R5 означает водород,
или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2Н-индол-2-она
R6 означает водород или C1-С10алкил, замещенный гидрокси или азидо,
R7 означает водород,
или R6 и R7 вместе образуют С3-С6циклоалкил,
R8 означает водород, галоген, нитро, циано, C1-С10алкил или C1-С10алкокси,
R9 означает водород, C1-С10алкил, галоген, гидрокси, C1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, производное по аминогруппе, C1-С10алкилтио, арилтио, C1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил или арилсульфинил,
R10 означает водород, C1-С10алкил, галоген, гидрокси, C1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, производное по аминогруппе, C1-С10алкилтио, арилтио, C1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил или арилсульфинил,
R11 означает водород, галоген, нитро, циано, C1-С10алкил или C1-С10алкокси,
R12 означает водород или галоген,
R13 означает водород, нитро, галоген, гетероцикл, амино, арил, C1-С10алкил, незамещенный или замещенный галогеном, или C1-С10алкокси, незамещенный или замещенный галогеном,
R14 означает водород, C1-С10алкил или галоген, R15 означает водород, C1-С10алкил или галоген,
где "сложноэфирная группа" означает группу формулы -COORc, где Rc означает C1-С10алкил или арил;
"гетероцикл" означает ароматическую или неароматическую одновалентную насыщенную циклическую углеводородную группу, содержащую 3-6 атомов углерода, содержащую в карбоциклическом цикле по меньшей мере один гетероатом, выбранный из О, S и/или N.
23. Соединение формулы XII
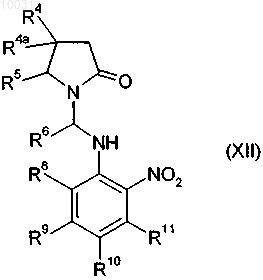
где
R4 означает водород, C1-С10алкил, C2-С12алкенил, C2-С12алкинил, арил, азидо, C1-С10алкоксикарбониламино, арилсульфонилокси или гетероцикл,
R4a означает водород или C1-С10алкил, или R4 и R4a вместе образуют C3-С8циклоалкил,
R5 означает водород,
или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2Н-индол-2-она
R6 означает водород или C1-С10алкил, замещенный гидрокси или азидо,
R8 означает водород, галоген, нитро, циано, C1-С10алкил или C1-С10алкокси,
R9 означает водород, C1-С10алкил, галоген, гидрокси, C1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, производное по аминогруппе, C1-С10алкилтио, арилтио, C1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил или арилсульфинил,
R10 означает водород, C1-С10алкил, галоген, гидрокси, C1-С10алкокси, арилокси, сложноэфирную группу, амидо, циано, нитро, амино, производное по аминогрупях, C1-С10алкилтио, арилтио, C1-С10алкилсульфонил, арилсульфонил, C1-С10алкилсульфинил или арилсульфинил,
R11 означает водород, галоген, нитро, циано, C1-С10алкил или C1-С10алкокси,
R12 означает водород или галоген,
R13 означает водород, нитро, галоген, гетероцикл, амино, арил, C1-С10алкил, незамещенный или замещенный галогеном, или C1-С10алкокси, незамещенный или замещенный галогеном,
R14 означает водород, C1-С10алкил или галоген,
R15 означает водород, C1-С10алкил или галоген,
где "сложноэфирная группа" означает группу формулы -COORc, где Rc означает C1-С10алкил или арил;
"гетероцикл" означает ароматическую или неароматическую одновалентную насыщенную циклическую углеводородную группу, содержащую 3-6 атомов углерода, содержащую в карбоциклическом цикле по меньшей мере один гетероатом, выбранный из О, S и/или N.
24. Соединение, выбранное из группы, включающей 4-(2-бром-2,2-дифторэтил)-1-гидроксиметилпирролидин-2-он, 1-(гидроксиметил)-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-(гидроксиметил)-4-пропилпирролидин-2-он, 4-(3-хлорфенил)-1-гидроксиметилпирролидин-2-он, 4-(3-фторфенил)-1-гидроксиметилпирролидин-2-он, 4-(4-хлорфенил)-1-гидроксиметилпирролидин-2-он, 4-(4-фторфенил)-1-гидроксиметилпирролидин-2-он, 4-(3,5-дифторфенил)-1-гидроксиметилпирролидин-2-он, 1-гидроксиметил-4-(2,3,5-трифторфенил)пирролидин-2-он, 1-гидроксиметил-4-(2,3,4-трифторфенил)пирролидин-2-он, 4-(3-хлор-4-фторфенил)-1-гидроксиметилпирролидин-2-он, 4-(3,4-дифторфенил)-1-гидроксиметилпирролидин-2-он, 1-гидроксиметил-4-(2,4,5-трифторфенил)пирролидин-2-он, 4-(3-азидо-2,4,6-трифторфенил)-1-гидроксиметилпирролидин-2-он, 4-(3-азидо-2,4-дифторфенил)-1-гидроксиметилпирролидин-2-он, 5-хлор-1-гидроксиметил-1,3-дигидроиндол-2-он, 1-(гидроксиметил)-1,3-дигидро-2Н-индол-2-он, 4-хлор-1-гидроксиметил-1,3-дигидроиндол-2-он, 4-фтор-1-гидроксиметил-1,3-дигидроиндол-2-он, 5-бром-1-гидроксиметил-1,3-дигидроиндол-2-он, 1-гидроксиметил-5-метил-1,3-дигидроиндол-2-он и 1-гидроксиметил-5-(2-метилтиазол-4-ил)-1,3-дигидроиндол-2-он, (2-оксо-4-пропилпирролидин-1-ил)метиловый эфир диэтилкарбаминовой кислоты, 4-бром-N-(1-имидазол-1-илциклопропил)бутирамид, этиловый эфир имидазол-1-ил(2-оксо-4-пропилпирролидин-1-ил)уксусной кислоты, (2-аминофенил){(2-оксо-4-пропилпирролидин-1-ил)метил}амин, (2-нитрофенил){(2-оксо-4-пропилпирролидин-1-ил)метил}амин, 1-(4-метоксибензил)-5-оксопирролидин-3-карбальдегид, 4-(2,2-дифторвинил)-1-(4-метоксибензил)пирролидин-2-он, 4-(2,2-дифторвинил)пирролидин-2-он, 4-(2-бром-2,2-дифторэтил)пирролидин-2-он, (4-бром-2,6-дифторфенил)пирролидин-1-илдиазен, 6-бром-2,4-дифтор-3-(пирролидин-1-илазо)бензальдегид, этиловый эфир 3-[6-бром-2,4-дифтор-3-(пирролидин-1-илазо)фенил]акриловой кислоты, этиловый эфир 3-[6-бром-2,4-дифтор-3-(пирролидин-1-илазо)фенил]-4-нитромасляной кислоты, 4-[2,4-дифтор-3-(пирролидин-1-илазо)фенил]пирролидин-2-он, 4-(3-азидо-2,4-дифторфенил)пирролидин-2-он, 4-бром-N-1-(гидроксициклопропил)бутирамид, этиловый эфир гидрокси(2-оксо-4-пропилпирролидин-1-ил)уксусной кислоты и 1-аминометил-4-пропилпирролидин-2-он.
Текст
010031 Настоящее изобретение относится к производным имидазола, к способам их получения, к содержащим их фармацевтическим композициям и к их применению в качестве лекарственных препаратов. В Европейском патенте 0162036 В 1 заявлено соединение(S)этил-2-оксо-1 пирролидинацетамид, которое известно под международным непатентуемым названием как леветирацетам. Леветирацетам, левовращающий изомер, заявлен в качестве защитного агента для лечения и профилактики поражений центральной нервной системы типа гипоксии и ишемии. Указанное соединение также эффективно при лечении эпилепсии, при терапевтических показаниях на которую было установлено, что его правовращающий изомер, (R)этил-2-оксо-1-пирролидинацетамид, также описанный в Европейском патенте 0165919 В 1, не проявляет биологической активности (Cover A.J. и др., Eur. J.Pharmacol., 222, 193-203 (1992. В статье Белавина И.Ю. и др. (Химико-фармацевтический журнал, 26(9-10), 74-76 (1992 описан 1[1-(1 Н-бензимидазол-1-ил)этил]-2-пирролидинон и его противосудорожная активность. Неожиданно было установлено, что некоторые производные имидазола проявляют более высокое терапевтическое действие. Таким образом, первым объектом изобретения является соединение формулы I и его фармацевтически приемлемая сольR1 означает водород, С 1-С 20 алкил, С 3-С 8 циклоалкил, галоген, гидрокси, алкокси, арилокси, сложноэфирную группу, амидогруппу, циано, нитро, аминогруппу, гуанидин, замещенную аминогруппу, алкилтио, арилтио, алкилсульфонил, арилсульфонил, алкилсульфинил, арилсульфинил, арил или гетероцикл,R2 означает водород, С 1-С 20 алкил, алкокси, аминогруппу, галоген, гидрокси, сложноэфирную группу, амидогруппу, нитро, циано, карбамат или арил,R3 означает водород, С 1-С 20 алкил, алкокси, аминогруппу, галоген, гидрокси, сложноэфирную группу, амидогруппу, нитро, циано, карбамат или арил,или R2 и R3 вместе с имидазольным циклом образуют 1 Н-бензимидазольный циклR4 означает водород, С 1-С 20 алкил, С 2-С 12 алкенил, С 2-С 12 алкинил, арил, азидо,алкоксикарбониламино, арилсульфонилокси или гетероцикл, R4a означает водород или С 1-С 20 алкил,или R4 и R4a вместе образуют С 3-С 8 циклоалкил, R5 означает водород,или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2 Н-индол-2 онаR6 означает водород или С 1-С 20 алкил,R7 означает водород,или R6 и R7 вместе образуют С 3-С 6 циклоалкил,R8 означает водород, галоген, нитро, циано, С 1-С 20 алкил или алкокси,R9 означает водород, С 1-С 20 алкил, галоген, гидрокси, алкокси, арилокси, сложноэфирную группу,амидогруппу, циано, нитро, аминогруппу, замещенную аминогруппу, алкилтио, арилтио, алкилсульфонил, арилсульфонил, алкилсульфинил или арилсульфинил,R10 означает водород, С 1-С 20 алкил, галоген, гидрокси, алкокси, арилокси, сложноэфирную группу,амидогруппу, циано, нитро, аминогруппу, замещенную аминогруппу, алкилтио, арилтио, алкилсульфонил, арилсульфонил, алкилсульфинил или арилсульфинил,R11 означает водород, галоген, нитро, циано, С 1-С 20 алкил или алкокси,R12 означает водород или галоген,-1 010031R13 означает водород, нитро, галоген, гетероцикл, аминогруппу, арил, С 1 С 20 алкил, незамещенный или замещенный галогеном, или алкокси,незамещенный или замещенный галогеном, R14 означает водород, С 1-С 20 алкил или галоген, R15 означает водород, С 1-С 20 алкил или галоген, при условии, что R4 не означает водород, если группа Знакуказывает место присоединения заместителей. Предпочтительным вариантом изобретения является соединение формулы I, его таутомеры, геометрические изомеры (включая цис- и транс-, Z и Е изомеры), энантиомеры, диастереизомеры и их смеси(включая все возможные смеси стереоизомеров), или его фармацевтически приемлемые солиR1 означает водород, С 1-С 20 алкил, С 3-С 8 циклоалкил, галоген, гидрокси,сложноэфирную группу, амидогруппу, циано, нитро, аминогруппу, гуанидин, алкилтио, алкилсульфонил, алкилсульфинил, арил или гетероцикл,R2 означает водород, С 1-С 20 алкил, галоген, циано, сложноэфирную группу, карбамат или амидогруппу,R3 означает водород, циано, С 1-С 20 алкил, галоген или сложноэфирную группу,или R2 и R3 вместе с имидазольным циклом образуют указанный 1H-бензимидазольный циклR4 означает водород, С 1-С 20 алкил, С 2-С 12 алкенил или арил,R4a означает водород,R5 означает водород,или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2 Н-индол-2-онаR6 означает водород или С 1-С 20 алкил,R7 означает водород,или R6 и R7 вместе образуют С 3-С 6 циклоалкил,R8 означает водород,R9 означает водород, С 1-С 20 алкил, галоген или алкокси,R10 означает водород, С 1-С 20 алкил, галоген или циано,R11 означает водород,R12 означает водород или галоген,R13 означает водород, галоген, гетероцикл или С 1-С 20 алкил,R14 означает водород,R15 означает водород,при условии, что R4 не означает водород, если группа-2 010031 Термин алкил, используемый в описании заявки, означает насыщенные одновалентные углеводородные радикалы с прямой (неразветвленной) или разветвленной цепью или циклические радикалы или их комбинации, содержащие 1-20 атомов углерода, предпочтительно 1-10 атомов углерода, более предпочтительно 1-4 атома углерода, наиболее предпочтительно 1-3 атома углерода. Алкильные группы необязательно замещены 1-5-заместителями, независимо выбранными из группы, включающей галоген,гидрокси, циано, азидо, арилокси, алкокси, аклилтио, алканоиламино, арилкарбониламино, аминокарбонил, метиламинокарбонил, диметиламинокарбонил или арил. Типичными алкильными группами являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, 1-этилпропил, н-гептил, 2,4,4 триметилпентил, н-децил, хлорметил, трифторметил, 2-бром-2,2-дифторэтил, 2,2,2-трифторэтил, 3,3,3 трифторэтил, гидроксиметил, цианометил, азидометил, (ацетиламино)метил, (пропиониламино)метил,(бензоиламино)метил, (4-хлорфенокси)метил, бензил, 2-фенилэтил или 2-(метилтио)этил. Предпочтительными алкильными группами являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, третбутил, 1-этилпропил, 2,4,4-триметилпентил, хлорметил, трифторметил, 2,2,2-трифторэтил, гидроксиметил, цианометил, азидометил, (ацетиламино)метил, (пропиониламино)метил, (бензоиламино)метил или 2-(метилтио)этил. Более предпочтительными алкильными группами являются метил, этил, н-пропил,изопропил, н-бутил, азидометил или трифторметил. Наиболее предпочтительными алкильными группами являются метил или н-пропил. Термин "циклоалкил", используемый в описании заявки, означает одновалентную насыщенную циклическую углеводородную группу, содержащую обычно 3-6-атомов углерода и замещенную одним или более заместителями, включающими, без ограничения перечисленным, группы, указанные выше для алкильных групп. Предпочтительными циклоалкильными группами являются циклопропил и циклогексил. Термин алкенил, используемый в описании заявки, означает ненасыщенные углеводородные радикалы с прямой или разветвленной цепью или циклические радикалы или их комбинации, содержащие по меньшей мере одну углерод-углеродную двойную связь и 2-12 атомов углерода, предпочтительно обычно 2-4 атома углерода. Алкенильные группы необязательно замещены одним или более заместителями, включающими, без ограничения перечисленным, группы, указанные выше для алкильных групп. Типичной алкенильной группой является этенил (винил), необязательно замещенный 1-3 галогенами. Предпочтительной алкенильной группой является 2,2-дифторвинил. Термин алкинил, используемый в описании заявки, означает углеводородные радикалы с прямой или разветвленной цепью или циклические радикалы или их комбинации, содержащие по меньшей мере одну углерод-углеродную тройную связь и 2-12 атомов углерода, предпочтительно 2-6 атома углерода. Алкенильные группы необязательно замещены одним или более заместителями, включающими, без ограничения перечисленным, группы, указанные выше для алкильных групп. Предпочтительной алкинильной группой является галогеналкинильная группа. Термин арил, используемый в описании заявки, означает фенил, необязательно замещенный 1-4 заместителями, независимо выбранными из группы, включающей галоген, циано, алкокси, алкилтио, С 1 С 3 алкил или азидо, предпочтительно галоген или азидо. Типичными арильными группами в описании заявки являются фенил, 3-хлорфенил, 3-фторфенил, 4-хлорфенил, 4-фторфенил, 3,4-дифторфенил, 3,5 дифторфенил, 3-хлор-4-фторфенил, 2,3,4-трифторфенил, 2,4,5-трифторфенил, 2,3,5-трифторфенил, 3,4,5 трифторфенил, 3-азидо-2,4-дифторфенил или 3-азидо-2,4,6-трифторфенил. Предпочительно арильные группы означают фенил, 3-хлорфенил, 3-фторфенил, 4-хлорфенил, 4-фторфенил, 3,4-дифторфенил, 3,5 дифторфенил, 3-хлор-4-фторфенил, 2,3,4-трифторфенил, 2,4,5-трифторфенил, 2,3,5-трифторфенил, 3,4,5 трифторфенил или 3-азидо-2,4-дифторфенил. Наиболее предпочтительными арильными группами являются фенил, 3-хлорфенил, 3-фторфенил, 3,5-дифторфенил, 2,3,4-трифторфенил, 2,4,5-трифторфенил,2,3,5-трифторфенил, 3,4,5-трифторфенил или 3-азидо-2,4-дифторфенил. Термин гетероцикл, используемый в описании заявки, означает ароматическую или неароматическую циклоалкильную группу, указанную выше, содержащую в карбоциклическом цикле по меньшей мере один гетероатом, выбранный из О, S и/или N. Гетероциклическая группа необязательно замещена алкильными группами или галогенами, а в карбоциклическом цикле один из атомов углерода необязательно заменен на карбонил. Типичными гетероциклами являются 2-пиридил, 3-пиридил, 4-пиридил, 2 фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-тетрагидрофуранил, 1 Н-пиррол-2-ил, 1-метил-1 Н-пиррол-2-ил,1 Н-пиразол-2-ил, 1 Н-пиразол-3-ил, 4-хлор-1-метил-1 Н-пиразол-3-ил, 5-хлор-1,3-диметил-1 Н-пиразол-4 ил, 1,2,3-тиадиазол-4-ил, 3,5-диметил-4-изотиазол, 1 Н-имидазол-2-ил, 1-метил-1 Н-имидазол-2-ил, 4 метил-1 Н-имидазол-5-ил или 2-метил-1,3-тиазол-4-ил. Предпочтительными гетероциклами являются 1 Нимидазол-2-ил, 1,2,3-тиадиазол-4-ил, 1 Н-пиразол-3-ил, 2-фурил, 3-фурил, 2-тиенил, 1-метил-1H-пиррол 2-ил, 1 Н-пиррол-2-ил. Термин "галоген", используемый в описании заявки, означает атом хлора, брома, фтора, иода. Типичными галогенами являются хлор, бром и фтор. Предпочтительными галогенами являются фтор, бром и хлор. Термин "гидрокси", используемый в описании заявки, означает группу формулы -ОН. Термин "алкокси", используемый в описании заявки, означает группу формулы -ORa, где Ra означа-3 010031 ет алкильную группу, указанную выше. Предпочтительной алкоксигруппой является метокси. Термин "арилокси", используемый в описании заявки, означает группу формулы -ORb, где Rb означает арильную группу, указанную выше. Предпочтительной арилоксигруппой является фенокси. Термин "сложноэфирная группа", используемый в описании заявки, означает группу формулы COORc, где Rc означает алкильную группу или арильную группу, указанную выше. Предпочтительной сложноэфирной группой является метоксикарбонил. Термин "амидогруппа", используемый в описании заявки, означает группу формулы -CONH2. Термин "аминогруппа", используемый в описании заявки, означает группу формулы -NH2. Термин "замещенная аминогруппа", используемый в описании заявки, означает алкиламиногруппу или ариламиногруппу, где термины алкил и арил имеют значения, указанные выше. Термин "циано", используемый в описании заявки, означает группу формулы -CN. Термин "нитро", используемый в описании заявки, означает группу формулы -NO2. Термин "азидо", используемый в описании заявки, означает группу формулы -N3. Термин "гуанидин", используемый в описании заявки, означает группу формулы -NHC(=NH)NH2. Термин "алкилтио", используемый в описании заявки, означает группу формулы -SRd, где Rd означает алкильную группу, указанную выше. Предпочтительной алкилтиогруппой является метилтио. Термин "алкилсульфонил", используемый в описании заявки, означает группу формулы -S(=O)2Re,где Re означает алкильную группу, указанную выше. Предпочтительной алкилсульфонильной группой является метилсульфонил. Термин "алкилсульфинил", используемый в описании заявки, означает группу формулы -S(=O)Rf,где Rf означает алкильную группу, указанную выше. Предпочтительной алкилсульфинильной группой является метилсульфинил. Термин "арилтио", используемый в описании заявки, означает группу формулы -SRg, где Rg означает арильную группу, указанную выше. Термин "арилсульфонил", используемый в описании заявки, означает группу формулы -S(=O)2Rh,где Rh означает арильную группу, указанную выше. Термин "арилсульфинил", используемый в описании заявки, означает группу формулы -S(=O)Ri,где Ri означает арильную группу, указанную выше. Термин "карбамат", используемый в описании заявки, означает группу формулы -N(H)C(O)ORj, гдеR означает алкил или арил, указанные выше. Типичными карбаматными группами являются (пропоксикарбонил)амино или (бензилоксикарбонил)амино. Предпочтительной (арилкарбонил)аминогруппой является бензоиламиногруппа. Термин "алканоиламино", используемый в описании заявки, означает группу формулы -NHC(=O)Rk, где-NHC(=O)Rm, где Rm означает арильную группу, указанную выше. Предпочтительной (арилкарбонил)аминогруппой является бензоиламиногруппа. Обычно R1 означает водород, С 1-С 10 алкил, незамещенный или замещенный галогеном, гидрокси,циано, метилтио, фенил или 4-хлорфенокси, гидрокси, С 3-С 6 циклоалкил, галоген, сложноэфирную группу, амидогруппу, нитро, циано, аминогруппу, фенил, алкилтио, алкилсульфонил, алкилсульфинил, гетероцикл, незамещенный или замещенный алкильными группами, или гуанидин. Предпочтительно R1 означает водород, метил, этил, изопропил, н-пропил, циклопропил, н-бутил, изобутил, трет-бутил, 1 этилпропил, 2,4,4-триметилпентил, гидроксиметил, хлорметил, трифторметил, 2,2,2-трифторэтил, цианометил, 2-(метилтио)этил, хлор, бром, нитро, циано, амино, аминокарбонил, метоксикарбонил, метилтио, метилсульфинил, метилсульфонил, фенил, 2-фурил, 3-фурил, 1 Н-пиррол-2-ил, 1-метил-1 Н-пиррол 2-ил, 2-тиенил, 1 Н-пиразол-3-ил, 1,2,3-тиадиазол-4-ил или 1 Н-имидазол-2-ил. Более предпочтительно R1 означает водород, метил, этил, изопропил, н-пропил, н-бутил, метилтио, нитро, циано, амино, хлор или 1 Н-пиррол-2-ил. Наиболее предпочтительно R1 означает водород, метил, метилтио, нитро, циано, амино или хлор. Обычно R2 означает водород, С 1-С 4 алкил, незамещенный или замещенный гидрокси, алканоиламино или бензоиламино, галоген, сложноэфирную группу, циано, алкилкарбамат, [(N-метокси-Nметил)амино]карбонил. Предпочтительно R2 означает водород, метил, гидроксиметил, (ацетиламино)метил, (пропиониламино)метил, (бензоиламино)метил, [(бензилокси)карбонил]амино, хлор или циано. Более предпочтительно R2 означает водород, хлор или циано. Обычно R3 означает водород, С 1-С 4 алкил, незамещенный или замещенный гидрокси, галоген,сложноэфирную группу или циано. Предпочтительно R3 означает водород, гидроксиметил, хлор, циано. Более предпочтительно R3 означает водород или циано. Наиболее предпочтительно R3 означает водород. Обычно R4 означает водород, С 1-С 4 алкил, незамещенный или замещенный галогенами, С 2 С 4 алкенил, замещенный галогенами, или фенильную группу, незамещенную или замещенную азидо и/или галогенами. Предпочтительно R4 означает водород, н-пропил, 2,2-дифторвинил, фенил, 3 хлорфенил, 3-фторфенил, 4-хлорфенил, 4-фторфенил, 3,5-дифторфенил, 3,4-дифторфенил, 3-хлор-4 фторфенил, 2,3,4-трифторфенил, 2,4,5-трифторфенил, 2,3,5-трифторфенил, 3,4,5-трифторфенил, 3-азидо-4 010031 2,4-дифторфенил или 3-азидо-2,4,6-трифторфенил. Более предпочительно R4 означает водород, н-пропил,2,2-дифторвинил, фенил, 3-хлорфенил, 3-фторфенил, 4-хлорфенил, 4-фторфенил, 3,5-дифторфенил, 3,4 дифторфенил, 3-хлор-4-фторфенил, 2,3,4-трифторфенил, 2,4,5-трифторфенил, 2,3,5-трифторфенил, 3,4,5 трифторфенил или 3-азидо-2,4-дифторфенил. Наиболее предпочтительно R4 означает н-пропил, 2,2 дифторвинил, фенил, 3-хлорфенил, 3-фторфенил, 3,5-дифторфенил, 2,3,4-трифторфенил, 2,4,5 трифторфенил, 2,3,5-трифторфенил, 3,4,5-трифторфенил или 3-азидо-2,4-дифторфенил. Обычно R4a означает водород. Обычно R5 означает водород. Обычно R6 означает водород или С 1-С 10 алкил, незамещенный или замещенный гидрокси или азидо. Предпочтительно R6 означает водород или азидометил. Более предпочтительно R6 означает водород. Обычно R7 означает водород. В других предпочтительных вариантах R6 и R7 вместе образуют циклоалкил. В других предпочтительных вариантах R2 и R3 вместе с имидазольным циклом образуют 1 Нбензимидазольный цикл. Обычно R8 означает водород. Обычно R9 означает водород, галоген, С 1-С 3 алкил или алкокси. Предпочтительно R9 означает водород, метил, хлор или метокси. Более предпочтительно R9 означает водород. Обычно R10 означает водород, галоген, циано, С 1-С 3 алкил, незамещенный или замещенный галогенами, или алкокси. Предпочтительно R10 означает метил, водород, трифторметил, фтор, циано или метокси. Более предпочтительно R10 означает водород, трифторметил, фтор или циано. Обычно R11 означает водород. В других предпочтительных вариантах R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2 Н-индол-2-она. Обычно R12 означает водород или галоген. Предпочтительно R12 означает водород, хлор или фтор. Более предпочтительно R12 означает водород. Обычно R13 означает водород, С 1-С 3 алкил, галоген или тиазолил, незамещенный или замещенный алкильными группами, такой, как метилтиазолил. Предпочтительно R13 означает водород, хлор, бром или метил. Наиболее предпочтительно R13 означает хлор, бром или метил. Обычно R14 означает водород. Обычно R15 означает водород. Предпочтительны прежде всего соединения, содержащие комбинации одной или более указанных предпочтительных групп. Наиболее общим вариантом изобретения являются соединения формулы I или их фармацевтически приемлемые соли, в которыхR1 выбирают из группы, включающей водород, С 1-С 10 алкил, незамещенный или замещенный группами галоген, гидрокси, циано, метилтио, фенил или 4-хлорфенокси; С 3-С 6 циклоалкил, галоген, сложноэфирную группу, амидогруппу, нитро, циано, аминогруппу, фенил, алкилтио, алкилсульфонил, алкилсульфинил, гетероцикл, незамещенный или замещенный алкильной группой; или гуанидин,R2 выбирают из группы, включающей водород, С 1-С 4 алкил, незамещенный или замещенный группами гидрокси, алканоиламино или бензоиламино; галоген, сложноэфирную группу, циано, алкилкарбамат или [(N-метокси-N-метил)амино]карбонил,R3 выбирают из группы, включающей водород, С 1-С 4 алкил, незамещенный или замещенный гидроксигруппой; галоген, сложноэфирную группу или циано,R4 выбирают из группы, включающей водород, С 1-С 4 алкил, незамещенный или замещенный галогенами, С 2-С 4 алкенил, замещенный галогенами, или фенильную группу, незамещенную или замещенную азидо и/или галогенами,R4a означает водород,R5 означает водород,R6 выбирают из группы, включающей водород или С 1-С 10 алкил, незамещенный или замещенный гидроксигруппой или азидогруппой,R7 означает водород,-5 010031 или R6 и R7 вместе образуют циклопропил,или R2 и R3 вместе с имидазольным циклом образуют указанный 1 Н-бензимидазольный циклR8 означает водород,R9 выбирают из группы, включающей водород, галоген, С 1-С 3 алкил, алкокси,R10 выбирают из группы, включающей водород, галоген, циано или С 1-С 3 алкил,незамещенный или замещенный галогенами, или алкокси, R11 означает водород,или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2 Н-индол-2 онаR12 выбирают из группы, включающей водород или галоген,R13 выбирают из группы, включающей водород, С 1-С 3 алкил, галоген, тиазолил,незамещенный или замещенный алкильными группами, такой как метилтиазолил, R14 означает водород, R15 означает водород, при условии, что R4 не означает водород, если группа Предпочтительным вариантом изобретения являются соединения формулы I или их фармацевтически приемлемые соли, в которых R1 выбирают из группы, включающей водород, метил, этил, изопропил,н-пропил, циклопропил, н-бутил, изобутил, трет-бутил, 1-этилпропил, 2,4,4-триметилпентил, трифторметил, 2,2,2-трифторэтил, гидроксиметил, хлорметил, цианометил, 2-(метилтио)этил, хлор, бром, нитро,циано, амино, аминокарбонил, метоксикарбонил, метилтио, метилсульфинил, метилсульфонил, фенил, 2 фурил, 3-фурил, 1 Н-пиррол-2-ил, 1-метил-1 Н-пиррол-2-ил, 2-тиенил, 1 Н-пиразол-3-ил, 1,2,3-тиадиазол-4 ил или 1H-имидазол-2-ил,R2 выбирают из группы, включающей водород, метил, гидроксиметил, (ацетиламино)метил, (пропиониламино)метил, (бензоиламино)метил, (бензилоксикарбонил)амино, хлор или циано,R3 выбирают из группы, включающей водород, гидроксиметил, хлор, циано,или R2 и R3 вместе с имидазольным циклом образуют указанный 1 Н-бензимидазольный циклR8 означает водород,R9 выбирают из группы, включающей водород, метил, хлор, метокси, R10 выбирают из группы,включающей метил, водород, трифторметил, фтор, циано или метокси,R11 означает водород,R4 выбирают из группы, включающей водород, н-пропил, 2,2-дифторвинил, фенил, 3-хлорфенил, 3 фторфенил, 4-хлорфенил, 4-фторфенил, 3,5-дифторфенил, 3,4-дифторфенил, 3-хлор-4-фторфенил, 2,3,4 трифторфенил, 2,4,5-трифторфенил, 2,3,5-трифторфенил, 3,4,5-трифторфенил, 3-азидо-2,4-дифторфенил или 3-азидо-2,4,6-трифторфенил,R4a означает водород,R5 означает водород,или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют указанный цикл 1,3-дигидро 2 Н-индол-2-она Более предпочтительным вариантом изобретения являются соединения формулы I или их фармацевтически приемлемые соли, в которых R1 выбирают из группы, включающей водород, метил, этил,изопропил, н-пропил, н-бутил, метилтио, нитро, циано, амино, хлор или 1 Н-пиррол-2-ил, R2 выбирают из группы, включающей водород, хлор, циано, R3 выбирают из группы, включающей водород, циано,или R2 и R3 вместе с имидазольным циклом образуют указанный 1 Н-бензимидазольный циклR8 означает водород,R9 означает водород,R10 выбирают из группы, включающей водород, трифторметил, фтор, циано,R11 означает водород,R4 выбирают из группы, включающей водород, н-пропил, 2,2-дифторвинил, фенил, 3-хлорфенил, 3 фторфенил, 4-хлорфенил, 4-фторфенил, 3,5-дифторфенил, 3,4-дифторфенил, 3-хлор-4-фторфенил, 2,3,4 трифторфенил, 2,4,5-трифторфенил, 2,3,5-трифторфенил, 3,4,5-трифторфенил или 3-азидо-2,4 дифторфенил,R4a означает водород,R5 означает водород,или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют указанный цикл 1,3-дигидро 2 Н-индол-2-она Наиболее предпочтительным вариантом изобретения являются соединения формулы I или их фармацевтически приемлемые соли, в которых R1 выбирают из группы, включающей водород, метил, метилтио, нитро, циано, амино, хлор,R2 выбирают из группы, включающей водород, хлор, циано,R3 означает водород,R4 выбирают из группы, включающей н-пропил, 2,2-дифторвинил, фенил, 3-хлорфенил, 3 фторфенил, 3,5-дифторфенил, 2,3,4-трифторфенил, 2,4,5-трифторфенил, 2,3,5-трифторфенил, 3,4,5 трифторфенил, 3-азидо-2,4-дифторфенил,R4a означает водород,R5 означает водород,или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют указанный цикл 1,3-дигидро 2 Н-индол-2-онаR12 означает водород,R13 выбирают из группы, включающей хлор, бром, метил,R14 означает водород,R15 означает водород, R6 означает водород, R7 означает водород. Предпочтительными соединениями являются: 1-(1 Н-имидазол-1-илметил)пирролидин-2-он, 1-(1 Нимидазол-1-илметил)-4-фенилпирролидин-2-он,4-(3-азидо-2,4,6-трифторфенил)-1-(1 Н-имидазол-1 илметил)пирролидин-2-он, 1-(1 Н-имидазол-1-илметил)-4-пропилпирролидин-2-он, (-)-4-(3-азидо-2,4 дифторфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он,(+)-4-(3-азидо-2,4-дифторфенил)-1-(1 Нимидазол-1-илметил)пирролидин-2-он, 1-[(2-этил-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он,1-[(2-изопропил-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он,1-[(2-метил-1 Н-имидазол-1 ил)метил]-4-пропилпирролидин-2-он, 1-[(2-фенил-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он,4-пропил-1-[(2-пропил-1 Н-имидазол-1-ил)метил]пирролидин-2-он,(+)-1-(1H-имидазол-1-илметил)-4 пропилпирролидин-2-он,(-)-1-(1 Н-имидазол-1-илметил)-4-пропилпирролидин-2-он,4-(2,2-дифторвинил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он, 4-(3-хлорфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он,1-[2-(метилтио)-1 Н-имидазол-1-ил]метил-4-пропилпирролидин-2-он,1-[2-(метилсульфинил)-1 Н-имидазол-1-ил]метил-4-пропилпирролидин-2-он,1-[(2-трет-бутил-1 Н-имидазол-1 ил)метил]-4-пропилпирролидин-2-он, 1-[1-(1 Н-имидазол-1-ил)циклопропил]пирролидин-2-он, 1-[(2 метил-1 Н-имидазол-1-ил)метил]-4-фенилпирролидин-2-он,1-[2-(метилсульфонил)-1 Н-имидазол-1 ил]метил-4-пропилпирролидин-2-он,1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1 Н-имидазол-2 карбоксамид, 4-(4-фторфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он, 1-(1 Н-имидазол-1-илметил)4-(3,4,5-трифторфенил)пирролидин-2-он, 4-(3-фторфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он,4-(3,5-дифторфенил)-1-(1H-имидазол-1-илметил)пирролидин-2-он, 4-(3,4-дифторфенил)-1-(1 Н-имидазол 1-илметил)пирролидин-2-он, 4-(3-хлор-4-фторфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он, 4-(4 хлорфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он, 1-(1 Н-имидазол-1-илметил)-4-(2,3,4-трифторфенил)пирролидин-2-он, 1-(1 Н-имидазол-1-илметил)-4-(2,3,5-трифторфенил)пирролидин-2-он, 1-(1 Нимидазол-1-илметил)-4-(2,4,5-трифторфенил)пирролидин-2-он, 1-[2-(гидроксиметил-1 Н-имидазол-1 ил]метил-4-пропилпирролидин-2-он, метиловый эфир 1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1 Нимидазол-2-карбоновой кислоты,1-[(2-нитро-1 Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он,1-[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-2 карбонитрил,1-[(2-амино-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он,1-[(2,4-дихлор-1 Нимидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-[(5-хлор-1 Н-имидазол-1-ил)метил]-4(3,4,5-трифторфенил)пирролидин-2-он, 1-[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Нимидазол-4-карбонитрил,1-[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-5 карбонитрил, (+)-1-(1 Н-имидазол-1-илметил)-4-фенилпирролидин-2-он, (-)-1-(1 Н-имидазол-1-илметил)4-фенилпирролидин-2-он,1-[2-оксо-4-(2,3,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-5 карбонитрил,(-)-1-[2-оксо-4-(2,3,4-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-5-карбонитрил, (+)-1-[2-оксо-4-(2,3,4-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-5-карбонитрил, (-)1-[2-оксо-4-(2,3,4-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-4-карбонитрил, (+)-1-[2-оксо-8 010031 4-(2,3,4-трифторфенил)-1-пирролидинил]метил-1 Н-имидазол-4-карбонитрил,(-)-1-[2-оксо-4-(3,4,5 трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-4-карбонитрил, (+)-1-[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1H-имидазол-4-карбонитрил,(+)-1-[2-оксо-4-(2,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-4-карбонитрил, (-)-1-[2-оксо-4-(2,4,5-трифторфенил)пирролидин-1 ил]метил-1 Н-имидазол-4-карбонитрил, (-)-1-[2-оксо-4-(2,3,5-трифторфенил)пирролидин-1-ил]метил 1 Н-имидазол-4-карбонитрил, (-)-1-[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-5-карбонитрил,1-[2-оксо-4-(2,3,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-5-карбонитрил, 1-[2-оксо-4-(2,3,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-5-карбонитрил, 1-[(5 метил-2-фенил-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(5-метил-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(5-фенил-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2 этил-5-метил-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он,1-[(2,5-диметил-1 Н-имидазол-1 ил)метил]-4-пропилпирролидин-2-он, 1-[(2-хлор-1 Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-[2-азидо-1-(1 Н-имидазол-1-ил)этил]-4-пропилпирролидин-2-он, 1-[(4-хлор-1 Н-имидазол 1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-[(2-бром-4,5-дихлор-1 Н-имидазол-1-ил)метил]-4 пропилпирролидин-2-он, 1-[(2-хлор-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, (+)-1-[2-оксо 4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-5-карбонитрил, 1-[5-(гидроксиметил)-1 Н-имидазол-1-ил]метил-4-пропилпирролидин-2-он, 1-[4-(гидроксиметил)-1 Н-имидазол-1-ил]метил-4 пропилпирролидин-2-он, бензиловый эфир 1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1 Н-имидазол-5 илкарбаминовой кислоты, N-[(1-[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1H-имидазол 5-ил)метил]ацетамид,N-[(1-[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-5 ил)метил]бензамид,N-[(1-[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-5 ил)метил]пропанамид,1-(1 Н-бензимидазол-1-илметил)-4-пропилпирролидин-2-он,1-[(2-метил-1 Нбензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 4-пропил-1-[(2-пропил-1 Н-бензимидазол-1-ил)метил]пирролидин-2-он,1-[(2-изопропил-1 Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он,4 пропил-1-[2-(трифторметил)-1 Н-бензимидазол-1-ил]метилпирролидин-2-он,1-[2-(метилтио)-1 Нбензимидазол-1-ил]метил-4-пропилпирролидин-2-он,1-[(2-амино-1 Н-бензимидазол-1-ил)метил]-4 пропилпирролидин-2-он,1-[2-(хлорметил)-1 Н-бензимидазол-1-ил]метил-4-пропилпирролидин-2-он,1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1 Н-бензимидазол-2-илацетонитрил,1-[(5-метокси-1 Нбензимидазол-1-ил)метил]-4-пропилпирролидин-2-он,1-[(5-метил-1 Н-бензимидазол-1-ил)метил]-4 пропилпирролидин-2-он, 1-[(5,6-диметил-1 Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1[2-изопропил-5-(трифторметил)-1 Н-бензимидазол-1-ил]метил-4-пропилпирролидин-2-он, 1-[(6-хлор 1 Н-бензимидазол-1-илметил]-4-пропилпирролидин-2-он, 1-[(2-оксо-4-пропилпирролидин-1-ил)метил]2-пропил-1 Н-бензимидазол-5-карбонитрил, 1-[2-этил-5-(трифторметил)-1 Н-бензимидазол-1-ил]метил 4-пропилпирролидин-2-он, 4-пропил-1-[2-(1 Н-пиррол-2-ил)-1 Н-бензимидазол-1-ил]метилпирролидин 2-он, 1-[(5-фтор-2-пропил-1H-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[6-метил-2-(1 Нпиррол-2-ил)-1 Н-бензимидазол-1-ил]метил-4-пропилпирролидин-2-он,1-[(6-метокси-2-пропил-1 Нбензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 2-бутил-1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1 Н-бензимидазол-5-карбонитрил, 1-[2-[2-(метилтио)этил]-5-(трифторметил)-1 Н-бензимидазол-1 ил]метил-4-пропилпирролидин-2-он,1-[(5-фтор-2-изобутил-1 Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он,1-[5-фтор-2-(2,4,4-триметилпентил)-1 Н-бензимидазол-1-ил]метил-4-пропилпирролидин-2-он,2-циклопропил-1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1 Н-бензимидазол-5-карбонитрил,1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-2-(1H-пиразол-3-ил)-1 Н-бензимидазол-5-карбонитрил, 1-[(2-циклопропил-5-фтор-1 Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(5-фтор 2-изопропил-1 Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он,1-[2-(3-фурил)-6-метокси-1 Нбензимидазол-1-ил]метил-4-пропилпирролидин-2-он, 1-[(2-циклопропил-6-метокси-1 Н-бензимидазол-1 ил)метил]-4-пропилпирролидин-2-он, 1-[(2-изопропил-6-метокси-1 Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-2-(1,2,3-тиадиазол-4-ил)-1 Н-бензимидазол-5-карбонитрил,1-[2-(1 Н-имидазол-2-ил)-5-(трифторметил)-1 Н-бензимидазол-1-ил]метил-4 пропилпирролидин-2-он,1-[5-фтор-2-(2,2,2-трифторэтил)-1 Н-бензимидазол-1-ил]метил-4-пропилпирролидин-2-он, 1-[2-(1-этилпропил)-6-метокси-1 Н-бензимидазол-1-ил]метил-4-пропилпирролидин 2-он, 1-[6-метокси-2-(1-метил-1 Н-пиррол-2-ил)-1 Н-бензимидазол-1-ил]метил-4-пропилпирролидин-2 он,1-[2-(2-фурил)-5-(трифторметил)-1 Н-бензимидазол-1-ил]метил-4-пропилпирролидин-2-он,4 пропил-1-[2-тиен-2-ил-5-(трифторметил)-1 Н-бензимидазол-1-ил]метилпирролидин-2-он,1-[2-(3 фурил)-5-(трифторметил)-1 Н-бензимидазол-1-ил]метил-4-пропилпирролидин-2-он, 1-[2-циклопропил 5-(трифторметил)-1 Н-бензимидазол-1-ил]метил-4-пропилпирролидин-2-он, 4-пропил-1-[2-(1 Н-пиррол 2-ил)-5-(трифторметил)-1 Н-бензимидазол-1-ил]метилпирролидин-2-он, 1-(1 Н-имидазол-1-илметил)-1,3 дигидро-2 Н-индол-2-он, 5-бром-1-(1 Н-имидазол-1-илметил)-1,3-дигидро-2 Н-индол-2-он, 5-хлор-1-(1 Нимидазол-1-илметил)-1,3-дигидро-2 Н-индол-2-он, 4-фтор-1-(1 Н-имидазол-1-илметил)-1,3-дигидро-2 Ниндол-2-он, 4-хлор-1-(1H-имидазол-1-илметил)-1,3-дигидро-2 Н-индол-2-он, 1-(1 Н-имидазол-1-илметил)5-метил-1,3-дигидро-2 Н-индол-2-он,1-[(2-оксо-2,3-дигидро-1 Н-индол-1-ил)метил]-1 Н-имидазол-5 карбонитрил и 1-[(5-хлор-2-оксо-2,3-дигидро-1 Н-индол-1-ил)метил]-1H-имидазол-5-карбонитрил. Более предпочтительными соединениями являются 1-(1 Н-имидазол-1-илметил)пирролидин-2-он, 1-9 010031(1 Н-имидазол-1-илметил)-4-фенилпирролидин-2-он, 1-(1 Н-имидазол-1-илметил)-4-пропилпирролидин-2 он, (-)-4-(3-азидо-2,4-дифторфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он, (+)-4-(3-азидо-2,4 дифторфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он,1-[(2-этил-1 Н-имидазол-1-ил)метил]-4 пропилпирролидин-2-он, 1-[(2-изопропил-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-[(2 метил-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он,4-пропил-1-[(2-пропил-1 Н-имидазол-1 ил)метил]пирролидин-2-он,(+)-1-(1H-имидазол-1-илметил)-4-пропилпирролидин-2-он,(-)-1-(1Hимидазол-1-илметил)-4-пропилпирролидин-2-он, 4-(2,2-дифторвинил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он,4-(3-хлорфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он,1-[2-(метилтио)-1 Нимидазол-1-ил]метил-4-пропилпирролидин-2-он,1-[(2-метил-1 Н-имидазол-1-ил)метил]-4-фенилпирролидин-2-он,4-(4-фторфенил)-1-(1H-имидазол-1-илметил)пирролидин-2-он,1-(1 Н-имидазол-1 илметил)-4-(3,4,5-трифторфенил)пирролидин-2-он,4-(3-фторфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он, 4-(3,5-дифторфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он, 4-(3,4-дифторфенил)-1(1 Н-имидазол-1-илметил)пирролидин-2-он,4-(3-хлор-4-фторфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он,4-(4-хлорфенил)-1-(1H-имидазол-1-илметил)пирролидин-2-он,1-(1 Н-имидазол-1 илметил)-4-(2,3,4-трифторфенил)пирролидин-2-он,1-(1 Н-имидазол-1-илметил)-4-(2,3,5-трифторфенил)пирролидин-2-он, 1-(1 Н-имидазол-1-илметил)-4-(2,4,5-трифторфенил)пирролидин-2-он, 1-[(2-нитро 1 Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он,1-[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-2-карбонитрил,1-[(2-амино-1 Н-имидазол-1-ил)метил]-4 пропилпирролидин-2-он, 1-[(5-хлор-1 Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он,1-[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-4-карбонитрил, 1-[2-оксо-4(3,4,5-трифторфенил)пирролидин-1-ил]метил-1H-имидазол-5-карбонитрил,(+)-1-(1 Н-имидазол-1 илметил)-4-фенилпирролидин-2-он, (-)-1-(1 Н-имидазол-1-илметил)-4-фенилпирролидин-2-он, (+)-1-[2 оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-4-карбонитрил,1-[(2-хлор-1 Нимидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-[2-азидо-1-(1H-имидазол-1-ил)этил]-4 пропилпирролидин-2-он, 1-[(2-хлор-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он, (+)-1-[2-оксо 4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-5-карбонитрил, 1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-2-пропил-1 Н-бензимидазол-5-карбонитрил,1-[2-этил-5-(трифторметил)-1 Нбензимидазол-1-ил]метил-4-пропилпирролидин-2-он,4-пропил-1-[2-(1 Н-пиррол-2-ил)-1 Н-бензимидазол-1-ил]метилпирролидин-2-он,1-[(5-фтор-2-пропил-1 Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он,2-бутил-1-[(2-оксо-4-пропилпирролидин-1-ил)метил]-1 Н-бензимидазол-5-карбонитрил, 1-[(5-фтор-2-изопропил-1 Н-бензимидазол-1-ил)метил]-4-пропилпирролидин-2-он, 1-(1H-имидазол-1-илметил)-1,3-дигидро-2 Н-индол-2-он,5-бром-1-(1 Н-имидазол-1-илметил)-1,3-дигидро-2 Ниндол-2-он, 5-хлор-1-(1 Н-имидазол-1-илметил)-1,3-дигидро-2 Н-индол-2-он, 1-(1 Н-имидазол-1-илметил)5-метил-1,3-дигидро-2 Н-индол-2-он, 1-[(5-хлор-2-оксо-2,3-дигидро-1 Н-индол-1-ил)метил]-1H-имидазол 5-карбонитрил. Наиболее предпочтительными соединениями являются 1-(1 Н-имидазол-1-илметил)-4 фенилпирролидин-2-он,1-(1 Н-имидазол-1-илметил)-4-пропилпирролидин-2-он,(-)-4-(3-азидо-2,4 дифторфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он,(+)-4-(3-азидо-2,4-дифторфенил)-1-(1 Нимидазол-1-илметил)пирролидин-2-он, 4-(2,2-дифторвинил)-1-(1 Н-имидазол-1-илметил)пирролидин-2 он, 4-(3-хлорфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он, 1-[2-(метилтио)-1 Н-имидазол-1 ил]метил-4-пропилпирролидин-2-он, 1-[(2-метил-1 Н-имидазол-1-ил)метил]-4-фенилпирролидин-2-он, 1(1 Н-имидазол-1-илметил)-4-(3,4,5-трифторфенил)пирролидин-2-он, 4-(3-фторфенил)-1-(1 Н-имидазол-1 илметил)пирролидин-2-он, 4-(3,5-дифторфенил)-1-(1H-имидазол-1-илметил)пирролидин-2-он, 1-(1 Нимидазол-1-илметил)-4-(2,3,4-трифторфенил)пирролидин-2-он,1-(1 Н-имидазол-1-илметил)-4-(2,3,5 трифторфенил)пирролидин-2-он, 1-(1 Н-имидазол-1-илметил)-4-(2,4,5-трифторфенил)пирролидин-2-он,1-[(2-нитро-1 Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, 1-[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-2-карбонитрил,1-[(2-амино-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он,1-[(5-хлор-1 Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он, (+)-1-(1H-имидазол-1-илметил)-4-фенилпирролидин-2-он, (-)-1-(1 Н-имидазол-1-илметил)4-фенилпирролидин-2-он, 1-[(2-хлор-1 Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он,1-[(2-хлор-1 Н-имидазол-1-ил)метил]-4-пропилпирролидин-2-он,(+)-1-[2-оксо-4-(3,4,5-трифторфенил)пирролидин-1-ил]метил-1 Н-имидазол-5-карбонитрил,5-бром-1-(1 Н-имидазол-1-илметил)-1,3 дигидро-2 Н-индол-2-он, 5-хлор-1-(1 Н-имидазол-1-илметил)-1,3-дигидро-2 Н-индол-2-он, 1-(1 Н-имидазол-1-илметил)-5-метил-1,3-дигидро-2 Н-индол-2-он, 1-[(5-хлор-2-оксо-2,3-дигидро-1 Н-индол-1-ил)метил]-1 Н-имидазол-5-карбонитрил. Самыми предпочтительными соединениями являются (-)-4-(3-азидо-2,4-дифторфенил)-1-(1 Нимидазол-1-илметил)пирролидин-2-он, (+)-4-(3-азидо-2,4-дифторфенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он, 4-(3-азидо-2,4-дифторфенил)-1-(1 Н-имидазол-1-илметил)пирролдини-2-он."Фармацевтически приемлемые соли" по изобретению включают терапевтически активные, нетоксичные соли кислот или оснований, которые способны образовывать соединения формулы I. Кислотно-аддитивные соли соединений формулы I, которые являются основаниями, получают обработкой свободного основания соответствующей кислотой, такой, как неорганическая кислота, напри- 10010031 мер, галоидводородная кислота, такая, как хлористо-водородная или бромисто-водородная кислота, серная, азотная, фосфорная кислота и т.п., или органическая кислота, такая например, как уксусная трифторуксусная, гидроксиуксусная, пропионовая, молочная, пировиноградная, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая,пара-толуолсульфоновая, цикламовая, салициловая, пара-аминосалициловая, памовая кислоты и т.п. Из соединений формулы I, содержащих кислотные протоны, можно получить терапевтически активные нетоксичные основно-аддитивные соли, например, соли металла или амина, при взаимодействии с соответствующими органическими или неорганическими основаниями. Соответствующие соли оснований включают, например, соли аммония, соли щелочных и щелочноземельных металлов, например,соли лития, натрия, калия, магния, кальция и т.п., соли органических оснований, например соли N-метилD-глюкамина, гидрабамина, и соли аминоксилот, например, таких как аргинин, лизин и т.п. Свободные основания получают при обработке солей соответствующим основанием или кислотой. Соединения формулы I и их соли могут находиться в форме сольвата, который также включен в объем настоящего изобретения. Такие сольваты включают, например, гидраты, алкоголяты и т.п. Многие соединения формулы I и некоторые промежуточные соединения содержат по меньшей мере один асимметрический атом углерода, который может находиться в R или S конфигурации; такие обозначения используются в соответствии с правилами, описанными в статье Pure Appl. Chem., 45, 11-30(1976). Изобретение также относится ко всем стереоизомерным формам, таким, как энантиомерные и диастереизомерные формы соединений формулы I или их смеси (включая все возможные смеси стереоизомеров). Некоторые соединения формулы I могут также существовать в виде таутомерных форм. Подразумевается, что такие формы, не описанные подробно в указанной выше формуле, также включены в объем настоящего изобретения. Другим предпочтительным вариантом настоящего изобретения являются также соединения формулы IA и их таутомерная форма IB. Подразумевается, что ссылка на соединение или соединения в описании настоящего изобретения, в каждом случае включает все возможные изомерные формы и их соли, если не указана конкретная изомерная форма. Соединения по настоящему изобретению могут существовать в различных полиморфных формах. Подразумевается, что такие формы, не не описанные подробно в указанной выше формуле, также включены в объем настоящего изобретения. Изобретение включает также все пролекарственные формы соединений формулы I и их различные семейства и подгруппы. Для специалиста в области синтетической органической химии представляется очевидным, что соединения формулы I по изобретению можно получить методами, аналогичными известным методам. А. В первом варианте изобретения некоторые соединения общей формулы I, в которых R означает водород, получают хлорированием соединения формулы II и последующим взаимодействием соответствующего производного формулы III с имидазолом формулы IV по следующему уравнению реакции Указанную реакцию можно проводить с использованием тионилхлорида (или любого другого хлорирующего агента, такого как HCl, POCl3, PCl5 и т.п.) в чистом реагенте или в толуоле при температуре от 20 до 80 С. Соединения формулы II можно получить гидроксиалкилированием соединения V альдегидом формулы R6CHO по уравнению Указанную реакцию можно проводить при нагревании производного пирролидона в присутствии альдегида (или его эквивалента, такого как параформальдегид в случае формальдегида) в присутствии кислоты или основания, таких как CF3CO2H или NaOH. Пирролидоны формулы V синтезируют соответствующими методами, описанными в литературе(1995 или методами, описанными в Международной патентной заявке WO 01/62726. Б. В другом варианте изобретения некоторые соединения общей формулы I, в которых R7 означает водород, можно получить превращением соединения формулы II в соответствующий карбамат формулыVI и последующим взаимодействием этого карабамата с соединением формулы IV по следующему уравнению реакции где R16 и R17 независимо выбирают из группы, включающей водород, С 1-С 20 алкил, арил, или эти радикалы вместе образуют гетероцикл, a R4, R4a, R5 и R6 имеют значения, указанные выше. Синтез карбамата VI можно проводить любым соответствующим методом, известным специалисту в данной области, или методом, описанным в US 3903110. Реакцию карбамата VI с производным имидазола формулы IV можно проводить тремя различными способами: стехиометрический вариант включает смешивание карбамата VI с избытком нуклеофила IV (обычно для полного потребления исходного карбамата VI используют 2,2 эквивалента реагента) в инертном растворителе, таком, как ацетонитрил, и нагревание смеси при температуре кипения растворителя в соответствующем реакторе или при воздействии микроволнового излучения (обычно для полного потребления исходного карбамата VI достаточно мощности излучения 100 Вт); каталитический вариант включает нагревание смеси соединения II с небольшим избытком нуклеофила IV (обычно необходимо 1,2 эквивалента) в присутствии каталитического количества карбамата VI(причем пирролидоновые остатки в соединениях II и VI могут быть различными) в соответствующем реакторе (при температуре кипения растворителя) или при воздействии микроволнового излучения(обычно для полного потребления исходного карбамата VI достаточно мощности излучения 100 Вт); в альтернативном варианте каталитический метод заключается в получении соединения II in situ и получении соединения I в одну стадию по уравнению реакции Эту реакцию можно проводить при использовании небольшого избытка нуклеофила IV (обычно необходимо 1,2 эквивалента), избытка альдегида R6CHO (обычно необходимо 4 эквивалента) и карбаматаVI в качестве катализатора (обычно необходимо 10 мол.%, но количество катализатора можно уменьшить) в инертном растворителе, таком как ацетонитрил, при воздействии микроволнового излучения(обычно для полного потребления исходного пирролидона V достаточно мощности излучения 100 Вт). Вместо микроволнового излучения можно также использовать обычное нагревание реакционной смеси. Вместо карбамата V в качестве катализатора можно также использовать N,N-дизамещенный карбамоилхлорид. В. В еще одном варианте изобретения некоторые соединения общей формулы I, в которых R6 и R7- 12010031 вместе образуют С 3-С 6 циклоалкил, a R5 означает водород, можно получить циклизацией соединения формулы VII по уравнению Указанную реакцию проводят при использовании в качестве основания карбоната калия в инертном растворителе (таком, как ДМФА) при температуре от 20 до 100 С. Соединение формулы VII можно получить хлорированием соединения формулы VIII и последующим взаимодействием соответствующего производного формулы IX с имидазолом формулы IV по уравнению реакции Указанную реакцию проводят, как описано в варианте А. Соединение формулы VIII можно получить любым соответствующим методом, известным специалисту в данной области. Г. В еще одном варианте изобретения некоторые соединения общей формулы I, в которых R6 означает амидогруппу или СН 2 ОН, можно получить из соединения формулы IX где R18 означает С 1-С 4 алкил, предпочтительно метил или этил. Реакцию проводят любым соответствующим методом, известным специалисту в данной области. Д. В еще одном варианте изобретения некоторые соединения общей формулы I, в которых R7 означает водород, a R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют цикл 1,3-дигидро-2 Ниндол-2-она получают при взаимодействии соединения формулы (XI) с альдегидом формулы R1CHO по уравнению Указанную реакцию проводят любым методом, известным специалисту в данной области. Соединения формулы XI можно получить восстановлением соединения формулы XII. Указанную реакцию проводят любым методом, известным специалисту в данной области. Соединения формулы XII можно получить при взаимодействии производного амина формулы XIII с соединением формулы XIV по уравнению Указанную реакцию проводят любым методом, известным специалисту в данной области. Соединения формулы XIII можно получить из соответствующего соединения формулы III любым методом, известным специалисту в данной области. Е. В еще одном варианте изобретения некоторые соединения общей формулы I получают модификацией функциональных групп.(а) Соединения общей формулы I, в которых R4 означает -CH=CF2, можно получить из соответствующего соединения формулы I, в котором R4 означает -CH2-CBrF2, при обработке основанием,(б) производные метилтиоимидазола можно оксилить с использованием NaIO4 в МеОН с образованием соответствующего производного метилсульфинилимидазола формулы I,(в) из производных алкилового эфира 1 Н-имидазол-2-карбоновой кислоты формулы I можно получить соответствующие амиды или соответствующий спирт,(г) производные нитроимидазола формулы I можно восстановить водородом в присутствии Pd/C с образованием соответствующих производных аминоимидазолов любым методом, известным специалисту в данной области,(д) соединение формулы I, в котором R6 означает -CH2N3, можно получить из соответствующего соединения формулы I, в котором R6 означает -СН 2 ОН, с использованием промежуточного мезилата формулы (XV)(е) соединения формулы I, в которых R2 и/или R3 означает -NHCOR19, где R19 означает группу алкил или арил, можно получить перегруппировкой Курциуса из соответствующей кислоты, где по меньшей мере один из заместителей R2 или R3 означает -СООН, в условиях, известных специалисту в данной области (например, при действии дифенилфосфоразидата и триэтиламина с поледующей остановкой in situ спиртом (R19OH), как описано в статье Kim D., Weinreb S.M., J. Org. Chem., 43, 125 (1978),(ж) соединения формулы I, в которых R2 и/или R3 означает -CH2NHCOR20, где R20 означает группу алкил или арил, можно получить селективным восстановлением соответствующего амида (R2 и/или R3 означает -CONH2) или нитрила (R2 и/или R3 означает -CN) формулы I с образованием производного аминометила формулы I (R2 и/или R3 означает -CH2NH2), и реакцией с хлорангидридом кислоты в любых условиях, известных специалисту в данной области,з) соединения формулы I, в которых R2 и/или R3 означает амидогруппу, получают активацией соответствующей кислоты, в которой R2 и/или R3 означает -СООН, и реакцией с первичным или вторичным амином в любых условиях, известных специалисту в данной области,- 14010031(и) соединения формулы I, в которых R2 и/или R3 означает -СН 2 ОН, можно получить из соответствующего соединения, в котором по меньшей мере один из заместителей R2 или R3 означает -CH2OSiMe2tBu, в любых условиях, известных специалисту в данной области, например, по реакции с н-Bu4NF в ТГФ при комнатной температуре. Такие модификации проводят любым методом, известным специалисту в данной области. Ж. В еще одном варианте изобретения некоторые соединения общей формулы I, в которых R2 и R3 вместе с имидазольным циклом образуют указанный 1 Н-бензимидазольный цикл получают по реакции соединения формулы (XI) с карбонилдиимидазолом. Указанную реакцию проводят любым методом, известным специалисту в данной области. Другим вариантом изобретения является синтез следующих промежуточных соединений формулы II: 4-(2-бром-2,2-дифторэтил)-1-гидроксиметилпирролидин-2-он,1-(гидроксиметил)-4-(3,4,5-трифторфенил)пирролидин-2-он,1-(гидроксиметил)-4-пропилпирролидин-2-он,4-(3-хлорфенил)-1-гидроксиметилпирролидин-2-он,4-(3-фторфенил)-1-гидроксиметилпирролидин-2-он,4-(4-хлорфенил)-1-гидроксиметилпирролидин-2-он,4-(4-фторфенил)-1-гидроксиметилпирролидин-2-он,4-(3,5-дифторфенил)-1-гидроксиметилпирролидин-2-он,1-гидроксиметил-4-(2,3,5-трифторфенил)пирролидин-2-он,1-гидроксиметил-4-(2,3,4-трифторфенил)пирролидин-2-он,4-(3-хлор-4-фторфенил)-1-гидроксиметилпирролидин-2-он,4-(3,4-дифторфенил)-1-гидроксиметилпирролидин-2-он,1-гидроксиметил-4-(2,4,5-трифторфенил)пирролидин-2-он,4-(3-азидо-2,4,6-трифторфенил)-1-гидроксиметилпирролидин-2-он,4-(3-азидо-2,4-дифторфенил)-1-гидроксиметилпирролидин-2-он,5-хлор-1-гидроксиметил-1,3-дигидроиндол-2-он,1-(гидроксиметил)-1,3-дигидро-2 Н-индол-2-он,4-хлор-1-гидроксиметил-1,3-дигидроиндол-2-он,4-фтор-1-гидроксиметил-1,3-дигидроиндол-2-он,5-бром-1-гидроксиметил-1,3-дигидроиндол-2-он,1-гидроксиметил-5-метил-1,3-дигидроиндол-2-он и 1-гидроксиметил-5-(2-метилтиазол-4-ил)-1,3-дигидроиндол-2-он. Другим вариантом настоящего изобретения является также синтез промежуточных соединений формулы VII в которых R6 и R7 вместе образуют С 3-С 6 циклоалкил, a R1, R2, R3, R4 и R4a имеют значения, указанные выше,или R2 и R3 вместе с имидазольным циклом образуют указанный 1 Н-бензимидазольный цикл где R8, R9, R10 и R11 имеют значения, указанные выше. Другим вариантом настоящего изобретения является синтез промежуточного соединения формулыVII, 4-бром-N-(1-имидазол-1-илциклопропил)бутирамида. Еще одним вариантом настоящего изобретения является синтез промежуточного соединения формулы X где R18 означает С 1-С 4 алкил,R1, R2 и R3 имеют значения, указанные выше,или R2 и R3 вместе с имидазольным циклом могут образовать указанный 1 Н-бензимидазольный цикл где R8, R9, R10 и R11 имеют значения, указанные выше, R4, R4a и R5 имеют значения, указанные выше, или R4, R4a и R5 вместе с 2-оксо-1-пирролидиновым циклом образуют указанный цикл 1,3-дигидро 2 Н-индол-2-она где R12, R13, R14 и R15 имеют значения, указанные выше. Еще одним вариантом настоящего изобретения является синтез промежуточного соединения формулы X, этилового эфира имидазол-1-ил-(2-оксо-4-пропилпирролидин-1-ил)уксусной кислоты. Еще одним вариантом настоящего изобретения является синтез промежуточного соединения формулы XI где R4, R4a, R5, R6, R8, R9, R10 и R11 имеют значения, указанные выше, или R4, R4a и R5 вместе с 2 оксо-1-пирролидиновым циклом образуют указанный цикл 1,3-дигидро-2 Н-индол-2-она где R12, R13, R14 и R15 имеют значения, указанные выше. Еще одним вариантом настоящего изобретения является синтез промежуточного соединения формулы XI, (2-аминофенил)(2-оксо-4-пропилпирролидин-1-ил)метиламина. Еще одним вариантом настоящего изобретения является синтез промежуточного соединения формулы XII где R4, R4a, R5, R6, R8, R9, R10 и R11 имеют значения, указанные выше, или R4, R4a и R5 вместе с 2- 16010031 оксо-1-пирролидиновым циклом образуют указанный цикл 1,3-дигидро-2 Н-индол-2-она где R12, R13, R14 и R15 имеют значения, указанные выше. Еще одним вариантом настоящего изобретения является синтез промежуточного соединения формулы XII, (2-нитрофенил)(2-оксо-4-пропилпирролидин-1-ил)метиламина. Другим вариантом изобретения является синтез следующих промежуточных соединений: 1-(4-метоксибензил)-5-оксопирролидин-3-карбальдегид,4-(2,2-дифторвинил)-1-(4-метоксибензил)пирролидин-2-он,4-(2,2-дифторвинил)пирролидин-2-он,4-(2-бром-2,2-дифторэтил)пирролидин-2-он,(4-бром-2,6-дифторфенил)пирролидин-1-илдиазен,6-бром-2,4-дифтор-3-(пирролидин-1-илазо)бензальдегид,этиловый эфир 3-[6-бром-2,4-дифтор-3-(пирролидин-1-илазо)фенил]акриловой кислоты,этиловый эфир 3-[6-бром-2,4-дифтор-3-(пирролидин-1-илазо)фенил]-4-нитромасляной кислоты,4-[2,4-дифтор-3-(пирролидин-1-илазо)фенил]пирролидин-2-он,4-(3-азидо-2,4-дифторфенил)пирролидин-2-он,4-бром-N-1-(гидроксициклопропил)бутирамид,этиловый эфир гидрокси(2-оксо-4-пропилпирролидин-1-ил)уксусной кислоты и 1-аминометил-4-пропилпирролидин-2-он. В настоящее время установлено, что соединения формулы I и их фармацевтически приемлемые соли могут использоваться при лечении многих нарушений. Например, соединения по изобретению могут использоваться при лечении эпилепсии, эпилептогенеза, нарушений в виде эпилептических припадков и судорог. Указанные соединения можно также использовать для лечения болезни Паркинсона. Указанные соединения можно также использовать для лечения дискинезии, индуцированной заместительной терапией допамином, поздней дискинезии, индуцированной приемом нейролептических средств, или хореи Гентингтона. Кроме того, настоящее изобретение относится к применению соединения формулы I для получения лекарственных средств, предназначенных для лечения и профилактики эпилепсии, эпилептогенеза, эпилептических припадков, судорог, болезни Паркинсона, дискинезии, индуцированной заместительной терапией допамином, поздней дискинезии, индуцированной приемом нейролептических средств, или хореи Гентингтона и других неврологических нарушений, включающих биполярные нарушения, маниакальный синдром, депрессию, тревогу, гиперактивное расстройство в виде потери внимания (ADHD),мигрень, невралгию тройничного нерва и другие виды невралгии, хроническую боль, нейропатическую боль, церебральную ишемию, сердечную аритмию, миотонию, злоупотребление кокаином, инсульт, миоклонию, тремор, наследственный тремор, простой или комплексный тик, синдром Туре, синдром усталых ног и другие нарушения движения, неонатальное церебральное кровотечение, боковой амиотрофический склероз, спастичность и дегенеративные заболевания, бронхиальную астму, астматическое состояние и аллергический бронхит, астматический синдром, повышенную чувствительность бронхов и бронхоспастические синдромы, а также аллергические и вазомоторные риниты и риноконъюнктивиты. Кроме того, соединения по изобретению можно также использовать для лечения других неврологических нарушений, включающих биполярные нарушения, маниакальный синдром, депрессию, тревогу,гиперактивное расстройство в виде потери внимания (ADHD), мигрень, невралгию тройничного нерва идругие виды невралгии, хроническую боль, нейропатическую боль, церебральную ишемию, сердечную аритмию, миотонию, злоупотребление кокаином, инсульт, миоклонию, тремор, наследственный тремор,простой или комплексный тик, синдром Туре, синдром усталых ног и другие нарушения движения, неонатальное церебральное кровотечение, боковой амиотрофический склероз, спастичность и дегенеративные заболевания, бронхиальную астму, астматическое состояние и аллергический бронхит, астматический синдром, повышенную чувствительность бронхов и бронхоспастические синдромы, а также аллергические и вазомоторные риниты и риноконъюнктивиты. Таким образом, настоящее изобретение включает также соединение формулы I или его фармацевтически приемлемую соль, указанную выше, для применения в качестве лекарственного средства. Еще одним объектом настоящего изобретения является применение соединения формулы I или его фармацевтически приемлемой соли, для получения лекарственного средства, предназначенного для лечения неврологических и других расстройств, указанных выше. Настоящее изобретение прежде всего относится к применению соединения формулы I или его фармацевтически приемлемой соли для получения лекарственного средства, предназначенного для лечения- 17010031 эпилепсии, болезни Паркинсона, дискинезии, мигрени, тремора, наследственного тремора, биполярных нарушений, хронической боли, нейропатической боли или бронхиальных астматических или аллергических состояний. Способы по изобретению включают введение млекопитающему (предпочтительно человеку), страдающему от вышеуказанных состояний или нарушений, соединения по изобретению в количестве, достаточном для снижения интенсивности симптомов или профилактики нарушения или состояния. Обычно соединение вводят в любой пригодной стандартной лекарственной форме, включающей,без ограничения перечисленным, от 3 до 3000 мг, предпочтительно от 25 до 500 мг активного ингредиента в стандартной лекарственной форме. Термин лечение, используемый в описании изобретения, включает лечебное и профилактическое действие. Лечебное действие означает эффективное лечение наблюдаемых симптомов нарушения или состояния. Профилактическое действие означает предотвращение проявлений или рецидивов нарушения или состояния. Термин эпилепсия, используемый в описании заявки, означает хроническое неврологическое расстройство, которое характеризуется неспровоцированными, повторяющимися эпилептическими припадками. Эпилептический припадок означает проявление аномального и избыточного синхронизированного разряда группы церебральных нейронов, причем клинические проявления такого разряда являются неожиданными и кратковременными. Термин эпилепсия, используемый в описании заявки, означает также нарушение функции головного мозга, которое характеризуется периодическими припадками. Припадки бывают неэпилептические, которые происходят в здоровом состоянии при сильном нервном возбуждении или при воздействии токсинов, или эпилептические, которые происходят без видимых причин. Термин припадок, используемый в описании заявки, означает временное изменение поведения вследствие нарушенного, синхронизировнного и ритмичного возбуждения популяций нейронов головного мозга. Термин симптомы болезни Паркинсона означает синдром, который характеризуется замедленностью движения (брадикинезия), ригидностью и/или тремором. Симптомы болезни Паркинсона наблюдаются при ряде состояний, чаще всего при идиопатическом паркинсонизме (т.е. болезни Паркинсона), но также после лечения шизофрении, воздействия токсинов/лекарственных средств и травмы головы. Принято считать, что первичной причиной болезни Паркинсона является дегенерация в головном мозге допаминергического проецирования из черного вещества в полосатое тело мозга. Это привело к широкому применению допамин-заместительных агентов (например, L-3,4-дигидроксифенилаланина (L-DOPA) и агонистов допамина) с целью симптоматического лечения болезни Паркинсона, причем такое лечение является достаточно эффективным, поскольку в результате повышается качество жизни пациентов, страдающих от болезни Паркинсона. Однако допамин-заместительное лечение характеризуется ограничениями, прежде всего из-за продолжительного лечения. Проблемы могут включать снижение эффективности лечения и появление ряда побочных действий, которые проявляются в виде аномальных непроизвольных движений, таких как дискинезия. Термин дискинезия означает развитие у субъекта аномальных непроизвольных движений. Такое состояние наблюдается у пациентов, страдающих от болезни Гентингтона, от болезни Паркинсона, которые прошли курс продолжительной допамин-заместительной терапии, и у пациентов, страдающих шизофренией, которые прошли курс продолжительного лечения нейролептиками. Дискинезия в целом характеризуется развитием у субъекта аномальных непроизволдных движений. Одной из причин дискинезии являются побочные действия при допамин-заместительной терапии паркинсонизма или другие нарушения движения, связанные базальными ганглиями. Термин мигрень, используемый в описании заявки, означает нарушение, которое харатеризуется повторяющимися приступами головной боли, которые широко варьируют по интенсивности, частоте и продолжительности. Приступы обычно являются односторонними и обычно ассоциируются с анорексией, тошнотой, рвотой, фонофобией и/или фотофобией. В некоторых случаях они обусловлены или ассоциированы с неврологическими и депрессивными нарушениями. Мигрень может длиться от 4 до 72 ч. Международное общество по головной боли (IHS, 1988) подразделяет мигрень на два основных типа: мигрень с аурой (предвестником эпилептического припадка, классическая мигрень) и мигрень без ауры(обычная мигрень). Мигрень с аурой включает фазу головной боли, которой предшествуют характерные зрительные, сенсорные, речевые или двигательные симптомы. При отсутствии таких симптомов головную боль классифицируют, как мигрень без ауры. Термин биполярные нарушения, используемый в описании заявки, означает такие нарушения,которые согласно Ассоциации психиатров США классифицируются как нарушения настроения (см. Diagnostic and Statistical Manual of Mental Disorders (DSM-IV), 4 изд., American Psychiatry Association, Вашингтон, DC (1994). Биполярные нарушения обычно характеризуются спонтанно запускаемыми повторяющимися (т.е. по меньшей мере дважды) эпизодами, при которых существенно нарушается гипервоз- 18010031 будимость, активность и настроение пациента, причем это нарушение в некоторых случаях заключается в повышении настроения, повышенной энергии и активности (мания или гипомания), а в других случаях в снижении настроения, пониженной энергии и активности (депрессия). Согласно DSM-IV биполярные нарушения подразделяются на четыре основных категории (биполярное нарушение I, биполярное нарушение II, циклотимия и иные биполярные нарушения). Термин маниакальный приступ, используемый в описании заявки, означает определенный период времени, в течение которого наблюдается аномально и устойчиво повышенное экспансивное или раздражительное состояние, которое сопровождается назидательной речью и психомоторным возбуждением. Термин гипоманиакальное состояние, используемый в описании заявки, означает менее экстремальный маниакальный эпизод с меньшей степенью остроты. Термин основное депрессивное состояние, используемые в описании заявки, означает период по меньшей мере две недели, в течение которого наблюдается либо подавленное состояние, либо потеря интереса или удовлетворения при почти любом виде активности, которое сопровождается пониженной концентрацией и психомоторной заторможенностью. Термин смешанный приступ, используемый в описании заявки, означает период времени (по меньшей мере одна неделя), при котором почти каждый день наблюдаются признаки маниакального приступа и основного депрессивного состояния. Термин хроническая боль, используемый в описании заявки, означает состояние, которое в настоящее время принято считать как патологическим процессом, отличающимся от острой боли. Обычно это боль, которая сохраняется после нормального периода выздоровления, причем такая боль может рассматриваться как хроническая в тот момент, когда пациент осознает, что боль будет занимать составную часть его жизни в обозримом будущем. По-видимому, большинство синдромов хронической боли включает невропатический компонент, который обычно сложнее поддается лечению, чем острая соматическая боль. Термин невропатическая боль, используемый в описании заявки, означает боль, которая вызывается патологическим изменением в том нерве, который сигнализирует о присутствии вредного стимула,при этом такой стимул не распознается организмом, что приводит к ошибочному ощущению боли. Иными словами, это означает, что система болевого ощущения включена и не может отключиться. Термин тик (судорога) означает обычные и часто втречающиеся неврологические нарушения. В большинстве случаев они ассоциируются с нарушениями поведения, включающими обсессивнокомпульсивное нарушение, недостаточность внимания, нарушение в виде гиперактивности и регуляции побуждений. Тик означает непроизвольные, неожиданные, быстрые, повторяющиеся, неритмичные стереотипные движения или звуки. Тик проявляется во многих формах, различной продолжительности и степени сложности. Простой моторный тик означает короткие быстрые движения, которые часто включают только одну группу мышц. Сложные моторные тики означают резкие движения, которые включают группу простых движений или более координированную последовательность движений. Простой звуковой тик включает звуки, такие, как хрюканье, лай, тявканье и их отмену. Сложный звуковой тик включает слоги, фразы, повтор чужих слов и повтор собственных слов человека. Активность соединений формулы I или их фармацевтически приемлемых солей в качестве противосудорожных средств определяют на модели аудиогенного припадка. Целью таких испытаний является оценка противосудорожной активности соединения с использованием аудиогенных припадков, вызванных у мышей, чувствительных к шуму, т.е. на модели генетического животного с ответной реакцией в виде припадков. На этой модели первичного большого эпилептического припадка симптомы заболевания вызываются безприменения электрической или химической стимуляции, а типы припадков по меньшей мере частично аналогичны по клинической феноменологии припадкам у человека (Loscher W., SchmidtD., Epilepsy Res., 2, 145-181 (1998), Buchhalter J.R., Epilepsia, 34, S31-S41 (1993. Результаты, полученные при испытании соединений формулы I, свидетельствуют о наличии у них высокой фармакологической активности. Другим методом определения высокой противосудорожной активности является исследование взаимодействия соединения с участком связывания леветирацетама (LBS), как описано в тексте заявки. Как указано в заявках США 10/308163 и 60/430372, LBS идентифицирован как белок семейства SV2. Предполагается, что ссылка в описании заявки на LBS включает ссылку на SV2. Активность в любом из вышеуказанных показаний можно определить при проведении соответствующих клинических испытаний способом, известным специалисту в данной области, предназначенным для конкретного показания и/или в общем случае при проведении основных клинических испытаний. При лечении заболеваний соединения формулы I или их фармацевтически приемлемые соли можно использовать в виде эффективной суточной дозы и вводить в форме фармацевтической композиции. Следовательно, еще одним вариантом настоящего изобретения является фармацевтическая композиция, включающая эффективное количество соединения формулы I или их фармацевтически приемлемые соли в комбинации с фармацевтически приемлемым разбавителем или носителем. Для получения фармацевтической композиции по изобретению одно или более соединений форму- 19010031 лы I или их фармацевтически приемлемых солей тщательно перемешивают с фармацевтически приемлемым разбавителем или носителем обычным методом, известным специалисту в данной области. Пригодные разбавители и носители выбирают в зависимости от требуемого способа введения, например перорального, ректального, парентерального или интраназального. Фармацевтические композиции, включающие соединения по изобретению, можно вводить, например, пероральным способом, парентеральным способом, т.е. внутривенным, внутримышечным и подкожным способом, подоболочечным способом, ингаляцией или интраназальным способом. Фармацевтические композиции для перорального введения могут находиться в твердой или жидкой форме и могут иметь форму таблеток, пилюлей, драже, желатиновых капсул, растворов, сиропов, жевательных резинок и т.п. Для этого активный ингредиент смешивают с инертным разбавителем или нетоксичным фармацевтически приемлемым носителем, таким как крахмал или лактоза. Указанные фармацевтические композиции необязательно могут также содержать связующий компонент, такой как микрокристаллическая целлюлоза, камедь трагаканта или желатин, дезинтегрирующий агент, такой как альгиновая кислота, замасливатель, такой как стеарат магния, глидант, такой как коллоидный диоксид кремния, посластитель, такой как сахароза или сахарин, красители, ароматизаторы, такие как перечная мята или метилсалицилат. Кроме того, изобретение включает композиции, которые высвобождают активное вещество контролируемым способом. Фармацевтические композиции для парентерального введения обычно представляют собой водные или масляные растворы или суспензии, обычно в ампулах, одноразовых шприцах, стеклянных или пластиковых флаконах или контейнерах для вливания. Кроме активного ингредиента такие растворы или суспензии необязательно могут также содержать стерильный разбавитель, такой как вода для инъекции, физиологический солевой раствор, масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители, антибактериальные агенты, такие как бензиловый спирт, антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия, хелатирующие агенты, такие как этилендиаминтетрауксусная кислота, буферные вещества, такие как ацетаты, цитраты или фосфаты, и агенты для регуляции осмотического давления, такие как хлорид натрия или декстроза. Указанные фармацевтические формы получают с использованием методов, известных фармакологам. Количество активного ингредиента в фармацевтических композициях может варьировать в широком интервале концентраций и в зависимости от ряда факторов, таких как пол пациента, возраст и масса,состояние здоровья, а также от способа введения. Таким образом, количество соединения формулы I в композициях для перорального введения составляет по меньшей мере от 0,5 до 80 мас.% в расчете на общую массу композиции. В настоящем изобретении установлено также, что соединения формулы I или их фармацевтически приемлемые соли можно вводить отдельно или в комбинации с другими фармацевтически активными ингредиентами. Такими дополнительными соединениями, которые можно использовать в комбинации с соединениями по изобретению, являются, без ограничения перечисленным, противовирусные агенты,антиспазматические средства (например, баклофен), противорвотные средства, агенты, стабилизирующие антиманиакальное состояние, аналгетики (например, аспирин, ибупрофен, парацетамол), наркотические аналгетики, местные анестетики, опиоидные аналгетики, соли лития, антидепрессанты (например,миансерин, флуоксетин, тразодон), трициклические антидепрессанты (например, имипрамин, десипрамин), противосудорожные средства (например, валпроевая кислота, карбамазепин, фенитоин), антипсихотические средства (например, рисперидон, галоперидол), нейролептики, бензодиазепины (например,диазепам, клоназепам), фенотиазины (например, хлорпромазин), блокаторы кальциевых каналов, амфетамин, клонидин, лидокаин, мексилетин, капсаицин, кофеин, кветиапин, антагонисты серотонина, блокаторы, антиаритмические средства, триптаны, производные (алкалоидов) спорыньи и амантадин. По настоящему изобретению особый интерес представляют композиции по меньшей мере одного соединения формулы I или его фармацевтически приемлемые соли и по меньшей мере одного соединения, индуцирующего невральное ингибирование, опосредованное рецепторами GABAA. Соединения формулы I проявляют эффективное действие на соединения, индуцирующие невральное ингибирование,опосредованное рецепторами GABAA, и во многих случаях способны эффективно излечивать состояния или нарушения при уменьшенном риске побочных действий. Примеры соединений, индуцирующих невральное ингибирование, опосредованное рецепторамиGABAA, включают следующие соединения: бензодиазепины, барбитураты, стероиды и противосудорожные агенты, такие, как валпроат, виагабатрин, тиагабин или их фармацевтически приемлемые соли. Бензодиазепины включают 1,4-бензодиазепины, такие как дизепам и клоназепам, и 1,5 бензодиазепины, такие как клобазам. Предпочтительным соединеним является клоназепам. Барбитураты включают фенобарбитал и пентобарбитал. Предпочтительным соединением является фенобарбитал. Стероиды включают адренокортикотропные гормоны, такие как тетракозактид ацетат. Противосудорожные средства включают гидантоины (фенитоин, этотоин и т.п.), оксазолидины(триметадион и т.п.), сукцинимиды (этосукцимид и т.п.), фенацемиды (фенацемид, ацетилфенетурид и т.п.), сульфонамиды (султиам, ацетоазоламид и т.п.), аминомасляные кислоты (например -амино-гидроксимасляная кислота и т.п.), валпроат натрия и его производные, карбамазепин и т.п. Предпочтительные соединения включают валпроевую кислоту, валпромид, валпроат пивоксила,валпроат натрия, полувалпропат натрия, дивалпроекс, клоназепам, фенобарбитал, вигабатрин, тиагабин,амантадин. Для предпочтительных пероральных композиций суточная доза составляет от 3 до 3000 мг соединений формулы I. В композициях, предназначенных для парентерального введения, количество соединения формулы I составляет по меньшей мере от 0,5 до 33 мас.% в расчете на общую массу композиции. В предпочтительных парентеральных композициях стандартная доза составляет от 3 до 3000 мг соединений формулы I. Суточная доза может варьировать в широком интервале стандартных лекарственных форм, содержащих доз соединение формулы I, в общем случае в интервале от 3 до 3000 мг. Однако подразумевается,что конкретные дозы изменяются в каждом случае в зависимости от индивидуальных требований по усмотрению лечащего врача. Связывающиеся с LBS соединения по настоящему изобретению и их меченые производные можно использовать в качестве стандартов и реагентов при определении способности анализируемых соединений (например, эффективности фармацевтических средств) связываться с рецептором LBS. Меченые производные лигандов LBS по настоящему изобретению также можно использовать в качестве радиоактивных индикаторов при визуализации в позитрон-эмисионной томографии (PET) или фотон-эмиссионной компьютерной томографии (SPECT). Следовательно, в настоящем изобретении предлагаются меченые лиганды в качестве средства для поиска в химическиих базах (библиотеках) эффективных фармацевтических агентов, прежде всего,предназначенных для лечения и профилактики состояний, указанных выше, на основании более эффективного связывания белков LBS/SV2, для локализации белков SV2 в тканях и для характеризации очищенных белков SV2. Белки SV2 включают SV2A, SV2B и SV2C, причем белки SV2A представляют собой участок (мишень) связывания противосудорожного средства леветирацетама и его аналогов. Изоформы белков SV2, а именно SV2A, SV2B или SV2C, можно выделить из тканей, прежде всего головного мозга, различных видов млекопитающих, включая человека, крысу или мышь. В другом варианте изоформы могут представлять собой клонированные варианты белков любых видов млекопитающих,включая человека, крысу и мышь, гетерологично экспрессированные и используемые при анализе. Способ поиска включает обработку мембран головного мозга млекопитающих или человека, или клеточных линий, экспрессирующих белки SV2 или их фрагменты, прежде всего SV2A, но включающих SV2B иSV2C, предполагаемым агентом и инкубацию мембран или белков или их фрагментов и агента с меченым соединением формулы I. Кроме того, способ включает определение ингибирования предполагаемым агентом связывания соединения формулы I с белком, т.е. идентификацию конкурентов за связывание с белком (SV2). Таким образом, тестирование позволяет идентифицировать новые лекарственные средства или соединения, которые связываются с LBS/SV2. Кроме того, в настоящем изобретении предлагаются фотоактивные лиганды SV2/LBS. Способ также включает анализ связывания изоформы SV2, например,SV2C, с меченым соединением формулы I. В то время как изоформа SV2, такая, как SV2A, связывает серию лигандов, которые являются производными леветирацетама, с идентичным сродством к LBS, изоформа SV2C селективно связывается с подгруппой этих лигандов, и прежде всего обладает высоким сродством связывания с соединениями формулы I. Меченые лиганды можно также использовать в качестве средства определения конформационного состояния белков SV2 после их солюбилизации, очистки и хроматографии. В лиганды можно ввести метку непосредственно или опосредованно. Примеры пригодных меток включают радиоактивную метку,такую, как 3 Н, флуоресцентную метку, ферментативную метку, европий, биотин и другие соответствующие метки, принятые для анализов этого типа. Для таких целей прежде всего предпочтительным соединением является [3 Н]-(+)-4-(3-азидо-2,4-дифтофенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он ([3 Н]соединение 7). Описание фигур На всех чертежах (+)-4-(3-азидо-2,4-дифтофенил)-1-(1 Н-имидазол-1-илметил)пирролидин-2-он обозначается как соединение 7, соединение Z означает (2S)-2-[4-(3-азидофенил)-2-оксопирролидин-1 ил]бутанамид (соединение 86 в заявке РСТ WO 01/62726), LO59 означает (S)-(-)этил-2-оксо-1 пирролидинацетамид, который известен под международным непатентуемым названием леветирацетам. На фиг. 1 приводится кривая насыщения связывания [3 Н]-соединения 7 мембранной фракции ткани головного мозга крысы. На оси Y приводится относительное связывание со свободным радиоактивным лигандом: соотношение B/F (фмоль/образец/нмоль), а на оси X указано количество связанного радиоактивного лиганда: В (фмоль/образец). Вмакс равно 9,2 пмоль/мг белка, a Kd равно 13 нМ. На фиг. 2 а и 2 б представлены кривые конкурентного связывания, которые свидетельствуют о том,что при связывании с LBS сродство соединение 7 в 30 выше по сравнению с леветирацетамом. На оси Y- 21010031 приводится связывание [3 Н]-соединения 7 (% от контроля), а на оси X представлен Log[лек.средство]М. Аанализируемые соединения включают леветирацетам (2 а) и соединение 7 (2b). На фиг. 3 представлены результаты электрофореза в геле мембранных белков, меченых [3 Н]соединением 7. На оси Y представлена радиоактивность (расп./мин) в срезах геля, а на оси X приведен номер среза геля. Каждый номер и стрелка на графике указывает положение и величину мол. массы (в кДа) стандартных белков. На фиг. 4 представлен график IC50 соединения 7 с использованием SPA-гранул, покрытых мембранной фракцией клеток головного мозга крысы и соединением 7. На оси Y приводится свзывание [3 Н]соединения 7 (расп./мин/образец), а на оси X представлен Log[лек.средство]М. Анализируемое лекарственное средство включает соединение 7 (двухкратный повтор). На фиг. 5 приводится связывание двух меченых радиоактивных лигандов ([3 Н]-соединения 7 и [3 Н]соединения А) с временно трансфектированными клетками COS-7, содержащими SV2C. На оси Y представлено связывание в имп./мин. На оси X первая пара гистограмм (1) означает специфическое связывание с клетками, экспрессирующими hSV2C, с использованием в качестве зонда [3 Н]-соединения 7 А) означает связывание только [3 Н], а (В) означает связывание [3 Н]-соединения 7 + избыток леветирацетама,который вытесняет специфически связанный зонд). Вторая пара гистограмм (2) представляет результаты аналогичного эксперимента с использованием нетрансфектированных клеток (А и В имеют значения,указанные выше), которые свидетельствует об отсутствии специфического связывания. Третья пара гистограмм (3) свидетельствует об отсутствии специфического связывания с клетками, трансфектированными hSV2C, с использованием в качестве зонда [3 Н]-соединения Z С) означает связывание [3 Н]соединения Z, a (D) означает связывание [3 Н]-соединения Z + избыток леветирацетама). На фиг. 6 представлен график IC50, где приводится сравнение связывания двух различных лигандов с SV2A и SV2C человека с использованием в качестве радиоактивного лиганда [3 Н]-соединения 7. На осиLog[лек.средство]М. Графики IC50 связывания соединения 7 с hSV2A и hSV2C обозначаются знаками (х) и и ( ), соответственно, графики связывания соединения Z с hSV2A и hSV2C представлены знаками, соответственно. Следует отметить различное сродство соединения Z к hSV2A и hSV2C и одинаковое. сродство соединения 7 к hSV2A и hSV2C Способы анализа по настоящему изобретению включают методы идентификации агентов или соединений, которые конкурируют за связывание с LBS (прежде всего с SV2A). Меченые соединения формулы I используются в методах по изобретению в качестве зондов для поиска новых соединений или агентов, которые связываются с LBS (прежде всего с SV2A). В таких вариантах анализа лиганды можно использовать в нативном виде (не используя модификацию) или их можно модифицировать различными способами, например, введением метки, например, за счет ковалентного или нековалентного связывания с группировкой, которая прямым или косвенным образом, обеспечивает формирование регистрируемого сигнала. В любом из этих методов анализа в материал можно ввести метку прямым или косвенным способом. Прямое введение метки включает присоединение меченых групп, таких как радиоактивные изотопы, включая, без ограничения перечисленным, [3 Н], [14 С], [32 Р], [35S] или [125I], ферменты, такие как пероксидаза и щелочная фосфатаза, флуоресцентные метки, позволяющие регистрировать изменение интенсивности флуоресценции, сдвиг длины волны или поляризацию флуоресценции, включая, без ограничения перечисленным, флуоресцеин или родамин. Непрямое введение метки включает биотинилирование одного компонента с последующим связыванием с авидином, коньюгированным с одной из вышеуказанных меток, или применение антител к лиганду. Если соединения предполагается фиксировать на твердом носителе, то такие соединения могут также включать промежуточные группы (спейсеры или линкеры). Для идентификации агентов или соединений, конкурирующих за свзывание или взаимодействующих с мечеными лигандами по изобретению при связывании с LBS (прежде всего с SV2A), можно использовать интактные клетки, клеточные или мембранные фрагменты, содержащие SV2A или весьSV2, или фрагмент, включающий LBS белка SV2. Агент или соединение можно инкубировать с клетками, мембранами, белком SV2 или фрагментом, до, во время или после инкубации с соединением L059 или его аналогом или производным. Методики анализа по изобретению можно модифицировать или проводить в любом пригодном формате, влючающем высокопроизводительные тест-системы, при которых регистрируется связывание соединения L059 или связывание его производных или аналогов с SV2 или с участками LBS в составе белка SV2. Многие программы поиска лекарственных средств с использованием библиотек соединений требуют применения высокопроизводительных тест-систем, поскольку необходимо максимизировать количество соединений, исследованных за данный период времени. В таких тест-системах можно использовать интактные клетки, клеточные или мембранные фрагменты, содержащие SV2, а также безклеточные или немембранные системы, например, полученные из очищенных или полуочищенных белков. Преимущества использования при анализе мембранного фрагмента, содержащего SV2, или очищенных белков SV2 или пептидов состоит в том, что обычно можно не принимать во внимание клеточную токсичность и/или биодоступность анализируемого соединения. Указанный анализ преимущественно направлен на исследование воздействия лекарственного средства на молекуляр- 22010031 ную мишень, например, при ингибировани связывания двух молекул. Такой метод анализа можно использовать для исследования способности анализируемого агента или соединения ингибировать связывание меченого лиганда по изобретению с SV2 или фрагментом SV2, включающим LBS, или связываниеL059 или его производных или аналогов с SV2 или или фрагментом SV2, включающим LBS. Ингибирование комплексообразования можно определять различными методами, такими, как метод фильтрования на планшетах для быстрого фильтрования (Flashplates, фирма Perkin Elmer), анализ на сцинтилляционных гранулах (SPA, фирма Amersham Biosciences). SPA-Метод является эффективным высокопроизводительным методом анализа (HTS), в котором используются микрогранулы, покрытые биологическим мембранами и который позволяет исключить стадии отделения или промывки. В настоящей заявке описан метод применения соединений формулы I в качестве зонда для в составе низко- и высокопроизводительных тест-систем при анализе связывания с изоформой белка SV2, например, SV2C. Кроме того, различие между связыванием лигандов с SV2C и SV2A свидетельствует о возможности идентификации специфичных к изоформам соединений, которые можно использовать для лечения заболеваний за счет селективного воздействия на SV2A или SV2C. В лиганд для исследования SV2C можно ввести метку прямым или косвенным способом. В качестве метки можно использовать любую из химических групп, такую, как Н, флуоресцентная метка, биотин или фермент. Меченые лиганды можно также использовать для анализа конформационного состояния SV2 после солюбилизации, очистки и хроматографии. Кроме того, в настоящем изобретении предлагаются фотоактивируемые производные лигандов для введения метки и обнаружения в биологических образцах. Фотоактивируемые лиганды можно также использовать для локализации и выделения SV2 из тканей, изолированных клеток, субклеточных фракций и мембран. Фотоактивируемые лиганды можно также использовать для сшивания SV2 и идентификации лиганд-связывающих доменов LBS. Изобретение иллюстрируется следующими примерами. Если не указано иное, соединения, приведенные в примерах, идентифицировали следующими методами. Спектры ЯМР снимали на ЯМР-спектрофотометре Bruker AC 250 с фурье-преобразованием, снабженным компьютером Aspect 3000 и 5 мм датчиком двойного резонанса 1 Н/13 С, или на ЯМРспектрофотометре Bruker DRX 400 FT, снабженном компьютером SG Indigo2 и 5 мм датчиком тройного резонанса с обращенной геометрией 1 Н/13 С/15N. Соединения растворяли в ДМСО-d6 (или в CDCl3) при концентрации 20 мг/мл, температуре образца составляла 313 или 300 K. Прибор регистрирует сигнал дейтерия в ДМСО-d6 (или CDCl3). Химические сдвиги приведены в част./млн относительно ТМС в качестве внутреннего стандарта. Анализы методом ЖХВР проводили с использованием следующей системы: Система ЖХВР Agilent 1100, укомплектованная колонкой Inertsil ODS 3 С 18, 2504,6 мм, диаметр частиц 5 мкм, элюент: градиент от 100% растворителя А (ацетонитрил/вода/Н 3 РО 4, 5:95:0,001, об./об./об.) до 100% растворителя Б (ацетонитрил/вода/Н 3 РО 4, 95:5:0,001, об./об./об.), 6 мин, промывка 100% растворителем Б в течение 4 мин, скорость элюирования 2,5 мл/мин, температура 35 С. Система ЖХВР HP 1090, укомплектованная колонкой ЖХВР Waters Symetry С 18, 250 4,6 мм,элюент: градиент от 100% растворителя А (МеОН/вода/Н 3 РО 4, 15:85:0,001 М, об./об./М) до 100% растворителя Б (МеОН/вода/Н 3 РО 4, 85:15:0,001 М, об./об./М), 10 мин, промывка 100% растворителем Б в течение 10 мин, скорость элюирования 1 мл/мин, температура 40 С. Масс-спектрометрию проводили в системе ЖХ-МС в следующих условиях. Условия проведения ЖХВР Система ЖХВР Waters Alliance 1100, укомплектованная колонкой Inertsil ODS 3, 2504,6 мм, диаметр частиц 5 мкм, элюент: градиент от 100% растворителя А (ацетонитрил/вода/ТФУ, 10:90:0,1,об./об./об.) до 100% растворителя Б (ацетонитрил/вода/ТФУ, 90:10:0,1, об./об./об.), 7 мин, промывка 100% растворителем Б в течение 4 мин, скорость элюирования 2,5 мл/мин, расщепление потока 1/25 непосредственно перед источником API. Условия проведения МС Образцы растворяли в ацетонитриле/воде, 70:30, об./об., при концентрации 250 мкг/мл. СпектрыAPI (+ или -) снимали с использованием масс-спектрометра Finnigan LCQ (San Jose, CA, США) с ионной ловушкой. Температура источника APCI 450 С, а нагревателя капилляра 160 С. Источник ESI работает при 3,5 кВ, а температура нагревателя капилляра составляет 210 С. МС DIP/EI проводят в следующих условиях: Образцы испаряли при нагревании от 50 до 250 С в течение 5 мин. EI (электронный удар) регистрировали с использованием масс-спектрометра Finnigan TSQ 700 (San Jose, CA, США) с тандемквадрупольным анализатором. Источник температуры нагревался при 150 С. При проведении МС на масс-спектрометре TSQ 700 (фирма Finnigan MAT, San Jose, СА, США) с тандем-квадрупольным анализатором в режиме ГХ-МС использовали газовый хроматограф 3400 (фирмаVarian, Walnut Creek, CA, США), снабженном вводом пробы с делителем потока/без делителя потока и колонкой с плавленным силикагелем DB-5MS (15 м 0,25 мм вн.д., 1 мкм, фирма JW Scientific, Folsom,- 23010031(автосамплер СТС A200S) и соединительную линию нагревали при температуре 290 и 250 С, соответственно. Образец (1 мкл) вводили с использованием делителя потока, а температуру термостата программировали в следующем режиме: 50 С в течение 5 мин, увеличение до 280 С (23 С/мин) и выдерживали в течение 10 мин. Спектрометр TSQ 700 работал в режиме электронного удара (EI) или химической ионизации (Cl/CH4) (интервал масс 33-800 Да, время сканирования 1,00 с). Источник температуры нагревали при 150 С. Удельное вращение регистрировали на поляриметре Perkin-Elmer 341. Угол вращения регистрировали при 25 С в 1% растворе в МеОН. Из-за плохой растворимости некоторые соединения растворяли вCH2Cl2 или ДМСО. Температуру плавления определяли на плавильном столике Buchi 535 или Tottoli 545 или с использованием нагревателя Perkin Elmer DSC 7. Температуры приводятся без поправки. Препаративную хроматографию проводили на силикагеле 60 Мерк, размер частиц 15-40 мкм,кат.1.15111.9025, с использованием колонки Novasep с осевым сжатием (внутренний диаметр 80 мм),скорость элюирования от 70 до 150 мл/мин. Количество силикагеля и смеси растворителей описаны в конкретных методиках. Препаративную хиральную хроматографию проводили на колонке Daicel Chiralpak AD, 20 мкм,100500 мм, с использованием лабораторного оборудования. В качестве элюента использовали смеси низших спиртов и линейных, разветвленных или циклических С 5-С 8 алканов, при скорости элюирования 350 мл/мин. Смеси растворителей указаны в кокретных методиках. В примерах используются следующие сокращения:N-иодсукцинимид ТФУ трифторуксусная кислота ТГФ тетрагидрофуран Синтез соединений формулы (I) иллюстрируется следующими примерами. Пример 1. Синтез 4-замещенных 1-гидроксиметилпирролидин-2-онов Исходные пирролидоны синтезируют соответствующими методами, описанными в литературе (см.,например, Gouliaev A.H., Monster J.B., Vedso M., Senning A., Org. Prep. Proceed. Int., 27, 273-303 (1995 или описанными в заявке PCT WO 01/62726-A2. 1.1. 4-(2-Бром-2,2-дифторэтил)-1-гидроксиметилпирролидин-2-он (v (а 7) 1.1.1. Синтез метилового эфира 1-(4-метоксибензил)-5-оксопирролидин-3-карбоновой кислоты (a1) Синтез проводили в трехгорлой колбе объемом 250 мл, снабженной магнитной мешалкой и обратным холодильником, в атмосфере инертного газа. 4-Метоксибензиламин (10 мг, 73 ммоля, 1 экв.) и диметиловый эфир итаконовой кислоты (12,7 г, 81 ммоль, 1,1 экв.) растворяли в 100 мл МеОН. Затем смесь кипятили с обратным холодильником в течение 10 ч, медленно охлаждали до 20 С в течение 4 ч и концентрировали досуха. Неочищенное промежуточное соединение и 0,69 г (7,30 ммоля, 0,1 экв.) 2 гидроксипиридина растворяли в 200 мл толуола в трехгорлой колбе объемом 250 мл, снабженной магнитной мешалкой, колонкой с кольцами Рашига и насадкой для перегонки, в атмосфере инертного газа. Смесь кипятили с обратным холодильником в течение 8 ч, полностью удаляя образующийся метанол перегонкой. Температуру смеси поднимали до 112 С. Затем смесь охлаждали и концентрировали досуха,при этом получали неочищенный сложный эфир. Продукт очищали хроматографией на колонке с силикагелем (элюент: AcOEt/н-гексан, 1:1, об./об.), при этом получали очищенный эфир al (16,48 г, 85,9%). 1 Н-ЯМР (250 МГц, C2D6SO):2,40-2,60 (m, 2H), 3,25-3,50 (m, 3 Н), 3,60 (s, 3 Н), 3,75 (s, 3 Н), 4,20- 24010031 1.1.2. Синтез 4-гидроксиметил-1-(4-метоксибензил)пирролидин-2-она (а 2) Синтез проводили в трехгорлой колбе объемом 250 мл, снабженной магнитной мешалкой и обратным холодильником, в атмосфере инертного газа. Раствор 8,48 г (32 ммоля, 1 экв.) метилового эфира 1(4-метоксибензил)-5-оксопирролидин-3-карбоновой кислоты (a1) в 120 мл EtOH охлаждали до 0 С, а затем медленно порциями добавляли твердый NaBH4 (3,6 г, 96 молей, 3 экв.) в течение 1,5 ч, поддерживая температуру от 2 до 4 С. Через 2 ч температуру поднимали до 12 С в течение 1 ч, а затем снова понижали до 2-4 С. К смеси добавляли по каплям насыщенный раствор NH4Cl (240 мл) в течение 1 ч, а затем 120 мл ацетона и смесь выдерживали при комнатной температуре в течение ночи. Смесь трижды экстрагировали CH2Cl2, экстракт сушили над MgSO4, фильтровали и концентрировали в вакууме, при этом получали неочищенный спирт, который очищали хроматографией на силикагеле (элюент:CH2Cl2/МеОН, 95:5, об./об.), при этом получали очищенный спирт а 2 (4,3 г, 57%). 1 Н-ЯМР (250 МГц, C2D6SO):2,15 (1 Н, dd, J 7,4), 2,40-2,60 (m, 2 Н), 2,95 (1 Н, dd, J 3,7, 9,2), 3,253,50 (m, 3 Н+сигнал растворителя), 3,70 (s, 3 Н), 4,20 (1 Н, d, J 13,8), 4,35 (1 Н, d, J 13,8), 4,65 (1 Н, t, J 4,6),6,87 (2H, d, J 7,4), 7,20 (2H, d, J 7,4). 1.1.3. Синтез 1-(4-метоксибензил)-5-оксопирролидин-3-карбальдегида (а 3) Раствор 4-гидроксиметил-1-(4-метоксибензил)пирролидин-2-она (а 2) (4,3 г, 0,018 моля) и Et3N (8,9 мл) в 25 мл CH2Cl2 в трехгорлой колбе в атмосфере аргона охлаждали до -10 С. Затем порциями добавляли пиридин/SO3 (10,1 г, 0,064 моля, 3 экв.) и температуру смеси поднимали до 1 С. Смесь выдерживали при -10 С в течение 3 ч, реакцию останавливали добавлением воды (100 мл) и трижды экстрагировалиCH2Cl2. Органическую фазу последовательно промывали 1 М раствором KHSO4, водой, солевым раствором, сушили над MgSO4, фильтровали и упаривали в вакууме, при этом получали неочищенный альдегид(а 3) (3,2 г, 87%). Продукт несколько раз высушивали азеотропной перегонкой с толуолом и использовали на следующей стадии. 1 Н-ЯМР (250 МГц, C2D6SO):2,45-2,60 (m, 2H), 3,25-3,55 (m, 3 Н), 3,75 (s, 3 Н), 4,30 (s, 2 Н), 6,80(2 Н, d, J 7,4), 7,20 (2 Н, d, J 7,4), 9,6 (s, 1H). 1.1.4. Синтез 4-(2,2-дифторвинил)-1-(4-метоксибензил)пирролидин-2-она (а 4) В раствор CF2Br2 (6,6 г, 0,031 моля) в 30 мл ТГФ в трехгорлой колбе в атмосфере аргона при -78 С добавляли (Me2N)3 Р (11,53 мл, 0,063 моля), при этом образуется осадок белого цвета, и смесь нагревали до комнатной температуры. Затем к предварительно полученной соли фосфония добавляли по каплям раствор 1-(4-метоксибензил)-5-оксопирролидин-3-карбальдегида (а 3) (3,7 г, 0,016 моля) в ТГФ (30 мл). Через 1 ч реакционную смесь фильтровали через целит и концентрировали в вакууме. Реакционную смесь разбавляли гексаном, промывали солевым раствором, сушили над MgSO4 и концентрировали в вакууме, при этом получали неочищенный олефин, который очищали хроматографией на колонке с силикагелем (элюент: CH2Cl2/МеОН, 99:1, об./об.), при этом получали 2,45 г дифторвинилпроизводного а 4(1H, d, J 15,0), 4,60 (1H, ddd, J 25,0, 7,5, 2,5), 6,86 (2H, d, J 7,4), 7,12 (2H, d, J 7,4). 1.1.5. Синтез 4-(2,2-дифторвинил)пирролидин-2-она (a5) В трехгорлую колбу объемом 200 мл, снабженную магнитной мешалкой, содержащую раствор 4(2,2-дифторвинил)-1-(4-метоксибензил)пирролидин-2-она (а 4) (1,8 г, 6,8 ммоля) в MeCN/Н 2 О (70 мл:110 мл) в атмосфере инертного газа при 4 С, добавляли нитрат церия/аммония (11,2 г, 0,02 моля, 3 экв.) и смесь выдерживали при 10 С в течение 5 ч. Затем реакционную смесь разбавляли водой, экстрагировалиAcOEt, сушили над MgSO4 и концентрировали в вакууме. Остаток разбавляли толуолом, твердое вещество отделяли фильтрованием и растворитель выпаривали. Остаток очищали хроматографией на силикагеле (элюент: CH2Cl2/МеОН, 99:1, об./об.), при этом получали фракцию А 1 (0,5 г целевого соединения) и фракцию Б (0,7 г смеси синтезированного промежуточного соединения и исходного материала). Фракцию Б в MeCN/Н 2 О (30 мл:50 мл) повторно обрабатывали нитратом церия/аммония (0,78 г) по вышеуказанной методике и продукт очищали, при этом получали фракцию А 2 (0,3 г). Объединенные фракции А 1+А 2 содержали 0,8 г 4-(2,2-дифторвинил)пирролидин-2-она (а 5) (81%), содержащего следы 4 метоксибензойной кислоты. ЖХ/МС: 148 (МН). 1.1.6. Синтез 4-(2-бром-2,2-дифторэтил)пирролидин-2-она (а 6) Синтез проводили в трехгорлой колбе объемом 50 мл, снабженной магнитной мешалкой, в атмосфере инертного газа. 4-(2,2-Дифторвинил)пирролидин-2-он (а 5) (0,1 г, 0,6 ммоля) в 10 мл раствора HBr в Н 2 О (62 мас.%) кипятили с обратным холодильником в течение 0,75 ч. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли водой, трижды экстрагировали CH2Cl2, экстракт сушили над MgSO4, фильтровали и концентрировали в вакууме, при этом получали 0,076 г 4-(2-бром-2,2 дифторэтил)пирролидин-2-она (а 6) (49%). ГХ/МС: 227/229 (М+ ). 1.1.7. Синтез 4-(2-бром-2,2-дифторэтил)-1-гидроксиметилпирролидин-2-она (а 7) В следующем примере описано гидроксиметилирование производного пирролидин-2-она. Синтез проводили в трехгорлой колбе объемом 50 мл, снабженной магнитной мешалкой, в атмо- 25010031 сфере инертного газа. Раствор 4-(2-бром-2,2-дифторэтил)пирролидин-2-она (а 6) (0,46 г, 2 ммоля), параформальдегида (0,12 г) и TMSC1 (10 мл) нагревали при 60 С в течение 1 ч. Реакционную смесь упаривали, при этом получали неочищенный 4-(2-бром-2,2-дифторэтил)-1-гидроксиметилпирролидин-2-он (а 7)(0,48 г, 92%). 1 Н-ЯМР (250 МГц, C2D6SO):2,10-2,23 (m, 1H), 2,40-2,80 (m, 4H + сигнал растворителя), 3,21 (1 Н,dd, J 10,0, 7,5), 3,57 (1H, dd, J 10,0, 7,5), 4,53 (1 Н, d, J 10,0), 4,60 (1H, d, J 10,0). Следующие соединения получали аналогично тому, как описано выше: 1-(гидроксиметил)-4-(3,4,5-трифторфенил)пирролидин-2-он,1-гидроксиметил-4-пропилпирролидин-2-он,1-гидроксиметил-4-фенилпирролидин-2-он,4-(3-хлорфенил)-1-гидроксиметилпирролидин-2-он,4-(3-фторфенил)-1-гидроксиметилпирролидин-2-он,4-(4-хлорфенил)-1-гидроксиметилпирролидин-2-он,4-(4-фторфенил)-1-гидроксиметилпирролидин-2-он,4-(3,5-дифторфенил)-1-гидроксиметилпирролидин-2-он,1-(гидроксиметил)-4-(2,3,5-трифторфенил)пирролидин-2-он,1-(гидроксиметил)-4-(2,3,4-трифторфенил)пирролидин-2-он,4-(3-хлор-4-фторфенил)-1-гидроксиметилпирролидин-2-он,4-(3,4-дифторфенил)-1-гидроксиметилпирролидин-2-он,1-гидроксиметил-4-(2,4,5-трифторфенил)пирролидин-2-он,4-(3-азидо-2,4,6-трифторфенил)-1-гидроксиметилпирролидин-2-он. 1.2. Синтез 4-(3-азидо-2,4-дифторфенил)-1-гидроксиметилпирролидин-2-она (а 15) 1.2.1. Синтез (4-бром-2,6-дифторфенил)пирролидин-1-илдиазена (а 8) В раствор 4-бром-2,6-дифторанилина (5,45 г, 0,026 моля) в эфире в трехгорлой колбе объемом 200 мл, снабженной магнитной мешалкой, в атмосфере инертного газа при -5 С добавляли HCl (13 М, 10 мл). Затем осторожно добавляли раствор NaNO2 (3,62 г, 0,056 моля) в воде (8 мл), поддерживая темературу ниже 0 С. Смесь выдерживали при 0 С в течение 0,5 ч, затем реакционную смесь быстро разделяли, и органический слой добавляли к раствору пирролидина (8,8 мл) в KОН (2 М, 66 мл), охлажденному до-15 С, при этом температура смеси повышалась максимум до -10 С. Смесь нагревали до 0 С в течение 0,5 ч, экстрагировали эфиром, органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенный триазен очищали хроматографией на силикагеле (элюент: CH2Cl2/гексан, 30:70,об./об.), при этом получали 5,46 г (4-бром-2,6-дифторфенил)пирролидин-1-илдиазена (а 8) (73%). ГХ/МС: 289/291 (М+). 1.2.2. Синтез 6-бром-2,4-дифтор-3-(пирролидин-1-илазо)бензальдегида (а 9) В раствор диизопропиламида (2 М в ТГФ, 12,5 мл) в трехгорлой колбе объемом 200 мл, снабженной магнитной мешалкой, в атмосфере инертного газа при -78 С добавляли раствор (4-бром-2,6 дифторфенил)пирролидин-1-илдиазена (а 8) (6,06 г, 0,021 моля) в ТГФ (50 мл) и смесь выдерживали при указанной температуре в течение 2 ч. Затем к раствору зеленого цвета добавляли сухой ДМФА (3,2 мл),через 2 ч смесь выливали в воду (200 мл), экстрагировали эфиром (3200 мл), органическую фазу сушили над MgSO4, фильтровали и концентрировали в вакууме, при этом получали неочищенный альдегид а 9(6,62 г, 99%). ГХ/МС: 317/319 (М+). 1.2.3. Синтез этилового эфира 3-[6-бром-2,4-дифтор-3-(пирролидин-1-илазо)фенил]акриловой кислоты (а 10) Синтез проводили в трехгорлой колбе объемом 0,3 л, снабженной магнитной мешалкой и капельной воронкой, в атмосфере инертного газа. 6-Бром-2,4-дифтор-3-(пирролидин-1-илазо)бензальдегид (а 9)(6,62 г, 20,8 ммоля, 1 экв.) растворяли в ТГФ (100 мл) и охлаждали до 0 С. Затем при интенсивном перемешивании добавляли этиловый эфир (трифенилфосфоранилиден)уксусной кислоты (9,43 г, 1,3 экв.),при этом температура повышалась до 10 С. Затем смесь перемешивали при 10 С в течение 1 ч, затем при комнатной температуре в течение ночи. Смесь концентрировали досуха, остаток суспендировали в диэтиловом эфире, оксид трифенилфосфина отделяли фильтрованием и фильтрат концентрировали досуха. Остаток очищали препаративной ЖХ на силикагеле (элюент: CH2Cl2/пентан, 50:50, об./об.), при этом получали 4,17 г очищенного этилового эфира 3-[6-бром-2,4-дифтор-3-(пирролидин-1 илазо)фенил]акриловой кислоты (а 10) (47%). ГХ/МС: 387/389 (М+). 1.2.4. Синтез этилового эфира 3-[6-бром-2,4-дифтор-3-(пирролидин-1-илазо)фенил]-4 нитромасляной кислоты (a11) Синтез проводили в трехгорлой колбе объемом 500 мл, снабженной обратным холодильником, магнитной мешалкой и капельной воронкой, в атмосфере инертного газа. Этиловый эфир 3-[6-бром-2,4 дифтор-3-(пирролидин-1-илазо)фенил]акриловой кислоты (а 10) (10,14 г, 26 ммолей,1 экв.) растворяли в 25 мл нитрометана. Затем при интенсивном перемешивании добавляли по каплям диазабициклоундецен(4 мл, 1 экв.), поддерживая температуру смеси ниже 25 С (на ледяной бане). Смесь ярко-красного цвета перемешивали при комнатной температуре в течение ночи, разбавляли диэтиловым эфиром, промывали 1 н. HCl и водную фазу дважды реэкстрагировали этиловым эфиром. Объединенные органические фазы сушили над MgSO4, фильтровали и концентрировали досуха,при этом получали 12,6 г неочищенного нитроэфира. Остаток очищали хроматографией на силикагеле(элюент: CH2Cl2/пентан, 50:50, об./об.), при этом получали 10,6 г этилового эфира 3-[6-бром-2,4-дифтор 3-(пирролидин-1-илазо)фенил]-4-нитромасляной кислоты (a11) (91%). ЖХ/МС: 449/451 (МН+). 1.2.5. Синтез 4-[2,4-дифтор-3-(пирролидин-1-илазо)фенил]пирролидин-2-она (а 13) Синтез проводили а автоклаве объемом 500 мл в атмофере инертного газа. Этиловый эфир 3-[6 бром-2,4-дифтор-3-(пирролидин-1-илазо)фенил]-4-нитромасляной кислоты (a11) (6,29 г, 14 ммолей) иEt3N (5,9 мл) растворяли в 120 мл этанола, добавляли суспензию предварительно высушенного трехкратной промывкой этанолом никеля Ренея (6 г) и смесь гидрировали в аппарате Парра при давлении водорода максимум 20 фунт./кв.дюйм, (реакция высоко экзотермическая, поэтому смесь необходимо охлаждать на ледяной бане). Смесь дегазировали, фильтровали через слой целита/норита и фильтрат концентрировали в вакууме, при этом получали 6,2 г неочищенного продукта. Продукт повторно гидрировали в аппарате Парра для удаления брома в присутствии вместо никеля Ренея 0,59 г Pd/C при давлении водорода максимум 40 фунт./кв.дюйм в течение 0,75 ч. Неочищенный аминоэфир очищали хроматографией на силикагеле (элюент: CH2Cl2/EtOH/NH4OH, 94,5:5:0,5, об./об./об.), при этом получали 3,6 г этилового эфира 4-амино[2,4-дифтор-3-(пирролидин-1-илазо)фенил]масляной кислоты (а 12) (выход 76%), который использовали на следующей стадии. ЖХ/МС: 341 (МН+). В колбе объемом 100 мл, снабженной обратным холодильником и магнитной мешалкой, растворяли 1,03 г (3 ммоля) аминоэфира (а 12) в 10 мл толуола и смесь кипятили с обратным холодильником в течение 16 ч. Затем раствор концентрировали досуха, при этом получали 0,82 г (92%) очищенного 4-[2,4 дифтор-3-(пирролидин-1-илазо)фенил]пирролидин-2-она (а 13). ГХ/МС: 294 (М+). 1.2.6. Синтез 4-(3-азидо-2,4-дифторфенил)пирролидин-2-она (а 14) В раствор 4-[2,4-дифтор-3-(пирролидин-1-илазо)фенил]пирролидин-2-она (а 13) (0,2 г, 0,68 ммоля) иHCl (1 н., 10 мл) в трехгорлой колбе объемом 25 мл, снабженной магнитной мешалкой, при комнатной температуре в атмосфере инертного газа добавляли NaN3 (0,133 г, 2 ммоля). Смесь выдерживали в течение 1,5 ч, реакцию останавливали добавлением NaOH (1 н.,10 мл), трижды экстрагировали CH2Cl2, органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме, при этом получали неочищенный 4-(3-азидо-2,4-дифторфенил)пирролидин-2-он (а 14), который использовали на следующей стадии. ГХ/МС: 238 (М+). 1.2.7. Синтез 4-(3-азидо-2,4-дифторфенил)-1-гидроксиметилпирролидин-2-она (а 15) В следующем примере описано гидроксиметилирование производных пирролидин-2-она. Синтез проводили в трехгорлой колбе объемом 50 мл, снабженной магнитной мешалкой, в атмосфере инертного газа. Раствор 4-(3-азидо-2,4-дифторфенил(пирролидин-2-она (а 14) (1,84 г, 7,73 ммоля) и формальдегида (35 мас.% в воде, 2,3 г) и NaOH (0,015 г) в EtOH (20 мл) нагревали при 60 С в течение 3 ч. Реакционную смесь упаривали и высушивали азеотропной перегонкой с толуолом, при этом получали неочищенный спирт, который очищали хроматографией на силикагеле (элюент: CH2Cl2/МеОН, 98:2,об./об.), при этом получали 4-(3-азидо-2,4-дифторфенил)-1-гидроксиметилпирролидин-2-он (а 15) (1,64 г,79%). ГХ/МС: 268 (М+). Пример 2. Синтез 1-имидазол-1-илметилпирролидин-2-онов из 1-гидроксиметилприролидин-2-онов 2.1. Синтез 4-(3-азидо-2,4-дифторфенил)-1-имидазол-1-илметилпирролидин-2-она с использованием -хлоренаминов В следующем примере описан синтез производных 1-имидазол-1-илметилпирролидин-2-она. Синтез проводили в трехгорлой колбе объемом 100 мл, снабженной магнитной мешалкой, в атмосфере инертного газа. В раствор 4-(3-азидо-2,4-дифторфенил)-1-гидроксиметилпирролидин-2-она (а 15)(1,9 г, 7,08 ммоля) в CH2Cl2 (45 мл) при 0 С добавляли перегнанный тетраметилхлоренамин (1,1 мл, 8,5 ммоля) и смесь перемешивали в течение 3,5 ч. Затем смесь переносили пипеткой в другую трехгорлую колбу, снабженную магнитной мешалкой, содержащую в атмосфере инертного газа при комнатной температуре раствор имидазола (2,4 г, 35,4 ммоля) в CH2Cl2 (45 мл) и температуру смеси поднимали до 28 С, при этом наблюдалось образованием осадка. Через 1 ч реакционную смесь фильтровали, упаривали в вакууме, разбавляли CH2Cl2, органический слой промывали водой, сушили над MgSO4, фильтровали и упаривали в вакууме. Остаток очищали хроматографией на силикагеле (элюент: CH2Cl2/EtOH/NH4OH,93,5:6:0,5, об./об.), при этом получали 4-(3-азидо-2,4-дифтофенил)-1-имидазол-1-илметилпирролидин-2 он (5) (1,66 г, 75%). Рацемат разделяли препаративной хиральной хроматографией (колонка: ChiralpakAD, элюент: петролейный эфир/EtOH), энантиомеры перекристаллизовывали из толуола и AcOEt, при этом получали два энантиомера в виде твердого вещества белого цвета: 6 (первая фракция, 0,5 г) и 7(вторая фракция, 0,45 г). ЖХ/МС: 319 (МН+). В другом варианте полученную смесь изомеров (рацемат, региоизомер и т.п.) разделяли препаративной ЖХВР на силикагеле или на хиральной фазе. 2.2. Синтез 1-[(4-хлор-1 Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-она (72) с использованием тионилхлорида Кроме метода 2.1, производные 1-имидазол-1-илметилпирролидин-2-она можно также получить по аналогичной реакции гидроксиметильных производных с тионилхлоридом в толуоле прн комнатной температуре в течение 16 ч, с последующим взаимодействием хлорметил-производного с имидазолом в присутствииEt3N при комнатной температуре. Например,1-гидроксиметил-4-(3,4,5 трифторфенил)пирролидин-2-он обрабатывают тионилхлоридом и 4-хлоримидазолом, при этом получают 1-[(4-хлор-1 Н-имидазол-1-ил)метил]-4-(3,4,5-трифторфенил)пирролидин-2-он (72). ЖХ/МС: 330/332 (МН+). 2.3. Синтез 4-(2,2-дифторвинил)-1-(1 Н-имидазол-1-илметил)пирроллидин-2-она (18) модификацией функциональной группы Синтез проводили в трехгорлой колбе объемом 50 мл, снабженной магнитной мешалкой, в атмосфере инертного газа. 4-(2-Бром-2,2-дифторэтил)-1-(1 Н-имидазол-1-илметил)пирроллидин-2-он (17)(0,16 г, 0,52 ммоля) и диазабицикло[5.4.0]ундец-7-ен (0,1 мл, 0,62 ммоля) в CHCl3 (0,5 мл) перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь фильтровали, упаривали в вакууме, разбавляли CH2Cl2, органический слой промывали водой, сушили над MgSO4, фильтровали и упаривали в вакууме. Остаток очищали хроматографией на силикагеле (элюент: CH2Cl2/EtOH/NH4OH,93,5:6:0,5, об./об./об.), при этом получали 4-(2,2-дифторвинил)-1-(1 Н-имидазол-1-илметил)пирроллидин 2-он (18) (0,092 г, 80%), который кристаллизовали из ТГФ в виде малеата. ЖХ/МС: 228 (МН+). В другом варианте для синтеза производных 1-имидазол-1-илметилпирролидин-2-она используют модификацию других функциональных групп.(а) Производные метилтиоимидазола можно окислить с использованием NaIO4 в МеОН (например,для синтеза 1-[2-(метилсульфинил)-1 Н-имидазол-1-ил]метил-4-пропилпирролидин-2-она (21.(б) Из метилового эфира 1 Н-имидазол-2-карбоновой кислоты можно получить соответствующие амиды (по реакции с амином в МеОН, например, для синтеза 1-[(2-оксо-4-пропилпирролидин-1 ил)метил]-1 Н-имидазол-2-карбоксамида (26 или соответствующий спирт (восстановлением NaBH4 в МеОН, например для синтеза 1-[2-(гидроксиметил)-1 Н-имидазол-1-ил]метил-4-пропилпирролидин-2 она (37.(в) Нитроимидазол можно восстановить водородом в присутствии Pd/C с образованием соответствующих аминоимидазолов (например, для синтеза 1-[(2-амино-1 Н-имидазол-1-ил)метил]-4 пропилпирролидин-2-она (42. Такие модификации известны любому специалисту по органическому синтезу. 3.1. Синтез 4-бром-N-(1-гидроксициклопропил)бутирамида (а 16) В трехгорлую колбу объемом 50 мл, снабженную магнитной мешалкой, содержащую суспензию гидрохлорида аминоциклопропанола (1,0 г, 9,13 ммоля, синтезированного по методу, описанному в статье Matthies D., Buechling U., Arch. Pharm. (Weinheim Ger.), 316, 598-608 (1983 и Et3N (2,21 г, 0,022 моля) в сухом ТГФ (20 мл) в атмосфере инертного газа при 0 С добавляли 4-бромбутирилхлорид (1,69 г,9,13 ммолей). Через 4 ч реакционную смесь выдерживали на бане с сухим льдом в течение ночи, добавляли вторую порцию 4-бромбутирилхлорида (0,34 г) и Et3N (0,44 г) и выдерживали при комнатной температуре в течение 2 ч. Затем реакционную смесь охлаждали до 0 С, фильтровали и концентрировали в вакууме, при этом получали неочищенный 4-бром-N-(1-гидроксициклопропил)бутирамид (а 16), который использовали на следующей стадии без дополнительной очистки. 3.2. Синтез 4-бром-N-(1-имидазол-1-илциклопропил)бутирамида (а 18) В трехгорлую колбу объемом 50 мл, снабженную магнитной мешалкой, содержащую неочищенный 4-бром-N-(1-гидроксициклопропил)бутирамид (а 16) (2,3 г, 9,13 ммоля) в CHCl3 (20 мл) в атмосфере инертного газа добавляли тионилхлорид (2,72 г, 0,023 моля) и смесь выдерживали при комнатной температуре в течение 3 ч. Затем смесь светло-оранжевого цвета упаривали, разбавляли ТГФ (5 мл) и добавляли в другую трехгорлую колбу объемом 50 мл, снабженнуюй магнитной мешалкой, содержащую раствор имидазола (0,622 г, 9,1 ммоля) и Et3N (2,8 г) в ТГФ (20 мл) в атмосфере инертного газа при комнатной температуре. Через 6 ч реакционную смесь охлаждали до 0 С, фильтровали и концентрировали в вакууме, при этом получали неочищенный 4-бром-N-(l-имидазол-1-илциклопропил)бутирамид (а 18) (2,76 г),который использовали на следующей стадии без дополнительной очистки. 3.3. Синтез 1-[1-(1 Н-имидазол-1-ил)циклопропил]пирролидин-2-она (23) Синтез проводили в трехгорлой колбе объемом 50 мл, снабженной магнитной мешалкой, в атмосфере инертного газа. Неочищенный 4-бром-N-(1-имидазол-1-илциклопропил)бутирамид (а 18) (2,76 г),K2 СО 3 (1,26 г, 9,1 ммоля) и KI (0,0075 г) в ДМФА (25 мл) нагревали при 60 С в течение 3 ч и при 80 С в течение 17 ч, охлаждали до комнатной температуры и концентрировали в вакууме. Реакционную смесь разбавляли CH2Cl2, фильтровали и концентрировали в вакууме, при этом получали неочищенный пирролидон (1,7 г). Остаток очищали хроматографией на силикагеле (элюент: CH2Cl2/MeOH/NH4OH,95:4,5:0,5, об./об./об.) и после обработки HCl в эфире (1 экв.) и перекристаллизации из MeCN получали гидрохлорид 1-[1-(1 Н-имидазол-1-ил)циклопропил]пирролидин-2-она (23) (0,033 г, 7,5%). ЖХ/МС: 192(МН+). Пример 4. Синтез и получение производных этилового эфира имидазол-1-ил(2-оксо-4 пропилпирролидин-1-ил)уксусной кислоты- 29010031 4.1. Синтез этилового эфира гидрокси(2-оксо-4-пропилпирролидин-1-ил)уксусной кислоты (а 19) Синтез проводили в трехгорлой колбе объемом 250 мл, снабженной магнитной мешалкой, в атмосфере инертного газа. Смесь 4-пропилпирролидин-2-она (0,5 г, 3,9 ммоля) и этилового эфира глиоксиловой кислоты (50% раствор в толуоле, 2,4 мл, 11 ммолей) в ацетоне нагревали при 60 С в течение 6 ч, добавляли вторую порцию этилового эфира глиоксиловой кислоты (0,4 мл) и смесь нагревали при 50 С в течение 17 ч. Реакционную смесь концентрировали в вакууме, при этом получали неочищенный этиловый эфир гидрокси(2-оксо-4-пропилпирролидин-1-ил)уксусной кислоты (а 19, 2,02 г), который использовали на следующей стадии без дополнительной очистки. 1 Н-ЯМР (250 МГц, CDCl3):0,92 (3 Н, t, J 7,5), 1,25-1,50 (7 Н, m), 2,10-2,25 (1 Н, m), 2,25-2,50 (m,1 Н), 2,58 (1 Н, dd, J 10,0, 7,5), 2,85 (1 Н, dd, J 10,0, 7,5, один из диастереоизомеров), 3,17 (1 Н, dd, J 7,5, 7,5,один из диастереоизомеров), 3,20 (1H, dd, J 10,0, 7,5, один из диастереизомеров), 3,63 (1 Н, dd, J 7,5, 7,5,один из диастереоизомеров), 4,32 (2 Н, q, J 7,5), 5,75 (1 Н, s). 4.2. Синтез этилового эфира имидазол-1-ил(2-оксо-4-пропилпирролидин-1-ил)уксусной кислоты(а 20) Неочищенный этиловый эфир гидрокси(2-оксо-4-пропилпирролидин-1-ил)уксусной кислоты (а 19)(0,901 г, 3,9 ммоля) и карбонилдиимидазол (0,95 г, 5,9 ммоля) в MeCN (20 мл) в трехгорлой колбе объемом 50 мл, снабженной магнитной мешалкой, в атмосфере инертного газа выдерживали при комнатной температуре в течение 48 ч, а затем смесь концентрировали в вакууме. Реакционную смесь разбавляли 0,1 М HCl и экстрагировали CH2Cl2. Водный слой подщелачивали до рН 9 добавлением твердого Na2CO3,экстрагировали CH2Cl2, сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (элюент: CH2Cl2/МеОН/NH4OH, 96:3,6:0,4, об./об./об.), при этом получали этиловый эфир имидазол-1-ил(2-оксо-4-пропилпирролидин-1-ил)уксусной кислоты (а 20) (0,8 г,82%). ЖХ/МС: 280 (МН+). 4.3. Синтез 1-(2-гидрокси-1-имидазол-1-илэтил)-4-пропилпирролидин-2-она (39) В раствор этилового эфира имидазол-1-ил(2-оксо-4-пропилпирролидин-1-ил)уксусной кислоты(а 20) (9,4 г, 0,034 ммоля) в сухом EtOH (200 мл) в трехгорлой колбе объемом 500 мл, снабженной магнитной мешалкой, при комнатной температуре в атмосфере инертного газа при 0 С порциями добавлялиNaBH4 (1,92 г, 0,05 моля). Через 2,5 ч реакционную смесь осторожно нейтрализовали добавлением насыщенного раствора NH4Cl и температуру повышали до 10 С. Растворитель выпаривали досуха, остаток очищали хроматографией на силикагеле (элюент: CH2Cl2/МеОН, 95:5, об./об.), при этом получали 1-(2 гидрокси-1-имидазол-1-илэтил)-4-пропилпирролидин-2-он (39) (5,47 г, 68%). ЖХ/МС: 238 (МН+). 4.4. Синтез 1-(2-азидо-1-имидазол-1-илэтил)-4-пропилпирролидин-2-она (71) В раствор 1-(2-гидрокси-1-имидазол-1-илэтил)-4-пропилпирролидин-2-она (39) (0,5 г, 2,1 ммоля) иEt3N (0,59 мл) в CH2Cl2 (10 мл) в трехгорлой колбе объемом 50 мл, снабженной магнитной мешалкой, в атмосфере инертного газа при 0 С добавляли мезилхлорид (0,36 г, 3,2 ммоля) и смесь перемешивали при 0 С в течение 1 ч. Затем к суспензии белого цвета добавляли насыщнный раствор K2 СО 3, экстрагировалиCH2Cl2, органический слой сушили над MgSO4, фильтровали и концентировали в вакууме, при этом получали мезилат (а 21), который использовали на следующей стадии. Неочищенный мезилат (а 21) (0,6 г, 0,002 моля), NaN3 (0,178 г, 0,002 моля) и NaI (0,17 г) в MeCN (5 мл) в трехгорлой колбе объемом 50 мл, снабженной магнитной мешалкой, в атмосфере инертного газа нагревали при 60 С в течение 1,5 ч, выдерживали при комнатной температуре в течение ночи, нагревали при 60 С в течение еще 4 ч, охлаждали до комнатной температуры и концентрировали в вакууме. Реакционную смесь разбавляли CH2Cl2, фильтровали и концентрировали в вакууме, при этом получали неочищенный азид, который очищали хроматографией на силикагеле (элюент: CH2Cl2/MeOH/NH4OH,95:4,5:0,5, об./об./об.), при этом получали 1-(2-азидо-1-имидазол-1-илэтил)-4-пропилпирролидин-2-он 5.1. Синтез 5-хлор-1-гидроксиметил-1,3-дигидроиндол-2-она (а 22) 5-Хлор-1,3-дигидроиндол-2-он (5 г, 0,029 моля), параформальдегид (1,07 г) и толуол (60 мл) нагревали в автоклаве для высокого давления при 120 С в течение 4 ч. Смесь охлаждали до комнатной температуры, разбавляли эфиром и фильтровали, при этом получали 5-хлор-1-гидроксиметил-1,3 дигидроиндол-2-он (а 22) в виде кристаллов белого цвета (4,03 г, 70%). 1 Н-ЯМР (250 МГц, C2D6SO):3,61 (2 Н, s), 5,04 (2 Н, d), 6,26 (1 Н, t), 7,08 (1 Н, d), 7,29-7,34 (2 Н, m). Следующие соединения получали аналогично тому, как описано выше: 1-(гидроксиметил)-1,3-дигидро-2 Н-индол-2-он,4-хлор-1-гидроксиметил-1,3-дигидроиндол-2-он,4-фтор-1-гидроксиметил-1,3-дигидроиндол-2-он,- 30
МПК / Метки
МПК: C07D 403/08, C07D 403/06, C07D 207/26, A61P 25/08, A61K 31/4025
Метки: применения, имидазола, производные, способы, получения
Код ссылки
<a href="https://eas.patents.su/30-10031-proizvodnye-imidazola-sposoby-ih-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные имидазола, способы их получения и применения</a>
Предыдущий патент: Зубная паста
Следующий патент: Расклинивающая смесь, способ ее формирования и способ разрыва геологической формации
Случайный патент: Способ получения гомополимера или сополимера этилена с самопроизвольной нуклеацией












