Амиды замещённых 3-аминотиено [2,3-b] пиридин-2-карбоновых кислот, способы их получения и применения
Номер патента: 8706
Опубликовано: 29.06.2007
Авторы: Ву Яньпин, Эми Джонатан, Хики Юджин, Хао Минхон, Немото Питер, Сунь Сансин, Сайуин Чарлз Л., Маршалл Даниел Ричард, Лю Вэйминь, Моруик Тина, Чэнь Чжидон, Сорсек Роналд Джон, Флек Роман Вольфганг
Формула / Реферат
1. Соединение формулы (I)
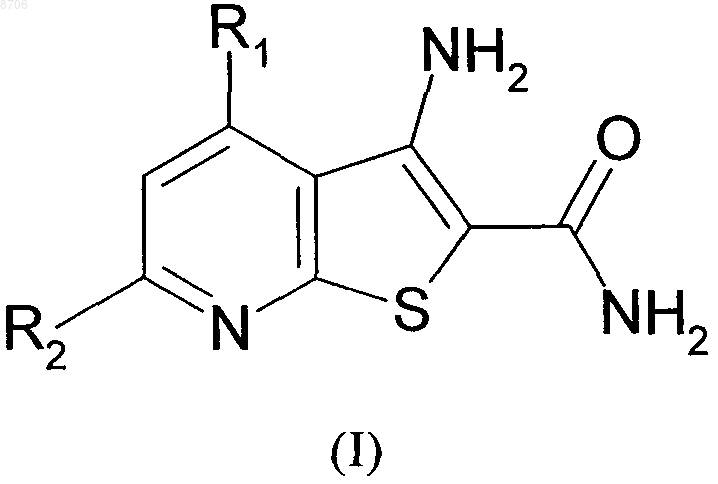
в которой:
R1 представляет собой
(а) фенил или пирролил, необязательно замещенный одним или двумя радикалами R3,
(в) R6OCH2-,
(г) R6(CH2)mNH-,
(д) R6(CH2)p(CH=CH)m-,
(е) (С1-С6)алкил, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R9,
(ж) (С1-С8)алкокси, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R9, или
(и) -N(R4)(R5);
R2 представляет собой
(а) (С1-С6)алкил, необязательно замещенный радикалом R10,
(в) (С1-С6)алкиламино, необязательно замещенный радикалом R10,
(г) гетероциклил, выбранный из 1-пиперидинила, 1-пиперазинила, 4-морфолинила, 1-пирролидинила, 1,4-диазациклогептан-1-ила, 1-азепанила и 4-тиоморфолино и необязательно замещенный радикалами R7 в количестве от одного до трех, или
(e) -N(R4)(R5);
R3 выбирают из (С1-С6)алкила, (С1-С6)алкокси, галогена, -CN, -СО2Н, -СO2(С1-С6)алкила, -S(O)n(С1-С6)алкила, -NO2, -ОН, -CF3;
R4 и R5 независимо выбирают из Н, (С1-С6)алкила, пиридила, бензила и фенилэтила;
R6 представляет собой фенильную группу, необязательно замещенную одной или двумя группами, выбранными из (С1-С6)алкила, СO2(С1-С6)алкила, C(O)NR4R5, -SO2NH2, -NO2, -ОН и (С1-С6)алкокси, или R6 представляет собой нафталин-2-ил, нафталин-1-ил или 2-тиенил;
R7 выбирают из -ОН, -CN, оксо, -СO2(С1-С6)алкила, -C(O)N(R4)(R5), -N(R4)(R5), -CH2N(R4)(R5), (С1-С6)алкила, -C(O)(C1-C6)aлкилN(R4)(R5), -S(O)n(С1-С6)алкила, H2NCH(R8)C(O)-, HO(CH2)mCH2CH (NH2)C(O)-, HOCH(R6)CH2NH- и -С(O)гетероциклила, где указанный гетероциклил выбирают из пиперидинила, или R7 представляет собой 2-гидроксиэтиламино, метилкарбамимидоил, гидроксиимино, гидразинокарбонил, сульфамоил, метансульфониламино, метилсульфонилгидразино, 2-гидроксипропиламино, 2,3-дигидроксипропиламино, 2-гидрокси-1-метилэтиламино, карбамоилметиламино, N'-фенилгидразино-карбонил или толуол-4-сульфониламино;
R8 выбирают из (С1-С6)алкила, -(CH2)1-4NH2, фенила или бензила;
R9 означает -ОН;
R10 означает -N(R4)(R5);
m означает 0 или 1;
n означает 0, 1 или 2 и
р означает 0, 1, 2 или 3;
а также фармацевтически приемлемые соли, сложные эфиры, таутомеры, индивидуальные изомеры и смеси изомеров этого соединения; при условии, что если R1 представляет собой фенил или пирролил, (С1-С6)алкил, -СF3, то в этом случае R2 не означает (С1-С6)алкил.
2. Соединение по п.1, в котором:
R1 представляет собой
(а) фенил, необязательно замещенный одним или двумя радикалами R3,
(в) R6OCH2-,
(г) R6(CH2)mNH-,
(д) R6(CH2)p(CH=CH)m-,
(е) (С1-С6)алкил, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R9,
(ж) (С1-С6)алкилОН,
(з) -CF3,
(и) (С1-С8)алкокси,
(к) -O(С1-С6)алкилОН или
(м) -N(R4)(R5);
R2 представляет собой гетероциклил, где гетероцикл выбирают из 1-пиперидинила, 1-пиперазинила, 4-морфолинила, 1-азепанила, 1-пирролидинила, 1,4-диазациклогептан-1-ила и 4-тиоморфолино, причем гетероциклил необязательно замещен радикалами R7 в количестве от одного до трех;
R3 выбирают из (С1-С6)алкила, (С1-С6)алкокси, галогена, -CN, -СO2Н, -СO2(С1-С6)алкила, -S(O)n(С1-С6)алкила, -NO2, -ОН, -CF3;
R4 и R5 независимо выбирают из Н, (С1-С6)алкила, пиридила, бензила и фенилэтила;
R6 представляет собой фенильную группу, необязательно замещенную одной или двумя группами, выбранными из (С1-С6)алкила, -СO2(С1-С6)алкила, -C(O)NR4R5, -SO2NH2, -NO2, -ОН и (С1-С6)алкокси, или R6 представляет собой нафталин-2-ил, нафталин-1-ил или 2-тиенил;
R7 выбирают из -ОН, -CN, оксо, -СO2(С1-С6)алкила, -C(O)N(R4)(R5), -N(R4)(R5), -CH2N(R4)(R5), (С1-С6)алкила, -C(O)(С1-С6)aлкилN(R4)(R5), -S(O)n(С1-С6)алкила, фенила, пиридила, H2NCH(R8)C(O)-, HO(CH2)mCH2CH(NH2)C(O)-, HOCH(R6)CH2NH- и -С(O)гетероциклила, где указанный гетероциклил выбирают из пиперидинила, или R7 представляет собой 2-гидроксиэтиламино, метилкарбамимидоил, гидроксиимино, гидразинокарбонил, сульфамоил, метансульфониламино, метилсульфонилгидразино, 2-гидроксипропиламино, 2,3-дигидроксипропиламино, 2-гидрокси-1-метилэтиламино, карбамоилметил-амино, N'-фенилгидразинокарбонил или толуол-4-сульфониламино;
R8 выбирают из (С1-С6)алкила, -(CH2)1-4NH2, фенила или бензила;
m означает 0 или 1;
n означает 0, 1 или 2 и
р означает 0, 1, 2 или 3;
а также фармацевтически приемлемые соли, сложные эфиры, таутомеры, индивидуальные изомеры и смеси изомеров этого соединения.
3. Соединение по п.1, в котором если R1 представляет собой (С1-С6)алкил, то он является незамещенным.
4. Соединение по п.1, в котором:
R1 представляет собой
(а) фенил, необязательно замещенный одним или двумя радикалами R3,
(б) R6CH=CH-,
(в) (С1-С6)алкил,
(г) -(С2-С3)алкил-ОН,
(д) -CF3,
(е) -(С1-С6)алкокси,
(ж) -ОС2-С3алкил-ОН;
R2 представляет собой гетероциклил, где гетероцикл выбирают из 1-пиперидинила, 1-пиперазинила, 1-азепанила и 1,4-диазациклогептан-1-ила, причем гетероциклил необязательно замещен радикалами R7 в количестве от одного до трех;
R3 выбирают из-СН3, -ОСН3, F, Cl, -CO2CH3, -SO2CH3 и -NO2;
R4 и R5 независимо выбирают из Н, -СН3 и бензила;
R6 представляет собой фенильную группу, необязательно замещенную одной или двумя группами, выбранными из Cl, F, (С1-С6)алкила, -CN, СO2(С1-С6)алкила, C(O)NR4R5, -SO2NH2, -NO2, -ОН, -NH2, -CF3 и (С1-С6)алкокси, или R6 представляет собой (С3-С6)циклоалкил, -СН2ОН, нафталин-2-ил, нафталин-1-ил или 2-тиенил;
R7 выбирают из -ОН, -CN, оксо, -СO2(С1-С6)алкила, -C(O)N(R4)(R5), -N(R4)(R5), -CH2N(R4)(R5), CH2OH, (С1-С6)алкила, -С(О)(C1-C6)aлкилN(R4)(R5), -NHC(O)N(R4)(R5), -S(O)n(С1-С6)алкила, H2NCH(R8)C(O)-, HO(CH2)mCH2CH(NH2)C(O)-, HOCH(R6)CH2NH- и -С(O)гетероциклила, где указанный гетероциклил выбирают из пиперидинила, или R7 представляет собой 2-гидроксиэтиламино, метилкарбамимидоил, гидроксиимино, гидразинокарбонил, сульфамоил, метансульфониламино, метилсульфонилгидразино, 2-гидроксипропиламино, 2,3-дигидроксипропиламино, 2-гидрокси-1-метилэтиламино, карбамоилметиламино, N'-фенилгидразинокарбонил или толуол-4-сульфониламино;
R8 выбирают из (С1-С6)алкила, -(CH2)1-4NH2, фенила или бензила;
а также фармацевтически приемлемые соли, сложные эфиры, таутомеры, индивидуальные изомеры и смеси изомеров этого соединения.
5. Соединение по п.4, в котором:
R1 представляет собой
(а) -СН2СН2СН3,
(б) -ОСН2СН3,
(д) -CF3;
R2 представляет собой гетероциклил, где гетероциклил выбирают из 1-пиперидинила и 1-пиперазинила, причем гетероциклил необязательно замещен радикалами R7 в количестве от одного до трех;
R4 и R5 независимо выбирают из Н, -СН3 и бензила;
R6 представляет собой фенильную группу, необязательно замещенную одной или двумя группами, выбранными из Cl, F, -СН3, -CN, -СО2СН3, -C(O)NR4R5, -NO2, -ОН, -NH2, -CF3 и -СН3, или R6 представляет собой нафталин-2-ил, нафталин-1-ил или 2-тиенил;
R7 выбирают из -ОН, -CN, оксо, -C(O)NH2, -NH2, -CH2NH2, -CH3, -NHC(O)NH2, H2NCH(R8)C(O)-, HOCH(R6)CH2NH- или R7 представляет собой 2-гидроксиэтиламино, метилкарбамимидоил, метансульфониламино, метилсульфонилгидразино, 2-гидроксипропиламино, 2,3-дигидроксипропиламино, карбамоилметиламино или N'-фенилгидразинокарбонил;
R8 представляет собой -(CH2)1-4NH2;
а также фармацевтически приемлемые соли, сложные эфиры, таутомеры, индивидуальные изомеры и смеси изомеров этого соединения.
6. Соединение, выбранное из группы, состоящей из следующих соединений:
амид 3-амино-6-(4-оксопиперидин-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-амино-4-цианопиперидин-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-(4-метансульфонилфенил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-метилсульфанилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-((Е)-стирил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-(4-нитрофенил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[1,4]диазепан-1-ил-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-[(Е)-2-(4-метоксифенил)винил]тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(2-аминометилпиперидин-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-трифторметилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-пиперазин-1-ил-4-трифторметилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-((Е)-2-n-толилвинил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[4-(2,3-дигидроксипропиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[4-(2-гидроксиэтиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-((Е)-2-м-толилвинил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-метансульфониламинопиперидин-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
метиловый эфир 4-[3-амино-6-(4-аминопиперидин-1-ил)-2-карбамоилтиено[2,3-b]пиридин-4-ил]бензойной кислоты;
амид 3-амино-6-[4-(2-гидрокси-2-фенилэтиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-пиперидин-4-ил-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-(2,5-дифторфенил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[4-(N'-фенилгидразинокарбонил)пиперазин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[4-((S)-2-гидрокси-2-фенилэтиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[4-((R)-2-гидрокси-2-фенилэтиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[2-гидрокси-2-(4-нитрофенил)этиламино]пиперидин-1-ил}-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-этокситиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[4-((S)-2-гидроксипропиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[4-((S)-2-гидроксипропиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[2-гидрокси-2-(3-гидроксифенил)этиламино]пиперидин-1-ил}-4-пропилтиено
[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[2-гидрокси-2-(4-гидроксифенил)этиламино]пиперидин-1-ил}-4-пропилтиено
[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминоазепан-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-амино-3-гидроксипиперидин-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-(2,4-дифторфенил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-(4-циано-3-фторфенил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-аминопиперидин-1-ил)-4-изопропокситиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[(1Н-индол-3-илметил)амино]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-гидроксипиперидин-1-ил)-4-трифторметилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[2-(4-аминофенил)-2-гидроксиэтиламино]пиперидин-1-ил}-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[2-гидрокси-2-(4-метоксифенил)этиламино]пиперидин-1-ил}-4-пропилтиено[2,3-b] пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[2-(4-хлорфенил)-2-гидроксиэтиламино]пиперидин-1-ил}-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-гидроксипиперидин-1-ил)-4-(4-метансульфонилфенил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
сложный метиловый эфир 4-{2-[1-(3-амино-2-карбамоил-4-пропилтиено[2,3-b]пиридин-6-ил)пиперидин-4-иламино]-1-гидроксиэтил}бензойной кислоты;
амид 3-амино-4-(4-циано-3-фторфенил)-6-(4-гидроксипиперидин-1-ил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-4-этокси-6-(4-гидроксипиперидин-1-ил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-4-пропил-6-(4-уреидопиперидин-1-ил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-aмино-6-((S)-3,4-дигидроксипиперидин-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-гидроксипиперидин-1-ил)-4-метилсульфанилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-(4-гидроксипиперидин-1-ил)-4-(3-гидроксипропил)тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[2-(4-карбамоилфенил)-2-гидроксиэтиламино]пиперидин-1-ил}-4-пропилтиено
[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-((S)-3-гидрокси-4-метансульфониламинопиперидин-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[4-(2-гидрокси-2-нафталин-2-илэтиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[4-(N'-метилсульфонилгидразино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[4-(2-гидрокси-2-нафталин-1-илэтиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
метиловый эфир 3-{2-[1-(3-амино-2-карбамоил-4-пропилтиено[2,3-b]пиридин-6-ил)пиперидин-4-иламино]-1-гидроксиэтил}бензойной кислоты;
амид 3-амино-6-(4-амино-4-метилпиперидин-1-ил)-4-этокситиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[2-гидрокси-2-(4-метилкарбамоилфенил)этиламино]пиперидин-1-ил}-4-пропил-тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[2-(4-диметилкарбамоилфенил)-2-гидроксиэтиламино]пиперидин-1-ил}-4-пропил-тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[2-(4-бензилкарбамоилфенил)-2-гидроксиэтиламино]пиперидин-1-ил}-4-пропил-тиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[2-(3-карбамоилфенил)-2-гидроксиэтиламино]пиперидин-1-ил}-4-пропилтиено
[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[4-(2-гидрокси-3-феноксипропиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-[4-(2-гидрокси-3-фенилпропиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[2-гидрокси-3-(4-метоксифенокси)пропиламино]пиперидин-1-ил}-4-пропилтиено [2,3-b]пиридин-2-карбоновой кислоты;
амид 3-амино-6-{4-[3-(4-карбамоилфенокси)-2-гидроксипропиламино]пиперидин-1-ил}-4-пропил-тиено[2,3-b]пиридин-2-карбоновой кислоты;
а также фармацевтически приемлемые соли, сложные эфиры, таутомеры, индивидуальные изомеры и смеси изомеров этого соединения.
7. Фармацевтическая композиция, включающая соединение по одному из пп.1-6.
8. Применение соединения по одному из пп.1-6 при изготовлении лекарственного средства для лечения воспалительного или аутоиммунного болезненного состояния.
9. Применение по п.8, при котором воспалительное или аутоиммунное заболевание или состояние выбирают из группы, состоящей из остеоартрита, нарушения реперфузии, астмы, рассеянного склероза, синдрома Гийена-Барре (острого первичного идиопатического полиневрита), болезни Крона (гранулематозной болезни), язвенного колита, псориаза, отторжения трансплантата, системной эритематозной волчанки, ревматоидного артрита, болезни Альцгеймера, токсического шока, инсулинзависимого сахарного диабета, острой и хронической боли, термического повреждения, синдрома расстройства дыхания у взрослых (ARDS), хронического обструктивного заболевания легкого (ХОЗЛ), посттравматических множественных повреждений органов, острого гломерулонефрита, дерматозов с острыми воспалительными компонентами, острого гнойного менингита или других нарушений или расстройств центральной нервной системы, базедовой болезни, астенического бульбарного паралича, склеродермии и атопического дерматита.
10. Применение по п.9, в котором воспалительное или аутоиммунное заболевание выбирают из остеоартрита, ревматоидного артрита, болезни Крона, язвенного колита, астмы, синдрома расстройства дыхания у взрослых (ARDS), хронического обструктивного заболевания легкого (ХОЗЛ).
11. Применение соединения по одному из пп.1-6 при изготовлении лекарственного средства для лечения атеросклероза, инфаркта миокарда или нарушения мозгового кровообращения.
12. Применение соединения по одному из пп.1-6 при изготовлении лекарственного средства для лечения рака, выбранного из лимфоидных, миелоидных и эпителиальных злокачественных новообразований, лейкемии, лимфомы, рака молочной железы, рака желудка, рака ободочной и прямой кишки, рака легкого и рака поджелудочной железы.
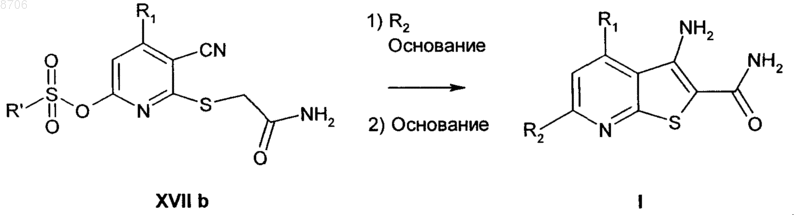
13. Способ получения соединения формулы (I)
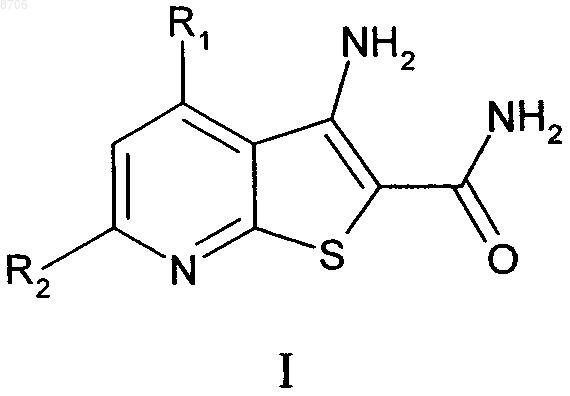
в которой R1 и R2 являются такими, как указано в п.4, способ включает:
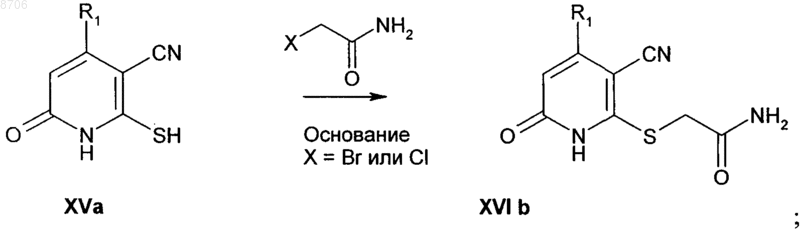
(а) взаимодействие соединения формулы (XVa) с 2-хлор- или 2-бромацетамидом в присутствии подходящего основания в подходящем растворителе с получением при этом промежуточного соединения формулы (XVIb)
(б) взаимодействие промежуточного соединения формулы (XVIb) с подходящим сульфонирующим реагентом в присутствии подходящего основания в подходящем растворителе с получением при этом сложного сульфонилового эфира формулы (XVIIb)
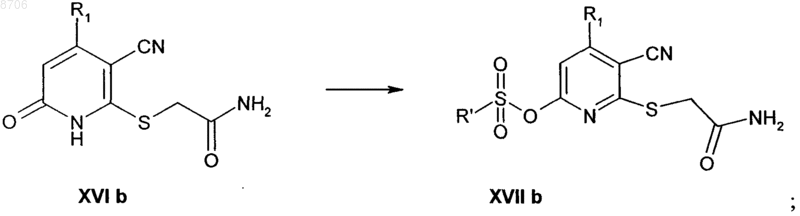
(в) взаимодействие промежуточного соединения формулы (XVIIb) с требуемым нуклеофильным соединением, таким как амин, для введения радикала R2 в присутствии подходящего основания, такого как триэтиламин, с последующим добавлением второго подходящего основания и дальнейшее взаимодействие с получением при этом целевого соединения формулы (I)
Текст
008706 По данной заявке, включающей прилагаемую формулу изобретения, испрашивается приоритет по дате подачи заявки, имеющей регистрационный номер 60/386312, поданной в Патентное ведомство США 6 июня 2002 г., и также по дате подачи заявки, имеющей регистрационный номер 60/457867, поданной в Патентное ведомство США 26 марта 2003 г., эти заявки указаны в качестве ссылки. Область техники, к которой относится изобретение Настоящее изобретение относится к производным амидов замещенных 3-аминотиено[2,3-b]пиридин-2-карбоновых кислот, которые могут быть использованы в качестве ингибиторов киназной активности комплекса киназы IВ (IKK). Вследствие этого эти соединения могут быть использованы для лечения заболеваний, медиатором которых является IKK, включая аутоиммунные заболевания, воспалительные заболевания и рак. Настоящее изобретение также относится к способам получения таких соединений и фармацевтическим композициям, содержащим эти соединения. Предшествующий уровень техникиNF-В или ядерный фактор В является фактором транскрипции, который индуцирует экспрессию большого числа провоспалительных и антиапоптозных генов. Они включают цитокины, такие как ИЛ-1RANTES (сокр. от англ. Regulated on Activation, Normal T-cell expressed and secreted), а также другие провоспалительные молекулы, включая СОХ-2 и молекулы клеточной адгезии, такие как ICAM-1, VCAM-1 и Е-селектин. Семейство NF-В включает гомо- и гетеродимерные факторы транскрипции, состоящие из членов Rel-семейства (см., например, P.A. Baeurle, D. Baltimore, Cell, 1996, v. 87, p. 13). В состоянии покоя NF-В присутствует в цитозоле клеток в виде комплекса с IВ. Семейство белков IВ выполняет функцию ингибиторов NF-В, препятствуя реализации функции ядерной локализации сигнала (см., например, U. Siebenlist et al., Ann. Rev. Cell Biol., 1994, v. 10, p. 405). После разрушении комплекса IВ NF-В, после которого происходит активация клеток, NF-В перемещается в ядра и активирует гены транскрипции. Разрушение комплекса IВ - NF-В и последующая активация NF-B инициируются посредством деградации IВ. При активации клеток при воздействии ряда провоспалительных стимулов, включающих ИЛ-1,ФНО- и LPS (бактериальный липополисахарид), два сериновых остатка IВ подвергаются фосфорилированию. После фосфорилирования IВ претерпевает полиубихинирование и последовательную деградацию при воздействии 26S протеазомы (см., например, V.J. Palombella et al., Cell, 1994, v. 78, p. 773),высвобождая NF-В для переноса в ядра. Фосфорилирование IВ протекает при участии IВ-киназ (см.,например, обзор: М. Karin, M. Delhase, Seminars in Immunology, 2000, v. 12, p. 85). Обычно IKK-комплекс включает по меньшей мере три субъединицы, IKK (также называемую IKK-1), IKK (или IKK-2) иIKK (или NEMO), хотя могут существовать и другие соответствующие комплексы, включающие IKK и IKK. Как IKK, так и IKK являются каталитическими субъединицами, хотя полагают, что IKK является регуляторной субъединицей. Как IKK, так и IKK могут фосфорилировать IВ. При использовании в тексте настоящей заявки термины IKK или комплекс IKK относятся к любому комплексу, который обладает киназной активностью, проявляющейся вследствие наличия субъединиц IKK и/или IKK.In vivo активация IKK происходит при фосфорилировании его каталитических субъединиц. КакIKK, так и IKK могут подвергаться фосфорилированию по сериновым остаткам, таким как S177 иS181 активационного петлевого фрагмента в случае IKK, и по остаткам S176 и S180 активационного петлевого фрагмента в случае IKK. Мутант IKK, содержащий остатки аланина вместо остатков серина в положениях 177 и 181, препятствует фосфорилированию IKK и последующей активации комплексаIKK с участием ФНО, ИЛ-1 и других активаторов процессов, протекающих в обратном направлении. Эти данные подтверждают ключевую роль IKK в процессе фосфорилирования IВ с последующим провоспалительным стимулированием. Исследования, при проведении которых в клетках и у животных ингибируют каскад реакций, в которых участвует NF-В, подтверждают концепцию, согласно которой ингибирование фосфорилированияIВ является эффективным подходом к лечению воспалительных, аутоиммунных и других заболеваний. При проведении этих исследований препятствовали активации NF-В посредством экспрессии недеградирующего варианта белка IВ. Экспрессия этого ингибитора в синовиальных клетках вследствие наличия у пациентов ревматоидного артрита приводила к снижению экспрессии ФНО-, ИЛ-6, ИЛ-1 и ИЛ 8, но не оказывала воздействия на противовоспалительные молекулы ИЛ-10, ИЛ-1ra и ИЛ-11. Матричные металлопротеиназы (ММР 1 и ММР 3) также являются обратными регуляторами (J. Bonderson et al.,Proc. Natl. Acad. Sci. U.S.A., 1999, v. 96, p. 5668). Трансгенная экспрессия ингибитора IВ в Т-клетках вызывала значительное снижение степени выраженности симптомов и количества приступов коллагениндуцированного артрита у мышей (R. Seetharaman et al., J. Immunol. 1999, v. 163, p. 1577). Эти эксперименты свидетельствуют о том, что подавление активности NF-В при заболеваниях суставов может снизить как степень выраженности симптомов, так и развитие ревматоидного артрита (RA). В первичных интестинальных эпителиальных клетках ингибитор активности NF-В блокирует экспрессию медиаторов ИЛ-1, ИЛ-8, iNOS и СОХ-2, которые являются регуляторами развития воспалительного заболевания-1 008706 кишечника (С. Jubin et al., J. Immunol., 1998, v. 160, p. 410). Экспрессия этого ингибитора в некоторых клетках опухоли усиливает гибель этих клеток при воздействии химиотерапевтических реагентов (A.A.Beg, D. Baltimore, Science, 1996, v. 274, p. 782). При исследовании биопсии легкого, полученной от пациентов с хроническим обструктивным заболеванием легких (ХОЗЛ), было показано, что повышенная экспрессия NF-В коррелирует со степенью выраженности симптомов заболевания (A. Di Stefano et al., Eur. Resp. J., 2002, v. 1, p. 437). Сообщалось об ингибировании активации NF-В с использованием ингибиторов IKK- как одном из противовоспалительных методов, которые потенциально могут быть полезны при лечении ХОЗЛ (P.J. Barnes, NatureRev. Drug Disc., 2002, v. 1, p. 437). Кроме того, указывалось, что ингибирование активности NF-В может являться терапевтическим методом лечения астмы (A. Pahl and I. Szelenyi, Infl. Res., 2002, v. 51, p. 273). В последних обзорах описана существенная роль медиаторов воспаления в развитии сердечно-сосудистых заболеваний. Сообщается, что медиаторы воспаления и клетки, приток которых в зону воспаления вызывают эти медиаторы, играют ключевую роль в развитии жировых прослоек и бляшек, которые приводят к атеросклерозу. В дополнение, сообщается о том, что они играют ключевую роль в последующей деградации окончаний волокон, которые формируются около бляшек, приводя к разрушению и образованию сгустков. Если сгустки значительно увеличиваются в размере, то это может привести к инфаркту миокарда и инсульту. Таким образом, противовоспалительные лекарственные средства, которые могут ингибировать продуцирование таких медиаторов и последующие приток и активацию соответствующих клеток, могут быть эффективными при лечении этих заболеваний (P. Libby, Scientific American,2002, 46). Результаты ряда исследований свидетельствуют о том, что активация NF-В также играет ключевую роль в патогенезе и формировании рака (см., например, обзоры: В. Haefner, Drug Disc. Today, 2002,v.7, p. 653; M. Karin et al., Nat. Rev. Cancer, 2002, v. 2, p. 301). Исследования показали, что клетки, в которых NF-В является постоянно активным, устойчивы к апоптозу. Это явление может вносить свой вклад в канцерогенез, предотвращая гибель таких клеток, которые претерпевают хромосомные изменения или повреждения. В дополнение, клетки опухоли, в которых NF-В является постоянно активным, устойчивы к противораковой терапии, включая химиотерапию и облучение. В дальнейших исследованиях обнаруживают связь активированного NF-В и ряда лимфоидных, миелоидных и эпителиальных злокачественных образований, включая лейкемию, лимфому и злокачественные образования молочной железы,желудочно-кишечного тракта, ободочной и прямой кишки, легкого и поджелудочной железы. Таким образом, полагают, что ингибиторы активности NF-В, включая ингибиторы IKK и IKK, могут быть использованы по отдельности или в сочетании с другими противораковыми средствами для лечения рака. Таким образом, приведенные выше данные свидетельствуют о том, что ингибирование функционирования NF-В посредством ингибирования IKK может являться полезным терапевтическим методом лечения аутоиммунных и воспалительных заболеваний, сердечно-сосудистых заболеваний и рака. Также проводились исследования на мышах с преднамеренно поврежденным геном IKK. Повреждение гена IKK приводит к гибели эмбрионов вследствие апоптоза гепатоцитов. Однако фибробласты из участков с поврежденным IKK не претерпевают активацию IKK и NF-В при стимулировании воздействием ИЛ-1 или ФНО (Q. Li et al., Science, 1999, v. 284, p. 321), что подтверждает ключевую рольIKK в активации NF-В при воздействии воспалительных стимулов. Условный генный нокаут осуществляют посредством экспрессии специфического для печени индуцибельного доминантно отрицательного трансгена IB (I. Lavon et al., Nature Medicine, 2000, v. 6, p. 573). Такие мыши жизнеспособны без каких-либо признаков дисфункции печени даже по истечении 1 года, но они действительно обладают ослабленной иммунной функцией. Это исследование подтверждает положение о том, что ингибирование активности IKK может привести к подавлению иммунной деятельности, не принося вреда печени. Мыши, лишенные IKK методом генного нокаута, умирают сразу после рождения и имеют ряд дефектов скелета и аномалий кожи. Для фибробластов и тимоцитов этих мышей наблюдалась нормальная IKKактивация и IВ-деградация в ответ на действие ФНО-, ИЛ-1 или LPS (Y. Нu et al., Science, 1999, v. 284,p. 316; К. Takeda et al., Science, 1999, v. 284, p. 313). Последние исследования нокаутных мышей показали особую роль IKK для развития и системы передачи сигнала клетками. В отличие от данных исследования мышей, которые были лишены IKK методом генного нокаута, мыши, которым ввели киназно неактивный вариант IKK, являются жизнеспособными и плодовитыми, что свидетельствовало о том, что перинатальные смертность и аномалии, наблюдающиеся в случае мышей, лишенных IKK методом генного нокаута, не являются следствием отсутствия киназной активности. Однако у таких мышей действительно наблюдались дефекты созревания В-клеток и развития вторичных лимфоидных органов (U.Senftleben et al., Science, 2001, v. 293, p. 1495). Этот фенотип, по-видимому, является следствием дефекта процессинга NF-KB2/p100 белка в р 52, ДНК-связывающую форму этого члена Rel-семейства факторов транскрипции. В свою очередь, это ведет к дефектам при активации подгруппы генов-мишеней NF-В в В-клетках. В дополнение, другие исследования на этих же мышах показали, что киназная активностьIKK необходима для активации NF-В в эпителии молочной железы во время беременности (Сао, Y., etal., Cell, 2001, v. 107, p. 763). Этот же каскад реакций специфически активируется при участии RANK,члена семейства ФНО рецепторов, приводит к фосфорилированию канонического IKK-субстрата IВ и завершается индуцированием гена циклин D1 (Cyclin D1), являющегося регулятором клеточного цикла. Эти исследования свидетельствуют о том, что ингибитор киназной активности IKK может быть использован для лечения заболеваний, связанных с несоответствующей активацией В-клеток, например таких заболеваний, как волчанка (О.Т. Chan et al., Immunological Rev., 1999, v. 169, p. 107) и ревматоидный артрит (A. Gause, С. Borek, Biodrugs, 2001, 15, 73). В дополнение, ингибитор IKK может быть использован при лечении рака молочной железы, поскольку NF-В проявляет значительную активность при наличии ряда опухолей молочной железы, и пролиферация множества таких опухолей зависит от функционирования циклина D1. Сообщалось о некоторых ингибиторах активности IKK. В опубликованных международных заявках WO 01/58890 и WO 03/037886 описаны производные гетероароматических карбоксамидов в качестве ингибиторов IKK. В опубликованной международной заявке WO 01/68648 описаны замещенные -карболины, обладающие IKK-ингибирующей активностью. Сведения о замещенных индолах, обладающихIKK-ингибирующей активностью, приведены в опубликованной международной заявке WO 01/30774. В опубликованной международной заявке WO 01/00610 описаны замещенные бензимидазолы, обладающиеNF-В-ингибирующей активностью. Сообщалось (М. Yin et al., Nature, 1998, v. 396, p. 77), что аспирин и салицилат связывают IKK и ингибируют активность IKK. В патентной заявке US 2001/0020030 A1 и в статье А.О. Stewart et al., J. Med. Chem., 2001, v. 44, p. 988 сообщается о замещенных тиенопиридинах, обладающих ингибирующей активностью в отношении клеточной адгезии. В патенте США US 6313301 сообщается о том, что тиенопиридины проявляют антагонистическую активность в отношении гонадолиберина. В патенте США US 5656638 приводятся сведения о том, что замещенные тиенопиридины являются ингибиторами теломеразы. В химической литературе описан ряд амидов 4,6-дизамещенной тиено[2,3-b]пиридин-2-карбоновой кислоты. Примеры включают амид 3-амино-4,6-диметилтиено[2,3-b]пиридин-2-карбоновой кислоты,диамид 3-амино-6-метилтиено[2,3-b]пиридин-2,4-дикарбоновой кислоты, 3-амино-4-метил-6-фенилтиено[2,3-b]пиридин-2-карбоксамид, амид 3-амино-6-метил-4-фенилтиено[2,3-b]пиридин-2-карбоновой кислоты, амид 3-амино-6-(4-бромфенил)-4-метилтиено[2,3-b]пиридин-2-карбоновой кислоты, амид 3-амино-4(4-бромфенил)-6-метилтиено[2,3-b]пиридин-2-карбоновой кислоты, 2-амид 4-бутиламид 3-амино-6-метилтиено[2,3-b]пиридин-2,4-дикарбоновой кислоты, амид 3-амино-6-фуран-2-ил-4-фенилтиено[2,3-b]пиридин-2-карбоновой кислоты, амид 3-амино-6-фуран-2-ил-4-пиридин-3-илтиено[2,3-b]пиридин-2-карбоновой кислоты, амид 3-амино-4-(4-хлорфенил)-6-фенилтиено[2,3-b]пиридин-2-карбоновой кислоты, 3 амино-4-(4-фторфенил)-6-фуран-2-илтиено[2,3-b]пиридин-2-карбоновой кислоты амид, амид 3-амино-4(4-хлорфенил)-6-фуран-2-илтиено[2,3-b]пиридин-2-карбоновой кислоты, амид 3-амино-4-(4-бромфенил)6-фуран-2-илтиено[2,3-b]пиридин-2-карбоновой кислоты, амид 3-амино-4,6-бис-(4-хлорфенил)тиено[2,3-b] пиридин-2-карбоновой кислоты, амид 3-амино-6-нафт-2-ил-4-пиридин-3-ил-тиено[2,3-b]пиридин-2-карбоновой кислоты, 2-амид 4-(2-гидроксиэтил)амид 3-амино-6-метилтиено[2,3-b]пиридин-2,4-дикарбоновой кислоты, 3-амино-6-метил-4-пиперидин-1-илтиено[2,3-b]пиридин-2-карбоксамид и 3-амино-4-метил 6-гидрокситиено[2,3-b]пиридин-2-карбоксамид, о которых сообщалось как о промежуточных соединениях, используемых для синтеза трициклических гетероциклических соединений, и для которых была оценена противоаллергическая активность (G. Wagner et al., Pharmazie, 1990, v. 45, p. 102). Другие примеры включают амид 3-амино-4,6-дифенилтиено[2,3-b]пиридин-2-карбоновой кислотыChem. Chim. Ther., 1999, v. 34, p. 301) и амид 3-амино-6-тиофен-2-ил-4-трифторметилтиено[2,3-b]пиридин-2-карбоновой кислоты (М.I. Abdel-Monem et al., Pharmazie, 2001, v. 56, p. 41). Однако нигде не сообщалось о том, что описанные соединения обладают способностью ингибировать активность IKK или IKK. Сущность изобретения Целью настоящего изобретения является получение новых соединений формулы (I) указанные в которой варьирующиеся радикалы R1 и R2 описаны в тексте заявки, эти соединения ингибируют активность IKK. Другой целью настоящего изобретения является разработка способа лечения заболеваний и болезненных состояний, которые обостряются при воздействии IKK, например таких, как аутоиммунные заболевания, воспалительные заболевания и рак, но не ограничивающихся указанным. Еще одной целью настоящего изобретения является разработка новых способов получения вышеуказанных новых соединений. Подробное описание изобретения Первый аспект настоящего изобретения включает способ лечения воспалительного или аутоиммунного состояния введением новых и известных соединений формулы (I)(а) фенил или гетероарил, выбранный из фуранила, тиенила, пиридила, пирролила, имидазолила и бензофуранила, необязательно замещенного одним или двумя радикалами R3,(б) гетероциклил, выбранный из 1-пиперидинила, 1-пиперазинила, 1-пирролидинила и 4-морфолинила, необязательно замещенного одной или двумя группами, выбранными из (C1-С 6)алкила, -CO2(C1C5)алкила, фенила, бензила, -ОН и -С(O)гетероарила, где гетероарил выбирают из фуранила, тиенила,пиридила и пирролила,(в) R6(CH2)mO-,(г) R6OCH2-,(д) R6(CH2)mNH-,(е) R6(CH2)p(CH=CH)m-,(ж) (C1-С 6)алкил, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R9,(з) (С 1-С 8)алкокси, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R9,(и) (C1-C8)алкилS(O)n-, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R9,(к) -N(R4)(R5) или(а) (C1-С 6)алкил, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R10,(б) (C1-С 6)алкокси, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R10,(в) (C1-С 6)алкиламино, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R10,(г) (C1-С 6)алкилтио, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R10,(д) гетероциклил(СН 2)m-, где указанный гетероцикл выбирают из пиперидинила, пиперазинила,морфолинила, азепанила, пирролидинила, 1,4-диазациклогептанила, азепанила, 2,5-диазабицикло[2,2,1] гептанила, оксазепанила и тиоморфолино и который необязательно замещен одним или тремя радикалами R7,(е) гетероциклил-СН 2O-, где гетероциклил выбирают из 1-пиперидинила, 1-пиперазинила, 4-морфолинила и 1-пирролидинила, необязательно замещенного (C1-С 6)алкилом,(ж) фенил, необязательно замещенный одним или тремя радикалами R3,(з)-N(R4)(R5),(и) гетероарил, выбранный из фуранила, тиенила, имидазолила, пиридила и пирролила, илиR4 и R5 независимо выбирают из Н, (C1-С 6)алкила, -С(O)(C1-С 6)алкила, -SO2(C1-С 6)алкила, фенила,пиридила, бензила, пиперидинила, фенилэтила и (СН 3)3 СОС(О)-;R6 представляет собой фенильную группу, необязательно замещенную одной или двумя группами,выбранными из галогена, (C1-С 6)алкила, -CN, -CO2(C1-С 6)алкила, -C(O)NR4R5, -SO2NH2, -NO2, -ОН, -NH2,-CF3 и (C1-С 6)алкокси, или R6 представляет собой (С 3-С 6)циклоалкил, -СН 2 ОН, нафталин-2-ил, нафталин 1-ил или 2-тиенил;R7 выбирают из -ОН, -CN, оксо, -СO2(C1-С 6)алкила, -СO2 Н, -C(O)N(R4)(R5), -N(R4)(R5), -CH2N(R4)(R5),-CH2OH, (C1-С 6)алкила, -СO2 бензила, гидрокси(C1-С 6)алкила, -С(О)(C1-С 6)aлкил-N(R4)(R5), -NHCO2(C1-С 6) алкила, -NHC(O)N(R4)(R5), -S(O)n(C1-С 6)алкила, (СН 3)3 СОС(O)-, фенила, пиридила, H2NCH(R8)C(О)-,HO(CH2)mCH2CH(NH2)C(O)-, HOCH(R6)CH2NH-, R6CH2CH(OH)CH2NH-, R6OCH2CH(OH)CH2NH- и -С(O) гетероциклила, где указанный гетероциклил выбирают из пиперидинила, пиперазинила, морфолинила и пирролидинила, или R7 представляет собой 2-гидроксиэтиламино, метилкарбамимидоил, гидроксиимино,гидразинокарбонил, сульфамоил, метансульфониламино, метилсульфонилгидразино, 2-гидроксипропиламино, 2,3-дигидроксипропиламино, 2-гидрокси-1-метилэтиламино, карбамоилметиламино, N'-фенилгидразинокарбонил или толуол-4-сульфониламино;n означает 0, 1 или 2; и р означает 0, 1, 2 или 3. В соответствии со вторым аспектом настоящего изобретения предлагаются соединения формулы (I)(а) фенил или гетероарил, выбранный из фуранила, тиенила, пиридила, пирролила, имидазолила и бензофуранила, необязательно замещенного одним или двумя радикалами R3,(б) гетероциклил, выбранный из 1-пиперидинила, 1-пиперазинила, 1-пирролидинила и 4-морфолинила, необязательно замещенного одной или двумя группами, выбранными из (C1-С 6)алкила, -CO2(C1-C5) алкила, фенила, бензила, -ОН и -С(O)гетероарила, где гетероарил выбирают из фуранила, тиенила, пиридила и пирролила,(в) R6(CH2)mO-,(г) R6OCH2-,(д) R6(CH2)mNH-,(е) R6(CH2)p(CH=CH)m-,(ж) (C1-С 6)алкил, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R9,(з) (C1-С 8)алкокси, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R9,(и) (C1-С 8) алкил S(O)n-, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R9,(к) -N(R4)(R5) или(а) (C1-С 6)алкил, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R10,(б) (C1-С 6)алкокси, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R10,(в) (C1-С 6)алкиламино, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R10,(г) (C1-С 6)алкилтио, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R10,(д) гетероциклил-(СН 2)m-, где указанный гетероцикл выбирают из пиперидинила, пиперазинила,морфолинила, азепанила, пирролидинила, 1,4-диазациклогептанила, азепанила, 2,5-диазабицикло[2,2,1] гептанила, оксазепанила и тиоморфолино и который необязательно замещен радикалами R7 в количестве от одного до трех,-5 008706(е) гетероциклил-СН 2 О-, где гетероциклил выбирают из 1-пиперидинила, 1-пиперазинила, 4-морфолинила и 1-пирролидинила, необязательно замещенного (C1-С 6)алкилом,(ж) фенила, необязательно замещенного радикалами R3 в количестве от одного до трех,(з) -N(R4)(R5),(и) гетероарила, выбранного из фуранила, тиенила, имидазолила, пиридила и пирролила, илиR4 и R5 независимо выбирают из Н, (C1-С 6)алкила, -С(O)(C1-С 6)алкила, -SO2(C1-С 6)алкила, фенила,пиридила, бензила, пиперидинила, фенилэтила и (СН 3)3 СОС(О)-;R6 представляет собой фенильную группу, необязательно замещенную одной или двумя группами,выбранными из галогена, (C1-С 6)алкила, -CN, -CO2(C1-С 6)алкила, -C(O)NR4R5, -SO2NH2, -NO2, -ОН, -NH2,-CF3 и (C1-С 6)алкокси, или R6 представляет собой (С 3-С 6)циклоалкил, -СН 2 ОН, нафталин-2-ил, нафталин 1-ил или 2-тиенил;R7 выбирают из -ОН, -CN, оксо, -СO2(C1-С 6)алкила, -СO2 Н, -C(O)N(R4)(R5), -N(R4)(R5), -CH2N(R4)(R5),-СН 2 ОН, (C1-С 6)алкила, -СO2 бензила, гидрокси(C1-С 6)алкила, -С(О)(C1-С 6)алкил-N(R4)(R5), -NHCO2(C1 С 6)алкила, -NHC(O)N(R4)(R5), -S(O)n(C1-С 6)алкила, (CH3)3COC(O)-, фенила, пиридила, H2NCH(R8)C(O)-,HO(CH2)mCH2CH(NH2)C(O)-, HOCH(R6)CH2NH-, R6CH2CH(OH)CH2NH-, R6OCH2CH(OH)CH2NH- и -С(O) гетероциклила, где указанный гетероциклил выбирают из пиперидинила, пиперазинила, морфолинила и пирролидинила, или R7 представляет собой 2-гидроксиэтиламино, метилкарбамимидоил, гидроксиимино,гидразинокарбонил, сульфамоил, метансульфониламино, метилсульфонилгидразино, 2-гидроксипропиламино, 2,3-дигидроксипропиламино, 2-гидрокси-1-метилэтиламино, карбамоилметиламино, N'-фенилгидразинокарбонил или толуол-4-сульфониламино;n означает 0, 1 или 2; р означает 0, 1, 2 или 3; а также фармацевтически приемлемые соли, сложные эфиры, таутомеры, индивидуальные изомеры и смеси изомеров этого соединения. В соответствии с другими вариантами осуществления настоящего изобретения предлагаются новые соединения формулы (I), как указано выше, и в которых:(а) фенил или гетероарил, выбранный из фуранила, тиенила, пиридила, пирролила, имидазолила и бензофуранила, необязательно замещенного одним или двумя радикалами R3,(б) R6(CH2)mO-,(в) R6OCH2-,(г) R6(CH2)mNH-,(д) R6(CH2)p(CH=CH)m-,(е) (C1-С 6)алкил, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R9,(ж) (C1-С 8)алкокси, необязательно частично или полностью галогенированный и необязательно замещенный одним или двумя радикалами R9,(з) (C1-С 8)алкилтио,(и) -N(R4)(R5) или(а) (C1-С 6)алкил, необязательно замещенный радикалом R10,(б) (C1-С 6)алкокси, необязательно замещенный радикалом R10,(в) (C1-С 6)алкиламино, необязательно замещенный радикалом R10,(г) гетероциклил, выбранный из 1-пиперидинила, 1-пиперазинила, 4-морфолинила, 1-азепанила, 1 пирролидинила, 1,4-диазациклогептан-1-ила, 1-азепанила, 2,5-диазабицикло[2,2,1]гептан-2-ила, оксазепан-4-ила и 4-тиоморфолино, причем гетероциклил необязательно замещен радикалами R7 в количестве от одного до трех,(д) гетероциклил-СН 2O-, где гетероциклил выбирают из 1-пиперидинила, 1-пиперазинила, 4-морфолинила и 1-пирролидинила, необязательно замещенного (C1-С 6)алкилом, илиR4 и R5 независимо выбирают из Н, (C1-С 6)алкила, -С(О)(C1-С 6)алкила, пиридила, бензила, пиперидинила и фенилэтила;R6 представляет собой фенильную группу, необязательно замещенную одной или двумя группами,выбранными из Cl, F, (C1-С 6)алкила, -CN, -СO2(C1-С 6)алкила, -C(O)NR4R5, -SO2NH2, -NO2, -ОН, -NH2,-CF3 и (C1-С 6)алкокси, или R6 представляет собой (C3-С 6)циклоалкил, -СН 2 ОН, нафталин-2-ил, нафталин 1-ил или 2-тиенил;R7 выбирают из -ОН, -CN, оксо, -СO2(C1-С 6)алкила, -C(O)N(R4)(R5), -N(R4)(R5), -CH2N(R4)(R5), -CH2OH,(C1-С 6)алкила, -С(О)(C1-С 6)алкил-N(R4)(R5), -NHC(O)N(R4)(R5), -S(O)n(C1-С 6)алкила, H2NCH(R8)C(О)-,HO(CH2)mCH2CH(NH2)C(O)-, HOCH(R6)CH2NH- и -С(O)гетероциклила, где указанный гетероциклил выбирают из пиперидинила, пиперазинила, морфолинила и пирролидинила, или R7 представляет собой 2 гидроксиэтиламино, метилкарбамимидоил, гидроксиимино, гидразинокарбонил, сульфамоил, метансульфониламино, метилсульфонилгидразино, 2-гидроксипропиламино, 2,3-дигидроксипропиламино, 2 гидрокси-1-метилэтиламино, карбамоилметиламино, N'-фенилгидразинокарбонил или толуол-4-сульфониламино;n означает 0, 1 или 2; р означает 0, 1, 2 или 3; а также фармацевтически приемлемые соли, сложные эфиры, таутомеры, индивидуальные изомеры и смеси изомеров этого соединения. Согласно еще одному варианту осуществления настоящего изобретения предлагаются новые соединения формулы (I), как указано выше, в которой:(а) фенил или гетероарил, выбранный из фуранила, тиенила и пиридила, необязательно замещенного одним или двумя радикалами R3,(б) R6(CH2)mO-,(в) R6OCH2-,(г) R6(CH2)mNH-,(д) R6(CH2)p(CH=CH)m-,(е) (C1-С 6)алкил,(ж) (C1-С 6)алкилОН,(з) -CF3,(и) (C1-C8)алкокси,(к) -O(C1-С 6)алкилОН,(л) (C1-C8)алкилтио,(м) -N(R4)(R5) илиR2 представляет собой гетероциклил, где указанный гетероцикл выбирают из 1-пиперидинила, 1 пиперазинила, 4-морфолинила, 1-азепанила, 1-пирролидинила, 1,4-диазациклогептан-1-ила, 1-азепанил 2,5-диазабицикло[2,2,1]гептан-2-ила, оксазепан-4-ила и 4-тиоморфолино и который необязательно замещен радикалами R7 в количестве от одного до трех;R4 и R5 независимо выбирают из Н, (C1-С 6)алкила, -С(О)(C1-С 6)алкила, пиридила, бензила, пиперидинила и фенилэтила;R6 представляет собой фенильную группу, необязательно замещенную одной или двумя группами,выбранными из Cl, F, (C1-С 6)алкила, -CN, -СO2(C1-С 6)алкила, -C(O)NR4R5, -SO2NH2, -NO2, -ОН, -NH2,-CF3 и (C1-С 6)алкокси, или R6 представляет собой (С 3-С 6)циклоалкил, -СН 2 ОН, нафталин-2-ил, нафталин 1-ил или 2-тиенил;R7 выбирают из -ОН, -CN, оксо, -СO2(C1-С 6)алкила, -СO2 Н, -C(O)N(R4)(R5), -N(R4)(R5), -CH2N(R4)(R5),-СН 2 ОН, (C1-С 6)алкила, -С(О)(C1-С 6)алкил-N(R4)(R5), -NHC(O)N(R4)(R5), -S(O)n(C1-С 6)алкила, фенила,пиридила, H2NCH(R8)C(O)-, HO(CH2)mCH2CH(NH2)C(O)-, HOCH(R6)CH2NH-, R6CH2CH(OH)CH2NH-,R6OCH2CH(OH)CH2NH- и -С(O)гетероциклила, где указанный гетероциклил выбирают из пиперидинила,пиперазинила, морфолинила и пирролидинила, или R7 представляет собой 2-гидроксиэтиламино, метилкарбамимидоил, гидроксиимино, гидразинокарбонил, сульфамоил, метансульфониламино, метилсульфонилгидразино, 2-гидроксипропиламино, 2,3-дигидроксипропиламино, 2-гидрокси-1-метилэтиламино,карбамоилметиламино, N'-фенилгидразинокарбонил или толуол-4-сульфониламино;n означает 0, 1 или 2; р означает 0, 1, 2 или 3; а также фармацевтически приемлемые соли, сложные эфиры, таутомеры, индивидуальные изомеры и смеси изомеров этого соединения. Согласно еще одному варианту осуществления настоящего изобретения предлагаются новые соединения формулы (I), как описано выше, в которой:(а) фенил, необязательно замещенный одним или двумя радикалами R3,(б) R6CH=CH-,(в) (C1-С 6)алкил,(г) -(С 2-С 3)алкил-ОН,(д) -CF3,(е) -(C1-С 6)алкокси,(ж) -O(С 2-С 3)алкилОН,(з) -(C1-С 6)алкилтио, илиR2 представляет собой гетероциклил, причем указанный гетероциклил выбирают из 1-пиперидинила, 1-пиперазинила, 1-азепанила, 1,4-диазациклогептан-1-ила и 1-азепанила и который необязательно замещен радикалами R7 в количестве от одного до трех;R4 и R5 независимо выбирают из Н, -СН 3 и бензила;R6 представляет собой фенильную группу, необязательно замещенную одной или двумя группами,выбранными из Cl, F, (C1-С 6)алкила, -CN, СO2(C1-С 6)алкила, C(O)NR4R5, -SO2NH2, -NO2, -ОН, -NH2, -CF3 и C1-С 6 алкокси, или R6 представляет собой (С 3-С 6)циклоалкил, -СН 2 ОН, нафталин-2-ил, нафталин-1-ил или 2-тиенил;R7 выбирают из -ОН, -CN, оксо, -CO2(C1-С 6)алкила, -C(O)N(R4)(R5), -N(R4)(R5), -CH2N(R4)(R5), СН 2 ОН,(C1-С 6)алкила, -С(О)(C1-С 6)алкил-N(R4)(R5), -NHC(O)N(R4)(R5), -S(O)n(C1-С 6)алкила, H2NCH(R8)C(O)-,HO(CH2)mCH2CH(NH2)C(O)-, HOCH(R6)CH2NH-, R6CH2CH(OH)CH2NH-, R6OCH2CH(OH)CH2NH- и -С(O) гетероциклила, где указанный гетероциклил выбирают из пиперидинила, пиперазинила, морфолинила и пирролидинила, или R7 представляет собой 2-гидроксиэтиламино, метилкарбамимидоил, гидроксиимино,гидразинокарбонил, сульфамоил, метансульфониламино, метилсульфонилгидразино, 2-гидроксипропиламино, 2,3-дигидроксипропиламино, 2-гидрокси-1-метилэтиламино, карбамоилметиламино, N'-фенилгидразинокарбонил или толуол-4-сульфониламино;R8 выбирают из (C1-С 6)алкила, -(CH2)1-4NH2, фенила или бензила; а также фармацевтически приемлемые соли, сложные эфиры, таутомеры, индивидуальные изомеры и смеси изомеров этого соединения. Согласно другому варианту осуществления настоящего изобретения предлагаются новые соединения формулы (I), как описано выше, в которой:R2 представляет собой гетероциклил, причем указанный гетероциклил выбирают из 1-пиперидинила и 1-пиперазинила, который необязательно замещен радикалами R7 в количестве от одного до трех;R4 и R5 независимо выбирают из Н, -СН 3 и бензила;R6 представляет собой фенильную группу, необязательно замещенную одной или двумя группами,выбранными из Cl, F, -СН 3, -CN, -СO2 СН 3, -C(O)NR4R5, -NO2, -ОН, -NH2, -CF3 и -СН 3, или R6 представляет собой нафталин-2-ил, нафталин-1-ил или 2-тиенил;R8 означает -(CH2)1-4NH2; а также фармацевтически приемлемые соли, сложные эфиры, таутомеры, индивидуальные изомеры и смеси изомеров этого соединения; при условии, что в каждом из указанных выше вариантов новых соединений в том случае, когда R1 представляет собой фенил или гетероарил, (C1-С 6)алкил, -CF3, -C(O)NR4R5 или гетероциклил, то тогда R2 не означает (C1-С 6)алкил, фенил, гетероарил, -CF3 или Н. В соответствии с первым аспектом настоящего-8 008706 изобретения, относящимся к способу лечения воспалительного или аутоиммунного состояния с использованием соединений формулы (I), это условие не применяется. Согласно другому варианту осуществления настоящего изобретения предлагаются следующие соединения.- 22008706 а также фармацевтически приемлемые соли, сложные эфиры, таутомеры, индивидуальные изомеры и смеси изомеров этого соединения. Для всех соединений, описанных в настоящей заявке, в том случае, если название, приведенное с использованием химической номенклатуры, находится в противоречии со структурной формулой, следует полагать, что соединение определяется приведенной структурной формулой. В соответствии еще c одним вариантом осуществления изобретения предлагаются следующие соединения: амид 3-амино-6-(4-оксопиперидин-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-амино-4-цианопиперидин-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-(4-метансульфонилфенил)тиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-метилсульфанилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-Е)-стирил)тиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-(4-нитрофенил)тиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-[1,4]диазепан-1-ил-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-[4-(2,4-диаминобутаноил)пиперазин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-[(Е)-2-(4-метоксифенил)винил]тиено[2,3-b]пиридин-2 карбоновой кислоты; амид 3-амино-6-(2-аминометилпиперидин-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-трифторметилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-пиперазин-1-ил-4-трифторметилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-Е)-2-n-толилвинил)тиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-[4-(2,3-дигидроксипропиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-[4-(2-гидроксиэтиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-Е)-2-м-толилвинил)тиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-метансульфониламинопиперидин-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; метиловый эфир 4-[3-амино-6-(4-аминопиперидин-1-ил)-2-карбамоилтиено[2,3-b]пиридин-4-ил]бензойной кислоты; амид 3-амино-6-[4-(2-гидрокси-2-фенилэтиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин 2-карбоновой кислоты; амид 3-амино-6-пиперидин-4-ил-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-(2,5-дифторфенил)тиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-[4-(N'-фенил-гидразинокарбонил)пиперазин-1-ил]-4-пропилтиено[2,3-b]пиридин-2 карбоновой кислоты; амид 3-амино-6-[4-S)-2-гидрокси-2-фенилэтиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-[4-R)-2-гидрокси-2-фенилэтиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-4-[2-гидрокси-2-(4-нитрофенил)этиламино]пиперидин-1-ил-4-пропилтиено[2,3-b] пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-этокситиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-[4-S)-2-гидроксипропиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2 карбоновой кислоты; амид 3-амино-6-[4-S)-2-гидроксипропиламино)пиперидин-1-ил]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-4-[2-гидрокси-2-(3-гидроксифенил)этиламино]пиперидин-1-ил-4-пропилтиено[2,3-b] пиридин-2-карбоновой кислоты; амид 3-амино-6-4-[2-гидрокси-2-(4-гидроксифенил)этиламино]пиперидин-1-ил-4-пропилтиено[2,3-b] пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминоазепан-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-амино-3-гидроксипиперидин-1-ил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-(2,4-дифторфенил)тиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-(4-циано-3-фторфенил)тиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-аминопиперидин-1-ил)-4-изопропокситиено[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-[(1 Н-индол-3-илметил)-амино]-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты;[2,3-b]пиридин-2-карбоновой кислоты; амид 3-амино-6-(4-амино-3,3-диметилциклогексил)-4-пропилтиено[2,3-b]пиридин-2-карбоновой кислоты; а также фармацевтически приемлемые соли, сложные эфиры, таутомеры, индивидуальные изомеры и смеси изомеров этого соединения. Настоящее изобретение включает фармацевтически приемлемые производные соединений форму- 24008706 лы (I). Термин "фармацевтически приемлемое производное" относится к любой фармацевтически приемлемой кислоте, соли или сложному эфиру соединения согласно настоящему изобретению или какоголибо другого соединения, которое при введении пациенту способно продуцировать (прямо или косвенно) соединение согласно настоящему изобретению, фармацевтически активный метаболит или фармацевтически активный остаток этого соединения. Фармацевтически приемлемые соли соединений согласно настоящему изобретению включают такие соли, которые получают с использованием фармацевтически приемлемых неорганических или органических кислот и оснований. Примеры подходящих кислот включают хлороводородную, бромоводородную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-n-сульфоновую, винно-каменную, уксусную, лимонную, метансульфоновую, муравьиную, бензойную, малоновую, нафталин-2-сульфоновую и бензолсульфоновую кислоты. Другие кислоты, например такая, как щавелевая кислота, хотя сами по себе не являются фармацевтически приемлемыми, могут быть использованы для получения солей, которые могут использоваться в качестве промежуточных соединений при получении соединений согласно настоящему изобретению и их фармацевтически приемлемых солей - продуктов присоединения кислоты. Соли, которые получают с использованием соответствующих оснований, включают соли щелочного металла (например, такого как натрий), щелочно-земельного металла (например, такого как магний), аммония и N-(C1-C4 алкил)4+ соли. В дополнение, соединения согласно настоящему изобретению включают пролекарства соединений формулы (I). Пролекарства включают такие соединения, которые в результате простого превращения могут быть модифицированы с получением при этом соединений согласно настоящему изобретению. Простые химические превращения включают гидролиз, окисление и восстановление, которые протекают ферментативно, метаболически или каким-либо иным образом. А именно, в том случае, когда пролекарство согласно настоящему изобретению вводят пациенту, пролекарство может быть превращено в соединение формулы (I), проявляя при этом требуемый фармакологический эффект. Любые соединения согласно настоящему изобретению, содержащие один или более асимметрический атом углерода, могут быть в виде рацематов и рацемических смесей, отдельных энантиомеров, смесей диастереомеров и индивидуальных диастереомеров. Все такие изомерные формы соединений, безусловно, входят в объем настоящего изобретения. Каждый стереоспецифический атом может находиться вR- или S-конфигурации, или возможна комбинация конфигураций. Некоторые соединения согласно настоящему изобретению могут существовать в более чем одной таутомерной форме. Настоящее изобретение включает все такие таутомеры. Соединения согласно настоящему изобретению представляют собой только такие соединения, которые рассматривают как "химически стабильные", как это понимает специалист в данной области техники. Например, соединение, которое имеет переменную валентность, или карбанион не относится к числу соединений, которые предусматриваются в рамках настоящего изобретения. В тексте заявки используют следующие сокращения: ДМФ означает диметилформамид; ДМСО означает диметилсульфоксид; ЕtOАс означает этилацетат;EtOH означает этанол; ЖХВР означает жидкостную хроматографию высокого разрешения; МеОН означает метанол; ТГФ означает тетрагидрофуран; ТСХ означает тонкослойную хроматографию. Термины, для которых здесь не приведены специальные определения, следует рассматривать в их обычном значении, в котором их использует специалист в данной области техники, с учетом описания изобретения и конкретного контекста. Например, "(C1-С 6)алкокси" представляет собой (C1-С 6)алкил с концевым кислородом, например метокси, этокси, пропокси, пентокси и гексокси. Все алкильные, алкиленовые или алкинильные группы следует рассматривать как группы, которые могут быть разветвленными и неразветвленными, если специально не указано иное. Другие более конкретные определения являются следующими. Термин "алкил" относится к насыщенному алифатическому радикалу, содержащему от 1 до 10 атомов углерода, или к моно- или полиненасыщенному алифатическому углеводородному радикалу, содержащему от 2 до 12 атомов углерода, если не указано иное. Моно- или полиненасыщенный алифатический углеводородный радикал содержит по меньшей мере одну двойную или тройную связь, соответственно. "Алкил" относится как к разветвленной, так и к неразветвленной алкильной группе. Примеры группы "алкил" включают алкильные группы, которые являются алкильными группами с линейной цепью, содержащими от 1 до 8 атомов углерода, и алкильные группы с разветвленной цепью, содержащие от 3 до 10 атомов углерода. Другие примеры включают низшие алкильные группы, которые представляют собой алкильные группы с линейной цепью, содержащие от 1 до 6 атомов углерода, и алкильные группы с разветвленной цепью, содержащие от 3 до 6 атомов углерода. Необходимо отметить, что любая комбинация терминов, в которой используется префикс "алк" или "алкил", относится к аналогам в соот- 25008706 ветствии с вышеуказанным определением термина "алкил". Например, такие термины, как "алкокси","алкилтио" относятся к алкильной группе, связанной с другой группой через атом кислорода или атом серы. "Алканоил" относится к алкильной группе, присоединенной к карбонильной группе (С=O). Следует полагать, что каждый алкил или аналог алкила, указанный в тексте настоящей заявки, может быть необязательно частично или полностью галогенированным. Термин "циклоалкил" относится к циклическому аналогу алкильной группы, определение которой приведено выше. Примерами циклоалкильных групп являются насыщенные или ненасыщенные неароматические циклоалкильные группы, содержащие от 3 до 8 атомов углерода, а другие примеры включают циклоалкильные группы, содержащие от 3 до 6 атомов углерода. Термин "гетероциклоалкил" относится к стабильному 4-8-членному (но предпочтительно 5- или 6 членному) моноциклическому или 8-11-членному бициклическому гетероциклическому радикалу, который может быть либо насыщенным, либо ненасыщенным и который является неароматическим. Каждый гетероцикл состоит из атомов углерода и из от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы. Гетероцикл может быть присоединен через любой атом, входящий в цикл, что приводит к созданию стабильной структуры. Примеры группы "гетероциклоалкил" включают такие радикалы, как пирролинил, пирролидинил, пиразолинил, пиразолидинил, пиперидинил, морфолинил, тиоморфолинил, пиперазинил, индолинил, азетидинил, тетрагидропиранил, тетрагидротиопиранил, тетрагидрофуранил, гексагидропиримидинил, гексагидропиридазинил, дигидрооксазолил, 1,2-тиазинанил-1,1-диоксид, 1,2,6-тиадиазинанил-1,1-диоксид, изотиазолидинил-1,1-диоксид и имидазолидинил-2,4-дион. Термин "галоген" относится к брому, хлору, фтору или иоду. Термин "арил" означает 6-12-членный ароматический карбоцикл, который может представлять собой одно кольцо или множество колец, сопряженных друг с другом или соединенных ковалентно. Термин"арил" включает, например, фенил и нафтил; в случае других терминов, в состав которых входит "арил",он определяется таким же образом, как указано выше, примеры таких фрагментов включают арилалкил,арилокси или арилтио. Термин "гетероарил" относится к стабильному 5-8-членному (но предпочтительно 5- или 6-членному) моноциклическому или 8-11-членному бициклическому ароматическому гетероциклическому радикалу. Каждый гетероцикл состоит из атомов углерода и из от 1 до 4 гетероатомов, выбранных из азота,кислорода и серы. Гетероарильная группа может быть присоединена через любой атом, входящий в цикл,что приводит к созданию стабильной структуры. Примеры "гетероарила" включают такие радикалы, как фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тетразолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил,индолизинил, индолил, изоиндолил, бензофуранил, бензотиенил, индазонил, бензимидазолил, бензотиазолил, бензоксазолил, пуринил, хинолизинил, хинолинил, изохинолинил, циннолинил, фталазинил, хиназолинил, хиноксалинил, нафтиридинил, птеридинил, карбазолил, акридинил, феназинил, фенотиазинил и фенооксазинил. Термины "необязательный" или "необязательно" означает, что указанное после него явление или обстоятельство может осуществиться или нет и что описание включает как примеры того, когда такое явление или обстоятельство осуществляется, так и примеры того, когда такое явление или обстоятельство не осуществляется. Например, "необязательно замещенный арил" означает, что арильный радикал может быть замещен или может быть незамещен и что описание включает как замещенные арильные радикалы, так и арильные радикалы, которые не имеют заместителей. Термин "замещенный" означает, что 1 или более атомов водорода, присоединенный к атому, группе или фрагменту, указано это специально или нет, замещается по выбору из указанной группы заместителей,при условии, что обычная валентность атома не превышается и что замещение приводит к получению стабильного соединения. Если показано, что связь с заместителем пересекает связь, соединяющую 2 атома в кольце, то в этом случае заместитель может быть присоединен к любому атому кольца. В том случае, когда заместитель приводится без указания атома, через который такой заместитель присоединяется к остальной части соединения, то тогда такой заместитель может быть присоединен через любой атом такого заместителя. Например, в том случае, когда заместитель представляет собой пиперазинил, пиперидинил или тетразолил, если не указано иное, такая пиперазинильная, пиперидинильная или тетразолильная группа может быть присоединена к остальной части молекулы соединения согласно настоящему изобретению через любой атом такой пиперазинильной, пиперидинильной или тетразолильной группы. В общем, в том случае, когда любой заместитель или группа указывается в составе любого заместителя или соединения более чем 1 раз, его определение в каждом случае не зависит от его определения в каждом другом случае. Таким образом, например, если указывается, что группа замещена радикалами R в количестве от 0 до 2, то такая группа необязательно замещена радикалами R в количестве вплоть до 2, и в каждом случае радикал R выбирают независимо из определенного перечня возможных радикалов R. Такие комбинации заместителей и/или переменных, однако, допустимы только в том случае, если они приводят к получению стабильного соединения. При использовании во всем тексте заявки термины "азот" и "сера" включают азот и серу в любом состоянии окисления, а также четвертичную форму основного азота.- 26008706 Способы терапевтического использования Согласно настоящему изобретению предлагаются новые способы использования соединений формулы (I). Соединения согласно настоящему изобретению эффективны при ингибировании активностиIKK и/или IKK. В частности, эти соединения могут быть использованы для блокирования болезненных процессов, обостряющихся при активации NF-В, медиатором которой является IKK, и при IKKактивации активности В клеток или регулятора клеточного цикла гена циклин D1. При блокировании активации NF-В соединения согласно настоящему изобретению эффективно блокируют транскрипцию генов, кодирующих воспалительные цитокины, включая ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8, ФНО, хемокины,включая ИЛ-8 и RANTES, а также другие провоспалительные молекулы, включая СОХ-2 и молекулы клеточной адгезии, такие как ICAM-1, VCAM-1 и Е-селектин. Эти медиаторы играют ключевую роль в этиологии воспалительных, аутоиммунных и сердечно-сосудистых нарушений и расстройств, а также рака. Предотвращение продуцирования этих медиаторов является необходимым средством лечения этих нарушений и расстройств. Таким образом, предлагается способ лечения таких состояний с использованием соединений согласно настоящему изобретению. Такие воспалительные и аутоиммунные состояния включают, но не ограничиваются указанным, остеоартрит, нарушения реперфузии, астму, хроническое обструктивное заболевание легкого (ХОЗЛ), рассеянный склероз, синдром Гийена-Барре (острый первичный идиопатический полиневрит), болезнь Крона (гранулематозная болезнь), язвенный колит, псориаз,отторжение трансплантата, системную эритематозную волчанку, ревматоидный артрит, болезнь Альцгеймера, синдром токсического шока, инсулинзависимый сахарный диабет, острую и хроническую боль,термические повреждения, синдром расстройства дыхания у взрослых (ARDS), посттравматические множественные повреждения органов, острый гломерулонефрит, дерматозы с острыми воспалительными компонентами, острый гнойный менингит или другие нарушения или расстройства центральной нервной системы, базедову болезнь, астенический бульбарный паралич, склеродермию и атопический дерматит. Указанные сердечно-сосудистые нарушения и расстройства включают, но не ограничиваются указанным,атеросклероз, инфаркт миокарда или нарушение мозгового кровообращения. Указанные заболевания раком включают, но не ограничиваются указанным, лимфоидные, миелоидные и эпителиальные злокачественные новообразования, включая лейкемию, лимфомы, рак молочной железы, рак желудка, рак ободочной и прямой кишки, рак легкого и рак поджелудочной железы. Соединения согласно настоящему изобретению также могут быть использованы для лечения нарушений и расстройств, связанных с IКК-активациейNF-В, вне зависимости от того, перечислены ли они выше и упоминались ли в разделе "Предшествующий уровень техники". Например, соединения согласно настоящему изобретению также могут быть использованы при лечении рака, усиливая эффективность химиотерапевтических агентов. Таким образом, настоящее изобретение также относится к способам лечения воспалительных и аутоиммунных заболеваний и других заболеваний, включая рак, способ лечения включает введение пациенту, нуждающемуся в таком лечении, фармацевтически эффективного количества соединения согласно настоящему изобретению. Для терапевтического применения соединения согласно настоящему изобретению могут вводиться в любой обычной дозированной форме любым общепринятым образом. Способы введения включают, но не ограничиваются указанным, такие способы, как внутривенное, внутримышечное, подкожное, внутрисуставное введение, введение посредством инфузии, подъязычное, чрескожное, пероральное, местное введение или введение посредством ингаляции. Предпочтительными способами введения являются пероральное и внутривенное введение. Специалисту в данной области техники будет понятно, каким образом в случае каждого из вышеуказанных способов введения приготавливают композиции, включающие соединения согласно настоящему изобретению. Настоящее изобретение также позволяет получать фармацевтические композиции, включающие терапевтически эффективное количество соединений согласно настоящему изобретению. Такие фармацевтические композиции включают фармацевтически приемлемые носители и наполнители, которые будут описаны ниже. Соединения согласно настоящему изобретению могут быть ведены по отдельности или в сочетании с наполнителями, которые повышают стабильность ингибиторов, облегчают в некоторых случаях введение фармацевтических композиций, содержащих эти соединения, обеспечивают более высокую растворимость или диспергируемость, повышают ингибирующую активность, обеспечивают дополнительное терапевтическое воздействие и достижение подобных эффектов, включая использование и других активных ингредиентов. Преимущественно, при такой комбинированной терапии используют меньшие дозировки общеизвестных терапевтических агентов, что позволяет избежать возможного токсического воздействия и нежелательных побочных эффектов, которые могут возникнуть в том случае, когда такие агенты используются для монотерапии. Соединения согласно настоящему изобретению могут быть физически объединены с общеизвестными терапевтическими агентами или другими наполнителями с получением при этом одной единой фармацевтической композиции. Преимущественно, соединения затем могут быть введены вместе в виде одной дозированной формы. При осуществлении некоторых вариантов осуществления изобретения фармацевтические композиции, включающие такие комбинации соединений, содержат по меньшей мере приблизительно 15%, но более предпочтительно по меньшей мере приблизительно 20% соединения согласно настоящему изобретению (мас./мас.) или этого соединения в комбинации. В ка- 27008706 честве альтернативы, соединения могут вводиться по отдельности (либо периодически, либо параллельно). Раздельное дозирование позволяет достичь большую гибкость осуществления режима дозирования. Как указывалось выше, дозированные формы соединений согласно настоящему изобретению включают фармацевтически приемлемые носители и разбавители, известные специалисту в данной области техники. Такие носители и разбавители включают, например, иониты, диоксид алюминия, стеарат алюминия, лецитин, белки сыворотки, буферные вещества, воду, соли или электролиты и производные целлюлозы. Предпочтительные дозированные формы включают таблетки, капсулы, таблетки с покрытием,жидкие препараты, растворы, суспензии, эмульсии, леденцы, сиропы, порошки для приготовления растворов, гранулы, суппозитории и трансдермальные пластыри. Способы получения таких дозированных форм известны (см., например, Н.С. Ansel, N.G. Popovish, Pharmaceutical Dosage Forms and Drug DeliverySystems, 5th ed., Lea и Febiger (1990. Уровень дозировок и соответствующие требования хорошо известны из предшествующего уровня техники и могут быть выбраны обычным специалистом в данной области техники из доступных способов и методик, подходящих для конкретного пациента. Для некоторых вариантов осуществления настоящего изобретения уровень дозировок составляет приблизительно 10-1000 мг на дозу для пациента массой 70 кг. Хотя может быть достаточна и 1 доза в день, может потребоваться до 5 доз в день. Для пероральной дозировки может потребоваться до 2000 мг/день. Как будет понятно специалисту в данной области техники, в зависимости от конкретных факторов могут потребоваться более высокие или более низкие дозировки. Например, конкретные дозировки и режим лечения будут зависеть от таких факторов, как общее состояние здоровья пациента, степень выраженности симптомов, особенности протекания или предрасположенность к заболеванию, а также от рекомендаций лечащего врача. Способы синтеза Настоящее изобретение также относится к способам получения соединений формулы (I). Соединения согласно настоящему изобретению могут быть получены в соответствии с общими методиками и согласно примерам, представленным ниже, и с использованием методов, известных специалисту в данной области техники. Оптимальные условия проведения реакции и продолжительность реакции могут варьироваться в зависимости от конкретных используемых реагентов. Если не указано иное, то используемые растворители, температура, давление и другие условия реакции могут быть легко выбраны обычным специалистом в данной области техники. Конкретные методики приведены в разделе, посвященном примерам синтеза. Протекание реакции может контролироваться обычными методами, например таким, как тонкослойная хроматография (ТСХ). Промежуточного соединения и продукты могут быть очищены с использованием методов, известных из предшествующего уровня техники, включая колоночную хроматографию, ЖХВР или перекристаллизацию. Как показано на схеме I, соединения формулы (I) могут быть получены с использованием в качестве исходного соединения 1,3-диона, имеющего заместители R1 и R2 (II). Взаимодействие соединения II с цианотиоацетамидом (III) в подходящем растворителе, например таком, как EtOH, в присутствии подходящего основания, например такого, как триэтиламин, приводит к получению замещенного 2-меркаптоникотинонитрила IV. Взаимодействие соединения IV с хлор- или бромацетамидом (V) в подходящем растворителе, таком как ДМФ, ТГФ или EtOH, в присутствии подходящего основания, например такого,как карбонат натрия, гидроксид натрия или этоксид натрия, приводит к получению целевого соединения формулы (I). Заместители R1 и R2 могут быть далее модифицированы с использованием методик, известных из предшествующего уровня техники, для того, чтобы получить дополнительные соединения согласно настоящему изобретению. Схема I Например, как показано на схеме II, используя вначале сложный дикетоэфир VI и методику, показанную выше, получают сложный эфир I (R1=CO2R', где R' представляет собой алкильную группу, такую как метил или этил). С использованием методов, известных из предшествующего уровня техники, R1 может быть модифицирован для того, чтобы получить другие необходимые R1. Например, гидролиз позволяет получить карбоновую кислоту I (R1=CO2H), а последующее взаимодействие карбоновой кислоты- 28008706 с амином RNH2 в общепринятых условиях конденсации приводит к получению амида I (R=C(O)NHR"). В качестве альтернативы, восстановление этого сложного эфира подходящим восстанавливающим агентом, таким как алюмогидрид лития, приводит к получению спирта I (R1=CH2OH). Взаимодействие спирта с фенолом АrОН в условиях реакции Мицунобу (Mitsunobu) позволяет получить простой ариловый эфир I (R1=СН 2 ОАr). Эти и другие модификации описаны в разделе, посвященном примерам синтеза. Схема II В соответствии с модификацией вышеуказанной методики получения соединения VII в качестве исходного соединения можно использовать сложный эфир 2-хлор- или 2-бром-3-цианоизоникотиновой кислоты (VIII, схема III). Группа 2-галогено затем может быть превращена в 2-меркаптогруппу с использованием методик, известных из предшествующего уровня техники, например при взаимодействии с тиомочевиной в подходящем растворителе, таком как EtOH, с получением при этом промежуточного соединения - сложного эфира VII. Схема III На схеме IV проиллюстрирована методика, в соответствии с которой можно получить соединение формулы (I), содержащее в качестве R1 аминогруппу. 2-Бром-4-гидроксиникотинонитрил (IX) обрабатывают 4-метоксибензилхлоридом в присутствии подходящего основания, например такого, как гидрид натрия, в подходящем растворителе, например таком, как ДМФ, получая при этом простой 4-метоксибензиловый эфир X. Это соединение затем можно превратить в 2-меркаптозамещенное соединение, как показано выше на схеме III. Полученное меркаптозамещенное соединение после этого можно подвергнуть взаимодействию с галогенацетамидом, как показано на схемах I и II, с получением при этом I (R1=4 метоксибензиловый простой эфир). В качестве альтернативы, возможно осуществить взаимодействие X с меркаптоацетамидом в присутствии подходящего основания, например такого, как гидрид натрия, в подходящем растворителе, таком как ДМФ, с получением при этом непосредственно соединения I (R1=4 метоксибензиловый простой эфир). Обработка этого простого эфира трифторуксусной кислотой приводит к получению соли XI. Взаимодействие соединения XI с N-фенилтрифторметансульфонимидом в присутствии подходящего основания, например такого, как диизопропилэтиламин, в подходящем растворителе, таком как диоксан, позволяет получить трифторметансульфонат XII. Взаимодействие соединения XII с амином R'R"NH в подходящем растворителе, например таком, как диоксан, приводит к получению соединения I (R1=NR'R"). В случае менее реакционноспособных аминов, например таких, как ариламины, возможно, но необязательно, нагревать реакционную смесь. Методика, которая может быть использована для введения в качестве R1 различных арильных или арилалкенильных групп и в качестве R2 нуклеофилов, таких как аминогруппы, показана на схеме V. Кислоту Мельдрума (Meldrum) (XIII) обрабатывают дисульфидом углерода, метилиодидом и подходящим основанием, например таким, как триэтиламин, в подходящем растворителе, например таком, как ДМСО, с получением при этом бис-метилсульфанилметилендиона XIV. В результате обработки соединения XIV 2-цианотиоацетамидом в присутствии подходящего основания, например такого, как этоксид натрия в этаноле, получают нитрил XVa. Взаимодействие соединения XVa с 2-хлор- или 2-бромацетамидом в присутствии подходящего основания, например такого, как гидрид натрия, в подходящем растворителе, таком как ДМФ, приводит к получению соединения XVIa. Циклизация с получением при этом промежуточного соединения - трифлата XVIIa - может быть достигнута посредством взаимодействия соединения XVI с N-фенилтрифторметансульфонимидом в присутствии подходящего основания, например такого, как гидрид натрия, в подходящем растворителе, таком как ДМФ. В результате взаимодействия соединения XVIIa с необходимой арилбороновой кислотой или арилалкенилбороновой кислотой в присутствии подходящего палладиевого катализатора, предпочтительно аддукта трис(дибензилиденацетон)(0)-хлороформ, фосфинового лиганда, предпочтительно три-2-фурилфосфина, и соли меди, предпочтительно медь(I)тиофен-2-карбоксилата, в подходящем растворителе, например таком, как ТГФ, приводит к получению целевого промежуточного соединения - арила или арилалкенила XVIII. ВзаимодействиеXVIII с необходимым нуклеофилом, таким как амин R'R"NH, как показано, в подходящем растворителе,таком как диоксан, приводит к получению целевого соединения формулы (I). Спирты (R'OH) или тиолы(R'SH) в присутствии подходящего основания могут быть использованы вместо амина для того, чтобы получить простую эфирную группу или простую тиоэфирную группу, соответственно, в положении R2. Схема V Модификация вышеуказанной методики, которая позволит получить в положении R1 алкильную группу, показана на схеме VI. Сложный эфир - алкиноат, такой как указанный метиловый сложный эфир,- 30
МПК / Метки
МПК: A61K 31/435, C07D 333/00, A61K 31/38, C07D 221/00, C07D 495/04, A61P 29/00
Метки: кислот, замещённых, 3-аминотиено, 2,3-b, применения, амиды, получения, пиридин-2-карбоновых, способы
Код ссылки
<a href="https://eas.patents.su/30-8706-amidy-zameshhyonnyh-3-aminotieno-23-b-piridin-2-karbonovyh-kislot-sposoby-ih-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Амиды замещённых 3-аминотиено [2,3-b] пиридин-2-карбоновых кислот, способы их получения и применения</a>
Предыдущий патент: Получение и очистка синтетического капсаицина
Следующий патент: Тонкодиспергированная композиция стабилизаторов для галогенсодержащих полимеров
Случайный патент: Ковш переменного объема с устройством активной загрузки












