Амидные производные карбоновых кислот
Номер патента: 10162
Опубликовано: 30.06.2008
Авторы: Игначней Сендрей Дьёрди, Домань Дьёрдь, Ваго Иштван, Надь Йожеф, Колок Шандор, Хорват Чилла, Бартаней Салаи Гишелла, Кешеру Дьёрдь, Ковачней Бозо Эва, Фаркаш Шандор, Биелик Аттила, Борза Иштван
Формула / Реферат
1. Амидные производные соединения карбоновых кислот формулы (I)
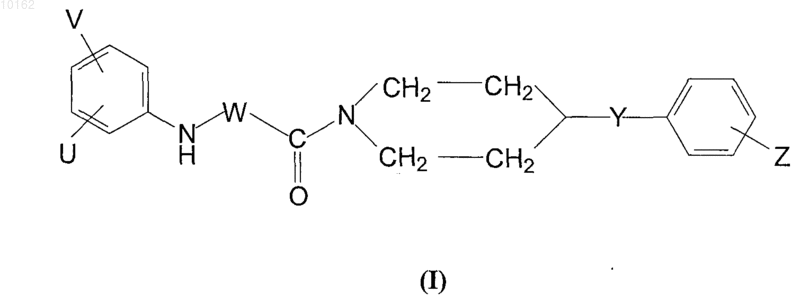
где
смежные V и U группы образуют вместе с -СН2- или -CH= группами 4-7-членное гомо- или гетероциклическое кольцо, которое может быть прервано 1-3 одинаковыми или различными гетероатомами, выбранными из группы N, и/или О, и/или S и которое может быть замещено 1-2 атомами О S или алкилом,
W является -CO-, -CH2- или -СН(-алкильной)- группой,
Y является атомом кислорода, так же как С1-С4алкиленом, С2-С4алкиниленом, циклоалкиленом, аминокарбонилом, -NH-, -N(алкил)-, -СН2О-, -CH(OH)-, -ОСН2- группой,
Z является водородом или атомом галогена, нитро, амино, алкилом, С1-С4алкокси, циано, трифторметилом, гидроксильной или карбоксильной группой
и оптические антиподы или рацематы и/или их фармацевтически приемлемые соли, образованные с кислотами и основаниями.
2. Соединения по п.1, где W означает -СН2-группу и V, U, Y и Z имеют значения, как определено для соединения формулы (I).
3. Соединения по п.1, где W означает -СО- группу и V, U, Y и Z имеют значения, как дано для соединения формулы (I).
4. Соединения по п.1, выбранные из следующей группы амидных производных карбоновой кислоты:
2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1Н-индол-5-ил)ацетамид,
2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,
2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1Н-бензоксазол-5-ил)ацетамид,
2-(4-бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидро-1Н-индол-5-ил)ацетамид,
2-(4-бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидро-1H-бензимидазол-5-ил)ацетамид,
2-(4-бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,
5-{2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксоэтиламино}-1,3-дигидробензоимидазол-2-он,
6-{2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксоэтиламино}-3Н-бензоксазол-2-он,
2-[4-(4-метилбензил)пиперидин-1-ил]-2-оксо-N-(3-оксо-3,4-дигидро-2Н-бензо[1,4]оксазин-7-ил) ацетамид,
2-[4-(4-метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)ацетамид,
2-[4-(4-хлорфенокси)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1Н-бензимидазол-5-ил)ацетамид,
2-[4-(4-хлорфенокси)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,
2-[4-(4-хлорбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,
2-[4-(4-хлорбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1H-бензимидазол-5-ил)ацетамид,
2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)-2-(4-п-толилоксипиперидин-1-ил)ацетамид,
2-оксо-N-(2-оксо-2,3-дигидро-1Н-бензимидазол-6-ил)-2-(4-п-толилоксипиперидин-1-ил)ацетамид,
2-[4-(4-хлорбензил)-пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1Н-индол-5-ил)ацетамид,
6-[2-(4-бензилпиперидин-1-ил)-2-оксоэтиламино]-3Н-бензоксазол-2-он,
2-(4-бензилпиперидин-1-ил)-N-(2-меркапто-3Н-бензимидазол-5-ил)-2-оксоацетамид,
2-(4-бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,
2-[4-(4-фторбензил)пиперидин-1-ил]-N-(2-меркапто-3Н-бензимидазол-5-ил)-2-оксоацетамид,
2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,
2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)-2-(4-п-толилоксипиперидин-1-ил)ацетамид,
N-(2-меркапто-3Н-бензимидазол-5-ил)-2-(4-п-толилоксипиперидин-1-ил)-2-оксоацетамид,
2-[4-(4-метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,
2-[4-(4-метоксибензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,
2-[4-(3-метоксибензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,
2-[4-(3-метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,
2-[4-(4-цианобензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,
2-[4-(3-фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,
2-[4-(2,4-дифторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,
6-{2-[4-(4-метилбензил)пиперидин-1-ил]-2-оксоэтиламино}-3Н-бензоксазол-2-он,
2-[4-(3,4-дифторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,
2-[4-(4-метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-1,2,3,4-тетрагидрохинолин-6-ил)ацетамид,
2-[4-(4-метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,
2-[4-(4-хлорфенокси)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,
2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)-2-(4-п-толилоксипиперидин-1-ил)ацетамид,
и/или их рацематы, оптические антиподы и/или фармацевтически приемлемые соли, образованные с кислотами или основаниями.
5. Фармацевтические композиции, обладающие эффектом специфического антагониста NMDA NR2B подтипа, содержащие биологически эффективную дозу производного амида карбоновой кислоты формулы (I), где значения V, U, W, Y и Z являются теми, которые определены в п.1, и/или его рацематы, оптические антиподы и/или фармацевтически приемлемые соли, образованные с кислотами или основаниями, в качестве активного ингредиента и носители, наполнители и им подобные добавки, обычно применяемые в фармацевтике.
6. Способ получения производных амидов карбоновых кислот формулы (I)

где значения V, U, W, Y и Z являются теми, которые определены в п.1, и/или их рацематов, оптических антиподов и/или фармацевтически приемлемых солей, образованных с кислотами или основаниями, являющихся активным ингредиентом, характеризующийся тем, что
а) карбоновая кислота формулы (II)
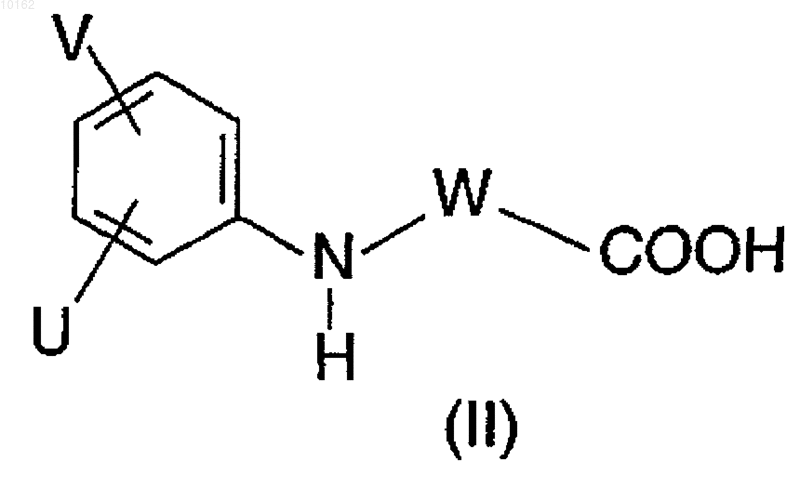
где значения U, V и W являются теми, которые определены для формулы (I), или ее реакционноспособное производное взаимодействует с амином формулы (III)
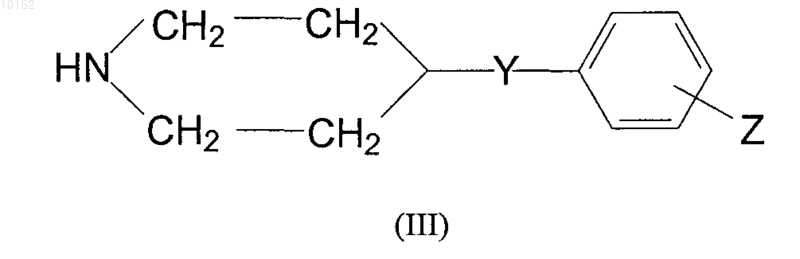
где значения Y и Z, являются теми, которые определены ранее для соединений формулы (I),
и происходит преобразование полученных соединений формулы (I), где значения V, U, W, Y и Z являются теми, которые определены в п.1, в другое соединение формулы (I) путем введения дополнительных заместителей, и/или модифицирования, и/или удаления имеющихся заместителей, и/или путем образования солей с кислотами, и/или высвобождения амида карбоновой кислоты формулы (I) из полученной кислотно-аддитивной соли путем обработки основанием и/или свободное производное амида карбоновой кислоты формулы (I) может быть преобразовано в соль путем обработки основанием и/или разделено на его оптические антиподы.
7. Способ получения производных амидов карбоновых кислот формулы (I)
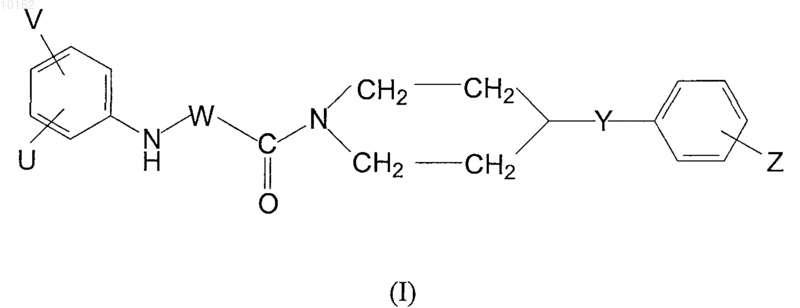
где значения V, U, W, Y и Z являются теми, которые определены в п.1, и/или их рацематов, оптических антиподов и/или фармацевтически приемлемых солей, образованных с кислотами или основаниями, являющихся активным ингредиентом, характеризующийся тем, что
для получения соединений формулы (I), имеющих -СО- группу в положении W, где значения Y, Z, U и V являются теми, которые определены ранее для соединений формулы (I), карбоновая кислота формулы (IV)
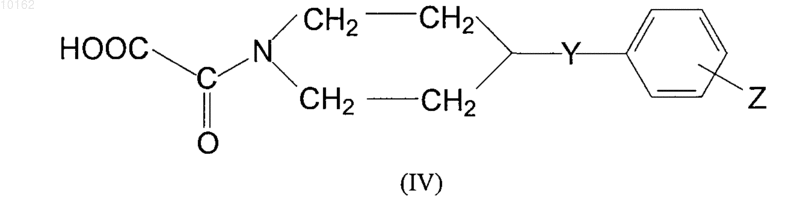
где значения Y и Z являются теми, которые описаны ранее для соединений формулы (I) или ее реакционноспособное производное, взаимодействует с амином формулы (V)
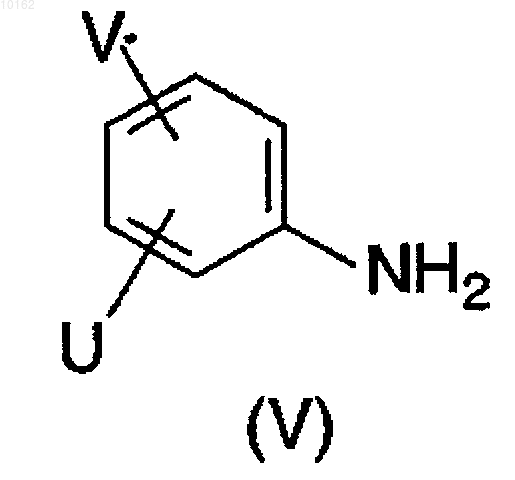
где значения U и V являются теми, которые определены ранее для соединений формулы (I),
и происходит преобразование полученных соединений формулы (I), где значения V, U, W, Y и Z являются теьш, которые определены в п.1, в другое соединение формулы (I) путем введения дополнительных заместителей, и/или модифицирования, и/или удаления, имеющихся заместителей, и/или путем образования солей с кислотами, и/или высвобождения амида карбоновой кислоты формулы (I) из полученной кислотно-аддитивной соли путем обработки основанием и/или свободное производное амида карбоновой кислоты формулы (I) может быть преобразовано в соль путем обработки основанием и/или разделено на его оптические антиподы.
8. Способ получения производных амидов карбоновых кислот формулы (I)
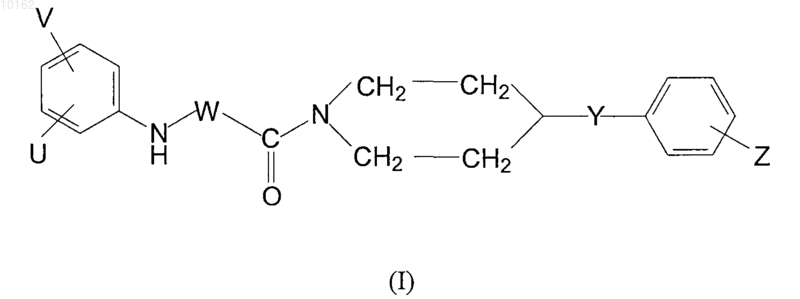
где значения V, U, W, Y и Z являются теми, которые определены в п.1, и/или их рацематов, оптических антиподов и/или фармацевтически приемлемых солей, образованных с кислотами или основаниями, являющихся активным ингредиентом, характеризующийся тем, что для получения соединений формулы (I), имеющих -СН2- или -СН(-алкильную)группу в положении W, где алкил является С1-С4 алкильной группой и значения Y, Z, U и V являются теми, которые определены ранее для соединений формулы (I), галоидное производное соединения формулы (VII)
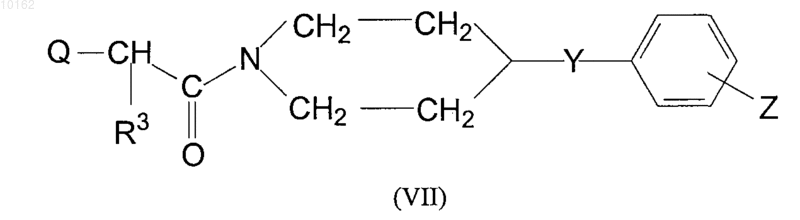
где значение Q является атомом галогена, R3 является атомом водорода или С1-С4 алкильной группой и Y и Z являются теми, которые описаны выше для соединений формулы (I), взаимодействует с амином формулы (V)
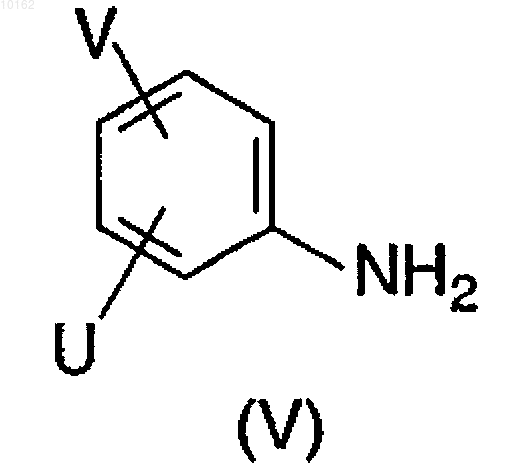
где значения U и V являются теми, которые определены ранее для соединений формулы (I), и роисходит преобразование полученных соединений формулы (I), где значения V, U, W, Y и Z являются теми, которые определены в п.1, в другое соединение формулы (I) путем введения дополнительных заместителей, и/или модифицирования, и/или удаления имеющихся заместителей, и/или путем образования солей с кислотами, и/или высвобождения амида карбоновой кислоты формулы (I) из полученной кислотно-аддитивной соли путем обработки основанием и/или свободное производное амида карбоновой кислоты формулы (I) может быть преобразовано в соль путем обработки основанием и/или разделено на его оптические антиподы.
9. Способ получения производных амидов карбоновых кислот формулы (I)
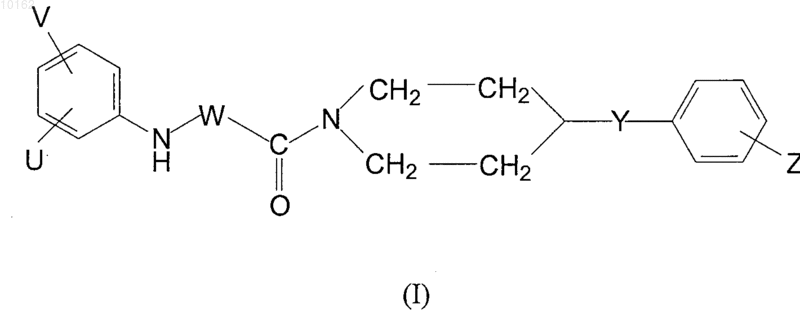
где значения V, U, W, Y и Z являются теми, которые определены в п.1, и/или их рацематов, оптических антиподов и/или фармацевтически приемлемых солей, образованных с кислотами или основаниями, являющихся активным ингредиентом, характеризующийся тем, что вторичный амин формулы (III)

где Y и Z имеют те же самые значения, которые определены для соединений формулы (I), взаимодействует с этилоксалилхлоридом в присутствии основания на твердой подложке в дихлорметане, полученный эфир формулы (VIII)
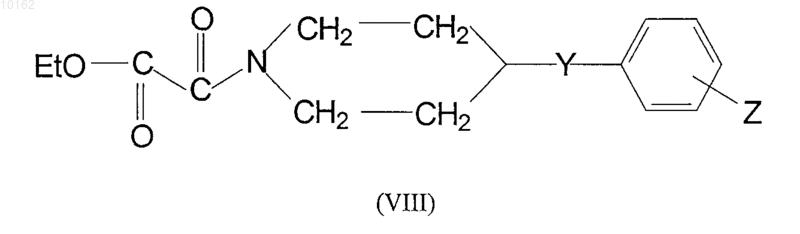
где Y и Z имеют те же самые значения, которые определены для соединений формулы (I), подщелачивают сильноосновной ионообменной смолой в этаноле и полученный оксаламид кислоты формулы (IX)
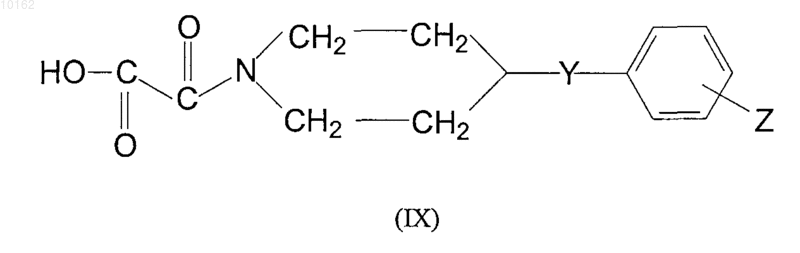
где Y и Z имеют те же самые значения, которые определены для соединений формулы (I), взаимодействует с амидом формулы (V)
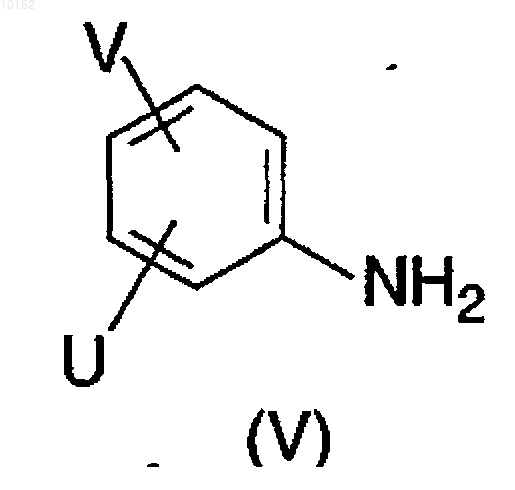
где значения U и V являются теми, которые определены ранее для соединений формулы (I), в смеси растворителей дихлорметан/диметилформамид в присутствии 1-[3-(диметиламино)пропил]-3-этилкарбодиимида и преобразование полученных соединений формулы (I), где Y, Z, U, V и W являются теми, как описано выше, в другое соединение формулы (I) путем введения дополнительных заместителей, и/или модифицирования, и/или удаления имеющихся заместителей, и/или путем образования солей с кислотами, и/или высвобождения производного амида карбоновой кислоты формулы (I) из полученной кислотно-аддитивной соли путем обработки основанием и/или свободное производное амида карбоновой кислоты формулы (I) может быть преобразовано в соль путем обработки основанием и/или разделено на его оптические антиподы.
10. Способ по любому из пп.6-9, характеризующийся тем, что образование реакционноспособного производного карбоновых кислот формулы (II) и (IV), где U, V, W или Y и Z являются теми, которые определены для соединений формулы (I), соответственно, происходит при использовании гексафторфосфата О-бензотриазол-1-ил-N,N,N',N'-тетраметилурония.
11. Способ получения фармацевтической композиции, обладающей эффектом специфического антагониста NMDA NR2B подтипа, характеризующийся тем, что смешивают производное амида карбоновой кислоты формулы (I), где значения V, U, W, Y и Z являются теми, как определено в п.1, и/или их рацематы, оптические антиподы и/или фармацевтически приемлемые соли, образованные с кислотами или основаниями, с носителями, наполнителями и им подобными добавками, обычно применяемыми в фармацевтике.
12. Способ лечения и облегчения симптомов следующих заболеваний млекопитающих, включая человека: травматическая рана мозга или спинного мозга, вирус человеческого иммунодефицита (ВИЧ), связанный с повреждением нейрона, амиотрофический боковой склероз, устойчивость и/или зависимость к лечению опиоидом боли, синдром отмены, например, алкоголя, опиоидов или кокаина, ишемическое нарушение ц.н.с, хроническое нейродегенеративное заболевание, такое как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боль и хроническое болевое состояние, такое как невропатическая боль или боль, связанная с раком, эпилепсией, беспокойством, депрессией, мигренью, психозом, мышечной судорогой, деменцией различного происхождения, гипогликемией, дегенеративной болезни сетчатки, глаукомы, астмы, шума в ушах, аминогликозидную связанную с применением антибиотика потерю слуха, включающий введение эффективного количества/количеств производного амида карбоновой кислоты формулы (I), где значения V, U, W, Y и Z являются теми, которые определены в п.1, и/или их рацематов, оптических антиподов и/или фармацевтически приемлемых солей, образованных с кислотами или основаниями, самих по себе или объединенных с носителями, наполнителями и им подобными добавками, обычно применяемыми в фармацевтике для лечения млекопитающих.
Текст
010162 Область техники, к которой относится изобретение Изобретение относится к новым производным амидов карбоновых кислот, которые являются антагонистами NMDA рецептора или являются промежуточными соединениями для их получения. Уровень техники N-Метил-D-аспарат (NMDA) рецепторы являются лиганд зависимыми катионными каналами,внедренными в клеточные мебраны нейронов. Сверхактивация NMDA рецепторов с помощью глутамата,его природного лиганда, может привести к избытку кальция в клетках. Это запускает каскад внутриклеточных процессов, что изменяет функцию клетки и в конечном счете может привести к гибели нейронов[TINS, 10, 299-302 (1987)]. Антагонисты NMDA рецепторов могут быть использованы для лечения многих болезней, которые сопровождаются избыточным выделением глютамата, основного нервного трансмиттера в центральной нервной системе. Знание структуры NMDA рецептора, функции и фармакологии достигнуто вследствие недавних достижений молекулярной биологии. NMDA рецепторы являются гетеромерными комплексами, создаваемыми из, по крайней мере, одной NR1 субъединицы и по крайней мере одной из четырех различныхNR2 субъединиц (NR2A-D). Оба пространственных распределения в CNS и фармакологическая чувствительность NMDA рецепторов, созданных из различных NR2 субъединиц, являются различными. Особенно интересной из них является NR2B субъединица, вследствие ее ограниченного распределения (самый высокий удельный вес в передней доле коры головного мозга и желатиноподобная субстанция спинного мозга). Соединения, выбранные для такого подтипа являются доступными [Curr. Pharm. Des., 5, 381-404(1999)] и, как было доказано, являются эффективными на моделях инсульта у животных [Stroke, 28,2244-2251 (1997)], травматического повреждения мозга [Brain Res., 792. 291-298 (1998)], болезни Паркинсона [Exp. Neurol., 163. 239-243 (2000)], невропатической и воспалительной боли [Neuropharmacology,38. 611-623 (1999)]. Кроме того, селективные антагонисты рецепторов NMDA подтип NR2B, как предполагают, обладают небольшими или не обладает вообще неблагоприятными побочными эффектами, которые обычно вызываются неизбирательными антагонистами NMDA рецепторов, такими как психодислептические эффекты, такими как головокружение, головная боль, галлюцинации, дисфория и нарушения познавательной и двигательной функции. Избирательный антагонизм NMDA подтипа NR2B может достигаться соединениями, которые специально связываются и действуют на аллостерический модулирующий сайт NR2B субъединицы рецептора. Этот связывающий сайт может быть описан с помощью исследований связывания со специфическими радиолигандами, такими как [125I]-ифенпродил [J.Neurochem., 61,120-126 (1993)] или [3H]-Ro 25,6981 [J. Neurochem., 70, 2147-2155 (1998)]. С тех пор как ифенпродил стал первым, хотя не достаточно специфичным, известным лигандом указанного рецептора, он был также назван как ифенпродил связывающий сайт. Аналоги производных амида карбоновой кислоты формулы (I) закрытой структуры известны из литературы. Флоридский Центр гетероциклических соединений [Department of Chemistry, University of Florida, PO Box 117200, Gainesville, FL, 32611-7200, USA] получил миллиграммовые количества трех соединений формулы (I) для биологического тестирования: N-(4-бромфенил)-4-(фенилметил)-1-пиперидинацетамид,4-оксо[4-(фенилметил)-1-пиперидинил]ацетил]амино]бензойной кислоты и этилового эфира 4-оксо[4(фенилметил)-1-пиперидинил]ацетил]амино]бензойной кислоты. Оксоэтиламиновые производные характеризуются как промежуточные соединения для ингибиторов тромбина [Bioorg. Med. Chem. Letters, 9, 925. (1999)]. Публикация не описывает эффект NMDA антагониста рецептора.N-(4-бензоилфенил)-4-(фенилметил)-1-пиперидинацетамид приведен в патенте No. US 6048900 в качестве селективного антагониста нейропептидного Y рецептора.N-(2-Формил-6-метилфенил)-4-(фенилметил-1-пиперидинацетамид описан в патенте No. AU 639529 в качестве промежуточного соединения для карбостирольного производного, которые является полезным в качестве антиаритмиков. Аминоацетарилиды являются также известными [Rev. Chim. (Bucharest), 33(7). 601. (1982); CA 97:174467 а] в качестве локальных анестезирующих и антифибрилляционных агентов. Производные пиперидина и аналоги, замещенные фенолами или эквивалентами фенола, обладающие специфической антагонистической активностью NMDA NR2B, описаны в международных патентных заявках WO 90/14087, WO 90/14088, WO 97/23202, WO 97/23214, WO 97/23215, WO 97/23216, WO 97/23458, WO 99/21539, WO 2000/25109, EP 648J44 и в US 5436255. Соединения, содержащие подструктуру 2-бензоксазолинона со сходной биологической активностью, описаны в международных патентных заявках WO 98/18793 и WO 2000/00197. Другие селективные антагонисты NMDA NR2B, имеющие конденсированные гетероциклические структуры описаны в WO 2001/30330, WO 2001/32171, WO 2001/32174, WO 2001/32177, WO 2001/32179, WO 2001/32615, WO 2001/32634. Тем не менее, по-прежнему сохраняется необходимость в новых антагонистах NMDA, которые воздействуют на такую мишень, как NR2B рецептор.-1 010162 Сущность изобретения Неожиданно было найдено, что новые амидные производные карбоновых кислот формулы (I) по настоящему изобретению являются функциональными антагонистами NMDA рецепторов, которые поражают (блокируют) NMDA рецепторы, в основном путем связывания с сайтом связывания ифенпродила. Поэтому, считается, что они являются специфичными антагонистами подтипа NR2B. Подробное описание изобретения Таким образом, настоящее изобретение относится в первую очередь к новым амидным производным карбоновых кислот формулы (I) где смежные V и U группы образуют вместе с -СН 2- или -CH= группами 4-7 членное гомо- или гетероциклическое кольцо, которое может быть прервано 1-3 одинаковыми или различными гетероатомами,выбранными из группы, N и/или О, и/или S, и которое может быть замещено 1-2 атомами О S или алкилом,W является -CO-, -СН 2- или -СН(-алкильной)- группой,Y является атомом кислорода, так же как С 1-С 4 алкиленом, С 2-С 4 алкиниленом, циклоалкиленом,аминокарбонилом, -NH-, -N(алкил)-, -СН 2 О-, -CH(OH)-, -ОСН 2- группой,Z является водородом или атомом галогена, нитро, амино, алкилом, C1-С 4 алкокси, циано, трифторметилом, гидроксильной или карбоксильной группой и оптические антиподы или рацематы и/или их фармацевтически приемлемые соли, образованные с кислотами и основаниями. В частности, соединений формулы (I), где W означает -СН 2-группу, и V, U, Y и Z имеют значения как определено для соединения формулы (I), а также соединений, где W означает -СО- группу, и V, U, Y и Z имеют значения как дано для соединения формулы (I). Кроме того, объектами настоящего изобретения являются фармацевтические композиции, содержащие амидные соединения карбоновых кислот формулы (I) или оптические антиподы или рацематы или их соли в качестве активных ингредиентов. Следующим объектом изобретения являются способы получения амидных соединений карбоновых кислот формулы (I) и фармацевтическое производство лекарственных препаратов, содержащих эти соединения, так же как способ лечения с использованием указанных соединений, который включает введение млекопитающему, нуждающемуся в лечении, включая человека - эффективного количества/количеств соединений формулы (I) настоящего изобретения как такого или как лекарственного средства. Новые амидные производные карбоновой кислоты формулы (I) настоящего изобретения являются высоко эффективными и селективными антагонистами NMDA рецептора, и более того, большинство этих соединений являются селективными антагонистами подтипа NR2B NMDA рецептора. В соответствии с настоящим изобретением амидные производные карбоновых кислот формулы (I) могут быть получены с помощью следующих процессов: а) карбоновая кислота формулы (II) где значения U, V и W являются теми, которые определены для формулы (I), или ее реакционноспособное производное взаимодействующее с амином формулы (III) где значения R1, R2, Y, Z, n и m являются теми, которые определены ранее для соединений формулыb) для получения соединений формулы (I), имеющих -СО- группу в положении W, где значения R1,2R , Y, Z, U, V, X, n и m являются теми, которые определены ранее для соединений формулы (I), карбоновая кислота формулы (IV) где значения X, R1, R2, Y, Z, n и m являются теми, которые определены ранее для соединений формулы (I) или ее реакионноспособное производное, взаимодействует с амином формулы (V) где значения U и V являются теми, которые определены ранее для соединений формулы (I); или с) для получения соединений формулы (I), имеющих -СН 2- или -СН(-алкильную)- группу в положении W, где алкил является С 1-С 4 алкильной группой и значения R1, R2, Y, Z, U, V, X, n и m являются теми,которые определены ранее для соединений формулы (I), галогенсодержащее производное соединения формулы (VII) где значение Q является атомом галогена, R3 является атомом водородом или С 1-С 4 алкильной группой и X, R1, R2, Y, Z, n и m являются теми, которые определены выше для соединений формулы (I),взаимодействует с амином формулы (V) где значения U и V являются теми, которые определены ранее для соединений формулы (I), илиd) вторичный амин формулы (III) где R1, R2, m, n, Y и Z имеют те же самые значения, которые определены для соединений формулы(I), взаимодействует с этилоксалилхлоридом в присутствии основания на твердой подложке в дихлорметане, полученный эфир формулы (VIII) где R1, R2, m, n, Y и Z имеют те же самые значения, которые определены для соединений формулы(I), подщелачивают сильноосновной ионной смолой в этаноле и полученный оксаламид кислоты формулы (IX) где R1, R2, m, n, Y и Z имеют те же самые значения, которые определены для соединений формулы где значения U и V являются теми, которые определены ранее для соединений формулы (I), в смеси дихлорметан/диметилформамид в присутствии 1-[3-(диметиламино)пропил]-3-этилкарбодиимида и полученное соединение формулы (I) - где R1, R2, Y, Z, U, V, X, W, n и m являются теми, как определено-3 010162 выше - в данном случае преобразуют в другое соединение формулы (I) путем введения дополнительных заместителей, и/или модифицирования, и/или удаления имеющихся заместителей, и/или путем образования солей с кислотами, и/или высвобождения амидного производного карбоновой кислоты формулы (I) из полученной кислотно-аддитивной соли путем обработки основанием и/или свободное амидное производное карбоновой кислоты формулы (I) может быть преобразовано в соль путем обработки основанием и/или разделено на его оптические антиподы. Образование амидной связи предпочтительно осуществляют путем получения активного производного из карбоновой кислоты формулы (II) или (IV), которое реагирует с амином формулы (III) или (V),предпочтительно, в присутствии основания. Превращение карбоновой кислоты в активное производное может быть осуществлено in situ во время образования амидной связи в подходящем растворителе (например, диметилформамиде, ацетонитриле, хлорированных углеводородах или углеводородах). Активными производными могут быть хлорангидриды кислот (например, полученные из карбоновой кислоты с тионилхлоридом), смешанные ангидриды (например, полученные из карбоновой кислоты с изобутилхлорформиатом в присутствии основания, например, триэтиламина), активные эфиры (например, полученные из карбоновой кислоты с гидроксибензтриазолом и дициклогексил-карбодиимидом или O-бензотриазол-1-ил-N,N,N',N'-тетраметилуроний гексафторфосфат (HBTU) в присутствии основания, например триэтиламина), кислотные азиды(например, полученные из гидразида карбоновой кислоты). Активные производные могут быть получены при температуре в интервале от комнатной до 0C. При этом добавляют подходящий амин формулы(III) или (V) в качестве основания или в качестве соли, образованной с неорганической кислотой, к полученному, таким образом, раствору или суспенизии в присутствии основания, например триэтиламина,требуемому для высвобождения амина. После реакций конденсации проводят тонкослойную хроматографию. Необходимое время реакции составляет 6-20 ч. Обработка реакционной массы может быть выполнена с помощью различных способов. Образование амидной связи, предпочтительно, проводят путем нагревания при кипении в подходящем растворителе амина формулы (V) с галоидсодержащим соединением формулы (IV) или (VII) в присутствии органического основания (например, триэтиламина, пиридина, пиперидина) или неорганического основания (например, карбоната натрия или карбоната калия) и иодида натрия. Подходящий растворитель может быть апротонным растворителем (например, толуолом, хлорированными углеводородами) или диполярным апротонным растворителем (например, кетоном, ацетонитрилом или диметилформамидом). После проведения реакции проводят тонкослойную хроматографию. Необходимое время реакции составляет 20-50 ч. Обработку реакционной массы также можно провести с помощью различных способов. Когда реакционная смесь является суспензией, осадок отфильтровывают, промывают водой и/или органическим растворителем и перекристаллизовывают из подходящего растворителя, что дает чистый продукт. Если кристаллизация не приводит к чистому продукту, тогда используют хроматографию на колонке для его очистки. Хроматографию на колонке выполняют в нормальной фазе, используя Кизельгель (Kiselgel) 60 в качестве адсорбента и различные системы растворителей, например толуол/метанол,хлороформ/метанол или толуол/ацетон, в качестве элюентов. Если реакционная смесь в конце реакции ацилирования или алкилирования представляет собой раствор, тогда его концентрируют и остаток кристаллизуют или очищают с помощью хроматографии на колонке, как описано выше. Структуру продуктов определяют с помощью РЖ, ЯМР и масс-спектрометрии. Полученные амидные производные карбоновой кислоты формулы: (I), вне зависимости от способа получения, в каждом случае могут быть переведены в другие соединения формулы (I) путем введения дополнительных заместителей и/или модифицирования и/или удаления имеющихся заместителей, и/или путем образования солей кислот и/или высвобождения производного амида карбоновой кислоты формулы (I) из полученных кислотно-аддитивных солей путем обработки основанием и/или свободное производное амида карбоновой кислоты формулы (I) может быть переведено в соль путем обработки а основания. Например, отщепление метальной и бензильной группы от метокси и бензилоксигрупп, которые находятся в Z положении, приводит к производным фенола. Удаление бензильной группы может быть осуществлено, например, каталитической гидрогенизацией или с помощью бромида водорода в растворе уксусной кислоты, отщепление метальной группы может быть осуществлено с помощью трибромида бора в растворе дихлорметана. Соединения формулы (I), содержащие свободную фенольную гидроксильную группу, могут быть преобразованы в ацилокси или сульфоксипроизводные с помощью различных ацилирующих или сульфонирующих агентов. Реакции выполняют при комнатной температуре в хлорированных углеводородах, используя хлорангидрид кислоты или ангидрид кислоты в качестве ацилирующего агента в присутствии основания (например, триэтиламина или карбоната натрия). Производные амида карбоновой кислоты формулы (I), содержащие нитрогруппу (I) могут быть переведены в амины с помощью каталитической гидрогенизации и амины могут затем реагировать, таким образом, что образуются кислотные амиды как описано для процесса ацилирования фенольных гидроксильных групп. Свободные гидроксильные группы могут быть этерифицированы с помощью ангидридов кислот или-4 010162 хлорангидридов кислот в присутствии основания. Карбоновые кислоты формулы (II) или (IV), первичные или вторичные амины формулы (III) или(V) и галогенсодержащие соединения формулы (VII) являются либо коммерчески доступными или они могут быть синтезированы с помощью различных известных способов. Синтез некоторых коммерчески не доступных карбоновых кислот формулы (II) или (IV) или галогенсодержащих соединений (VII) приведены в примерах. Следуя этим методикам другие коммерчески не доступные карбоновые кислоты формулы (II) или (IV) или галогенсодержащие соединения формулы (VII) также могут быть получены. Экспериментальные методики Оценка функционального NMDA-антагонистического потенциала соединений в первичных культурах корковых нейронов крысы, основанная на измерении внутриклеточной концентрации кальция с помощью флуориметрического счетчика Известно, что в процессе постнатального развития субъединичный состав нейронных NMDA рецепторов изменяется. Подобное изменение было обнаружено в нейронных клеточных культурах [Eur. J.Neurosci., 10, 1704-1715 (1998)]. Согласно данным из уровня техники и нашим собственным иммуноцитохимическим исследованиям, нейронные клетки, культивированные в течение 4-7 дней in vitro, преимущественно экспрессируют NR2B субъединицу вместе с NR1 субъединицей. Поэтому функциональный тест на NMDA-антагонизм в этих клетках отражает главным образом действие на рецепторы, содержащие NR2B субъединицу. Так как NMDA рецепторы, как известно, являются проницаемыми для ионов кальция при возбуждении, степень активации NMDA рецептора и его ингибирование функциональными антагонистами может характеризоваться путем измерения повышения внутриклеточной концентрации кальция после введения в клетки агониста (NMDA). Так как между NMDA рецепторами крысы и человека наблюдается очень высокая гомология последовательности (99, 95, 97% для NR1, NR2A иNR2B субъединиц, соответственно), полагается, что существует небольшое, если вообще имеется, различие в их фармакологической чувствительности. Следовательно, результаты, полученные с (клонированными или природными) NMDA рецепторами крысы, могут хорошо экстраполироваться на NMDA рецепторы человека. Измерения внутриклеточного кальция проводились на первичных неокортикальных клеточных культурах, полученных от 17-дневных эмбрионов крыс Charles River [для подробного получения неокортикальной клеточной культуры см. Johnson, M.I; Bunge, R.P. (1992): Primary cell cultures of peripheral andPress Inc., 13-38.] После выделения клетки помещают в стандартные 96-ячеечные микропланшеты и культуры поддерживают в атмосфере 95% воздух - 5% CO2 при 37 С до испытания. Культуры используют для внутриклеточных измерений кальция через 4-7 дней in vitro. Клетки окрашивают флуоресцентным Са 2+-чувствительным красителем Fluo-4/AM (2-2,5 мкМ) до испытания. Окрашивание останавливают, промывая дважды раствором, использующимся также в процессе измерения(140 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 5 мМ HEPES [4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота], 5 мМ HEPES-Na, 20 мМ глюкозы, 10 мкМ глицина, рН=7,4). Затем добавляют тестируемое соединение, растворенное в вышеупомянутом растворе (90 мкл/ячейка). Измерения внутриклеточного кальция проводят с помощью флуориметрического счетчика. Изменения вызывают введением 40 мкМNMDA в флуо-4-флуоресценцию, что отражает внутриклеточную концентрацию кальция. Ингибирующую активность тестируемого соединения оценивают измерением снижения роста кальция в присутствии различных концентраций соединения. После измерения применяют стандартную процедуру калибровки [Meth. Cell Biol., 40, 155-181 (1994)] для преобразования данных флюоресценции в величины концентрации кальция. Ингибирующий потенциал соединения в отдельной точке концентрации выражают в виде процентного ингибирования контрольного NMDA ответа. Сигмоидальные кривые концентрация-ингибирование строят по данным и определяют значения IC50 как концентрация, которая обеспечивает половину максимального ингибирования, достигаемого с помощью соединения. Средние значения IC50 получают по крайней мере из трех независимых экспериментов. Определение связывания соединений с NR2B субъединицей [3H]-Ro 25,6981 испытанием на связывание Метод, по существу, подобен методу, описанному Mutel и другими. [J. Neurochem., 70, 2147-2155(1998)], за исключением температуры инкубации и концентрации радиолиганда. Кратко, мембраны выделяют из передней доли мозга самцов крыс Wistar. Их инкубируют в присутствии и отсутствии тестируемого соединения в течение 2 ч при комнатной температуре. Неспецифическое связывание определяют с помощью 10 мкМ Ro-25,6981, и оно обычно составляет менее 7% от полного связывания. Концентрация применяемого радиолиганда (3H-Ro-25,6981) составляет 4 нМ. Значения IC50 (концентрации 50% ингибирования) определяют по сигмоидальным кривым, построенным по кривым концентрация - замещение. Биологическая активность соединений Значения IC50 для выбранных примеров соединений этого изобретения в функциональном NMDA антагонизме и в тестах на связывание представлены в таблице 1 и сравниваются со значениями, опреде-5 010162 ленными для самых сильных известных из уровня техники соединений. Соединения данного изобретения проявляют значения IC50 менее чем 50 мкМ в функциональномNMDA антагонизме и в тестах на связывание. Таким образом, соединения и фармацевтические композиции данного изобретения являются специфическими NMDA антагонистами NR2 В-подтип. Некоторые из соединений имеют превосходящую активность по сравнению с известными из уровня техники соединениями (см. табл. 1). Таблица 1. NMDA антагонист/связывающая активность соединений на природных нейронах /нейронных мембранах крысRo-связывание IC50: IC50, определенное испытанием на связывание с [3H]-Ro 25,6981 на церебральных мембранах крысы. Соединениями из уровня техники являются следующие соединения:Ro 256981: R-(R,S)-1-(4-гидроксифенил)-2-метил-3-[4-(фенилметил)пиперидин-1-ил]-1-пропанол. Ифенпродил: эритро-2-(4-бензилпиперидино)-1-(4-гидроксифенил)-1-пропанол. Формалиновый тест на мыши для измерения эффективности in vivo Инъекция растворенного формалина в заднюю лапу крыс или мышей, как известно, вызывает двухфазное связанное с болью поведение, измеряемое как время, затраченное на облизывание/покусывание поврежденной лапы. Вторая фаза обычно определяется как события, связанные с болью, происходящие с 15-60 мин временными интервалами после инъекции формалина. Известно, что NMDA рецепторы вовлечены во вторую фазу ответа на инъекцию формалина, и этот поведенческий ответ чувствителен к блокаде NMDA рецепторов [Dickenson, A. и Besson J.-M. (Editors): Chapter 1, стр. 6-7: Animal models ofAnalgesia; и Глава 8, стр 180-183: Mechanism of Central Hypersensitivity: Excitatory Amino Acid Mechanisms and Their Control - In Pharmacology of Paul. Springer-Verlag (Berlin) 1997.] Поэтому вторая фаза формалиновых испытаний используется для характеристики эффективности соединений in vivo. Считается, что ингибирование второй фазы ответа указывает на болеутоляющее действие против химическииндуцированной постоянной боли [Hunskaar, S., и др.: Formalin Test in Mice, a Useful Technique for Evaluating Mild Analgesics, Journal of Neuroscience Methods, 14 (1985) 69-76] Используют самцов альбиносов мышей NMRI Charles River (20-25 г). До эксперимента не давали никакую твердую пищу в течение 16 ч, но животные имели свободный доступ к 20% раствору глюкозы. Животных оставляли на 1 ч акклиматизироваться в стеклянном цилиндре (15 см в диаметре), затем перемещали в идентичный цилиндр с зеркалом, помещенным сзади, для облегчения наблюдения. Тестируемые вещества суспендировали в 5% Твин-80 (10 мл на кг веса тела) и вводили орально за 15 мин до инъекции формалина (20 мкл 1%-ого формалина в 0,9% солевом растворе, вводимый подкожно в дорзальную поверхность правой задней лапки). Измеряли время, потраченное на облизывание и покусывание инъецированной лапы от 20 до 25 мин после инъекции формалина. Для определения значений ED50 группам из 5 мышей вводили различные дозы (по крайней мере пять) тестируемых веществ и в тот же день наблюдали результаты, выраженные как % времени ингибирования, потраченное на облизывание по сравнению с контрольной группой. Значения ED50 (то есть доза, приводящая к 50% ингибированию) были рассчитаны выравниванием сигмоидальной кривой Больтцмана.: Значения ED50 не были определены, если ингибирование составляло менее чем 50% при дозе 20 мг/кг. Заболевания, которые можно успешно лечить NMDA антагонистами, включают травматическое повреждение головного мозга [Neurol. Res., 21, 330-338 (1999)] или спинного мозга [Eur. J. Pharmacol., 175,165-74 (1990)], нейронные повреждения, связанные с вирусом иммунодефицита человека (ВИЧ) [Annu.Rev. Pharmacol. Toxicol., 1998; 38159-77], амиотрофический боковой склероз [Neurol. Res., 21, 309-12(1999)], толерантность и/или зависимость от опиоидного лечения боли [Brain. Res., 731, 171-181 (1996)],синдромы зависимости, например, от алкоголя, опиатов или кокаина [Drug and Alcohol Depend., 59, 1-15[Expert Opin. Investig. Drugs, 9, 1397-406 (2000)]. NMDA антагонист может также быть полезен для лечения церебральной ишемии любого происхождения (например, инсульт, хирургия сердца), хронических нейродегенеративных нарушений, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боль (например, посттравматическая или послеоперационная) и хронических болевых состояний, таких как нейропатическая боль или боль, связанная с раком, эпилепсии, беспокойства, депрессии,мигрени, психоза, гипогликемии, дегенеративных нарушений сетчатки (например, CMV ретинит), глаукомы, астмы, звона в ушах, потери слуха, вызванной аминогликозидным антибиотиком [Drug News Perspect 11, 523-569 (1998) и WO 00/00197]. Соответственно, эффективные количества соединений по изобретению могут успешно использоваться для лечения травматических повреждений головного мозга или спинного мозга, нейронных повреждений, связанных с вирусом иммунодефицита человека (ВИЧ), амиотрофического бокового склероза, толерантности и/или зависимости от опиоидного лечения боли, синдромов зависимости, например, от алкоголя, опиатов или кокаина, ишемических заболеваний ЦНС, хронических нейродегенеративных нарушений, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боли и хронических болевых состояний, таких как нейропатическая боль или боль, связанная с раком, эпилепсии, беспокойства, депрессии, мигрени, психоза, мышечных спазмов, слабоумия различного происхождения,гипогликемии, дегенеративных нарушений сетчатки, глаукомы, астмы, звона в ушах, потери слуха, вызванной аминогликозидным антибиотиком. Соединения по изобретению, а также их фармацевтически приемлемые соли, могут использоваться отдельно или соответственно в форме фармацевтических композиций. Эти композиции (лекарственные средства) могут быть в твердой, жидкой или полужидкой форме и могут добавляться фармацевтические адъюванты и вспомогательные материалы, которые обычно используются на практике, такие как носители, наполнители, разбавители, стабилизаторы, увлажняющие или превращающие в эмульсию агенты,регуляторы рН и осмотического давления, отдушки или ароматизаторы, а также добавки, облегчающие продвижение или обеспечивающие получение состава. Дозировка, требующаяся для проявления терапевтического эффекта, может изменяться в широких пределах и будет зависеть от индивидуальных требований в каждом из конкретных случаев, в зависимости от стадии болезни, состояния и веса тела излечиваемого пациента, а также от чувствительности пациента к активному компоненту, способа введения и количества ежедневных приемов. Фактическая доза используемого активного компонента может быть успешно определена лечащим врачом, специалистом в области болезни пациента. Фармацевтические композиции, содержащие активный ингредиент согласно настоящему изобретению, обычно содержат от 0,01 до 100 мг активного ингредиента в отдельной единичной дозировке. Конечно, возможно, что количество активного ингредиента в некоторых композициях превышает верхнюю или нижнюю границы, определенные выше. Твердыми формами фармацевтических композиций могут быть, например, таблетки, драже, капсулы, пилюли или ампулы с лиофилизованным порошком, полезные для получения инъекций. Жидкими-7 010162 композициями являются инъецируемые и вливаемые композиции, жидкие лекарственные средства, упакованные жидкости и капли. Полужидкими составами могут быть мази, бальзамы, кремы, встряхиваемые смеси и свечи. Для простого введения подходит, если фармацевтические композиции включают единицы дозировки, содержащие количество активного ингредиента, вводимого однократно или в несколько приемов, или половину, третью или четвертую часть от этого количества. Такими единицами дозировки являются, например, таблетки, которые могут быть выполнены с углублениями, обеспечивающими деление таблетки на две или четыре части, чтобы точно ввести требующееся количество активного ингредиента. Таблетки могут быть покрыты кислоторастворимым слоем, чтобы облегчить высвобождение содержания активного ингредиента после прохождения желудка. Такие таблетки являются покрытыми для кишечника. Подобный эффект может достигаться также при заключении в капсулу активного ингредиента. Фармацевтические композиции для орального введения могут содержать, например, лактозу или крахмал в качестве эксципиентов, натрия карбоксиметилцеллюлозу, метилцеллюлозу, поливинил пирролидин или крахмальную пасту в качестве связующих агентов или гранулирующих агентов. Картофельный крахмал или микрокристаллическую целлюлозу добавляют в качестве разрыхляющих агентов, может также использоваться ультрамилопектин или формальдегидный казеин. Тальк, коллоидная кремниевая кислота, стеарин, стеарат кальция или магния могут использоваться в качестве антиадгезионного агента и смазки. Таблетка могут быть изготовлена, например, влажным гранулированием с последующим прессованием. Смешанные активные ингредиенты и эксципиенты, а также в данном случае часть расщепляющих веществ гранулируются с водным, спиртовым или водно-спиртовым раствором связующих веществ в соответствующем оборудовании, затем гранулят высушивается. Другие расщепляющие вещества, смазки и антиадгезионные агенты добавляются к высушенному грануляту, и смесь прессуется в таблетку. В данном случае таблетки сделаны с углублением, делящим на две части, чтобы упростить введение. Таблетки могут быть изготовлены непосредственно из смеси активного ингредиента и подходящих вспомогательных средств с помощью прессования. В данном случае таблетки могут быть покрыты с помощью добавок, обычно использующихся в фармацевтической практике, например, стабилизаторами,отдушками, красителями, такими как сахар, производными целлюлозы (метил- или этилцеллюлоза, натрия карбоксиметилцеллюлоза и т.д.), поливинил пирролидоном, фосфатом кальция, карбонатом кальция, пищевыми красителями, пищевыми ликерами, ароматическими агентами, пигментами оксида железа и т.д. В случае капсул смесь активного ингредиента и вспомогательных средств заполняется в нее. Жидкие оральные композиции, например суспензии, сиропы, эликсиры могут быть получены, используя воду, гликоли, масла, спирты, красители и отдушки. Для ректального введения композицию готовят в виде свечей или клизм. Свечи могут содержать кроме активного ингредиента носитель, так называемый свиной жир для свечей. Носителями могут быть растительные масла, такие как гидрогенизированные растительные масла, триглицериды C12-C18 жирных кислот (предпочтительно носители с торговым названием Witepsol). Активный ингредиент гомогенно смешивается с расплавленным загустителем для свечей, и формируются свечи. Для парентерального введения композицию получают в виде раствора для инъекции. Для получения раствора для инъекции активные ингредиенты растворяют в дистиллированной воде и/или в различных органических растворителях, таких как гликолиевые эфиры, в данном случае в присутствии солюбилизатора, например полиоксиэтиленсорбитан-монолаурат, -моноолеат или моностеарат (Tween 20,Tween 60, Tween 80). Раствор для инъекции может также содержать различные вспомогательные средства, такие как консерванты, например этилендиамин тетраацетат, а также агенты для регулирования рН и буферы и в данном случае местное обезболивающее средство, например лидокаин. Раствор для инъекции, содержащий активный ингредиент по изобретению, отфильтровывают до заполнения в ампулы и стерилизуют после заполнения. Если активный ингредиент является гигроскопическим, он затем может быть стабилизирован лиофилизацией. Следующие примеры иллюстрируют изобретение без намерения так или иначе ограничить его объем. Пример 1. 2-[4-(4-Фторбензил)пиперидин-1-ил 1-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)ацетамид (45 70001598). 1a) Этиловый эфир [4-(4-фторбензил)пиперидин-1-ил]оксоуксусной кислоты. К перемешиваемому раствору 2,3 г (10 ммоль) гидрохлорида 4-(4-фторбензил)пиперидина [J. Med.Chem., 35, 4903. (1992)] и 4,5 мл (32 ммоль) триэтиламина в 80 мл хлороформа 2,5 мл (22 ммоль) добавляют по каплям этилоксалилхлорида в 20 мл хлороформа при температуре ниже 10C и реакционную смесь перемешивают при комнатной температуре в течение 10 ч. Затем к смеси добавляют 50 мл 8% раствора гидрокарбоната натрия, органический слой отделяют и водную фазу экстрагируют трижды 25 мл хлороформа. Объединенные органические слои сушат над сульфатом натрия, концентрируют, остаток обрабатывают диизопропиловым эфиром и кристаллы фильтруют, что дает на выходе 2,1 г (72%) на-8 010162 званного соединения. Температура плавления.: 72-74 С (диизопропиловый эфир). 1b) [4-(4-Фторбензил)пиперидин-1-ил]оксоуксусной кислоты. К перемешиваемому раствору 1,91 г (6,5 ммоль) этилового эфира [(4-фторбензил)-пиперидин-1-ил]оксоуксусной кислоты в 15 мл этанола добавляют раствор 1,18 г (21,1 ммоль) гидроксида калия в 3 мл воды. Реакционную смесь перемешивают при комнатной температуре в течение 6 ч, затем охлаждают и подкисляют соляной кислотой. Твердое вещество собирают, промывают водой, что дает на выходе 1,68 гTech.)] и 100 мл диметилформамида перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь концентрируют. Затем к смеси добавляют 150 мл 8% раствора гидрокарбоната натрия и 150 мл хлороформа. Органический слой отделяют и водную фазу экстрагируют трижды по 25 мл хлороформа. Объединенные органические слои сушат над сульфатом натрия, концентрируют и остаток очищают с помощью хроматографии на колонке, используя Кизельгель (Kiselgel) 60 в качестве адсорбента (Merk) и смесь хлороформ: метанол = 19:1 в качестве элюента, что дает на выходе 2,67 г (68%) названного соединения. T. пл.: 195-197 С (диэтиловый эфир). Пример 2. 2-[4-(4-Фторбензил)пиперидин-1-ил 1-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-бензимидазол-5 ил)ацетамид (45 70001623). Смесь 2,5 г (9,6 ммоль) [4-(4-фторбензил)пиперидин-1-ил]оксоуксусной кислоты (пример 1b), 1,1 мл (8 ммоль) триэтиламина, 1,2 г (8 ммоль) 5-амино-1,3-дигидробензимидазол-2-она [J. Amer. Chem.Soc., 80, 1657. (1958)] 3,03 г (8 ммоль) HBTU и 80 мл диметилформамида перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь концентрируют, затем добавляют 100 мл 8% раствора гидрокарбоната натрия. Осажденный продукт отфильтровывают и повторно кристаллизуют из метанола,что дает на выходе 1,51 г (48%) названного соединения. T. пл.:260C (метанол). Пример 3. 2-[4-(4-Фторбензил)пиперидин-1-ил-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид (45 70001620). Названное соединение получают из [4-(4-фторбензил)пиперидин-1-ил]оксоуксусной кислоты (пример 1b) и 6-амино-3 Н-бензоксазол-2-она [J. Chem. Soc., 321. (1938)] в соответствии со способом, описанным в примере 1c. T. пл.: 224-227 С (диэтиловый эфир). Пример 4. 2-[4-(4-Фторбензил)пиперидин-1-ил 1-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-5-ил)ацетамид (45 70001759). Названное соединение получают из 5-амино-3 Н-бензоксазол-2-она [J. Med. Chem., 10, 408. (1967)] и[4-(4-фторбензил)-пиперидин-1-ил]-оксоуксусной кислоты (пример 1b) в соответствии со способом, описанным в примере 2. T. пл.: 226-231C (вода). Пример 5. 2-(4-Бензилпиперидин-1-ил)-N-(4-цианофенил)-2-оксоацетамид (45 70001798). 5 а). Этиловый эфир (4-бензилпиперидин-1-ил)оксоуксусной кислоты. Названное соединение получают из 4-бензилпиперидина (Aldrich) и этилоксалилхлорида в соответствии со способом, описанным в примере 1a. T. пл.: масло. 5b) (4-Бензилпиперидин-1-ил)оксоуксусной кислоты. Названное соединение получают из этилового эфира (4-бензилпиперидин-1-ил)-оксоуксусной кислоты в соответствии со способом, описанным в примере 1b. T. пл.: 109-112 С (этанол-вода). 5 с) 2-(4-Бензилпиперидин-1-ил)-N-(4-цианофенил)-2-оксоацетамид. Названное соединение получают из 4-аминобензонитрила (Aldrich) и (4-бензилпиперидин-1-ил)оксоуксусной кислоты в соответствии со способом, описанным в примере 2. T. пл.: 166-169 С (диэтиловый эфир). Пример 6. 2-(4-Бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)ацетамид (45 70001823). Названное соединение получают из (4-бензилпиперидин-1-ил)оксоуксусной кислоты (пример 5b) и 5-амино-1,3-дигидроиндол-2-она в соответствии со способом, описанным в примере 2. T. пл.: 115-118 С(вода). Пример 7. 2-(4-Бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-бензимидазол-5-ил)ацетамид (45 70001824). Названное соединение получают из (4-бензилпиперидин-1-ил)-оксоуксусной кислоты (пример 5b) и 5-амино-1,3-дигидробензимидазол-2-она в соответствии со способом, описанным в примере 2. T. пл.:260C (вода). Пример 8. 2-(4-Бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид (45 70001861). Названное соединение получают из (4-бензилпиперидин-1-ил)-оксоуксусной кислоты (пример 5b) и 6-амино-3 Н-бензоксазол-2-она в соответствии со способом, описанным в примере 1c. T. пл.: 190-193 С-9 010162 Пример 9. 1-(4-Бензилпиперидин-1-ил)-N-(1H-индазол-5-ил)-2-оксоацетамид (45 70001814). Названное соединение получают из 5-аминоиндазола (Aldrich) и (4-бензилпиперидин-1-ил)оксоуксусной кислоты (пример 5b) в соответствии со способом, описанным в примере 1c. T. пл.: 204209C (диэтиловый эфир). Пример 10. 1-[4-(4-Фторбензил)пиперидин-1-ил]-N-(1H-индазол-5-ил)-2-оксоацетамид(45 70001816). Названное соединение получают из 5-аминоиндазола (Aldrich) и [4-(4-фторбензил)пиперидин-1 ил]оксоуксусной кислоты (пример 1b) в соответствии со способом, описанным в примере 2. T. пл.: 198200C (диэтиловый эфир). Пример 11. 2-[4-(4-Фторбензил)пиперидин-1-ил-2-оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)ацетамид (45 70001818). Названное соединение получают из 7-амино-4 Н-бензо[1,4]оксазин-3-она [J. Med. Chem., 32, 1627.(1989)] и [4-(4-фторбензил)пиперидин-1-ил]-оксоуксусной кислоты (пример 1b) в соответствии со способом, описанным в примере 2. T. пл.: 209-212C (диэтиловый эфир). Пример 12. N-(1 Н-Бензимидазол-5-ил)-2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксоацетамид (45 70001820). Названное соединение получают из (1 Н-бензимидазол-5-ил) амина [Synth. Commun., 29. 2435.(1999)] и [4-(4-фторбензил)пиперидин-1-ил]оксоуксусной кислоты (пример 1b) в соответствии со способом, описанным в примере 1c. T. пл.: 104-110C (диэтиловый эфир). Пример 13. 2-(4-Бензилпиперидин-1-ил-2-оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил) ацетамид (45 70001844). Названное соединение получают из 7-амино-4 Н-бензо[1,4]оксазин-3-она и (4-бензилпиперидин-1 ил)оксоуксусной кислоты (пример 5b) в соответствии со способом, описанным в примере 2. T. пл.: 123126 С (диэтиловый эфир). Пример 14. 2-[4-(4-Фторбензил)пиперидин-1-ил 1-N-(1H-индазол-6-ил)-2-оксоацетамид(45 70001815). Названное соединение получают из 6-аминоиндазола (Aldrich) и [4-(4-фторбензил)-пиперидин-1 ил]оксоуксусной кислоты (пример 1b) в соответствии со способом, описанным в примере 2. T. пл.: 162164 С (диэтиловый эфир). Пример 15. 2-Оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)-2-(4-п-толилоксипиперидии-1-ил)ацетамид (45 70002274). 15 а). Этиловый эфир оксо-(4-п-толилоксипиперидин-1-ил)уксусной кислоты. Названное соединение получают из 4-п-толилоксипиперидина [J. Med. Chem., 21, 309. (1978)] и этилоксалилхлорида в соответствии со способом, описанным в примере 1a. T. пл.: масло. 15b) Оксо-(4-п-толилоксипиперидин-1-ил)-уксусной кислоты. Названное соединение получают из этилового эфира оксо-(4-п-толилоксипиперидин-1-ил)уксусной кислоты в соответствии со способом, описанным в примере 1b. T. пл.: 109-112C (этанол-вода). 15 с) 2-Оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)-2-(4-п-толилоксипиперидин-1-ил)ацетамид. Названное соединение получают из оксо-(4-п-толилоксипиперидин-1-ил)уксусной кислоты и 5 амино-1,3-дигидроиндол-2-она в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол: метанол = 4:1 в качестве элюента. T. пл.: 176-178 С (диэтиловый эфир). Пример 16. 2-[4-(4-Фторфенокси)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)ацетамид (45 70002365). 16 а). Этиловый эфир [4-(4-фторфенокси)пиперидин-1-ил]оксоуксусной кислоты. Названное соединение получают из 4-(4-фторфенокси)пиперидин (US 3260723) и этилоксалилхлорида в соответствии со способом, описанным в примере 1a. T. пл.: масло. 16b) [4-(4-Фторфенокси)-пиперидин-1-ил]оксоуксусной кислоты. Названное соединение получают из этилового эфира [4-(4-фторфенокси)-пиперидин-1-ил]оксоуксусной кислоты в соответствии со способом, описанным в примере 1b. T. пл.: 147-149C (этанолвода). 16 с) 2-[4-(4-Фторфенокси)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)ацетамид. Названное соединение получают из [4-(4-фторфенокси)пиперидин-1-ил]оксоуксусной кислоты и 5 амино-1,3-дигидроиндол-2-она в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 209-211 С (диэтиловый эфир). Пример 17. 2-Оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)-2-(4-феноксипиперидин-1-ил)ацетамид(45 70002366). 17 а) Этиловый эфир оксо-(4-феноксипиперидин-1-ил)уксусной кислоты. Названное соединение получают из 4-феноксипиперидина (J. Med. Chem., 17, 1000. (1974)] и этилоксалилхлорида в соответствии со способом, описанным в примере 1a. T. пл.: масло. 17b) Оксо-(4-феноксипиперидин-1-ил)уксусной кислоты.- 10010162 Названное соединение получают из этилового эфира оксо-(4-феноксипиперидин-1-ил)уксусной кислоты в соответствии со способом, описанным в примере 1b. T. пл.: 109-112 С (этанол-вода). 17 с) 2-Оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)-2-(4-феноксипиперидин-1-ил)ацетамид. Названное соединение получают из оксо-(4-феноксипиперидин-1-ил)уксусной кислоты и 5-амино 1,3-дигидроиндол-2-она в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 78-81C (диэтиловый эфир). Пример 18. 2-[4-(4-Хлорфенокси)пиперидин-1-ил-2-оксо-N-(2-оксо-2,3-дигидро-1H-индол-5-ил) ацетамид (45 70002367). 18 а) Трет-бутиловый эфир 4-(4-хлорфенокси)пиперидин-1-карбоновой кислоты. В атмосфере аргона, к перемешиваемому раствору 10,0 г (49,7 ммоль) трет-бутилового эфира 4 гидроксипиперидин-1-карбоновой кислоты [Bioorg. Med. Chem. Lett. 10 2815. (2000)] в 80 мл диметилформамида добавляют 3,0 г (60%, 75 ммоль) гидрида натрия. Реакционную смесь перемешивают в течение часа при температуре 40C, затем добавляют по каплям при температуре 20C 5,3 мл (49,7 ммоль) 1 хлор-4-фторбензола (Aldrich) в 20 мл диметилформамида. Реакционную смесь перемешивают в течение 4 ч при температуре 80C, а затем охлаждают до температуры 20C, добавляют по каплям 1 мл этанола,выливают в 100 мл воды и экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия и концентрируют. Остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60(Merk) в качестве адсорбента и этилацета в качестве элюента, что дает на выходе 11,07 г (75,5%) названного соединения. T. пл.: масло. 18b) 4-(4-Хлорфенокси)пиперидин гидрохлорид. К раствору 150 мл 2,5 M соляной кислоты в этилацетате 11,07 г (37,5 ммоль) добавляют третбутиловый эфир 4-(4-хлорфенокси)пиперидин-1-карбоновой кислоты. Реакционную смесь перемешивают в течение 3 часов при температуре 20C, а затем концентрируют до 50 мл. Осажденные кристаллы отфильтровывают, промывают этилацетатом, что дает на выходе 7,0 г (75,2%) названного соединения. T. пл.: 194-196 С. 18 с) Этиловый эфир [4-(4-хлорфенокси)пиперидин-1-ил]оксоуксусная кислота. Названное соединение получают из 4-(4-хлорфенокси)пиперидина и этилоксалилхлорида в соответствии со способом, описанным в примере 1a. T. пл.: масло. 18d) [4-(4-Хлорфенокси)пиперидин-1-ил-оксоуксусная кислота. Названное соединение получают из этилового эфира [4-(4-фторфенокси)пиперидин-1-ил]оксоуксусной кислоты в соответствии со способом, описанным в примере 1b. T. пл.: 144-145 С (этанол-вода). 18 е) 2-[4-(4-Хлорфенокси)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)ацетамид. Названное соединение получают из [4-(4-хлорфенокси)пиперидин-1-ил]оксоуксусной кислоты и 5 амино-1,3-дигидроиндол-2-она в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 198-200C (диэтиловый эфир). Пример 19. 2-[4-(4-Хлорфенокси)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-бензимидазол 5-ил)-ацетамид (45 70002405). Названное соединение получают из [4-(4-хлорфенокси)пиперидин-1-ил]оксоуксусной кислоты(пример 18d) и 5-амино-1,3-дигидробензимидазол-2-она в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь хлороформ:метанол = 10:1 в качестве элюента. T. пл.: 286-288 С (изопропанол). Пример 20. 2-[4-(4-Хлорфенокси)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил) ацетамид (45 70002407). Названное соединение получают из [4-(4-хлорфенокси)пиперидин-1-ил]оксоуксусной кислоты(пример 18d) и 6-амино-3 Н-бензоксазол-2-она в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель(Kiselgel) 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 242244 С (изопропанол). Пример 21. 2-(4-Бензилпиперидин-1-ил)-2-оксо-N-(2-тиоксо-2,3-дигидробензоксазол-6-ил)ацетамид (45 70002446). К перемешиваемому раствору 0,3 г (1,8 ммоль) 6-амино-3 Н-бензоксазол-2-тиона [J. Org. Chem., 19; 758. (1954)] и 0,6 мл (4,3 ммоль) триэтиламина в 20 мл хлороформа добавляют по каплям при температуре 0C 0,5 г (1,8 ммоль) (4-бензилпиперидин-1-ил)оксоацетилхлорид (пример 27 с) в 10 мл хлороформа. Реакционную смесь перемешивают при комнатной температуре в течение часа, затем промывают водой и органический слой концентрируют. Остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента, что дает на выходе 0,46 г (61,9%) названного соединения. T. пл.: 203C (изопропанол). Пример 22. 2-[4-(4-Хлорбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6- 11010162 ил)ацетамид (45 70002466). 22 а) Этиловый эфир [4-(4-хлорбензил)пиперидин-1-ил-оксоуксусной кислоты. Названное соединение получают из 4-(4-хлорбензил)пиперидина (C.A. 77, 34266 w) и этилоксалилхлорида в соответствии со способом, описанным в примере 1a. T. пл.: масло. 22b) [4-(4-Хлорбензил)пиперидин-1-ил]оксоуксусная кислота. Названное соединение получают из этилового эфира [4-(4-хлорбензил)-пиперидин-1-ил]оксоуксусной кислоты в соответствии со способом, описанным в примере 1b. T. пл.: 147-148 С (этанол-вода). 22 с) 2-[4-(4-Хлорбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид. Названное соединение получают из [4-(4-хлорбензил)пиперидин-1-ил]оксоуксусной кислоты и 6 амино-3 Н-бензоксазол-2-она в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 215 С (изопропанол). Пример 23. 2-[4-(4-Хлорбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-бензимидазол-5 ил)ацетамид (45 70002467). Названное соединение получают из [4-(4-хлорбензил)пиперидин-1-ил]оксоуксусной кислоты (пример 22b) и 5-амино-1,3-дигидробензимидазол-2-она в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60(Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 299-300C (изопропанол). Пример 24. 2-Оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)-2-(4-п-толилоксипиперидин-1-ил)ацетамид (45 70002480). Названное соединение получают из оксо-(4-п-толилоксипиперидин-1-ил)уксусной кислоты (пример 15b) и 6-амино-3 Н-бензоксазол-2-она в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 203C (изопропанол). Пример 25. 2-Оксо-N-(2-оксо-2,3-дигидро-1H-бензимидазол-6-ил)-2-(4-п-толилоксипиперидин-1 ил)ацетамид (45 70002481). Названное соединение получают из оксо-(4-п-толилоксипиперидин-1-ил)-уксусной кислоты (пример 15b) и 5-амино-1,3-дигидробензимидазол-2-она в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60(Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 294 С (изопропанол). Пример 26. 2-[4-(4-Хлорбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)ацетамид (45 70002486). Названное соединение получают из [4-(4-хлорбензил)-пиперидин-1-ил]-оксоуксусной кислоты(пример 22b) и 5-амино-1,3-дигидроиндол-2-она в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60(94,8 ммоль) ди-трет-бутилдикарбоната, 13,2 мл (94,8 ммоль) триэтиламина и 0,2 г (1,6 ммоль) 4(диметиламино)пиридина перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь промывают водой, сушат над сульфатом натрия и концентрируют, что дает на выходе 15,3 г (99,5%) названного соединения. Сырой продукт используют на следующей стадии. 27b) трет-Бутиловый эфир 5-амино-2,3-дигидроиндол-1-карбоновой кислоты. Смесь 15,3 г (60,7 ммоль) трет-бутилового эфира 5-нитро-2,3-дигидроиндол-1-карбоновой кислоты,200 мл метанола, 200 мл тетрагидрофурана и 1 г 10% Pd/C катализатора гидрогенизируют. После завершения реакции катализатор отфильтровывают, промывают тетрагидрофураном и фильтрат концентрируют. Остаток обрабатывают смесью диизопропилового эфира и гексаном и выпавшие в осадок кристаллы отфильтровывают, что дает на выходе 12,2 г (90,5%) названного соединения. T. пл.: 75-76 С (изопропил эфир-гексан). 27 с) (4-бензилпиперидин-1-ил-оксоацетилхлорид. Смесь 28,78 г (116,3 ммоль) (4-бензилпиперидин- 1-ил)-оксоуксусной кислоты (пример 5b) и 50 мл тионилхлорида нагревают при кипении в течение 2 ч. Реакционную смесь концентрируют, что дает на выходе 30,5 г (98,6%) названного соединения в качестве твердого вещества. Сырой продукт используют на следующей стадии. 27d) трет-Бутиловый эфир 5-[2-(4-бензилпиперидин-1-ил)-2-оксоацетиламино]-2,3-дигидроиндол-1 карбоновой кислоты. К перемешиваемому раствору 0,5 г (2,25 ммоль) трет-бутилового эфира 5-амино-2,3-дигидроиндол- 12010162 1-карбоновой кислоты и 0,4 мл (2,8 ммоль) триэтиламина в 20 мл хлороформа добавляют по каплям при температуре 0C 0,7 г (2,6 ммоль) (4-бензилпиперидин-1-ил)-оксоацетилхлорида в 10 мл хлороформа. Реакционную смесь перемешивают при комнатной температуре в течение часа, затем промывают водой и органический слой концентрируют. Остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол: метанол = 4:1 в качестве элюента, что дает на выходе 0,9 г (88,7%) названного соединения как твердое вещество. Сырой продукт используют на следующей стадии. 27 е) 2-(4-Бензилпиперидин-1-ил)-N-(23-дигидро-1 Н-ищюл-5-ил)-2-оксоацетамид К раствору 10 мл 2,5 M соляной кислоты в этилацетате добавляют 0,9 г (2,0 ммоль) трет-бутилового эфира 5-[2-(4-бензилпиперидин-1-ил)-2-оксоацетиламино]-2,3-дигидроиндол-1-карбоновой кислоты. Реакционную смесь перемешивают в течение 3 ч при температуре 20C, затем концентрируют. Продукт преобразуют в основание с помощью 2 M раствора карбоната натрия, экстрагируют хлороформом, органический слой концентрируют и остаток сушат, что дает на выходе 0,45 г (64,1%) названного соединения. T. пл.: 152 С. Пример 28. N-(2-Амино-3 Н-бензимидазол-5-ил)-2-(4-бензилпиперидин-1-ил)-2-оксоацетамид трифторацетат (45 70002545). 28 а) трет-Бутиловый эфир (5-нитро-1H-бензимидазол-2-ил)карбаминовой кислоты. трет-Бутиловый эфир (6-нитро-1 Н-бензимидазол-2-ил)карбаминовой кислоты. Смесь 11,86 г (39,4 ммоль) нитрата 5-нитро-1(3)Н-бензимидазол-2-иламина (US 2324123), 150 мл дихлорметана, 11,0 г (50,4 ммоль) ди-трет-бутилдикарбоната и 14,0 мл (100,6 ммоль) триэтиламина перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь промывают водой, сушат над сульфатом натрия и концентрируют. Остаток кристаллизуют из изопропанола, что дает на выходе 13,3 г (97,2%) смесь 1:1 названных соединений в виде твердого вещества. T. пл.: 151-152 С (изопропанол). 28b) трет-Бутиловый эфир (5-амино-1 Н-бензимидазол-2-ил)карбаминовой кислоты. трет-Бутиловый эфир (6-амино-1 Н-бензимидазол-2-ил)карбаминовой кислоты. Смесь 13,3 г (47,8 ммоль) трет-бутилового эфира (5-нитро-1 Н-бензоимидазол-2-ил)карбаминовой кислоты и трет-бутилового эфира (6-нитро-1 Н-бензимидазол-2-ил)карбаминовой кислоты, 100 мл метанола, 100 мл тетрагидрофурана и 1 г 10% Pd/C катализатора гидрогенизируют. После завершения реакции катализатор отфильтровывают, промывают тетрагидрофураном и фильтрат концентрируют. Остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь хлороформ:метанол = 10:1 в качестве элюента, что дает на выходе 4,72 г (40,4%) трет-бутилового эфира (6-амино-1 Н-бензоимидазол-2-ил)-карбаминовой кислоты трет-бутилового эфира (Rf 0,5), T. пл.: 159 С (диэтиловый эфир) и 4,2 г (36,0%) (5-амино-1H-бензоимидазол-2-ил)-карбаминовой кислоты третбутилового эфира (Rf 0,4) T. пл.: 168 С (диэтиловый эфир). 28 с) трет-Бутиловый эфир 5-[2-(4-Бензилпиперидин-1-ил)-2-оксоацетиламино]-1 Н-бензоимидазол 2-ил]карбаминовой кислоты. К перемешиваемому раствору 1,0 г (4,06 ммоль) трет-бутилового эфира (6-амино-1 Н-бензимидазол 2-ил)-карбаминовой кислоты и 0,8 мл (5,7 ммоль) триэтиламина в 30 мл хлороформа добавляют по каплям при температуре 0C 1,5 г (5,6 ммоль) (4-бензилпиперидин-1-ил)-оксоацетилхлорид (пример 27 с) в 20 мл хлороформа. Реакционную смесь перемешивают при комнатной температуре в течение часа, затем промывают водой и органический слой концентрируют. Остаток кристаллизуют из смеси хлороформметанол = 10:1, что дает на выходе 1,3 г (67,1%) названного соединения. T. пл.: 192 С (хлороформметанол = 10:1). 28d) N-(2-Амино-3 Н-бензимидазол-5-ил)-2-(4-бензилпиперидин-1-ил)-2-оксоацетамид трифторацетат. К раствору 5 мл 5% трифторуксусной кислоты в дихлорметане добавляют 0,8 г (1,67 ммоль) третбутилового эфира 5-[2-(4-бензилпиперидин-1-ил)-2-оксоацетиламино]-1 Н-бензимидазол-2-илкарбаминовой кислоты. Реакционную смесь перемешивают в течение 48 часов при температуре 20C. Выпавшие в осадок кристаллы отфильтровывают и промывают дихлорметаном, что дает на выходе 0,8 г(45 700025791. Названное соединение получают из (4-бензилпиперидин-1-ил)оксоуксусной кислоты (пример 5b) и 2,6-диаминобензтиазола [Arch. Pharm., 13, 48. (1935)] в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 203C (изопропанол). Пример 30. 2-(4-Бензилпиперидин-1-ил)-N-(2,2-диоксо-2,3-дигидро-1 Н-26-бензо[с]изотиазол-5 ил)-2-оксоацетамид (45 70002724). Названное соединение получают из (4-бензилпиперидин-1-ил)оксоуксусной кислоты (пример 5b) и 5-амино-1,3-дигидро-2,1-бензизотиазол-2,2-диоксида [J. Het. Chem., 23, 1645. (1986)] в соответствии со- 13010162 способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 181-182 С (изопропанол). Пример 31. 2-[4-(4-трет-Бутилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6 ил)ацетамид (45 70002797). 31 а) Этиловый эфир [4-(4-трет-бутилбензил)пиперидин-1-ил]оксоуксусной кислоты. Названное соединение получают из 4-(4-трет-бутилбензил)пиперидина [J. Org. Chem. 64, 3763.(1999)] и этилоксалилхлорида в соответствии со способом, описанным в примере 1a. T. пл.: масло. 31b) [4-(4-трет-Бутилбензил)пиперидин-1-ил]оксоуксусная кислота. Названное соединение получают из этилового эфира [4-(4-трет-бутилбензил)пиперидин-1 ил]оксоуксусной кислоты в соответствии со способом, описанным в примере 1b. T. пл.: масло. 31c) 2-[4-(4-трет-Бутилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил) ацетамид. Названное соединение получают из [4-(4-трет-бутилбензил)пиперидин-1-ил]оксоуксусной кислоты и 6-амино-3 Н-бензоксазол-2-она в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 168 С (диэтиловый эфир-гександиизопропиловый эфир). Пример 32. 2-[4-(4-Дианобензил)пиперидин-1-ил-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил) ацетамид (45 70002844). 32 а) 4-(1-Бензилпиперидин-4-илиденметил)бензонитрил. В атмосфере аргона, к перемешиваемому раствору 5,0 г (26,4 ммоль) N-бензил-4-пиперидона (Aldrich) и 7,0 г (27,6 ммоль) диэтилового эфира (4-цианобензил)-фосфорной кислоты [J. Chem. Soc. PerkinTrans 2., 3, 395. (2001)]) в 50 мл диметилформамида добавляют при температуре 0C 1,5 г (60%, 37,5 ммоль) гидрида натрия. Реакционную смесь перемешивают в течение 4 ч при температуре 20C, затем добавляют по каплям 1 мл этанола, выливают в 100 мл воды и экстрагируют диэтиловым эфиром. Органический слой сушат над сульфатом натрия и концентрируют. Сырой продукт используют на следующей стадии. T. пл.: масло. 32b) 4-(1-Бензилпиперидин-4-илметил)бензонитрил. Смесь 8,25 г (28,6 ммоль) 4-(1-бензилпиперидин-4-илиденметил)бензонитрила, 200 мл этанола и 0,5 г 10% Pd/C катализатора гидрогенизируют. После завершения реакции катализатор отфильтровывают,промывают тетрагидрофураном и фильтрат концентрируют. Остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 95-96 С (диизопропиловый эфир). 32 с) Гидрохлорид 4-пиперидин-4-илметилбензонитрила. К перемешиваемому раствору 0,5 г (1,72 ммоль) 4-(1-бензилпиперидин-4-илметил)бензонитрила в 3 мл дихлорэтана добавляют по каплям при температуре 0C 0,2 мл (1,85 ммоль) 1-хлорэтилхлорформиата. Реакционную смесь перемешивают при температуре 0C в течение часа и нагревают при кипении в течение 8 ч, затем концентрируют и остаток нагревают при кипении в 10 мл метанола. Реакционную смесь концентрируют и остаток кристаллизуют изопропанолом, что дает на выходе 0,384 г (94,4%) названного соединения. T. пл.: 194C (изопропанол). 32d) Этиловый эфир N-(2-оксо-2,3-дигидробензоксазол-6 ил)оксаламовой кислоты. Названное соединение получают из 6-амино-3 Н-бензоксазол-2-она и этилоксалилхлорида в соответствии со способом, описанным в примере 1a. T. пл.: 180-186 С. 32 е) N-(2-Оксо-2,3-дигидробензоксазол-6-ил)оксаламовая кислота. Названное соединение получают из этилового эфира N-(2-оксо-2,3-дигидробензоксазол-6-ил)оксаламовой кислоты в соответствии со способом, описанным в примере 1b. T. пл.: 254 С (этанол-вода). 32f) 2-[4-(4-Цианобензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид. К смеси 0,3 г (1,5 ммоль) N(2-оксо-2,3-дигидробензоксазол-6-ил)-оксаламовой кислоты, 0,165 мл(1,5 ммоль) N-метилморфолина в 8 мл диметилформамиде добавляют по каплям при температуре 0C 0,2 мл (1,5 ммоль) изобутилхлорформиата и смесь перемешивают при температуре 0 С в течение часа. Затем добавляют 0,333 г (1,4 ммоль) гидрохлорида 4-пиперидин-4-илметил-бензонитрила и 0,165 мл (1,5 ммоль) N-метилморфолина и реакционную смесь перемешивают при температуре 0C в течение часа и при комнатной температуре еще в течение 16 ч. Реакционную смесь концентрируют и остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента, что дает на выходе 0,045 г (8,0%) названного соединения. Rf. 0,4.T. пл.: 259-260C (изопропанол). Пример 33. 2-Оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)-2-[4-(4-трифторметилбензил)пиперидин-1-ил]-ацетамид (45 70002930). Названное соединение получают из 4-(4-трифторметилбензил)-пиперидина [J. Org. Chem., 64, 3763.- 14010162 способом, описанным в примере 32f. Остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 217 С (изопропанол). Пример 34. 2-[4-(2,4-Дифторбензил)пиперидин-1-ил-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6 ил)ацетамид (45 70002931). 34 а) трет-Бутиловый эфир 4-(2,4-дифторбензилиден)пиперидин-1-карбоновой кислоты. Названное соединение получают из N-(трет-бутоксикарбонил)-4-пиперидона и диэтилового эфира(2,4-дифторбензил)фосфорной кислоты [Eur. J. Med. Chim. Ther., 27, 845. (1992)] в соответствии со способом, описанным в примере 32 а. Остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и гексан:этилацетат = 4:1 в качестве элюента. T. пл.: масло. 34b) трет-Бутиловый эфир 4-(2,4-дифторбензил)пиперидин-1-карбоновой кислоты. Названное соединение получают из трет-бутилового эфира 4-(2,4-дифторбензилиден)-пиперидин-1 карбоновой кислоты в соответствии со способом, описанным в примере 32 а. Сырой продукт используют на следующей стадии. T. пл.: масло. 34 с) 4-(2,4-Дифторбензил)пиперидин. Названное соединение получают из трет-бутилового эфира 4-(2,4-дифторбензил)-пиперидин-1 карбоновой кислоты в соответствии со способом, описанным в примере 18b. T. пл.: 191C (этилацетатдиэтиловый эфир). 34d) 2-[4-(2,4-Дифторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид. Названное соединение получают из 4-(2,4-дифторбензил)пиперидина и N-(2-оксо-2,3 дигидробензоксазол-6-ил)оксаламовой кислоты (пример 32 е) в соответствии со способом, описанным в примере 32f. Остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол: метанол = 4:1 в качестве элюента. T. пл.: 231C (изопропанол). Пример 35. N-(2,2-Диоксо-2,3-дигидро-1 Н-26-бензо[с]изотиазол-5-ил)-2-[4-(4-фторбензил)пиперидин-1-ил)-2-оксоацетамид (45 70002966). Названное соединение получают из [4-(4-фторбензил)пиперидин-1-ил]оксоуксусной кислоты (пример 1a) и 5-амино-1,3-дигидро-2,1-бензизотиазол-2,2-диоксида в соответствии со способом, описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 183184 С (изопропанол). Пример 36. 2-[4-(3,4-Дифторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6 ил)ацетамид (45 70002967). Названное соединение получают из 4-(3,4-дифторбензил)пиперидина [J. Org. Chem., 64, 3763.(1999)] и N-(2-оксо-2,3-дигидробензоксазол-6-ил)-оксаламовой кислоты (пример 32 е) в соответствии со способом, описанным в примере 32f. Остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента. T. пл.: 233 С (изопропанол). Пример 37. 2-(4-Бензилпиперидин-1-ил)-2-оксо-N-(2-трифторметил-1 Н-бензоимидазол-5-ил)ацетамид (45 70002968). Названное соединение получают из (4-бензилпиперидин-1-ил)-оксоуксусной кислоты (пример 5b) и 2-трифторметил-1(3)Н-бензимидазол-5-иламина (NL 6501323, CA 66; 28771) в соответствии со способом,описанным в примере 2. Отфильтрованные кристаллы очищают с помощью хроматографии на колонке,используя Кизельгель 60 (Merk) в качестве адсорбента и смесь толуол:метанол = 4:1 в качестве элюента.T. пл.: 142 С (изопропанол). Пример 38. 2-[4-(4-Фторбензил)пиперидин-1-ил-2-оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-6-ил)ацетамид (45 70001819). Названное соединение получают из 6-амино-4 Н-бензо[1,4]оксазин-3-она [Indian J. Chem. Sect. B, 24,1263. (1985)] и [4-(4-фторбензил)пиперидин-1-ил]оксоуксусной кислоты (пример 1b) в соответствии со способом, описанным в примере 2. T. пл.: 197-200C (диэтиловый эфир). Пример 39. 2-(4-Бензилпиперидин-1-ил)-2-оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-6-ил) ацетамид (45 70001845). Названное соединение получают из 6-амино-4 Н-бензо[1,4]оксазин-3-она и (4-бензилпиперидин-1 ил)оксоуксусной кислоты (пример 5b) в соответствии со способом, описанным в примере 1c. T. пл.: 186187 С (диэтиловый эфир). Пример 40. 2-(4-Бензилпиперидин-1-ил)-N-(1H-бензимидазол-5-ил) 2-оксоацетамид (45 70001846). Названное соединение получают из 5-аминобензимидазола и (4-бензилгошеридин-1-ил)оксоуксусной кислоты (пример 5b) в соответствии со способом, описанным в примере 1c. T. пл.: 85-87 С (диэтиловый эфир). Пример 41. 2-(4-Бензилпиперидин-1-ил)-N-(1 Н-индазол-6-ил)-2-оксоацетамид (45 70001878). Названное соединение получают из 6-аминоиндазола (Aldrich) и (4-бензилпиперидин-1-ил)- 15010162 оксоуксусной кислоты (пример 5b) в соответствии со способом, описанным в примере 1c. T. пл.: 160164C (диэтиловый эфир). Пример 42. 2-(4-Бензилоксипиперидин-1-ил)-2-оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7 ил)ацетамид (45 70002186). 42 а) Этиловый эфир N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)оксаламовой кислоты. Названное соединение получают из 7-амино-4 Н-бензо[1,4]оксазином-3-она [J. Med. Chem., 32, 1627.(1989)] и этилхлороксоацетата (Aldrich) в соответствии со способом, описанным в примере 1a. T. пл.: 239-240C (вода). 42b) N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)оксаламовая кислота. Названное соединение получают из этилового эфира N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин 7-ил)оксаламовой кислоты и гидроксида калия в соответствии со способом, описанным в примере 1b. T. пл.: 232,5-235,5C (вода). 42 с) 2-(4-Бензилоксипиперидин-1-ил)-2-оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил) ацетамид. Названное соединение получают из N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)-оксаламовой кислоты и 4-бензилоксипиперидина [Tetrahedron Lett., 36, 3465. (1995)] в соответствии со способом, описанным в примере 1c. T. пл.: 143-146 С (диэтиловый эфир). Пример 43. 2-Оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)-2-(4-феноксипиперидин-1 ил)ацетамид (45 70002188). Названное соединение получают из N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)-оксаламовой кислоты (пример 42b) и 4-феноксипиперидина в соответствии со способом, описанным в примере 2. T. пл.: 196-199 С (диэтиловый эфир). Пример 44. 2-Оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)-2-(4-феноксиметилпиперидин-1-ил)ацетамид (45 70002244). Названное соединение получают из N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)-оксаламовой кислоты (пример 42b) и 4-феноксиметилпиперидина [DE 254 999 (1977)] в соответствии со способом,описанным в примере 1c. T. пл.: 215-217 С (диэтиловый эфир). Пример 45. 2-Оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)-2-(4-фенэтилпиперидин-1 ил)ацетамид (45 70002250). Названное соединение получают из N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)оксаламовой кислоты (пример 42b) и 4-фенэтилпиперидина [J. Amer. Chem. Soc., 72, 4953. (1950)] в соответствии со способом, описанным в примере 1c. T. пл.: 128-132 С (диэтиловый эфир). Пример 46. 2-[4-(Гидроксифенилметил)пиперидин-1-ил]-2-оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)ацетамид (45 70002251). Названное соединение получают из N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)оксаламовой кислоты (пример 42b) и фенилпиперидин-4-илметанола [J. Amer. Chem. Soc.,52, 4006. (1930)] в соответствии со способом, описанным в примере 1c. T. пл.: 195-197 С (диэтиловый эфир). Пример 47. 2-Оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)-2-(4-п-толилоксипиперидинил)ацетамид (45 70002333). Названное соединение получают из N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)оксаламовой кислоты (пример 42b) и 4-п-толилоксипиперидина в соответствии со способом, описанным в примере 1c.T. пл.: 226-228 С (диэтиловый эфир). Пример 48. 2-[4-(4-Метилбензил)пиперидин-1-ил]-2-оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)ацетамид (45 70002339). Названное соединение получают из N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)оксаламовой кислоты (пример 42b) и 4-(4-метилбензил)пиперидина [J Org. Chem., 64,3763. (1999)] в соответствии со способом, описанным в примере 1c. T. пл.: 228-231 С (диэтиловый эфир). Пример 49. 2-(4-Бензилпиперидин-1-ил)-N-(2-меркапто-3 Н-бензимидазол-5-ил)-2-оксоацетамид (45 70002567) 49 а). Этиловый эфир N-(2-меркапто-3 Н-бензимидазол-5-ил)оксаламовой кислоты. Названное соединение получают из 6-амино-1H-бензимидазол-2-тиола [J. Chem. Soc, 1515 (1950)] и этилхлороксоацетата (Aldrich) в соответствии со способом, описанным в примере 1a. T. пл.: 225-226 С(вода). 49b) N-(2-Меркапто-3 Н-бензимидазол-5-ил)оксаламовая кислота. Названное соединение получают из этилового эфира N-(2-меркапто-3 Н-бензимидазол-5-ил)оксаламовой кислоты и гидроксида калия в соответствии со способом, описанным в примере 1b. T. пл.: 276280C (вода). 49 с) 2-(4-Бензилпиперидин-1-ил)-N-(2-меркапто-3 Н-бензимидазол-5-ил)-2-оксоацетамид. Названное соединение получают из N-(2-меркапто-3 Н-бензимидазол-5-ил)-оксаламовой кислоты и 4-бензилпиперидина в соответствии со способом, описанным в примере 1c. T. пл.: 277-281C (диэтиловый эфир).(45 70002568). 50 а) Этиловый эфир N-(2-оксо-2,3-дигидробензотиазол-6-ил)-оксаламовой кислоты. Названное соединение получают из 6-амино-3 Н-бензотиазол-2-она [Liebigs Ann. Chem., 277. 244(1893)] и этилхлороксоацетата (Aldrich) в соответствии со способом, описанным в примере 1a. T. пл.: 226-231C (вода). 50b) N-(2-Оксо-2,3-дигидробензотиазол-6-ил)оксаламовая кислота. Названное соединение получают из N-(2-оксо-2,3-дигидробензотиазол-6-ил)оксаламовой кислоты этилового эфира и гидроксида калия в соответствии со способом, описанным в примере 1b. T. пл.: 275278 С (вода). 50 с) 2-(4-Бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид. Названное соединение получают из N-(2-оксо-2,3-дигидробензотиазол-6-ил)оксаламовой кислоты и 4-бензилпиперидина в соответствии со способом, описанным в примере 1c. T. пл.: 201-203C (диэтиловый эфир). Пример 51. 2-[4-(4-Фторбензил)пиперидин-1-ил]-N-(2-меркапто-3 Н-бензимидазол-5-ил)-2 оксоацетамид (45 70002569). Названное соединение получают из N-(2-меркапто-3 Н-бензимидазол-5-ил)оксаламовой кислоты(пример 49b) и 4-(4-фторбензил)пиперидина в соответствии со способом, описанным в примере 1c. T. пл.: 286-288 С (диэтиловый эфир). Пример 52. 2-[4-(4-Фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил) ацетамид (45 70002615). Названное соединение получают из N-(2-оксо-2,3-дигидробензотиазол-6-ил)оксаламовой кислоты(пример 50b) и 4-(4-фторбензил)пиперидина в соответствии со способом, описанным в примере 1c. T. пл.: 223,5-225,5 С (диэтиловый эфир). Пример 53. 2-Оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)-2-(4-п-толилоксипиперидин-1-ил)ацетамид (45 70002706). Названное соединение получают из N-(2-оксо-2,3-дигидробензотиазол-6-ил)-оксаламовой кислоты(пример 50b) и 4-п-толилоксипиперидина в соотвегствии со способом, описанным в примере 1c. T. пл.: 215-217 С (диэтиловый эфир). Пример 54. 2-[4-(4-Метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил) ацетамид (45 80002247). Названное соединение получают из N-(2-оксо-2,3-дигидробензотиазол-6-ил)-оксаламовой кислоты(пример 50b) и 4-(4-метилбензил)пиперидина в соответствии со способом, описанным в примере 1c. T. пл.: 221-222 С (диэтиловый эфир). Пример 55. 2-[4-(4-Хлорфенокси)иперидин-1-ил-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил) ацетамид (45 80002398). Названное соединение получают из N-(2-оксо-2,3-дигидробензотиазол-6-ил)-оксаламовой кислоты(пример 50b) и 4-(4-хлорбензил)пиперидина в соответствии со способом, описанным в примере 1c. T. пл.: 245-247 С (диэтиловый эфир). Пример 56. N-(2-Меркапто-3 Н-бензимидазол-5-ил)-2-(4-п-толилоксипиперидин-1-ил)-2-оксоацетамид (45 70002739). Названное соединение получают из N-(2-меркапто-3 Н-бензимидазол-5-ил)оксаламовой кислоты(пример 49b) и 4-п-толилоксипиперидина в соответствии со способом, описанным в примере 1c. T. пл.: 311-314 С (диэтиловый эфир). Пример 57. 2-(4-Бензилпиперидин-1-ил)-2-оксо-N-(3-тиоксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7 ил)ацетамид (45 70002614). 57 а) 7-Амино-4 Н-бензо[1,4]оксазин-3-тион. Перемешиваемую смесь 1,0 г 7-нитро-4 Н-бензо[1,4]оксазин-3-тиона [Indian J. Chem. Sect. B, 12,1279. (1984)] и 4,0 г дитионита натрия в 30 мл этанола и 30 мл воды нагревают при кипении в течение 2 ч. Затем реакционную смесь концентрируют и остаток подвергают хроматографии на колонке, используя Кизельгель 60 в качестве адсорбента (Merk) и смесь хлороформ: метанол = 9:1 в качестве элюента, что дает на выходе 0,33 г (38%) названного соединения. T. пл.: 205-211C (диэтиловый эфир). 57b) 2-(4-Бензилпиперидин-1-ил)-2-оксо-N-(3-тиоксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил)ацетамид. Названное соединение получают из 7-амино-4 Н-бензо[1,4]оксазин-3-тиона и (4-бензилпиперидин 1-ил)оксоуксусной кислоты (пример 5b) в соответствии со способом, описанным в примере 1c. T. пл.: 193-196 С (диэтиловый эфир). Пример 58. 2-[4-(4-Фторбензил)пиперидин-1-ил]-N-(индан-5-ил)-2-оксоацетамид (45 70002198). Названное соединение получают из [4-(4-фторбензил)пиперидин-1-ил]оксоуксусной кислоты (пример 1b) и 5-аминоиндана (Aldrich) в соответствии со способом, описанным в примере 1c. T. пл.: 150152C (диэтиловый эфир).- 17010162 Пример 59. 2-(4-Бензилпиперидин-1-ил)-N-(индан-5-ил)-2-оксоацетамид (45 70002224). Названное соединение получают из (4-бензилпиперидин-1-ил)оксоуксусной кислоты (пример 5b) и 5-аминоиндана (Aldrich) в соответствии со способом, описанным в примере 1c. T. пл.: 106-109C (диэтиловый эфир). Пример 60. 2-[4-(4-Фторбензил)пиперидин-1-ил]-N-(1H-индол-5-ил)-2-оксоацетамид (45 70002239). Названное соединение получают из [4-(4-фторбензил)-пиперидин-1-ил]-оксоуксусной кислоты(пример 1b) и 5-аминоиндола (Aldrich) в соответствии со способом, описанным в примере 1c. T. пл.: 8082C (этилацетатом). Пример 61. N-(4-Бромфенил)-2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксоацетамид (45 70002307). Смесь 0,64 г (2,4 ммоль) [4-(4-фторбензил)пиперидин-1-ил]оксоуксусной кислоты, 0,34 мл (2,4 ммоль)тритиламина, 0,35 г (2 ммоль) 4-броманилина (Aldrich), 0,91 г (2,4 ммоль) HBTU и 10 мл диметилформамида перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь концентрируют. Затем к смеси добавляют 30 мл 8% раствора гидрокарбоната натрия и 30 мл хлороформа. Органический слой отделяют и водную фазу трижды экстрагируют по 20 мл хлороформа. Объединенные органические слои сушат над сульфатом натрия, концентрируют. Остаток обрабатывают диэтиловым эфиром и кристаллы отфильтровывают, что дает на выходе 0,36 г (43%) названного соединения. T. пл.: 156158 С (диэтиловый эфир). Следующее соединение получают из [4-(4-метилбензил)пиперидин-1-ил]оксоуксусной кислоты(пример 70b) и 5-амино-1,3-дигидро-2,1-бензизотиазол-2,2-диоксида в соответствии со способом, описанным выше: N-(2,2-диоксо-2,3-дигидро-1 Н-26-бензо[с]изотиазол-5-ил)-2-[4-(4-метилбензил)пиперидин-1-ил)-2-оксоацетамид (45 70003031). T. пл.: 186 С (изопропанол). Пример 62. 2-[4-[4-Метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил) ацетамид (45 70002346) 62 а). Этиловый эфир N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)оксаламовой кислоты. Названное соединение получают из 1-амино-1,3-дигидроиндол-2-она и этилоксалилхлорида в соответствии со способом, описанным в примере 1a. T. пл.: 235-237 С (диэтиловый эфир). 62b) N-(2-Оксо-2,3-дигидро-1H-индол-5-ил)оксаламовая кислота. Названное соединение получают из этилового эфира N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)оксаламовой кислоты и гидроксида калия в соответствии со способом, описанным в примере 1b. T. пл.: 256 С (вода). 62 с) 2-[4-[4-Метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)ацетамид. Названное соединение получают из N-(2-оксо-2,3-дигидро-1H-индол-5-ил)оксаламовой кислоты и 4-(4-метилбензил)пиперидина в соответствии со способом, описанным в примере 1c. T. пл.: 196-199 С(диэтиловый эфир). Пример 63. 2-(4-Бензилпиперидин-1-ил)-N-(1H-индол-5-ил)-2-оксоацетамид (45 70002347). Названное соединение получают из 5-аминоиндола (Aldrich) и (4-бензилпиперидин-1-ил)оксоуксусной кислоты (пример 5b) в соответствии со способом, описанным в примере 1c. T. пл.: 68-72 С(гексан). Пример 64. 2-[(4-Гидроксифенилметил)пиперидин-1-ил]-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)-2 оксоацетамид (45 70002348). Названное соединение получают из N-(2-оксо-2,3-дигидро-1H-индол-5-ил)оксаламовой кислоты(пример 62b) и фенил-[4]пиперидилметанола в соответствии со способом, описанным в примере 1c. T. пл.: 88-100C (разложение) (диэтиловый эфир). Пример 65. 2-[4-(2-Метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил) ацетамид (45 70002350). Названное соединение получают из N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)оксаламовой кислоты(пример 62b) и 4-(2-метилбензил)пиперидина [J. Org. Chem., 64, 3763. (1999)] в соответствии со способом, описанным в примере 1c. T. пл.: 211-213C (диэтиловый эфир). Пример 66. 2-Оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)-2-(4-феноксиметилпиперидин-1-ил)ацетамид (45 70002351). Названное соединение получают из N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)оксаламовой кислоты(пример 62b) и 4-феноксиметилпиперидина в соответствии со способом, описанным в примере 1c. T. пл.: 200-202C (диэтиловый эфир). Пример 67. 2-[4-[4-Метоксибензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5 ил)ацетамид (45 70002391). Названное соединение получают из N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)оксаламовой кислоты(пример 62b) и 4-(4-метоксибензил)пиперидина [US 3632767 (1972)] в соответствии со способом, описанным в примере 1c. T. пл.: 215-217 С (диэтиловый эфир). Пример 68. 2-[4-(3-Фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)ацетамид (45 70002439). Названное соединение получают из N-(2-оксо-2,3-дигидро-1H-индол-5-ил)оксаламовой кислоты(45 70002440). Названное соединение получают из N-(2-оксо-2,3-дигидро-1H-индол-5-ил)-оксаламовой кислоты(пример 62b) и 4-фенэтилпиперидина в соответствии со способом, описанным в примере 1c. T. пл.: 236240C (диэтиловый эфир). Пример 70. 2-[4-(4-Метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил) ацетамид (45 70002764). 70a) Этиловый эфир [4-(4-метилбензил)пиперидин-1-ил]оксоуксусной кислоты. Названное соединение получают из 4-(4-метилбензил)пиперидина и этилоксалилхлорида в соответствии со способом, описанным в примере 1a. T. пл.: масло. 70b) [4-(4-Метилбензил)пиперидин-1 ил]оксоуксусная кислота. Названное соединение получают из этилового эфира[4-(4-метилбензилпиперидин-1-ил)оксоуксусной кислоты в соответствии со способом, описанным в примере 1b. T. пл.: 133-135 С (этанол-вода). 70 с) 2-[4-(4-Метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил]ацетамид. Названное соединение получают из 5-амино-1,3-дигидроиндол-2-она и [4-(4-метилбензил)пиперидин-1-ил)оксоуксусной кислоты в соответствии со способом, описанным в примере 1c. T. пл.: 216-220C(диэтиловый эфир). Пример 71. 2-[4-[4-Метоксибензил)пиперидин-1-ил-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6 ил)ацетамид (45 70002777). Названное соединение получают из N-(2-оксо-2,3-дигидробензоксазол-6-ил)оксаламовой кислоты(пример 32 е) и 4-(4-метоксибензил)-пиперидина в соответствии со способом, описанным в примере 1c. T. пл.: 193-197 С (диизопропиловый эфир). Пример 72. 2-[4-(3-Метоксибензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6 ил)ацетамид (45 70002838). Названное соединение получают из N-(2-оксо-2,3-дигидробензоксазол-6-ил)оксаламовой кислоты(пример 32 е) и 4-(3-метоксибензил)пиперидин [US 3632767 (1972)] в соответствии со способом, описанным в примере 2. T. пл.: 110-115C (диизопропиловый эфир). Пример 73. 2-[4-(3-Метилбензил)-пиперидин-1-ил-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил) ацетамид (45 70002839). Названное соединение получают из N-(2-оксо-2,3-дигидробензоксазол-6-ил)оксаламовой кислоты(пример 32 е) и 4-(3-метилбензил)пиперидина в соответствии со способом, описанным в примере 2. T. пл.: 204-208C (диизопропиловый эфир). Пример 74. N-(1,3-Диоксо-2,3-дигидро-1 Н-изоиндол-5-ил)-2-[4-(4-фторбензил)пиперидин-1-ил]-2 оксоацетамид (45 70002840). Названное соединение получают из 5-аминоизоиндол-1,3-диона [Tetrahedron 54, 7485. (1998)] и [4(4-фторбензил)пиперидин-1-ил]оксоуксусной кислоты (пример 1b) в соответствии со способом, описанным в примере 1c. T. пл.: 226-228 С (диэтиловый эфир). Пример 75. 2-(4-Бензилпиперидин-1-ил)-N-(1,3-диоксо-2,3-дигидро-1 Н-изоиндол-5-ил)-2-оксоацетамид (45 70002841). Названное соединение получают из 5-аминоизоиндол-1,3-диона и (4-бензилпиперидин-1-ил)оксоуксусной кислоты (пример 5b) в соответствии со способом, описанным в примере 1c. T. пл.: 239241C (диэтиловый эфир). Пример 76. 2-[4-[3-Фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил) ацетамид (45 70002897). Названное соединение получают из N-(2-оксо-2,3-дигидробензоксазол-6-ил)оксаламовой кислоты(пример 32 е) и 4-(3-фторбензил)пиперидина в соответствии со способом, описанным в примере 1c. T. пл.: 215-217 С (диэтиловый эфир). Пример 77. N-(2,3-Диоксо-2,3-дигидро-1H-индол-5-ил)-2-[4-(4-фторбензил)пиперидин-1-ил]-2 оксоацетамид (45 70002570). Названное соединение получают из 5-амино-1H-индол-2,3-диона [HeIv. Chim-Acta 19. 1327. (1936)] и [4-(4-фторбензил)пиперидин-1-ил]оксоуксусной кислоты (пример 1b) в соответствии со способом, описанным в примере 1c. T. пл.: 205-206C (диэтиловый эфир). Пример 78. 2-(4-Бензилпиперидин-1-ил)-N-(2,3-диоксо-2,3-дигидро-1 Н-индол-5-ил)-2-оксоацетамид(45 70002616). Названное соединение получают из 5-амино-1 Н-индол-2,3-диона [HeIv. Chim-Acta 19. 1327. (1936)] и (4-бензилпиперидин-1-ил)оксоуксусной кислоты (пример 5b) в соответствии со способом, описанным в примере 1c. T. пл.: 234-236 С (диэтиловый эфир). Пример 79. 2-[4-(4-Метилбензил-пиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидро-1H-бензимидазол- 19010162 5-ил)ацетамид (45 80002201). Названное соединение получают из [4-(4-метилбензил)пиперидин-1-ил]оксоуксусной кислоты(пример 70b) и 5-амино-1,3-дигидробензимидазол-2-она в соответствии со способом, описанным в примере 1c. T. пл.:280C (диэтиловый эфир). Пример 80. 2-[4-(4-Метилбензил)пиперидин-1-ил)-2-оксо-N-(2-оксо-1,2,3,4-тетрагидрохинолин-6 ил-ацетамид (45 80002221). Названное соединение получают из [4-(4-метилбензил)пиперидин-1-ил]оксоуксусной кислоты(пример 70b) и 6-амино-3,4-дигидро-1 Н-хинолин-2-она [J.Chem. Soc, 183. (1969)] в соответствии со способом, описанным в примере 2. T. пл.: 209-213C (вода). Пример 81. 2-[4-(4-Фторбензил)пиперидин-1-ил]-N-(2-оксо-2,3-дигидро-1H-бензоксазол-6-ил)ацетамид (45 70001655) 81 а) 2-Xлop-N-(2-оксо-2,3 -дигидробензоксазол-6-ил)ацетамид. К перемешиваемому раствору 1,5 г (10 ммоль) 6-амино-3 Н-бензоксазол-2-она и 3,4 мл (24 ммоль) триэтиламина в 90 мл хлороформа добавляют по каплям при температуре ниже 10C 2 мл (24 ммоль) хлорацетилхлорида в 20 мл хлороформа и реакционную смесь перемешивают при комнатной температуре в течение 10 ч. Реакционную смесь концентрируют и к остатку добавляют 100 мл 8% раствор гидрокарбоната натрия. Осажденный продукт отфильтровывают и промывают водой, что дает на выходе 1,76 г(78%) названного соединения. T. пл.: 228-231C (вода). 81b) 2-[4-(4-Фторбензил)пиперидин-1-ил]-N-(2-оксо-2,3-дигидро-1 Н-бензоксазол-6-ил)ацетамид. Смесь 0,91 г (4 ммоль) 2-хлор-N-(2-оксо-2,3-дигидробензоксазол-6-ил)-ацетамида, 0,7 г (4 ммоль) иодида калия, 1,2 мл (8 ммоль) триэтиламина, 0,7 г (3 ммоль) гидрохлорида 4-(4-фторбензил)пиперидина и 50 мл ацетонитрила нагревают при кипении в течение 20 ч. Реакционную смесь концентрируют и к остатку добавляют 30 мл воды и 30 мл хлороформа. Органический слой отделяют и водную фазу экстрагируют трижды по 10 мл хлороформа. Объединенные органические слои сушат над сульфатом натрия, концентрируют и остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 в качестве адсорбента (Merk) и смесь хлороформ:метанол = 97:3 в качестве элюента, что дает на выходе 0,3 г (26%) названного соединения. T. пл.: 232-234 С (диэтиловый эфир). Пример 82. Гидрохлорид 2-[4-(4-Фторбензил)пиперидин-1-ил-N-(2-оксо-2,3-дигидро-1 Н-бензоксазол-6-ил)ацетамида (45 70002909). К перемешиваемой суспензии 1,5 г (3,9 ммоль) 2-[4-(4-фторбензил)пиперидин-1-ил]-N-(2-оксо-2,3 дигидро-1 Н-бензоксазол-6-ил)ацетамида (пример 81 b) в 40 мл диэтилового эфира добавляют 4 мл 2,5 N соляной кислоты в этилацетате. Смесь перемешивают в течение часа при комнатной температуре, кристаллы отфильтровывают и промывают диэтиловым эфиром, что дает на выходе 1,64 г (100%) названного соединения. T. пл.: 210-216C (разложение) (диэтиловый эфир). Пример 83. 5-2-[4-(4-Фторбензил)пиперидин-1-ил]-2-оксоэтиламино-1,3-дигидробензоимидазол 2-он (45 70001863). 83 а) 2-Хлор-1-[4-(4-фторбензил)пиперидин-1-ил]этанон. Названное соединение получают из 4-(4-фторбензил)пиперидина и хлорацетилхлорида в соответствии со способом, описанным в примере 81 а. T. пл.: 85-87 С (вода). 83b) 5-2-[4-(4-Фторбензил)пиперидин-1-ил]-2-оксоэтиламино-1,3-дигидробензимидазол-2-он. Названное соединение получают из 2-хлор-1-[4-(4-фторбензил)-пиперидин-1-ил]-этанона и 5 амино-1,3-дигидробензимидазол-2-она в соответствии со способом, описанным в примере 81b. T. пл.: 249-251C (диэтиловый эфир). Пример 84. 6-(2-[4-(4-Фторбензил)пиперидин-1-ил-2-оксоэтиламино-3 Н-бензоксазол-2-он (45 70001944). Названное соединение получают из 2-хлор-1-[4-(4-фторбензил)пиперидин-1-ил]этанона (пример 83 а) и 6-амино-3 Н-бензоксазол-2-она в соответствии со способом, описанным в примере 81b. T. пл.: 202205C (диэтиловый эфир). Пример 85. 1-[4-(4-Фторбензил)пиперидин-1-ил]-2-(1H-индазол-5-иламино)этанон (45 70001843). Названное соединение получают из 5-аминоиндазола (Aldrich) и 2-хлор-1-[4-(4-фторбензил)пиперидин-1-ил]этанона (пример 83 а) в соответствии со способом, описанным в примере 81b. T. пл.: 113114 С (диэтиловый эфир). Пример 86. 1-(4-Бензилпиперидин-1-ил)-2-(1 Н-индазол-5-иламино)этанон (45 70001949). 86 а) 2-Хлор-1-(4-бензилпиперидин-1-ил)этанон. Названное соединение получают из 4-бензилпиперидина и хлорацетилхлорида в соответствии со способом, описанным в примере 81 а. T. пл.: 42-47 С. 86b) 1-(4-бензилпиперидин-1-ил)-2-(1H-индазол-5-иламино)этанон. Названное соединение получают из 5-аминоиндазола и 2-хлор-1-(4-бензилпиперидин-1-ил)этанона в соответствии со способом, описанным в примере 81b. T. пл.: 153-155 С (диэтиловый эфир). Пример 87. 2-[4-(4-Фторбензил)пиперидин-1-ил]-2-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-иламино)этанон (45 70002015). Названное соединение получают из 7-амино-4 Н-бензо[1,4]оксазин-3-она и 2-хлор-1-[4-(4- 20010162 фторбензил)пиперидин-1-ил]этанона (пример 83 а) в соответствии со способом, описанным в примере 81b. T. пл.: 156-161 С (диэтиловый эфир). Пример 88. 2-(4-Бензилпиперидин-1-ил)-2-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-иламино) этанон (45 70002104). Названное соединение получают из 7-амино-4 Н-бензо[1,4]оксазин-3-она и 2-хлор-1-(4-бензилпиперидин-1-ил)этанона (пример 86 а) в соответствии со способом, описанным в примере 81b. T. пл.: 172175 С (диэтиловый эфир). Пример 89. 1-[4-(4-Фторбензил)пиперидин-1-ил]-2-(1H-индазол-6-иламино)этанон (45 70001817). Названное соединение получают из 6-аминоиндазола и 2-хлор-1-[4-(4-фторбензил)пиперидин-1 ил]этанона (пример 83 а) в соответствии со способом, описанным в примере 81b. T. пл.: 181-183 С (диэтиловый эфир). Пример 90. 1-(4-Бензилпиперидин-1-ил)-2-(1H-индазол-6-иламино)этанон (45 70001950). Названное соединение получают из 6-аминоиндазол и 2-хлор-1-(4-бензилпиперидин-1-ил)этанона(пример 86 а) в соответствии со способом, описанным в примере 81b. T. пл.: 179-182 С (диэтиловый эфир). Пример 91. 1-[4-(4-Фторбензил)пиперидин-1-ил]-2-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-6-иламино)этанон (45 70002176). Названное соединение получают из 6-амино-4 Н-бензо[1,4]оксазин-3-она и 2-хлор-1-[4-(4 фторбензил)пиперидин-1-ил]этанона (пример 83 а) в соответствии со способом, описанным в примере 81b. T. пл.: 220-223C (диэтиловый эфир). Пример 92. N-(4-2-[4-(4-Фторбензил)пиперидин-1-ил-2-оксоэтиламинофенил)метансульфонамид(45 70002491). Смесь 1,08 г (4 ммоль) 2-хлор-1-[4-(4-фторбензил)-пиперидин-1-ил]этанона (пример 83 а), 1,5 г (8 ммоль) метансульфоновой кислоты-(4-аминоанилид), 0,68 г (4 ммоль) иодида калия, 1,2 мл (8 ммоль) триэтиламина и 40 мл толуола нагревают при кипении в течение 3 ч. Реакционную смесь концентрируют и к остатку добавляют 30 мл воды и 30 мл хлороформа. Органический слой отделяют и водную фазу экстрагируют трижды по 10 мл хлороформа. Объединенные органические слои сушат над сульфатом натрия. Затем концентрируют и остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 в качестве адсорбента (Merk) и смесь хлороформ:метанол = 99:1 в качестве элюента, что дает на выходе 0,96 г (57%) названного соединения. T. пл.: 177-181 С (диизопропиловый эфир). Пример 93. 1-(4-Бензилпиперидин-1-ил)-2-(2-оксо-2,3-дигидробензотиазол-6-иламино)этанон (45 70003033). Названное соединение получают из 6-амино-3 Н-бензотиазол-2-она и 2-хлор-1-(4-бензилпиперидин 1-ил)-этанона (пример 86 а) в соответствии со способом, описанным в примере 92. T. пл.: 196-199 С (диэтиловый эфир). Пример 94. 1-(4-п-Толилоксипиперидин-1-ил)-2-(2-оксо-2,3-дигидробензотиазол-6-иламино)этанон(45 70003072) 94 а) 2-хлор-1-(4-п-толилоксипиперидин-1-ил)этанон. Названное соединение получают из 4-п-толилоксипиперидина и хлорацетилхлорида в соответствии со способом, описанным в примере 81 а. T. пл.: масло. 94b) 1-(4-п-Толилоксипиперидин-1-ил)-2-(2-оксо-2,3-дигидробензотиазол-6-иламино)этанон. Названное соединение получают из 6-амино-3 Н-бензотиазол-2-она и 2-хлор-1-(4-п-толилоксипиперидин-1-ил)-этанона в соответствии со способом, описанным в примере 92. T. пл.: 189-191 С (диэтиловый эфир). Пример 95. 2-(4-п-Толилоксипиперидин-1-ил)-2-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7 иламино)этанон (45 70003118). Названное соединение получают из 7-амино-4 Н-бензо[1,4]оксазин-3-она и 2-хлор-1-(4-п-толилоксипиперидин-1-ил)-этанона (пример 94 а) в соответствии со способом, описанным в примере 92. T. пл.: 223224 С (диэтиловый эфир). Пример 96. 1-[4-(4-Фторбензил)пиперидин-1-ил]-2-(2-оксо-2,3-дигидробензотиазол-6-иламино)этанон (45 70003032). Названное соединение получают из 6-амино-3 Н-бензотиазол-2-она и 2-хлор-1-[4-(4-фторбензил)пиперидин-1-ил]этанона (пример 83 а) в соответствии со способом, описанным в примере 92. T. пл.: 149155 С (диэтиловый эфир). Пример 97. 5-2-[4-(4-Фторбензил)пиперидин-1-ил]-2-(2-оксоэтиламино)-1,3-дигидроиндол-2-он(45 70002509). Названное соединение получают из 5-амино-1,3-дигидроиндол-2-она и 2-хлор-1-[4-(4-фторбензил) пиперидин-1-ил]-этанона (пример 83 а) в соответствии со способом, описанным в примере 92. T. пл.: 161164 С (диэтиловый эфир). Пример 98. 5-[2-[4-Бензил)пиперидин-1-ил)-2-оксоэтиламино]-1,3-дигидроиндол-2-он(45 70002642). Названное соединение получают из 5-амино-1,3-дигидроиндол-2-она и 2-хлор-1-(4-бензилпипе- 21010162 ридин-1-ил)-этанона (пример 86 а) в соответствии со способом, описанным в примере 92. T. пл.: 155160C (диэтиловый эфир). Пример 99. 6-2-[4-(4-Фторбензил)пиперидин-1-ил]-2-оксоэтиламино-3 Н-бензоксазол-2-он гидрохлорид (45 70002862). Названное соединение получают из 6-2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксоэтиламино-3 Нбензоксазол-2-она (пример 84) в соответствии со способом, описанным в примере 82. T. пл.: 180-210C(разложение)(этилацетат). Пример 100. 5-[2-(4-Бензилпиперидин-1-ил)-2-оксоэтиламино]-1,3-дигидробензимидазол-2-он (45 70002223). Названное соединение получают из 5-амино-1,3-дигидробензимидазол-2-она и 2-хлор-1-(4-бензилпиперидин-1-ил)этанона (пример 86 а) в соответствии со способом, описанным в примере 81b. T. пл.: 237238 С (диэтиловый эфир). Пример 101. 5-[2-(4-Бензилпиперидин-1-ил)-2-оксоэтиламино]-1,3-дигидробензоимидазол-2-он гидрохлорид (45 70002907). Названное соединение получают из 5-[2-(4-бензилпиперидин-1-ил)-2-оксоэтиламино]-1,3 дигидробензимидазол-2-она (пример 100) в соответствии со способом, описанным в примере 82. T. пл.: 215-230C (разложение) (этилацетатом). Пример 102. 5-2-[4-(4-Фторбензил)пиперидин-1-ил]-2-оксоэтиламино-1,3-дигидробензимидазол 2-он гидрохлорид (45 70002908). Названное соединение получают из 5-2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксоэтиламино-1,3 дигидробензимидазол-2-она (пример 83b) в соответствии со способом, описанным в примере 82. T. пл.: 217-229 С (разложение) (этилацетатом). Пример 103.N-(4-2-[4-(4-Метилбензил)пиперидин-1-ил]-2-оксоэтиламинофенил)метансульфонамид (45 70002955). 103 а) 2-Хлор-1-[4-(4-метилбензил)пиперидин-1-ил]этанон. Названное соединение получают из 4-(4-метилбензил)пиперидина и хлорацетилхлорида в соответствии со способом, описанным в примере 81 а. T. пл.: масло. 103b) N-(4-2-[4-(4-Метилбензил)пиперидин-1-ил]-2-оксоэтиламинофенил)метансульфонамид. Названное соединение получают из 2-хлор-1-[4-(4-метилбензил)пиперидин-1-ил]этанона и метансульфоновой кислоты-(4-аминоанилид) в соответствии со способом, описанным в примере 92. T. пл.: 133-135 С (диизопропиловый эфир). Пример 104. 6-2-[4-(4-Метилбензил)пиперидин-1-ил]-2-оксоэтиламино)-3 Н-бензоксазол-2-он (45 70002956). Названное соединение получают из 2-хлор-1-[4-(4-метилбензил)пиперидин-1-ил]этанона (пример 103 а) и 6-амино-3 Н-бензоксазол-2-она в соответствии со способом, описанным в примере 92. T. пл.: 212215 С (метанол). Пример 105. 7-2-[4-(4-Метилбензил)пиперидин-1-ил]-2-оксоэтиламино-4 Н-бензо[1,4]оксазин-3 он (45 70003022). Названное соединение получают из 2-хлор-1-[4-(4-метилбензил)пиперидин-1-ил]этанона (пример 103 а) и 7-амино-4 Н-бензо[1,4]оксазином-3-она в соответствии со способом, описанным в примере 92. T. пл.: 206-208C (этанол). Пример 106. 6-[2-(4-Бензилпиперидин-1-ил)-2-оксоэтиламино]-3 Н-бензоксазол-2-он (45 70002530). Названное соединение получают из 6-амино-3 Н-бензоксазол-2-она и 2-хлор-1-(4-бензилпиперидин 1-ил)этанона (пример 86 а) в соответствии со способом, описанным в примере 81b. T. пл.: 204-206C (диэтиловый эфир). Пример 107. 6-[2-(4-Бензилпиперидин-1-ил)-2-оксоэтиламино]-3,4-дигидро-1 Н-хинолин-2-он (45 70003105). Названное соединение получают из 6-амино-3,4-дигидро-1 Н-хинолин-2-она и 2-хлор-1-(4 бензилпиперидин-1-ил)-этанона (пример 86 а) в соответствии со способом, описанным в примере 92. T. пл.: 184-187 С (этанол). Пример 108. 6-2-[4-(4-Хлорфенокси)пиперидин-1-ил]-2-оксоэтиламино-3 Н-бензоксазол-2-он (45 70003134). 108 а) 2-Хлор-1-[4-(4-хлорфенокси)пиперидин-1-ил]этанон. Названное соединение получают из гидрохлорида 4-(4-хлорфенокси)пиперидина (пример 18b) и хлорацетилхлорида в соответствии со способом, описанным в примере 81 а. T. пл масло. 108b) 6-2-[4-(4-Хлорфенокси)пиперидин-1-ил]-2-оксоэтиламино-3 Н-бензоксазол-2-он. Названное соединение получают из 6-амино-3 Н-бензоксазол-2-она и 2-хлор-1-[4-(4-хлорфенокси) пиперидин-1-ил]этанона в соответствии со способом, описанным в примере 92. T. пл.: 180-183C (диэтиловый эфир). Пример 109. 6-2-[4-(4-Хлорфенокси)пиперидин-1-ил]-2-оксоэтиламино-3,4-дигидро-1H-хннолин 2-он (45 70003135).- 22010162 Названное соединение получают из 6-амино-3,4-дигидрохинолин-2-она и 2-хлор-1-[4-(4-хлорфенокси)пиперидин-1-ил]этанона (пример 108 а) в соответствии со способом, описанным в примере 92. T. пл.: 248-251C (диэтиловый эфир). Пример 110. 5-2-[4-(4-Хлорфенокси)пиперидин-1-ил]-2-оксоэтиламино]-1,3-дигидробензоимидазол-2-он (45 70003137). Названное соединение получают из 5-амино-1,3-дигидробензимидазол-2-она и 2-хлор-1-[4-(4 хлорфенокси)пиперидин-1-ил]этанона (пример 108 а) в соответствии со способом, описанным в примере 92. T.пл.: 201-205C (диэтиловый эфир). Пример 111. 6-2-[4-(4-Фторбензил)пиперидин-1-ил]-2-оксоэтиламино-3,4-дигидро-1 Н-хинолин-2 он (45 70003136). Названное соединение получают из 6-амино-3,4-дигидрохинолин-2-она и 2-хлор-1-[4-(4 фторбензил)пиперидин-1-ил]этанона (пример 83 а) в соответствии со способом, описанным в примере 92.T. пл.: 197-200C (этиловый спирт). Пример 112. 6-[2-(4-Бензил пиперидин-1-ил)-1-метил-2-оксоэтиламино]-3 Н-бензоксазол-2-он (45 70002184). 112 а) 1-(4-Бензилпиперидин-1-ил)-2-бромпропан-1-он. Названное соединение получают из 4-бензилпиперидина и 2-бромпропионилхлорида в соответствии со способом, описанным в примере 81 а. T. пл.: масло. 112b) 6-[2-(4-Бензилпиперидин-1-ил)-1-метил-2-оксоэтиламино]-3 Н-бензоксазол-2-он. Смесь 1,03 г (3,33 ммоль) 1-(4-бензилпиперидин-1-ил)-2-бромпропан-1-она, 0,5 г (3,33 ммоль) 6 амино-3 Н-бензоксазол-2-она, 1,0 г (7,2 ммоль) карбоната калия и 15 мл диметилформамида нагревают при кипении в течение 5 ч. Реакционную смесь фильтруют и фильтрат концентрируют. Остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 в качестве адсорбента (Merk) и смесь гексан:этилацетатом = 4:1 в качестве элюента, что дает на выходе 0,46 г (36,5%) названного соединения.T. пл.: 91C (гексан). Пример 113. 2-(3-Бензил-8-аза-бицикло[3,2,1]окт-8-ил)-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5 ил)ацетамид (45 70002703). Названное соединение получают из N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)-оксаламовой кислоты(45 70001830). Названное соединение получают из 5-амино-3 Н-бензоксазол-2-она и (4-бензилпиперидин-1-ил)оксоуксусной кислоты (пример 5b) в соответствии со способом, описанным в примере 2. T. пл.: 187190C (вода). Пример 115. 2-[4-(4-Гидроксибензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6 ил)ацетамид (45 70003208). Названное соединение получают из 2-[4-(4-метоксибензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3 дигидробензоксазол-6-ил)ацетамида (пример 71) в соответствии со способом, описанным в примере 121.T. пл.: 235-239 С (диэтиловый эфир). Пример 116. 7-2-[4-(4-Хлорфенокси)пиперидин-1-ил]-2-оксоэтиламино-4 Н-бензо[1,4]оксазин-3 он (45 70003085). Названное соединение получают из 2-хлор-1-[4-(4-хлорфенокси)пиперидин-1-ил]этанона (пример 108) и 7-амино-4 Н-бензо[1,4]оксазин-3-она в соответствии со способом, описанным в примере 92. T. пл.: 207-210 С (метанол). Пример 117. 6-[2-Оксо-2-(4-Феноксипиперидин-1-ил)этиламино]-3 Н-бензоксазол-2-он(45 70003156). 117 а) 2-Хлор-1-(4-феноксипиперидин-1-ил)этанон. Названное соединение получают из 4-феноксипиперидина и хлорацетилхлорида в соответствии со способом, описанным в примере 81 а. T. пл.: масло. 117b) 6-[2-Оксо-2-(4-феноксипиперидин-1-ил)этиламино]-3 Н-бензоксазол-2-он. Названное соединение получают из 2-хлор-1-(4-фенокси)пиперидин-1-ил]этанона и 6-амино-3 Нбензоксазол-2-она в соответствии со способом, описанным в примере 92. T. пл.: 220-223 С (диэтиловый эфир). Пример 118. 2-(4-Бензилпиперидин-1-ил)-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)ацетамид (45 70001712). 118 а) 2-Хлор-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)ацетамид. Названное соединение получают из 5-амино-1,3-дигидроиндол-2-она и хлорацетилхлорида в соответствии со способом, описанным в примере 81 а. T. пл.: 166-170C (вода). 118b) 2-(4-Бензилпиперидин-1-ил)-Н-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)ацетамид. Смесь 0,9 г (4 ммоль) 2-хлор-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)ацетамида, 0,7 г (4 ммоль) ио- 23010162 дида калия, 0,6 мл (4 ммоль) триэтиламина, 0,53 мл (3 ммоль) 4-бензилпиперидина и 50 мл ацетонитрила нагревают при кипении в течение 20 ч. Реакционную смесь концентрируют и к остатку добавляют 30 мл воды и 30 мл хлороформа. Органический слой отделяют и водную фазу экстрагируют трижды по 10 мл хлороформа. Объединенные органические слои сушат над сульфатом натрия, концентрируют и остаток обрабатывают диэтиловым эфиром и выпавшие в осадок кристаллы отфильтровывают, что дает на выходе 0,7 г (64%) названного соединения. T. пл.: 176-180C (диэтиловый эфир). Пример 119. 2-(4-Бензилпиперидин-1-ил)-N-(4-метоксифенил)ацетамид (45 70002794). Названное соединение получают из 2-хлор-N-(4-метоксифенил)ацетамида [J. Heterocycl. Chem., 32,1429. (1995)] и 4-бензилпиперидина в соответствии со способом, описанным в примере 118b. T. пл.: 8183 С (гексан). Пример 120. 2-(4-Бензилпиперидин-1-ил)-N-(4-гидроксифенил)ацетамид (45 70002863). К перемешиваемому раствору 0,68 г (2 ммоль) 2-(4-бензилпиперидин-1-ил)-N-(4-метоксифенил)ацетамида (пример 119) и в 30 мл дихлорметана добавляют по каплям при температуре -20C 0,95 мл (10 ммоль) трибромида бора в 9 мл дихлорметана и реакционную смесь перемешивают при комнатной температуре в течение 10 ч. Реакционную смесь концентрируют. Затем добавляют к смеси 30 мл 8% раствора гидрокарбоната натрия и 20 мл хлороформа. Органический слой отделяют и водную фазу экстрагируют трижды по 20 мл хлороформа. Объединенные органические слои сушат над сульфатом натрия, концентрируют и остаток очищают с помощью хроматографии на колонке, используя Кизельгель 60 в качестве адсорбента (Merk) и смесь хлороформ: метанол = 9:1 в качестве элюента, что дает на выходе 0,4 г(62%) названного соединения. T. пл.: 66-70C (гексан). Пример 121. Стадия (1). Получение эфирных производных формулы (VIII) где R1, R2, m, n, Y и Z имеют те же самые значения, которые даны для соединений формулы (I). 0,1 ммоль вторичных аминов формулы (III) - где R1, R2, m, n, Y и Z имеют те же самые значения, которые даны для соединений формулы (I) - растворяют в 0,4 мл CH2Cl2. K раствору добавляют основание на твердой подложке 2,5 (диизопропиламинометилполистирол, 3 ммоль/г, Fluka, cat.nr.(номер в каталоге): 38343) (83 мг) и 11,2 мкл этилоксалилхлорида. Смесь энергично встряхивают в течение 2 ч при температуре 40C. Суспензию отфильтровывают и смолу промывают трижды CH2Cl2. Фильтрат концентрируют в вакууме, (выход: 100%). Стадия (2). Гидролиз полученных выше эфирных производных до моноамидов щавелевой кислоты формулы (IX) где R1, R2, m, n, Y и Z имеют те же самые значения, которые даны для соединений формулы (I). Эфиры формулы (VIII), полученные выше, растворяют в 0,8 мл этанола и добавляют 120 мг ионообменной основной смолы (DOWEX-2X8-100) в форме OH-. Смесь энергично встряхивают в течение 16 ч при температуре 60C, а затем растворитель отфильтровывают. Смолу промывают трижды этанолом. Затем смолу суспендируют в 0,8 мл этилацетата, добавляют 0,8 мл 1,5 M смеси HCl / этилацетат и смесь энергично встряхивают в течение 3 ч при комнатной температуре. Смолу отфильтровывают, промывают этилацетатом и фильтрат концентрируют в вакууме, (выход:100%). Стадия (3). Конденсация. Полученные выше моноамиды щавелевой кислоты формулы (IX) растворяют в 2 мл CH2Cl2/ДМФА 1:1.0,125 ммоль амина формулы (V) - где V и U имеют значения, которые даны для соединений формулы(I) и добавляют 0,25 ммоль 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (EDC) и смесь энергично встряхивают в течение 12 ч. Смесь разбавляют 2 мл CH2Cl2 и трижды экстрагируют 4 мл воды. К органическому раствору добавляют твердое вещество, содержащее 4-бензилоксибензальдегид (200 мг, 3 ммоль/г, Novabiochem, номер в каталоге: 01-64-0182) и смесь энергично встряхивают в течение 2 ч при температуре 40C. Смолу отфильтровывают и фильтрат концентрируют, что дает на выходе конечный продукт, который представляет собой соединение формулы (I) - где X означает -СО- группу и R1, R2, Y,Z, U, V, n и m имеют значения, как определены выше. Пример 122. Способы определения характеристик и очистки соединений. Соединения настоящего изобретения характеризуются с помощью высокоэффективной жидкостной хроматографии, в связи с чем их подключают к селективному масс детектору (LC/MS), используя HP 1100 Бинарную градиентную хроматографическую систему с микроабразцом (Agilent, Waldbronn), кон- 24010162 тролируя с помощью ChemStation математического обеспечения. Используют HP детектор на диодной матрице, чтобы получить УФ спектр при 225 и 240 нм. Все эксперементы выполняют, используя HPMSD (Agilent, Waldbronn) один квадропульный спектрометр, оснащенный электроспрейным ионизирующем источником, который позволяет установить структуру. Синтезируемые продукты растворяют в 1 мл ДМСО (Aldrich, Germany). Каждый раствор в количестве 100 мкл разбавляют с помощью ДМСО до объема 1000 мкл. Аналитические хроматографические эксперименты выполняют на приборе Discovery RP С-16 Amid, 5 см X 4,6 мм X 5 мкм колонке из Supelco(Bellefonte, Pennsilvania) с объемной скоростью потока 1 мл/минута как ограничительное условие. Полученные соединения характеризуют с помощью его k' значения (чистота, коэффициент производительности), k' факторы оценивают с помощью следующей формулы:k' = (tR-t0)/t0, где k'= коэффициент производительности, tR = время удержания и t0 = время удержания элюента. Элюент А является водой, содержащей 0,1% трифторуксусной кислоты (TFA) (Sigma, Germany),элюент В являлся 95% ацетонитрилом (Merk, Germany), содержащей 0,1% TFA и 5% элюента А. Градиент элюирования используют, начиная с 100% элюента А и обрабатывая 100% элюентом В в течение 5 мин. Полупрепаративное разделение соединений настоящего изобретения - чистота ниже 85% - проводят, используя ту же самую высокоэффективную хроматографческую систему. Разделение выполняют на приборе Discovery RP С-16 Amid, 20 см X 10 X 5 мм полупрепаративной колонке из Supelco (Bellefonte,Pennsilvania) со скоростью потока 3 мл/мин. Сбор фракций основывается на массовом селективном разделении. Градиент элюирования используют, начиная с 80% элюента А и обрабатывая 65% элюентом В в течение 35 мин для такого соединения, где коэффициент производительности более чем 2,5. Градиент элюирования используют, начиная со 100% элюента А и обрабатывая 55% элюентом В в течение 30 мин для такого соединения, где коэффициент производительности, менее чем 2,5. Собранные фракции оценивают с помощью описанных выше аналитических методов и растворитель испаряют с помощью SpeedVac (Savant, USA). Соединения, полученные как описанные в примере 121, показаны в табл. 3. Таблица 3. Соединения формулы (I), полученные как описано в примере 121, где X означает -СОгруппу, оба -(CHR1)m- и -(CHR2)n- являются -CH2-СН 2- группами, U и V образуют вместе двухвалентную группу и Y и Z имеют те значения, которые даны ниже:a) Таблетки. 0,01-50% активного ингредиента формулы (I), 15-50% лактозы, 15-50% картофельного крахмала, 515% поливинилпирролидона, 1-5% талька, 0,01-3% стеарата магния, 1-3% колоидного диоксида кремния и 2-7% ультраамилопектина смешивают, затем гранулируют с помощью влажной грануляции и прессуют в таблетки.b) Драже, покрытые оболочкой таблетки. Таблетки, сделанные согласно способу, описанному выше, покрывают слоем, состоящим из энтероили гастро-растворимой (растворимой в желудке) пленки или пленки из сахара и талька. Драже полируют с помощью смеси воска карнуба и пчелиного воска.c) Капсулы. 0,01-50% активного ингредиента формулы (I), 1-5% сульфата натрий лаурила, 15-50% крахмала, 1550% лактозы, 1-3% коллоидного диоксида кремния и 0,01-3% стеарата магния тщательно смешивают,смесь пропускают через сита и заполняют ею твердые желатиновые капсулы.d) Суспензии. Ингредиенты: 0,01-15% активного ингредиента формулы (I), 0,1-2% гидроксида натрия, 0,1-3% лимонной кислоты, 0,05-0,2% нипагина (натрий метил-4-гидрооксибензоат), 0,005-0,02% нипасола, 0,010,5% карбополя (полиакриловая кислота), 0,1-5% 96%-ого этилового спирта, 0,1-1% отдушки, 20-70% сорбита (70%-ный водный раствор) и 30-50% дистиллированной воды. К раствору нипагина и лимонной кислоты в 20 мл дистиллированной воды, добавляют при энергичным перемешивании малыми дозами карбополь и раствор оставляют стоять в течение 10-12 ч. Затем добавляют при перемешивании гидроксид натрия в 1 мл дистиллированной воды, водный раствор сорбитола и наконец спиртовой экстракт малины. К указанному носителю добавляют активный ингредиент небольшими порциями и суспендируют. Наконец, суспензию доводят до желательного конечного объема с помощью дистиллированной воды и суспензированный сироп пропускают через коллоидное помольное оборудование.e) Свечи. Для каждой свечи смешивают 0,01-15% активного ингредиента формулы: I и 1-20% лактозы, затем расплавляют 50-95% адептов про суппозитория (например, Witepsol 4), охлаждают до температуры 35 С и смесь активного ингредиента и лактозы смешивают с ее гомогенизатором. Полученную смесь формуют в охлажденном виде.f) Лиофилизованные порошковые композиции в ампулах. 5%-ый раствор маннита или лактозы готовят с дважды перегнанной дистиллированной водой для использования в виде инъекций, после чего раствор фильтруют, чтобы иметь стерильный раствор. Раствор 0,01-5% активного ингредиента формулы (I), который также готовят с дважды перегнанной дистиллированной водой для использования в качестве инъекций и указанный раствор фильтруют, чтобы иметь также стерильный раствор. Указанные два раствора смешивают в асептических условиях, заполняют частично по 1 мл в ампулы, содержание ампул лиофилизуют и герметично закрывают в атмосфере азота. Перед введением содержание ампул растворяют в стерильной воде или 0,9% (физиологическом) стерильном водном растворе хлористого натрия. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Амидные производные соединения карбоновых кислот формулы (I) где смежные V и U группы образуют вместе с -СН 2- или -CH= группами 4-7-членное гомо- или гетероциклическое кольцо, которое может быть прервано 1-3 одинаковыми или различными гетероатомами,выбранными из группы N, и/или О, и/или S и которое может быть замещено 1-2 атомами О S или алкилом,W является -CO-, -CH2- или -СН(-алкильной)- группой,Y является атомом кислорода, так же как С 1-С 4 алкиленом, С 2-С 4 алкиниленом, циклоалкиленом,аминокарбонилом, -NH-, -N(алкил)-, -СН 2 О-, -CH(OH)-, -ОСН 2- группой,Z является водородом или атомом галогена, нитро, амино, алкилом, С 1-С 4 алкокси, циано, трифторметилом, гидроксильной или карбоксильной группой и оптические антиподы или рацематы и/или их фармацевтически приемлемые соли, образованные с кислотами и основаниями.- 27010162 2. Соединения по п.1, где W означает -СН 2-группу и V, U, Y и Z имеют значения, как определено для соединения формулы (I). 3. Соединения по п.1, где W означает -СО- группу и V, U, Y и Z имеют значения, как дано для соединения формулы (I). 4. Соединения по п.1, выбранные из следующей группы амидных производных карбоновой кислоты: 2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)ацетамид,2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-бензоксазол-5-ил)ацетамид,2-(4-бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)ацетамид,2-(4-бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидро-1H-бензимидазол-5-ил)ацетамид,2-(4-бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,5-2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксоэтиламино-1,3-дигидробензоимидазол-2-он,6-2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксоэтиламино-3 Н-бензоксазол-2-он,2-[4-(4-метилбензил)пиперидин-1-ил]-2-оксо-N-(3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-ил) ацетамид,2-[4-(4-метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)ацетамид,2-[4-(4-хлорфенокси)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-бензимидазол-5 ил)ацетамид,2-[4-(4-хлорфенокси)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,2-[4-(4-хлорбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,2-[4-(4-хлорбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1H-бензимидазол-5 ил)ацетамид,2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)-2-(4-п-толилоксипиперидин-1-ил)ацетамид,2-оксо-N-(2-оксо-2,3-дигидро-1 Н-бензимидазол-6-ил)-2-(4-п-толилоксипиперидин-1-ил)ацетамид,2-[4-(4-хлорбензил)-пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1 Н-индол-5-ил)ацетамид,6-[2-(4-бензилпиперидин-1-ил)-2-оксоэтиламино]-3 Н-бензоксазол-2-он,2-(4-бензилпиперидин-1-ил)-N-(2-меркапто-3 Н-бензимидазол-5-ил)-2-оксоацетамид,2-(4-бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,2-[4-(4-фторбензил)пиперидин-1-ил]-N-(2-меркапто-3 Н-бензимидазол-5-ил)-2-оксоацетамид,2-[4-(4-фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)-2-(4-п-толилоксипиперидин-1-ил)ацетамид,N-(2-меркапто-3 Н-бензимидазол-5-ил)-2-(4-п-толилоксипиперидин-1-ил)-2-оксоацетамид,2-[4-(4-метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,2-[4-(4-метоксибензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,2-[4-(3-метоксибензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,2-[4-(3-метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,2-[4-(4-цианобензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,2-[4-(3-фторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,2-[4-(2,4-дифторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,6-2-[4-(4-метилбензил)пиперидин-1-ил]-2-оксоэтиламино-3 Н-бензоксазол-2-он,2-[4-(3,4-дифторбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид,2-[4-(4-метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-1,2,3,4-тетрагидрохинолин-6-ил)ацетамид,2-[4-(4-метилбензил)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,2-[4-(4-хлорфенокси)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)-2-(4-п-толилоксипиперидин-1-ил)ацетамид,и/или их рацематы, оптические антиподы и/или фармацевтически приемлемые соли, образованные с кислотами или основаниями. 5. Фармацевтические композиции, обладающие эффектом специфического антагониста NMDANR2B подтипа, содержащие биологически эффективную дозу производного амида карбоновой кислоты формулы (I), где значения V, U, W, Y и Z являются теми, которые определены в п.1, и/или его рацематы,оптические антиподы и/или фармацевтически приемлемые соли, образованные с кислотами или основаниями, в качестве активного ингредиента и носители, наполнители и им подобные добавки, обычно применяемые в фармацевтике. 6. Способ получения производных амидов карбоновых кислот формулы (I)- 28010162 где значения V, U, W, Y и Z являются теми, которые определены в п.1, и/или их рацематов, оптических антиподов и/или фармацевтически приемлемых солей, образованных с кислотами или основаниями,являющихся активным ингредиентом, характеризующийся тем, что а) карбоновая кислота формулы (II) где значения U, V и W являются теми, которые определены для формулы (I), или ее реакционноспособное производное взаимодействует с амином формулы (III) где значения Y и Z, являются теми, которые определены ранее для соединений формулы (I),и происходит преобразование полученных соединений формулы (I), где значения V, U, W, Y и Z являются теми, которые определены в п.1, в другое соединение формулы (I) путем введения дополнительных заместителей, и/или модифицирования, и/или удаления имеющихся заместителей, и/или путем образования солей с кислотами, и/или высвобождения амида карбоновой кислоты формулы (I) из полученной кислотно-аддитивной соли путем обработки основанием и/или свободное производное амида карбоновой кислоты формулы (I) может быть преобразовано в соль путем обработки основанием и/или разделено на его оптические антиподы. 7. Способ получения производных амидов карбоновых кислот формулы (I) где значения V, U, W, Y и Z являются теми, которые определены в п.1, и/или их рацематов, оптических антиподов и/или фармацевтически приемлемых солей, образованных с кислотами или основаниями,являющихся активным ингредиентом, характеризующийся тем, что для получения соединений формулы (I), имеющих -СО- группу в положении W, где значения Y, Z,U и V являются теми, которые определены ранее для соединений формулы (I), карбоновая кислота формулы (IV) где значения Y и Z являются теми, которые описаны ранее для соединений формулы (I) или ее реакционноспособное производное, взаимодействует с амином формулы (V) где значения U и V являются теми, которые определены ранее для соединений формулы (I),и происходит преобразование полученных соединений формулы (I), где значения V, U, W, Y и Z являются теми, которые определены в п.1, в другое соединение формулы (I) путем введения дополнительных заместителей, и/или модифицирования, и/или удаления, имеющихся заместителей, и/или путем образования солей с кислотами, и/или высвобождения амида карбоновой кислоты формулы (I) из полученной кислотно-аддитивной соли путем обработки основанием и/или свободное производное амида карбоновой кислоты формулы (I) может быть преобразовано в соль путем обработки основанием и/или разделено на его оптические антиподы. 8. Способ получения производных амидов карбоновых кислот формулы (I) где значения V, U, W, Y и Z являются теми, которые определены в п.1, и/или их рацематов, оптических антиподов и/или фармацевтически приемлемых солей, образованных с кислотами или основаниями,являющихся активным ингредиентом, характеризующийся тем, что для получения соединений формулы(I), имеющих -СН 2- или -СН(-алкильную)группу в положении W, где алкил является С 1-С 4 алкильной группой и значения Y, Z, U и V являются теми, которые определены ранее для соединений формулы (I),галоидное производное соединения формулы (VII) где значение Q является атомом галогена, R3 является атомом водорода или С 1-С 4 алкильной группой и Y и Z являются теми, которые описаны выше для соединений формулы (I), взаимодействует с амином формулы (V) где значения U и V являются теми, которые определены ранее для соединений формулы (I), и роисходит преобразование полученных соединений формулы (I), где значения V, U, W, Y и Z являются теми,которые определены в п.1, в другое соединение формулы (I) путем введения дополнительных заместителей, и/или модифицирования, и/или удаления имеющихся заместителей, и/или путем образования солей с кислотами, и/или высвобождения амида карбоновой кислоты формулы (I) из полученной кислотноаддитивной соли путем обработки основанием и/или свободное производное амида карбоновой кислоты формулы (I) может быть преобразовано в соль путем обработки основанием и/или разделено на его оптические антиподы. 9. Способ получения производных амидов карбоновых кислот формулы (I) где значения V, U, W, Y и Z являются теми, которые определены в п.1, и/или их рацематов, оптических антиподов и/или фармацевтически приемлемых солей, образованных с кислотами или основаниями,являющихся активным ингредиентом, характеризующийся тем, что вторичный амин формулы (III) где Y и Z имеют те же самые значения, которые определены для соединений формулы (I), взаимодействует с этилоксалилхлоридом в присутствии основания на твердой подложке в дихлорметане, полученный эфир формулы (VIII) где Y и Z имеют те же самые значения, которые определены для соединений формулы (I), подщелачивают сильноосновной ионообменной смолой в этаноле и полученный оксаламид кислоты формулы
МПК / Метки
МПК: C07D 295/185, C07D 417/12, A61P 25/28, C07D 401/12, A61K 31/445, C07D 413/12, C07D 407/12, C07D 451/02
Метки: амидные, производные, кислот, карбоновых
Код ссылки
<a href="https://eas.patents.su/30-10162-amidnye-proizvodnye-karbonovyh-kislot.html" rel="bookmark" title="База патентов Евразийского Союза">Амидные производные карбоновых кислот</a>
Предыдущий патент: Пиразолы и способы их получения и применения
Следующий патент: Связанные с матрицей пептидомиметики β-шпилечной структуры с активностью антагонистов cxcr4
Случайный патент: Исполнительный механизм газового клапана












