N-арилдиазаспирациклические соединения и способы их получения и применения
Номер патента: 9789
Опубликовано: 28.04.2008
Авторы: Миллер Крэйг Х., Шмитт Джеффри Д., Бхатти Балвиндер С.
Формула / Реферат
1. Соединение, представленное следующей формулой 1
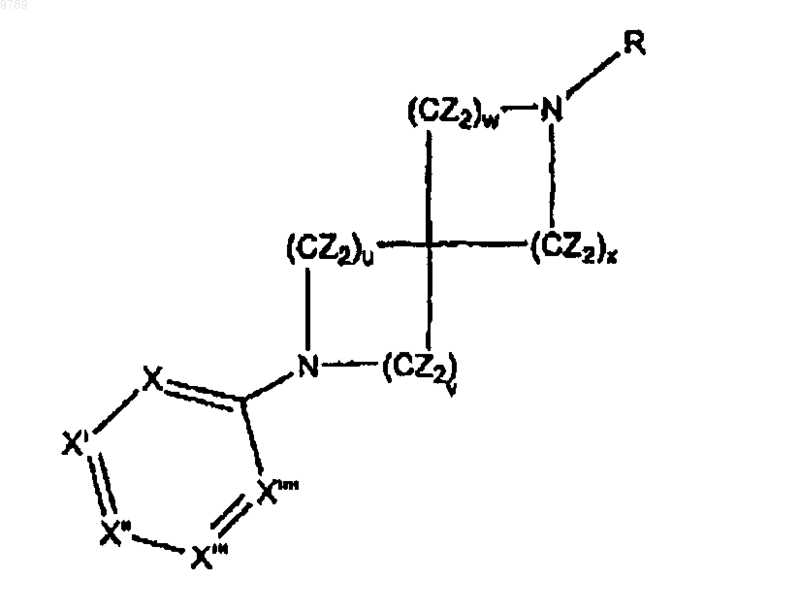
а также его фармацевтически приемлемые соли,
где u, v, w и x, каждый независимо равен 0, 1, 2 или 3, причем значения выбираются так, что соединения выбираются из 1,7-диазаспиро[4,4]нонанов, 2,7-диазаспиро[4,4]нонанов, 1,6-диазаспиро[3,5]нонанов, 2,6-диазаспиро[4,5]нонанов, 1,7-диазаспиро[4,5]деканов и 1,8-диазаспиро[5,5]ундеканов,
R представляет собой водород, С1-С8алкил, ацил, алкоксикарбонил или арилоксикарбонил,
Z независимо выбран из группы, включающей водород, C1-С8алкил, замещенный C1-С8алкил, С3-С8циклоалкил, замещенный С3-С8циклоалкил, гетероциклил, замещенный гетероциклил, С3-С10арил, замещенный С6-С10арил, С1-С8алкил-С6-С10арил, замещенный C1-С8алкил-С6-С10арил, С6-С10арил-С1-С8алкил и замещенный С6-С10арил-С1-С8алкил;
где "гетероциклил" относится к насыщенным или ненасыщенным циклическим радикалам, содержащим один или несколько атомов О, N и/или S в качестве элемента кольцевой структуры и содержащим от двух до семи углеродных атомов в кольце;
где заместители "замещенного C1-С8алкила", "замещенного С3-С8циклоалкила", "замещенного гетероциклила", "замещенного С6-С10арила", "замещенного С1-С8алкил-С6-С10арила" и "замещенного С6-С10арил-С1-С8алкила" относятся к заместителю, выбранному из гидрокси, алкокси, арилокси, меркапто, арила, гетероцикло, гало, амино, карбоксила, карбамида и циано;
и где каждый из X, X', X", X'" и X"" независимо представляет собой азот или углерод, связанный с заместителями, при условии, что кольцо представляет собой фенил, пиридинил или пиримидинил.
2. Соединение по п.1, где как X', так и X"' представляют собой азот.
3. Соединение по п.1, где X, X" и X"" представляют собой углерод, связанный с заместителями.
4. Соединение по п.3, где заместители при X, X" и X"" представляют собой водород.
5. Фармацевтическая композиция, включающая соединение по п.1.
6. Способ лечения или профилактики нарушения ЦНС, ассоциируемого с высвобождением нейротрансмиттеров, опосредованного никотиновыми рецепторами, включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в лечении.
7. Способ по п.6, где нарушение ЦНС выбрано из группы, состоящей из пресенильного слабоумия (раннее развитие болезни Альцгеймера), старческого слабоумия (деменция типа Альцгеймера), деменции Lewy Body, деменции, связанной со СПИДом, множественных церебральных инфарктов, паркинсонизма, включая болезнь Паркинсона, болезни Пика, хореи Хантигтона, поздней дискинезии, гиперкинеза, мании, нарушения дефицита внимания, беспокойства, депрессии, недостаточности познавательной способности, дислексии, шизофрении и синдрома Тиретта.
8. Способ по п.6, где соединение вводят в дозе, эффективной для лечения или профилактики нарушения ЦНС, но не в дозе, приводящей к проявлению заметных побочных эффектов, связанных со стимуляцией мышечных или ганглиозных рецепторов.
9. Способ обезболивания, уменьшения воспаления, лечения язвенного колита, воспалительных и аутоиммунных заболеваний, лечения нейродегенеративных заболеваний и/или лечения конвульсий, включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в таком лечении.
10. Способ лечения бактериальных, грибковых и/или вирусных инфекций и/или действия токсинов, продуцируемых такими инфекциями, включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в таком лечении.
11. Способ лечения воспаления кишечника, дивертикулита, острого холангита, афтозного стоматита, артрита, нейродегенеративных заболеваний, болезни Кройтцфельда-Якоба, кахексии, вторичной по отношению к инфекции, генетических заболеваний и нарушений и/или аутоиммунных нарушений, включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в таком лечении.
12. Способ ингибирования высвобождения цитокина, включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в таком лечении.
13. Способ лечения язвенного колита, включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в таком лечении.
14. Способ обезболивания, включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в таком лечении.
15. Соединения, выбранные из группы, включающей
7-(3-пиридил)-1,7-диазаспиро[4,4]нонан,
7-(5-пиримидинил)-1,7-диазаспиро[4,4]нонан,
7-(2-пиразинил)-1,7-диазаспиро[4,4]нонан,
7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонан,
7-(6-хлор-3-пиридил)-1,7-диазаспиро[4,4]нонан,
1-(3-пиридил)-1,7-диазаспиро[4,4]нонан,
1-метил-7-(3-пиридил)-1,7-диазаспиро[4,4]нонан,
1-метил-7-(5-метокси-3-пиридил)-1,7-диазаспиро[4,4]нонан,
1-метил-7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонан,
2-метил-7-(3-пиридил)-2,7-диазаспиро[4,4]нонан,
6-(3-пиридил)-1,6-диазаспиро[3,4]октан,
1-метил-6-(3-пиридил)-1,6-диазаспиро[3,4]октан,
2-(3-пиридил)-2,6-диазаспиро[4,5]декан,
7-(3-пиридил)-1,7-диазаспиро[4,5]декан, и
их фармацевтически приемлемые соли.
16. Фармацевтическая композиция, включающая эффективное количество соединения по п.15.
Текст
009789 Область техники, к которой относится изобретение Настоящее изобретение относится к фармацевтическим композициям, содержащим соединения,способные воздействовать на никотиновые холинорецепторы, например, в качестве модуляторов специфических субтипов никотиновых рецепторов. Настоящее изобретение также относится к способам лечения широкого разнообразия состояний и нарушений, в частности тех, которые ассоциируются с дисфункцией центральной и аутоиммунной нервных систем. Описание известного уровня техники Никотин проявляет различные фармакологические эффекты (Pullan et al., N. Engl. J. Med. 330: 811815 (994, некоторые из которых вызваны высвобождением нейротрансмиттеров (см., например, Sjak-shieet al., Brain Res. 624: 295 (1993), где предлагаются нейрозащитные эффекты никотина). Например, при введении никотина ацетилхолин, допамин, норэпинефрин, серотонин и глютамат высвобождаются нейронами (Rowell et al., J. Neurochem. 43: 1593 (1084); Rapier et al., J. Neurochem. 50: 1123 (1988); Sandor et(1992. Подтверждающие сообщения и дополнительные недавние исследовния показывают, что введение никотина модулирует глютамат, оксид азота, GABA, такикинины, цитокины и пептиды в центральной нервной системе (ЦНС) (см. обзор Brioni et al., Adv., Pharmacol. 37: 153 (1997. Также сообщалось,что никотин усиливает фармакологическое действие некоторых фармацевтических композиций, используемых для лечения некоторых заболеваний. См., например, Sanberg et al., Pharmacol. BiochemBehavior 46: 303 (1993); Harsing et al., J. Neurochem. 59: 48 (1993) и Hughes, Proceedings from Intl. Symp. Nic., S40(1994). Были предложены различные дополнительные полезные фармакологические эффекты никотина. См. например, Decina et al., Biol. Psychiatry 28: 502 (1990); Wagner et al., Pharmacopsychiatry 21: 301et al., J. Pharmacol. Exp. Ther. 221: 91 (1982), а также Hamon, Trends in Pharmacol. Res. 15: 36 (1994). Помимо самого никотина, различные производные никотина, предположительно, могут быть использованы при лечении различных состояний и нарушений. См, например, Williams et al., Drug Newset al., J. Med. ChemChem. 40 (28): 4169 (1997); Bannon et al., Science 279: 77 (1998); PCT WO 94/08992,PCT WO 96/31475, PCT WO 96/40682 и патенты США 5583140, Bencherif et al., 5597919, Dull et al.,5604231, Smith et al. и 5852041, Cosford et al. Имеются сообщения о том, что никотин и различные производные никотина могут быть использованы при лечении различных заболеваний ЦНС. См., например, публикации, патенты США 51871166,Kikuchi et al., 5672601 Cignarella, PCT WO 99/21834 и PCT WO 97/40049, патентная заявка GB 2295387 и европейская патентная заявка 297858. Нарушения ЦНС относятся к неврологическому нарушению, они могут быть индуцированы лекарством; могут быть отнесены к генетической предрасположенности, инфекции или травме или иметь неизвестную этиологию. Нарушения ЦНС включают нейропсихиатрические нарушения, неврологические нарушения и психические заболевания и включают нейродегенеративные заболевания, нарушения поведения, расстройства познавательной способности и аффективные расстройства познавательной способности. Существуют некоторые нарушения ЦНС, клинические проявления которых могут быть приписаны дисфункции ЦНС (например, нарушения, возникающие из-за высвобождения недостаточного количества нейротрансмиттеров, неудовлетворительных свойств нейротрансмиттерных рецепторов и/или неприемлемого взаимодействия между нейротрансмиттерами и нейротрансмиттерными рецепторами). Некоторые заболевания ЦНС могут быть приписаны недостатку холина, допамина, норэпинефрина и/или серотонина. Относительно общеизвестные нарушения ЦНС включают пресенильное слабоумие (ранее развитие болезни Альцгеймера), старческое слабоумие (деменция типа Альцгеймера), микроинфарктную деменцию, деменцию, связанную со СПИДом, болезнь Крейтцфельда-Якоба, болезнь Пика, паркинсонизм,включая болезнь Паркинсона, прогрессирующий супраядерный паралич, хорею Хантингтона, позднюю дискенизию, гиперкинезию, манию, нарушения, связанные с дефицитом внимания, беспокойство, дислексию, шизофрению, депрессию, обессивно-компульсивные нарушения и синдром Тиретта. Ограничение в применении некоторых производных никотина связано с тем, что они ассоциируются с различными нежелательными побочными эффектами, например стимулированием мышечных и ганглиозных рецепторов. Были бы желательны соединения, композиции и способы для профилактики и/или лечения болезненных состояний или нарушений (например, нарушений ЦНС), включающих облегчение симптомов этих нарушений, где соединения обладают никотиновой фармакологией с полезным эффектом (например, при воздействии на ЦНС) без значительных связанных побочных эффектов. Кроме этого, было бы весьма желательно разработать соединения, композиции и способы, которые воздействуют на функцию ЦНС без существенного воздействия на рецепторы тех подтипов, которые обладают способностью вызывать нежелательные побочные эффекты (например, заметную активность в области сер-1 009789 дечно-сосудистых и скелетных мышечных участков). Настоящее изобретение относится к таким соединениям, композициям и способам. Сущность изобретения Предложены соединения, содержащие их фармацевтические композиции, и способы их получения и применения. Соединения представляют собой N-арилдиазаспироциклические соединения, мостиковые аналоги N-гетероарил диазаспироциклических производных, или пролекарства, или метаболиты этих соединений. Арильная группа может представлять собой 5- или 6-членное гетероциклическое кольцо (гетероарил). Примеры N-арилдиазаспироциклических соединений включают 7-(3-пиридил)-1,7-диазаспиро[4,4] нонан и 1-(3-пиридил)-1,7-диазаспиро[4,4]нонан. Примеры мостиковых аналогов N-гетероарил диазаспироциклических производных включают 1'-(3-пиридил)спиро[1-азабицикло[2,2,1]гептан-2,3'-пирролидин]. Соединения и композиции могут быть использованы для лечения и/или профилактики широкого разнообразия состояний или нарушений, в частности таких нарушений, которые характеризуются дисфункцией никотиновой холинергической нейротрансмиссии, включая нарушения, вовлекающие нейромодуляцию высвобождения нейротрансмиттеров, такое как высвобождение допамина. Другим примером нарушений, которые могут быть подвергнуты лечению и/или профилактике, являются нарушения ЦНС,характеризующиеся нарушением в нормальном высвобождении нейротрансмиттеров. Соединения и композиции также могут быть использованы для облегчения боли. Способы включают введение пациенту эффективного количества N-арилдиазаспироциклического соединения, мостикового аналога N-гетероарил диазаспироциклического соединения, или его пролекарства или метаболита для облегчения конкретного нарушения. Фармацевтические композиции включают эффективное количество описанных здесь соединений. При применении эффективных количеств соединения могут взаимодействовать с сайтами релевантных никотиновых рецепторов объекта лечения и действовать в качестве терапевтического средства для предупреждения и/или лечения широкого разнообразия состояний и нарушений, в частности таких нарушений, которые характеризуются изменением в нормальном высвобождении нейтротрансмиттера. Фармацевтические композиции оказывают терапевтически полезное воздействие на пациентов, страдающих от указанных выше нарушений и обладающих клиническими симптомами таких нарушений. При использовании эффективных количеств соединения обладают способностью: (i) иметь никотиновую фармакологию и воздействовать на сайты релевантных никотиновых рецепторов (например, связываться с никотиновыми ацетилхолиновыми рецепторами и модулировать их функцию) и/или (ii) модулировать секрецию нейротрансмиттеров и, таким образом, предотвращать и подавлять симптомы, связанные с этими заболеваниями. Кроме этого, соединения могут: (i) изменять количество никотиновых холинергических рецепторов в мозгу пациента, (ii) обладать нейрозащитным действием и (iii) при использовании в эффективных количествах не давать нежелательных вредных побочных эффектов (например, побочных эффектов,таких как значительное повышение кровяного давления и ритма сердечных сокращений, значительные отрицательные воздействия на желудочно-кишечный тракт и значительное воздействие на скелетные мышцы). Предполагается, что фармацевтические композиции являются безопасными и эффективными в отношении профилактики и лечения разнообразных состояний и нарушений. Предыдущие и другие аспекты настоящего изобретения подробно объяснены в следующем ниже описании и примерах. Подробное описание изобретения Описаны соединения, фармацевтические композиции, включающие соединения, а также способы их получения и применения. Следующие ниже определения будут полезны для понимания границ и объема описанного здесь изобретения. Как здесь используется, алкил относится к прямым или разветвленным алкильным радикалам,включающим радикалы C1-C8, предпочтительно С 1-С 5, такие как метил, этил или изопропил; замещенный алкил относится к алкильным радикалам, дополнительно содержащим один или несколько заместителей, таких как гидрокси, алкокси, арилокси, меркапто, арил, гетероцикло, гало, амино, карбоксил,карбамид, циано и т.п.; алкенил относится к прямым или разветвленным углеводородным радикалам,включающим C1-C8, предпочтительно C1-C5, и содержащим по меньшей мере одну углерод-углеродную двойную связь; замещенный алкенил относится к алкенильным радикалам, дополнительно содержащим один или несколько заместителей, как указано выше; циклоалкил относится к насыщенным или ненасыщенным, неароматическим, содержащим циклическое кольцо радикалам, состоящим из 3-8 углеродных атомов, предпочтительно от 3 до 6 углеродных атомов; замещенный циклоалкил относится к циклоалкильным радикалам, дополнительно содержащим один или несколько заместителей, как указано выше; арил относится к ароматическим радикалам, состоящим из 6-10 углеродных атомов; замещенный арил относится к арильным радикалам, дополнительно содержащим один или несколько заместителей, как указано выше; алкиларил относится к алкилзамещенным арильным радикалам; замещенный алкиларил относится к алкиларильным радикалам, дополнительно содержащим один или несколько заместителей, как указано выше; арилалкил относится к арилзамещенным алкильным радикалам; термин замещенный арилалкил относится к арилалкильным радикалам, дополнительно содержащим-2 009789 один или несколько заместителей, как указано выше; гетероциклил относится к насыщенным или ненасыщенным циклическим радикалам, содержащим 1 или несколько гетероатомов (например, О, N, S) в качестве элемента кольцевой структуры и содержащим от 2 до 7 углеродных атомов в кольце; замещенный гетероциклил относится к гетероциклильным радикалам, дополнительно содержащим один или несколько заместителей, как указано выше.I. Соединения. Соединения представляют собой N-арил диазаспироциклические соединения, мостиковые аналогиN-гетероарил диазаспироциклических соединений, пролекарства или метаболиты этих соединений и их фармацевтически приемлемые соли. Соединения могут присоединиться к и модулировать никотиновые ацетилхолиновые рецепторы в мозгу пациента в области коры головного мозга, гиппокампа, таламуса, базальной ганглии и спинного мозга. При таком связывании соединения проявляют никотиновую фармакологию, и в частности модулируют высвобождение различных нейротрансмиттеров, включая допамин, другие катехоламины, такие как норэпинефрин, такой как серотонин, ацетилхолин, GABA, глютамат, неропептиды, оксид азота, цитокины и другие нейротрансмиттеры и нейромедиаторы. Константы связывания рецепторов являются мерой способности соединения связываться с половиной сайтов релевантных рецепторов некоторых клеток мозга пациента. См., например, Cheng et al., Biochem.Pharmacol. 22: 3099 (1973). Константы связывания рецепторов соединений, описанных здесь, обычно превышают 0,1 нМ, и часто имеют значение выше 1 нМ, и часто превышают 10 нМ, часто имеют значение менее 100 мкМ, очень часто менее 10 мкМ и часто менее 5 мкМ. Предпочтительные соединения обычно имеют константы связывания рецепторов менее 2,5 мкМ, иногда менее 1 мкМ и могут быть менее 100 нМ. Описанные здесь соединения могут демонстрировать никотиновую функцию путем эффективной активации нейротрансмиттерной секреции из препаратов нервных окончаний (например, синаптосом). Как таковые, указанные соединения могут активировать релевантные нейроны с целью высвобождения или секреции ацетилхолина, допамина и других нейротрансмиттеров. Обычно типичные соединения активируют допаминовую секрецию в количествах по меньшей мере одной трети, обычно по меньшей мере в 10 раз меньших, часто по меньшей мере в 100 раз меньших и иногда по меньшей мере в 1000 раз меньших тех значений, которые требуются для активации никотиновых рецепторов мышечного типа. Некоторые соединения вызывают секрецию допамина в количестве, которое сравнимо со значением, вызываемым эквимолярным количеством (S)-(-)-никотина. Предпочтительно, чтобы такие соединения были способными пересекать гематоэнцефалитический барьер и, таким образом, проникать в центральную нервную систему пациента. Значения log P характеризуют меру способности соединения проникать через диффузионный барьер, такой как биологическая мембрана, включая гематоэнцефалитический барьер. См., например, Hansen et al., J. Med. Chem. 11: 1(1968). Типичные величины log P для соединений, описанных здесь, обычно имеют значения больше-0,5, часто больше 0 и часто больше 0,5, и эти значения обычно меньше 3, часто меньше 2 и, как правило,меньше 1. В соответствии с одним из воплощений соединения настоящего изобретения имеют структуру,представленную ниже формулой 1 В формуле 1 u, v, w и x, каждый независимо равен 0, 1, 2 или 3, причем значения выбираются так,что соединения выбираются из 1,7-диазаспиро[4,4]нонанов, 2,7-диазаспиро[4,4]нонанов, 1,6-диазаспиро[3,5]нонанов, 2,6-диазаспиро[4,5]нонанов, 1,7-диазаспиро[4,5]деканов и 1,8-диазаспиро[5,5]ундеканов,R представляет собой водород, C1-С 8 алкил, ацил, алкоксикарбонил или арилоксикарбонил,Z независимо выбран из группы, включающей водород, C1-С 8 алкил, замещенный C1-С 8 алкил, С 3 С 8 циклоалкил, замещенный С 3-С 8 циклоалкил, гетероциклил, замещенный гетероциклил, С 6-С 10 арил, замещенный С 6-С 10 арил, C1-С 8 алкил-С 6-С 10 арил, замещенный C1-С 8 алкил-С 6-С 10 арил, С 6-С 10 арил-С 1-С 8 алкил и замещенный С 6-С 10 арил-C1-С 8 алкил; где гетероциклил относится к насыщенным или ненасыщенным циклическим радикалам, содержащим 1 или несколько атомов О, N и/или S в качестве элемента кольцевой структуры и содержащим от 2 до 7 углеродных атомов в кольце;-3 009789 где заместители замещенного C1-С 8 алкила, замещенного С 3-С 8 циклоалкила, замещенного гетероциклила, замещенного C6-С 10 арила, замещенного С 1-С 8 алкил-С 6-С 10 арила и замещенного C6 С 10 арил-С 1-С 8 алкила относятся к заместителю, выбранному из гидрокси, алкокси, арилокси, меркапто,арила, гетероцикло, гало, амино, карбоксила, карбамила и циано; и где каждый из X, X', X", X'" и X независимо представляет собой азот или углерод, связанный с заместителями, при условии, что кольцо представляет собой фенил, пиридинил или пиримидинил. Далее, R представляет собой водород, низший алкил, ацил, алкоксикарбонил или арилоксикарбонил, предпочтительно водород или низший алкил. Каждый Z независимо представляет собой водород или подходящий неводородный заместитель(например, алкил, замещенный алкил, циклоалкил, замещенный циклоалкил, гетероциклил, замещенный гетероциклил, арил, замещенный арил, алкиларил, замещенный алкиларил, арилалкил или замещенный арилалкил, но предпочтительно низший алкил или арил). Каждый из X, X', X", X'" и X независимо представляет собой азот, азот, связанный с кислородом(например, N-оксидная или N-O функциональная группа), или углерод, связанный с заместителем. Не более трех из X, X', X", X'" и X представляют собой азот или азот, связанный с кислородом, и предпочтительно, чтобы лишь один или два из X, X', X", X'" и X представляли собой азот или азот, связанный с кислородом. Кроме этого, весьма предпочтительно, чтобы не более чем один из X, X', X", X'" и X представлял собой азот, связанный с кислородом; и предпочтительно, чтобы в том случае, когда одна из указанных разновидностей представляет собой азот, связанный с кислородом, этой разновидностью являлсяX'". Наиболее предпочтительно, когда X'" представляет собой азот. В некоторых предпочтительных случаях как X', так и X"' представляют собой азот. Обычно X, X" и X представляют собой углерод, связанный с заместителем, и обычно заместители при X, X" и X"' представляют собой водород. В некоторых других предпочтительных соединениях, в которых X'" представляет собой углерод, связанный с таким заместителем, как водород, оба X и X" представляют собой азот. В других предпочтительных соединениях, в которых X' представляет собой углерод, связанный с такой разновидностью заместителя, как водород, оба, X и X'", представляют собой азот. Заместители, связанные с любым из X, X', X", X'", X и Y, Y', Y" и Y'" (в том случае, когда любой из углеродов связан с заместителями или азот связан с заместителями), обычно характеризуются величиной сигма m в интервале -0,3 и 0,75, часто в интервале -0,25-0,6; и каждое из значений сигма m может отдельно представлять собой 0 или не равняться 0 в соответствии с методикой определения Hansen et al.,Chem. Rev. 91: 165 (1991). Примеры подходящих заместителей, связанных с X, X', X", X'", X (в том случае, когда любой представляет собой углерод, связанный с заместителями, или азот, связанный с заместителями), включают водород, алкил, замещенный алкил, алкенил, замещенный алкенил, гетероциклил, замещенный гетероциклил, циалокалкил, замещенный циклоалкил, арил, замещенный арил, алкиларил, замещеннный алкиларил, арилалкил, замещенный арилалкил, галоген (например, F, Cl, Br, или I), -OR', -NR'R, -CF3, -CN,-NO2, -C2R', -SR', -N3, -C(=O)NR'R, -NR'C(=O)R, -C(=O)R', -C(=O)OR', -OC(=O)R', -О(CR'R)rC(=O)R',-O(CR'R)rNRC(O)R', -O(CR'R')rNRSO2R', -ОС(=O)NR'R, -NR'C(=O)OR, -SO2R', -SO2NR'R, и -NR'SO2R,где R' и R", каждый независимо, представляют собой водород, низший алкил (например, прямой или разветвленный алкил, включая C1-C8, предпочтительно C1-C5, например метил, этил или изопропил), циклоалкил, гетероциклил, арил или арилалкил (например, бензил), и r представляет собой целое число 1-6. R' и R" могут быть объединены с образованием циклической функциональной группы. Термин замещенный применительно к алкилу, арилу, циклоалкилу и т.п. относится к указанным выше заместителям,начиная с галогена и оканчивая группой -NR'SO2R". Характерные арильные группы включают фенил, нафтил, фуранил, тиенил, пиридинил, пиримидинил, пиразинил, пиридазинил, хинолил и индолил. Примерами других ароматических кольцевых систем могут служить описанные Gibson et al., J. Med. Chem. 39: 4065 (1996). Любая из таких групп, содержащих ароматические группы, может быть замещена по меньшей мере одним заместителем, таким как описанный выше применительно к х' и т.п. Представители таких заместителей включают алкил, арил, галоген,гидрокси, алкокси, арилокси или аминогруппу. Соседние заместители X, X', X", X'", X (когда заместитель присутствует) могут быть объединены с образованием одного или нескольких насыщенных или ненасыщенных, замещенных или незамещенных карбоциклических или гетероциклических колец, содержащих, без конкретных ограничений, эфирные, ацетальные, кетальные, аминные, кетонные, лактонные, лактамовые, кармабатные или мочевинные функциональные группы. Соединения могут существовать в стереоизомерных формах, включающих индивидуальные энантиомеры и рацемические смеси таких соединений, а также смеси с различной степенью избытка энантиомера. Соединения могут находиться в виде свободного основания или в виде соли (например, фармацевтически приемлемой соли). Примерами подходящих фармацевтически приемлемых солей могут служить аддитивные соли неорганических кислот, такие как сульфат, фосфат и нитрат; аддитивные соли органических кислот, такие как ацетат, галактарат, пропионат, сукцинат, лактат, гликолят, малат, тартрат, цит-4 009789 рат, малеат, фумарат, метансульфонат, п-толуолсульфонат и аскорбат; соли кислотных аминокислот,такие как аспартат и глютамат; соли щелочных металлов, например соли натрия и калия; соли щелочноземельных металлов, таких как магний и кальций; соли аммония; соли органических оснований, таких как триметиламин, триэтиламин, пиридин, пиколин, дициклогексиламин и N,N'-дибензилэтилендиамин; а также соли основных аминокислот, таких как лизин и аргинин. Соли в ряде случаев могут находиться в виде гидратов или сольватов этанола. Стехиометрия соли может меняться в зависимости от природы компонентов. Характериные соли описаны в патентах США 5597919, Dull et al., 5616716, Dull et al. и 5663356, Ruecroft et al., которые включены здесь в виде ссылок в полном объеме. Характерные соединения включают следующие: 7-(3-пиридил)-1,7-диазаспиро[4,4]нонан,7-(5-пиримидинил)-1,7-диазаспиро[4,4]нонан,7-(5-изоксазолил)-1,7-диазаспиро[4,4]нонан,7-(5-изотиазолил)-1,7-диазаспиро[4,4]нонан,7-(5-(1,2,4-оксадиазол)ил)-1,7-диазаспиро[4,4]нонан,7- (2-(1,3,4-оксадиазол)ил)-1,7-диазаспиро[4,4]нонан,7-(2-пиразинил)-1,7-диазаспиро[4,4]нонан,7-(3-пиридазинил)-1,7-диазаспиро[4,4]нонан,7-(5-метокси-3-пиридил)-1,7-диазаспиро[4,4]нонан,7-(5-циклопентилокси-3-пиридил)-1,7-диазаспиро[4,4]нонан,7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонан,7-(5-(4-гидроксифенокси)-3-пиридил)-1,7-диазаспиро[4,4]нонан,7-(5-этинил-3-пиридил)-1,7-диазаспиро[4,4]нонан,7-(6-хлор-3-пиридил)-1,7-диазаспиро[4,4]нонан,7-(6-метокси-3-пиридазинил)-1,7-диазаспиро[4,4]нонан,1-(3-пиридил)-1,7-диазаспиро[4,4]нонан,1-(5-пиримидинил)-1,7-диазаспиро[4,4]нонан,1-(5-изоксазолил)-1,7-диазаспиро[4,4]нонан,1-(5-изотиазолил)-1,7-диазаспиро[4,4]нонан,1-(5-(1,2,4-оксадиазолил)ил)-1,7-диазаспиро[4,4]нонан,1-(2-(1,3,4-оксадиазол)ил)-1,7-диазаспиро[4,4]нонан,1-(2-пиразинил)-1,7-диазаспиро[4,4]нонан,1-(3-пиридазинил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(3-пиридил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(5-пиримидинил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(5-изоксазолил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(5-изотиазолил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(5-(1,2,4-оксадиазол)ил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(2-(1,3,4-оксадиазол)ил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(2-пиразинил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(3-пиридазинил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(5-метокси-3-пиридил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(5-циклопентилокси-3-пиридил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(5-(4-гидоксифенокси)-3-пиридил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(5-этинил-3-пиридил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(6-хлор-3-пиридил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(6-метокси-3-пиридазинил)-1,7-диазаспиро[4,4]нонан,7-метил-1-(3-пиридил)-1,7-диазаспиро[4,4]нонан,7-метил-1-(5-пиримидинил)-1,7-диазаспиро[4,4]нонан,7-метил-1-(5-изоксазолил)-1,7-диазаспиро[4,4]нонан,7-метил-1-(5-изотиазолил)-1,7-диазаспиро[4,4]нонан,7-метил-1-(5-(1,2,4-оксадиазол)ил)-1,7-диазаспиро[4,4]нонан,7-метил-1-(2-(1,3,4-оксадиазол)ил)-1,7-диазаспиро[4,4]нонан,7-метил-1-(2-пиразинил)-1,7-диазаспиро[4,4]нонан,7-метил-1-(3-пиридазинил)-1,7-диазаспиро[4,4]нонан,2-(3-пиридил)-2,7-диазаспиро[4,4]нонан,2-(5-пиримидинил)-2,7-диазаспиро[4,4]нонан,2-(5-изоксазолил)-2,7-диазаспиро[4,4]нонан,2-(5-изотиазолил)-2,7-диазаспиро[4,4]нонан,2-(5-(1,2,4-оксадиазол)ил)-2,7-диазаспиро[4,4]нонан,2-(2-(1,3,4-оксадиазол)ил)-2,7-диазаспиро[4,4]нонан,2-(2-пиразинил)-2,7-диазаспиро[4,4]нонан,-5 009789 2-(3-пиридазинил)-2,7-диазаспиро[4,4]нонан,2-(5-метокси-3-пиридил)-2,7-диазаспиро[4,4]нонан,2-(5-циклопентилокси-3-пиридил)-2,7-диазаспиро[4,4]нонан,2-(5-фенокси-3-пиридил)-2,7-диазаспиро[4,4]нонан,2-(5-(4-гидроксифенокси)-3-пиридил)-2,7-диазаспиро[4,4]нонан,2-(5-этинил-3-пиридил)-2,7-диазаспиро[4,4]нонан,2-(6-хлор-3-пиридил)-2,7-диазаспиро[4,4]нонан,2-(6-метокси-3-пиридазинил)-2,7-диазаспиро[4,4]нонан,2-метил-7-(3-пиридил)-2,7-диазаспиро[4,4]нонан,2-метил-7-(5-метокси-3-пиридил)-2,7-диазаспиро[4,4]нонан,2-метил-7-(5-фенокси-3-пиридил)-2,7-диазаспиро[4,4]нонан,6-(3-пиридил)-1,6-диазаспиро[3,4]октан,1-метил-6-(3-пиридил)-1,6-диазаспиро[3,4]октан,2-(3-пиридил)-2,5-диазаспиро[3,4]октан,5-метил-2-(3-пиридил)-2,5-диазаспиро[3,4]октан,6-(3-пиридил)-1,6-диазаспиро[3,5]нонан,1-метил-6-(3-пиридил)-1,6-диазаспиро[3,5]нонан,2-(3-пиридил)-2,5-диазаспиро[3,5]нонан,5-метил-2-(3-пиридил)-2,5-диазаспиро[3,5]нонан,2-(3-пиридил)-2,6-диазаспиро[4,5]декан,6-метил-2-(3-пиридил)-2,6-диазаспиро[4,5]декан,7-(3-пиридил)-1,7-диазаспиро[4,5]декан,1-метил-7-(3-пиридил)-1,7-диазаспиро[4,5]декан,8-(3-пиридил)-1,8-диазаспиро[5,5]ундекан,1-метил-8-(3-пиридил)-1,8-диазаспиро[5,5]ундекан. Соединения формулы 1 могут быть получены с использованием общей методики, включающей арилирование одной аминогруппы необязательно защищенного диазаспироалкана (схема 1). Арилирование по N с помощью соответствующего арила или предпочтительно гетероарила, галогенида или трифлата может проводиться способами, известными специалисту в данной области, например с использованием катализатора на основе металла (например, соединения меди или палладия). В предпочтительном общем способе настоящего изобретения используют методики Buchwald или Hartwiget al., J. Am. Chem. Soc. 120: 9722 (1998, в которых амин взаимодействует с катализатором - комплексом палладия(0), фосфиновым лигандом и основанием. Так, 1-бензил-1,7-диазаспиро[4,4]нонан взаимодействует с 3-бромпиридином в присутствии трис-(дибензилиденацетон)дипалладия(0), 2,2'-бис(дифенилфосфино)-1,1'-бинафтила и трет-бутилата натрия в среде толуола с образованием 1-бензил-7-(3 пиридил)диазаспиро[4,4]нонана. В результате удаления бензильной группы гидрированием над катализатором, представляющим собой 10% палладия на угле, получают 7-(3-пиридил)диазаспиро[4,4]нонан. С другой стороны, специалисту в данной области должно быть ясно, что стратегии с использованием других защитных групп могут использоваться для получения продуктов, содержащих арильную группу на атоме N', вместо атома N, и где QI представляет собой (CZ2)u, QII представляет собой (CZ2)v, QIII представляет собой (CZ2)w, a QIV представляет собой (CZ2)х, где u, v, w и х определены выше (реакция 1,схема 1). Особенно полезной комбинацией защитных групп в настоящем изобретении является бензил и карбамат, в частности трет-бутилкарбамат. Таким образом, 1-бензил-1,7-диазаспиро[4,4]нонан превращают в 1-бензил-7-(трет-бутоксикарбонил)-1,7-диазаспиро[4,4]нонан в результате обработки ди-трет-бутилдикарбонатом. В результате последующего гидрирования и катализируемого палладием арилирования с использованием 3-бромпиридина получают 7-(трет-бутоксикарбонил)-1-(3-пиридил)диазаспиро[4,4]нонан. Удаляя трет-бутоксикарбонильную группу с помощью хлористо-водородной кислоты, получают 1(3-пиридил)-диазаспиро[4,4]нонан. Во многих случаях, когда N и N' отличаются по стерическим сообра-6 009789 жениям и когда N является третичным (как изображено в реакции 2 на схеме 1), селективное арилирование N может осуществляться без первой защиты группы N'. Таким образом, в результате описанного выше взаимодействия 1,7-диазаспиро[4,4]нонана с 3-бромпиридином в условиях катализа палладием почти исключительно получают 7-(3-пиридил)-диазаспиро[4,4]нонан. Для специалиста в данной области ясно, что может быть легко осуществлено включение заместителей в гетероарильное кольцо, введенное в диазаспироалкан. Такие заместители обладают собственными полезными свойствами или способствуют осуществлению последующих стадий синтеза. Может быть разработан соответствующим образом защищенный гетероарилдиазаспироалкан, дающий начало ряду ценных соединений, содержащих заместители в гетероарильном кольце. Так, например, по описанной выше методике, 1-бензил-7-(5-бром-3-пиридил)-1,7-диазаспиро[4,4]нонан может быть получен взаимодействием 3,5-дибромпиридина с 1-бензил-1,7-диазаспиро[4,4]нонаном. Превращение 1-бензил-7-(5 бром-3-пиридил)диазаспиро[4,4]нонана в соответствующее 5-аминозамещенное производное может быть осуществлено по общей методике Zwart et al., Recueil Trav. Chim. Pays-Bas 74: 1062 (1955), согласно которой производное брома нагревают с водным аммиаком в присутствии медного катализатора. Аналогичным образом могут быть получены 5-алкиламинозамещенные производные. 5-Этинилпроизводные соединения могут быть получены из 5-бром производного в результате катализируемого палладием сочетания с использованием 2-метил-3-бутин-2-ола с последующим удалением ацетоновой группы, катализируемым основанием (гидрид натрия) в соответствии с общей методикой, описанной Cosford et al., J.Med. Chem. 39: 3235 (1996). В результате последовательных реакций гидрирования 5-этинильные аналоги могут быть превращены в соответствующее 5-этенильное производное и далее в соответствующие 5 этильные аналоги. 5-Азидозамещенные аналоги могут быть получены из 5-бром производного по реакции с азидом лития в среде N,N-диметилформамида. 5-Алкилтиозамещенные аналоги могут быть получены из 5-бромпроизводного по реакции с соответствующим алкилмеркаптидом натрия (алкантиолат натрия) с использованием методов, известных специалисту в области органического синтеза. Ряд других аналогов, имеющих заместители в положении 5 пиридинового кольца, могут быть синтезированы из соответствующих аминопроизводных, vide supra, через стадию образования промежуточной соли 5-диазония. Примеры других 5-замещенных аналогов, которые могут быть получены из солевых интермедиатов 5-диазония, без конкретных ограничений, включают 5-гидрокси, 5-алкокси, 5-фтор,5-хлор, 5-иод, 5-циано и 5-меркапто. Такие соединения могут быть синтезированы по цитированной выше методике Zwart et al. Так, например, 1-бензил-7-(5-гидрокси-3-пиридил)-1,7-диазаспиро[4,4]нонан может быть получен в результате взаимодействия соответствующей промежуточной соли 5-диазония с водой. Аналогичным образом, 1-бензил-7-(5-алкокси-3-пиридил)-1,7-диазаспиро[4,4]нонаны могут быть получены по реакции соли диазония со спиртами. Как должно быть понятно специалисту, соответствующие соли 5-диазония могут использоваться для синтеза циано или галогенпроизводных. 5-Меркаптозамещенные производные могут быть получены по методикам, описанным Hoffman et al., J. Med. Chem. 36: 953 (1993). В свою очередь, полученный таким образом 5-меркаптан может быть превращен в 5-алкилтиозамещенное производное по реакции с гидридом натрия и соответствующим алкилбромидом. В результате последующего окисления может быть получен сульфон. 5-Ациламидоаналоги указанных выше соединений могут быть получены по реакции соответствующих 5-аминопроизводных с соответствующим ангидридом или хлорангидридом кислоты с использованием методов, известных специалисту в области органического синтеза. 5-Гидроксизамещенные аналоги указанных выше соединений могут использоваться для получения соответствующих 5-алканоилоксизамещенных производных по реакции с соответствующей кислотой, ее ангидридом или хлорангидридом. Аналогичным образом, 5-гидроксипроизводные являются предшественниками как 5-арилокси, так и 5-гетероарилоксипроизводных по реакции нуклеофильного ароматического замещения электрон-дефицитных ароматических колец (например, 4-фторбензонитрил и 2,4 дихлорпиримидин). Такая химия хорошо известна специалисту в области органического синтеза. Другие производные также могут быть получены из 5-гидроксипроизводных в результате алкилирования алкилгалогенидами в присутствии подходящего основания или по реакции Mitsunobu, в которой обычно используют триалкил- или триарилфосфин и диэтилазодикарбоксилат. Стандартные условия реакции Mitsunobu описаны Hughes, Org. React. (N.Y.) 42: 335 (1992) и Hughes, Org. Prep. Proced. Int. 28: 127 (1996). 5-Цианозамещенные аналоги указанных выше соединений могут быть подвергнуты гидролизу с целью получения соответствующих 5-карбоксамидозамещенных производных. В результате последующего гидролиза получают замещенные 5-карбоновые кислоты. В результате восстановления 5-цианозамещенных аналогов литийалюминийгидридом получают соответствующие 5-аминометиловые аналоги. 5-Ацилзамещенные аналоги могут быть получены из соответствующих 5-карбоксизамещенных аналогов по реакции с соответствующим алкиллитием с использованием методик, известных специалисту в области органического синтеза. 5-Карбоксизамещенные аналоги указанных выше соединений могут быть превращены в соответствующие сложные эфиры по реакции с соответствующим спиртом в присутствии кислотного катализатора. Соединения со сложноэфирной группой в положении 5 пиридильного кольца могут быть восстановлены с помощью борогидрида натрия или литийалюминийгидрида с образованием соответствующих 5-7 009789 гидроксиметилзамещенных аналогов. В свою очередь, такие аналоги по общепринятой технологии могут быть превращены в соединения, содержащие эфирный фрагмент в положении 5 пиридильного кольца, в результате взаимодействия с гидридом натрия и соответствующим алкилгалогенидом. С другой стороны,5-гидроксиметилзамещенные аналоги могут взаимодействовать с хлористым тозилом с образованием 5 тозилоксиметильных аналогов. 5-Карбоксизамещенные аналоги могут быть превращены в соответствующие 5-алкиламиноацильные аналоги в результате последовательного взаимодействия с хлористым тионилом и соответствующим алкиламином. Известно, что некоторые из таких амидов легко подвергаются нуклеофильному замещению ацилом с образованием кетонов. Таким образом, так называемые амиды Weinreb (N-метокси-N-метиламиды) реагируют с ариллитиевыми реагентами с образованием соответствующих диарилкетонов. См., например, Selnick et al., Tet. Lett. 34: 2043 (1993). 5-Тозилоксиметилзамещенные аналоги вышеупомянутых соединений могут быть превращены в соответствующие 5-метилзамещенные производные в результате восстановления литийалюминийгидридом. 5-Тозилоксиметилзамещенные аналоги вышеупомянутых соединений также могут использоваться для получения 5-алкилзамещенных производных по реакции с алкиллитиевым реагентом. 5-Гидроксизамещенные аналоги вышеупомянутых соединений могут использоваться для получения 5-N-алкил- или 5N-арилкарбамоилоксизамещенных производных по реакции с участием N-алкил- или N-арилизоцианатов. 5-Аминозамещенные аналоги вышеупомянутых соединений могут использоваться для получения 5 алкоксикарбоксамидозамещенных производных и 5-мочевинных производных по реакции с участием алкилхлорформиатов и N-алкил- или N-арилизоцианатов, соответственно, с использованием методик,хорошо известных специалисту в области органического синтеза. Химические аналоги веществ, описанных выше для получения 5-замещениых диазаспиропроизводных пиридиновых аналогов, могут использоваться для синтеза аналогов, имеющих заместители в 2, 4 и 6 положениях пиридинового кольца. Так, например, некоторые 2-, 4- и 6-аминопиридилдиазаспироалканы могут быть превращены в соответствующие промежуточные соли диазония, которые могут быть трансформированы в разнообразные соединения с заместителями в 2, 4 и 6 положениях пиридинового кольца,аналогично тому, что было описано выше в отношении 5-замещенных аналогов. Необходимые 2-, 4- и 6 аминопиридил диазаспироалканы могут быть получены по реакции Чичибабина взаимодействием незамещенных пиридилдиазаспироалканов (например, описанный выше 1-бензил-7-(3-пиридил)-1,7-диазаспиро[4,4]нонан) с амидом натрия. Аналогичные реакции описаны в Chemistry of Heterocyclic Compounds, Volume 14, part 3, pp.3-5(Interscience Publishers, 1962) и Lahti et al., J. Med. Chem. 42: 2227 (1999). После прекращения преобразований функциональной группы желаемого гетероарильного кольца в соответствующих условиях из диазабицикла может быть удалена необязательная защитная группа. Так,например, в результате гидрогенолиза 1-бензил-7-(5-алкокси-3-пиридил)-1,7-диазаспиро[4,4]нонана может быть получен 7-(5-алкокси-3-пиридил)-1,7-диазаспиро[4,4]нонан. Специалисту в области органической химии должна быть понятна необходимость применения двух защитных групп для химических фрагментов, требующихся для генерации конкретных функциональных групп. В некоторых случаях оказывается необходимым сохранять конкретную функциональность в результате замены одной защитной группы на другую. В соответствии с другим подходом к синтезу пиридинзамещенных пиридилдиазаспироалканов 3,5 дибромпиридин может быть превращен в соответствующие 5-алкокси-3-бром- и 5-арилокси-3-бромпиридины под воздействием алкоксидов натрия или арилоксидов натрия. Аналогичные способы описаныComins et al., J. Org. Chem. 55: 69 (1990) и Hertog et al., Recueil Trav. China. Pays-Bas 74: 1171 (1955). Такой метод проиллюстрирован получением 7-(5-(4-метоксифенокси)-3-пиридил)-1,7-диазаспиро[4,4]нонана. Взаимодействием 3,5-дибромпиридина с 4-метоксифеноксидом натрия в среде N,N-диметилформамида получают 3-бром-5-(4-метоксифенокси)пиридин. Сочетание 3-бром-5-(4-метоксифенокси)пиридина с 1-бензил-7-(3-пиридил)-1,7-диазаспиро[4,4]нонаном в присутствии трет-бутилата натрия и каталитического количества трис-(дибензилиденацетон)дипалладия(0) и 2,2'-бис-(дифенилфосфино)-1,1'-бинафтила в толуоле с последующим гидрогенолизом бензильной защитной группы приводит к образованию 7-(5(4-метоксифенокси)-3-пиридил)-1,7-диазаспиро[4,4]нонана. Выше описаны другие арилгалогениды, подвергающиеся реакции сочетания, катализируемой палладием. Так, 7-(5-пиримидинил)-1,7-диазаспиро[4,4]нонан аналогичным образом получают из 5-бромпиридина и необязательно защищенного в положении 1 1,7-диазаспиро[4,4]нонана с последующим удалением защитной группы, если это необходимо. Такая технология особенно применима в тех случаях, когда используют 3-бромпиридин, 3,5-дибромпиридин и 5-бромпиридин, ароматические кольца которых не активированы в отношении нуклеофильного ароматического замещения. В некоторых случаях сочетание гетероароматического кольца с образованием диазаспироцикла может осуществляться без использования палладиевых катализаторов. Примеры как 5-, так и 6-членных гетероароматических кольцевых производных, которые активированы в отношении нуклеофильного ароматического замещения, известны специалисту в области органического синтеза. Так, например, 7-(6 хлор-3-пиридазинил)-1,7-диазаспиро[4,4]нонан может быть синтезирован из 3,6-дихлорпиридазина и 1,7 диазаспиро[4,4]нонана. Аналогичным образом, взаимодействием 2,6-дихлорпиразина и 2-бромтиазола с-8 009789 1,7-диазаспиро[4,4]нонаном могут быть получены 7-(6-хлор-2-пиразинил)-1,7-диазаспиро[4,4]нонан и 7(2-тиазоил)-1,7-диазаспиро[4,4]нонан, соответственно. Раскрытые в заявке реакции сочетания, как катализируемые палладием, так и протекающие без него, представляют собой новый подход к высокопроизводительной синтетической технологии. Таким образом, может быть создана библиотека соединений настоящего изобретения путем сочетания, проводимого в формате 96-луночного планшета, например, различных галоаренов с различными диазаспиропроизводными. Специальные диазаспирокольцевые системы Необязательно защищенные диазаспироалкановые промежуточные соединения, используемые для получения соединений формулы 1, могут быть получены разнообразными способами. Некоторые из таких диазаспироалкановых промежуточных соединений являются известными веществами и могут быть получены известными способами. Однако синтез таких промежуточных веществ с использованием химии палладия является новым в данной области и до сих пор фармацевтическая активность интермедиатов не оценивалась. Соединения формулы 1, в которой u=v=1, w=0, a x=3, имеют 2,5-диазаспиро[3,4]октановую основу,которая может быть сформирована, как показано на схеме 2. В соответствии с методикой Overman, J. Am. Chem Soc. 107: 1698 (1985) и Tet. Lett. 25: 1635(1985), алкилирование этилового эфира N-бензил-L-пролина (Aldrich Chemical) с использованием сильного основания, такого как диизопропиламид лития (LDA), и аминометилового эквивалента цианометилбензиламина, приводит к образования бета-лактама. Последующее восстановление полученного соединения с помощью литийалюминийгидрида приводит к образованию 2,5-дибензильного производного 2,5 диазаспиро[3,4]октана. В результате удаления бензильных защитных групп путем гидрирования или окислительного отщепления, например, с помощью нитрата церий-аммония получают 2,5-диазаспиро[3,4]октан. С другой стороны, может использоваться химический способ, аналогичный описанному в заявке на EP патент 90117078.7 (номер публикации EP 0417631), в результате чего получают геминальное бис-(гидроксиметил)производное, которое далее превращают в желаемый 2,5-диазаспиро[3,4]октан(схема 2). Можно ожидать, что описанное выше последующее, катализируемое палладием, арилирование будет протекать селективно в отношении стерически менее затрудненного азетидинильного азота с образованием 2-арил-2,5-диазаспиро[3,4]октанов. Изомерные 5-арил-2,5-диазаспиро[3,4]октаны могут быть получены в результате первоначальной защиты азетидинильного азота (например, с помощью карбаматной группы) с последующим осуществлением арилирования, сопровождающегося удалением защитной группы. Схема 2 Соединения формулы 1, в которой u=2, v=1, w=0, a x=3, содержат 1,7-диазаспиро[4,4]нонановую основу, которая может быть получена различными способами, некоторые из которых показаны выше на схеме 3. В соответствии с одним из воплощений (способ А) соответственно защищенный пролиновый эфир, например этиловый эфир N-бензил-L-пролина, может быть подвергнут депротонированию с помощью диизопропиламида лития и вступать в реакцию присоединения Michael с образованием нитроэтилена. В результате получают метил 2-(2-нитроэтил)-1-бензилпирролидин-2-карбоксилат. В результате последующего восстановления нитрогруппы с использованием никеля Ренея, сопровождающегося лактамизацией, осуществляемой методами, известными специалисту в данной области (например, нагреванием в подходящем растворителе в присутствии или в отсутствие кислотного или основного катализатора), получают 1-бензил-1,7-диазаспиро[4,4]нонан-6-он. С другой стороны, 1,7-диазаспиро[4,4]нонан-6-он может быть получен одним из нескольких способов, описанных в литературе. Такой метод показывает, что соответствующим образом защищенный пролиновый эфир может депротонироваться с помощью диизопропиламида лития и вступать в реакцию с алкилирующим агентом, таким как хлорацетонитрил, после чего проводят восстановление нитрила и-9 009789 циклизацию (способ В, схема 3), используя методику Culbertson et al., J. Med. Chem. 33: 2270 (1990). Другие методы показывают, что соответствующим образом защищенный пролиновый эфир может депротонироваться с помощью диизопропиламида лития и вступать в реакцию с алкилирующим агентом, таким как бромистый аллил (способ С, схема 3). Образующийся олефин далее подвергается окислительному расщеплению с образованием альдегида, о чем сообщается Genin et al., J. Org. Chem. 58: 2334(1993); Hinds et al., J. Med. Chem. 34: 1777 (1991); Kim et al., J. Org. Chem. 61: 3138 (1996); EP 0360390 и патент США 5733912. После этого альдегид может подвергаться восстановительному аминированию с помощью соли аммония или первичного алифатического или ароматического амина с использованием способов, известных специалисту в данной области. С другой стороны, альдегид может восстанавливаться в соответствующий спирт, который может трансформироваться в амин в результате конверсии в уходящую группу, с последующим замещением соответствующим амином. Этот же результат может достигаться замещением уходящей группы ионом азида и последующим восстановлением в первичный амин,для чего используют способы, известные специалисту в данной области. Как отмечалось выше, спирт может превращаться в амин с использованием условий Mitsunobo. Алкил 2-аминоэтилпирролидин-2 карбоксилат, полученный одним из описанных выше способов, может циклизоваться в спиролактам с помощью способов, известных специалисту, например при нагревании в подходящем растворителе в присутствии или в отсутствие кислотного или основного катализатора. Лактам, полученный любым из описанных выше способов (способы А, В и С), может вступать в реакцию с подходящим восстанавливающим агентом, таким как литийалюминийгидрид, с образованием защищенного 1,7-диазаспиро[4,4]нонана, в данном примере 1-бензил-1,7-диазаспиро[4,4]нонана. Защитная группа может удаляться с помощью способов, известных в данной области, с образованием желаемого 1,7-диазаспиро[4,4]нонана. Арилирование по любому атому азота может осуществляться с помощью способов, описанных в настоящем документе. Схема 3c) (i) LiAlH4 или BH3; (ii) [-PG]. 1,7-диазаспиро[4,4]нонановая основа также может быть получена в соответствии со схемой 4. Конверсия 1,4-диоксаспиро[4,5]декан-8-она в 4-бензоилоксициклогексанон может быть легко осуществлена специалистом в данной области. Последующая трансформация 4-бензоилоксициклогексанона в 1,7-диазаспиро[4,4]нонан (через образование промежуточного 4-оксокапролактама, как показано на схеме) может быть осуществлена по методике Majer et al., Coll. Czech. Chem. Comm. 47: 950 (1982). Схема 4[4,4]нонановую основу, которая может быть получена согласно схеме 5. Такой способ описан Overman et Соединения формулы 1, в которой u=3, v=1, w=0 и х=3, содержит 1,7-диазаспиро[4,5]декановую основу, которая может быть получена в соответствии со схемой 6. Как следует из работы Kim et al., J. Org.Chem. 61: 3138 (1996), патента ЕР 360390 и патента США 5733912, соответственно защищенный пролиновый эфир (например, этиловый эфир N-бензил-L-пролина) может быть подвергнут депротонированию с помощью диизопропиламида лития и вступать в реакцию с алкилирующим агентом, таким как бромистый аллил. В патенте США 5733912 также указывается, что может осуществляться гидроборирова- 10009789 ние/окисление аллильной боковой цепи с образованием 2-(гидроксипропильной)группы. Для специалиста в данной области понятно, что гидроксильная группа может быть далее превращена в аминогруппу различными способами, например путем окисления с последующим восстановительным аминированием. С другой стороны, надлежащим образом защищенный пролиновый эфир может депротонироваться с помощью диизопропиламида лития и вступать в реакцию с алкилирующим агентом, таким как дииодпропан. Конверсия первичного иодида в амин может осуществляться известными способами, например взаимодействием с аммиаком в присутствии медного катализатора. Образовавшийся аминоэфир способен циклизоваться с образованием защищенного 1,7-диазаспиро[4,5]декан-6-она с использованием любого известного способа, например при нагревании в подходящем растворителе в присутствии или в отсутствие кислотного или основного катализатора, как это обсуждалось выше. Другой способ получения известного 1,7-диазаспиро[4,5]декан-6-она описан Loefas et al., J. Het. Chem. 21: 583 (1984), и в этом способе используется сужение цикла 2,10-диазабицикло[4,4,0]дец-1-ена. Полученный любым из указанных способов 1,7-диазаспиро[4,5]декан-6-он может далее вступать во взаимодействие с восстанавливающим агентом, таким как литийалюминийгидрид, с последующим удалением защитной группы, с образованием желаемого 1,7-диазаспиро[4,5]декана. После этого с использованием описанных способов может проводиться арилирование по любому из атомов азота. Схема 6c) (i) BH3 или LiAlH4; (ii) [-PG]. Соединения формулы 1, в которой u=2, v=1, w=0, a х=4, содержат 2,6-диазаспиро[4,5]декановую основу, которая может быть получена по способу Ciblat, et al., Tet. Lett. 42: 4815 (2001). Так, например,коммерчески доступный 1-бензил-3-пирролидинон может взаимодействовать с 2-метил-2-(2-аминоэтил)1,3-диоксоланом (Islam and Raphael, J. Chem. Soc. 3151 (1955 в рамках внутримолекулярной реакции Манниха (Mannich). Продукт реакции, этиленкеталь 2-бензил-2,10-диазаспиро[4,5]декан-7-она, может гидролизоваться в кетон с использованием водного раствора соляной кислоты. Дезоксигенация кетона может проводиться стандартными способами, например путем конверсии в соответствующий 1,3-дитиан с последующей обработкой никелем Ренея. Полученный в результате 2-бензил-2,6-диазаспиро[4,5]декан может непосредственно арилироваться по азоту в положении 6 или превращаться в 6-(трет-бутоксикарбонил)-2,6-диазаспиро[4,5]декан в результате взаимодействия с ди-трет-бутилдикарбонатом, после чего проводят гидрирование. Последнее производное далее арилируют по азоту в положении 2. Аналогичные химические реакции могут использоваться для превращения других азациклических кетонов в соответствующие спиродиазасоединения. Таким образом, реакция любого из N-защищенных 3-азетидинонов(1998 с 2-метил-2-(2-аминоэтил)-1,3-диоксоланом с последующей дезоксигенацией (описанной выше) приводит к образованию соответствующим образом защищенного 2,5-диазаспиро[3,5]нонана (формула 1,в которой u=1, v=1, w=0, а х=4). Соединения формулы 1, в которой u=v=2, w=0, a x=3, содержат 1,8-диазаспиро[4,5]декановый каркас, который может быть получен в соответствии со схемой 7. В соответствии с методикой Wittekind etal., J. Het. Chem. 9: 11 (1972) защищенный 4-пиперидон может быть превращен в 4-нитропиперидин. Последующее присоединение, например, этилакрилата по Michael и восстановление нитрогруппы никелем Ренея приводит к образованию 1,8-диазаспиро[4,5]декан-2-она. Полученный лактам может быть восстановлен соответствующим восстанавливающим агентом, таким как литийалюминийгидрид, после чего проводят удаление защитной группы с образованием необязательно замещенного 1,8-диазаспиро[4,5]декана. Арилирование по любому атому азота может проводиться любым из описанных способов. Схема 7- 11009789 Соединения формулы 1, в которой u=2, v=1, w=x=2, содержат 2,8-диазаспиро[4,5]декановый каркас,который может быть получен в соответствии со схемой 8. В соответствии с различными способамиChem. Lett. 8: 1851 (1998, защищенный 4-пиперидон может быть превращен олефинированием по Wittig в 4-пиперидинилиденовый эфир уксусной кислоты. Последующее присоединение аниона нитрометана поMichael, сопровождающееся восстановлением нитрогруппы и спонтанной циклизацией на никеле Ренея,приводит к образованию защищенного 2,8-диазаспиро[4,5]декан-3-она. Взаимодействие защищенного 2,8-диазаспиро[4,5]декан-3-она с восстанавливающим агентом, таким как литийалюминийгидрид, с последующим удалением защитной группы приводит к образованию 2,8 диазаспиро[4,5]декана. Арилирование по любому атому азота может проводиться описанным способом. Схема 8 Соединения формулы 1, в которой u=2, v=1, w=4 и х=0, содержат 1,8-диазаспиро[5,5]декановую основу и могут быть получены в соответствии со способами, используемыми для аналогичных 1,7-диазаспиро[4,4]нонанов в результате замены пролинового эфира на пипеколинат. Также может использоваться способ, описанный Zhu et al., J. Org. Chem. 58: 6451 (1993). Соединения формулы 1, в которой u=3, v=1, w=1, a x=3, имеют симметричный 2,8-диазаспиро[5,5] ундекановый каркас и могут быть получены в соответствии со способами, описанными в Helv. Chim.Acta 36: 1815 (1953), J. Org. Chem. 28: 336 (1963) или предпочтительно Culbertson et al., J. Med. Chem. 33: 2270 (1990). Соединения формулы 1, в которой u=v=2, а w=x=2, имеют симметричный 3,9-диазаспиро[5,5]ундекановый каркас и могут быть получены в соответствии со способами, описанными Rice et al., J. Het.Chem. 1: 125 (1964), патенте США 3282947 или J. Med. Chem. 8: 62 (1965). Отдельные энантиомерные соединения настоящего изобретения могут быть получены различными способами. Один из таких способов, хорошо известный специалисту в области органического синтеза,заключается в расщеплении с использованием диастереомерных солей. Соединения настоящего изобретения содержат основные азотные атомы и способны взаимодействовать с кислотами с образованием кристаллических солей. Различные кислоты, карбоновые и серные, коммерчески доступны в энантиомерно чистой форме. Примерами таких кислот могут служить винная, дибензоил- и ди-п-толуоилвинная и камфарасульфокислоты. При взаимодействии любой из указанных или других отдельных энантиомерных кислот с рацемическим аминовым основанием образуются диастереомерные соли. В результате фракционной кристаллизации таких солей и последующей регенерации оснований происходит их энантиомерное расщепление. Другие методы разделения включают преобразование энантиомерной смеси в диастереомерные амиды и карбаматы с использованием хиральной кислоты или хлорформиата. Так, например, при сочетании рацемического 7-(3-пиридил)-1,7-диазаспиро[4,4]нонана с N-(трет-бутоксикарбонил)-S-пролином,осуществляемого с помощью дифенилхлорфосфата и с последующим удалением защитных групп (с использованием трифторуксусной кислоты), образующиеся диастереомерные пролиновые амиды 7-(3 пиридил)-1,7-диазаспиро[4,4]нонана могут быть разделены методом жидкостной хроматографии. Выделенные амиды далее трансформируют в (+) и (-) 7-(3-пиридил)-1,7-диазаспиро[4,4]нонан с помощью деградации Эдмана (Edman). Селективные синтезы индивидуальных энантиомеров также могут быть осуществлены способами,известными специалисту в данной области. Такие способы могут меняться при изменении химии конструирования диазаспироциклов. Так, например, в случае синтеза, в котором алкилирование пролинового производного используют для образования диазаспиросистемы (например, как описано для 1,7-диазаспиро[4,4]нонановой системы), алкилирование пролина может осуществляться стереоспецифически. Таким образом, такие способы, как те, что описаны Beck et al., Org. Synth. 72: 62 (1993) или Wang и Germanas,Synlett.: 33 (1999), могут использоваться для регулирования стереохимии стадии алкилирования. В том случае, когда энантиомерно чистый пролиновый эфир (коммерчески доступный от Aldrich) используют в качестве исходного материала для такой реакции, продукт алкилирования также представляет собой индивидуальный энантиомер. В таких реакциях алкилирования могут использоваться разнообразные электрофилы, включающие аллилгалогениды, которые применялись для сборки спиросистем, имеющих отношение к соединениям настоящего изобретения, см., например, Genin и Johnson, J. Amer. Chem. Soc. 114: 8778 (1992).- 12009789 Дополнительные синтетические методы Рассматриваемые соединения могут быть получены разнообразными способами. Могут использоваться альтернативные способы описанной выше реакции сочетания, катализируемой палладием. Так,например, специалисту в данной области органического синтеза понятно, что одно или несколько азосодержащих колец может образовываться с использованием любого из множества традиционных синтезов аминов. Так, например, ариламин способен взаимодействовать с производным защищенного циклического амина (см. схему 12), содержащим два реакционоспособных электрофила, с образованием Nарилдиазаспиросоединения. В таких химических превращениях могут принимать участие множество электрофилов (например, галогениды и сульфонаты в реакции нуклеофильного замещения, альдегиды в реакции восстановительного аминирования, сложные эфиры и другие производные кислот в реакции замещения ацила с последующим восстановлением). Схема 12E=CH2Z (где Z=X или сульфонат), CHO, CO2R. Необходимые для реакции бис-электрофилы могут быть синтезированы разнообразными способами. Схемы 2, 3 и 6 включают использование таких интермедиатов (на примере реакций с бензиламином или аммонием). Pedersen, et al., J. Org. Chem. 58: 6966 (1993), а также Berkowitz, et al., J. Org. Chem. 60: 1233 (1995) описывают алкилирование дианионов N-ацил -аминоэфиров. Такие же реакции алкилирования могут использоваться для синтеза N-арилдиазаспиро-соединений. Так, например, дианион коммерчески доступного (Acros) этил 2-пирролидон-5-карбоксилата может алкилироваться этилбромоацетатом с образованием этил 5-(карбоэтоксиметил)-2-пирролидон-5-карбоксилата. Второе спиро-кольцо может формироваться по реакции этил 5-(карбоэтоксиметил)-2-пирролидон-5-карбоксилата с ариламином. Полученный в результате 2-арил-2,6-диазаспиро[4,4]нонан-1,3,7-трион может восстанавливаться дибораном с образованием 7-арил-1,7-диазаспиро[4,4]нонана. Последовательность стадий синтеза может меняться в зависимости от природы арильной группы. Аналогичным образом, конкретные способы требуют использования стадий введения/удаления защитных групп. В реакциях, изображенных на схеме 12, может использоваться большое число ариламинов. Помимо аминопиридинов и аминопиримидинов, 3-аминоизоксазол является коммерчески доступным продуктом(Aldrich). Ha его основе могут быть синтезированы N-изоксазолилдиазаспиро соединения. Изомерный 4 аминоизоксазол может быть получен восстановлением соответствующего нитросоединения по способу,описанному Reiter, J. Org. Chem. 52: 2714 (1987). Примеры других аминопроизводных 5-членных ароматических циклов включают 3-аминоизотиазол, полученный согласно Holland, et al., J. Chem. Soc., 7277(1965), и 4-аминоизотиазол, полученный по методу Avalos, et al., An. Quim. 72: 922 (1976). Таким образом, могут быть получены разнообразные N-арилдиазаспиро-соединения настоящего изобретения, в которых арильная группа представляет собой 5-членнный гетероцикл.III. Фармацевтические композиции. Описанные в тексте соединения могут вводиться в фармацевтические композиции и использоваться для профилактики болезненных состояний или нарушений у пациента, подверженного таким состояниям или нарушениям, и/или лечения пациента, страдающего указанными состояниями или заболеваниями. Описанные в тексте фармацевтические композиции включают одно или более соединений формулы 1 и/или их фармацевтически приемлемые соли. Оптически активные соединения могут использоваться в виде рацемических смесей или индивидуальных энантиомеров. Могут использоваться различные способы применения рассматриваемых соединений. Композиции предпочтительно применяют перорально (например, в жидкой форме в среде растворителя, такого как водная или неводная жидкость, или в среде твердого носителя). Предпочтительные композиции для перорального применения включают пилюли, таблетки, капсулы, каплеты, сиропы и растворы, включая жесткие желатиновые капсулы и капсулы пролонгированного действия. Композиции могут формироваться в виде стандартных дозировочных форм или в виде многократных или мелких дозировочных форм. Предпочтительные композиции находятся в жидкой или полужидкой форме. Могут использоваться композиции, включающие жидкий фармацевтически инертный носитель, такой как вода или другие фармацевтически приемлемые жидкости или полутвердые вещества. Специалистам в данной области хорошо известно использование таких жидкостей или полутвердых материалов. Рассматриваемые композиции могут вводиться в виде инъекций, например, внутривенно, внутримышечно, подкожно, внутрибрюшинно, внутриартериально, внутритрахейно и внутрицеребровентрику- 13009789 лярно. Предпочтительным способом применения является внутривенное введение. Подходящие носители для инъекций хорошо известны специалистам, и они включают 5% растворы декстрозы, физиологический раствор и фосфатный забуференный рассол. Рассматриваемые соединения также могут применяться в виде вливаний и инъекций (например, в виде суспензии или эмульсии в фармацевтически применимой жидкости или смеси жидкостей). Рецептуры также могут вводиться другими способами, например применяться ректально. Рецептуры для ректального применения, такие как свечи, хорошо известны специалистам в данной области. Соединения также могут применяться путем ингаляции (например, в виде аэрозоля, назально или с использованием распределительных устройств, описанных в патенте США 4922901, Brooks et al., причем на содержание этого документа полностью ссылаются в настоящем описании); местным путем (например, в виде лосьона); или трансдермально (например, с использованием трансдермального пластыря, применяя технологию, которая разработана Novartis and Alza Corporation). Хотя возможно применение рассматриваемого соединения в виде нерасфасованного химического вещества, предпочтительно, чтобы каждое соединение находилось в виде фармацевтической композиции или рецептуры с целью эффективного и действенного применения. Типичные способы введения таких соединений известны опытным специалистам. Полноценность рассматриваемых рецептур может зависеть от природы используемой композиции и состояния пациента,получающего лечение. Такие рецептуры могут содержать жидкий носитель, который может быть маслянистым, водным, эмульгируемым материалом или содержать некоторые растворители, подходящие для конкретного типа применения. Композиции могут вводиться теплокровному животному периодически, постепенно, непрерывно с постоянной или регулируемой скоростью (причем в качестве животных могут использоваться такие млекопитающие, как мыши, крысы, кошки, кролики, собаки, свиньи или обезьяны), но предпочтительно применять эти вещества на людях. Может также меняться время приема фармацевтической рецептуры и число ее приемов в день. Предпочтительно в ходе применения активные ингредиенты взаимодействуют с рецепторными сайтами внутри организма пациента, что оказывает влияние на функционирование ЦНС. При лечении нарушений ЦНС предпочтительное применение предназначается для оптимизации эффекта на те релевантные рецепторные подтипы, которые оказывают влияние на функционирование ЦНС, при этом минимизируя влияние на подтипы рецепторов мышечного типа. Другие подходящие способы применения соединений настоящего изобретения описаны Smith et al. в патенте США 5604231. Предпочтительно композиции применяют таким образом, чтобы активные ингредиенты взаимодействовали с участками, на которых происходит продукция цитокинов или на нее оказывается влияние. Описанные в настоящем документе соединения являются очень мощными веществами в плане лечения указанных состояний и нарушений (т.е. они оказывают влияние на продукцию и/или секрецию цитокинов в очень малых концентрациях) и обладают высокой эффективностью (т.е. они ингибируют продукцию и/или секрецию цитокинов в относительно высокой степени). В некоторых случаях описанные в документе соединения могут использоваться в качестве части фармацевтической композиции совместно с другими соединениями, предназначенными для профилактики или лечения конкретного заболевания. Помимо эффективных количеств описанных соединений фармацевтические композиции также могут содержать различные другие компоненты в виде присадок и вспомогательных средств. Примеры фармацевтически применимых компонентов или вспомогательных средств, которые могут использоваться в определенных обстоятельствах, включают антиоксиданты, акцепторы свободных радикалов, пептиды, факторы роста, антибиотики, бактериостаты, иммуносупрессоры, антикоагулянты, буферные агенты, противовоспалительные агенты, антипиретики, пролонгаторы,обезболивающие препараты, стероиды, витамины, минарелы и кортикостероиды. Такие компоненты могут обеспечивать дополнительное терапевтическое действие, оказывая эффект на терапевтическое действие фармацевтической композиции или препятствуя проявлению возможных побочных эффектов, которые могут сопутствовать применению фармацевтической композиции. Соответствующая доза соединения представляет собой количество, эффективное для предотвращения появления симптомов заболевания или лечения некоторых симптомов заболевания, которыми страдает пациент. Термины эффективное количество, терапевтическое количество или эффективная доза относятся к количеству, которое в достаточной степени проявляет желаемые фармакологические или терапевтические эффекты и в результате осуществляет эффективную профилактику или лечение заболевания. При лечении болезней ЦНС эффективное количество соединения представляет собой количество,достаточное для прохождения гематоэнцефалического барьера пациента с целью связывания с соответствующими рецепторными участками в мозге пациента и активации соответствующих никотиновых рецепторных подтипов (например, обеспечивая секрецию нейтротрансмиттера и приводя к эффекттвной профилактике или лечению заболевания). Профилактика заболевания проявляется в замедлении проявления начала симптомов болезни. Лечение заболевания проявляется в уменьшении болезненных симптомов, рецидивов симптомов заболевания. Предпочтительно, чтобы эффективное количество было дос- 14009789 таточным для обеспечения желаемого результата, но недостаточным для возникновения заметных побочных эффектов. Эффективная доза может изменяться в зависимости от таких факторов, как состояние пациента, тяжесть симптомов заболевания и способ применения фармацевтической композиции. При применении на людях эффективная доза типичных соединений обычно предусматривает применение соединения в количестве, достаточном для активации соответствующих рецепторов, ответственных за выделение нейтротрансмиттера (например, допамина), и в то же время это количество должно быть недостаточным для значительной индукции воздействия на скелетные мышцы и ганглии. Эффективная доза соединений может изменяться при переходе от пациента к пациенту, но в общем случае она включает количества, начиная с тех, что обеспечивают воздействие на ЦНС или другие желаемые терапевтические эффекты, но ниже тех, при которых наблюдаются мышечные эффекты. Соединения при их использовании в эффективных количествах в соответствии со способом настоящего изобретения обладают селективностью в отношении некоторых релевантных никотиновых рецепторов, но при этом они в значительной степени не активируют рецепторы, связные с нежелательными побочными эффектами, при концентрациях, по меньшей мере, более высоких, чем те, что требуются для выделения допамина или других нейротрансмиттеров. Сказанное означает, что конкретная доза соединения, эффективная для профилактики и/или лечения болезней ЦНС, по существу, не эффективна для активации некоторых никотиновых рецепторов ганглиозного типа при концентрации более высокой в 5 раз,предпочтительно более чем в 100 раз и более предпочтительно более чем в 1000 раз, чем концентрация,требующаяся для активации выделения допамина. Такая селективность некоторых соединений, описанных в настоящем документе, в отношении рецепторов ганглиозного типа, ответственных за сердечнососудистые побочные эффекты, демонстрируется отсутствием способности рассматриваемых соединений к активации никотиновой функции надпочечной хромаффиновой ткани при концентрациях более высоких, чем те, что требуются для активации выделения допамина. При применении на пациенте эффективная доза типичных соединений обычно требует введения соединения в количестве по меньшей мере 1, часто по меньшей мере 10 и, как правило, по меньшей мере 25 мкг/ 24 ч/пациент. Эффективная доза обычно не превышает 500, часто 400 и, как правило, 300 мкг/24 ч/пациент. Кроме этого, применение эффективной дозы проводят таким образом, что концентрация соединения в плазме пациента обычно не превышает 500 нг/мл и часто не превышает 100 нг/мл. Использование эффективных количеств описанных в документе соединений в соответствии со способом настоящего изобретения в некоторой степени может предупреждать развитие нарушений ЦНС,облегчать симптомы заболеваний ЦНС и, в некоторый степени, уменьшать интенсивность рецидивов заболеваний ЦНС. Эффективные количества рассматриваемых соединений обычно ниже пороговой концентрации, требующейся для проявления заметных побочных эффектов, например эффектов, имеющих отношение к скелетным мышцам. Соединения могут применяться в терапевтическом окне, в котором осуществляется лечение некоторых заболеваний центральной нервной системы и не проявляются некоторые побочные эффекты. В идеальном случае, эффективная доза описанных в тексте соединений достаточна для оказания желательного воздействия на ЦНС, но недостаточна (т.е. не слишком высока) для оказания нежелательных побочных эффектов. Предпочтительная дозировка соединения эффективна для лечения заболеваний ЦНС, но она составляет менее 1/5, часто менее 1/10, от количества, требующегося для заметного проявления некоторых побочных эффектов. Наиболее предпочтительные эффективные дозы включают очень низкие концентрации соединения,при которых наблюдаются максимальные лечебные эффекты и минимальные побочные эффекты. Концентрации, определяемые отношением количества соединения к объему релевантной ткани, обычно служат оценкой степени воздействия соединения на продукцию цитокинов. Обычно эффективная доза таких соединений требует применения соединения в количестве менее 5 мг/кг массы пациента. Часто соединения настоящего изобретения вводят в количестве менее 1 мг/кг массы пациента, обычно в количестве менее 100 мкг/кг массы пациента, как правило, соединение вводят в количестве от 10 мкг до менее 100 мкг/кг массы пациента. В тех случаях, когда низкие концентрации соединений не влияют на никотиновые рецепторы мышечного типа, эффективная доза составляет менее 5 мг/кг массы пациента; часто такие соединения вводят в количестве от 50 мкг до менее 5 мг/кг массы пациента. Указанные выше эффективные дозы предусматривают, что количество применяется в виде однократной дозы или в виде одной или нескольких доз, применяемых за 24-часовой период времени. При лечении людей эффективная доза типичных соединений обычно требует применения соединения в количестве по меньшей мере 8, часто по меньшей мере 10 и наиболее часто по меньшей мере 25 мкг/24 ч/пациент. При лечении людей эффективная доза типичных соединений обычно требует применения активного соединения в количестве не превышающем 500, обычно 400 и часто 300 мкг/24 ч/пациент. Кроме этого, рассматриваемые композиции успешно применяют с эффективной дозой, при которой концентрация соединения в плазме пациента обычно не превышает 500 пг/мл, как правило, 300 пг/мл и часто не превышает 100 пг/мл. Такой способ применения является дозазависимым и обеспечивает ингибирование- 15009789 продукции и/или секреции цитокинов при применении низких концентраций, однако, такие ингибирующие эффекты не проявляются при более высоких концентрациях. Рассматриваемые соединения проявляют ингибирующие эффекты на продукцию и/или секрецию цитокинов при использовании в количествах, меньших тех, что необходимы для заметной активации субтипов релевантных никотиновых рецепторов.IV. Способы применения соединений и/или фармацевтических композиций. Рассматриваемые соединения могут использоваться для лечения тех типов болезненных состояний и нарушений, для которых в качестве терапевтических средств предложены другие типы никотиновых производных. См., например, Williams et al., Drug News Perspec. 7 (4): 205 (1994), Arneric et al., CNS Drug(1997), Bannon et al., Science 279: 77 (1998), PCT WO 94/08992, PCT WO 96/31475, а также в патентах США 5583140, Bencherif et al., 5597919, Dull et al., и 5604231, Smith et al., причем на полное содержание цитированных работ ссылаются в настоящем описании. Соединения могут использоваться в качестве дополнительной терапии в комбинации с существующими методами лечения упомянутых выше заболеваний и нарушений. В таких случаях предпочтительно применять активные ингредиенты таким способом, который оптимизирует эффекты, касающиеся аномальной продукции цитокинов, минимизируя при этом влияние на субтипы рецепторов, которые связаны с мышцами и ганглием. Желаемый результат может достигаться методами направленной терапии и/или такой регуляцией дозировки, при которой желаемый эффект достигается без использования пороговой дозы, ответственной за проявление заметных побочных эффектов. Лечение нарушений центральной нервной системы (ЦНС) Описанные выше соединения являются эффективными средствами лечения разнообразных нарушений ЦНС. Примеры заболеваний ЦНС, которые могут лечиться в соответствии с настоящим изобретением, включают пресенильное слабоумие (раннее развитие болезни Альцгеймера), старческое слабоумие(деменция типа Альцгеймера), деменцию Lewy Body, деменцию связанную со СПИДОМ, множественные церебральные инфаркты, дрожательный паралич, включающий болезнь Паркинсона, болезнь Пика,хорею Хантигтона (Huntington), позднюю дискенизию, гиперкинез, манию, нарушения, связанные с дефицитом внимания, беспокойство, депрессию, недостаточность познавательной способности, дислексию,шизофрению и синдром Тиретта. Болезни ЦНС могут лечиться и/или предотвращаться введением пациенту количества соединения или фармацевтической композиции, которое является эффективным для обеспечения определенной профилактики развития болезни ЦНС (т.е. в этом случае обеспечивается защитный эффект), ослабляет симптомы нарушений ЦНС и ослабляет интенсивность рецидива заболевания ЦНС. Способ настоящего изобретения заключается в применении эффективного количества соединения, выбранного из указанных выше общих формул. Другие заболевания Помимо лечения заболеваний ЦНС фармацевтические композиции могут использоваться для профилактики или лечения других болезненных состояний, заболеваний и нарушений. Примерами могут служить нейродегенеративные заболевания, такие аутоиммунные болезни, как Lupus, нарушения, связанные с секрецией цитокинов, противовоспалительные применения, а также предписания, содержащиеся в PCT WO 98/25619. Фармацевтические композиции могут ослаблять многие симптомы, связанные с перечисленными состояниями, заболеваниями и нарушениями. Ингибирование секреции цитокинов желательно для лечения кахексии, воспаления, нейродегенеравтивных заболеваний, вирусных инфекций и неоплазии. Кахексия часто является вторичным заболеванием при инфекции (например, как в случае со СПИДом, СПИД-связанным комплексом и неоплазией) или раковой терапии. Примеры воспалительных заболеваний, подлежащие лечению, включают острый холангит, афтозный стоматит, астму, язвенный колит, воспаление желудка, поухит, вирусную пневмонию и артрит (например, ревматоидный артрит и остеоартрит). Фармацевтические композиции также могут использоваться в качестве противоинфекционных агентов (например, средств для уничтожения бактерий, грибков и вирусных инфекций, а также таких эффектов, как сепсис или другие токсины). Соединения могут использоваться в качестве анальгетиков для лечения конвульсий, симптоматичных эпилепсии, лечения таких состояний, как сифилис и болезнь Creutzfeld-Jakob. Рассматриваемые соединения также могут соответствующим образом синтезироваться и использоваться в качестве фармацевтических композиций или внутри них, которые применяют в качестве диагностических зондов. Соединения, синтезируемые способом настоящего изобретения, обладают способностью связываться и в большинстве случае вызывать активацию никотиновых холинергических рецепторов в мозге пациента (например, с теми рецепторами, которые модулируют секрецию допамина). Такие соединения обла- 16009789 дают способностью экспрессировать никотиновую фармакологию, и в особенности проявлять свойства никотиновых агонистов. Константы связывания рецепторов типичных соединений, используемых при осуществлении настоящего изобретения, обычно имеют значение выше 0,1 нМ, как правило, 1 нМ и часто выше 10 нМ. Константы связывания рецепторов соединений такого типа обычно имеют значения менее 1 мкМ, как правило, менее 100 нМ и часто менее 50 нМ. Константы связывания рецепторов характеризуют способность соединения связывать половину сайтов релевантных рецепторов некоторых мозговых клеток пациента. См. Cheng, et al., Biochem. Pharmacol. 22: 3099 (1973). Соединения, используемые в способе настоящего изобретения, способны демонстрировать никотиновую функцию, эффективно стимулируя ионный поток через и/или секрецию нейротрансмиттера из нервных окончаний препаратов (например, синаптосомы таламуса или стриаты). По существу, рассматриваемые соединения способны активировать релевантные нейроны и выделять или секретировать ацетилхолин, допамин или другие нейротрансмиттеры. Обычно типичные соединения, используемые для осуществления настоящего изобретения, эффективно обеспечивают активацию релевантных рецепторов в количествах по меньшей мере 30%, как правило, по меньшей мере 50% и часто по меньшей мере 75%, от максимального количества,обеспечиваемого (S)-(-)-никотином. Как правило, типичные соединения, используемые при осуществлении настоящего изобретения, являются более мощными веществами в выявлении активации соответствующих рецепторов, чем (S)-(-)-никотин. Обычно типичные соединения, используемые для осуществления настоящего изобретения, эффективно обеспечивают секрецию допамина в количествах по меньшей мере 50%, как правило, по меньшей мере 75% и часто по меньшей мере около 100%, от максимального количества, обеспечиваемого (S)-(-)-никотином. Некоторые соединения настоящего изобретения обеспечивают секрецию допамина в количествах, превышающих те, что максимально продуцируются (S)-(-)никотином. Как правило, типичные соединения, используемые для осуществления настоящего изобретения, уступают (S)-(-)-никотину по мощности секреции нейротрансмиттера, например допамина. Соединения настоящего изобретения при использовании в эффективных количествах согласно способу настоящего изобретения теряют способность в значительной активации никотиновых рецепторов человеческой мышцы. В этом отношении, соединения настоящего изобретения демонстрирует плохую способность в создании потока ионов изотопного рубидия через никотиновые рецепторы в клеточных препаратах, экспрессирующих никотиновые ацетилхолиновые рецепторы мышечного типа. Таким образом, рассматриваемые соединения демонстрируют константы активации рецептора или значения EC50(т.е. параметры, характеризующие концентрацию соединения, необходимую для активации половины релевантных рецепторных участков скелетной мышцы пациента), имеющие очень высокие значения (например, более 100 мкМ). Обычно типичные предпочтительные соединения, используемые для осуществления настоящего изобретения, активируют поток ионов изотопного рубидия менее чем на 10%, часто менее чем на 5%, от максимального количества, обеспечиваемого S-(-)-никотином. Соединения настоящего изобретения, используемые в эффективных количествах в соответствии со способом настоящего изобретения, обладают селективностью в отношении соответствующих никотиновых рецепторов, но не обеспечивают значительную активацию рецепторов, связанных с нежелательными побочными эффектами. Это значит, что конкретная доза соединения, обеспечивающая профилактику и/или лечение болезни ЦНС, по существу, неэффективна в проявлении активации некоторых никотиновых рецепторов ганглиозного типа. Такая селективность соединений настоящего изобретения относительно рецепторов, ответственных за сердечно-сосудистые побочные эффекты, демонстрируется недостаточной способностью указанных соединений активировать никотиновую функцию хромафиновой ткани надпочечника. Таким образом, рассматриваемые соединения обладают плохой способностью к стимуляции потока ионов изотопного рубидия через никотиновые рецепторы в клеточных препаратах, являющихся производными надпочечника. Обычно типичные предпочтительные соединения, используемые для осуществления настоящего изобретения, активируют поток ионов изотопного рубидия менее чем на 10%, часто менее чем на 5%, от максимального количества, обеспечиваемого S-(-)-никотином. При использовании в эффективных количествах по способу настоящего изобретения соединения изобретения обладают некоторой эффективностью в профилактике развития болезней ЦНС, ослаблении симптомов болезней ЦНС и некотором уменьшении интенсивности рецидива заболевания ЦНС. Однако эти эффективные количества рассматриваемых соединений недостаточны для проявления заметных побочных эффектов, как это продемонстрировано пониженными эффектами на препаратах, имитирующих влияние на сердечно-сосудистую систему, или влиянием на скелетные мышцы. Таким образом, применение соединений настоящего изобретения обеспечивает терапевтическое окно, в котором осуществляется лечение некоторых заболеваний центральной нервной системы и исключается проявление некоторых побочных эффектов. Другими словами, эффективная доза описанных в тексте соединений достаточна для оказания желательного воздействия на ЦНС, но недостаточна (т.е. не слишком высока) для оказания нежелательных побочных эффектов. Предпочтительно эффективное применение соединения настоящего изобретения, завершающееся лечением заболевания ЦНС, происходит при введении менее 1/3,часто менее 1/5 и очень часто менее 1/10, количества, достаточного для проявления в значительной степени каких-либо побочных эффектов. Следующие ниже примеры приведены для иллюстрации настоящего изобретения и не ограничива- 17009789 ют его область. В этих примерах, если не оговорено особо, то все части и проценты приведены в массовом выражении. Выходы реакции представлены в мольных процентах. В следующих ниже примерах используют некоторые коммерчески доступные материалы. 3-Бромпиридин, 3,5-дибромпиридин, 5-бромникотиновую кислоту, 5-бромпиримидин и 4-пентен-2-ол приобретали у Aldrich Chemical Company илиAldrich Chemical Company. Колоночную хроматографию проводили с использованием Merck силикагеля 60 (70-230 меш) или оксида алюминия (активированный, нейтральный, Brockmann I, стандартный сорт,размер около 150 меш). Реакции под давлением приводили в толстостенной стеклянной трубке (емкость 185 мл), снабженной резьбой Ace-Thread и плунжерным клапаном от Асе Glass Inc. Реакционные смеси обычно нагревали с использованием бани с высокотемпературным силиконом, и указанные температуры относятся к температуре масляной бани. В следующих ниже примерах используются следующие сокращения: CHCl3 относится к хлороформу, CH2Cl2 относится к дихлорметану, СН 3 ОН относится к метанолу,DMF обозначает N,N-диметилформамид, и EtOAc относится к этилацетату, THF - к тетрагидрофурану иV. Анализы. Анализ на связывание Способность соединений к связыванию релевантных рецепторных участков определяли в соответствие с методикой, описанной в патенте США 5597919 to Dull et al. Константы ингибирования (Ki значения) рассчитывали из значения IC50 по способу Cheng et al., Biochem. Pharmacol. 22: 3099 (1973). Для субтипа 42 значение Ki для каждого примера заявки составляло менее 1 мкМ, что указывает на прочное связывание соединений настоящего изобретения с рецептором. Определение величины Log P Значения Log P, используемые для оценки относительной способности соединений проходить через гематоэнцефалический барьер (Hansch, et al., J. Med. Chem. 11: 1 (1968, рассчитывали с использованием программного пакета Cerius2 Version 3.5 от Molecular Simulations, Inc. Определение секреции допамина Секрецию допамина измеряли с использованием методики, описанной в патенте США 5597919, выданном Dull et al. Секрецию выражали в виде процента выделения, достигнутого при концентрации (S)-(-)никотина, обеспечивающей максимальный эффект. Представленные значения ЕС 50 выражали в нМ, а значение Emax представляет собой выделенное количество в процентах относительно S)-(-)-никотина. Определение выделения ионов рубидия Выделение рубидия измеряли по методике, описанной Bencherif et al., JPET 279: 1413-1421 (1996). Приведенные значения EC50 выражали в нМ, а значения Emax представляют собой выраженное в процентах выделившееся количество ионов рубидия относительно 300 мкМ ионов тетраметиламмония. Определение взаимодействия с мышечными рецепторами Определение взаимодействия соединений с мышечными рецепторами проводили по методике, описанной Dull et al. в патенте США 5597919. Максимальную активацию индивидуальными соединениями (Emax) определяли в виде процента от максимальной активации, индуцированной (S)-(-)-никотином. Приведенные значения Emax в виде процентов представляют собой выделенное количество относительно(S)-(-)-никотина. Определение взаимодействия с ганглиозными рецепторами Определение взаимодействия соединений с ганглиозными рецепторами проводили по методике,описанной Dull et al. в патенте США 5597919. Максимальную активацию индивидуальными соединениями (Emax) определяли в виде процента от максимальной активации, индуцированной (S)-(-)никотином. Приведенные значения Emax в виде процентов представляют собой выделенное количество относительно (S)-(-)-никотина. Селективность Селективность соединений в отношении конкретного рецептора может быть оценена сравнением связывания рассматриваемых соединений с различными рецепторами с использованием известного способа.VI. Синтетические примеры. Следующие ниже синтетические примеры приведены исключительно в целях иллюстрации и не ограничивают область изобретения. В этих примерах, если не оговорено особо, все части и проценты даны в массовом выражении. Выходы реакции приведены в мольных процентах. Пример 1. Образец 1 представляет собой дигидрохлорид 7-(3-пиридил)-1,7-диазаспиро[4,4]нонана, полученный следующим методом. Нитроэтилен. Нитроэтилен получали по методике, описанной Ranganathan, et al., J. Org. Chem. 45: 1185 (1980). Этил 2-(2-нитроэтил)-1-бензилпирролидин-2-карбоксилат. В атмосфере азота раствор диизопропиламина (4,34 г, 6,01 мл, 42,9 ммоль) в сухом ТГФ (50 мл)- 18009789 охлаждали на бане со льдом, добавляя при этом с помощью шприца н-бутилитий (17,1 мл 2,5M раствора в гексане, 42,8 ммоль). Ледяную баню удаляли и раствор дизопропиламида лития вначале нагревали до комнатной температуры и затем переносили с помощью канюли в перемешиваемый раствор этил (S)-Nбензил пирролидин-2-карбоксилата (10,0 г, 42,9 ммоль) (Fluka) в сухом ТГФ (50 мл), выдерживая при-78 С в среде жидкого азота. Операция добавления занимала 10 мин. После дополнительного перемешивания в течение 30 мин при -78 С енолятный раствор обрабатывали (через канюлю) раствором нитроэтилена (3,13 г, 42,9 ммоль) в сухом ТГФ (20 мл). После этого смесь перемешивали в течение 1 ч при -78 С. Затем добавляли насыщенный водный раствор хлористого аммония (при -78 С) и полученную смесь нагревали до комнатной температуры и экстрагировали этилацетатом (4 х 30 мл). Экстракты сушили(K2CO3) и концентрировали на роторном испарителе. Остаток очищали методом хроматографии на колонке с силикагелем Merck 60 (70-230 меш), используя в качестве элюента смесь гексан/этилацетат в соотношении 9:1 (об./об.). Концентрирование выбранных фракций давало 10,0 г (76,3%) вязкого коричневого масла. 6-Бензил-2,6-диазаспиро[4,4]нонан-1-он. В раствор этил 2-(2-нитроэтил)-1-бензилпирролидин-2-карбоксилата (6,00 г, 19,6 ммоль) в абсолютном этаноле в сосуде для гидрирования добавляли никель Ренея ( 2 г). Смесь встряхивали в течение 12 ч в атмосфере водорода (50 фунт/дюйм 2) на аппарате Парра, фильтровали через слой Целита и концентрировали на роторном испарителе. Согласно данным GCMC (масспектрометрическая газовая хроматография), было показано, что продукт гидрирования представляет собой смесь первичного амина и лактама, образующегося в результате циклизации амина в сложный эфир. Полученную смесь растворяли в толуоле (150 мл). Добавляли каталитическое количество п-толуолсульфокислоты ( 30 мг) и смесь нагревали с обратным холодильником в атмосфере азота в течение 24 ч. После выпаривания толуола остаток (теперь представляющий чистый лактам, согласно данным GCMC) кристаллизовался с получением 4,20 г (93,1%) коричневого твердого материала (т.пл. 152-153 С). 1-Бензил-1,7-диазаспиро[4,4]нонан. Литийалюминийгидрид (1,98 г, 52,2 ммоль) добавляли порциями в атмосфере аргона к охлаждемому на бане со льдом раствору 6-бензил-2,6-диазаспиро[4,4]нонан-1-она (4,00 г, 17,4 ммоль) в сухом ТГФ(100 мл). Капельную воронку заменяли обратным холодильником и смесь нагревали в условиях дефлегмации в течение 24 ч. Смесь охлаждали до 0 С и по каплям обрабатывали (предостережение: экзотермическая реакция) 10M водный раствор гидроксида натрия до тех пор, пока не прекратится выделение водорода и соли алюминия не станут гранулами. Затем смесь перемешивали в течение 1 ч при 0 С и фильтровали через целит. Фильтрат сушили (K2CO3) и концентрировали, получая в остатке 3,60 г (95,7%) вязкой бесцветной жидкости. 1-Бензил-7-(3-пиридил)-1,7-диазаспиро[4,4]нонан. Смесь 1-бензил-1,7-диазаспиро[4,4]нонана (2,00 г, 9,26 ммоль), 3-бромопиридина (1,38 г, 8,73 ммоль),трет-бутилата калия (2,50 г, 22,3 ммоль), трис(дибензилиденацетон)дипалладия(0) (0,318 г, 0,347 ммоль),2,2'-бис-(дифенилфосфино)-1,1'-бинафтила (0,324 г, 0,520 ммоль) и сухого толуола (50 мл) помещали в трубку для работы под давлением в атмосфере аргона. Смесь перемешивали и нагревали при 90 С (температура бани) в течение 24 ч и охлаждали. Добавляли воду (20 мл) и полученную смесь экстрагировали этилацетатом (6 х 25 мл). Экстракты сушили (K2CO3) и концентрировали. Колоночная хроматография остатка на силикагеле Merck 60 (70-230 меш) с использованием хлороформ/ацетон в соотношении 6:4(об./об.), после концентрирования выбранных фракций давала 1,80 г (66,2%) светлого коричневого масла. Дигидрохлорид 7-(3-пиридил)-1,7-диазаспиро[4,4]нонана. Водный раствор соляной кислоты (0,5 мл 12 М раствора) и 10% палладия на угле (0,100 г) добавляли к раствору 1-бензил-7-(3-пиридил)-1,7-диазаспиро[4,4]нонана (1,0 г, 3,41 ммоль) в метаноле (30 мл). Смесь встряхивали в атмосфере водорода (50 фунт/дюйм 2) на аппарате Парра в течение 24 ч и фильтровали через целит. Фильтрат концентрировали на роторном испарителе и подвергали хроматографической очистке на колонке с силикагелем Merck 60 (70-230 меш). В результате элюирования водным раствором аммиака/метанолом/хлороформом в соотношении 0,01:1:19 (об./об.) и концентрирования выбранных фракций получали 0,650 г (93,8%) вязкого коричневого масла. Часть (300 мг, 1,48 ммоль) этого продукта обрабатывали водным раствором соляной кислоты (2 мл). Воду удаляли азеотропной отгонкой, периодически добавляя небольшие объемы (5 мл) этанола и используя роторное испарение. Полученное твердое вещество перекристаллизовывали из горячего изопропанола с получением 360 мг (88,2%) мелких коричневых кристаллов. Пример 2. Образец 2 представляет собой дигидрохлорид 1-(3-пиридил)-1,7-диазаспиро[4,4]нонана, который получен по следующей методике. трет-Бутил 6-бензил-2,6-диазаспиро [4,4]нонан-2-карбоксилат. Ди-трет-бутилдикарбонат (1,45 г, 6,64 ммоль) добавляли к раствору 1-бензил-1,7-диазаспиро[4,4] нонана (1,30 г, 6,01 ммоль) и триэтиламина (1 мл) в дихлорметане (25 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь выливали в насыщенный водный раствор бикарбоната натрия (10 мл) и экстрагировали хлороформом (4 х 25 мл). Экстракты сушили (K2CO3) и кон- 19009789 центрировали на роторном испарителе. Остаток подвергали колоночной хроматографии на силикагелеMerck 60 (70-230 меш), проводя элюирование и получая после концентрирования выбранных фракций 1,85 г (97,4%) вязкого бесцветного масла. трет-Бутил 2,6-диазаспиро[4,4]нонан 2-карбоксилат. Раствор трет-бутил 6-бензил-2,6-диазаспиро[4,4]нонан-2-карбоксилата (1,70 г, 5,37 ммоль) в метаноле (30 мл) смешивали с 10% палладия на угле (50 мг). Смесь встряхивали в атмосфере водорода(50 фунт/дюйм 2) на аппарате Парра в течение 8 ч и фильтровали через целит. Фильтрат концентрировали на роторном испарителе и подвергали обработке в высоком вакууме, получая остаток (1,26 г) в виде вязкого светло-коричневого масла (100%), который был достаточно чистым для использования в последующей реакции. трет-Бутил 6-(3-пиридил)-2,6-диазаспиро[4,4]нонан-2-карбоксилат. Смесь трет-бутил 2,6-диазаспиро[4,4]нонан-2-карбоксилата (1,00 г, 4,4 ммоль), 3-бромопиридина(25 мл) помещали в трубку для работы под давлением в атмосфере аргона. Смесь перемешивали и нагревали при 180 С (температура бани) в течение 8 ч и охлаждали. Согласно анализу методом тонкослойной хроматографии было показано, что конверсия имела чрезвычайно низкое значение. Вторую партию реагентов, взятых в тех же количествах, за исключением трет-бутил 2,6-диазаспиро[4,4]нонан-2-карбоксилата, помещали в трубку для работы под давлением, которую возвращали в баню еще на 8 ч. Реакция снова протекали лишь в незначительной степени, вследствие чего добавляли третью партию реагентов и нагревание (при 180 С) продолжали еще в течение 8 ч. Добавляли воду (20 мл) и смесь экстрагировали этилацетатом (6 х 25 мл). Экстракты сушили (K2CO3) и концентрировали. Остаток подвергали колоночной хроматографии на силикагеле Merck 60 (70-230 меш), проводя элюирование смесью хлороформ/ацетон в соотношении 6:4 (об./об.), получая после концентрации выбранных фракций 150 мг (11%) светло-коричневого масла. Дигидрохлорид 1-(3-пиридил)-1,7-диазаспиро[4,4]нонана. Раствор трет-бутил 6-(3-пиридил)-2,6-диазаспиро[4,4]нонан-2-карбоксилата (100 мг, 0,330 ммоль) в дихлорметане (5 мл) быстро перемешивали с 1 мл 12 М раствора хлористо-водородной кислоты при комнатной температуре в течение 1 ч, и в течение этого времени двухфазная смесь становилась однофазной. Дихлорметан выпаривали и остаток растворяли в воде (3 мл) и сильно подщелачивали (рН 9) карбонатом калия. Смесь насыщали хлористым натрием и экстрагировали хлороформом (4 х 10 мл). Экстракты сушили над K2CO3 и концентрировали, вначале на роторном испарителе и затем в высоком вакууме. В результате получали 50 мг (73%) вязкого коричневого масла, которое согласно анализу GCMS имело чистоту 98%. Образец такого свободного основания (40 мг, 0,20 ммоль) растворяли в 10 каплях 12 М раствора хлористо-водородной кислоты. Воду подвергали азеотропной отгонке, проводя периодическое добавление небольших объемов этанола (5 мл) и используя роторной испаритель. Полученное твердое вещество перекристаллизовывали из горячего изопропанола с получением 40 мг (72%) мелких коричневых кристаллов (т.пл. 170-175 С). Пример 3. Образец 3 представляет собой 1-метил-7-(3-пиридил)-1,7-диазаспиро[4,4]нонан, который получают по следующей методике. 1-Метил-7-(3-пиридил)-1,7-диазаспиро[4,4]нонан. 7-(3-Пиридил)-1,7-диазаспиро[4,4]нонан (30 мг, 0,15 ммоль) растворяли в 98% муравьиной кислоте(0,5 мл) и формальдегиде (1 мл, 28% водный раствор). Реакционную смесь нагревали с обратным холодильником в течение 8 ч. Смесь охлаждали до комнатной температуры, подщелачивали насыщенным водным раствором бикарбоната натрия до рН 9-10 и экстрагировали хлороформом (4 х 3 мл). Объединенные хлороформные экстракты сушили (K2CO3), фильтровали и концентрировали на роторном испарителе с получением 30 мг желаемого соединения (93,6%) в виде светло-коричневой жидкости. Пример 4. Образец 4 представляет собой 1-метил-7-(5-этокси-3-пиридил)-1,7-диазаспиро[4,4]нонан, который получали по следующей методике. 5-Бром-3-этоксипиридин. В атмосфере азота натрий (4,60 г, 200 ммоль) добавляли в абсолютированный этанол (100 мл) при 0-5 С и перемешиваемой смеси давали нагреваться до комнатной температуры в течение 18 ч. В полученный раствор добавляли 3,5-дибромпиридин (31,5 г, 133 ммоль), после чего добавляли ДМФ (100 мл). Смесь нагревали при 70 С в течение 48 ч. Коричневую смесь охлаждали, переливали в воду (600 мл) и экстрагировали эфиром (3 х 500 мл). Объединенные эфирные экстракты сушили (Na2SO4), фильтровали и концентрировали на роторном испарителе. В результате очистки вакуумной дистилляцией получали 22,85 г (85%) масла, т.к. 89-90 С при 2,8 мм Hg (литературное значение т.к. 111 С при 5 мм Hg, см. K.Clarke, et al., J. Chem. Soc. 1885 (1960. 1-Бензил-7-(5-этокси-3-пиридил)-1,7-диазаспиро[4,4]нонан. 1-Бензил-1,7-диазаспиро[4,4]нонан (500,0 мг, 2,4 ммоль) растворяли в сухом толуоле (15 мл), про- 20009789 водя растворение в 50 мл круглодонной колбе, снабженной магнитной мешалкой. Через раствор медленно барботировали азот. В перемешиваемый раствор добавляли 3-бром-5-этоксипиридин (513,8 мг,2,55 ммоль), трет-бутилат калия (1039,0 мг, 9,26 ммоль), rac-2,2'-бис-(дифенилфосфино)-1,1'-бинафтил(86,4 мг, 0,14 ммоль) и трис-(дибензилиденацетон)дипалладий(0) (63,6 мг, 0,06 ммоль), продолжая пропускать через раствор газообразный азот. Поток азота перекрывали, колбу закрывали и нагревали при 90 С в течение 8 ч. Реакционную смесь охлаждали и растворитель удаляли на роторном испарителе. Полученный остаток суспендировали в насыщенном водном растворе бикарбоната натрия (10 мл) и экстрагировали хлороформом (4 х 25 мл). Объединенные органические экстракты сушили (Na2SO4), фильтровали и концентрировали на роторном испарителе до образования густой темной массы. В результате очистки колоночной хроматографией, используя в качестве элюента смесь метанол/хлороформ (2:98 об./об.),получали 0,54 г желаемого соединения в виде светло-коричневой вязкой жидкости (69%). 7-(5-Этокси-3-пиридил)-1,7-диазаспиро[4,4]нонан. К раствору 1-бензил-7-(5-этокси-3-пиридил)-1,7-диазаспиро[4,4]нонана (540 мг, 1,6 ммоль) в этаноле (25 мл) в сосуде для работы под давлением добавляли концентрированную HCl (1 мл) и катализаторPearlman (Pd(OH)2, 20% на угле, 50 мг). Раствор встряхивали под давлением газообразного водорода 50 фунт/кв.дюйм в течение 8 ч. Катализатор удаляли фильтрацией через целит и осадок на фильтре промывали этанолом (20 мл). Растворитель удаляли на роторном испарителе и остаток подщелачивали насыщенным водным раствором бикарбоната натрия до рН 8-9. Добавляли твердый хлористый натрий (2 г) и полученную смесь экстрагировали хлороформом (4 х 20 мл). Объединенные хлороформные экстракты сушили (Na2SO4), фильтровали и концентрировали на роторном испарителе с получением 360,7 мг желаемого соединения в виде светло-коричневой вязкой жидкости (91,1%). 1-Метил-7-(5-этокси-3-пиридил)-1,7-диазаспиро[4,4]нонан. К перемешиваемому раствору 7-(5-этокси-3-пиридил)-1,7-диазаспиро[4,4]нонана (360,4 мг, 1,4 ммоль) в 37% водном растворе формальдегида (4 мл) в токе азота добавляли 98% муравьиную кислоту (2 мл). Реакционную смесь нагревали до начала стекания флегмы в течение 8 ч. Реакционную смесь охлаждали до комнатной температуры, затем подщелачивали насыщенным водным раствором бикарбоната натрия до рН 8-9 и экстрагировали хлороформом (4 х 15 мл). Объединенные хлороформные экстракты сушили(Na2SO4), фильтровали и концентрировали роторным выпариванием с получением вязкой коричневой жидкости. Продукт подвергали дистилляции в аппарате Kugelrohr (2 мм, 180 С) с получением светлокремового сиропа (340 мг, 89,3%). Пример 5. Образец 5 представляет собой 1-метил-7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонан, и его получают по следующей методике. 3-Бром-5-феноксипиридин. Гидрид натрия (1,35 г 80% раствора в минеральном масле, 45,0 ммоль) добавляли в перемешиваемый раствор фенола (4,26 г, 45,3 ммоль) в ДМФ (30 мл) при 0 С в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 3 ч, обрабатывали 3,5-дибромпиридином (4,0 г, 16,9 ммоль) и нагревали при 100 С в течение 48 ч. Реакционную смесь охлаждали до комнатной температуры, переливали в смесь воды (100 мл) и 5 М раствора гидроксида натрия (10 мл), после чего экстрагировали эфиром(3 х 60 мл). Объединенные эфирные экстракты сушили (Na2SO4), фильтровали и подвергали роторному выпариванию с получением светло-желтого полутвердого материала (4,9 г). Полученный материал подвергали хроматографической очистке на колонке с силикагелем (200 г), используя в качестве элюента смесь гексан/этилацетат/хлороформ (8:1:1, об./об.), с получением 2,86 г (выход 68%) бесцветного масла. 1-Бензил-7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонан. 1-Бензил-1,7-диазаспиро[4,4]нонан (500,0 мг, 2,4 ммоль) растворяли в сухом толуоле (15 мл), проводя процесс в 50 мл круглодонной колбе, снабженной магнитной мешалкой. Через раствор медленно барботировали газообразный азот. В перемешиваемый раствор добавляли 3-бром-5-феноксипиридин(636,8 мг, 2,55 ммоль), трет-бутилат калия (1039 мг, 9,26 ммоль), rac-2,2'-бис-(дифенилфосфино)-1,1'бинафтил (86,4 мг, 0,14 ммоль) и трис-(дибензилиденацетон)дипалладий(0) (63,6 мг, 0,06 ммоль), продолжая пропускать через раствор газообразный азот. Поток азота перекрывали, колбу закрывали и нагревали при 90 С в течение 8 ч. Реакционную смесь охлаждали и растворитель удаляли на роторном испарителе. Полученный остаток суспендировали в насыщенном водном растворе бикарбоната натрия (10 мл) и экстрагировали хлороформом (4 х 25 мл). Объединенные органические экстракты сушили (Na2SO4),фильтровали, концентрировали на роторном испарителе до образования густой темной массы. Полученный продукт очищали методом колоночной хроматографии с использованием в качестве элюента смеси метанол/хлороформ (2:98, об./об.) с получением 0,70 г желаемого соединения в виде светло-коричневой вязкой жидкости (78,6%). 7-(5-Фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонан. К раствору 1-бензил-7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонана (690 мг, 1,79 ммоль) в этаноле (25 мл), помещенному в сосуд для работы под давлением, добавляли концентрированную HCl и катализатор Пирлмана (Pearlman) (Pd(OH)2 20% на угле, 50 мг). Раствор встряхивали в течение 8 ч при давлении водорода 50 фунт/дюйм 2. Катализатор удаляли фильтрацией через целит и осадок на фильтре- 21009789 промывали этанолом (20 мл). Растворитель удаляли на роторном испарителе и остаток подщелачивали насыщенным водным раствором бикарбоната натрия до рН 8-9. Добавляли твердый хлористый натрий (2 г) и раствор экстрагировали хлороформом (4 х 20 мл). Объединенные хлороформные экстракты сушили(Na2SO4), фильтровали и концентрировали на роторном испарителе с получением 490 мг желаемого соединения в виде светло-коричневой вязкой жидкости (92,7%). 1-Метил-7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонан. К перемешиваемому раствору 7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонана (420 мг, 1,42 ммоль) в 37% водном растворе формальдегида (5 мл) добавляли 98% муравьиную кислоту (3 мл) в атмосфере азота. Реакционную смесь нагревали до начала стекания флегмы в течение 8 ч. Реакционную смесь охлаждали до комнатной температуры, затем подщелачивали насыщенным водным раствором бикарбоната натрия до рН 8-9 и экстрагировали хлороформом (4 х 15 мл). Объединенные хлороформные экстракты сушили (Na2SO4), фильтровали и концентрировали на роторном испарителе с получением темно-коричневой вязкой жидкости. Продукт подвергали дистилляции в аппарате Kugelrohr (2 мм, 180 С) с получением светло-кремового сиропа (400 мг, 90,9%). Дигидрохлорид 1-метил-7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонана. 1-Метил-7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонан (200 мг, 0,65 ммоль) растворяли в концентрированной HCl (1 мл) и на раствор воздействовали ультразвуком в течение 5 мин. Избыток кислоты и воды удаляли повторным азеотропным выпариванием в присутствии небольших порций этанола. Получали продукт в виде желтого твердого материала. Твердое вещество растворяли в минимальном количестве абсолютированного этанола (1 мл) и после этого до помутнения раствора по каплям добавляли эфир. В результате охлаждения в холодильнике в течение ночи получали светло-кремовые кристаллы,которые фильтровали, промывали эфиром и сушили в вакуумной печи с получением 210 мг (85,4%) чистого дигидрохлорида, т.пл. 180-191 С. Примеры 6 и 7. Образцы 12 и 13 представляют собой (+) и (-) 7-(3-пиридил)-1,7-диазаспиро[4,4]нонаны, которые,соответственно, получали по следующей методике. Диастереомерные 7-(3-пиридил)-1,7-диазаспиро[4,4]нонана S-пролинамиды. Триэтиламин (6,0 мл, 43 ммоль) и дифенил хлорфосфат (4,0 мл, 19 ммоль) добавляли в указанном порядке в перемешиваемую суспензию N-(трет-бутоксикарбонил)-S-пролина (4,67 г, 21,7 ммоль) в дихлорметане (100 мл) в атмосфере азота. После перемешивания в течение 1,5 ч при комнатной температуре реакционную смесь обрабатывали раствором 7-(3-пиридил)-1,7-диазаспиро[4,4]нонана (4,40 г, 21,6 ммоль) в дихлорметане (10 мл). Полученную смесь перемешивали в течение 3 дней при комнатной температуре. Затем добавляли раствор гидроксида натрия (30 мл 5 М раствора). После дополнительного перемешивания в течение 1 ч смесь переливали в делительную воронку, содержащую хлороформ (30 мл) и воду (30 мл). Смесь тщательно встряхивали, и происходило расслаивание системы. Органический слой и 30 мл хлороформного экстракта водного слоя объединяли, сушили (MgSO4) и концентрировали на роторном испарителе. Остаток (7,2 г) растворяли в дихлорметане (100 мл) и объединяли с трифторуксусной кислотой (50 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. Летучие вещества испаряли, вначале на роторном испарителе и затем с помощью вакуумного насоса. Полученный остаток очищали препаративной HLPC, используя в качестве элюента 10% ацетонитрила и 0,1% трифторуксусной кислоты в воде. Выбранные фракции объединяли и концентрировали, получая в качестве остатка 3,13 г (выход 79%) диастереомера, который элюировал через 11,4 мин, и 2,90 г (выход 74%) диастереомера, который элюировал через 13,2 мин. Причем оба продукта представляли собой материалы в виде белой пены (предположительно монотрифторацетаты).(+) и (-) 7-(3-Пиридил)-1,7-диазаспиро[4,4]нонан. Каждый из двух диастереомерных S-пролиновых амидов растворяли в дихлорметане (50 мл) и триэтиламине (2-4 мл) и затем объединяли с фенилизотиоцианатом (1,73 г, 12,8 ммоль для ранее элюирующего диастереомера и 1,57 г, 11,6 ммоль для позже элюирующего диастереомера). Две полученные реакционные смеси перемешивали при комнатной температуре в течение 16 ч, после чего, согласно данным тонкослойной хроматографии, было установлено, что реакции завершились. Смеси концентрировали на роторном испарителе и каждый из полученных остатков переносили в дихлорметан (10 мл) и обрабатывали трифторуксусной кислотой (10 мл). Реакционные смеси выдерживали при 50 С в течение 16 ч и концентрировали досуха. В результате разделения методом колоночной хроматографии на силикагеле с использованием в качестве элюента смеси хлороформ/метанол/аммиак в соотношении 80:20:2 получали 620 мг материала (производного ранее элюирующего диастереомера, выход 40,5%) и 720 мг материала(производного более поздно элюирующего диастереомера, выход 50,7%) в виде образцов светло-коричневого масла. Хиральный HPLC анализ проводили на колонке Chiralcel OD, используя в качестве элюента смесь гексан/этанол в соотношении 7:3. Изомер, являющийся производным диастереомера, элюирующего первым, имел более длительные время удерживания на хиральной колонке (10,9 мин), тогда как изомер, производный позже элюирующего диастереомера, имел время удерживания на хиральной колонке порядка 8,7 мин. В пределах точности анализа (2%) образцы представляли собой энантиомерно чистые материалы.- 22009789 Из описания сущности настоящего изобретения ясно, что возможны его различные модификации,замены и изменения. Следует иметь в виду, что варианты практической реализации изобретения могут отличаться от специально описанных воплощений. Подразумевается, что такие модификации, замены и вариации охватываются областью настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное следующей формулой 1 а также его фармацевтически приемлемые соли,где u, v, w и x, каждый независимо равен 0, 1, 2 или 3, причем значения выбираются так, что соединения выбираются из 1,7-диазаспиро[4,4]нонанов, 2,7-диазаспиро[4,4]нонанов, 1,6-диазаспиро[3,5]нонанов, 2,6-диазаспиро[4,5]нонанов, 1,7-диазаспиро[4,5]деканов и 1,8-диазаспиро[5,5]ундеканов,R представляет собой водород, С 1-С 8 алкил, ацил, алкоксикарбонил или арилоксикарбонил,Z независимо выбран из группы, включающей водород, C1-С 8 алкил, замещенный C1-С 8 алкил, С 3-С 8 циклоалкил, замещенный С 3-С 8 циклоалкил, гетероциклил, замещенный гетероциклил, С 3-С 10 арил, замещенный С 6-С 10 арил, С 1-С 8 алкил-С 6-С 10 арил, замещенный C1-С 8 алкил-С 6-С 10 арил, С 6-С 10 арил-С 1-С 8 алкил и замещенный С 6-С 10 арил-С 1-С 8 алкил; где гетероциклил относится к насыщенным или ненасыщенным циклическим радикалам, содержащим один или несколько атомов О, N и/или S в качестве элемента кольцевой структуры и содержащим от двух до семи углеродных атомов в кольце; где заместители замещенного C1-С 8 алкила, замещенного С 3-С 8 циклоалкила, замещенного гетероциклила, замещенного С 6-С 10 арила, замещенного С 1-С 8 алкил-С 6-С 10 арила и замещенного С 6-С 10 арил-С 1-С 8 алкила относятся к заместителю, выбранному из гидрокси, алкокси, арилокси, меркапто,арила, гетероцикло, гало, амино, карбоксила, карбамида и циано; и где каждый из X, X', X", X'" и X независимо представляет собой азот или углерод, связанный с заместителями, при условии, что кольцо представляет собой фенил, пиридинил или пиримидинил. 2. Соединение по п.1, где как X', так и X"' представляют собой азот. 3. Соединение по п.1, где X, X" и X представляют собой углерод, связанный с заместителями. 4. Соединение по п.3, где заместители при X, X" и X представляют собой водород. 5. Фармацевтическая композиция, включающая соединение по п.1. 6. Способ лечения или профилактики нарушения ЦНС, ассоциируемого с высвобождением нейротрансмиттеров, опосредованного никотиновыми рецепторами, включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в лечении. 7. Способ по п.6, где нарушение ЦНС выбрано из группы, состоящей из пресенильного слабоумияLewy Body, деменции, связанной со СПИДом, множественных церебральных инфарктов, паркинсонизма,включая болезнь Паркинсона, болезни Пика, хореи Хантигтона, поздней дискинезии, гиперкинеза, мании, нарушения дефицита внимания, беспокойства, депрессии, недостаточности познавательной способности, дислексии, шизофрении и синдрома Тиретта. 8. Способ по п.6, где соединение вводят в дозе, эффективной для лечения или профилактики нарушения ЦНС, но не в дозе, приводящей к проявлению заметных побочных эффектов, связанных со стимуляцией мышечных или ганглиозных рецепторов. 9. Способ обезболивания, уменьшения воспаления, лечения язвенного колита, воспалительных и аутоиммунных заболеваний, лечения нейродегенеративных заболеваний и/или лечения конвульсий,включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в таком лечении. 10. Способ лечения бактериальных, грибковых и/или вирусных инфекций и/или действия токсинов,продуцируемых такими инфекциями, включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в таком лечении. 11. Способ лечения воспаления кишечника, дивертикулита, острого холангита, афтозного стоматита,артрита, нейродегенеративных заболеваний, болезни Кройтцфельда-Якоба, кахексии, вторичной по отношению к инфекции, генетических заболеваний и нарушений и/или аутоиммунных нарушений, включа- 23009789 ющий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в таком лечении. 12. Способ ингибирования высвобождения цитокина, включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в таком лечении. 13. Способ лечения язвенного колита, включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в таком лечении. 14. Способ обезболивания, включающий введение эффективного количества соединения по п.1 пациенту, нуждающемуся в таком лечении. 15. Соединения, выбранные из группы, включающей 7-(3-пиридил)-1,7-диазаспиро[4,4]нонан,7-(5-пиримидинил)-1,7-диазаспиро[4,4]нонан,7-(2-пиразинил)-1,7-диазаспиро[4,4]нонан,7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонан,7-(6-хлор-3-пиридил)-1,7-диазаспиро[4,4]нонан,1-(3-пиридил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(3-пиридил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(5-метокси-3-пиридил)-1,7-диазаспиро[4,4]нонан,1-метил-7-(5-фенокси-3-пиридил)-1,7-диазаспиро[4,4]нонан,2-метил-7-(3-пиридил)-2,7-диазаспиро[4,4]нонан,6-(3-пиридил)-1,6-диазаспиро[3,4]октан,1-метил-6-(3-пиридил)-1,6-диазаспиро[3,4]октан,2-(3-пиридил)-2,6-диазаспиро[4,5]декан,7-(3-пиридил)-1,7-диазаспиро[4,5]декан, и их фармацевтически приемлемые соли. 16. Фармацевтическая композиция, включающая эффективное количество соединения по п.15.
МПК / Метки
МПК: A61K 31/435, C07D 487/20, C07D 471/10, C07D 471/20, C07D 487/10, C07D 453/02, A61K 31/40
Метки: соединения, n-арилдиазаспирациклические, способы, получения, применения
Код ссылки
<a href="https://eas.patents.su/25-9789-n-arildiazaspiraciklicheskie-soedineniya-i-sposoby-ih-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">N-арилдиазаспирациклические соединения и способы их получения и применения</a>
Предыдущий патент: Способ лечения заболевания дыхательных путей, пищевая композиция и способ получения пищевой и лечебной композиций
Следующий патент: Пористый электрод, твердый окисный топливный элемент и способ их изготовления
Случайный патент: Фунгицидная смесь












