Новые сульфонилбензойные кислоты и способ получения 4-бензамидопиразоло-5-карбоксамидов с их использованием
Номер патента: 4315
Опубликовано: 26.02.2004
Авторы: Стрит Стивен Дирек Альберт, Вуд Энтони, Баннедж Марк Эдвард, Мэтиас Джон Пол
Формула / Реферат
1. Способ получения соединения формулы (IXA) или (IXB)
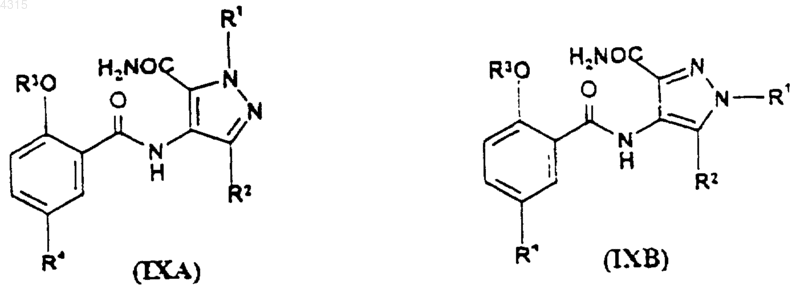
при котором соединение формулы (XA) или (XB) соответственно

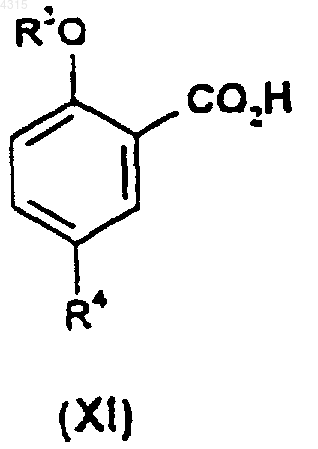
подвергают взаимодействию с соединением формулы (XI)
где R1 представляет собой C1-C3алкил, замещенный C3-C6циклоалкилом, CONR5R6 или N-связанной гетероциклической группой, выбранной из пиразолила, имидазолила, триазолила, пирролидинила, пиперидинила, морфолинила и 4-R9-пиперазинила; (CH2)nHet или (CH2)nAr;
R2 представляет собой C1-C6алкил;
R3 представляет собой C1-C6алкил, возможно замещенный C1-C4алкоксигруппой;
R4 представляет собой SO2NR7R8;
R5 и R6, каждый независимо, выбраны из H и C1-C4алкила, возможно замещенного C1-C4алкоксигруппой, или вместе с атомом азота, к которому они присоединены, образуют пирролидинильную, пиперидинильную, морфолинильную или 4-R9-пиперазинильную группу;
R7 и R8 вместе с атомом азота, к которому они присоединены, образуют 4-R10-пиперазинильную группу;
R9 представляет собой C1-C4алкил;
R10 представляет собой H или C1-C4алкил, возможно замещенный OH, C1-C4алкоксигруппой или CONH2;
Het представляет собой C-связанную 6-членную гетероциклическую группу, содержащую один или два атома азота, возможно в форме его моно-N-оксида, либо C-связанную 5-членную гетероциклическую группу, содержащую от одного до четырех гетероатомов, выбранных из азота, кислорода и серы, причем любая из указанных гетероциклических групп возможно замещена одним или двумя заместителями, выбранными из C1-C4алкила, возможно замещенного C1-C4алкоксигруппой, C1-C4алкоксигруппы, галогено и NH2;
Ar представляет собой фенил, возможно замещенный одним или двумя заместителями, выбранными из C1-C4алкила, C1-C4алкоксигруппы, галогено, CN, CONH2, NO2, NH2, NHSO2(C1-C4алкил) и SO2NH2; и
n равняется 0 или 1.
2. Способ по п.1, где R1 представляет собой C1-C2алкил, замещенный C3-C5циклоалкилом, CONR5R6 или N-связанной гетероциклической группой, выбранной из пиразолила, триазолила, морфолинила и 4-R9-пиперазинила; (CH2)nHet или (CH2)nAr; R5 представляет собой H, а R6 представляет собой C1-C4алкил, возможно замещенный C1-C4алкоксигруппой, или R5 и R6 вместе с атомом азота, к которому они присоединены, образуют морфолинильную группу; Het выбран из пиридинила, 1-оксидопиридинила, пиридазинила, пиримидинила, пиразинила, имидазолила, изоксазолила, тиазолила, триазолила и оксадиазолила, каждый из которых возможно замещен одним или двумя заместителями, выбранными из CH3, CH2CH2OCH3, OCH3 и NH2; и R2, R3, R4, R9, Ar и n такие, как определено ранее в п.1.
3. Способ по п.2, где R1 представляет собой C1-C2алкил, замещенный циклобутилом, CONR5R6, пиразол-1-илом, 1,2,3-триазол-1-илом, 1,2,4-триазол-1-илом, морфолин-4-илом или 4-метилпиперазин-1-илом; пиримидин-2-ил; CH2Het или (CH2)nAr; R2 представляет собой C1-C3алкил; R3 представляет собой C1-C3алкил, возможно замещенный C1-C2алкоксигруппой; R5 представляет собой H, а R6 представляет собой C1-C2алкил, возможно замещенный C1-C2алкоксигруппой, или R5 и R6 вместе с атомом азота, к которому они присоединены, образуют морфолин-4-ильную группу; R10 представляет собой C1-C2алкил, возможно однозамещенный OH, OCH3 либо CONH2; Het выбран из пиридин-2-ила, 1-оксидопиридин-2-ила, пиридин-3-ила, пиридазин-3-ила, пиридазин-4-ила, пиримидин-4-ила, пиримидин-5-ила, пиразин-2-ила, 3-метоксипиридин-2-ила, 6-аминопиридин-2-ила, 1-метилимидазол-2-ила, 3,5-диметилизоксазол-4-ила, 2-метилтиазол-4-ила, 1-метил-1,2,4-триазол-5-ила, 1-(2-метоксиэтил)-1,2,4-триазол-5-ила, 4-метил-1,2,4-триазол-3-ила, 3-метил-1,2,4-триазол-5-ила, 1,2,4-оксадиазол-3-ила и 5-метил-1,2,4-оксадиазол-3-ила; Ar выбран из фенила, 4-хлорфенила, 4-бромфенила, 2-цианофенила, 2-карбамоилфенила, 4-карбамоилфенила, 2-нитрофенила, 4-нитрофенила, 2-аминофенила, 4-аминофенила, 2-метансульфонамидофенила, 4-метансульфонамидофенила, 4-этансульфонамидофенила, 4-(проп-2-илсульфонамидо)фенила и 4-сульфамоилфенила; и n такой, как определено ранее в п.2.
4. Способ по п.3, где R1 представляет собой циклобутилметил, морфолин-4-илкарбонилметил, 2-(морфолин-4-ил)этил, пиримидин-2-ил, CH2Het или (CH2)nAr; R2 представляет собой CH2CH3 или CH2CH2CH3; R3 представляет собой CH2CH3, CH2CH2CH3 или CH2CH2OCH3; R10 представляет собой CH3, CH2CH3 или CH2CH2OH; Het выбран из пиридин-2-ила, пиридазин-3-ила, пиразин-2-ила, 3-метоксипиридин-2-ила, 6-аминопиридин-2-ила, 1-метилимидазол-2-ила, 3,5-диметилизоксазол-4-ила, 1-метил-1,2,4-триазол-5-ила, 1-(2-метоксиэтил)-1,2,4-триазол-5-ила и 5-метил-1,2,4-оксадиазол-3-ила; Ar выбран из фенила, 2-аминофенила, 2-метансульфонамидофенила, 4-метансульфонамидофенила, 4-этансульфонамидофенила и 4-(проп-2-илсульфонамидо)фенила; и n такой, как определено ранее в п.3.
5. Соединение формулы (XI)
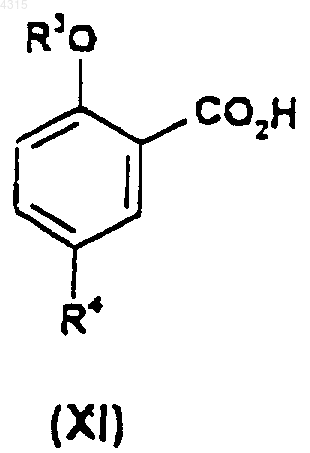
где R3 представляет собой C1-C6алкил, возможно замещенный C1-C4алкоксигруппой;
R4 представляет собой SO2NR7R8;
R7 и R8 вместе с атомом азота, к которому они присоединены, образуют 4-R10-пиперазинильную группу;
R10 представляет собой H или C1-C4алкил, возможно замещенный OH, C1-C4алкоксигруппой или CONH2;
при условии, что когда R3 представляет собой этил, тогда R4 не является 4-метилпиперазин-1-илсульфонилом.
6. Соединение по п.5, где R3 представляет собой C1-C3алкил, возможно замещенный C1-C2алкоксигруппой; R10 представляет собой C1-C2алкил, возможно однозамещенный OH, OCH3 либо CONH2.
7. Соединение по п.6, где R3 представляет собой CH2CH3, CH2CH2CH3 или CH2CH2OCH3; R10 представляет собой CH3, CH2CH3 или CH2CH2OH.
Текст
1 Это изобретение относится к группе новых сульфонилбензойных кислот, а также к способу с их использованием, предназначенному для получения 4-бензамидопиразоло-5-карбоксамидов, которые служат исходными соединениями для синтеза пиразоло[4,3-d]пиримидин-7-онов,которые ингибируют циклический гуанозин 3',5'-монофосфат-фосфодиэстеразу (cGMP PDE) и поэтому представляют собой сильнодействующие и селективные ингибиторы циклический гуанозин-3',5'-монофосфат-фосфодиэстеразы типа 5 (cGMP PDE5) и поэтому полезны в различных терапевтических областях. Таким образом, согласно настоящему изобретению предложен способ получения 4-бензамидопиразоло-5-карбоксамидов формулы (IХА) или (IХВ): при котором соединение формулы (ХА) илиR5 и R6 каждый независимо выбраны из Н и С 1-С 4 алкила, возможно замещенного С 1-С 4 алкоксигруппой, или вместе с атомом азота, к которому они присоединены, образуют пирролидинильную, пиперидинильную, морфолинильную или 4-R9-пипepaзинильнyю группу;Het представляет собой С-связанную 6 членную гетероциклическую группу, содержащую один или два атома азота, возможно в форме его моно-N-оксида, либо С-связанную 5 членную гетероциклическую группу, содержащую от одного до четырех гетероатомов, выбранных из азота, кислорода и серы, причем любая из указанных гетероциклических групп возможно замещена одним или двумя заместителями, выбранными из С 1-С 4 алкила, возможно замещенного С 1-С 4 алкоксигруппой, С 1-С 4 алкоксигруппы, галогено и NH2; Аr представляет собой фенил, возможно замещенный одним или двумя заместителями,выбранными из С 1-С 4 алкила, С 1-С 4 алкоксигруппы, галогено, CN, CONH2, NO2, NH2,NНSO2(С 1-С 4 алкил) и SO2NH2; и n равняется 0 или 1. Предпочтительно R1 представляет собой С 1-С 2 алкил, замещенный С 3-С 5 циклоалкилом,CONR5R6 или N-связанной гетероциклической группой, выбранной из пиразолила, триазолила,морфолинила и 4-R9-пипepaзинилa; (CH2)nHet или (СН 2)nАr; R5 представляет собой Н, а R6 представляет собой С 1-С 4 алкил, возможно замещенный С 1-С 4 алкоксигруппой, или R5 и R6 вместе с атомом азота, к которому они присоединены, образуют морфолинильную группу; Het выбран из пиридинила, 1-оксидопиридинила,пиридазинила, пиримидинила, пиразинила,имидазолила, изоксазолила, тиазолила, триазолила и оксадиазолила, каждый из которых возможно замещен одним или двумя заместителями, выбранными из СН 3, СН 2 СH2 ОСН 3, ОСН 3 иCH2Het или (СН 2)nАr; R2 представляет собой C1 С 3 алкил; R3 представляет собой С 1-С 3 алкил,возможно замещенный С 1-С 2 алкоксигруппой; R5 представляет собой Н, а R6 представляет собой С 1-С 2 алкил, возможно замещенный С 1-С 2 алкоксигруппой, или R5 и R6 вместе с атомом азота, к которому они присоединены, образуют морфолин-4-ильную группу; R10 представляет собой С 1-С 2 алкил, возможно однозамещенный ОН,ОСН 3 либо CONH2; Het выбран из пиридин-2 ила, 1-оксидопиридин-2-ила, пиридин-3-ила,пиридазин-3-ила, пиридазин-4-ила, пиримидин 4-ила, пиримидин-5-ила, пиразин-2-ила, 3 метоксипиридин-2-ила, 6-аминопиридин-2-ила,1-метилимидазол-2-ила,3,5-диметилизоксазол-4-ила, 2-метилтиазол-4-ила, 1-метил-1,2,4 триазол-5-ила, 1-(2-метоксиэтил)-1,2,4-триазол 5-ила, 4-метил-1,2,4-триазол-3-ила, 3-метил 1,2,4-триазол-5-ила, 1,2,4-оксадиазол-3-ила и 5 метил-1,2,4-оксадиазол-3-ила; Аr выбран из фенила, 4-хлорфенила, 4-бромфенила, 2-циано 3 фенила, 2-карбамоилфенила, 4-карбамоилфенила, 2-нитрофенила, 4-нитрофенила, 2-аминофенила, 4-аминофенила, 2-метансульфонамидофенила, 4-метансульфонамидофенила, 4-этансульфонамидофенила, 4-(проп-2-илсульфонамидо)фенила и 4-сульфамоилфенила; и n такой,как определено ранее. Наиболее предпочтительно R1 представляет собой циклобутилметил, морфолин-4-илкарбонилметил, 2-(морфолин-4-ил)этил, пиримидин-2-ил, CH2Het или (СН 2)nАr; R2 представляет собой СН 2 СН 3 или СH2 СH2CH3; R3 представляет собой СН 2 СН 3, СН 2 СН 2 СН 3 или СН 2 СН 2OСН 3;R10 представляет собой СН 3, СH2 СН 3 или СН 2 СН 2OН; Het выбран из пиридин-2-ила, пиридазин-3-ила, пиразин-2-ила, 3-метоксипиридин-2-ила, 6-аминопиридин-2-ила, 1-метилимидазол-2-ила, 3,5-диметилизоксазол-4-ила, 1 метил-1,2,4-триазол-5-ила, 1-(2-метоксиэтил)1,2,4-триазол-6-ила и 5-метил-1,2,4-оксадиазол 3-ила; Аr выбран из фенила, 2-аминофенила, 2 метансульфонамидофенила, 4-метансульфонамидофенила, 4-этансульфонамидофенила и 4(проп-2-илсульфонамидо)фенила; и n такой, как определено ранее. Согласно изобретению предложены также сульфонилбензойные кислоты формулы (XI)R10 представляет собой Н или С 1-С 4 алкил,возможно замещенный ОН, С 1-С 4 алкоксигруппой или CONH2; при условии, что когда R3 представляет собой этил, тогда R4 не является 4-метилпиперазин-1-илсульфонилом. Предпочтительными являются соединения формулы (XI), где R3 представляет собой С 1-С 3 алкил, возможно замещенный С 1-С 2 алкоксигруппой; R10 представляет собой C1-С 2 алкил,возможно однозамещенный ОН, ОСН 3 либоCONH2. Наиболее предпочтительной группой соединений формулы (XI) является такая, где R3 представляет собой СН 2 СН 3, CH2CH2CH3 илиCH2CH2OCH3; R10 представляет собой СН 3,СН 2 СН 3 или CH2CH2OH. Реакция сочетания соединения формулы(ХА) или (ХВ) с соединением формулы (XI) может быть осуществлена с использованием общепринятых методик образования амидной связи, наПример через ацилхлоридное произ 004315 4 водное соединения (XI), гарантируя, что любой потенциально уязвимый заместитель (например,когда R10 представляет собой С 1-С 4 алкил, замещенный ОН или CONH2) соответствующим образом защищен. В частности, может быть использован любой из множества вариантов сочетания аминокислот. Например кислоту формулы (XI) можно активировать, используя карбодиимид, такой как 1,3-дициклогексилкарбодимид или 1-этил-3(3-диметиламинопроп 1-ил)карбодиимид,возможно в присутствии 1-гидроксибензотриазола и/или катализатора, такого как 4-диметиламинопиридин, либо используя соль галогенотрисаминофосфония, такую как бром-трис(пирролидино)фосфония гексафторфосфат. Тот и другой тип связывания проводят в подходящем растворителе, таком как дихлорметан, возможно в присутствии третичного амина, такого как Nметилморфолин или N-этилдиизопропиламин(например, когда либо соединение формулы(ХА) или (ХВ), либо активирующий реагент представлены в форме соли присоединения кислоты), при температуре приблизительно 0 С. Предпочтительно используют 1,1-2,0 молярных эквивалентов активирующего реагента и 2,0-3,0 молярных эквивалента любого третичного амина. Смесь (XI) и либо (ХА), либо (ХВ) обрабатывают приблизительно одним молярным эквивалентом сочетающего реагента (бензотриазол 1-илокси)трипирролидинофосфония гексафторфосфата (РуВОР) в подходящем растворителе,таком как диметилформамид, при приблизительно комнатной температуре. Еще в одном варианте, карбоксильную группу (XI) сначала можно активировать с использованием приблизительно до 5%-ного избытка такого реагента, как N,N'-карбонилдимидазол, в подходящем растворителе, например этилацетате или бутан-2-оне, при температуре от приблизительно комнатной до приблизительно 80 С с последующим взаимодействием промежуточного имидазолида с либо (ХА), либо(ХВ) при температуре от приблизительно 20 до приблизительно 90 С. Синтезы соединений по изобретению и ряда других соединений, иллюстрирующих возможность осуществления настоящего изобретения, проиллюстрированы следующими примерами и подготовительными примерами. Спектры 1H-ядерного магнитного резонанса (ЯМР) регистрировали, используя спектрометры либо Varian Unity 300, либо Varian Inova 400, и во всех случаях полученные спектры соответствуют предполагаемым структурам. Характеристические химические сдвигиданы в миллионных долях по нисходящей от тетраметилсилана с использованием общепринятых сокращений для обозначения основных пиков: например s - синглет; d - дублет; t - триплет; q квартет; m - мультиплет; b - широкий. 5 Масс-спектры (m/z) регистрировали на масс-спектрометре Fisions Instruments Trio с использованием метода термораспылительной ионизации. Под комнатной температурой подразумевается температура 20-25 С. Пример 1. Аминосульфонилирование 1/2 алкилированных 5-(2-алкоксифенил)-3-алкил 1/2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 онов. Хлорсульфоновую кислоту (30 ммоль) медленно добавляют к охлажденному во льду образцу либо N1-, либо N2-алкилированного субстрата (3 ммоль) с последующим добавлением тионилхлорида (4,5 ммоль), затем полученную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 24 ч. Реакционную смесь охлаждают во льду и осторожно вливают в перемешиваемую смесь воды со льдом, далее осадок собирают и высушивают вакуум-отсосом, получая неочищенный сульфонилхлорид достаточной чистоты для того, чтобы использовать его непосредственно на последующей стадии N-сульфонилирования. Избыток (как правило от 2 до 5 мол. экв.) 1-замещенного пиперазина добавляют порциями к перемешиваемой смеси сульфонилхлорида и этанола. Реакционную смесь перемешивают в течение 20 ч при комнатной температуре, а затем упаривают при пониженном давлении. Остаток распределяют между этилацетатом и насыщенным водным раствором бикарбоната натрия, далее органическую фазу отделяют и объединяют с тремя этилацетатными экстрактами водной фазы. Объединенные органические растворы высушивают (Na2SO4) и упаривают при пониженном давлении, получая неочищенный сульфонамид, который очищают колоночной хроматографией на силикагеле. В тех случаях, когда сульфонилхлорид не выпадает в осадок при прекращении реакции хлорсульфирования ледяной водой, полученный водный раствор разбавляют равным объемом этанола, охлаждают во льду и обрабатывают соответствующим пиперазиновым производным, как описано выше. Пример 2. 5-5-[4-(2-Гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-3-нпропил-1-(пиридин-2-ил)метил-1.6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (12%) из соединения, указанного в заголовке подготовительного примера 17, и 1-(2-гидроксиэтил) пиперазина, используя методику из примера 1. Обнаружено: С 58,18; Н 6,25; N 15,81. С 29 Н 37N7O5S соответствует: С 58,47; Н 6,26; N 16,46%.(CDCl3): 1.00 (3 Н, t), 1.18(3H,t), 1.88 (2 Н,m), 2.04 (2 Н, m), 2.30 (1 Н, s), 2.58 (2 Н, m), 2.66(1 Н, s), 10.94 (1 Н, s). MCHP: m/z 596(M+1)+. Пример 3. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]3-н-пропил 2-(пиридин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (53%) из соединения, указанного в заголовке подготовительного примера 20, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С 58,96; Н 6,23; N 17,03. С 28 Н 35N7O4S соответствует: С 59,45; Н 6,24; N 17,33%.(CDCl3): 0.96 (3H, t), 1.16 (3H, t), 1.76(1 Н, m), 7.83 (1 Н, d), 8.58 (1 Н, d), 8.78 (1 Н, s),10.60 (1 Н, s). MCHP: m/z 566 (M+1)+. Пример 4. 5-5-[4-(2-Метоксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-1(1-метил-1,2,4-триазол-5-ил)метил-3-н-пропил 1,6-дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7oн. Получают в виде твердого вещества белого цвета (43%) из соединения, указанного в заголовке подготовительного примера 59, и 1-(2 метоксиэтил)пиперазина, используя методику из примера 1.(CDCl3): 1.00 (3H, t), 1.20 (3H, t), 1.86(240 мг; 0,4 ммоль), в метаноле (40 мл), и смесь гидрируют при 345 кПа (50 фунт./кв.дюйм.) и 50 С в течение 20 ч, затем оставляют охлаждаться и фильтруют. Фильтр промывают метанолом (50 мл) и объединенные метанольные растворы упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь дихлорметан:метанол (95:5) в качестве элюента, с последующей кристаллизацией из этилацетата, что позволяет получить указанное в заголовке соединение (190 мг) в виде порошка белого цвета. Обнаружено: С 58,98; Н 6,20; N 17,25.(1 Н, d), 8.80 (1 Н, s), 10.85 (1 Н, s). Пример 6. 5-[2-Этокси-5-(4-метилпиперазин-1-илсульфонил)фенил]-1-(2-метансульфонамидобензил)-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Метансульфонилхлорид (31 мкл; 0,40 ммоль) добавляют к перемешиваемому, охлажденному во льду раствору соединения, указанного в заголовке примера 52 (150 мг; 0,27 ммоль), в пиридине (3 мл), и смесь перемешивают при комнатной температуре в течение 2 ч,затем упаривают при пониженном давлении. Остаток обрабатывают водой (10 мл), и полученную суспензию экстрагируют дихлорметаном (общий объем 40 мл). Объединенные экстракты высушивают (Na2SO4) и упаривают при пониженном давлении, получая масло оранжевого цвета, которое очищают хроматографией на силикагеле, используя смесь этилацетат : метанол : 0,880 водный аммиак (94:5:1) в качестве элюента и получая указанное в заголовке соединение (62 мг) в виде пены белого цвета. Обнаружено: С 54,03; Н 5,87; N 14,70. С 29 Н 37N7O6S2 соответствует: С 54,10; Н 5,79; N 15,23%.(CDCl3): 1.02 (3H, t), 1.66 (3H, t), 1.90MCHP: m/z 644 (М+1)+. Пример 7. 5-[5-(4-Карбамоилметилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-нпропил-2-(пиридин-2-ил)метил-2,6-дигидро-7 Нпиразоло[4,3-d]-пиримидин-7-он. Получают в виде пены бледно-желтой окраски (16%) из соединения, указанного в заголовке подготовительного примера 20, и 1 карбамоилметилпиперазина (Indian J. Chem.,1984, 23 В, 650), используя методику из примера 1.(CDCl3): 0.95 (3H, t), 1.17 (3H, t), 1.73(M+1)+. Пример 8. 5-[5-(4-Этипиперазин-1-илсульфонил)-2-н-пропоксифенил]-2-(2-нитрофенил)3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены желтого цвета(36%) из соединения, указанного в заголовке подготовительного примера 123, и 1-этилпиперазина, используя методику из примера 1.(CDCl3): 0.90 (3H, t), 0.99 (3H, m), 1.11(1H, d), 8.82 (1 Н, s), 10.64 (1 Н, s). MCHP: m/z 610 (M+1)+. Пример 9. 2-(2-Аминофенил)-5-[5-(4-этилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3d]пиримидин-7-он. Перемешиваемую смесь соединения, указанного в заголовке примера 8 (622 мг; 1,02 ммоль), 10%-ного палладия на угле (100 мг),этанола (10 мл) и этилацетата (30 мл) гидрируют при 345 кПа (50 ф/кв дюйм) и 50 С в течение 3 ч и затем при комнатной температуре в течение 18 ч. Полученную смесь фильтруют, затем фильтрат объединяют с этилацетатной промывкой фильтра и упаривают при пониженном давлении, что позволяет получить указанное в заголовке соединение (100%) в виде порошка белого цвета.(CDCl3): 0.87 (3H, t), 0.98 (3H, m),1.12(3H, t), 1.70 (2H, m), 2.01 (2 Н, q), 2.38 (2 Н,m), 2.48 (4 Н, m), 2.90 (2 Н, t), 3.08 (4 Н, m), 3.92(583 мг; 1,0 ммоль), в пиридине (8 мл) в атмосфере азота и полученный раствор перемешивают при 50 С в течение 18 ч, затем упаривают при пониженном давлении. Остаток распределяют между этилацетатом и водой, затем отделенную органическую фазу промывают солевым раствором, высушивают (MgSO4) и упаривают при пониженном давлении. Полученную пену коричневой окраски очищают колоночной хроматографией на силикагеле, используя градиентное элюирование смесью дихлорметан: метанол (от 100:0 до 99:1, до 98:2, до 97:3), получая указанное в заголовке соединение (32%) в виде пены кремовой окраски. Обнаружено: С 53,96; Н 6,01; N 14,38. С 30H39N7O6S2; 0,60 Н 2O соответствует: С 53,89; Н 6,06; N 14,67%.(CDCl3): 0.91 (3H, t), 1.01 (3H, t), 1.19(3H,t), 1.75 (2 Н, m), 2.07 (2 Н, m), 2.40 (2 Н, q), 2.53m/z 658 (М+1)+. Пример 11. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(1-оксидопиридин-2-ил)метил-3-н-пропил-2,6-дигидро 7 Н-пиразоло[4,3-d]пиpимидин-7-oн. 3-Хлорпероксибензойную кислоту (5055%-ную; 152 мг; 0,44 ммоль) в атмосфере азота добавляют к перемешиваемому раствору соеди 9 нения, указанного в заголовке примера 3 (108 мг; 0,19 ммоль), в дихлорметане (5 мл), и перемешивание продолжают в течение 18 ч. Реакционную смесь разбавляют дихлорметаном (20 мл), последовательно промывают 5%-ным водным раствором метабисульфита натрия (20 мл),10%-ным водным раствором карбоната калия(20 мл) и солевым раствором (15 мл), затем высушивают (МgSO4) и упаривают при пониженном давлении. Полученную пену желтого цвета очищают колоночной хроматографией на силикагеле, используя градиентное элюирование смесью дихлорметан:метанол: 0,880 водный аммиак (от 100:1:1 до 100:3:1), получая указанное в заголовке соединение (36 мг) в виде твердого вещества оранжевого цвета.(CDCl3): 1.00 (3H, t), 1.15 (3H, t), 1.79(1 Н, d), 8.80 (1 Н, s), 10.66 (1 Н, s). MCHP: m/z 582 (М+1)+. Подготовительный пример 1. Этиловый эфир 3-этил-1 Н-пиразол-5-карбоновой кислоты. Этанольный раствор этилата натрия (21 мас.%; 143 мл; 0,39 моль) в атмосфере азота добавляют по каплям к перемешиваемому охлажденному во льду раствору диэтилоксалата(59,8 мл; 0,44 моль) в абсолютном этаноле (200 мл) и полученный раствор перемешивают в течение 15 мин. Затем по каплям добавляют бутан-2-он (39 мл; 0,44 моль), охлаждение убирают, реакционную смесь перемешивают в течение 18 ч при комнатной температуре и затем в течение 6 ч при 40 С, после чего вновь применяют охлаждающую баню. Далее по каплям добавляют ледяную уксусную кислоту (25 мл; 0,44 моль), полученный раствор перемешивают в течение 30 мин при 0 С, по каплям добавляют гидразингидрат (20 мл; 0,44 моль), затем реакционную смесь оставляют нагреваться до комнатной температуры и поддерживают ее в течение 18 ч перед тем, как упарить при пониженном давлении. Остаток распределяют между дихлорметаном (300 мл) и водой (100 мл), далее отделяют органическую фазу, промывают водой(2 х 100 мл), высушивают (Na2SO4) и концентрируют при пониженном давлении, получая указанное в заголовке соединение (66,0 г).(CDCl3): 1.04 (3H, t), 1.16 (3H, t), 2.70(М+1)+. Подготовительный пример 2. 3-Этил-1 Нпиразол-5-карбоновая кислота. Водный раствор гидроксида натрия (10 М; 100 мл; 1,0 моль) добавляют по каплям к перемешиваемой суспензии соединения, указанного в заголовке подготовительного примера 1 (66,0 г; 0,39 моль), в метаноле, и полученный раствор кипятят с обратным холодильником в течение 4 ч. Охлажденную реакционную смесь концен 004315 10 трируют при пониженном давлении до объема приблизительно 200 мл, разбавляют водой (200 мл) и эту смесь промывают толуолом (3 х 100 мл). Полученную водную фазу подкисляют концентрированной соляной кислотой до рН 4,осадок собирают и высушивают вакуумотсосом, получая указанное в заголовке соединение (34,1 г).(ДMCOd6): 1.13 (3H, t), 2.56 (2 Н,q), 6.42 (1 Н, s). Подготовительный пример 3. 4-Нитро-3-нпропил-1 Н-пиразол-5-карбоновая кислота. Дымящую серную кислоту (17,8 мл) добавляют по каплям к перемешиваемой охлажденной во льду дымящей азотной кислоте (16,0 мл), полученный раствор нагревают до 50 С,затем порциями в течение 30 мин добавляют 3 н-пропил-1 Н-пиразол-5-карбоновую кислоту(Chem. Pharm. Bull., 1984, 32, 1568; 16,4 г; 0,106 моль), поддерживая температуру реакционной смеси ниже 60 С. Полученный раствор нагревают в течение 18 ч при 60 С, оставляют охлаждаться, затем выпивают на лед. Собирают белый осадок, промывают водой и высушивают вакуум-отсосом, получая указанное в заголовке соединение (15,4 г), т.пл. 170-172 С. Обнаружено: С 42,35; Н 4,56; N 21,07. С 7 Н 9N3O4 соответствует: С 42,21; Н 4,55; N 21,10%.(ДМСОd6): 0.90 (3H, t), 1.64 (2 Н, m),2.83 (2 Н, m), 14.00 (1 Н, s). Подготовительный пример 4. 3-Этил-4 нитро-1 Н-пиразол-5-карбоновая кислота. Получают из соединения, указанного в заголовке подготовительного примера 2, аналогично подготовительному примеру 3 в виде твердого вещества коричневой окраски (64%).(ДМСОd6): 1.18 (3H, t), 2.84 (2 Н, m),13.72 (1H, s). Подготовительный пример 5. 4-Нитро-3-нпропил-1 Н-пиразол-5-карбоксамид. Раствор соединения, указанного в заголовке подготовительного примера 3 (15,4 г; 0,077 моль), в тионилхлориде (75 мл) кипятят с обратным холодильником в течение 3 ч, и затем охлажденную реакционную смесь упаривают при пониженном давлении. Остаток азеотропно отгоняют с тетрагидрофураном (2 х 50 мл), затем суспендируют в тетрагидрофуране (50 мл), далее перемешиваемую суспензию охлаждают во льду и обрабатывают в течение 1 ч газообразным аммиаком. Добавляют воду (50 мл) и полученную смесь упаривают при пониженном давлении, получая твердое вещество, которое после растирания с водой и высушивания вакуумотсосом, дает указанное в заголовке соединение 11 Подготовительный пример 6. 3-Этил-4 нитро-1 Н-пиразол-5-карбоксамид. Получают из соединения, указанного в заголовке подготовительного примера 4, аналогично подготовительному примеру 5 в виде твердого вещества белого цвета (90%).(ДМСОd6): 1.17 (3H, t), 2.87 (2H, m), 7.40(М+1)+. Подготовительный пример 7. 4-Амино-3-нпропил-1 Н-пиразол-5-карбоксамид. Перемешиваемую смесь соединения, указанного в заголовке подготовительного примера 5 (10,0 г; 0,050 моль), 10%-ного палладия на угле (1,5 г) и этанола (400 мл) гидрируют в течение 18 ч при 345 кПа (50 фунт/кв.дюйм) и 50 С, затем фильтруют. Фильтрат объединяют с этанольной промывкой (200 мл) фильтра и далее упаривают при пониженном давлении, получая твердое вещество оранжевого цвета, которое в результате кристаллизации из смеси этилацетат: метанол дает указанное в заголовке соединение(6,8 г) в виде твердого вещества белого цвета,т.пл. 196-201 С. Обнаружено: С 48,96; Н 6,98; N 32,08. С 7 Н 12N4 О; 0,25 H2O соответствует: С 48,68; Н 7,30; N 32,44%.(ДМСОd6): 0.88 (3H, t), 1.55(2 Н, m), 2.46 (2 Н, t), 4.40 (2 Н, s), 7.00 (1 Н, s),7.12 (1 Н, s), 12.20 (1 Н, s). Подготовителный пример 8. 4-Амино-3 этил-1 Н-пиразол-5-карбоксамид. Получают из соединения, указанного в заголовке подготовительного примера 6, аналогично подготовительному примеру 7, в виде твердого вещества коричневой окраски (80%).(ДМСОd6): 1.08 (3H, t), 2.45 (2 Н, q), 4.50MCHP: m/z 155 (M+1)+. Подготовительный пример 9. 4-(2-н-Пропоксибензамидо)-3-н-пропил-1 Н-пиразол-5 карбоксамид. Раствор 2-н-пропоксибензоилхлорида (57,6 г; 0,291 моль) в дихлорметане (50 мл) добавляют по каплям к перемешиваемой охлажденной во льду суспензии соединения, указанного в заголовке подготовительного примера 7 (35,0 г; 0,208 моль), в безводном пиридине (350 мл), и полученную смесь перемешивают в течение 18 ч при комнатной температуре, затем упаривают при пониженном давлении. Остаток азеотропно отгоняют с толуолом (2 х 100 мл) и полученное твердое вещество коричневой окраски растирают с эфиром (100 мл), получая указанное в заголовке соединение (83,0 г) в виде твердого вещества бежевой окраски.(СН 3 ОНd4): 0.92 (3H, t), 1.14(3H, t), 1.65 12 Подготовительный пример 10. 3-Этил-4-(2 н-пропоксибензамидо)-1 Н-пиразол-5-карбоксамид. Получают из соединения, указанного в заголовке подготовительного примера 8, аналогично подготовительному примеру 9, в виде твердого вещества бежевой окраски (68%).(ДМСОd6): 0.93 (3H, t), 1.12 (3H, t), 1.86(M+1)+. Подготовительный пример 11. 4-(2-Этоксибензамидо)-3-н-пропил-1 Н-пиразол-5-карбоксамид. Получают из соединения, указанного в заголовке подготовительного примера 7, и 2 этоксибензоилхлорида аналогично подготовительному примеру 9, в виде твердого вещества белого цвета (64%), т.пл. 209-211 С. Обнаружено: С 60,73; Н 6,41; N 17,80. С 16 Н 20N4O3 соответствует: С 60,74; Н 6,37; N 17,71%.(ДМСОd6): 0.82 (3H, t), 1.42 (3H, t), 1.56(2 Н, m), 1.75 (2 Н, t), 4.27 (2 Н, q), 7.07 (1 Н, m),7.22 (2 Н, m), 7.52 (2 Н, m), 8.00 (1H,d), 10.40 (1H,s), 12.96 (1H, s). Подготовительный пример 12. 5-(2-нПропоксифенил)-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. трет-Бутилат калия (93,0 г; 0,832 моль) в атмосфере азота добавляют порциями к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 9 (83,0 г; 0,25 моль), в пропан-2-оле (800 мл), и смесь кипятят с обратным холодильником в течение 18 ч, затем оставляют охлаждаться. Добавляют воду (100 мл), получая гомогенный раствор,который подкисляют до рН 6 2M соляной кислотой. Полученный белый осадок собирают и высушивают вакуум-отсосом, получая указанное в заголовке соединение (37,4 г). Обнаружено: С 65,36; Н 6,49; N 17,99.[4,3-d]пиримидин-7-он. Получают из соединения, указанного в заголовке подготовительного примера 10, аналогично подготовительному примеру 12, в виде твердого вещества белого цвета (85%).(ДМСОd6): 0.95 (3H, t), 1.15 (3H, t), 1.72[4,3-d]пиримидин-7-он. Получают из соединения, указанного в заголовке подготовительного примера 11, аналогично подготовительному примеру 12, в виде твердого вещества белого цвета (88%), т.пл. 199-201 С. Обнаружено: С 64,44; Н 6,19; N 18,44.(1H, m), 7.50 (1H, m), 8.57 (1H, d), 11.36 (1 Н, s),11.88 (1 Н, s). Подготовительный пример 15. Алкилирование 5-(2-алкоксифенил)-3-алкил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-онов. Для N-алкилирования соединений, указанных в способах получения 12, 13 и 14, применяют пять общих методик, способы А-Е. В некоторых случаях в результате одной и той же реакции могут быть получены оба N1- и N2 изомера. Способ А. Алкилгалогенид (2,75 ммоль) добавляют в атмосфере азота к перемешиваемой суспензии пиразоло[4,3-d]пиримидинонового субстрата(2,5 ммоль) в 1 М водном растворе гидроксида натрия (7,25 ммоль) и реакционную смесь обрабатывают в течение 72 ч при 50 С, затем оставляют охлаждаться. Полученную смесь экстрагируют этилацетатом (2 х 25 мл) и объединенные экстракты высушивают (МgSO4) и упаривают при пониженном давлении, получая неочищенный продукт, который очищают колоночной хроматографией на силикагеле. Способ В. 60%-ную (мас./мас.) дисперсию гидрида натрия в минеральном масле (0,39 ммоль) добавляют в атмосфере азота к перемешиваемому охлажденному во льду раствору субстрата (0,39 ммоль) в безводном тетрагидрофуране (8 мл). Через 1 ч при 0 С добавляют алкилгалогенид(0,43 ммоль) и реакционную смесь нагревают в течение 24 ч при 45 С, затем оставляют охлаждаться. Полученную смесь упаривают при пониженном давлении, и остаток распределяют между этилацетатом (40 мл) и солевым раствором (30 мл). Органическую фазу отделяют, высушивают (MgSO4) и упаривают при пониженном давлении, что позволяет получить неочищенный продукт, который очищают колоночной хроматографией на силикагеле. Способ С. 2 М раствор бис(триметилсилил)амида натрия в тетрагидрофуране (2,2 ммоль) в атмосфере азота добавляют по каплям к перемешиваемому охлажденному во льду раствору субстрата(2 ммоль) в безводном тетрагидрофуране (8 мл) и раствор перемешивают в течение 1 ч при 0 С,перед тем как охладить до -70 С. Затем добав 004315 14 ляют алкилгалогенид (2 ммоль), охлаждение убирают и полученный раствор перемешивают в течение 24 ч при комнатной температуре, затем упаривают при пониженном давлении. Остаток распределяют между этилацетатом (40 мл) и водным раствором бикарбоната натрия (30 мл),органическую фазу отделяют, высушивают(MgSO4) и упаривают при пониженном давлении, получая неочищенный продукт, который очищают колоночной хроматографией на силикагеле. С другой стороны, может быть применен 0,5 М раствор бис(триметилсилил)амида калия в толуоле с безводным толуолом в качестве растворителя, и в этом случае алкилирование осуществляют при температуре приблизительно 40 С в течение 20 ч. Способ D. Раствор субстрата (4,8 ммоль), алкилгалогенида (4,8 ммоль) и Aliquat (ТМ) 336 (150 мг) в дихлорметане (80 мл) в атмосфере азота добавляют к перемешиваемому 1 М водному раствору гидроксида натрия (15 ммоль). Двухфазную смесь энергично перемешивают в течение 72 ч при комнатной температуре, затем водную фазу отделяют и экстрагируют этилацетатом (2 х 25 мл). Экстракты объединяют с органической фазой и этот раствор высушивают (MgSO4) и упаривают при пониженном давлении, получая неочищенный продукт, который очищают колоночной хроматографией на силикагеле. Способ Е. Трифенилфосфин (1,77 ммоль) и алканол(1,77 ммоль) добавляют к перемешиваемому раствору субстрата (1,60 ммоль) в безводном тетрагидрофуране (10 мл). Полученный раствор охлаждают до -5 С и по каплям добавляют диэтилазодикарбоксилат (1,77 ммоль), затем реакционную смесь оставляют нагреваться до комнатной температуры, перемешивают в течение 18 ч и упаривают при пониженном давлении. Остаток распределяют между этилацетатом (30 мл) и водой (30 мл), далее органическую фазу отделяют, объединяют с этилацетатным экстрактом (50 мл) водной фазы, высушивают(Na2SО 4) и упаривают при пониженном давлении, получая неочищенный продукт, который очищают колоночной хроматографией на силикагеле. Подготовительный пример 16. 3-Этил-5-(2 н-пропоксифенил)-1-(пиридин-2-ил)метил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (15%) из соединения, указанного в заголовке подготовительного примера 13, и 2-хлорметилпиридина, используя методику из подготовительного примера 15 В.(CDCl3): 1.18 (3H, t), 1.43 (3H, t), 2.00 15 Подготовительный пример 17. 5-(2-нПропоксифенил)-3-н-пропил-1-(пиридин-2-ил) метил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (22%) из соединения, указанного в заголовке подготовительного примера 12, и 2-хлорметилпиридина, используя методику из подготовительного примера 15D.(CDCl3): 1.01 (3H, t), 1.17 (3H, t), 1.90(1 Н, d), 11.20 (1 Н, s). MCHP: m/z 404 (M+1)+. Подготовительный пример 18. 3-Этил-5-(2 н-пропоксифенил)-2-(пиридин-2-ил)метил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (22%) из соединения, указанного в заголовке подготовительного примера 13, и 2 хлорметилпиридина, используя методику из подготовительного примера 15 В. Выход в 43% может быть достигнут с использованием методики из подготовительного примера 15 С.(CDCl3): 1.12 (3H, t), 1.30 (3H, t), 1.99MCHP: m/z 390 (M+1)+. Подготовительный пример 19. 5-(2 Этоксифенил)-3-н-пропил-2-(пиридин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин 7-он. Получают в виде пены белого цвета (59%) из соединения, указанного в заголовке подготовительного примера 14, и 2-хлорметилпиридина, используя методику из подготовительного примера 15 В.(СDСl3): 0.98 (3H, t), 1.60 (3H, t), 1.76(1 Н, s). MCHP: m/z 390 (M+1)+. Подготовительный пример 20. 5-(2-нПропоксифенил)-3-н-пропил-2-(пиридин-2-ил) метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (54%) из соединения, указанного в заголовке подготовительного примера 12, и 2-хлорметилпиридина, используя методику из подготовительного примера 15 В.(CDCl3): 0.98 (3H, t), 1.16 (3H, t), 1.77 16 метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены кремовой окраски(32%) из соединения, указанного в заголовке подготовительного примера 12, и 3-хлорметилпиридина, используя методику из подготовительного примера 15 В.(CDCl3): 0.98 (3H, t), 1.14(3H, t), 1.78(2 Н,m), 2.00 (2 Н, m), 2.92 (2 Н, t). 4.19 (2 Н, t), 5.58(2 Н, s), 7.04 (1H,d), 7.14 (1 Н, m), 7.24 (1 Н, m),7.43 (1 Н, m), 7.48 (1 Н, m), 8.40 (1 Н, d), 8.59 (2 Н,m), 10.91 (1 Н, s). MCHP: m/z 404 (M+1)+. Подготовительный пример 22. 4-(2-Фенилэтенил)пиридазин. Хлорид цинка (820 мг; 6 ммоль) добавляют к перемешиваемой смеси бензальдегида (6,11 мл; 60 ммоль) и 4-метилпиридазина (2,83 г; 30 ммоль) и полученную смесь нагревают в течение 20 ч при 150 С. Охлажденную реакционную смесь распределяют между дихлорметаном (40 мл) и 2 М водным раствором гидроксида натрия(20 мл), затем органическую фазу отделяют,объединяют с дихлорметановым экстрактом (80 мл) водной фазы, высушивают (Na2SO4) и упаривают при пониженном давлении. Оставшееся масло бледно-коричневой окраски очищают колоночной хроматографией на силикагеле, используя смесь дихлорметан:метанол (99:1) в качестве элюента и получая указанное в заголовке соединение (3,65 г) в виде твердого вещества бледно-коричневой окраски. Обнаружено: С 78,95; Н 5,52; N 15,39.(2 Н, m), 9.12 (1 Н, d), 9.30 (1 Н, s). MCHP: m/z 183 (М+1)+. Подготовительный пример 23. 3-(2-Фенилэтенил)пиридазин. Получают в виде твердого вещества (59%) из 3-метилпиридазина, используя методику из подготовительного примера 22.(CDCl3): 7.12 (1 Н, d), 7.34 (3H, m), 7.56(2 Н, d), 7.72 (1 Н, d), 8.37 (1 Н, s), 8.50 (1 Н, s),8.60 (1 Н, s). MCHP: m/z 183 (M+1)+. Подготовительный пример 24. 4-(2-Фенилэтенил)пиримидин. Получают в виде твердого вещества (77%) из 4-метилпиримидина, используя методику из подготовительного примера 22.(CDCl3): 7.06(1 Н, d), 7.36 (4 Н, m), 7.58 (2 Н, m), 7.92 (1 Н, d),8.69 (1 Н, d), 9.14 (1 Н, s). Подготовительный пример 25. 4-Гидроксиметилпиридазин. Через перемешиваемый раствор соединения, указанного в заголовке подготовительного примера 22 (3,60 г; 0,02 моль), в метаноле(150 мл) при -10 С барботируют озон. Через 30 мин смесь очищают азотом, порциями добавляют боргидрид натрия (750 мг; 0,02 моль) и полученный раствор перемешивают в течение 2 ч 17 при комнатной температуре. Реакционную смесь подкисляют 2 М соляной кислотой, затем подщелачивают 0,880 водным раствором аммиака и упаривают при пониженном давлении. Очистка остатка колоночной хроматографией на силикагеле с градиентным элюированием смесью дихлорметан: метанол (от 98:2 до 96:4) дает указанное в заголовке соединение (1,64 г) в виде твердого вещества рыжевато-коричневой окраски. Обнаружено: С 54,26; Н 5,42; N 25,01.(М+1)+. Подготовительный пример 26. 3-Гидроксиметилпиридазин. Получают в виде твердого вещества (76%) из соединения, указанного в заголовке подготовительного примера 23, используя методику из подготовительного примера 25.(CDCl3): 3.66 (1 Н, s), 4.92 (2 Н, s), 7.48(2 Н, m), 9.06 (1H, d). Подготовительный пример 27. 4-Гидроксиметилпиримидин. Получают в виде твердого вещества желтого цвета (83%) из соединения, указанного в заголовке подготовительного примера 24, используя методику из подготовительного примера 25.(CDCl3): 2.88 (1 Н, s), 4.78 (2 Н, s), 7.36(1 Н, d), 8.72 (1H, d), 9.18 (1H, s). Подготовительный пример 28. 3-Хлорметилпиридазина гидрохлорид. К охлажденной во льду колбе, содержащей соединение, указанное в заголовке подготовительного примера 26 (920 мг, 8 ммоль), добавляют тионилхлорид (3,05 мл, 42 ммоль) и реакционную смесь перемешивают в течение 45 мин при комнатной температуре, затем упаривают при пониженном давлении. Остаток азеотропно отгоняют с толуолом (40 мл), получая неочищенное указанное в заголовке соединение (1,4 г) в виде твердого вещества коричневой окраски,степени чистоты которого достаточно для получения свободного основания, необходимого для проведения последующих реакций алкилирования.(ДМСОd6): 4.98 (2 Н, s), 7.80 (1H, m), 7.90(1 Н, d), 8.19 (1H, s), 9.22 (1H, d). Подготовительный пример 29. 3-Этил-5-(2 н-пропоксифенил)-2-(пиридазин-3-ил)метил 2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. Получают в виде пены (28%) из соединений, указанных в заголовках подготовительных примеров 13 и 28 (свободное основание), используя методику из подготовительного примера 15 С.(М+1)+. Подготовительный пример 30. 5-(2-н-пропоксифенил)-3-н-пропил-2-(пиридазин-3-ил) метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены кремовой окраски(25%) из соединений, указанных в заголовках подготовительных примеров 12 и 28 (свободное основание), используя методику из подготовительного примера 15 С.(CDCl3): 0.93 (3H, t), 1.10 (3H, t), 1.73MCHP: m/z 405 (M+1)+. Подготовительный пример 31. 5-(2-н-Пропоксифенил)-3-н-пропил-2-(пиридазин-4-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин 7-он. Получают в виде смолы (13%) из соединений, указанных в заголовках подготовительных примеров 12 и 25, используя методику из подготовительного примера 15 Е. Обнаружено: С 65,19; Н 5,99; N 20,69. С 22 Н 24N6O2 соответствует: С 65,33; Н 5,98; N 20,78%.(CDCl3): 0.99 (3H, t), 1.13 (3H, t), 1.85(1 Н, s), 11.29 (1 Н, s). MCHP: m/z 405 (M+1)+. Подготовительный пример 32. 5-(2-н-Пpoпoкcифeнил)-3-н-пpoпил-2-(пиpимидин-4-ил) мeтил-2,6-дигидpo-7H-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (9%) из соединений, указанных в заголовках подготовительных примеров 12 и 27, используя методику из подготовительного примера 15 Е.(CDCl3): 0.96 (3H, t), 1.12 (3H, t), 1.76[4,3-d]пиpимидин-7-oн. Получают в виде пены желтого цвета(40%) из соединения, указанного в заголовке подготовительного примера 12, и 2,4-дихлор 5 хлорметилпиримидина (Annalen, 1966, 692,119), используя методику из подготовительного примера 15 В.(CDCl3): 0.97 (3H, t), 1.07 (3H, t), 1.80MCHP: m/z 474 (M+1)+. Подготовительный пример 34. 5-(2-н-Пропоксифенил)-3-н-пропил-2-(пиримидин-5-ил) метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Соединение, указанное в заголовке подготовительного примера 33 (523 мг; 1,1 ммоль),добавляют к раствору триэтиламина (3,0 мл; 21,5 ммоль) в этаноле (25 мл) с последующим добавлением 10%-ного палладия на угле (150 мг); смесь гидрируют в течение 1 ч при 276 кПа(40 фунт/кв.дюйм) и комнатной температуре,затем фильтруют. Фильтрат объединяют с этанольной промывкой (50 мл) фильтра и затем упаривают при пониженном давлении. Остаток суспендируют в воде (15 мл) и смесь экстрагируют этилацетатом (50 мл), затем экстракт высушивают (Nа 2SO4) и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь дихлорметан: метанол (98:2) в качестве элюента, что позволяет получить указанное в заголовке соединение (243 мг) в виде пены кремовой окраски.(CDCl3): 0.96 (3H, t), 1.06 (3H, t), 1.79(1H, s). MCHP: m/z 405 (M+1)+. Подготовительный пример 35. 3-Этил-5-(2 н-пропоксифенил)-2-(пиразин-2-ил)метил-2,6 дигидро-7H-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены (46%) из соединения, указанного в заголовке подготовительного примера 13, и 2-хлорметилпиразина (J. Оrg.Chem., 1973, 38, 2049), используя методику из подготовительного примера 15 В.(CDCl3): 1.08 (3H, t), 1.34 (3H, t), 1.96m/z 391 (M+1)+. Подготовительный пример 36. 5-(2-н-Пропоксифенил)-3-н-пропил-2-(пиразин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин 7-он. Получают в виде пены кремовой окраски(25%) из соединения, указанного в заголовке подготовительного примера 12, и 2-хлорметилпиразина (J. Оrg. Chem., 1973, 38, 2049), используя методику из подготовительного примера 15 В.(CDCl3): 0.97 (3H, t), 1.08(3H, t), 1.78(2H,m), 1.98 (2H, m), 2.99 (2 Н, t), 4.16 (2H, t), 5.66 20 Подготовительный пример 37. 4-(2-Этоксибензамидо)-3-метил-1 Н-пиразол-5-карбоксамид. Получают из 4-амино-3-метил-1 Н-пиразол-5-карбоксамида (J. Оrg. Chem., 1956, 21,833) и 2-этоксибензоилхлорида аналогично подготовительному примеру 9, в виде порошка белого цвета (83%).(ДМСОd6): 1.44(3H, t), 2.28 (3H, s), 4.28m/z 289 (М+1)+. Подготовительный пример 38. 4-(2-Метоксибензамидо)-3-н-пропил-1 Н-пиразол-5-карбоксамид. Получают из соединения, указанного в заголовке подготовительного примера 7, и 2 метоксибензоилхлорида аналогично подготовительному примеру 9, в виде порошка белого цвета (55%).(ДМСОd6): 0.84 (3H, t), 1.55 (2 Н, m), 2.79[4,3-d]пиримидин-7-он. Получают из соединения, указанного в заголовке подготовительного примера 37, аналогично подготовительному примеру 12, в виде твердого вещества белого цвета (92%).(ДМСОd6): 1.30 (3H, t), 2.40 (3H, s), 4.12[4,3-d]пиримидин-7-он. Получают из соединения, указанного в заголовке подготовительного примера 38, аналогично подготовительному примеру 12, в виде твердого вещества белого цвета (71%).(ДМСОd6): 0.92 (3H, t), 1.76 (2 Н, m), 2.80(2 Н, t), 3.85 (3H, s), 7.08 (1 Н, m), 7.17 (1 Н, d),7.49 (1 Н, m), 7.64 (1 Н, d), 11.47-11.94 (1 Н, br),13.69-13.94 (1 Н, br). MCHP: m/z 285 (М+1)+. Подготовительный пример 41. 5-(2-Метоксифенил)-3-н-пропил-1-(пиридин-2-ил)метил 1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. Получают в виде твердого кристаллического вещества белого цвета (38%) из соединения, указанного в заголовке подготовительного примера 40, и 2-хлорметилпиридина, используя методику из подготовительного примера 15D. Обнаружено: С 67,00; Н 5,60; N 18,49.(1 Н, d), 7.16 (2H, m), 7.47 (1 Н, m), 7.59 (1 Н, m),8.48 (1 Н, d), 8.58 (1 Н, d), 10.88 (1 Н, s). Подготовительный пример 42. 5-(2-Этоксифенил)-3-метил-2-(пиридин-2-ил)метил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (21%) из соединения, указанного в заголовке подготовительного примера 39, и 2-хлорметилпиридина, используя методику из подготовительного примера 15 В. Обнаружено: С 65,30; Н 5,08; N 18,79.(2 Н, q), 5.66 (2 Н, s), 7.08 (3H, m), 7.20 (1 Н, m),7.44 (1 Н, m), 7.62 (1 Н, m), 8.42 (1 Н, d), 8.59 (1 Н,d), 10.88 (1 Н, s). MCHP: m/z 362 (M+1)+. Подготовительный пример 43. 5-(2-Метоксифенил)-3-н-пропил-2-(пиридин-2-ил)метил 2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. Получают в виде твердого кристаллического вещества белого цвета (29%) из соединения, указанного в заголовке подготовительного примера 40, и 2-хлорметилпиридина, используя методику из подготовительного примера 15 В. Обнаружено: С 66,93; Н 5,61; N 18,61.MCHP: m/z 376 (М+1)+. Подготовительный пример 44. 5-[5-(4-третБутоксикарбонилпиперазин-1-илсульфонил)2-н-пропоксифенил]-3-н-пропил-2-(пиридин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде твердого вещества (60%) из соединения, указанного в заголовке подготовительного примера 20, и 1-трет-бутоксикарбонилпиперазина, используя методику из примера 1.(CDCl3): 0.96 (3H, t), 1.15 (3H, t), 1.40(1 Н, m), 7.82 (1 Н, d), 8.58 (1 Н, d), 8.78 (1 Н, s),10.60 (1 Н, s). MCHP: m/z 652 (M+1)+. Подготовительный пример 45. 3-Метокси 2-метилпиридин. Перемешиваемый раствор 3-гидрокси-2 метилпиридина (1,0 г; 9,2 ммоль), фенилтриметиламмония бромида (2,2 г; 11 ммоль) и метилата натрия (550 мг; 11 ммоль) в диметилформамиде (10 мл) кипятят с обратным холодильником в течение 3 ч, затем охлажденную реакционную смесь промывают водой (40 мл) и экстрагируют эфиром (3 х 40 мл). Объединенные экстракты высушивают (Na2SO4) и упаривают при пони 004315 22 женном давлении, затем остаток очищают колоночной хроматографией на силикагеле, используя смесь гексан:этилацетат (1:1) в качестве элюента и получая указанное в заголовке соединение (190 мг) в виде твердого вещества.(CDCl3): 2.34 (3H, s), 3.68 (3H, s), 6.93(2 Н, m), 7.94 (1 Н, d). MCHP: m/z 124 (M+1)+. Подготовительный пример 46. 2-Хлорметил-3-метоксипиридин. Соединение, указанное в заголовке подготовительного примера 45 (190 мг; 1,5 ммоль),добавляют к перемешиваемому раствору бензамида (5 мг; 0,4 ммоль) в дихлорметане (2 мл) и смесь нагревают до температуры дефлегмации. Порциями добавляют трихлоризоциануровую кислоту (190 мг; 0,82 ммоль), затем реакционную смесь перемешивают при температуре дефлегмации в течение 3 ч, оставляют охлаждаться и обрабатывают водой (2 мл) и 50%-ным водным раствором гидроксида калия (3 мл). Отделенную водную фазу промывают дихлорметаном (3 х 10 мл), объединенные органические растворы высушивают (Na2SO4) и упаривают при пониженном давлении, получая указанное в заголовке соединение (180 мг) в виде бесцветного масла.(CDCl3): 3.91 (3H, s), 4.76 (2 Н, s), 7.25(2 Н, m), 8.20 (1 Н, d). MCHP: m/z 158 (М+1)+. Подготовительный пример 47. 1-(3-Метоксипиридин-2-ил)метил-5-(2-н-пропоксифенил)3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (4%) из соединений, указанных в заголовках подготовительных примеров 12 и 46, используя методику из подготовительного примера 15 В.(CDCl3): 0.98 (3H, t), 1.12 (3H, t), 1.83(2H,m), 1.97(2H, m), 2.92 (2 Н, t), 3.80 (3H, s), 4.16(2 Н, t), 5.96 (2 Н, s), 7.00 (1H,d), 7.10 (3H, m),7.41 (1 Н, m), 8.01 (1 Н, d), 8.48 (1 Н, d), 11.08 (1 Н,s). MCHP: m/z 434 (M+1)+. Подготовительный пример 48. 2-(3-Метоксипиридин-2-ил)метил-5-(2-н-пропоксифенил)3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде твердого вещества белого цвета (78%) из соединений, указанных в заголовках подготовительных примеров 12 и 46,используя методику из подготовительного примера 15 В.(CDCl3): 0.98 (3H, t), 1.06 (3H, t), 1.78 23 Получают в виде твердого вещества белого цвета (78%) из соединения, указанного в заголовке подготовительного примера 12, и 2 бромметил-6-пивалоиламинопиридина (Chem.Lett., 1995, 61), используя методику из подготовительного примера 15 В.(CDCl3): 0.99 (3H, t), 1.12 (3H, t), 1.36[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (12%) из соединения, указанного в заголовке подготовительного примера 12, и 2 бромметил-6-пивалоиламинопиридина (Chem.Lett., 1995, 61), используя методику из подготовительного примера 15 В.(CDCl3): 1.00 (3H, t), 1.16 (3H, t), 1.32m/z 503 (M+1)+. Подготовительный пример 51. 1-(1-Метилимидазол-2-ил)метил-5-(2-н-пропоксифенил)3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде твердого вещества белого цвета (21%) из соединения, указанного в заголовке подготовительного примера 12, и свободного основания 2-хлорметил-1-метилимидазола гидрохлорида (J. Chem. Soc., 1957,3305), используя методику из подготовительного примера 15 В.(CDCl3): 1.00 (3H, t), 1.18(3H, t), 1.86 (2H,m), 2.02 (2 Н, m), 2.92 (2 Н, t), 3.70 (3H, s), 4.19MCHP: m/z 407 (M+1)+. Подготовительный пример 52. 2-(1-Meтилимидaзoл-2-ил)мeтил-5-(2-н-пpoпoкcифeнил)3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде твердого вещества белого цвета (18%) из соединения, указанного в заголовке подготовительного примера 12, и свободного основания 2-хлорметил-1-метилимидазола гидрохлорида (J. Chem. Soc., 1957, 3305), используя методику из подготовительного примера 15 В.(CDCl3): 0.98 (3H, t), 1.14 (3H, t), 1.75 24 Подготовительный пример 53. 1-(3,5-Диметилизоксазол-4-ил)метил-5-(2-н-пропоксифенил)3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде твердого вещества белого цвета (44%) из соединения, указанного в заголовке подготовительного примера 12, и 4 хлорметил-3,5-диметилизоксазола,используя методику из подготовительного примера 15D. Обнаружено: С 65,40; Н 6,47; N 16,53. С 23 Н 27N5O3 соответствует: С 65,54; Н 6,49; N 16,62%.(CDCl3): 1.02 (3H, t), 1.17 (3H, t), 1.86(1H, s). MCHP: m/z 422 (М+1)+. Подготовительный пример 54. 5-(2-Этоксифенил)-3-метил-1-(3,5-диметилизоксазол-4 ил)метил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (72%) из соединения, указанного в заголовке подготовительного примера 39, и 4-хлорметил-3,5-диметилизоксазола, используя методику из подготовительного примера 15 А. Обнаружено: С 63,19; Н 5,55; N 18,30. С 20 Н 21N5O3 соответствует: С 63,31; Н 5,58; N 18,46%.(CDCl3): 1.64 (3H, t), 2.34 (3H, s), 2.52[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (16%) из соединения, указанного в заголовке подготовительного примера 12, и 4 хлорметил-3,5-диметилизоксазола, используя методику из подготовительного примера 15D. Обнаружено: С 64,88; Н 6,41; N 16,33. С 23 Н 27N5O3 соответствует: С 65,54; Н 6,49; N, 16,62%.(CDCl3): 1.00 (3H, t), 1.14 (3H, t), 1.78(1H, s). MCHP: m/z 422 (M+1)+. Подготовительный пример 56. 1-(2-Метилтиазол-4-ил)метил-5-(2-н-пропоксифенил)-3-нпропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде порошка белого цвета(30%) из соединения, указанного в заголовке подготовительного примера 12, и свободного основания 4-хлорметил-2-метилтиазола гидрохлорида, используя методику из подготовительного примера 15D.MCHP: m/z 424 (M+1)+. Подготовительный пример 57. 5-(2-Этоксифенил)-3-метил-2-(2-метилтиазол-4-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин 7-он. Получают в виде твердого вещества белого цвета (22%) из соединения, указанного в заголовке подготовительного примера 39, и свободного основания 4-хлорметил-2-метилтиазола гидрохлорида, используя методику из подготовительного примера 15 В. Обнаружено: С 59,47; Н 4,95; N 18,10. C19H19N5O2S соответствует: С 59,83; Н 5,02; N 18,36%.(CDCl3): 1.58 (3H, t),2.65 (3H, s), 2.69 (3H, s), 4.28 (2 Н, q), 5.60 (2 Н,s), 6.90 (1 Н, s), 7.04 (1 Н, d), 7.13 (1 Н, m), 7.44(1 Н, m), 8.42 (1 Н, d), 10.85 (1 Н, s). MCHP: m/z 382 (M+1)+. Подготовительный пример 58. 2-(2-Метилтиазол-4-ил)метил-5-(2-н-пропоксифенил)-3-нпропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде порошка белого цвета(10%) из соединения, указанного в заголовке подготовительного примера 12, и свободного основания 4-хлорметил-2-метилтиазола гидрохлорида, используя методику из подготовительного примера 15D. Обнаружено: С 61,90; Н 6,04; N 15,95.(1 Н, s). MCHP: m/z 424 (M+1)+. Подготовительный пример 59. 1-(1-Метил 1,2,4-триазол-5-ил)метил-5-(2-н-пропоксифенил)-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (31%) из соединения, указанного в заголовке подготовительного примера 12, и свободного основания 5-хлорметил-1-метил-1,2,4 триазола гидрохлорида (J. Antibiotics, 1993, 46,1866), используя методику из подготовительного примера 15 В.(CDCl3): 1.00 (3H, t), 1.18 (3H,t), 1.86 (2 Н,m), 2.02 (2 Н, m), 2.94 (2 Н, t), 3.98 (3H, s), 4.20 26 нил)-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3d]пиримидин-7-он. Получают в виде бесцветной пены (25%) из соединения, указанного в заголовке подготовительного примера 12, и свободного основания 5-хлорметил-1-метил-1,2,4-триазола гидрохлорида (J. Antibiotics, 1993, 46, 1866), используя методику из подготовительного примера 15 В.(CDCl3): 1.00 (3H, t), 1.14 (3H, t), 1.80(1 Н, s). MCHP: m/z 408 (M+1)+. Подготовительный пример 61. 1-(2 Метоксиэтил)-1,2,4-триазол. 2-Бромэтилметиловый эфир (6,7 мл; 0,072 моль) добавляют к перемешиваемой охлажденной во льду суспензии 1,2,4-триазола (5,0 г; 0,072 моль) и карбоната калия (10 г; 0,072 моль) в ацетоне (50 мл). Через следующие 3 ч охлаждающую баню удаляют и перемешивание продолжают в течение 18 ч при комнатной температуре. Реакционную смесь фильтруют, фильтрат упаривают при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя смесь дихлорметан:метанол (95:5) в качестве элюента и получая указанное в заголовке соединение (5,2 г) в виде прозрачного масла.(CDCl3): 3.32 (3H, s), 3.74 (2 Н, t), 4.34(M+1)+. Подготовительный пример 62. 5-Гидроксиметил-1-(2-метоксиэтил)-1,2,4-триазол. Раствор соединения, указанного в заголовке подготовительного примера 61 (4,3 г; 0,034 моль), в 40%-ном водном растворе формальдегида (5 мл; 0,098 моль) нагревают при 140 С в течение 18 ч в герметичном сосуде. Охлажденную реакционную смесь упаривают при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, используя смесь дихлорметан:метанол (97:3) в качестве элюента и получая указанное в заголовке соединение (87%) в виде масла.(CDCl3): 3.30 (3H, s), 3.76 (2 Н, t), 4.08(1 Н, s), 4.41 (2 Н, t), 4.78 (2 Н, s), 7.85 (1 Н, s). m/z 158 (М+1)+. Подготовительный пример 63. 5-Хлорметил-1-(2-метоксиэтил)-1,2,4-триазола гидрохлорид соединение, указанное в заголовке подготовительного примера 62 (3,5 г; 0,022 моль), добавляют по каплям к перемешиваемому охлажденному во льду тионилхлориду (10 мл), охлаждающую баню затем убирают. Реакционную смесь перемешивают при комнатной температуре в течение 5 ч и затем упаривают при пониженном давлении. Азеотропная отгонка остатка с толуолом (50 мл) дает указанное в заголовке соединение (4,6 г) в виде масла желтого цвета.(2 Н, t), 5.15 (2 Н, s), 8.40 (1 Н, s), 10.09 (1H, s). Подготовительный пример 64. 1-[1-(2 Метоксиэтил)-1,2,4-триазол-5-ил]метил-5-(2-нпропоксифенил)-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (30%) из соединения, указанного в заголовке подготовительного примера 12, и свободного основания соединения, указанного в заголовке подготовительного примера 63, используя методику из подготовительного примера 15 В.(CDCl3): 1.00 (3H, t), 1.16 (3H, t), 1.86(М+1)+. Подготовительный пример 65. 2-[1-(2 Метоксиэтил)-1,2,4-триазол-5-ил]метил-5-(2-нпропоксифенил)-3-н-пропил-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (20%) из соединения, указанного в заголовке подготовительного примера 12, и свободного основания соединения, указанного в заголовке подготовительного примера 63, используя методику из подготовительного примера 15 В.(CDCl3): 1.03 (3H, t), 1.13 (3H, t), 1.83(M+1)+. Подготовительный пример 66. 1-(4-Метил 1,2,4-триазол-3-ил)метил-5-(2-н-пропоксифенил)-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (34%) из соединения, указанного в заголовке подготовительного примера 12, и свободного основания 3-хлорметил-4-метил-1,2,4 триазола гидрохлорида (Chem. Pharm. Bull.,1994, 42, 85), используя методику из подготовительного примера 15 В.(CDCl3): 1.00 (3H, t), 1.18(3H, t), 1.85 (2 Н,m), 2.03 (2 Н, m), 2.92 (2 Н, t), 3.73 (3H, s), 4.20(2 Н, t), 6.05 (2 Н, s), 7.06 (1 Н, d), 7.16 (1 Н, m),7.48 (1 Н, m), 8.10 (1 Н, s), 8.50 (1 Н, d), 11.28 (1 Н,s). MCHP: m/z 408 (M+1)+. Подготовительный пример 67. 1-(1,2,4 Оксадиазол-3-ил)метил-5-(2-н-пропоксифенил)3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества беловатой окраски (24%) из соединения, указанного в заголовке подготовительного примера 12, и 3 хлорметил-1,2,4-оксадиазола, используя методику из подготовительного примера 15D.(CDCl3): 1.02 (3H, t), 1.18(3H, t), 1.88 (2 Н,m), 2.00 (2 Н, m), 2.97 (2 Н, t), 4.19 (2 Н, t), 6.02m/z 395 (M+1)+. Подготовительный пример 68. 2-Бензилоксикарбонилметил-5-(2-н-пропоксифенил)-3-нпропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества желтого цвета (45%) из соединения, указанного в заголовке подготовительного примера 12, и бензилбромацетата, используя методику из подготовительного примера 15 В.(CDCl3): 1.00 (3H, t), 1.14(3H, t), 1.81 (2 Н,m), 2.00 (2 Н, m), 2.89 (2 Н, t), 4.18 (2 Н, t), 5.17(1H, s). Подготовительный пример 69. 2-Карбоксиметил-5-(2-н-пропоксифенил)-3-н-пропил 2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. 10%-ный Палладий на угле (20 мг) добавляют к раствору соединения, указанного в заголовке подготовительного примера 68 (207 мг; 0,45 ммоль), в этилацетате (25 мл) и смесь перемешивают в атмосфере водорода при 138 кПа(20 фунт/кв.дюйм) в течение 20 ч и затем фильтруют. Упаривание фильтрата при пониженном давлении позволяет получить указанное в заголовке соединение (95%) в виде порошка желтого цвета.(ДМСОd6): 0.93 (6 Н, m), 1.71 (4 Н, m),2.84 (2 Н, t), 4.03 (2 Н, t), 5.21 (2 Н, s), 7.09 (1H,m), 7.16 (1 Н, d), 7.48 (1 Н, m), 7.69 (1 Н, d), 11.52(1 Н, s). MCHP: m/z 371 (М+1)+. Подготовительный пример 70. N-третБутоксикарбонил-N'-2-[5-(2-н-пропоксифенил)-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3d]пиримидин-7-он-2-ил]ацетилгидразин. Оксалилхлорид (0,33 мл; 3,8 ммоль) добавляют по каплям к перемешиваемой охлажденной во льду суспензии соединения, указанного в заголовке подготовительного примера 69(0,70 г; 1,9 ммоль), в дихлорметане (7 мл) с последующим добавлением диметилформамида (2 капель), охлаждение убирают и реакционную смесь перемешивают при комнатной температуре в течение 2 ч, затем упаривают при пониженном давлении. Азеотропная отгонка остатка с дихлорметаном (30 мл) дает требуемый ацилхлорид в виде твердого вещества желтого цвета. Это промежуточное соединение добавляют к перемешиваемому раствору трет-бутилкарбазата (0,25 г; 1,9 ммоль) и триэтиламина (0,40 мл; 2,8 ммоль) в дихлорметане (10 мл) и смесь перемешивают при комнатной температуре в течение 2 ч, затем промывают 5%-ным водным раствором лимонной кислоты (20 мл). Водные промывки экстрагируют дихлорметаном (50 мл), объединенные органические растворы высушивают (MgSO4) и упаривают при понижен 29 ном давлении. Очистка остатка колоночной хроматографией с использованием градиентного элюирования смесью гексан:этилацетат (от 1:1 до 1:2) дает указанное в заголовке соединение (0,29 г) в виде твердого вещества оранжевого цвета.(CDCl3): 1.06 (3H, t), 1.15 (3H, t), 1.44(9H, s), 1.88 (2H, m), 2.00 (2 Н, m), 3.02 (2 Н, t),4.17 (2 Н, t), 5.20 (2 Н, s), 6.59 (1 Н, s), 7.04 (1 Н, d),7.12 (1 Н, m), 7.44 (1 Н, m), 8.40 (1 Н, d), 8.72 (1 Н,s), 10.96 (1 Н, s). MCHP: m/z 485 (M+1)+. Подготовительный пример 71. N-2-[5-(2 н-Пропоксифенил)-3-н-пропил-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он-2-ил]ацетил гидразина гидрохлорид. Перемешиваемый охлажденный во льду раствор соединения, указанного в заголовке подготовительного примера 70 (0,28 г; 0,58 ммоль), в дихлорметане (5 мл) насыщают хлористым водородом и вслед за этим охлаждение убирают. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, затем упаривают при пониженном давлении, получая указанное в заголовке соединение (0,22 г) в виде твердого вещества желтого цвета.(ДМСОd6): 0.95 (6 Н, m), 1.72 (4 Н, m),2.89 (2 Н, t), 4.02 (2 Н, t), 5.28 (2 Н, s), 7.06 (1 Н,m), 7.16 (1 Н, d), 7.48 (1H, m), 7.68 (1 Н, d), 11.58(2 Н, s). MCHP: m/z 385 (M+1)+. Подготовительный пример 72. 2-(3-Метил 1,2,4-триазол-5-ил)метил-5-(2-н-пропоксифенил)-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3d]пиримидин-7-он. Раствор метилата натрия (62 мг; 1,16 ммоль) в этаноле (2 мл) добавляют к перемешиваемому раствору ацетамидина гидрохлорида(82 мг; 0,87 ммоль) в этаноле и смесь перемешивают при комнатной температуре в течение 45 мин. Затем метилат натрия (30 мг; 0,58 ммоль) добавляют к перемешиваемой суспензии соединения, указанного в заголовке подготовительного примера 71 (220 мг; 0,58 ммоль), в этаноле (4 мл) и эту смесь добавляют к ранее приготовленному этанольному раствору ацетамидина. Реакционную смесь перемешивают при температуре дефлегмации в течение 72 ч, оставляют охладиться и разбавляют водой (15 мл),затем полученную смесь экстрагируют этилацетатом (общий объем 40 мл) и объединенные органические растворы высушивают (MgSO4) и упаривают при пониженном давлении. Полученное масло желтого цвета очищают колоночной хроматографией на силикагеле, используя градиентное элюирование смесью эфир:метанол(от 97:3 до 90:10) и получая указанное в заголовке соединение (120 мг) в виде твердого вещества белого цвета.(CDCl3): 1.02 (3H, t), 1.12 (3H, t), 1.85MCHP: m/z 408 (М+1)+. Подготовительный пример 73. 2-Цианометил-5-(2-н-пропоксифенил)-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. 2 М Раствор бис(триметилсилил)амида натрия в тетрагидрофуране (4,42 мл; 8,8 ммоль) добавляют к перемешиваемому охлажденному во льду раствору соединения, указанного в заголовке подготовительного примера 12 (2,3 г; 7,4 ммоль), в тетрагидрофуране (25 мл) и полученный раствор перемешивают в течение 30 мин перед тем, как охладить до температуры приблизительно -70 С. По каплям добавляют бромацетонитрил (0,54 мл; 7,7 ммоль), охлаждающую баню убирают и по истечение следующих 20 ч реакцию осторожно гасят метанолом (5 мл), и реакционную смесь упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя градиентное элюирование смесью дихлорметан:метанол (от 99:1 до 95:5), с последующей кристаллизацией из смеси гексан:этилацетат,что позволяет получить указанное в заголовке соединение (1,89 г) в виде твердого вещества белого цвета. Обнаружено: С 64,84; Н 5,98; N 19,71.MCHP: m/z 703 (2M+1)+. Подготовительный пример 74. 2-[5-(2-нПропоксифенил)-3-н-пропил-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он-2-ил]ацетамидоксим. Карбонат натрия (199 мг; 1,9 ммоль) и гидроксиламина гидрохлорид (260 мг; 3,7 ммоль) добавляют к перемешиваемой суспензии соединения, указанного в заголовке подготовительного примера 73 (878 мг; 2,5 ммоль), в 50%ном водном этаноле (10 мл) и смесь кипятят с обратным холодильником в течение 18 ч, затем оставляют охлаждаться. Полученный осадок собирают, промывают водой (30 мл) и высушивают под вакуумом, что позволяет получить указанное в заголовке соединение (902 мг) в виде твердого вещества белого цвета. Обнаружено: С 59,23; Н 6,26; N 21,51. 31 Уксусный ангидрид (336 мкл; 3,38 ммоль) добавляют к раствору соединения, указанного в заголовке подготовительного примера 74 (684 мг; 1,69 ммоль), в тетрагидрофуране (5 мл) и смесь перемешивают при температуре дефлегмации в течение 3 ч, затем оставляют охлаждаться. Полученный осадок собирают, промывают эфиром (20 мл) и высушивают под вакуумом, получая указанное в заголовке соединение(650 мг) в виде твердого вещества белого цвета. Обнаружено: С 59,02; Н 6,09; N 19,58.[4,3-d]пиримидин 7-он. Раствор соединения, указанного в заголовке подготовительного примера 75 (630 мг; 1,50 ммоль), в диглиме (5 мл) перемешивают при температуре дефлегмации в течение 5 ч, оставляют охладиться и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь гексан:этилацетат (34:66) в качестве элюента и получая указанное в заголовке соединение (520 мг) в виде твердого вещества. Обнаружено: С 61,40; Н 5,86; N 20,28. С 21 Н 24N6O3 соответствует: С 61,75; Н 5,92; N 20,57%.(ДМСОd6): 0.95 (6 Н, m), 1.74 (4 Н, m),2.58 (3H, s), 2.98 (2 Н, t), 4.03 (2 Н, t), 5.76 (2 Н, s),7.06 (1 Н, m), 7.16 (1 Н, d), 7.45 (1 Н, m), 7.66 (1 Н,d), 11.55 (1 Н, s). MCHP: m/z 409 (M+1)+. Подготовительный пример 77. 2-Цианометил-5-(2-этоксифенил)-3-н-пропил-2,6-дигидро 7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества (73%) из соединения, указанного в заголовке подготовительного примера 14, и бромацетонитрила,используя методику из подготовительного примера 73.(CDCl3): 1.10 (3H, t), 1.60 (3H, t), 1.95(2 Н, m), 3.08 (2 Н, t), 4.31 (2 Н, q), 5.28 (2 Н, s),7.07 (1 Н, d), 7.14 (1 Н, m), 7.48 (1 Н, m), 8.42 (1 Н,d), 11.01 (1 Н, s). MCHP: m/z 338 (M+1)+. Подготовительный пример 78. 2-[5-(2 Этоксифенил)-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7-oн-2-ил]aцeтaмидoкcим. Получают в виде твердого вещества белого цвета (89%) из соединения, указанного в заголовке подготовительного примера 77, используя методику из подготовительного примера 74.(ДМСОd6): 0.94 (3H, t), 1.33 (3H, t), 1.74[4,3-d]пиримидин-7-он. Соединение, указанное в заголовке подготовительного примера 78 (160 мг; 0,43 ммоль),добавляют к смеси уксусного ангидрида (122 мкл; 1,3 ммоль), уксусной кислоты (2,5 мл; 40 ммоль) и толуола (2 мл), затем полученную смесь перемешивают при температуре дефлегмации в течение 18 ч, оставляют охладиться и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя градиентное элюирование смесью гексан:этилацетат (от 1:1 до 1:3) и получая указанное в заголовке соединение (45 мг) в виде твердого вещества.(ДМСОd6): 0.92 (3H, t), 1.31 (3H, t), 1.72(2 Н, m), 2.57 (3H, s), 2.97 (2 Н, t), 4.12 (2 Н, q),5.76 (2 Н, s), 7.05 (1 Н, m), 7.14 (1 Н, d), 7.47 (1 Н,m), 7.64 (1 Н, d), 11.64 (1 Н, s). Подготовительный пример 80. Бензиловый эфир 1-бензил-4-нитро-3-н-пропилпиразол-5 карбоновой кислоты. Бензилбромид (20,4 мл; 0,172 моль) добавляют по каплям в течение 5 мин к перемешиваемому охлажденному во льду раствору соединения из подготовительного примера 3 (17,0 г; 0,085 моль) и карбоната цезия (56,1 г; 0,173 моль) в диметилформамиде (150 мл), затем охлаждение убирают. По истечение 19 ч добавляют воду (300 мл) и смесь экстрагируют эфиром(общий объем 1000 мл). Объединенные экстракты высушивают (MgSO4) и упаривают при пониженном давлении, получая масло, очистка которого колоночной хроматографией на силикагеле с использованием градиентного элюирования смесью пентан:этилацетат (от 95:5 до 90:10) позволяет получить указанное в заголовке соединение (13,0 г) в виде твердого вещества(2 Н, t). 5.30 (2 Н, s), 5.39 (2 Н, s), 7.17 (2 Н, m),7.30 (8 Н, m). MCHP: m/z 397 (М+18)+. Подготовительный пример 81. 1-Бензил-4 нитро-3-н-пропилпиразол-5-карбоновая кислота. Смесь соединения, указанного в заголовке подготовительного примера 80 (13,0 г; 0,034 моль), и 6 М водный раствор гидроксида натрия(65 мл) перемешивают при температуре дефлегмации в течение 2 ч, оставляют охладиться, разбавляют водой (130 мл) и полученную смесь экстрагируют эфиром (500 мл). Водную фазу при перемешивании охлаждают во льду, подкисляют концентрированной соляной кислотой и экстрагируют дихлорметаном (общий объем 500 мл). Объединенные дихлорметановые экстракты высушивают (MgSO4) и упаривают при 33 пониженном давлении, получая указанное в заголовке соединение (10,0 г) в виде твердого вещества белого цвета.(CDCl3): 1.10 (3H, t), 1.78 (2 Н, m), 2.94(2 Н, t), 5.78 (2 Н, s), 7.32 (5 Н, m). Подготовительный пример 82. 1-Бензил-4 нитро-3-н-пропилпиразол-5-карбоксамид. Получают в виде порошка кремовой окраски (79%) из соединения, указанного в заголовке подготовительного примера 81, используя методику из подготовительного примера 5.(CDCI3): 1.00 (3H, t), 1.76 (2H, m),2.90(2H, t), 5.60 (2 Н, s), 7.30 (5 Н, m). МСНР: m/z 306 (М+18)+. Подготовительный пример 83. 4-Амино-1 бензил-3-н-пропилпиразол-5-карбоксамид. Перемешиваемую смесь соединения, указанного в заголовке подготовительного примера 82 (7,0 г; 0,024 моль), хлорида двухвалентного олова дигидрата (27,4 г; 0,122 моль) и этанола(140 мл) кипятят с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают,подщелачивают насыщенным водным раствором карбоната аммония, фильтруют и фильтрат экстрагируют дихлорметаном (общий объем 750 мл). Объединенные экстракты высушивают(МgSO4) и упаривают при пониженном давлении, получая указанное в заголовке соединение(4,8 г) в виде твердого вещества оранжевого цвета.(CDCl3): 0.99 (3H, t), 1,70 (2H, m), 2.58MCHP: m/z 259 (М+1)+. Подготовительный пример 84. 5-Хлорсульфонил-2-этоксибензойная кислота. Расплавленную 2-этоксибензойную кислоту (25,0 г; 0,150 моль) добавляют к перемешиваемой охлажденной во льду смеси тионилхлорида (11 мл; 0,151 моль) и хлорсульфоновой кислоты (41,3 мл; 0,621 моль), поддерживая при этом температуру реакционной смеси ниже 25 С. Полученную смесь перемешивают при комнатной температуре в течение 18 ч, а затем выливают в перемешиваемую смесь льда (270 г) и воды (60 мл), получая осадок беловатой окраски. Перемешивание продолжают в течение 1 ч,затем продукт собирают фильтрованием, промывают водой и высушивают под вакуумом,получая указанное в заголовке соединение(36,08 г). Эталонный образец, т. пл. 115-116 С,получают кристаллизацией из смеси гексан:толуол. Обнаружено: С 41,02; Н 3,27. C9H9ClO5S соответствует: С 40,84; Н 3,43%.(CDCl3): 1.64 (3H, t), 4.45 (2H, q), 7.26 34 1-Метилпиперазин (33,6 мл; 0,303 моль) добавляют к перемешиваемой суспензии соединения, указанного в заголовке подготовительного примера 84 (34,4 г; 0,130 моль), в воде. (124 мл) при температуре приблизительно 10 С, поддерживая при этом температуру реакционной смеси ниже 20 С. Полученный раствор охлаждают до температуры приблизительно 10 С, и через 5 мин начинается кристаллизация твердого материала. По истечении следующих 2 ч твердое вещество собирают фильтрованием,промывают ледяной водой и высушивают под вакуумом, получая неочищенный продукт (36,7 г). Образец (15,0 г) очищают путем его перемешивания в ацетоне при температуре дефлегмации в течение 1 ч; полученную суспензию оставляют охлаждаться до комнатной температуры и кристаллическое твердое вещество собирают фильтрованием и высушивают под вакуумом, что позволяет получить указанное в заголовке соединение (11,7 г), т.пл. 198-199 С, 1H ЯМР-спектр которого идентичен спектру, полученному для продукта приведенной ниже методики (b).(b): двухстадийная методика. Раствор соединения, указанного в заголовке подготовительного примера 84 (50,0 г; 0,189 моль), в ацетоне (150 мл) добавляют по каплям к перемешиваемой смеси 1-метилпиперазина(20,81 г; 0,208 моль) и триэтиламина (28,9 мл; 0,207 моль), поддерживая при этом температуру реакционной смеси ниже 20 С. Во время добавления образуется кристаллическое вещество белого цвета, перемешивание продолжают в течение следующих 1,5 ч. Фильтрование с последующим промыванием ацетоном и высушиванием продукта под вакуумом дает гидрохлорид-триэтиламинную двойную соль указанного в заголовке соединения (78,97 г), т.пл. 166169 С. Обнаружено: С 51,33; Н 8,14; N 9,06; Cl 8,02. C14H20N2O5S; C6H15N; HCl соответствует: С 51,55; Н 7,79; N 9,02; Cl 7,61%.(ДМСОd6): 1.17 (9H, t), 1.32 (3H, t), 2.15(1H, d). Двойную соль (30,0 г) перемешивают в воде (120 мл), получая полностью прозрачный раствор, из которого быстро начинается кристаллизация твердого вещества. По истечении 2 ч твердое вещество собирают фильтрованием,промывают водой и высушивают под вакуумом,получая указанное в заголовке соединение(14,61 г) в виде твердого вещества белого цвета. Эталонный образец, т.пл. 201 С, получают перекристаллизацией из водного этанола. Обнаружено: С 51,09; Н 6,16; N 8,43. С 14H20N2O5S соответствует: С 51,21; Н 6,14; N 8,53%.(Бензотриазол-1-илокси)трипирролидинфосфония гексафторфосфат (РуВОР; 7,6 г; 0,015 моль) добавляют к перемешиваемому раствору соединений, указанных в заголовках подготовительных примеров 83 (3,8 г; 0,015 моль) и 85(5,3 г; 0,016 моль), в диметилформамиде (50 мл) и полученный раствор оранжевого цвета перемешивают при комнатной температуре в течение 20 ч, затем выливают в воду (250 мл). Смесь экстрагируют этилацетатом (общий объем 750 мл) и объединенные экстракты последовательно промывают 10%-ным водным раствором бикарбоната натрия (100 мл) и водой (100 мл), высушивают (MgSO4) и упаривают при пониженном давлении, получая твердое вещество оранжевого цвета. Кристаллизация из этанола дает указанное в заголовке соединение (6,76 г) в виде кристаллического твердого вещества белого цвета, т.пл. 182-184 С. Обнаружено: С 58,88; Н 6,27; N 14,66. С 28 Н 36N6O5S соответствует: С 59,14; Н 6,38; N 14,78%.(CDCl3): 0.97 (3H, t), 1.59 (3H, t), 1.68(1 Н, s). MCHP: m/z 569 (М+1)+. Подготовительный пример 87. 1-(4-Хлорбензил)-5-(2-н-пропоксифенил)-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (62%) из соединения, указанного в заголовке подготовительного примера 12, и 4 хлорбензилхлорида, используя методику из подготовительного примера 15 А. Обнаружено: С 65,96; Н 5,80; N 12,77.(1 Н, s). MCHP: m/z 437 (M+1)+. Подготовительный пример 88. 1-(4-Хлорбензил)-5-(2-этоксифенил)-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде кристаллического твердого вещества белого цвета (77%) из соединения, указанного в заголовке подготовительного примера 14, и 4-хлорбензилхлорида, используя методику из подготовительного примера 15 А. Обнаружено: С 65,34; Н 5,52; N 13,38. С 23H23ClN4O2 соответствует: С 65,32; Н 5,48; N 13,25%.(CDCl3): 1.02(3H, t), 1.63 (3H, t), 1.90 (2H,m), 2.96 (2H, t), 4.32 (2H, q), 5.74 (2H, s), 7.05m/z 423 (M+1)+. Подготовительный пример 89. 2-(4-Бромбензил)-5-(2-этоксифенил)-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде бесцветного масла (54%) из соединения, указанного в заголовке подготовительного примера 14, и 4-бромбензилхлорида,используя методику из подготовительного примера 15 В.(CDCl3): 0.94 (3H, t), 1.58 (3H, t), 1.73(1H, s). MCHP: m/z 484 (M+18)+. Подготовительный пример 90. 1-(2-Цианобензил)-5-(2-этоксифенил)-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества (17%) из соединения, указанного в заголовке подготовительного примера 14 и 2-цианобензилбромида, используя методику из подготовительного примера 15D. Обнаружено: С 69,58; Н 5,60; N 16,90. С 24 Н 23N5O2 соответствует: С 69,72; Н 5,61; N 16,94%.(CDCl3): 1.03 (3H, t), 1.60 (3H, t), 1.90MCHP: m/z 414 (М+1)+. Подготовительный пример 91. 1-(4-Карбамоилбензил)-5-(2-этоксифенил)-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (73%) из соединения, указанного в заголовке подготовительного примера 14, и 4 карбамоилбензилхлорида, используя методику из подготовительного примера 15 А. Обнаружено: С 66,22; Н 5,81; N 16,06. С 24 Н 25N5O3 соответствует: С 66,81; Н 5,84; N 16,23%.(CDCl3): 1.02 (3H, t), 1.62 (3H, t), 1.90(1H, s). MCHP: m/z 432 (M+1)+. Подготовительный пример 92. 2-(4-Карбамоилбензил)-5-(2-этоксифенил)-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (47%) из соединения, указанного в заголовке подготовительного примера 14, и 4 карбамоилбензилбромида, используя методику из подготовительного примера 15 В. Обнаружено: С 66,10; Н 5,78; N 16,02.(1H, d), 10.92 (1H, s). MCHP: m/z 432 (M+1)+. Подготовительный пример 93. 5-(2-Этоксифенил)-1-(2-нитробензил)-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества беловатой окраски (39%) из соединения, указанного в заголовке подготовительного примера 14, и 2 нитробензилхлорида, используя методику из подготовительного примера 15 А. Обнаружено: С 63,62; Н 5,32; N 16,07. С 23 Н 23N5O4 соответствует: С 63,73; Н 5,35; N 16,16%.(CDCl3): 1.05 (3H, t), 1.60 (3H, t), 1.92MCHP: m/z 434 (M+1)+. Подготовительный пример 94. 1-(2-Нитробензил)-5-(2-н-пропоксифенил)-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (46%) из соединения, указанного в заголовке подготовительного примера 12, и 2 нитробензилхлорида, используя методику из подготовительного примера 15 А.(CDCl3): 1.02 (3H, t), 1.15(3H, t), 1.90 (2 Н,m), 2.00 (2 Н, m), 2.99 (2 Н, t), 4.20 (2 Н, t), 6.24(2 Н, s), 6.66 (1 Н, d), 7.04 (1 Н, d), 7.18 (1 Н, m),7.45 (3H, m), 8.14 (1 Н, d), 8.54 (1 Н, d), 11.26 (1 Н,s). MCHP: m/z 448 (M+1)+. Подготовительный пример 95. 5-(2-Этоксифенил)-1-(4-нитробензил)-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Получают в виде кристаллического твердого вещества (61%) из соединения, указанного в заголовке подготовительного примера 14, и 4 нитробензилхлорида, используя методику из подготовительного примера 15 А. Обнаружено: С 63,59; Н 5,31; N 16,02.MCHP: m/z 434 (M+1)+. Подготовительный пример 96. 5-(2-Этоксифенил)-2-(4-нитробензил)-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Получают в виде твердого вещества желтого цвета (30%) из соединения, указанного в заголовке подготовительного примера 14, и 4 нитробензилбромида, используя методику из подготовительного примера 15 С.(CDCl3): 0.98 (3H, t), 1.60 (3H, t), 1.76 38 ксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-3-н-пропил-1,6-дигидро-7 Нпиразоло [4,3-d]пиримидин-7-он. Имидазол (39 мг; 0,57 ммоль) и третбутилдиметилсилилхлорид (69 мг; 0,46 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке примера 53 (233 мг; 0,38 ммоль), в дихлорметане (4 мл) и смесь перемешивают при комнатной температуре в течение 20 ч. Добавляют воду (5 мл), водную фазу отделяют и экстрагируют дихлорметаном(20 мл), затем объединенные органические растворы высушивают (Na2SO4) и упаривают при пониженном давлении. Полученное масло желтого цвета очищают колоночной хроматографией на силикагеле, используя смесь пентан:этилацетат (1:1) в качестве элюента, что позволяет получить указанное в заголовке соединение (212 мг) в виде бесцветного масла.(CDCl3): 0.00 (6 Н, s), 0.85 (9 Н, s), 1.02(2H, m), 7.36 (1H, m), 7.60 (1H, d), 7.70 (1H, d),7.82 (1H, d), 8.80 (1H, s), 9.70 (1H, s), 10.98 (1H,s). MCHP: m/z 724 (M+1)+. Подготовительный пример 98. 5-5-[4-(2 трет-Бутилдиметилсилилоксиэтил)пиперазин-1 илсульфонил]-2-н-пропоксифенил-1-(2-метансульфонамидобензил)-3-н-пропил-1,6-дигидро 7 Н-пиразоло[4,3-d]пиримидин-7-он. Метансульфонилхлорид (24 мкл; 0,30 ммоль) добавляют к перемешиваемому охлажденному во льду раствору соединения, указанного в заголовке подготовительного примера 97(200 мг; 0,28 ммоль), в пиридине (3 мл), и смесь перемешивают при комнатной температуре в течение 20 ч, затем упаривают при пониженном давлении. Остаток обрабатывают водой (10 мл) и полученную суспензию экстрагируют этилацетатом (общий объем 40 мл). Объединенные экстракты высушивают (Na2SO4) и упаривают при пониженном давлении, получая масло желтого цвета, которое очищают колоночной хроматографией на силикагеле, используя смесь пентан:этилацетат (1:1) в качестве элюента и получая указанное в заголовке соединение (145 мг) в виде бесцветного масла.(CDCl3): 0.00 (6 Н, s), 0.85 (9 Н, s), 1.02(2H, m), 7.36 (1H, m), 7.60 (1H, d), 7.70 (1 Н, d),8.80 (1H,s), 9.70 (1 Н, s), 10.98 (1 Н, s). MCHP:m/z 802 (M+1)+. Подготовительный пример 99. 5-(2-Этоксифенил)-3-н-пропил-1-(4-сульфамоилбензил)1,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7 он. Получают в виде твердого вещества (51%) из соединения, указанного в заголовке подгото 39 вительного примера 14, и 4-сульфамоилбензилхлорида (J. Med. Chem., 1986, 29, 1814), используя методику из подготовительного примера 15 А. Обнаружено: С 58,78; Н 5,37; N 14,83. С 23 Н 25N5O4S соответствует: С 59,08; Н 5,39; N 14,98 %.(ДМСОd6): 0.90 (3H, t), 1.32 (3H, t),1.74 (2H, m), 2.79 (2H, t), 4.14 (2H, q), 5.78 (2H,s), 7.04 (1H, m), 7.16 (1H, d), 7.28 (2H, s), 7.38(2H, d), 7.45 (1H, m), 7.66 (1H, d), 7.78 (2H, d),12.02 (1H, s). MCHP:m/z 468 (M+1)+. Подготовительный пример 100. 1-Бензилоксикарбонилметил-5-(2-н-пропоксифенил)-3 н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (28%) из соединения, указанного в заголовке подготовительного примера 12, и бензилбромацетата, используя методику из подготовительного примера 15D.(CDCl3): 1.02 (3H, t), 1.17(3H, t), 1.90 (2H,m), 2.02 (2H, m), 2.97 (2H, t), 4.19 (2H, t), 5.21(1H, s). MCHP: m/z 461 (M+1)+. Подготовительный пример 101. 1-Карбоксиметил-5-(2-н-пропоксифенил)-3-н-пропил 1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. Получают в виде твердого вещества бежевой окраски (92%) из соединения, указанного в заголовке подготовительного примера 100, используя методику из подготовительного примера 69.(CDCl3): 1.04 (3H, t), 1.18 (3H, t), 1.91N-Метилморфолин (91 мкл; 0,83 ммоль) добавляют в атмосфере азота к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 101 (93 мг; 0,23 ммоль), в дихлорметане (5 мл) и полученный раствор охлаждают в ледяной бане. Добавляют этиламина гидрохлорид (24 мг; 0,30 ммоль), 1-гидроксибензотриазола гидрат (41 мг; 0,30 ммоль) и 1-(3-диметиламинопропил)-3 этилкарбодиимида гидрохлорид (73 мг; 0,38 ммоль), затем полученную смесь оставляют нагреваться до комнатной температуры, перемешивают в течение следующих 20 ч и упаривают при пониженном давлении. Остаток распределяют между этилацетатом (10 мл) и 2 М соляной кислотой (10 мл), отделенную водную фазу промывают этилацетатом (10 мл) и объединенные органические растворы последовательно 40 промывают насыщенным водным раствором бикарбоната натрия (10 мл) и солевым раствором (10 мл), высушивают (MgSO4) и упаривают при пониженном давлении, получая указанное в заголовке соединение (89 мг) в виде твердого вещества кремовой окраски.(CDCl3): 1.03 (3H, t), 1.10 (3H, t), 1.18[4,3-d]пиримидин-7-он. Получают в виде порошка белого цвета(44%) из соединения, указанного в заголовке подготовительного примера 101,и 2 метоксиэтиламина, используя методику из подготовительного примера 102.(CDCl3): 1.03 (3H, t), 1.18 (3H, t), 1.88(2 Н,m), 2.00 (2 Н, m), 2.98 (2 Н, t), 3.29 (3H, s), 3.42(4 Н, m), 4.21 (2 Н, t), 5.29 (2 Н, s), 6.45 (1 Н, s),7.04 (1 Н, d), 7.15 (1 Н, d), 7.48 (1H, m), 8.50 (1 Н,d), 11.27 (1 Н, s). MCHP: m/z 428 (M+1)+. Подготовительный пример 104. 1-(Морфолин-4-илкарбонилметил)-5-(2-н-пропоксифенил)-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3d]пиримидин-7-он. Получают в виде пены кремовой окраски(95%) из соединения, указанного в заголовке подготовительного примера 101, и морфолина,используя методику из подготовительного примера 102.(CDCl3): 1.03 (3H, t), 1.19 (3H, t), 1.90MCHP: m/z 440 (M+1)+. Подготовительный пример 105. 2-(NЭтилкарбамоилметил)-5-(2-н-пропоксифенил)3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде порошка белого цвета(58%) из соединения, указанного в заголовке подготовительного примера 69, и этиламина гидрохлорида, используя методику из подготовительного примера 102.(CDCl3): 1.10 (3H, t), 1.05 (3H, t), 1.14(3H,t), 1.82 (2 Н, m), 2.02 (2 Н, m), 3.00 (2 Н, t), 3.30(2 Н, m), 4.19 (2H, t), 4.99 (2 Н, s), 6.23 (1 Н, s),7.07 (1 Н, d), 7.15 (1 Н, m), 7.48 (1 Н, m), 8.42 (1 Н,d), 11.00 (1 Н, s). MCHP: m/z 398 (М+1)+. Подготовительный пример 106. 2-[N-(2 Метоксиэтил)карбамоилметил]-5-(2-н-пропоксифенил)-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены кремовой окраски(74%) из соединения, указанного в заголовке подготовительного примера 69, и 2-метокси 41 этиламина, используя методику из подготовительного примера 102.(CDCl3): 1.02 (3H, t), 1.15(3H, t), 1.84 (2 Н,m), 2.00 (2 Н, m), 3.00 (2 Н, t), 3.28 (3H, s), 3.40(4 Н, m), 4.19 (2H, t), 5.00 (2 Н, s), 6.40 (1 Н, s),7.06 (1 Н, d), 7.16 (1 Н, m), 7.46 (1 Н, m), 8.43 (1 Н,d), 10.97 (1 Н, s). MCHP: m/z 428 (M+1)+. Подготовительный пример 107. 2-(Морфолин-4-илкарбонилметил)-5-(2-н-пропоксифенил)-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3d]пиримидин-7-он. Получают в виде пены белого цвета (55%) из соединения, указанного в заголовке подготовительного примера 69, и морфолина, используя методику из подготовительного примера 102.(CDCl3): 1.05 (3H, t), 1.13 (3H, t), 1.91N-Метилморфолин (1,5 мл; 13,8 ммоль),затем 1-гидроксибензотриазол (1,483 г; 11,0 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (2,317 г; 12,0 ммоль) добавляют к перемешиваемому охлажденному во льду раствору S-(-)-2-хлорпропионовой кислоты (1,0 г; 9,2 ммоль) в дихлорметане (30 мл) и полученный раствор перемешивают приблизительно при 0 С в течение 45 мин. Далее добавляют морфолин (2,4 мл; 27,6 ммоль), охлаждение убирают и реакционную смесь перемешивают при комнатной температуре в течение 66 ч, затем упаривают при пониженном давлении. Остаток распределяют между этилацетатом и водой, затем отделенную органическую фазу промывают солевым раствором, высушивают(МgSO4) и упаривают при пониженном давлении. Полученное масло желтого цвета очищают колоночной хроматографией на силикагеле, используя смеси гексан-этилацетат (3:1 и затем 2:1) в качестве элюентов и получая указанное в заголовке соединение (57 мг) в виде бесцветного масла. []25D +51(с = 0,1; СН 3 ОН).(CDCl3): 1.67 (3H, d), 3.42-3.89 (8 Н, m), 4.53 (1 Н, q).[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (44%) из соединений, указанных в заголовках подготовительных примеров 12 и 108, используя методику из подготовительного примера 15 В.(CDCl3): 1.02 (3H, t), 1.18 (3H, t), 1.78 42 Подготовительный пример 110. 2-[1S(Морфолин-4-илкарбонил)этил]-5-(2-н-пропоксифенил)-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (33%) из соединений, указанных в заголовках подготовительных примеров 12 и 108, используя методику из подготовительного примера 15 В.(CDCl3): 1.05 (3H, t), 1.15 (3H, t), 1.82(1H, d), 10.94 (1 Н, s). MCHP:m/z 454 (M+1)+. Подготовительный пример 111. 4-(2RХлорпропаноил)морфолин. Получают в виде масла бледно-желтой окраски (16%) из R-(+)-2-хлорпропионовой кислоты и морфолина, используя методику из подготовительного примера 108. []25D -46 (с = 0,1; СН 3 ОН).(CDCl3): 1.69 (3H, d), 3.49-3.87 (8 Н, m),4.53 (1 Н, q). MCHP: m/z 195 (M+NH4)+. Подготовительный пример 112. 1-[1R(Морфолин-4-илкарбонил)этил]-5-(2-н-пропоксифенил)-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества желтого цвета (8%) из соединений, указанных в заголовках подготовительных примеров 12 и 111,используя методику из подготовительного примера 15 В.(CDCl3): 1.02 (3H, t), 1.18 (3H, t), 1.79[4,3-d]пиримидин-7-он. Получают в виде порошка желтого цвета(23%) из соединений, указанных в заголовках подготовительных примеров 12 и 111, используя методику из подготовительного примера 15 В.(CDCl3): 1.04 (3H, t), 1.14 (3H, t), 1.82(1 Н, m), 8.40 (1 Н, d), 10.95 (1 Н, s). MCHP: m/z 454 (M+1)+. Подготовительный пример 114. 1-(2 Морфолин-4-илэтил)-5-(2-н-пропоксифенил)-3 н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде прозрачного масла (40%) из соединения, указанного в заголовке подготовительного примера 12, и свободного основания 4-(2-хлорэтил)морфолина гидрохлорида, используя методику из подготовительного примера 15 В.(1 Н, d), 10.65 (1 Н, s). MCHP: m/z 427 (M+2)+. Подготовительный пример 115. 2-(2-Морфолин-4-илэтил)-5-(2-н-пропоксифенил)-3-нпропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены желтого цвета(24%) из соединения, указанного в заголовке подготовительного примера 12, и свободного основания 4-(2-хлорэтил)морфолина гидрохлорида, используя методику из подготовительного примера 15 В. Обнаружено: С 63,90; Н 7,33; N 16,21.[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (17%) из соединения, указанного в заголовке подготовительного примера 12, и 1-(2-хлорэтил)-4 метилпиперазина (Europ. J. Med. Chem., 1995,30, 77), используя методику из подготовительного примера 15 В.(CDCl3): 1.05 (3H, t), 1.12(3H, t), 1.86 (2H,m), 1.98 (2H, m), 2.28 (3H, s), 2.44 (4 Н, m), 2.58(4 Н, m), 2.97 (4 Н, m), 4.17 (2H, t), 4.39 (2H, t),7.03 (1 Н, d), 7.12 (1 Н, m), 7.44 (1 Н, m), 8.40 (1 Н,d), 10.85 (1 Н, s). MCHP: m/z 439 (M+1)+. Подготовительный пример 117. 1-(2 Хлорэтил)пиразол. 1-Бром-2-хлорэтан (6,0 мл; 72 ммоль) добавляют по каплям в атмосфере азота к энергично перемешиваемой охлажденной во льду смеси пиразола (5,0 г; 73 ммоль), карбоната калия (10,0 г; 73 ммоль) и ацетона (95 мл). Через 3 ч охлаждение убирают и реакционную смесь перемешивают при комнатной температуре в течение следующих 3 дней, затем фильтруют. Фильтрат упаривают при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя смесь дихлорметан:метанол (97:3) в качестве элюента и получая указанное в заголовке соединение (1,62 г) в виде прозрачного масла.(CDCl3): 3.90 (2 Н, m), 4.42 (2 Н, m), 6.23 44 Получают в виде твердого вещества белого цвета (63%) из соединений, указанных в заголовках подготовительных примеров 12 и 117,используя методику из подготовительного примера 15 В.(CDCl3): 0,82 (3H, t), 1.10 (3H, t), 1.56(1 Н, m), 8.36 (1 Н, d), 10.58 (1 Н, s). MCHP: m/z 407 (M+1)+. Подготовительный пример 119. 1-(2 Хлорэтил)-1,2,3-триазол. Метилат натрия (7,0 г; 121 ммоль) добавляют к перемешиваемому охлажденному во льду раствору 1,2,3-триазола (8,4 г; 121 ммоль) в метаноле (125 мл) с последующим добавлением по каплям 1-бром-2-хлорэтана (10,0 мл; 121 ммоль). Охлаждение убирают и реакционную смесь перемешивают при комнатной температуре в течение 2 дней, затем упаривают при пониженном давлении. Остаток распределяют между этилацетатом (125 мл) и солевым раствором(100 мл), затем отделенную органическую фазу высушивают (MgSO4) и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь дихлорметан: метанол (96:4) в качестве элюента и получая указанное в заголовке соединение (2,19 г) в виде прозрачного масла.(CDCl3): 3.88 (2 Н, m), 4.68 (2 Н, m), 7.50(1 Н, s), 7.60 (1 Н, s). MCHP: m/z 132 (М+1)+. Подготовительный пример 120. 5-(2-нПропоксифенил)-3-н-пропил-2-[2-(1,2,3-триазол-1 ил)этил]-2,6-дигидро-7 Н-пиразоло[4,3d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (60%) из соединений, указанных в заголовках подготовительных примеров 12 и 119,используя методику из подготовительного примера 15 В.(CDCl3): 0.82 (3H, t), 1.07 (3H, t), 1.50(2 Н, m), 7.40 (1 Н, m), 7.46 (1 Н, s), 8.38 (1H, d),10.96 (1 Н, s). MCHP: m/z 408 (M+1)+. Подготовительный пример 121. 1-(2-Хлорэтил)-1,2,4-триазол. Получают в виде прозрачного масла (22%) из 1,2,4-триазола и 1-бром-2-хлорэтана, используя методику из подготовительного примера 117.(CDCl3): 3.79 (2 Н, m), 4.18 (2 Н, m), 7.84(1 Н, s), 8.04 (1 Н, s). Подготовительный пример 122. 5-(2-нПропоксифенил)-3-н-пропил-2-[2-(1,2,4-триазол-1 ил)этил]-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде пены белого цвета (32%) из соединений, указанных в заголовках подго 45 товительных примеров 12 и 121, используя методику из подготовительного примера 15 В.(CDCl3): 0.88 (3H, t), 1.11 (3H, t), 1.58(1H,d), 10.90 (1 Н, s). MCHP: m/z 408 (M+1)+. Подготовительный пример 123. 2-(2 Нитрофенил)-5-(2-н-пропоксифенил)-3-н-пропил-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин 7-он. Получают в виде порошка желтого цвета(60%) из соединения, указанного в заголовке подготовительного примера 12,и 2 фторнитробензола, используя методику из подготовительного примера 15 В.(СDСl3): 0.90 (3H, t), 1.07 (3H, t), 1.76(2 Н, m), 1.99 (2 Н, m), 2.84 (2 Н, t), 4.15 (2 Н, t),7.01 (1 Н, d), 7.10 (1H,t), 7.43 (1 Н, t), 7.58 (1 Н, d),7.70 (1 Н, t), 7.78 (1 Н, t), 8.16 (1 Н, d), 8.42 (1 Н,m), 10.93 (1 Н, s). MCHP: m/z 434 (M+1)+. Подготовительный пример 124. 2-(4 Нитрофенил)-5-(2-н-пропоксифенил)-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин 7-он. Получают в виде твердого вещества желтого цвета (72%) из соединения, указанного в заголовке подготовительного примера 12, и 4 фторнитробензола, используя методику из подготовительного примера 15 В.(CDCl3): 0.96 (3H, t), 1.14(3H, t), 1.80 (2 Н,m), 2.02 (2 Н, m), 3.12 (2 Н, t), 4.20 (2 Н, t), 7.08(3H, m), 11.03 (1 Н, s). MCHP: m/z 434 (М+1)+. Подготовительный пример 125. 5-(2-нПропоксифенил)-3-н-пропил-2-пиримидин-2 ил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин 7-он. Получают в виде твердого вещества белого цвета (26%) из соединения, указанного в заголовке подготовительного примера 12, и 2 хлорпиримидина, используя методику из подготовительного примера 15 В.(CDCl3): 1.00 (3H, t), 1.17(3H, t), 1.80(2 Н,m), 2.01 (2 Н, m), 3.48 (2 Н, t), 4.19 (2H, t), 7.05m/z 391 (M+1)+. Подготовительный пример 126. 2-Циклобутилметил-5-(2-этоксифенил)-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают (25%) из соединения, указанного в заголовке подготовительного примера 14, и метансульфонилоксиметилциклобутанаChem. Soc. Perkin II, 1981, 970), используя методику из подготовительного примера 15 С. Обнаружено: С 68,62; Н 7,13; N 15,21. 46 7.03 (1H, d), 7.12 (1H, m), 7.44 (1H, m), 8.40 (1H,d), 10.84 (1H, s). MCHP: m/z 367 (M+1)+. Подготовительный пример 127. 2-Циклобутилметил-5-(2-н-пропоксифенил)-3-н-пропил 2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. Получают в виде твердого вещества белого цвета (23%) из соединения, указанного в заголовке подготовительного примера 12, и метансульфонилоксиметилциклобутана (J. Chem. Soc.Perkin II, 1981, 970), используя методику из подготовительного примера 15 С.(CDCl3): 1.05 (3H, t), 1.12 (3H, t), 1.842.06 (10 Н, m), 2.98 (3H, m), 4.17 (2 Н, t), 4.32 (2 Н,d), 7.04 (1 Н, d), 7.12 (1 Н, m), 7.44 (1 Н, m), 8.39(1 Н, d), 10.70 (1 Н, s). MCHP: m/z 381 (М+1)+. Подготовительный пример 128. Метиловый эфир 2-(2-метоксиэтокси)бензойной кислоты. Диэтиловый эфир азодикарбоновой кислоты (7,0 г; 40,4 ммоль) добавляют по каплям к перемешиваемому раствору метилового эфира салициловой кислоты (5,1 г; 33,5 ммоль), 2 метоксиэтанола (2.6 г; 34,1 ммоль) и трифенилфосфина (10,6 г; 40,4 ммоль), затем реакционную смесь перемешивают при комнатной температуре в течение 18 ч и упаривают при пониженном давлении. Остаток растирают с эфиром,полученную смесь фильтруют, фильтрат упаривают при пониженном давлении и полученный остаток очищают колоночной хроматографией на силикагеле, используя градиентное элюирование смесью пентан:эфир (от 100:0 до 80:20),что позволяет получить указанное в заголовке соединение (4,80 г; 68%) в виде бесцветного масла.(CDCl3): 3.51 (3H, s), 3.85 (2 Н, t), 3.92(3H, s), 4.23 (2 Н, t), 7.03 (2 Н, m), 7.48 (1 Н, m),7.83 (1H, d). Подготовительный пример 129. 2-(2 Метоксиэтокси)бензойная кислота. Смесь соединения, указанного в заголовке подготовительного примера 128 (4,8 г; 22,8 ммоль), и 2 М водного раствора гидроксида натрия (25 мл; 50 ммоль) перемешивают при комнатной температуре в течение 4 ч, затем промывают эфиром. Полученный водный раствор подкисляют до рН 3, используя 1 М соляную кислоту, и экстрагируют дихлорметаном (3 х 50 мл). Объединенные экстракты высушивают (МgSO4) и упаривают при пониженном давлении, получая указанное в заголовке соединение (4,16 г; 93%) в виде масла.(CDCl3): 3.50 (3H, s), 3.86(2 Н, t), 4.41 (2 Н, t), 7.08 (1 Н, d), 7.19 (1 Н, m),7.58 (1H, m), 8.22 (1H, d). Подготовительный пример 130. 3-Этил-4 нитро-2-(пиридин-2-ил)метилпиразол-5-карбоксамид. Смесь соединения, указанного в заголовке подготовительного примера 6 (20,0 г; 109 ммоль), 2-хлорметилпиридина гидрохлорида(17,9 г; 109 ммоль), карбоната цезия (74,7 г; 222 ммоль) и диметилформамида (120 мл) перемешивают при комнатной температуре в течение 18 ч, затем упаривают при пониженном давлении. Остаток распределяют между дихлорметаном (100 мл) и водой (100 мл), затем водную фазу отделяют и экстрагируют дихлорметаном(3 х 100 мл). К экстрактам добавляют органическую фазу и объединенные дихлорметановые растворы высушивают (МgSO4) и упаривают при пониженном давлении. Кристаллизация остатка из смеси дихлорметан:метанол дает 1 изомер указанного в заголовке соединения, то есть 3-этил-4-нитро-1-(пиридин-2-ил)метилпиразол-5-карбоксамид. Маточную жидкость упаривают при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя градиентное элюирование смесью дихлорметан: метанол (от 100:0 до 95:5) и получая указанное в заголовке соединение(17,36 г, 58%) в виде твердого вещества белого цвета.(CDCl3): 1.16(3H, t), 3.06 (2 Н, q), 5.48(2 Н, s), 5.88 (1 Н, s), 7.19 (1 Н, d), 7.27 (2 Н, m),7.70 (1 Н, m), 8.57 (1 Н, d). Подготовительный пример 131. 4-Амино 3-этил-2-(пиридин-2-ил)метилпиразол-5-карбоксамид. Получают в виде твердого вещества белого цвета (87%) из соединения, указанного в заголовке подготовительного примера 130, используя методику из подготовительного примера 7 за исключением того, что гидрирование осуществляют в течение только 4 ч.(CDCl3): 1.03(3H, t), 2.53(2H, q), 4.00 (2 Н,s), 5.22 (1 Н, s), 5.36 (2 Н, s), 6.60 (1 Н, s), 6.81 (1 Н,d), 7.20 (1H, m), 7.62 (1 Н, m), 8.57 (1 Н, d).MCHP: m/z 246 (M+1)+. Подготовительный пример 132. 3-Этил-4[2-(2-метоксиэтокси)бензамидо]-2-(пиридин-2 ил)метилпиразол-5-карбоксамид. Оксалилхлорид (3,05 г; 24 ммоль) добавляют по каплям к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 129 (2,35 г; 12 ммоль), и диметилформамида (5 капель) в дихлорметане (40 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем упаривают при пониженном давлении. Раствор остаточного неочищенного ацилхлорида в дихлорметане (20 мл) добавляют по каплям к перемешиваемой суспензии соединения, указанного в заголовке подготовительного примера 131 (2,45 г; 10 ммоль), в смеси триэтиламина(5,05 г; 50 ммоль) и дихлорметана (20 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и затем упаривают при пониженном давлении. Остаток распределяют между этилацетатом (50 мл) и водой (20 мл), затем органическую фазу последовательно промывают 1 М водным раствором лимонной 48 кислоты (20 мл), 2 М водным раствором гидроксида натрия (20 мл) и солевым раствором (20 мл), высушивают (МgSO4) и упаривают при пониженном давлении. Неочищенный продукт очищают колоночной хроматографией на силикагеле, используя градиентное элюирование смесью дихлорметан: метанол (от 100:0 до 93:7) и получая указанное в заголовке соединение(M+1)+. Подготовительный пример 133. 3-Этил-5[2-(2-метоксиэтокси)фенил]-2-(пиридин-2-ил) метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. трет-Бутилат калия (1,12 г; 10 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 132 (3,15 г; 7,45 ммоль), в н-пропаноле(40 мл) и реакционную смесь кипятят с обратным холодильником в течение 6 ч, затем оставляют охлаждаться. Добавляют этилацетат (60 мл) и полученную смесь последовательно промывают 1 М водным раствором лимонной кислоты (25 мл) и солевым раствором (25 мл), высушивают (MgSO4) и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя градиентное элюирование смесью дихлорметан: метанол (от 100:0 до 95:5), что позволяет получить указанное в заголовке соединение (2,17 г; 72%).(CDCl3): 1.29 (3H, t), 3.00 (2 Н, q), 3.57(2 Н, m), 7.12 (1 Н, m). 7.20 (1 Н, m), 7.43 (1 Н, m),7.60 (1H, m), 8.34 (1 Н, d), 8.57 (1 Н, d), 11.03 (1 Н,s). MCHP: m/z 407 (М+2)+. Подготовительный пример 134. 5-Хлорсульфонил-2-н-пропоксибензойная кислота. Трехгорлую колбу, снабженную скруббером с 5 М водным гидроксидом натрия (550 мл),заполняют тионилхлоридом (40 мл; 0,55 моль) и хлорсульфоновой кислотой (150 мл; 2,26 моль) и смесь при перемешивании охлаждают приблизительно до -10 С. В течение 20 мин добавляют раствор 2-н-пропоксибензойной кислоты (100 г; 0,55 моль) в дихлорметане (200 мл), обеспечивая поддержание температуры реакционной смеси ниже 5 С, затем реакционную смесь оставляют нагреваться до комнатной температуры. Полученный раствор добавляют в течение 1 ч к перемешиваемой охлажденной во льду воде, поддерживая при этом температуру на уровне приблизительно 0 С, и перемешивание продолжают в течение следующих 30 мин. Смесь фильтруют,полученное твердое вещество промывают холодной водой (100 мл) и высушивают под ва 49 куумом, получая указанное в заголовке соединение (122,2 г; 80%) в виде твердого вещества белого цвета.(ДМСОd6): 1.13 (3H, t), 2.00 (2 Н, m), 4.32(2 Н, t), 7.23 (1 Н, d), 8.21 (1H, m), 8.82 (1H, d). Подготовительный пример 135. 5-(4-Этилпиперазин-1-илсульфонил)-2-н-пропоксибензойная кислота. 1-Этилпиперазин (135 мл; 1,063 моль) добавляют в течение 10 мин к перемешиваемой охлажденной во льду суспензии соединения,указанного в заголовке подготовительного примера 134 (295,5 г; 1,063 моль), в воде (1,2 л) с последующим добавлением 50%-ного (в/о) водного раствора гидроксида натрия (64 мл; 0,33 моль) с такой скоростью, чтобы поддерживать значение рН от 6 до 7. Реакционную смесь перемешивают при температуре ниже 10 С в течение 2 ч, рН подводят до значения 7 и перемешивание продолжают при комнатной температуре в течение 18 ч. Далее рН подводят до значения 5, используя концентрированную соляную кислоту, добавляют хлористый натрий (240 г) и полученную смесь энергично перемешивают до тех пор, пока не получат раствор. Этот водный раствор экстрагируют дихлорметаном (2 х 1,05 л), экстракты объединяют и дихлорметан удаляют дистилляцией, заменяя его по мере этого процесса на бутан-2-он так, чтобы поддерживать постоянство объема; при достижении температуры головной фракции приблизительно 77 С раствор охлаждают приблизительно до 36 С. По каплям в течение 1 ч добавляют метансульфоновую кислоту (59 мл; 0,909 моль) и еще бутан-2-он (500 мл) с постепенным нагреванием до 75 С, что делает возможным постоянное перемешивание, и полученную суспензию перемешивают при комнатной температуре в течение следующих 18 ч. Фильтрование с последующей промывкой бутан-2-оном (500 мл) и высушиванием при 40 С полученного твердого вещества дает метансульфонатную соль указанного в заголовке соединения (383 г; 80%), т.пл. 187-188 С.(ДМСОd6): 0.97 (3H, t), 1.15 (3H, t), 1.75(2 Н, m), 3.10 (4 Н, m), 3.50 (2 Н, m), 3.70 (2 Н, m),4.11 (2 Н, t), 7.39 (1 Н, d), 7.86 (1 Н, m), 7.93 (1 Н,m). Часть (20 г) этой соли растворяют в воде(100 мл), затем рН перемешанного раствора подводят до значения 5,3, используя 5 М водный раствор гидроксида натрия, и добавляют хлористый натрий (26 г). Далее добавляют 4 метилпентан-2-он (200 мл), затем полученную смесь энергично перемешивают в течение 30 50 мин и фильтруют. Полученное твердое вещество высушивают, получая неочищенный продукт(10 г, 64%), т.пл. 83-90 С, кристаллизация образца которого из смеси бутан-2-он : ацетон дает указанное в заголовке соединение в чистом виде, т.пл. 143-145 С.(ДМСОd6): 0.91 (3H, t), 0.99 (3H, t),1.74(2 Н, m), 2.30 (2 Н, q), 2.45 (4 Н, m), 2.85 (4 Н,m), 4.09 (2 Н, t), 7.32 (1 Н, d), 7.70 (1 Н, d), 7.87(1 Н, s). MCHP: m/z 357 (М+1)+. Подготовительный пример 136. 3-Этил-4[5-(4-этилпиперазин-1-илсульфонил)-2-н-пропоксибензамидо]-2-(пиридин-2-ил)метилпиразол 5-карбоксамид. Перемешиваемую смесь соединения, указанного в заголовке подготовительного примера 135 (356,5 г; 1,0 моль), и бутан-2-она (2,85 л) кипятят с обратным холодильником и затем перегоняют при атмосферном давлении до удаления значительной части (1,08 л) растворителя. Полученный раствор охлаждают в атмосфере азота до комнатной температуры и к нему в течение 2 ч добавляют 97%-ный N,N-карбонилдиимидазол (163,9 г; 0,98 моль), используя архимедов винт и завихрение с бутан-2-оном (100 мл). Смесь нагревают до температуры дефлегмации в течение 1 ч, перемешивают в течение следующих 30 мин, оставляют охладиться и перемешивают при комнатной температуре в течение дальнейших 18 ч. Далее соединение,указанное в заголовке подготовительного примера 131 (245,3 г; 1,0 моль), промывают, используя бутан-2-он (20 мл), и реакционную смесь перемешивают при температуре дефлегмации в течение 32 ч и затем при комнатной температуре в течение 18 ч. Полученное твердое вещество собирают, дважды промывают бутан 2-оном (300 мл, затем 150 мл), высушивают с вакуум-отсосом и затем перемешивают с водой(1,725 л) в течение 30 мин. Фильтрование дает твердое вещество, которое промывают водой(215 мл) и высушивают при 55 С, получая указанное в заголовке соединение (385,1 г; 66%) в виде твердого вещества беловатой окраски, т.пл. 191-192 С. Обнаружено: С 57,43; Н 6,38; N 16,69. С 28 Н 37N7O5S соответствует: С 57,62; Н 6,39; N 16,80.(СDСl3): 1.05 (9 Н, m), 2.04 (2 Н, m), 2.38MCHP: m/z 584 (М+1)+. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы при котором соединение формулы (ХА) илиHet представляет собой С-связанную 6 членную гетероциклическую группу, содержащую один или два атома азота, возможно в форме его моно-N-оксида, либо С-связанную 5 членную гетероциклическую группу, содержащую от одного до четырех гетероатомов, выбранных из азота, кислорода и серы, причем любая из указанных гетероциклических групп возможно замещена одним или двумя заместителями, выбранными из С 1-С 4 алкила, возможно замещенного С 1-С 4 алкоксигруппой, С 1-С 4 алкоксигруппы, галогено и NH2; Аr представляет собой фенил, возможно замещенный одним или двумя заместителями,выбранными из С 1-С 4 алкила, С 1-С 4 алкоксигруппы, галогено, CN, CONH2, NO2, NH2,NHSO2(C1-C4 алкил) и SO2NH2; и 52 2. Способ по п.1, где R1 представляет собой С 1-С 2 алкил, замещенный С 3-С 5 циклоалкилом,CONR5R6 или N-связанной гетероциклической группой, выбранной из пиразолила, триазолила,морфолинила и 4-R9-пипepaзинилa; (CH2)nHet или (СН 2)nАr; R5 представляет собой Н, а R6 представляет собой С 1-С 4 алкил, возможно замещенный С 1-С 4 алкоксигруппой, или R5 и R6 вместе с атомом азота, к которому они присоединены, образуют морфолинильную группу; Het выбран из пиридинила, 1-оксидопиридинила,пиридазинила, пиримидинила, пиразинила,имидазолила, изоксазолила, тиазолила, триазолила и оксадиазолила, каждый из которых возможно замещен одним или двумя заместителями, выбранными из СН 3, СН 2 СН 2OСН 3, ОСН 3 иNH2; и R2, R3, R4, R9, Аr и n такие, как определено ранее в п.1. 3. Способ по п.2, где R1 представляет собой замещенный циклобутилом,С 1-С 2 алкил,CONR5R6, пиразол-1-илом, 1,2,3-триазол-1 илом, 1,2,4-триазол-1-илом, морфолин-4-илом или 4-метилпиперазин-1-илом; пиримидин-2-ил;CH2Het или (CH2)nAr; R2 представляет собой C1 С 3 алкил; R3 представляет собой C1-С 3 алкил,возможно замещенный С 1-С 2 алкоксигруппой; R5 представляет собой Н, а R6 представляет собой С 1-С 2 алкил,возможно замещенный С 1 С 2 алкоксигруппой, или R5 и R6 вместе с атомом азота, к которому они присоединены, образуют морфолин-4-ильную группу; R10 представляет собой С 1-С 2 алкил, возможно однозамещенный ОН, ОСН 3 либо CONH2; Het выбран из пиридин 2-ила, 1-оксидопиридин-2-ила, пиридин-3-ила,пиридазин-3-ила, пиридазин-4-ила, пиримидин 4-ила, пиримидин-5-ила, пиразин-2-ила, 3 метоксипиридин-2-ила, 6-аминопиридин-2-ила,1-метилимидазол-2-ила,3,5-диметилизоксазол-4-ила, 2-метилтиазол-4-ила, 1-метил 1,2,4-триазол-5-ила,1-(2-метоксиэтил)-1,2,4 триазол-5-ила, 4-метил-1,2,4-триазол-3-ила, 3 метил-1,2,4-триазол-5-ила, 1,2,4-оксадиазол-3 ила и 5-метил-1,2,4-оксадиазол-3-ила; Аr выбран из фенила, 4-хлорфенила, 4-бромфенила, 2 цианофенила, 2-карбамоилфенила, 4-карбамоилфенила, 2-нитрофенила, 4-нитрофенила, 2 аминофенила, 4-аминофенила, 2-метансульфонамидофенила, 4-метансульфонамидофенила,4-этансульфонамидофенила, 4-(проп-2-илсульфонамидо)фенила и 4-сульфамоилфенила; и n такой, как определено ранее в п.2. 4. Способ по п.3, где R1 представляет собой циклобутилметил, морфолин-4-илкарбонилметил, 2-(морфолин-4-ил)этил, пиримидин-2-ил,CH2Het или (CH2)nAr; R2 представляет собой СН 2 СН 3 или СН 2 СН 2 СН 3; R3 представляет собой СН 2 СН 3, СН 2 СН 2 СН 3 или СН 2 СН 2OСН 3; R10 представляет собой СН 3, СН 2 СН 3 или СН 2 СН 2OН; Het выбран из пиридин-2-ила, пиридазин-3-ила, пиразин-2-ила, 3-метоксипиридин-2-ила, 6-аминопиридин-2-ила, 1-метилимидазол-2-ила, 3,5-диметилизоксазол-4-ила, 1 53 метил-1,2,4-триазол-5-ила, 1-(2-метоксиэтил)1,2,4-триазол-5-ила и 5-метил-1,2,4-оксадиазол 3-ила; Аr выбран из фенила, 2-аминофенила, 2 метансульфонамидофенила, 4-метансульфонамидофенила, 4-этансульфонамидофенила и 4(проп-2-илсульфонамидо)фенила; и n такой, как определено ранее в п.3. 5. Соединение формулы (XI)R10 представляет собой Н или С 1-С 4 алкил,возможно замещенный ОН, С 1-С 4 алкоксигруппой или CONH2; при условии, что когда R3 представляет собой этил, тогда R4 не является 4-метилпиперазин-1-илсульфонилом. 6. Соединение по п.5, где R3 представляет собой C1-С 3 алкил, возможно замещенный С 1-С 2 алкоксигруппой; R10 представляет собой С 1-С 2 алкил, возможно однозамещенный ОН, ОСН 3 либо CONH2. 7. Соединение по п.6, где R3 представляет собой СН 2 СН 3, СН 2 СН 2 СН 3 или СН 2 СН 2OСН 3;R10 представляет собой СН 3, СН 2 СН 3 или СН 2 СН 2OН.
МПК / Метки
МПК: C07D 403/04, C07D 487/04, C07D 403/06, C07D 231/40, A61K 31/519
Метки: кислоты, новые, сульфонилбензойные, использованием, 4-бензамидопиразоло-5-карбоксамидов, получения, способ
Код ссылки
<a href="https://eas.patents.su/28-4315-novye-sulfonilbenzojjnye-kisloty-i-sposob-polucheniya-4-benzamidopirazolo-5-karboksamidov-s-ih-ispolzovaniem.html" rel="bookmark" title="База патентов Евразийского Союза">Новые сульфонилбензойные кислоты и способ получения 4-бензамидопиразоло-5-карбоксамидов с их использованием</a>
Предыдущий патент: Способ синтеза n-[(s)-1-карбоксибутил]-(s)-аланиновых эфиров и их применение в синтезе периндоприла
Следующий патент: Способ лечения гиперсекреции слизи
Случайный патент: Способ периодической переработки вторичных материалов во вращающихся реакторах
































