Новые производные дигидроксигексановой кислоты
Номер патента: 3137
Опубликовано: 27.02.2003
Авторы: Браун Мэттью Фрэнк, Кэт Джон Чарлз, Посс Кристофер Стенли
Формула / Реферат
1. Соединение формулы
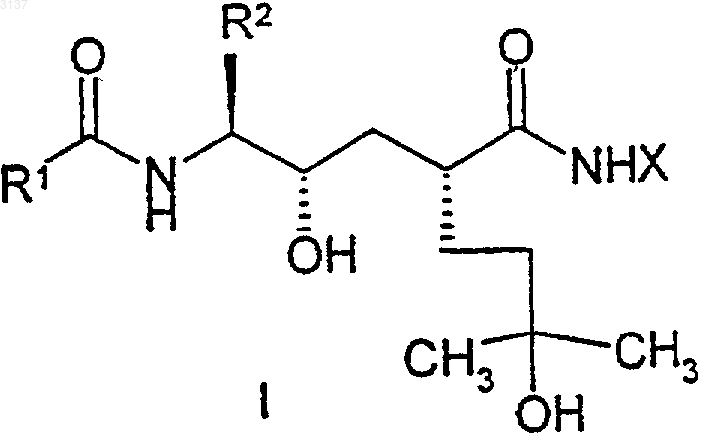
где указанное соединение представляет собой
[4(R)-карбамоил-1(S)-(3-хлорбензил)-2(S),7-дигидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
(IS)-бензил-4(R)-карбамоил-2(S),7-дигидрокси-7-метилоктил)амид 7,8-дифторхинолин-3-карбоновой кислоты;
(1(S)-бензил-4(R)-карбамоил-2(S),7-дигидрокси-7-метилоктил)амид 6,7,8-трифторхинолин-3-карбоновой кислоты;
[4(R)-карбамоил-1(S)-(3-фторбензил)-2(S),7-дигидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
(1(S)-бензил-2(S),7-дигидрокси-4(R)-гидроксикарбамоил-7-метилоктил)амид хиноксалин-2-карбоновой кислоты;
[4(R)-карбамоил-1(S)-(2-хлорбензил)-2(S),7-дигидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[1(S)-(2-фторбензил)-2(S),7-дигидрокси-4(R)-гидроксикарбамоил-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[4(R)-карбамоил-1(S)-(2-фторбензил)-2(S),7-дигидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[1(S)-(3,4-дифторбензил)-2(S),7-дигидрокси-4(R)-гидроксикарбамоил-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[4(R)-карбамоил-1(S)-(3,4-дифторбензил)-2(S),7-дигидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты или
(4(R)-карбамоил-2(S),7-дигидрокси-7-метил-1(S)-нафталин-1-илметилоктил)амид хиноксалин-2-карбоновой кислоты.
2. Фармацевтическая композиция для лечения или профилактики нарушения или состояния, выбранного из аутоиммунных заболеваний, острых и хронических воспалительных состояний, аллергических состояний, инфекции, связанной с воспалением, вирусом, отторжения ткани при трансплантации, атеросклероза, рестеноза, ВИЧ-инфекции и грануломатоза, у млекопитающего, содержащая соединение по п.1, которое эффективно для лечения или профилактики такого нарушения или состояния, и фармацевтически приемлемый носитель.
3. Фармацевтическая композиция для лечения или профилактики нарушения или состояния, которое можно лечить или предупредить путем ингибирования связывания MIP-1a с рецептором CCR1 у млекопитающего, содержащая количество соединения по п.1 или его фармацевтически приемлемой соли, эффективное для лечения или профилактики такого нарушения или состояния, и фармацевтически приемлемый носитель.
4. Способ лечения или профилактики нарушения или состояния, выбранного из аутоиммунных заболеваний, острых и хронических воспалительных состояний, аллергических состояний, инфекции, связанной с воспалением, вирусом, отторжения ткани при трансплантации, атеросклероза, рестеноза, ВИЧ-инфекции и грануломатоза у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения по п.1 или его фармацевтически приемлемой соли, которое эффективно для лечения или профилактики такого нарушения или состояния.
5. Способ лечения или профилактики нарушения или состояния, которое можно лечить или предотвратить антагонистическим действием на рецептор CCR1 у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения по п.1 или его фармацевтически приемлемой соли, которое эффективно для лечения или профилактики такого нарушения или состояния.
6. Фармацевтическая композиция для лечения или профилактики нарушения или состояния, выбранного из аутоиммунных заболеваний, острых и хронических воспалительных состояний, аллергических состояний, инфекции, связанной с воспалением, вирусом, отторжения ткани при трансплантации, атеросклероза, рестеноза, ВИЧ-инфекции и грануломатоза у млекопитающего, содержащая эффективное для антагонистического действия на рецептор CCR1 количество соединения по п.1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
7. Фармацевтическая композиция для лечения или профилактики нарушения или состояния, которое можно лечить или предотвратить антагонистическим действием на рецептор CCR1 у млекопитающего, содержащая эффективное для антагонистического действия на рецептор CCR1 количество соединения по п.1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
Текст
1 Предпосылки изобретения Данное изобретение относится к новым производным дигидроксигексановой кислоты,способам их применения и содержащих их фармацевтическим композициям. Соединения данного изобретения являются сильнодействующими и селективными ингибиторами связывания МIР-1 с его CCR1 рецептором, обнаруженным на воспалительных и иммуномодуляторных клетках (предпочтительно, лейкоцитах и лимфоцитах). CCR1 рецептор иногда называется также как CCCKRI-рецептором. Эти соединения ингибируют также индуцированный MIP-1 (и относящимся к нему хемокином, который как показано, взаимодействует с CCR1 (например, RANTES и МСР-3, хемотаксис клеток ТНР-1 и лейкоцитов человека, и потенциально пригодны для лечения или профилактики аутоиммунных заболеваний (таких как ревматоидный артрит, диабет типа I (с недавним началом), воспалительное заболевание кишечника, ретробульбарный неврит, псориаз, рассеянный склероз, полимиалгический ревматизм, увеит и васкулит), острых и хронических воспалительных состояний (таких как остеоартрит, респираторный дистресссиндром взрослого человека, респираторный дистресс-синдром грудных детей, ишемическое реперфузионное повреждение и гломерулонефрит), аллергических состояний (таких как астма и атопический дерматит), инфекции, связанной с воспалением (такой как вирусное воспаление(включая грипп и гепатит) и болезнь ГийенаБарре), отторжения ткани при трансплантацииMIP-1 и RANTES являются растворимыми хемотактическими пептидами (хемокинами),которые продуцируются воспалительными клетками, в частности, лимфоцитами CD8+, полиморфоядерными лейкоцитами (PMNs) и макрофагами, J. Biol. Chem., 270 (30) 29671-29675(1995). Эти хемокины действуют путем индуцирования миграции и активации ключевых воспалительных и иммуномодуляторных клеток. Повышенные уровни хемокинов были найдены в синовиальной жидкости у пациентов с ревматоидным артритом, у пациентов с отторжением трансплантированной ткани, в том числе хроническим, и в назальных выделениях у пациентов с аллергическим ринитом после воздействия аллергена (Teran, et al., J. Immunol., 1806-1812(1996) and Kuna et al., J. Allergy Clin. Immunol. 321 (1994. Антитела, которые препятствуют взаимодействию хемокин/рецептор путем нейтрализации MIP-1 или разрыва гена, обеспечивали прямое доказательство роли MIP-1 иRANTES в заболевании путем ограничения рек 003137Cook et al., Science, 269, 1583 (1995. Одновременно эти данные показывают, что антагонистыCCR1 могут быть эффективными при лечении нескольких, основанных на иммунитете, заболеваний. Соединения, описанные в пределах данного изобретения, являются хорошо растворимыми, сильнодействующими и селективными антагонистами CCR1. Патент США 4923864, выданный 8 мая 1990, относится к некоторым гетероциклическим гексанамидам, которые можно использовать для лечения гипертензии. Публикация РСТ WO 89/01488, опубликованная 23 февраля 1989, относится к ингибирующим ренин пептидам, которые имеют непептидные связи. Публикация РСТ WO 93/025057, опубликованная 4 февраля 1993, относится к аналогам дипептидов, которые, как заявлено, ингибируют ретровирусные протеазы. Публикация РСТ WO 93/17003, опубликованная 2 сентября 1993, относится к другим аналогам дипептидов, которые, как заявлено,ингибируют ретровирусные протеазы. Публикация РСТ WO 92/17490, опубликованная 15 октября 1992, относится к пептидам,содержащим, по меньшей мере, один 0 фосфатный моноэфир или диэфир. Заявлено,что данные соединения обладают активностью для ингибирования ретровирусов. Публикация Европейского патента 708065,опубликованная 24 апреля 1996, относится к антивирусным ингибиторам эфиров аспартатпротеазы. Предварительная заявка на патент США 60/039169, поданная 26 февраля 1997, относится к другим производным гексановой кислоты,которые также являются антагонистами взаимодействия MIP-1/RANTES с CCR1. Краткое изложение сущности изобретения Данное изобретение относится к соединениям формулы I где указанное соединение представляет собой(4(R)-карбамоил-2(S),7-дигидрокси-7-метил-1(S)-нафталин-1-илметилоктил)амид хиноксалин-2-карбоновой кислоты; и их фармацевтически приемлемым солям. Данное изобретение относится также к фармацевтически приемлемым кислотно-аддитивным солям соединений формулы I. Кислоты,которые используют для получения фармацевтически приемлемых, кислотно-аддитивных солей вышеупомянутых основных соединений данного изобретения, являются кислотами, которые образуют нетоксичные кислотноаддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлоридная, гидробромидная, гидроиодидная, нитратная, сульфатная, бисульфатная, фосфатная, кислая фосфатная, ацетатная, лактатная,цитратная, кислая цитратная, тартратная, битартратная, сукцинатная, малеатная, фумаратная,глюконатная, сахаратная, бензоатная, метансульфонатная, этансульфонатная, бензолсульфонатная, п-толуолсульфонатная и памоатная[т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоатная)] соли. Изобретение относится также к основноаддитивным солям формулы I. Химическими основаниями, которые можно использовать в качестве реагентов для получения фармацевтически приемлемых основных солей тех соединений формулы I, которые кислотны по природе, являются основания, которые образуют нетоксичные основные соли с такими соединениями. Такие нетоксичные основные соли включают, но не ограничиваются ими, соли, полученные из фармакологически приемлемых катионов, таких как катионы щелочных металлов(например, калия и натрия) и катионы щелочноземельных металлов (например, кальция и магния), аммониевые или водорастворимые аминоаддитивные соли, такие как N-метилглюкамин(меглумин), и низшие алканоламмониевые и другие основные соли фармацевтически приемлемых органических аминов. Данное изобретение относится также к фармацевтической композиции для лечения или профилактики нарушения или состояния, выбранного из аутоиммунных заболеваний (таких как ревматоидный артрит, диабет типа I (с недавним началом), воспалительное заболевание кишечника, ретробульбарный неврит, псориаз,рассеянный склероз, полимиалгический ревматизм, увеит и васкулит), острых и хронических воспалительных состояний (таких как остеоартрит, респираторный дистрес-ссиндром взрослого человека, респираторный дистрес-ссиндром грудных детей, ишемическое реперфузионное повреждение и гломерулонефрит), аллергических состояний (таких как астма и атопический дерматит), инфекции, связанной с воспалением(такой как вирусное воспаление (включая грипп и гепатит) и болезнь Гийена-Барре), отторжения ткани при трансплантации, атеросклероза, рестеноза, ВИЧ-инфекции (использование сорецептора) и гранулематозных заболеваний (в том числе саркоидоз, проказу и туберкулез) у млекопитающего, предпочтительно человека, содержащей количество соединения формулы I или его фармацевтически приемлемой соли,эффективное для лечения или профилактики такого нарушения или состояния, и фармацевтически приемлемый носитель. Данное изобретение относится также к фармацевтической композиции для лечения или профилактики нарушения или состояния, которое можно лечить или предупредить путем ингибирования связывания МIР-1 с рецепторомCCR1 у млекопитающего, предпочтительно человека, содержащей количество соединения формулы I или его фармацевтически приемлемой соли, эффективное для лечения или профилактики такого нарушения или состояния, и фармацевтически приемлемый носитель. Примеры таких нарушений и состояний перечислены в предыдущем абзаце. Данное изобретение относится также к способу лечения или профилактики нарушения или состояния, выбранного иэ аутоиммунных заболеваний (таких как ревматоидный артрит,диабет типа I (с недавним началом), воспалительное заболевание кишечника, ретробульбарный неврит, псориаз, рассеянный склероз, полимиалгический ревматизм, увеит и васкулит),острых и хронических воспалительных состояний (таких как остеоартрит, респираторный дистресс-синдром взрослого человека, респираторный дистресс-синдром грудных детей, ишемическое реперфузионное повреждение и гломерулонефрит), аллергических состояний (таких как астма и атопический дерматит), инфекции,связанной с воспалением (такой как вирусное воспаление (включая грипп и гепатит) и болезнь Гийена-Барре), отторжения ткани при транс 5 плантации, атеросклероза, рестеноза, ВИЧинфекции (использование сорецептоpa) и гранулематозных заболеваний (в том числе саркоидоз, проказу и туберкулез) у млекопитающего,предпочтительно человека, включающему введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения формулы I или его фармацевтически приемлемой соли, которое эффективно для лечения или профилактики такого нарушения или состояния. Данное изобретение относится также к способу лечения или профилактики нарушения или состояния, которое можно лечить или предотвратить антагонистическим действием на рецептор CCR1 у млекопитающего, предпочтительно человека, включающему введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения формулы I или его фармацевтически приемлемой соли, которое эффективно для лечения или профилактики такого нарушения или состояния. Данное изобретение относится также к фармацевтической композиции для лечения или профилактики нарушения или состояния, выбранного из аутоиммунных заболеваний (таких как ревматоидный артрит, диабет типа I (с недавним началом), воспалительное заболевание кишечника, ретробульбарный неврит, псориаз,рассеянный склероз, полимиалгический ревматизм, увеит и васкулит), острых и хронических воспалительных состояний (таких как остеоартрит, респираторный дистресс-синдром взрослого человека, респираторный дистресс-синдром грудных детей, ишемическое реперфузионное повреждение и гломерулонефрит), аллергических состояний (таких как астма и атопический дерматит), инфекции, связанной с воспалением(такой как вирусное воспаление (включая грипп и гепатит) и болезнь Гийена-Барре), отторжения ткани при трансплантации, атеросклероза, рестеноза, ВИЧ-инфекции (использование сорецептора) и гранулематозных заболеваний (в том числе саркоидоз, проказу и туберкулез), у млекопитающего, предпочтительно человека, содержащей эффективное для антагонистического действия на рецептор CCR1 количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Данное изобретение относится также к фармацевтической композиции для лечения или профилактики нарушения или состояния, которое можно лечить или предотвратить антагонистическим действием на рецептор CCR1 у млекопитающего, предпочтительно человека, содержащей эффективное для антагонистического действия на рецептор CCR1 количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. 6 Данное изобретение относится также к способу лечения или профилактики нарушения или состояния, выбранного из аутоиммунных заболеваний (таких как ревматоидный артрит,диабет типа I (с недавним началом заболевания), воспалительное заболевание кишечника, ретробульбарный неврит, псориаз,рассеянный склероз, полимиалгический ревматизм, увеит и васкулит), острых и хронических воспалительных состояний (таких как остеоартрит, респираторный дистресс-синдром взрослого человека, респираторный дистресс-синдром грудных детей, ишемическое реперфузионное повреждение и гломерулонефрит), аллергических состояний (таких как астма и атопический дерматит), инфекции, связанной с воспалением(такой как вирусное воспаление (включая грипп и гепатит) и болезнь Гийена-Барре), отторжения ткани при трансплантации, атеросклероза, рестеноза, ВИЧ-инфекции (использование сорецептора) и гранулематозных заболеваний (в том числе саркоидоз, проказу и туберкулез) у млекопитающего,предпочтительно человека,включающему введение млекопитающему, нуждающемуся в таком лечении или профилактике, эффективного для антагонистического действия на рецептор CCR1 количества соединения формулы I или его фармацевтически приемлемой соли. Данное изобретение включает в себя также фармацевтические композиции, содержащие пролекарства соединений формулы I, и способы лечения или профилактики, включающие введение пролекарств соединений формулы I. Соединения формулы I, имеющие свободные амино, амидо, гидрокси или карбоксильные группы,можно превратить в пролекарства. Пролекарства включают соединения, у которых аминокислотный остаток или полипептидная цепь из двух или более (например, двух, трех или четырех) аминокислотных остатков, которые ковалентно связаны через пептидные связи, связывается со свободными амино, гидрокси или группами карбоновых кислот соединений формулы I. Аминокислотные остатки включают 20 природных аминокислот, обычно обозначаемых символами из трех букв, и включают также 4 гидроксипролин, гидроксилизин, демозин, изодемозин, 3-метил-гистидин, норвалин, бетааланин, гамма-аминомасляную кислоту, цитрулин, гомоцистеин, гомосерин, орнитин и метионинсульфон. Пролекарства включают также соединения, где карбонаты, карбаматы, амиды и алкиловые сложные эфиры ковалентно связаны с вышеуказанными заместителями формулы I через карбонильный углерод боковой цепи пролекарства. Пролекарства включают также соединения формулы I, в которых амидный азот и гидроксигруппа, взятые вместе, образуют циклическую группу, такую как группа следующей формулы где R1 и R2 такие как определено в формуле I, иU и V, независимо, представляют карбонил, метилен, SO2 или SО 3 и b равно целому числу от одного до трех, где каждая метиленовая группа необязательно замещена гидрокси. Подробное описание изобретения Соединения формулы I можно получить в соответствии со следующей схемой реакции и следующим обсуждением. Схема 1 Схема 1 относится к получению соединении формулы I, имеющих точную стереохимию, Соединения формулы I, или любое из его промежуточных соединений, можно разделить колоночной хроматографией по способам, хорошо известным специалистам в данной области, чтобы получить чистые соединения формулы I. В соответствии со схемой 1, соединения формулы I можно получить из соединений формулы II взаимодействием с аммиаком или другим летучим амином с низкой молекулярной массой в полярном растворителе при температуре от примерно -10C до примерно 35C,предпочтительно, при примерно 30C. Подходящие растворители включают спирты, такие как метанол, этанол или бутанолы; или простые эфиры, такие как глим или диоксан (с эфирным растворителем можно использовать кислотный катализатор). Предпочтительным растворителем является метанол. Соединения формулы II получают сочетанием соединения формулы III с кислотой фор 003137 8 мулы R1 СO2H (или ее хлорангидридом, где R1 представляет хиноксалин-2-карбоновую кислоту, 7,8-дифторхинолин-3-карбоновую кислоту или 6,7,8-трифторхинолин-3-карбоновую кислоту). Такую реакцию сочетания обычно проводят при температуре от примерно -30C до примерно 80C, предпочтительно от примерно 0 С до около 25C. Примерами подходящих сочетающих реагентов, которые активируют функциональную группу карбоновой кислоты, являются дициклогексилкарбодиимид/гидроксибензотриазол (DCC/HBT), N-3-диметиламинопропилN'-этилкарбодиимид (EDC)/НВТ, 2-этокси-1 этоксикарбонил-1,2-дигидрохинолин (EEDQ),карбонилдиимидазол (CDI)/диметиламинопиридин (DMAP) и диэтилфосфорилцианид. Сочетание проводят в инертном растворителе, предпочтительно, апротонном растворителе, таком как ацетонитрил, дихлорметан, хлороформ и диметилформамид. Предпочтительным растворителем является дихлорметан. Для обсуждения других условий, используемых для амидного сочетания см. HoubenWeyl, Vol. XV, part. II, Е. Wunsch, Ed., GeorgePress, New York) 1979-1983. Соединения формулы III можно получить путем снятия защиты и алкенового гидролиза соединений формулы IV взаимодействием с трифторуксусной кислотой. Подходящие защитные группы формулы Р включают третбутоксикарбонил. Соединения формулы IV можно получить взаимодействием соединения формулы V с 4 бром-2-метил-2-бутеном в присутствии сильного основания в апротонном полярном растворителе. Подходящие основания включают диалкиламиды лития, такие как N-изопропил-N-циклогексиламид лития, LDA или гидрид калия. Подходящие растворители включают простые эфиры (такие как ТГФ (тетрагидрофуран), глим или диоксан), бензол или толуол, предпочтительно,ТГФ. Вышеуказанную реакцию проводят при температуре примерно -78C до примерно 0C,предпочтительно, при примерно - 78C. Соединения формулы V можно получить способами, хорошо известными специалистам в данной области, или они могут быть коммерчески доступны. Конкретно, соединения формулыV можно получить способом Fray et. al. , (J. Org. Соединения формулы VII получают восстановлением аминокислот или сложных ами 9 ноэфиров в спирты (Stanfield et al., J. Org. Chem. 46, 4799-4800 (1981), Soai et al., Bull. Chem. Soc.Jpn ., 57, 2327 (1984 с последующим окислением спиртов в альдегиды формулы VII (Luly et(1991. Неприродные аминокислоты можно получить по способу Myers et al., Tet. Lett. 36,(1995) and Myers et al., J, Am. Chem. Soc., 117,8488-8489 (1995). Альтернативно, соединения формулы V можно также получить по способу DeCamp etal., (Tetrahedron Lett., 32, 1867 (1991. Если не оговорено особо, давление каждой из вышеуказанных реакций не является критическим. Реакции, обычно, проводят при давлении от примерно 1 до примерно 3 атмосферы,предпочтительно, при окружающей среды давлении (примерно 1 атм). Соединения формулы I, которые являются основными по природе, способны образовывать большое число различных солей с разными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемы для введения животным, на практике часто желательно сначала выделить соединение формулы I из реакционной смеси в виде фармацевтически неприемлемой соли и затем просто превратить последнюю в свободное основное соединение обработкой щелочным реагентом и затем превратить свободное основание в фармацевтически приемлемую кислотноаддитивную соль. Кислотно-аддитивные соли основных соединений данного изобретения легко получают обработкой основного соединения,по существу, эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После осторожного выпаривания растворителя получают целевую твердую соль. Кислоты, которые используют для получения фармацевтически приемлемых кислотноаддитивных солей основных соединений данного изобретения, являются кислотами, которые образуют нетоксичные кислотно-аддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлоридная,гидробромидная, гидроиодидная, нитратная,сульфатная или бисульфатная, фосфатная или кислая фосфатная, ацетатная, лактатная, цитратная или кислая цитратная, тартратная или битартратная, сукцинатная, малеатная, фумаратная, глюконатная, сахаратная, бензоатная,метансульфонатная, этансульфонатная, бензолсульфонатная, п-толуолсульфонатная и памоатная[т.е. 1,1'-метилен-бис-(2-гидрокси-3 нафтоатная)] соли. Те соединения формулы I, которые также кислотны по природе, способны образовывать основные соли с различными фармакологически 10 приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или щелочноземельных металлов, и особенно, соли натрия и калия. Все эти соли получают общепринятыми методиками. Химическими основаниями, которые используют в качестве реагентов для получения фармацевтически приемлемых основных солей данного изобретения, являются химические основания, которые образуют нетоксичные основные соли с описанными здесь кислотными соединениями формулы I. Эти нетоксичные основные соли включают соли, полученные из таких фармакологически приемлемых катионов,как катионы натрия, калия, кальция и магния и т.д. Эти соли можно легко получить обработкой соответствующих кислотных соединений водным раствором, содержащим требуемые фармакологически приемлемые катионы, и затем выпариванием получаемого раствора досуха,предпочтительно, при пониженном давлении. Альтернативно, их можно также получить перемешиванием вместе растворов кислотных соединений в низшем спирте и требуемого алкоксида щелочного металла, и затем выпариванием получаемого раствора досуха таким же образом, как указано выше. В любом случае,предпочтительно, используют стехиометрические количества реагентов, чтобы обеспечить полноту реакции и максимальный выход продукта. Соединения формулы I и их фармацевтически приемлемые соли (далее называемые также совокупно, как активные соединения) являются сильнодействующими антагонистами рецепторов CCR1. Эти активные соединения полезны для лечения или профилактики аутоиммунных заболеваний (таких как ревматоидный артрит, диабет типа I (с недавним началом заболевания), воспалительное заболевание кишечника, ретро-бульбарный неврит, псориаз,рассеянный склероз, полимиалгический ревматизм, увеит и васкулит), острых и хронических воспалительных состояний (таких как остеоартрит, респираторный дистресс-синдром взрослого человека, респираторный дистресс-синдром грудных детей, ишемическое реперфузионное повреждение и гломерулонефрит), аллергических состояний (таких как астма и атопический дерматит) инфекции, связанной с воспалением(такой как вирусное воспаление (включая грипп и гепатит) и болезнь Гийена-Барре, отторжения ткани при трансплантации, хронического и острого, атеросклероза, рестеноза, ВИЧинфекции (использование сорецептора) и гранулематозных заболеваний (в том числе саркоидоза, проказы и туберкулеза). Активность соединений изобретения можно оценить по методикам, известным специалистам в данной области. Примеры признанных методов определения индуцированной CCR1 миграции можно найти в Coligan, J. E., Kruisbeek, А.М., Margulies, D.H., Shevach, Е.М., Stro 11ber, W. editors: Current Protocols in Immunology,6.12.1 - 6.12.3 (John Wiley and Sons, NY, 1991). Один конкретный пример того, как определить активность соединения для ингибирования миграции, описывается подробно ниже. Определение хемотаксиса Способность соединений ингибировать хемотаксис к различным хемокинам можно оценить с использованием стандартных 48- или 96-луночных камер Boyden'a с 5-микронным поликарбонатным фильтром. Все реагенты и клетки можно приготовить в стандартной культуральной среде для тканей RPMI (BioWhitikkerInc.), дополненной 1 мг/мл сывороточного альбумина течения. Вкратце, MIP-1 (Peprotech,Inc., P.O. Box 275, Rocky Hill NJ) или другие испытуемые агонисты помещали в нижние отделения камеры Boyden'a. Затем прикладывали поликарбонатный фильтр и прикрепляли верхнее отделение. Количество выбранного агониста представляет собой количество, определенное для получения максимального количества хемотаксиса в этой системе (например, 1 нМ дляMIP-1 оно должно быть адекватным). Клетки ТНР-1 (АТСС TIB-202), первичные моноциты человека, или первичные лимфоциты,выделенные стандартными методиками, можно затем добавить в верхние отделения в тройном повторе вместе с различными концентрациями испытуемого соединения. Разведения соединений можно приготовить с использованием стандартных серологических методик и затем смешать с клетками перед добавлением в камеру. После подходящего периода инкубации при 37C (например, 3,5 ч для клеток ТНР-1, 90 мин для первичных моноцитов) камеру удаляют, клетки в верхнем отделении отсасывают,верхнюю часть фильтра вытирают и число мигрирующих клеток можно определить следующим методом. Для клеток ТНР-1, камеру (96-луночный вариант, изготовленный Neuroprobe) можно центрифугировать для выталкивания клеток из нижнего отделения и число клеток можно количественно определить по сравнению со стандартной кривой по изменению цвета красителя флуороцеиндиацетата. Для первичных моноцитов человека или лимфоцитов фильтр можно окрасить красителемDif Quik (American Scientific Products) и число мигрирующих клеток можно определить микроскопическим способом. Число клеток, мигрирующих в присутствии соединения, делят на число клеток, мигрирующих в контрольных лунках (без соединения). Получаемое число представляет собой % ингибирование для соединения, которое можно затем с помощью стандартных графических методик нанести на график в зависимости от концентрации используемого соединения. Затем определяют точку 50% ингибирования с исполь 003137 12 зованием метода линейной аппроксимации для всех испытуемых концентраций. Линейная аппроксимация для всех данных точек должна иметь коэффициент корреляции (R квадратичный)90%, чтобы считать определение действительным. Все соединения изобретения, которые были испытаны, имели при определении хемотаксиса IC50 ниже, чем 25 мкМ. Композиции данного изобретения можно изготовить общепринятым способом с использованием одного или более фармацевтически приемлемых носителей. Так, активные соединения данного изобретения можно изготовить в форме препарата для перорального, трансбуккального, интраназального, парентерального(например, внутривенного, внутримышечного или подкожного) или ректального введения или в форме, подходящей для введения ингаляцией или инсуффляцией. Активные соединения данного изобретения можно также изготовить в форме препарата для пролонгированного действия. Для перорального введения фармацевтические композиции могут быть в форме, например, таблеток или капсул, полученных общепринятым способом с фармацевтически приемлемыми эксципиентами, такими как связывающие агенты (например, предварительно желатинированный маисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микронекристаллическая целлюлоза или фосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); дезинтегранты (например, картофельный крахмал или натриевая соль гликолята крахмала) или увлажняющие средства (например лаурилсульфат натрия). Таблетки можно покрыть способами, хорошо известными в данной области. Жидкие препараты для перорального заведения могут быть в форме, например, растворов, сиропов или суспензий или они могут быть представлены в виде сухого продукта для создания препарата с водой или другим подходящим наполнителем перед использованием. Такие жидкие препараты можно получить общепринятыми способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты(например, сироп сорбита, метилцеллюлоза или гидрированные пищевые жиры); эмульгирующие агенты (например, лецитин или аравийская камедь); неводные носители (например, миндальное масло, маслянистые сложные эфиры или этиловый спирт) и консерванты (например,метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Для трансбуккального введения композиция может быть в форме таблеток или лепешек,приготовленных общепринятым способом. Активные соединения данного изобретения могут быть составлены для парентерального 13 введения инъекцией, в том числе с использованием общепринятых методик катетеризации или инфузией. Составы для инъекции могут быть представлены в стандартной лекарственной форме, например, в ампулах или контейнерах для многократного приема, с добавленным консервантом. Композиции могут быть в таких формах, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать образующие форму агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в форме порошка для воссоздания, перед использованием, с подходящим наполнителем, например, со стерильной апирогенной водой. Активные соединения изобретения могут быть составлены в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащие общепринятые суппозиторные основы, такие как масло какао или другие глицериды. Для интраназального введения или введения ингаляцией, активные соединения изобретения удобным образом доставляют в форме раствора или суспензии из имеющего насос распылительного контейнера, который сжимается или накачивается пациентом, или в виде аэрозольного спрея, подаваемого из находящегося под давлением контейнера или распылителя с использованием подходящего пропелланта, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае находящегося под давлением аэрозоля, стандартную дозу можно определить путем обеспечения клапана для поставки измеренного количества. Находящийся под давлением контейнер или распылитель может содержать раствор или суспензию активного соединения. Могут быть изготовлены капсулы и картриджи (изготовленные,например, из желатина) для использования в ингаляторе или инсуффляторе, содержащие порошкообразную смесь соединения изобретения и подходящей порошкообразной основы, такой как лактоза или крахмал. Предполагаемая доза активных соединений изобретения для перорального, парентерального или трансбуккального введения среднему взрослому человеку для лечения состояний, указанных выше (например, ревматоидного артрита) составляет от 0,1 до 1000 мг активного ингредиента на стандартную дозу, которую можно вводить, например, от 1 до 4 раз в день. Аэрозольные составы для лечения указанных выше состояний (например, ревматоидного артрита), у среднего взрослого человека, предпочтительно, приспосабливают так, чтобы каждая измеренная доза или пуф аэрозоля содержал от 20 мкг до 1000 мкг соединения изобретения. Общая суточная доза с аэрозолем будет находиться в пределах от 0,1 до 1000 мг. Введе 003137 14 ние можно проводить несколько раз в день, например, 2, 3, 4 или 8 раз, вводя, например, 1, 2 или 3 дозы каждый раз. Активные агенты могут быть составлены для пролонгированного действия по способам,хорошо известным специалистам в данной области. Примеры таких составов можно найти в патентах Соединенных Штатов 3538214,4060598, 4173626, 3119742 и 3492397. Соединения изобретения можно также использовать в комбинационной терапии с другими терапевтическими агентами, такими как иммунодепрессивные агенты, например, циклоспорин А и FK-506, Cellcept, рапамицин, леуфлонамид, или с классическими противовоспалительными агентами (например, ингибиторами циклооксигеназы/липоксегеназы), такими как тенидап, аспирин, ацетаминофен, напроксен и пироксикам, стероиды, в том числе преднизон,азатиоприн, и биологическими агентами, такие как ОКТ-3, моноклональные антитела противIL-2 (такие как ТАС). Соединения данного изобретения обладают неожиданной растворимостью, которую нельзя было предсказать на основе патентной заявки США 60/039169, поданной 26 февраля 1997. Конкретно, все соединения данного изобретения имеют лучшую, по меньшей мере в 13 раз, растворимость, чем можно было бы ожидать на основе соединений из предварительной заявки США 60/039169. Конкретно, (2(S)гидрокси-6-метил-4(R)-метилкарбамоил-1(S)нафталин-2-илметилгептил)амид хиноксалин-2 карбоновой кислоты (пример 127) и (N-1(S)бензил-4(R)-карбамоил-7-фотор-2(S)-гидрокси 7-метилоктил)-5,6-дихлорникотинамид (пример 247), оба имеют растворимости меньше чем 5 мкг/мл, при определении по описанному ниже кинетическому анализу растворимости. Следующие примеры иллюстрируют получение соединений данного изобретения. Точки плавления не корректированы. Данные ЯМР приводятся в частях на миллиони относятся к затворному сигналу дейтерия растворителя образца (дейтериохлороформ, если не оговорено особо). Коммерческие реагенты использовали без дополнительной очистки. ТГФ относится к тетрагидрофурану. ДМФ относится к N,Nдиметилформамиду. Хроматография относится к колоночной хроматографии, проведенной с использованием силикагеля 32-63 мм и осуществленной в условиях давления азота (флэшхроматография). Масс-спектры низкого разрешения (LRMS) регистрировали либо при помощи Hewlett Packard 5989, используя химическую ионизацию (аммоний), либо платформы химической ионизации при атмосферном давлении (APCI) Fisons (или Micro Mass), которая использует смесь 50/50 ацетонитрил/вода с 0,1% муравьиной кислотой в качестве ионизирующего агента. Комнатная температура или температура окружающей среды относится к 20-25 С. 15 Все неводные реакции проводили в атмосфере азота для удобства и обеспечения максимального выхода. Концентрирование при пониженном давлении означает, что использовали роторный испаритель. Названия для соединений изобретения присваивали по версии Autonom 2.0 PCbatch информационной системы Beilstein GmbH(ISBN 3-89536-976-4). Растворимость соединений определяли кинетическим анализом растворимости, так как описано в Advanced Drug Delivery Review, 23, 325 (1997). Один вариант метода, описанного вAdvanced Drug Delivery Review, 23, 3-25 (1997),описывается ниже. Специалисту в данной области будет понятно, что растворимость можно определить многими различными методами. Растворимость соединений определяют при четырех установленных концентрациях и выражают как мкг/мл. Растворимость или нерастворимость измеряют в фосфатном буфере с использованием планшета-ридера для снятия турбидиметрических показаний путем автоматизированного микродобавления соединения,предварительно растворенного в ДМСО. Растворимость при 50, 100, 200 и 250 или 100, 200,400 и 500 микрограмм/мл можно определить предварительным растворением 1 мг соединения в достаточном количестве ДМСО, чтобы достичь начальной концентрации 20 или 40 мкг/мкл. УФ-прозрачный 96-луночный микропланшет spectramax 250 заполняют 200 мкл исходного фосфатного буферного раствора с рН 7. Серию из 25 считываний поглощения в матрице 5 на 5 при длине волны 492 нм получали для каждой лунки в микропланшете, содержащем только рН-буфер. Это сканирование следует использовать в качестве контроля (слепого опыта), и величины исходной оптической дисперсии (OD) использовали в качестве базовой линии. Соединения в растворе ДМСО затем добавляют (в виде столбцов) в микропланшет. До двадцати четырех проб анализируют с каждым соединением, помещаемым в четыре смежных лунки в виде столбцов. Каждый столбец микропланшета содержит четыре концентрации соединения с возрастающей концентрацией и в возрастающем порядке рядов (A-D) или рядов(Е-Н). Объем добавленного в каждую лунку исходного ДМСО изменяется от 0,25 до 1,25% объема буфера лунки. Планшет затем встряхивают в течение 20 мин для смешивания смеси. Стандартная процедура распределения: Объем, Мкг соединения в% ДМСО Ряд мкл ДМСО А 0,5 20 0,25 В 1,0 20 0,50 С 2,0 20 1,00 После добавления соединения предпринимают второе сканирование, состоящее из серии двадцати пяти считываний поглощения в матрице 5 х 5 для каждой лунки в микропланшете при той же самой длине волны, которая была в первом сканировании слепого опыта. Исходные величины OD соединений для каждого считывания в матрице 5 х 5 вычитают из соответствующих величин слепого опыта в матрице 5 х 5 для получения исходных данных OD для растворимости. Данные, полученные из ридера Tecan SLRSpectra Image, затем анализируют с использованием компьютерной программы Visual Basic(или их можно вычислить вручную по способам, хорошо известным специалистам в данной области), так чтобы получить данные растворимости для каждого соединения. Считается, что соединение находится вне раствора, когда величина поглощения выше, чем базовая величина, в три раза. Все соединения данного изобретения имели растворимость выше чем 100 мкг/мл. Получение 1. Метод А. Аллильное алкилирование. Трет-Бутиловый сложный эфир 1(S)[4(R)-(3-метилбут-2-енил)-5-оксотетрагидрофуран-2(S)-ил]-2-фенилэтилкарбаминовой кислоты. К высушенной в пламени круглодонной колбе в атмосфере азота добавляют тетрагидрофуран (40 мл), затем 1,1,1,3,3,3-гексаметилдисилазан (8 мл, 37,8 ммоль). Смесь охлаждают до 0 С и добавляют н-бутиллитий (14,5 мл 2,5 М раствора в гексане, 36,0 ммоль). Смесь перемешивают в течение 15 мин, затем охлаждают до -78 С на бане сухой лед/ацетон. По каплям,через шприц добавляют трет-бутиловый сложный эфир 1(S)-[5-оксотетрагидрофуран-2(S)ил]-2-фенилэтилкарбаминовой кислоты (5 г,16,4 ммоль) (получен методом Fray, J. Org.Chem., (51), 4828 (1986, растворенный в тетрагидрофуране (50 мл), и перемешивание продолжают в течение 30 мин. По каплям, через шприц добавляют раствор 4-бром-2-метил-2-бутена(2,07 мл, 18,0 ммоль) в 40 мл ТГФ. Перемешивание продолжают в течение 3 ч, в течение этого времени температура повышается до -60 С. Смесь гасят медленным добавлением насыщенного водного хлорида аммония (25 мл). После нагревания до комнатной температуры раствор разбавляют простым эфиром (300 мл) и переносят в делительную воронку. Органическую фазу промывают насыщенной водной лимонной кислотой (2 х 100 мл), насыщенным водным бикарбонатом натрия (NаНСО 3) (2 х 100 мл) и 100 мл рассола. Органический слой сушат над сульфатом магния (MgSO4) и растворитель удаляют при пониженном давлении. Тонкослойная хро 17 матография в смеси 1:2 гексан/диэтиловый эфир(Et2O) обнаруживает продукт с Rf 0,8. Получаемое сырое масло хроматографируют на силикагеле (225 г) с элюированием смесью 2:1 гексан/диэтиловый эфир, получая 4,73 г (77%) целевого соединения. ТСХ: смесь 1:2 гексан/Et2O(1H, м), 2,24 (1H, м), 1,92 (1H, м), 1,65 (3 Н, с),1,58 (3 Н, с), 1,37 (9 Н, с). Способ В. (1(S)-Бензил-4(R)-карбамоил 2(S),7-дигидрокси-7-метилоктил)амид хиноксалин-2-карбоновой кислоты. К лактону из способа А (100 мг, 0,27 ммоль) добавляют неразбавленную трифторуксусную кислоту (1 мл). Получаемый раствор перемешивают в течение 1 ч и трифторуксусную кислоту удаляют в вакууме. Оставшуюся часть сольватируют в метиленхлориде (10 мл) и триэтиламине (0,15 мл, 1,07 ммоль). Хиноксалилхлорид (58 мг, 0,3 ммоль) добавляют в твердом виде, и смесь перемешивают в течение 18 ч. Смесь переносят в делительную воронку и промывают лимонной кислотой (2 х 10 мл),NаНСО 3 (10 мл) и рассолом (10 мл). Органический слой сушат (MgSO4) и фильтруют. Фильтрат концентрируют в вакууме и получаемый остаток хроматографируют на силикагеле (10 г) с элюированием смесью 2:1 гексан : этилацетат,получая 99 мг хиноксалинамида. Этот материал сольватируют в МеОН и в течение 5 мин барботируют газообразный аммиак. Получаемый раствор перемешивают в течение 16 ч и растворитель удаляют в вакууме. Оставшуюся часть перекристаллизовывают(метиленхлорид/метанол/гексан), получая целевое соединение (90 мг,72%). 1(6 Н, с). Пример 1. (4(R)-Карбамоил-2(S),7-дигидрокси-7-метил-1(S)-тиофен-2-илметилоктил) амид хиноксалин-2-карбоновой кислоты. К высушенной в пламени круглодонной колбе в атмосфере азота добавляют тетрагидрофуран (5 мл), затем 1,1,1,3,3,3-гексаметилдисилазан (0,78 мл, 3,7 ммоль). Смесь охлаждают до 0 С и добавляют н-бутиллитий (1,4 мл 2,5 М раствор в гексанах, 3,38 ммоль). Смесь перемешивают в течение 15 мин, затем охлаждают до -78 С на бане сухой лед/ацетон. По каплям,через шприц добавляют трет-бутиловый слож 003137BOC-L-2-тиенилаланина в качестве исходного материала, растворенный в тетрагидрофуране (6 мл). По каплям, через шприц, добавляют раствор 4-бром-2-метил-2-бутена (0,21 мл, 1,77 ммоль) в 5 мл ТГФ. Перемешивание продолжают в течение 3 ч, в течение этого времени температура повышается до -60 С. Смесь гасят медленным добавлением насыщенного водного хлорида аммония. После нагревания до комнатной температуры раствор разбавляют простым эфиром и переносят в делительную воронку. Органическую фазу промывают насыщенной водной лимонной кислотой, насыщенным водным бикарбонатом натрия (NaHCO3) и рассолом. Органический слой сушат над сульфатом магния (MgSO4) и растворитель удаляют при пониженном давлении. Тонкослойная хроматография в смеси 2:1 гексан/диэтиловый эфир(Et2O) обнаруживает продукт с Rf 0,25. Получаемое сырое масло хроматографируют на силикагеле с элюированием смесью 2:1 гексаны/диэтиловый эфир, получая 450 мг (74%) лактона. К вышеуказанному лактону (450 мг, 1,19 ммоль) добавляют неразбавленную трифторуксусную кислоту (4,5 мл). Получаемый раствор перемешивают в течение 1 ч и трифторуксусную кислоту удаляют в вакууме. Получаемую соль амина (100 мг, 0,34 ммоль) сольватируют в метиленхлориде (15 мл) и триэтиламине (0,2 мл,1,34 ммоль). Хиноксалилхлорид (71 мг, 0,37 ммоль) добавляют в твердом виде, и смесь перемешивают в течение 18 ч. Смесь переносят в делительную воронку и промывают лимонной кислотой, NaНСО 3 и рассолом. Органический слой сушат (MgSO4) и фильтруют. Фильтрат концентрируют в вакууме и получаемый остаток хроматографируют на силикагеле с элюированием смесью 2:1 гексаны:этилацетат, получая 108 мг (71%) хиноксалинамида. Этот материал сольватируют в МеОН и в течение 5 мин барботируют газообразный аммиак. Получаемый раствор перемешивают в течение 16 ч и растворитель удаляют в вакууме. Оставшуюся часть перекристаллизовывают(метиленхлорид/метанол/гексаны), получая целевое соединение (60 мг, 53%). Точка плавления (Т. пл.) 158-159. Масс-спектр низкого разрежения (LRMS) 471, 453, 436. Растворимость выше чем 250 мг/мл. Табл. 1 относится к получению соединений формулы I способами, аналогичными способам получения 1 и примера 1. где указанное соединение представляет собой 2. Фармацевтическая композиция для лечения или профилактики нарушения или состояния, выбранного из аутоиммунных заболеваний, острых и хронических воспалительных состояний, аллергических состояний, инфекции,связанной с воспалением, вирусом, отторжения ткани при трансплантации, атеросклероза, рестеноза, ВИЧ-инфекции и грануломатоза, у млекопитающего, содержащая соединение по п.1,которое эффективно для лечения или профилактики такого нарушения или состояния, и фармацевтически приемлемый носитель. 3. Фармацевтическая композиция для лечения или профилактики нарушения или состояния, которое можно лечить или предупредить путем ингибирования связывания MIP-1 с рецептором CCR1 у млекопитающего, содержащая количество соединения по п.1 или его фармацевтически приемлемой соли, эффективное для лечения или профилактики такого нарушения или состояния, и фармацевтически приемлемый носитель. 4. Способ лечения или профилактики нарушения или состояния, выбранного из аутоиммунных заболеваний, острых и хронических воспалительных состояний, аллергических состояний, инфекции, связанной с воспалением,вирусом, отторжения ткани при трансплантации, атеросклероза, рестеноза, ВИЧ-инфекции и грануломатоза у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения по п.1 или его фармацевтически приемлемой соли, которое эффективно для ле 22 чения или профилактики такого нарушения или состояния. 5. Способ лечения или профилактики нарушения или состояния, которое можно лечить или предотвратить антагонистическим действием на рецептор CCR1 у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения по п.1 или его фармацевтически приемлемой соли, которое эффективно для лечения или профилактики такого нарушения или состояния. 6. Фармацевтическая композиция для лечения или профилактики нарушения или состояния, выбранного из аутоиммунных заболеваний, острых и хронических воспалительных состояний, аллергических состояний, инфекции,связанной с воспалением, вирусом, отторжения ткани при трансплантации, атеросклероза, рестеноза, ВИЧ-инфекции и грануломатоза у млекопитающего, содержащая эффективное для антагонистического действия на рецептор CCR1 количество соединения по п.1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. 7. Фармацевтическая композиция для лечения или профилактики нарушения или состояния, которое можно лечить или предотвратить антагонистическим действием на рецепторCCR1 у млекопитающего, содержащая эффективное для антагонистического действия на рецептор CCR1 количество соединения по п.1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
МПК / Метки
МПК: C07D 241/44, A61P 29/00, C07C 231/00, A61K 31/498
Метки: новые, кислоты, дигидроксигексановой, производные
Код ссылки
<a href="https://eas.patents.su/12-3137-novye-proizvodnye-digidroksigeksanovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные дигидроксигексановой кислоты</a>












