Спироэпоксиды как промежуточные продукты синтеза
Формула / Реферат
1. Способ получения соединения формулы (А)
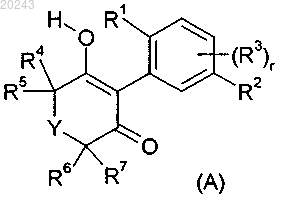
включающий реакцию соединения формулы (I) с кислотой,
где R1 обозначает галоген, С1-С4-алкил, С1-С4-галоалкил, С3-С6-циклоалкил или С1-С4-галоалкокси;
R2 обозначает галоген или фенил, замещенный галогеном, нитро, циано, C1-С2-алкилом, C1-С2-галоалкилом, C1-С2-алкокси или C1-С2-галоалкокси;
r равен 0 или 1;
если r равен 1, то R3 обозначает C1-С3-алкил;
Y обозначает О и
R4, R5, R6 и R7 независимо друг от друга обозначают водород, C1-С2-алкил, C1-С2-галоалкил или С1-С2-алкокси-С1-С2-алкил;
или, где это возможно, его N-окиси или соли.
2. Способ по п.1, где R2 обозначает фенил, замещенный в пара-положении галогеном и необязательно дополнительно замещенный галогеном, нитро, C1-С2-алкилом, С1-С2-галоалкилом, С1-С2-алкокси или С1-С2-галоалкокси.
3. Способ по п.1 или 2, где R2 обозначает фенил, замещенный в пара-положении хлором и необязательно дополнительно замещенный галогеном, нитро, С1-С2-алкилом, C1-С2-галоалкилом, С1-С2-алкокси или С1-С2-галоалкокси.
4. Способ по любому из пп.1-3, где R3 обозначает водород, что означает, что r равно 0.
5. Способ по п.1, где
R1 обозначает этил, метил или циклопропил;
R2 обозначает фенил или фенил, замещенный галогеном или С1-С2-алкилом;
R3 обозначает водород, что означает, что r равно 0; и
R4, R5, R6 и R7 независимо друг от друга обозначают С1-С2-алкил.
6. Способ по п.1, где
R1 обозначает метил, этил, циклопропил, н-пропил, галоген, трифторметокси, дифторметокси или трифторметил;
R2 обозначает галоген или фенил, замещенный галогеном, С1-С2-алкилом, С1-С2-галоалкилом, С1-С2-галоалкокси или C1-С2-алкокси;
R3 обозначает водород, r равно 0;
R4, R5, R6 и R7 независимо друг от друга обозначают водород, метил или этил; и
Y обозначает кислород.
7. Способ по любому из пп.1-6, где кислота обозначает кислоту Бренстеда или кислоту Льюиса.
8. Способ по любому из пп.1-6, где кислота обозначает кислоту Бренстеда, которая представляет собой неорганическую или органическую кислоту.
9. Способ по любому из пп.1-8, где использован пригодный растворитель, выбранный по принципу совместимости с кислотой.
10. Способ по п.9, где пригодный растворитель представляет собой хлорированный углеводород, спирт, эфир, ароматическую или органическую кислоту, или смесь таких растворителей.
11. Способ по п.10, где пригодный растворитель представляет собой дихлорметан, дихлорэтан, диэтиловый эфир, уксусную кислоту, муравьиную кислоту, толуол, бензол, метанол, этанол, изопропанол или тетрагидрофуран, или смесь таких растворителей.
12. Способ по любому из пп.1-11, где температура реакции находится в пределах между -50 и 83°С.
13. Способ по любому из пп.1-11, где температура реакции находится в пределах между -50 и 40°С.
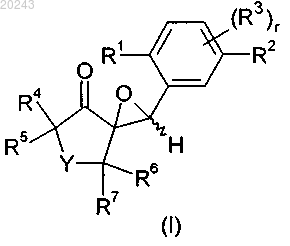
14. Соединение формулы I
где R1 обозначает галоген, С1-С4-алкил, С1-С4-галоалкил, С3-С6-циклоалкил или С1-С4-галоалкокси;
R2 обозначает галоген или фенил, замещенный галогеном, нитро, циано, C1-С2-алкилом, С1-С2-галоалкилом, С1-С2-алкокси или C1-С2-галоалкокси;
r равен 0 или 1;
если r равен 1, то R3 обозначает C1-С3-алкил;
Y обозначает О; и
R4, R5, R6 и R7 независимо друг от друга обозначают водород, C1-С2-алкил, С1-С2-галоалкил или С1-С2-алкокси-С1-С2-алкил;
или, где это возможно, его N-окись или соль.
15. Соединение по п.14, где R2 обозначает фенил, замещенный в пара-положении галогеном и необязательно дополнительно замещенный галогеном, нитро, С1-С2-алкилом, С1-С2-галоалкилом, С1-С2-алкокси или С1-С2-галоалкокси.
16. Соединение по п.14, где R3 обозначает водород, что означает, что r равно 0, или R3 обозначает C1-С3-алкил.
17. Соединение по п.14, где
R1 обозначает этил, метил или циклопропил;
R2 обозначает фенил или фенил, замещенный галогеном или C1-С2-алкилом;
R3 обозначает водород, что означает, что r равно 0; и
R4, R5, R6 и R7 независимо друг от друга обозначают C1-С2-алкил; и
Y обозначает О.
18. Соединение по п.14, где
R1 обозначает метил, этил, циклопропил, н-пропил, галоген, трифторметокси, дифторметокси или трифторметил;
R2 обозначает галоген или фенил, замещенный галогеном, С1-С2-алкилом, С1-С2-галоалкилом, C1-С2-галоалкокси или С1-С2-алкокси;
R3 обозначает водород, r равно 0;
R4, R5, R6 и R7 независимо друг от друга обозначают водород, метил или этили
Y обозначает кислород.
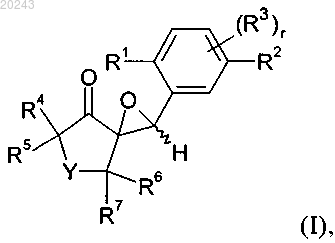
19. Способ получения соединения формулы I
включающий реакцию соединения формулы (F)
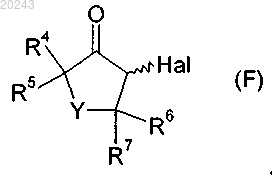
с соединением формулы (D)
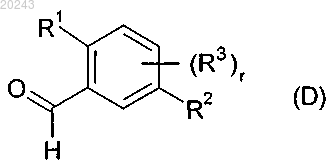
где значения R1, R2, R3, R4, R5, R6, R7, Y и r определены в п.14 и Hal обозначает хлор, бром или йод.
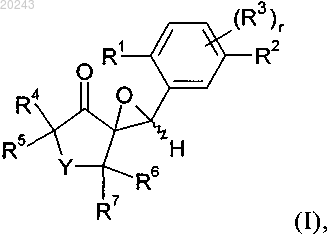
20. Способ получения соединения формулы I
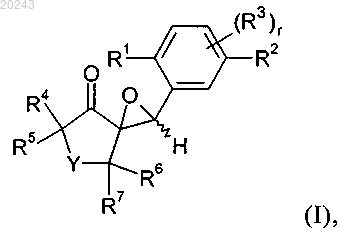
включающий реакцию соединения формулы (С)
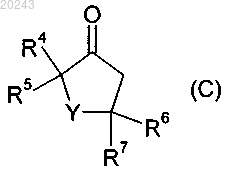
с соединением формулы (D)
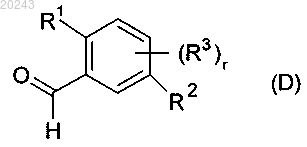
с получением соединения формулы (В)
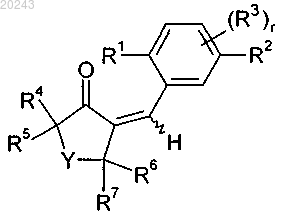
и затем реакцию соединения формулы (В) с окисляющим агентом, где значения R1, R2, R3, R4, R5, R6, R7, Y и r определены в п.14.
Текст
СПИРОЭПОКСИДЫ КАК ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ СИНТЕЗА Настоящее изобретение предлагает соединения формулы I Скатт Джеймс Николас (GB) в которой замещаемые группы соответствуют определению в п.1 патентной формулы. Данные соединения представляют собой промежуточные продукты, применимые для получения 4-фенил-3,5-пирандионов, 4-фенил-3,5-тиопирандионов и 6-фенилциклогексан-1,3,5-трионов,обладающих гербицидной активностью. Настоящее изобретение касается новых соединений, их приготовления и использования в качестве промежуточных продуктов в получении замещаемых 4-фенил-3,5-пирандионов, 4-фенил-3,5 тиопирандионов и 6-фенилциклогексан-1,3,5-трионов, обладающих гербицидной активностью. Обладающие гербицидным действием 4-фенил-3,5-пирандионы, 4-фенил-3,5-тиопирандионы и 6 фенилциклогексан-1,3,5-трионы и процесс получения этих соединений описаны, например, в публикацииWO 08/071405. Недавно было обнаружено, что в качестве ключевых промежуточных продуктов в процессе приготовления таких гербицидно-активных дионов и трионов могут использоваться определенные замещенные эпоксикетоны. Настоящее изобретение позволяет получть их с высоким выходом и со значительными преимуществами по сравнению с известными процессами. Соответственно, настоящее изобретение касается соединений формулы IR2 обозначает водород, галоген, метилсульфонилокси, C1-С 4 галоалкилсульфонилокси, птолилсульфонилокси, как вариант - замещенные арилом или гетероарилом;r равняется 0, 1, 2 или 3. Если r равняется 1, R3 обозначает С 1-С 6 алкил, C1-С 6 галоалкил, C1-С 6 алкокси, C1-С 6 галоалкокси, C1 С 6 алкилтио, C1-С 6 алкилсульфинил, C1-С 6 алкилсульфонил, циано или нитро; либо, если r равняется 2 или 3, заместителями R3, независимо друг от друга, являются C1-С 6 алкил, C1-С 6 галоалкил, C1-С 6 алкокси, C1 С 6 галоалкокси, C1-С 6 алкилтио, C1-С 6 алкилсульфинил, C1-С 6 алкилсульфонил, циано или нитро;R4, R5, R6 и R7, независимо друг от друга, обозначают водород, С 1-С 4 алкил, С 1-С 4 галоалкил, С 1 С 4 алкоксиС 1-С 4 алкил,С 1-С 4 алкилтиоС 1-С 4 алкил,С 1-С 4 алкилсульфинилС 1-С 4 алкил,С 1-С 4 алкилсульфонилС 1-С 4 алкил, циклопропил или циклопропил, замещенный C1- или С 2 алкилом, C1- или С 2 галоалкилом либо галогеном; циклобутил или циклобутил, замещенный C1- или С 2 алкилом; оксетанил или оксетанил, замещенный C1- или С 2 алкилом; С 5-С 7 циклоалкил или С 5-С 7 циклоалкил, замещенный C1 или С 2 алкилом либо C1- или С 2 галоалкилом, при этом метиленовая группа фрагмента алкила - как вариант - замещена атомом кислорода или серы либо сульфиниловой или сульфониловой группой; С 4 С 7 циклоалкенил или С 4-С 7 циклоалкенил, замещенный C1- или С 2 алкилом либо C1- или С 2 галоалкилом,при этом метиленовая группа фрагмента циклоалкенила - как вариант - замещена атомом кислорода или серы либо сульфиниловой или сульфониловой группой; циклопропилС 1-С 5 алкил или циклопропилС 1 С 5 алкил, замещенный C1- или С 2 алкилом, C1- или С 2 галоалкилом или галогеном; циклобутилС 1-С 5 алкил или циклобутилС 1-С 5 алкил, замещенный C1- или С 2 алкилом; оксетанилС 1-С 5 алкил или оксетанилС 1 С 3 алкил, замещенный C1- или С 2 алкилом; С 5-С 7 циклоалкилС 1-С 5 алкил или С 5-С 7 циклоалкилС 1-С 5 алкил,замещенный C1-или С 2 алкилом либо C1- или С 2 галоалкилом, при этом метиленовая группа фрагмента циклоалкила - как вариант - замещена атомом кислорода или серы либо сульфиниловой или сульфониловой группой; С 4-С 7 циклоалкенилС 1-С 5 алкил или С 4-С 7 циклоалкенилС 1-С 5 алкил, замещенный C1- или С 2 алкилом либо С 1- или С 2 галоалкилом, при этом метиленовая группа фрагмента циклоалкенила - как вариант - замещена атомом кислорода или серы либо сульфиниловой или сульфониловой группой; фенил или фенил, замещенный С 1-С 4 алкилом, C1-С 4 алкокси, С 1-С 4 галоалкилом, галогеном, нитро, циано, С 1 С 4 алкилтио, C1-С 4 алкилсульфинилом, С 1-С 4 алкилсульфонилом или С 1-С 4 алкилкарбонилом; бензил или бензил, замещенный С 1-С 4 алкилом, C1-С 4 алкокси, С 1-С 4 галоалкилом, галогеном, нитро, циано, С 1 С 4 алкилтио, C1-С 4 алкилсульфинилом, С 1-С 4 алкилсульфонилом или С 1-С 4 алкилкарбонилом; гетероарил или гетероарил, замещенный С 1-С 4 алкилом, С 1-С 4 алкокси, C1-С 4 галоалкилом, галогеном, нитро, циано,С 1-С 4 алкилтио, C1-С 4 алкилсульфинилом, С 1-С 4 алкилсульфонилом или С 1-С 4 алкилкарбонилом; илиR4 и R5 или R6 и R7 соединяются, формируя 5-7-членное насыщенное или ненасыщенное кольцо, в котором метиленовая группа - как вариант - замещена атомом кислорода или серы, либо 5-7-членное насыщенное или ненасыщенное кольцо, замещенное C1- или С 2 алкилом, где метиленовая группа кольца как вариант - замещена атомом кислорода или серы; или R4 и R7 соединяются для формирования 5-7 членного насыщенного или ненасыщенного кольца, незамещенного или замещенного C1- или С 2 алкилом,C1-или С 2 алкокси, C1- или С 2 алкоксиС 1- или С 2 алкилом, гидрокси, галогеном; фенила или фенила, замещенного С 1-С 4 алкилом, С 1-С 4 алкокси, C1-С 4 галоалкилом, галогеном, нитро, циано, С 1-С 4 алкилтио, C1 С 4 алкилсульфинилом, С 1-С 4 алкилсульфонилом или С 1-С 4 алкилкарбонилом; гетероарила или гетероарила, замещенного С 1-С 4 алкилом, С 1-С 4 алкокси, С 1-С 4 галоалкилом, галогеном, нитро, циано, С 1-1 020243 С 4 алкилтио, С 1-С 4 алкилсульфинилом, С 1-С 4 алкилсульфонилом или С 1-С 4 алкилкарбонилом. Настоящее изобретение также касается нового процесса получения соединений формулы I. Кроме того, настоящее изобретение касается процесса получения 4-фенил-3,5-пирандионов, 4 фенил-3,5-тиопирандионов и 6-фенилциклогексан-1,3,5-трионов представленной ниже формулы (А) с использованием соединений формулы I в качестве промежуточных продуктов. В определениях заместителей соединений формулы I заместителями алкила и (гало)алкильными фрагментами алкокси, алкилтио и т. д., которые имеют от 1 до 6 атомов углерода, предпочтительно являются метил, этил, пропил, бутил, пентил и гексил в форме их прямых и разветвленных изомеров. Применимые циклоалкильные группы содержат от 3 до 7 атомов углерода; ими являются, например, циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Предпочтительными являются циклопропил, циклобутил, циклопентил и циклогексил. Применимые циклоалкеновые группы содержат от 4 до 7 атомов углерода и могут содержать до 3 двойных связей. Предпочтительными галогенами являются фтор, хлор и бром. Предпочтительными примерами арилов являются фенил и нафтил. Предпочтительными примерами гетероарилов являются тиенил, фурил, пирролил, изоксазолил, оксазолил, оксетанил,изотиазолил, тиазолил, пиразолил, имидазолил, триазолил, тетразолил, пиридил, пиримидинил, пиразинил, триазинил, оксадиазолил, тиадиазолил, пиридазинил и, где это необходимо, N-окиси и соли этих соединений. Эти арилы и гетероарилы могут замещаться одним или несколькими заместителями; при этом предпочтительными заместителями являются галоген, С 1-С 4 алкил, С 1-С 4 галоалкил, С 2-С 4 алкенил,С 2-С 4 галоалкенил, С 2-С 4 алкинил, С 1-С 4 алкокси, С 1-С 4 галоалкокси, C1-С 4 алкилтио, С 1-С 4 алкилсульфинил,С 1-С 4 алкилсульфонил, С 1-С 4 галоалкилтио, С 1-С 4 галоалкилсульфинил, С 1-С 4 галоалкилсульфонил, нитро или циано. В предпочтительной группе соединений формулы I R1 обозначает галоген, C1-С 4 алкил, С 1 С 4 галоалкил, С 3-С 6 циклоалкил или С 1-С 4-галоалкокси. В другой предпочтительной группе соединений формулы I R2 обозначает галоген, арил или гетероарил; либо арил или гетероарил, любой из которых замещен галогеном, С 1-С 4 алкилом, С 1-С 4 галоалкилом, С 2 С 4 алкенилом, С 2-С 4 галоалкенилом, С 2-С 4 алкинилом, С 1-С 4 алкокси, С 1-С 4 галоалкокси, фенокси, С 1 С 4 алкилтио, С 1-С 4 алкилсульфинилом, С 1-С 4 алкилсульфонилом, С 1-С 4 галоалкилтио, С 1-С 4 галоалкилсульфинилом, С 1-С 4 галоалкилсульфонилом, С 3-С 6 циклоалкилом, С 1-С 4 алкилсульфонилокси, С 1-С 4 галоалкилсульфонилокси, С 1-С 4 алкоксиС 1-С 4 алкилом, С 1-С 4 алкилтиоС 1-С 4 алкилом, С 1-С 4 алкилсульфинилС 1-С 4 алкилом, С 1 С 4 алкилсульфонилС 1-С 4 алкилом, нитро, циано, тиоцианато, гидрокси, амино, C1-С 6 алкиламино, C1 С 6 диалкиламино, С 3-С 6 циклоалкиламино, морфолино, тиоморфолино, С 1-С 6 алкилкарбониламино, С 1 С 6 алкоксикарбониламино,С 3-С 6 алкенилоксикарбониламино,С 3-С 6 алкинилоксикарбониламино,C1 С 6 алкиламинокарбониламино, ди(С 1-С 6 алкил)аминокарбониламино, формилом, C1-С 6 алкилкарбонилом, С 2 С 6 алкенилкарбонилом, С 2-С 6 алкинилкарбонилом, карбокси, C1-С 6 алкоксикарбонилом, С 3-С 6 алкенилоксикарбонилом, С 3-С 6 алкинилоксикарбонилом, карбоксамидо, C1-С 6 алкиламинокарбонилом, ди(С 1-С 6 алкил) аминокарбонилом,C1-С 6 алкилкарбонилокси,C1-С 6 алкиламинокарбонилокси,ди(С 1-С 6 алкил)аминокарбонилокси или C1-С 6 алкилтиокарбониламино. Предпочтительно R2 в соединениях формулы I обозначает галоген, арил или гетероарил; либо арил или гетероарил, любой из которых замещен галогеном, С 1-С 4 алкилом, С 1-С 4 галоалкилом, фенокси, С 2 С 4 алкенилом, С 2-С 4 галоалкенилом, С 2-С 4 алкинилом, С 1-С 4 алкокси, С 1-С 4 галоалкокси, С 1-С 4 алкилтио, С 1 С 4 алкилсульфинилом, С 1-С 4 алкилсульфонилом, С 1-С 4 галоалкилтио, С 1-С 4 галоалкилсульфинилом, С 1 С 4 галоалкилсульфонилом, нитро или циано. Более предпочтительно R2 обозначает фенил, тиенил, фурил, пирролил, изоксазолил, оксазолил,изотиазолил, тиазолил, пиразолил, имидазолил, триазолил, тетразолил, пиридил, пиримидинил, пиразинил, триазинил, пиридазинил, оксадиазолил и тиадиазолил, а также N-окиси и соли этих соединений, при этом настоящие кольца незамещены или замещены галогеном, С 1-С 4 алкилом, С 1-С 4 галоалкилом, С 2 С 4 алкенилом, С 2-С 4 галоалкенилом, С 2-С 4 алкинилом, С 1-С 4 алкокси, C1-С 4 галоалкокси, С 1-С 4 алкилтио, С 1 С 4 алкилсульфинилом, C1-С 4 алкилсульфонилом, С 1-С 4 галоалкилтио, С 1-С 4 галоалкилсульфинилом, C1 С 4 галоалкилсульфонилом, нитро или циано. В еще более предпочтительных соединениях формулы I R2 обозначает фенил или пиридил либо фенил или пиридил, любой из которых замещен галогеном, нитро, циано, C1-С 2 алкилом, С 1-С 2 галоалкилом,С 1-С 2 алкокси или С 1-С 2 галоалкокси. В особо предпочтительной группе соединений R2 обозначает фенил, замещенный в пара-положении галогеном (в частности, хлором) и - как вариант - далее замещенный галогеном, нитро, C1-С 2 алкилом, C1 С 2 галоалкилом, C1-С 2 алкокси или C1-С 2 галоалкокси. Предпочтительно R3 обозначает водород (r равняется 0) или C1-С 6 алкил, в особенности водород. Предпочтительно, если r равняется 1, R3 обозначает C1-С 3 алкил. Предпочтительными являются те соединения формулы I, в которых R4, R5, R6 и R7, независимо друг от друга, обозначают водород, С 1-С 4 алкил, С 1-С 4 галоалкил, С 1-С 4 алкоксиС 1-С 4 алкил, С 1-С 4 алкилтиоС 1 С 4 алкил, С 1-С 4 алкилсульфинилС 1-С 4 алкил, С 1-С 4 алкилсульфонилС 1-С 4 алкил; С 5-С 7 циклоалкил или С 5 С 7 циклоалкил, замещенный С 1- или С 2 алкилом либо C1- или С 2 галоалкилом, и в которых метиленовая группа - как вариант - замещена атомом кислорода или серы либо сульфиниловой или сульфониловойC1- или С 2 галоалкилом, и в которых метиленовая группа - как вариант - замещена атомом кислорода или серы либо сульфиниловой или сульфониловой группой. Более предпочтительно R4, R5, R6 и R7, независимо друг от друга, обозначают водород, C1-С 2 алкил,С 1-С 2 галоалкил или С 1-С 2 алкоксиС 1-С 2 алкил. В предпочтительной группе соединений формулы (I) R1 обозначает этил, метил или циклопропил; 2R обозначает фенил или фенил, замещенный галогеном или С 1-С 2 алкилом; R3 обозначает водород, a R4,R5, R6 и R7, независимо друг от друга, обозначают С 1-С 2 алкил. В другой предпочтительной группе соединений формулы (I) R1 обозначает метил, этил, циклопропил, n-пропил, галоген, трифторметокси, дифторметокси и трифторметил; R4, R5, R6 и R7, независимо друг от друга, обозначают водород, метил и этил; R2 обозначает галоген, фенил, замещенный галогеном,C1-С 4 алкилом, С 1-С 4 галоалкилом, С 1-С 4 галоалкокси или С 1-С 4 алкокси; R3 обозначает водород, a Y обозначает кислород, причем более предпочтительно R1 обозначает этил или циклопропил; R4, R5, R6 и R7 обозначают метил; R2 обозначает фенил, единожды или дважды замещенный фтором, хлором, метокси или метилом; R3 обозначает водород, a Y обозначает кислород, причем наиболее предпочтительно R1 обозначает этил; R4, R5, R6 и R7 обозначают метил, R2 обозначает 4-хлорфенил, 2,4-дихлорфенил и 2 фтор-4-хлорфенил, R3 обозначает водород, a Y обозначает кислород. В другой предпочтительной группе соединений формулы (I) R1 обозначает этил, трифторметил,циклопропил, дифторметокси, трифторметокси, фтор, бром или йод; R4, R5, R6 и R7, независимо друг от друга, обозначают водород или метил; R2 обозначает бром, 4-хлорфенил, 2-фтор-4-хлорфенил, 2,4 дихлорфенил; R3 обозначает водород, a Y обозначает О, причем более предпочтительно R1 обозначает этил, циклопропил; R4, R5, R6 и R7 обозначают метил; R2 обозначает бром, 4-хлорфенил, 2-фтор-4 хлорфенил или 2,4-дихлорфенил; R3 обозначает Н, a Y обозначает О. В еще одном варианте изобретения было выявлено, что соединения формулы I могут быть легко обращены в 4-фенил-3,5-пирандионы, 4-фенил-3,5-тиопирандионы и 6-фенилциклогексан-1,3,5-трионы представленной ниже формулы (А) в присутствии кислоты. Схема реакции где Y, R1, R2, R3, r, R4, R5, R6 и R7 соответствуют определению выше. Применимыми кислотами являются кислоты Бренстеда, такие как неорганические и органические кислоты, например серная кислота, соляная кислота, хлорид водорода, п-толуолсульфокислота, уксусная кислота и муравьиная кислота, кислоты Льюиса, такие как галоидные соединения, например трхфтористый бор, хлорид алюминия, хлорид железа, хлорид олова(IV), хлорид цинка, бромид цинка, перхлорат лития, а также трифлаты металлов, такие как трифлат скандия и трифлат иттербия. Могут использоваться также смеси этих кислот. Превращение соединения формулы (I) в соединение формулы (А) может считаться примером полупинаколиновой перегруппировки (см., например, М. Paulson, M. DaliyaС.BuchananD. Jhaveri, J. Org. Chem. (1961), 26 4295-9;H. House, Richard L. Wasson, J. Am. Chem. Soc,(1956), 78, 4394-400), но такая трансформация неизвестна для соединений типа (I). Условия реакций, используемые в процессе настоящего изобретения, аналогичны условиям, описанным в приведенной выше литературе, или могут быть установлены специалистами в данной области науки. Применимыми растворителями являются те, которые были выбраны по принципу совместимости с используемой кислотой; к их числу принадлежат хлорированные углеводороды, спирты, эфиры, ароматические соединения и органические кислоты, например дихлорметан, дихлорэтан, диэтиловый эфир, уксусная кислота, муравьиная кислота, толуол, бензол, метанол, этанол, изопропанол и тетрагидрофуран. Могут использоваться также смеси растворителей. Предпочтительно реакция проводится с использованием концентрированной серной кислоты в дихлорэтане. Предпочтительная температура реакции находится в пределах от -50 до 83 С, еще более предпочтительно - от -50 до 40 С. Дополнительным предпочтительным условием реакции является использование раствора перхлората лития в эфире в сочетании с 0,1-100 мол.% трифлата иттербия в виде кислоты в диапазоне температур от 0 до 60 С. Настоящий процесс отличается от вышеупомянутой разработкиd) высокой концентрацией участвующих в реакции веществ (до 20%, пример Р 1, этап 4);e) широко - в особенности во 2 и 5 позициях - замещаемыми производными фенила в качестве исходных соединений;g) экономическими и экологическими преимуществами благодаря тому факту, что процесс может использоваться как частичный этап в процедуре непрерывной реакции для получения 4-фенил-3,5 пирандионов, 4-фенил-3,5-тиопирандионов и 6-фенилциклогексан-1,3,5-трионов формулы (А), которые,как известно, обладают гербицидными свойствами. Таким образом, настоящий процесс получения в особенности применим для экономичного получения промышленных объемов дионов и трионов формулы (А). В другом варианте осуществления настоящего изобретения соединения формулы (I) можно получить путем эпоксидирования соединений формулы (В), как это продемонстрировано в следующей схеме реакции: где Y, R1, R2, R3, r, R4, R5, R6 и R7 соответствуют определению выше. Соединения формулы (В) являются новыми соединениями, которые были специально разработаны в качестве промежуточных продуктов для синтеза соединений формулы (I); они составляют другой вариант настоящего изобретения. Эпоксидирование выполняется обработкой соединения формулы (В) применимым окисляющим веществом, таким как органическая перекись или гиперхлорит металла, например диметилдиоксиран,гипохлорит натрия, перекись водорода, трет-бутилпероксид или трифторнадуксусная кислота, как вариант - в комбинации с применимым основанием (таким как гидроксид или карбонат щелочного металла,гидроксид или карбонат щелочно-земельного металла либо аминовое основание, такое как 1,8 диазабицикло[5.4.0]ундек-7-ин), как вариант - в применимом растворителе (таком как спирт, галогенированный углеводород или ароматическое соединение, например метанол, этанол, дихлорметан или толуол) и при соответствующей температуре. Реакцию можно также проводить в двухфазной среде, где реагент межфазного переноса также обычно используется в концентрации 0,001-50 мол.%. Реагентом межфазного переноса предпочтительно является соль четвертичного аммониевого основания, краун-эфир,полиэтиленгликоль или соль фосфония при соответствующей температуре. Аналогичные реакции известны в литературе (например, Коробицина И.К., Студзинский О.П. Журнал органической химииMarples, J. Chem. Soc. Perkin 1, 1988, 875-879). Могут использоваться также смеси окисляющих веществ,оснований и растворителей. Предпочтительно эпоксидирование осуществляется с использованием перекиси водорода и гидроксида металла (особенно гидроксида лития или гидроксида натрия) в метаноле при температуре от -10 до 60 С. Соединение формулы (В) можно приготовить из соединения формулы (С) путем конденсации с бензальдегидом формулы (D) в присутствии применимого основания и - как вариант - в присутствии применимого растворителя (см., например, A. Lagrange, S. Forestier, G. LangB. Luppi, EP 368717 A1; Предпочтительно основанием является гидроксид металла, такой как гидроксид натрия или гидроксид калия, либо алкоксид металла, такой как метилат натрия, этилат натрия или трет-бутилат калия. Предпочтительно растворителем является диметоксиэтан, диоксан, тетрагидрофуран, диэтиловый эфир или алкиловый спирт, такой как метанол, этанол или изопропанол. Могут использоваться также смеси оснований и, в частности, растворителей. Соединения формулы (С), в которой Y обозначает О, являются известными соединениями (см., например, М. NewmanW. Reichle, Org. Synth. Coll. Vol. V., (1973), 1024; Залькинд Ю., Венус-Данилова Э. и Рябцева В. Журнал общей химии, (1950), 20, 2222-9; М. Bertrand, J. Dulcere, G. Gil, J. GrimaldiP.Sylvestre-Panthet, Tetrahedron Letters (1976), (18), 1507-8) или могут быть приготовлены из известных соединений с помощью известных специалистам методов. Соединения формулы (С), в которой Y обозначает С=О, являются известными соединениями (см., например, N.J. Turro, D.R. Morton, E. Hedaya, М.Е.(1998), 63(4), 1352-1355; S. N. Crane, D.J. Burnell, Journal of Organic Chemistry (1998), 63(16), 5708-5710; С.E. Elliott, D.O. Miller, D.J. Burnell, Journal of the Chemical Society, Perkin Transactions 1 (2002), (2), 217226) или могут быть приготовлены из известных соединений с помощью известных специалистам методов. Соединения формулы (С), в которой Y обозначает S, SO или SO2, являются известными соединениями (см., например, Е.R. Buchman, H. Cohen, Journal of the American Chemical Society (1944), 66, 847-8;Trompenaars, S. Harkema, G.J. Van Hummel, Journal of Organic Chemistry (1981), 46(2), 424-34; F. Duus,Synthesis (1985), (6-7), 672-4; J. Schatz, Science of Synthesis (2002), 9, 287-422) или могут быть приготовлены из известных соединений с помощью известных специалистам методов. Соединения формулы (D) либо являются известными соединениями, либо могут быть приготовлены путем формилирования соединения формулы (Е), в которой Hal обозначает хлор, бром или йод где R1, R2, R3 и r, а также Hal обозначают галоген согласно определению выше. Предпочтительными соединениями формулы (D) являются соединения формулы (D1) где R1, R3 и r соответствуют определению выше, a R20 и R30, независимо друг от друга, обозначают водород, метил, метокси, фтор, хлор или бром. Соединения формулы (D), которые являются новыми, а также новые соединения формулы (D1) были специально разработаны в качестве промежуточных продуктов для синтеза соединений формулы (I) и представляют собой еще один вариант настоящего изобретения. Применимые условия для формилирования арилгалогенидов известны и включают, например, обработку арилгалогенида применимым металлорганическим реагентом (таким как изопропилхлорид магния, п-бутиллитий, сек-бутиллитий или трет-бутиллитий) либо обработку применимым щелочным или щелочно-земельным металлом (таким как литий или магний) в соответствующем растворителе (таком как диэтиловый эфир, диметоксиэтан или тетрагидрофуран). Затем полученный реагент арильного соединения металла вступает в реакцию с применимым формилирующим реагентом, таким как N,Nдиметилформамид или N-формилморфолин. Соединение формулы (D) - как вариант - можно приготовить из соединения формулы (Е) (в которой Hal может также обозначть псевдогалоген, такой как трифлат) путем обработки карбонилирующим агентом (таким как монооксид углерода) в присутствии приме-5 020243 нимого катализатора, основания и восстанавливающего вещества (см., например, L. AshfieldС. Barnard, Org. Process Res. Dev., 11 (1), 39-43, 2007). Соединения формулы (Е) либо являются известными соединениями (см., например, публикацию WO 2008/071405), либо могут быть синтезированы из известных промежуточных продуктов с помощью стандартных химических превращений. Соединение формулы (I) - как вариант - можно приготовить путем реакции соединения формулы(F) (в которой галогеном является хлор, бром или йод, предпочтительно хлор или бром) с соединением формулы (D), как это продемонстрировано в следующей схеме реакции. Реакцию (F) и (D) можно проводить с применимым основанием, как вариант - в применимом растворителе при соответствующей температуре. Предпочтительно основанием является гидроксид щелочного или щелочно-земельного металла (такой как гидроксид натрия, гидроксид лития или гидроксид калия), алкоксид щелочного или щелочно-земельного металла (такой как метилат натрия, этилат натрия или трет-бутилат калия), карбонат щелочного или щелочно-земельного металла (такой как карбонат калия, карбонат натрия или бикарбонат натрия), амид металла (такой как диизопропиламид лития, гексаметилдисилазид лития или 2,2,6,6-тетраметилпиперидид), металлорганический гидрид (такой как бутил лития или этилмагний бромид) или гидрид металла (такой как гидрид натрия или гидрид калия). К числу применимых растворителей принадлежат хлорированные углеводороды, эфиры, спирты, ароматические соединения и различные полярные апротонные растворители, например 1,2-диметоксиэтан, тетрагидрофуран, 1,4-диоксан, диэтиловый эфир, дибутиловый эфир, дихлорметан, дихлорэтан, ацетонитрил, диметилсульфоксид, бензол, толуол, метанол, этанол, изопропанол или трет-бутанол; их выбирают по принципу совместимости с основанием в условиях реакции. Реакцию также можно проводить в двухфазной среде, где реагент межфазного переноса также обычно используется в концентрации 0,001-50 мол.%. Реагентом межфазного переноса предпочтительно является соль четвертичного аммониевого основания,краун-эфир, полиэтиленгликоль или соль фосфония. Наиболее предпочтительно реакцию проводят с использованием диизопропиламида лития в тетрагидрофуране при температуре от -100 до 60 С. Обращение соединения формулы (F) в соединение формулы (I) можно считать примером реакции конденсации Дарзана (см., например, W.N. Wassef, М.М. El-Barky, Journal of Chemical Research, Synopses (1990), (12),402-3; J. Li, X. Liu, X. Li, Youji Huaxue (2007), 27(11), 1428-1431; Y. Tong, Y. Cheng, X. Guo, S. Wu, Hecheng Huaxue (2007), 15(1), 102-104; С. Parmenon, J. Guillard, D. Caignard, N. Hennuyer, B. Staels, V.(2007), p11; J. M. Concellon, E. Bardales, R. Llavona, Journal of Organic Chemistry (2003), 68(4), 1585-1588),но такая трансформация неизвестна для соединений типа (F). Соединения формулы (F), в которой Y обозначает О, либо являются известными соединениями (см.,например, Н. Richet, R. Dulou, R., G. Dupont, Bulletin de la Societe Chimique de France (1947), 693-9; H.Richet, Ann. Chim. [12] (1948), 3 317-54; Коробицина И.К., Юрьев Ю.К., Чебурков Ю.А., Лукина Э.М. Журнал общей химии (1955), 25, 734-8; I. Коробицина И.К., Юрьев Ю.К., Чебурков Ю.А., Лукина Э.М. Журнал общей химии (1955), 25, 690-702; F. Leonard, A.Wajngurt, H. Horn, Journal of Organic Chemistry(1956), 21, 1400-4; Коробицина И.К., Жукова И.Г., Кувшинова В.А., Гайдамович Н.Н., Юрьев Ю.К. Доклады Академии наук СССР (1957), 114, 327-30; Коробицина И.К., Жукова И.Г., Юрьев Ю.К. Журнал общей химии (1959), 29, 2190-6; Коробицина И.К., Родина Л.Л., Сташкова Л.М., Химия гетероциклических соединений (1966), (6), 843-7; G. Hoehne, F. Marschner, K. Praefcke, P. Weyerstahl, Chem. Ber. (1975),108(2), 673-82; H. Saimoto, T. Hiyama, H. Nozaki, Bull. Chem. Soc. Jpn., (1983), 56(10), 3078-87; ЗвонокA.M., Кузьменок Н.М., Тищенко И.Г., Станишевский Л.С. Журнал общей химии (1985), 21(6), 1330-4),либо могут быть приготовлены из соединений формулы (С) в известных условиях. Соединения формулы(F), в которой Y обозначает S, SO и SO2, либо являются известными соединениями (см., например, М.(1992), 33(29), 4201-4), либо могут быть приготовлены из соединений формулы (С) в известных условиях. Соединения формулы (F), в которой Y обозначает С=О, можно приготовить из соединений формулы(С) в аналогичных условиях галогенизации. Настоящее изобретение подробнее проиллюстрировано в примерах ниже, но не ограничивается ими. К раствору 4-бром-1-этил-2-йодбензола (31,8 г, 103 ммоль) (описание см. в публикации WO 2008/071405) в безводном тетрагидрофуране (250 мл) при -20 С по капле добавляют изопропилхлорид магния (55 мл, 110 ммоль, 2 М раствора в тетрагидрофуране) в течение 10 мин. После завершения добавления реакционную смесь перемешивают при температуре -20 С в течение 3 ч, затем по капле добавляют безводный N,N-диметилформамид (16,0 мл, 200 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение еще 2,5 ч, затем оставляют стоять на ночь. Добавляют 2 М соляной кислоты(90 мл) и неочищенный продукт экстрагируют в дихлорметане. Органические вещества соединяют, высушивают над сульфатом магния, затем фильтруют и фильтрат выпаривают при пониженном давлении для получения 5-бром-2-этилбензальдегида (21,20 г) в виде оранжевой жидкости. Этап 2. Получение 4-(5-бром-2-этилбензилидин)-2,2,5,5-тетраметилдигидрофуран-3-она В очень холодный раствор дигидро-2,2,5,5-тетраметил-3(2 Н)-фуранона (13,4 г, 94,34 ммоль) в безводном 1,2-диметоксиэтане (32 мл) добавляют одну порцию метилата натрия (5,6 г, 103,8 ммоль), реакционную смесь перемешивают при данной температуре в течение 5 мин. Затем к полученной суспензии по капле добавляют раствор 5-бром-2-этилбензальдегида (20 г, 94,34 ммоль) в 1,2-диметоксиэтане (32 мл) в течение 10 мин. Затем раствор перемешивают при температуре 0 С в течение 1 ч, разводят диэтиловым эфиром и промывают 2 М соляной кислоты ( 2). Органические фракции соединяют, высушивают над сульфатом магния, фильтруют и фильтрат выпаривают под вакуумом для получения 4-(5-бром-2 этилбензилидин)-2,2,5,5-тетраметилдигидрофуран-3-она (30,2 г) в виде желтой жидкости. Этап 3. Получение 2-(5-бром-2-этилфенил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она К раствору 4-(5-бром-2-этилбензилидин)-2,2,5,5-тетраметилдигидрофуран-3-она (32,07 г, 95,15 ммоль) в метаноле (1570 мл) при 35 С добавляют 50% водный раствор пероксида водорода (8,10 мл,142,73 ммоль), сразу после чего добавляют водный раствор 2 М гидроксида лития (9,51 мл, 19,03 ммоль). Данную реакционную смесь перемешивают при температуре 35 С ровно в течение 1 ч, затем гасят насыщенным метабисульфитом натрия (340 мл) и дистиллированной водой (340 мл). После перемешивания при комнатной температуре в течение 15 мин растворители упаривают под вакуумом (до около 500 мл),по истечении этого времени продукт выделяется в виде твердого вещества желтого цвета. К этой суспензии добавляют дистиллированную воду (500 мл), и продукт отделяют путем фильтрации. После дополнительного промывания дистиллированной водой твердое вещество сушат под вакуумом всю ночь для получения 2-(5-бром-2-этилфенил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она (29,30 г) в виде твердого вещества желтого цвета, которое используется при выполнении следующего этапа без очистки. 1 Н NMR (CDCl3):7,47-7,40 (m, 2 Н), 7,10 (d, 1 Н), 4,43 (s, 1H), 2,62-2,60 (m, 2 Н), 1,40 (s, 3 Н), 1,37 (s,3 Н), 1,30-1,20 (m, 6 Н), 0,78 (s, 3 Н). Этап 4. Получение 4-(5-бром-2-этилфенил)-2,2,6,6-тетраметилпиран-3,5-диона К очень холодному раствору концентрированной серной кислоты (2 мл) в течение 5 мин по капле добавляют второй раствор 2-(5-бром-2-этилфенил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она(0,995 г, 2,82 ммоль) в 1,2-дихлорэтане (2 мл). Эту двухфазную смесь энергично перемешивают в течение 1 ч при 0 С, затем выливают в очень холодную воду (15 мл). Затем этот водный раствор упаривают под вакуумом для удаления всех органических летучих компонентов, тем самым получя сыпучее твердое вещество. Твердое вещество фильтруют, сушат под вакуумом, затем промывают гексанами для получения 4-(5-бром-2-этилфенил)-2,2,6,6-тетраметилпиран-3,5-диона (0,81 г) в виде твердого вещества кремового цвета. 1 Н NMR (CDCl3):7,48 (1H, dd), 7,23-7,21 (2 Н, m), 5,60 (1 Н, s), 2,45-2,33 (2 Н, m), 1,60 (6 Н, d), 1,48 К раствору эфира 4-бром-2,2,5-триметил-2,5-дигидрофуран-3-ил уксусной кислоты (19,14 г, 0,11 ммоль) (описание см. здесь: T.Hiyama et al. Bull. Chem. Soc. Jpn., 56, 3078-3087 (1983 в безводном хлороформе (75 мл) при -20 С в течение 45 мин по капле добавляют раствор брома (18,00 г, 0,11 моль) в безводном хлороформе (200 мл). После перемешивания при данной температуре в течение 30 мин реакционную смесь оставляют нагреваться до комнатной температуры, затем дополнительно перемешивают в течение 1 ч. После разведения хлороформом (250 мл) органическую фазу промывают разведенным водным раствором бикарбоната натрия, затем рассолом, после чего фазы разделяют. Органические растворители удаляют при пониженном давлении для получения 4-бром-2,2,5-триметилдигидрофуран-3-она(23,50 г) в виде масла темно-оранжевого цвета. Данный материал используется в следующем этапе без очистки. Этап 2. Получение 2-(5-бром-2-этилфенил)-4,6,6-триметил-1,5-диоксаспиро[2.4]гептан-7-она К раствору диизопропиламида лития (0,12 моль) в безводном тетрагидрофуране (150 мл) при -70 С добавляют второй раствор 4-бром-2,2,5-триметил-4,5-дигидро-3(2 Н)-фуранона (23,5 г, 0,11 моль) в безводном тетрагидрофуране (40 мл) с такой скоростью, чтобы поддерживать внутреннюю температуру ниже -65 С. После завершения добавления реакционную смесь перемешивают при температуре -70 С в течение дополнительных 20 мин, затем в течение 20 мин по капле добавляют 2-этил-5-бромбензальдегид вания при -70 С в течение 20 мин реакционную смесь оставляют нагреваться до комнатной температуры,затем перемешивают в течение дополнительных 30 мин. Реакционную смесь затем гасят, выливая ее в лед/воду (окисленную до рН 3 с помощью 2 М соляной кислоты) (500 мл) и экстрагируют этилацетатом(3100 мл). Органические фракции соединяют, промывают водой и рассолом, затем высушивают над сульфатом магния. Суспензию фильтруют и фильтрат упаривают под вакуумом для получения смеси 2(5-бром-2-этилфенил)-4,6,6-триметил-1,5-диоксаспиро[2.4]гептан-7-она и 2-этил-5-бромбензальдегида(40,50 г), в приблизительном соотношении 3:1. Данный материал используется в следующем этапе без очистки. 1 Н NMR (CDCl3):7,47 (m, 1H), 7,41 (m, 1H), 7,10 (d, 1H), 4,47 (q, 1H), 4,39 (s, 1H), 2,60 (q, 2H),1,38 (s, 3H), 1,35 (s, 3H), 1,23 (t, 3H), 0,70 (d, 3H). Этап 3. Получение 4-(5-бром-2-этилфенил)-2,2,6,-триметилпиран-3,5-диона К очень холодной концентрированной серной кислоте (50 мл) добавляют раствор неочищенного 2(5-бром-2-этилфенил)-4,6,6-триметил-1,5-диоксаспиро[2.4]гептан-7-она (40 г) в 1,2-дихлорэтане (50 мл) в течение 20 мин. После дальнейшего перемешивания при 0 С в течение 1 ч реакционную смесь осторожно выливают в лед (500 г), и две фазы разделяют. Водную фазу далее экстрагируют дихлорметаном (2100 мл), затем все органические фракции соединяют, промывают водой и упаривают при пониженном давлении. Неочищенный продукт повторно растворяют в этилацетате (500 мл), экстрагируют в 0,5 М водного карбоната калия и промывают дополнительным количеством этилацетата (2). Водную фазу затем осторожно окисляют концентрированной соляной кислотой и продукт экстрагируют этилацетатом(3150 мл). Органические фракции соединяют, промывают рассолом, затем высушивают над сульфатом магния, фильтруют и фильтрат упаривают под вакуумом. Неочищенный продукт затем далее очищают с помощью колоночной флэш-хроматографии для получения 4-(5-бром-2-этилфенил)-2,2,6 триметилпиран-3,5-диона (14,10 г) в виде белой пены. 1 Н NMR (CDCl3):1,08 (m, 3 Н), 1,38-1,62 (m, 9H), 2,25 (m, 2H), 4,38 и 4,71 (1H, 1 Н), 5,72 и 5,83 (2(1,12 г, 7,19 ммоль), фосфата калия (2,03 г, 9,59 ммоль), дициклогексил-(2',6'-диметоксибифенил-2-ил)фосфан (0,079 г, 0,19 ммоль) и ацетата палладия (0,022 г, 0,096 ммоль) добавляют дегазированный толуол (9 мл), затем смесь дополнительно очищают с помощью азота. После этого суспензию закупоривают,затем перемешивают при комнатной температуре в течение 5 мин и нагревают при температуре 160 С в течение 1 ч микроволновым облучением. После охлаждения реакционную смесь распределяют между 2 М соляной кислоты и дихлорметаном, а затем водную фазу далее экстрагируют дихлорметаном (2). Органические фракции соединяют, затем выпаривают при пониженном давлении для получения неочи-9 020243 щенного продукта, который очищают с помощью колоночной флэш-хроматографии (100% гексана к 10% этилацетата в гексанах в качестве элюента) для получения 4'-хлор-4-трифторметил-бифенил-3 карбальдегида (1,78 г) в виде камеди оранжевого цвета. Данный материал используется непосредственно в следующем этапе. Этап 2. Получение 4-[1-(4'-хлор-4-трифторметилбифенил-3-ил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она К очень холодному раствору 2,2,5,5-тетраметилдигидрофуран-3-она (0,887 г, 6,25 ммоль) в 1,2 диметоксиэтане (10 мл) добавляют одну порцию метилата натрия (0,405, 7,50 ммоль). Реакционную смесь перемешивают при температуре 0 С в течение 30 мин, затем по капле добавляют 4'-хлор-4 трифторметилбифенил-3-карбальдегид (1,779 г, 6,25 ммоль) в виде раствора в 1,2-диметоксиэтане (10 мл). Реакционную смесь перемешивают при температуре 0 С в течение 30 мин и затем при комнатной температуре в течение еще 1 ч, после чего ее распределяют между 1 М соляной кислоты и дихлорметаном. Водную фазу экстрагируют снова дихлорметаном, затем все органические фракции соединяют и выпаривают для получения 4-[1-(4'-хлор-4-трифторметилбифенил-3-ил)метилиден]-2,2,5,5 тетраметилдигидрофуран-3-она (2,50 г) в виде камеди желтого цвета. Данный материал используется непосредственно в следующем этапе. Этап 3. Получение 2-(4'-хлор-4-трифторметилбифенил-3-ил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она К раствору 4-[1-(4'-хлор-4-трифторметилбифенил-3-ил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она (2,50 г, 6,12 ммоль) в метаноле (75 мл) при 35 С добавляют 50% водный раствор пероксида водорода (0,70 мл, 12,2 ммоль), сразу после чего добавляют водный раствор 2 М гидроксида лития (0,76 мл, 1,52 ммоль). Эту смесь перемешивают при температуре 35 С в течение 45 мин, затем оставляют остывать до комнатной температуры и гасят насыщенным раствором метабисульфита натрия. Неочищенный продукт экстрагируют диэтиловым эфиром (2), затем все органические фракции соединяют и высушивают над сульфатом магния. После фильтрации фильтрат упаривают под вакуумом для получения 2-(4'-хлор-4-трифторметилбифенил-3-ил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7 она (2,59 г) в виде камеди желтого цвета. Данный материал используется непосредственно в следующем этапе. Этап 4. Получение 4-(4'-хлор-4-трифторметилбифенил-3-ил)-2,2,6,6-тетраметилпиран-3,5-диона К очень холодному раствору неочищенного 2-(4'-хлор-4-трифторметилбифенил-3-ил)-4,4,6,6 тетраметил-1,5-диоксаспиро[2.4]гептан-7-она (2,59 г, 6,12 ммоль) в дихлорэтане (25 мл) добавляют концентрированную серную кислоту (5 мл), затем перемешивают при данной температуре в течение 2 ч. Реакционную смесь выливают в лед, экстрагируют дихлорметаном (2) и соединенные органические фракции выпаривают при пониженном давлении с получением камеди коричневого цвета. Очистка с помощью колоночной флэш-хроматографии (изогексан к 30% этилацетата в изогексане в качестве элюента), а затем с помощью препаративной ВЭЖХ с обращенными фазами позволяет получить 4-(4'-хлор-4 трифторметилбифенил-3-ил)-2,2,6,6-тетраметилпиран-3,5-дион (0,370 г) в виде твердого вещества белого цвета. 1 Н NMR (CDCl3):7,85 (d, 1H), 7,69 (d, 1H), 7,53 (d, 2H), 7,44 (d, 2H), 7,39 (s, 1H), 1,60 (app. d, 6H),1,48 (s, 6H). Пример Р 4. Получение 4-(5-бром-2-йодфенил)-2,2,6,6-тетраметилпиран-3,5-диона К раствору 5-бром-2-йодбензонитрила (5,00 г, 16,00 ммоль) в безводном тетрагидрофуране (80 мл) при -80 С по капле добавляют диизобутил алюминий гидрид (16,0 мл, 16,0 ммоль, 1 М раствора в толуоле) в течение 10 мин. Реакционную смесь перемешивают при температуре -80 С в течение 1 ч, затем оставляют нагреваться до комнатной температуры и перемешивают всю ночь. Затем по капле добавляют дополнительное количество диизобутила алюминия гидрида (16,0 мл, 16,0 ммоль, 1 М раствора в толуоле) при комнатной температуре и реакционную смесь дополнительно перемешивают в течение 1 ч. После осторожного гашения 2 М соляной кислоты (охлаждение в ванне со льдом) неочищенный продукт экстрагируют этилацетатом (2), затем все органические фракции соединяют, высушивают над сульфатом магния и фильтруют. Фильтрат выпаривают при пониженном давлении, затем очищают с помощью колоночной флэш-хроматографии (изогексан к 10% этилацетата в изогексановом элюенте) для получения 5-бром-2-йодбензальдегида (0,85 г). Этап 2. Получение 4-[1-(5-бром-2-йодфенил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она К очень холодному раствору 2,2,5,5-тетраметилдигидрофуран-3-она (0,388 г, 2,73 ммоль) в безводном 1,2-диметоксиэтане (5 мл) добавляют одну порцию метилата натрия (0,177 г, 3,27 ммоль). Реакционную смесь перемешивают при данной температуре в течение 5 мин, затем по капле добавляют 5-бром-2 йодбензальдегид (0,850 г, 2,73 ммоль) в виде раствора в 1,2-диметоксиэтане (5 мл). Реакционную смесь далее перемешивают при температуре 0 С в течение 30 мин, затем при комнатной температуре в течение 1 ч. После распределения между 1 М соляной кислоты и дихлорметаном органическую фазу разделяют, а водную фазу снова экстрагируют дополнительным количеством дихлорметана. Все органические фракции соединяют, затем упаривают под вакуумом для получения 4-[1-(5-бром-2-йодфенил)метилиден]2,2,5,5-тетраметилдигидрофуран-3-она (1,18 г) в виде камеди желтого цвета. Этап 3. Получение 2-(5-бром-2-йодфенил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она К раствору 4-[1-(5-бром-2-йодфенил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она (1,18 г,2,73 ммоль) в метаноле (50 мл) при 35 С добавляют 50% водный раствор пероксида водорода (0,31 мл,- 11020243 5,46 ммоль), сразу после чего добавляют 2 М водного гидроксида лития (0,34 мл, 0,68 ммоль). Настоящую смесь перемешивают при температуре 35 С в течение 3 ч, затем гасят насыщенным водным метабисульфитом натрия и экстрагируют дихлорметаном. Органическую фазу разделяют, а водную фазу экстрагируют снова дихлорметаном. Все органические фракции соединяют, затем выпаривают при пониженном давлении для получения 2-(5-бром-2-йодфенил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан 7-она в виде масла, которое используется непосредственно в следующем этапе. Этап 4. Получение 4-(5-бром-2-йодфенил)-2,2,6,6-тетраметилпиран-3,5-диона К неочищенному 2-(5-бром-2-йодфенил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-ону (из этапа 3) добавляют очень холодную концентрированную серную кислоту, затем реакционную смесь перемешивают при комнатной температуре в течение 30 мин. После разведения с дистиллированной водой продукт экстрагируют дихлорметаном (2), затем соединенные органические фазы выпаривают при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (20% этилацетата в изогексане к этилацетату в качестве элюента) позволяет получить 4-(5-бром-2-йодфенил)-2,2,6,6 тетраметилпиран-3,5-дион (0,225 г) в виде твердого вещества бежевого цвета. 1 Н NMR (CDCl3):7,80 (d, 1 Н), 7,33 (m, 1H), 7,25 (m, 1H), 1,66 (s, 3H), 1,60 (s, 3H), 1,55 (s, 3H), 1,48 4-[1-(5-бром-2-трифторметоксифенил)метилиден]-2,2,5,5-тетраметил К очень холодному раствору 2,2,5,5-тетраметилдигидрофуран-3-она (2,84 г, 20,00 ммоль) в безводном 1,2-диметоксиэтане (6 мл) добавляют одну порцию метилата натрия (1,19 г, 22,04 ммоль). После перемешивания при данной температуре в течение 5 мин добавляют раствор 5-бром-2 трифторметоксибензальдегида (4,84 г, 18,00 ммоль) в 1,2-диметоксиэтане (6 мл) в течение 10 мин, затем перемешивают при температуре 0 С в течение еще 1 ч. После нагревания до комнатной температуры реакционную смесь разводят эфиром и промывают 2 М соляной кислоты (2). Органические фракции соединяют, высушивают над сульфатом магния, фильтруют и фильтрат выпаривают под вакуумом для получения 4-[1-(5-бром-2-трифторметоксифенил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она К раствору 4-[1-(5-бром-2-трифторметоксифенил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3 она (7,06 г, 18,00 ммоль) в метаноле (300 мл) при 35 С добавляют 50% водный раствор пероксида водорода (1,80 мл, 27,00 ммоль), сразу после чего добавляют 2 М водного раствора гидроксида лития (1,80 мл,3,60 ммоль). После перемешивания при данной температуре в течение 1 ч реакционную смесь оставляют остывать, затем гасят 1% раствором метабисульфита натрия (отрицательный тест с помощью йодкрахмальной реактивной бумаги). Реакционную смесь экстрагируют диэтиловым эфиром (3), затем органическую фазу повторно промывают насыщенным водным раствором бикарбоната натрия (2), затем рассолом. Все органические фракции соединяют, высушивают над сульфатом магния, фильтруют и фильтрат упаривают под вакуумом для получения 2-(5-бром-2-трифторметоксифенил)-4,4,6,6 тетраметил-1,5-диоксаспиро[2.4]гептан-7-она (6,34 г, 86%) в виде масла желтого цвета. 1 Н NMR (CDCl3):7,84 (s, 0,4H, изомер А), 7,56 (s, 0,6H, изомер В), 7,52 (d, 0,6 Н, изомер В), 7,48 К очень холодному раствору концентрированной серной кислоты (10 мл) по капле добавляют второй раствор 2-(5-бром-2-трифторметоксифенил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она(6,34 г, 15,00 ммоль) в 1,2-дихлорэтане (10 мл) в течение 5 мин. Эту двухфазную смесь энергично перемешивают в течение 2 ч при 0 С, затем выливают в очень холодную воду, промывая небольшим количеством дополнительного 1,2-дихлорэтана/воды. Затем эту смесь упаривают под вакуумом для удаления всех органических растворителей до образования сыпучего твердого вещества. Твердое вещество фильтруют, промывают водой, затем изогексаном и после этого сушат под вакуумом всю ночь. Затем твердое вещество повторно разводят в этилацетате, высушивают над сульфатом магния, фильтруют и фильтрат выпаривают под вакуумом для получения 4-(5-бром-2-трифторметоксифенил)-2,2,6,6-тетраметилпиран 3,5-диона (4,17 г, 68%). 1 Н NMR (CDCl3):7,57 (dd, 1 Н), 7,24 (d, 2H), 1,52 (br.s, 12H). Пример Р 6. Получение 4-(4-бром-4'-хлорбифенил-3-ил)-2,2,6,6-тетраметилпиран-3,5-диона туре -75 С по капле добавляют изопропилхлорид магния (18,96 мл, 15% раствор в тетрагидрофуране),чтобы поддерживать внутреннюю температуру ниже -70 С. После завершения добавления реакционную смесь перемешивают при температуре -75 С в течение 2 ч, затем нагревают до -45 С. Затем по капле добавляют безводный N,N-диметилформамид (1,71 г, 0,0184 моль), поддерживая температуру ниже - 40 С,затем нагревая до комнатной температуры и гася 2 М соляной кислоты (60 мл). После этого реакционную смесь разводят диэтиловым эфиром, две фазы разделяют и водную фазу экстрагируют дополнительным количеством диэтилового эфира. Соединенные органические экстракты промывают рассолом, высушивают над сульфатом магния, фильтруют и фильтрат упаривают под вакуумом. Неочищенный продукт очищают с помощью колоночной флэш-хроматографии (2% этилацетат в гексановом элюенте) для получения 4-бром-4'-хлорбифенил-3-карбальдегида (2,7 г, 75%) в виде твердого вещества белого цвета. Этап 2. Получение 4-[1-(4-бром-4'-хлорбифенил-3-ил)метилиден]-2,2,5,5-тетраметилдигидрофуран 3-она В очень холодный раствор дигидро-2,2,5,5-тетраметилфуран-3-она (1,37 г, (9,68 ммоль в безводном 1,2-диметоксиэтане (10 мл) добавляют одну порцию метилата натрия (0,575 г, 10,60 ммоль), затем реакционную смесь перемешивают при данной температуре в течение 10 мин. Затем к данной суспензии по капле добавляют второй раствор 4-бром-4'-хлорбифенил-3-карбальдегида (2,60 г, 8,80 ммоль) в 1,2 диметоксиэтане (10 мл). После завершения добавления реакционную смесь перемешивают при температуре 0 С в течение еще 1 ч, затем гасят 2 М соляной кислоты (50 мл). После дополнительного перемешивания в течение еще 1 ч раствор разводят диэтиловым эфиром, две фазы разделяют и после этого водную фазу экстрагируют диэтиловым эфиром (2). Затем объединенные органические фракции промывают рассолом, после чего высушивают над сульфатом магния, фильтруют и фильтрат упаривают под вакуумом для получения 4-[1-(4-бром-4'-хлорбифенил-3-ил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она(3,40 г, 92%) в виде камеди желтого цвета. Этап 3. Получение 2-(4-бром-4'-хлорбифенил-3-ил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан 7-она(3,40 г, 9,03 ммоль) в метаноле (140 мл) при 35 С добавляют 50% водный раствор пероксида водорода(1,04 мл, 15,60 ммоль), сразу после чего добавляют 2 М водного раствора гидроксида лития (1,15 мл, 2,30 ммоль). Реакционную смесь перемешивают в течение дополнительных 45 мин при температуре 35 С,затем оставляют остывать до комнатной температуры и гасят насыщенным раствором метабисульфита натрия. После экстрагирования продукта диэтиловым эфиром (3) органическую фазу разделяют, промывают дополнительным количеством воды, после чего высушивают над сульфатом магния. После фильтрации фильтрат упаривают под вакуумом для получения 2-(4-бром-4'-хлорбифенил-3-ил)-4,4,6,6 тетраметил-1,5-диоксаспиро[2.4]гептан-7-она (3,0 г) в виде твердого вещества желтого цвета. Этот материал обладает достаточной чистотой для использования непосредственно в следующем этапе. Этап 4. Получение 4-(4-бром-4'-хлорбифенил-3-ил)-2,2,6,6-тетраметилпиран-3,5-диона К очень холодному раствору 2-(4-бром-4'-хлорбифенил-3-ил)-4,4,6,6-тетраметил-1,5 диоксаспиро[2.4]гептан-7-она (3,00 г, 6,90 ммоль) в дихлорметане (3,5 мл) добавляют концентрирован- 14020243 ную серную кислоту (6,5 мл) с такой скоростью, чтобы удерживать внутреннюю температуру ниже 5 С. После завершения добавления реакционную смесь перемешивают еще 20 мин, после чего по капле добавляют дистиллированную воду (25 мл) при температуре 0 С. Температуру реакционной смеси поддерживают в диапазоне 5-10 С в течение 5 мин, затем упаривают под вакуумом для удаления органических растворителей. Водную фазу фильтруют и полученное твердое вещество растирают с гексаном для получения 4-(4-бром-4'-хлорбифенил-3-ил)-2,2,6,6-тетраметилпиран-3,5-диона (2,56 г, 85%). К очень холодному раствору дигидро-2,2,5,5-тетраметилфуран-3-она (4,56 г, 32,10 ммоль) в безводном 1,2-диметоксиэтане (25 мл) добавляют одну порцию метилата натрия (1,91 г, 35,10 ммоль). После перемешивания при комнатной температуре в течение 10 мин по капле добавляют второй раствор 5 бром-2-фторбензальдегида (5,93 г, 29,10 ммоль) в безводном 1,2-диметоксиэтане (45 мл), затем перемешивают при температуре 0 С в течение дополнительных 45 мин. Реакционную смесь гасят 2 М соляной кислоты (50 мл), затем разводят диэтиловым эфиром и две фазы разделяют. Водную фазу далее экстрагируют диэтиловым эфиром (2), затем все органические фракции соединяют, промывают рассолом и высушивают над сульфатом магния. После фильтрации фильтрат упаривают под вакуумом для получения 4-[1-(5-бром-2-фторфенил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она (9,30 г, 96%) в виде камеди желтого цвета. Этап 2. Получение 2-(5-бром-2-фторфенил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она К раствору 4-[1-(5-бром-2-фторфенил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она (9,30 г,29,00 ммоль) в метаноле (280 мл) при 35 С добавляют 50% водный раствор пероксида водорода (3,36 мл,50,40 ммоль), сразу после чего добавляют 2 М водного раствора гидроксида лития (3,68 мл, 7,36 ммоль). Перемешивание продолжают при данной температуре в течение 1 ч, затем реакционную смесь оставляют остывать до комнатной температуры, после чего гасят насыщенным метабисульфитом натрия (100 мл) и экстрагируют эфиром (3). Органические фракции соединяют, высушивают над сульфатом магния,фильтруют и фильтрат упаривают под вакуумом для получения 2-(5-бром-2-фторфенил)-4,4,6,6 тетраметил-1,5-диоксаспиро[2.4]гептан-7-она (6,60 г, 68%) в виде камеди желтого цвета. Этап 3. Получение 4-(5-бром-2-фторфенил)-2,2,6,6-тетраметилпиран-3,5-диона 19,30 ммоль) в дихлорметане (8 мл) по капле добавляют второй очень холодный раствор концентрированной серной кислоты (13,8 мл), удерживая температуру ниже 5 С. Реакционную смесь перемешивают в течение дополнительных 30 мин, затем гасят дистиллированной водой (50 мл). После перемешивания в течение дополнительных 10 мин органические фракции удаляют под вакуумом, затем полученный осадок фильтруют и растирают в порошок с водой. После промывания гексанами твердое вещество сушат для получения 4-(5-бром-2-фторфенил)-2,2,6,6-тетраметилпиран-3,5-диона (4,30 г, 65%). 1 Н NMR (CDCl3):7,5 (m, 1 Н), 7,34 (m, 1H), 7,06 (m, 1H), 5,69 (br. s, 1H), 1,56 (d, 6H), 1,52 (d, 6H). Пример Р 8. Получение 4-(4'-хлор-4-циклопропил-2'-фторбифенил-3-ил)-2,2,6,6-тетраметилпиран 3,5-диона(30,0 г, 0,17 моль) и карбоната натрия (24,0 г, 0,23 моль) добавляют 1,2-диметоксиэтан (225 мл) и дистиллированную воду (75 мл), затем суспензию перемешивают в атмосфере азота. После этого к настоящей смеси добавляют хлорид [1,1'-бис(дифенилфосфино)ферроцен]палладия(II) (4,5 г, 7,5 ммоль), затем нагревают при температуре кипения всю ночь. После охлаждения до комнатной температуры и разведения дистиллированной водой (500 мл) и дихлорметаном (500 мл) две фазы разделяют и водную фазу снова экстрагируют дихлорметаном (2500 мл). Органические фракции соединяют, промывают рассолом (800 мл), затем высушивают над сульфатом магния. Суспензию фильтруют и фильтрат упаривают под вакуумом. Неочищенный продукт очищают с помощью колоночной флэш-хроматографии (5-10% этилацетата в изогексановом элюенте) для получения 4'-хлор-2'-фтор-4-гидроксибифенил-3 карбальдегида (33,61 г, 89%) в виде твердого вещества светло-желтого цвета. Этап 2. Получение эфира 4'-хлор-2'-фтор-3-формилбифенил-4-ил трифторметансульфоновой кислоты К очень холодной смеси 4'-хлор-2'-фтор-4-гидроксибифенил-3-карбальдегида (33,60 г, 0,13 моль) и пиридина (31,0 мл, 0,36 моль) в безводном дихлорметане (700 мл) по капле добавляют трифторметансульфоновый ангидрид (27,0 мл, 0,16 ммоль) в течение 30 мин, удерживая температуру ниже 10 С. Затем реакционную смесь оставляют нагреваться до комнатной температуры, после чего перемешивают всю ночь. После разведения дистиллированной водой (500 мл) и дихлорметаном (500 мл) два слоя разделяют и водную фазу снова экстрагируют дихлорметаном (2500 мл). Органические фракции соединяют, промывают рассолом (800 мл), затем высушивают над сульфатом магния и упаривают под вакуумом. Неочищенный продукт очищают с помощью колоночной флэш-хроматографии (10% этилацетата в гексановом элюенте) для получения эфира 4'-хлор-2'-фтор-3-формилбифенил-4-ил трифторметансульфоновой кислоты в виде масла желтого цвета. К смеси эфира 4'-хлор-2'-фтор-3-формилбифенил-4-ил трифторметансульфоновой кислоты (30,0 г,0,078 моль), циклопропилбороновой кислоты (8,80 г, 0,10 моль), фосфата калия (58,40 г, 0,28 моль) и бромида натрия (8,0 г, 0,078 моль) добавляют толуол (300 мл), затем дистиллированную воду (30 мл) в атмосфере азота. Затем к смеси добавляют одну порцию тетракис(трифенилфосфин)палладия (9,60 г,8,40 ммоль) и затем смесь нагревают при 100 С всю ночь. После охлаждения до комнатной температуры смесь разводят дистиллированной водой (500 мл) и этилацетатом (500 мл), два слоя разделяют и водную фазу снова экстрагируют этилацетатом (2500 мл). Органические фракции соединяют, промывают дистиллированной водой (1 л), затем рассолом (1 л), после чего высушивают над сульфатом магния. Суспензию фильтруют и фильтрат упаривают под вакуумом. Неочищенный продукт очищают с помощью колоночной флэш-хроматографии на силикагеле, затем дополнительно с помощью колоночной флэшхроматографии на щелочном оксиде алюминия (10% этилацетата в гексане в качестве элюента) для получения 4'-хлор-4-циклопропил-2'-фторбифенил-3-карбальдегида (7,6 г, 36%). Этап 4. Приготовление 4-[1-(4'-хлор-4-циклопропил-2'-фторбифенил-3-ил)метилиден]-2,2,5,5 тетраметилдигидрофуран-3-она В очень холодный раствор дигидро-2,2,5,5-тетраметилфуран-3-она (8,40 г, 0,059 моль) в безводном 1,2-диметоксиэтане (75 мл) добавляют одну порцию метилата натрия (3,60 г, 0,066 моль) и реакционную смесь перемешивают при данной температуре в течение 30 мин. Затем в течение 20 мин по капле добавляют раствор 4'-хлор-4-циклопропил-2'-фторбифенил-3-карбальдегида (14,80 , 0,054 ммоль), удерживая температуру ниже 10 С. Реакционную смесь перемешивают при данной температуре в течение 1 ч, затем оставляют нагреваться до комнатной температуры до ее разведения диэтиловым эфиром и дистиллированной водой. Две фазы разделяют и водную фазу экстрагируют снова диэтиловым эфиром (2). Органические фракции соединяют, промывают рассолом, затем высушивают над сульфатом магния. Суспензию фильтруют и фильтрат упаривают под вакуумом для получения 4-[1-(4'-хлор-4-циклопропил-2'фторбифенил-3-ил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она (19,80 г), который достаточно очищен для непосредственного использования в следующем этапе. Этап 5. 2-(4'-Хлор-4-циклопропил-2'-фторбифенил-3-ил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-он К раствору 4-[1-(4'-хлор-4-циклопропил-2'-фторбифенил-3-ил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она (19,80 г, 0,050 ммоль) в метаноле (830 мл) при температуре 35 С добавляют 50% водный раствор пероксида водорода (5,00 мл, 0,075 ммоль), сразу после чего добавляют раствор 2 М гидроксида лития (5,00 мл, 0,01 моль). Смесь перемешивают при данной температуре в течение еще 2 ч, затем оставляют остывать до комнатной температуры. Затем реакционную смесь гасят 10% метабисульфитом натрия (отрицательный тест с помощью йодкрахмальной реактивной бумаги), затем разводят диэтиловым эфиром. Большую часть метанола удаляют под вакуумом, а неочищенную смесь распределяют между дистиллированной водой и диэтиловым эфиром. Водную фазу далее экстрагируют диэтиловым эфиром (2), затем все органические фракции соединяют и промывают насыщенным бикарбонатом натрия( 2), затем рассолом. После осушения над сульфатом магния суспензию фильтруют и фильтрат упаривают под вакуумом для получения 2-(4'-хлор-4-циклопропил-2'-фторбифенил-3-ил)-4,4,6,6-тетраметил 1,5-диоксаспиро[2.4]гептан-7-она (18,2 г) в виде пены оранжевого цвета. Этот материал обладает достаточной чистотой для использования непосредственно в следующем этапе без дальнейшей очистки. 1 Н NMR (CDCl3):7,48 (s, 1H), 7,39 (d, 1H), 7,32 (t, 1H), 7,24-7,12 (m, 2H), 7,00 (d, 1H), 4,76 (s, 1 Н),1,84-1,76 (m, 1 Н), 1,42-1,26 (m, 9 Н), 1,11-0,96 (m, 2 Н), 0,88-0,79 (m, 4 Н), 0,78-0,71 (m, 1 Н). Этап 6. Получение 4-(4'-хлор-4-циклопропил-2'-фторбифенил-3-ил)-2,2,6,6-тетраметилпиран-3,5 диона К смеси 2-(4'-хлор-4-циклопропил-2'-фторбифенил-3-ил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она (18,20 г, 0,044 моль) и трифлата иттербия (2,40 г, 4,40 ммоль) добавляют раствор 5 М перхлората лития (приготовленный из 46 мл диэтилового эфира и 24,40 г перхлората лития). Полученную суспензию перемешивают при комнатной температуре в течение 3 дней, затем разводят диэтиловым эфиром (85 мл) и добавляют дополнительное количество трифлата иттербия (7,80 г, 0,014 моль). После перемешивания при комнатной температуре еще в течение 3 дней добавляют дополнительное количество трифлата иттербия (13,63 г, 0,025 моль) и реакционную смесь перемешивают в течение 11 дней. В заключение добавляют дополнительную порцию перхлората лития (24,40 г, 0,23 моль) и реакционную смесь нагревают при температуре 27 С (внутренняя температура) в течение 1 дня. Реакционную смесь распределяют между диэтиловым эфиром и дистиллированной водой, две фазы разделяют и водную фазу экстрагируют диэтиловым эфиром (2). Органические фракции соединяют, промывают рассолом, затем высушивают над сульфатом магния. Суспензию фильтруют и фильтрат упаривают под вакуумом. Неочищенный материал очищают с помощью колоночной флэш-хроматографии (10% этилацетата в гексанах в качестве элюента) до образования масла, которое растирают с гексанами для получения 4-(4'-хлор 4-циклопропил-2'-фторбифенил-3-ил)-2,2,6,6-тетраметилпиран-3,5-диона (4,78 г) в виде твердого вещества белого цвета. 1 Н NMR (CDCl3):7,47 (d, 1 Н), 7,38 (t, 1H), 7,23 (s, 1H), 7,21-7,12 (m, 3H), 5,68 (s, 1H), 1,75 (m, 1H),1,62 (s, 6H), 1,49 (s, 6H), 0,92-0,82 (m, 2H), 0,81-0,75 (m, 1H), 0,61-0,53 (m, 1H). Пример Р 9. Получение 4-(2',4'-дихлор-4-циклопропилбифенил-3-ил)-2,2,6,6-тетраметилпиран-3,5 диона(32,0 г, 0,17 моль) и карбоната натрия (24,0 г, 0,23 моль) добавляют 1,2-диметоксиэтан (225 мл) и дистиллированную воду (75 мл), затем суспензию перемешивают в атмосфере азота. После этого к настоящей смеси добавляют хлорид [1,1'-бис(дифенилфосфино)ферроцен]палладия(II) (4,5 г, 7,5 ммоль), затем нагревают при температуре кипения всю ночь. После охлаждения до комнатной температуры и разведения дистиллированной водой (500 мл) и дихлорметаном (500 мл) две фазы разделяют, и водную фазу снова экстрагируют дихлорметаном (2500 мл). Органические фракции соединяют, промывают рассолом (800 мл), затем высушивают над сульфатом магния. Суспензию фильтруют и фильтрат упаривают под вакуумом. В завершение неочищенный продукт очищают с помощью колоночной флэшхроматографии (10% этилацетата в изогексановом элюенте) для получения 2',4'-дихлор-4- 18020243 гидроксибифенил-3-карбальдегида (32,73 г, 82%) в виде твердого вещества светло-желтого цвета. Этап 2. Получение эфира 2',4'-дихлор-3-формилбифенил-4-ил трифторметансульфоновой кислоты К очень холодной смеси 2',4'-дихлор-4-гидроксибифенил-3-карбальдегида (31,70 г, 0,12 моль) и пиридина (25,0 мл, 0,29 моль) в безводном дихлорметане (650 мл) по капле добавляют трифторметансульфоновый ангидрид (22,0 мл, 0,13 ммоль) в течение 30 мин, поддерживая температуру в пределах 0-10 С. Затем реакционную смесь оставляют нагреваться до комнатной температуры, после чего перемешивают всю ночь. После разведения дистиллированной водой (500 мл) и дихлорметаном (300 мл) два слоя разделяют и органическую фазу далее промывают насыщенным водным раствором сульфата меди (3500 мл), водой (500 мл), затем рассолом (500 мл). После осушения над сульфатом магния растворитель удаляют под вакуумом и неочищенный продукт очищают с помощью колоночной флэш-хроматографии(10% этилацетата в гексановом элюенте) для получения эфира 2',4'-дихлор-3-формилбифенил-4-ил трифторметансульфоновой кислоты в виде масла оранжевого цвета. Этап 3. Получение 2',4'-дихлор-4-циклопропилбифенил-3-карбальдегида К смеси эфира 2',4'-дихлор-3-формилбифенил-4-ил трифторметансульфоновой кислоты (30,0 г,0,075 моль), циклопропилбороновой кислоты (8,50 г, 0,097 моль), фосфата калия (56,30, 0,27 моль) и бромида натрия (7,7 г, 0,075 моль) добавляют толуол (300 мл), затем дистиллированную воду (30 мл) в атмосфере азота. Затем к данной смеси добавляют одну порцию тетракис(трифенилфосфин) палладия(9,30 г, 0,0081 моль) и затем смесь нагревают при 100 С всю ночь. После охлаждения до комнатной температуры смесь разводят дистиллированной водой (500 мл) и этилацетатом (500 мл), два слоя разделяют. Водную фазу далее экстрагируют дихлорметаном (2500 мл), затем все органические фракции соединяют, промывают дистиллированной водой (1 л), затем рассолом (1 л). После высушивания над сульфатом магния суспензию фильтруют и фильтрат упаривают под вакуумом. Неочищенный продукт очищают с помощью колоночной флэш-хроматографии на силикагеле (2-10% этилацетата в гексанах в качестве элюента), затем дополнительно с помощью колоночной флэш-хроматографии на щелочном оксиде алюминия (10% этилацетата в гексане в качестве элюента) для получения 2',4'-дихлор-4 циклопропилбифенил-3-карбальдегида (11,7 г, 54%). Этап 4. Приготовление 4-[1-(2',4'-дихлор-4-циклопропилбифенил-3-ил)метилиден]-2,2,5,5 тетраметилдигидрофуран-3-она В очень холодный раствор дигидро-2,2,5,5-тетраметилфуран-3-она (15,70 г, 0,11 моль) в безводном 1,2-диметоксиэтане (285 мл) добавляют одну порцию метилата натрия (6,50 г, 0,12 моль) и реакционную смесь перемешивают при данной температуре в течение 30 мин. Затем в течение 20 мин по каплям добавляют раствор 2'4'-дихлор-4-циклопропилбифенил-3-карбальдегида (13,70 г, 0,047 ммоль), поддерживая температуру ниже 10 С. Реакционную смесь перемешивают при данной температуре в течение 2 ч,затем оставляют нагреваться до комнатной температуры до ее разведения диэтиловым эфиром и дистиллированной водой. Две фазы разделяют и водную фазу экстрагируют снова диэтиловым эфиром (2). Органические фракции соединяют, промывают рассолом, затем высушивают над сульфатом магния. Суспензию фильтруют и фильтрат упаривают под вакуумом. Водную фазу далее окисляют с помощью 2 М соляной кислоты, затем снова экстрагируют диэтиловым эфиром (2), высушивают над сульфатом магния и упаривают под вакуумом. Все органические фракции соединяют, затем разводят толуолом и азеотропной смесью (4) для получения 4-[1-(2',4'-дихлор-4-циклопропилбифенил-3-ил)метилиден]2,2,5,5-тетраметилдигидрофуран-3-она (20,0 г), который достаточно очищен для непосредственного использования в следующем этапе. Этап 5. 2-(2',4'-Дихлор-4-циклопропилбифенил-3-ил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-он К раствору 4-[1-(2',4'-дихлор-4-циклопропилбифенил-3-ил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она (20,0 г, 0,048 моль) в метаноле (800 мл) при температуре 35 С добавляют 50%-ный водный пероксид водорода (4,80 мл, 0,072 ммоль), сразу после чего добавляют раствор 2 М гидроксида лития (4,80 мл, 9,60 ммоль). Смесь перемешивают при данной температуре в течение еще 2 ч, затем оставляют остывать до комнатной температуры. Затем реакционную смесь гасят 10% метабисульфитом натрия (отрицательный тест с помощью йодкрахмальной реактивной бумаги), затем разводят диэтиловым эфиром. Большую часть метанола удаляют под вакуумом, а неочищенную смесь распределяют между дистиллированной водой и диэтиловым эфиром. Водную фазу далее экстрагируют диэтиловым эфиром (2), затем все органические фракции соединяют и промывают насыщенным бикарбонатом натрия (2), затем рассолом. После осушения над сульфатом магния суспензию фильтруют и фильтрат упаривают под вакуумом для получения 2-(2',4'-дихлор-4-циклопропилбифенил-3-ил)-4,4,6,6-тетраметил-1,5 диоксаспиро[2.4]гептан-7-она (17,80 г) в виде пены оранжевого цвета. Этот материал обладает достаточной чистотой для использования непосредственно в следующем этапе без дальнейшей очистки. 1 Н NMR (CDCl3):7,49 (s, 1 Н), 7,37 (s, 1H), 7,37-7,25 (m, 2H), 7,20 (d, 1H), 6,99 (d, 1H), 4,75 (s, 1H),1,80 (m, 1H), 1,40-1,28 (m, 9H), 1,10-0,98 (m, 2H), 0,90-0,80 (m, 4H), 0,75-0,80 (m, 1H). Этап 6. Получение 4-(2',4'-дихлор-4-циклопропилбифенил-3-ил)-2,2,6,6-тетраметилпиран-3,5-диона К смеси 2-(2',4'-дихлор-4-циклопропилбифенил-3-ил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она (17,80 г, 0,041 моль) и трифлата иттербия (2,20 г, 4,41 ммоль) добавляют раствор 5 М перхлората лития (приготовленный из 42 мл диэтилового эфира и 22,30 г перхлората лития). Полученную суспензию перемешивают при комнатной температуре в течение 17 дней, на этом этапе добавляют дополнительное количество диэтилового эфира (42 мл), перхлората лития (22,3 г, 0,21 моль) и трифлата иттербия (19,8 г, 0,035 моль). Затем реакционную смесь нагревают при температуре 27 С (внутренняя температура) в течение 1 дня, затем распределяют между диэтиловым эфиром и дистиллированной водой. Две фазы разделяют, водную фазу экстрагируют диэтиловым эфиром (2), затем все органические фракции соединяют, промывают рассолом и высушивают над сульфатом магния. Суспензию фильтруют и фильтрат упаривают под вакуумом. Неочищенный материал очищают с помощью колоночной флэшхроматографии (этилацетат/гексан в качестве элюента) до образования масла, которое растирают с гексанами для получения 4-(2',4'-дихлор-4-циклопропилбифенил-3-ил)-2,2,6,6-тетраметилпиран-3,5-диона(2,80 г) в виде твердого вещества белого цвета. 1 Н NMR (CDCl3):7,48 (s, 1 Н), 7,38 (dd, 1H), 7,29 (s, 2H), 7,16-7,11 (m, 2H), 5,69 (s, 1H), 1,76 (m,1H), 1,61 (d, 6H), 1,49 (d, 6H), 0,92-0,86 (m, 2H), 0,82-0,76 (m, 1H), 0,62-0,54 (m, 1H).(1,34 г, 7,0 ммоль) и карбоната натрия (0,99, 7,98 ммоль) в системе смешанных растворителей 1,2 диметоксиэтана (12 мл) и дистиллированной воды (4 мл) перемешивают в атмосфере азота, затем продувают азотом (2). После этого добавляют одну порцию хлорида [1,1'-бис(дифенилфосфино)ферроцен]палладия(II) (1,15 г, 1,41 ммоль) и суспензию снова продувают азотом, затем нагревают при температуре кипения всю ночь. После охлаждения до комнатной температуры реакционную смесь разводят дистиллированной водой (10 мл) и экстрагируют дихлорметаном (10 мл). Водную фазу снова экстрагируют дихлорметаном (2), и в заключение соединенные органические фракции промывают рассолом и высушивают над сульфатом магния. Неочищенный продукт очищают с помощью колоночной флэшхроматографии (изогексан к элюенту в соотношении 75:25 изогексана/этилацетата) для получения 2',4'дихлор-4-этилбифенил-3-карбальдегида в виде желтого масла. Этап 2. Получение 4-[1-(2',4'-дихлор-4-этилбифенил-3-ил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она К очень холодному раствору 2,2,5,5-тетраметилдигидрофуран-3-она (1,15 г, 0,0081 моль) в 1,2 диметоксиэтане (2 мл) добавляют одну порцию метилата натрия (0,481 г, 0,0089 моль). Затем реакционную смесь перемешивают при данной температуре в течение 5 мин, после чего добавляют второй раствор 2',4'-дихлор-4-этилбифенил-3-карбальдегида (2,02 г, 0,0072 моль) в 1,2-диметоксиэтане (2,7 мл). После перемешивания в течение дополнительных 2 ч при температуре 0 С реакционную смесь оставляют стоять на ночь при комнатной температуре. Неочищенный раствор выливают в 2 М соляной кислоты и экстрагируют эфиром (3). Органические фракции соединяют, промывают рассолом, высушивают над сульфатом магния и упаривают под вакуумом. Остаток очищают с помощью колоночной флэшхроматографии (5% этилацетата в изогексане к 25% этилацетата в изогексане) для получения 4-[1-(2',4'дихлор-4-этилбифенил-3-ил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она в виде камеди желтого цвета. Этап 3 А. Получение 2-(2',4'-дихлор-4-этилбифенил-3-ил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она К раствору 4-[1-(2',4'-дихлор-4-этилбифенил-3-ил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3 она (2,04 г, 0,0051 моль) в метаноле (24 мл) при температуре 55 С добавляют раствор пероксида водоро- 21020243 да (0,43 мл, 0,0076 моль, 50% водный раствор), сразу после чего добавляют водный гидроксид лития(0,25 мл, 0,0005 моль). Реакционную смесь нагревают при данной температуре в течение 30 мин, затем быстро охлаждают до комнатной температуры и гасят насыщенным тиосульфатом натрия. Неочищенный продукт экстрагируют диэтиловым эфиром (3), промывают насыщенным бикарбонатом натрия, затем высушивают над сульфатом магния. Остаток очищают с помощью колоночной флэш-хроматографии (5% этилацетата в изогексане к 25% этилацетата в изогексане) для получения 2-(2',4'-дихлор-4-этилбифенил 3-ил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она в виде камеди желтого цвета. Этап 3 В. Получение 2-(2',4'-дихлор-4-этилбифенил-3-ил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4] гептан-7-она К раствору 4-[1-(2',4'-дихлор-4-этилбифенил-3-ил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3 она (0,500 г, 1,24 ммоль) в толуоле (3,7 мл) добавляют водный раствор гиперхлорита натрия (3,30 г, 6,20 ммоль, 14%-ный активированный хлор) и гидросульфат тетрабутиламмония (0,013 мл, 0,04 ммоль) и двухфазную жидкость затем перемешивают при температуре 50 С в течение 4 ч. Реакционную смесь затем разводят дополнительным толуолом, фазы разделяют и органическую фазу снова промывают дистиллированной водой (2). Органическую фазу высушивают над сульфатом натрия, затем упаривают под вакуумом для получения 2-(2',4'-дихлор-4-этилбифенил-3-ил)-4,4,6,6-тетраметил-1,5 диоксаспиро[2.4]гептан-7-она в виде твердого вещества белого цвета. Этап 4 А. Получение 4-(2',4'-дихлор-4-этилбифенил-3-ил)-2,2,6,6-тетраметилпиран-3,5-диона К очень холодному раствору концентрированной серной кислоты (6 мл) по капле добавляют второй раствор 2-(2',4'-дихлор-4-этилбифенил-3-ил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она (1,90 г,0,0045 моль) в 1,2-дихлорэтане (6 мл) в течение 5 мин. Эту двухфазную смесь энергично перемешивают в течение 2 ч при 0 С, затем выливают в лед и экстрагируют диэтиловым эфиром. Все органические фракции соединяют, промывают рассолом, высушивают над сульфатом магния, затем упаривают под вакуумом. Неочищенный продукт очищают с помощью колоночной флэш-хроматографии (5% этилацетата в изогексане к 25% этилацетата в изогексане) для получения 4-(2',4'-дихлор-4-этилбифенил-3-ил)2,2,6,6-тетраметилпиран-3,5-диона в виде камеди желтого цвета. 1 Н NMR (CDCl3):7,48 (d, 1H), 7,43 (m, 2H), 7,30 (m, 2H), 7,13 (d, 1H), 5,71 (br. s, 1H), 2,55-2,44 (m,2H), 1,62 (s, 6H), 1,49 (app. d, 6H), 1,17 (t, 3H). Этап 4 В. Получение 4-(2',4'-дихлор-4-этилбифенил-3-ил)-2,2,6,6-тетраметилпиран-3,5-диона К раствору 2-(2',4'-дихлор-4-этилбифенил-3-ил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7 она (0,0418 г, 0,10 ммоль) в толуоле (0,3 мл) добавляют моногидрат пара-толуолсульфокислоты (0,019 г,0,10 ммоль). Затем смесь нагревают до 150 С в течение 1 ч, после чего ее оставляют остывать до комнатной температуры. Реакционную смесь выливают в дистиллированную воду, высушивают над сульфатом натрия, затем упаривают под вакуумом для получения 4-(2',4'-дихлор-4-этилбифенил-3-ил)-2,2,6,6 тетраметилпиран-3,5-диона. К суспензии 5-бромсалицилальдегида (7,60 г, 0,038 моль) и карбоната цезия (17,30 г, 0,053 моль) в безводном N,N-диметилформамиде (55 мл) добавляют хлордифторацетат натрия (13,30 г, 0,087 моль), а затем дистиллированную воду (10 мл). Реакционную смесь нагревают до 100 С в течение 6 ч (крупные куски твердого вещества измельчают с помощью шпателя), затем оставляют остывать до комнатной температуры и гасят концентрированной соляной кислотой (15 мл). После перемешивания в течение дополнительных 2 ч реакционную смесь разводят дистиллированной водой и экстрагируют этилацетатом ( 2). Органические фракции соединяют, промывают водным раствором 2 М гидроксида натрия, рассолом, затем высушивают над сульфатом магния. Суспензию фильтруют и фильтрат упаривают в вакууме для получения 5-бром-2-трифторметоксибензальдегида (5,66 г) достаточной чистоты для использования непосредственно в следующем этапе. Этап 2. Получение 4-[1-(5-бром-2-дифторметоксифенил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она К очень холодному раствору 2,2,5,5-тетраметилдигидрофуран-3-она (3,60 г, 0,025 ммоль) в безводном 1,2-диметоксиэтане (8 мл) добавляют одну порцию метилата натрия (1,51 г, 0,028 моль). После перемешивания при данной температуре в течение 5 мин добавляют по каплям раствор 5-бром-2 дифторметоксибензальдегида (5,66 г, 0,023 моль) в 1,2-диметоксиэтане (8 мл) в течение 10 мин, затем перемешивают при температуре 0 С в течение еще 1 ч. После нагревания до комнатной температуры реакционную смесь разводят эфиром и промывают 2 М соляной кислоты (2). Органические фракции соединяют, высушивают над сульфатом магния и выпаривают под вакуумом для получения 4-[1-(5-бром 2-дифторметоксифенил)метилиден]-2,2,5,5-тетраметилдигидрофуран-3-она (8,89 г) в виде масла оранжевого цвета. Этап 3. Получение 2-(5-бром-2-дифторметоксифенил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она(8,89 г, 0,023 моль) в метаноле (380 мл) при 35 С добавляют 50% водный раствор пероксида водорода(2,30 мл, 0,034 моль), сразу после чего добавляют водный раствор 2 М гидроксида лития (2,30 мл, 0,0046 моль). После перемешивания при данной температуре в течение 1 ч реакционную смесь оставляют остывать, затем гасят 10% раствором метабисульфита натрия (отрицательный тест с помощью йодкрахмальной реактивной бумаги). Реакционную смесь экстрагируют диэтиловым эфиром ( 3), затем органическую фазу повторно промывают насыщенным водным раствором бикарбоната натрия ( 2), затем рассолом. Все органические фракции соединяют, высушивают над сульфатом магния, фильтруют и фильтрат упаривают под вакуумом для получения 2-(5-бром-2-дифторметоксифенил)-4,4,6,6-тетраметил-1,5 диоксаспиро[2.4]гептан-7-она (7,22 г) в виде камеди желтого цвета. Этап 4. Получение 4-(5-бром-2-дифторметоксифенил)-2,2,6,6-тетраметилпиран-3,5-диона К очень холодному раствору концентрированной серной кислоты (12 мл) по капле добавляют второй раствор 2-(5-бром-2-дифторметоксифенил)-4,4,6,6-тетраметил-1,5-диоксаспиро[2.4]гептан-7-она(7,22 г, 18,00 ммоль) в 1,2-дихлорэтане (12 мл) в течение 5 мин. Эту двухфазную смесь энергично перемешивают в течение 2 ч при температуре 0 С, затем оставляют стоять на ночь при комнатной температуре. Реакционную смесь выливают в очень холодную воду, промывая небольшим количеством дополнительного 1,2-дихлорэтана/воды, затем упаривают под вакуумом для удаления всех органических растворителей. Неочищенный продукт затем экстрагируют этилацетатом ( 3), после чего все органические фракции соединяют, промывают рассолом и высушивают над сульфатом магния. Суспензию фильтруют и фильтрат упаривают под вакуумом, затем очищают с помощью колоночной флэш-хроматографии (10% к 25% этилацетата в гексане в качестве элюента) до образования масла, которое растирают с гексанами для получения 4-(5-бром-2-дифторметоксифенил)-2,2,6,6-тетраметилпиран-3,5-диона (2,08 г) в виде твердого вещества белого цвета. 1 Н NMR (CDCl3):7,54 (dd, 0,75H, изомер А), 7,51 (dd, 0,25H, изомер В), 7,37 (d, 0,75H, изомер А),7,32 (d, 0,25H, изомер В), 7,15 (d, 0,75H, изомер А), 7,06 (d, 0,25 Н, изомер), 6,32 (t, 0,75 Н, изомер А), 6,29(t, 0,25 Н, изомер В) 1H), 5,86 (s, 0,75 Н, изомер А), 5,28 (s, 0,25H, изомер А), 1,58-1,44 (m, 12H, изомеры А и В). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (А) включающий реакцию соединения формулы (I) с кислотойR2 обозначает галоген или фенил, замещенный галогеном, нитро, циано, C1-С 2-алкилом, C1-С 2 галоалкилом, C1-С 2-алкокси или C1-С 2-галоалкокси;R4, R5, R6 и R7 независимо друг от друга обозначают водород, C1-С 2-алкил, C1-С 2-галоалкил или С 1 С 2-алкокси-С 1-С 2-алкил; или, где это возможно, его N-окиси или соли. 2. Способ по п.1, где R2 обозначает фенил, замещенный в пара-положении галогеном и необязательно дополнительно замещенный галогеном, нитро, C1-С 2-алкилом, С 1-С 2-галоалкилом, С 1-С 2-алкокси или С 1-С 2-галоалкокси. 3. Способ по п.1 или 2, где R2 обозначает фенил, замещенный в пара-положении хлором и необязательно дополнительно замещенный галогеном, нитро, С 1-С 2-алкилом, C1-С 2-галоалкилом, С 1-С 2-алкокси или С 1-С 2-галоалкокси. 4. Способ по любому из пп.1-3, где R3 обозначает водород, что означает, что r равно 0. 5. Способ по п.1, гдеR2 обозначает фенил или фенил, замещенный галогеном или С 1-С 2-алкилом;R4, R5, R6 и R7 независимо друг от друга обозначают С 1-С 2-алкил. 6. Способ по п.1, гдеR2 обозначает галоген или фенил, замещенный галогеном, С 1-С 2-алкилом, С 1-С 2-галоалкилом, С 1 С 2-галоалкокси или C1-С 2-алкокси;R4, R5, R6 и R7 независимо друг от друга обозначают водород, метил или этил; иY обозначает кислород. 7. Способ по любому из пп.1-6, где кислота обозначает кислоту Бренстеда или кислоту Льюиса. 8. Способ по любому из пп.1-6, где кислота обозначает кислоту Бренстеда, которая представляет собой неорганическую или органическую кислоту. 9. Способ по любому из пп.1-8, где использован пригодный растворитель, выбранный по принципу совместимости с кислотой. 10. Способ по п.9, где пригодный растворитель представляет собой хлорированный углеводород,спирт, эфир, ароматическую или органическую кислоту, или смесь таких растворителей. 11. Способ по п.10, где пригодный растворитель представляет собой дихлорметан, дихлорэтан, диэтиловый эфир, уксусную кислоту, муравьиную кислоту, толуол, бензол, метанол, этанол, изопропанол или тетрагидрофуран, или смесь таких растворителей. 12. Способ по любому из пп.1-11, где температура реакции находится в пределах между -50 и 83 С. 13. Способ по любому из пп.1-11, где температура реакции находится в пределах между -50 и 40 С. 14. Соединение формулы IR2 обозначает галоген или фенил, замещенный галогеном, нитро, циано, C1-С 2-алкилом, С 1-С 2 галоалкилом, С 1-С 2-алкокси или C1-С 2-галоалкокси;R4, R5, R6 и R7 независимо друг от друга обозначают водород, C1-С 2-алкил, С 1-С 2-галоалкил или С 1 С 2-алкокси-С 1-С 2-алкил; или, где это возможно, его N-окись или соль. 15. Соединение по п.14, где R2 обозначает фенил, замещенный в пара-положении галогеном и необязательно дополнительно замещенный галогеном, нитро, С 1-С 2-алкилом, С 1-С 2-галоалкилом, С 1-С 2 алкокси или С 1-С 2-галоалкокси. 16. Соединение по п.14, где R3 обозначает водород, что означает, что r равно 0, или R3 обозначаетR2 обозначает фенил или фенил, замещенный галогеном или C1-С 2-алкилом;R4, R5, R6 и R7 независимо друг от друга обозначают C1-С 2-алкил иR2 обозначает галоген или фенил, замещенный галогеном, С 1-С 2-алкилом, С 1-С 2-галоалкилом, C1 С 2-галоалкокси или С 1-С 2-алкокси;R4, R5, R6 и R7 независимо друг от друга обозначают водород, метил или этил иY обозначает кислород. 19. Способ получения соединения формулы I включающий реакцию соединения формулы (F) где значения R1, R2, R3, R4, R5, R6, R7, Y и r определены в п.14 и Hal обозначает хлор, бром или йод. 20. Способ получения соединения формулы I включающий реакцию соединения формулы (С) с получением соединения формулы (В) и затем реакцию соединения формулы (В) с окисляющим агентом, где значения R1, R2, R3, R4, R5,R , R , Y и r определены в п.14. 6
МПК / Метки
МПК: C07D 493/10, C07D 309/32
Метки: спироэпоксиды, продукты, синтеза, промежуточные
Код ссылки
<a href="https://eas.patents.su/28-20243-spiroepoksidy-kak-promezhutochnye-produkty-sinteza.html" rel="bookmark" title="База патентов Евразийского Союза">Спироэпоксиды как промежуточные продукты синтеза</a>
Предыдущий патент: Передвижная установка для дозирования, перемешивания и упаковки
Следующий патент: Урацильные циклопропилнуклеотиды
Случайный патент: Способ получения нитробифенилов












