Урацильные циклопропилнуклеотиды
Номер патента: 20244
Опубликовано: 30.09.2014
Авторы: Ван Хоф Стивен Морис Паула, Рабуассон Пьер Жан-Мари Бернар, Вандекеркхове Лен Анна Мария, Йонкерс Тим Хьюго Мария, Вандик Коэн
Формула / Реферат
1. Соединение формулы (I)
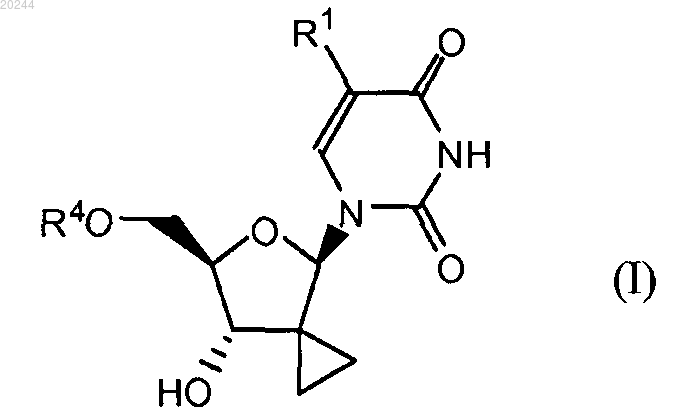
включая все его возможные стереоизомеры, где
R1 представляет собой водород или галоген;
R4 представляет собой группу формулы
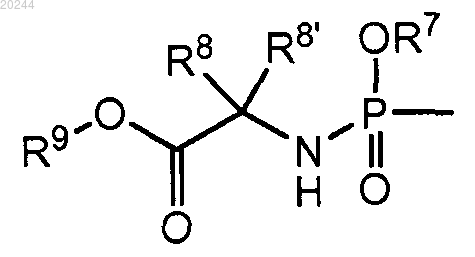
R7 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из галогена, С1-С6алкила, С3-С6алкенила, С1-С6алкокси, С1-С6алкоксикарбонила, гидрокси и амино; или R7 представляет собой нафтил; или R7 представляет собой индолил или N-С1-С6алкилоксикарбонилиндолил;
R8 представляет собой водород, С1-С6алкил, бензил;
R8' представляет собой водород, С1-С6алкил, бензил или
R8 и R8' вместе с атомом углерода, к которому они присоединены, образуют С3-С7циклоалкил;
R9 представляет собой С1-С10алкил, С3-С6алкенил, С3-С7циклоалкил, бензил;
или его фармацевтически приемлемые соль или сольват.
2. Соединение по п.1, где R7 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из галогена, С1-С6алкила, С3-С6алкенила и С1-С6алкокси, или R7 представляет собой нафтил.
3. Соединение по п.1, где R7 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из галогена и С1-С6алкила.
4. Соединение по п.1, где R7 представляет собой фенил, необязательно замещенный галогеном или С1-С6алкилом, или R7 представляет собой нафтил.
5. Соединение по любому из пп.1-4, где R8 представляет собой водород и R8' представляет собой водород или С1-С6алкил.
6. Соединение по любому из пп.1-4, где группа

где R8 представляет собой водород и R8' представляет собой С1-С6алкил, бензил.
7. Соединение по п.6, где R8 представляет собой водород и R8' представляет собой С1-С2алкил.
8. Соединение по п.6, где R8 представляет собой водород и R8' представляет собой метил.
9. Соединение по п.1, где R9 представляет собой С1-С8алкил или бензил.
10. Соединение по п.1, где R9 представляет собой метил, этил, изопропил, 1-метилпропил, изобутил, бутил, трет-бутил, бензил, циклопентил, 5-гексенил, 2,2-диметилбутил, октил или 2-пропилпентил.
11. Соединение по п.10, где R9 представляет собой этил, изобутил, бутил, бензил, циклопентил, 5-гексенил, 2,2-диметилбутил или 2-пропилпентил.
12. Фармацевтическая композиция, содержащая эффективное против вируса HCV количество соединения формулы (I), как определено в любом из пп.1-11, и фармацевтически приемлемый носитель.
13. Применение соединения по любому из пп.1-11 в качестве ингибитора HCV.
Текст
Ван Хоф Стивен Морис Паула,Вандекеркхове Лен Анна Мария,Вандик Коэн (BE) Описаны соединения формулы I, включающие любые их возможные стереоизомеры, гдеR1 представляет собой водород или галоген; R4 представляет собой группу формулы(II), R7 представляет собой необязательно замещенный фенил; нафтил; индолил или NС 1-С 6 алкилоксикарбонилиндолил; R8 представляет собой водород, C1-С 6 алкил, бензил; R8' представляет собой водород, С 1-С 6 алкил, бензил или R8 и R8' вместе с атомом углерода, к которому они присоединены, образуют С 3-С 7 циклоалкил; R9 представляет собой C1-С 10 алкил, С 3 С 7 циклоалкил, С 3-С 6 алкенил, бензил, или их фармацевтически приемлемая соль или сольват, а также фармацевтические композиции и применение соединений I в качестве ингибиторов HCV. Йонкерс Тим Хьюго Мария,Рабуассон Пьер Жан-Мари Бернар,(71)(73) Заявитель и патентовладелец: СЕНТОКОР ОРТО БАЙОТЕК ПРОДАКТС Эл.Пи. (US); МЕДИВИР АБ (SE) Техническая область Это изобретение относится к новым нуклеотидам, которые являются ингибиторами полимеразы вируса гепатита С (HCV), и к их применению для лечения или профилактики HCV. Уровень техникиHCV представляет собой вирус с одноцепочечной положительной смысловой РНК, относящийся к семейству вирусов Flaviviridae рода hepacivirus. Область NS5B РНК-полигена кодирует РНК-зависимую РНК-полимеразу (RdRp), которая необходима для репликации вируса. После первоначальной острой инфекции у большинства инфицированных индивидуумов развивается хронический гепатит, посколькуHCV реплицируется предпочтительно в гепатоцитах, но не является прямо цитопатическим. В частности,отсутствие энергичного Т-лимфоцитарного ответа и высокая предрасположенность вируса к мутациям,по-видимому, обеспечивают высокий уровень хронической инфекции. Хронический гепатит может прогрессировать в фиброз печени, ведущий к циррозу, конечному заболеванию печени, и НСС (печеночноклеточную карциному), что делает его ведущей причиной трансплантаций печени. Существует шесть основных генотипов HCV и более чем 50 подтипов, которые дифференциально распределены географически. Генотип HCV 1 является преобладающим генотипом в Европе и в США. Широкая генетическая гетерогенность HCV имеет важное диагностическое и клиническое значение,возможно, объясняя сложность разработки вакцины и отсутствие ответа на современную терапию. Передача HCV может происходить при контакте с зараженной кровью или продуктами крови, например, после переливания крови или внутривенного употребления наркотиков. Внедрение диагностических тестов, используемых для скрининга крови, привело к тенденции снижения частоты появления посттрансфузионного HCV. Однако с учетом медленного прогрессирования в конечное заболевание печени существующие инфекции продолжают представлять собой серьезную медицинскую и экономическую проблему на десятилетия. Современные способы лечения HCV основаны на (пегилированном) интерфероне-альфа (IFN-) в комбинации с рибавирином. Эта комбинированная терапия приводит к устойчивому вирусологическому ответу более чем у 40% пациентов, инфицированных HCV генотипа 1, и у приблизительно 80% из пациентов, инфицированных генотипами 2 и 3. Помимо ограниченной эффективности в отношении HCV генотипа 1 эта комбинированная терапия имеет существенные побочные эффекты и плохо переносится многими пациентами. Основные побочные эффекты включают гриппоподобные симптомы, гематологические нарушения и нейропсихиатрические симптомы. Таким образом, существует потребность в эффективных, удобных и лучше переносимых способах лечения. Опыт с лекарственными средствами против ВИЧ, в частности с ингибиторами протеазы ВИЧ, показал, что субоптимальная фармакокинетика и сложные схемы дозирования приводят к неуспеху, связанному с непроизвольным нарушением режима дозирования. Это, в свою очередь, означает, что 24-часовая минимальная концентрация (минимальная концентрация в плазме) для соответствующих лекарственных средств в режиме для ВИЧ часто падает ниже порога IC90 или ED90 на большую часть суток. Считается,что 24-часовой минимальный уровень по меньшей мере IC50 и, более реалистично, IC90 или ED90 необходим для замедления развития мутантов, ускользающих от действия лекарственных средств. Достижение необходимой фармакокинетики и метаболизма лекарственных средств для обеспечения таких минимальных уровней является неотложной задачей при создании лекарственных средств.NS5B необходима для репликации одноцепочечного положительного смыслового РНК-геномаHCV. Этот фермент вызывает значительный интерес среди химиков, работающих в медицине. Известны как нуклеозидные, так и ненуклеозидные ингибиторы NS5B. Нуклеозидные ингибиторы могут действовать в равной степени как терминаторы цепи или как конкурентные ингибиторы, которые препятствуют связыванию нуклеотида с полимеразой. Для функционирования в качестве терминатора цепи нуклеозидный аналог должен захватываться клеткой и превращаться in vivo в трифосфат. Это превращение в трифосфат обычно опосредуется клеточными киназами,которые обеспечивают дополнительные требования к структуре потенциального нуклеозидного ингибитора полимеразы. Кроме того, это ограничивает прямую оценку нуклеозидов в качестве ингибиторов репликации HCV до клеточных анализов, в которых возможно фосфорилирование in situ. Было предпринято несколько попыток для разработки нуклеозидов в качестве ингибиторов RdRpHCV, но хотя небольшое количество соединений достигли клинической разработки, ни одно из них не достигло окончательной регистрации. Среди проблем, насчитываемых на сегодняшний день с нацеленными на HCV нуклеозидами, находятся токсичность, мутагенность, отсутствие селективности, слабая эффективность, плохая биодоступность, субоптимальные режимы дозирования и вытекающая из этого высокая нагрузка лекарственными препаратами и стоимость продуктов. В некоторых патентах и патентных заявках, а также в научных публикациях описаны нуклеозидные аналоги, обладающие активностью ингибирования HCV. В WO 2004/002999 описаны модифицированные 2' и 3'-нуклеозидные пролекарства для лечения инфекций flaviridae. В WO 2008/043704 в качестве ингибиторов полимеразы HCV описаны 4-амино-1-2R,3S,4S,5R)-5-азидо-4-гидрокси-5-гидроксиметил 3-метилтетрагидрофуран-2-ил)-1 Н-пиримидин-2-он и его сложноэфирные производные. Существует потребность в ингибиторах HCV, которые могут преодолеть недостатки современной терапии HCV, такие как побочные эффекты, ограниченная эффективность, возникновение резистентности и связанный с несоблюдением режима неуспех, а также повысить постоянный вирусологический ответ. Настоящее изобретение относится к группе ингибирующих HCV производных 1-(7-гидрокси-6 гидроксиметил-5-оксиспиро[2,4]гепт-4-ил)-1 Н,3 Н-пиримидин-2,4-диона с полезными свойствами в отношении одного или нескольких из следующих параметров: противовирусная эффективность, благоприятный профиль развития устойчивости, отсутствие токсичности и генотоксичности, благоприятная фармакокинетика и фармакодинамика и простота изготовления и введения. Соединение 1-4R,6R,7S)-7 гидрокси-6-гидроксиметил-5-оксаспиро[2,4]гепт-4-ил)-1 Н,3 Н-пиримидин-2,4-дион, также называемое 2'дезокси-2'-спироциклопропилуридином, описано в J. Am, Chem. Soc, 1992, 114, 4007-4008. Соединения по изобретению также могут быть привлекательными вследствие того факта, что они лишены активности против других вирусов, в частности против ВИЧ. ВИЧ-инфицированные пациенты часто страдают от коинфекций, таких как HCV. Лечение таких пациентов ингибитором HCV, который также ингибирует ВИЧ, может привести к возникновению устойчивых штаммов ВИЧ. Описание изобретения В одном аспекте настоящее изобретение относится к соединениям, которые могут быть представлены формулой I включая все возможные их стереоизомеры, где: R1 представляет собой водород или галоген; R4 представляет собой группу формулыR7 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из галогена, С 1-С 6 алкила, С 3-С 6 алкенила, С 1-С 6 алкокси, C1 С 6 алкоксикарбонила, гидрокси и амино; или R7 представляет собой нафтил; или R7 представляет собой индолил или N-С 1-С 6 алкилоксикарбонилиндолил;R9 представляет собой C1-С 10 алкил, С 3-С 7 циклоалкил, С 3-С 6 алкенил, бензил; или к их фармацевтически приемлемой соли или сольвату. В следующем аспекте изобретение относится к применению соединений формулы I, как указано в настоящем документе, для ингибирования HCV. Альтернативно предусматривается применение для изготовления лекарственного средства на основе соединения формулы I, как указано в настоящем документе. Соединения настоящего изобретения могут быть быть получены, исходя из промежуточного соединения, имеющего структуру, представленную выше, но где R4 представляет собой водород. Группа -NH-C(R8) (R8')-C(=O)- образует аминокислотный остаток, который включает природные и неприродные аминокислотные остатки. Особый интерес представляют аминокислотные остатки, где R8 представляет собой водород. Когда в последнем случае R8 отличен от водорода, конфигурация у асимметричного атома углерода может представлять собой L-конфигурацию аминокислоты. Ее примерами являются остатки аланина (Ala), валина (Val), изолейцина (Ile) и фенилаланина (Phe), в частности L-AIa,L-Val, L-Ile и L-Phe. Примеры аминокислотных остатков, где R8 и R8' вместе с атомом углерода, к которому они присоединены, образуют С 3-С 7 циклоалкил, являются 1,1-циклопропиламинокислота или 1,1 циклобутиламинокислота. Подгруппы соединений формулы I представляют собой соединения формулы I или подгруппы соединений формулы I, как определено в настоящем документе, где R1 представляет собой водород; или где R1 представляет собой йод. Подгруппы соединений формулы I представляют собой соединения формулы I или подгруппы соединений формулы I, как определено в настоящем документе, где R4 представляет собой группу формулы Подгруппы соединений формулы I представляют собой соединения формулы I или подгруппы соединений формулы I, как определено в настоящем документе, где:(a) R7 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из галогена, С 1-С 6 алкила, С 3-С 6 алкенила, С 1-С 6 алкокси, гидрокси и амино; или R7 представляет собой нафтил; или R7 представляет собой индолил; или R7 представляет собой Nтрет-бутилоксикарбонилиндолил.(b) R7 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из галогена, С 1-С 6 алкила, С 3-С 6 алкенила и С 1-С 6 алкокси; или R7 представляет собой нафтил;(c) R7 представляет собой фенил, необязательно замещенный галогеном или С 1-С 6 алкилом, или R7 представляет собой нафтил;(f) R7 представляет собой фенил, необязательно замещенный хлором или С 1-С 6 алкилом; или R7 представляет собой нафтил;(g) R7 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из галогена и С 1-С 6 алкила;(h) R7 представляет собой фенил, необязательно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из галогена, С 1-С 6 алкила, С 3-С 6 алкенила, С 1-С 6 алкокси, гидрокси и амино; или(i) R7 представляет собой фенил, необязательно замещенный одним заместителем, выбранным из галогена, С 1-С 6 алкила, С 3-С 6 алкенила, С 1-С 6 алкокси, гидрокси и амино; или R7 представляет собой нафтил; или R7 представляет собой индолил; или R7 представляет собой N-трет-бутилоксикарбонилиндолил;(j) R7 представляет собой фенил, необязательно замещенный одним заместителем, выбранным из галогена, C1-С 6 алкила, С 3-С 6 алкенила и С 1-С 6 алкокси;(l) R7 представляет собой 5-индолил или N-трет-бутилоксикарбонил-5-индолил. В одном варианте осуществления группа R7, являющаяся индолилом в соединениях формулы I или в любой их подгруппе, представляет собой 5-индолил, или группа R7, являющаяся N-С 1 С 6 алкилоксикарбонилиндолилом, представляет собой N-трет-бутилоксикарбонил-5-индолил, в частностиN-трет-бутилоксикарбонил-5-индолил. Индолильная группа, когда она присоединена по ее 5-положению,может быть представлена следующим образом: где R7a представляет собой водород или C1-С 6 алкилоксикарбонил, или, в частности, R7a представляет собой водород или трет-бутилоксикарбонил. Подгруппы соединений формулы I представляют собой соединения формулы I или подгруппы соединений формулы I, как определено в настоящем документе, где R8 представляет собой водород и R8' представляет собой метил или С 1-С 6 алкил, такой как изопропил или изобутил. Подгруппы соединений формулы I представляют собой соединения формулы I или подгруппы соединений формулы I, как определено в настоящем документе, где группа представляет собой глицил, аланил или валил (Gly, Ala или Val; в частности Gly, L-Ala или L-Val). Подгруппы соединений формулы I представляют собой соединения формулы I или подгруппы соединений формулы I, как определено в настоящем документе, где группа-3 020244 где R8 представляет собой водород и R8' представляет собой водород, С 1-С 6 алкил, бензил; или R8 представляет собой водород и R8' представляет собой водород или С 1-С 6 алкил; R8 представляет собой водород и R8' представляет собой С 1-С 2 алкил; R8 представляет собой водород и R8' представляет собой метил. В одном варианте осуществления R8 и R8' вместе с атомом углерода, к которому они присоединены,образуют С 3-С 7 циклоалкил; или, в частности, образуют С 3-С 4 циклоалкил; или, в частности, образуют циклопропил. Подгруппы соединений формулы I представляют собой соединения формулы I или подгруппы соединений формулы I, как определено в настоящем документе, где:(h) R9 представляет собой циклопентил; 5-гексенил; 2,2-диметилбутил; октил; 2-пропилпентил. Интерес представляют соединения, упомянутые в экспериментальной части, и их фармацевтически приемлемые соли или сольваты. Особый интерес представляют соединения 1, 3, 5, 9, 10, 11, 12, 13, 14,15, приведенные в экспериментальной части. Соединения формулы I имеют несколько центров хиральности, в частности у атомов углерода 1',3'и 4'. Хотя стереохимия этих атомов углерода является фиксированной, соединения могут проявлять по меньшей мере 75%, предпочтительно по меньшей мере 90%, например более чем 95%, энантиомерную чистоту по каждому из хиральных центров. Хиральность также может присутствовать в заместителях, например, где R4 представляет собой который может иметь хиральность в несущем R8 углероде (где R8 и R8' отличаются) и в атоме фосфора. Фосфор как хиральный центр, может присутствовать как Rp или Sp, или смеси таких стереоизомеров, включая рацематы. Также могут существовать диастереоизомеры вследствие хирального центра фосфора и хирального атома углерода. В следующем аспекте изобретение относится к соединению формулы I или его фармацевтически приемлемой соли, гидрату или сольвату, для применения в лечении или профилактике (или для изготовления лекарственного средства для лечения или профилактики) инфекции HCV. Типичные генотипыHCV в контексте лечения или профилактики согласно изобретению включают генотип lb (преобладающий в Европе) или 1 а (преобладающий в Северной Америке). Также изобретение относится к способу лечения или профилактики инфекции HCV, в частности, генотипа 1 а или 1b. Соединения формулы I представлены в качестве определенного стереоизомера. Абсолютную конфигурацию таких соединений можно определять с использованием известных в данной области способов, например, таких как рентгенодиффракция или ЯМР и/или по вовлечению исходных материалов с известной стереохимией. Фармацевтические композиции по изобретению предпочтительно содержат, по существу, стереоизомерно чистые препараты указанного стереоизомера. Чистые стереоизомерные формы соединений и промежуточных соединений, упоминаемых в настоящем документе, определяют как изомеры, по существу не содержащие других энантиомерных или диастереомерных форм с той же основной молекулярной структурой указанных соединений или промежуточных соединений. В частности, термин "стереоизомерно чистый" относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток по меньшей мере 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) вплоть до стереоизомерного избытка 100% (т.е. 100% одного изомера и отсутствие других), более конкретно, к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток от 90 до 100%, еще более конкретно, имеющим стереоизомерный избыток от 94 до 100% и особенно имеющим стереоизомерный избыток от 97 до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый" следует понимать сходным образом, но с учетом энантиомерного избытка и диастереомерного избытка, соответственно, рассматриваемой смеси. Чистые стереоизомерные формы соединений и промежуточных соединений по изобретению можно получать с использованием известных в данной области способов. Например, энантиомеры можно отделять друг от друга селективной кристаллизацией их диастереомерных солей с оптически активными кислотами или основаниями. Их примерами являются виннокаменная кислота, дибензоилвиннокаменная кислота, дитолуолвиннокаменная кислота и камфоросульфоновая кислота. Альтернативно энантиомеры можно разделять хроматографическими способами с использованием хиральных стационарных фаз. Ука-4 020244 занные чистые стереохимически изомерные формы также могут происходить из соответствующих чистых стереохимически изомерных форм соответствующих исходных материалов, при условии что реакция протекает стереоспецифично. Предпочтительно, если является желательным конкретный стереоизомер, указанное соединение синтезируют стереоспецифическими способами получения. В этих способах преимущественно используются энантиомерно чистые исходные материалы. Диастереомерные рацематы соединений формулы I можно получать по отдельности общепринятыми способами. Соответствующие способы физического разделения, которые можно преимущественно использовать, представляют собой, например, селективную кристаллизацию и хроматографию, например колоночную хроматографию. Фармацевтически приемлемые аддитивные соли содержат терапевтически активные нетоксичные формы кислотно- и основно-аддитивных солей соединений формулы (I). Интерес представляют свободные, т.е. несолевые, формы соединений формулы I или любой подгруппы соединений формулы I, описанных в настоящем документе. Фармацевтически приемлемые кислотно-аддитивные соли можно удобным образом получать обработкой формы основания соответствующей кислотой. Соответствующие кислоты включают, например,неорганические кислоты, такие как галогенводородные кислоты, например хлористо-водородная или бромисто-водородная кислота, серная, азотная, фосфорная кислоты и т.п.; или органические кислоты,например, такие как уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая(т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная (т.е. гидроксилбутандиовая) , виннокаменная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая кислоты и т.п. Напротив, указанные солевые формы можно превращать обработкой соответствующим основанием в форму свободного основания. Соединения формулы (I), содержащие кислотный протон, также можно превращать в их нетоксичные формы аддитивных солей металлов или аминов обработкой соответствующими органическими и неорганическими основаниями. Соответствующие формы солей оснований включают, например, соли аммония, соли щелочных и щелочноземельных металлов, например, соли лития, натрия, калия, магния,кальция и т.п., соли с органическими основаниями, например соли бензатина, N-метил-D-глюкамина,гидрабамина, и соли с аминокислотами, например, такими как аргинин, лизин и т.п. Термин "сольваты" охватывает любые фармацевтически приемлемые сольваты, которые способны образовывать соединения формулы I, а также их соли. Такие сольваты представляют собой, например,гидраты, алкоголяты, например этаноляты, пропаноляты и т.п. Некоторые из соединений формулы (I) также могут существовать в их таутомерной форме. Например, таутомерными формами амидных (-C(=O)-NH-) групп являются иминоспирты (-С(ОН)=N-), которые могут становиться стабилизированными в кольцах с ароматической структурой. Примером такой формы является уридин. Подразумевают, что такие формы, хотя и не указаны явно в структурных формулах,представленных в настоящем документе, включены в объем настоящего изобретения. Как используют в настоящем документе, "С 1-С 4 алкил" в качестве группы или части группы определяет насыщенные прямые или разветвленные углеводородные радикалы, имеющие от 1 до 4 атомов углерода, например, такие как метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил, 2 метил-2-пропил. "С 1-С 6 алкил" охватывает С 1-С 4 алкильные радикалы и их высшие гомологи, имеющие 5 или 6 атомов углерода, например, такие как 1-пентил, 2-пентил, 3-пентил, 2,2-диметилпропил, 1-гексил,2-гексил, 2-метил-1-бутил, 2-метил-1-пентил, 2-этил-1-бутил, 3-метил-2-пентил и т.п. Среди С 1 С 6 алкилов интерес представляет С 1-С 4 алкил. "C1-С 10 алкил" охватывает С 1-С 6 алкильные радикалы и их высшие гомологи, имеющие 7, 8, 9 или 10 атомов углерода, например, такие как гептил, 2-гептил, 3 гептил, 2-метилгексил, октил, 2-октил, 3-октил, нонил, 2-нонил, 3-нонил, 2-бутилпентил, децил, 2-децил и т.п. Среди С 1-С 10 алкилов представляет интерес C1-С 6 алкил."С 3-С 7 циклоалкил" включает циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Интерес представляет циклопропил, циклопентил и циклогексил. Термин "С 3-6 алкенил" в качестве группы или части группы определяет прямые и разветвленные углеводородные радикалы, имеющие насыщенные углерод-углеродные связи и по меньшей мере одну двойную связь и имеющие от 3 до 6 атомов углерода, например, такие как 1-пропенил, 2-пропенил (или аллил), 1-бутенил, 2-бутенил, 3-бутенил, 2-метил-2-пропенил, 2-пентенил, 3-пентенил, 2-гексенил, 3 гексенил, 4-гексенил, 2-метил-2-бутенил, 2-метил-2-пентенил и т.п. В одном варианте осуществления атом углерода, связывающий С 3-6 алкенильную группу с остальной частью молекулы, является насыщенным. Среди С 3-6 алкенилов интерес представляет С 3-4 алкенил. Среди С 3-6 алкенилов или С 3-4 алкенилов интерес представляют радикалы, имеющие одну двойную связь. Термин "галоген" является общим термином для фтора, хлора, брома и йода. Как используют в настоящем документе, "(=O)" или "оксо" образуют карбонильную группу, когда они связаны с атомом углерода. Следует отметить, что атом может быть замещен оксогруппой только тогда, когда позволяет валентность этого атома. Как используют в настоящем документе, положения радикалов на любой молекулярной группе, используемой в определениях, могут быть любыми в такой группе, при условии, что она является химически стабильной. Когда переменная присутствует более одного раза в какой-либо группе, каждое определение является независимым. Когда их используют в настоящем документе, термин "соединения формулы I" или "соединения по настоящему изобретению" или сходные термины включают соединения формулы I, в том числе возможные стереохимически изомерные формы и их фармацевтически приемлемые соли и сольваты. Также соединения настоящего изобретения могут быть изотопно меченными, где один или несколько атомов заменены изотопом, который отличается от изотопа, обычно встречающегося в природе. Примеры таких изотопов включают изотопы водорода, такие как 2 Н и 3 Н; углерода, такие как 11 С, 13 С и 14 С; азота, такие как 13N и 15N; кислорода, такие как 15O, 17O и 18O; фосфора, такие как 31 Р и 32 Р; серы, такие как 35S; фтора, такие как 18F; хлора, такие как 36Cl; брома, такие как 75Br, 76Br, 77Br и 82Br; и йода, такие как 123I, 124I, 125I и 131I. Изотопно меченные соединения по изобретению можно получать способами,аналогичными способам, описанным в настоящем документе, с использованием подходящих изотопно меченных реагентов или исходных материалов, или известных в данной области способов. Выбор изотопа, включенного в изотопно меченное соединение, зависит от конкретного применения этого соединения. Например, для анализа распределения в тканях включают радиоактивный изотоп, такой как 3 Н или 14 С. Для радиовизуализации пригоден позитронно-эмиссионный изотоп, такой как 11 С, 18F, 13N или 15O. Включение дейтерия может обеспечить увеличенную метаболическую стабильность, приводящую, например, к увеличению времени полужизни соединения in vivo или к снижению потребностей в дозировках. Общие способы синтеза Исходный материал 2'-дезокси-2'-спироциклопропилуридин можно получать, как описано в J. Am,Chem. Soc, 1992, 114, 4007-4008. Соединения формулы I, где R4 представляет собой группу можно получать реакцией этого исходного материала со сложным эфиром фосфорамидохлористой кислоты 1d. Последнюю можно получать реакцией спирта 1 а с POCl3 в присутствии основания, таким образом, получая фосфорилдихлорид 1b, который далее подвергают реакции с аминокислотой 1 с. Соединения формулы I, где R1 представляет собой галоген, можно получать, первоначально превращая промежуточное соединение 1 е в его гидроксизащищенную форму 1f, которую затем галогенируют в 1g, например N-галогенсукцинимидом, например N-йодсукцинимидом, с получением 1h. Пригодные гидроксизащитные группы представляют собой алкилированные силильные группы, в частности,создающие пространственное препятствие алкилированные силильные группы, такие как третбутилдиметилсилильная, триизопропилсилильная или 1,1,3,3-тетраизопропилдисилоксан-1,3-диильная(TIPDS) группа. Эти группы вносят реакцией исходных спиртов с подходящим производным силилхлорида и их можно впоследствии удалять с помощью фторидного соединения, такого как фторид тетрабутиламмония (TBAF), с получением соединений 1h. Эти реакции представлены на следующей схеме, гдеPg представляет собой гидроксизащитную группу, такую как силильные группы, упомянутые выше. В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное против вируса ICV количество соединения формулы I, как указано в настоящем документе, и фармацевтически приемлемый носитель. Терапевтически эффективное количество в этом контексте представляет собой количество, достаточное для профилактического действия против инфекции HCV, для стабилизации или снижения инфекции HCV у инфицированных индивидуумов или индивидуумов, имеющих риск инфицирования. В следующем аспекте это изобретение относится к способу получения фармацевтической композиции, как указано в настоящем документе, который включает смешение в однородную смесь фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы I, как указано в настоящем документе. Таким образом, соединения по настоящему изобретению или их любую подгруппу можно изготавливать в виде различных фармацевтических форм в зависимости от пути введения. В качестве пригодных композиций могут быть указаны все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по этому изобретению эффективное количество конкретного соединения, необязательно в форме аддитивной соли или комплекса с металлом,а также активный ингредиент объединяют в однородную смесь с фармацевтически приемлемым носителем, который может иметь различные формы, в зависимости от желаемой формы препарата для введения. Эти фармацевтические композиции являются желательными в стандартной дозированной лекарственной форме, пригодной, в частности, для введения перорально, ректально, подкожно или путем парентеральной инъекции. Например, при получении композиций в пероральной дозированной форме можно использовать любую из обычных фармацевтических сред, например, таких как вода, гликоли, масла,спирты и т.п. в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, дезинтегрирующие вещества и т.п. в случае порошков, пилюль, капсул и таблеток. Вследствие их простоты введения таблетки и капсулы представляют собой наиболее предпочтительные стандартные дозированные лекарственные формы, в случае которых обычно используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно содержит стерильную воду, по меньшей мере в большей его части, хотя могут быть включены другие ингредиенты, например, для способствования растворимости. Можно приготавливать инъецируемые растворы, например, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также можно получать инъецируемые суспензии, в случае которых можно использовать подходящие жидкие носители, суспендирующие вещества и т.п. Также включены препараты в твердой форме, предназначенные для превращения, непосредственно перед применением, в препараты в жидкой форме. В композициях, пригодных для подкожного введения, носитель необязательно содержит усиливающее проникновение средство и/или пригодное смачивающее вещество, необязательно в сочетании с пригодными добавками любой природы в небольших соотношениях, которые не приводят к значительному вредоносному эффекту на кожу. Соединения по настоящему изобретению также можно вводить путем пероральной ингаляции или инсуфляции в форме раствора, суспензии или сухого порошка с использованием любой известной в данной области системы для доставки. Особенно преимущественным является изготовление указанных выше фармацевтических композиций в стандартной дозированной форме для простоты введения и единообразия дозировки. Стандартная дозированная форма, как используют в настоящем документе, относится к физически дискретным единицам, пригодным в качестве стандартных дозировок, причем каждая единица содержит заданное количество активного ингредиента, вычисленное для обеспечения желаемого терапевтического эффекта, с требуемым фармацевтическим носителем. Примерами таких стандартных дозированных форм являются таблетки (включая шероховатые таблетки или покрытые таблетки), капсулы, пилюли, суппозитории, пакеты с порошком, пластинки, инъецируемые растворы или суспензии и т.п., и их отдельные множества. Соединения формулы I демонстрируют активность против HCV и их можно использовать для лечения и профилактики инфекции HCV или заболеваний, ассоциированных с HCV. Последние включают прогрессирующий фиброз печени, воспаление и некроз, ведущие к циррозу, конечному заболеванию печени, и НСС. Более того, полагают, что ряд соединений по этому изобретению является активным против мутантных штаммов HCV. Кроме того, многие из соединений по этому изобретению демонстрируют благоприятный фармакокинетический профиль и имеют привлекательные свойства с точки зрения биодоступности, включая приемлемые время полужизни, AUC (площадь под кривой) и пиковые значения, и отсутствие неблагоприятных явлений, таких как недостаточно быстрое начало действие и удержание в тканях. Антивирусную активность in vitro соединений формулы I против HCV можно тестировать в клеточной системе с репликоном HCV на основе Lohmann et al. (1999) Science, 285:110-113, дальнейшие модификации которой описаны в Krieger et al. (2001) Journal of Virology 75: 4 614-4624 (включенная в настоящий документ в качестве ссылки), которая далее проиллюстрирована в разделе "Примеры". Эта модель, хотя и не является полной моделью инфекции HCV, широко признана в качестве наиболее надежной и эффективной модели автономной репликации РНК HCV, доступной в настоящее время. Понятно, что является важной возможность отличить соединения, которые специфично препятствуют функциям HCV, от соединений, которые оказывают цитотоксические или цитостатические эффекты, в модели с репликоном HCV, и, следовательно, вызывают снижение РНК HCV или связанной с ним концентрации репортерного фермента. В данной области известны анализы для оценки клеточной цитотоксичности на основе, например, активности митохондриальных ферментов, с использованием флуорогенных окислительно-восстановительных красителей, таких как резазурин. Более того, для оценки неселективного ингибирования активности связанного репортерного гена, такого как ген люциферазы светляка,существуют клеточные обратные скрининги. Пригодные типы клеток могут быть стабильно трансфицированы репортерным геном люциферазы, экспрессия которого зависит от конститутивно активного промотора гена, и такие клетки можно использовать для обратного скрининга в целях устранения неселективных ингибиторов. Вследствие их антивирусных свойств, в частности их свойств против HCV, соединения формулы I,включая любые их возможные стереоизомеры, фармацевтически приемлемые аддитивные соли или сольваты, пригодны для лечения теплокровных животных, в частности людей, инфицированных HCV, и для профилактики инфекций HCV. Таким образом, соединения по настоящему изобретению можно использовать в качестве лекарственных средств, в частности, в качестве лекарственных средств против HCV. Указанное применение в качестве лекарственного средства включает системное введение индивидуумам, инфицированным HCV,или индивидуумам, чувствительным к инфекции HCV, количества, эффективного для борьбы с условиями, ассоциированными с инфекцией HCV. Как правило, предусматривается, что эффективное против вируса суточное количество может составлять от приблизительно 0,01 до приблизительно 700 мг/кг, или от приблизительно 0,5 до приблизительно 400 мг/кг, или от приблизительно 1 до приблизительно 250 мг/кг, или от приблизительно 2 до приблизительно 200 мг/кг, или от приблизительно 10 до приблизительно 150 мг/кг массы тела. Может быть пригодным введение требуемой дозы в качестве двух, трех, четырех или более субдоз через соответствующие интервалы на протяжении суток. Указанные субдозы могут быть изготовлены в виде стандартных дозированных лекарственных форм, например, содержащих от приблизительно 1 до приблизительно 6000 мг, или от приблизительно 50 до приблизительно 5000 мг, или от приблизительно 100 до приблизительно 2000 мг, или от приблизительно 200 до приблизительно 1000 мг, или от приблизительно 100 до приблизительно 600 мг, или от приблизительно 200 до приблизительно 500 мг активного ингредиента на стандартную дозированную форму. Также соединения формулы I, его фармацевтически приемлемой соли или сольвата могут использоваться в комбинации с другим противовирусным соединением, в частности другим соединением противHCV. Термин "комбинация" может относиться к продукту, содержащему (а) соединение формулы I, как указано выше, и (b) необязательно другое соединение против HCV, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при лечении инфекции HCV. Соединения против HCV, которые можно использовать в таких комбинациях, включают ингибиторы полимеразы HCV, ингибиторы протеазы HCV, ингибиторы других мишеней в жизненном цикле HCV и иммуномодулирующие средства и их комбинации. Ингибиторы полимеразы HCV включают NM283BMS790052, примерами циклофилиновых ингибиторов NS5B являются А-831, А-689, NIM-811 и DEBIO025. Ингибиторы других мишеней в жизненном цикле HCV, включая ингибиторы хеликазы NS3; инги-8 020244AVI-4065; siRNA, такие как SIRPLEX-140-N; кодируемая вектором короткая шпилечная РНК (shRNA); ДНКзимы; специфичные к HCV рибозимы, такие как гептазим, RPI.13919; ингибиторы проникновения,такие как НереХ-С, HuMax-НерС; ингибиторы альфа-глюкозидазы, такие как целгосивир, UT-231B и т.п.; КРЕ-02003002 и BIVN 401. Иммуномодулирующие средства включают природные и рекомбинантные соединения изоформ интерферона, включая -интерферон, -интерферон, -интерферон и -интерферон, такие как Intron A,RoferoN-A, CanferoN-А 300, Advaferon, Infergen, Humoferon, Sumiferon MP, Alfaferone, IFNbeta и Feron; соединения производных интерферона с полиэтиленгликолем (пегилированного), такие как PEG интерферон 2 а (Pegasys), PEG интерферон 2b (PEG-Intron), и пегилированный IFN-conl; составы и производные соединений интерферона длительного действия, такие как слитый с альбумином интерферон альбуферон ; соединения, которые стимулируют синтез интерферона в клетках, такие как резиквимод; интерлейкины; соединения, которые усиливают развитие ответа Т-хелперов 1 типа,такие как SCV-07; агонисты TOLL-подобных рецепторов, такие как CpG-10101 (актилон) и исаторибин; тимозин -1; ANA-245; ANA-246; дигидрохлорид гистамина; пропагерманий; тетрахлордекаоксид; амплиген; IMP-321; KRN-7000; антитела, такие как сивасир и XTL-6865; и профилактические и терапевтические вакцины, такие как InnoVac С и HCV E1E2/MF59. Другие противовирусные средства включают рибавирин, амантадин, вирамидин, нитазоксанид; телбувидин; NOV-205; тарибавирин; ингибиторы внутренней посадки рибосом; ингибиторы вирусов широкого спектра, такие как ингибиторы IMPDH, и микофеноловая кислота и ее производные, и включая, но не ограничиваясь ими, VX-497 (меримеподиб), VX-148 и/или VX-944); или комбинации любых из указанных выше. Конкретные средства для применения в указанных комбинациях включают интерферон- (IFN-),пегилированный интерферон- или рибавирин, а также лекарственные средства на основе антител, направленных против эпитопов HCV, малых интерферирующих РНК (siRNA), рибозимов, ДНКзимов, антисмысловых РНК, низкомолекулярных антагонистов, например, протеазы NS3, хеликазы NS3 и полимеразы NS5B. Соединения формулы I могут использоваться с соединениями против ВИЧ. Последние предпочтительно представляют собой ингибиторы ВИЧ, которые оказывают положительный эффект на метаболизм лекарственных средств, и/или фармакокинетику, которая повышает биодоступность. Примером такого ингибитора ВИЧ является ритонавир. По существу, это изобретение, кроме того, относится к комбинации, содержащей (а) соединение формулы I или его фармацевтически приемлемую соль или сольват; и(b) ритонавир или его фармацевтически приемлемую соль. Соединение ритонавир, его фармацевтически приемлемые соли, и способы его получения описаны в WO 94/14436. Комбинация может быть получена путем смешивания соединения формулы I, как указано выше, и другого средства, такого как противовирусное средство, включая средство против HCV или средство против ВИЧ, в частности, средства, упомянутые выше. Указанные комбинации могут быть применимы для изготовления лекарственного средства для лечения инфекции HCV у млекопитающего, инфицированного ими, причем указанная комбинация, в частности, содержит соединение формулы I, как описано выше, и интерферон- (IFN-), пегилированный интерферон- или рибавирин. В ином случае изобретение относится к способу лечения млекопитающего, в частности человека, инфицированного HCV, включающему введение указанному млекопитающему эффективного количества комбинации, указанной в настоящем документе. В частности, указанное лечение включает системное введение указанной комбинации, и эффективное количество представляет собой такое количество, которое является эффективным в отношении лечения клинических состояний, ассоциированных с инфекцией HCV. Такие комбинации изготавливают в форме фармацевтической композиции, которая включает активные ингредиенты, описанные выше, и носитель, как описано выше. Каждый из активных ингредиентов может быть изготовлен по отдельности, и составы можно вводить совместно, или может быть предоставлен один состав, содержащий оба из них, и, если желательно, дополнительные активные ингредиенты. В первом случае комбинации также можно вводить в качестве комбинированного препарата для одновременного, раздельного или последовательно применения в терапии HCV. Указанная композиция может иметь любые формы, описанные выше. В одном варианте оба ингредиента изготавливают в одной дозированной лекарственной форме, такой как фиксированная комбинация дозировок. Фармацевтическая композиция может содержать:(а) терапевтически эффективное количество соединения формулы I, включая его возможную стереоизомерную форму, или его фармацевтически приемлемую соль, или его фармацевтически приемлемый сольват, и (b) терапевтически эффективное количество ритонавира или его фармацевтически приемлемой соли, и(с) носитель. Отдельные компоненты комбинаций можно вводить по отдельности в различное время в ходе тера-9 020244 пии или одновременно в разделенных или единых комбинированных формах. Подразумевают, что настоящее изобретение охватывает все такие режимы одновременного или чередующегося введения, и термин "введение" следует интерпретировать соответствующим образом. В предпочтительном варианте осуществления отдельные дозированные лекарственные формы вводят одновременно. Комбинации могут содержать количество ритонавира или его фармацевтически приемлемой соли,которое достаточно для клинического повышения биодоступности соединения формулы I относительно биодоступности, когда указанное соединение формулы I вводят отдельно. В ином случае комбинации могут содержат количество ритонавира или его фармацевтически приемлемой соли, которое является достаточным для повышения по меньшей мере одной фармакокинетической переменной соединения формулы I, выбранной из t1/2, Cmin, Cmax, Css, AUC через 12 ч или AUC через 24 ч, относительно указанной по меньшей мере одной фармакокинетической переменной, когда соединение формулы I вводят отдельно. Комбинации можно вводить человеку в диапазонах дозировок, конкретных для каждого компонента, содержащегося в указанных комбинациях, например соединение формулы I, как указано выше, и ритонавир или его фармацевтически приемлемая соль, могут иметь уровни дозировок в диапазоне от 0,02 до 10,0 г/сутки. Соотношение масс соединения формулы I и ритонавира может находиться в диапазоне от приблизительно 30:1 до приблизительно 1:15, или от приблизительно 15:1 до приблизительно 1:10, или от приблизительно 15:1 до приблизительно 1:1, или от приблизительно 10:1 до приблизительно 1:1, или от приблизительно 8:1 до приблизительно 1:1, или от приблизительно 5:1 до приблизительно 1:1, или от приблизительно 3:1 до приблизительно 1:1, или от приблизительно 2:1 до 1:1. Соединение формулы I и ритонавир можно вводить совместно один раз или два раза в сутки, предпочтительно перорально, где количество соединения формулы I на дозу является таким, как описано выше; и количество ритонавира на дозу составляет от 1 до приблизительно 2500 мг, или от приблизительно 50 до приблизительно 1500 мг,или от приблизительно 100 до приблизительно 800 мг, или от приблизительно 100 до приблизительно 400 мг, или от 40 до приблизительно 100 мг ритонавира. Примеры Подразумевают, что представленные ниже примеры иллюстрируют изобретение, и их не следует истолковывать как ограничение его объема. В каждом случае приведены время удержания (Rt (мин и наблюдаемое m/z. Когда при LC-MS наблюдают разделение двух диастереомеров, указаны два значения времени удержания. Когда в соединении не указан стереохимический индикатор для атома фосфора, это соединение представляет собой смесь 1:1 двух диастереомеров по фосфору. В некоторых случаях эта смесь была разделена, но не зная точной стереохимической конфигурации. Такие соединения были обозначены как А и В, и они могут быть охарактеризованы по их физико-химическим свойствам. Пример 1. Синтез соединения (1) К 1-нафтолу (1,0 экв., 69,4 ммоль, 10,0 г) в диэтиловом эфире (250 мл) добавляли оксихлорид фосфора (1,0 экв., 69,4 ммоль, 6,5 мл) и раствор охлаждали до -78 С. Добавляли сухой N,Nдиизопропилэтиламин (DIPEA; 1,0 экв., 69,4 ммоль, 12,1 мл) и полученный раствор оставляли нагреваться до комнатной температуры в течение ночи. Белую суспензию фильтровали в инертной атмосфере и все летучие соединения удаляли с получением А в виде бесцветной жидкости, которую использовали без дальнейшей очистки на следующей стадии. Раствор А (1,0 экв., 4,6 ммоль, 1,0 г) и гидрохлорид бензилового сложного эфира 2- 10020244 аминопропионовой кислоты (1,0 экв., 4,6 ммоль, 1,2 г) в CH2Cl2 (40 мл) охлаждали до -80 С. По каплям добавляли сухой DIPEA (2,0 экв., 9,3 ммоль, 1,6 мл). Через 1 ч реакционную смесь нагревали до комнатной температуры. Перемешивание продолжали в течение 1 дополнительного часа и растворитель удаляли при пониженном давлении. Добавляли сухой диэтиловый эфир и осадок отфильтровывали и промывали два раза сухим диэтиловым эфиром в атмосфере аргона. Фильтрат выпаривали досуха с получением соединения В, которое хранили в виде 0,97 М раствора в тетрагидрофуране (THF) при -18 С. К раствору С (1,0 экв., 0,59 ммоль, 150 мг) в сухом THF (6 мл) добавляли трет-бутил MgCl (1,5 экв.,0,89 ммоль, 521 мкл, 1,7 М раствор в THF) при комнатной температуре. По каплям добавляли раствор В(1,4 экв., 0,83 ммоль, 852 мкл, 0,97 М раствор в THF) и смесь перемешивали при комнатной температуре в течение 2,5 ч. Добавляли тридцать капель насыщенного водного раствора NH4Cl и реакционную смесь выпаривали на диоксиде кремния, затем очищали колоночной хроматографией (0-5% метанол в CH2Cl2) с получением 1 (74 мг, выход=19%, чистота=96%) в качестве смеси диастереомеров. 1 Н ЯМР (400 МГц, ДМСО-d6)(м.д.): 0,39-0,61 (м, 3 Н); 1,01-1,12 (м, 1 Н); 1,18-1,33 (м, 3 Н); 3,884,09 (м, 3 Н); 4,16-4,31 (м, 1 Н); 4,31-4,42 (м, 1 Н); 4,96-5,16 (м, 2 Н); 5,35-5,49 (м, 2 Н); 5,95 (с, 1 Н); 6,25-6,37 К раствору (D) (1,44 г, 2,9 ммоль) в сухом DMF (30 мл) добавляли при комнатной температуре Nйодсукцинимид (1,63 г, 7,25 ммоль, 2,5 экв.). Реакционную смесь нагревали до 110 С и перемешивали при этой температуре в течение ночи. После охлаждения до комнатной температуры реакцию гасили добавлением 7,5% мас./об. раствора NaHSO3 в насыщенном растворе NaHCO3. Смесь далее разбавляли насыщенным раствором NaHCO3 (250 мл) и экстрагировали этилацетатом (3200 мл). Объединенные органические слои сушили (Na2SO4) , фильтровали и концентрировали с получением желтого масла. Очистка колоночной хроматографией (гептан/этилацетат, градиент от 10 до 30%) дала (Е) в виде белого твердого вещества (1,44 г, 80%). 1 Н ЯМР (400 МГц, ДМСО-d6)(м.д.): 0,54 (дт, J=10,05, 5,12 Гц, 1 Н); 0,62-0,70 (м, 1 Н); 0,76 (дт,J=10,05, 5,12 Гц, 1 Н); 0,87-1,14 (м, 2 9 Н); 3,74-3,82 (м, 1 Н); 3,96 (дд, J=12,88, 2,34 Гц, 1 Н); 4,09 (дд,J=12,88, 3,90 Гц, 1 Н); 4,53 (д, J=7,80 Гц, 1 Н); 5,73 (с, 1 Н); 7,89 (с, 1 Н); 11,73 (с, 1 Н). LC-MS: Rt=8,94 мин,m/z=645 (M+Na)+. К суспензии (Е) (1,24 г, 1,99 ммоль) в метаноле (20 мл) добавляли при комнатной температуре фторид аммония (369 мг, 5 экв.). Реакционную смесь нагревали до 50 С в атмосфере аргона и перемешивали в течение 7 ч. После концентрирования смеси полученный осадок очищали колоночной хроматографией(дихлорметан/метанол, градиент от 2,5 до 10%). Это привело к (F) в виде белого твердого вещества (711 мг, 92%). 1 Н ЯМР (400 МГц, ДМСО-d6)(м.д.): 0,50-0,65 (м, 3 Н); 1,05 (т, J=5,95 Гц, 1 Н); 3,56-3,67 (м,1 Н); 3,70-3,80 (м, 2 Н); 4,05-4,15 (м, 1 Н); 5,13-5,27 (м, 2 Н); 5,85 (с, 1 Н) ; 8,44 (с, 1 Н); 11,65 (ушир.с, 1 Н). Соединение (F) (120 мг, 0,316 ммоль), предварительно высушенное совместным выпариванием с пиридином, растворяли в N-метилимидазоле (0,3 мл, 3,79 ммоль, 12 экв.) и добавляли сухой дихлорметан(3,2 мл) при комнатной температуре в атмосфере аргона и 1 М раствор соответствующего фосфорамидохлоридата (1,2 экв.). Реакционную смесь перемешивали в течение 3 ч. Если требовалось, добавляли дополнительный реагент. После полного израсходования исходного материала реакционную смесь разбавляли дихлорметаном и промывали 0,5 М водным раствором НС 1. Водный слой экстрагировали дихлорметаном и объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали. Осадок очищали колоночной хроматографией (дихлорметан/метанол, градиент от 1 до 10%) с получением продуктов 36-39 в виде белых твердых веществ (выход 68-77%).LC-MS: Rt=4,24 мин, m/z=653 (M+ NH4)+. Соединение (38). 1 Н ЯМР (400 МГц, ДМСО-d6)(м.д.): 0,49-0,63 (м, 3 Н) ; 1,02-1,10 (м, 1 Н); 1,15 (д, J=5,07 Гц, 6 Н); 1,18-1,25 (м, 3 Н); 3,70-3,84 (м, 1 Н); 3,86-3,97 (м, 1 Н); 4,02-4,10 (м, 1 Н); 4,12-4,34 (м, 2 Н); 4,78-4,90 (м,1 Н); 5,29-5,40 (м, 1 Н); 5,85-5,91 (м, 1 Н); 5,91-5,99 (м, 1 Н); 7,12-7,24 (м, 3 Н); 7,31-7,40 (м, 2 Н); 7,93 (с,1 Н); 11,70 (ушир.с, 1 Н). LC-MS: Rt=4,74 мин, m/z=667 (M+NH4)+. Биологические примеры Анализ с репликоном. Соединения формулы I исследовали в отношении активности ингибирования репликации РНКHCV, также известной как репликон HCV, в клеточном анализе, нацеленном на идентификацию соединений, которые ингибируют клеточную линию, функциональную в отношении репликации HCV. Клеточный анализ был основан на бицистронной экспрессирующей конструкции, как описано Lohmann et al.(1999), Science vol. 285 pp. 110-113 с модификациями, описанными Krieger et al. (2001), Journal of Virology 75: 4614-4 624, в стратегии скрининга с множеством мишеней. В анализе использовали стабильно трансфицированную клеточную линию Huh-7 luc/neo (в дальнейшем в настоящем документе обозначаемую как Huh-Luc). Эта клеточная линия содержит РНК, кодирующую бицистронную экспрессирующую конструкцию, содержащую области NS3-NS5B HCV типа lb дикого типа, транслированные с участка внутренней посадки рибосомы (IRES) из вируса энцефаломиокардита (EMCV), перед которым находится репортерная часть (FfL-люцифераза) и часть селективного маркера (neoR, неомицинфосфотрансфераза). Конструкция ограничена 5'- и 3'-NTR (нетранслируемые области) из HCV типа lb. Целостность культуры клеток с репликоном в присутствии G418 (neoR) зависит от репликации HCV РНК. Для скрининга противовирусных соединений использовали стабильно трансфицированные клетки с репликоном,которые экспрессируют РНК HCV, которая реплицируется автономно и на высоких уровнях, кодирующую, помимо прочего, люциферазу. Клетки с репликоном высевали в 384-луночные планшеты в присутствии тестируемых и контрольных соединений, которые добавляли в различных концентрациях. После инкубации в течение трех суток измеряли репликацию HCV путем анализа активности люциферазы (с использованием стандартных субстратов и реагентов анализа люциферазы и устройства для визуализации микропланшетов Perkin ElmerViewLux ultraHTS). Клетки с репликоном в контрольных культурах обладают высокой экспрессией люциферазы в отсутствие какого-либо ингибитора. Мониторинг ингибиторной активности соединений в отношении активности люциферазы проводили на клетках Huh-Luc, получая кривую доза-эффект для каждого тестируемого соединения. Затем вычисляли величины ЕС 50, которые соответствуют количеству соединения, требуемому для снижения уровня выявленной активности люциферазы на 50%, или, более конкретно, способности генетически связанной РНК репликона HCV реплицироваться. Клеточная токсичность Клеточную токсичность определяли в анализе с репликоном Huh7-CMV-Luc. Клетки с репликоном(2500 клеток/лунка), стабильно трансформированные репортерным геном люциферазы под контролем конститутивного промотора цитомегалогенвируса (CMV), культивировали в присутствии или отсутствие тестируемого соединения в различных концентрациях. После инкубации в течение трех суток при 37 С в увлажненной атмосфере с 5% CO2 количественно определяли пролиферацию клеток путем измерения активности Luc и выражали в качестве значения CC50 (цитотоксичность, 50% ингибиторная концентрация роста клеток). Тесты проводили в 384-луночных планшетах. Анализ с ВИЧ Соединения по изобретению тестировали в отношении их эффективности против вируса иммунодефицита человека (ВИЧ) дикого типа. Противовирусную активность оценивали с использованием кле 1 точного анализа, проведенного согласно следующей процедуре. Конструировали линию Т-клеток человека МТ 4 с зеленым флуоресцентным белком (GFP) и ВИЧ-специфичным промотором и длинным концевым повтором ВИЧ-1(LTR). Эту клеточную линию, обозначенную как МТ 4 LTR-EGFP, можно использовать для оценки in vitro активности исследуемых соединений против ВИЧ. В клетках, инфицированных ВИЧ-1, продуцируется белок Tat, который активирует промотор LTR, и, в конечном итоге, приводит к стимуляции продукции репортера GFP, позволяя измерить существующую ВИЧ-инфекцию флуориметрически. Можно определить величины эффективной концентрации, такие как 50% эффективная концентрация (ЕС 50), и обычно их выражают в мкМ. Величину ЕС 50 определяют как концентрацию тестируемого соединения, которая снижает флуоресценцию ВИЧ-инфицированных клеток на 50%. Мониторинг инфекции ВИЧ-1 проводили с использованием сканирующего микроскопа. Анализ изображения позволяет высокочувствительную детекцию вирусной инфекции. Измерения проводили до некроза клеток, который обычно происходит через пять суток, после инфицирования, в частности, измерения проводили через трое суток после инфицирования. В колонке IIIB таблицы приведены величины ЕС 50 против штамма IIIB дикого типа. Результаты, приведенные в табл. 1, иллюстрируют, что соединения по настоящему изобретению демонстрируют активность против HCV, хотя и лишены активности против ВИЧ. Они демонстрируют благоприятные результаты с точки зрения токсичности и имеют приемлемый индекс селективности (соотношение между ЕС 50 и СС 50). Результаты В таблице представлены результаты анализа с репликоном (ЕС 50, репликон) и результаты цитотоксичности (СС 50 (мкМ) (Huh-7, полученные для соединений согласно примерам, приведенным выше. Также приведена активность против ВИЧ (ЕС 50 ВИЧ (мкМ и клеточная токсичность в клеточной линии с ВИЧ (СС 50 (мкМ) (МТ-4. Таблица"-" означает, что результат теста не доступен ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) включая все его возможные стереоизомеры, гдеR1 представляет собой водород или галоген;R4 представляет собой группу формулыR7 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из галогена, С 1-С 6 алкила, С 3-С 6 алкенила, С 1-С 6 алкокси, С 1 С 6 алкоксикарбонила, гидрокси и амино; или R7 представляет собой нафтил; или R7 представляет собой индолил или N-С 1-С 6 алкилоксикарбонилиндолил;R9 представляет собой С 1-С 10 алкил, С 3-С 6 алкенил, С 3-С 7 циклоалкил, бензил; или его фармацевтически приемлемые соль или сольват. 2. Соединение по п.1, где R7 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из галогена, С 1-С 6 алкила, С 3-С 6 алкенила и С 1 С 6 алкокси, или R7 представляет собой нафтил. 3. Соединение по п.1, где R7 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из галогена и С 1-С 6 алкила. 4. Соединение по п.1, где R7 представляет собой фенил, необязательно замещенный галогеном или С 1-С 6 алкилом, или R7 представляет собой нафтил. 5. Соединение по любому из пп.1-4, где R8 представляет собой водород и R8' представляет собой водород или С 1-С 6 алкил. 6. Соединение по любому из пп.1-4, где группа где R8 представляет собой водород и R8' представляет собой С 1-С 6 алкил, бензил. 7. Соединение по п.6, где R8 представляет собой водород и R8' представляет собой С 1-С 2 алкил. 8. Соединение по п.6, где R8 представляет собой водород и R8' представляет собой метил. 9. Соединение по п.1, где R9 представляет собой С 1-С 8 алкил или бензил. 10. Соединение по п.1, где R9 представляет собой метил, этил, изопропил, 1-метилпропил, изобутил,бутил, трет-бутил, бензил, циклопентил, 5-гексенил, 2,2-диметилбутил, октил или 2-пропилпентил. 11. Соединение по п.10, где R9 представляет собой этил, изобутил, бутил, бензил, циклопентил, 5 гексенил, 2,2-диметилбутил или 2-пропилпентил. 12. Фармацевтическая композиция, содержащая эффективное против вируса HCV количество со- 21020244 единения формулы (I), как определено в любом из пп.1-11, и фармацевтически приемлемый носитель. 13. Применение соединения по любому из пп.1-11 в качестве ингибитора HCV.
МПК / Метки
МПК: C07H 19/10, A61P 31/14, A61K 31/7072
Метки: урацильные, циклопропилнуклеотиды
Код ссылки
<a href="https://eas.patents.su/23-20244-uracilnye-ciklopropilnukleotidy.html" rel="bookmark" title="База патентов Евразийского Союза">Урацильные циклопропилнуклеотиды</a>
Предыдущий патент: Спироэпоксиды как промежуточные продукты синтеза
Следующий патент: Низколегированная сталь с высоким пределом текучести и высокой стойкостью к сульфидному растрескиванию под напряжением
Случайный патент: Колпачок для заполненных медицинскими жидкостями емкостей







