Тиазолпиразолопиримидин в качестве антагониста рецептора крф1
Номер патента: 15179
Опубликовано: 30.06.2011
Авторы: Хембр Эрик Джеймс, Амдоучи Чафик Амдоучи, Майерс Джейсон Кеннет, Хипскинд Филип Артур, Такакува Такако, Чэнь Чжаогэнь, Тот Джеймс Ли
Формула / Реферат
1. Соединение формулы I
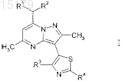
где R1и R2 представляют собой независимо этил или н-пропил;
R3 представляет собой водород, Cl, Br, метил, трифторметил или метокси;
R4 представляет собой водород, Br, RaRbN-, метоксиметил, н-бутил, ацетамидо, пиридин-4-ил, морфолин-4-ил, 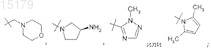
Ra и Rb представляют собой независимо водород, C1-C3-алкил, H2NCH2CH2-, (CH3)3COC(O)NHCH2CH2- или CH3CH2CH2NHCH2CH2-;
или фармацевтически приемлемая соль указанного соединения.
2. Соединение по п.1 или его фармацевтически приемлемая соль, отличающееся тем, что R3 представляет собой Cl, Br, метил или трифторметил.
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R3 представляет собой Cl или Br.
4. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, отличающееся тем, что R4представляет собой RaRbN-, пиридин-4-ил, морфолин-4-ил или ![]()
5. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, отличающееся тем, что R4представляет собой морфолин-4-ил или ![]()
6. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, отличающееся тем, что R4представляет собой RaRbN-, а Ra и Rb представляют собой независимо C1-C3-алкил.
7. Соединение по п.1 или его фармацевтически приемлемая соль, представляющее собой 3-[4-бром-2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил]-2,5-диметил-7-(1-пропилбутил)пиразоло[1,5-a]пиримидин.
8. Соединение по п.1 или его фармацевтически приемлемая соль, представляющее собой 3-(4-бром-2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин.
9. Соединение по п.1 или его фармацевтически приемлемая соль, представляющее собой 3-(4-хлор-2-морфолин-4-илтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин.
10. Фармацевтическая композиция, содержащая соединение по любому из пп.1-9 или его фармацевтически приемлемую соль и фармацевтически приемлемый наполнитель.
11. Применение соединения по любому из пп.1-9 или его фармацевтически приемлемой соли в терапии.
12. Применение соединения по любому из пп.1-9 или его фармацевтически приемлемой соли для лечения тревожности или депрессии.
13. Применение соединения по любому из пп.1-9 или его фармацевтически приемлемой соли для лечения злоупотребления алкоголем или психоактивными веществами.
Текст
ТИАЗОЛПИРАЗОЛОПИРИМИДИН В КАЧЕСТВЕ АНТАГОНИСТА РЕЦЕПТОРА КРФ 1 Настоящее изобретение относится к соединениям формулы I фармацевтическим композициям на основе указанных соединений и применению указанных соединений в качестве антагонистов рецепторов 1 типа кортикотропин-рилизинг-фактора (КРФ 1) для лечения психических и нейроэндокринных нарушений, заболеваний нервной системы и метаболического синдрома. Чэнь Чжаогэнь, Амдоучи Чафик Амдоучи,Хембр Эрик Джеймс, Хипскинд Филип Артур, Майерс Джейсон Кеннет, Такакува Такако, Тот Джеймс Ли (US)(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 015179 Область изобретения Настоящее изобретение относится к новым соединениям на основе тиазолпиразолопиримидина,фармацевтическим композициям на основе указанных соединений и применению указанных соединений в качестве антагонистов рецепторов 1 типа кортикотропин-рилизинг-фактора (КРФ 1) для лечения психических и нейроэндокринных нарушений, заболеваний нервной системы и метаболического синдрома. Уровень техники Кортикотропин-рилизинг-фактор (КРФ) представляет собой пептид, содержащий остатки 41 аминокислоты, являющийся основным физиологическим регулятором секреции пептида, образующегося из проопиомеланокортина (ПОМК) из передней доли гипофиза. С помощью иммуногистохимической локализации КРФ было показано, что указанный гормон не только участвует в эндокринных процессах в гипофизе, но также широко распространен вне гипоталамической области, в центральной нервной системе и обусловливает целый ряд вегетативных, электрофизиологических и поведенческих эффектов, выступая в качестве нейтромедиатора или нейромодулятора на участках мозга. Также имеются доказательства того, что КРФ играет важную роль в формировании совокупного ответа иммунной системы на физиологические, психологические и иммунологические стресс-факторы. КРФ связывают с психическими нарушениями и заболеваниями нервной системы, включая депрессию, тревожность, а также следующие заболевания и состояния: болезнь Альцгеймера, болезнь Хантингтона, синдром прогрессирующего супрануклеарного паралича, боковой амиотрофический склероз, болезнь Паркинсона, эпилепсию, мигрень, злоупотребление алкоголем и психоактивными веществами и связанный с ними абстинентный синдром, ожирение, метаболический синдром, врожденную гиперплазию надпочечников, болезнь Кушинга, гипертонию, инсульт, синдром раздраженного кишечника, стрессиндуцированную язву желудка, предменструальный синдром, сексуальную дисфункцию, преждевременные роды, воспалительные нарушения, аллергии, рассеянный склероз, висцеральную боль, нарушения сна, опухоли гипофиза или эктопические опухоли гипофизарной природы, синдром хронической усталости и фибромиалгию. Были идентифицированы подтипы КРФ-рецепторов, КРФ 1 и КРФ 2, которые распространены в мозгу неоднородно, что позволяет предположить потенциальное разнообразие функций у данного вида рецепторов. Например, широко распространенные КРФ 1-рецепторы мозга тесно связаны с эмоциональной реакцией на воздействие внешних стресс-факторов. Представляется важным, что КРФ 1-, но не КРФ 2 рецепторы, как полагают, опосредуют некоторые виды анксиогенных эффектов. В то же время более дискретный характер распределения КРФ 2-рецепторов в септальной/гипоталамической области и наличие альтернативных эндогенных лигандов позволяют предположить, что КРФ 2-рецептор выполняет иную функциональную роль. Так, сообщалось о новом нейропептиде КРФ-семейства, обладающем преимущественным сродством к КРФ 2-рецепторам по сравнению с КРФ 1-рецепторами, который способен подавлять аппетит, не вызывая при этом характерных поведенческих эффектов, наблюдаемых при селективном агонизме КРФ 1. В других случаях агонизм КРФ 2 обусловливает эффекты, аналогичные тем, что наблюдали для антагонистов КРФ 1 или при делеции гена КРФ 1. Например, агонисты КРФ 2 были предложены для применения в качестве агентов для лечения ожирения; в то же время антагонисты КРФ 1 также могут играть важную роль при лечении ожирения. Некоторые пирроло[2,3-d]пиримидины, пирроло[3,2-d]пиримидины, пиразоло[1,5-a]пиримидины,1,2,3-триазоло[4,5-b]пиридины и пиразоло[1,5-a]-1,3,5-триазины, подходящие для применения в качестве антагонистов КРФ, предложены в WO 94/13676, WO 97/29109, WO 98/08847 и WO 98/03510. В настоящем изобретении предложены новые тиазолпиразолопиримидины, подходящие для применения в качестве антагонистов рецептора КРФ 1. С учетом вышесказанного в настоящее время существует потребность в новых эффективных и селективных антагонистах КРФ 1, которые представляют потенциальный интерес в качестве терапевтических агентов для лечения психических и нейроэндокринных нарушений, заболеваний нервной системы и метаболического синдрома. Кроме того, поскольку большинство представленных на рынке лекарственных препаратов для лечения заболеваний ЦНС и сердечнососудистой системы характеризуются недостаточно высокой биодоступностью и фармакокинетическими показателями, также существует потребность в новых соединениях, обладающих улучшенной биодоступностью и фармакокинетическими показателями по сравнению с известными антагонистами КРФ, такими как CP154526 и NBI30775.-1 015179 Краткое описание изобретения Согласно одному из вариантов реализации в настоящем изобретении предложено соединение формулы I где R1 и R2 представляют собой независимо этил или н-пропил;Rb представляют собой независимо водород,C1-C3-алкил,H2NCH2CH2-,(CH3)3COC(O)NHCH2CH2- или CH3CH2CH2NHCH2CH2-; или фармацевтически приемлемая соль указанного соединения. Согласно другому варианту реализации в настоящем изобретении предложена фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый наполнитель. Согласно еще одному варианту реализации настоящее изобретение относится к способу лечения депрессии, тревожности, злоупотребления алкоголем или психоактивными веществами, ожирения, гипертонии, метаболического синдрома, синдрома раздраженного кишечника, эпилепсии, инсульта, нарушений сна, аллергии, мигрени, предменструального синдрома, бесплодия, сексуальной дисфункции,врожденной гиперплазии надпочечников, болезни Кушинга, преждевременных родов, стрессиндуцированной язвы желудка, воспалительных нарушений, опухолей гипофиза или эктопических опухолей гипофизарной природы, синдрома хронической усталости, фибромиалгии, висцеральной боли или рассеянного склероза у пациента, включающему введение пациенту, который в этом нуждается, терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения. Согласно другому варианту реализации настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли для получения лекарственного препарата для лечения депрессии, тревожности, злоупотребления алкоголем или психоактивными веществами, ожирения, гипертонии, метаболического синдрома, синдрома раздраженного кишечника, эпилепсии, инсульта,нарушений сна, аллергии, мигрени, предменструального синдрома, бесплодия, сексуальной дисфункции,врожденной гиперплазии надпочечников, болезни Кушинга, преждевременных родов, стрессиндуцированной язвы желудка, воспалительных нарушений, опухолей гипофиза или эктопических опухолей гипофизарной природы, синдрома хронической усталости, фибромиалгии, висцеральной боли или рассеянного склероза. Согласно следующему варианту реализации настоящее изобретение относится к соединению формулы I или его фармацевтически приемлемой соли, подходящему для применения для лечения депрессии,тревожности, злоупотребления алкоголем или психоактивными веществами, ожирения, гипертонии, метаболического синдрома, синдрома раздраженного кишечника, эпилепсии, инсульта, нарушений сна, аллергии, мигрени, предменструального синдрома, бесплодия, сексуальной дисфункции, врожденной гиперплазии надпочечников, болезни Кушинга, преждевременных родов, стресс-индуцированной язвы желудка,воспалительных нарушений, опухолей гипофиза или эктопических опухолей гипофизарной природы, синдрома хронической усталости, фибромиалгии, висцеральной боли или рассеянного склероза. Согласно другому варианту реализации настоящее изобретение относится к соединению формулы I или его фармацевтически приемлемой соли, подходящему для применения в терапевтических целях. Подробное описание изобретения Используемые в настоящем описании термины, если не указано иное, имеют следующие значения."Алкил" означает насыщенную алифатическую углеводородную группу, которая может быть линейной или разветвленной и содержит от 1 до 5 атомов углерода в цепи."Фармацевтически приемлемый наполнитель" относится к используемому в составах фармацевтически приемлемому носителю, раствору или добавке, применяемой для улучшения характеристик состава. Указанные наполнители должны быть совместимы с другими компонентами состава и не оказывать негативного воздействия на реципиента; такие наполнители хорошо известны специалисту в данной области техники (см., например, Remingtons Pharmaceutical Sciences, 19th Edition, Mack Publishing Company, 1995). Термин "фармацевтически приемлемые соли" относится к сравнительно нетоксичным солям соеди-2 015179 нений согласно настоящему изобретению, представляющим собой соли присоединения неорганических и органических кислот и соли присоединения щелочей. Указанные соли могут быть получены in situ на завершающей стадии выделения и очистки соединений согласно изобретению. В частности, соли присоединения кислот могут быть получены путем раздельного проведения реакции очищенного соединения в форме свободного основания с подходящей органической или неорганической кислотой и выделения полученной соли (см., например, Remingtons Pharmaceutical Sciences, 19th Edition, Mack Publishing"Терапевтически эффективное количество" или "эффективное количество" означает количество соединения формулы I согласно настоящему изобретению или фармацевтической композиции, содержащей соединение формулы I согласно настоящему изобретению, обеспечивающее биологический или терапевтический ответ или требуемое терапевтическое воздействие на ткань, систему, животное или человека,ожидаемое исследователем, ветеринаром, врачом или другим специалистом. Термины "лечение", "лечить", "лечащий" и др. включают как замедление, так и обращение прогрессирования нарушения. Указанные термины также включают облегчение, смягчение, ослабление, устранение или уменьшение одного или нескольких симптомов нарушения или состояния, даже если указанное нарушение или состояние фактически не устраняется или прогрессирование указанного нарушения или состояния как таковое не замедляется или не обращается. Термин "лечение" и другие подобные термины также включают предупредительное (например, профилактическое) и паллиативное лечение. Предупреждение заболевания проявляется в виде замедления или отсрочки появления симптомов заболевания. Символ в структурной формуле молекулы указывает на место присоединения данного конкретного заместителя. В случае когда любой из переменных параметров встречается в составе любого из фрагментов или в формуле I более одного раза, значение такого параметра в каждом случае определяется независимо. Далее, комбинации заместителей и/или переменных параметров допускаются только в случае, если такие комбинации приводят к образованию стабильных соединений. Для специалиста в данной области техники очевидно, что при выборе соединений согласно настоящему изобретению выбор различных заместителей, т.е. R1, R2 и др., должен осуществляться в соответствии с хорошо известными принципами построения химической структуры. В рамках используемой в настоящем описании стандартной номенклатуры в первую очередь указывают терминальную часть обозначенной боковой цепи с последующим перечислением расположенных рядом функциональных групп в направлении места присоединения заместителя. Например, заместитель арилкарбониламиноалкил равнозначен заместителю арил-C(O)-NH-алкил-. Настоящее изобретение включает следующие варианты реализации, которые альтернативным образом могут дополнительно комбинироваться между собой:(и) соединение формулы I, где Ra и Rb представляют собой независимо C1-C3-алкил;(т) применение соединения формулы I или его фармацевтически приемлемой соли для лечения депрессии или тревожности;(у) применение соединения формулы I или его фармацевтически приемлемой соли для лечения злоупотребления алкоголем или психоактивными веществами;(ф) применение соединения формулы I или его фармацевтически приемлемой соли для лечения злоупотребления алкоголем и связанного с ним абстинентного синдрома;(х) соединение формулы I или его фармацевтически приемлемая соль, характеризующееся в отношении связывания КРФ 1 значением Ki500 нМ;(ц) соединение формулы I или его фармацевтически приемлемая соль, характеризующееся в отношении связывания КРФ 1 значением Ki50 нМ;(ч) соединение формулы I или его фармацевтически приемлемая соль, характеризующееся в отношении связывания КРФ 1 значением Ki5 нМ;(ш) соединение формулы I или его фармацевтически приемлемая соль, характеризующееся в отношении связывания КРФ 1 значением Ki500 нМ и проявляющее избирательное связывание с КРФ 1 (т.е. меньшие значения Ki) по сравнению с КРФ 2;(щ) соединение формулы I или его фармацевтически приемлемая соль, характеризующееся в отношении связывания КРФ 1 значением Ki50 нМ и проявляющее избирательное связывание с КРФ 1 (т.е. меньшие значения Ki) по сравнению с КРФ 2;(ы) соединение формулы I или его фармацевтически приемлемая соль, характеризующееся в отношении связывания КРФ 1 значением Ki5 нМ и проявляющее избирательное связывание с КРФ 1 (т.е. меньшие значения Ki) по сравнению с КРФ 2; и/или(э) конкретные примеры соединений, обладающих превосходными биодоступностью и показателями фармакокинетического профиля по сравнению с некоторыми известными антагонистами КРФ (например, CP154526 и NBI30775), такие как соединение примера 15. Составы на основе соединений согласно настоящему изобретению предпочтительно представляют собой фармацевтические композиции, подходящие для введения различными способами. Предпочтительно указанные композиции предназначены для перорального введения. Такие фармацевтические композиции и способы их получения хорошо известны в данной области техники (см., например, Remington:The Science и Practice of Pharmacy, A. Gennaro, et al., eds., 19th ed., Mack Publishing Co., 1995). Соединения формулы I в общем случае эффективны в широком диапазоне дозировок. Например,суточная доза обычно находится в пределах от примерно 0,0001 до примерно 30 мг/кг массы тела. В некоторых случаях наиболее подходящими являются дозировки, меньшие нижнего предельного значения указанного интервала, в то время как в других случаях без каких-либо негативных побочных эффектов могут применяться дозировки, превышающие верхнее предельное значение указанного интервала. Таким образом, указанный диапазон дозировок никоим образом не ограничивает настоящее изобретение. Представляется очевидным, что конкретное количество вводимого соединения должно определяться лечащим врачом с учетом соответствующих факторов, включая состояние, подвергаемое лечению, выбранный способ введения, конкретное вводимое соединение или соединения, возраст, вес и ответ организма конкретного пациента, а также степень тяжести симптомов у данного пациента. Соединения формулы I представляют собой антагонисты КРФ 1 и подходят как таковые для лечения состояний, поддающихся лечению путем снижения тонуса рецепторов КРФ 1 или стимулирования указанных рецепторов. Кортикотропин-рилизинг-фактор (КРФ), представляющий собой пептид, содержащий остатки 41 аминокислоты, и являющийся основным физиологическим регулятором секреции пептида, образующегося из проопиомеланокортина (ПОМК) из передней доли гипофиза [J. Rivier et al., Proc.Natl. Acad. Sci. (USA) 80:4851 (1983); W. Vale et al., Science 213:1394 (1981)], связывают с возникновением ряда патологических состояний. Например, с помощью иммуногистохимической локализации КРФ было показано, что указанный гормон не только участвует в эндокринных процессах в гипофизе, но также широко распространен вне гипоталамической области, в центральной нервной системе и обусловливает целый ряд вегетативных, электрофизиологических и поведенческих эффектов, выступая в качестве нейромедиатора или нейромодулятора на участках мозга [W. Vale et al., Rec. Prog. Horm. Res. 39:245(1983); G.F. Koob, Persp. Behav. Med. 2:39 (1985); E.B. De Souza et al., J. Neurosci. 5:3189 (1985)]. Также имеются доказательства того, что КРФ играет важную роль в формировании совокупного ответа иммунной системы на физиологические, психологические и иммунологические стресс-факторы [см., например,J.E. Blalock, Physiological Reviews 69:1 (1989); J.E. Morley, Life Sci. 41:527 (1987)]. КРФ связывают с психическими нарушениями и заболеваниями нервной системы, включая депрессию и тревожность [D.M. Nielsen, Life Sci. 78:909-919; H.E. Kunzel et al., J. Psychiatr. Res. 37:525-533; D.R.Gehlert et al., Eur. J. Pharmacol. 509:145-153]. Кроме того, постулируется, что КРФ вносит вклад в этиологию и патофизиологию болезни Альцгеймера, болезни Хантингтона, синдрома прогрессирующего супрануклеарного паралича и бокового амиотрофического склероза, поскольку указанные заболевания связаны с дисфункцией нейронов КРФ в центральной нервной системе [см. обзор в работе Е.В. De Souze,Hosp. Practice, 23:59 (1988)]. Было установлено, что постоянное введение КРФ приводит к ухудшению работы допаминовой системы, что позволяет предположить, что КРФ участвует в развитии болезни Паркинсона [E. Izzo et al., Pharmacol. Biochem. Behav. 81:701-708 (2005)]. Другие неврологические нарушения, связанные с КРФ, включают эпилепсию [T.Z. Baram et al., Brain Res. 770:89-95 (1997)] и мигрень[T.C. Theoharides et al., Endocrinology, 136:5745-5750 (1995)]. КРФ связывают со злоупотреблением алкоголем и психоактивными веществами и сопутствующим абстинентным синдромом [D.H.B. Overstreet etal., Pharmacol. Biochem. Behav. 77:405-413; Y. Shaham et al., Psychopharmacology (Berl), 137:184-190]. Кроме того, имеются подтверждения того, что КРФ участвует в развитии различных эндокринных нарушений и сердечно-сосудистых заболеваний, таких как ожирение [E. Timofeeva и D. Richard, Neuroendocrinology, 66:327-340 (1997)], метаболический синдром [A.M. Ward et al., Metabolism, 53:720-726 (2004)],врожденная гиперплазия надпочечников [D.P. Merke и G.B. Cutler Jr., Endocrinol. Metab. Clin. North Am. 30:121-135 (2001)], болезнь Кушинга [M. Labeur et al., Curr. Drug Targets Immune Endocr. Metabol. Disord. 4:335-342 (2004)], гипертония [R.J. Briscoe, et al., Brain Res. 881:204-207 (2000)] и инсульт [S.L. Stevens etal., J. Cereb. Blood Flow Metab. 23:1151-1159 (2003)]. Было показано, что с КРФ связаны желудочнокишечные нарушения, такие как синдром раздраженного кишечника [Y. Tache et al., Eur J. Surg. Suppl. 16-22 (2002)] и стресс-индуцированная язва желудка [K.E. Gabry et al., Mol. Psychiatry, 7:474-483, 433(2002)]. Также имеются указания на то, что КРФ играет роль в развитии различных нарушений у женщин, например предменструального синдрома [F. Facchinetti et al., Psychosom. Med. 56:418-422 (1994)],бесплодия [L. Ghizzoni et al., Endocrinology, 138:4806-4811 (1997)], сексуальной дисфункции [J.E. Jones etWadhwa et al., Am. J. Obstet. Gynecol. 191:1063-1069 (2004)]. Далее, имеются доказательства того, что КРФ оказывает значительное влияние на иммунную систему, что указывает на терапевтический потенциал КРФ для лечения воспалительных заболеваний [A. Gravanis и A.N. Margioris, Curr. Med. Chem. 12:1503-1512 (2005)], аллергии [L.K. Singh et al., Brain Behav. Immun. 13:225-239 (1999)], рассеянного склероза и других аутоиммунных нарушений [C. Benou et al., J. Immunol. 174:5407-5413 (2005)]. Помимо этого, КРФ связывают с висцеральной болью [M. Nijsen et al., Neurogastroenterol. Motil. 17:423-432(2005)], опухолями гипофиза или эктопическими опухолями гипофизарной природы [K.D. Dieterich et al.,J. Clin. Endocrinol. Metab. 83:3327-3331 (1998)], синдромом хронической усталости и фибромиалгией [G.Neeck и L.J. Crofford, Rheum. Dis. Clin. North Am. 26:989-1002 (2000)]. Были идентифицированы подтипы КРФ-рецепторов, КРФ 1 и КРФ 2, которые распространены в мозгу неоднородно [D.T. Chalmers et al., TIPS, 17:166-72 (1996)], что позволяет предположить потенциальное разнообразие функций у данного вида рецепторов [S.C. Heinrichs et al., Regul. Peptides, 71:15 (1997)]. Например, широко распространенные КРФ 1-рецепторы мозга тесно связаны с эмоциональной реакцией на воздействие внешних стресс-факторов [G. Liebsch et al., Regul. Peptides 59:229-39 (1995); D.W. Schulz,PNAS, 93:10477-82 (1996)]. Представляется важным, что КРФ 1-, но не КРФ 2-рецепторы, как полагают,опосредуют некоторые виды анксиогенных эффектов [Heinrichs et al., 1997]. В то же время более дискретный характер распределения КРФ 2-рецепторов в септальной/гипоталамической области [D.T.Chalmers et al., J. Neurosci. 15(10):6340-50 (1995)] и наличие альтернативных эндогенных лигандов [J.Vaughan et al., Nature 378:287-92 (1995)] позволяют предположить, что КРФ 2-рецептор выполняет иную функциональную роль [Heinrichs et al., 1997]. Так, сообщалось о новом нейропептиде КРФ-семейства,обладающем преимущественным сродством к КРФ 2-рецепторам по сравнению с КРФ 1-рецепторами,который способен подавлять аппетит, не вызывая при этом характерных поведенческих эффектов, наблюдаемых при селективном агонизме КРФ 1 [H. Tezval et al., PNAS, 101(25):9468-9473 (2004)]. В некоторых случаях агонизм КРФ 2 обусловливает эффекты, аналогичные тем, что наблюдали для антагонистов КРФ 1 или при делеции гена КРФ 1 [S.C. Heinrichs, Trends in Pharmacological Sciences, 20(8):311-5(1999)]. Например, агонисты КРФ 2 были предложены для применения в качестве агентов для лечения ожирения; в то же время антагонисты КРФ 1 также могут играть важную роль при лечении ожирения [C.-5 015179 Получение соединений согласно изобретению Все соединения согласно настоящему изобретению могут быть получены, например, с помощью приведенных ниже схем синтеза. Однако приведенное далее описание получения соединений никоим образом не ограничивает настоящее изобретение. Например, конкретные стадии синтеза согласно каждой из указанных схем могут комбинироваться различным образом или могут быть объединены со стадиями других схем для получения дополнительных соединений формулы I. Продукт, полученный на каждой из стадий, может быть выделен с помощью традиционных способов, включая экстракцию, выпаривание, осаждение, хроматографию, фильтрование, растирание в порошок, кристаллизацию и др. На приведенных ниже схемах все заместители, если не указано иное, являются такими, как определено ранее, а подходящие реагенты хорошо известны и широко используются в данной области техники. Схема 1 Получение соединения формул (6a, 6b), (7) или (8a-8c) можно проводить в соответствии с реакциями, представленными на схеме 1. Подходящее соединение формул (6a, 6b), (7) или (8a-8c) представляет собой соединение, в котором R1 и R2 являются такими, как определено для соединения формулы I, иR3a=H или CH3, R3b=Br или CH3, a R3c=H, CH3 или Br. Согласно схеме 1 на стадии 1 пиразоло[1,5-a]пиримидин-7-он формулы (1) превращают в 7-хлор 2,5-диметилпиразоло[1,5-a]пиримидин с использованием оксихлорида фосфора и диметиланилина в инертном растворителе, таком как толуол, при температуре, равной температуре кипения растворителя. На стадии 2 реактив Гриньяра формулы (3) (X=Cl или Br) подвергают взаимодействию с хлоридом формулы (2) в инертном растворителе, таком как толуол, при температуре, равной температуре кипения указанного растворителя, с образованием 7-алкилпиразолопиримидина формулы (4). Альтернативно, 7-алкилпиразолопиримидин формулы (4) может быть получен согласно стадиям 35. На стадии 3 этилацетоацетат ацилируют галогенангидридом формулы (4a) в присутствии хлорида магния с образованием сложного дикетоэфира формулы (4b). Полученный сложный дикетоэфир формулы(4b) подвергают декарбоксилированию в условиях реакции Крапчо (Krapcho) с образованием дикетона формулы (4c). Например, для проведения декарбоксилирования (4b) нагревают в диметилсульфоксиде при температуре примерно от 130 до 170C. На стадии 5 дикетон формулы (4c) подвергают циклизации с 3-амино-5-метилпиразолом в протонном растворителе, таком как метанол, этанол или уксусная кислота,с образованием 7-алкилпиразолопиримидина формулы (4). Предпочтительные условия проведения реакции предполагают использование уксусной кислоты при температуре примерно от 0 до 60C.-6 015179 На стадии 6 пиразолопиримидин формулы (4) превращают в йодпиразолопиримидин формулы (5) с использованием избытка N-йодсукцинимида в ацетонитриле. Согласно схеме 1 на стадиях 7 и 8 йодпиразолопиримидин формулы (5) подвергают взаимодействию с тиазолгалогенидом цинка в условиях реакции сочетания Негиши (Negishi) с образованием тиазолилпиразолопиримидина формулы (6a) или (6b) (Jensen, J.; Skjaerbaek, N.; Vedso, P. Synthesis, 2001, 128). Тиазолгалогенид цинка получают способами, хорошо известными специалисту в данной области техники. Например, на стадии 7 2-триметилсиланилтиазол обрабатывают н-, втор- или трет-бутилом лития с последующей заменой лития на цинк с помощью ZnCl2. Проводят реакцию сочетания цинкорганического реагента с йодпиразолопиримидином формулы (5) в присутствии палладиевого катализатора, например дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладий(II) дихлорметана, в инертном растворителе, таком как ТГФ, при температуре, равной температуре кипения указанного растворителя, в течение примерно от 12 до 36 ч с образованием тиазолпиразолопиримидина формулы (6a). Альтернативно, на стадии 8 с использованием 5-бром-4-метилтиазола и металлического цинка получают тиазолбромид цинка, который используют в реакции сочетания Негиши, проводимой, по существу, как указано для стадии 7, и получают тиазолпиразолопиримидин формулы (6b). Согласно схеме 1 на стадии 9 тиазол формул (6a, 6b) бромируют с образованием бром- или дибромтиазола формулы (7), где R3b=Br или CH3. Бромирование тиазола проводят с использованием либо 1, либо 2 эквивалентов N-бромсукцинимида, в зависимости от того, представляет ли R3a CH3 или H соответственно. Алкилтиазол формул (8a-8c) получают либо из тиазола формулы (6a, 6b) на стадии 11, либо из бромтиазола формулы (7) на стадии 10. На стадии 10 путем замены галогена на литий, проводимой с использованием н-, втор- или трет-бутила лития, получают тиазоллитиевый реагент, который далее подвергают взаимодействию с электрофилом, таким как алкилгалогенид, например простой метиловый эфир йодметила или йодбутан. На стадии 11 путем депротонирования с использованием н-, втор- или третбутила лития получают тиазоллитиевый реагент, который далее подвергают взаимодействию с электрофилом, таким как простой метиловый эфир йодметила или йодбутан. Для специалиста в данной области техники очевидно, что в тиазольную циклическую систему легко могут быть введены функциональные группы и легко могут быть получены промежуточные соединения на основе тиазола, такие как 2-триметилсиланилтиазол (Dondoni, A.; et al. J. Org. Chem. 1988, 53, 1748). 5-Бром-4-метилтиазол получают путем бромирования 4-метилтиазола бромом в уксусной кислоте(Collins, I.J., et al. WO 2003093252, 13 Nov. 2003). 2,5-Диметил-4H-пиразоло[1,5-a]пиримидин-7-он (1) легко может быть получен путем конденсации этилацетоацетата с 5-метил-2H-пиразол-3-иламином в кипящей уксусной кислоте. Схема 2 Получение соединений формул (9), (10) или (11) можно проводить в соответствии с реакциями,представленными на схеме 2. Подходящее соединение формул (9), (10) или (11) представляет собой соединение, в котором R1, R2, Ra и Rb являются такими, как определено для формулы I, R3b=Br или CH3,R4a=-NRaRb или -N-морфолинил, a het определен на схеме. На стадии 1 проводят сочетание бромтиазола формулы (7) с цинксодержащим гетероциклическим реагентом в ходе реакции сочетания Негиши с образованием тиазольного гетероцикла формулы (9). Например, 1-метил-1,2,4-триазол обрабатывают н-, втор- или трет-бутилом лития с последующей обработкой хлоридом цинка при температуре примерно от -80 до -65C и подвергают взаимодействию in situ с бромтиазолом формулы (7). Реакцию предпочтительно проводят в инертном растворителе, таком как ТГФ, в присутствии палладиевого катализатора, такого как дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладий(II) дихлорметан или тетракис(трифенилфосфин)палладий(0).-7 015179 Реакционную смесь нагревают до кипения. Альтернативно, цинксодержащий гетероциклический реагент получают из галогенгетероцикла, такого как 4-йодпиридин, и металлического цинка. Согласно схеме 2 на стадии 2 промежуточное соединение, представляющее собой 2-формилтиазол,получают путем замены галогена на литий, проводимой с помощью н-, втор- или трет-бутила лития, с последующим взаимодействием с N-формилморфолином. Полученный формилтиазол подвергают восстановительному аминированию в присутствии органического амина, такого как морфолин, с образованием морфолинилметилтиазола формулы (10). Способы восстановительного аминирования хорошо известны в данной области техники и обычно включают применение неорганического боргидридного реагента, такого как боргидрид натрия или цианборгидрид натрия. Предпочтительные условия проведения реакции предполагают использование триацетоксиборгидрида натрия в инертном растворителе, таком как дихлорметан или ТГФ. На стадии 3 бромтиазол формулы (7) подвергают реакции замещения с амином формулы -NRaRb или морфолином с образованием аминотиазола формулы (11). Реакцию проводят в инертном растворителе, таком как ТГФ или диоксан, с использованием неорганического основания, такого как карбонат цезия, при температуре от 70 до 110C. Схема 3 Получение соединений формул (13), (14) или (15) можно проводить в соответствии с реакциями,представленными на схеме 3. Подходящее соединение формул (13), (14) или (15) представляет собой соединение, в котором R1, R2 и R4 являются такими, как определено для формулы I. Для специалиста в данной области техники очевидно, что 4-бромтиазол, такой как соединение формулы (12), легко подвергается превращению в соединение с другими функциональными группами. Например, на стадии 1 бромид может быть дегалогенирован с помощью хлорида меди с образованием тиазола формулы (13), который далее подвергают хлорированию с помощью N-хлорсукцинимида с образованием 4-хлортиазола формулы (14). Согласно схеме 3 на стадии 3 4-бромтиазол формулы (12) вводят в реакцию замещения с метоксидом натрия в присутствии йодида меди(I) в метаноле при температуре примерно от 100 до 120C в инертном растворителе, таком как диметилформамид, с образованием 4-метокситиазола формулы (15). Получение соединений формул (17), (18), (19), (20), (20 а) или (21) можно проводить в соответствии с реакциями, представленными на схеме 4. Подходящее соединение формул (17), (18), (19), (20), (20a) или (21) представляет собой соединение, в котором R1, R2, Ra и Rb являются такими, как определено для формулы I, R4a представляет собой -NRaRb или -N-морфолинил, а het определен на схеме. Согласно схеме 4 на стадии 1 йодпиразолопиримидин формулы (5) и 5-бромтиазол формулы (16) подвергают сочетанию в условиях реакции Негиши с образованием диметилпирролилтиазола формулы(17). Например, 5-бромтиазол формулы (16) обрабатывают н-, втор- или трет-бутилом лития и далее хлоридом цинка при температуре примерно от -80 до -65C. Цинкорганический реагент in situ подвергают взаимодействию с йодпиразолопиримидином формулы (5). Реакцию сочетания предпочтительно проводят в инертном растворителе, таком как ТГФ, при температуре, равной температуре кипения растворителя, в присутствии палладиевого катализатора, такого как бис-(три-трет-бутилфосфин)палладий(0). На стадии 2 из диметилпирролилтиазола формулы (17) удаляют защитную группу с образованием аминотиазола формулы (19). Полученный диметилпиррол обрабатывают гидроксиламином в уксусной кислоте при температуре примерно от 60 до 100C в течение примерно от 4 до 8 ч, предпочтительно в течение примерно 6 ч. На стадии 3 получение тиазолацетамида формулы (18) проводят в тех же условиях, что и на стадии 2, за исключением того, что время проведения реакции составляет примерно 72 ч. Согласно схеме 4 на стадии 4 2-аминотиазол формулы (19) превращают в 2-бромтиазол формулы(20) с помощью реакции Зандмейера. Предпочтительные условия проведения реакции предполагают использование алкилонитрила, такого как трет-бутилнитрил, и бромида меди(II) в ацетонитриле при температуре примерно от 60 до 80C. На стадии 5 2-бромтиазол формулы (20) вводят в реакцию замещения с амином формулы -NRaRb или морфолином с образованием аминотиазола формулы (21). Реакцию проводят в инертном растворителе, таком как метанол, ТГФ или диоксан, или же без разбавления с использованием избытка указанного амина при температуре примерно от 70 до 110C. Альтернативно, реакцию проводят с использованием участвующего во взаимодействии амина и избытка триэтиламина или неорганического основания, такого как карбонат цезия. Кроме того, синтез аминотиазолов формулы (21) может включать ряд стадий удаления защитных групп, например удаление группы трет-бутилового эфира карбаминовой кислоты (BOC), в случае, если наличие указанных стадий необходимо или желательно для проведения указанных выше реакций, при этом -NRaRb содержит дополнительную функциональную аминную группу, как определено для соединения формулы I. Выбор и применение подходящих защитных групп хорошо известны и широко практикуются в данной области техники (см., например, Protecting Groups in Organic Synthesis, Theodora Greene (Wiley-Interscience. Согласно схеме 4 на стадии 6 2-бромтиазол формулы (20) подвергают сочетанию с цинксодержащим гетероциклическим реагентом в условиях реакции сочетания Негиши с образованием тиазольного гетероцикла формулы (20a) по способу, аналогичному описанному для схемы 2, стадия 1. Для специалиста в данной области техники очевидно, что замещенный тиазол формулы (16) может-9 015179 быть получен с помощью известных в данной области техники способов. Например, циклизация тиомочевины с бромкетоном, таким как 3-бром-1,1,1-трифторпропан-2-он, приводит к образованию 4 трифторметилтиазол-2-иламина. Последующее бромирование и защита аминной группы с помощью гексан-2,5-диона приводят к образованию соединения (16). Схема 5 Получение соединений формулы (23) можно проводить в соответствии с реакциями, представленными на схеме 5. Подходящее соединение формулы (23) представляет собой соединение, в котором R1 иR2 являются такими, как определено для формулы I, а R4b определен на схеме. Йодпиразолопиримидин формулы (5) и 4-хлор-2-морфолинтиазол, например, формулы (22) подвергают сочетанию с образованием пиразолопиримидинтиазола формулы (23). Например, участвующие в реакции вещества подвергают сочетанию в присутствии йодида меди, ацетата палладия и трифенилфосфина,а также основания, такого как карбонат цезия. Реакцию сочетания предпочтительно проводят в инертном растворителе, таком как ДМФ, при температуре примерно от 100 до 150C в течение от 4 до 24 ч. Для специалиста в данной области техники очевидно, что замещенный тиазол формулы (22) может быть получен с помощью известных в данной области техники способов. Например, 2,4-дихлортиазол может быть подвергнут взаимодействию с морфолином с образованием 2-морфолинотиазола формулы(22). 2,4-Дихлортиазол также может быть подвергнут полному бромированию с образованием 2,5 дибром-4-хлортиазола. Дальнейшая замена атома брома на литий с помощью н-бутил лития в ТГФ при-90C и гашение реакции водой приводят к получению 2-бром-4-хлортиазола [J. Chem. Soc. Perkin TransI: Org. Bioorg. Chem. (1972-1999), (2):215-219 (1992)]. 2-Бром-4-хлортиазол может быть подвергнут сочетанию с цинксодержащим гетероциклическим реагентом в условиях реакции Негиши с образованием указанного тиазол-2-илтриазола или пиридина. Схема 6 Получение соединений формулы (27) можно проводить в соответствии с реакциями, представленными на схеме 6. Подходящее соединение формулы (27) представляет собой соединение, в котором R1 иR2 являются такими, как определено для формулы I, а het определен на схеме на стадии 1 или стадии 3 соответственно. Согласно схеме 6 на стадии 1 тиазольный гетероцикл, например, формулы (25) получают путем взаимодействия йодпиразолопиримидина формулы (5) с бромтиазолом формулы (24). Реакцию проводят в присутствии N-бутиламмонийбромида и основания, такого как ацетат калия, а также палладиевого катализатора, такого как ацетат палладия, и трис-(2,4-ди-трет-бутилфенил)фосфина, в инертном растворителе, таком как N-метилпирролидон, при температуре примерно от 100 до 150C. Альтернативно, на стадии 2 тиазолилпиразолопиримидин формулы (6a) йодируют с образованием 2-йодтиазола формулы (26). Указанный тиазол обрабатывают диизопропиламидом лития при температуре от -70 до -80C в течение примерно 1 ч, после чего обрабатывают N-йодсукцинимидом примерно при- 10015179 той же температуре в инертном растворителе, таком как ТГФ. Далее на стадии 3 получают триазолил или 4-пиридилтиазол формулы (25) в условиях реакции сочетания Негиши, аналогичных указанным для стадии 1 схемы 2. Согласно схеме 6 на стадии 4 тиазолилпиразолопиримидин формулы (25) бромируют с образованием бромтиазола формулы (27). Бромирование проводят с использованием N-бромсукцинимида в присутствии небольшого количества уксусной кислоты в инертном растворителе, таком как ацетонитрил. Соединение формулы (21), где het=2,5-диметилпиррол-1-ил, далее может использоваться для получения соединений согласно настоящему изобретению в соответствии со схемой 4, стадии 2-5. Для специалиста в данной области техники очевидно, что тиазольные гетероциклические соединения формулы (24) легко могут быть получены с помощью известных в данной области техники способов. Например, амид тиазол-2-карбоновой кислоты может быть подвергнут циклизации с образованием триазола с использованием 1,1-диметокси-N,N-диметилметанамина с последующим взаимодействием с Nметилгидразином, приводящим к образованию триазолилтиазола, который далее может быть бромирован с помощью N-бромсукцинимида. В литературе описаны способы получения 4-тиазол-2-илпиридина, который может быть бромирован с образованием 4-(5-бромтиазол-2-ил)пиридина. 5-Бром-2-(2,5-диметилпиррол-1 ил)тиазол легко может быть получен путем взаимодействия 2-амино-5-бромтиазола с гексан-2,5-дионом. В настоящем описании "ТСХ" относится к тонкослойной хроматографии; "ВЭЖХ" относится к высокоэффективной жидкостной хроматографии; "ЖХ/МС" относится к жидкостной хроматографии/массспектрометрии; "ГХ/МС" относится к газовой хроматографии/масс-спектрометрии; "ВПМСВР" относится к времяпролетной масс-спектрометрии высокого разрешения; "ХИАД" относится к химической ионизации при атмосферном давлении; относится к химическому сдвигу в миллионных долях относительно тетраметилсилана; "ТГФ" относится к тетрагидрофурану; "EtOAc" относится к этилацетату; "MeOH" относится к метанолу; "EtOH" относится к этанолу; "ДМФ" относится к диметилформамиду. Примеры Не вдаваясь в дальнейшие пояснения, полагают, что специалист в данной области техники на основании приведенного выше описания способен в полной мере реализовать настоящее изобретение. Далее с целью более подробного описания настоящего изобретения приведены примеры реализации и препаративные примеры. Указанные примеры приведены в иллюстративных целях и никоим образом не ограничивают настоящее изобретение. Используемые реактивы и исходные материалы легко доступны или без труда могут быть синтезированы специалистом в данной области техники. В примерах 1-35 приведены представительные соединения и способы их получения. Примеры A-D иллюстрируют различные способы биологического исследования, подходящие для определения биологических свойств соединений согласно настоящему изобретению. Для специалиста в данной области техники очевидны подходящие варианты способов, изложенных в приведенных примерах. Названия соединений согласно настоящему изобретению получены с помощью ChemDraw Ultra, версия 7.0.1. Названия солей приведены в виде"свободное основание плюс сопряженная кислота". Препаративный пример 1. 2,5-Диметил-4H-пиразоло[1,5-a]пиримидин-7-он. Этилацетоацетат (128 г, 0,98 моль) добавляли по каплям к уксуснокислому раствору (500 мл) 5-метил 2H-пиразол-3-иламина (100 г, 0,95 моль), поддерживая температуру равной 25-28C. Смесь кипятили с обратным холодильником в течение 10 ч, после чего охлаждали до комнатной температуры. Реакционную смесь добавляли к простому трет-бутилметиловому эфиру (5 л), охлажденному до 5C, поддерживая температуру ниже 10C. Перемешивали смесь в течение 1 ч при 5C и фильтровали. Полученный продукт сушили под вакуумом в течение ночи и получали твердое вещество белого цвета (158 г, 96%). Препаративный пример 2. 7-Хлор-2,5-диметилпиразоло[1,5-a]пиримидин. К суспензии 2,5-диметил-4H-пиразоло[1,5-a]пиримидин-7-она (10,0 г, 61,3 ммоль) в толуоле(150 мл) добавляли N,N-диметиланилин (9,7 мл, 76,7 ммоль). К полученной суспензии белого цвета добавляли по каплям оксихлорид фосфора (11,2 мл, 122,6 ммоль). Кипятили с обратным холодильником в течение 3 ч в атмосфере инертного газа, охлаждали до комнатной температуры и концентрировали реакционную смесь под разрежением с образованием маслянистой жидкости коричневого цвета. Полученное масло растворяли в этилацетате (250 мл) и подщелачивали 1,0 н. NaOH. Органическую фазу отделяли и экстрагировали щелочной раствор водной фазы этилацетатом (2100 мл). Органические фазы объединяли, сушили над безводным сульфатом магния, фильтровали и концентрировали под разрежением с образованием твердого вещества коричневого цвета. Полученный продукт очищали методом флэшхроматографии, используя в качестве элюента ступенчатый градиент от 80% гексана/20% (30% ТГФ/гексан) до 0% гексана/100% (30% ТГФ/гексан) с 20% шагом изменения концентрации, при этом получали твердое вещество светло-зеленого цвета (6,65 г, 59%). ЭС/МС m/z (35Cl) 182,3 (M+1)+.- 11015179 Альтернативный способ получения. 2,5-Диметилпиразоло[1,5-a]пиримидин-7-он (20 г, 122 ммоль) добавляли к 1,4-диоксану (60 мл). Смесь перемешивали при 22C в течение 10 мин, после чего добавляли N,N-диэтиланилин (20,8 мл,128 ммоль). Перемешивали смесь в течение еще 5 мин, после чего добавляли оксихлорид фосфора(11,7 мл, 126 ммоль) в течение 15 мин. Смесь перемешивали при 22C в течение 15 мин, нагревали до 8085C в течение 35 мин и выдерживали при этой температуре в течение 1,5 ч. Охлажденную реакционную смесь медленно добавляли к раствору вторичного кислого фосфата калия (106,7 г, 612,82 ммоль) в воде(325 мл), охлажденному до 0-5C, поддерживая температуру реакционной смеси в процессе добавления ниже 5C. Смесь перемешивали при 22C, после чего добавляли метил-трет-бутиловый эфир (150 мл). Органический слой отделяли, а водный слой экстрагировали метил-трет-бутиловым эфиром (2100 мл). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и выпаривали растворитель. Продукт очищали с помощью гель-хроматографии с использованием в качестве элюента гексана/этилацетата (2/1), при этом получали титульное соединение в виде твердого вещества желтого цвета В высушенную в сушильном шкафу колбу, снабженную обратным холодильником, добавляли безводный ТГФ (40 мл), йод (каталитическое количество), магниевую стружку (1,92 г, 78,9 ммоль) и 4 бромгептан (9,4 мл, 52 ммоль). Смесь кипятили с обратным холодильником на масляной бане. Температура реакционной смеси резко повышалась с началом протекания реакции Гриньяра. Реакционную смесь перемешивали в течение еще 4 ч при 90C и охлаждали до комнатной температуры. После осаждения металлического магния (которое также может быть обеспечено с помощью центрифугирования) реактив Гриньяра с помощью полой трубки в атмосфере аргона под давлением переносили в колбу, содержащую 7-хлор-2,5-диметилпиразоло[1,5-a]пиримидин (4,80 г, 26,3 ммоль) в безводном толуоле (20 мл). Реакционную смесь кипятили с обратным холодильником в атмосфере инертного газа в течение ночи. Смесь охлаждали до комнатной температуры и гасили реакцию водой. Разбавляли смесь этилацетатом (150 мл),добавляли воду (100 мл) и насыщенный хлорид аммония (50 мл). Проводили разделение и экстрагировали водную фазу дихлорметаном (75 мл). Органические фазы объединяли, сушили над безводным сульфатом магния, фильтровали и концентрировали под разрежением. Полученный остаток очищали методом флэш-хроматографии, используя в качестве элюента ступенчатый градиент от 80% гексана/20% (20% этилацетата/гексан) до 0% гексана/100% (20% этилацетата/гексан) с 20% шагом изменения концентрации, при этом получали кристаллическое вещество желтого цвета (3,08 г, 48%). ЭС/МС m/z 246,3 (M+1)+. Альтернативный способ получения. Смесь магниевой стружки (3,5 г, 144 ммоль) и каталитического количества йода (100 мг) в ТГФ(100 мл) нагревали до 65C в атмосфере азота. Добавляли несколько капель чистого 4-бромгептана и нагревали смесь до начала протекания реакции. Затем добавляли раствор 4-бромгептана (17,6 мл,94,9 ммоль) в ТГФ (42 мл), поддерживая температуру равной 65-70C, в течение 2 ч. Смесь кипятили с обратным холодильником дополнительно в течение 1 ч, после чего охлаждали до 22C. Полученный реактив Гриньяра добавляли к раствору 7-хлор-2,5-диметилпиразоло[1,5-a]пиримидина (10,2 г,53,3 ммоль) в ТГФ (60 мл), охлажденному до 0C, в атмосфере азота. С помощью полой трубки добавляли в течение 45 мин раствор магниевого реактива, поддерживая температуру ниже 10C. Далее смесь перемешивали в течение еще 30 мин при 5C. К полученной смеси добавляли 10% водный раствор хлорида аммония (мас./мас.) (125 мл) и перемешивали при 22C в течение 30 мин. Органический слой отделяли, а водный слой экстрагировали этилацетатом (225 мл). Полученные органические слои объединяли и сушили над сульфатом натрия. Смесь фильтровали и выпаривали растворитель. Полученный сырой продукт очищали методом флэш-хроматографии на силикагеле с использованием в качестве элюента гексана/этилацетата (5/1) и получали титульное соединение (8 г, 62%). ЭС/МС m/z 246 (M+1)+. Препаративный пример 3a. 7-(1-Пропилбутил)-2,5-диметилпиразоло[1,5-a]пиримидин. Альтернативная схема синтеза. Стадия 1. Этиловый эфир 2-ацетил-3-оксо-4-пропилгептановой кислоты. Хлорид магния (14,63 г, 153,70 ммоль) добавляли к дихлорметану (500 мл) с последующим добавлением всего количества этилацетоацетата (19,55 мл, 20,00 г, 153,79 ммоль) за один прием и перемешивали при комнатной температуре в течение 1 ч. Смесь охлаждали на ледяной бане и добавляли по каплям- 12015179 пиридин (24,86 мл, 24,32 г, 307,39 ммоль). К полученной суспензии белого цвета добавляли по каплям ди-н-пропилацетилхлорид (25,00 г, 153,70 ммоль) при 0C в атмосфере азота. По окончании добавления баню убирали, смесь нагревали до комнатной температуры и перемешивали в течение 16 ч. Реакцию гасили 1 н. HCl (400 мл) и отделяли нижний слой. Органическую часть сушили над сульфатом магния,фильтровали и концентрировали под вакуумом с образованием масла желтого цвета (34 г, 86%). Полученный продукт использовали на следующей стадии без дополнительной очистки. Стадия 2. 5-Пропилоктан-2,4-дион. Этиловый эфир 2-ацетил-3-оксо-4-пропилгептановой кислоты (32,4 г, 126,39 ммоль) растворяли в смеси диметилсульфоксида (100 мл) и воды (5 мл). Раствор нагревали при 150C в течение от 6 до 8 ч или следили за ходом реакции с помощью ГХ/МС. Реакционную смесь охлаждали и экстрагировали гептаном (3100 мл). Объединенные органические слои промывали водой (100 мл) и насыщенным солевым раствором (100 мл) и концентрировали под вакуумом при 50C до удаления большей части гептана. Получали 23,29 г масла, которое использовали непосредственно на следующей стадии. Стадия 3. 7-(1-Пропилбутил)-2,5-диметилпиразоло[1,5-a]пиримидин. Смешивали 5-пропилоктан-2,4-дион (15 г, 81,40 ммоль) с уксусной кислотой (15 мл) и охлаждали на ледяной бане. Добавляли небольшими порциями 5-амино-3-метилпиразол (7,91 г, 81,40 ммоль) и перемешивали при комнатной температуре. Полноту протекания реакции устанавливали с помощью ГХ/МС через 3 ч. Анализ методом ГХ указывал на наличие изомера в нужной области, аналогичной соответствующей области для образца сравнения. Смесь разбавляли для устранения избытка уксусной кислоты. Добавляли воду (50 мл) и проводили экстракцию гептаном (50 мл). Промывали гептановый раствор насыщенным солевым раствором (50 мл). Органический слой сушили над MgSO4, фильтровали и концентрировали под вакуумом с образованием неочищенного масла (15,8 г, 79%). 1(м, 4H), 0,85 (т, 6H). Следующее соединение получали, по существу, согласно препаративному примеру 3, следуя аналогичной методике. Для получения реактива Гриньяра использовали 3-бромпентан. Препаративный пример 5. 7-(1-Пропилбутил)-3-йодо-2,5-диметилпиразоло[1,5-a]пиримидин. Растворяли 7-(1-пропилбутил)-2,5-диметилпиразоло[1,5-a]пиримидин (3,08 г, 12,5 ммоль) в безводном ацетонитриле (25 мл) и добавляли 6 порций (по 0,70 г каждая) N-йодсукцинимида (4,2 г, 18,7 ммоль) с интервалом в 10 мин. Перемешивали смесь в течение выходных дней при комнатной температуре. Удаляли ацетонитрил и разбавляли полученное масло дихлорметаном (100 мл). Промывали насыщенным раствором хлорида аммония (250 мл). Собирали органическую фазу, сушили над безводным сульфатом магния, фильтровали и концентрировали под разрежением, при этом получали масло темно-красного цвета. Полученное масло очищали методом флэш-хроматографии, используя в качестве элюента ступенчатый градиент от 100% гексана/0% (20% этилацетата/гексан) до 0% гексана/100% (20% этилацетата/гексан) с 50% шагом изменения концентрации, и получали масло оранжевого цвета (10,97 г, 87%). 1H ЯМР (400 МГц, CDCl3): 6,42 (с, 1H), 3,74-3,70 (м, 1H), 2,58 (с, 3H), 2,46 (с, 3H), 1,74-1,68 (м, 4H),1,28-1,14 (м, 4H), 0,84 (т, J=7,0 Гц, 6H). Указанное ниже соединение получали, по существу, согласно препаративному примеру 5. Альтернативный способ получения соединения согласно препаративному примеру 6. Уксусную кислоту (1 мл) и N-йодсукцинимид (6,7 г, 29,9 ммоль) добавляли за один прием к раствору 7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидина (6 г, 27,5 ммоль) в ацетонитриле (60 мл). Смесь перемешивали при 22C в течение 2 ч. Выпаривали растворитель и переносили полученный остаток в воду (50 мл) и метил-трет-бутиловый эфир (100 мл). Органическую часть отделяли, сушили над сульфатом натрия, фильтровали и выпаривали растворитель с образованием титульного соединения- 13015179 Препаративный пример 7. 2-Триметилсиланилтиазол. Смешивали н-бутил лития (20,4 мл, 51,0 ммоль, 2,5 М в гексане) с диэтиловым эфиром (50 мл) в трехгорлой колбе, снабженной капельной воронкой и термометром. Охлаждали до -78C и добавляли по каплям раствор тиазола (4,25 г, 50,0 ммоль) в диэтиловом эфире (50 мл). По окончании добавления реакционную смесь перемешивали при -78C в течение 30 мин, после чего добавляли хлортриметилсилан(5,4 г, 50,0 ммоль). Перемешивали при -78C в течение 1 ч, после чего нагревали до комнатной температуры. Реакцию гасили добавлением насыщенного раствора бикарбоната натрия. Водный слой экстрагировали диэтиловым эфиром. Объединенные органические слои промывали насыщенным солевым раствором и сушили над сульфатом натрия, фильтровали и концентрировали под разрежением. Полученный остаток очищали перегонкой и получали 8,33 г (52-56C/15 мм рт.ст.) титульного соединения. 1H ЯМР (400 МГц, CDCl3): 8,13 (d, 1H, J=2,6 Гц), 7,54 (d, 1H, J=2,6 Гц), 0,43 (с, 9H). Препаративный пример 8. 5-Бром-4-метилтиазол. Бром (9,27 мл, 182 ммоль) добавляли к раствору 4-метилтиазола (15,0 г, 152 ммоль) в уксусной кислоте (30 мл) при 0C. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение ночи. Разбавляли дихлорметаном и промывали 1 н. NaOH и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный сырой продукт очищали методом колоночной хроматографии на силикагеле, используя в качестве элюента гексан/этилацетат (5/1), и получали титульное соединение (9,94 г, 37%). 1H ЯМР (400 МГц, CDCl3):8,69 (с, 1H), 2,43 (с, 3H). Препаративный пример 9. Этиловый эфир тиазол-2-карбоновой кислоты. К смеси 2-триметилсилилтиазола (135 г, 858,1 ммоль) в толуоле (1350 мл) добавляли раствор этилхлорформиата (98,4 мл, 1,03 моль) в толуоле (1350 мл) в течение 15 мин. Перемешивали реакционную смесь при 22C в течение 2 ч. Добавляли водный раствор карбоната натрия 25% (мас./мас.) (5 л) и перемешивали смесь в течение 30 мин. Органический слой отделяли и проводили обратную экстракцию водного слоя метиленхлоридом (21 л). Полученные органические слои объединяли, растворитель выпаривали и получали титульное соединение (134 г, 99%). ЭС/МС m/z 158 (M+1)+. Препаративный пример 10. Амид тиазол-2-карбоновой кислоты. Этиловый эфир тиазол-2-карбоновой кислоты (150 г, 0,9 моль) добавляли к смеси метанола (75 мл) и 30% водного раствора гидроксида аммония (750 мл) и кипятили смесь с обратным холодильником в течение 1 ч. Затем охлаждали до 22C и выпаривали метанол под вакуумом. Смесь перемешивали в течение 30 мин при комнатной температуре и отфильтровывали твердое вещество. Выделенный твердый продукт сушили под вакуумом и получали титульное соединение (98 г, 85%). ЭС/МС m/z 129 (M+1)+. Препаративный пример 11. 1-Метил-5-тиазол-2-ил-1H-[1,2,4]триазол. 1,1-Диметокси-N,N-диметилметанамин (240 мл) охлаждали до 10C и добавляли амид тиазол-2 карбоновой кислоты (60 г, 421 ммоль) в три приема. Смесь перемешивали при 10C в течение 30 мин. Затем смесь постепенно нагревали до кипения в течение 45 мин. Отгоняли образовавшийся метанол, после чего нагревали реакционную смесь до 100C в течение 1,5 ч. Охлаждали смесь до 60C и удаляли избыток 1,1-диметокси-N,N-диметилметанамина перегонкой под вакуумом. Остаток охлаждали до 22C и добавляли гексан (200 мл). Смесь растирали в порошок в течение 15 мин, фильтровали и сушили твердый продукт до постоянной массы перед использованием на следующей стадии. Полученное твердое вещество (68 г) добавляли к уксусной кислоте (680 мл) и охлаждали смесь до 10C. Добавляли N-метилгидразин (27 мл, 509 ммоль) с такой скоростью, чтобы температура реакционной смеси не поднималась выше 15C. Нагревали смесь до 20C в течение 30 мин, после чего постепенно нагревали до 90C. Перемешивали смесь при 90C в течение 30 мин, после чего охлаждали до 22C. С помощью перегонки под вакуумом удаляли уксусную кислоту. К остатку добавляли воду и доводили значение pH до 8 добавлением 25% водного раствора гидроксида натрия. Водный слой экстрагировали метил-трет-бутиловым эфиром (3600 мл). Органические слои объединяли и выпаривали растворитель. Полученный остаток очищали методом хроматографии на силикагеле, используя в качестве элюента гексан/изопропанол (9/1), и получали титульное соединение (49 г, 70%). ЭС/МС m/z 167 (M+1)+. Препаративный пример 12. 5-(5-Бромтиазол-2-ил)-1-метил-1H-[1,2,4]триазол. К смеси метил-5-тиазол-2-ил-1H-[1,2,4]триазола (6,55 г, 39,4 ммоль) и диметилформамида (32 мл) добавляли N-бромсукцинимид (14 г, 78,8 ммоль) в три приема в течение 1 ч. Смесь перемешивали при- 14015179 22C в течение 18 ч, после чего добавляли к воде (300 мл), охлажденной до 0-5C. Водный слой отделяли и экстрагировали метил-трет-бутиловым эфиром (2200 мл). Органические слои объединяли и промывали 7% водным раствором гидрокарбоната натрия (100 мл), после чего сушили над сульфатом натрия,фильтровали и выпаривали растворитель с образованием титульного соединения (9,5 г, 93%). ЭС/МС m/z (79Br/81Br) 245/247 (M+1)+. Препаративный пример 13. 2,5-Диметил-3-[2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил]-7-(1-пропилбутил)пиразоло[1,5a]пиримидин. Смешивали 5-(5-бромтиазол-2-ил)-1-метил-1H-[1,2,4]триазол (6,5 г, 23,8 ммоль) и 2,5-диметил-7-(1 пропилбутил)пиразоло[1,5-a]пиримидин (6 г, 24,5 ммоль) в N-метилпирролидиноне (58 мл) и перемешивали в атмосфере азота до растворения. Затем добавляли тетра-N-бутиламмонийбромид (5,47 г,16,7 ммоль) и ацетат калия (11,8 г, 119 ммоль) и нагревали смесь до 100C в атмосфере азота. Дегазировали горячую смесь в три приема путем вакуумирования/продувки азотом. Затем добавляли ацетат палладия (216 мг, 0,94 ммоль) и трис-(2,4-ди-трет-бутилфенил)фосфин (787 мг, 1,2 ммоль). Нагревали смесь в течение 4 ч при 125C в атмосфере азота. Охлаждали смесь до 22C и добавляли в воду (750 мл). Водный слой экстрагировали метил-трет-бутиловым эфиром (3200 мл), органические слои объединяли и выпаривали. Полученный остаток очищали фильтрованием через слой силикагеля с использованием в качестве элюента гексана/этилацетата (4/1). Фракции, содержащие продукт, объединяли и выпаривали растворитель с образованием титульного соединения (7 г, 72%). ЭС/МС m/z 410 (M+1)+. Препаративный пример 14. 2,5-Диметил-7-(1-пропилбутил)-3-тиазол-5-илпиразоло[1,5-a]пиримидин. В высушенную в сушильном шкафу колбу добавляли 2-триметилсиланилтиазол (1,765 г,11,24 ммоль), растворенный в безводном ТГФ (30 мл), и охлаждали в атмосфере инертного газа до -78C. Медленно добавляли н-бутил лития (2,5 М раствор в гексане, 4,5 мл, 11,24 ммоль) и перемешивали 30 мин при -78C. Добавляли одной аликвотой безводный хлорид цинка (2,26 г, 16,58 ммоль) и перемешивали 30 мин при -78C. После нагревания смеси до комнатной температуры смесь перемешивали в течение 30 мин и добавляли 7-(1-пропилбутил)-3-йодо-2,5-диметилпиразоло[1,5-a]пиримидин (1,624 г,5,18 ммоль) и дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладий(II) дихлорметан (0,423 г,0,518 ммоль). Кипятили с обратным холодильником в течение ночи на масляной бане (90C) в атмосфере инертного газа. Охлаждали реакционную смесь до комнатной температуры, гасили реакцию насыщенным раствором бикарбоната натрия и разбавляли смесь этилацетатом (150 мл). Водный слой отделяли и экстрагировали этилацетатом (75 мл). Органические фазы объединяли, сушили над безводным сульфатом магния, фильтровали и концентрировали под разрежением. Остаток очищали методом флэшхроматографии с использованием в качестве элюента ступенчатого градиента от 100% гексана/0% (30% ТГФ/гексан) до 0% гексана/100% (30% ТГФ/гексан) с 10% шагом изменения концентрации и получали твердое вещество белого цвета (0,720 г, 42%). ЭС/МС m/z 329,0 (M+1)+. Указанное ниже соединение получали, по существу, согласно препаративному примеру 14. Альтернативный способ получения соединения согласно препаративному примеру 15. н-Бутил литий (76,5 мл, 191 ммоль, 2,5 М в гексане) добавляли к раствору 2-триметилсилилтиазола(30 г, 191 ммоль) в ТГФ (450 мл) при -78C в атмосфере азота, поддерживая температуру в процессе добавления ниже -74C. Смесь перемешивали при -78C в течение 30 мин, после чего добавляли хлорид цинка в виде сухого порошка (39,9 г, 286 ммоль) за один прием и нагревали смесь до 22C в течение 1 ч. Добавляли 7-(1-этилпропил)-3-йодо-2,5-диметилпиразоло[1,5-a]пиримидин (30 г, 87 ммоль) и 1,1'-бис-(дифенилфосфино)ферроценпалладия(II) хлорид (6,5 г, 8 ммоль) и кипятили смесь с обратным холодильником в атмосфере азота в течение 8 ч. Охлаждали смесь до 22C и добавляли 10% водный раствор хлорида аммония (450 мл). Органический слой отделяли и экстрагировали водный слой метил-третбутиловым эфиром (2100 мл). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и выпаривали растворитель с образованием титульного соединения (20,4 г, 78%). ЭС/МС m/z 301 (M+1)+- 15015179 Препаративный пример 16. 7-(1-Этилпропил)-3-(2-йодтиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидин. Свежеприготовленный раствор диизопропиламида лития (150 мл, 62,4 ммоль, 0,6 М в ТГФ) добавляли к смеси 7-(1-этилпропил)-2,5-диметил-3-тиазол-5-илпиразоло[1,5-a]пиримидина (17,8 г, 62,4 ммоль) в ТГФ (100 мл) при -78C в атмосфере азота, поддерживая температуру в процессе добавления ниже-74C. Смесь перемешивали при -78C в течение 1 ч, после чего добавляли раствор N-йодосукцинимида(15 г, 63 ммоль) в ТГФ (100 мл), поддерживая температуру смеси ниже -74C. Реакционную смесь постепенно нагревали до 22C, после чего добавляли 10% водный раствор хлорида аммония (300 мл). Органический слой отделяли и экстрагировали водный слой метил-трет-бутиловым эфиром (2200 мл). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и выпаривали растворитель. Полученный остаток очищали методом хроматографии на силикагеле с использованием в качестве элюента гексана/ацетона (5/1) с образованием титульного соединения (15 г, 60%). ЭС/МС m/z 427 (M+1)+. Пример 1. 7-(1-Этилпропил)-2,5-диметил-3-(4-метилтиазол-5-ил)пиразоло[1,5-a]пиримидин. Цинк Rieke (10 г в 100 мл ТГФ, 13,2 мл, 18,48 ммоль) добавляли к 5-бром-4-метилтиазолу (2,13 г,18,48 ммоль) и кипятили смесь с обратным холодильником в течение 2 ч. Охлаждали смесь до комнатной температуры и отделяли цинк центрифугированием. Через раствор 7-(1-этилпропил)-3-йод-2,5 диметилпиразоло[1,5-a]пиримидин (900 мг, 2,62 ммоль) в безводном тетрагидрофуране (10 мл) барботировали азот и добавляли раствор бромида цинкорганического соединения с последующим добавлением[1,1'-бис-(дифенилфосфино)ферроцен]дихлорпалладия(II) (106 мг, 0,13 ммоль). Перемешивали реакционную смесь при кипячении с обратным холодильником в течение ночи и охлаждали до комнатной температуры. Добавляли к реакционной смеси раствор хлорида аммония и проводили экстракцию дихлорметаном. Органическую фазу сушили над сульфатом натрия, фильтровали и удаляли растворитель под вакуумом. Полученный сырой продукт очищали методом колоночной хроматографии на силикагеле,используя в качестве элюента гексан/этилацетат (3/1), и получали титульное соединение (652 мг, 79%). 1H ЯМР (400 МГц, CDCl3):8,80 (с, 1H), 6,48 (с, 1H), 3,63 (м, 1H), 2,57 (с, 3H), 2,43 (с, 3H), 2,40 (с,3H), 1,85 (м, 4H), 0,90 (т, 6H, J=7,3 Гц). ЭС/МС m/z 315 (M+1)+. Препаративный пример 17. 3-(2,4-Дибромтиазол-5-ил)-2,5-диметил-7-(1-пропилбутил)пиразоло[1,5-a]пиримидин. 2,5-Диметил-7-(1-пропилбутил)-3-тиазол-5-илпиразоло[1,5-а]пиримидин (3,15 г, 9,59 ммоль) растворяли в ацетонитриле (100 мл) и добавляли одной аликвотой N-бромсукцинимид (4,27 г, 24,0 ммоль). Перемешивали смесь в течение ночи в атмосфере инертного газа и проверяли полноту протекания реакции с помощью ТСХ. Концентрировали смесь под разрежением, разбавляли полученное масло дихлорметаном (150 мл) и промывали водой (75 мл). Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали под разрежением. Полученное масло очищали методом флэш-хроматографии с использованием в качестве элюента ступенчатого градиента от 100% гексана/0% (30% ТГФ/гексан) до 0% гексана/100% (30% ТГФ/гексан) (0-10-15-20-25-30-35-40-45-50-100% 30% ТГФ/гексана) и получали кристаллический продукт желтого цвета (3,70 г, 79%). ЭС/МС m/z (79Br81Br) 486,7 (M+1)+. Указанные ниже соединения получали, по существу, согласно препаративному примеру 17 за исключением того, что в качестве растворителя использовали дихлорметан. В высушенную в сушильном шкафу колбу добавляли 3-(2,4-дибромтиазол-5-ил)-2,5-диметил-7-(1 пропилбутил)пиразоло[1,5-a]пиримидин (0,973 г, 2,00 ммоль), безводный диоксан (20 мл), морфолин(0,872 г, 10,0 ммоль) и карбонат цезия (1,95 г, 6,00 ммоль). Кипятили смесь с обратным холодильником на масляной бане (105C) в атмосфере инертного газа в течение ночи. Проверяли полноту протекания реакции с помощью ЖХ/МС. Разбавляли смесь этилацетатом (100 мл), промывали водой (50 мл) и проводили обратную экстракцию водной фазы этилацетатом (50 мл). Органические фазы объединяли, сушили над сульфатом магния, фильтровали и концентрировали под разрежением. Полученный остаток очищали методом флэш-хроматографии с использованием в качестве элюента ступенчатого градиента от 100% гексана/0% (40% дихлорметан/20% этилацетат/2% 7 н. раствора аммиака в метаноле/38% гексана) до 0% гексана/100% (40% дихлорметан/20% этилацетат/2% 7 н. раствора аммиака в метаноле/38% гексана) с 10% шагом изменения концентрации и получали твердое вещество грязно-белого цвета (0,878 г, 89%). ЭС/МС m/z (79Br) 491,7 (M+1)+. Указанные ниже соединения получали, по существу, согласно примеру 4 с использованием в качестве амина 2,0 диметиламина/ТГФ или морфолина и с использованием ТГФ или диоксана в качестве растворителя. Реакцию проводили в герметичном сосуде или трубке Шленка. В высушенную в сушильном шкафу колбу добавляли 1-метил-1,2,4-триазол (0,498, 6,00 ммоль) и безводный ТГФ (20 мл) и охлаждали в атмосфере инертного газа до -78C. Медленно добавляли н-бутил лития (2,5 М раствор в гексане, 2,4 мл, 6,0 ммоль) и перемешивали в течение 30 мин. Добавляли одной аликвотой безводный хлорид цинка (1,36 г, 10,0 ммоль) и перемешивали в течение 30 мин при-78C. После того как реакционная смесь нагревалась до комнатной температуры, смесь перемешивали в течение 30 мин и добавляли 3-(2,4-дибромтиазол-5-ил)-2,5-диметил-7-(1-пропилбутил)пиразоло[1,5a]пиримидин (0,973 г, 2,00 ммоль) и дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладий(II) дихлорметан (0,163 г, 0,200 ммоль). Кипятили реакционную смесь с обратным холодильником в течение ночи на масляной бане (90C) в атмосфере инертного газа. Охлаждали реакционную смесь до комнатной температуры, гасили реакцию водой и разбавляли смесь этилацетатом (100 мл). Водный слой отделяли и экстрагировали дихлорметаном (50 мл). Органические фазы объединяли, сушили над безводным сульфатом магния, фильтровали и концентрировали под разрежением. Полученный остаток очищали методом флэш-хроматографии с использованием в качестве элюента ступенчатого градиента от 100% гексана/0%(10% ацетонитрила/40% ТГФ/50% гексана) до 0% гексана/100% (10% ацетонитрила/40% ТГФ/50% гексана) с 10% шагом изменения концентрации и получали твердое вещество белого цвета (0,090 г, 9%). ЭС/МС m/z (79Br) 487,7 (M+1)+. Альтернативный способ получения. К раствору 2,5-диметил-3-[2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил]-7-(1-пропилбутил)пиразоло[1,5-a]пиримидина (6 г, 14,65 ммоль) в ацетонитриле (60 мл) добавляли N-бромсукцинимид(2,74 г, 15,4 ммоль) за один прием и перемешивали при 22C в течение 10 ч. Выпаривали растворитель и растворяли полученный остаток в смеси воды (50 мл) и метил-трет-бутилового эфира (100 мл). Органический слой отделяли и экстрагировали водный слой дополнительным количеством метил-третбутилового эфира (250 мл). Органические слои объединяли и выпаривали растворитель. Полученный- 17015179 продукт очищали фильтрованием через слой силикагеля с использованием в качестве элюента гексана/этилацетата (3/1). Фракции, содержащие продукт, объединяли и выпаривали растворитель. Добавляли гептан (25 мл) и растирали в порошок твердое вещество. Отфильтровывали твердое вещество и сушили под вакуумом с образованием титульного соединения (5,5 г, 77%). ЭС/МС m/z (79Br/81Br) 488/490 (M+1)+. Пример 10 а. 3-[4-Бром-2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил]-2,5-диметил-7-(1 пропилбутил)пиразоло[1,5-a]пиримидина гидрохлорид 3-[4-Бром-2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил]-2,5-диметил-7-(1 пропилбутил)пиразоло[1,5-a]пиримидин (750 мг, 1,54 ммоль) растворяли в ацетоне (5 мл) и добавляли 1 М HCl в диэтиловом эфире (1,84 мл, 1,84 ммоль). Смесь перемешивали при комнатной температуре в течение 3 ч и концентрировали под вакуумом. Остаток растворяли в диэтиловом эфире/гексане=1/1(м, 4H), 1,96 (м, 4H), 0,81 (м, 6H). Указанное ниже соединение получали, по существу, согласно примеру 10. н-Бутил литий (2,5 М раствор в гексане, 0,6 мл, 1,5 ммоль) добавляли в атмосфере азота к раствору 1-метил-1,2,4-триазола (124,5 мг, 1,5 ммоль) в ТГФ (3 мл) при -78C и перемешивали смесь в течение 30 мин. Добавляли безводный хлорид цинка (409 мг, 3,0 ммоль) и продолжали перемешивание в течение 30 мин при постепенном нагревании смеси до комнатной температуры, после чего перемешивали смесь в течение 2 ч. Добавляли 3-(2,4-дибромтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5a]пиримидин (229 мг, 0,5 ммоль) с последующим добавлением тетракис(трифенилфосфин)палладия(58 мг, 0,05 ммоль) и кипятили смесь с обратным холодильником в течение ночи. Охлаждали смесь до комнатной температуры, разбавляли этилацетатом и промывали насыщенным раствором хлорида аммония. Органическую часть сушили над сульфатом натрия, фильтровали и концентрировали. Полученный остаток очищали методом флэш-хроматографии с использованием в качестве элюента гексана:этилацетата (10:2,5) с образованием титульного соединения в виде пены желтого цвета (77 мг). МС (ХИАД) m/z (79Br) 460,4 (M+1)+. Альтернативный способ получения соединения согласно примеру 21. Уксусную кислоту (1 мл) и N-бромсукцинимид (4,1 г, 22 ммоль) добавляли к раствору 7-(1 этилпропил)-2,5-диметил-3-[2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил]пиразоло[1,5-a]пиримидина(8 г, 21 ммоль) в ацетонитриле (80 мл). Смесь перемешивали в течение 2 ч при 22C. Затем выпаривали растворитель и добавляли к полученному остатку воду (50 мл) и метил-трет-бутиловый эфир (100 мл). Отделяли органическую часть, сушили над сульфатом натрия, фильтровали и выпаривали растворитель. Полученный остаток перекристаллизовывали из изопропилового спирта с образованием титульного соединения (8,7 г, 90%). ЭС/МС m/z (79Br/81Br) 460/462 (M+1)+.- 18015179 Пример 12 а. 3-(4-Бром-2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил)-7-(1-этилпропил)-2,5 диметилпиразоло[1,5-a]пиримидин, п-толуолсульфокислота. 3-(4-Бром-2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил)-7-(1-этилпропил)-2,5 диметилпиразоло[1,5-a]пиримидин (50 мг, 0,109 ммоль) растворяли в ацетоне (3 мл). Добавляли 0,25 М водный раствор п-толуолсульфокислоты (434,4 мкл, 0,109 ммоль) и выпаривали полученную смесь до сухого остатка. Для обеспечения частичного растворения твердого вещества добавляли этилацетат(12 мл). Добавляли метанол (1 мл) и получали прозрачный раствор. Концентрировали полученный раствор путем медленного выпаривания, проводимого до появления кристаллов. Полученные кристаллы отделяли фильтрованием и сушили под вакуумом при 25C, при этом получали примерно 50 мг титульного соединения. Стехиометрический состав полученной соли устанавливали с помощью ионной хроматографии с использованием следующих условий проведения анализа методом ВЭЖХ: колонка: Phenomenex Phenosphere SAX, 4,6150 мм при 30C; подвижная фаза: 50% ацетонитрил/50% 0,025 М натрийфосфатный буфер с pH 4,5; расход=1,5 мл/мин; детектирование: УФ при 205 нм; объем вводимой пробы=5 мкл; время проведения анализа=3 мин. Теоретически рассчитанное значение: 27,2% тозилата; найдено: 28,4% тозилата (среднее значение по результатам трех определений методом ВЭЖХ). Пример 13. 4-Хлор-5-[2,5-диметил-7-(1-пропилбутил)пиразоло[1,5-a]пиримидин-3-ил]тиазол-2 илдиметиламин. В высушенную в сушильном шкафу колбу добавляли 4-бром-5-[2,5-диметил-7-(1 пропилбутил)пиразоло[1,5-a]пиримидин-3-ил]тиазол-2-илдиметиламин (0,20, 0,44 ммоль) и безводный ТГФ (3,0 мл) и охлаждали смесь в атмосфере азота до -78C. Медленно добавляли н-бутил лития (1,6 М раствор в гексане, 0,42 мл, 0,67 ммоль) и перемешивали в течение 30 мин. Добавляли одной аликвотойN-хлорсукцинимид (0,120 г, 0,889 ммоль) и перемешивали в течение 30 мин при -78C. После того как реакционная смесь нагревалась до комнатной температуры, смесь перемешивали в течение 5 ч, наблюдая за ходом реакции с помощью ЖХ/МС. Разбавляли смесь этилацетатом (100 мл), промывали насыщенным раствором хлорида аммония (50 мл) и проводили обратную экстракцию водной фазы дихлорметаном(50 мл). Органические фазы объединяли, сушили над безводным сульфатом магния, фильтровали и концентрировали под разрежением. Полученный остаток очищали методом флэш-хроматографии с использованием в качестве элюента ступенчатого градиента от 100% гексана/0% (25% ТГФ/гексан) до 0% гексана/100% (25% ТГФ/гексан) с 10% шагом изменения концентрации и получали твердое вещество белого цвета (0,087 г, 48%). ЭС/МС m/z (35Cl) 406,0 (M+1)+. Указанные ниже соединения получали, по существу, согласно примеру 13 с использованием подходящих бромтиазолов, полученных, как указано выше. Препаративный пример 18. 2,4-Дихлортиазол. Смесь тиазолидин-2,4-диона (50 г, 0,43 моль) в оксихлориде фосфора (240 мл) охлаждали до 5C и добавляли пиридин (34 мл, 0,43 моль) в течение 15 мин. Смесь нагревали до 125C в течение 4 ч, после чего охлаждали до 22C. Удаляли избыток оксихлорида путем перегонки под вакуумом и добавляли полученный остаток в воду (1 л), охлажденную до 5C. Экстрагировали смесь метиленхлоридом(3400 мл). Органические слои объединяли и выпаривали растворитель с образованием титульного соединения (50 г, 76%). ЭИ/МС m/z (35Cl35Cl/35Cl37Cl/37Cl37Cl) 153/155/157 (M+1)+. Препаративный пример 19. 4-Хлор-2-морфолинтиазол. К смеси 2,4-дихлортиазола (34 г, 0,22 моль) в ацетонитриле (425 мл) добавляли карбонат калия(60,9 г, 0,44 моль), а затем морфолин (21,2 мл, 0,225 моль) по каплям в течение 30 мин. Смесь кипятили с обратным холодильником при 40C, после чего охлаждали до 22C. Смесь фильтровали и выпаривали фильтрат. Остаток растирали в порошок с добавлением изопропилового спирта(60 мл) при 22C в течение 1 ч. Твердое вещество отфильтровывали и сушили под вакуумом до постоянной массы с образованием титульного соединения (34,5 г, 76%). ЭС/МС m/z (35Cl) 205 (M+1)+.(116 мг, 0,25 ммоль) растворяли в ТГФ в атмосфере азота (1,5 мл) и охлаждали до -78C. Добавляли нбутил лития (0,1 мл 2,5 М раствор в гексане, 0,25 ммоль) и перемешивали при -78C в течение 30 мин. Добавляли N-хлорсукцинимид (33,4 мг, 0,25 ммоль) и перемешивали смесь в течение еще 30 мин, постепенно нагревая до комнатной температуры. После перемешивания смеси в течение ночи реакцию гасили добавлением насыщенного раствора хлорида аммония и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Полученный сырой продукт очищали методом флэш-хроматографии, используя в качестве элюента смесь гексан:дихлорметан:этилацетат (5:5:2) с образованием титульного соединения (54 мг). МС (ХИАД) m/z (35Cl) 420,6 (M+1)+. 1H ЯМР (400 МГц, CDCl3): 6,44 (с, 1H), 3,79 (т, 4 Н, J=4,8 Гц), 3,63-3,56 (м, 1H), 3,47 (т, 4 Н,J=4,8 Гц), 2,55 (с, 3H), 2,45 (с, 3H), 1,88-1,75 (м, 4H), 0,87 (т, 6H, J=7,5 Гц). Альтернативный способ получения соединения согласно препаративному примеру 6. Смешивали 7-(1-этилпропил)-3-йод-2,5-диметилпиразоло[1,5-a]пиримидин (9 г, 26,2 ммоль) и 4 хлор-2-морфолинтиазол (7,5 г, 36,7 ммоль) в диметилформамиде (90 мл), предварительно дегазированном с помощью азота. Добавляли карбонат цезия (17,8 г, 55 ммоль), йодид меди (250 мг, 1,31 ммоль),трифенилфосфин (550 мг, 2,09 ммоль) и ацетат палладия (117 мг, 0,52 ммоль). Смесь нагревали до 125C в течение 16 ч, после чего охлаждали до 22C. Добавляли воду (900 мл) и экстрагировали метил-третбутиловым эфиром (3200 мл). Органические фазы объединяли и выпаривали растворитель. Полученный остаток очищали методом хроматографии на силикагеле с использованием в качестве элюента гексана/этилацетата (4/1) с образованием титульного соединения (6,4 г, 62%). ЭС/МС m/z (35Cl) 420 (M+1)+. Пример 16 а. 3-(4-Хлор-2-морфолин-4-илтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидина гидрохлорид. 3-(4-Хлор-2-морфолин-4-илтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин(1,40 г, 3,33 ммоль) растворяли в ацетоне (10 мл) при 50C и охлаждали до комнатной температуры. Добавляли соляную кислоту (2 М раствор в диэтиловом эфире, 2,0 мл, 4,0 ммоль) и хорошо перемешивали с помощью ультразвука. Раствор немного концентрировали и добавляли минимальное количество диэтилового эфира для получения HCl соли. Смесь охлаждали в холодильнике в течение ночи. Добавляли дополнительно соляную кислоту (2 М раствор в диэтиловом эфире, 2,0 мл, 4,0 ммоль) и охлаждали в холодильнике. Полученный кристаллический продукт фильтровали и сушили, при этом получали титульное соединение (1,15 г, 75%). ЭС/МС m/z (35Cl) 420 (M+1)+. 1(3 мл) при -78C. Через 30 мин добавляли 1-йодбутан (138 мг, 0,75 ммоль) и продолжали перемешивание в течение 1 ч. Нагревали смесь до комнатной температуры и перемешивали в течение 1 ч. Реакцию гасили добавлением раствора хлорида аммония и экстрагировали этилацетатом. Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали. Полученный сырой продукт очищали методом флэш-хроматографии с использованием в качестве элюента гексана/этилацетата (10/1,5) с образованием титульного соединения в виде пены оранжевого цвета (78 мг). ЭС/МС m/z (81Br) 437,4 (M+1)+. Указанное ниже соединение получали, по существу, согласно примеру 17.- 20015179 Пример 19. 7-(1-Этилпропил)-3-(2-метоксиметилтиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидин. н-Бутил лития (2,5 М раствор в гексане, 0,4 мл, 1,0 ммоль) добавляли в атмосфере азота к раствору 7-(1-этилпропил)-2,5-диметил-3-тиазол-5-илпиразоло[1,5-a]пиримидина (300 мг, 1,0 ммоль) в ТГФ (3 мл) при -78C. Перемешивали смесь в течение 30 мин и добавляли метиловый эфир 1-йодметила (205 мг,1,2 ммоль). Продолжали перемешивание в течение 1 ч, после чего медленно нагревали смесь до комнатной температуры и перемешивали в течение ночи. Реакцию гасили добавлением насыщенного раствора хлорида аммония и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный сырой продукт очищали методом флэш-хроматографии с использованием в качестве элюента гексана/этилацетата (10/2) с образованием титульного соединения в виде пены желтого цвета (184 мг). МС (ХИАД) m/z 345,3 (M+1)+. Пример 20. 3-(4-Хлор-2-метоксиметилтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин. н-Бутил лития (2,5 М раствор в гексане, 174 мл, 0,43 ммоль) добавляли при перемешивании к раствору 7-(1-этилпропил)-3-(2-метоксиметилтиазол-5-ил)-2,5-диметилпиразоло[1,5-a]пиримидина (150 мг,0,43 ммоль) в ТГФ (3 мл) при -78C. Перемешивали смесь в течение 30 мин и добавляли Nхлорсукцинимид (87 мг, 0,653 ммоль). Перемешивали смесь в течение 30 мин, после чего медленно нагревали до комнатной температуры, при этом реакция продолжалась в течение ночи. Гасили реакцию добавлением насыщенного раствора хлорида аммония, экстрагировали этилацетатом, сушили над сульфатом натрия, фильтровали и концентрировали. Полученный остаток очищали методом флэшхроматографии с использованием в качестве элюента гексана/этилацетата (10/2) с образованием титульного соединения (7 мг). МС (ХИАД) m/z (35Cl) 379,3 (M+1)+. Пример 21. 7-(1-Этилпропил)-2,5-диметил-3-[2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил]пиразоло[1,5a]пиримидин. Смешивали 3-(4-бром-2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил)-7-(1-этилпропил)-2,5 диметилпиразоло[1,5-a]пиримидин (175 мг, 0,38 ммоль) и йодид меди(I) (132 мг, 1,33 ммоль) в ДМФ(5 мл) и нагревали до 120C в течение 24 ч. Охлаждали смесь до комнатной температуры, разбавляли этилацетатом и промывали насыщенным солевым раствором. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный сырой продукт очищали методом флэш-хроматографии с использованием в качестве элюента гексана и затем гексана/EtOAc (10/1,8) с образованием твердого вещества желтого цвета (45 мг). ЭС/МС m/z 382,0 (M+1)+. Альтернативный способ получения. н-Бутил лития (2,5 М раствор в гексане, 57,6 мл, 144 ммоль) добавляли к раствору N-метилтриазола(11,95 г, 144 ммоль) в ТГФ (600 мл) при -78C в атмосфере азота, поддерживая температуру смеси в процессе добавления ниже -74C. Затем добавляли сухой порошкообразный хлорид цинка (26 г, 192 ммоль) за один прием и нагревали смесь до 22C в течение 1 ч. Добавляли 7-(1-этилпропил)-3-(2-йодтиазол-5 ил)-2,5-диметилпиразоло[1,5-a]пиримидин (12,5 г, 29 ммоль) и тетракис(трифенил)фосфинпалладиевый катализатор (1,15 г, 0,01 моль) за один прием и кипятили смесь с обратным холодильником в атмосфере азота в течение 8 ч. Охлаждали смесь до 22C и добавляли воду (300 мл). Органический слой отделяли и экстрагировали водный слой метил-трет-бутиловым эфиром (2200 мл). Органические слои объединяли,сушили над сульфатом натрия, фильтровали и выпаривали растворитель. Полученный продукт очищали пропусканием через слой силикагеля с использованием в качестве элюента гексана/этилацетата (4/1) и получали титульное соединение (8 г, 72%). ЭС/МС m/z 382 (M+1)+. Пример 22. 3-(4-Хлор-2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил)-7-(1-этилпропил)-2,5 диметилпиразоло[1,5-a]пиримидин. Смесь 7-(1-этилпропил)-2,5-диметил-3-[2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил)пиразоло[1,5-a]пиримидина (20 мг, 0,052 ммоль) и N-хлорсукцинимида (7,6 мг, 0,0569 ммоль) в дихлорметане(0,5 мл) и ацетонитриле (0,5 мл) перемешивали при комнатной температуре в течение ночи в запаянной колбе и концентрировали. Полученный остаток очищали методом флэш-хроматографии с использованием в качестве элюента гексана и затем гексана/этилацетата (10/1,5) с образованием титульного соединения (16 мг). ЭС/МС m/z (35Cl) 416,0 (M+1)+.- 21015179 Пример 23. 7-(1-Этилпропил)-3-(4-метокси-2-морфолин-4-илтиазол-5-ил)-2,5-диметилпиразоло[1,5a]пиримидин. Смесь 3-(4-бром-2-морфолин-4-илтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5a]пиримидина (162 мг, 0,35 ммоль), метоксида натрия (57 мг, 1,05 ммоль) и йодида меди(I) (67 мг,0,35 ммоль) в метаноле (3 мл) перемешивали в запаянной колбе вместимостью 4 мл в течение 15 ч при 120C. Охлаждали смесь до комнатной температуры, удаляли фильтрованием твердое вещество и концентрировали фильтрат под вакуумом. Полученный остаток очищали методом флэш-хроматографии с использованием в качестве элюента гексана/ТГФ (10/2). Продукт перекристаллизовывали из метанола и получали титульное соединение (20 мг). ЭС/МС m/z 416,0 (M+1)+. Препаративный пример 20. 4-Бром-5-[7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин-3-ил]тиазол-2-карбальдегид. н-Бутил лития (1,6 М раствор в гексане, 0,312 мл, 0,50 ммоль) добавляли в атмосфере азота к раствору 3-(2,4-дибромтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидина (230 мг,0,50 ммоль) в ТГФ (2,5 мл) при -78C и перемешивали смесь в течение 30 мин. Добавляли раствор Nформилморфолина (58 мг, 0,50 ммоль) в ТГФ (0,5 мл). Перемешивали смесь в течение 1 ч и затем выдерживали при -20C в течение ночи. Нагревали реакционную смесь до комнатной температуры, разбавляли эфиром и гасили реакцию добавлением 4 н. HCl (4 мл). Отделяли органический слой и экстрагировали 4 н. HCl (24 мл). Водные слои объединяли, обрабатывали твердым бикарбонатом натрия до достижения pH 8-9, после чего экстрагировали диэтиловым эфиром. Все полученные органические слои объединяли, промывали насыщенным солевым раствором, сушили над сульфатом натрия и фильтровали. Полученный сырой продукт очищали методом флэш-хроматографии с использованием в качестве элюента смеси гексана/дихлорметана/этилацетата (5/5/1) с образованием титульного соединения (154 мг). МС (ХИАД) m/z (81Br) 409,0 (M+1)+. Пример 24. 3-(4-Бром-2-морфолин-4-ил-метилтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5a]пиримидин. Смешивали 4-бром-5-[7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин-3-ил]тиазол-2 карбальдегид (150 мг, 0,368 ммоль), морфолин (35 мг, 0,405 ммоль) и триацетоксиборгидрид натрия(97 мг, 0,46 ммоль) в дихлорметане (3 мл) и метаноле (0,5 мл). Перемешивали смесь в течение ночи, добавляли дополнительно морфолин (35 мг, 0,405 ммоль) и триацетоксиборгидрид натрия (97 мг,0,46 ммоль) и перемешивали в течение еще 4 ч. Удаляли растворитель под вакуумом, разбавляли смесь дихлорметаном и промывали насыщенным солевым раствором. Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный продукт очищали методом флэш-хроматографии с использованием в качестве элюента смеси дихлорметан:2 М раствор аммиака в метаноле (10:1) с образованием смеси. Полученную смесь очищали с помощью обращенно-фазовой колоночной хроматографии с использованием элюента, состав которого изменялся от воды/ацетонитрила(80/20) до воды/ацетонитрила (10/90), и получали титульное соединение (20 мг). ЭС/МС m/z (81Br) 480,0 (M+1)+. Пример 25. 3-(4-Бром-2-пиридин-4-илтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин. н-Бутил лития (1,6 М раствор в гексане, 0,312 мл, 0,5 ммоль) добавляли в атмосфере азота к раствору 3-(2,4-дибромтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидина(229 мг,0,5 ммоль) в ТГФ (4 мл) при -78C. После перемешивания в течение 30 мин добавляли безводный хлорид цинка (264 мг, 1,5 ммоль) и продолжали перемешивание в течение 30 мин. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Добавляли 4-йодпиридин (103 мг,0,5 ммоль) с последующим добавлением хлорида 1,1'-бис-(дифенилфосфино)ферроценпалладия(II) (продукта присоединения дихлорметана) (0,408 мг, 0,05 ммоль). Реакционную смесь кипятили с обратным холодильником в течение ночи. Охлаждали смесь до комнатной температуры, разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали. Полученный сырой продукт очищали методом флэш-хроматографии с использованием в качестве элюента смеси дихлорметан:2 н. раствор аммиака в метаноле (10:0,75) с образованием смеси. Полученную смесь очищали с помощью обращенно-фазовой колоночной хроматографии с использованием элюента, состав которого изменялся от вода:ацетонитрил=80:20 до вода:ацетонитрил=10:90, с образованием титульного соединения (19 мг). ЭС/МС m/z (79Br) 456,0 (M+1)+.- 22015179 Препаративный пример 21. 4-Трифторметилтиазол-2-иламин. Тиомочевину (4,0 г, 52,3 ммоль) и 3-бром-1,1,1-трифторпропан-2-он (5,5 мл, 10 г, 52,3 ммоль) добавляли к этанолу (100 мл) и нагревали при 50C в течение 2 ч. Охлаждали смесь до комнатной температуры и концентрировали до получения сухого остатка. Растворяли полученный остаток в воде и доводили pH раствора до pH 12 с помощью 2 М NaOH, после чего проводили экстракцию диэтиловым эфиром(4). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученный продукт очищали методом хроматографии на силикагеле (CH2Cl2) и получали титульное соединение (6,9 г, 79%). ЭС/МС m/z 169 (M+1)+. Препаративный пример 22. 5-Бром-4-трифторметилтиазол-2-иламина гидробромид. Бром (2,0 мл, 6,28 г, 39,3 ммоль) добавляли по каплям к охлаждаемому на ледяной бане раствору 4 трифторметилтиазол-2-иламина (6,0 г, 35,7 ммоль) в диэтиловом эфире (60 мл). По окончании добавления смесь перемешивали в течение 1 ч, после чего нагревали до комнатной температуры. Твердое вещество отделяли фильтрованием и промывали диэтиловым эфиром с образованием титульного соединения(10,5 г, 90%). ЭС/МС m/z (79Br/81Br) 247/249 (M+1)+. Препаративный пример 23. 5-Бром-2-(2,5-диметилпиррол-1-ил)-4-трифторметилтиазол. Гексан-2,5-дион (3,5 мл, 3,4 г, 30,2 ммоль) добавляли к раствору 5-бром-4-трифторметилтиазол-2 иламин гидрохлорида (9,0 г, 27,4 ммоль) в метаноле (60 мл). Перемешивали смесь при комнатной температуре в течение ночи. Добавляли фосфатный буфер (50 мл, pH 7). Образовавшийся осадок отделяли фильтрованием и промывали водой. Осадок на фильтре растворяли в CH2Cl2 и сушили над сульфатом натрия, после чего фильтровали и концентрировали раствор под вакуумом с образованием титульного соединения (8,2 г, 92%). 1(25 мл) охлаждали на бане из сухого льда. Добавляли по каплям трет-бутил литий (1,7 М раствор в пентане, 8,5 мл, 14,5 ммоль). Перемешивали смесь в течение 45 мин, после чего добавляли по каплям хлорид цинка (0,5 М раствор в ТГФ, 14,6 мл, 7,3 ммоль). Перемешивали в течение 5 мин и убирали охлаждающую баню. Смесь перемешивали в течение 30 мин, после чего добавляли 7-(1-этилпропил)-3-йод-2,5 диметилпиразоло[1,5-a]пиримидин (1,5 г, 4,4 ммоль) и бис-(три-трет-бутилфосфин)палладий(0) (450 мг,0,9 ммоль). Кипятили смесь с обратным холодильником в течение 24 ч. Охлаждали реакционную смесь,выливали в диэтиловый эфир и промывали водой (2). Объединенные водные слои экстрагировали диэтиловым эфиром. Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали до получения сухого остатка под вакуумом. Полученный остаток очищали с помощью хроматографии на силикагеле (75-100% CH2Cl2 в гексане) с образованием титульного соединения (1,47 г,72%). Рассчитанное значение m/z согласно ВПМСВР для C23H26F3N5S+H+: 462,1939, найдено: 462,1915. Пример 27. 5-[7-(1-Этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин-3-ил]-4-трифторметилтиазол-2-иламин. Гидроксиламин (2 мл, 50% раствор в воде) добавляли к раствору 3-[2-(2,5-диметилпиррол-1-ил)-4 трифторметилтиазол-5-ил]-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидина (1,1 г, 2,3 ммоль) в уксусной кислоте (10 мл). Реакционную смесь нагревали до 80C в течение 6 ч, после чего охлаждали до комнатной температуры. Выливали смесь в диэтиловый эфир и промывали 2 М NaOH (2) и один раз водой. Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали до получения сухого остатка под вакуумом. Полученный остаток очищали методом хроматографии на силикагеле(40% раствор этилацетата в гексане) с образованием титульного соединения (0,76 г, 87%). ЭС/МС m/z 384 (M+1)+.- 23015179 Препаративный пример 24. 3-(2-Бром-4-трифторметилтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин. Смесь бромида меди(II) (540 мг, 2,4 ммоль) и трет-бутилнитрита (0,36 мл, 310 мг, 3,0 ммоль) в ацетонитриле (20 мл) нагревали до 60C. Добавляли 5-[7-(1-этилпропил)-2,5-диметилпиразоло[1,5a]пиримидин-3-ил]-4-трифторметилтиазол-2-иламин (755 мг, 2,0 ммоль) в виде твердого вещества. Нагревали реакционную смесь до 80C в течение 2 ч. Охлаждали реакционную смесь, выливали в диэтиловый эфир и экстрагировали водой (3). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом до получения сухого остатка. Полученный остаток очищали методом хроматографии на силикагеле с использованием CH2Cl2 и получали титульное соединение (0,77 г, 87%). ЭС/МС m/z (79Br/81Br) 447, 449 (M+1)+. Пример 28. 5-[7-(1-Этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин-3-ил]-4-трифторметилтиазол-2 илдиметиламин. Запаянную пробирку, содержащую 3-(2-бром-4-трифторметилтиазол-5-ил)-7-(1-этилпропил)-2,5 диметилпиразоло[1,5-a]пиримидин (313 мг, 0,7 ммоль) и диметиламин (2 М раствор в ТГФ, 4 мл,8 ммоль) в метаноле (4 мл), нагревали до 80C в течение 2 ч. Охлаждали реакционную смесь и концентрировали под вакуумом. Полученный остаток очищали методом хроматографии на силикагеле с использованием в качестве элюента 0-30% этилацетата в CH2Cl2 и получали титульное соединение (0,28 г,97%). Рассчитанное значение m/z согласно ВПМСВР для C19H24F3N5S+H+ составляло 412,1770, найдено: 412,1783. Указанное ниже соединение получали, по существу, согласно примеру 28 за исключением того, что реакционную смесь кипятили с обратным холодильником в течение 8 ч.N-5-[7-(1-Этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин-3-ил]-4-трифторметилтиазол-2 илацетамид. Гидроксиламин (50% раствор в воде, 5 мл) добавляли к раствору 3-[2-(2,5-диметилпиррол-1-ил)-4 трифторметилтиазол-5-ил]-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидина (2,4 г, 5,2 ммоль) в уксусной кислоте (25 мл). Реакционную смесь нагревали до 80C в течение 72 ч. Охлаждали смесь до комнатной температуры, выливали в диэтиловый эфир и промывали 2 М NaOH (2) и один раз водой. Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали до получения сухого остатка. Полученный остаток очищали методом колоночной хроматографии с использованием в качестве элюента 40% раствора этилацетата в гексане и получали титульное соединение (0,28 г, 13%). Рассчитанное значение m/z согласно ВПМСВР для C19H22F3N5OS+H+ составляло 426,1575, найдено: 426,1565. Пример 31. трет-Бутиловый эфир трет-Бутиловый эфир (2-аминоэтил)карбаминовой кислоты (0,5 мл, 506 мг, 3,2 ммоль) добавляли к раствору 3-(2-бром-4-трифторметилтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидина (100 мг, 0,22 ммоль) и триэтиламина (0,3 мл, 222 мг, 2,2 ммоль) в метаноле (1 мл). Выпаривали метанол и нагревали смесь до 80C в течение ночи. Охлаждали реакционную смесь до комнатной температуры и концентрировали под вакуумом. Полученный остаток очищали методом колоночной хроматографии с использованием в качестве элюента 10-50% этилацетата в CH2Cl2 и получали титульное соединение (0,11 г, 97%). ЭС/МС m/z 527,2 (M+1)+. Указанное ниже соединение получали, по существу, согласно примеру 31 с использованием подходящего амина.(2-5-[7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин-3-ил]-4 трифторметилтиазол-2-иламиноэтил)карбаминовой кислоты (101 мг, 0,192 ммоль) добавляли к 1 М HCl в метаноле (1 мл). Реакционную смесь нагревали при 70C в течение ночи. Охлаждали реакционную смесь и концентрировали под вакуумом из метанола/этилацетата. Полученный остаток растирали в порошок с добавлением этилацетата и получали титульное соединение (64 мг, 78%). ЭС/МС m/z 427,0 (M+1)+. Указанные ниже соединения получали, по существу, согласно примеру 33. Пример A. Оценка активности in vivo с помощью связывания ex vivo. Оценку активности соединений согласно настоящему изобретению in vivo проводили с помощью связывания ex vivo. Согласно методике, описанной в работе D.R. Gehlert et al., EJP 509: 145-153 (2005),соединение вводили перорально крысам. Далее проводили оценку связывания ex vivo I-саувагина с мозжечком, как описано в работе Gehlert et al. Соединение согласно примеру 15 обеспечивало 65% ингибирование при дозе 10 мг/кг. Пример B. Исследование связывания КРФ 1 с помощью фильтрования. Для устранения ограничений, накладываемых на экспрессию плазмидами КРФ 1 человека, связанных с получением рекомбинантной клеточной линии с плотностью рецепторов, достаточной для проведения исследования связывания, использовали систему ретровирусной экспрессии Phoenix, лицензированную Стэнфордом (Stanford). Для получения мембран и реактивов для проведения связывания(200 мкл) использовали стабильную клеточную линию HEK-hCRF1, при этом использовали следующие реактивы: 50 мкл 125I-саувагина (конечная концентрация 0,2 нМ), 50 мкл соединения и 100 мкл мембран КРФ 1 (25 мг/реакцию). Реакции проводили при инкубировании при комнатной температуре в течение 2 ч, после чего проводили фильтрование через предварительно обработанный фильтрующий 96 луночный планшет FB Millipore из стекловолокна. Содержимое лунок дважды промывали ледяным буфером, используемым для проведения исследования (50 мМ трис, 12,5 мМ NaCl, 1 мМ ЭДТА, 10 мМMgCl2, 0,05% бычьего сывороточного альбумина (BSA), pH 7,2), сушили на воздухе в течение ночи и производили подсчет с помощью 100 мкл Microscint 40 с использованием счетчика MicroBeta. Определение неспецифичного связывания (HCC) проводили в присутствии 0,5 мкМ немеченого саувагина. В общем случае определение проводили три раза и точки, соответствующие среднему результату, наносили на график с помощью Graph Pad Prism.- 25015179 С помощью настоящего исследования было установлено, что соединения согласно настоящему изобретению ингибировали связывание 125I-саувагина (4 нМ) в роллерных/адгезивных клетках, проявляя константу ингибирования Ki менее 1 мкМ. Например, соединение согласно примеру 15 характеризовалось значением Ki, равным 6,2 нМ. Пример C. Исследование связывания КРФ 2 с помощью фильтрования. Для устранения ограничений, накладываемых на экспрессию плазмидами КРФ 2 человека, связанных с получением рекомбинантной клеточной линии с плотностью рецепторов, достаточной для проведения исследования связывания, использовали систему ретровирусной экспрессии Phoenix, лицензированную Стэнфордом (Stanford). Для получения мембран и реактивов для проведения связывания(200 мкл) использовали стабильную клеточную линию HEK-hCRF2, при этом использовали следующие реактивы: 50 мкл 125I-саувагина (конечная концентрация 0,2 нМ), 50 мкл соединения и 100 мкл мембран КРФ 2 (25 мг/реакцию). Реакции проводили при инкубировании при комнатной температуре в течение 2 ч, после чего проводили фильтрование через предварительно обработанный фильтрующий 96 луночный планшет FB Millipore из стекловолокна. Содержимое лунок дважды промывали ледяным буфером, используемым для проведения исследования (50 мМ трис, 12,5 мМ NaCl, 1 мМ ЭДТА, 10 мМMgCl2, 0,05% бычьего сывороточного альбумина (BSA), pH 7,2), сушили на воздухе в течение ночи и производили подсчет с помощью 100 мкл Microscint 40 с использованием счетчика MicroBeta. Определение неспецифичного связывания (HCC) проводили в присутствии 0,5 мкМ немеченого саувагина. Альтернативно, проводили оценку соединений с помощью сцинтилляционного анализа сближения. Указанный анализ проводили с использованием следующих реактивов: 50 мкл 125I-саувагина (конечная концентрация 0,2 нМ), 50 мкл соединения или немеченого саувагина (NSB), 100 мкл раствора, содержащего 250 мкг зерен SPA, содержащих агглютинин пшеничных зародышей, мембраны КРФ 2 (1,5 мкг/реакцию). Планшеты инкубировали в течение 4-5 ч при комнатной температуре, после чего проводили центрифугирование при 200 г в течение 10 мин. Граничные значения радиоактивности определяли с помощью сцинтилляционного счетчика Wallac Trilux. В общем случае определение проводили три раза и точки,соответствующие среднему результату, наносили на график с помощью Graph Pad Prism. Сначала проводили оценку соединений при некоторой установленной концентрации и в случае, если наблюдалась достаточная активность, далее осуществляли построение кривых концентрация-отклик. Конкретные примеры соединений, испытуемых в ходе исследования связывания КРФ 2, проявляли слабое сродство к рецепторам КРФ 2. Например, соединение согласно примеру 15 проявляло 11% ингибирование при концентрации 50 мкМ. Полученные результаты позволяют предположить, что соединения согласно настоящему изобретению обладают избирательным действием в отношении рецептора КРФ 1(по сравнению с КРФ 2). Пример D. Биодоступность и фармакокинетические свойства. Термин "объем распределения" (volume of distribution, Vdist) относится к содержанию лекарственного препарата в организме по сравнению с содержанием указанного лекарственного препарата в крови или плазме. Термин "объем распределения" относится к объему жидкости, необходимому для того, чтобы содержание лекарственного препарата в организме было равным содержанию указанного лекарственного препарата в крови или плазме: Vdist=содержание лекарственного препарата в организме/содержание указанного лекарственного препарата в плазме или крови (Goodman и Gillman's). В случае дозы, равной 10 мг,и концентрации в плазме, равной 10 мг/л, объем распределения равен 1 л. Объем распределения отражает степень содержания лекарственного препарата во внесосудистых тканях. Большой объем распределения указывает на тенденцию соединения связываться с компонентами тканей относительно связывания с белком плазмы крови. В ходе клинических исследований Vdist может использоваться для установления нагрузочной дозы, обеспечивающей получение установившейся концентрации. Для определения объема распределения самцам крыс Спрага-Доули (N=3) однократно вводили внутривенно дозу соединения, составлявшую 1 мг/кг. Образцы плазмы отбирали в моменты времени от 0,08 до 24 ч после введения. Для определения концентрации в плазме проводили анализ образцов плазмы методом ЖХ/МС/МС. Для определения фармакокинетических показателей, включая Vdist и клиренс плазмы (КП), проводили вычисления фармакокинетических показателей для плазмы. Соединения согласно настоящему изобретению предпочтительно обладают хорошими показателями биодоступности. Например, большинство представленных на рынке лекарственных препаратов для лечения заболеваний ЦНС и сердечно-сосудистых заболеваний проявляют Vdist, определенный для человека, составляющий 10 л/кг. По сравнению с такими антагонистами КРФ, как CP154526 (Schulz et al.,Proc. Natl. Acad. Sci. (USA), 93:10477 (1996 и NBI30775 (Chen et al., Drug Development Research, 65:216(2005, для которых Vdist, определенный для крыс, составляет 114 и 76 л/кг соответственно при раздельном определении. Соединение согласно примеру 15 настоящего изобретения при раздельном определении проявляло Vdist, определенный для крыс, составлявший всего 7,2 л/кг после однократного внутривенного введения дозы в 1 мг/кг. Кроме того, клиренс плазмы (КП) является мерой скорости выведения лекарственного препарата из- 26015179 организма. При внутривенном введении и определении кинетических показателей первого порядка клиренс плазмы может быть рассчитан в соответствии со следующим уравнением: КП=доза/AUC, где AUC представляет собой общую площадь фигуры, ограниченной кривой зависимости содержания лекарственного препарата в плазме от времени, от нулевого момента времени до бесконечности. Для используемых для сравнения антагонистов КРФ CP154526 и NBI37582 клиренс плазмы, определенный для крыс, составлял 83 и 306 мл/мин/кг соответственно, при раздельном определении после однократного внутривенного введения дозы соединения, в то время как значение клиренса плазмы для соединения согласно примеру 15 настоящего изобретения, определенное для крыс, при раздельном определении составляло лишь 23,6 мл/мин/кг. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I где R1 и R2 представляют собой независимо этил или н-пропил;Rb представляют собой независимо водород,C1-C3-алкил,H2NCH2CH2-,(CH3)3COC(O)NHCH2CH2- или CH3CH2CH2NHCH2CH2-; или фармацевтически приемлемая соль указанного соединения. 2. Соединение по п.1 или его фармацевтически приемлемая соль, отличающееся тем, что R3 представляет собой Cl, Br, метил или трифторметил. 3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R3 представляет собой Cl или Br. 4. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, отличающееся тем,что R4 представляет собой RaRbN-, пиридин-4-ил, морфолин-4-ил или 5. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, отличающееся тем,что R4 представляет собой морфолин-4-ил или 6. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, отличающееся тем,что R4 представляет собой RaRbN-, а Ra и Rb представляют собой независимо C1-C3-алкил. 7. Соединение по п.1 или его фармацевтически приемлемая соль, представляющее собой 3-[4-бром 2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил]-2,5-диметил-7-(1-пропилбутил)пиразоло[1,5a]пиримидин. 8. Соединение по п.1 или его фармацевтически приемлемая соль, представляющее собой 3-(4-бром 2-(2-метил-2H-[1,2,4]триазол-3-ил)тиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин. 9. Соединение по п.1 или его фармацевтически приемлемая соль, представляющее собой 3-(4-хлор 2-морфолин-4-илтиазол-5-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-a]пиримидин. 10. Фармацевтическая композиция, содержащая соединение по любому из пп.1-9 или его фармацевтически приемлемую соль и фармацевтически приемлемый наполнитель. 11. Применение соединения по любому из пп.1-9 или его фармацевтически приемлемой соли в терапии. 12. Применение соединения по любому из пп.1-9 или его фармацевтически приемлемой соли для лечения тревожности или депрессии. 13. Применение соединения по любому из пп.1-9 или его фармацевтически приемлемой соли для лечения злоупотребления алкоголем или психоактивными веществами.
МПК / Метки
МПК: A61P 29/00, C07D 487/04, A61K 31/505, A61P 25/30, A61P 25/22, A61P 25/24
Метки: тиазолпиразолопиримидин, рецептора, крф1, антагониста, качестве
Код ссылки
<a href="https://eas.patents.su/28-15179-tiazolpirazolopirimidin-v-kachestve-antagonista-receptora-krf1.html" rel="bookmark" title="База патентов Евразийского Союза">Тиазолпиразолопиримидин в качестве антагониста рецептора крф1</a>
Предыдущий патент: Противовирусные производные пиримидиновых нуклеозидов
Следующий патент: Твердый препарат, содержащий алоглиптин и пиоглитазон
Случайный патент: Производные триазоло[4,5-d]пирамидина и их применение в качестве антагонистов пуринового рецептора
































