Фенантреноновые соединения, композиции и способы
Формула / Реферат
1. Соединение формулы (I)
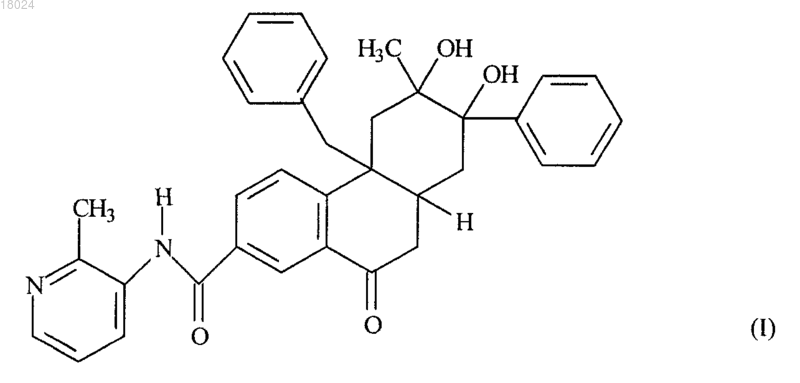
или его фармацевтически приемлемая соль.
2. Соединение по п.1, представляющее собой (4βR,6R,7R,8αS)-4β-бензил-6,7-дигидрокси-6-метил-N-(2-метилпиридин-3-ил)-10-оксо-7-фенил-4β,5,6,7,8,8α,9,10-октагидрофенантрен-2-карбоксамид, или его фармацевтически приемлемая соль.
3. Кальциевая соль соединения по п.2.
4. Натриевая соль соединения по п.2.
5. Фармацевтическая композиция, содержащая соединение по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
6. Композиция по п.5, содержащая фармацевтически эффективное количество (4βR,6R,7R,8αS)-4β-бензил-6,7-дигидрокси-6-метил-N-(2-метилпиридин-3-ил)-10-оксо-7-фенил-4β,5,6,7,8,8α,9,10-октагидрофенантрен-2-карбоксамида или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
7. Способ модуляции глюкокортикоидного рецептора, включающий приведение в контакт глюкокортикоидного рецептора с соединением по п.1 или его фармацевтически приемлемой солью.
8. Способ лечения состояния, опосредованного активностью глюкокортикоидного рецептора, у субъекта, включающий введение указанному субъекту соединения по п.1 или его фармацевтически приемлемой соли.
9. Способ по п.8, где указанное состояние представляет собой состояние, связанное с воспалением.
10. Способ по п.8, где указанное состояние представляет собой астму, дерматит, воспалительное заболевание кишечника, болезнь Альцгеймера, большую психотическую депрессию, невропатию, отторжение трансплантата, рассеянный склероз, хронический увеит или хроническую обструктивную болезнь легких.
11. Способ по п.8, где указанное состояние представляет собой ревматоидный артрит.
12. Способ по п.8, где указанное состояние представляет собой дерматит.
13. Способ по п.8, где указанное состояние представляет собой астму.
14. Способ по п.8, где указанное состояние представляет собой болезнь Альцгеймера.
15. Способ по п.8, где указанное состояние представляет собой воспалительное заболевание кишечника.
16. Способ уменьшения побочных эффектов, связанных с модуляцией глюкокортикоидного рецептора, включающий введение субъекту соединения по п.1.
Текст
Изобретение относится к соединению формулы (I) или его соли, которые являются модуляторами глюкокортикоидного рецептора. Соединение и соли по данному изобретению являются полезными при лечении состояний, опосредованных активностью глюкокортикоидного рецептора. Ракер Пол Винсент (US) Поликарпов А.В., Борисова Е.Н. (RU) Область изобретения Настоящее изобретение включает соединения, которые являются модуляторами глюкокортикоидного рецептора. Настоящее изобретение также включает композиции и способы применения соединений и композиций. Предшествующий уровень техники Модуляторы глюкокортикоидного рецептора представляют собой лиганды глюкокортикоидного рецептора, которые используются для лечения целого ряда состояний из-за их мощной противовоспалительной, антипролиферативной и иммуномодулирующей активности; J. Miner, et al., Expert Opin. Investig.Drugs (2005), 14(12):1527-1545. Примеры модуляторов глюкокортикоидного рецептора включают дексаметазон, преднизон, преднизолон, RU-486 и описанные в WO 2000/66522 и WO 2004/005229. Лечение модуляторами глюкокортикоидного рецептора часто связано с побочными эффектами, такими как разрежение кости и остеопороз. Идентификация модулятора глюкокортикоидного рецептора, который является эффективным,мощным и имеет уменьшенные побочные эффекты, удовлетворяет медицинскую потребность. Краткое изложение сущности изобретения Данное изобретение относится к соединению формулы (I) или его соли. Оно включает соединение 4-бензил-6,7-дигидро-6-метил-N-(2-метилпиридин-3-ил)10-оксо-7-фенил-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксамид или его фармацевтически приемлемую соль. Данное изобретение также относится к композициям, содержащим терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель. Также предложен способ приведения в контакт глюкокортикоидного рецептора с соединением формулы (I). Дополнительно предложены способы лечения состояния, опосредованного активностью глюкокортикоидного рецептора, у субъекта путем введения данному субъекту соединения формулы (I). Подробное описание Это приведенное здесь подробное описание предназначено лишь для ознакомления других специалистов в данной области с изобретениями, принципами и практическими приложениями с тем, чтобы другие специалисты в данной области могли адаптировать и применять изобретения в их многочисленных формах в том виде, в котором они могут наилучшим образом подходить для требований конкретного применения. Эти изобретения, следовательно, не ограничиваются воплощениями, описанными в данном описании изобретения, и могут быть модифицированы. А. Определения. Для следующих определенных терминов следует применять эти определения, если в формуле изобретения или где-нибудь в данном описании изобретения не приведено отличное определение. Термин "носитель" описывает ингредиент в фармацевтической композиции или препарате, отличный от активного фармацевтического соединения. Носители могут быть фармацевтически приемлемым веществом или наполнителем или комбинациями одного или более чем одного вещества и/или наполнителя. Примеры включают жидкие или твердые наполнители, разбавители, эксципиенты, растворители,сорастворители, буферы, консерванты, антиоксиданты, увлажнители, разрыхлители, связующие агенты,суспендирующие агенты, поверхностно-активные вещества, увлажняющие агенты, объемообразующие агенты, полимеры, скользящие вещества, красители, корригенты, подсластители, смазки, влагоудерживающие средства и таблетирующие или инкапсулирующие вещества. Фраза "приведение в контакт с глюкокортикоидным рецептором" означает то, что осуществляется контакт с глюкокортикоидным рецептором in vivo, ex vivo или in vitro, и включает введение соединения или соли по настоящему изобретению субъекту, имеющему глюкокортикоидный рецептор, а также, например, введение соединения или соли по данному изобретению в образец, содержащий клеточный, неочищенный или очищенный препарат, содержащий данный глюкокортикоидный рецептор. Например,приведение в контакт включает взаимодействия между соединением и рецептором, такое как связывание. Фраза "состояние, связанное с воспалением" включает артрит, фибромиалгию, анкилозирующий спондилоартрит, псориаз, системную красную волчанку, подагру, недифференцированную спондилоар-1 018024 тропатию, ювенильный спондилоартрит, болезнь Крона, неспецифический язвенный колит, синдром раздраженного кишечника, воспалительное заболевание кишечника и боль, связанную с вышеупомянутыми состояниями. Конкретные примеры артрита включают ревматоидный артрит, остеоартрит, реактивный артрит, инфекционный артрит, псориатический артрит, полиартрит, ювенильный артрит, ювенильный ревматоидный артрит, ювенильный реактивный артрит и ювенильный псориатический артрит. Термин "модулирование" или "модуляторы" включает антагониста, агониста, частичных антагонистов, частичных агонистов или их смеси либо соотношения. Термин "субъект" относится к любому животному, включая млекопитающих, таких как мыши,крысы, другие грызуны, кролики, собаки, кошки, свиньи, крупный рогатый скот, лошади, приматы или люди. Термин "проведение лечения" (и соответствующие термины "лечить" и "лечение") включает проведение паллиативного, восстановительного и превентивного ("профилактического") лечения субъекта. Термин "проведение паллиативного лечения" относится к лечению, которое облегчает или ослабляет эффект или интенсивность состояния у субъекта без излечения данного состояния. Термин "проведение превентивного лечения" (и соответствующий термин "проведение профилактического лечения") относится к лечению, которое предупреждает появления состояния у субъекта. Термин "проведение восстановительного лечения" ("куративного") относится к лечению, которое останавливает развитие, уменьшает патологические проявления или полностью устраняет состояние у субъекта. Проведение лечения может осуществляться терапевтически эффективным количеством соединения, соли или композиции, которое вызывает биологический или медицинский ответ ткани, системы или субъекта, которого добивается индивидуум, такой как пациент, исследователь, доктор, ветеринар или практикующий врач. Термины "фармацевтически эффективное" или "терапевтически эффективное" относятся к количеству описанного здесь соединения или его соли, которое является достаточным для обеспечения эффективного лечения, как обсуждалось выше. Понятно, что то, что содержит фармацевтически или терапевтически эффективное количество, может быть меньшим количеством данного соединения или соли при его введении в комбинации с другим агентом, чем при одиночном применении. Б. Соединения. Согласно настоящему изобретению предложены трициклические соединения формулы (I). Эти соединения являются полезными в качестве модуляторов глюкокортикоидного рецептора. Настоящее изобретение также включает соединение формулы (II) или его соль. Настоящее изобретение включает соединение 4-бензил-6,7-дигидро-6-метил-N-(2-метилпиридин 3-ил)-10-оксо-7-фенил-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксамид или его фармацевтически приемлемую соль. Также включены соединение (4R,6R,7R,8S)-4-бензил-6,7-дигидрокси-6-метил-N(2-метилпиридин-3-ил)-10-оксо-7-фенил-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксамид или его фармацевтически приемлемая соль. Фармацевтически приемлемые соли соединений по настоящему изобретению включают их соли присоединения кислоты и основные соли (включая дисоли). В одном воплощении настоящее изобретение включает гидрохлоридную соль соединения формулы (I). В другом воплощении настоящее изобретение включает кальциевую соль соединения формулы (I). В другом воплощении настоящее изобретение включает натриевую соль соединения формулы (I). Фармацевтически приемлемые соли присоединения кислоты образованы из кислот, которые образуют нетоксичные соли. Примеры включают следующие соли: ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камсилат, цитрат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид,гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2 напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат,сахарат, стеарат, сукцинат, тартрат, тозилат и трифторацетат. Фармацевтически приемлемые основные соли образованы основаниями, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Для обзора по подходящим солям см. "Handbook of Pharmaceutical Salts: Properties, Selection andUse" от Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Соль может быть легко получена смешиванием растворов соединений по настоящему изобретению и желательной кислоты или основания в зависимости от ситуации. Данная соль может выпадать в осадок из раствора и может быть собрана фильтрованием или может быть выделена выпариванием растворителя. Степень ионизации данной соли может варьировать от полностью ионизированной до почти неионизированной. Соединения по настоящему изобретению можно вводить в виде пролекарств. Таким образом, определенные производные, которые сами по себе могут иметь слабую фармакологическую активность или могут не иметь ее, при введении в организм могут превращаться в соединения по настоящему изобретению, имеющие желательную активность, например, путем гидролитического расщепления. Такие производные именуются "пролекарства". Дополнительную информацию по применению пролекарств можно найти в "Pro-drugs as Novel Delivery Systems", vol. 14, ACS Symposium Series (T. Higuchi and W. Stella) и в"Bioreversible Carriers in Drug Design", Pergamon Press, 1987 (ed. E.В. Roche, American Pharmaceutical Association). Пролекарства, например, можно получать заменой подходящих функциональных групп, присутствующих в соединениях по настоящему изобретению, определенными группировками, известными специалистам в данной области как "прогруппировки", как, например, описано Н. Bundgaard в "Design ofProdrugs" (Elsevier, 1985). Некоторые примеры таких пролекарств включают:(1) где данное соединение содержит спиртовую функциональную группу (-ОН), ее эфир, например замену атома водорода (С 1-С 6)алканоилоксиметилом; и(2) где данное соединение содержит вторичную функциональную аминогруппу, ее амид, например замену атома водорода (С 1-С 10)алканоилом. Фосфатные формы описанных здесь соединений могут быть получены способами, известными в данной области, такими как способы, раскрытые в WO 2008/070149, WO 2008/064274 и WO 2006/078846. Соединение(4 а-бензил-2,3-дигидрокси-3-метил-N-(2-метилпиридин-3-ил)-9-оксо-2-фенил-1,2,3,4,4 а,9,10,10 а-октагидрофенантрен-7-карбоксамидо)метилдигидрофосфат и стереоизомер 2R,3R,4aR10aS)-4 а-бензил-2,3-гидрокси-3 метил-N-(2-метилпиридин-3-ил)-9-оксо-2-фенил-1,2,3,4,4 а,9,10,10 а-октагидрофенантрен-7-карбоксамидо)метилдигидрофосфат можно получить согласно схеме, приведенной ниже Наконец, определенные соединения по настоящему изобретению сами по себе могут действовать как пролекарства других соединений по настоящему изобретению. Например, определенные соединения формулы (I) или (II) возможно рассматривать как пролекарство других соединений, охватываемых формулой (I) или (II). Все изомеры, такие как стереоизомеры, геометрические (цис/транс или Z/E) изомеры и таутомерные формы данных соединений или солей включены в объем настоящего изобретения, включая соединения или соли, имеющие более чем один тип изомерии, и смеси одного или более чем одного из них. Например, следующее описывает соединение формулы (II) и таутомер. Также включены соли присоединения кислоты или основные соли, где противоион является оптически активным, например D-лактат или L-лизин, или рацемическим, например DL-тартрат или DLаргинин. Изомеры могут быть разделены традиционными методиками, хорошо известными специалистам в данной области. Настоящее изобретение включает изотопно меченые соединения, где один или более чем один атом заменен атомами, имеющими то же самое атомное число, но атомную массу или массовое число, отличные от атомной массы или массового числа, обычно обнаруживаемых в природе. Изотопно меченые соединения по данному изобретению обычно можно получить традиционными методиками, известными специалистам в данной области, или способами, аналогичными способам, описанным в сопроводительных примерах и получениях, с использованием подходящего изотопно меченого реагента вместо ранее использованного немеченого реагента. Для лечения состояний, упоминающихся ниже, можно вводить соединения по настоящему изобретению. Также возможно использовать соли соединений по настоящему изобретению. В. Композиции. Соединения или соли по настоящему изобретению могут быть частью композиции. Композиции также могут включать одно или более чем одно соединение или соль по настоящему изобретению. Данная композиция также может включать энантиомерный избыток одного или более чем одного соединения по настоящему изобретению. В данную композицию могут быть включены другие фармакологически активные вещества и носители. Одним воплощением является композиция, содержащая соединение формулы (I) или его соль. Другим воплощением является композиция, содержащая соединение формулы (I) или его соль и носитель. Например, данный носитель может быть эксципиентом. Выбор эксципиента в большой степени будет зависеть от таких факторов, как конкретный способ введения, эффект эксципиента на растворимость и стабильность и природа данной лекарственной формы. Данная композиция может быть твердой, жидкой или обоих видов и может быть приготовлена в виде препарата с соединением в виде композиции в стандартной дозе, например таблетки, которая может содержать от 0,05 до 95 мас.% активных соединений. Соединения или соли по настоящему изобретению могут быть связаны с подходящими полимерами или другими носителями лекарственных средств. Г. Способы. Настоящее изобретение включает способ приведения в контакт глюкокортикоидного рецептора с соединением или солью по настоящему изобретению. Настоящее изобретение также включает способ лечения состояния, опосредованного активностью глюкокортикоидного рецептора, у субъекта, включающий введение данному субъекту соединения или соли по настоящему изобретению. Состояние, опосредованное активностью глюкокортикоидного рецептора, включает: а) эндокринные расстройства, такие как первичная или вторичная адренокортикоидная недостаточность, врожденная гиперплазия надпочечников, негнойный тиреоидит и гиперкальцемия, связанная с раковым заболеванием; б) ревматические расстройства, такие как псориатический артрит, ревматоидный артрит, включая ювенильный ревматоидный артрит, анкилозирующий спондилоартрит, острый и подострый бурсит, острый неспецифический тендосиновит, острый подагрический артрит, посттравматический остеоартрит,синовит при остеоартрите и эпикондилит; в) коллагеновые заболевания, такие как системная красная волчанка и острый ревматический кардит; г) дерматологические состояния, такие как пузырчатка, буллезный герпетиформный дерматит, тяжелая полиморфная эритема (синдром Стивенса-Джонсона), эксфолиативный дерматит, грибовидный микоз, псориаз и себорейный дерматит; д) аллергические состояния, такие как сезонные или круглогодичные аллергии, аллергический ринит, бронхиальная астма, контактный дерматит, атопический дерматит, сывороточная болезнь и реакции гиперчувствительности на лекарственные средства; е) глазные заболевания и состояния, такие как аллергические краевые язвы роговицы, глазной герпес, воспаление переднего отрезка, диффузный задний увеит и хороидит, хронический увеит, симпатическая офтальмия, аллергический конъюнктивит, кератит, хориоретинит, неврит зрительного нерва, ирит и иридоциклит; ж) респираторные заболевания, такие как симптоматический саркоидоз, эозинофильная пневмония,бериллиоз, прогрессирующий или острый милиарный туберкулез легких и аспирационная пневмония; з) гематологические расстройства, такие как идиопатическая тромбоцитопеническая пурпура, вторичная тромбоцитопения, приобретенная (аутоиммунная) гемолитическая анемия, эритробластопения(анемия эритроцитов) и врожденная (эритроидная) гипопластическая анемия; и) неопластические заболевания, такие как лейкоз и лимфома; к) отечные состояния, такие как индуцирующие диурез или протеинурию при нефротическом син-4 018024 дроме, без уремии, идиопатического типа или обусловленные красной волчанкой; л) желудочно-кишечные заболевания, такие как неспецифический язвенный колит, регионарный энтерит, воспалительное заболевание кишечника, болезнь Крона, гастрит, синдром раздраженного кишечника; м) разнородные состояния, такие как туберкулезный менингит и трихиноз; и н) неврологические состояния, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, боковой амиотрофический склероз, повреждение спинного мозга, большая психотическая депрессия и периферическая невропатия. Состояние, опосредованное активностью глюкокортикоидного рецептора, также включает отторжение трансплантата (например, почки, печени, сердца, легкого, поджелудочной железы (например, островков Лангерганса, костного мозга, роговицы, тонкого кишечника, аллотрансплантатов кожи, гомотрансплантатов кожи (таких как применяемые при лечении ожогов), ксенотрансплантатов клапанов сердца, сывороточную болезнь и болезнь "трансплантат против хозяина", аутоиммунные заболевания,такие как ревматоидный артрит, псориатический артрит, рассеянный склероз, диабет типа I и типа II,ювенильный диабет, ожирение, астму, воспалительное заболевание кишечника (такое как болезнь Крона и неспецифический язвенный колит), гангренозную пиодермию, волчанку (системную красную волчанку), миастению гравис, псориаз, дерматит, дерматомиозит, экзему, себорею, воспаление легких, увеит глаза, гепатит, диффузный токсический зоб, тиреоидит Хашимото, аутоиммунный тиреоидит, синдром Бехчета или Шегрена (сухие глаза/рот), пернициозную или иммуногемолитическую анемию, атеросклероз, болезнь Аддисона (аутоиммунное заболевание надпочечников), идиопатическую недостаточность надпочечников, аутоиммунное полигландулярное заболевание (также известное как аутоиммунный полигландулярный синдром), гломерулонефрит, склеродермию, очаговую склеродермию, лишай Вильсона,витилиго (депигментация кожи), круговую алопецию, аутоиммунную алопецию, аутоиммунный гипопитуитаризм, синдром Гийена-Барре и альвеолит; аллергические заболевания, опосредованные Т-клетками,включая контактную аллергию, аллергическую реакцию замедленного типа, контактный дерматит(включая контактный дерматит, вызванный сумахом), крапивницу, аллергические реакции кожи, респираторные аллергические реакции (сенная лихорадка, аллергический ринит) и глютензависимую энтеропатию (целиакия); воспалительные заболевания, такие как остеоартрит, острый панкреатит, хронический панкреатит, острый респираторный дистресс-синдром, синдром Сезари и сосудистые заболевания, которые имеют воспалительный и/или пролиферативный компонент, такие как рестеноз, стеноз и артросклероз. Состояние, опосредованное активностью глюкокортикоидного рецептора, также включает: а) астму любого типа, этиологии или патогенеза, в частности астму, выбранную из группы, состоящей из атопической астмы, неатопической астмы, аллергической астмы, атопической бронхиальной IgEопосредованной астмы, бронхиальной астмы, идиопатической астмы, истинной астмы, эндогенной астмы, вызванной патофизиологическими нарушениями, экзогенной астмы, вызванной факторами окружающей среды, идиопатической астмы неизвестного или неочевидного происхождения, неатопической астмы, бронхитной астмы, эмфизематозной астмы, астмы, вызванной физическими упражнениями, астмы, вызванной аллергеном, астмы, вызванной холодным воздухом, профессиональной астмы, инфекционной астмы, вызванной бактериальной, грибковой, протозойной или вирусной инфекцией, неаллергической астмы, начальной стадии астмы, стридора новорожденных и бронхиолита; б) хронический или острый бронхостеноз, хронический бронхит, обструкцию малых дыхательных путей и эмфизему; в) обструктивные или воспалительные заболевания дыхательных путей любого типа, этиологии или патогенеза, в частности обструктивное или воспалительное заболевание дыхательных путей, выбранное из группы, состоящей из хронической эозинофильной пневмонии, хронической обструктивной болезни легких (ХОБЛ), ХОБЛ, которая включает хронический бронхит, легочную эмфизему или диспное, связанное или не связанное с ХОБЛ, ХОБЛ, которая характеризуется необратимой прогрессирующей обструкцией дыхательных путей, респираторного дистресс-синдрома взрослых (ARDS), обострения гиперреактивности дыхательных путей после терапии другим лекарственным средством и заболевания дыхательных путей, которое связано с легочной гипертензией; г) бронхит любого типа, этиологии или патогенеза, в частности бронхит, выбранный из группы, состоящей из острого бронхита, острого ларинго-трахеального бронхита, арахинового бронхита, катарального бронхита, крупозного бронхита, сухого бронхита, инфекционного астматического бронхита, продуктивного бронхита, стафилококкового или стрептококкового бронхита и везикулярного бронхита, острого поражения легкого; д) бронхоэктаз любого типа, этиологии или патогенеза, в частности бронхоэктаз, выбранный из группы, состоящей из цилиндрического бронхоэктаза, мешотчатого бронхоэктаза, веретенообразного бронхоэктаза, капиллярного бронхоэктаза, кистозного бронхоэктаза, сухого бронхоэктаза и фолликулярного бронхоэктаза. Другое воплощение включает применение соединения или соли по настоящему изобретению для использования при лечении обструктивных или воспалительных заболеваний дыхательных путей любого типа, этиологии или патогенеза, в частности обструктивного или воспалительного заболевания дыхательных путей, выбранного из группы, состоящей из хронической эозинофильной пневмонии, хронической обструктивной болезни легких (ХОБЛ), ХОБЛ, которая включает хронический бронхит, легочную эмфизему или диспное, связанное или несвязанное с ХОБЛ, ХОБЛ, которая характеризуется необратимой прогрессирующей обструкцией дыхательных путей, респираторного дистресс-синдрома взрослых(ARDS), обострения гиперреактивности дыхательных путей после терапии другим лекарственным средством и заболевания дыхательных путей, которое связано с легочной гипертензией, или астмы любого типа, этиологии или патогенеза, в частности астмы, выбранной из группы, состоящей из атопической астмы, неатопической астмы, аллергической астмы, атопической бронхиальной lgE-опосредованной астмы, бронхиальной астмы, идиопатической астмы, истинной астмы, эндогенной астмы, вызванной патофизиологическими нарушениями, экзогенной астмы, вызванной факторами окружающей среды, идиопатической астмы неизвестного или неочевидного происхождения, неатопической астмы, бронхитной астмы, эмфизематозной астмы, астмы, вызванной физическими упражнениями, астмы, вызванной аллергеном, астмы, вызванной холодным воздухом, профессиональной бронхиальной астмы, инфекционной астмы, вызванной бактериальной, грибковой, протозойной или вирусной инфекцией, неаллергической астмы, ранней стадии астмы, стридора новорожденных и бронхиолита. Настоящее изобретение включает способ лечения состояния, связанного с воспалением, у субъекта,включающий введение данному субъекту соединения или соли по настоящему изобретению. Настоящее изобретение включает способ лечения у субъекта состояний, таких как астма, дерматит,воспалительное заболевание кишечника, болезнь Альцгеймера, большая психотическая депрессия, невропатия, отторжение трансплантата, рассеянный склероз, хронический увеит или хроническая обструктивная болезнь легких, включающий введение данному субъекту соединения или соли по настоящему изобретению. Настоящее изобретение включает способ лечения ревматоидного артрита у субъекта, включающий введение данному субъекту соединения или соли по настоящему изобретению. Ревматоидный артрит считается хроническим аутоиммунным и воспалительным заболеванием, являющимся причиной воспаленных суставов, которые в конечном счете набухают, становятся болезненными и претерпевают деградацию хряща, кости и связок данного сустава. Результатом ревматоидного артрита является деформируемость, нестабильность, ригидность сустава и рубцевание в пределах сустава. Данные суставы разрушаются с сильно варьирующей скоростью. На картину заболевания могут влиять многие факторы, включая генетическую предрасположенность. Люди с ревматоидным артритом могут иметь мягкое течение, периодические вспышки с длительными периодами ремиссии без заболевания,или постоянно прогрессирующее заболевание, которое может развиваться медленно или быстро. Ревматоидный артрит может начинаться неожиданно с одновременным воспалением многих суставов. Чаще он начинается едва ощутимо, постепенно поражая разные суставы. Обычно воспаление является симметричным, поражая суставы на обеих сторонах тела. Типично, сперва воспаляются мелкие суставы в пальцах рук, пальцах ног, кистях, ступнях, запястьях, локтях и лодыжках с последующим воспалением суставов коленей и бедер. Боль, связанная с ревматоидным артритом, типично представляет собой соматическую ноцицептивную боль. Распухшие запястья могут защемлять нерв и приводить к онемению или пощипыванию,обусловленным запястным синдромом. Под пораженными коленями могут развиваться кисты, которые могут разрываться, вызывая боль и припухлость голеней. Настоящее изобретение включает способ лечения дерматита у субъекта, включающий введение данному субъекту соединения или соли по настоящему изобретению. Настоящее изобретение включает способ лечения хронической обструктивной болезни легких у субъекта, включающий введение данному субъекту соединения или соли по настоящему изобретению. Настоящее изобретение включает способ лечения астмы у субъекта, включающий введение данному субъекту соединения или соли по настоящему изобретению. Настоящее изобретение включает способ лечения болезни Альцгеймера у субъекта, включающий введение данному субъекту соединения или соли по настоящему изобретению. Настоящее изобретение включает способ уменьшения побочных эффектов, связанных с модуляцией глюкокортикоидного рецептора, включающий введение субъекту соединения формулы (I). Настоящее изобретение включает способ уменьшения побочных эффектов, связанных с лечением преднизолоном, включающий введение субъекту соединения формулы (I). Настоящее изобретение дополнительно включает способы лечения вышеупомянутых состояний,заболеваний и расстройств у субъекта или субъекта, восприимчивого к такому состоянию, путем введения данному субъекту одного или более чем одного соединения или соли по настоящему изобретению. В одном воплощении вышеупомянутое лечение представляет собой превентивное лечение. В другом воплощении вышеупомянутое лечение представляет собой паллиативное лечение. В другом воплощении вышеупомянутое лечение представляет собой восстановительное лечение. Д. Дозировка и введение. Для выбора наиболее подходящей лекарственной формы и пути введения для лечения предложен-6 018024 ного показания соединения или соли по данному изобретению можно проанализировать на их биофармацевтические свойства, такие как растворимость и стабильность раствора (в интервале рН), и проницаемость. Дозы соединений или солей по данному изобретению варьируют от 0,1 до 100 мг для перорального введения и дозы варьируют от 2 мг или менее для введения ингаляцией. Данная доза может быть введена в однократной дозе или в двух или более чем двух раздельных дозах и может находиться вне приведенного здесь типичного интервала. Дозировки основаны на среднем человеческом субъекте, имеющем массу тела примерно от 60 до 70 кг. Дозирование и схема дозирования зависят от субъекта и целого ряда условий, которые могут влиять на дозирование (возраст, пол, масса тела и т.д.). Врач или другой профессионал в области медицины легко сможет определить дозы для субъектов, чьи массы находятся вне этого интервала, таких как младенцы и пожилые люди. Пероральное введение. Соединения по настоящему изобретению и их соли можно вводить перорально. Пероральное введение может включать проглатывание, так что данное соединение или соль проникают в желудочнокишечный тракт, и/или щечное, язычное или подъязычное введение, посредством которых данное соединение или соль поступают в кровоток непосредственно изо рта. Препараты, подходящие для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или твердые капсулы, содержащие мульти- или наночастицы, жидкости или порошки; лепешки (включая лепешки, заполненные жидкостью); жевательные резинки; гели; быстро диспергирующие лекарственные формы; пленки; овули; спреи и щечные/мукоадгезивные пластыри. Дополнительно, соединение или соли по данному изобретению можно вводить в виде высушенной распылением дисперсии. Жидкие препараты включают суспензии, растворы, сиропы и эликсиры. Такие препараты можно использовать в качестве наполнителей в мягких или твердых капсулах (сделанных, например, из желатина или гидроксипропилметилцеллюлозы), и типично они содержат носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло и один или более чем один эмульгатор и/или суспендирующий агент. Жидкие препараты также могут быть получены путем растворения твердого препарата, например, из саше. Соединения по данному изобретению и их соли также можно использовать в быстрорастворимых,быстрораспадающихся лекарственных формах, таких как лекарственные формы, описанные у Liang andChen (2001) в Expert Opinion in Therapeutic Patents, 11(6), 981-986. Для лекарственных форм в виде таблетки, в зависимости от дозы, лекарственное средство может составлять от 1 до 80 мас.% данной лекарственной формы, более типично от 5 до 60 мас.% данной лекарственной формы. Помимо лекарственного средства таблетки обычно содержат разрыхлитель. Примеры разрыхлителей включают натрий крахмал гликолят, натрийкарбоксиметилцеллюлозу, кальцийкарбоксиметилцеллюлозу, натрий кроскармеллозу, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, замещенную низшими алкилами, крахмал, прежелатинизированный крахмал и натрия альгинат. В общем, данный разрыхлитель будет составлять от 1 до 25 мас.%, предпочтительно от 5 до 20 мас.% данной лекарственной формы. Связующие вещества обычно используют для придания препарату в виде таблетки когезивных свойств. Подходящие связующие вещества включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические камеди, поливинилпирролидон, прежелатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводная и тому подобное), маннит, ксилит,декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и двухосновный фосфат кальция дигидрат. Таблетки также возможно могут содержать поверхностно-активные агенты, такие как натрия лаурилсульфат и полисорбат 80, и скользящие вещества, такие как диоксид кремния и тальк. Поверхностно-активные агенты, если присутствуют, могут составлять от 0,2 до 5 мас.% таблетки и скользящие вещества могут составлять от 0,2 до 1 мас.% таблетки. Таблетки также обычно содержат смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазывающие вещества обычно составляют от 0,25 до 10 мас.%, предпочтительно от 0,5 до 3 мас.% таблетки. Другие возможные ингредиенты включают антиоксиданты, красители, корригенты, консерванты и агенты, маскирующие вкус. Типичные таблетки содержат вплоть до примерно 80% лекарственного средства, от примерно 10 до примерно 90 мас.% связующего вещества, от примерно 0 до примерно 85 мас.% разбавителя, от примерно 2 до примерно 10 мас.% разрыхлителя и от примерно 0,25 до примерно 10 мас.% смазывающего вещества. Твердые препараты для перорального введения могут быть приготовлены в виде препарата немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают препараты отложенного, замедленного, импульсного, контролируемого, направленного и запрограммированного высвобождения. Подходящие препараты модифицированного высвобождения для целей данного изобретения описаны в патенте США 6106864. Подробности других подходящих технологий высвобождения, таких как высокоэнергетические дисперсии и осмотические и покрытые частицы, можно найти у Verma et al.(2001) в Pharmaceutical Technology On-line, 25(2), 1-14. Интервалы дозы для перорального введения также включают от 0,1 до 80 мг, от 15 до 80 мг, от 0,1 до 25 мг. Парентеральное введение. Соединения или соли по данному изобретению также можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Пример 2 возможно вводить в кровоток. Подходящие способы парентерального введения включают внутривенное, внутриартериальное, внутрибрюшинное, внутриоболочечное, внутрижелудочковое, внутриуретральное, внутристернальное, внутричерепное, внутримышечное,внутрисуставное и подкожное. Подходящие устройства для парентерального введения включают игольные (включая микроигольные) инъекторы, безыгольные инъекторы и инфузионные устройства. Парентеральные препараты типично представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферы (предпочтительно до рН от 3 до 9), но, для некоторых применений, они могут быть приготовлены в виде препарата более подходящим способом как стерильный неводный раствор или в виде высушенной формы для применения в сочетании с подходящим наполнителем, таким как стерильная апирогенная вода. Получение парентеральных препаратов в стерильных условиях, например, путем лиофилизации можно легко осуществить с использованием стандартных фармацевтических методик, хорошо известных специалистам в данной области. Растворимость соединений по настоящему изобретению и их солей, используемых при получении парентеральных растворов, можно увеличить применением подходящих методик получения препаратов,таких как включение агентов, улучшающих растворимость. Препараты для парентерального введения могут быть приготовлены в виде препаратов немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают препараты отложенного, замедленного, импульсного, контролируемого, направленного и запрограммированного высвобождения. Таким образом, соединения по данному изобретению можно приготовить в виде препарата как суспензию или как твердое вещество, полутвердую или тиксотропную жидкость для введения в виде имплантированного депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких препаратов включают стенты, покрытые лекарственным средством, полутвердые (препараты) и суспензии, содержащие микросферы поли(dl-молочнойсогликолевой)кислоты (PGLA), загруженные лекарственным средством. Местное введение. Соединения или соли по данному изобретению также можно вводить местно, (внутри)кожно или чрескожно на кожу или слизистую оболочку. Пример 1 можно вводить в кожу. Типичные препараты для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки,пластыри для кожи, облатки, импланты, губки, волокна, бинты и микроэмульсии. Также можно использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть включены усилители проникновения, см., например, Finnin and Morgan (October, 1999) J. Pharm. Sci, 88 (10), 955-958. Другие средства местного введения включают доставку электропорацией, ионофорезом, фонофорезом, сонофорезом и микроигольную или безыгольную (например, Powderject, Bioject и т.д.) инъекцию. Препараты для местного введения могут быть приготовлены в виде препаратов немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают препараты отложенного, замедленного, импульсного, контролируемого, направленного и запрограммированного высвобождения. Ингаляциониое/интраназальное введение. Соединения или соли по данному изобретению также можно вводить в нос или путем ингаляции,типично в форме сухого порошка (либо одного, либо в виде смеси, например в сухой смеси с лактозой,или в виде смешанных компонентных частиц, например смешанных с фосфолипидами, такими как фосфатидилхолин) из порошкового ингалятора, в виде аэрозольного спрея из контейнера под давлением,насоса, пульверизатора, атомайзера (предпочтительно атомайзера с использованием электродинамики для продукции мелких капелек) или небулайзера с применением или без применения подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан, или в виде капель для носа. Для применения в нос данный порошок может содержать биоадгезивный агент, например хитозан или циклодекстрин. Контейнер под давлением, насос, пульверизатор, атомайзер или небулайзер содержат раствор или суспензию соединения(ий) по изобретению, содержащие, например, этанол, водный этанол или подхо-8 018024 дящий альтернативный агент для диспергирования, солюбилизации или продления высвобождения активного агента, пропеллент(ты) в качестве растворителя и, возможно, поверхностно-активное вещество,такое как сорбитан триолеат, олеиновая кислота или олигомолочная кислота. Перед применением в препарате в виде сухого порошка или суспензии данный лекарственный продукт микронизируют до размера, подходящего для доставки путем ингаляции (типично меньше чем 5 мкм). Этого можно достигнуть любым подходящим способом измельчения, таким как размол на спиральной струйной мельнице, размол на струйной мельнице с псевдоожиженным слоем, переработка сверхкритической жидкости с образованием наночастиц, гомогенизация под высоким давлением или сушка распылением. Капсулы (сделанные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры и картриджи для применения в ингаляторе или инсуффляторе могут быть приготовлены в виде препарата с содержанием смеси порошка соединения по изобретению, подходящей основы порошка, такой как лактоза или крахмал, и модификатора эффективности, такого как L-лейцин, маннит или стеарат магния. Лактоза может быть безводной или находиться в форме моногидрата, предпочтительно последней. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящий препарат раствора для применения в атомайзере с использованием электрогидродинамики может содержать соединение по настоящему изобретению, пропиленгликоль, стерильную воду,этанол и хлорид натрия. Альтернативные растворители, которые можно использовать вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Препараты для введения путем ингаляции/введения в нос можно приготовить в виде препарата немедленного и/или модифицированного высвобождения, например, с использованием PGLA. Препараты модифицированного высвобождения включают препараты отложенного, замедленного, импульсного,контролируемого, направленного и запрограммированного высвобождения. В случае порошковых ингаляторов и аэрозолей единица дозирования определяется посредством клапана, который доставляет отмеренное количество. Единицы согласно данному изобретению типично организованы для доставки отмеренной дозы или "впрыск", который можно вводить в одной дозе или,более обычно, в виде раздельных доз в течение суток. Интервалы дозы для введения путем ингаляции варьируют от 2 до менее чем 1 мг или менее. Комбинация. Соединения или соли по данному изобретению можно вводить в комбинации с одним или более чем одним терапевтическим агентом, таким как лекарственное средство. Соединение по настоящему изобретению или его соль можно вводить в то же самое время или в другое время, что и один или более чем один другой терапевтический агент. Например, термин "в комбинации" включает одновременное введение комбинации соединения или соли по данному изобретению и терапевтического агента субъекту, когда такие компоненты приготовлены совместно в виде препарата в стандартной лекарственной форме, которая высвобождает указанные компоненты в организме указанного субъекта, по существу, в то же самое время; по существу, одновременное введение комбинации соединения или соли по данному изобретению и терапевтического агента субъекту, нуждающемуся в таком лечении, когда такие компоненты приготовлены в виде препарата отдельно друг от друга в раздельных лекарственных формах, которые указанный субъект принимает, по существу, в то же самое время, вследствие чего указанные компоненты высвобождаются в организме указанного субъекта, по существу, в то же самое время; последовательное введение комбинации соединения или соли по данному изобретению и терапевтического агента субъекту, когда такие компоненты приготовлены в виде препарата отдельно друг от друга в раздельных лекарственных формах, которые указанный субъект принимает в последовательные моменты времени со значительным интервалом времени между каждым введением, вследствие чего указанные компоненты высвобождаются в организме указанного субъекта, по существу, в разные моменты времени; и последовательное введение такой комбинации соединения или соли по данному изобретению и терапевтического агента субъекту, когда такие компоненты совместно приготовлены в виде препарата в стандартной лекарственной форме, которая высвобождает указанные компоненты контролируемым образом, при этом указанный субъект вводит их одновременно, последовательно и/или с перекрыванием во времени, в тот же самый и/или в разные моменты времени, где каждая часть может быть введена либо тем же самым, либо другим путем. Например, соединения или соли по настоящему изобретению можно использовать в комбинации,частично или полностью, в дополнение других противовоспалительных агентов. Примеры фармацевтических агентов, которые можно использовать в комбинации с описанными здесь соединениями и солями,включают ингибиторы TNF (фактор некроза опухоли-альфа), ингибиторы СОХ-2 (циклооксигеназа-2),ингибиторы 5-липоксигеназы, агонисты рецептора лейкотриенов, ингибиторы PDE4 (фосфодиэстераза 4), антигистаминные ингибиторы H1, антагонисты гастропротекторного рецептора H2, миметики инсулиноподобного фактора роста типа 1 (IGF-1), ингибиторы металлопротеаз матрикса, нестероидные противовоспалительные агенты, ингибиторы р 38, ингибиторы Р 2 Х 7, ингибиторы 2, противовирусные агенты и другие агенты, описанные на с. 32-38 WO 2004/005229. Е. Применение в изготовлении композиции или лекарственного средства. В одном воплощении настоящее изобретение включает способы получения композиции или лекарственного средства, содержащего соединения или соли по настоящему изобретению, для применения при лечении состояния, опосредованного активностью глюкокортикоидного рецептора. В другом воплощении данное изобретение включает применение одного или более чем одного соединения или соли по настоящему изобретению при получении композиции или лекарственного средства против воспаления, состояния, связанного с воспалением, ревматоидного артрита, дерматита, болезни Альцгеймера. Настоящее изобретение также включает применение одного или более чем одного соединения или соли по настоящему изобретению для изготовления композиции или лекарственного средства для лечения одного или более чем одного состояния, подробно описанного в разделе способов. Ж. Схемы. Соединения по настоящему изобретению можно получить с использованием способов, проиллюстрированных в общих схемах синтеза и экспериментальных методиках, подробно описанных ниже. Реакции приведенных здесь способов синтеза проводят в подходящих растворителях, которые легко могут быть выбраны специалистом в области органического синтеза, причем указанные подходящие растворители обычно представляют собой любой растворитель, который, по существу, является нереактивным с исходными веществами (реагентами), промежуточными соединениями или продуктами при температурах, при которых проводятся данные реакции. Данную реакцию можно проводить в одном растворителе или в смеси более чем одного растворителя. В зависимости от конкретной стадии реакции могут быть выбраны подходящие растворители для конкретной стадии реакции. Получение соединений по данному изобретению может включать защиту и снятие защиты с разных химических групп. Необходимость защиты и снятия защиты и выбор подходящих защитных групп легко может сделать специалист в данной области. Химию защитных групп можно найти, например, в T.W.(1999), которая включена сюда посредством ссылки во всей ее полноте. За реакциями можно следить согласно любому подходящему способу, известному в данной области. Например, образование продукта можно отслеживать спектроскопическими способами, такими как спектроскопия ядерного магнитного резонанса (например, 1 Н или 13 С), инфракрасная спектроскопия,спектрофотометрия (например, в УФ-видимой области) или масс-спектрометрия, или посредством хроматографии, такой как высокоэффективная жидкостная хроматография (ВЭЖХ) или тонкослойная хроматография. Используемые здесь исходные вещества либо имеются в продаже, либо могут быть получены общепринятыми способами синтеза. Данные общие схемы синтеза представлены с целью иллюстрации и не предназначены для того,чтобы быть ограничивающими. 1(R)-Бензил-5-бром-9(S)-гидро-10(R)-гидрокси-10(R)-метил-трицикло[7.3.1.02,7]тридека-2,4,6-триен-13 он формулы А-8 получали с использованием протокола, описанного на схеме А, который в общем раскрыт в Соединение В-1, 7-бром-2-этокси-3,4,4,9-тетрагидро-4-(фенилметил)-(4S)-фенантрен можно получить, как описано в европейских патентных заявках ЕР 1201649 и ЕР 1201660 (обе принадлежат Liu Исходное вещество А-8 (450 г; 1,17 моль) растворяли в этаноле (4,5 л) при температуре окружающей среды. Добавляли 21% этоксид натрия в этаноле (44 мл; 0,12 моль) и данную смесь нагревали до температуры дефлегмации в течение 3 ч. Как только исходное вещество А-8 было израсходовано, данную реакционную смесь охлаждали до -25 С. К данной смеси медленно добавляли ацетилхлорид (250 мл; 3,51 моль), поддерживая температуру около -25 С. После завершения добавления смесь нагревали до 0 С и выдерживали при данной температуре, пока не расходовался промежуточный енон. Данная смесь представляла собой суспензию в этот момент времени. К смеси добавляли 21% этоксид натрия в этаноле(1,31 л; 3,51 моль), поддерживая температуру от -5 до 5 С. Если данная смесь не была основной, добавляли дополнительное количество этоксида натрия. Температуру данной смеси повышали до 25 С и затем разводили ее водой (5,9 л). Смесь фильтровали и твердое вещество промывали водой (3 х). Соединение,указанное в заголовке (440 г; 85% площади) получали в виде бежевого твердого вещества. 1 Н ЯМР(S)-4-Бензил-7-бром-2-этокси-3,4,4,9-тетрагидрофенантрен (1270 г; 3,2 моль; 85% площади, который можно получить, как описано в получении 1) растворяли в толуоле (6,45 л). Добавляли этиленгликоль (898 мл; 16,1 моль) и пара-толуолсульфоновую кислоту (6,1 г; 0,03 моль) и данную реакционную смесь нагревали до температуры дефлегмации. Растворитель (1 л) отгоняли из данной смеси и заменяли свежим толуолом (1 л). Это процесс перегонки повторяли еще два раза. Каждый раз добавляли дополнительное количество п-толуолсульфоновой кислоты (6,1 г) и добавляли свежий толуол. На протяжении данной реакции по мере того, как субстрат превращался в продукт, образовалось два промежуточных соединения (определенных ЖХ (жидкостная хроматография. Конечная точка реакции представляла собой точку равновесия между двумя промежуточными соединениями и данным продуктом. Как только достигалась конечная точка, данную смесь охлаждали до температуры окружающей среды. Смесь промывали 0,5 М NaOH (2 л). Фазы быстро разделяли, и обе фазы были темными с небольшим слоем хлопьев. Данную смесь промывали водой (2 л). Фазы разделялись очень медленно. Смесь сушили азеотропной перегонкой. К данной смеси добавляли метанол (4 л) и отгоняли из смеси растворитель (4 л). Добавление метанола и отгонку растворителя повторяли еще два раза. Добавляли к данной смеси метанол и через несколько минут происходило осаждение. Добавляли к смеси дополнительное количество метанола (4 л) и затем доводили ее до температуры дефлегмации. Через 30 мин данную смесь охлаждали до 0 С. Данную смесь фильтровали и твердое вещество промывали охлажденным метанолом (22 л). Данное твердое вещество сушили в вакуумной печи при 65 С. Соединение, указанное в заголовке (882 г; 98% площади),получали в виде бежевого твердого вещества. 1 Н ЯМР (ДМСО)млн-1: 1.71 (m, 2 Н), 2.06 (m, 2 Н), 2.31(S)-4-Бензил-7-бром-2,2-(1,2-этилендиокси)-1,2,3,4,4,9-гексагидрофенантрен (719 г; 1,75 моль, который можно получить, как описано в получении 2) растворяли в тетрагидрофуране (7,19 л) и охлаждали до -70 С. 1,6 М н-бутиллитий в гексане (2270 мл; 2,27 моль) добавляли при такой скорости, что поддерживалась температура ниже -60 С. Данную смесь выдерживали еще 15 мин после добавления. Добавляли диоксид углерода (108 г; 2,45 моль), поддерживая температуру ниже -60 С. Данную смесь выдерживали еще 15 мин после добавления. Смесь нагревали до температуры окружающей среды. Из данной смеси отгоняли растворитель (7 л) при атмосферном давлении. К смеси добавляли ДМФ (диметилформамид) (7 л). Смесь охлаждали до температуры окружающей среды. Добавляли метилйодид (152 мл; 2,45 моль), и данную смесь выдерживали, пока реакция не была завершена (примерно 1 ч). Смесь нагревали до 70 С и растворитель отгоняли путем постепенного уменьшения давления до 70 мм рт. ст. (9,332103 Па). Как только перегонка заканчивалась, данную смесь охлаждали до комнатной температуры. К смеси медленно добавляли воду (6,5 л) для того, чтобы осадить продукт. Данную смесь фильтровали и твердое вещество промывали водой (3). Данное твердое вещество высушивали на фильтре. Неочищенный продукт (736 г; 74% площади) получали в виде бежевого твердого вещества. Данный продукт очищали хроматографией. 463 г продукта выделяли после хроматографии. Это вещество отделяли от н-гептана (6130 мл). Выделяли 394 г соединения, указанного в заголовке. Еще 70 г соединения, указанного в заголовке, выделяли из маточного раствора посредством хроматографии. 1 Н ЯМР (ДМСО)млн-1: 1.74 (m, 2 Н), 2.10 (m, 2 Н), 2.33(S)-Метил-4-бензил-7,7-(1,2-этилендиокси)-4,5,6,7,8,10-гексагидрофенантрен-2-карбоксилат (201 г; 0,515 моль, который можно получить, как описано в получении 3) и 50 мл этиленгликоля растворяли в толуоле (2,0 л) в автоклаве. К этой смеси добавляли 10 г 5% Pd/C (сухой катализатор). Данный автоклав затем плотно закрывали и продували азотом (три цикла) с последующей продувкой водородом (три цикла). Данную реакцию проводили в течение 18 ч при давлении 551,581 кПа (80 psi) и температуре 50 С. Проводили анализ ВЭЖХ для отслеживания завершения реакции и селективности (типичная селективность составляет 95:5, транс:цис). Данную суспензию фильтровали через Celite для удаления катализатора и раствор в толуоле концентрировали при 50 С под вакуумом приблизительно до 200 мл. Поддерживая температуру 50 С, добавляли 1 л 1-бутанола и нагревали данный раствор до 60 С, пока он не стал прозрачным. При охлаждении образующееся твердое вещество, указанное в заголовке, выделяли вакуумфильтрацией (196 г; 97%; транс относительно цис: 95,75 к 4,24). 1 Н ЯМР (300 МГц, CDCl3)млн-1: 7.79(4S,8R)-Метил-4-бензил-7,7-(1,2-этилендиокси)-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксилат (10 г, 25,5 ммоль), IPA (75 мл) и водную 2 М HCl (25 мл, 51,0 ммоль) смешивали вместе и нагревали до температуры дефлегмации. Во время нагревания данная смесь становилась гомогенной. Смесь выдерживали при температуре дефлегмации, пока не гидролизовался кеталь (примерно 30-45 мин). Данную реакцию останавливали, когда оставалось примерно 3% кеталя. К данной смеси добавляли 2,5 М NaOH (40 мл, 101,9 ммоль) и продолжали нагревание. Смесь выдерживали при температуре дефлегмации, пока не гидролизовался сложный эфир (примерно 30 мин). Добавляли водный 2 М HCl (40 мл) и данную смесь охлаждали до 40 С. При добавлении кислоты образовались две жидкие фазы. Для инициации кристаллизации добавляли затравочные кристаллы. Через 30 мин после начала кристаллизации добавляли дополнительное количество водного 2 М HCl (40 мл). Данную смесь охлаждали до 20 С и выдерживали в течение 60 мин. Смесь фильтровали и твердое вещество промывали водой. Данное твердое вещество сушили в вакуумной печи при 70 С. Получали бледно-желтое твердое вещество (7,86 г,выход 92%). 1 Н ЯМР (ДМСО):1.50 (m, 1 Н), 1.65 (m, 1 Н), 1.90 (m, 1 Н), 2.05 (m, 1H), 2.20 (d, 1H), 2.30 (d,1H), 2.40 (dd, 1H), 2.65 (d, 1H), 2.80 (d, 1H), 3.00 (m, 3 Н), 4.30 (d, 1H), 6.40 (d, 1H), 6.60 (d, 2H), 7.10 (m,3 Н), 7.35 (d, 1H), 7.65 (s, 1H), 12.75 (s, 1H).(4S,8R)-4-Бензил-7-оксо-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоновую кислоту (6,5 г,19,44 ммоль) суспендировали в воде (65 мл). Добавляли 2,5 М NaOH (11,7 мл, 29,16 ммоль) с последующим добавлением бензальдегида (2,16 мл, 21,38 ммоль). Данная смесь становилась гомогенной с течением времени (при 50 С в течение 4 ч или при 25 С в течение ночи). Данную реакцию считали завершенной, когда оставалось менее чем 2% (4S,8R)-4-бензил-7-оксо-4,5,6,7,8,8,9,10-октагидрофенантрен 2-карбоновой кислоты (препарат 5). Данную смесь охлаждали до 25 С, если ее температура еще не составляла 25 С. К смеси добавляли EtOAc (65 мл) с последующим добавлением водного 2 М HCl (29 мл). Кристаллизация обычно происходила во время добавления кислоты или вскоре после этого. Данную смесь перемешивали в течение 60 мин. Добавляли гептан (65 мл) и перемешивали смесь в течение дополнительных 60 мин. Не беспокойтесь об отделении водной фазы; отфильтруйте всю смесь и промойте твердое вещество водой с последующей промывкой гептаном. Получали бледно-желтое твердое вещество (6,55 г, 80% выход). 1 Н ЯМР (ДМСО):1.70 (m, 1H), 1.85 (m, 1 Н), 2.45 (m, 3 Н), 2.65 (d, 3 Н), 2.95 (m,2 Н), 3.50 (d, 1H), 6.15 (d, 2 Н), 6.25 (d, 1 Н), 6.70 (t, 2 Н), 6.90 (t, 1H), 7.30 (d, 1 Н), 7.50 (m, 5 Н), 7.70 (d, 2H),12.75 (s, 1H). Получение 7. (4R,6E,7S,8R)-4-Бензил-6-бензилиден-7-гидрокси-7-фенил-4,5,6,7,8,8,9,10 октагидрофенантрен-2-карбоновая кислота Хлорид церия(III) (5,00 г, 20,29 ммоль) перемешивали в тетрагидрофуране (50 мл) при 50 С в течение 16 ч. Температуру реакционной среды внутри отслеживали JKEM. Образующийся молочно-белый раствор охлаждали до -75 С и энергично перемешивали. В холодную суспензию загружали по каплям фенилмагния бромид (1,0 М в ТГФ (тетрагидрофуран), 19,1 ммоль) в течение 15 мин, поддерживая температуру менее -70 С. Данный раствор выдерживали при -73 С в течение 15 мин и добавляли по каплям в течение 20 мин раствор(4R,6E,8R)-4-бензил-6-бензилиден-7-оксо-4,5,6,7,8,8,9,10 октагидрофенантрен-2-карбоновой кислоты (3,5 г, 8,311 ммоль) в тетрагидрофуране (40 мл), поддерживая температуру реакции ниже -70 С. Получали данные ВЭЖХ/МС, показывающие наличие остающегося исходного вещества. Данную реакционную смесь перемешивали еще 3 ч, получали данные ВЭЖХ/МС и исходное вещество сохранялось. Добавляли дополнительные 2 мл раствора бензилмагния бромида (2,0 ммоль) в течение 10 мин и получали данные ВЭЖХ/МС. Добавляли дополнительный 1 мл раствора бензилмагния бромида (1,0 ммоль) в течение 10 мин и получали данные ВЭЖХ/МС. Данный раствор перемешивали в течение 30 мин при -73 С, давали ему нагреться до 10 С и затем охлаждали до 0 С. Данную реакцию гасили добавлением по каплям насыщенного водного KHSO4, поддерживая температуру менее 10 С. Всего добавляли 50 мл насыщенного раствора. В данном растворе образовались твердые вещества,и их удаляли вакуум-фильтрацией. Осадок на фильтре промывали тетрагидрофураном (40 мл) и водой(40 мл). Добавляли этилацетат (100 мл) и слои разделяли. Органический слой промывали насыщенным хлоридом аммония (100 мл), сушили над сульфатом натрия и удаляли растворитель при пониженном давлении. Водный слой проверяли ВЭЖХ/МС, и он не содержал какого-либо продукта. Остаток переносили в метанол (15 мл) и добавляли воду. Данный раствор становился молочно-белым и, в конечном сче- 15018024 те, формировался осадок. Добавляли маленькие количества метанола и воды для улучшения качества и количества осадка. Твердые вещества собирали вакуум-фильтрацией и сушили на воздухе в течение примерно 2 ч. Получали 3,4 г соединения, указанного в заголовке, в виде светло-желтого твердого вещества с 81%-ным выходом. 1 Н ЯМР (400 МГц, ДМСО-d6)млн-1 12.65 (1 Н, s), 7.44-7.56 (7 Н, m), 7.34-7.39(1 Н, m), 1.59-1.74 (2 Н, m); ЖХ/МС, tr =3,77 мин (от 5 до 95% ацетонитрил/вода в течение 5 мин при скорости 1 мл/мин, при 254 нм, при 50 С). Получение 8. (4R,7R,8R)-4-Бензил-7-гидрокси-6-оксо-7-фенил-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоновая кислота(4R,6E,7S,8R)-4-Бензил-6-бензилиден-7-гидрокси-7-фенил-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоновую кислоту (37,7 г, 75,7 ммоль) растворяли в 1200 мл метиленхлорида. Данную реакционную смесь охлаждали до -78 С и продували азот через реакционную смесь в течение 15 мин. Далее продували озон через данную смесь, и появлялся голубоватый оттенок. Озон непрерывно продували через реакционную смесь в течение 3 ч. Через 1 ч получали данные ВЭЖХ/МС, и исходное вещество сохранялось. Продолжали загрузку озоном. Получали данные ВЭЖХ/МС через 2 ч и через 1 ч и исходное вещество сохранялось. Продолжали загрузку озоном. Получали данные ВЭЖХ/МС через 3 ч. Расход исходного вещества не изменялся. Загрузку озоном прекращали и продували азот через данную реакционную среду, пока голубое окрашивание не исчезало. Добавляли диметилсульфид (20 мл) и метанол (20 мл) и реакционную смесь нагревали до комнатной температуры. Растворитель удаляли при пониженном давлении и образующееся густое масло растворяли в этилацетате (100 мл). Добавляли к данному раствору гептаны (100 мл) и перемешивали смесь. Образующийся раствор был слегка мутным. Данный раствор хранили при комнатной температуре в течение ночи без перемешивания. Образовались белые кристаллы. 5,7 г данных кристаллов собирали после ВЭЖХ/МС и получали данные 1 Н ЯМР. Растворитель удаляли из маточных растворов. Получали 44 г оранжево-коричневого масла. Получали данные ВЭЖХ/МС. Маточный раствор очищали с использованием препаративной хроматографии с обращенной фазой с получением дополнительных 22 г соединения, указанного в заголовке, для общего извлечения 27,5 г с 85%ным выходом. МН+ [m/z] 501 M+Na [m/z] 523; 1 Н ЯМР (400 МГц, ДМСО-d6)млн-1 2.00 (s, 4 Н), 2.10-2.21(4R,7R,8R)-4-Бензил-7-гидрокси-6-оксо-7-фенил-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоновую кислоту (21 г, 49,2 ммоль), 3-амино-2-пиколин (5,8 г, 52,2 ммоль) и 1-метилимидазол (20 мл, 246,2 ммоль) растворяли в безводном ацетонитриле (105 мл). Для контроля умеренного экзотерма медленно добавляли циклический ангидрид 1-пропанфосфоновой кислоты (50 мас.% в этилацетате) (47 мл, 78,8 ммоль). Данную смесь перемешивали при 25 С, пока реакция на завершалась (менее чем за 1 ч). Добавляли к данной смеси этилацетат (86 мл). Данную смесь промывали водой (4100 мл). Органическую фазу сушили MgSO4 и концентрировали досуха. Продукт, указанный в заголовке (22,3 г, 89%-ный выход), получали в виде светло-желтой пены. 1 Н ЯМР (ДМСО):1.95 (m, 2H), 2.10 (m, 3H), 2.35 (s, 3H), 2.75 (m, 3 Н), 3.0 (d, 1 Н),3.05 (m, 2H), 5.70 (s, 1H), 6.15 (d 1H), 6.60 (m, 2H), 7.10 (m, 3H), 7.25 (m, 2H), 7.30 (m, 5H), 7.65 (d, 1H),- 16018024 В круглодонную колбу, высушенную пламенем, добавляли 50 мл (4R,7R,8R)-4-бензил-7 гидрокси-N-(2-метилпиридин-3-ил)-6-оксо-7-фенил-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксамида (0,28 г, 0,54 ммоль) в ТГФ (5 мл). Данный раствор охлаждали до -17 С в бане со льдом/ацетоном. К данной реакционной смеси добавляли MeLiLiBr (0,1 мл). Через 1 ч ЖХ/МС показала, что исходное вещество сохранялось, так что добавляли дополнительные 0,15 мл. Данную реакционную смесь перемешивали в течение 2 ч до достижения комнатной температуры. Посредством ВЭЖХ определяли, что оставалось 2,5% исходного вещества. К данной реакционной смеси медленно добавляли NH4Cl и наблюдали выделение газа. Данную реакционную смесь разбавляли до 125 мл ацетонитрилом и водой. Реакционную смесь очищали хроматографией с обращенной фазой, затем лиофилизировали. Полученный сухой порошок вновь растворяли в ацетонитриле и воде с двумя каплями концентрированной HCl. Данный раствор лиофилизировали досуха. Получали продукт, указанный в заголовке (231,4 мг), в виде соли HCl с 73%ным выходом. LRMS (масс-спектрометрия низкого разрешения) ES+ 533,1 1 Н ЯМР (300 МГц, метанол-d4)млн-1 1.23-1.28 (m, 3 Н), 1.53-1.62 (m, 1 Н), 1.90-2.20 (m, 3 Н), 2.70-2.74 (m, 3 Н), 2.84 (d, J=14,90 Гц, 1 Н),2.92 - 3.22 (m, 2 Н), 3.28-3.40 (m, 4 Н), 3.91 (d, J=12,08 Гц, 1 Н), 6.50 (d, J=8,26 Гц, 2 Н), 6.84-6.92 (m, 2 Н),6.99-7.10 (m, 3 Н), 7.13-7.29 (m, 3 Н), 7.45 (dd, J=8,15, 1,91 Гц, 1 Н), 7.56-7.65 (m, 2 Н), 7.77 (d, J=1,81 Гц,1 Н), 7.88 (dd, J=8,26, 5,84 Гц, 1 Н), 8.51-8.63 (m, 2 Н). Пример 1. (4R,6R,7R,8S)-4-Бензил-6,7-дигидрокси-6-метил-N-(2-метилпиридин-3-ил)-10-оксо 7-фенил-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксамид Образец твердого (4R,6R,7R,8R)-4-бензил-6,7-дигидрокси-6-метил-N-(2-метилпиридин-3-ил)-7 фенил-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксамида (2200 мг, 4,130 ммоль) растворяли при комнатной температуре в растворе метиленхлорида (10 мл) и метанола (100 мл). Данный полученный раствор обрабатывали 10 мл раствора 2 н. HCl в МеОН и перемешивали в течение еще 10 мин. В это время данный реакционный раствор визуально проверяли для того, чтобы убедиться в том, что все твердые вещества растворились, и затем проводили охлаждение до -78 С. Охлажденный раствор обрабатывали устойчивой струей озона (скорость тока 5 см 3, генерированного генератором Azcozon, AZCO IndustriesLtd., модельRMU16-8, при установленном давлении О 2 - 206,842 кПа (30 psi. После 5 ч постоянного тока озона, данная реакция была практически завершена с образованием целевого соединения, указанного в заголовке, как установлено анализом ЖХМС (М+Н LRMS 547,2 а.е.м.). Данный раствор приобретал темно-синий цвет. Холодный реакционный раствор продували азотом в течение 5 мин для устранения большей части озона, и данная реакционная смесь приобретала значительно менее голубую окраску. В это время добавляли 20 мл диметилсульфида таким способом, который не повышал внутреннюю температуру реакционной смеси до уровня выше -70 С. После этого следовало удаление охлаждающей бани,данной реакционной смеси давали самой нагреться до комнатной температуры (1 ч) и выдерживали ее при этой температуре в течение еще 3 ч. В это время данный реакционный раствор концентрировали с получением остатка и растворяли в 25 мл ТГФ, затем образующийся раствор в ТГФ непосредственно подвергали хроматографии с обращенной фазой на С-18 колонке (градиент 15 мин, от подвижной фазы 5% ацетонитрила до подвижной фазы 95% ацетонитрила в воде). Образующееся соединение, указанное в заголовке, фильтровали через ионообменную смолу (StratoSphere SPE, PL-НСО 3 MP-Resin, продукт но- 17018024 мер 3540-С 603) для удаления любых солей ТФУ (трифторуксусная кислота) и получения продукта, указанного в заголовке, в виде его родительского соединения. Образующееся твердое вещество кристаллизовали посредством следующей методики: данное твердое вещество суспендировали с МеОН (7 мл),твердые вещества собирали через 1 ч и промывали дополнительными 2 мл МеОН с получением 1802 мг соединения, указанного в заголовке, 79%. Аналитические данные являются следующими. 1 Н ЯМР (500 МГц, D6 ДМСО)млн-1 1.18 (s, 3 Н), 1.51 (dd, J=12,66, 1,96 Гц, 1 Н), 1.99 (d, J=14,96 Гц, 1 Н), 2.40 (dd,J=18,88, 4,85 Гц, 1 Н), 2.43 -2.49 (m, 1 Н), 2.49 (ушир. s., 3 Н), 2.56 (t, J=12,82 Гц, 1 Н), 2.61 (d, J=12,53 Гц,1 Н), 2.75 (d, J=15,12 Гц, 1 Н), 2.92 (dd, J=18,59, 12,74 Гц, 1 Н), 4.05 (d, J=12,45 Гц, 1 Н), 6.65 (d, J=8,27 Гц,1 Н), 6.79 (dd, J=7,69, 1,59 Гц, 2 Н), 7.05-7.13 (m, 3 Н), 7.15-7.21 (m, 1 Н), 7.25 (t, J=7,69 Гц, 2 Н), 7.49 (dd,J=7,94, 5,10 Гц, 1 Н), 7.62 (dd, J=7,44, 1,25 Гц, 2 Н), 7.87 (dd, J=8,23, 2,13 Гц, 1 Н), 8.01 (dd, J=7,78, 1,00 Гц,1 Н), 8.46 (dd, J=5,01, 1,50 Гц, 1 Н), 8.54 (d, J=2,09 Гц, 1 Н), 10.18-10.58 (m, 1 Н, NH). В зависимости от содержания воды в ДМСО могут быть видны два протона ОН при 4,78 и 5,44 млн-1. HRMS m/z 547,2619(C35H35N2O4: расчетное значение для М+Н, 547,2591).I. Биологические данные. Стимулированная липополисахаридом (ЛПС) человеческая цельная кровь. Венозную кровь от доноров-людей отбирали в виде 10 мл аликвот в пробирки, содержащие гепарин натрия (BD Vacutainer от Becton Dickinson and Company, Franklin Lakes, NY). Кровь добавляли в стерильные полистирольные круглодонные 96-луночные планшеты для культуры ткани (Corning Costar) по 180 мкл/лунку. Кровь помещали в увлажненный инкубатор с 5%-ным CO2 при 37 С, пока готовили соединения (почти 60 мин). Соединения готовили из 10 мМ маточных растворов в диметилсульфоксиде (ДМСО, SigmaAldrich). Маточный раствор соединения разводили в ДМСО с получением подходящей исходной концентрации, затем последовательно разводили 1/3 в ДМСО (т.е. 15 мкл соединения + 30 мкл ДМСО) с последующим разведением каждого последовательного разведения 1/167 в растворе носителя (2% ДМСО в фосфатно-солевом буферном растворе (фосфатно-солевой буферный раствор по Дульбекко без хлорида кальция и хлорида магния, Invitrogen Corporation, Carlsbad CA. Соединение или носитель добавляли к крови в 10 мкл аликвотах в тройной повторности, пропуская наружные лунки для минимизации возможных краевых эффектов. Конечная наивысшая концентрация каждого соединения в анализе варьировала от 3 до 0,3 мкМ. Конечная концентрация ДМСО в данном анализе составляла 0,1%. Планшеты, содержащие пробы, осторожно встряхивали для перемешивания и вновь помещали в инкубатор. Маточный раствор ЛПС (серотип 0111:В 4 Е. coli, Sigma-Aldrich), который хранили в аликвотах 100 мкг/мл в RPMI при -20 С, разводили 1/50 в RPMI с получением рабочего маточного раствора. После 60 мин инкубации 10 мкл полученного рабочего маточного раствора ЛПС добавляли к крови до конечной концентрации 100 нг/мл. В лунки, подлежащие использованию в качестве негативного контроля, добавляли среду RPMI без ЛПС. Данный планшет вновь осторожно встряхивали и планшеты инкубировали в течение ночи 22 ч. После инкубации кровь центрифугировали при 1500g в течение 5 мин и плазму удаляли либо для замораживания при -20 С, либо для анализа на высвобождение цитокинов. Измерение и анализ высвобождения цитокинов. Уровни белков IL-1 (интерлейкин-1 бета), IFG (интерферон-гамма) и TNF (фактор некроза опухоли-альфа) измеряли с использованием наборов для анализа Meso Scale (Meso Scale Discovery, Gaithersburg, MD, U.S.A.). Реагентам давали нагреться до комнатной температуры. Планшеты Meso Scale блокировали 150 мкл разбавителя Meso Scale Block В, осторожно встряхивали при комнатной температуре в течение 60 мин. Планшеты промывали трижды промывочным буфером (PBS, Invitrogen Corporation, с 0,05% Tween-20, Sigma-Aldrich). Калибровочные стандарты для стандартных кривых получали в разбавителе для анализа человеческой плазмы/сыворотки в виде последовательного разведения 1/5 с достижением конечных концентраций, варьирующих от 50000 до 3,2 пг/мл. Образцы добавляли в количестве от 10 до 20 мкл/лунку и калибровочные стандарты добавляли в количестве 20 мкл/лунку, затем инкубировали при комнатной температуре с осторожным встряхиванием в течение 2 ч. Планшеты вновь промывали 3 промывочным буфером. Детекторное антитело разводили в разбавителе для антител человеческой плазмы/сыворотки до концентрации 1 мкг/мл и добавляли в планшет в количестве 20 мкл/лунку. Планшеты инкубировали, как и раньше, в течение 2 ч и вновь промывали. Буфер Т для считывания (4) разводили 1:1 mq H2O до 2 концентрации и добавляли в каждую лунку 150 мкл. Планшеты считывали наSPECTOR Imager 6000 (Meso Scale Discovery) с получением грубых значений сигнала. Значения сигналов отдельных проб сравнивали с позитивными и негативными контролями (кровь с ЛПС, обработанная носителем, и кровь без ЛПС, обработанная носителем, соответственно) с получением% ингибирования. Для каждого донора усредняли значения в тройной повторности. Значения для трех или четырех доноров усредняли и откладывали на графике с использованием 4-параметрических аппроксимирующих кривых в надстройке LabStats для приложения Microsoft Excel. Преднизолон приобретали у Sigma-Aldrich (Saint Louis, МО). Таблица 1 Средние значения ингибирования преднизолона Таблица 2 Средние значения ингибирования примера 1 Соединение сравнения А представляет собой (4S,7S,8R)-4-бензил-7-гидрокси-N-2 метилпиридин-3-ил)метил)-7-(3,3,3-трифторпропил)-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксамид, синтез которого описан в примере 771 С-3 на с. 241 WO 00/66522 (Dow et al.), и имеет следующую структуру: Следующие соединения для сравнения В-D могут быть получены описанными здесь способами,способами, известными в данной области, и согласно схеме D, приведенной ниже. Следующее соединение сравнения Е можно получить обычными способами, известными в данной области, и согласно реакционной схеме Е, приведенной ниже(2R,2S,4R,10R)-4 а-бензил-2-фенил 1,2,3,4,4,9,10,10-октагидрофенантрен-2,3,7-триол, синтез которого описан в примере 30 на с. 106 международной заявки WO 2004/005229 (Chantigny et al.) и имеет следующую структуру: Соединение сравнения G представляет собой (2R,3S,4R,10R)-4a-бензил-7-(2-метилпиридин-3 илметокси)-2-фенил-1,2,3,4,4,9,10,10-октагидрофенантрен-2,3-диол, синтез которого описан в примере 32 на с. 107 международной заявки WO 2004/005229 (Chantigny et al.) и имеет следующую структуру: Таблица 3 Средние значения ингибирования соединением сравнения А Таблица 4 Средние значения ингибирования соединением сравнения F Таблица 5 Средние значения ингибирования соединением сравнения G Пример 1, соединение сравнения F, соединение сравнения G и преднизолон все представляют собой лиганды глюкокортикоидного рецептора, однако, каждый лиганд дает отличный профиль ингибирования цитокинов из цельной человеческой крови, стимулированной ЛПС ex vivo. Преднизолон, полный агонист ГР (глюкокортикоидный рецептор), демонстрирует полное ингибирование INF, TNF и IL-1. Пример 1 также ингибирует высвобождение цитокинов в зависимости от концентрации. Будучи частичным агонистом/антагонистом, пример 1 не показывает ингибирования до уровня преднизолона. Кроме того, уровень ингибирования, наблюдаемый для примера 1, является разным между измеренными цитокинами, то есть IFN=73%, TNF=43% и IL-1=38%. В отличие от примера 1, соединение сравнения F и соединение сравнения G значимо не ингибируют TNF или IL-1 (менее чем 20% при 3000 нМ) и показывают значительно менее эффективное ингибирование IFN (только 22 или 41% ингибирования при 3000 нМ соответственно). Таким образом, в то время как пример 1, соединение сравнения F, соединение сравнения G и преднизолон связываются с тем же самым рецептором, они демонстрируют заметно разные активности. Данные in vivo. Мышиный артрит, индуцированный коллагеном (mCIA). Мышиный артрит, индуцированный коллагеном, является обычно используемой доклинической моделью хронического ревматоидного артрита, при котором после иммунизации коллагеном типа II происходит опухание суставов и деструкция костей. Ранее было показано, что снижение частоты и тяжести заболевания предсказывает болезненную модификацию, признаки и симптомы облегчения соответственно в клинической постановке. В терапевтической модели mCIA индукция частоты и тяжести заболевания были синхронизированы через стимуляцию ЛПС. Самцов мышей DBA/J иммунизировали 100 мкг коровьего коллагена типа II(bCII) на сутки 0. Все мыши получали интраперитонеальную инъекцию 20 мкг ЛПС на сутки 28 и заболеванию давали развиваться до суток 34. В сутки 34 все мыши имели заболевание (частота=100%) со средним показателем тяжести семь. Дозировку соединений в терапевтическом режиме начинали в сутки 34 и продолжали до суток 49. Сравнивали разные обработки путем измерения уменьшения частоты (т.е. прекращение заболевания) и уменьшения тяжести опухания лап с течением времени. 28-суточная мышиная модель побочных эффектов. 10-12-недельных самок мышей Swiss Webster (Taconic, Germantown, U.S.A.), имеющих массу 27-29 г, используют согласно указаниям Институционального комитета по уходу и использованию животных и согласно указаниям NIH (Национальный институт здоровья, США) по обеспечению жизни лабораторных животных. Мышей акклиматизируют к установке для животных Pfizer в течение 3-7 суток до начала исследования. Преднизолон и соединения DAGR вводят путем искусственного питания через рот всего в течение 28 суток. Каждая группа обработки обычно состоит из 8-10 мышей. Для установления схемы дозировки для данных исследований проводится пилотный эксперимент по зависимости фармакодинамики от времени для количественного измерения репрессии TNF после одной ED80 (эффективная доза) дозы (определенной из модели острой эндотоксемии мышей, вызванной ЛПС). Для того чтобы значимо репрессировать TNF за 24-часовой период, определили, что для преднизолона был необходим режим дозирования дважды в день. Соединения DAGR варьировали по требующейся для них частоте доз. Массы тела измеряют на первые и последние сутки каждого эксперимента. Пробы крови получают через примерно 3 недели дозировки для статического фармакокинетического анализа. Для оценки эффектов соединения на TNF, индуцированный ЛПС, все мыши получают интраперитонеальную инъекцию ЛПС (Salmonella Typhosa, Sigma, St. Louis, L-7895) через 2,5 ч после последней дозы в сутки 28. Мышей умерщвляют через 90 мин после введения ЛПС. Образцы сыворотки анализируют на остеокальцин и TNF, используя многоканальный тест Linco (St. Charles, МО) и Luminex 100 (Austin, TX). Образ- 22018024 цы разводят 1:20 и анализ проводят согласно инструкциям производителя. Стандарт остеокальцина покупают отдельно у Biomedical Technologies Incorporated (Stoughton, MA). Измеряют сывороточный инсулин для оценки эффектов соединения на резистентность к инсулину. Инсулин измеряли с использованием набора Ultrasensitive Mouse EIA от Alpco Diagnostics (Salem, NH), следуя протоколу производителя. Гистоморфометрия кортикальной кости. На протяжении прижизненной части каждого исследования мыши получали две интраперитонеальные инъекции флуорохрома кальцеина (С-0875; Sigma-Aldrich; 20 мг/кг; 200 мкл/мышь), растворенного в 2% бикарбонате натрия, в сутки 1 и 26 для измерений гистоморфометрии кости. Флуорохромные метки включаются в минеральное вещество кости и позволяют измерять скорость образования кости. Во время отбора ткани вырезается левая большеберцовая кость и очищается для измерений кортикальной гистоморфометрии. После удаления всей кожи и мышц большеберцовые кости помещают в темноте в 70% этанол (4 С) минимум на 24 ч. Для гистоморфометрического анализа кортикальной кости используются шлифованные поперечные срезы. Срезы костей делают с использованием низкоскоростной пилы (Isomer, Buehler, Lake Bluff, IL),оснащенной алмазным пластинчатым лезвием. Конец каждой большеберцовой кости удаляют рядом со сращением большеберцовой и малоберцовой кости и нарезают 75-мм поперечный срез. Срезы шлифуют с использованием шероховатой стеклянной пластинки и пробки до примерно 25 мм, пока они не станут прозрачными, и все метки не станут различимыми под флуоресцентным микроскопом. Срезы обезвоживают с использованием следующих растворов минимум в течение 2 мин в каждом растворе: 1) 70%-ный этанол, 2) 95%-ный этанол, 3) 100%-ный этанол, 4) этанол/ксилол 50/50 и 5) ксилол (дважды) (Sigma, St.Louis, 534056). Срезы закрепляют с использованием Eukitt Quick Mounting Medium (Sigma, St. Louis,03989) и покрывают покровным стеклом. Скорость образования кости рассчитывают с использованием программы Osteomeasure Bone Analysis (Decatur, Georgia), отслеживая 1-ю и 2-ю флуоресцентную метку,помимо отслеживания внутреннего и наружного периметра кости. Скорость образования кости рассчитывают по следующему уравнению: (ширина между метками/интервал мечения)(периметр мечения/периметр кости). Измеряют по меньшей мере 5 образцов из каждой группы обработки в каждом исследовании. Получение стандарта и образца для анализа фармакокинетики и система ЖХ/МС/МС. Уровни кортикостерона, преднизолона и соединения измеряют во всех образцах сыворотки. Следующие стандарты готовят в контрольной мышиной сыворотке из маточного раствора в ДМСО: 5; 2,5; 1,25; 0,3125; 0,078; 0,0195; 0,00488; 0,00122; 0,00305; 0,000076 мкг/мл. 30 мкл образцов сыворотки (неизвестные образцы и стандартные образцы сыворотки) переносят в новый 96-луночный планшет. Добавляют ацетонитрил (170 мл, содержащий 1 мкМ толбутамид в качестве внутреннего стандарта) для осаждения сыворотки и предоставления внутреннего стандарта для анализа МС/МС. Данный планшет центрифугируют в течение 5 мин при 4000 об/мин, 25 С. 90 мкл супернатанта переносят для инъекции и 5 мкл инъецируют в систему ЖХ/МС/МС для анализа. Концентрации меньше предела количественной оценки (LOQ) доложены как ноль (0) и используются при оценке средних концентраций и оценке AUC(площадь под кривой). Площадь под кривой концентрация-время от момента времени ноль до времени(определения) последней концентрации, которую можно количественно измерить (t) [AUC(0-t)], определяют с использованием линейного трапециевидного способа. Статистическая оценка значения ED50 (эффективная доза 50) и ED50 получают для разных параметров с использованием черырехпараметрических логистических аппроксимаций данных. Для каждого эксперимента/группы дозы определяют резко отклоняющиеся значения путем расчета числа стандартных отклонений каждого значения для мыши от среднего значения их группы и последующего деления на стандартное отклонение данной группы. В средних значениях и стандартных отклонениях, используемых в этом расчете, опускали исследуемое значение так, что если бы оно было резко отклоняющимся значением, оно бы не имело влияния. Если исследуемое значение отклоняется на более чем 2,5 стандартных отклонения от среднего, оно не использовалось в остальных расчетах. Затем для каждого животного рассчитывают значения процента ингибирования с использованием средних значений для контрольных групп, обработанных носителем и 10 мг/кг преднизолона. Индивидуальные значения процента ингибирования у мышей затем аппроксимируют к четырехпараметрической логистической модели с использованием среднего значения площади под кривой для каждой группы. Поскольку оцениваются все четыре параметра, нижнее плато не является фиксированным при 0%, и верхнее плато не было фиксированным при 100%, значения ED50 и ED80 рассчитывают с использованием формулы обратной калибровки для ответа, равного 50 или 80%. Обозначение "но" означает "не определяется". Индекс диссоциации. Индекс диссоциации (DI) выбирали как меру для количественной оценки диссоциации соединений относительно диссоциации преднизолона в показателях биомаркеров противовоспалительной эффективности и побочных эффектов. Индексы диссоциации рассчитывали с использованием клинически релевантных биомаркеров, которые могли бы быть использованы в раннем клиническом исследовании. Сывороточный остеокальцин и сывороточный TNF, индуцированный LPS, принимаются клинически как предсказывающие образование кости и противовоспалительную эффективность соответственно. Индекс диссоциации был основан на следующих принципах: 1) для диссоциации требуется граница дозы между биомаркерами воспаления и побочными эффектами [такими как остеокальцин (ОС), инсулин или скорость образования кости], и индекс диссоциации был определен по формуле с использованием подавления остеокальцина (ОС) в качестве примера побочного эффекта 2) DI соединения можно рассматривать по отношению к индексу диссоциации, наблюдаемому с преднизолоном, его клиническим компаратором. Исправленный или нормализованный DI определяли как DI соединения, разделенный на DI преднизолона. Индекс диссоциации или его фармацевтически приемлемая соль. 2. Соединение по п.1, представляющее собой (4R,6R,7R,8S)-4-бензил-6,7-дигидрокси-6-метилN-(2-метилпиридин-3-ил)-10-оксо-7-фенил-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксамид,или его фармацевтически приемлемая соль. 3. Кальциевая соль соединения по п.2. 4. Натриевая соль соединения по п.2. 5. Фармацевтическая композиция, содержащая соединение по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. 6. Композиция по п.5, содержащая фармацевтически эффективное количество (4R,6R,7R,8S)-4 бензил-6,7-дигидрокси-6-метил-N-(2-метилпиридин-3-ил)-10-оксо-7-фенил-4,5,6,7,8,8,9,10-октагидрофенантрен-2-карбоксамида или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. 7. Способ модуляции глюкокортикоидного рецептора, включающий приведение в контакт глюкокортикоидного рецептора с соединением по п.1 или его фармацевтически приемлемой солью. 8. Способ лечения состояния, опосредованного активностью глюкокортикоидного рецептора, у субъекта, включающий введение указанному субъекту соединения по п.1 или его фармацевтически приемлемой соли. 9. Способ по п.8, где указанное состояние представляет собой состояние, связанное с воспалением. 10. Способ по п.8, где указанное состояние представляет собой астму, дерматит, воспалительное заболевание кишечника, болезнь Альцгеймера, большую психотическую депрессию, невропатию, отторжение трансплантата, рассеянный склероз, хронический увеит или хроническую обструктивную болезнь легких. 11. Способ по п.8, где указанное состояние представляет собой ревматоидный артрит. 12. Способ по п.8, где указанное состояние представляет собой дерматит. 13. Способ по п.8, где указанное состояние представляет собой астму. 14. Способ по п.8, где указанное состояниепредставляет собой болезнь Альцгеймера. 15. Способ по п.8, где указанное состояние представляет собой воспалительное заболевание кишечника. 16. Способ уменьшения побочных эффектов, связанных с модуляцией глюкокортикоидного рецептора, включающий введение субъекту соединения по п.1.
МПК / Метки
МПК: A61K 31/44, A61P 29/00, C07D 213/75
Метки: композиции, соединения, фенантреноновые, способы
Код ссылки
<a href="https://eas.patents.su/26-18024-fenantrenonovye-soedineniya-kompozicii-i-sposoby.html" rel="bookmark" title="База патентов Евразийского Союза">Фенантреноновые соединения, композиции и способы</a>
Предыдущий патент: Контейнер для лекарственного средства, не доступный для открывания детьми
Следующий патент: Устройство автоматической блокировки полотна роллет в крайнем нижнем положении
Случайный патент: Глазной антисептик