Сульфаматные и сульфамидные производные для лечения эпилепсии и родственных расстройств
Номер патента: 13685
Опубликовано: 30.06.2010
Авторы: Маккомси Дэвид Ф., Рейтц Ален Б., Марьянофф Брюс Э., Паркер Майкл Н.
Формула / Реферат
1. Соединение формулы (II)
![]()
в которой R1 и R2, каждый независимо, выбирают из группы, состоящей из водорода и алкила, содержащего от 1 до 4 атомов углерода;
R4 выбирают из группы, состоящей из водорода и алкила, содержащего от 1 до 4 атомов углерода;
а является целым числом от 1 до 2;
структуру ![]() выбирают из группы, состоящей из
выбирают из группы, состоящей из
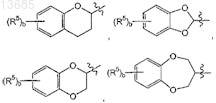
где b представляет собой целое число от 0 до 4;
каждый R5независимо выбирают из группы, состоящей из галогена, алкила, содержащего от 1 до 4 атомов углерода, и нитро;
при условии, что когда структура ![]() представляет собой структуру
представляет собой структуру
![]()
тогда а=1;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором
R1 и R2, каждый независимо, выбирают из группы, состоящей из водорода и алкила, содержащего от 1 до 4 атомов углерода;
R4 выбирают из группы, состоящей из водорода и алкила, содержащего от 1 до 4 атомов углерода;
а является целым числом от 1 до 2;
структуру ![]() выбирают из группы, состоящей из
выбирают из группы, состоящей из
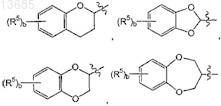
где b представляет собой целое число от 0 до 2;
каждый R5независимо выбирают из группы, состоящей из галогена, алкила, содержащего от 1 до 4 атомов углерода, и нитро;
при условии, что когда структура ![]() представляет собой структуру
представляет собой структуру
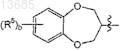
тогда а=1;
или его фармацевтически приемлемая соль.
3. Соединение по п.1 или 2, в котором
R1 и R2, каждый независимо, выбирают из группы, состоящей из водорода и алкила, содержащего от 1 до 4 атомов углерода;
R4 выбирают из группы, состоящей из водорода и метила;
а является целым числом от 1 до 2;
структуру ![]() выбирают из группы, состоящей из
выбирают из группы, состоящей из
2-(2,3-дигидробензо[1,4]диоксинила),
2-(бензо[1,3]диоксолила),
3-(3,4-дигидро-2Н-бензо[1,4]диоксепинила),
2-(2,3-дигидробензо[1,4]диоксинила),
2-(6-хлор-2,3-дигидробензо[1,4]диоксинила),
2-(6-фтор-2,3-дигидробензо[1,4]диоксинила),
2-(хроманила),
2-(5-фтор-2,3-дигидробензо[1,4]диоксинила),
2-(7-хлор-2,3-дигидробензо[1,4]диоксинила),
2-(6-хлорбензо[1,3]диоксолила),
2-(7-нитро-2,3-дигидробензо[1,4]диоксинила),
2-(7-метил-2,3-дигидробензо[1,4]диоксинила),
2-(5-хлор-2,3-дигидробензо[1,4]диоксинила),
2-(6-бром-2,3-дигидробензо[1,4]диоксинила),
2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинила),
2-(8-хлор-2,3-дигидробензо[1,4]диоксинила),
2-(2,3-дигидронафто[2,3-b][1,4]диоксинила) и
2-(4-метилбензо[1,3]диоксолила);
при условии, что когда структура ![]() является 3-(3,4-дигидро-2Н-бензо[1,4]диоксепинилом), тогда а=1;
является 3-(3,4-дигидро-2Н-бензо[1,4]диоксепинилом), тогда а=1;
или его фармацевтически приемлемая соль.
4. Соединение по п.3, в котором
R1 и R2, каждый независимо, выбирают из группы, состоящей из водорода и метила;
R4 выбирают из группы, состоящей из водорода и метила;
а является целым числом от 1 до 2;
структуру ![]() выбирают из группы, состоящей из
выбирают из группы, состоящей из
2-(бензо[1,3]диоксолила),
2-(2,3-дигидробензо[1,4]диоксинила),
2-(2,3-дигидробензо[1,4]диоксинила),
2-(6-хлор-2,3-дигидробензо[1,4]диоксинила),
2-(7-хлор-2,3-дигидробензо[1,4]диоксинила),
2-(7-метил-2,3-дигидробензо[1,4]диоксинила),
2-(6-бром-2,3-дигидробензо[1,4]диоксинила) и
2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинила);
или его фармацевтически приемлемая соль.
5. Соединение, выбранное из группы, состоящей из N-[(6-хлор-2,3-дигидро-1,4-бензодиоксин-2-ил)метил]сульфамида, и его фармацевтически приемлемая соль.
6. Соединение, выбранное из группы, состоящей из
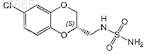
и его фармацевтически приемлемая соль.
7. Соединение формулы (III)
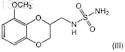
или его фармацевтически приемлемая соль.
8. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение по п. 1.
9. Фармацевтическая композиция, получаемая смешиванием соединения по п.1 и фармацевтически приемлемого носителя.
10. Способ получения фармацевтической композиции, включающий смешивание соединения по п.1 и фармацевтически приемлемого носителя.
11. Способ лечения эпилепсии или родственных расстройств у субъекта, нуждающегося в лечении, включающий введение субъекту терапевтически эффективного количества соединения по п.1.
12. Способ лечения эпилепсии у субъекта, нуждающегося в лечении, включающий введение субъекту терапевтически эффективного количества соединения по п.1.
13. Способ по п.11, в котором расстройство выбирают из эссенциального тремора или синдрома неспокойных конечностей.
14. Применение соединения по п.1 для получения лекарственного средства для лечения эпилепсии или родственных расстройств, у субъекта, нуждающегося в лечении.
Текст
013685 Перекрестные ссылки на родственные заявки Заявка на данное изобретение имеет приоритет предварительной заявки США 60/580178, поданной 16 июня 2004 г., которая во всей полноте включена здесь в виде ссылки. Область техники, к которой относится изобретение Настоящее изобретение относится к новым сульфамидным производным, фармацевтическим композициям, их содержащим, и их применению для лечения эпилепсии и родственных расстройств. Предпосылки создания изобретения Термин "эпилепсия" определяет состояние, при котором человек подвержен повторным припадкам вследствие основного хронического процесса. Термин "эпилепсия" относится к клиническому симптому,а не к отдельному конкретному заболеванию, так как существует множество форм эпилепсии и причин ее возникновения. Определяя эпилепсию как процесс, характеризуемый двумя и более непровоцируемыми припадками, ее распространение в различных популяциях по всему миру оценивают приблизительно как 0,3-0,5% при уровне распространения эпилепсии, составляющем 5-10 человек на 1000. Существенным этапом при оценке состояния пациента, у которого случился припадок, и помощи ему является определение типа случившегося припадка. Разные типы припадков различают по основному признаку, а именно: является ли судорожная активность парциальной (синоним: фокальной) или генерализованной. Парциальными припадками являются такие припадки, при которых судорожная активность ограничена дискретными отделами коры головного мозга. Если во время припадка сознание полностью сохранено, то клинические проявления считают относительно простыми и припадок относят к типу простого парциального припадка. При нарушении сознания припадок определяют как сложный парциальный припадок. Важная дополнительная подгруппа включает в себя такие припадки, которые начинаются как парциальные припадки и затем диффузно распространяются по коре головного мозга. Эти припадки известны как парциальные припадки с вторичной генерализацией. Генерализованные припадки одновременно вовлекают диффузные области мозга по типу билатеральной симметрии. Абсанс, или малый судорожный припадок (petit mal), характеризуется внезапными короткими эпизодами потери сознания без потери контроля положения тела. Нетипичные абсансы обычно включают в себя большую продолжительность эпизодов потери сознания, менее резкие начало и прекращение припадка и более явные двигательные симптомы, которые могут иметь фокальные признаки или признаки латерализации. Генерализованные тонико-клонические или большие судорожные припадки (grand mal), основной тип гинерализованных припадков, характеризуются резким началом без предвещающих симптомов. Начальной фазой припадка является тоническое сокращение мышц, затрудненное дыхание, заметное усиление симпатического тонуса, ведущее к росту частоты сердечных сокращений,кровяного давления и размера зрачка. Через 10-20 с тоническая фаза припадка обычно развивается в клоническую фазу, получаемую в результате наложения периодов расслабления и сокращения мышц. Периоды расслабления постепенно возрастают, пока не наступает окончание иктальной фазы, которая обычно продолжается не более 1 мин. Постиктальная фаза характеризуется невосприимчивостью, мышечной вялостью и избыточным слюноотделением, которое может вызвать свистящее дыхание и частичную обструкцию дыхательных путей. Атонические припадки характеризуются резкой потерей постурального мышечного тонуса, продолжающейся в течение 1-2 с. Сознание кратковременно нарушается, но обычно отсутствует постиктальная спутанность сознания. Миоклонические припадки характеризуются резким кратковременным сокращением мышц, которое может вовлекать полностью все тело или какуюто одну его часть (www.harrisonsonline.com, March 29, 2001). Ингибиторы карбоангидразы (CAIs) широко использовались в медицине, главным образом в качестве антиглаукомных и антисекреторных лекарственных средств или диуретических средств, и являются ценными соединениями. Однако системные антиглаукомные средства (такие как ацетазоламид) обладают возможными нежелательными побочными эффектами, включая парестезии, почечно-каменную болезнь и потерю массы. Топирамат является хорошо известным противосудорожным лекарственным средством, которое обладает ингибирующими свойствами по отношению к отдельной пальцевидной макромолекулярной карбоангидразе, что, как предполагают, является причиной парестезии, как было замечено некоторыми пациентами, принимающими топирамат. Остается необходимость в обеспечении эффективного лечения эпилепсии и родственных расстройств, предпочтительно лечения, не имеющего связанных с ним побочных эффектов, обусловленных ингибированием карбоангидраз.-1 013685 Сущность изобретения Настоящее изобретение относится к новым сульфамидным производным, фармацевтическим композициям, их содержащим, и их применению для лечения эпилепсии и родственных расстройств. Более предпочтительно настоящее изобретение относится к соединениям формулы (II), которые определены в дальнейшем. Настоящее изобретение относится к новым сульфамидным производным, соединениям формулы (II) где R1 и R2, каждый независимо, выбирают из группы, состоящей из водорода и низшего алкила;R4 выбирают из группы, состоящей из водорода и низшего алкила;a является целым числом от 1 до 2; структуру выбирают из группы, состоящей из где b является целым числом от 0 до 4;c является целым числом от 0 до 2; каждый R5 независимо выбирают из группы, состоящей из галогена, низшего алкила и нитро; при условии, что когда структура представляет собой тогда а=1; или их фармацевтически приемлемой соли. Настоящее изобретение, кроме того, относится к соединению формулы (III) или его фармацевтически приемлемой соли. Иллюстрацией к изобретению является фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и любое из соединений, описанных выше. Иллюстрацией изобретения является фармацевтическая композиция, полученная смешиванием любого из соединений, описанных выше, и фармацевтически приемлемого носителя. Иллюстрацией изобретения является способ получения фармацевтической композиции, включающий смешивание любого из соединений, описанных выше, и фармацевтически приемлемого носителя. Примером изобретения служит способ лечения эпилепсии и родственных расстройств у субъекта, в нем нуждающегося, включающий введение субъекту терапевтически эффективного количества любых соединений или фармацевтических композиций, описанных выше. Еще одним примером изобретения является применение любого из соединений, здесь описанных,для получения лекарственного средства для лечения эпилепсии или родственных расстройств у субъекта,нуждающегося в лечении.-2 013685 Подробное описание изобретения Настоящее изобретение относится к соединениям формулы (II) где структура , a, R1, R2 и R4 являются такими, как они были здесь описаны. Настоящее изобретение, кроме того, относится к соединению формулы (III). Соединения формул(II) и (III) применимы для лечения эпилепсии и родственных расстройств. Если не указано иначе, термин "галоген", используемый здесь, будет обозначать хлор, бром, фтор и йод. Если не указано иначе, термин "алкил", используемый сам по себе или как часть замещающей группы, включает в себя прямые и разветвленные цепи. Например, алкильные радикалы включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил и т.п. Если не указано иначе, термин "низший", когда его употребляют вместе с термином "алкил", означает, что углеродная цепь содержит от 1 до 4 атомов углерода. Если не указано иначе, термин "алкокси", используемый здесь, будет означать кислородсодержащий радикал простого эфира, содержащий описанные выше алкильные группы с неразветвленной или разветвленной цепью, например метокси, этокси, н-пропокси, втор-бутокси, трет-бутокси, н-гексилокси и т.п. Символ , используемый здесь, будет обозначать наличие стереогенного центра. Когда отдельная группа является "замещенной" (например, алкил, арил и т.д.), она может иметь один или несколько заместителей, предпочтительно от одного до пяти заместителей, более предпочтительно от одного до трех заместителей, наиболее предпочтительно от одного до двух заместителей, независимо выбираемых из перечня заместителей. При ссылке на заместители термин "независимо" означает, что, когда возможны несколько таких заместителей, эти заместители могут быть одинаковыми или отличаться друг от друга. По стандартной номенклатуре, используемой на протяжении данного описания, концевую часть определяемой боковой цепи описывают первой с последующим описанием соседней с ней функциональной группы и далее по направлению к месту присоединения. Таким образом, например,"фенилалкиламинокарбонилалкильный" заместитель относится к группе, описываемой формулой В описании изобретения, предпочтительно в схемах и примерах, используют следующие сокращения и обозначения:Et2O = диэтиловый эфир ЕА или EtOAc = этилацетатHPLC = жидкостная хроматография при высоком давленииPd-C = палладий на углеродном катализатореRP HPLC = жидкостная хроматография с обращенной фазой при высоком давлении-3 013685 Если не указано особо, используемые здесь термины "эпилепсия и родственные расстройства" или"эпилепсия или родственное расстройство" будут обозначать любое расстройство, при котором субъект(предпочтительно взрослый человек, ребенок или младенец) претерпевает один или несколько припадков и/или состояний тремора. Подходящие примеры включают в себя, кроме прочих, эпилепсию (включая,кроме прочих, эпилепсии определенной локализации, генерализованные эпилепсии, эпилепсии как с генерализованными, так и с локальными припадками и т.п.), припадки, возникающие как осложнение заболевания или состояния (такие как припадки, связанные с энцефалопатией, фенилкетонурией, юношеской болезнью Гоше, прогрессирующей миоклонической эпилепсией Ландборга, с ударом, травмой головы, стрессом, гормональными изменениями, использованием лекарственных средств или отмены лекарственных средств, потреблением спирта или прекращением потребления спирта, утратой сна и т.п.),эссенциальный тремор, синдром неспокойных конечностей и т.п. Предпочтительно, когда расстройство выбирают из эпилепсии (независимо от типа, основной причины или происхождения), эссенциального тремора или синдрома неспокойных конечностей; более предпочтительно, когда расстройство является эпилепсией (независимо от типа, основной причины или происхождения) или эссенциальным тремором. Термин "субъект", используемый здесь, обозначает животное, предпочтительно млекопитающее,наиболее предпочтительно человека, который является или являлся объектом лечения, наблюдения или эксперимента. Термин "терапевтически эффективное количество", используемый здесь, означает количество активного соединения или фармацевтического средства, которое выявляет биологическую или медицинскую ответную реакцию в системе тканей, животном или человеке, которую ищет исследователь, ветеринар, врач или другой клиницист. Эта реакция включает в себя смягчение симптомов заболевания или расстройства, подвергаемого лечению. Термин "композиция", используемый здесь, включает в себя продукт, содержащий описанные ингредиенты в описанных количествах, так же как любой продукт, который прямо или косвенно получают из комбинации описанных ингредиентов в описанных количествах. Когда соединения по данному изобретению имеют по крайней мере один хиральный центр, они могут соответственно находиться в виде энантиомеров. Когда соединения обладают двумя или более хиральными центрами, они могут дополнительно находиться в виде диастереомеров. Это следует понимать таким образом, что все такие изомеры и их смеси включены в объем настоящего изобретения. Более того, некоторые из кристаллических форм соединений могут находиться в виде полиморфных модификаций; и такие полиморфные модификации включены в настоящее изобретение. В дополнение, некоторые из соединений могут образовывать сольваты с водой (т.е. гидраты) или с обычными органическими растворителями; такие сольваты также включены в объем данного изобретения. Когда в процессе получения соединений по изобретению получают смесь стереоизомеров, эти изомеры могут быть разделены с помощью обычных процедур, таких как препаративная хроматография. Соединения могут быть получены в виде рацемических форм или же индивидуальные энантиомеры могут быть получены или энантиоспецифичным синтезом, или путем повторного растворения. Соединения можно, например, разлагать на составляющие энантиомеры с помощью стандартных методик, таких как образование диастереомерных пар посредством образования соли под действием оптически активной кислоты, такой как (-)-ди-п-толуоил-D-винная кислота и/или (+)-ди-п-толуоил-L-винная кислота, с последующими дробной кристаллизацией и регенерацией свободного основания. Соединения могут также быть разложены путем образования диастереомерных сложных эфиров или амидов с последующим хроматографическим разделением и удалением хирального вспомогательного вещества. Альтернативно,соединения могут быть разложены, используя колонку HPLC с хиральным наполнителем. В течение любого из способов получения соединений по настоящему изобретению может оказаться необходимым и/или желательным защитить чувствительные или реакционноспособные группы, принадлежащие любым из рассматриваемых молекул. Это может быть достигнуто с помощью общепринятых защитных групп, таких как группы, описанные в Protective Groups in Organic Chemistry, ed. J.F.W.WileySons, 1991. Защитные группы могут быть удалены на последующей удобной для этого стадии,используя методы, известные в данной области техники. В объем настоящего изобретения включают пролекарства соединениий по изобретению. Вообще говоря, такие пролекарства будут функциональными производными соединений, которые легко превращаются в требуемые соединения in vivo. Таким образом, в способах лечения по настоящему изобретению термин "введение" будет включать в себя лечение разнообразных описанных расстройств конкретно описанным соединением или соединением, которое не может быть описано конкретно, но которое после введения пациенту превращается в обозначенное соединение in vivo. Общепринятые процедуры выбора и получения соответствующих производных пролекарств описаны, например, в Design of Prodruqs, ed.-4 013685 Настоящее изобретение предлагает фармацевтические композиции, содержащие соединение формулы (II) и/или соединение формулы (III) вместе с фармацевтически приемлемым носителем. Предпочтительно, когда эти композиции находятся в виде стандартных лекарственных форм, таких как таблетки,пилюли, капсулы, порошки, гранулы, стерильные парентеральные растворы или суспензии, дозированный аэрозоль или жидкие аэрозоли, капли, ампулы, аутоинжекторные устройства или суппозитории для орального, парентерального, интраназального, подъязычного или ректального введения или для введения путем ингаляции или инсуффляции. Альтернативно, композиция может находиться в форме, пригодной для введения один раз в неделю или один раз в месяц; например нерастворимая соль активного соединения, такая как деканоат, может быть приспособлена для обеспечения депонирования при внутримышечной инъекции. Для получения твердых композиций, таких как таблетки, основной активный ингредиент смешивают с фармацевтическим носителем, например общепринятыми ингредиентами для таблетирования, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, дикальцийфосфат или смолы, и с другими фармацевтическими разбавителями, например водой, для образования твердой композиции предварительного препарата, содержащей гомогенную смесь основного ингредиента. Когда композиции предварительного препарата называют гомогенными, это означает,что активный ингредиент распределен равномерно по всей композиции, так что композиция легко может быть разделена на равноэффективные лекарственные формы, такие как таблетки, пилюли и капсулы. Эту твердую композицию предварительного препарата затем делят на стандартные лекарственные формы описанного выше типа, содержащие от приблизительно 1 до приблизительно 1000 мг активного ингредиента по настоящему изобретению. Таблетки или пилюли новой композиции могут быть покрыты оболочкой или составлены иначе для получения лекарственной формы, обладающей преимуществом пролонгированного действия. Например, таблетка или пилюля может содержать компонент во внутренней дозировке и во внешней дозировке, где последняя представляет собой оболочку предыдущей. Два компонента могут быть разделены энтеросолюбильным слоем, который служит для противодействия разложению в желудке и позволяет внутреннему компоненту пройти неповрежденным в двенадцатиперстную кишку или иметь замедленное высвобождение. Множество веществ могут быть использованы для таких энтеросолюбильных слоев или оболочек; такие материалы включают ряд полимерных кислот с такими веществами, как шеллак, цетиловый спирт и ацетат целлюлозы. Жидкие формы, в виде которых новые композиции по настоящему изобретению могут быть объединены для орального введения или для введения путем инъецирования, включают в себя водные растворы, должным образом ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии с пригодными в пищу маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло; так же как эликсиры и аналогичные фармацевтические наполнители. Пригодные диспергирующие или суспендирующие агенты для водных суспензий включают в себя синтетические или природные смолы, такие как трагакант, аравийская камедь, альгинат, декстран, натрийкарбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или желатин. Для получения фармацевтических композиций по изобретению соединение формулы (II) и/или соединение формулы (III) перемешивают с фармацевтическим носителем до образования однородной смеси в соответствии с общепринятой процедурой фармацевтического смешивания. Этот носитель может иметь самые разнообразные формы в зависимости от требуемой для введения формы препарата, например стерильные препараты для внутривенного инъецирования будут получать, используя соответствующие солюбилизирующие средства. Разовая доза содержала бы от приблизительно 10 до приблизительно 300 мг активного ингредиента. Таблетки содержат все или некоторые из нижеследующих неактивных ингредиентов: водной лактозы, предварительно клейстеризованного крахмала, микрокристаллической целлюлозы, натрийкрахмал-глюколата, стеарата магния, очищенной воды, карнаубского воска, гидроксипропилметилцеллюлозы, диоксида титана, полиэтиленгликоля, синтетического оксида железа и полисорбата 80. Специалист в данной области техники увидит, что оральные таблетки, содержащие соединение формулы (II) и/или соединение формулы (III), могут быть получены аналогичным образом и могут содержать аналогичные неактивные ингредиенты. Специалист в данной области техники увидит, что фармацевтические композиции, содержащие более одного активного ингредиента, могут быть получены аналогичным образом по известным методикам. В одном варианте осуществления настоящего изобретения R1 выбирают из группы, состоящей из водорода и метила. Еще в одном варианте осуществления настоящего изобретения R2 выбирают из группы, состоящей из водорода и метила. И еще в одном варианте осуществления настоящего изобретения R1 и R2, каждый, представляют собой водород или R1 и R2, каждый, представляют собой метил. В одном варианте осуществления настоящего изобретения -(СН 2)а- выбирают из группы, состоящей из -СН 2- и -СН 2-СН 2-. Еще в одном варианте осуществления настоящего изобретения -(СН 2)апредставляет собой -СН 2-. В одном варианте осуществления настоящего изобретения R4 выбирают из группы, состоящей из водорода и метила, предпочтительно R4 является водородом. В одном варианте осуществления настоящего изобретения a=1.-5 013685 В одном варианте осуществления настоящего изобретения b является целым числом и принимает значения от 0 до 2. Еще в одном варианте осуществления настоящего изобретения с является целым числом и принимает значения от 0 до 2. Еще в одном варианте осуществления настоящего изобретения b является целым числом и принимает значения от 0 до 1. Еще в одном варианте осуществления настоящего изобретения с является целым числом и принимает значения от 0 до 1. И еще в одном варианте осуществления настоящего изобретения сумма b и с является целым числом и принимает значения от 0 до 2,предпочтительно является целым числом со значениями от 0 до 1. И еще в одном варианте осуществления настоящего изобретения b является целым числом и принимает значения от 0 до 2, а с является 0. является циклической В одном варианте осуществления настоящего изобретения структура структурой, которую выбирают из группы, состоящей из нижеследующих структур: Еще в одном варианте осуществления настоящего изобретения структура представляет собой циклическую структуру, выбранную из группы, состоящей из нижеследующих структур: В одном варианте осуществления настоящего изобретения структура лическую структуру, выбранную из группы, состоящей из 2-(хроманила),2-(6-хлор-2,3-дигидробензо[1,4]диоксинила),2-(бензо[1,3]диоксолила),2-(5-хлор-2,3-дигидробензо[1,4]диоксинила),2-(7-нитро-2,3-дигидробензо[1,4]диоксинила),2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинила),2-(2,3-дигидронафто[2,3-b][1,4]диоксинила) и 2-(7-хлорбензо[1,3]диоксолила). представляет собой цик Еще в одном варианте осуществления настоящего изобретения структура циклическую структуру, выбранную из группы, состоящей из 2-(5-хлор-2,3-дигидробензо[1,4]диоксинила),2-(7-нитро-2,3-дигидробензо[1,4]диоксинила),2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинила) и 2-(2,3-дигидронафто[2,3-b][1,4]диоксинила). В одном варианте осуществления настоящего изобретения структуру стоящей из нижеследующих структур: Еще в одном варианте осуществления настоящего изобретения структуру состоящей из нижеследующих структур: В одном варианте осуществления настоящего изобретения структуру стоящей из 2-(2,3-дигидробензо[1,4]диоксинила),2-(бензо[1,3]диоксолила),3-(3,4-дигидробензо[1,4]диоксепинила),2-(6-хлор-2,3-дигидробензо[1,4]диоксинила),2-(6-фтор-2,3-дигидробензо[1,4]диоксинила),2-(хроманила),2-(5-фтор-2,3-дигидробензо[1,4]диоксинила),2-(7-хлор-2,3-дигидробензо[1,4]диоксинила),2-(6-хлорбензо[1,3]диоксолила),2-(7-нитро-2,3-дигидробензо[1,4]диоксинила),2-(7-метил-2,3-дигидробензо[1,4]диоксинила),2-(5-хлор-2,3-дигидробензо[1,4]диоксинила),2-(6-бром-2,3-дигидробензо[1,4]диоксинила),2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинила),2-(8-хлор-2,3-дигидробензо[1,4]диоксинила),2-(2,3-дигидронафто[2,3-b][1,4]диоксинила) и 2-(4-метилбензо[1,3]диоксолила). Еще в одном варианте осуществления настоящего изобретения структуру состоящей из 2-(бензо[1,3]диоксолила),2-(2,3-дигидробензо[1,4]диоксинила),2-(6-хлор-2,3-дигидробензо[1,4]диоксинила),2-(7-хлор-2,3-дигидробензо[1,4]диоксинила),2-(7-метил-2,3-дигидробензо[1,4]диоксинила),2-(6-бром-2,3-дигидробензо[1,4]диоксинила) и 2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинила). выбирают из группы, со выбирают из группы, выбирают из группы,Еще в одном варианте осуществления настоящего изобретения структуру состоящей из 2-(2,3-дигидробензо[1,4]диоксинила),2-(7-метил-2,3-дигидробензо[1,4]диоксинила) и 2-(6-бром-2,3-дигидробензо[1,4]диоксинила). В одном варианте осуществления настоящего изобретения R3 выбирают из группы, состоящей из галогена, низшего алкила, гидрокси замещенного низшего алкила, -О-(низшего алкила), нитро, циано,амино, низшего алкиламино и ди(низший алкил)амино. Еще в одном варианте осуществления настоящего изобретения R3 выбирают из группы, состоящей из галогена и нитро. Еще в одном варианте осуществления настоящего изобретения R3 выбирают из группы, состоящей из хлора и нитро. В одном варианте осуществления настоящего изобретения R5 выбирают из группы, состоящей из(II) галогена и низшего алкила. Еще в одном варианте осуществления настоящего изобретения R5 выбирают из хлора, фтора, брома и метила. В одном варианте осуществления настоящего изобретения стереоцентр соединения формулы (II) имеет S-конфигурацию. Еще в одном варианте осуществления настоящего изобретения стереоцентр соединения формулы (II) имеет R-конфигурацию. В одном варианте осуществления настоящего изобретения соединение формулы (II) присутствует в виде энантиомерно обогащенной смеси, в которой % энантиомерного обогащения (%ее) составляет более чем приблизительно 75%, предпочтительно более чем приблизительно 90%, более предпочтительно более чем приблизительно 95%, наиболее предпочтительно более чем приблизительно 98%.-7 013685 Еще одним вариантом осуществления настоящего изобретения являются соединения формулы (II),у которых MES активность при дозе 100 мг/кг больше или равна 3/5 mice. Репрезентативными соединениями по настоящему изобретению являются соединения, которые перечислены в табл. 1. Дополнительные соединения по настоящему изобретению перечислены в табл. 2. В табл. 1 и 2 столбец, озаглавленный "стерео", определяет стереоконфигурацию углеродного атома гетероцикла, присоединенного по связи, обозначенной звездочкой. Если обозначения отсутствуют, то соединение было получено как смесь стереоконфигураций. Там, где приведены "R" или "S" обозначения, стереоконфигурация основывалась на энантиомерно обогащенном исходном веществе. Таблица 1 Репрезентативные соединения формулы (II) Таблица 2 Дополнительные соединения по настоящему изобретению Соединения формулы (II) можно получить способом, отображенным на схеме 1. Схема 1-9 013685 Таким образом, соответственно замещенное соединение формулы (VII), известное соединение или соединение, получаемое известными методами, подвергают взаимодействию с сульфамидом, известным соединением, в котором сульфамид предпочтительно присутствует в количестве от приблизительно 2 до приблизительно 5 экв. в органическом растворителе, таком как ТГФ (THF), диоксан и т.п., предпочтительно при повышенной температуре в интервале от приблизительно 50 до приблизительно 100 С, более предпочтительно приблизительно при температуре образования флегмы для получения соответствующего соединения формулы (IIa). Альтернативно, соответственно замещенное соединение формулы (VII), известное соединение или соединение, получаемое известными методами, подвергают взаимодействию в органическом растворителе, таком как ДМФА, ДМСО и т.п., с соответственно замещенным соединением формулы (VIII), известным соединением или соединением, получаемым известными методами, в присутствии основания,такого как TEA, DIPEA, пиридин и т.п., для получения соответствующего соединения формулы (II). Соединения формулы (V), в котором структура можно получить способом, отображенным на схеме 2. Схема 2 Таким образом, соответственно замещенное соединение формулы (X), известное соединение или соединение, получаемое известными методами, подвергают взаимодействию с соответственно замещенным соединением формулы (XI), известным соединением или соединением, получаемым известными методами, в органическом растворителе, таком как метанол, этанол, IPA и т.п., в присутствии основания,такого как метилат натрия, этилат натрия, т-бутилат натрия, метилат калия, т-бутилат калия и т.п., предпочтительно при повышенной температуре в интервале от приблизительно 50 до приблизительно 100 С,более предпочтительно приблизительно при температуре образования флегмы для получения соответствующего соединения формулы (XII). Соединение формулы (XII) подвергают взаимодействию с соответственно выбранным восстановителем, таким как LAH и т.п., в органическом растворителе, таком как ТГФ, диэтиловый эфир и т.п., для получения соответствующего соединения формулы (Va). Соединения формулы (VII), в которых структура можно получить способом, отображенным на схеме 3. Схема 3 Таким образом, соответственно замещенное соединение формулы (XIII), известное соединение или соединение, получаемое известным методом (например, показанным на схеме 2, приведенной выше),подвергают взаимодействию с NH4OH известным соединением, необязательно, в органическом раство- 10013685 рителе, таком как ацетонитрил и т.п., для получения соответствующего соединения формулы (XIV). Соединение формулы (XIV) подвергают взаимодействию с соответственно выбранным восстановителем, таким как LAH и т.п., в органическом растворителе, таком как ТГФ, диэтиловый эфир и т.п., для получения соответствующего соединения формулы (VIIa). выбирают из можно получить способом, отображенным на схеме 4. Схема 4 Таким образом, соответственно замещенное соединение формулы (XV), известное соединение или соединение, получаемое известными методами, подвергают взаимодействию в органическом растворителе, таком как ацетонитрил, ТГФ, диоксан и т.п., с 3-хлор-2-хлорметилпропеном известным соединением в присутствии основания, такого как карбонат калия, карбонат натрия, бикарбонат натрия, триэтаноламин (TEA), DIPEA и т.п., предпочтительно при повышенной температуре в интервале от приблизительно 50 до приблизительно 100 С, более предпочтительно приблизительно при температуре образования флегмы для получения соответствующего соединения формулы (XVI). Соединение формулы (XVI) подвергают взаимодействию с бораном в органическом растворителе,таком как ТГФ, диоксан и т.п., для получения соответствующего соединения формулы (XVII), которое предпочтительно не отделяют. Соединение формулы (XVII) подвергают воздействию с аминосульфокислотой предпочтительно при повышенной температуре в интервале от приблизительно 50 до приблизительно 100 С, более предпочтительно приблизительно при температуре образования флегмы для получения соответствующего соединения формулы (VIIb). выбирают из можно получить способом, отображенным на схеме 5. Схема 5 Таким образом, соответственно замещенное соединение формулы (XVIII), соединение, полученное согласно схеме 4, приведенной выше, подвергают взаимодействию с пероксидом, таким как перекись водорода и т.п., в органическом растворителе, таком как хлороформ, DCE, DCM и т.п., в присутствии основания, такого как NaOH, KOH и т.п., для получения соответствующего соединения формулы (Vb). Соединения формулы (V), в которых структуру можно получить способом, отображенным на схеме 6. Таким образом, соответственно замещенное соединение формулы (XIX), известное соединение или соединение, получаемое известными методами, подвергают взаимодействию с соответственно выбранным восстановителем, таким как LAH и т.п., в органическом растворителе, таком как ТГФ, диэтиловый эфир и т.п., для получения соответствующего соединения формулы (Vc). Соединения формулы (VII), в которых структуру можно получить способом, отображенным на схеме 7. Схема 7 Таким образом, соответственно замещенное соединение формулы (XX), известное соединение или соединение, получаемое известными способами, подвергают взаимодействию с NH4OH, необязательно, в органическом растворителе, таком как ацетонитрил и т.п., в присутствии связующего вещества, такого как DCC и т.п., для получения соответствующего соединения формулы (XXI). Соединение формулы (XXI) подвергают взаимодействию с соответственно выбранным восстановителем, таким как LAH и т.п., в органическом растворителе, таком как ТГФ, диэтиловый эфир и т.п., для получения соответствующего соединения формулы (VIIc). Соединения формулы (V), в которых структуру и в которых а=1, можно получить способом, отображенным на схеме 8. Схема 8 Таким образом, соответственно замещенное соединение формулы (XXII), известное соединение или соединение, получаемое известными способами, подвергают взаимодействию в органическом растворителе, таком как ДМФА, ДМСО, ацетонитрил и т.п., с соответственно замещенным соединением формулы(XXIII) известным соединением или соединением, получаемым известными способами, в присутствии основания, такого как K2CO3, Na2CO3, NaHCO3 и т.п., предпочтительно при повышенной температуре в интервале от приблизительно 50 до приблизительно 100 С, более предпочтительно при повышенной температуре в интервале от приблизительно 50 до приблизительно 75 С для получения соответствующего соединения формулы (Vd). Соединения формулы (VII), в которых структуру и в которых а=2, можно получить способом, отображенным на схеме 9. Таким образом, соответственно замещенное соединение формулы (XXIV), в котором J1 представляет собой соответствующую уходящую группу, такую как Br, Cl, I, тозил, мезил, трифлил и т.п., которое является известным соединением или соединением, получаемым известными методами (например, активированием соответствующего соединения, в котором J1 является ОН), подвергают взаимодействию в органическом растворителе, таком как ДМСО, ДМФА, ТГФ и т.п., с цианидом, таком как цианид калия,цианид натрия и т.п., для получения соответствующего соединения формулы (XXV). Соединение формулы (XXV) восстанавливают с помощью известных методов, например путем взаимодействия с соответствующим восстановителем, таким как LAH, боран и т.п., для получения соответствующего соединения формулы (VIIe). выбирают из и в которых а=1, можно получить способом, отображенным на схеме 10. Схема 10 Таким образом, соответственно замещенное соединение формулы (XXVI), известное соединение или соединение, получаемое известными методами (например, способом, отображенным на схеме 8,приведенной выше), активируют известным способом для получения соответствующего соединения формулы (XXVII), в котором J2 представляет собой соответствующую уходящую группу, такую как Br,Cl, I, тозилат, мезилат, трифлат и т.п. Соединение формулы (XXVII) подвергают взаимодействию в органическом растворителе, таком как ДМФА, ДМСО, ацетонитрил и т.п., с солью фталимида, такой как фталимид калия, фталимид натрия и т.п., предпочтительно при повышенной температуре в интервале от приблизительно 50 до приблизительно 200 С, более предпочтительно приблизительно при температуре образования флегмы для получения соответствующего соединения формулы (XXVIII). Соединение формулы (XXVI) подвергают взаимодействию в органическом растворителе, таком как этанол, метанол и т.п. с N2H4, известным соединением предпочтительно при повышенной температуре в интервале от приблизительно 50 до приблизительно 100 С, более предпочтительно приблизительно при температуре образования флегмы для получения соответствующего соединения формулы (VIId). Соединения формулы (V), в которых структуру и в которых а=2, можно получить способом, отображенным на схеме 11. Таким образом, соответственно замещенное соединение формулы (XXVII), в котором J2 представляет собой CN, известное соединение или соединение, получаемое известными методами, гидролизуют с помощью известных способов, например взаимодействием с соответствующей кислотой или основанием, для получения соответствующего соединения формулы (XXIX). Соединение формулы (XXIX) восстанавливают с помощью известных способов, например взаимодействием с соответствующим восстановителем, таким как LAH и т.п., для получения соответствующего соединения формулы (Ve). Специалист в данной области техники увидит, что соединения формул (V) и (VII), в которых структуру выбирают из нижеследующих структур: можно получить аналогично способами, отображенными на схемах 2-11, приведенных выше, выбирая и заменяя соответствующими соединениями с конденсированными нафтильными структурами исходные вещества с конденсированными бензольными структурами (например, соединения формул (X), (XIII),(XV), (XVIII), (XIX), (XX), (XXII), (XXIV) и т.д.). Специалист в данной области техники, кроме того, увидит, что когда требуется один энантиомер соединения формулы (V) или соединения формулы (VII) (или смесь энантиомеров, обогащенная одним энантиомером), то способы, описанные выше в схемах 1-11, можно использовать, заменяя соответствующее исходное вещество одним соответствующим энантиомером (или смесью энантиомеров, обогащенной одним энантиомером). Нижеследующие примеры, которые не предназначены для ограничения изобретения каким-либо образом и не должны быть истолкованы как в какой-либо мере ограничивающие изобретение, предложены для лучшего понимания изобретения. Подробное разъяснение изобретения предлагают в формуле изобретения. Пример 1. 3,4-Дигидро-2 Н-бензо[b][1,4]диоксепин-3-ил)метил)сульфамид (соединение 3) Катехол (5,09 г, 46,2 ммоль) и карбонат калия объединяли в ацетонитриле и нагревали до кипения в течение 1 ч. Добавляли 2-хлорметил-3-хлор-1-пропен (5,78 г, 46,2 ммоль) и реакцию продолжали в течение 24 ч при кипячении с обратным холодильником. Раствор охлаждали до комнатной температуры и фильтровали. Фильтрат упаривали, остаток разбавляли водой и экстрагировали диэтиловым эфиром(3 раза). Объединенный органический раствор сушили над MgSO4 и концентрировали. Хроматография(2% простой этиловый эфир в гексане) показала выход 3-метилен-3,4-дигидро-2 Нбензо[b][1,4]диоксепина в виде бесцветного масла. МС (электрораспылительная ионизация): 163,2 (М+Н+).(100 мл). Добавляли боран в ТГФ (1,0 М в ТГФ, 10,3 мл) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли аминосульфокислоту (6,97 г, 61,6 ммоль). Реакционную смесь нагревали в течение ночи до температуры образования флегмы. Реакционную смесь охлаждали до комнатной температуры и добавляли водный гидроксид натрия (3,0 М, 100 мл). Раствор экстрагировали этилацетатом (3 раза по 100 мл). Объединенный органический раствор сушили над MgSO4. Раствор концентрировали в вакууме и очищали хроматографией (2-8% метанолом в дихлорметане) для получения 3,4-дигидро-2 Н-бензо[b][1,4]диоксепин-3-ил)метил)амина в виде бесцветного масла. МС (электрораспылительная ионизация): 180,1 (М+Н+). 1H ЯМР (300 МГц, ДМСО):6,92 (м, 4 Н), 4,21 (м, 2 Н), 4,07 (м, 2 Н), 3,33 (широкий, 2 Н), 3,16 (д,J=4 Гц, 1 Н), 2,72 (д, J=4 Гц, 1H), 2,30 (м, 1 Н). 3,4-Дигидро-2 Н-бензо[b][1,4]диоксепин-3-ил)метил)амин (2,90 г, 16,2 ммоль) и сульфамид (3,11 г,32,4 ммоль) объединяли в сухом диоксане (60 мл) и нагревали в течение ночи до температуры образования флегмы. Добавляли хлороформ и осадок удаляли фильтрованием. Фильтрат концентрировали в вакууме и очищали хроматографией (2-8% ацетон в дихлорметане), чтобы получить указанное в названии соединение в виде не совсем белого твердого вещества. МС: 258,8 (М+Н+). 1 Н ЯМР (300 МГц, DMCO):6,92 (м, 4 Н), 6,71 (ушир., 1 Н), 6,59 (ушир., 2 Н), 4,19 (м, 2 Н), 4,04 (м,2 Н), 3,00 (м, 2 Н), 2,39 (м, 1 Н). Пример 2. N-(2,3-Дигидробензо[1,4]диоксин-2-илметил)сульфамид (соединение 1)(4,4 г, 26 ммоль) и сульфамид (5,1 г, 53 ммоль) объединяли в 1,4-диоксане (100 мл) и кипятили с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и незначительное количество твердого вещества фильтровывали и отбрасывали. Фильтрат упаривали в вакууме и остаток очищали, используя колоночную флеш-хроматографию (DCM:метанол=10:1), чтобы получить белое твердое вещество. Твердое вещество перекристаллизовывали из DCM, чтобы получить соединение, указанное в названии, в виде белого твердого вещества. Т.п.: 97,5-98,5 С. Аналит. расчет: С, 44,25; Н, 4,95; N, 11,47; S, 13,13 Аналит. найдено: С, 44,28; Н, 4,66; N, 11,21; S, 13,15 1 Н ЯМР (ДМСО d6):6,85 (м, 4 Н), 6,68 (шир. с, 3 Н, NH), 4,28 (м, 2 Н), 3,97 (дд, J=6,9, 11,4 Гц, 1 Н),3,20 (м, 1 Н), 3,10 (м, 1 Н). Пример 3. (Бензо[1,3]диоксол-2-илметил)сульфамид (соединение 2) Катехол (10,26 г, 93,2 ммоль), метилат натрия (25 мас.% в метаноле, 40,3 г, 186 ммоль) и метилдихлорацетат (13,3 г, 93,2 ммоль) объединяли в сухом метаноле (100 мл). Раствор нагревали до кипения в течение ночи. Реакционную смесь охлаждали до комнатной температуры, подкисляли, добавляя концентрированную хлористо-водородную кислоту и затем в вакууме уменьшали в объеме до приблизительно 50 мл. Добавляли воду и смесь экстрагировали диэтиловым эфиром (3 раза по 100 мл). Объединенный органический раствор сушили с помощью MgSO4, концентрировали до получения коричневого твердого вещества и хроматографировали (2% этилацетат в гексане) для получения метилового эфира бензо[1,3]диоксол-2-карбоновой кислоты в виде бесцветного масла. МС (электрораспылительная ионизация): 195,10 (М+Н+). 1 Н ЯМР (300 МГц, CDCl3):6,89 (ушир., 4 Н), 6,29 (с, 1 Н), 4,34 (кв., J=7 Гц, 2 Н), 1,33 (т, J=7 Гц,3H). К метиловому эфиру бензо[1,3]диоксол-2-карбоновой кислоты (7,21 г, 40,0 ммоль) добавляли гидроксид аммония (29% в воде, 10 мл) и достаточное количество ацетонитрила для получения гомогенной смеси (5 мл). Раствор перемешивали в течение 2 ч при комнатной температуре и затем добавляли дистиллированную воду. Амид бензо[1,3]диоксол-2-карбоновой кислоты осаждали в виде белого твердого вещества, собирали фильтрованием и использовали без дополнительной очистки. МС (электрораспылительная ионизация): 160,00 (М+Н+). 1(ТГФ, 100 мл). К раствору медленно при комнатной температуре добавляли алюмогидрид лития (LAH, 1M в ТГФ, 39,5 мл 39,5 ммоль). Реакционную смесь перемешивали в течение 24 ч при комнатной температуре. Добавляли дистиллированную воду для разрушения избытка LAH. Добавляли водный гидроксид натрия (3,0 М, 100 мл) и раствор экстрагировали этилацетатом (3 раза по 100 мл). Объединенный органический раствор промывали водой и сушили над MgSO4. Растворитель выпаривали, чтобы получить С-бензо[1,3]диоксол-2-илметиламин в виде бесцветного масла. МС (электрораспылительная ионизация): 152,1 (М+Н+). 1 Н ЯМР (300 МГц, CDCl3):6,87 (м, 4 Н), 6,09 (т, J=4 Гц, 1 Н), 3,13 (д, J=4 Гц, 2 Н). С-Бензо[1,3]диоксол-2-илметиламин (2,94 г, 19,4 ммоль) и сульфамид (3,74 г, 38,9 ммоль) объединяли в сухом диоксане (50 мл) и раствор нагревали до кипения в течение ночи. Реакционную смесь концентрировали и остаток хроматографировали (2-10% ацетон в дихлорметане), чтобы получить соединение, указанное в названии, в виде белого твердого вещества. МС (электрораспылительная ионизация): 230,0 (М+Н+). 1 Н ЯМР (300 МГц, CDCl3):6,87 (м, 4 Н), 6,25 (т, J=4 Гц, 1 Н), 4,79 (шир., 1 Н), 4,62 (шир., 1 Н), 3,64 Катехол (13,2 г, 0,12 моль) и карбонат калия (16,6 г, 0,12 моль) перемешивали в ДМФА (250 мл),добавляли (2R)-глицидилтозилат (22,8 г, 0,10 моль) и реакционную смесь в течение 24 ч перемешивали при 60 С. Реакционную смесь охлаждали до комнатной температуры и разбавляли ледяной водой (1 л) и экстрагировали диэтиловым эфиром (4 раза). Объединенный органический раствор 3 раза промывали 10% карбонатом калия, 1 раз - водой, 1 раз - соляным раствором и упаривали в вакууме, чтобы получить белое твердое вещество, которое очищали колоночной флеш-хроматографией (DCM:метанол=50:1), чтобы получить 2S)-2,3-дигидробензо[1,4]диоксин-2-ил)метанол в виде твердого вещества. Твердое вещество (13,3 г, 68 ммоль) растворяли в пиридине (85 мл), охлаждали до 0 С, добавляли п-толуолсульфонилхлорид (13,0 г, 68 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь разбавляли диэтиловым эфиром (1 л) и 1 н. HCl (1,2 л). Органический слой отделяли и 2 раза промывали 1 н. HCl (500 мл), 4 раза - водой (150 мл),1 раз - соляным раствором, сушили (MgSO4), упаривали в вакууме для получения белого твердого вещества, которое очищали колоночной флеш-хроматографией (Hept:EA=2:1) для получения(2S)-2,3-дигидробензо[1,4]диоксин-2-илметилового эфира толуол-4-сульфокислоты в виде белого твердого вещества. Белое твердое вещество объединяли с фталимидом калия (14,4 г, 78 ммоль) в ДМФА (250 мл) и нагревали до кипения в течение 1 ч; охлаждали до комнатной температуры и вливали в воду (1,5 л) при энергичном перемешивании; и перемешивали еще 30 мин. Белое твердое вещество фильтровали и твердое вещество промывали несколько раз водой, 2% NaOH и снова - водой и оставляли для сушки на воздухе, чтобы получить (2S)-2-(2,3-дигидробензо[1,4]диоксин-2-илметил)изоиндол-1,3-дион в виде белого порошкообразного твердого вещества. Белое порошкообразное твердое вещество объединяли с гидразином (2,75 г, 86 ммоль) в EtOH(225 мл) и нагревали при кипячении с обратным холодильником в течение 2 ч, охлаждали до комнатной температуры и добавляли 1 н. HCl до pH 1,0; перемешивали в течение 15 мин. Белое твердое вещество фильтровали и промывали свежеприготовленным EtOH (твердое вещество отбрасывали). Фильтрат упаривали в вакууме до твердого вещества, которое распределяли между диэтиловым эфиром и разбавленным водным NaOH. Раствор диэтилового эфира сушили (Na2SO4) и упаривали в вакууме для получения светло-желтого масла. Масло очищали колоночной флеш-хроматографией (DCM:MeOH=10:1) с выходом масла. Часть масла (4,82 г, 29 ммоль) в 2-пропаноле (250 мл) обрабатывали 1 н. раствором HCl (30 мл),нагревали на паровой бане до гомогенного состояния и оставляли охлаждаться до комнатной температуры. После 3 ч смесь охлаждали льдом в течение 2 ч. Белое хлопьевидное твердое вещество (соответствующая соль HCl и (2S)-С-(2,3-дигидробензо[1,4]диоксин-2-ил)метиламина) отфильтровывали и затем снова перекристаллизовывали из 2-пропанола, чтобы получить белое твердое вещество.[]D=-69,6 (c=1,06 EtOH). Белое твердое вещество распределяли между DCM и разбавленным NaOH и DCM сушили (Na2SO4) и упаривали в вакууме, чтобы получить (2S)-С-(2,3-дигидробензо[1,4]диоксин-2-ил)метиламин в виде масла.- 16013685 Масло (2,1 г, 12,7 ммоль) и сульфамид (2,44 г, 25,4 ммоль) кипятили с обратным холодильником в диоксане (75 мл) в течение 2 ч и неочищенный продукт очищали колоночной флеш-хроматографией(DCM:MeOH=10:1), чтобы получить белое твердое вещество, которое перекристаллизовывали из DCM для получения указанного в названии соединения в виде белого кристаллического твердого вещества. Т.п. 102-103 С.(1,52 г, 15 ммоль) объединяли в ДМФА (10 мл) и при охлаждении на ледяной бане добавляли диметилсульфамоилхлорид (1,44 г, 10 ммоль). Реакционную смесь перемешивали в течение 3 ч при продолжении охлаждения. Реакционную смесь распределяли между этилацетатом и водой. Раствор этилацетата промывали соляным раствором, сушили (MgSO4) и упаривали в вакууме для получения масла. Масло очищали, используя колоночную флеш-хроматографию (этилацетат:гептан=1:1), чтобы получить белое твердое вещество, которое перекристаллизовывали (этилацетат/гексан) для получения указанного в названии соединения в виде белого хлопьевидного твердого вещества. Т.п. 76-78 С. МС: 273 (МН+). Аналит. расчет: С, 48,52; Н, 5,92; N, 10,29; S, 11,78 Аналит. найдено: С, 48,63; Н, 5,62; N, 10,20; S, 11,90 1 Н ЯМР (CDCl3):6,87 (м, 4 Н), 4,59 (шир.м, 1 Н, NH), 4,35 (м, 1 Н), 4,27 (дд, J=2,3, 11,4 Гц, 1 Н), 4,04 Рацемический 2,3-дигидро-1,4-бенздиоксин-2-илметиламин (825 мг, 5 ммоль) растворяли в этилформиате (15 мл), кипятили с обратным холодильником в течение 30 мин и упаривали в вакууме, чтобы получить N-(2,3-дигидробензо[1,4]диоксин-2-илметил)формамид в виде масла. Масло в диэтиловом эфире (25 мл) обрабатывали 1 М LAH в ТГФ (9,0 мл, 9,0 ммоль) при 0 С и перемешивали в течение 5 ч при комнатной температуре. Реакционную смесь охлаждали на ледяной бане и гасили водой (0,50 мл), а затем 3 н. раствором NaOH (0,50 мл) и водой (0,50 мл). Затем смесь перемешивали при комнатной температуре в течение 1 ч. Твердое вещество фильтровали и фильтрат упаривали в вакууме, чтобы получить осадок, который распределяли между 1 н. раствором HCl и диэтиловым эфиром. Основность водной фазы увеличивали с помощью 1 н. раствора NaOH и экстрагировали диэтиловым эфиром. Органическую фазу сушили (MgSO4) и упаривали в вакууме, чтобы получить(2,3-дигидробензо[1,4]диоксин-2-илметил)метиламин в виде масла. МС: 180 (МН+). 1 Н ЯМР (CDCl3):6,85 (м, 4 Н), 4,30 (м, 2 Н), 4,02 (дд, J=7,9, 11,6 Гц, 1 Н), 2,85 (м, 2 Н), 2,50 (с, 3 Н). Масло (380 мг, 2,1 ммоль) и сульфамид (820 мг, 8,5 ммоль) объединяли в диоксане (15 мл), кипятили с обратным холодильником в течение 1,5 ч и упаривали в вакууме, чтобы получить неочищенный остаток. Остаток очищали посредством колоночной хроматографии (этилацетат/гептан 1:1) и полученное твердое вещество перекристаллизовывали из смеси этилацетат/гексан, чтобы получить указанное в названии соединение в виде белого твердого вещества. Т.п. 97-98 С. МС: 257 (М-1). Аналит. расчет: С, 46,50; Н, 5,46; N, 10,85; S, 12,41 Аналит. найдено: С, 46,48; Н, 5,65; N, 10,90; S, 12,07 1 Н ЯМР (CDCl3):6,86 (м, 4 Н), 4,52 (ушир.с, 2 Н), 4,46 (м, 1 Н), 4,29 (дд, J=2,3, 11,5 Гц, 1 Н), 4,05 (дд,J=6,5, 11,5 Гц, 1 Н), 3,51 (дд, J=6,7, 14,9 Гц, 1 Н), 3,40 (дд, J=5,9, 14,9 Гц, 1 Н), 2,99 (с, 3 Н). Нижеследующая процедура описана в примере 4, приведенном выше, 4-хлоркатехол подвергали реакции, чтобы получить смесь (2S)-С-(7-хлор-2,3-дигидробензо[1,4]диоксин-2-ил)метиламина и(2S)-С-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-ил)метиламина (соотношение изомеров 6-хлор:7-хлор,определенное с помощью RP HPLC, составляло приблизительно 3:1). Смесь растворяли в 2-пропаноле (100 мл) и добавляли 1 н. раствор HCl в диэтиловом эфире до получения pH 1,0. Хлористо-водородную соль, которая выпадала в осадок, фильтровали (2,65 г) и перекристаллизовывали из смеси метанол/IPA для получения белых кристаллов. Белые кристаллы распределяли между DCM и разбавленным раствором NaOH. DCM-часть сушили и упаривали в вакууме, чтобы получить очищенный (2S)-С-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-ил)метиламин в виде масла.[]D=-67,8 (c=1,51, CHCl3). Масло (7,75 ммоль) и сульфамид (1,50 г, 15,5 ммоль) объединяли в диоксане (50 мл) и кипятили с обратным холодильником в течение 2 ч, охлаждали до комнатной температуры и упаривали в вакууме,чтобы получить твердое вещество. Продукт очищали колоночной флеш-хроматографией, используя смесь DCM/метанол (20:1), чтобы получить указанное в названии соединение в виде белого твердого вещества. МС: 277 (М-1).(2S)-С-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-ил)метиламина, полученной выше, выделяли (соотношение изомеров 6-хлор:7-хлор составляло приблизительно 1:1) и упаривали в вакууме, чтобы получить твердое вещество, которое распределяли между DCM (200 мл) и разбавленным раствором NaOH (0,5 М, 50 мл). Раствор DCM промывали 1 раз соляным раствором, сушили (Na2SO4) и упаривали в вакууме, чтобы получить масло, которое очищали посредством HPLC с обращенной фазой (10-50% ACN (ацетонитрила) с 0,16% TFA в воде с 0,20% TFA) для получения (2S)-С-(7-хлор-2,3-дигидробензо[1,4]диоксин-2-ил)метиламина в виде остатка. Остаток объединяли с сульфамидом (0,90 г, 9,4 ммоль) в диоксане (25 мл) и кипятили с обратным холодильником в течение 2,5 ч, охлаждали до комнатной температуры и упаривали в вакууме, чтобы получить масло. Масло очищали колоночной флеш-хроматографией, используя смесь DCM/метанол, в соотношении 10:1, чтобы получить (2S)-(-)-N-(7-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамид в виде белого твердого вещества. МС: 277 (М-1). 1 Н ЯМР (CDCl3/CD3OD):6,88 (д, J=0,7 Гц, 1 Н), 6,81 (м, 2 Н), 4,37 (м, 1 Н), 4,30 (дд, J=2,3, 11,6 Гц,1 Н), 4,04 (дд, J=7,0, 11,6 Гц, 1 Н), 3,38 (м, 2 Н). Пример 8. Хроман-2-илметилсульфамид (соединение 10)(40 мл) и ДМФА (10 мл). Добавляли диметиламинопропилэтилкарбодиимид (EDC, 4,84 г, 25 ммоль) при комнатной температуре и реакционную смесь перемешивали в течение 30 мин. Добавляли гидроксид аммония (2,26 мл, 33,4 ммоль) и реакционную смесь перемешивали в течение 16 ч. Реакционную смесь разбавляли DCM (50 мл) и водой (50 мл). С помощью 1 н. раствора HCl pH смеси устанавливали приблизительно равным 3,0. DCM отделяли и водную фазу экстрагировали DCM дважды. Объединенную фазуDCM сушили (Na2SO4) и упаривали в вакууме, чтобы получить масло, которое очищали колоночной флеш-хроматографией (этилацетат). Масло (5,35 г, 30 ммоль) в ТГФ (90 мл) перемешивали при добавлении 1 М LAH в ТГФ (36 мл,36 ммоль); затем реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Реакцию гасили водой, перемешивали в течение 2 ч, раствор декантировали, сушили (Na2SO4) и упаривали в вакууме, чтобы получить С-хроман-2-илметиламин в виде маслянистого амина. Маслянистый амин (1,63 г, 10 ммоль) и сульфамид (1,92 г, 20 ммоль) объединяли в диоксане (50 мл) и доводили до температуры образования флегмы в течение 2 ч. Раствор охлаждали и упаривали в вакууме для получения масла, которое очищали колоночной хроматографией (DCM:метанол=10:1), чтобы получить белое твердое вещество. Твердое вещество перекристаллизовывали из смеси этилацетат/гексан,- 18013685 чтобы получить хроман-2-илметилсульфамид в виде белого твердого вещества. Т.п. 100-101 С. МС: 241 (М-1). Аналит. расчет: С, 49,57; Н, 5,82; N, 11,56; S, 13,23 Аналит. найдено: С, 49,57; Н,5,80; N, 11,75; S, 13,33 Пример 9. Хроман-2-илметилсульфамат (соединение 11)(30 мл, 30 ммоль) и перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили водой и затем перемешивали в течение 2 ч. ТГФ раствор декантировали с твердого вещества, которое промывали свежеприготовленным ТГФ. Объединенный ТГФ раствор сушили (Na2SO4) и упаривали в вакууме, чтобы получить хроман-2-илметанол в виде масла. Хроман-2-илметанол (1,97 г, 12 ммоль) в ДМФА (30 мл) охлаждали на ледяной бане в атмосфере аргона до приблизительно 0C, объединяли с 95% NaH (0,39 г, 15,6 ммоль) и перемешивали в течение 30 мин. Затем к реакционной смеси добавляли сульфамоилхлорид (2,78 г, 24 ммоль) и перемешивали в течение 1 ч. Реакционную смесь разбавляли этилацетатом (100 мл) и водой (100 мл). Раствор в этилацетате отделяли, а водную фазу дважды экстрагировали этилацетатом. Объединенную этилацетатную фазу сушили (MgSO4), упаривали в вакууме, чтобы получить масло, которое очищали колоночной флешхроматографией (этилацетат/гексан 1:2), в виде белого твердого вещества, которое перекристаллизовывали из смеси этилацетат/гексан для получения указанного в названии соединения в виде белого твердого вещества. Т.п. 87-90 С. МС: 242,1 [М-Н]-. Аналит. расчет: С, 49,37; Н, 5,39; N, 5,76; S, 13,18 Аналит. найдено: С, 49,46; Н, 5,17; N, 5,72; S, 13,09 Пример 10. 2-(2,3-Дигидробензо[1,4]диоксин-2-ил)этилсульфамид (соединение 16)(6,87 г, 30 ммоль) в ДМСО (90 мл) и перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь затем разбавляли водой (250 мл) и дважды экстрагировали диэтиловым эфиром. Диэтиловый эфир промывали водой, затем дважды промывали соляным раствором, сушили (Na2SO4) и упаривали в вакууме, чтобы получить 2-цианометил-(2,3-дигидробензо[1,4]диоксин) в виде белого твердого вещества. 1BH3 в ТГФ (80 мл, 80 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 5 ч,затем перемешивали при комнатной температуре в течение 16 ч. При охлаждении на ледяной бане добавляли 2 н. HCl до pH 1,0. Реакционную смесь затем перемешивали в течение 1 ч при комнатной температуре и упаривали в вакууме, чтобы получить масло. Масло распределяли между 3 н. NaOH и диэтиловым эфиром и раствор в диэтиловом эфире промывали соляным раствором, сушили (Na2SO4) и упаривали в вакууме, чтобы получить неочищенный 2-(2,3-дигидробензо[1,4]диоксин-2-ил)этиламин. МС: 180 (М+Н)+. Неочищенный 2-(2,3-дигидробензо[1,4]диоксин-2-ил)этиламин в диоксане (100 мл) объединяли с сульфамидом (3,0 г, 31 ммоль) и нагревали до температуры образования флегмы в течение 2 ч. Раствор охлаждали и упаривали в вакууме, чтобы получить оранжевое твердое вещество, которое очищали колоночной хроматографией (DCM:MeOH=10:1) для получения белого твердого вещества. Твердое вещество перекристаллизовывали из DCM, чтобы получить указанное в названии соединение в виде твердого вещества. МС: 257 (М-1). Т.п. 101-103 С (уточн.). 1 Н ЯМР (CDCl3):6,86 (м, 4 Н), 4,70 (м, 1 Н), 4,52 (с, 2 Н), 4,30 (м, 2 Н), 3,94 (дд, J=7,4, 11,3 Гц, 1 Н),3,43 (дд, J=6,4, 12,9 Гц, 2 Н), 1,94 (дд, J=6,5, 12,9 Гц, 2 Н). Элементный анализ: Измерено: С, 46,48; Н, 5,60; N, 10,81; S, 12,41 Расчет: С, 46,50; Н, 5,46; N, 10,85; S, 12,41(200 мл). Добавляли (2R)-глицидилтозилат (9,12 г, 40 ммоль) и реакционную смесь перемешивали при 60 С в течение 24 ч. Реакционную смесь охлаждали до комнатной температуры и затем разбавляли ледяной водой (600 мл) и экстрагировали диэтиловым эфиром (4 раза). Объединенный органический раствор промывали 3 раза 10% карбонатом калия, дважды соляным раствором, сушили (MgSO4) и упаривали в вакууме, чтобы получить густое масло(2S)-2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксин)метанола. Масло (2S)-2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксин)метанола (6,4 г, 27 ммоль) растворяли в пиридине (50 мл) и охлаждали до 0 С. Затем добавляли п-толуолсульфонилхлорид (5,2 г, 27 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь разбавляли диэтиловым эфиром и 1 н. раствором HCl (750 мл). Отделяли органический слой и промывали 2 раза 1 н. раствором HCl (250 мл), 1 раз водой (150 мл), 2 раза соляным раствором, сушили (MgSO4) и упаривали в вакууме, чтобы получить светло-желтое твердое вещество (2S)-6,7-дихлор-2,3-дигидробензо[1,4]диоксин-2-илметилового сложного эфира толуол-4-сульфокислоты. 1 Н ЯМР (CDCl3):7,79 (д, J=8,3 Гц, 2 Н), 7,36 (д, J=8,0 Гц, 2 Н), 6,94 (с, 1 Н), 6,83 (с, 1 Н), 4,37 (м,1 Н), 4,2 (м, 3 Н), 4,03 (дд, J=6,3, 11,7 Гц, 1 Н), 2,47 (с, 3 Н).(8,0 г, 20,5 ммоль) объединяли с фталимидом калия (6,1 г, 33 ммоль) в ДМФА (75 мл) и нагревали до кипения в течение 1 ч; охлаждали до комнатной температуры и при энергичном перемешивании вливали в воду (0,5 л) и затем перемешивали 30 мин. Белое твердое вещество фильтровали и твердое вещество промывали несколько раз водой, 2% раствором NaOH и снова водой, затем оставляли сушиться на воздухе, чтобы получить (2S)-2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксин-2-илметил)изоиндол-1,3-дион(6,0 г, 80%) в виде белого порошкообразного твердого вещества. Белое порошкообразное твердое вещество объединяли с гидразином (1,06 г, 33 ммоль) в EtOH(80 мл) и нагревали при кипении в течение 2 ч, затем охлаждали до комнатной температуры. Добавляли 1 н. раствор HCl, чтобы установить pH реакционной смеси равным 1,0, и затем реакционную смесь перемешивали в течение 15 мин. Белое твердое вещество фильтровали и промывали свежеприготовленнымEtOH (твердое вещество отбрасывали), а фильтрат упаривали в вакууме до твердого вещества, которое распределяли между диэтиловым эфиром и разбавленным водным раствором NaOH. Раствор в диэтиловом эфире сушили (Na2SO4) и упаривали в вакууме до получения густого масла (2S)-2-аминометил-(6,7 дихлор-2,3-дигидробензо[1,4]диоксина). 1 Н ЯМР (CDCl3):6,98 (с, 1 Н), 6, 96 (с, 1 Н), 4,25 (дд, J=2,0, 11,2 Гц, 1 Н), 4,15 (м, 1 Н), 4,0 (м, 1 Н),2,97 (д, J=5,5 Гц, 2 Н). Часть масла (3,8 г, 16 ммоль) и сульфамид (3,1 г, 32,4 ммоль) в течение 2 ч кипятили в диоксане с обратным холодильником (100 мл). Неочищенный продукт очищали колоночной флеш-хроматографией(DCM:MeOH 20:1), чтобы получить указанное в названии соединение в виде белого твердого вещества,которое перекристаллизовывали из смеси этилацетат/гексан для получения указанного в названии соединения в виде белого кристаллического твердого вещества. МС: 311,0 [М-Н]-. Т.п. 119-121 С.Pd/C в метаноле (120 мл) и встряхивали в атмосфере водорода (39 фунт/дюйм 2 (psi при комнатной температуре в течение 3 ч. Твердые вещества фильтровали и промывали 10% М в DCM и фильтрат упаривали в вакууме, чтобы получить неочищенный продукт. Неочищенный продукт растворяли в 0,2 н. HCl(25 мл), замораживали и подвергали лиофилизации, чтобы получить указанное в названии соединение в форме соответствующей хлористо-водородной соли в виде белого хлопьевидного твердого вещества. МС: 260 (М+Н)+. 1 Указанное в названии соединение получали по методике, описанной в примере 4, приведенном выше, исходя из 4-метилкатехола, чтобы получить белое твердое вещество, которое перекристаллизовывали из смеси этилацетат/гексан для получения указанного в названии соединения в виде белого твердого вещества. МС: 257 [М-Н]-. 1 Н ЯМР (CDCl3):6,76 (м, 1 Н), 6,66 (м, 2 Н), 4,80 (м, 1 Н), 4,57 (шир.с, 1 Н), 4,40 (м, 1 Н), 4,28 (м, 1 Н),4,03 (дд, J=6,9, 11,4 Гц, 1 Н), 3,45 (м, 2 Н), 2,25 (с, 3 Н). Элементный анализ: Расчет: С, 46,50; Н, 5,46; N, 10,85; S, 12,41 Найдено: С, 46,65; Н, 5,60; N, 10,84; S, 12,61 Пример 14. 6,7-Дихлор-2,3-дигидробензо[1,4]диоксин-2-илметиловый эфир сульфаминовой кислоты (соединение 27)(2S)-6,7-Дихлор-2,3-дигидробензо[1,4]диоксин-2-илметанол (2,0 г, 8,5 ммоль), полученный по методике, описанной в примере 11, приведенном выше, в ДМФА (20 мл) охлаждали на ледяной бане. Затем в атмосфере аргона добавляли 95% гидрид натрия (0,28 г, 11 ммоль) и реакционную смесь перемешивали 30 мин. Добавляли сульфамоилхлорид (1,97 г, 17 ммоль) и реакционную смесь перемешивали с охлаждением на ледяной бане. Через 1 ч реакционную смесь разбавляли водой (50 мл) и 3 раза экстрагировали этилацетатом. Объединенный этилацетат промывали соляным раствором, сушили (Na2SO4) и упаривали в вакууме до получения масла, которое очищали колоночной флеш-хроматографией (этилацетат/гептан 1:1), чтобы получить белое твердое вещество. Белое твердое вещество перекристаллизовывали из бензола для получения указанного в названии соединения в виде белого твердого вещества. Т.п. 109-111 С. МС: 312 [М-Н]-. 1(2S)-6-Хлор-2,3-дигидробензо[1,4]диоксин-2-илметанол (6,4 г, 32 ммоль) получали по методике,описанной в пример 7, приведенном выше, в ДМФА (80 мл) охлаждали на ледяной бане. Затем в атмосфере аргона на протяжении 20 мин добавляли 95% гидрид натрия (1,06 г, 42 ммоль) и 30 мин перемешивали реакционную смесь. На протяжении 10 мин добавляли сульфамоилхлорид (7,4 г, 64 ммоль) и реакционную смесь перемешивали, охлаждая на ледяной бане. Через 1 ч реакционную смесь разбавляли водой (300 мл) и 3 раза экстрагировали этилацетатом. Объединенные экстракты этилацетата промывали соляным раствором, сушили (MgSO4) и упаривали в вакууме, чтобы получить масло, которое очищали колоночной флеш-хроматографией (этилацетат/гексан 1:2) для получения белого твердого вещества. Белое твердое вещество 3 раза перекристаллизовывали из бензола, чтобы получить указанное в названии соединение в виде белого твердого вещества. Т.п. 113-116 С. МС: 278 [М-Н]-.[]D=-41,0 (с=1,32, М). Н ЯМР (CDCl3):6,91 (д, J=1,9 Гц, 1 Н), 6,84 (м, 2 Н), 4,82 (ушир.с, 2 Н), 4,50 (м, 1 Н), 4,41 (м, 2 Н),4,31 (дд, J=2,3, 11,6 Гц, 1 Н), 4,12 (дд, J=6,3, 11,6 Гц, 1 Н). Элементный анализ: Измерено: С, 38,57; Н, 3,42; N, 4,92; S, 11,53 Расчет: С, 38,65; Н, 3,60; N, 5,01; S, 11,46 Пример 16. Анализ in vivo. Тестирование максимальным электрошоком (MES). Противосудорожную активность определяли, используя тестирование MES, проводимое в соответствии с процедурой, подробно описанной ниже. Swinyard E.A., Woodhead J.H., White H.S., Franklin M.R.Drugs. 3rd ed. New York: Raven Press, 1989: 85-102. Перед тестированием самцов мышей-альбиносов линии CF-1 (25-35 г) подвергали голоданию в течение 16 ч. Мышей произвольно выбирали в контрольные и тестируемые группы. Животным давали тестируемое соединение или наполнитель, соответственно варьируя концентрации. В день анализа, за 30 мин до шока, мышам орально вводили определенную дозу наполнителя (0,5% метилцеллюлозы) или тестируемого соединения (100-300 мг/кг). Припадки инициировали транскорнеальным электрошоком, используя подаваемый в течение 0,2 с переменный ток с частотой 60 Гц и силой тока 50 мА. Мышей в тестируемых группах подвергали действию электрораздражителя с временными интервалами от 15 мин до 4 ч от момента введения тестируемого соединения. Шок мгновенно приводил к полному тоническому распрямлению тела. Тест завершали, когда наблюдали полный цикл судорожной деятельности (обычно менее чем через 1 мин после электростимуляции); и мышей мгновенно умерщвляли, осуществляя ингаляцию двуокиси углерода. Момент окончания теста рассматривали как устранение относящегося ко всему телу тонического экстензорного компонента припадка. Отсутствие этого компонента указывало на то, что тестируемое соединение обладало способностью препятствовать распространению припадка через нервную ткань. Величина ED50 тестируемого соединения (которую рассчитывали, если было необходимо) представляла собой рассчитанную дозу, необходимую для блокирования относящегося к задним конечностям тонического экстензорного компонента припадка, вызываемого MES у 50% тестируемых грызунов. Пробитанализ использовали для расчета ED50 и 95% фидуциальных пределов (FL). Типичные соединения по настоящему изобретению тестировали в соответствии с процедурой, описанной выше. Полученные результаты перечислены в табл. 3. Результаты представляют соотношение количества мышей с предотвращенным полным тоническим растяжением тела к общему количеству тестируемых на данное время мышей (при данном уровне дозировки тестируемого соединения). 1- 22013685 Таблица 3 Активность по отношению к MES-стимуляции у мышей Пример 17. В качестве конкретного варианта осуществления оральной композиции 100 мг соединения 8, получаемого аналогично описанному в примере 7, формируют вместе с мелкоизмельченной лактозой, количество которой достаточно для обеспечения суммарного количества, от 580 до 590 мг, необходимого для заполнения капсулы из твердого геля 0-го размера. В то время как в предшествующем описании показаны основные принципы настоящего изобретения вместе с примерами, приведенными в целях иллюстрации, будет понятно, что практика изобретения включает в себя все обычные варианты, приспособления и/или модификации, которые включены в объем нижеследующей формулы изобретения, и их эквиваленты. в которой R1 и R2, каждый независимо, выбирают из группы, состоящей из водорода и алкила, содержащего от 1 до 4 атомов углерода;R4 выбирают из группы, состоящей из водорода и алкила, содержащего от 1 до 4 атомов углерода; а является целым числом от 1 до 2; структуру где b представляет собой целое число от 0 до 4; каждый R5 независимо выбирают из группы, состоящей из галогена, алкила, содержащего от 1 до 4 атомов углерода, и нитро; при условии, что когда структура тогда а=1; или его фармацевтически приемлемая соль. 2. Соединение по п.1, в которомR1 и R2, каждый независимо, выбирают из группы, состоящей из водорода и алкила, содержащего от 1 до 4 атомов углерода;R4 выбирают из группы, состоящей из водорода и алкила, содержащего от 1 до 4 атомов углерода; а является целым числом от 1 до 2; структуру где b представляет собой целое число от 0 до 2; каждый R5 независимо выбирают из группы, состоящей из галогена, алкила, содержащего от 1 до 4 атомов углерода, и нитро; при условии, что когда структура тогда а=1; или его фармацевтически приемлемая соль. 3. Соединение по п.1 или 2, в которомR1 и R2, каждый независимо, выбирают из группы, состоящей из водорода и алкила, содержащего от 1 до 4 атомов углерода;R4 выбирают из группы, состоящей из водорода и метила; а является целым числом от 1 до 2; выбирают из группы, состоящей из структуру 2-(2,3-дигидробензо[1,4]диоксинила),2-(бензо[1,3]диоксолила),3-(3,4-дигидро-2 Н-бензо[1,4]диоксепинила),2-(2,3-дигидробензо[1,4]диоксинила),2-(6-хлор-2,3-дигидробензо[1,4]диоксинила),- 24013685 2-(6-фтор-2,3-дигидробензо[1,4]диоксинила),2-(хроманила),2-(5-фтор-2,3-дигидробензо[1,4]диоксинила),2-(7-хлор-2,3-дигидробензо[1,4]диоксинила),2-(6-хлорбензо[1,3]диоксолила),2-(7-нитро-2,3-дигидробензо[1,4]диоксинила),2-(7-метил-2,3-дигидробензо[1,4]диоксинила),2-(5-хлор-2,3-дигидробензо[1,4]диоксинила),2-(6-бром-2,3-дигидробензо[1,4]диоксинила),2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинила),2-(8-хлор-2,3-дигидробензо[1,4]диоксинила),2-(2,3-дигидронафто[2,3-b][1,4]диоксинила) и 2-(4-метилбензо[1,3]диоксолила); является 3-(3,4-дигидро-2 Н-бензо[1,4]диоксепинилом), тогда при условии, что когда структура а=1; или его фармацевтически приемлемая соль. 4. Соединение по п.3, в которомR1 и R2, каждый независимо, выбирают из группы, состоящей из водорода и метила;R4 выбирают из группы, состоящей из водорода и метила; а является целым числом от 1 до 2; выбирают из группы, состоящей из структуру 2-(бензо[1,3]диоксолила),2-(2,3-дигидробензо[1,4]диоксинила),2-(2,3-дигидробензо[1,4]диоксинила),2-(6-хлор-2,3-дигидробензо[1,4]диоксинила),2-(7-хлор-2,3-дигидробензо[1,4]диоксинила),2-(7-метил-2,3-дигидробензо[1,4]диоксинила),2-(6-бром-2,3-дигидробензо[1,4]диоксинила) и 2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинила); или его фармацевтически приемлемая соль. 5. Соединение, выбранное из группы, состоящей из N-[(6-хлор-2,3-дигидро-1,4-бензодиоксин-2 ил)метил]сульфамида, и его фармацевтически приемлемая соль. 6. Соединение, выбранное из группы, состоящей из и его фармацевтически приемлемая соль. 7. Соединение формулы (III) или его фармацевтически приемлемая соль. 8. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение по п. 1. 9. Фармацевтическая композиция, получаемая смешиванием соединения по п.1 и фармацевтически приемлемого носителя. 10. Способ получения фармацевтической композиции, включающий смешивание соединения по п.1 и фармацевтически приемлемого носителя. 11. Способ лечения эпилепсии или родственных расстройств у субъекта, нуждающегося в лечении,включающий введение субъекту терапевтически эффективного количества соединения по п.1. 12. Способ лечения эпилепсии у субъекта, нуждающегося в лечении, включающий введение субъекту терапевтически эффективного количества соединения по п.1. 13. Способ по п.11, в котором расстройство выбирают из эссенциального тремора или синдрома неспокойных конечностей. 14. Применение соединения по п.1 для получения лекарственного средства для лечения эпилепсии или родственных расстройств у субъекта, нуждающегося в лечении. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61P 25/08, C07D 321/08, C07D 317/58, A61K 31/357, A61K 31/353, C07D 319/20, C07D 311/58
Метки: сульфамидные, расстройств, производные, сульфаматные, родственных, лечения, эпилепсии
Код ссылки
<a href="https://eas.patents.su/26-13685-sulfamatnye-i-sulfamidnye-proizvodnye-dlya-lecheniya-epilepsii-i-rodstvennyh-rasstrojjstv.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфаматные и сульфамидные производные для лечения эпилепсии и родственных расстройств</a>
Предыдущий патент: Гетероциклические соединения бороновой кислоты
Следующий патент: Гидрохлорид 4-[[4-[[4-(2-цианоэтенил)-2,6-диметилфенил]амино]-2-пиримидинил]амино]бензонитрила
Случайный патент: Устройство для ввода кабелей питания и волокна оптоволоконной сети населенного района












