Бициклические бензамиды производных 3- или 4-замещенного 4- (аминометил) пиперидина с гастрокинетическими свойствами
Номер патента: 2619
Опубликовано: 27.06.2002
Авторы: Босман Жан-Поль Рене Мари Андре, Сюркин Мишель, Де Клейн Мишель Анна Йозеф
Формула / Реферат
1. Соединение формулы (I)

его стереохимически изомерная форма, его N-оксидная форма, или его фармацевтически приемлемая аддитивная соль кислоты или основания, где
R1 и R2, взятые вместе, образуют двухвалентный радикал формулы
-O-СН2-O- (а-1)
-O-СН2-СН2- (а-2)
-O-СН2-СН2-O- (а-3)
-O-СН2-СН2-СН2- (а-4)
-O-СН2-СН2-СН2-O- (а-5)
-O-СН2-СН2-СН2-СН2- (а-6),
где в указанных двухвалентных радикалах один или два атома водорода могут быть замещены C1-6алкилом,
R3 представляет водород или галоген,
R4 представляет водород или C1-6алкил,
R5 представляет водород или C1-6алкил,
L представляет С3-6циклоалкил, С5-6 циклоалканон или С2-6алкенил или
L представляет радикал формулы
-Alk-R6 (b-1)
-Alk-X-R7 (b-2)
-Alk-Y-C(=O)-R9 (b-3) или
-Alk-Y-C(=O)-NR11R12 (b-4),
где каждый Alk представляет С1-12алкандиил, и
R6 представляет водород, гидрокси, циано, C1-6алкилсульфониламино, С3-6циклоалкил, С5-6циклоалканон или Het1,
R7 представляет водород, C1-6алкил, гидроксиС1-6алкил, С3-6 циклоалкил или Het2,
Х представляет О, S, SO2 или NR8, причем R8 представляет водород или C1-6алкил,
R9 представляет водород, C1-6алкил, С3-6циклоалкил, C1-6алкилокси или гидрокси,
Y представляет NR10 или прямую связь, причем R10 представляет водород или C1-6алкил,
R11 и R12, каждый независимо, представляют водород, С1-6алкил, С3-6циклоалкил, или R11 и R12, объединенные с атомом азота, несущим R11 и R12, могут образовывать кольцо пирролидинила или пиперидинила, причем оба могут быть необязательно замещены C1-6алкилом, амино или моно- или ди(C1-6алкил)амино, или указанные R11 и R12, объединенные с атомом азота, несущим R11 и R12, могут образовывать пиперазинильный или 4-морфолинильный радикал, причем оба могут быть замещены C1-6алкилом, и
Het1 и Het2, каждую независимо, выбирают из фурана; фурана, замещенного C1-6алкилом или галогеном; тетрагидрофурана; тетрагидрофурана, замещенного C1-6алкилом; диоксолана; диоксолана, замещенного C1-6алкилом; диоксана; диоксана, замещенного С1-6алкилом; тетрагидропирана; тетрагидропирана, замещенного C1-6алкилом; пирролидинила; пирролидинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано или C1-6алкила; пиридинила; пиридинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6алкила; пиримидинила; пиримидинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6алкила, C1-6алкилокси, амино и моно- и ди(С1-6алкил)амино; пиридазинила; пиридазинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6алкилокси, C1-6алкила или галогена; пиразинила; пиразинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6 алкила, C1-6алкилокси, амино, моно- и ди(C1-6алкил) амино и C1-6алкилоксикарбонила,
Het1 может быть также радикалом формулы
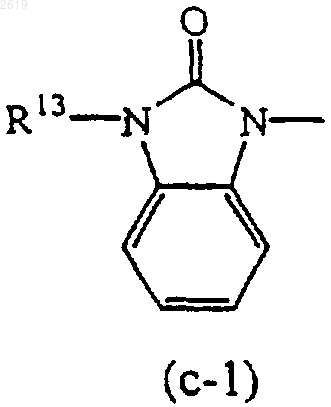
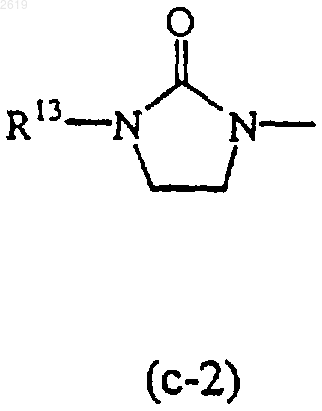

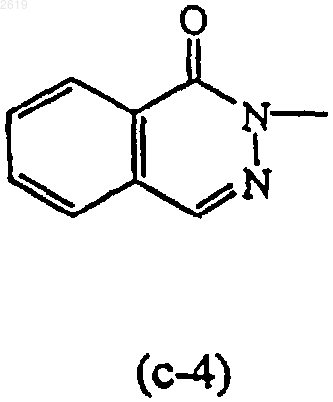
Het1 и Het2, каждый независимо, может быть также выбран из радикалов формулы
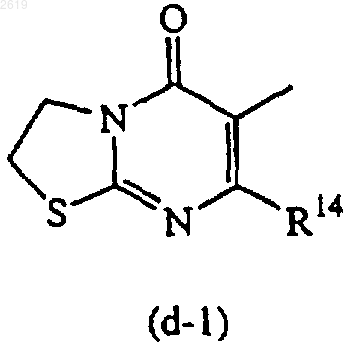
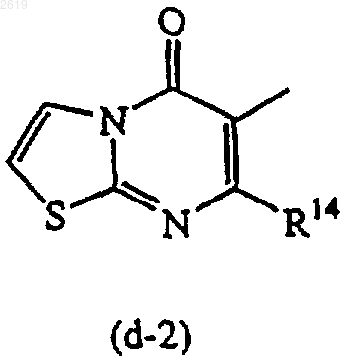
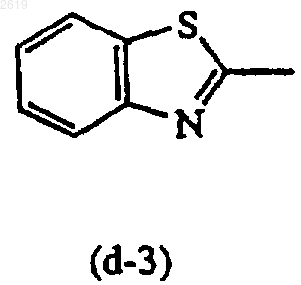
R13 и R14, каждый независимо, представляют водород или C1-4алкил.
2. Соединение по п.1, в котором радикал OR4 расположен в положении 3 центрального пиперидинового фрагмента, имеющего транс-конфигурацию.
3. Соединение по п.1, в котором радикал OR4 расположен в положении 4 центральной пиперидиновой части.
4. Соединение по любому из пп.1-3, в котором L представляет С3-6циклоалкил или С2-6алкенил; или L представляет радикал формулы (b-1), в котором каждый Alk представляет C1-6алкандиил, и R6 представляет водород, гидрокси, циано, амино, C1-6алкилсульфониламино, С3-6циклоалкил или Het1, где Het1 представляет тетрагидрофуран; диоксалан; диоксалан, замещенный C1-6алкилом; тетрагидропиран; пиридазинил, замещенный одним или несколькими заместителями, выбранными из гидрокси, галогена и C1-6алкила; или радикал формулы (с-1), (с-3) или (с-4), в котором R13 представляет С1-4алкил; или L представляет радикал формулы (b-2), в котором Alk представляет C1-6алкандиил, Х представляет О и R7 представляет C1-6алкил или гидроксиС1-6 алкил; или L представляет радикал формулы (b-2), в котором Alk представляет C1-6алкандиил, R7 представляет Het2, где Het2 представляет пиразинил, замещенный C1-6алкилом, и Х представляет NR8, где R8 представляет водород или C1-6алкил; или L представляет радикал формулы (b-3), в котором Y представляет прямую связь и R9 представляет C1-6алкил, гидрокси или C1-6алкилокси; или L представляет радикал формулы (b-4), в котором Y представляет прямую связь и R11 и R12, объединенные с атомом азота, несущим R11 и R12, образуют пирролидинил.
5. Соединение по п.4, в котором L представляет бутил; пропил, замещенный метокси, метилкарбонилом или 2-метил-1,3-диоксаланом; этил, замещенный 4-метил-2-пиридазиноном или тетрагидропиранилом; или метил, замещенный тетрагидрофуранилом или тетрагидропиранилом.
6. Соединение по п.1, представляющее собой транс-(-)-4-амино-5-хлор-2,3-дигидро-N-[[3-гидрокси-1-(3-метоксипропил)-4-пиперидинил] метил]-2,2-диметил-7-бензофуранкарбоксамид, его фармацевтически приемлемую аддитивную соль кислоты или его N-оксидную форму.
7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-6.
8. Способ приготовления фармацевтической композиции по п.7, в котором терапевтически активное количество соединения по любому из пп.1-6 тщательно смешивают с фармацевтически приемлемым носителем.
9. Соединение формулы (III)
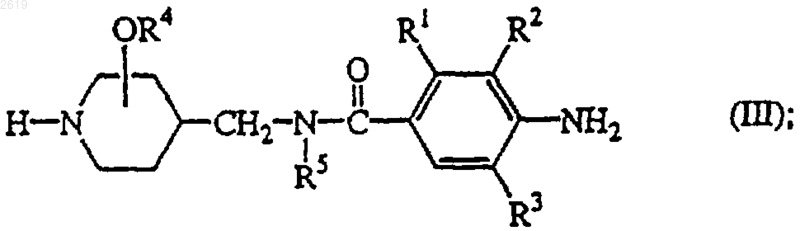
его фармацевтически приемлемая аддитивная соль кислоты или его стереохимически изомерная форма, где R1, R2, R3, R4 и R5 такие, как они определены в п.1 для соединения формулы (I).
10. Способ получения соединения формулы (I) реакцией N-алкилирования промежуточного соединения формулы (II) промежуточным соединеншхь формулы (III) в реакционно-инертном растворителе и, необязательно, в присутствии подходящего основания
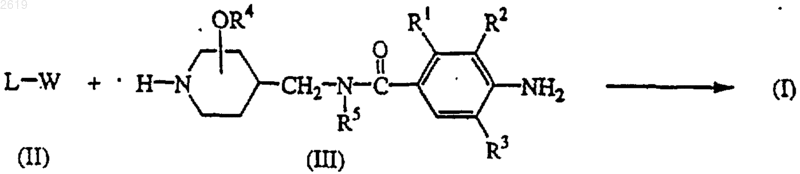
и, необязательно, одно полученное соединение формулы (I) превращают в другое соединение формулы (I) по известным реакциям превращения; или, если требуется, соединение формулы (I) превращают в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) превращают в форму свободного основания щелочью; или, если требуется, получают его стереохимически изомерные формы.
11. Способ получения соединения формулы (I) реакцией соответствующего кетонового или альдегидного промежуточного соединения формулы L'=О (IV), где указанное L'=O является соединением формулы L-H, в котором два сдвоенных атома водорода в C1-12алкандиильной группе замещены на =O, с промежуточным соединением формулы (III)
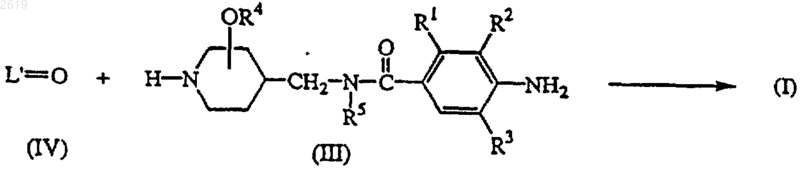
и, необязательно, одно полученное соединение формулы (I) превращают в другое соединение формулы (I) по известным реакциям превращения; или, если требуется, соединение формулы (I) превращают в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) превращают в форму свободного основания щелочью; или, если требуется, получают его стереохимически изомерные формы.
12. Способ получения соединения формулы (I) реакцией промежуточного соединения формулы (V) с производным карбоновой кислоты формулы (VI) или его реакционноспособным функциональным производным
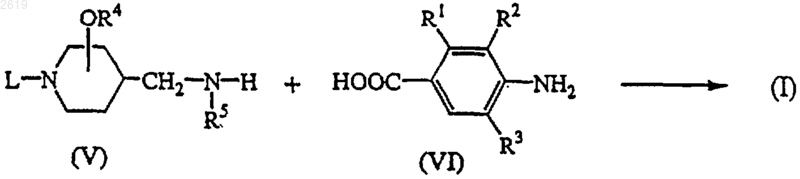
и, необязательно, превращением одного полученного соединения формулы (I) в другое соединение формулы (I) по известным реакциям превращения; или, если требуется, превращением соединения формулы (I) в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, превращением аддитивной соли кислоты соединения формулы (I) в форму свободного основания щелочью; или, если требуется, получением его стереохимически изомерной формы.
13. Способ получения соединения формулы (I) реакцией карбонилирования промежуточного соединения формулы (VII), в котором Х представляет бром или йод, в присутствии промежуточного соединения формулы (V) в реакционно-инертном растворителе в присутствии подходящего катализатора и третичного амина и при температуре в интервале между комнатной температурой и температурой дефлегмации реакционной смеси
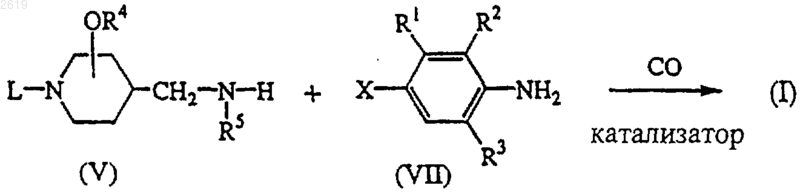
где в вышеприведенной схеме реакции радикалы L, R1, R2, R3, R4 и R5 такие, как они определены в п.1, и W представляет подходящую отщепляемую группу; и, необязательно, одно полученное соединение формулы (I) превращают в другое соединение формулы (I) по известным реакциям превращения; или, если требуется, соединение формулы (I) превращают в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) превращают в форму свободного основания щелочью; или, если требуется, получают его стереохимически изомерные формы.
14. Способ получения соединения формулы (III) реакцией промежуточного соединения формулы (VIII), в котором PG представляет подходящую защитную группу с кислотой формулы (VI) или ее реакционноспособным функциональным производным в реакционно-инертном растворителе с последующим снятием защиты, дающим соединения формулы (III)
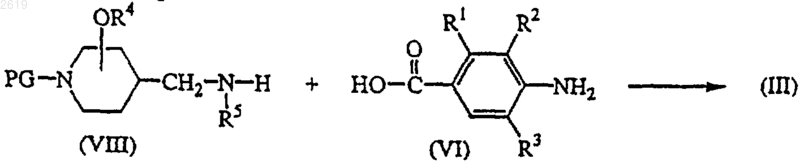
где в вышеприведенной схеме реакции радикалы L, R1, R2, R3, R4 и R5 такие, как они определены в п.1, и W представляет подходящую отщепляемую группу; и, необязательно, одно полученное соединение формулы (III) превращают в другое соединение формулы (III) по известным реакциям превращения; или, если требуется, соединение формулы (III) превращают в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (III) превращают в форму свободного основания щелочью; или, если требуется, получают его стереохимически изомерные формы.
Текст
1 Настоящее изобретение относится к новым соединениям формулы (I), имеющим превосходные гастрокинетические свойства. Кроме того, изобретение относится к способам получения таких новых соединений, фармацевтическим композициям, содержащим указанные новые соединения, а также к применению указанных соединений в качестве лекарств.Journal of Medicinal Chemistry, 1993, 36,pp.4121-4123 описывает 4-амино-N-[(1-бутил-4 пиперидинил)метил]-5-хлор-2-метоксибензамид как сильный и селективный антагонист рецептора 5 НТ 4.WO 93/05038, опубликованная 18 марта 1993 (SmithKline Beecham PLC), описывает ряд замещенных 4-пиперидинилметил-8-амино-7 хлор-1,4-бензодиоксан-5-карбоксамидов,имеющих антагонистическую активность по отношению к рецептору 5 НТ 4.(SmithKline Beecham PLC), описывает ряд производных замещенного 4-пиперидинилметилоксазино[3,2-а]индолкарбоксамида, имеющих антагонистическую активность к рецептору 5HT4. Все вышеупомянутые ранее известные источники обнаруживают, что замещенные 4 пиперидинилметилкарбоксамиды и их аналоги имеют антагонистическую активность к 5 НТ 4 рецептору. Указывается, что соединения, проявляющие 5 НТ 4-антагонизм представляют потенциальный интерес для лечения, например, синдрома воспаленного кишечника, в особенности такого аспекта синдрома воспаленного кишечника, как диаррея, т.е. эти соединения блокируют способность 5 НТ (что обозначает 5 гидрокситриптамин или серотонин) стимулировать кишечную подвижность (см. WO 93/05038,стр.8, строки 12-17). Основным отличием в структуре этих гастрокинетических соединений является присутствие гидрокси- или алкилоксигруппы на центральном пиперидиновом кольце.WO 93/16072, опубликованная 19 августа 1993, описывает 5-амино-N-[(1-бутил-4-пиперидинил)метил]-6-хлор-3,4-дигидро-2 Н-1-бензопиран-8-карбоксамид, имеющий антагонистическую активность к 5 НТ 4-рецептору. В BioorganicMedicinal Chem.Lett., 1996,6, pp.263-266 и в WO 96/33186, опубликованной 24 октября 1996 (Pharmacia S.P.A.), описан 4 амино-N-(1-бутил-4-пиперидинил)метил-5 хлор-2,3-дигидро-7-бензофуранкарбоксамид,имеющий антагонистическую активность к 5 НТ 4-рецептору. Соединения по настоящему изобретению отличаются от соединений по ранее опубликованным документам благодаря наличию гидрокси- или C1-6-алкилоксигруппы в положении 3 центрального пиперидинового кольца. ЕР-0 299 566, опубликованный 18 января 1989, описывает N-(3-гидрокси-4-пиперидинил) бензамиды, имеющие стимулирующую актив 002619 2 ность по отношению к желудочно-кишечной подвижности. ЕР-0 309 043, опубликованный 29 марта 1989, описывает замещенные N-(1-алкил-3 гидрокси-4-пиперидинил)бензамиды, имеющие стимулирующую активность по отношению к желудочно-кишечной подвижности. ЕР-0 389 037, опубликованный 26 сентября 1990, описывает производные N-(3-гидрокси-4 пиперидинил)(дигидробензофуран, дигидро-2 Нбензопиран или дигидробензодиоксин) карбоксамида, имеющие стимулирующую активность по отношению к желудочно-кишечной подвижности. Все три последние из ранее опубликованных документов описывают производные карбоксамида, в которых амидная функциональная группа непосредственно связана с пиперидиновым кольцом, тогда как все соединения по настоящему изобретению имеют амидную функциональную группу, где между азотом карбамоила и пиперидиновым кольцом имеется метиленовая группа. ЕР-0 774 460 от 21 мая 1997 и WO 97/11054 от 27 марта 1997 описывают ряд соединений бензойной кислоты в качестве агонистов 5-НТ 4, используемых для лечения расстройств желудочной подвижности. Соединения по настоящему изобретению отличаются от описанных в двух последних документах, благодаря присутствию гидроксиили C1-6-алкилоксигруппы в положении 3 или 4 центрального пиперидинового кольца. Кроме того, соединения по настоящему изобретению, в которых R2 не есть водород, отличаются также и структурно от соединений по указанным ранее опубликованным документам. Задача, которую решает данное изобретение - обеспечение соединения, имеющего свойства стимулировать желудочно-кишечную подвижность, в особенности имеющего превосходную активность в опорожнении желудка. Предпочтительно указанные соединения должны быть активными при пероральном введении. Решение этой задачи обеспечивается новыми соединениями формулы (I), которые отличаются структурно от ранее известных, среди прочего, присутствием гидрокси- или C1-6 алкилоксигруппы в положении 3 или 4 центрального пиперидинового кольца или присутствием метиленовой группы между карбамоиловой группой и пиперидиновым кольцом. Настоящее изобретение относится к соединению формулы (I) его стереохимически изомерной форме, его Nоксидной форме или к его фармацевтически 3 приемлемой аддитивной соли кислоты или основания, гдеR1 и R2, взятые вместе, образуют двухвалентный радикал формулы-О-СН 2-СН 2-СН 2-СН 2- (а-6),где в указанных двухвалентных радикалах один или два атома водорода могут быть замещеныR3 представляет водород или галоген;R4 представляет водород или C1-6 алкил;R5 представляет водород или C1-6 алкил;R7 представляет водород, C1-6 алкил, гидроксиС 1-6 алкил, С 3-6-циклоалкил или Het2; Х представляет О, S, SO2 или NR8, причем указанный R8 представляет водород или C1-6 алкил;Y представляет NR10 или непосредственную связь, причем указанный R10 представляет водород или C1-6 алкил;R11 и R12, могут образовывать пирролидинильное или пиперидинильное кольцо, причем оба могут быть необязательно замещены C1-6 алкилом, амино или моно- или ди(C1-6 алкил)амино, или указанные R11 и R12, соединенные с атомом азота, несущим R11 и R12, могут образовывать пиперазинильный или 4-морфолинильный радикал, причем оба могут быть замещены C1-6 алкилом; иHet1 и Het2 каждый независимо выбран из фурана; фурана, замещенного C1-6 алкилом или галогеном; тетрагидрофурана; тетрагидрофурана, замещенного C1-6 алкилом; диоксолана; диоксолана, замещенного C1-6 алкилом; диоксана; диоксана, замещенного C1-6 алкилом; тетрагидропирана; тетрагидропирана, замещенного C1-6 алкилом; пирролидинила; пирролидинила, замещенного одним или двумя заместителями,каждый из которых независимо выбран из галогена, гидрокси, циано или C1-6 алкила; пиридинила; пиридинила, замещенного одним или двумя заместителями, каждый из которых неза 002619 4 висимо выбран из галогена, гидрокси, циано или C1-6 алкила; пиримидинила; пиримидинила,замещенного одним или двумя заместителями,каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6 алкила, С 1-6 алкилокси, амино и моно- и ди(C1-6 алкил) амино; пиридазинила; пиридазинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6 алкилокси,C1-6 алкила или галогена; пиразинила; пиразинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6 алкила, C1-6 алкилокси, амино, моно- и ди(C1-6 алкил)амино иHet1 может быть также радикалом формулыHet1 и Het2, каждый независимо, может быть также выбран из радикалов формулыR13 и R14, каждый независимо, представляют водород или C1-4 алкил. Как использовано в предшествующих определениях, галоген представляет общее родовое название для фтора, хлора, брома и йода; С 1-4 алкил обозначает насыщенные углеводород 5 ные радикалы с прямой и разветвленной цепью,имеющие от 1 до 4 атомов углерода, такие как,например, метил, этил, пропил, бутил, 1-метилэтил, 2-метилпропил, и т.п.; C1-6 алкил предназначен, чтобы включать С 1-4 алкил и его высшие гомологи, имеющие 5 или 6 атомов углерода,такие как, например, 2-метилбутил, пентил, гексил и т.п.; С 3-6 циклоалкил есть общее название для циклопропила, циклобутила, циклопентила и циклогексила; С 2-6 алкенил обозначает ненасыщенные углеводородные радикалы с прямой и разветвленной цепью, имеющие от 2 до 6 атомов углерода, такие как этенил, пропенил, бутенил, пентенил или гексенил; С 1-12 алкандиил означает двухвалентные углеводородные радикалы с прямой или разветвленной цепью, содержащие от 1 до 12 атомов углерода, такие как,например, 1,2-этандиил, 1,3-пропандиил, 1,4 бутандиил, 1,5-пентандиил, 1,6-гександиил, 1,7 гептандиил, 1,8-октандиил, 1,9-нонандиил, 1,10 декандиил, 1,11-ундекандиил, 1,12-додекандиил и их разветвленные изомеры; C1-6 алкандиил определен аналогично С 1-12 алкандиилу. Радикал -OR4 предпочтительно находится в 3- или 4-положении пиперидиновой группы. Термин "стереохимически изомерные формы", как он употреблен выше, означает все возможные изомерные формы, которыми может обладать соединение формулы (I). Если не упомянуто или не указано другое, химическое наименование соединения означает смесь всех возможных стереохимически изомерных форм,где указанная смесь содержит все диастереомеры и энантиомеры основной молекулярной структуры. Более подробно, центры, порождающие стереоизомерию, могут иметь R- или Sконфигурацию; заместители у двухвалентных циклических (частично) насыщенных радикалов могут иметь цис- или транс-конфигурацию. Соединения, включающие двойные связи, могут иметь Е или Z-стереохимию по указанной двойной связи. Предполагается, что стереохимически изомерные формы соединений формулы (I) входят в предмет настоящего изобретения. Предполагается, что фармацевтически приемлемые аддитивные соли кислот и оснований, как упомянуто выше, включают терапевтически активную и нетоксичную аддитивную соль кислоты и основания, которые могут образовываться соединениями формулы (I). Фармацевтически приемлемые аддитивные соли кислот могут обычно быть получены путем обработки основной формы подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогено-водородные кислоты, например хлористо-водородная или бромисто-водородная кислота, серная,азотная, фосфорная кислота и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая (то 6 есть этандионовая), яблочная, янтарная (то есть бутандионовая), малеиновая, фумаровая, малоновая, винная, лимонная, метансульфоновая,этансульфоновая, бензилсульфоновая, п-толуолсульфоновая, цикламеновая, салициловая, паминосалициловая, памоиновая и подобные кислоты. Наоборот, указанные солевые формы могут быть преобразованы в свободную основную форму путем обработки соответствующим основанием. Соединения формулы (I), содержащие кислотный протон, могут быть также преобразованы в форму их нетоксичной аддитивной соли металла или амина обработкой соответствующими органическими и неорганическими основаниями. Подходящие формы основных солей включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например, соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, наприме соли бензатина, N-метил-D-глюкамина,гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Термин "аддитивные соли", как он использован выше, включает также сольваты, которые соединение формулы (I) способно образовывать также как и его соли. Такими сольватами являются, например, гидраты, алкоголяты и т.п. Некоторые из соединений формулы (I) могут также существовать в своей таутомерной форме. Предполагается, что такие формы, хотя они и не показаны прямо в вышеприведенной формуле, подпадают под предмет настоящего изобретения. Например, когда ароматическое гетероциклическое кольцо замещено гидроксигруппой, кетоформа может быть преобладающим таутомером. Предполагается, что N-оксидные формы соединений формулы (I), которые могут быть получены известным способом, включают те соединения формулы (I), в которых один или несколько атомов азота окислено до N-оксида. Имеются в виду, в частности, те N-оксиды, в которых N-оксидирован азот пиперидина. Группа интересующих соединений состоит из тех соединений формулы (I), где применены одно или несколько из следующих ограничений:a) R1 и R2, взятые вместе, образуют радикал формулы (а-1), (а-2), (а-3), (а-4), (а-5) или (а 6), в котором необязательно один или два атома водорода замещены С 1-4 алкилом;c) R4 представляет водород или метил и радикал -OR4 расположен в положении 3 или 4 пиперидинового кольца, илиd) R5 представляет водород. Более интересными соединениями являются те соединения формулы (I), где R1 и R2, взятые вместе, образуют радикал формулы (а-2) 7 или (а-4), в котором необязательно один или два атома водорода замещены метилом. Еще более интересными соединениями являются те соединения формулы (I), в которых R4 представляет водород или метил. Предпочтительными соединениями являются те более интересные соединения, в которых радикал -OR4 расположен в положении 3 центральной пиперидиновой группы, имеющей транс-конфигурацию, то есть радикал -OR4 находится в транс-положении по отношению к метилену центральной пиперидиновой группы. Другими предпочтительными соединениями являются те более интересные соединения, в которых радикал -OR4 расположен в положении 4 центральной пиперидиновой группы. Весьма предпочтительными соединениями являются те соединения, в которых L представляет С 3-6 циклоалкил или С 2-6 алкенил или радикал формулы (b-1), в котором каждыйAlk представляет C1-6 алкандиил, и R6 представляет водород, гидрокси, циано, амино, C1-6 алкилсульфониламино, С 3-6 циклоалкил или Het1,где Het1 представляет тетрагидрофуран; диоксалан; диоксалан, замещенный C1-6 алкилом; тетрагидропиран; пиридазинил, замещенный одним или несколькими заместителями, выбранными из гидрокси, галогена и C1-6 алкила; или радикал формулы (с-1), (с-3) или (с-4), в котором R13 представляет С 1-4 алкил; или радикал формулыC1-6 алкил или гидроксиС 1-6 алкил; или радикал формулы (b-2), в котором Alk представляет C1-6aлкандиил, R7 представляетR8 представляет водород или C1-6 алкил; или радикал формулы (b-3), в котором Y представляет направленную связь и R9 представляетC1-6 алкил, гидрокси или C1-6 алкилокси; или радикал формулы (b-4), в котором Y представляет направленную связь и R11 и R12, представляют C1-6 алкил, или R11 и R12, соединенные с атомом азота, несущим R11 и R12, образуют пирролидинил. Предпочтительными соединениями являются те соединения, в которых L представляет бутил; пропил, замещенный метокси; метилкарбонилом или 2-метил-1,3-диоксаланом; этил,замещенный 4-метил-2-пиридазиноном или тетрагидропиранилом; или метил, замещенный тетрагидрофуранилом или тетрагидропиранилом. Наиболее предпочтительными являются транс-4-амино-N-[(1-бутил-3-гидрокси-4 пиперидинил)метил]-5-хлор-2,3-дигидро-7 бензофуранкарбоксамид,транс-4-амино-5-хлор-2,3-дигидро-N-3 гидрокси-1-(3-метоксипропил)-4-пиперидинил] метил]-7-бензофуранкарбоксамид, 002619 8 транс-4-амино-5-хлор-2,3-дигидро-N-[3 гидрокси-1-[(тетрагидро-2-фуранил)метил]-4 пиперидинил]-7-бензофуранкарбоксамид,транс-4-амино-5-хлор-2,3-дигидро-N-3 гидрокси-1-(4-оксопентил)-4-пиперидинил]метил]-7-бензофуранкарбоксамид,транс-4-амино-5-хлор-2,3-дигидро-N-[3 гидрокси-1-[(тетрагидро-2-пиранил)метил]-4 пиперидинил]-7-бензофуранкарбоксамид,транс-4-амно-5-хлор-2,3-дигидро-N-3 метокси-1-(3-метоксипропил)-4-пиперидинил] метил]-7-бензофуранкарбоксамид,транс-4-амино-5-хлор-2,3-дигидро-N-3 метокси-1-[(тетрагидро-2-фуранил)метил]-4 пиперидинил]метил]-7-бензофуранкарбоксамид,транс-4-амино-5-хлор-2,3-дигидро-N-3 гидрокси-1-(3-метоксипропил)-4-пиперидинил] метил]-2,2-диметил-7-бензофуранкарбоксамид,транс-4-амино-5-хлор-2,3-дигидро-N-3 метокси-1-(4-оксопентил)-4-пиперидинил]метил]-7-бензофуранкарбоксамид; транс-5-aмино-N-[(1-бутил-3-гидрокси-4 пиперидинил)метил]-6-хлор-3,4-дигидро-2 Н-1 бензопиран-8-карбоксамид и их фармацевтически приемлемые соли присоединения кислоты или основания, стереоизомерные формы или Nоксиды; и транс-(-)-4-амино-5-хлор-2,3-дигидро-N3-гидрокси-1-(3-метоксипропил)-4-пиперидинил]метил]-2,2-диметил-7-бензофуранкарбоксамид, его фармацевтически приемлемая соль присоединения кислоты или его N-оксидная форма. Соединения по настоящему изобретению могут быть, в общем, получены N-алкилированием промежуточного соединения формулы(III) промежуточным соединением формулы (II),в котором W представляет подходящую отщепляемую группу, такую как, например, галоген,т.е. фтор, хлор, бром, йод, или, в других случаях, W может также быть сульфонилоксигруппой, например, метансульфонилокси, бензолсульфонилокси, трифторметансульфонилокси и подобной реакционноспособной отщепляемой группой. Реакцию можно вести в реакционно-инертном растворителе, таком как, например, ацетoнитрил, и необязательно в присутствии подходящего основания, такого как, например, карбонат натрия, карбонат калия или триэтиламин. Перемешивание может увеличить скорость реакции. Реакцию можно обычно проводить при температуре в интервале от комнатной температуры до температуры кипячения реакционной смеси с обратным холодильником. В другом варианте соединения формулы(I) могут быть также получены восстановительным N-алкилированием промежуточного соединения формулы (III) промежуточным соедине 9 нием формулы L'=O (IV), где L'=O представляет производное формулы L-H, в котором два сдвоенных атома водорода заменены кислородом по хорошо известной методике восстановительного Указанное восстановительное N-алкилирование можно вести в реакционно-инертном растворителе, таком как, например, дихлорметан,этанол, толуол или их смеси, и в присутствии восстановителя, такого как, например, боргидрид, например, боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид. Может оказаться также удобным использовать в качестве восстановителя водород в сочетании с подходящим катализатором, таким как, например,палладий на древесном угле или платина на древесном угле. В случае, когда в качестве восстановителя используют водород, может оказаться выгодным добавить в реакционную смесь дегидратирующий агент, такой как, например,трет-бутилат алюминия. Для предотвращения нежелательного дальнейшего гидрирования некоторых функциональных групп в реагентах и продуктах реакции может также быть выгодно добавить в реакционную смесь подходящий каталитический яд, например, тиофен или смесь хинолин-сера. Для повышения скорости реакции можно увеличивать температуру в интервале от комнатной температуры до температуры дефлегмации реакционной смеси и необязательно может быть поднято давление газообразного водорода. Соединения формулы (I) могут быть получены путем реакции промежуточного соединения формулы (V) с производным карбоновой кислоты формулы (VI) или с его реакционноспособным функциональным производным, таким как, например, производные карбонилимидазола. Указанное образование амидной связи может быть осуществлено путем перемешивания реагентов в подходящем растворителе, необязательно в присутствии основания, такого как имидазолид натрия. Кроме того, соединения формулы (I) могут быть получены путем карбонилирования промежуточного соединения формулы (VII), в котором Х представляет бром или йод, в присутствии промежуточного соединения формулы Указанная реакция карбонилирования может быть проведена в реакционно-инертном 10 растворителе, таком как, например, ацетонитрил или тетрагидрофуран, в присутствии подходящего катализатора и подходящего основания, такого как третичный амин, например,триэтиламин, и при температуре, варьируемой между комнатной температурой и температурой кипения реакционной смеси с обратным холодильником. Подходящими катализаторами являются, например, комплексы палладий (трифенилфосфин). Окись углерода вводится при атмосферном давлении или при повышенном давлении. Аналогичные реакции карбонилирования описаны в главе 8 в "Palladium reagents in organic synthesis", Academic Press Ltd., BenchtopEdition 1990 by Richard F.Heck и в приведенных там ссылках. Из вышеупомянутой ссылки известна указанная реакция образования амида с металлическими катализаторами, которые являются растворимыми как комплексы палладий(трифенилфосфин). Неожиданно было обнаружено,что эти реакции могут также проводиться с металлическими катализаторами, которые являются нерастворимыми или иммобилизованными на твердом носителе. Подходящими катализаторами являются, например, палладий на угле, никель Ренея или Сu2 О. Эти нерастворимые катализаторы или катализаторы на твердой фазе намного более дешевы чем комплексы металлов, и с ними намного легче иметь дело при осуществлении синтеза в промышленных масштабах. Иными словами, был найден новый и целенаправленный способ получать амиды следующим образом: В вышеприведенных формулах Rd представляет любой заместитель, который может быть у фенила, n представляет целое число от 1 до 5, и R'R"NH может быть любым первичным или вторичным амином. Термин "галид" относится к хлору, брому, йоду. Предпочтительными галидами являются бром и йод. Предпочтительным катализатором является палладий на угле. Давление СО, т.е. окиси углерода, может варьироваться в соответствии с подложками и реагентами, и квалифицированный специалист,конечно, будет в состоянии найти подходящий интервал после небольших предварительных экспериментов. Предпочтительным давлением СО, т.е. окиси углерода, является давление 50 кг/см 2 (около 4,9 х 106 Па). Приемлемо его изменение в интервале между примерно 1 кг/см 2(около 1 х 105 Па) и примерно 100 кг/см 2 (около 10 х 106 Па). Температура реакции может меняться от комнатной температуры до температуры кипения реакционной смеси с обратным холодильником. 11 Реакцию предпочтительно проводят в растворителе, которым может быть сам аминR'R"NH, или ацетонитрил, или тетрагидрофуран. Предпочтительно указанный амин R'R"NH представляет первичный амин. Обычно присутствует также основание. Представляющим интерес подходящим основанием является, например, триэтиламин. Исходные материалы и некоторые промежуточные соединения являются известными соединениями и имеются в продаже или могут быть получены по обычным методикам реакций, известным из практики. Например, ряд промежуточных соединений формулы (VI) может быть получен по известным методикам,описанным в ЕР-0 389 037. Однако некоторые промежуточные формулы (VI) являются новыми, и, следовательно,изобретение предлагает также новые промежуточные формулы (VI), в которых R1 представляет метокси, R2 представляет метил или метокси,и R3 представляет хлор. Указанные промежуточные формулы (VI) получают, как описано в примере А.3. Промежуточное соединение формулы (III) может быть получено путем реакции промежуточного соединения формулы (VIII), в которомPG представляет подходящую защитную группу, такую как, например, трет-бутоксикарбонильная или бензильная группа, или фотоудаляемую группу, с кислотой формулы (VI) или ее подходящим реакционноспособным функциональным производным, таким как, например,производные карбонилимидазола, и последующего удаления защитной группы из полученного таким образом промежуточного соединения,т.е. удалением PG известными способами. Промежуточное соединение формулы (V) может быть получено путем реакции промежуточного соединения формулы (X) с промежуточным формулы (II). Указанное промежуточное соединение формулы (X) может быть получено путем удаления защитной группы из промежуточного формулы (VIII). В некоторых случаях может быть правильно защитить аминную группу, несущую радикалR5 в вышеописанной последовательности реакций. Защитные группы для функциональной аминогруппы хорошо известны. Эти защитные группы могут быть затем удалены в подходящее время при дальнейшем синтезе. Промежуточные соединения формулы(VIII-a), являясь промежуточными соединениями формулы (VIII), в которых PG' есть защитная 12 группа, которая не может быть удалена гидрированием,такая как,например,третбутоксикарбонил, могут быть получены в соответствии со схемой 1. Схема 1 В схеме 1 промежуточное соединение формулы (ХI-а) превращают в промежуточное соединение формулы (XII), в котором W1 представляет отщепляемую группу, такую как галоген или сульфонилокси. Далее промежуточное соединение (XII) вводят в реакцию с промежуточным соединением формулы (XIII), в которомPG2 представляет защитную группу, которая может быть удалена гидрированием, такая как,например, бензил. Удаление защитной группыPG2 из промежуточного соединение (XIV) дает промежуточные соединения формулы (VIII-а). Промежуточные соединения формулы(VIII-a-1), определенные как промежуточные соединения формулы (VIII-a), в которых R4 представляет метил, могут быть получены, как описано в схеме 2. Схема 2 В схеме 2 промежуточное формулы (ХI-а),в котором R4a представляет водород, превращают в промежуточное соединение формулы (XII1), в котором W2 представляет подходящую отщепляемую группу, такую как, например, тозилатная группа. Затем вторичную гидроксигруппу промежуточного соединения (XII-1), т.е. группу -OR4a превращают в метокси, используя подходящие условия метилирования, такие как,например, обработку гидридом натрия в тетрагидрофуране и добавление метилйодида. Превращение промежуточного соединения (XX) в промежуточное соединение (VIII-a-1) может быть проведено при использовании известных методик реакции. В аспекте настоящего изобретения предложены новые соединения формулы (IX), в которых R15 и R16, каждый независимо, выбран из водорода или защитной группы PG, и R4 и R5 таковы, как они определены выше. Подходящими защитными группами PG являются, например, С 1-4 алкилкарбонил, С 1-4 алкилоксикарбонил,тригалоидметилкарбонил, дифенилметил, трифенилметил или арилметил, где арил необяза 13 тельно имеет до двух заместителей, выбранных из С 1-4 алкилокси или галогена. Указанные новые соединения формулы (IX) включают промежуточные соединения формулы (VIII), (X) и Промежуточные соединения формулы (ХIа), в которых PG1 представляет защитную группу, которая не может быть удалена гидрированием, такую как, например, трет-бутоксикарбонил, могут быть превращены в промежуточные формулы (XI-b), в которых PG2 представляет защитную группу, которая может быть удалена гидрированием, такая как, например,бензил, при использовании подходящей последовательности реакций удаления-введения защитной группы. Наоборот, промежуточные формулы (XI-b) могут быть также преобразованы в промежуточные соединения формулы (XIa). Промежуточное соединение формулы (XIb), где группа -OR4 находится в положении 3 на пиперидиновой группе, R4 водород и PG2 представляет бензильную группу, имеющее трансконфигурацию, известно из J. Med. Chem., 16,pp.156-159 (1973). В указанной статье описано также производное формулы (XIX), в котором группа -OR4 находится в положении 3 пиперидиновой группы и R4 водород, имеющее трансконфигурацию. Промежуточные соединения формулы (XI1-a) определены как промежуточные соединения формулы (ХI-а), где группа -OR4 находится в положении 3 пиперидиновой группы. Эти промежуточные соединения формулы(XI-1-a), где R4 представляет C1-6 алкил, имеющие цис-конфигурацию, могут быть получены путем гидрирования промежуточного соединения формулы (XVI) по известным методикам. Промежуточное соединение (XVI), где PG1 иPG2 таковы, как определены выше, может быть получено путем реакции защищенного пиперидона формулы (XV) с фосфониевым реагентом формулы [(арил)3P-CH2-O-PG2]+-галид в условиях, подходящих для протекания реакции Виттига. Последующее удаление группы PG2 дает промежуточные соединения формулы (XI-1-a),имеющие цис-конфигурацию. Был найден новый способ получения промежуточных соединений формулы (XI-1-b), 002619 14 имеющих транс-конфигурацию. Указанный новый синтез начинают с промежуточного соединения формулы (XI-1-b), имеющего цисконфигурацию, или с промежуточного соединения формулы(XVII),имеющего цисконфигурацию. В указанных промежуточных соединениях формулы (XI-1-b) и (XVII) PG2 такова, как определено выше, R4a представляет водород, C1-6 алкил или защитную группу, такую как, например, бензил, трет-бутоксикарбонил или подобную. Указанную реакцию инверсии проводят в подходящем растворителе, таком как, например,простой эфир, например, тетрагидрофуран, в присутствии СuОСr2 О 3 в атмосфере водорода и в присутствии подходящего основания, такого как, например, оксид кальция. Предпочтительные давление водорода и температура реакции зависят от исходного вещества. Если исходят из цис-(XI-1-b), то давление водорода предпочтительно находится в интервале от 900 до 2000 кПа (измеряется при комнатной температуре), и температура реакции находится в интервале от комнатной температуры до 200 С, предпочтительно температура реакции составляет около 120 С. Если исходят из цис-(XVII), то предпочтительное давление водорода находится в интервале от 1500 до 2200 кПа, предпочтительно между 1800 и 2000 кПа. Температура реакции находится в интервале между 100 и 200 С, предпочтительно около 125 С. По-видимому, достигается равновесие, обычно при соотношении диастереомеров около 65:35 (транс:цис) по анализу методом газовой хроматографии. Однако путем перекристаллизации возможно очистить целевой транс-изомер. Подходящим растворителем для перекристаллизации является простой эфир, например, диизопропиловый эфир. Чистое промежуточное соединение формулы транс-(XI-1-b),имеющее трансконфигурацию, может быть также получено хроматографическими методами, такими как,например, гравитационная хроматография или ВЭЖХ, исходя из смеси цис/транс промежуточного соединения (XI-1-b). Еще одним новым способом получения промежуточных формулы транс-(XI-1-b) является реакция промежуточного соединения формулы (XVIII) с бораном или производными борана. Сам боран имеется в продаже в виде комплекса боран-тетрагидрофуран. Производные борана, в особенности хиральные производные 15 борана, также имеются в продаже. Реакцию с бораном проводят в реакционно-инертном растворителе, предпочтительно простом эфире,например, в тетрагидрофуране. Пока добавляют боран или производное борана, температуру реакционной смеси поддерживают ниже 0 С,предпочтительно при температуре около -30 С. После добавления борана или производного борана к реакционной смеси температуре дают подняться, продолжая перемешивание. Смесь перемешивают в течение нескольких часов. Затем добавляют гидрoксид, например, гидроксид натрия, а также перекись, например, перекись водорода, и реакционную смесь перемешивают при повышенной температуре в течение нескольких часов. После этой обработки реакционный продукт выделяют известным способом.(XVIII) могут быть получены путем реакции промежуточного соединения формулы (XXI),где PG2 такова, как определено выше, и W представляет отщепляемую группу, как определена выше, с промежуточным соединением формулы(XXII), и последующего восстановления полученного таким образом промежуточного соединения (XXIII) боргидридом натрия с получением промежуточных соединений формулы Указанная процедура синтеза может быть также применена для получения промежуточных соединений формулы (V). Соответственно,промежуточное соединение формулы (II) реагирует с промежуточным соединением формулы(XXII) и, полученное таким образом, промежуточное соединение формулы (XXIV) восстанавливают до промежуточного соединения формулы (XXV), используя боргидрид натрия. Затем промежуточные соединения формулы (XXV) превращают в промежуточные соединения формулы (XXVI), используя вышеописанную процедуру реакций для превращения промежуточных соединений (XVIII) в промежуточные соединения формулы транс-(XI-b).(XXVI) могут быть превращены в промежуточные соединения формулы (V), имеющие трансконфигурацию, при использовании процедуры 16 реакций, каковая описана выше в схеме 1 или схеме 2. Промежуточные соединения формулы(VIII-a) определены как промежуточные соединения формулы (VIII), в которых группа -OR4 находится в положении 4 пиперидиновой группы и R4 представляет водород. Указанные промежуточные соединения формулы (VIII-a) могут быть получены путем реакции промежуточного соединения формулы(XXVII) с нитрометаном при соответствующих условиях реакции, таких как, например, метилат натрия в метаноле, и затем превращения нитрогруппы в аминогруппу, с получением тем самым промежуточных формулы (VIII-a). Промежуточные соединения формулы (Va), определенные как промежуточные соединения формулы (V), в которых R5 представляет водород, могут быть получены следующим образом: Промежуточное соединение формулы (II) подвергают взаимодействию с промежуточным соединением формулы (XXIX), в котором PG3 представляет подходящую защитную группу,такую как п-толуолсульфонил, и полученное таким образом промежуточное соединение формулы (XXX) восстанавливают в промежуточное соединение формулы (XXXI), используя боргидрид натрия. Затем промежуточные соединения формулы (XXXI) превращают в промежуточные соединения формулы (XXXII), используя вышеописанную процедуру реакций для превращения промежуточных соединений(XVIII) в промежуточные соединения формулы транс-(XI-b). Затем путем удаления защитной группы PG3 из промежуточных соединений(XXXII) получают промежуточные соединения формулы (V-a). Соединения формулы (I), их N-оксидные формы, фармацевтически приемлемые соли и стереоизомерные формы обладают благоприятными свойствами стимулировать кишечную активность. В частности настоящие соединения проявляют значительную активность опорожнения желудка, о чем свидетельствует фармакологический пример С-1 "Опорожнение желудка от некалорийной жидкой пищи, вызванное введением лидамидина собакам, находящимся в бессознательном состоянии" - тест. Соединения формулы (I) также проявляют благоприятное действие, такое как увеличение 17 базального давления НЭС, т.е. нижнего эзофагеального сфинктера. Большинство промежуточных соединений формулы (III) проявляют активность, аналогичную активности конечных соединений формулы(I). Ввиду способности соединений по настоящему изобретению улучшать желудочнокишечную подвижность и, в особенности, активировать опорожнение желудка, рассматриваемые соединения являются полезными для лечения состояний, связанных с затрудненным или ослабленным опорожнением желудка и, в более общем плане, для лечения состояний, связанных с затрудненным или ослабленным желудочнокишечным транзитом. С точки зрения использования соединений формулы (I) следует, что настоящее изобретение предлагает также способ лечения теплокровных животных, включая человека (в общем называемых здесь пациентами), страдающих от состояний, связанных с затрудненным или ослабленным опорожнением желудка и, в более общем плане, страдающих от состояний, связанных с затрудненным или ослабленным желудочно-кишечным транзитом. Соответственно,предлагается способ лечения пациентов, страдающих от состояний, таких как, например, гастроэсфагональный рефлюкс, диспепсия, гастропарез, запор, послеоперационный заворот кишок и кишечная псевдонепроходимость. Гастропарез может быть вызван аномалиями желудка или осложнением от таких болезней, как диабет, прогрессирующий системный склероз,нервная анорексия и миотоническая дистрофия. Запор может быть результатом таких состояний,как недостаточность мышечного тонуса кишечника или кишечные спазмы. Послеоперационный заворот кишок представляет собой непроходимость или ослабление кинетики кишечника, вызванные нарушением мышечного тонуса после хирургического вмешательства. Кишечная псевдонепроходимость является состоянием, характеризуемым запором, болью от колик и рвотой, но без признаков физической непроходимости. Соединения по настоящему изобретению могут быть поэтому использованы или для устранения реальной причины состояния, или для облегчения пациентов от симптомов таких состояний. Диспепсия представляет собой ослабление пищеварительной функции, которое может возникнуть как симптом первичной желудочно-кишечной дисфункции, в особенности желудочно-кишечной дисфункции, связанной с повышенным мышечным тонусом или являющейся осложнением, вызванным другими заболеваниями, такими как аппендицит, расстройства желчного пузыря или истощение. Симптомы диспепсии могут также возникнуть под воздействием химических веществ,например селективных ингибиторов обратного 18 усвоения серотонина (СИОУС), таких как флуоксетин, парксетин, флювоксамин и сертралин. Кроме того, некоторые соединения являются стимуляторами кинетической активности толстой кишки. Таким образом, предлагается применение соединения формулы (I) в качестве лекарства и,в частности, применение соединения формулы(I) для приготовления лекарств для лечения состояний, включающих пониженную желудочнокишечную подвижность, в особенности, пониженную способность к опорожнению желудка. Предусмотрены и профилактическое и терапевтическое лечение. Для приготовления фармацевтических композиций по этому изобретению эффективное количество конкретного соединения в форме соли присоединения основания или кислоты в качестве активного ингредиента соединяют при тщательном перемешивании с фармацевтически приемлемым носителем, который может иметь разнообразные формы в зависимости от формы композиции, предназначенной для введения. Эти фармацевтические композиции желательно представляются в виде единичных дозированных форм, пригодных предпочтительно для введения перорально, ректально или парентеральными инъекциями. Например, при приготовлении композиций в дозированной форме для перорального введения может быть применена любая из фармацевтических сред, такая как, например, вода, гликоли, масла, спирты и тому подобное в случае оральных жидких композиций, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие, разрыхлители и т.п. в случае порошков, пилюль, капсул и таблеток. Благодаря легкости их введения, таблетки и капсулы представляют собой наиболее хорошую форму дозированных единиц для перорального введения, и в этом случае, очевидно, используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерильную воду, по меньшей мере,по большей части, хотя могут быть включены другие ингредиенты, например, для облегчения растворимости. Могут быть приготовлены, например, растворы для инъекций, в которых носитель включает солевой раствор, раствор глюкозы или смесь солевого и глюкозного растворов. Могут быть также приготовлены суспензии для инъекций и в этом случае могут быть применены подходящие жидкие носители, суспендирующие агенты и т.п. В композициях, предназначенных для подкожного введения, носитель необязательно включает агент, улучшающий проникновение через кожу и/или подходящий увлажнитель, необязательно соединенные с подходящими добавками любой природы в малых количествах, которые не оказывают существенно вредного влияния на кожу. Указанные 19 добавки могут способствовать введению через кожу и/или могут быть полезными для приготовления желаемых композиций. Эти композиции могут вводиться различными способами,например в виде накожного пластыря, нашлепки, мази. Аддитивные соли кислот соединений формулы (I), благодаря их повышенной растворимости в воде по сравнению с соответствующей основной формой, являются явно более подходящими для приготовления водных композиций. Особенно благоприятно готовить вышеупомянутые фармацевтические композиции в дозированной единичной форме для легкого введения и однородности дозировки. Термин"дозированные единичные формы", как он использован здесь в описании и формуле изобретения, относится к физически дискретным единицам, пригодным в качестве единичных доз,где каждая единица содержит предписанное количество активного ингредиента, рассчитанное для того, чтобы вызвать желаемый терапевтический эффект, в сочетании с требуемым фармацевтическим носителем. Примерами таких дозированных единичных форм являются таблетки (включая шероховатые или покрытые таблетки), капсулы, пилюли, пакетики порошков, свечи, растворы или суспензии для инъекций, мера чайной ложки, мера столовой ложки и т.п., а также их отдельные множества. Фармацевтические композиции для перорального введения могут принимать вид твердых дозированных форм, например таблеток (и в форме только глотаемых и разжевываемых таблеток), капсул или гелевых капсул, приготавливаемых обычными способами с фармацевтически приемлемыми вспомогательными веществами, такими как связующие агенты (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза), наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция), смазывающих веществ, (например, стеарат магния, тальк или окись кремния), разрыхлителей (например, картофельный крахмал или натрий-гликолят крахмала) или увлажнителей (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой с использованием хорошо известных способов. Жидкие композиции для перорального введения могут принимать вид, например,растворов, сиропов или суспензий, или могут быть представлены в виде сухого продукта для смешения с водой или другим подходящим носителем перед употреблением. Такие жидкие композиции могут готовиться обычными способами необязательно с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбитола, метилцеллюлоза,гидроксипропилметилцеллюлоза или гидрированные пищевые жиры), эмульгаторы (например, лецитин или камедь), неводные 20 носители (например, миндальное масло, маслянистые сложные эфиры или этиловый спирт) и консерванты (например, метил- или пропил-пгидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подсластители включают предпочтительно, по меньшей мере, один сильный подсластитель, такой как сахарин, сахарин натрия или кальция, аспартам,ацесульфам калия, цикламат натрия, алимат,дигидрохальконовый подсластитель, монеллин,стевиозид или сукралоза (4,1',6'-трихлор-4,1',6'тридеоксигалактосахароза),предпочтительно сахарин, сахарин натрия или кальция и необязательно объемный подсластитель, такой как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальт, глюкоза, сироп гидрированной глюкозы,ксилитол, карамель или мед. Интенсивные подсластители обычно применяют в малых концентрациях. Например, в случае сахарина натрия концентрация может меняться от 0,04 до 0,1% (вес/об) в расчете на общий объем конечной композиции и предпочтительно составляет примерно 0,06% в низкоконцентрированных композициях и примерно 0,08% в высококонцентрированных композициях. Объемный подсластитель может быть эффективно использован в больших количествах,меняющихся от примерно 10 до примерно 35%,предпочтительно от примерно 10 до примерно 15% (вес/об). Фармацевтически приемлемыми вкусовыми добавками, которые могут замаскировать ингредиенты с горьким вкусом, для низкоконцентрированных композиций являются предпочтительно фруктовые вкусовые добавки, такие как добавки с вкусом вишни, малины, черной смородины или клубники. Сочетание двух вкусовых добавок может дать очень хорошие результаты. Для высококонцентрированных композиций могут потребоваться более сильные вкусовые добавки, такие как карамельношоколадная вкусовая добавка (Caramel Chocolate flavour), добавка с вкусом мяты (Cool Mintflavour), фантазийная вкусовая добавка (Fantasyflavour) и тому подобные фармацевтически приемлемые сильные вкусовые добавки. Каждая вкусовая добавка может присутствовать в конечной композиции в концентрации, меняющейся от 0,05 до 1% (вес/об). Преимущественно используют сочетания указанных сильных вкусовых добавок. Предпочтительно используют вкусовую добавку, которая не подвергается каким-либо изменениям или потере вкуса и цвета в кислотных условиях композиции. Композиции по настоящему изобретению могут необязательно включать антифлатулент(агент, препятствующий газообразованию), такой как симетикон, альфа-D-галактозидаза или тому подобное. Соединения по изобретению могут быть также приготовлены в виде депо препаратов. Такие композиции пролонгированного действия 21 могут быть введены путем имплантации (например, подкожно или внутримышечно) или внутримышечных инъекций. Так, например,соединения могут быть введены в композицию с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами,или как ограниченно растворимые производные,например как ограниченно растворимая соль. Соединения по изобретению могут быть введены в композиции для парентерального введения путем инъекций, обычно внутривенных, внутримышечных или подкожных инъекций, например, путем инъекции болюса или непрерывной внутривенной инфузии. Композиции для инъекций могут быть представлены в единичных дозированных формах, например в ампулах, или в многодозных контейнерах с добавкой консерванта. Композиции могут иметь такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать такие рецептурообразующие агенты как изотонизирующие, суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в форме порошка для соединения с подходящим носителем, например стерильной свободной от пирогенных примесей водой перед применением. Соединения по изобретению могут быть также введены в композиции для ректального применения, такие как свечи или удерживаемые клизмы, содержащие, например, обычные основы для свечей, такие как масло какао или другие глицериды. Соединения по изобретению могут быть использованы для интраназального введения,например, в виде жидкого спрея, порошка или в форме капель. В общем, предполагается, что терапевтически эффективное количество должно составлять от примерно 0,001 до примерно 2 мг/кг веса тела, предпочтительно от примерно 0,02 до примерно 0,5 мг/кг веса тела. Способ лечения может также включать введение активного ингредиента в режиме от двух до четырех приемов в сутки. Экспериментальная часть В методиках, описанных ниже, использованы следующие сокращения: "АЦН" означает ацетонитрил; "ТГФ" означает тетрагидрофуран;"НОАс" означает уксусную кислоту; "МИК" означает метилизобутилкетон. Для некоторых химических продуктов использована химическая формула, например 22 СН 2 Сl2 для дихлорметана, СН 3 ОН для метанола,NH3 для аммиака, НСl для хлористо-водородной кислоты, NaH для гидрида натрия, СаСО 3 для карбоната кальция, СО для окиси углерода и КОН для гидроксид калия. Для некоторых соединений формулы (I) точная стереохимическая конфигурация экспериментально не определена. В этих случаях стереохимическая изомерная форма, которая была выделена первой, обозначена как А, и вторая как В без дополнительного указания точной стереохимической конфигурации. А. Получение промежуточных соединений. Пример A.1. а) Раствор 4-пиридинметанола (1,84 моль) в АЦН (1000 мл) добавляли к раствору бензилхлорида (2,2 моль) и полученную смесь кипятили в колбе с обратным холодильником в течение 3 ч, охлаждали до комнатной температуры и выпаривали. Остаток суспендировали в диэтиловом эфире, отфильтровывали и сушили, получая 1-(фенилметил)-4-(гидроксиметил)пиридинхлорид (411 г, 97%).(2200 мл) и охлаждали до -20 С. Под атмосферой азота порциями добавляли боргидрид натрия (1,75 моль). Реакционную смесь перемешивали в течение 30 мин и по каплям добавляли воду (200 мл). Реакционную смесь частично упаривали, добавляли воду и реакционную смесь экстрагировали ДХМ. Органический слой отделяли, сушили, фильтровали и упаривали. Остаток очищали на силикагеле (элюент ДХМ), получая 155 г 1,2,3,6-тетрагидро-1(фенилметил)-4-пиридинметанола. Пример А.2. а) Раствор 1,2,3,6-тетрагидро-1-(фенилметил)-4-пиридинметанола (0,5 моль) в ТГФ (1000 мл) охлаждали до -30 С и в атмосфере азота по каплям добавляли к раствору борана в ТГФ (1 М,1000 мл) в то время как температуру реакционной смеси поддерживали между -20 и -30 С. После добавления реакционную смесь перемешивали в течение 4 ч, позволяли ей нагреться до комнатной температуры и перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь охлаждали до -10 С и по каплям добавляли воду (25 мл). Затем по каплям одновременно добавляли NaOH (3M в воде, 70 мл) и перекись водорода (30% раствор в воде, 63,3 мл), в то время как температуру реакционной смеси поддерживали при -10 С. Добавляли ещеNaOH (50% в воде, 140 мл). Реакционную смесь перемешивали при кипячении в колбе с обратным холодильником в течение 4 ч. Реакционную смесь охлаждали и отфильтровывали. Фильтрат упаривали. Полученный осадок растворяли в воде (500 мл) и насыщали К 2 СО 3. Продукт экстрагировали ДХМ. Полученный раствор сушили над MgSO4 и упаривали. Остаток кристаллизовали из смеси ДИПЭ/СН 3 СN. 23 После нескольких кристаллизаций получали транс-1-(фенилметил)-3-гидрокси-4-пиперидинметанол (выход 50,1%).-транс-1-(фенилметил)-3 гидрокси-4-пиперидинметанола (17,8 г, 0,085 моль) (описан ранее в J. Med. Chem., 16, pp.156159 (1973 в метаноле (250 мл) гидрировали при 50 С с палладием на активированном угле(10%, 2 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывали и фильтрат упаривали, получая 12 г -транс-3-гидрокси-4-пиперидинметанола (промежуточное соединение 1-а), который использовали на следующей стадии реакции без дополнительной очистки. Соответствующий цис-изомер известен из J. Org. Chem., 34, pp. 3674-3676 (1969).c) Смесь промежуточного соединения (1-а)(0,086 моль) в ДХМ (250 мл) перемешивали при комнатной температуре. По каплям добавляли раствор ди-трет-бутилдикарбоната(ВОСангидрид) (0,086 моль) в ДХМ (50 мл) и полученную реакционную смесь перемешивали при комнатной температуре. Осаждалось масло. Добавляли метанол (60 мл) и полученный реакционный раствор перемешивали в течение 60 мин при комнатной температуре. Растворитель выпаривали. Остаток кристаллизовали из ДИПЭ. Осадок отфильтровывали и сушили, получая 13,7 г (68,8%) 1,1-диметил(транс)-3-гидрокси-4(гидроксиметил)-1-пиперидинкарбоксилатаd) Промежуточное соединение (1-b) (0,087 моль) растворяли в хлороформе (400 мл) и пиридине (7,51 мл). Раствор охлаждали до 0 С. За 20 мин порциями добавляли 4-метилбензолсульфонилхлорид (0,091 моль). Реакционную смесь перемешивали и кипятили в колбе с обратным холодильником в течении 16 ч. Добавляли еще 4-метилбензолсульфонилхлорид (1,7 г) и пиридин (1,4 мл), полученную реакционную смесь перемешивали и кипятили в колбе с обратным холодильником в течение 6 ч, затем охлаждали,промывали лимонной кислотой (10 мас.% в Н 2 О), промывали рассолом, фильтровали и выпаривали растворитель. Остаток очищали флэшколоночной хроматографией на силикагеле(элюент: ДХМ). Целевые фракции собирали и растворитель выпаривали, получая 9 г промежуточного соединения (1-с) в виде бесцветного масла.e) Смесь промежуточного соединения (1-с)(100 мл) перемешивали в течение 16 ч при 125 С (автоклав). Реакционную смесь охлаждали. Растворитель выпаривали. Остаток распределяли между ДХМ и водным раствором К 2 СО 3. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали, получая 15,4 г 1,1-диметил-(транс)-3-гидрокси-4-(фенилметил)амино]метил]-1-пиперидинкарбоксилатаf) Смесь промежуточного соединения (1-d)(100 мл) гидрировали на палладии на угле (10%,1 г) в качестве катализатора. После поглощения Н 2 (1 эквивалент) катализатор отфильтровывали и фильтрат упаривали. Остаток отверждали в ДИПЭ+АЦН, отфильтровывали и сушили (вакуум, 40 С), получая 4 г (76%) 1,1 диметил(транс)-4-(аминометил)-3-гидрокси-1 пиперидинкарбоксилата (промежуточное соединение 1-е, т.пл. 178 С). Аналогичным образом, но исходя из цис-3 гидрокси-4-пиперидинметанолаJ.Org.Chem., 34, pp.3674-3676 (1969 получали 1,1-диметил(цис)-4-(аминометил)-3-гидрокси-1 пиперидинкарбоксилат (промежуточное соединение 1-f). Пример А.3. а) К смеси 1,3-бензодиоксол-4-амина (4,11 г) в ДХМ (40 мл) и СН 2 ОН (20 мл) добавляли СаСО 3 (3,9 г). Эту смесь перемешивали при комнатной температуре. При комнатной температуре порциями добавляли дихлорйодатN,N,N-триметилбензолметанаминия (11,5 г). Полученную реакционную смесь перемешивали в течение 15 мин при комнатной температуре. Смесь разбавляли водой. Слои разделяли. Водную фазу экстрагировали ДХМ. Объединенные органические слои промывали водой, сушили,фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl/гeкcaн 80/20). Чистые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из ДИПЭ. Осадок отфильтровывали и сушили, получая 3,5 гb) Уксусный ангидрид (14,25 мл) добавляли по каплям к смеси промежуточного соединения (2-а) (36,6 г) в уксусной кислоте (500 мл) и перемешивали при комнатной температуре. Реакционную смесь перемешивали в течение 15 мин при комнатной температуре. Реакционную смесь выливали в воду (500 мл). Осадок отфильтровывали, промывали водой, затем сушили, получая 39,29 г (92,6%) N-(7-йод-1,3 бензодиоксол-4-ил)ацетамида (промежуточное соединение 2-b).(500 мл) перемешивали при 150 С под давлением СО 4,9 х 106 Па (50 кг/см 2) в течение 16 ч. Реакционную смесь охлаждали, фильтровали через дикалит и фильтрат упаривали. Остаток разбавляли водой, затем трижды экстрагировали ДХМ. Объединенные органические слои сушили, фильтровали и растворитель выпаривали. Остаток растворяли в уксусной кислоте (250 мл) и по каплям добавляли уксусный ангидрид (6 мл). Смесь перемешивали в течение 30 мин при комнатной температуре, затем разбавляли водой(250 мл) и полученный осадок отфильтровыва 25 ли, промывали водой, затем сушили, получая 19,4 г (64,7 %) метил 7-(ацетиламино)-1,3 бензодиоксол-4-карбоксилата (промежуточное соединение 2-с).d) Смесь промежуточного соединения (2-с)e) Промежуточное (2-d) (18,2 г) добавляли к раствору КОН (37,6 г) в воде (380 мл). Полученную реакционную смесь перемешивали и кипятили в колбе с обратным холодильником в течение 3 ч. Смесь охлаждали, подкисляли хлористо-водородной кислотой и полученный осадок отфильтровывали, промывали водой, суспендировали в АЦН, отфильтровывали, затем сушили, получая 14 г ( 95%) 7-амино-6-хлор 1,3-бензодиоксол-4-карбоновой кислоты (промежуточное соединение 2-е). Аналогичным способом получали 3,4 дигидро-9-йод-2 Н-1,5-бензодиоксепин-6-амин(промежуточное соединени 2-f). Пример А.4. Смесь промежуточного соединения (2-е) (1 г) и 1,1'-карбонил-бис-1H-имидазола (0,8 г) в АЦН (80 мл) перемешивали и кипятили в колбе с обратным холодильником в течение 3 ч. Растворитель выпаривали. Остаток распределяли между водой и ДХМ. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали. Остаток суспендировали в ДИПЭ,отфильтровывали, затем сушили, получая 0,8 гN-[4-амино-5-хлор-2,3-дигидро-2,2-диметил-7-бензофуранкарбоил]-1H-имидазол (промежуточное соединение 3-b). Аналогичным образом были также получены:N-[8-хлор-3,4-дигидро-9-ацетиламино-2 Н 1,5-бензодиазепин-6-оил]-1H-имидазол (промежуточное соединение 3-d) и 1-[(5-амино-6-хлор-3,4-дигидро-2 Н-1 бензопиран-8-ил)карбонил]-1H-имидазол (промежуточное соединение 3-е). Пример А.5. Смесь промежуточного соединения (1-f)(0,087 моль) в АЦН (600 мл) перемешивали и кипятили в колбе с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали до 0 С и растворитель выпаривали. Остаток распределяли между ДХМ и водой. Органический 26 слой отделяли, сушили, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 97/3). Чистые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из АЦН. Осадок отфильтровывали и сушили, получая 28,7 г (78%) -1,1 диметилэтил цис-4-(4-амино-5-хлор-2,3-дигидро-7-бензофуранил)карбонил]амино] метил]3-гидрокси-1-пиперидинкарбоксилата (промежуточное соединение 4, т.пл. 218 С) . Пример А.6. Смесь промежуточного соединения (4)(0,065 моль) в смеси HCl/2-пропанол (120 мл) и метаноле (1000 мл) перемешивали и кипятили в колбе с обратным холодильником в течение 30 мин. Реакционную смесь охлаждали и растворитель выпаривали. Остаток распределяли между ДХМ и водным раствором NaCl. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали. Остаток растворяли в 2 пропаноле и превращали в соль хлористоводородной кислоты (1:2) с HCl/2-пропанолом. Осадок отфильтровывали и сушили, получая 14,6 г (64%) дигидрохлорида цис-4-амино-5 хлор-2,3-дигидро-N-[(3-гидрокси-4-пиперидинил)метил]-7-бензофуранкарбоксамида (промежуточное соединение 10, т.пл. 280 С) . Пример А.7.a) К охлажденной смеси этил 4-оксо-1 пиперидинкарбоксилата (85,5 г), нитрометана(33,6 г) в метаноле (240 мл) при перемешивании добавляли по каплям метилат натрия (10 г). После завершения перемешивание продолжали в течение 2 ч при температуре около 10 С и затем в течение ночи при комнатной температуре. Реакционную смесь упаривали при комнатной температуре, к маслянистому остатку добавляли колотый лед и все подкисляли уксусной кислотой. Продукт экстрагировали трихлорметаном,экстракт сушили, фильтровали и упаривали. Маслянистый остаток отверждали растиранием в петролейном эфире. Продукт отфильтровывали и сушили, получая 73 г этил-4-гидрокси-4(нитрометил)-1-пиперидинкарбоксилата (промежуточное 5).b) Смесь промежуточного соединения (5)(150 мл) гидрировали в аппарате Парра с палладием на угле (10%, 5 г). После того, как поглотилось расчетное количество водорода, катализатор отфильтровывали и фильтрат упаривали. К остатку добавляли колотый лед и все подщелачивали гидроокисью калия. Водную фазу высаливали карбонатом калия и продукт экстрагировали бензолом. Экстракт сушили, фильтровали и упаривали, получая 63,5 г этил 4-(аминометил)-4-гидрокси-1-пиперидинкарбоксилатаa) Промежуточное соединение (1-d) очищали и разделяли на его энантиомеры хираль 27 ной колоночной хроматографией на ChiralcelAD (колонка n: AD2000; тип: DAC; 20 мкм,1000; диаметр колонки: 11 см; элюент: гексан/этанол 80/20, ввод: 1 г/200 мл). Собирали две группы чистых фракций и их растворитель выпаривали. Элюированная первой фракция,(А)-остаток содержала 1,1-диметил (транс)-3 гидрокси-4-(фенилметил)амино]метил]-1 пиперидинкарбоксилат (промежуточное соединение 25).b) Смесь промежуточного соединения (25)(0,56 моль) в метаноле (700 мл) гидрировали при 50 С с палладием на угле (5 г, 10 %) в качестве катализатора. После поглощения водородаc) Смесь промежуточного соединения (3-b)(0,62 моль) в АЦН (4300 мл) перемешивали и кипятили в колбе с обратным холодильником в течение 90 мин. Растворитель выпаривали. Остаток распределяли между водой (1000 мл) и этилацетатом (4000 мл) . Слои разделяли. Водный слой еще раз экстрагировали этилацетатом(1000 мл). Объединенные органические слои промывали водой (2 х 500 мл), сушили, фильтровали через силикагель и растворитель выпаривали. Добавляли 2-пропанол, затем опять упаривали, получая 310 г (количественный выход; используется на следующей стадии реакции без дополнительной очистки) 1,1 диметилэтил (транс)-4-(4-амино-5-хлор-2,3 дигидро-2,2-диметил-7-бензофуранил)карбонил] амино]метил]-3-гидрокси-1-пиперидинкарбоксилата (промежуточное соединение 26).d) Смесь промежуточного соединения (26)(0,011 моль) в смеси НСl в 2-пропаноле (12 мл) и метаноле (100 мл) перемешивали и кипятили в колбе с обратным холодильником в течение 30 мин. Смесь охлаждали и растворитель выпаривали. Остаток распределяли между водой/NН 3 и ДХМ. Органический слой отделяли, сушили,фильтровали и растворитель выпаривали, получая 2,84 г (73%) (-)-(транс)-4-амино-5-хлор-2,3 дигидро-N-[(3-гидрокси-4-пиперидинил)метил]-2,2-диметил-7-бензофуранкарбоксамида(промежуточное соединение 14). Образец (0,5 г) кристаллизовали из АЦН с каплей воды, отфильтровывали и сушили, получая 0,2 г промежуточного соединения (14) [т.пл. 116 С;[]20D= -15,91 (с = 25,14 мг/5 мл в СН 3 ОН)]. Таким и подобным образом были получены следующие соединения. В. Получение конечных соединений. Пример B.1. Смесь промежуточного соединения (10)(0,076 моль) и йодида калия (каталитическое количество) в МИК (300 мл, осушен над MgSO4) перемешивали и кипятили в колбе с обратным холодильником в течение 48 ч. Реакционную смесь охлаждали, фильтровали и фильтрат упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/(СН 3 ОН/NН 3) 95/5). Чистые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из ДИПЭ (0 С), отфильтровывали и сушили, получая 5,5 г (64%) цис-4-амино-5-хлор 2,3-дигидро-N-3-гидрокси-1-[3-(2-метил-1,3 диоксалан-2-ил) пропил]-4-пиперидинил]метил]-7-бензофуранкарбоксамида (соединение 7,т.пл. 118 С). Пример В.2. Смесь промежуточного (17) (0,006 моль) и 1-бутиральдегида (0,014 моль) в метаноле (150 мл) гидрировали на платине на угле (5%, 1 г) в качестве катализатора в присутствии и тиофена,4% (1 мл). После поглощения водорода (1 эквивалент) катализатор отфильтровывали и фильтрат упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2/(СН 3 ОН/NН 3) 95/5). Чистые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из ДИПЭ+АЦН. Осадок отфильтровывали и сушили, получая 0,53 г 30 диоксин-5-карбоксамида (соединение 55, т.пл. 122 С). Пример В.3. Смесь соединения (7) (0,008 моль) в НСl (8 мл) и ТГФ (80 мл) перемешивали и кипятили в колбе с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали, затем подщелачивали СН 3 ОН/NН 3 (до рН=14). Добавляли ДХМ. Органический слой отделяли, сушили,фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/(СН 3 ОН/NН 3) 95/5). Чистые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из АЦН. Осадок отфильтровывали и сушили, получая 1,7 г (цис)-4-амино-5-хлор-2,3-дигидpo-N-3-гидрокси-1-(4-оксопентил)-4-пиперидинил] метил]7-бензофуранкарбоксамида (соединение 4, т.пл. 118 С). Припер В.4. Соединение (38) (10 г) очищали и разделяли на энантиомеры хиральной колоночной хроматографии на Chiralcel AD (20 мкм, 1000; элюент: гексан/этанол 80/20, ввод: 1 г/200 мл). Собирали две группы чистых фракций и их растворитель выпаривали. (А) -остаток кристаллизовали из ДИПЭ с малым количеством АЦН и небольшим количеством воды. Осадок отфильтровывали, промывали и сушили, получая 3,5 г транс-(-)-4-амино-5-хлор-2,3-дигидро-N-3-гидрокси-1-(3-метоксипропил)-4-пиперидинил]метил]-2,2-диметил-7-бензофуранкарбоксамида(с=0,5% в СН 3 ОН)]. Точная конфигурация была определена как (3S,4S).(В)-остаток кристаллизовали из ДИПЭ с малым количеством АЦН и небольшим количеством воды. Осадок отфильтровывали, промывали и сушили, получая 3,6 г транс 4-амино 5-хлор-2,3-дигидро-N-3-гидрокси-1-(3-метоксипропил)-4-пиперидинил]метил]-2,2-диметил 7-бензофуранкарбоксамида [соединение 40,т.пл.97 С;[]20D = +12,72 (с=0,5 % в СН 3 ОН)]. Пример В.5. Смесь соединения (76) (0,015 моль) в СН 3 ОН/NН 3 (250 мл) гидрировали при 10 С с никелем Ренея (3 г) в качестве катализатора. После поглощения расчетного количества водорода (2 эквивалента) катализатор отфильтровывали через дикалит и фильтрат упаривали, получая 5,7 г -транс-5-амино-N-1-(2-аминоэтил)-3-гидрокси-4-пиперидинил]метил]-6-хлор 3,4-дигидро-2 Н-1-бензопиран-8-карбоксамида(соединение 82). Таблицы от F-1 до F-8 перечисляют соединения, которые были получены согласно одному из вышеприведенных примеров.C.1. Опорожнение желудка от некалорийной жидкой пищи, вызванное введением лидамидина собакам, находящимся в бессознательном состоянии. Самок беспородных собак, весящих 7-14 кг, обучили стоять спокойно в Павловских станках. Им имплантировали желудочную канюлю под общей анестезией с асептическими предосторожностями. После лапоратомии по срединной линии был сделан разрез стенки желудка в продольном направлении между большей и меньшей кривой на 2 см выше нервов Латарже. Канюля была прикреплена к стенке желудка посредством двойного кисетного шва и выведена через колотую рану в левом квадранте гипохондрии. Собакам давали восстановительный период, по меньшей мере, две недели. Эксперименты начинали после периода голодания в 24 ч, во время которого вода была доступна без ограничения. В начале эксперимента канюля была открыта для того, чтобы удалять любой желудочный сок или остатки пищи. Желудок промывали 40-50 мл тепловатой воды. Исследуемое соединение вводили внутривенно (в объеме 3 мл через головную вену),подкожно (в объеме 3 мл) или перорально (в объеме 1 мл/кг веса тела), вводя внутрижелудочно через канюлю устройством, которое заполняло просвет канюли; после введения испы 002619 36 туемого соединения впрыскивали 5 мл 0,9%NaCl для того, чтобы сделать поправку на мертвый объем системы впрыска). Немедленно после ввода испытуемого соединения или его растворителя вводили подкожно 0,63 мг/кг лидамидина. Спустя 30 мин канюлю открывали для того, чтобы определить количество жидкости,присутствующей в желудке, за чем быстро следовало повторное введение жидкости. Затем через канюлю вводили пробную пищу. Эта пробная пища состояла из 250 мл дистиллированной воды, содержащей глюкозу (5 г/л) в качестве метки. Канюля оставалась закрытой в течение 30 мин, после чего содержимое желудка сливалось из желудка для измерения общего объема (t=30 мин). Для последующего анализа отбирали 1 мл содержимого желудка, за чем быстро следовало повторное введение остального объема в желудок. Эту последовательность действий повторяли 4 раза с 30 мин интервалом(t= 60, 90, 120, 150 мин). В 1 мл пробах содержимого желудка определяли концентрацию глюкозы на автоматическом анализаторе Hitachi 717 по гексокиназному способу (Schmidt, 1961). Эти данные использовали для определения абсолютного количества глюкозы, остающегося в желудке после каждого 30-минутного периода, как меру остаточного объема самой пищи независимо от выделения кислоты. Через полученные точки проводили кривые (содержание глюкозы как функция времени), используя весовой нелинейный регрессионный анализ. Опорожнение желудка оценивали количественно как время, необходимое для вывода 70% пищи (t70%). Контрольное время опорожнения рассчитывали как среднее t70% последних 5 экспериментов с растворителем у одной и той же собаки. Ускорение замедленного опорожнения желудка (t) рассчитывали как разность времени между t70% соединения и t70% растворителя. Для учета вариаций скорости опорожнения у разных собак величину t выражали как % от t70% растворителя (Schuurkes etal., 1992). Таблица С-1 Ускорение опорожнения желудка от жидкой пищи, задержанного лидамидином, у собак,находящихся в бессознательном состоянии, определяли для следующих соединений при дозе 0,01 мг/кг (столбец Т/Ta) и 0,0025 мг/кг (столбец Т/Tb). Соед. Т/Тb Т/Тa 1 Таблица С-2. Ускорение опорожнения желудка от жидкой пищи, задержанного лидамидином, у собак, 38 для соединений при дозе 0,01 мг/кг (столбец Т/Ta) и 0,0025 мг/кг (столбец Т/Тb). Промежут. Т/Tb Т/Ta его стереохимически изомерная форма, его Nоксидная форма, или его фармацевтически приемлемая аддитивная соль кислоты или основания, гдеR1 и R2, взятые вместе, образуют двухвалентный радикал формулы-O-СН 2-СН 2-СН 2-СН 2- (а-6),где в указанных двухвалентных радикалах один или два атома водорода могут быть замещеныC1-6 алкилом,R3 представляет водород или галоген,R4 представляет водород или C1-6 алкил,R5 представляет водород или C1-6 алкил,L представляет С 3-6 циклоалкил, С 5-6 циклоалканон или С 2-6 алкенил илиR представляет водород или C1-6 алкил,R9 представляет водород, C1-6 алкил, С 3-6 циклоалкил, C1-6 алкилокси или гидрокси,Y представляет NR10 или прямую связь,причем R10 представляет водород или C1-6 алкил,R11 и R12, каждый независимо, представляют водород, С 1-6 алкил, С 3-6 циклоалкил, илиR11 и R12, объединенные с атомом азота, несущим R11 и R12, могут образовывать кольцо пирролидинила или пиперидинила, причем оба могут быть необязательно замещены C1-6 алкилом,амино или моно- или ди(C1-6 алкил)амино, или указанные R11 и R12, объединенные с атомом 39 азота, несущим R11 и R12, могут образовывать пиперазинильный или 4-морфолинильный радикал, причем оба могут быть замещены C1-6 алкилом, иC1-6 алкилом; пирролидинила; пирролидинила,замещенного одним или двумя заместителями,каждый из которых независимо выбран из галогена, гидрокси, циано или C1-6 алкила; пиридинила; пиридинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано,C1-6 алкила; пиримидинила; пиримидинила, замещенного одним или двумя заместителями,каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6 алкила, C1-6 алкилокси, амино и моно- и ди(С 1-6 алкил)амино; пиридазинила; пиридазинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C16 алкилокси, C1-6 алкила или галогена; пиразинила; пиразинила, замещенного одним или двумя заместителями, каждый из которых независимо выбран из галогена, гидрокси, циано, C1-6 алкила, C1-6 алкилокси, амино, моно- и ди(C1-6 алкил) амино и C1-6 алкилоксикарбонила,Het1 может быть также радикалом формулыHet1 и Het2, каждый независимо, может быть также выбран из радикалов формулыR13 и R14, каждый независимо, представляют водород или C1-4 алкил. 2. Соединение по п.1, в котором радикалOR4 расположен в положении 4 центральной пиперидиновой части. 4. Соединение по любому из пп.1-3, в котором L представляет С 3-6 циклоалкил или С 2-6 алкенил; или L представляет радикал формулы(b-1), в котором каждый Alk представляет C1-6 алкандиил, и R6 представляет водород, гидрокси, циано, амино, C1-6 алкилсульфониламино,С 3-6 циклоалкил или Het1, где Het1 представляет тетрагидрофуран; диоксалан; диоксалан, замещенный C1-6 алкилом; тетрагидропиран; пиридазинил, замещенный одним или несколькими заместителями, выбранными из гидрокси, галогена и C1-6 алкила; или радикал формулы (с-1),(с-3) или (с-4), в котором R13 представляет С 1-4 алкил; или L представляет радикал формулы (b2), в котором Alk представляет C1-6 алкандиил, Х представляет О и R7 представляет C1-6 алкил или гидроксиС 1-6 алкил; или L представляет радикал формулы (b-2), в котором Alk представляет C1-6 алкандиил, R7 представляет Het2, где Het2 представляет пиразинил, замещенный C1-6 алкилом, и Х представляет NR8, где R8 представляет водород или C1-6 алкил; или L представляет радикал формулы (b-3), в котором Y представляет прямую связь и R9 представляет C1-6 алкил, гидрокси или C1-6 алкилокси; или L представляет радикал формулы (b-4), в котором Y представляет прямую связь и R11 и R12, объединенные с атомом азота, несущим R11 и R12, образуют пирролидинил. 5. Соединение по п.4, в котором L представляет бутил; пропил, замещенный метокси,метилкарбонилом или 2-метил-1,3-диоксаланом; этил, замещенный 4-метил-2-пиридазиноном или тетрагидропиранилом; или метил, замещенный тетрагидрофуранилом или тетрагидропиранилом. 6. Соединение по п.1, представляющее собой транс-(-)-4-амино-5-хлор-2,3-дигидро-N-3 гидрокси-1-(3-метоксипропил)-4-пиперидинил] 41 метил]-2,2-диметил-7-бензофуранкарбоксамид,его фармацевтически приемлемую аддитивную соль кислоты или его N-оксидную форму. 7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-6. 8. Способ приготовления фармацевтической композиции по п.7, в котором терапевтически активное количество соединения по любому из пп.1-6 тщательно смешивают с фармацевтически приемлемым носителем. 9. Соединение формулы (III) его фармацевтически приемлемая аддитивная соль кислоты или его стереохимически изомерная форма, где R1, R2, R3, R4 и R5 такие, как они определены в п.1 для соединения формулы (I). 10. Способ получения соединения формулы (I) реакцией N-алкилирования промежуточного соединения формулы (II) промежуточным соединением формулы (III) в реакционноинертном растворителе и, необязательно, в присутствии подходящего основания и, необязательно, одно полученное соединение формулы (I) превращают в другое соединение формулы (I) по известным реакциям превращения; или, если требуется, соединение формулы(I) превращают в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) превращают в форму свободного основания щелочью; или, если требуется, получают его стереохимически изомерные формы. 11. Способ получения соединения формулы (I) реакцией соответствующего кетонового или альдегидного промежуточного соединения формулы L'=О (IV), где указанное L'=O является соединением формулы L-H, в котором два сдвоенных атома водорода в C1-12 алкандиильной группе замещены на =O, с промежуточным соединением формулы (III) и, необязательно, одно полученное соединение формулы (I) превращают в другое соединение формулы (I) по известным реакциям превращения; или, если требуется, соединение формулы(I) превращают в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) превращают в форму свободного основания ще 002619 42 лочью; или, если требуется, получают его стереохимически изомерные формы. 12. Способ получения соединения формулы (I) реакцией промежуточного соединения формулы (V) с производным карбоновой кислоты формулы (VI) или его реакционноспособным функциональным производным и, необязательно, превращением одного полученного соединения формулы (I) в другое соединение формулы (I) по известным реакциям превращения; или, если требуется, превращением соединения формулы (I) в фармацевтически приемлемую аддитивную соль кислоты, или,напротив, превращением аддитивной соли кислоты соединения формулы (I) в форму свободного основания щелочью; или, если требуется,получением его стереохимически изомерной формы. 13. Способ получения соединения формулы (I) реакцией карбонилирования промежуточного соединения формулы (VII), в котором Х представляет бром или йод, в присутствии промежуточного соединения формулы (V) в реакционно-инертном растворителе в присутствии подходящего катализатора и третичного амина и при температуре в интервале между комнатной температурой и температурой дефлегмации реакционной смеси где в вышеприведенной схеме реакции радикалы L, R1, R2, R3, R4 и R5 такие, как они определены в п.1, и W представляет подходящую отщепляемую группу; и, необязательно, одно полученное соединение формулы (I) превращают в другое соединение формулы (I) по известным реакциям превращения; или, если требуется,соединение формулы (I) превращают в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (I) превращают в форму свободного основания щелочью; или, если требуется, получают его стереохимически изомерные формы. 14. Способ получения соединения формулы (III) реакцией промежуточного соединения формулы (VIII), в котором PG представляет подходящую защитную группу с кислотой формулы (VI) или ее реакционноспособным функциональным производным в реакционноинертном растворителе с последующим снятием защиты, дающим соединения формулы (III) где в вышеприведенной схеме реакции радикалы L, R1, R2, R3, R4 и R5 такие, как они определены в п.1, и W представляет подходящую отщепляемую группу; и, необязательно, одно полученное соединение формулы (III) превращают в другое соединение формулы (III) по известным реакциям превращения; или, если требует 44 ся, соединение формулы (III) превращают в фармацевтически приемлемую аддитивную соль кислоты, или, напротив, аддитивную соль кислоты соединения формулы (III) превращают в форму свободного основания щелочью; или,если требуется, получают его стереохимически изомерные формы.
МПК / Метки
МПК: C07D 405/12, A61P 1/10, A61K 31/445
Метки: 4-замещенного, свойствами, бензамиды, бициклические, производных, аминометил, пиперидина, гастрокинетическими
Код ссылки
<a href="https://eas.patents.su/23-2619-biciklicheskie-benzamidy-proizvodnyh-3-ili-4-zameshhennogo-4-aminometil-piperidina-s-gastrokineticheskimi-svojjstvami.html" rel="bookmark" title="База патентов Евразийского Союза">Бициклические бензамиды производных 3- или 4-замещенного 4- (аминометил) пиперидина с гастрокинетическими свойствами</a>
Предыдущий патент: Способ мокрой очистки газов и устройство для его осуществления
Следующий патент: Новые соединения 1 – аза – 2 – алкил – 6 – арилциклоалкана, способ их получения и содержащие их фармацевтические композиции
Случайный патент: Слитые белки rage и способы применения












