Кристаллические трипептидные ингибиторы эпоксикетон-протеазы
Формула / Реферат
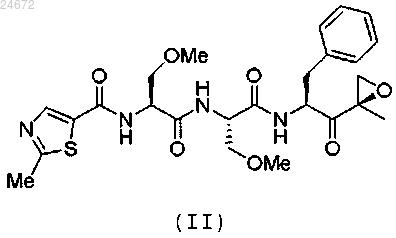
1. Способ лечения рака у пациента, включающий введение терапевтически эффективного количества кристаллической формы соединения формулы (II)
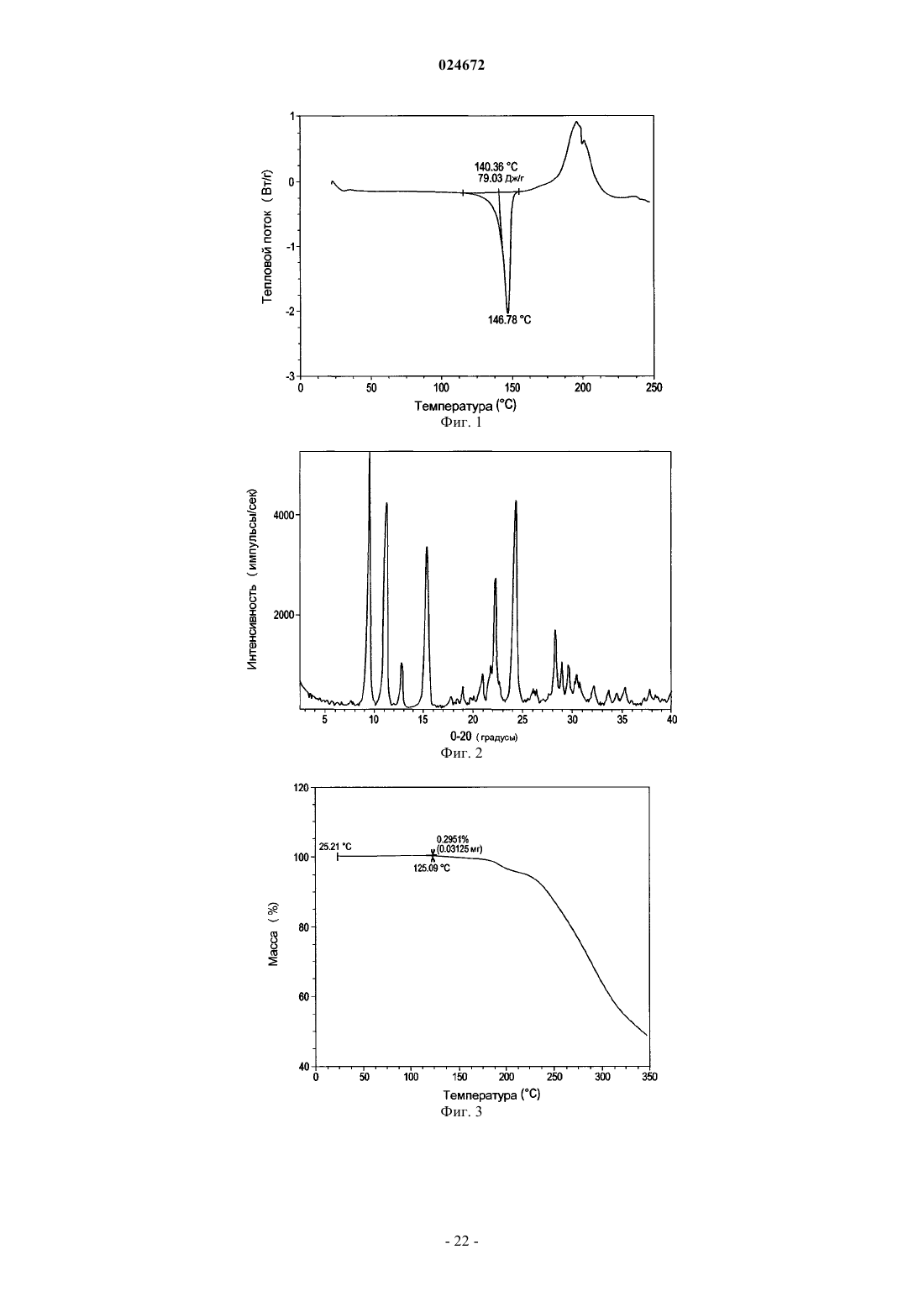
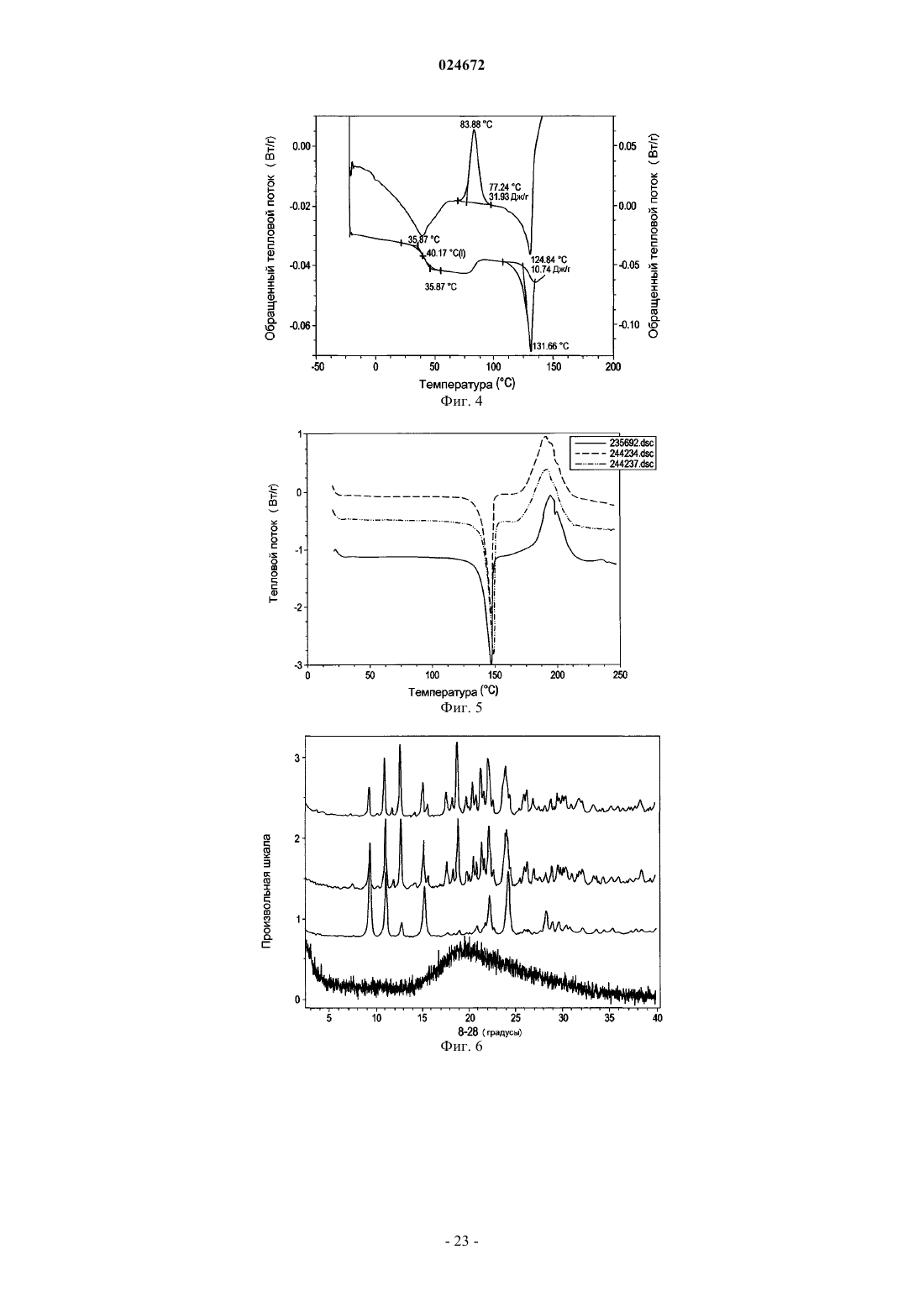
характеризующейся рентгеновской дифрактограммой с величинами 2θ 8,94; 9,39; 9,76; 10,60; 11,09; 12,74; 15,27; 17,74; 18,96; 20,58; 20,88; 21,58; 21,78; 22,25; 22,80; 24,25; 24,66; 26,04; 26,44; 28,32; 28,96; 29,65; 30,22; 30,46; 30,78; 32,17; 33,65; 34,49; 35,08; 35,33; 37,85; 38,48.
2. Способ по п.1, где рак выбран из группы, состоящей из гематологических онкологических заболеваний, макроглобулинемии Вальденстрема, множественной миеломы, диффузной В-клеточной лимфомы, мантийно-клеточной лимфомы, рака поджелудочной железы и рака легких.
3. Способ по п.2, где раком является множественная миелома.
4. Способ лечения аутоиммунного заболевания у пациента, включающий введение терапевтически эффективного количества кристаллической формы соединения формулы (II)
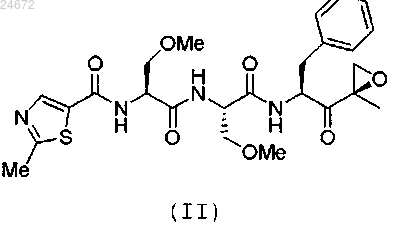
характеризующейся рентгеновской дифрактограммой с величинами 2θ 8,94; 9,39; 9,76; 10,60; 11,09; 12,74; 15,27; 17,74; 18,96; 20,58; 20,88; 21,58; 21,78; 22,25; 22,80; 24,25; 24,66; 26,04; 26,44; 28,32; 28,96; 29,65; 30,22; 30,46; 30,78; 32,17; 33,65; 34,49; 35,08; 35,33; 37,85; 38,48.
5. Способ по п.4, где аутоиммунное заболевание выбирают из группы, состоящей из красной волчанки, ревматоидного артрита и презентации антигена.
Текст
КРИСТАЛЛИЧЕСКИЕ ТРИПЕПТИДНЫЕ ИНГИБИТОРЫ ЭПОКСИКЕТОНПРОТЕАЗЫ Изобретение относится к способу лечения рака у пациента, включающему введение терапевтически эффективного количества кристаллической формы соединения формулы (II) Родственные заявки Заявка на данное изобретение испрашивает приоритет предварительной заявки на патент США под серийным 61/162196, поданной 20 марта 2009 г., и предварительной заявки на патент США под серийным 61/180561, поданной 22 мая 2009 г. Описания указанных выше заявок полностью включены в настоящий патент путем ссылки. Предпосылки изобретения В эукариотах распад белка преимущественно опосредуется по убихитиновому пути, в котором являющиеся мишенью для распада белки легируются к полипептиду из 76 аминокислот убихитину. После нацеливания убихитинированные белки затем служат в качестве субстратов для протеасомы 26S, мультикаталитической протеазы, которая расщепляет белки на короткие пептиды посредством действия трех основных протеолитических активностей. Хотя опосредованный протеасомой распад выполняет общую функцию во внутриклеточном белковом обороте, он также играет ключевую роль во многих процессах,таких как представление антигенов класса I главного комплекса гистосовместимости (МНС), апоптоз,регуляция роста клеток, активация NF-KB (транскрипционного фактора kB), процессинг антигенов и трансдукция провоспалительных сигналов. Протеасома 20S представляет собой мультикаталитический протеазный комплекс с молекулярной массой 700 кДа, состоящий из 28 субъединиц, организованных в четыре кольца. В дрожжах и других эукариотах 7 различныхсубъединиц образуют внешние кольца, и 7 различныхсубъединиц содержат внутренние кольца, а субъединицы служат в качестве сайтов связывания для регуляторных комплексов 19S (РА 700) и 11IS (PA28), а также в качестве физического барьера для внутренней протеолитической камеры, образованной двумя кольцамисубъединиц. Таким образом, считается, что протеасома существует в виде частицы 26S ("протеасомы 26S"). Эксперименты in vivo показали, что ингибирование формы 20S протеасомы может легко коррелироваться с ингибированием протеасомы 26S. Отщепление аминоконцевых пропоследовательностейсубъединиц во время образования частицы обнажает аминоконцевые остатки треонина, которые служат в качестве каталитических нуклеофитов. Таким образом, субъединицы, ответственные за каталитическую активность в протеасомах, обладают аминоконцевым нуклеофильным остатком, и эти субъединицы относятся к семейству гидролаз N-концевого нуклеофила (Ntn)(где нуклеофильный N-концевой остаток представляет собой, например, Cys, Ser, Thr и другие нуклеофильные части). Это семейство включает, например, пенициллин G ацилазу (PGA), пенициллин V ацилазу (PVA), глутамин PRPP амидотрансферазу (GAT) и бактериальную глиукуозиласпарагиназу. В дополнение к повсеместно экспрессированнымсубъединицам, высшие позвоночные также обладают тремя индуцируемыми интерфероном-субъединицами (LMP7, LMP2 и MECL1), которые замещают их нормальные копии, соответственно, 5, 1 и 7, таким образом, изменяя каталитическую активность протеасомы. Посредством использования различных пептидных субстратов, три основных вида протеолитической активности были определены для 20S протеасомы эукариота: активность, подобная химотрипсину(CT-L), которая отщепляет после крупных гидрофобных остатков; подобная трипсину активность (T-L),которая отщепляет после основных остатков; и активность, гидролизующая пептидилглутамил-пептид(PGPH), которая отщепляет после кислотных остатков. Два дополнительных менее охарактеризованных вида активности также приписывали протеасоме: активность BrAAP, которая отщепляет после разветвленноцепочечных аминокислот; и активность SNAAP, которая отщепляет после мелких нейтральных аминокислот. Представляется, что различные каталитические сайты вносят вклад в основные виды протеолитической активности протеасомы, поскольку ингибиторы, точечные мутации всубъединицах и обмен индуцирующихинтерферонсубъединиц в различных степенях изменяют указанные виды активности. Необходимы улучшенные композиции и способы получения и составления ингибитора (ингибиторов) протеасом. Краткое изложение сущности изобретения Один аспект изобретения относится к кристаллическим соединениям, имеющим структуру формулы (I) или их фармацевтически приемлемым солямR1, R2 и R3 представляют водород; каждая из групп R4, R5, R6, R7 и R8 независимо выбрана из водорода, С 1-6-алкила,С 1-6-гидроксиалкила, С 1-6-алкоксиалкила, арила и С 1-6-аралкила, каждый из которых необязательно заме-1 024672 щен группой, выбранной из алкила, амида, амина, карбоновой кислоты или ее фармацевтически приемлемой соли, сложного эфира карбоновой кислоты, тиола и тиоэфира, предпочтительно R4, R5 и R6 независимо выбраны из C1-6-тиоэфира, С 4-6-гидроксиалкила и C1-6-аралкила и R7 представляет С 1-6-алкил,предпочтительнее R4 и R5 представляют C1-6-тиоэфир, и R7 представляет C1-6-алкил. Краткое описание чертежей На фиг. 1 показана DSC (дифференциальная сканирующая калориметрическая) термограмма кристаллического соединения 1. На фиг. 2 показан тип XRPD (порошковой рентгеновской дифракции) кристаллического соединения 1. На фиг. 3 показана TG (термограмма) кристаллического соединения 1. На фиг. 4 показаны модулированные термограммы аморфного соединения 1, обращенного теплового потока (нижняя кривая) и необращенного теплового потока (верхняя кривая). На фиг. 5 показано сравнение DSC термограмм кристаллического соединения 1, полученного в соответствии с примером 2 (средняя кривая), примером 3 (верхняя кривая) и примером 4 (нижняя кривая). На фиг. 6 показан тип XRPD аморфного соединения 1. Полученного в соответствии с примером 1(верхняя кривая), по сравнению с типами XRPD кристаллического соединения 1, полученного в соответствии с примером 2 (верхняя кривая), примером 3 (2-я кривая снизу) и примером 4 (2-я кривая сверху). На фиг. 7 показана TG термограмма аморфного соединения 1. Подробное описание изобретения В определенных вариантах осуществления изобретение относится к кристаллическим соединениям,имеющим структуру формулы (I) или их фармацевтически приемлемым солямR1, R2 и R3 представляют водород; каждая из групп R4, R5, R6, R7 и R8 независимо выбрана из водорода, C1-6-алкила,С 1-6-гидроксиалкила, С 1-5-алкоксиалкила, арила и C1-6-аралкила, каждый из которых необязательно замещен группой, выбранной из алкила, амида, амина, карбоновой кислоты или ее фармацевтически приемлемой соли, сложного эфира карбоновой кислоты, тиола и тиоэфира, предпочтительно R4, R5 и R6 независимо выбраны из С 1-6-тиоэфира, С 1-6-гидроксиалкила и C1-6-аралкила и R7 представляет С 1-6-алкил,предпочтительнее R4 и R5 представляют С 1-6-тиоэфир, и R7 представляет С 1-6-алкил. В определенных вариантах осуществления изобретение относится к кристаллическому соединению формулы (II) В определенных вариантах осуществления изобретение относится к способу получения кристаллического соединения формулы (I) или (II), включающему: (i) получение аморфного соединения, например в соответствии с заявкой на патент США 11/595804; (ii) растворение аморфного соединения в органическом растворителе; (iii) доведение раствора до сверхнасыщения; (iv) отделение кристаллов, например фильтрацией кристаллов, декантацией жидкости из кристаллов или другой подходящей методикой отделения; и (v) промывание кристаллов. В определенных вариантах осуществления получение, кроме того,включает индукцию кристаллизации. В определенных вариантах осуществления получение, кроме того,включает сушку, предпочтительно при пониженном давлении, например в условиях вакуума. В определенных вариантах осуществления аморфное соединение может быть растворено в растворителе, выбранном из ацетонитрила, этилацетата, гептанов, гексанов, изопропилацетата, метанола, метилэтилкетона, тетрагидрофурана, толуола и воды или любой их комбинации. В определенных вариантах осуществления аморфное соединение формулы (II) может быть растворено в органическом растворителе,выбранном из ацетонитрила, гептанов, гексанов, метанола, тетрагидрофурана и толуола или любой их комбинации. В определенных предпочтительных вариантах осуществления органический растворитель представляет собой толуол, гидрофуран или ацетонитрил, предпочтительно ацетонитрил или толуол. В определенных вариантах осуществления доведение раствора до сверхнасыщения включает медленное добавление антирастворителя, такого как вода, гептаны, гексаны или другая полярная или неполярная жидкость, смешиваемая с органическим растворителем, предоставление возможности раствору охладиться (с осаждением или без осаждения раствора), уменьшение объема раствора или любую их комбинацию. В определенных вариантах осуществления доведение раствора до сверхнасыщения включает добавление антирастворителя, охлаждение раствора до окружающей температуры или ниже и уменьшение объема раствора, например выпариванием растворителя из раствора. В определенных вариантах осуществления предоставление раствору возможности охладиться может быть пассивным (например, предоставление раствору возможности отстояться при окружающей температуре) или активным(например, охлаждением раствора на ледяной бане или морозильнике). В определенных вариантах осуществления способ, кроме того, включает индукцию осаждения или кристаллизации. В определенных вариантах осуществления индукция осаждения или кристаллизации включает вторичную нуклеацию, где нуклеация происходит в присутствии кристаллов затравки или при взаимодействиях с окружающей средой (стенками кристаллизатора, перемешивающими импеллерами,обработкой ультразвуком и т.д.). В определенных вариантах осуществления промывание кристаллов включает промывание жидкостью, выбранной из антирастворителя, ацетонитрила, гептанов, гексанов, метанола, тетрагидрофурана,толуола, воды или их комбинации. В определенных вариантах осуществления кристаллы промываются комбинацией антирастворителя и органического растворителя. В определенных вариантах осуществления антирастворитель представляет собой воду, тогда как в других вариантах осуществления он представляет собой алкановый растворитель, такой как гексан или пентан, или ароматический углеводородный растворитель, такой как бензол, толуол или ксилол. В определенных вариантах осуществления промывание кристаллов включает промывание кристаллического соединения формулы (II) смесью тетрагидрофурана и алканового растворителя, такого как гексаны или гептаны, или смесью ацетонитрила и воды. В определенных вариантах осуществления промывание кристаллов включает промывание кристаллического соединения формулы (II) толуолом. В предпочтительных таких вариантах осуществления толуол охлаждается перед промыванием. В определенных вариантах осуществления кристаллическое соединение формулы (II) является по существу чистым. В определенных вариантах осуществления точка плавления кристаллического соединения формулы (II) находится в диапазоне от примерно 135 до примерно 160 С, от примерно 140 до примерно 155 С, от примерно 145 до примерно 150 С, или даже от примерно 147 до примерно 149 С,например примерно 149 С. В определенных вариантах осуществления DSC кристаллического соединения формулы (II) имеет резкий эндотермический максимум при температуре примерно 147 С, например в результате плавления и разрушения кристаллической формы, как показано на фиг. 1. В определенных вариантах осуществления тип порошковой рентгеновской дифракции кристаллического соединения формулы (II) представляет собой (-2): 8,94; 9,39; 9,76; 10,60; 11,09; 12,74; 15,27; 17,74; 18,96; 20,58; 20,88; 21,58; 21,78; 22,25; 22,80; 24,25; 24,66; 26,04; 26,44; 28,32; 28,96; 29,65; 30,22; 30,46; 30,78; 32,17; 33,65; 34,49; 35,08; 35,33; 37,85; 38,48, как показано на фиг. 2. В определенных вариантах осуществления TG термограмма кристаллического соединения формулы(II) проявляет потерю массы от 0,0 до 0,3% в температурном диапазоне от 25 до 125 С, как показано на фиг. 3. В определенных вариантах осуществления кристаллическое соединение формулы (II) не сольватировано (например, кристаллическая решетка не содержит молекул растворителя). В определенных вариантах осуществления кристаллическое соединение формулы (II) является сольватированным. В определенных вариантах осуществления изобретение относится к способу получения кристаллического соединения формулы (II) включающему (i) взаимодействие соединения формулы (III) где X представляет любой подходящий противоион, с соединением формулы (IV) в органическом растворителе(ii) получение раствора соединения формулы (II) в органическом растворителе; (iii) доведение раствора до сверхнасыщения для обеспечения возможности образования кристаллов; и (iv) отделения кристаллов для получения кристаллического соединения формулы (II), например фильтрацией кристаллов,декантации или любой другой подходящей методикой отделения. В определенных вариантах осуществления соединение формулы (II) не очищается хроматографией перед получением раствора в органическом растворителе. В определенных вариантах осуществления получение, кроме того, включает индукцию кристаллизацию. В определенных вариантах осуществления получение, кроме того, включает промывание кристаллов, например растворителем или жидкостью, не являющейся растворителем. В определенных вариантах осуществления получение, кроме того, включает сушку, предпочтительно при пониженном давлении, например в вакууме. В определенных вариантах осуществления X представляет противоион, выбранный из гидробромида, гидрохлорида, сульфата, фосфата, нитрата, ацетата, трифторацетата, цитрата, метансульфоната, валерата, олеата, пальмитата, стеарата, лаурата, бензоата, лактата, сукцината, тосилата, малоната, малеата,фумарата, сукцината, тартрата, месилата, 2-гидроксиэтансульфоната и т.п. (См., например, публикациюBerge et al. (1977) "Pharmaceutical Salts", J. Pharm. Sci. 66: 1-19.) В определенных вариантах осуществления X выбран из трифторацетата, метансульфоната, толуолсульфоната, ацетата, хлорида и бромида,предпочтительно трифторацетата. В определенных вариантах осуществления органический растворитель выбран из ацетонитрила,этилацетата, гептанов, гексанов, изопропилацетата, метанола, метилэтилкетона, тетрагидрофурана, толуола и воды или любой их комбинации. В определенных вариантах осуществления аморфное соединение формулы (II) может быть растворено в органическом растворителе, выбранном из ацетонитрила, гептанов, гексанов, метанола, тетрагидрофурана и толуола или любой их комбинации. В определенных вариантах осуществления органический ацетонитрил, предпочтительно ацетонитрил или толуол. В определенных вариантах осуществления получение, кроме того, включает промывание кристаллов формулы (II). В определенных вариантах осуществления промывание кристаллов включает промывание жидкостью, выбранной из антирастворителя, ацетонитрила, гептанов, гексанов, метанола, тетрагидрофурана, толуола, воды или их комбинации. В определенных вариантах осуществления кристаллы промываются комбинацией антирастворителя и органического растворителя. В определенных вариантах осуществления антирастворитель представляет собой воду, тогда как в других вариантах осуществления,он представляет собой щелочной растворитель, такой как гексан или пентан, или ароматический углеводородный растворитель, такой как бензол, толуол или ксилол. В определенных вариантах осуществления получение, кроме того, включает сушку кристаллов обоих соединений формулы (II), предпочтительно при пониженном давлении, например в вакууме. В определенных вариантах осуществления изобретение относится к фармацевтической композиции,содержащей кристаллическое соединение формулы (II) и фармацевтически приемлемый носитель. В определенных вариантах осуществления фармацевтическая композиция выбрана из таблеток, капсул и растворов для инъекций. Виды применения кристаллических трипептидных эпоксикетонов. Организованный распад белка играет решающую роль в поддержании нормальных клеточных функций, и протеасома является неотъемлемой частью процесса распада белка. Протеасома регулирует уровни белков, которые важны для развития клеточного цикла и апоптоза в нормальных и злокачественных клетках, например циклинов, каспаз, BCL2 и nF-kB (Kumatori et al., Proc. Natl. Acad. Sci. USA (1990) 87:7071-7075; Almond et al., Leukemia (2002) 16: 433-443). Таким образом, неудивительно, что ингибиро-4 024672 вание активности протеасомы может внедряться в терапевтические способы для лечения различных патологических состояний, таких как злокачественные, не злокачественные и аутоиммунные заболевания, в зависимости от вовлеченных в процесс клеток. Модели и in vitro, и in vivo показали, что злокачественные клетки, в целом, восприимчивы к ингибированию протеасомы. Действительно, ингибирование протеасомы также было обосновано в качестве терапевтической стратегии для лечения множественной меланомы. Это частично могло быть связано с зависимостью обладающих высокой пролиферативной способностью злокачественных клеток от системы протеасомы для быстрого удаления белков (Rolfe et al., J. MoI. Med. (1997) 75:5-17; Adams, Nature(2004) 4: 349-360). Поэтому определенные варианты осуществления изобретения относятся к способу лечения онкологических заболеваний, включающему введение нуждающемуся в таком лечении индивиду эффективного количества описанного в настоящем изобретении соединения, ингибитора протеасомы. Используемый в настоящем описании термин "онкологические заболевания" включает без ограничения гематологические онкологические заболевания и солидные опухоли. Онкологические заболевания относятся к заболеваниям крови, костей, органов, кожной ткани и сосудистой системы, включая без ограничения онкологические заболевания мочевого пузыря, крови, костей, мозга, молочных желез, шейки матки, грудной клетки, ободочной кишки, эндометрия, пищевода, глаз, головы, почек, печени, легких, лимфатических узлов, ротовой полости, шеи, яичников, поджелудочной железы, предстательной железы,прямой кишки, почечных структур, кожи, желудка, семенников, горла и матки. Определенные онкологические заболевания включают без ограничения лейкоз (острый лимфолейкоз (ALL), острый миелолейкоз(AML), хронический лимфолейкоз (CLL), хронический миелолейкоз (CML), волосатоклеточный лейкоз),новообразования из зрелых В-клеток (мелколимфоцитарную лимфому, В-клеточный пролимфоцитарный лейкоз, лимфоплазмацитарную лимфому (такую как макроглобулинемия Вальденстрема), лимфому селезеночной краевой зоны, плазмацитарную миелому, плазмацитому, болезни отложения моноклонального иммуноглобулина, болезни тяжелой цепи, В-клеточную лимфому внеузловой краевой зоны (лимфомуMALT), В-клеточную лимфому узловой краевой зоны (NMZL), фолликулярную лимфому, мантиеклеточную лимфому, диффузную В-клеточную лимфому, средостенную (тимическую) В-крупноклеточную лимфому, внутрисосудистую В-крупноклеточную лимфому, первичную выпотную лимфому и лимфому/лейеоз Буркитта), новообразования из зрелых Т-клеток и естественных киллерных (NK) клеток(Т-клеточный пролимфоцитарный лейкоз, Т-клеточный крупный гранулярный лимфолейкоз, агрессивный NK-клеточный лейкоз, Т-клеточный лейкоз/лимфому взрослых, внеузловую NK/T-клеточную лимфому, Т-клеточную лимфому типа энтеропатии, печеночно-селезеночную Т-клеточную лимфому, бластную NK-клеточную лимфому, фунгоидный микоз (синдром Сезари), первичную кожную анапластическую крупноклеточную лимфому, лимфоматоидный папулез, ангиоиммунобластную Т-клеточную лимфому, не специфицированную Т-клеточную лимфому и анапластическую крупноклеточную лимфому),лимфому Ходжкина (узелковый склероз, смешанную целлюлярность, обогащенную лимфоцитами, с истощенным или не истощенным запасом лимфоцитов, узелковую с преобладанием лимфоцитов), миелому(множественную миелому, безболезненную миелому, вялотекущую миелому), хроническое миелопролиферативное заболевание, миелодиспластическое/миелопролиферативное заболевание, миелодиспластические синдромы, лимфопролиферативные расстройства, связанные с иммунодефицитом, гистиоцитарные новообразования и новообразования из дендритных клеток, мастоцитоз, хондросаркому, саркому Эвинга, фибросаркому, злокачественную гигантоклеточную опухоль, миеломное заболевание костей,остеосаркому, рак молочных желез (гормонально зависимый, гормонально независимый), гинекологические онкологические заболевания (шейки матки, эндометрия, фаллопиевых труб, гестационное трофобластическое заболевание, яичников, брюшины, матки, влагалища и вульвы), базальноклеточную карциному (ВСС), плоскоклеточную карциному (SCC), злокачественную меланому, выступающую дерматофибросаркому, карциному из клеток Меркеля, саркому Капоши, астроцитому, пилоцитарную астроцитому, лихэмбриопластическую нейроэпителиальную опухоль, олигодендроглиомы, эпиндимому, мультиформную глиобластому, смешанные глиомы, олигоастроцитомы, медуллобластому, ретинобластому,нейробластому, герминому, тератому, злокачественную мезотелиому (брюшинную мезотелиому, перикардиальную мезотелиому, плевральную мезотелиому), гастро-энтеро-панкреатическую или гастроэнтеропанкреатическую нейроэндокринную опухоль (GEP-NET), карциноид, панкреатическую эндокринную опухоль (PET), колоректальную аденокарциному, колоректальную карциному, агрессивную нейроэндокринную опухоль, лейомиосаркому, муцинозную аденокарциному, перстневидноклеточную аденкарциному, печеночноклеточную карциному, холангиокарциному, гепатобластому, гемангиому, печеночную аденому, очаговую узелковую гиперплазию (узелковую регенеративную гиперплазию, гамартому), немелкоклеточную легочную карциному (NSCLC) (плоскоклеточную легочную карциному, аденокарциному, крупноклеточную легочную карциному), мелкоклеточную легочную карциному, карциному щитовидной железы, рак предстательной железы (гормонально рефракторный, независимый от андрогенов,зависимый от андрогенов, гормонально нечувствительный), почечноклеточную карциному и саркомы мягких тканей (фибросаркому, злокачественную фиброзную гистиоцитому, дерматофибросаркому, липосаркому, рабдомиосаркому, лейомиосаркому, гемангоисаркому, синовиальную саркому, злокачественную опухоль периневрия периферических нервов/нейрофибросаркому, внескелетную остеосаркому). Многие опухоли гематопоэтических и лимфоидных тканей характеризуются увеличением клеточной пролиферации или определенным типом клеток. Хронические миелопролиферативные заболевания(CMPD) представляют собой клональные расстройства гематопоэтических стволовых клеток, характеризуемые пролиферацией в костном мозге одной или более миелоидных линий дифференциации, приводящие к возросшему числу гранулоцитов, эритроцитов и/или тромбоцитов в периферической крови. В сущности, применение ингибиторов протеасомы для лечения таких заболеваний является привлекательным и исследуется в настоящее время (Cilloni et al., Haematologica (2007) 92: 1124-1229). CMPD могут включать хронический миелолейкоз, хронический нейтрофильный лейкоз, хронический эозинофильный лейкоз, истинную полицитемию, хронический идиопатический миелофиброз, эссенциальную тромбоцитопению и не классифицируемое хроническое миелопролиферативное заболевание. Один аспект изобретения представляет собой способ лечения CMPD, включающий введение нуждающемуся в таком лечении индивиду эффективного количества описанного в настоящей заявке соединения, являющегося ингибитором протеасомы. Миелодиспластические/миелопролиферативные заболевания, такие как хронический миелолейкоз,атипичный хронический миелолейкоз, ювенильный миелолейкоз и не классифицируемое миелодиспластическое/миелопролиферативное заболевание, характеризуются гиперцеллюлярностью костного мозга вследствие пролиферации в одном или более из миелоидных линий дифференцировки. Ингибирование протеасомы описанными в настоящей заявке соединением или композицией может служить в качестве лечения указанных миелодиспластических/миелопролиферативных заболеваний путем введения нуждающемуся в таком лечении индивиду эффективного количества соединения или композиции. Миелодиспластические синдромы (MDS) относятся к группе расстройств гематопоэтических стволовых клеток, характеризуемых дисплазией и неэффективным гематопоэзом в одной или более из основных линий миелоидных клеток. Воздействие ингибитором протеасомы на NF-kB в качестве мишени при данных гематологических злокачественных заболеваниях вызывает апоптоз, посредством этого уничтожая злокачественные клетки (Braun et al. Cell Death and Differentiation (2006) 13:748-758). Еще один вариант осуществления изобретения представляет собой способ лечения MDS, включающий введение нуждающемуся в таком лечении индивиду эффективного количества описанного в настоящем изобретении соединения. MDS включает рефракторную анемию с кольцевидными сидеробластами, рефракторную цитопению с дисплазией множества линий дифференциации, рефракторную анемию с избытком бластов,не классифицируемый миелодиспластический синдром и миелодиспластический синдром, связанный с изолированной аномалией хромосомы del(5q). Мастоцитоз представляет собой пролиферацию тучных клеток и их последующее накопление в одной или более системах органов. Мастоцитоз включает без ограничения кожный мастоцитоз, безболезненный системный мастоцитоз (ISM), системный мастоцитоз с ассоциированным клональным гематологическим, не связанным с линией дифференциации тучных клеток заболеванием (SM-AHNMD), агрессивный системный мастоцитоз (ASM), тучноклеточный лейкоз (MCL), тучноклеточную саркому (MCS) и внекожную мастоцитому. Другой вариант осуществления изобретения представляет собой способ лечения мастоцитоза,включающий введение эффективного количества описанных в настоящем изобретении соединения или композиции индивиду, у которого диагностирован мастоцитоз. Протеасома регулирует NF-кВ, который в свою очередь регулирует гены, участвующие в иммунной и воспалительной реакции. Например, NF -kB требуется для экспрессии гена к легкой цепи иммуноглобулина, гена -цепи рецептора IL-2, гена класса I главного комплекса гистосовместимости и ряда цитокиновых генов, кодирующих, например, IL-2, IL-6, фактор, стимулирующий колонии гранулоцитов, иIFN-(5 (Palombella et al., Cell (1994) 78:773-785). Таким образом, в определенных вариантах осуществления изобретение относится к способам воздействия на уровень экспрессии IL-2, MHC-I, IL-6, TNF,IFN- или любых из ранее упомянутых белков, причем каждый способ включает введение индивиду эффективного количества описанных в настоящем изобретении соединения или композиции ингибитора протеасомы. В определенных вариантах осуществления изобретение включает способ лечения аутоиммунных заболеваний у млекопитающего, включающий введение терапевтически эффективного количества описанных в настоящей заявке соединения или композиции. В настоящем описании "аутоиммунное заболевание" представляет собой заболевание или расстройство, возникающее из собственных тканей индивида, и направленное против них. Примеры аутоиммунных заболеваний или расстройств включают без ограничения воспалительные реакции, такие как воспалительные кожные заболевания, включая псориаз и дерматит (например, атопический дерматит); системную склеродермию и склероз; реакции, связанные с воспалительным кишечным заболеванием (таким как болезнь Крона и язвенный колит); респираторный дистресс синдром (включая респираторный дистресс синдром взрослых; ARDS); дерматит; менингит; энцефалит; увеит; колит; гломерулонефрит; аллергические состояния, такие как экзема и астма, и другие состояния, включающие инфильтрацию Т-клеток, и хронические воспалительные реакции; атеросклероз; недостаточность адгезии лейкоцитов; ревматоидный артрит; системную красную волчанку(SLE); сахарный диабет (например, сахарный диабет I типа или инсулинозависимый сахарный диабет); рассеянный склероз; синдром Рейно; аутоиммунный тироидит; аллергический энцефаломиелит; синдром Шегрена; ювенильный диабет; и иммунные реакции, связанные с острой и отсроченной гиперчувствительностью, опосредованной цитокинами и Т-лимфоцитами, обычно обнаруживаемые при туберкулезе,саркоидозе, полимиозите, грануломатозе и васкулите; пернициозную анемию (болезнь Эдиссона); заболевания, вовлекающие лейкоцитарный диапедез; воспалительное расстройство центральной нервной системы (ЦНС); синдром повреждения множества органов; гемолитическую анемию (включая без ограничения криоглобулинемию или Кумбо-положительную анемию); генерализованную миастению; заболевания, опосредованные комплексом антиген-антитело; заболевание, вызванное антителом против основной мембраны клубочков; антифосфолипидный синдром; аллергический неврит; болезнь Грэйвса; миастенический синдром Лэмберта-Итона; буллезную псевдопузырчатку; пузырчатку; аутоиммунные полиэндокринопатии; болезнь Рейтера; синдром мышечной скованности; болезнь Бехчета; гигантоклеточный артериит; нефрит, вызванный иммунными комплексами; нефропатия, вызванная IgA; полинейропатии, вызванные IgM; иммунную тромбоцитопеническую пурпуру (ITP) или аутоиммунную тромбоцитопению. Иммунная система проводит скрининг для выявления аутологичных клеток, которые инфицированы вирусами, подверглись онкогенной трансформации или представляют незнакомые пептиды на их поверхности. Внутриклеточный протеолиз генерирует мелкие пептиды для представления Т-лимфоцитам для вызова иммунных реакций, опосредованных классом I MHC. Таким образом, в определенных вариантах осуществления изобретение относится к способу применения соединения в качестве иммуномодулирующего средства для ингибирования или изменения представления антигена в клетке, включающему воздействие на клетку (или введение индивиду) соединения, описанного в настоящем изобретении. Определенные варианты осуществления включают способ лечения заболеваний трансплантата или связанных с ним, таких как болезнь трансплантат против хозяина или болезнь хозяин против трансплантата у млекопитающего, включающий введение терапевтически эффективного количества соединения, описанного в настоящем изобретении. Используемый в настоящем описании термин "трансплантат" относится к биологическому материалу, полученному у донора для трансплантации реципиенту. Трансплантаты включают такие разнообразные материалы как, например, изолированные клетки, такие как островковые клетки; ткань, такую как амниотическая оболочка новорожденного, костный мозг, гематопоэтические клетки-предшественники и глазную ткань, такую как ткань роговицы; и органы, такие как кожа, сердце,печень, селезенка, поджелудочная железа, доля щитовидной железы, почка, трубчатые органы (например, кишечник, кровеносные сосуды или пищевод). Трубчатые органы могут использоваться для замещения поврежденных частей пищевода, кровеносных сосудов или желчного протока. Кожные трансплантаты могут использоваться не только по поводу ожогов, но также в качестве покрытия поврежденного кишечника или для закрытия определенных дефектов, таких как диафрагмальная грыжа. Источником трансплантата может быть любое млекопитающее, включая человека, или трупы, или живые доноры. В некоторых случаях, донор и реципиент представляют собой одно и то же млекопитающее. Предпочтительно трансплантат представляет собой костный мозг или орган, такой как сердце, и донор трансплантата и хозяин совпадают по антигенам II класса HLA антигенов. Новообразования из гистиоцитарных и дендритных клеток происходят из фагоцитов и добавочных клеток, которые играют основные роли в процессинге и представлении антигенов лимфоцитам. Было показано, что истощение запаса протеасомы в дендритных клетках изменяет их вызванные антигеном реакции (Chapatte et al., Cancer Res. (2006) 66:5461-5468). Таким образом, другой вариант осуществления изобретения включает введение эффективного количества описанного в настоящем изобретении соединения или композиции индивиду с новообразованием из гистиоцитов или дендритных клеток. Новообразования из гистиоцитов или дендритных клеток включают гистиоцитарную саркому, гистиоцитоз клеток Лангерганса, саркому из клеток Лангерганса, саркому/опухоль из смыкающихся дендритных клеток и не специфицированную саркому из дендритных клеток. Было показано, что ингибирование протеасомы благоприятно для лечения заболеваний, при которых пролиферирует некий тип клеток, и иммунных расстройств; таким образом, один вариант осуществления изобретения включает лечение лимфопролиферативных заболеваний (LPD), связанных с первичными иммунными расстройствами (PID), состоящее в ведении эффективного количества описанного соединения нуждающемуся в нем индивиду. Самыми распространенными клиническими формами иммунодефицита, связанного с повышенной частотой лимфопролиферативных расстройств, включая Вклеточные и Т-клеточные новообразования и лимфомы, являются первичные синдромы иммунодефицита и другие первичные иммунные расстройства, инфекция человеческим вирусом иммунодефицита (HIV,ВИЧ), ятрогенное подавление иммунитета у пациентов, которые получили аллотрансплантаты органа или костного мозга, и ятрогенное подавление иммунитета, связанное с лечением метотрексатом. ДругиеPID, обычно связанные с LPD, представляют собой без ограничения атаксию телангиэктазию (AT), стиндром Вискотта-Олдрича (WAS), обычный вариабельный иммунодефицит (CVID), тяжелый комбинированный иммунодефицит (SCID), Х-сцепленное лимфопролиферативное расстройство (XLP), сидром хромосомных поломок Ниймегена (NBS), синдром гипер-IgM и аутоиммунный лимфопролиферативный синдром (ALPS). Дополнительные варианты осуществления изобретения относятся к способам воздействия на зависимую от протеасомы регуляцию онкопротеинов и способам лечения или ингибирования роста злокачественного новообразования, причем каждый способ включает воздействие на клетку (in vivo, например у индивида, или in vitro) описанной в настоящей заявке композицией ингибитора протеасомы. Происходящие из HPV-16 и HPV-18 Е 6 протеины стимулируют АТИФ- и убихитин-зависимую конъюгацию и распад р 53 в неочищенных ретикулоцитарных лизатах. Было показано, что рецессивный онкоген р 53 накапливается при непермиссивной температуре в линии клеток с мутированным термолабильным Е 1. Повышенные уровни р 53 могут привести к апоптозу. Примеры прото-онкопротеинов, разлагаемых системой убихитина, включают c-Mos, c-Fos и c-Jun. В определенных вариантах осуществления изобретение относится к способу лечения связанного с р 53 апоптоза, включающему введение индивиду эффективного количества описанной в настоящем изобретении композиции ингибитора протеасомы. Другой аспект изобретения относится к применению описанных в настоящей заявке композиций ингибитора протеасомы для лечения нейродегенеративных заболеваний и состояний, включая без ограничения инсульт, ишемическое повреждение нервной системы, травму нервов (например, сотрясение мозга, травму спинного мозга и травматическое повреждение нервной системы), рассеянный склероз и другие иммуно опосредованные нейропатии (например, синдром Гиллена-Барре и его варианты, острую двигательную аксонную нейропатию, острую воспалительную демиелинирующую полинейропатию и синдром Фишера), комплекс деменции при ВИЧ инфекции/СПИДе, аксономию, диабетическую нейропатию, болезнь Паркинсона, болезнь Хантингтона, рассеянный склероз, бактериальный, паразитарный,грибковый и вирусный менингит, энцефалит, сосудистую деменцию, деменцию в результате множественных инфарктов, деменцию с тельцами Леви, деменцию, связанную с поражением лобной доли мозга,такую как болезнь Пика, субкортикальные деменции (такие как болезнь Хантингтона или прогрессирующий супрануклеарный паралич), синдромы очаговой атрофии коры (такие как первичная афазия),метаболические-токсические деменции (такие как хронический гипотиреоз или недостаточность В 12) и деменции, вызванные инфекциями (такие как сифилис или хронический менингит). Болезнь Альцгеймера характеризуется внеклеточными отложениями -амилоидного белка (-АР) в сенильных бляшках и сосудах мозга. -АР представляет собой пептидный фрагмент из 39-42 аминокислот, происходящих из предшественника амилоидного белка (АРР). Известны по меньшей мере три изоформы АРР (695, 751 и 770 аминокислот). Альтернативный сплайсинг мРНК генерирует изоформы; нормальный процессинг воздействует на часть последовательности -АР, посредством этого предотвращая генерирование -АР. Считается, что аномальный процессинг белка протеасомой вносит вклад в обилие-АР в мозге при болезни Альцгеймера. Фермент процессинга АРР у крыс содержит примерно 10 различных субъединиц (22 кДа-32 кДа). Субъединица 25 кДа имеет N-концевую последовательность X-GlnAsn-Pro-Met-X-Thr-Gly-Thr-Ser, которая идентична -субъединице человеческой мультикаталитической протеазы (Kojima, S. et al., Fed. Eur. Biochem. Soc, (1992) 304:57-60). Фермент процессинга АРР расщепляет в связи Gln15-Lys16; в присутствии иона кальция, фермент также расщепляет в связи Met'1Asp1 и связи Asp1Ala2 для высвобождения внеклеточного домена -АР. Поэтому один аспект изобретения относится к способу лечения болезни Альцгеймера, включающему введение индивиду эффективного количества описанного в настоящей заявке соединения или композиции ингибитора протеасомы. Такое лечение включает снижение скорости процессинга -АР, снижение скорости образования бляшки -АР, снижение скорости генерирования -АР и уменьшение клинических признаков болезни Альцгеймера. Фиброз представляет собой избыточное и стойкое образование фиброзной соединительной ткани,возникающее в результате гиперпролиферативного роста фибробластов и связан с активацией пути передачи сигналов TGF-. Фиброз включает экстенсивное отложение внеклеточной матрицы и может происходить по существу внутри любой ткани или по нескольким различным тканям. Обычно, уровень белка внутриклеточной передачи сигналов (Smad), который активирует транскрипцию генов-мишеней после стимуляции TGF-, регулируется активностью протеасомы (Xu et al., 2000). Однако ускоренная деградация компонентов передачи сигналов TGF- наблюдалась при фибротических состояниях, таких как муковисцедоз, инъекционный фиброз, эндомиокардиальный фиброз, идиопатический легочный фиброз,миелофиброз, забрюшинный фиброз, прогрессирующий массивный фиброз, нефрогенный системный фиброз. Другие состояния, которые часто связаны с фиброзом, включают цирроз, диффузное паренхиматозное легочное заболевание, синдром боли после вазэктомии, туберкулез, серповидноклеточная анемия и ревматоидный артрит. Один вариант осуществления изобретения представляет собой способ лечения фибротического или связанного с фибротическим состояния, включающий введение эффективного количества описанной в настоящем изобретении композиции нуждающемуся в таком лечении индивиду. Лечению жертв ожогов часто препятствует фиброз. Таким образом, в определенных вариантах осуществления изобретение относится к местному или системному введению обсуждаемого ингибитора для лечения ожогов. Закрытие ран после хирургических вмешательств часто связано с образованием деформирующих рубцов, которое может быть предотвращено ингибированием фиброза. Таким образом, в определенных вариантах осуществления изобретение относится к способу предотвращения или умень-8 024672 шению деформирующего рубцевания. Считается, что избыточная продукция индуцированных липополисахаридом (LPS) цитокинов, таких как TNFa является центральным механизмом в процессах, связанных с септическим шоком. Кроме того, в целом принято считать, что первой стадией в активации клеток LPS является связывание LPS со специфическими рецепторами мембраны. - и -субъединицы комплекса протеасомы 20S были идентифицированы в качестве связывающих LPS белков, свидетельствуя о том, что вызванная LPS трансдукция сигналов может быть важной терапевтической мишенью при лечении или предотвращении сепсиса(Qureshi, N. et al., J. Immun. (2003) 171: 1515-1525). Поэтому в определенных вариантах осуществления композиция ингибитора протеасомы может применяться для ингибирования TNFa для предотвращения и/или лечения септического шока. Ишемия и реперфузионное повреждение приводит к гипоксии, состоянию, при котором имеется дефицит кислорода, достигающего тканей организма. Это состояние вызывает увеличенный распадIk-В, посредством этого, приводя к активации NF-кВ (Koong et al., 1994). Было продемонстрировано,что тяжесть повреждения в результате гипоксии может быть уменьшена введением ингибитора протеасомы (Gao et al., 2000; Bao et al., 2001; Pye et al., 2003). Поэтому определенные варианты осуществления изобретения относятся к способу лечения ишемического состояния или реперфузионного повреждения,включающему введение нуждающемуся в таком лечении индивиду эффективного количества описанного в настоящем изобретении соединения ингибитора протеасомы. Примеры таких состояний или повреждений включают без ограничения острый коронарный синдром (уязвимые бляшки), артериальное окклюзионное заболевание (окклюзии сердечных, периферических артерий и других сосудов), атеросклерозNF-kB также специфически связывается с ВИЧ-энхансером/промотором. По сравнению с Nefmac239, ВИЧ регуляторный белок Nef pbj14 отличается двумя аминокислотами в области, которая регулирует связывание протеинкиназы. Считается, что протеинкиназа передает сигналы фосфорилирования IkB, запуская распад IkB по пути убихитина-протеасомы. После распада, NF-kB высвобождается в ядро, таким образом, усиливая транскрипцию ВИЧ (Cohen, J., Science, (1995) 267:960). В определенных вариантах осуществления изобретение относится к способу ингибирования или уменьшения ВИЧ инфекции у индивида или способу снижения уровня экспрессии вирусного гена, причем каждый способ включает введение индивиду эффективного количества описанной в настоящей заявке соединения или композиции ингибитора протеасомы. Вирусные инфекции вносят вклад в патологию многих заболеваний. Сердечные состояния, такие как текущий миокардит и дилятационная кардиомиопатия были связаны с коксакивирусом В 3. В сравнительном цельногеномном микрочиповом анализе инфицированных мышиных сердец, специфические протеасомные субъединицы были равномерно стимулированы в сердцах мышей, у которых развился хронический миокардит (Szalay et al, Am J Pathol 168:1542-52, 2006). Некоторые вирусы используют убихитин-протеасомную систему на стадии вхождения вируса, где вирус высвобождается из эндосомы в цитозоль. Вирус гепатита мышей (MHV) относится к семейству Coronaviridae, которое также включает коронавирус тяжелого острого респираторного синдрома (SARS). Yu и Lai (J Virol 79:644-648, 2005) продемонстрировали, что обработка инфицированных MHV клеток ингибтором протеасомы привела к уменьшению вирусной репликации, коррелирующемуся со сниженным вирусным титром, по сравнению с титром необработанных клеток. Вирус гепатита В человека (HBV), член семейства вирусов Hepadnaviridae, аналогичным образом для размножения требует вирусно кодируемых оболочечных белков. Ингибирование пути распада протеасомы вызывает значительное снижение количества секретируемых оболочечных белков (Simsek et al., J Virol 79:12914-12920, 2005). В дополнение к HBV, другие вирусы гепатита (А, С, D и Е) могут также использовать путь распада убихина-протеасомы для секреции, морфогенеза и патогенеза. Соответственно, в определенных вариантах осуществления изобретение относится к способу лечения вирусной инфекции, такой как SARS или гепатит А, В, С, D и Е, включающему контакт клетки с (или введение индивиду) эффективным количеством описанного в настоящем изобретении соединения или композиции. В определенных вариантах осуществления описанная композиция может применяться для лечения паразитарной инфекции, такой как инфекции, вызванной протозойными паразитами. Считается, что протеасома указанных паразитов участвует в первую очередь в таких видах клеточной активности как дифференциация и репликация (Paugara et al., Trends Parasitol. 2003, 19(2): 55-59). Кроме того, было показано, что виды энтамебы утрачивают способность инцистации при воздействии ингибиторов протеасомы(Gonzales et al., Arch. Med. Res. 1997, 28, Spec No: 139-140). В таких определенных вариантах осуществления протоколы введения для композиций ингибитора протеасомы используются для лечения паразитарных инфекций у людей, вызванных протозойным паразитом, выбранным из видов Plasmodium (включая P. falciparum, P. vivax, P. Malariae и Р. ovale, которые вызывают малярию), видов Trypanosoma (включая Т. cruzi, которая вызывает болезнь Чагаса, и Т. Brucei, которая вызывает африканскую сонную болезнь), видов Leishmania (включая L. amazonesis, L. donovani, L. infantum, L. mexicana, и т.д.), Pneumocys-9 024672tis carinii (простейшее, которое, как известно, вызывает пневмонию у пациентов со СПИДом и другими видами подавления иммунитета), Toxoplasma gondii, Entamoeba histolytica, Entamoeba invadens м Giardialamblia. В определенных вариантах осуществления описанные композиции ингибитора протеасомы используются для лечения паразитарных инфекций у животных и скота, вызванных простейшими паразитами, выбранными из Plasmodium hermani, видов Cryptosporidium, Echinococcus granulosus, Eimeria tenella, Sarcocystis neurona и Neurospora crassa. Другие соединения, которые действуют в качестве ингибиторов протеасомы при лечении паразитарных заболеваний, описаны в документе WO 98/10779, который полностью включен в настоящее описание путем ссылки. В определенных вариантах осуществления композиции ингибитора протеасомы ингибируют активность протеасомы у паразита без извлечения из эритроцитов и лейкоцитов. В таких определенных вариантах осуществления длинный период полураспада в клетках крови может обеспечить продолжительную защиту в отношении терапии против рецидивирующего воздействия паразитов. В определенных вариантах осуществления композиции ингибитора протеасомы могут обеспечить продолжительную защиту в отношении химиопрофилактики против будущей инфекции. Прокариоты имеют эквивалент эукариотной частице протеасомы 20S. Хотя субъединичная композиция частицы прокариота 20S проще, чем субъединичная композиция эукариотов, она способна гидролизовать пептидные связи аналогичным образом. Например, нуклеофильная атака на пептидную связь происходит через остаток треонина на N-конце -субъединиц. Таким образом, один вариант осуществления данного изобретения относится к способу лечения прокариотных инфекций, включающему введение индивиду эффективного количества описанных в настоящем изобретении соединения или композиции. Прокариотные инфекции могут включать заболевания, вызванные или микобактриями (такими как туберкулез, проказа или язва Бурули), или архебактериями. Было также продемонстрировано, что ингибиторы, которые связываются с протеасомой 20S, стимулируют формирование костной ткани в органных культурах костей. Кроме того, когда такие ингибиторы вводились системно мышам, то определенные ингибиторы протеасомы увеличивали объем костей и скорость образования костной ткани более чем на 70% (Garrett, I. R. et al., J. Clin. Invest. (2003) 111: 1771-1782), поэтому свидетельствуя о том, что убихитин-протеасомный механизм регулирует дифференциацию остеобластов и формирование костной ткани. Поэтому описанные соединение или композиция ингибитора протеасомы могут использоваться при лечении и/или профилактике заболеваний, связанных с потерей костной ткани, таких как остеопороз. Таким образом, в определенных вариантах осуществления изобретение относится к способу лечения заболевания или состояния, выбранного из онкологического заболевания, аутоиммунного заболевания, состояния, связанного с трансплантатом, нейродегенеративного заболевания, состояния, связанного с фиброзом, состояний, связанных с ишемией, инфекции (вирусной, паразитарной или прокариотической) и заболеваний, связанных с потерей костной ткани, включающему введение описанных в настоящей заявке соединения или композиции. Введение кристаллических трипептидных эпоксикетонов. Соединения, полученные как описано в настоящей заявке, могут вводиться в различных формах, в зависимости от подлежащего лечению расстройства и возраста, состояния и массы тела пациента, как хорошо известно в данной области. Например, когда соединения предстоит вводить перорально, они могут находиться в виде таблетки, капсулы, гранулы, порошка или сиропа; или для парентерального введения, они могут находиться в виде растворов для инъекций (внутривенных, внутримышечных или подкожных), препаратов для капельной инфузии или суппозиториев. Для введения через слизистую оболочку глаз, соединения могут находиться в виде глазных капель или глазных мазей. Указанные препаративные формы могут быть получены обычными средствами и, при желании, активный ингредиент может смешиваться с любой обычной добавкой или эксципиентом, таким как связывающий агент, разрыхлитель, смазывающее вещество, корригент, солюбилизирующий агент, суспендирующий агент, эмульгирующий агент, агент покрытия, циклодекстрин и/или буфер. Хотя дозировка будет варьироваться в зависимости от симптомов, возраста и массы тела пациента, природы и тяжести подлежащего лечению или профилактике расстройства, пути введения и формы лекарственного средства; в целом, рекомендуемая суточная доза составляет от 0,01 до 2000 мг соединения для взрослого пациента-человека, и ее можно вводить одной дозой или дробными дозами. Количество активного ингредиента, которое может комбинироваться с материалом носителя для получения одной лекарственной формы, в целом составляет количество соединения, которое обеспечивает терапевтический эффект. Точное время введения и/или количество композиции, которое даст наиболее эффективные результаты с точки зрения эффективности лечения у данного пациента, будет зависеть от активности, фармакокинетики и биодоступности конкретного соединения, физиологического состояния пациента (включая возраст, пол, тип и стадию заболевания, общее физическое состояние, реактивности на данную дозировку и типа медикаментозной терапии), пути введения и т.д. Однако указанные выше рекомендации могут использоваться в качестве основы для тонкого подбора лечения, например определения оптимального времени введения и/или вводимого количества, которое потребует не более чем обычного экспериментирования, состоящего из мониторинга индивида и подбора дозировки и/или времени введения. Фраза "фармацевтически приемлемые" используется в настоящем описании для обозначения тех лигандов, материалов, композиций и/или лекарственных форм, которые, в пределах объема здравого медицинского суждения, подходят для применения в контакте с тканями людей и животных без избыточной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, соразмерно с целесообразным соотношением выгода/риск. Используемая в настоящем изобретении фраза "фармацевтически приемлемый носитель" означает фармацевтически приемлемый материал, композицию или наполнитель, такой как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал. Каждый носитель должен быть "приемлемым" в смысле совместимости с другими ингредиентами препаративной формы и безвредным для пациента. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал, картофельный крахмал и замещенный и незамещенный циклодекстрин; (3) целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, масло семян хлопка, масло сафлора, кунжутное масло, оливковое масло, кукурузное масло и масло соевых бобов; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) забуферивающие агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) беспирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатные буферные растворы; и (21) другие нетоксичные совместимые вещества, используемые в фармацевтических препаративных формах. В определенных вариантах осуществления фармацевтические композиции по настоящему изобретению являются не пирогенными, т.е. не вызывают значительных подъемов температуры при введении пациенту. Термин "фармацевтически приемлемая соль" относится к относительно нетоксичным аддитивным солям неорганических и органических кислот ингибитора(ов). Указанные соли могут быть получены insitu во время конечного выделения и очистки ингибитора(ов) или отдельным взаимодействием очищенного ингибитора(ов) в его форме свободного основания подходящей органической или неорганической кислотой и выделением образованной таким образом соли. Репрезентативные соли включают гидробромиды, гидрохлориды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, валераты, олеаты, апальмитаты, стеараты, лаураты, бензоаты, лактаты, фосфаты, тосилаты, цитраты, малеаты, фумараты, сукцинаты,тартраты, нафтилаты, месилаты, глюкогептонаты, лактобионаты, лаурилсульфонаты и соли аминокислот и т.п. (См., например, Berge et al., (1977) "Pharmaceutical Salts", J. Pharm. Sci. 66: 1-19.) В других случаях, ингибиторы, которые могут использоваться в способах по настоящему изобретению, могут содержать одну или более кислотных функциональных групп и, таким образом, способны образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми основаниями. Термин "фармацевтически приемлемые соли" в данных случаях относится к относительно нетоксичным аддитивным солям неорганических и органических оснований ингибитора(ов). Эти соли могут быть аналогичным образом получены in situ во время конечного выделения и очистки ингибитора(ов) или отдельным взаимодействием очищенного ингибитора(ов) в форме его свободной кислоты с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла с аммиаком или с фармацевтически приемлемым органическим первичным, вторичным или третичным амином. Репрезентативные щелочные и щелочноземельные соли включают соли лития, натрия, калия,кальция, магния и алюминия и т.п. Репрезентативные органические амины, используемые для образования основных аддитивных солей, включают этиламин, диэтиламин, этилендиамин, этаноламин, диэтаноламин, пиперазин и т.п. (см., например, приведенную выше ссылку Berge et al.). Смачивающие агенты, эмульгаторы и смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красящие агенты, вещества, способствующие высвобождению, покрывающие вещества, подсластители, ароматизирующие и одорирующие вещества, консерванты и антиоксиданты могут также присутствовать в композициях. Примеры фармацевтически приемлемых антиоксидантов включают: (1) растворимые в воде антиоксиданты, такие как аскорбиновая кислота, цистеин гидрохлорид, бисульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; (2) маслорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат,альфа-токоферол и т.п.; и (3) агенты, образующие хелаты ионов металлов, такие как лимонная кислота,этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и т.п. Препаративные формы, подходящие для перорального введения, могут быть представлены в виде капсул, облаток, пилюль, таблеток, лепешек (с использованием ароматизированной основы, обычно сахарозы и акации или трагаканта), порошков, гранул или раствора или суспензии в водной или неводной жидкости, или в виде эмульсии масло-в-воде или вода-в-масле, или в виде эликсира или сиропа, или в виде пастилок (с использованием инертной матрицы, такой как желатин и глицерин, или сахароза и акация) и/или в виде полосканий для ротовой полости и т.п., причем каждая форма содержит заданное ко- 11024672 личество ингибитора (ингибиторов) в качестве активного ингредиента. Композиция может также вводиться в виде болюса или пасты различной консистенции. В твердых лекарственных формах для перорального введения (капсулах, таблетках, пилюлях, драже, порошках, гранулах и т.п.) активный ингредиент может быть смешан с одним или более фармацевтически приемлемых носителей, таких как цитрат натрия или дикальций фосфат, и/или один из следующих: (1) наполнителей или увеличителей объема, таких как крахмалы, циклодекстрины, лактоза, сахароза, глюкоза, маннит и/или кремневая кислота; (2) связывающих веществ, таких как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или акация; (3) увлажнителей,таких как глицерин; (4) разрыхлителей, таких как агар-агар, карбонат кальция, крахмал картофеля или тапиоки, альгиновая кислота, определенные салицилаты и карбонат натрия; (5) задерживающих растворений агенты, такие как парафин; (6) ускорителей всасывания, таких как соединения четвертичного аммония; (7) смачивающих агентов, таких как, например, ацетиловый спирт и глицерол моностеарат; (8) абсорбентов, таких как каолиновая и бентонитовая глина; (9) смазывающих веществ, таких как тальк,стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси; и (10) красящих агентов. В случае капсул, таблеток и пилюль, фармацевтические композиции могут также содержать забуферивающие агенты. Твердые композиции аналогичного типа могут также использоваться в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах с использованием таких эксципиентов как лактоза или молочные сахара, а также полиэтиленгликоли с высокой молекулярной массой и т.п. В определенных вариантах осуществления кристаллический трипептидный эпоксикетон вводится млекопитающему в виде капсулы. В другом варианте осуществления кристаллический трипептидный эпоксикетон представляет собой соединение формулы (I). В более предпочтительном варианте осуществления кристаллический трипептидный эпоксикетон представляет собой соединение формулы(II). Таблетка может быть получена прессованием или формовкой, возможно, с одним или более добавочных ингредиентов. Прессованные таблетки могут быть получены с использованием связывающего вещества (например, желатина или гидроксипропилметилцеллюлозы), смазывающего вещества, инертного разбавителя, консерванта, разрыхлителя (например, гликолят крахмала натрия или поперечносшитой карбоксиметилцеллюлозы натрия), поверхностно-активного или диспергирующего агента. Формованные таблетки могут быть получены формовкой в подходящей машине смеси порошкообразного ингибитора (ингибиторов), смоченного инертным жидким разбавителем. На таблетках и других твердых лекарственных формах, таких как драже, капсулы, пилюли и гранулы, возможно наличие насечки или они могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия, и другие покрытия, хорошо известные в области получения фармацевтических препаративных форм. Они могут также составляться так, чтобы обеспечить медленное или контролируемое высвобождение активного ингредиента, содержащегося в них, используя, например, гидроксипропилметилцелюлозу в различных пропорциях для обеспечения желательного профиля высвобождения, другие полимерные матрицы, липосомы и/или микросферы. Они могут стерилизоваться, например, фильтрацией через задерживающий бактерии фильтр, или включением стерилизующих агентов в форме стерильной инъецируемой среды непосредственно перед применением. Возможно также содержание в указанных композициях контрастирующих агентов, и они могут также иметь композицию, высвобождающую только активный ингредиент (ингредиенты), или предпочтительно в определенной части желудочно-кишечного тракта, возможно, отсроченным образом. Примеры композиций для заливки, которые могут использоваться, включают полимерные вещества и воски. Активный ингредиент может быть также представлен в микро-инкапсулированной форме, если целесообразно, с одним или более из описанных выше эксципиентов. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активному ингредиенту, жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, масло семян хлопка,масло земляного ореха, кукурузное масло, зародышевое масло, оливковое масло, касторовое масло и кунжутное масло), глицерол, тетрагидрофуриловый спирт, полизтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси. Кроме инертных разбавителей, пероральные композиции могут также включать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подсластители, ароматизаторы,красители, одоранты и консерванты. Суспензии, в дополнение к активному ингредиенту (ингредиентам), могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбитол и сложные эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант и их смеси. Препаративные формы для ректального или вагинального введения могут быть представлены в виде суппозитория, который может быть получен смешиванием одного или более ингибитора (ингибиторов) с одним или более подходящих не раздражающих эксципиентов или носителей, включающих, например, масло какао, полиэтиленгликоль, воск для суппозиториев или салицилат, который является твердым при комнатной температуре, но жидким при температуре тела и поэтому расплавится в прямой кишке или полости влагалища и высвободит активный агент. Препаративные формы, которые подходят для вагинального введения, также включают пессарии,тампоны, кремы, гели, пасты, пены или аэрозольные препаративные формы, содержащие такие носители,которые целесообразны, как известно в данной области. Лекарственные формы для местного или трансдермального введения ингибитора(ов) включают порошки, аэрозоли, мази, пасты, кремы, лосьоны, гели, растворы, накладки и ингаляционные средства. Активный компонент может смешиваться в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферам или газами-вытеснителями, которые могут потребоваться. Мази, пасты, кремы и гели могут содержать, в дополнение к ингибитору(ам), эксципиенты, такие как животные или растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремневая кислота, тальк и оксид цинка или их смеси. Порошки и аэрозоли могут содержать, в дополнение к ингибитору(ам), эксципиенты, такие как лактоза, тальк, кремневая кислота, гидроксид алюминия, силикаты кальция и полиамидный порошок или смеси указанных веществ. Аэрозоли могут дополнительно содержать заказные газы-вытеснители, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан. Ингибитор(ры) могут альтернативно вводиться аэрозолем. Это осуществляется получением водного аэрозоля, липосомного препарата или твердых частиц, содержащих композицию. Может использоваться неводная суспензия (например, фторуглеродного газа-вытеснителя). Предпочтительны ультразвуковые распылители, потому что они минимизируют воздействие на агент сдвига, который может привести к распаду соединения. Обычно, водный аэрозоль получают включением в состав водного раствора или суспензии агента вместе с обычными фармацевтически приемлемыми носителями и стабилизаторами. Носители и стабилизаторы могут варьироваться в зависимости от требований к конкретной композиции, но обычно включают неионные поверхностно-активные вещества (Tweens, Pluronics, сложные эфиры сорбитана, лецитин, Кремофоры), фармацевтически приемлемые сорастворители, такие как полиэтиленгликоль, безвредные белки, подобные сывороточному альбумину, олеиновую кислоту, аминокислоты, такие как глицин,буферы, соли, сахара или сахарные спирты. Аэрозоли в целом получают из изотонических растворов. Трансдермальные накладки или системы имеют дополнительное преимущество обеспечения контролируемой доставки ингибитора(ов) в организм. Такие лекарственные формы могут быть получены растворением или диспергированием агента в соответствующей среде. Могут быть также использованы усилители всасывания для увеличения тока ингибитора(ов) через кожу. Скорость такого тока может контролироваться или обеспечением регулирующей частоты мембраны, или диспергирования ингибитора(ов) в полимерной матрице или геле. Фармацевтические композиции по настоящему изобретению, подходящие для парентерального введения, содержат один или более ингибиторов в комбинации с одним или более фармацевтически приемлемых стерильных водных или неводных растворов, дисперсий, суспензий или эмульсий, или стерильные порошки, влагосодержание в которых может восстанавливаться стерильными инъекционными растворами или дисперсиями непосредственно перед применением, в которых могут содержаться антиоксиданты, буферы, бактериостатические агенты, растворенные вещества, которые делают препаративные формы изотоничными с кровью предполагаемого реципиента, или суспендирующие агенты или загустители. Примеры подходящих водных и неводных носителей, которые могут использоваться в фармацевтических композициях по изобретению, включают воду, этанол, полиолы (такие как глицерол, пропиленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилацетат. Должная текучесть может поддерживаться, например, использованием покрывающих материалов, таких как лецитин, поддержанием требуемого размера частиц в случае дисперсий и использованием поверхностно-активных веществ. Эти композиции могут также содержать адъюванты, такие как консерванты, смачивающие агенты,эмульгирующие агенты и диспергирующие агенты. Предотвращение действия микроорганизмов может быть обеспечено включением различных антибактериальных и противогрибковых агентов, например парабена, хлорбутанола, фенолсорбиновой кислоты и т.п. Может также быть желательным включение в композиции агентов, регулирующих тоничность, таких как сахара, хлорид натрия и т.п. соединений. Кроме того, продолжительное всасывание инъецируемой фармацевтической формы может быть обеспечено включением агентов, которые задерживают всасывание, таких как моностеарат алюминия и желатин. В некоторых случаях для удлинения эффекта лекарственного средства желательно обеспечение возможности всасывания лекарственного средства в результате подкожной или внутримышечной инъекции. Например, отсроченное всасывание парентерально введенной лекарственной формы осуществляется растворением или суспендированием лекарственного средства в масляном носителе. Инъецируемые депо формы получают образованием микрокапсульных матриц ингибитора(ов) в биологически разлагаемых полимерах, таких как полилактид-полигликозид. В зависимости от отношения лекарственного средства к полимеру и природы конкретного используемого полимера, можно регулировать скорость высвобождения лекарственного средства. Примеры других биологически разлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъецируемые депо препаративные формы также получают заключением лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями тела. Препараты могут вводиться перорально, парентерально, местно или ректально. Они, конечно, вводятся в формах, подходящих для каждого пути введения. Например, они вводятся в форме таблеток или в форме капсул, инъекций, ингаляций, глазного лосьона, мази, суппозитория, инфузии, местно в форме лосьона или мази; и ректально суппозиторием. Предпочтительно пероральное введение. Фразы "парентеральное введение" и "вводимые парентерально", используемые в настоящем описании, означают путь введения, отличный от энтерального и местного введения, обычно инъекцией, и включает без ограничения внутривенную, внутримышечную, внутриартериальную, внутритрахеальную,внутрикапсулярную, внутриорбитальную, внутрисердечную, интрадермальную, внутрибрюшинную,транстрахеальную, подкожную, субкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную и интрастернальную инъекцию и инфузию. Используемые в настоящем описании фразы "системное введение", "введенные системно", "периферическое введение" и "введенные периферически" означают введение лиганда, лекарственного средства или другого материала путем, отличным от непосредственного введения в центральную нервную систему, так, чтобы он поступал в систему пациента и, таким образом, подвергался метаболизму и других подобным процессам, например подкожным введением. Указанные ингибитор(ы) могут вводиться для лечения людям и другим животным любым подходящим путем введения, включая введение перорально, интраназально, например в виде аэрозоля, ректально, интравагинально, парентерально, внутрицистернально и местно, например в виде порошков, мазей или капель, включая введение буккально и сублингвально. Независимо от выбранного пути введения, ингибитор(ы), которые могут применяться в подходящей гидрированной форме, и/или фармацевтические композиции по настоящему изобретению, составляются в фармацевтически приемлемые лекарственные формы обычными способами, известными специалистам в данной области. Действительные уровни дозировки активных ингредиентов в фармацевтических композициях по настоящему изобретению могут варьироваться с тем, чтобы получить количество активного ингредиента, которое эффективно для достижения желательной терапевтической реакции у конкретного пациента,композиции и пути введения без токсичности для пациента. Концентрация описанного соединения в фармацевтически приемлемой смеси будет варьироваться в зависимости от нескольких факторов, включая подлежащую введению дозировку соединения, фармакокинетических характеристик используемого соединения(ий) и пути введения. В целом, композиции по настоящему изобретению могут быть предоставлены в водном растворе, содержащем примерно 0,1-10% мас./об. описанного в настоящем изобретении соединения, среди других веществ, для парентерального введения. Типичные диапазоны доз составляют от примерно 0,01 до примерно 50 мг/кг массы тела в день, введенные 1-4 дробными дозами. Каждая дробная доза может содержать некоторые или различные соединения по изобретению. Дозировка будет представлять собой эффективное количество, зависящее от нескольких факторов, включая общее состояние здоровья пациента, и препаративной формы и пути введения выбранного соединения(ий). Определения. Термин "Сх-y-алкил" относится к замещенным или незамещенным насыщенным углеводородным группам, включая прямоцепочечные алькильные и разветвленноцепочечные алкильные группы, которые содержат от х до у атомов углерода в цепи, включая галогеналкильные группы, такие как трифторметил и 2,2,2-трифторэтил, и т.д. С 0 алкил указывает углеводород, где группа находится в концевом положении,связь, если внутренняя. Термин "С 2-y-алкенил" и "С 2-y-алкинил" относится к замещенным или незамещенным ненасыщенным алифатическим группам, аналогичным по длине, и возможному замещению описанным выше алкилам, но которые содержат по меньшей мере соответственно одну двойную или тройную связь. Термин "алкокси" относится к алкильной группе, имеющей присоединенный к ней кислород. Репрезентативные алкоксигруппы включают метокси, этокси, пропокси, трет-бутокси и т.п. "Простой эфир" представляет собой два углеводорода, ковалентно связанные кислородом. Соответственно, заместитель алкила, который делает указанный алкил простым эфиром, представляет собой или напоминает алкокси. Термин "C1-6-алкоксиалкил" относится к С 1-6-алкильной группе, замещенной алкоксигруппой, посредством этого, образуя простой эфир. Используемый в настоящем описании термин "С 1-6-аралкил" относится к C1-6-алкильной группе, замещенной арильной группой. Термины "амин" и "амино" признаны в данной области и относятся и к незамещенным, и к замещенным аминам и их солям, например части, которая может быть представлена общими формулами где каждая из групп R9, R10 и R10' независимо представляет водород, алкил, алкенил, -(CH2)m-R8 илиR и R10, взятые вместе с атомом N, к которому они присоединены, завершают гетероцикл, имеющий от 4 до 8 атомов в кольцевой структуре; R8 представляет арил, циклоалкил, циклоалкенил, гетероциклил или полициклил; и m=0 или целому числу от 1 до 8. В предпочтительных вариантах осуществления только одна из групп R9 или R10 может представлять карбонил, например R9, R10 и азот вместе не образуют имид. В еще более предпочтительных вариантах осуществления R9 и R10 (и, возможно, R10') каждая независимо представляет водород, алкил, алкенил или -(CH2)m-R8- В определенных вариантах осуществления аминогруппа является основной, означая, что протонированная форма имеет pKa7,00. Термины "амид" и "амино" являются признанными в данной области как аминозамещенный карбонил и включает часть, которая может быть представлена общей формулой 9 где R9, R10 являются, как определено выше. Предпочтительные варианты осуществления амида не должны включать имиды, которые могут быть нестабильными. Используемый в настоящем описании термин "арил" включает 5-, 6- и 7-членные замещенные или незамещенные однокольцовые ароматические группы, в которых каждый атом кольца представляет углерод. Термин "арил" также включает полициклические кольцевые системы, имеющие два или более циклических колец, в которых два или более атома углерода являются общими для двух примыкающих колец, где по меньшей мере одно из колец является ароматическим, например другие циклические кольца могут представлять циклоалкилы, циклоалкенилы, циклоалкинилы, арилы, гетероарилы и/или гетероциклилы. Арильные группы включают бензол, нафталин, фенантрен, фенол, анилин и т.п. Используемые в настоящем описании термины "карбоцикл" и "карбоциклил" относятся к неароматическим замещенным или незамещенным кольцам, в которых каждый атом кольца представляет углерод. Термины "карбоцикл" и "карбоциклил" также включают полициклические кольцевые системы,имеющие два или более циклических кольца, в которых два или более атомов углерода являются общими для двух примыкающих колец, где по меньшей мере одно из колец является карбоциклическим, например другие циклические кольца могут представлять циклоалкилы, циклоалкенилы, циклоалкинилы,арилы, гетероарилы и/или гетероциклилы. Термин "карбонил" признан в данной области и включает такие части, которые могут быть представлены общей формулой где X представляет связь или представляет кислород или серу;R11 представляет водород, алкил, алкенил, -(CH2)m-R8 или фармацевтически приемлемую соль;R11' представляет водород, алкил, алкенил или -(CH2)m-R8, где m и R8 являются как определено выше. Когда X представляет кислород, и R11 или R11' не представляет водород, то формула представляет"карбоновую кислоту". Термин "гетероарил" включает замещенные или незамещенные ароматические от 5- до 7-членных кольцевые структуры, предпочтительнее от 5- до 6-членных кольца, чьи кольцевые структуры включают от одного до четырех гетероатомов. Термин "гетероарил" также включает полициклические кольцевые системы, имеющие два или более циклических кольца. В которых два или более атомов углерода являются общими для двух примыкающих колец, где по меньшей мере одно из колец является гетероароматическим, например другие циклические кольца могут представлять циклоалкилы, циклоалкенилы, циклоалкинилы, арилы, гетероарилы и/или гетероциклилы. Гетероарильные группы включают, например,пиррол, фуран, тиофен, имидазол, изоксазол, оксазол, тиазол, триазол, пиразол, пиридин, пиразин, пири- 15024672 дазин и пиримидин и т.п. Используемый в настоящем описании термин "гетероатом" означает атом любого элемента, кроме углерода или водорода. Предпочтительные гетероатомы представляют собой азот, кислород, фосфор и серу. Термин "гетероциклил" или "гетероциклильная группа" относятся к замещенным или незамещенным не ароматическим от 3- до 10-членным кольцевым структурам, предпочтительнее от 3- до 7-членным кольцам, чьи кольцевые структуры включают от одного до четырех гетероатомов. Термины"гетероциклил" или "гетероциклическая группа" также включают полициклические кольцевые системы,имеющие два или более колец, в которых два или более атома углерода являются общими для двух примыкающих колец, где по меньшей мере одно из колец является гетероциклическим, например другие циклические кольца могут представлять циклоалкилы, циклоалкенилы, циклоалкинилы, арилы, гетероарилы и/или гетероциклилы. Гетероциклильные группы включают, например, тетрагидрофуран, пиперидин, пиперазин, пирролидин, морфолин, лактоны, лактамы и т.п. соединения. Используемый в настоящем описании термин "C1-6-гетероциклоалкил" относится к C1-6-алкильной группе, замещенной гетероциклильной группой. Термин "C1-6-гидроксиалкил" относится к С 1-6-алкильной группе, замещенной гидроксигруппой. Используемый в настоящем описании термин "ингибитор" предназначен для описания соединения,которое блокирует или снижает активность фермента (например, ингибирование протеолитического расщепления стандартных флуорогенных пептидных субстратов, таких как suc-LLVY-AMC, Box-LLRAMC и Z-LLE-AMC, ингибирование различных видов каталитической активности протеасомы 20S). Ингибитор может действовать конкурентным или неконкурентным ингибированием. Ингибитор может связываться обратимо или необратимо, и поэтому термин включает соединения, которые являются суицидальными субстратами фермента. Ингибитор может модифицировать один или более сайтов на активном сайте фермента или около него, или он может вызвать конформационное изменение в других участках фермента. Используемый в настоящем описании термин "перорально биодоступное" предназначен для описания соединения, вводимого мыши в дозе 40 мг/кг или менее, 20 мг/кг или менее или даже 10 мг/кг или менее, где через 1 ч после перорального введения такое соединение проявляет ингибирование по меньшей мере примерно на 50%, по меньшей мере примерно на 75% или даже по меньшей мере примерно на 90% активности протеасомы CT-L в крови. Используемый в настоящем описании термин "пептид" включает не только стандартную амидную связь со стандартными -заместителями, но обычно используемые пептидомиметики, другие модифицированные связи, не встречающиеся естественно боковые цепи и модификации боковых цепей, как детально описано ниже. Термины "полициклил" или "полициклические" относятся к двум или более кольцам (например,циклоалкилам, циклоалкенилам, циклоалкинилам, арилам, гетероарилам и/или гетероциклилам), в которых два или более атомов углерода являются общими для двух примыкающих колец, например кольца представляют собой "конденсированные кольца". Каждое из колец полицикла может быть замещенным или незамещенным. Используемый в настоящем описании термин "протеасома" предназначен для включения иммуно- и конститутивных протеасом. Используемый в настоящем описании термин "по существу чистый" относится к кристаллическому полиморфу, чистота которого составляет более чем 90%, означая, что он содержит менее чем 10% любого другого соединения, включая соответствующее аморфное соединение. Предпочтительно кристаллический полиморф имеет чистоту более чем 95%, или даже чистоту более чем 98%. Термин "предотвращение" признан в данной области и при использовании в отношении состояния,такого как местный рецидив (например, боли), заболевания, такого как онкологическое заболевание,синдромокомплекса, такого как сердечная недостаточность или любое другое медицинское состояние,хорошо понятно в данной области и может включать введение композиции, которая снижает частоту или задерживает начало симптомов медицинского состояния у индивида относительно индивида, который не получает композицию. Таким образом, предотвращение онкологического заболевания включает, например, снижение числа случаев выявляемого злокачественного роста у популяции пациентов, получающих профилактическое лечение, относительно не получавшей лечение контрольной популяции, и/или задержку появления случаев выявляемого злокачественного роста у популяции пациентов, получающих лечение, в сравнении с не получавшей лечение контрольной популяцией, например на статистически и/или клинически значимое количество. Предотвращение инфекции включает, например, снижение числа диагнозов инфекции у получавшей лечение популяции, в сравнении с не получавшей лечение контрольной популяцией, и/или задержку начала симптомов инфекции у получавшей лечение популяции, в сравнении с не получавшей лечение контрольной популяцией. Предотвращение боли включает, например, снижение выраженности или задержку возникновения болевого ощущения, испытываемого индивидами, у получавшей лечение популяции, в сравнении с не получавшей лечение контрольной популяцией. Термин "пролекарство" охватывает соединения, которые в физиологических условиях превращаются в терапевтически активные средства. Обычный способ получения пролекарства состоит во включении выбранных частей, которые гидролизуются в физиологических условиях для выявления желательной молекулы. В других вариантах осуществления пролекарство превращается ферментативной активностью животного-хозяина. Термин "профилактическое или терапевтическое" лечение признан в данной области и включает введение в организм хозяина одной или более описываемых композиций. Если композиция вводится перед клиническим проявлением нежелательного состояния (например, заболевания или другого нежелательного состояния животного-хозяина), то лечение является профилактическим (т.е. оно защищает организм хозяина против развития нежелательного состояния), тогда как если она вводится после проявления нежелательного состояния, то лечение является терапевтическим (т.е. предназначено для уменьшения, облегчения или стабилизации существующего нежелательного состояния или его побочных эффектов). Используемый в настоящем описании термин "протеасома" предназначен для включения иммуно- и конститутивных протеасом. Термин "замещенные" относится к частям, имеющим заместители, замещающие водород, на одном или более атомах углерода основной цепи. Следует понимать, что "замещение" или "замещенный чемто" включает предположение условия, что такое замещение происходит в соответствии с допускаемой валентностью замещенного атома и заместителя, и что замещение приводит к получению устойчивого соединения, например которое спонтанно не подвергается трансформации, например перестройкой, циклизацией, элиминацией и т.д. Используемый в настоящем описании термин "замещенный" предусматривается для включения всех допустимых заместителей органических соединений. В широком аспекте,допустимые заместители включают ациклические и циклические, разветвленные и неразветвленные,карбоциклические и гетероциклические, ароматические и не ароматические заместители органических соединений. Допустимые заместители могут быть одиночными или множественными и одинаковыми или различными для соответствующих органических соединений. В целях настоящего изобретения гетероатомы, такие как азот, могут иметь заместители водорода и/или любые допустимые заместители описанных в настоящем изобретении органических соединений, которые соответствуют величинам валентности гетероатомов. Заместители могут включать, на пример, галоген, гидроксил, карбонил (такой как карбоксил, алкоксикарбонил, формил или ацил), тиокарбонил (такой как сложный тиоэфир), алкоксил,фосфорил, фосфат, фосфонат, фосфинат, амино, амидо, амидин, имин, циано, нитро, азидо, сульфгидрил,алкилтио, сульфат, сульфонат, сульфамоил, сульфонамидо, сульфонил, гетероциклил, аралкил или ароматическую или гетероароматическую часть. Специалисту в данной области будет понятно, что части,замещенные на углеводородной цепи, при целесообразности сами могут быть замещены."Терапевтически эффективное количество" соединения в отношении обсуждаемого способа лечения относится к количеству соединения(ий) в препарате, который при введении в качестве части желательной схемы дозировки (млекопитающему, предпочтительно человеку) облегчает симптом, облегчает состояние или замедляет начало развития патологических состояний в соответствии с клинически приемлемыми стандартами для подлежащего лечению расстройства или состояния, или с косметической целью, например, при целесообразном соотношении выгоды/риска, применяемого для любого медицинского лечения. Термин "простой тиоэфир" относится к алкильной группе, как определено выше, имеющей присоединенную к ней серную часть. В предпочтительном варианте осуществления "простой тиоэфир" представлен -S-алкилом. Репрезентативные простые тиоэфирные группы включают метилтио, этилтио и т.п. Используемый в настоящем описании термин "лечение" включает вызов обратного развития,уменьшение или прекращение симптомов, клинических признаков и лежащего в основе патологии состояния с тем, чтобы улучшить или стабилизировать состояние индивида. Синтез соединения (А). К раствору простого метилового эфира N-Boc-серина (43,8 г, 200 ммоль), триэтиламина (26,5 г,260 ммоль) и 4-(диметиламино)пиридина в дихлорметане (1,2 л) при 0 С добавляли раствор бензилхлорформиата (41 г, 240 ммоль) в дихлорметане (250 мл) в течение 30 мин. Полученную смесь перемешивали при такой же температуре в течение еще 3 ч. Добавляли насыщенный водный раствор бикарбоната натрия (200 мл), и органический слой отделяли, остаточную смесь экстрагировали дихлорметаном (2400 мл). Комбинированные органические слои промывали насыщенным водным бикарбонатом натрия (200 мл) и рассолом (200 мл), сушили над сульфатом натрия и фильтровали через Целит-545. Растворители удаляли при пониженном давлении, и остаток очищали флэш-хроматографией (силикагель, гексан и этилацетат). Соединение (А) (54 г) выделяли и характеризовали LC/MS (жидкостной хроматографией/масс спектрометрией) (LRMS(МН) m/z: 310,16). Синтез соединения (В). К раствору соединения (А) (54 г) в дихлорметане (200 мл) при 0 С добавляли трифторуксусную кислоту (200 мл) в течение 10 мин, и полученную смесь перемешивали при такой же температуре еще в течение 3 ч. Растворители удаляли при пониженном давлении, и остаток помещали в высокий вакуум на ночь, получая соль TFA (трифторуксусной кислоты) соединения (В), которое характеризовали LC/MS(LRMS (MH) m/z: 210,11). Синтез соединения (С). К раствору соединения (В) (43,8 г, 200 ммоль), простого метилового эфира N-Boc-серина (36,7 г,167 ммоль), НОВТ (гидроксибензотриазола) (27 г, 200 ммоль) и HBTU (1 Н-бензотриазолия) (71,4 г,200 ммоль) в тетрагидрофуране (1,2 л) при 0 С добавляли раствор N,N-диэтилизопропиламин (75 г,600 ммоль) в тетрагидрофуране (250 мл) в течение 10 мин, и рН полученной смеси составил 8. Смесь перемешивали при комнатной температуре еще в течение 5 ч. Большую часть растворителя удаляли при пониженном давлении при комнатной температуре и разбавляли насыщенным водным раствором бикарбоната натрия (400 мл). Затем его экстрагировали этилацетатом (3400 мл), промывали бикарбонатом натрия (100 мл) и рассолом (100 мл). Объединенные органические слои сушили над сульфатом натрия и фильтровали через Целит-545. Растворители удаляли при пониженном давлении. И остаток очищали флэш-хроматографией (силикагель, гексан и этилацетат). Соединение (С) (65 г) выделяли и характеризовали LC/MS (LRMS (MH) m/z: 411,21). Синтез соединения (D). К раствору соединения (С) (18 г) в дихлорметане (100 мл) при 0 С добавляли трифторуксусную кислоту (80 мл) в течение 5 мин, и полученную смесь перемешивали при той же температуре в течение еще 3 ч. Растворители удаляли при пониженном давлении, и остаток помещали в высокий вакуум на ночь,получая соль TFA промежуточного соединения (D), которое характеризовали LC/MS (LRMS (MH) m/z: 311,15). Синтез соединения (Е). К раствору этил 2-метилтиазол-5-карбоксилата (15 г, 88 ммоль) в тетрагидрофуране (50 мл) при 0 С добавляли водный раствор гидроксида натрия (5N, 50 мл) в течение 10 мин, и полученный раствор перемешивали при комнатной температуре в течение еще 2 ч. Его затем подкисляли хлористоводородной кислотой (2N) до рН 1 и экстрагировали тетрагидрофураном (3x100 мл). Объединенные органические слои промывали рассолом (30 мл) и сушили над сульфатом натрия. Большую часть растворителей удаляли при пониженном давлении и остаток лиофилизировали для получения соединения (Е) (14 г). Синтез соединения (F). К раствору соединения (D) (41 ммоль) и 2-метил-тиазол-5-карбоновой кислоты (Е) (6,0 г, 42 ммоль),НОВТ (7,9 г, 50 ммоль) и HBTU (18,0 г, 50 ммоль) в тетрагидрофуране (800 мл) при 0 С добавляли раствор N,N-диэтилизопропиламина (50 г) в тетрагидрофуране (200 мл) в течение 5 мин до тех пор, пока его рН не достигнет уровня приблизительно 8,5. Полученную смесь перемешивали при такой же температуре в течение ночи. Затем ее гасили насыщенным водным раствором бикарбоната натрия (200 мл), и большую часть растворителей удаляли при пониженном давлении. Остаточную смесь экстрагировали этилацетатом (3400 мл). Объединенные органические слои промывали насыщенным водным раствором бикарбоната натрия (200 мл) и рассолом (100 мл), сушили над сульфатом натрия и фильтровали через Целит-545. Растворители удаляли при пониженном давлении,и остаток очищали флэш-хроматографией (силикагель, этилацетат с 2% метанолом). Соединение (F)(17,1 г) выделяли и характеризовали LC/MS (LRMS (МН) m/z: 436,15). Синтез соединения (G). К раствору соединения (F) (17,1 г, 95 ммоль) в метаноле (300 мл) добавляли 10% Pd/C (3 г). Полученной смеси давали возможность перемешиваться при давлении 1 атмосферы водорода в течение 48 ч. Смесь фильтровали через Целит 545, и фильтровальную лепешку промывали метанолом (200 мл). Органические слои концентрировали при пониженном давлении, и остаток помещали в высокий вакуум для получения соединения (G), которое характеризовали LC/MS (LRMS (МН) m/z: 346,1). Синтез соединения (Н).N-Boc фенилаланинкетоэпоксид (140 мг, 0,46 ммоль) разбавляли DCM (дихлорметаном) (2 мл) и охлаждали до 0 С. К данному раствору добавляли трифторуксусную кислоту (6 мл). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 1 ч, и в это время TLC (тонкослойная хроматография) показала полное расходование исходного материала. Полученный раствор концентрировали при пониженном давлении и помещали в высокий вакуум для получения соли TFA соединения (Н). Синтез соединения I. К раствору указанного выше соединения (Н) (131 мг, 0,38 ммоль) и (J) (0,46 ммоль), НОВТ (75 мг,0,48 ммоль) и HBTU (171 мг, 0,48 ммоль) в тетрагидрофуране (20 мл) и N,N-диметилформамиде (10 мл) при 0 С по каплям добавляли N,N-диэтилизопропиламин (1 мл). Смесь перемешивали при такой же температуре еще в течение 5 ч. Затем ее гасили насыщенным водным раствором бикарбоната натрия (20 мл),и большую часть растворителей удаляли при пониженном давлении. Затем остаточную смесь экстрагировали этилацетатом (340 мл). Объединенные органические слои промывали насыщенным водным раствором бикарбоната натрия (20 мл) и рассолом (10 мл), сушили над сульфатом натрия и фильтровали через Целит-545. Растворители удаляли при пониженном давлении, и остаток очищали HPLC (ВЭЖХ)(0,02 М водный ацетат аммония и ацетонитрил (66/34) для получения соединения 1 (92 мг), которое лиофилизировали и характеризовали LC/MS (LRMS (MH) m/z: 533,2). Пример 2. Аморфное соединение 1 (50 мг) растворяли в ацетонитриле (1 мл), затем добавляли деионизированную воду (2 мл), и раствор доводили до сверхнасыщения медленным выпариванием 1 мл в течение примерно 1-2 недель. Полученные кристаллы фильтровали, промывали 1 мл раствора ацетонитрил-вода в соотношении 1:2 и сушили в вакууме в течение 12 ч для получения кристаллического полиморфа соединения 1 (25 мг) с точкой плавления 148 С. Характерная кривая DSC образца, зарегистрированная дифференциальным сканирующим калориметром ТА Instruments Differential Scanning Calorimeter 2920 при скорости нагревания 10 С/мин, показана на фиг. 1. Пример 3. Аморфное соединение 1 (611 мг) растворяли в тетрагидрофуране (5 мл) с последующим добавлением гексанов (5 мл), и в раствор вносили затравку кристаллического полиморфа соединения 1, полученного в примере 2, и раствор доводили до сверхнасыщения медленным выпариванием 5 мл в течение примерно 17 ч. Полученные кристаллы фильтровали, промывали 1 мл тетрагидрофурана-гексанов в соотно- 19024672 шении 1:1 и сушили в вакууме в течение 12 ч для получения кристаллического полиморфа соединения 1(25 мл). В раствор вносили затравку кристаллического полиморфа соединения 1, полученного в примере 2, и раствор доводили до сверхнасыщения медленным выпариванием 20 мл в течение примерно 2 дней. Полученные кристаллы фильтровали, промывали 15 мл толуола и сушили в вакууме в течение 12 ч для получения кристаллического полиморфа соединения 1 (88 мг) с точкой плавления 149 С. Пример 5. Аморфное соединение 1 (312 мг) растворяли в толуоле (50 мл), нагретом до примерно 100 С для завершения растворения, затем добавляли гексаны (50 мл), и в раствор вносили затравку кристаллического полиморфа соединения I, полученного в примере 2, и раствор доводили до сверхнасыщения медленным выпариванием 60 мл в течение примерно 2 дней. Полученные кристаллы фильтровали, промывали 10 мл толуола и сушили в вакууме в течение 12 ч для получения кристаллического полиморфа соединения 1(156 мг) с точкой плавления 149 С. Пример 6. Аморфное соединение 1 (1,4 г) растворяли в толуоле (25 мл), нагретом до 50 С для завершения растворения, затем раствор доводили до сверхнасыщения охлаждением до 22 С и предоставлением соединению возможности кристаллизоваться в течение 12 ч. Полученные кристаллы фильтровали, промывали 5 мл гексанов и сушили в вакууме в течение 12 ч для получения кристаллического полиморфа соединения 1 (0,94 г) с точкой плавления 149 С. Пример 7. Синтез соединения 1. Синтез соединения (Н).N-Boc фенилаланинкетоэпоксид (1,0 экв.) растворяли в DCM (3 л/кг N-Boc фенилаланинкетоэпоксида) в 3-горловой колбе с круглым дном в инертной атмосфере, и раствор охлаждали на ледяной бане. Затем добавляли TFA (5,0 экв.) со скоростью для поддержания внутренней температуры ниже 10 С. Затем реакционную смесь согревали приблизительно до 20 С и перемешивали в течение 1-3 ч. Затем к реакционной смеси добавляли МТВЕ (простой метил-трет-бутиловый эфир) (3,6 л/кг N-Вос фенилаланинкетоэпоксида) при поддержании температуры смеси ниже 25 С. Затем добавляли гептан (26,4 л/кг N-Boc фенилаланинкетоэпоксида), реакционную смесь охлаждали до температуры от -5 до 0 С в течение 2-3 ч для обеспечения возможности кристаллизации соединения (Н). Белое твердое вещество фильтровали и промывали гептаном (3 л/кг N-Boc фенилаланинкетоэпоксида). Белое твердое вещество затем сушили в вакууме в течение 12 ч при 22 С. Полученный выход составил 86%, при ВЭЖХ чистоте 99,4%. Синтез соединения 1. Соединение (Н) (1,2 экв.), соединение (G) (1,0 экв.), HBTU (1,2 экв.), НОВТ (1,2 экв.) и Nметилпирролидинон (8 л/кг соединения (G добавляли в сухую колбу при инертной температуре, и смесь перемешивали при 23 С для завершения растворения. Затем реакционную смесь охлаждали до температуры от -5 до 0 С, и диизопропилэтиламин (2,1 экв.) добавляли в течение 15 мин, в то же время,поддерживая внутреннюю температуру менее чем 0 С. Реакционную смесь перемешивали при 0 С в течение 12 ч. Неочищенное соединение 1 осаждали выливанием реакционной смеси на 8% бикарбонат натрия(40 л/кг соединения (G и суспензию неочищенного соединения 1 перемешивали в течение 12 ч при 20-25 С, с последующим перемешиванием при 0-5 С в течение 1 ч. Белое твердое вещество фильтровали и промывали водой (5 л/кг соединения (G. Затем белое твердое вещество ресуспендировали в воде(15 л/кг) в течение 3 ч при 20-25 С, фильтровали и промывали водой (5 л/кг соединения (G и изопропилацетатом (22 л/кг соединения (G. Белое твердое вещество сушили в вакууме при 45 С до постоянной массы. Выход неочищенного соединения 1 составил 65%, при ВЭЖХ чистоте 97,2%. Неочищенное соединение 1 полностью растворяли в изопропилацетате (20 л/кг неочищенного соединения 1) перемешиванием и нагреванием при 85 С. Затем раствор в горячем состоянии фильтровали для удаления любого материала в виде частиц, и раствор вновь нагревали до 85 С с получением прозрачного раствора. Прозрачному раствору давали возможность охладиться со скоростью 10 С в час до 20 С, когда происходила существенная кристаллизация соединения 1. Суспензию перемешивали при 20 С в течение 6 ч с последующим перемешиванием при 0-5 С в течение минимум 2 ч и фильтрацией и промыванием изопропил ацетатом (1 л/кг неочищенного соединения 1). Очищенное соединение 1 сушили в вакууме при 45 С в течение минимум 24 ч до постоянной массы. Выход соединения 1 составил 87%,при ВЭЖХ чистоте 97,2%. Пример 8. Синтез соединения 1. Соединение (Н) (1,1 экв.), соединение (G) (1,0 экв.), HBTU (1,5 экв.), НОВТ (1,5 экв.) и DMF (8 л/кг соединения (G добавляли в сухую колбу в инертной атмосфере, и смесь перемешивали при 23 С для завершения растворения. Затем реакционную смесь охлаждали до температуры от -5 до 0 С, и добавляли диизопропилэтиламин (2,1 экв.) в течение 15 мин, в то же время, поддерживая внутреннюю реакционную температуру менее чем 0 С. Затем реакционную смесь перемешивали при 0 С в течение 3 ч. Реакционную смесь гасили добавлением предварительно охлажденным насыщенным раствором бикарбоната натрия (94 л/кг соединения (G, в то же время, поддерживая внутреннюю температуру на уровне менее 10 С. Содержимое затем переносили в делительную воронку. Смесь экстрагировали этилацетатом (24 л/кг соединения (G, и органический слой промывали насыщенным раствором бикарбоната натрия (12 л/кг соединения (G и насыщенным раствором хлорида натрия (12 л/кг соединения (G). Органический слой концентрировали при пониженном давлении при температуре бани менее чем 30 С до 15 л/кг соединения (G), с последующей совместной перегонкой с изопропил ацетатом (224 л/кгPR-022). Конечный объем доводили до 82 л/кг соединения (G) изопропилацетатом перед нагреванием до 60 С с получением прозрачного раствора. Смеси прозрачного раствора давали возможность охладиться до 50 С перед добавлением кристаллов затравки. Раствору давали возможность охладиться до 20 С, когда происходила существенная кристаллизация соединения 1. Суспензию перемешивали при 0 С в течение 12 ч перед фильтрацией и промыванием изопропил ацетатом (2 л/кг соединения 1). Соединение 1 сушили в вакууме при 20 С в течение 12 ч до постоянной массы. Выход соединения 1 составил 48%, при ВЭЖХ чистоте 97,4%. Эквиваленты. Специалистам в данной области будет понятно или они смогут определить не более чем обычным экспериментированием многочисленные эквиваленты соединений и способы их применения, описанные в настоящей заявке. Считается, что такие эквиваленты находятся в пределах объема настоящего изобретения и охватываются следующей формулой изобретения. Все приведенные выше ссылки и публикации включены в настоящее описание путем ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения рака у пациента, включающий введение терапевтически эффективного количества кристаллической формы соединения формулы (II) характеризующейся рентгеновской дифрактограммой с величинами 2 8,94; 9,39; 9,76; 10,60; 11,09; 12,74; 15,27; 17,74; 18,96; 20,58; 20,88; 21,58; 21,78; 22,25; 22,80; 24,25; 24,66; 26,04; 26,44; 28,32; 28,96; 29,65; 30,22; 30,46; 30,78; 32,17; 33,65; 34,49; 35,08; 35,33; 37,85; 38,48. 2. Способ по п.1, где рак выбран из группы, состоящей из гематологических онкологических заболеваний, макроглобулинемии Вальденстрема, множественной миеломы, диффузной В-клеточной лимфомы, мантийно-клеточной лимфомы, рака поджелудочной железы и рака легких. 3. Способ по п.2, где раком является множественная миелома. 4. Способ лечения аутоиммунного заболевания у пациента, включающий введение терапевтически эффективного количества кристаллической формы соединения формулы (II) характеризующейся рентгеновской дифрактограммой с величинами 2 8,94; 9,39; 9,76; 10,60; 11,09; 12,74; 15,27; 17,74; 18,96; 20,58; 20,88; 21,58; 21,78; 22,25; 22,80; 24,25; 24,66; 26,04; 26,44; 28,32; 28,96; 29,65; 30,22; 30,46; 30,78; 32,17; 33,65; 34,49; 35,08; 35,33; 37,85; 38,48. 5. Способ по п.4, где аутоиммунное заболевание выбирают из группы, состоящей из красной волчанки, ревматоидного артрита и презентации антигена.
МПК / Метки
МПК: A61P 37/06, A61P 31/00, A61P 37/00, A61P 29/00, A61K 31/426, A61P 37/08, A61P 19/10, A61P 35/00, A61P 25/28, A61P 9/10
Метки: ингибиторы, эпоксикетон-протеазы, кристаллические, трипептидные
Код ссылки
<a href="https://eas.patents.su/25-24672-kristallicheskie-tripeptidnye-ingibitory-epoksiketon-proteazy.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллические трипептидные ингибиторы эпоксикетон-протеазы</a>
Предыдущий патент: Многозарядная пусковая установка
Следующий патент: Узел уплотнения шарового запорного элемента
Случайный патент: Способ воспроизведения шумов мяча в процессе спортивного мероприятия и мяч для осуществления способа