Фукоидансодержащие пищевые продукты, в частности, вызывающие апоптоз
Номер патента: 2021
Опубликовано: 24.12.2001
Авторы: Умеда Есихиса, Кихара Хироси, Като Икуносин, Икаи Катсусиге
Формула / Реферат
1. Фукоидансодержащий пищевой продукт, из которого частично или полностью извлечены альгины, полученный из фукоидансодержащего вещества посредством экстрагирования указанного фукоидансодержащего вещества в присутствии соли кальция.
2. Пищевой продукт по п.1, в котором солью кальция является хлорид кальция.
3. Фукоидансодержащий пищевой продукт, из которого частично или полностью извлечены альгины, полученный из фукоидан-содержащего вещества посредством экстрагирования указанного фукоидансодержащего вещества щелочным раствором с последующим добавлением к экстракту соли кальция.
4. Пищевой продукт по п.3, в котором щелочным раствором является раствор карбоната натрия.
5. Пищевой продукт по п.3, в котором солью кальция является хлорид кальция.
6. Фукоидансодержащий пищевой продукт, из которого частично или полностью извлечены альгины, полученный из фукоидан-содержащего вещества посредством экстрагирования указанного фукоидансодержащего вещества щелочным раствором с последующим подкислением экстракта.
7. Пищевой продукт по п.6, в котором щелочным раствором является раствор карбоната натрия.
8. Пищевой продукт по любому из пп.1-7, содержащий фукоидан, полученный из морских водорослей.
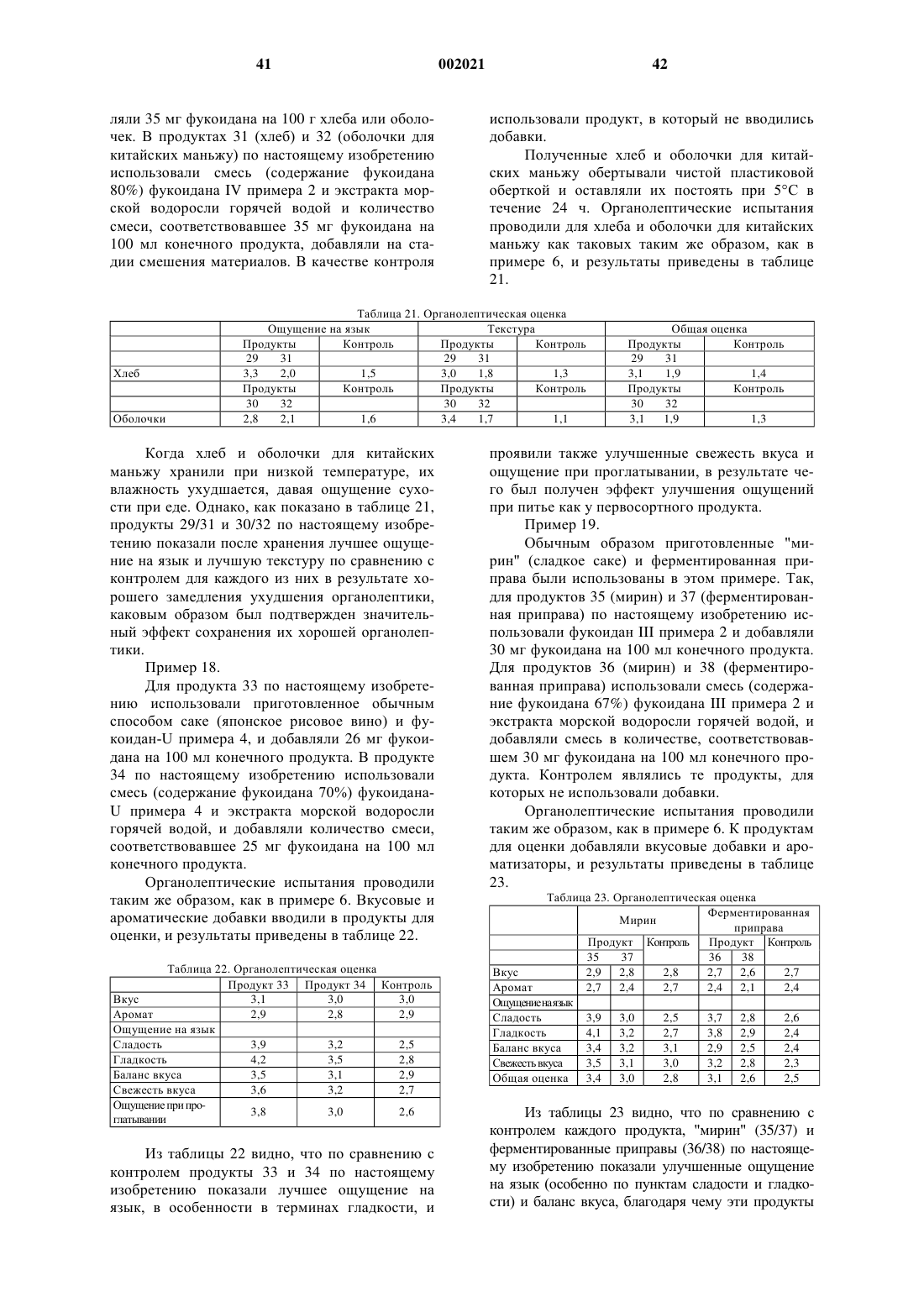
9. Пищевой продукт по п.8, в котором фукоидан является фукоиданом-U и/или фукоиданом F, имеющим следующие физические и химические свойства:
физические и химические свойства фукоидана-U:
1) компонентный сахар содержит уроновую кислоту, и
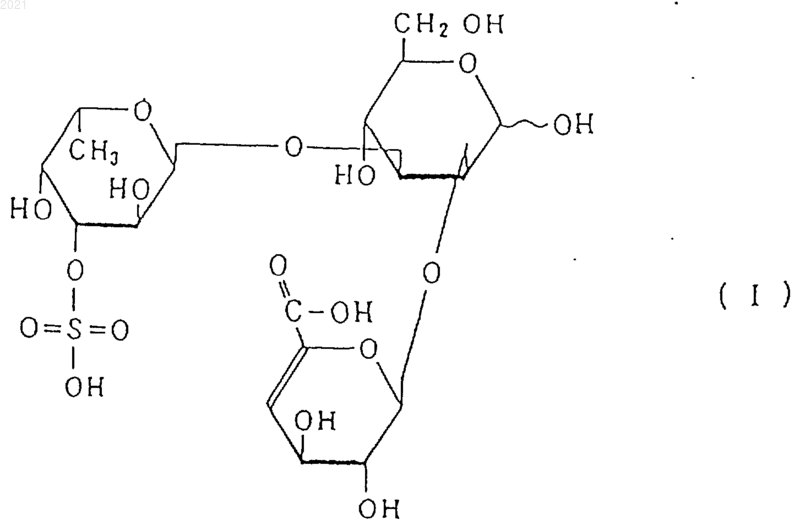
2) молекулярный вес снижается под действием эндофукоиданлиазы, продуцированной Flavobacterium sp. SA-0082 (FERM BP-5402), обспечивая один или более продуктов, выбранных из соединений, представленных, по меньшей мере, следующими формулами (I), (II) и (III):
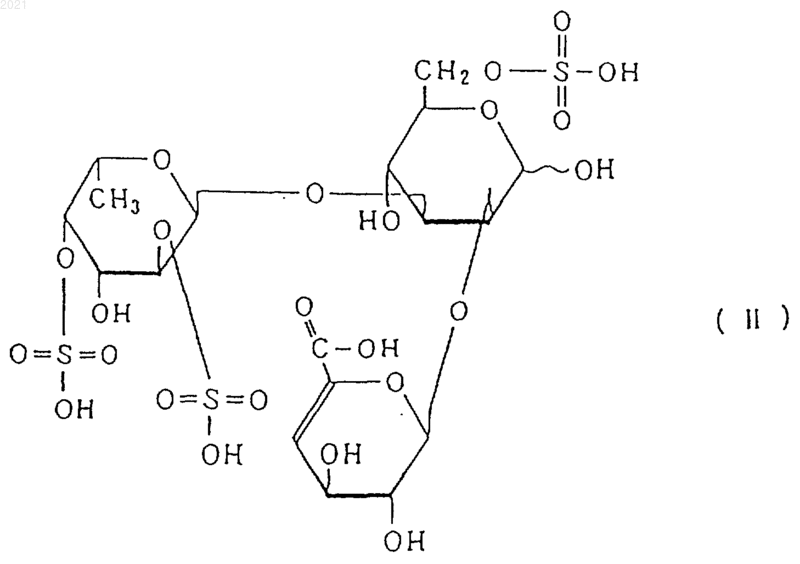
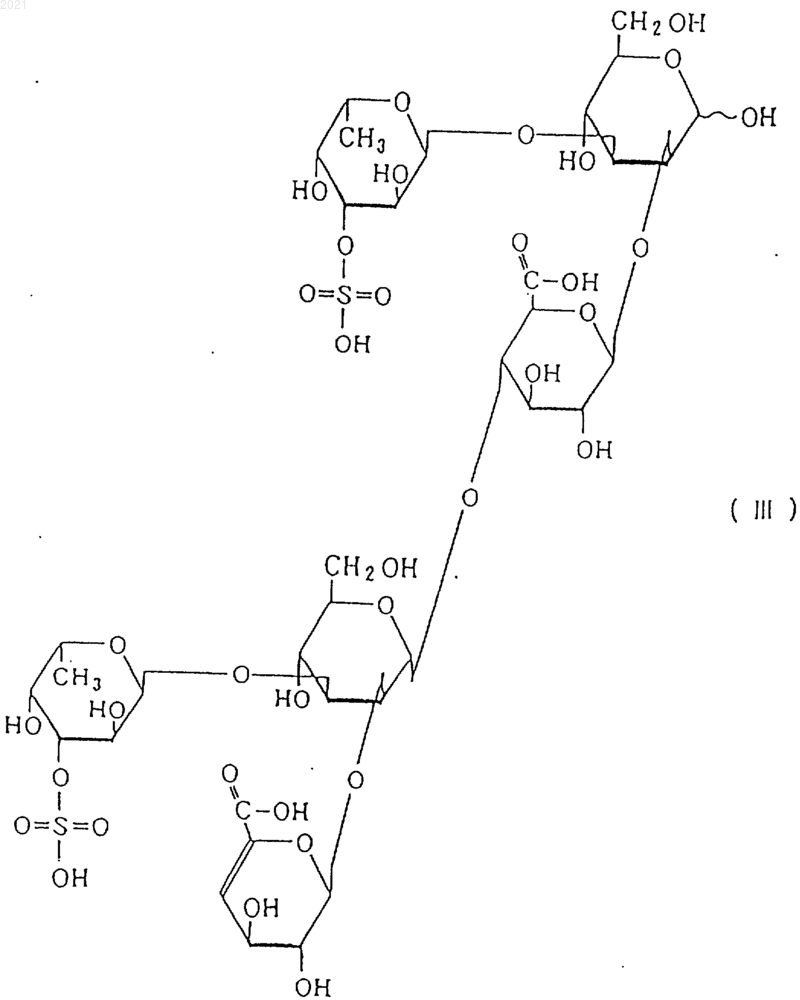
физические и химические свойства фукоидана-F:
1) компонентный сахар по существу не содержит уроновой кислоты, и
2) молекулярный вес по существу не снижается под действием эндофукоиданлиазы, продуцированной Flavobacterium sp. SA-0082 (FERM BP-5402).
10. Пищевой продукт по любому из пп.1-9, представляющий собой напиток.
11. Пищевой продукт по любому из пп.1-10, в котором фукоидан является расщепленным фукоиданом.
12. Пищевой продукт по любому из пп.1-11, в котором количество фукоидана, рассчитанного как фукоза, составляет 0,001 вес./вес.% или более.
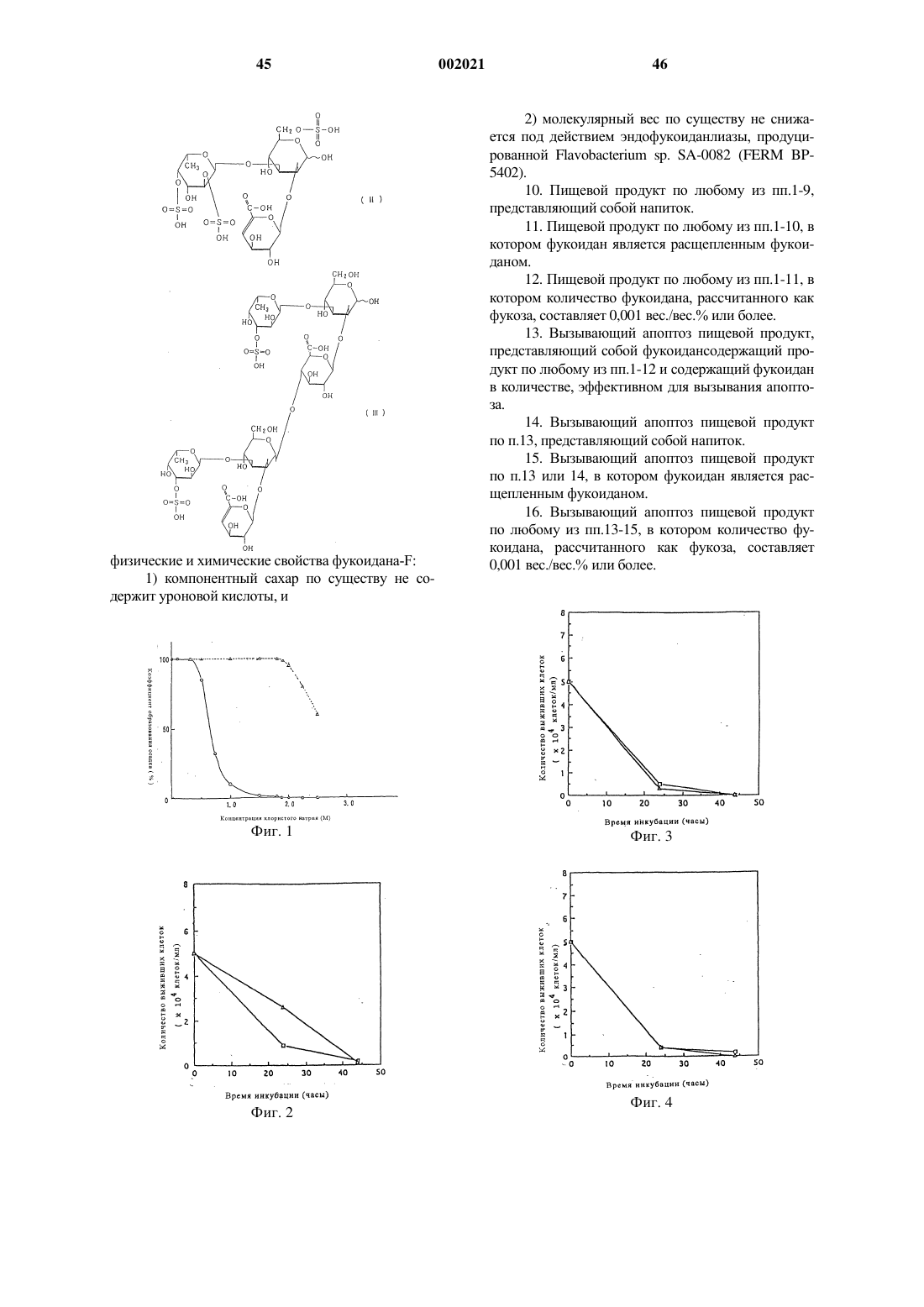
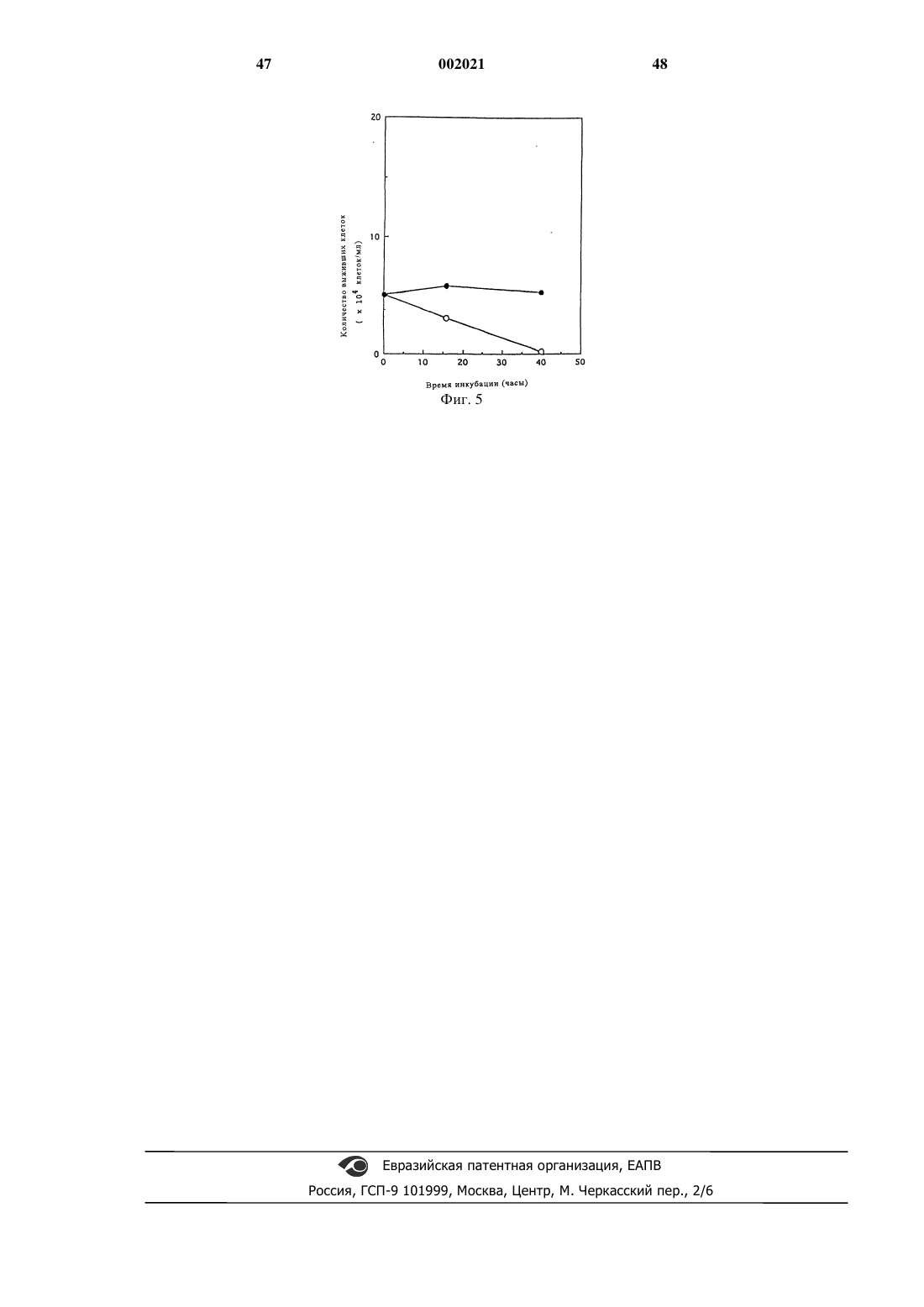
13. Вызывающий апоптоз пищевой продукт, представляющий собой фукоидансодержащий продукт по любому из пп.1-12 и содержащий фукоидан в количестве, эффективном для вызывания апоптоза.
14. Вызывающий апоптоз пищевой продукт по п.13, представляющий собой напиток.
15. Вызывающий апоптоз пищевой продукт по п.13 или 14, в котором фукоидан является расщепленным фукоиданом.
16. Вызывающий апоптоз пищевой продукт по любому из пп.13-15, в котором количество фукоидана, рассчитанного как фукоза, составляет 0,001 вес./вес.% или более.
Текст
1 Настоящее изобретение относится к фукоидансодержащим пищевым продуктам, и в частности, к подобным пищевым продуктам,вызывающим апоптоз. Фукоидан представляет собой полисахарид, содержащий сульфатированную фукозу. Этот полисахарид имеется в морских водорослях, трепангах и т.п. До настоящего времени не были известны попытки уделить внимание фукоидану и его полезному применению в пищевых продуктах и напитках. Задача настоящего изобретения состоит в том, чтобы предложить фукоидансодержащие материалы и содержащие их пищевые продукты и напитки, обладающие физиологической активностью, полезные для здоровья и имеющие превосходный вкус. Существо настоящего изобретения кратко изложено ниже. Так, первый объект настоящего изобретения относится к пищевому продукту или напитку, содержащему фукоидан, полученный из фукоидансодержащих веществ. Другой объект изобретения относится к пищевому продукту или напитку, содержащему фукоидан, причем альгины, происходящие от фукоидансодержащих веществ, имеют пониженное содержание или они удалены. Третий объект настоящего изобретения относится к индуцирующему апоптоз ("apoptosis") пищевому продукту или напитку, содержащему фукоидан, полученный из фукоидансодержащих веществ, в количестве, эффективном для индуцирования апоптоза. Четвертый объект касается индуцирующего апоптоз пищевого продукта или напитка, содержащего фукоидан в количестве, эффективном для индуцирования апоптоза, в котором альгины, происходящие от фукоидансодержащих веществ, имеют пониженное содержание или они удалены. Термин "альгины", используемый в настоящем описании, относится к альгиновой кислоте, ее солям и эфирам, а также их модифицированным продуктам. На сопровождающих иллюстрациях фиг. 1 показывает скорости образования осадка для фукоида-на-U и фукоидана-F; фиг. 2 показывает индуцирующее апоптоз действие экстракта (0,2 мг/мл), полученного из морских водорослей; фиг. 3 показывает индуцирующее апоптоз действие экстракта (0,5 мг/мл), полученного из морских водорослей; фиг. 4 показывает индуцирующее апоптоз действие экстракта (1 мг/мл), полученного из морских водорослей; фиг. 5 показывает индуцирующее апоптоз действие фукоидана-U и фукоидана-F. Настоящее изобретение более подробно пояснено ниже. 2 Фукоидан может быть получен из морских водорослей, трепангов, и т.п., и по настоящему изобретению может быть использован полученный таким образом фукоидан. Использование морских водорослей и трепангов, содержащих большие количества фукоидана, является по изобретению наиболее предпочтительным. Примерами фукоидана по изобретению являются фукоидан в очищенном виде и/или фукоидансодержащие вещества. Примерами фукоидансодержащих веществ являются фукоидансодержащие экстракты. Фукоидансодержащие экстракты включают экстракт из неочищенного материала, полученного из фукоидансодержащих веществ, и продукт, полученный обработкой указанного экстракта, причем предпочтителен экстракт с высоким содержанием фукоидана. Примерами указанного фукоидансодержащего экстракта, такого как экстракт морских водорослей, являются экстракты, полученные экстрагированием морских водорослей в присутствии соли кальция. В качестве соли кальция может быть использован, например, хлористый кальций. Примерами указанного экстракта морских водорослей являются растворимые вещества,которые получены экстрагированием морских водорослей щелочным раствором с последующим добавлением соли кальция к экстракту. В качестве щелочного раствора может быть использован, например, раствор карбоната натрия,тогда как, например, хлористый кальций может быть использован в качестве соли кальция. Примерами указанных экстрактов морских водорослей являются растворимые вещества,которые получены экстрагированием морских водорослей щелочным раствором с последующим подкислением полученного экстракта. В качестве щелочного раствора может быть использован, например, раствор карбоната натрия. Температура и время экстракции сырьевых материалов из фукоидинсодержащих веществ могут находиться в интервале 40-200 С и 1-360 мин, соответственно, и обычно их выбирают в интервале 50-130 С и 10-180 мин, соответственно. Примером фукоидана, используемого по настоящему изобретению, является вещество, в котором содержание фукоидана больше, чем в водном экстракте материала, полученного из фукоидансодержащего вещества, и в котором содержание альгинов существенно снижено или они удалены. В качестве такого вещества можно предложить материал, не имеющий таких свойств, как высокая вязкость и кислотная коагуляция, обуславливаемых альгинами, и гелеобразование, вызываемое ионами многовалентных металлов, которые отрицательно влияют на качество пищевых продуктов и напитков и не оказывают влияния на физические свойства,присущие пищевым продуктам и напиткам. 3 В особенности для продукта, полученного обработкой экстракта морских водорослей активированным углем, селективно удаляется только запах морских водорослей, и указанный продукт наиболее предпочтителен для использования в пищепродуктах и напитках, у которых запах морских водорослей нежелателен. Фукоидан, используемый по настоящему изобретению, может быть получен в больших количествах из съедобных фукоидансодержащих веществ, таких как съедобные морские водоросли и трепанги, и в высшей степени безопасен. Нет особых ограничений для пищевых продуктов и напитков по настоящему изобретению, и таковыми могут быть, например, продукты переработки злаковых [такие как продукты, изготовленные из пшеничной муки, из крахмала, обработанных premix продукты, лапша, макароны, хлеб, бобовые джемы, "соба"(японская гречишная лапша), "фу" (японский пшеничный клейкий хлеб), "биифун" (китайские бобовые желейные палочки), "харусаме" (японские бобовые желейные палочки) и упакованные "мочи" (рисовые кексы)], продукты переработки жиров и масел [такие как жиры и масла в пластиковых упаковках, фритюрные масла, салатные масла, майонезы и заправки], продукты переработки соевых бобов [такие как "тофу"(соевый творог), "мисо" (ферментированная соевая паста) и "натто" (ферментированные соевые бобы)], продукты переработки мяса [такие как ветчина, бекон, прессованная ветчина и колбасы], морепродукты [такие как мороженое рыбное филе, "камабоко" (вареная рыбная паста), "чикува" (другой тип вареной рыбной пасты), "ханпен" (рыбные кексы), "сацума-аге"(жареные во фритюре рыбные шарики), "цумире"' (вареная рыбная паста), "сужи" (продукты из рыбьих мышц), рыбная ветчина, рыбные колбасы, сушеный бонито, продукты переработки рыбьей икры, консервированные морепродукты и "цукудани" (рыба, отваренная в соевом соусе)], молочные продукты [такие как сырое молоко, сливки, йогурт, масло, сыр, сгущенное молоко, порошковое молоко и мороженое], продукты обработки овощей и фруктов [такие как пасты, джемы, маринады, фруктовые напитки,овощные напитки и смешанные напитки], кондитерские изделия [такие как шоколад, бисквиты, булочки, кексы, "мочи-гаши" (рисовые круглые кексы) и рисовые крекеры], алкогольные напитки [такие как японские саке, китайские вина, виски, "сочу" (японские дистиллированные спирты), водка, бренди, джин, ром, пиво, алкогольные напитки для закуски, фруктовые вина и ликеры], столовые напитки [такие как зеленый чай, чай, черный китайский чай,кофе, освежающие напитки и напитки с молочной кислотой], приправы [такие как соевый соус, вустерский соус, уксус и "мирин" (сладкое саке)], баночные, бутылочные или пакетирован 002021 4 ные пищевые продукты ["гиумеши" (тушеное мясо с рисом), "камамеши" (отварной рис, помещенный в небольшие горшочкообразные контейнеры), "секихан" (рис, отваренный с красными бобами), приправленный ккэри рис и другие пищевые продукты быстрого приготовления],полусухие или концентрированные пищевые продукты [такие как печеночная паста и другие пасты, супы для "соба" или "удон" и концентрированные супы], сухие пищевые продукты [такие как лапша быстрого приготовления, кэрри"roux" быстрого приготовления, растворимый кофе, сухие соки, сухие супы, суп "мисо" быстрого приготовления и пищевые продукты быстрого приготовления, напитки и супы], замороженные пищевые продукты [такие как замороженные "сукиаки", "чаванмуши" (приготовленное в горшочке рагу), "унаги-кабаяки" (жареные угри), гамбургер-стейк, "шао-маи" (китайские паровые клецки), "гийоза" (жареные во фритюре клецки, фаршированные измельченной свининой, и т.д.), желе и фруктовые смеси], твердые пищевые продукты, жидкие пищевые продукты[такие как супы], специи и другие обработанные сельскохозяйственные, лесные, дикорастущие и морские продукты. Нет особых ограничений для приготовления пищевых продуктов и напитков по настоящему изобретению, но любые способы кулинарной обработки и приготовления и любые технологические методы, которые обычно применяются, могут быть использованы для обеспечения того, чтобы полученный в результате пищевой продукт или напиток содержал фукоидан. Когда эффективное количество индуцирующего апоптоз фукоидана добавлено в пищевой продукт или напиток, можно получить индуцирующий апоптоз пищевой продукт или напиток. В случае кулинарной обработки и приготовления, фукоидан может быть добавлен до, во время или после кулинарной обработки и приготовления. По другому варианту приготовленное блюдо или изготовленный продукт могут быть добавлены к фукоидану, так, чтобы фукоидан оказался разбавленным. При приготовлении пищевых продуктов или напитков фукоидан может быть добавлен на любой стадии, или пищевой продукт, или напиток, или продукт этих стадий может быть добавлен к фукоидану так, чтобы фукоидан оказался разбавленным и содержал пищевой продукт или напиток. Добавление может проводиться за один раз или по частям в несколько приемов. Таким образом возможно легко приготовить новый пищевой продукт или напиток или индуцирующий апоптоз пищевой продукт или напиток, имеющие индуцирующее апоптоз действие, содержащее эффективное количество фукоидана. В случае,когда используют вышеупомянутые стадии,тогда пищепродукт или напиток, в которых содержится фукоидан, добавленный к ним и/или разбавленный ими, и индуцирующий апоптоз пищепродукт или напиток, где содержится фукоидан, добавленный к ним и/или разбавленный ими, содержащие эффективное количество фукоидана, могут быть определены как пищевые продукты или напитки по настоящему изобретению. Количество фукоидана, которое должно быть добавлено в пищевой продукт, было затем исследовано при использовании модельного напитка, как описано ниже. Исследовательский пример 1. Для проведения модельных испытаний напитка готовили буфер 0,01 М молочной кислоты с рН 3,8 и затем в нем растворяли имеющийся в продаже сахар так, чтобы получить концентрацию сахарозы 5 вес/об.% после приготовления раствора. Использовали фукоидан II примера 1,и 0 (контроль), 0.1, 0.5, 1, 5, 10, 20, 30, 40, 50,100, 150 и 200 мг вес/об. % его добавляли, в результате чего получали растворы сахарозы, содержащие фукоидан, и их подвергали органолептическому испытанию для оценки, при питье, их сладости и мягкости, ощущения при проглатывании и на сбалансированность вкуса. Использовали 20 испытателей и испытание проводили с использованием пятибалльного метода оценки (где 5 ставится за хороший показатель и 1 - за плохой). Результаты приведены в таблице 1 в виде средних значений. 6 Таблица 1. Органолептическое испытание модельного напитка Ощущение Сбаланси- Общая Количество Ощущение при прогла- рованность оценка добавленного на языке вкуса фукоидана Сладость Мягкость тывании Из таблицы 1 видно, что с точки зрения ощущения на языке, ощущения при проглатывании и баланса вкуса при органолептической оценке заметен эффект добавления фукоидана,т.е. при его концентрациях 0,1 мг вес/об.% или более. Исследовательский пример 2. К модельному напитку примера 1, содержащему 30 мг вес/об.% фукоидана II, добавляли альгиновую кислоту, полученную из морских водорослей в количестве 0 (контроль), 5, 10, 20,30, 40, 60, 80, 100, 150 или 200 мг вес/об.% и оценивали влияние соотношения присутствующих в смеси фукоидана к альгиновой кислоте на ощущение при съедании посредством такого же органолептического испытания, как в исследовательском примере 1. Средние значения результатов приведены в таблице 2. Таблица 2. Влияние фукоидана и альгиновой кислоты на органолептические оценки Фукоидановое Ощущение при СбалансироАльгиновая Фукоидан Ощущение на языке число проглатывании ванность вкуса кислота мг вес/об.% Сладость Мягкость 0 30 100 4,5 4,7 4,3 4,5 5 4,5 4,5 4,5 4,4 3,9 3,2 3,1 3,1 немного остается на языке 3,0 немного остается на языке 2,6 немного остается на языке Из таблицы 2 видно, что общая оценка была наивысшей у модельного напитка, когда к нему добавляли только фукоидан, а когда отношение веса фукоидана к весу альгиновой кислоты и фукоидана (обозначенное здесь и ниже как фукоидановое число) становилось меньше, то оценка ухудшалась. По данным органолептиче ской оценки эффект, достигаемый при добавлении 10 мг вес/об.% фукоидана был замечен, когда фукоидановое число составляло 43% или более. Эффект, достигаемый при добавлении 5 мг вес/об.% фукоидана, был замечен, когда фукоидановое число было 13% или более, тогда как случаи, где не было отмечено остаточное 7 ощущение на языке, были достигнуты, когда число было 27% или более. Нет никакого особого ограничения для количества фукоидана в пищевых продуктах или напитках по изобретению, но количество может быть соответствующим образом выбрано при рассмотрении органолептической и физиологической активности. Например, его количество, рассчитанное по фукозе, на 100 частей пищевого продукта или напитка по цистеинсернокислотному методу составляет 0,001 частей или более, и с точки зрения органолептичности пищи или вкуса напитка, с точки зрения индуцирования апоптоза, и также с точки зрения цены, указанное количество предпочтительно составляет 0,005-10 частей, или, более предпочтительно, 0,01-1,0 часть. В данном случае, термин "часть" ("части"), использованный в этом описании, означает часть/части по весу. Нет никакого особого ограничения на форму пищевых продуктов или напитков по настоящему изобретению, если только они содержат фукоидан по настоящему изобретению,и указанная форма включает ту, которая может быть принята перорально в виде таблеток, гранул, капсул, геля и золя. Пищевой продукт или напиток по изобретению содержит эффективное количество физиологически активного фукоидана, и благодаря его индуцирующему апоптоз или подобному действию, продукт по изобретению является полезным для здоровья или функциональным пищевым продуктом или напитком, проявляющим эффект предотвращения или подавления рака. Он представляет собой пищевой продукт или напиток, который особенно полезен для поддержания желудка и кишечника в здоровом состоянии. В настоящем изобретении фукоидан представляет собой полисахарид, содержащий в молекуле сульфат фукозы и/или продукт ее разложения, и здесь нет особого ограничения. В данном случае фукозосодержащий полисахарид,полученный из бурых водорослей, обычно называют фукоиданом, фукоидином или фуканом,и, хотя уже известны несколько его молекулярных разновидностей, фукоидан по настоящему изобретению включает любую и все из них. Примерами модифицирования фукоидана являются способы химической модификации путем обработки его кислотой и т.п., физической модификации путем обработки его ультразвуковыми волнами и т.п., ферментативной модификации, и способ модифицирования его микроорганизмами. По настоящему изобретению может быть использован любой модифицированный фукоидан, содержащий в молекуле сульфатированную фукозу и индуцирующий апоптоз. В указанных молекулярных разновидностях фукоидана имеется группа, где фукоза является основным компонентом, и другая группа, 002021 8 где содержится несколько процентов урониевой кислоты, и в которых содержится большое количество фукозы и маннозы в качестве составляющих сахаридов. Здесь и далее группа, в которой урониевая кислота не содержится в существенных количествах, будет называться фукоидан-F, тогда как другая, в которой содержится урониевая кислота, будет называться фукоидан-U, и их смесь будет называться фукоиданом. По настоящему изобретению и фукоидан-F и фукоидан-U могут использоваться по отдельности, или оба могут использоваться совместно. Таким образом, пищевые продукты или напитки, в которых основным компонентом является фукоидан-F или фукоидан-U, также охватываются настоящим изобретением. Такие пищевые продукты или напитки с повышенным содержанием указанных фукоиданов, в особенности фукоидана-U, обладают сильным укрепляющим здоровье действием. Экстракт, полученный из фукоидансодержащих натуральных продуктов в соответствии с изобретением, содержит фукоидан-U, который получен, например, способом по примеру 4, и имеет следующие физические и химические свойства:(1) составляющий сахар содержит урониевую кислоту; иBP-5402),чтобы в результате образовать, по меньшей мере, одно из соединений, выбранных из тех, которые представлены нижеследующими формулами (I), (II) и (III). Экстракт, полученный из фукоидансодержащих натуральных продуктов в соответствии с изобретением, содержит фукоидан-F, который получен, например, способом по примеру 5, и имеет следующие физические и химические свойства:(1) составляющий сахар является по существу свободен от урониевой кислоты; и(2) и по существу не модифицирован эндофукоиданлиазой, продуцируемой Flavobackterium sp. SA-0082 (FERM BP-5402). Если фукоидан обработан модифицирующим его микроорганизмом, таким как вышеупомянутой производящей эндофукоиданлиазуFlavobacterium sp. SA-0082 (FERM BP-5402),может быть получен микробиологически модифицированный фукоидан. Далее, когда вышеупомянутый фукоиданU обработан эндофукоиданлиазой, такой как продуцируется Flavobacterium sp. SA-0082(FERM BP-5402), может быть получен ферментативно модифицированный фукоидан-U. Эти модифицированные фукоидан и/или фукоиданU легко фракционировать по их молекулярным весам. Пищевые продукты или напитки, которые содержат эти модифицированные фукоиданы, добавленные к ним и/или разбавленные ими, также являются пищевыми продуктами и напитками по изобретению. При производстве экстракта, полученного из морских водорослей, который является одним из примеров фукоидана, содержащегося в пищевых продуктах и напитках по изобретению, пригодными морскими водорослями являются, например, Rhodophyceae, такие как обычная красная водоросль (Porphyra tenera), Gelidium cartilagimeum и Gracilaria confervoides; Chlorophyceae, такие как Ulva lactuca; и Phaeophyceae, такие как Ecklonia cava, Eisenia arboria var.Laminaria japonica, и среди них морские водоросли с высоким содержанием фукоидана являются особо подходящими для настоящего изобретения. 10 Что касается морских водорослей, используемых по изобретению, то морская водоросль,которая содержит большое количество фукоидана, такая как Phaeophyceae, может быть, например, непосредственно высушена, размолота и экстрагирована, или свежая водоросль может быть мелко нарезана и высушена. Может быть применен любой способ экстрагирования, обеспечивающий эффективное извлечение фукоидана. Способ приготовления экстракта морской водоросли может включать в себя стадию промывки водоросли водой, спиртом или водным спиртом. Экстракция водоросли также может проводиться в присутствии спирта. По настоящему изобретению морскую водоросль экстрагируют, например, раствором соли кальция, такой как хлористый кальций,чтобы получить экстракт морской водоросли в растворе хлористого кальция. Предпочтительно осуществлять экстракцию при использовании 10-1000 частей раствора хлористого кальция на одну часть сухой водоросли, так, чтобы концентрация хлористого кальция была 25 мМ или более. Если используют свежую водоросль, то предпочтительно использовать 1-100 частей раствора хлористого кальция на одну часть свежей водоросли при концентрации хлористого кальция 25 мМ или более. Предпочтительно проводить экстракцию при 50-130 С в течение 10-180 мин. Вообще пригодны любые условия экстракции, обеспечивающие эффективное извлечение фукоидана,если содержание альгинов в экстракте понижено. После завершения экстракции водоросли раствором соли кальция нерастворимые вещества удаляют. Способ удаления нерастворимых веществ может быть выбран из центрифугирования, фильтрации и т.п. Соль кальция может быть удалена из раствора, из которого удалены нерастворимые вещества, например, ультрафильтрацией или способами ионообмена. Раствор, из которого удалена соль кальция, может быть далее обработан активированным углем,ионообменником, и т.п. так, чтобы селективно устранить запах морской водоросли. По настоящему изобретению морскую водоросль, например, экстрагируют щелочным раствором, таким как раствор карбоната натрия,чтобы получить экстракт морской водоросли в карбонате натрия. Затем к указанному экстракту добавляют соль кальция, такую как хлористый кальций, и образующиеся в результате нерастворимые вещества удаляют, в результате чего могут быть получены растворимые фракции полученного из морской водоросли экстракта. Предпочтительно, чтобы экстракция проводилась при использовании 10-160 частей раствора карбоната натрия на одну часть водорос 11 ли, и чтобы концентрация карбоната натрия составляла 0,1-5%. Когда используют свежую водоросль,предпочтительно использовать 1-60 частей раствора карбоната натрия на одну часть свежей водоросли при концентрации карбоната натрия 0,1-5%. Предпочтительно, чтобы экстракция проводилась при 50-130 С в течение 10-180 мин. Могут быть приняты любые условия экстракции, которые обеспечивают эффективное извлечение фукоидана в экстракт. В данном случае,термин "%", использованный в этом описании,относится к весовым процентам. После завершения экстрагирования водоросли раствором карбоната натрия к экстракту добавляют соль кальция, такую как хлористый кальций, и выделившиеся нерастворимые компоненты удаляют. Количество добавляемого хлористого кальция находится в таких пределах,чтобы альгины больше не выпадали в осадок при добавлении его к натрийкарбонатному экстракту, и любые условия будут подходящими,если только альгины могут быть эффективно осаждены из экстракта. Способ удаления образующихся в результате нерастворимых компонентов может быть выбран из центрифугирования, фильтрации и т.п. Соли, такие как карбонат натрия и хлористый кальций из раствора, из которого удалены нерастворимые компоненты,могут быть удалены, например, способами ультрафильтрации или ионообмена. Раствор, из которого удалены соли, может быть затем обработан активированным углем, ионообменником,и т.п. так, чтобы селективно устранить запах морской водоросли. По настоящему изобретению морскую водоросль, например, экстрагируют щелочным раствором, таким как раствор карбоната натрия с получением экстракта морской водоросли в карбонате натрия. После этого экстракт подкисляют кислотой, такой как разбавленная серная кислота, и образующиеся нерастворимые компоненты удаляют, в результате чего получают растворимое вещество полученного из морской водоросли экстракта. Экстракцию морской водоросли раствором карбоната натрия проводят способом, упомянутым выше. После завершения экстрагирования водоросли раствором карбоната натрия к экстракту добавляют раствор кислоты, такой как разбавленная серная кислота, и образующиеся в результате нерастворимые компоненты удаляют. Количество добавляемой разбавленной серной кислоты находится в таких пределах, чтобы рН экстракта карбонатом натрия достиг значения 12,5, и любые условия будут подходящими, если только подкислен экстракт, посредством чего альгины могут быть эффективно осаждены из экстракта. Способ удаления образующихся в результате нерастворимых компонентов может 12 быть выбран из центрифугирования, фильтрации и т.п. Соли могут быть удалены из раствора,из которого удалены нерастворимые компоненты, например, способами ультрафильтрации или ионообмена. Раствор, из которого удалены соли,может быть, если необходимо, нейтрализован, и после чего кислый или нейтрализованный раствор может быть затем обработан активированным углем, ионообменником, и т.п. так, чтобы селективно устранить запах морской водоросли. Фукоидан по изобретению может быть или жидким, или твердым. Для получения твердого фукоидана может быть выбран подходящий из известных способов, таких как распылительная сушка или сушка вымораживанием. Обычно фукоидан мало устойчив к кислотам и щелочам и потому деградирует на низкомолекулярные вещества при использовании кислых или щелочных растворов. Если правильно подобрать температуру нагревания, рН и т.п., легко получить желаемый модифицированный деградацией продукт. Можно регулировать средний молекулярный вес и распределение молекулярных весов посредством, например,гель-фильтрации, обработки на мембране для фракционирования по молекулярному весу, и т.д. Молекулярный вес и содержание сахарного компонента в фукоидане варьируют в зависимости от времени сбора материала для получения фукоидана, способа сушки указанного материала, способа хранения указанного материала, и т.д., и также зависит от условий нагрева, рН и т.д. во время процесса экстракции фукоидана. Например, фукоидан гидролизуется кислотой, в то время как в щелочных условиях он превращается в низкомолекулярные продукты в результате бета-отщепления урониевой кислоты. Соответственно, по отношению к фукоидану-U и фукоидану-F, упомянутым в этом описании,молекулярный вес и распределение молекулярного веса, приведенные здесь, являются просто примерами и могут быть легко изменены регулированием условий процесса получения фукоидана. Например, когда фукоидан нагревают при 100 С в течение одного часа в слабо щелочных условиях, и когда для удаления соли используют мембрану из молекулярного сита,имеющего размер пор 300, возможно получить фукоидан, фукоидан-U, фукоидан-F и т.д.,имеющий распределение молекулярного веса от примерно 1.000 до примерно 10.000. В зависимости от использованных условий может быть получен фукоидан, имеющий любой молекулярный вес и любое распределение молекулярного веса, и такой продукт может быть использован в качестве фукоидана по изобретению. Когда фукоидан и/или продукт его деградации в соответствии с настоящим изобретением добавляют к жидкой культуре раковых клеток, спустя один или несколько дней после добавления наступает апоптоз указанных раковых клеток. В данном случае они не проявляют ток 13 сичности по отношению к нормальным клеткам. В особенности, фукоидан, полученный из съедобных морских водорослей и/или продукт его разложения в высокой степени безопасны. Настоящее изобретение будет далее пояснено на нижеследующих примерах, хотя настоящее изобретение не ограничивается этими примерами. Пример 1.(1) Kjellmaniella crassifolia хорошо высушивали и 20 кг сухой водоросли размалывали с помощью свободного дезинтегратора (Nara Kikai Seisakusho). Дигидрат хлористого кальция (7,3 кг)Kjellmaniella crassifolia. Через смесь продували пар, в результате чего температура жидкости поднималась с 12 до 90 С в течение 40 мин, затем температуру поддерживали на уровне 9095 С в течение одного часа при перемешивании и охлаждали, получая 1100 л охлажденной смеси. Эту смесь подвергали обработке на сепараторе твердое-жидкость (тип CNA, WestfalierSeparator), чтобы разделить смесь на твердую и жидкую фазы, после чего получили около 900 л надосадочной жидкости. Надосадочную жидкость (360 л) концентрировали до 20 л, используя FE10-FC-FUS0382(Daicel) (молекулярный вес включительно 30.000). К концентрату добавляли 20 л водопроводной воды, после чего смесь концентрировали до 20 л, и эту операцию повторяли пять раз,чтобы удалить из смеси соль, в результате чего приготовили 25 л экстрактного раствора, полученного из морской водоросли с высоким содержанием фукоидана. Экстрактный раствор имел рН около 6,5,кислотность 0,06 мл, степень сахаристости 0,8% по Brix и концентрацию кальция 1.200 ppm. Указанный раствор (один литр) сушили вымораживанием, получая 13 г сухого продукта,в котором содержалось 65% фукоидана и 33% фукоидана-U. Содержание фукоидана-U измеряли посредством ЖХВР, используя стандартное вещество фукоидан-U, который был получен в примере 4. В данном случае содержание фукоидана рассчитывали по нижеследующему сернокислотно-цистеиновому методу, используя водный раствор стандартного фукоидана (0,4 мг/мл),полученного в примере 5. Испытуемый раствор (200 мкл) набирали в пробирку, к нему при охлаждении льдом добавляли 900 мкл смеси 6:1 концентрированной серной кислоты и воды, и полученную смесь хорошо охлаждали и перемешивали. Ее выдерживали при примерно 20 С в течение трех минут и нагревали в бане с кипящей водой в течение десяти минут. После нагревания ее охлаждали в(неокрашенная часть). После перемешивания смеси давали постоять в течение одного часа и определяли поглощения при 400 и 460 нм. Содержание фукоидана в испытуемом растворе рассчитывали по следующей формуле: Содержание (мг/мл) = Испытуемый раствор(А 400-А 460)-Неокрашенная часть (А 400-А 460)] х число разведения х 20,4 В формуле А 400 представляет поглощение при 400 нм, тогда как А 460 представляет поглощение при 460 нм. В данном случае рН измеряли с помощью рН-метра, тогда как кислотность выражали через количество (мл) 0,1N NaOH, требующееся для нейтрализации 10 мл пробы раствора до рН 7,0. Степень сахаристости измеряли сахарометром Brix, тогда как концентрацию кальция измеряли посредством спектрометрии атомного поглощения. Затем к раствору экстракта из морской водоросли с высоким содержанием фукоидана,добавляли 2% активированного угля (выпускаемого в качестве пищевой добавки ShirasagiBrand), и смесь обрабатывали в течение 30 мин,грубо фильтровали и окончательно фильтровали, используя фильтр 0,8 мкм, чтобы получить фильтрат (фукоидан I), проходящий через фильтр. Затем одну половину фильтрата нагревали при 120 С в течение 60 мин под давлением, чтобы получить термически обработанную жидкость (фукоидан II). Фильтрат, прошедший через фильтр, сушили вымораживанием и 10 мг высушенного продукта суспендировали в каждом из 10 мл 1% раствора карбоната натрия и 100 мкл раствора хлористого кальция. В обоих растворах высушенный продукт полностью растворялся и загрязнения альгинами не были отмечены.(2) Kjellmaniella crassifolia хорошо сушили и 20 кг сухой водоросли размалывали с помощью дезинтегратора (Fitz Mill; Hosokawa Micron). Дигидрат хлористого кальция (7,2 кг)(Nippon Soda) растворяли в 400 л водопроводной воды, после чего смешивали с 20 кг размолотой Kjellmaniella crassifolia. Через смесь при перемешивании в течение 95 мин продували пар, в результате чего температура жидкости поднималась с 28 до 95 С, и смесь поддерживали при температуре 95 С в течение двух часов при перемешивании и охлаждали, получая 500 л охлажденного продукта. Охлажденный продукт подвергали сепарации на твердую и жидкую фазы, используя твердо-жидкостный сепаратор (Tanabe Weltech), 15 получая около 450 л надосадочной жидкости после сепарирования. Указанную жидкость концентрировали до 40 л, используя FE10-FC-FUS0382 (молекулярный вес включительно 30.000 (Daicel). После этого к концентрату непрерывно добавляли стерилизованную фильтрацией воду при скорости потока 40-60 л/ч, проводя таким образом обессоливание до тех пор, пока электропроводность не достигала значения 1,0 мС/см 2, в результате чего готовили 40 л экстрактного раствора, полученного из морской водоросли с высоким содержанием фукоидана. Затем к указанному раствору экстракта добавляли 0,4 кг Celite 545 (изготовленного Celite) и 0,4 кг Silica 600-S (Chuo Silica) в качестве вспомогательных фильтровальных веществ, и смесь фильтровали, используя пресс-фильтр (16 ступеней х 15 см; фильтровальная бумага: ADVANTEC 327) с предварительным нанесением 0,1 кг Celite 545 и 0,1 кг Silica 600-S. Полученный в результате фильтрат подвергали непрерывной сильной тепловой обработке, используя тарельчатый нагреватель (Nichihan Seisakusho), при 98 С в течение 60 с и охлаждали, получая 46 л экстрактного раствора(фукоидан IV), полученного из морской водоросли с высоким содержанием фукоидана. Указанный экстрактный раствор имел рН около 7, кислотность 0 мл, степень сахаристости 1,2% по Brix и концентрацию кальция 920 ppm,содержание твердого вещества 1,2% и содержание фукоидана 17 мг/мл. Ни альгиновая кислота, ни йод не были обнаружены. Содержание альгиновой кислоты определяли методом ЖХВР, используя доступную в продаже альгиновую кислоту в качестве стандартного вещества. Содержание фукоидана рассчитывали по сернокислотному-цистеиновому методу, используя в качестве стандартного раствора водный раствор (0,4 мг/мл) стандартного фукоидана, полученного в примере 5. Электропроводность измеряли электрокондуктометром. Йод выделяли бромом и титровали тиосульфатом натрия. Содержание твердого вещества определяли по сухому весу после обработки в центрифужном сепараторе (при 60 С в течение 18 ч).(3) Kjellmaniella crassifolia хорошо высушивали и 20 кг сухой водоросли размалывали с помощью дезинтегратора (Fitz Mill; HosokawaMicron). Дигидрат хлористого кальция (NipponSoda) (7,3 кг) растворяли в 400 л водопроводной воды, после чего смешивали с 20 кг размолотойKjellmaniella crassifolia. Через смесь при перемешивании в течение 95 мин продували пар, в результате чего температура жидкости поднималась с 28 до 95 С, и смесь поддерживали при температуре 95 С в течение двух часов при пе 002021 16 ремешивании и охлаждали, получая 500 л охлажденного продукта. Охлажденный продукт подвергали твердожидкостной сепарации, используя соответствующий сепаратор (Tanabe Weltech), получая около 450 л надосадочной жидкости после сепарирования. Указанную жидкость концентрировали до 40 л, используя FE10-FC-FUS0382 (молекулярный вес включительно 30.000 (Daicel). После этого к концентрату непрерывно добавляли стерилизованную фильтрацией воду при скорости потока 30 л/ч, проводя таким образом обессоливание до тех пор, пока электропроводность не достигала значения 1,0 мС/см 2, в результате чего готовили 34 л экстрактного раствора, полученного из морской водоросли с высоким содержанием фукоидана. После этого 1,1 кг пектина (Pomocin PectinLM-13CG; Hercules) добавляли к 20 л водопроводной воды, пар продували через смесь так,что температура поднималась с 28 до 120 С в течение пяти часов при перемешивании и охлаждали, получая 28 л охлажденного продукта. Затем 34 л экстрактного раствора, полученного из морской водоросли с высоким содержанием фукоидана, смешивали с 28 л термообработанного пектина, и смесь доводили до рН 3,5 ангидридом лимонной кислоты (Fuso Kagaku). После этого добавляли 0,9 кг Celite545(Chuo Silica) в качестве вспомогательных фильтровальных веществ, и смесь фильтровали,используя пресс-фильтр (16 ступеней х 15 см; фильтровальная бумага: ADVANTEC 327) с предварительным нанесением 0,2 кг Celite 545 и 0,2 кг Silica 600-S. К полученному фильтрату добавляли 18 л чистой воды и полученную смесь подвергали непрерывной сильной тепловой обработке, используя тарельчатый нагреватель (Nichihan Seisakusho), при 98 С в течение 60 с и охлаждали,получая 80 л экстрактного раствора (фукоиданVI), полученного из морской водоросли с высоким содержанием фукоидана. Указанный экстрактный раствор имел рН около 3,5, кислотность 1,7 мл, степень сахаристости 2,1% по Brix и концентрацию кальция 710 ppm, содержание твердого вещества 2,0%,содержание фукоидана 13 мг/мл и содержание фукоидана-U 6,6 мг/мл. Ни альгиновая кислота,ни йод не были обнаружены. Один литр указанного раствора сублимировали (вымораживанием), получая 20 г высушенного продукта. Пример 2. Свежую Laminaria japonica мелко нарезали,200 г полученной мелко нарезанной водоросли суспендировали в 600 мл 1% водного раствора карбоната натрия, суспензию нагревали при 60 С в течение одного часа и добавляли к ней воду, доводя общий объем до одного литра. 17 Этот раствор центрифугировали, супернатантную жидкость собирали и добавляли к ней воду,доводя общий объем до четырех литров. К этому раствору добавляли 500 мМ хлористого кальция до тех пор, пока не прекращалось выпадение осадка, и образовавшийся осадок выделяли на фильтровальной бумаге. Полученный фильтрат концентрировали и обессоливали с помощью устройства Microacilyzer, получая 3,6 л обессоленного продукта. Половину продукта подвергали сублимированию, получая 2,1 г сухой фракции экстракта (фукоидан III) из водоросли с высоким содержанием фукоидана. Другую половину обессоленного раствора обрабатывали 2% активированного угля с последующим нагреванием под давлением при 120 С в течение 60 мин, получая термически обработанный раствор (фукоидан IV). Вышеописанный сублимированный продукт (10 мг) суспендировали в 10 мл 1% раствора карбоната натрия и в 100 мМ раствора хлористого кальция. В обоих растворах указанная фракция полностью растворилась и загрязнения альгинами не были обнаружены. Пример 3. Индуцирующая апоптоз активность экстрактов, полученных из морских водорослей с высоким содержанием фукоидана, приготовленных в примерах 1 и 2. Клетки промиелоцитной лейкемии человека HL-60 (ATCC CCl-240), инкубированные при 37 С в среде RPMI 1640 (Gibco), содержащей 10% околоплодной телячьей сыворотки (JRHBioscience), обработанной при 56 С в течение 30 мин, суспендировали в среде ASF 104 (Ajinomoto), чтобы получить суспензию, содержащую 5 х 105 клеток/9 мл. К 9,0 мл этой суспензии добавляли 1 мл каждого из растворов экстрактов(фукоиданы I и III), полученных из морских водорослей с высоким содержанием фукоидана по примерам 1 и 2 [приготовленных путем растворения каждого из фукоиданов в 50 мМ буфереHEPES (рН 7,2), содержащем 100 мМ хлористого натрия, до концентрации 5 мг/мл с последующей стерилизацией при 121 С в течение 20 мин], и каждую смесь инкубировали при 37 С в течение 18 ч в присутствии 5% двуокиси углерода. Инкубированные клетки центрифугировали для отделения от надосадочной жидкости. Полученные клетки суспендировали в 20 мкл 50 мМ Трис-гидрохлоридного буфера (рН: 7,8),содержащего 10 мМ этилендиаминтетраацетата и 0,5% лаурилсаркозината натрия, затем добавляли к суспензии 1 мкл рибонуклеазы А (10 мг/мл) (Sigma) с последующей обработкой при 50 С в течение 30 мин и 1 мкл протеиназы К(10 мг/мл) с последующей обработкой при 50 С в течение одного часа. Клетки после обработки использовали в качестве пробы и подвергали электрофорезу с использованием 2% агарового геля при постоянном напряжении 100 вольт. Гель погружали в этидийбромид на 30 мин, и затем проверяли состояние ДНК в геле, исполь 002021 18 зуя трансиллюминатор (просвечиватель), устанавливая лэддер (полосы нуклеотидов), характерный для апоптоза. Из этих результатов стало ясно, что у клеток HL-60 апоптоз индуцируется экстрактами,полученными из морских водорослей с высоким содержанием фукоидана, приготовленными по примерам 1 и 2. Далее, каждый из указанных экстрактов(фукоидан II и фукоидан IV), полученных из морских водорослей с высоким содержанием фукоидана, приготовленных по примерам 1 и 2,растворяли в физиологическом солевом растворе, чтобы получить раствор 5 мг/мл, с последующей стерилизацией при 121 С в течение 20 мин и полученный раствор использовали как испытуемый раствор для измерения индуцирующей апоптоз активности по вышеупомянутому методу, в результате чего такой же эффект был подтвержден для каждого из испытуемых растворов. После этого клетки промиелоцитной лейкемии человека HL-60 (АТСС ССl-240), инкубированные при 37 С в среде RPMI 1640(Gibco), содержащей 10% околоплодной телячьей сыворотки (JRH Bioscience), обработанной при 56 С в течение 30 мин, суспендировали в среде ASF 104 (Ajinomoto), чтобы получить суспензию, содержащую 2,5 х 105 клеток/4,5 мл. К 4,5 мл этой суспензии добавляли 0,5 мл каждого из растворов экстрактов (фукоиданы I иIII), полученных из морских водорослей с высоким содержанием фукоидана в примерах 1 и 2[приготовленных путем растворения каждого из фукоиданов в 50 мМ буфере HEPES (рН 7,2),содержащем 100 мМ хлористого натрия, чтобы получить концентрации 2 мг/мл, 5 мг/мл и 10 мг/мл, с последующей стерилизацией при 121 С в течение 20 мин], и каждую смесь инкубировали при 37 С в присутствии 5% двуокиси углерода. Спустя 24 и 44 ч от начала инкубации отбирали в качестве пробы по 0,5 мл культуральной жидкости и подсчитывали число выживших клеток в среде по методу, описанному "Techniques in Tissue Culture", 2-ое издание (публикация Asakura Shuppan; ред. Japan Tissue CultureSociety, 1 ноября 1990, стр. 26-28). Так, подсчет проводили после окрашивания клеток краской Трипан синий на гемоцитометре. Результаты показаны на фиг. 2-4. Фиг. 2 показывает пролиферацию клеток в присутствии 0,2 мг/мл каждого фукоидана, где ордината показывает количество выживших клеток на мл культуральной жидкости (х 104/мл; это будет применимо также к последующим описаниям), а абсцисса показывает длительность инкубации(часы). Фиг. 3 показывает пролиферацию клеток в присутствии 0,5 мг/мл каждого фукоидана, где ордината показывает число выживших клеток на мл культуральной жидкости, а абсцисса показывает длительность инкубации (часы). Фиг. 4 показывает пролиферацию клеток в присутст 19 вии 1 мг/мл каждого фукоидана, где ордината показывает количество выживших клеток на мл культуральной жидкости, а абсцисса показывает длительность инкубации (часы). На каждой из фиг. 2-4 треугольник обозначает количество выживших клеток для каждого периода инкубации в присутствии экстракта (фукоидан I), полученного из морской водоросли с высоким содержанием фукоидана по примеру 1, тогда как квадрат обозначает количество выживших клеток для каждого периода инкубации в присутствии экстракта (фукоидан III), полученного из морской водоросли с высоким содержанием фукоидана по примеру 2. В данном случае в контроле, где проба не добавлялась, количество выживших клеток в культуральной жидкости составляло 1,5 х 105/мл и 3,1 х 105/мл после инкубации в течение 24 и 44 ч, соответственно. Как показано на фиг. 2-4, экстракт, полученный из морских водорослей с высоким содержанием фукоидана, способен убивать клеткиHL-60 путем апоптоза в течение двух суток, при условии, что его концентрация в среде составляет, по меньшей мере, 200 мкг/мл. Далее, каждый из указанных экстрактов(фукоидан II, фукоидан IV, фукоидан V и фукоидан VI), полученных из морских водорослей с высоким содержанием фукоидана в примерах 1 и 2, растворяли в физиологическом солевом растворе, чтобы получить растворы 2-10 мг/мл,с последующей стерилизацией при 121 С в течение 20 мин, и полученные растворы использовали как испытуемые растворы для измерения индуцирующей апоптоз активности в соответствии с вышеописанной методикой, в результате чего такой же эффект был подтвержден для каждого из испытуемых растворов. Пример 4. Получение фукоидана-U. Водоросль Kjellmaniella crassifolia хорошо высушивали, 2 кг высушенной водоросли размалывали на свободном дезинтеграторе (NaraKikai Seisakusho), полученный сухой порошок суспендировали в девяти литрах 80% этанола, и суспензию нагревали при 80 С в течение двух часов. После этого суспензию фильтровали через фильтровальную бумагу, получая осадок. Осадок подвергали вышеупомянутым операциям промывки этанолом и последующей фильтрации и указанные операции повторяли три раза, в результате чего получили промытый этанолом осадок. Его суспендировали в 36 л 0,2 М раствора ацетата кальция, нагревали при 95 С в течение двух часов и фильтровали. Остаток промывали четырьмя литрами 0,2 М раствора ацетата кальция, получая 36 л фукоиданового экстракта из Kjellmaniella crassifolia. Вышеупомянутый экстракт концентрировали до двух литров на ультрафильтраторе, оборудованном ультрафильтрующей мембраной,имеющей молекулярный вес исключения 100.000, к нему добавляли соль, чтобы получить 20 ее конечную концентрацию 1,5 М и затем добавляли 5% цетилпиридинийхлорид до тех пор,пока не прекращалось образование осадка. Полученный таким образом осадок удаляли центрифугированием. Полученную в результате надосадочную жидкость концентрировали до одного литра путем ультрафильтрации, к ней добавляли четыре литра этанола и образовавшийся осадок отбирали центрифугированием. К этому осадку добавляли 100 мл 4 М водного раствора хлористого натрия, смесь хорошо перемешивали, добавляли этанол, чтобы довести его концентрацию до 80%, и смесь перемешивали и центрифугировали, получая осадок. Осадок суспендировали в 80% этаноле, после чего проводили центрифугирование, и такие операции повторяли до тех пор, пока не исчезало поглощение в надосадочной жидкости на 260 нм. Полученный осадок растворяли в двух литрах 2 М водного раствора хлористого натрия, образовавшееся нерастворимое вещество удаляли центрифугированием, добавляли 50 мл DEAECellofine A-800 (Seikagaku Kogyo), смесь перемешивали и добавленную смолу удаляли фильтрацией. Фильтрат пропускали через колонку с DEAE-Cellofine A-800, доведенную до равновесия 2 М водным раствором хлористого натрия, непоглощенные вещества подвергали ультрафильтрации на ультрафильтраторе, оборудованном пористой тканью, которая способна исключить молекулярный вес 100.000 и менее, в результате чего полностью удаляли окрашивающие вещества и соль, и затем нерастворимые вещества удаляли путем центрифугирования и фильтрации с последующим сублимированием, получая фукоидан-U. Вес сублимированного фукоидана-U составил 15 г. Фиг. 1 показывает способность к образованию осадка фукоидана-U и фукоидана-F, который получен в нижеследующем примере 5,при различных концентрациях хлористого натрия в присутствии избытка цетилпиридинхлорида. На фиг. 1 ордината показывает коэффициент осаждения (%), тогда как абсцисса показывает концентрацию (М) хлористого натрия. Сплошная линия с кружочками относится к коэффициенту осаждения фукоидана-U по настоящему изобретению при различных концентрациях (М) хлористого натрия, тогда как пунктирная линия с треугольниками относится к коэффициенту осаждения фукоидана-F по изобретению при различных концентрациях (М) хлористого натрия. Коэффициенты осаждения определяли по температуре раствора 37 С следующим образом. Фукоидан-U и фукоидан-F каждый растворяли в воде и в 4 М растворе хлористого натрия при концентрации 2% каждого. Затем эти растворы смешивали в различных соотношениях,получая тем самым 125 мкл порции растворов 21 фукоидана-U и фукоидана-F, имеющих разные концентрации хлористого натрия. Далее цетилпиридинхлорид растворяли в воде и в 4 М хлористом натрии в концентрации 2,5%, и полученные растворы смешивали в различных соотношениях, получая тем самым 1,25% растворы цетилпиридинхлорида с различными концентрациями хлористого натрия. Для полного осаждения фукоидана-U и фукоидана-F, каждый из которых растворен в воде при концентрации 2%, требуется в 3,2 раза больше по объему 1,25% раствора цетилпиридинхлорида. К 125 мкл порциям 2% растворов фукоидана-U и фукоидана-F с различными концентрациями хлористого натрия добавляли 400 мкл порции растворов цетилпиридинхлорида с различными концентрациями хлористого натрия. После тщательного перемешивания и отстоя в течение 30 мин каждую смесь центрифугировали и определяли содержание сахара в надосадочной жидкости по фенольно-сернокислому методу [Analytical Chemistry, 28, 350 (1956] с последующим расчетом коэффициента осаждения каждого фукоидана при каждой концентрации хлористого натрия. Молекулярный вес полученного таким образом фукоидана-U определяли методом гельфильтрации с помощью Sephacryl S-500. В результате найдено распределение молекулярного веса вокруг примерно 190.000. Далее анализировали компоненты фукоидана-U. Сперва определяли содержание фукозы в соответствии с методикой, описанной в Journalof Biological Chemistry, 175, 595 (1948). Затем полученный таким образом сухой препарат фукоидана-U растворяли в 1N соляной кислоте, чтобы получить концентрацию 0,5%, и обрабатывали при 110 С в течение двух часов,чтобы тем самым гидролизовать его на составляющие сахара. Вслед за этим восстанавливаемые концы полученных гидролизом моносахаридов подвергали пиридил-(2)-аминированиюGlycoTAG (каждый от Takara Shuzo) и анализировали соотношение составляющих сахаров методом ЖХВР. Далее определяли содержание урониевой кислоты в соответствии с методикой, описанной в Analytical Biochemistry, 4, 330 (1962). Вслед за этим определяли содержание серной кислоты в соответствии с методикой, описанной в Biochemical Journal, 84, 106 (1962). В результате было найдено, что составляющими сахарами фукоидана-U являются фукоза, манноза, галактоза, глюкоза, рамноза, ксилоза и урониевая кислота, и в нем не содержалось существенных количеств других нейтральных сахаров. Соотношение мольных содержаний главных компонентов было следующим: фукоза : манноза : галактоза : урониевая кислота 22 Структура фукоидана-U была определена следующим образом. Модифицирование фукоидана-U ферментами, способными деградировать фукоидан-U, и очистка продуктов ферментации: Очищенный фукоидан-U обрабатывали эндофукоиданлиазой, как будет описано далее,и полученные продукты очищали. А именно, 16 мл 1% раствора фукоиданаU, 12 мл 50 мМ фосфатного буфера (рН 8,0), 4 мл 4 М раствора хлористого натрия и 8 мл 32 мЕ/мл раствора эндофукоиданлиазы смешивали и оставляли взаимодействовать при 25 С в течение 48 ч. Было подтверждено, что поглощение реакционной смеси на 230 нм увеличивается по мере протекания реакции, доказывая тем самым,что идет разложение фукоидана-U этим ферментом. После обессоливания с помощью MicroAcilyzer G3 (Asahi Chemical Industry) реакционную смесь разделяли на три фракции (а), (b) и(с) с помощью DEAE-Sepharose FF. Вышеупомянутую эндофукоиданлиазу готовили следующим образом. Штамм, который используется для продуцирования этого фермента, может быть выбран произвольно, при условии, что он был способен продуцировать эндофукоиданлиазу. В качестве конкретного примера его можно указать на Flavobacterium sp. SA-0082 (FERM BP-5402). Этот штамм был выделен авторами настоящего изобретения из морской воды в Aomori. Он определен как Flavobacterium sp. SA0082 и депонирован в National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology (1-3, Higashi 1chome, Tsukuba, Ibagari, 305 Japan) с депозитарным номером FERM P-14872 29 марта 1995, а затем получил депозитарный номер FERM ВP5402 (перевод в международный депозит был заявлен 15 февраля 1996). Питательные вещества, которые должны быть добавлены к среде для культивирования штамма, могут быть выбраны произвольно, при условии, что применяемый штамм может усваивать их так, чтобы продуцировать эндофукоиданлиазу. Примеры подходящих источников углерода включают фукоидан, порошок морских водорослей, альгиновую кислоту, фукозу,глюкозу, маннитол, глицерин, сахарозу, мальтозу, лактозу и крахмал, в то время как примеры подходящих источников азота включают экстракт дрожжей, пептон, касаминокислоты, кукурузный экстракт, мясной экстракт, обезжиренные соевые бобы, сульфат аммония и хлористый аммоний. Среда может дополнительно содержать неорганические вещества и соли металлов, такие как соли натрия, фосфаты, соли калия, соли магния и соли цинка. Выход эндофукоиданлиазы, продуцируемой при культивировании штамма, изменяется в зависимости от условий культивирования. В общем, предпочтительно, чтобы температура 23 культивирования находилась в интервале от 15 до 30 С, а рН среды - от 5 до 9. Выход эндофукоиданлиазы достигает максимума при культивировании штамма при аэрации и перемешивании в течение времени от 5 до 72 ч. Само собой разумеется, что условия культивирования выбираются должным образом в зависимости от применяемого штамма, состава среды и т.д. так,чтобы достичь максимального выхода. Эндофукоиданлиаза содержится и в клетках и в надосадочной жидкости культуры. Вышеупомянутая Flavobacterium sp. SA0082 культивируется в подходящей среде, и клетки собирали и разрывали применяемыми для разрыва клеток, такими как обработка ультразвуком. Таким образом получали свободный от клеток экстракт. После этого экстракт очищали по методике, обычно применяемой на практике, чтобы получить препарат очищенного фермента. Очистка, например, может быть проведена высаливанием, ионообменной хроматографией, колоночной хроматографией гидрофобной связи,гель-фильтрацией или подобными методами,чтобы посредством этого получить очищенную эндофукоиданлиазу, свободную от любой другой эндофукоиданлиазы. Культуральная жидкость, полученная удалением клеток из вышеупомянутой культуральной среды, также содержит большое количество этого фермента (внеклеточный фермент), который может быть очищен теми же методами, которые применяют для очистки внутриклеточного фермента. Ниже приведен пример очистки эндофукоиданлиазы.Flavobacterium sp. SA-0082 (FERM BP5402)высевали в 600 мл среды, содержащей искусственную морскую воду (рН 7,5, JamarinLaboratory), содержащей 0,25% глюкозы, 1,0% пептона и 0,05% экстракта дрожжей, которую вводили пипеткой в двухлитровую колбу Эрленмейера и стерилизовали при 120 С в течение 20 мин. Затем штамм культивировали в ней при 24 С в течение 24 ч, чтобы получить тем самым посеянную культуру. В тридцатидвухлитровый сосуд-ферментер вводили 20 л среды, состоящей из искусственной морской воды (рН 7,5,Jamarin Laboratory), содержащей 0,25% глюкозы, 1,0% пептона, 0,05% экстракта дрожжей и 0,01 пеноподавляющего агента (КМ 70, Shin-EtsuChemical Co., Ltd), и стерилизовали при 120 С в течение 20 мин. После охлаждения среду инокулировали 600 мл вышеупомянутой посевной культурой, которую затем культивировали в нем при 24 С при аэрировании со скоростью 10 л/мин и перемешивали при 124 об/мин. После завершения культивирования культуральную среду центрифугировали, чтобы тем самым отобрать клетки. Отобранные клетки суспендировали в 20 мМ ацетатфосфатного буфера (рН 7,5), содер 002021 24 жащего 200 мМ хлористого натрия, разрывали обработкой ультразвуком и центрифугировали,получая тем самым клеточный экстракт. Эндофукоиданлиаза в этом клеточном экстракте проявляет активность 5 мЕ/мл среды. К этому экстракту добавляли сульфат аммония так, чтобы в конце достичь 90% насыщения. После растворения за счет перемешивания смесь центрифугировали и осадок суспендировали в таком же буфере, как тот вышеупомянутый буфер, в котором суспендировали клетки. Затем суспензию тщательно диализировали в 20 мМ ацетатно-фосфатном буфере (рН 7,5), содержащем 50 мМ хлористого натрия. После удаления осадка, образованного диализным центрифугированием, его адсорбировали в колонке DEAE-Sepharose FF, которую доводили до равновесия 20 мМ ацетатно-фосфатным буфером (рН 7,5), содержащим 50 мМ хлористого натрия. Затем адсорбированное вещество хорошо промывали тем же буфером и проявляли линейным градиентным элюированием хлористым натрием от 50 мМ до 600 мМ. Активные фракции объединяли и добавляли к ним хлористый натрий так, чтобы получить конечную концентрацию 4 мМ. Далее его адсорбировали в колонке Phenyl Sepharose CL-4B, которую доводили до равновесия 20 мМ фосфатным буфером(рН 8,0), содержащим 4 М хлористого натрия. Затем адсорбированное вещество хорошо промывали тем же буфером и проявляли линейным градиентным элюированием хлористым натрием от 4 М до 1 М. Активные фракции объединяли и концентрировали ультрафильтрацией. Далее его подвергали гель-фильтрации с помощьюSephacryl S-300, который доводили до равновесия 10 мМ фосфатным буфером, содержащим 50 мМ хлористого натрия. Активные фракции объединяли. Молекулярный вес фермента, определенный по времени удерживания на Sephacryl S300, составил около 460.000. Затем активные фракции диализировали в 10 мМ фосфатном буфере (рН 7), содержащем 250 мМ хлористого натрия. Раствор фермента адсорбировали в колонке Mono Q HR5/5, которую доводили до равновесия 10 мМ фосфатным буфером (рН 7),содержащим 250 мМ хлористого натрия. Адсорбированное вещество хорошо промывали тем же буфером и проявляли линейным градиентным элюированием хлористым натрием от 250 до 450 мМ. Активные фракции объединяли,получая тем самым очищенный фермент. Таблица 3 суммирует вышеописанные стадии очистки. Стадия Клеточный экстракт Осаждение сульфатом аммония Таблица 3 Общий Общая Удельная Выход протеин активность активность Активность этого фермента определяли следующим образом. Пятьдесят микролитров 2,5% раствора фукоидана, полученного изKjellmaniella crassifolia, 10 мкл этого фермента и 60 мкл 83 мМ фосфатного буфера (рН 7,5), содержащего 667 мМ хлористого натрия, смешивали и оставляли реагировать при 37 С в течение 3 ч. Затем 105 мкл реакционной смеси смешивали с 2 мл воды при перемешивании и измеряли поглощение (AT) при 230 нм. В качестве контроля использовали реакционную смесь,приготовленную тем же методом, но при замене фермента одним вышеупомянутым буфером,использованным для растворения фермента, и другую реакционную смесь, приготовленную тем же методом, но при замене фукоидана одной водой, и замеряли также их поглощением(АВ 1 и АВ 2). Количество фермента, которым можно разорвать полностью один миллимоль гликозидных связей между маннозой и урониевой кислотой за одну минуту, принято за одну единицу(Е). Разорванные таким образом связи определяли, принимая милимольный коэффициент молекулярного поглощения ненасыщенной урониевой кислоты, образовавшейся при реакции элиминирования за 5,5. Активность фермента определяли по следующему уравнению: Активность(Е/мл=(AT-АВ 1-АВ 2)х 2,105 х 120/(5,5 х 105 х 0,01 х 180); 2,105 - объем (мл) образца, поглощение которого измеряли; 120 - объем (мкл) реакционной смеси фермента; 5,5 - миллимольный коэффициент молекулярной экстинции (/мМ) ненасыщенной урониевой кислоты на 230 нм; 105 - объем (мкл) реакционной смеси, использованной для разбавления; 0,01 - объем (мл) фермента; и 180 - время реакции (мин); Протеин определяли измерением поглощения раствора фермента на 280 нм и расчетом,принимая поглощение 1 мг/мл раствора протеина за 1,0. Фукоидан, происходящий из Kjellmaniellacrassifolia, использованной как субстрат, готовили следующим образом. Сырую Kjellmaniella crassifolia измельчали мельницей модели М-2 (Nara Kikai Seisakusho) и обрабатывали 10-кратным количеством 85% метанола при 70 С в течение 2 ч. Затем ее фильтровали и остаток дополнительно обрабатывали 10-кратным количеством метанола при 70 С в течение 2 ч. После фильтрации к остатку добавляли 20-кратное количество воды. Затем 26 смесь обрабатывали при 100 С в течение 3 ч и фильтровали, получая таким образом экстракт. Концентрацию соли в экстракте доводили до такого же уровня, как у 400 мМ раствора хлористого натрия. Затем к нему добавляли цетилпиридинхлорид до тех пор, пока не прекращалось образование осадка. После центрифугирования осадок тщательно промывали этанолом,чтобы тем самым полностью убрать цетилпиридинхлорид. Далее его подвергали обессоливанию и удалению веществ с низким молекулярным весом, используя ультрафильтрацию ультрафильтрационной мембраной (мол. вес. 100.000), фирмы Amicon. Образованный таким образом осадок удаляли центрифугированием. Надосадочную жидкость сублимировали с получением очищенного фукоидана Kjellmaniellacrassifolia. Анализ структуры реакции фермента Вышеупомянутая эндофукоиданлиаза представляет собой фермент, который разрывает альфа 14 связь между D-маннозой и Dглюкурониевой кислотой в сложном полисахариде. Когда полученный выше фукоидан-U обрабатывают этим ферментом, образуются олигосахариды, имеющие структуры, представленные приведенными выше формулами (I), (II) и(III). Часть каждой из вышеупомянутых трех фракций (а), (b) и (с), разделенных и очищенных на DEAE-Sepharose FF подвергают пиридил-(2)аминированию по восстанавливаемому концу,используя GlycoTAG и набор реагентов GlycoTAG (оба от Takara Shuzo), чтобы тем самым получить ПА-сахариды (ПА-а), (ПА-b) и (ПА-с). Эти (ПА-а), (ПА-b) и (ПА-с) анализировали посредством ЖХВР и исследовали различия ПАпродуктов из трех олигосахаридов, представленных формулами (I), (II) и (III). В данном случае условия ЖХВР были следующими.(i) Анализ ЖХВР с использованием колонки, фракционирующей по молекулярному весу. аппаратура: Модель L-6200 (Hitachi, Ltd); колонка: SHODEX SB-803 (4,6 х 250 мм,Showa Denko); элюент: 0,2 М хлористый натрий : диметилсульфоксид =9 : 1; детектирование: флюорометрический детектор F-1150 (Hitachi, Ltd), длина волны возбуждения: 320 нм, длина волны флюоресценции: 400 нм; скорость потока: 1 мл/мин; и температура колонки: 50 С.Yakuhin Kensa Kyo-kai); элюент: 50 мМ уксусная кислотатриэтиламин (рН 5,5); 27 детектирование: флюорометрический детектор F-1150 (Hitachi, Ltd), длина волны возбуждения: 320 нм, длина волны флюоресценции: 400 нм; скорость потока: 1 мл/мин; и температура колонки: 40 С. В результате двух вышеупомянутых анализов ЖХВР все три олигосахарида, полученные разложением фукоидана-U вышеуказанной эндофукоиданлиазой, были идентичны, соответственно, трем олигосахаридам, представленным формулами (I), (II) и (III). Поэтому соединение (а) имеет структуру, в которой ненасыщенная D-глюкурониевая кислота и L-фукоза, имеющая присоединенную к ней сульфатную группу, присоединены к Dманнозе, которая представляет собой восстанавливаемый радикал; соединение (b) имеет структуру, в которой ненасыщенная D-глюкурониевая кислота и L-фукоза, имеющая две присоединенных к ней сульфатных группы,присоединены к D-маннозе, которая представляет собой восстанавливаемый радикал и имеет присоединенную к ней сульфатную группу; и соединение (с) имеет структуру, в которой ненасыщенная D-глюкурониевая кислота иL-фукоза, имеющая присоединенную к ней сульфатную группу, присоединены к Dманнозе, которая представляет собой восстанавливаемый радикал, и к этой D-глюкурониевой кислоте присоединена D-манноза, и в свою очередь, к этой D-маннозе дополнительно присоединены D-глюкурониевая кислота и L-фукоза,имеющая присоединенную к ней сульфатную группу. Как обсуждалось выше, полученный фукоидан-U имеет структуру, в которой Dглюкурониевая кислота и D-манноза, чередуясь,связаны друг с другом иL-фукоза присоединена, по меньшей мере, к одной Dманнозе. Кроме того он имеет предпочтительную структуру, представленную следующей общей формулой (IV), в которой, по меньшей мере,одна из спиртовых гидроксильных групп сульфатирована, а n обозначает целое число, равное или большее 1. Таким образом, когда фукоидан-U обрабатывают вышеупомянутой эндофукоиданлиазой,получают олигосахариды, представленные упомянутыми формулами (I), (II) и (III). Удельное вращение этого высушенного вымораживанием фукоидана-U, измеренное высокоскоростным и высокочувствительным(1) Получение стандартного фукаиданового вещества, фукоидана-F и фукоидана-U. Два килограмма тщательно высушенной(Nara Kikai Seisakusho). Полученный таким образом сухой порошок суспендировали в 9 л 80% этанола и обрабатывали при 80 С в течение 2 ч. Затем смесь фильтровали через фильтровальную бумагу, чтобы получить остаток. Этот остаток повторно промывали этанолом и фильтровали трижды таким же образом, как описано выше, чтобы получить тем самым остаток после этанольной промывки. Этот остаток суспендировали в 36 л 0,2 М раствора ацетата кальция,обрабатывали при 95 С в течение 2 ч и фильтровали. Остаток промывали 4 л 0,2 М раствора ацетата кальция, получая тем самым 36 л экстракта, содержащего фукоидан из Kjellmaniellacrassifolia. К полученному таким образом фильтрату добавляли 5% цетилпиридинхлорид до тех пор, пока не прекращалось образование осадка. Затем осадки отбирали центрифугированием и промывали, суспендируя их в 3 л 0,4 М водного раствора хлористого натрия с последующим центрифугированием. После троекратного повторения процедуры промывки, к осадку добавляли 1 л 4 М водного раствора хлористого натрия и смесь перемешивали. Затем к ней добавляли этанол так, чтобы получить концентрацию 80%, и смесь перемешивали и центрифугировали, получая тем самым осадок. Полученный осадок суспендировали в 80% этаноле и центрифугировали. Эти процедуры повторяли до тех пор, пока поглощение надосадочной жидкости на 260 нм не достигало нуля. Осадок растворяли в 3 л 2 М водного раствора хлористого натрия. После удаления нерастворимых веществ 100 мл DEAE-Cellufine A-800 (Seikagaku Kogyo) добавляли к смеси и перемешивали. Далее добавленную выше смолу удаляли фильтрацией. Фильтрат подавали на колонку с DEAECellufine A-800, доведенную до равновесия 2 М водным раствором хлористого натрия и непоглощенную часть подвергали ультрафильтрации с использованием ультрафильтратора, оборудованного пористой мембраной для исключения мол. веса 100.000 или менее, чтобы полностью удалить окрашивающие вещества и хлористый натрий. Далее, нерастворимые вещества удаляли центрифугированием и фильтрацией с последующим сублимированием для получения стандартного фукоиданового вещества. Вес указанного стандартного фукоиданового вещества составил 90 г. Семь граммов этого сублимированного стандартного фукоиданового вещества отвешивали и растворяли в 0,2 М хлористом кальции. Затем 4.000 мл колонку с DEAE-Sepharose FF доводили до равновесия 0,2 М хлористым каль 29 цием. Стандартное фукоидановое вещество,растворенное в 0,2 М хлористом кальции вводили в колонку с DEAE-Sepharose FF и тщательно промывали 0,2 М хлористым кальцием. Далее, ее проявляли линейным градиентным элюированием хлористым натрием от 0 до 4 М. Из полученных таким образом фракций, фракции, имеющие концентрацию хлористого натрия от 0,05 до 0,8 М объединяли, обессоливали диализом и затем подвергали сушке вымораживанием. Таким образом получали 2,1 г фукоидана-U, существенно отделенного от фукоидана-F. Из числа элюированных выше фракций фракции с концентрацией хлористого натрия от 0,9 до 1,5 М объединяли, обессоливали диализом и затем подвергали сушке вымораживанием. Таким образом получали 4,7 г фукоидана-F, существенно отделенного от фукоидана-U. Молекулярный вес фукоидана-F определяли посредством гель-фильтрации, используяSephacryl S-500, и было найдено, что он имеет распределение молекулярного веса вокруг примерно 190.000. Компоненты фукоидана-F анализировали по методике, упомянутой в примере 4. Составляющими сахарами для фукоиданаF были фукоза и галоктоза, и их молярное соотношение было около 10:1. Урониевая кислота и другие нейтральные сахара не содержались в заметных количествах. Молярное отношение фукозы к сульфату было около 1:2. Однопроцентный раствор фукоидана-F (16 мл) смешивали с 8 мл 32 мЕ/мл вышеупомянутого раствора эндофукоиданлиазы, 12 мл 50 мМ фосфатного буфера (рН 8,0) и 4 мл 4 М хлористого натрия и инкубировали при 25 С в течение 48 ч. Продукт реакции деградации не был обнаружен, и не было также замечено превращение фукоидана-F в низкомолекулярные вещества. Затем удельное вращение этого высушенного вымораживанием фукоидана-F было измерено высокоскоростным высокочувствительным поляриметром SEPA- 300 (Horiba, Ltd.) и найдено равным -135.(2) Сублимированный фукоидан VI, упомянутый в примере 1-(3) использовали в качестве фукоидана и продукты деградации фукоидана микроорганизмами получали нижеследующим образом. Шестьдесят граммов вышеупомянутого сублимированного (высушенного замораживанием) фукоидана VI взвешивали, растворяли в 20 л искусственной морской воды (Jamarin(FERM BP-5402) и проводили инкубацию в течение 26 ч при следующих условиях инкубации: температура 24 С, рН 7, скорость перемешивания 125 об/мин, аэрация 10 л/мин. Культураль 002021 30 ную среду центрифугировали для удаления клеток, обрабатывали на ультрафильтрационном приборе, оборудованном пористой тканью с молекулярным весом исключения 30.000 или менее для полного удаления низкомолекулярных веществ, и центрифугировали и фильтровали для удаления нерастворимых веществ и продуктов микробиальной деградации фукоидана,которые не были исключены пористой тканью с молекулярным весом исключения 30.000 или ниже, и сушили вымораживанием. Вес сублимированного микробиально деградированного фукоидана составил 32 г.(3) Сублимированный фукоидан-VI, упомянутый в примере 1-(3), был обработан по методике, упомянутой в примере 5-(1) для получения фукоидана-U, и затем продукты деградации фукоидана-U с использованием эндофукоиданлиазы были получены следующим образом. Так, 7 г вышеупомянутого высушенного замораживанием фукоидана-VI взвешивали и растворяли в 0,2 М хлористом кальции. Затем 4.000 мл колонку с DEAE-Sepharose FF доводили до равновесия 0,2 М хлористым кальцием. После этого вышеупомянутый фукоидан, растворенный как таковой, загружали в колонку сDEAE-Sepharose FF, хорошо промывали 0,2 М хлористым кальцием и элюировали с градиентом от 0 до 4 М хлористого натрия. Из элюированных фракций собирали те фракции, где концентрации хлористого натрия были 0,05-0,8 М,обессоливали посредством диализа и сушили вымораживанием, получая фукоидан-U. Фукоидан-U, приготовленный таким образом, смешивали с 250 мл 100 мМ Трисгидрохлоридного буфера (рН 8,0), 250 мл 0,8 М хлористого натрия и 0,15 мл раствора эндофукоиданлиазы (19 Е/мл), продуцированной штаммом Flavobacterium sp. SA-0082 (FERMBP-5402) и оставляли реагировать при 25 С в течение 80 ч. Реакционную смесь подвергали ультрафильтрации, используя ультрафильтрационную установку, оборудованную пористой тканью,исключающей молекулярный вес 3.000 или менее и, после того как низкомолекулярные вещества были полностью удалены, нерастворимое вещество удаляли методами центрифугирования и фильтрации, чтобы собрать ферментативно расщепленный фукоидан-U, который не был исключен пористой тканью, имеющей молекулярный вес исключения 3.000 или менее. Указанную фракцию обессоливали на MicroacilyzerG3 и сушили вымораживанием, получая высушенный замораживанием ферментативно расщепленный фукоидан-U.(4) Индуцирующая апоптоз активность фукоидана-U и фукоидана-F. Клетки промиелоцитной лейкемии человека HL-60 (ATCC CCL-240) инкубировали при 37 С в среде RPMI 1640 (Gibco), содержащей 10% околоплодной телячьей сыворотки (JRH(Ajinomoto Co., Ltd) таким образом, чтобы получить концентрацию 5 х 104 клеток/900 мкл. Затем суспензию вводили пипеткой в шестиячеечный планшет (Falcon) в количестве 4,5 мл на ячейку. Каждый из фукоидана-F и фукоидана-U, полученных в примере 5-(1) растворяли в 30 мМ НЕРЕS-буфере (рН 7), содержащем 120 мМ хлористого натрия так, чтобы получить концентрацию 10 мг/мл, с последующей обработкой в автоклаве при 121 С в течение 20 мин, и 100 мкл полученного раствора добавляли к каждой из уже приготовленных суспензий с последующей инкубацией при 37 С в присутствии 5% двуокиси углерода. В качестве контроля только вышеупомянутый буфер добавляли к таким же количествам, после чего подвергали их такой же инкубации. Число выживших клеток спустя 16 и 40 ч от начала инкубации подсчитывали по методике, описанной вShuppan, edited by Japan Tissue Culture Society,pp. 26-28). Так, подсчет проводили после окрашивания трипаном синим на гемоцитометре. Результаты приведены на фиг. 5. Так, фиг. 5 показывает связь между временем инкубации и количеством выживших клеток в культуральной среде, когда фукоидан-U, и фукоидан-F добавлены к культуральной среде клеток HL-60 до их концентрации 1 мг/мл. Абсцисса показывает время инкубации (час), тогда как ордината показывает число выживших клеток. Что касается типа сульфатированных фукозосодержащих полисахаридов, то незакрашенные кружочки относятся к фукоидану-U, тогда как черные кружочки обозначают фукоидан-F. В данном случае число выживших клеток в культуральной среде контроля (пробы не добавлялись) спустя 16 и 40 ч после начала инкубации составили 7 х 104 клеток/мл и 1,4 х 105 клеток/мл, соответственно. В результате было найдено, что фукоиданU и фукоидан-F индуцируют апоптоз у клетокHL-60, поскольку скорость размножения клеток подавлялась. Каждый из фукоиданов, которые были разложены микроорганизмами, полученными в примере 5-(2), и фукоидан-U, который был разложен ферментом, полученным в примере 5-(3) выше, растворяли в 30 мМ буфера HEPES (рН 7), содержащем 120 мМ хлористого натрия,чтобы получить его концентрацию 10 мг/мл, с последующей обработкой в автоклаве при 121 С в течение 20 мин и измеряли достигнутую таким образом индуцирующую апоптоз активность в соответствии с вышеупомянутой методикой, после чего были получены такие же результаты, как показанные на фиг. 5 для фукоидана-U. 32 Пример 6. Зеленый чай готовили обычным способом,используя 10 г листьев зеленого чая, 0,2 г витамина С и 1.000 мл деионизированной воды. В продукте 1 по настоящему изобретению использовали фукоидан-II примера 1 и добавляли 30 мг фукоидана на 100 мл продукта. В продукте 2 по настоящему изобретению использовали смесь(содержащую 60% фукоидана) фукоидана-II примера 1 и экстракта, полученного из морской водоросли горячей водой по обычному способу[Kjellmaniella crassifolia экстрагировали горячей водой при 95 С в течение одного часа обычным методом, и экстракт обрабатывали активированным углем и подвергали сушке вымораживанием (содержание фукоидана 50%); такой же материал использовали также в следующих примерах] и добавляли ее в количествах, соответствовавших содержанию 30 мг фукоидана на 100 мл конечного продукта. Контролем было то,где ничего не добавляли. Органолептический тест проводился 20 испытателями по пятибальной шкале (где 5 означает "хорошо", тогда как 1 означает "плохо") в терминах ощущения на язык, баланса вкуса, свежести вкуса и ощущения при проглатывании, и средние результатов показаны в таблице 4. Таблица 4. Органолептическая оценка Продукт 1 Продукт 2 Контроль Ощущение на язык Сладость 4,5 3,3 2,1 Гладкость 4,7 2,9 2,0 Баланс вкуса 4,2 2,7 2,0 Свежесть вкуса 4,0 2,5 2,0 Ощущение при проглаты 4,5 3,1 2,3 вании Общая оценка 4,4 2,9 2,1 Оценки в таблице 4 показывают, что при сравнении с контролем продукты 1 и 2 по настоящему изобретению показали лучшее ощущение на язык, лучшие баланс и свежесть вкуса,выдающийся аромат и вкус чая и превосходный баланс вкуса. Пример 7. Питательный напиток готовили по обычному способу в соответствии с рецептурой, приведенной в таблице 5. Таблица 5. Рецептура Фруктозо-глюкозный жидкий сахар Очищенный мед Экстракт гуараньи Экстракт корейского жень-шеня Королевское желе Витамин С Никотинамид Витамин B1 гидрохлорид Витамин B6 гидрохлоридL-Изолейцин Лимонная кислота Аромат Деионизированная вода Всего В продукте 3 по настоящему изобретению использовали фукоидан-U примера 4 и добавляли 40 мг фукоидана на 100 мл конечного продукта. В продукте 4 использовали смесь (содержащую 67% фукоидана) фукоидана-U примера 4 и экстракта морской водоросли горячей водой и добавляли ее в количествах, соответствовавших содержанию 40 мг фукоидана на 100 мл конечного продукта. Контролем было то, где ничего не добавляли. Органолептический тест проводился таким же образом, как в примере 6. Результаты приведены в таблице 6. Таблица 6. Органолептическая оценка Продукт 3 Продукт 4 Контроль Ощущение на язык Сладость 3,0 2,5 1,8 Гладкость 3,5 2,4 1,5 Баланс вкуса 3,6 3,2 3,0 Свежесть вкуса 3,8 3,0 2,8 Ощущение при прогла 3,7 3,4 3,0 тывании Общая оценка 3,4 2,9 2,4 Из таблицы 6 видно, что продукты 3 и 4 по настоящему изобретению вполне являлись освежающими напитками, имевшими улучшенные ощущения на язык, баланс вкуса, свежесть вкуса и ощущение при проглатывании по сравнению с контролем. Пример 8. Фукоидановый напиток концентрированного типа готовили обычным способом в соответствии с рецептурой, приведенной в таблице 7. Таблица 7. Рецептура Мальтозный жидкий сахар (кг) Порошок ума (японский абрикос) (кг) 1/5 прозрачный лимонный сок (кг) Пектин (кг) Ангидрид лимонной кислоты (кг) Витамин С (кг) Аромат (кг) Деионизированная вода Всего (литры) рН продукта: 3,1 В продукте 5 по настоящему изобретению использовали фукоидан V, упомянутый в примере 1-(2) и добавляли 400 мг фукоидана на 100 мл конечного продукта. В продукте 6 по настоящему изобретению была использована смесь (содержащая 80% фукоидана) фукоиданаV и экстракта морской водоросли горячей водой, и ее количество соответствовало 400 мг фукоидана на 100 мл конечного продукта. Поскольку продукты были напитками концентрированного типа, в качестве контроля были приготовлены Контроль 1, куда добавили 400 мг/100 мл дурановой смолы (загуститель) и Контроль 2, куда добавили 400 мг/100 мл ксантановой смолы. Их подвергли органолептическому испытанию таким же образом, как в примере 6, и ее результаты приведены в таблице 8. 34 Таблица 8. Органолептическая оценка Продукт 3 Продукт 4 Контроль 1 Контроль 2 Ощущение на язык Сладость 4,0 3,7 3,5 3,4 Гладкость 4,1 3,6 3,3 3,2 Баланс вкуса 4,0 3,8 3,2 3,1 Свежесть вкуса 3,5 3,3 3,1 3,3 Ощущение при про 3,7 3,6 3,2 3,3 глатывании Общая оценка 4,0 3,7 3,3 3,2 Из таблицы 8 видно, что продукты 5 и 6 по настоящему изобретению проявили лучшее ощущение на язык и баланс вкуса по сравнению с контролем 1 и 2, что дает хорошие продукты,имеющие превосходный вкус в качестве напитков концентрированного типа. Далее, использовали фукоидан VI, упомянутый в примере 1-(3),и добавили 400 мг фукоидана на 100 мл продукта, чтобы приготовить напиток концентрированного типа, который показал такой же результат. Кроме того, использовали каждый из деградированных продуктов, полученных по примерам 5-(2) и (3), и добавляли 400 мг указанного разложенного продукта на 100 мл конечного продукта, чтобы приготовить напитки концентрированного типа, которые дали такие же результаты. Пример 9. Алкогольный напиток готовили обычным способом в соответствии с рецептурой, приведенной в таблице 9. Таблица 9. Рецептура Концентрированный сок замороженных цитрусов "уншу" (45 по Brix) Гранулированный сахар Лимонная кислота Цитрат натрия Апельсиновая эссенция 5% (об) водный раствор спирта Всего Примечание: Приготовленный напиток охлаждали до 5 С и затем в него вводили угольную кислоту с помощью обычного сифона для газирования. Для продукта 7 по настоящему изобретению использовали фукоидан II примера 1 и добавляли 35 мг фукоидана на 100 мл конечного продукта. Для продукта 8 по настоящему изобретению использовали смесь (содержание фукоидана 55%) фукоидана II примера 1 и экстракта морской водоросли горячей водой и добавляли ее количество, соответствующее 35 мг фукоидана. В качестве контроля использовали продукт, к которому не добавляли фукоидан. Органолептическое испытание проводили таким же образом, как в примере 6, и результаты его приведены в таблице 10. Таблица 10. Органолептическая оценка Продукт 7 Продукт 8 Контроль Ощущение на язык Сладость 4,2 3,3 2,7 Гладкость 4,3 3,1 2,8 Баланс вкуса 4,0 3,5 2,5 Свежесть вкуса 3,9 3,0 2,7 Ощущение при прогла 3,5 2,7 2,1 тывании Общая оценка 4,0 3,1 2,6 Как показано в таблице 10, продукты 7 и 8 по настоящему изобретению имели улучшенные ощущение на язык, баланс вкуса, свежесть вкуса и ощущение при проглатывании по сравнению с контролем. В особенности у продукта 7 кислотный вкус становился мягче, придавая продукту вкус спелого королевского апельсина. Пример 10. Спортивный напиток готовили обычным способом в соответствии с рецептурой, приведенной в таблице 11. Таблица 11. Рецептура Глюкоза Фруктоза Лимонная кислота Цитрат натрия Чистая соль Лактат кальция Хлористый магний Витамин С Витамин B1 гидрохлорид Аромат лимонного лайма Деионизированная вода Всего Для продукта 9 по настоящему изобретению использовали фукоидан-U примера 4 и добавляли 30 мг фукоидана на 100 г конечного продукта. Для продукта 10 по настоящему изобретению использовали смесь (содержание фукоидана 75%) фукоидана-U примера 4 и экстракта морской водоросли горячей водой и добавляли ее количество, соответствующее 30 мг фукоидана. В качестве контроля использовали продукт, к которому не добавляли фукоидан. Органолептическое испытание проводили таким же образом, как в примере 6. Результаты приведены в таблице 12. Таблица 12. Органолептическая оценка Продукт 9 Продукт 10 Контроль Ощущение на язык Сладость 4,5 3,8 2,5 Гладкость 4,3 3,5 2,3 Баланс вкуса 3,9 3,5 3,2 Свежесть вкуса 3,7 3,2 2,9 Ощущение при прогла 4,0 3,5 2,8 тывании Общая оценка 4,0 3,5 2,7 Из таблицы 12 видно, что по сравнению с контролем продукты 9 и 10 по настоящему изобретению имели лучшие ощущение на язык,ощущение при проглатывании и баланс вкуса,показанный превосходным балансом компонентов, и дали значительный эффект зрелого вкуса. Пример 11. Для приготовления сливового бренди с фруктами 1440 г 75% (вес) фруктозоглюкозного жидкого сахара, 670 мл 95% (об) спирта и 340 мл воды смешивали в пятилитровой бутыли, снабженной крышкой, и помещали в нее 1 кг незрелых слив. Для продукта 11 по настоящему изобретению при загрузке материалов использовали фукоидан III примера 2 и добавляли 40 мг фукоидана на 100 мл конечного продукта. Для про 36 дукта 12 по настоящему изобретению использовали смесь(содержание фукоидана 70%) фукоидана III и экстракта морской водоросли горячей водой и добавляли ее количество, соответствующее 40 мг фукоидана на 100 мл конечного продукта. В качестве контроля использовали продукт, к которому не добавляли фукоидан. Каждую бутыль закрывали и давали ей стоять при комнатной температуре в течение двух месяцев при периодическом перемешивании. После этого в них добавляли по 1020 мл 28% (об) водного спирта, перемешивали и продолжали вызревание еще в течение двух месяцев для приготовления сливового бренди. Каждое из полученных вызревших сливовых бренди подвергали органолептическому испытанию таким же образом, как в примере 6. Результаты приведены в таблице 13. Таблица 13. Органолептическая оценка Продукт 11 Продукт 12 Контроль Ощущение на язык Сладость 4,5 3,2 2,5 Гладкость 4,2 3,3 2,6 Баланс вкуса 4,6 4,0 2,4 Свежесть вкуса 3,8 3,5 2,7 Ощущение при про 4,2 3,4 2,8 глатывании Общая оценка 4,3 3,5 2,6 Из таблицы 13 видно, что продукты 11 и 12 по настоящему изобретению имели лучшее ощущение на язык и ощущение при проглатывании по сравнению с контролем и показали зрелый и хорошо сбалансированный вкус, подобный вкусу продукта, который вызревал длительное время. Пример 12. В продукте 13 по настоящему изобретению использовали гомогенизированное обычное молоко (содержавшее 88,6% вес/об воды, 2,8% вес/об протеина, 3,5% вес/об жира, 4,5% вес/об лактозы и 0,8% вес/об золы) и фукоидан I примера 1 и добавляли 30 мг фукоидана на 100 мл конечного продукта. В продукте 14 по настоящему изобретению использовали смесь(содержание фукоидана 80%) фукоидана I и экстракта морской водоросли горячей водой в количестве,соответствовавшем 30 мг фукоидана. В качестве контроля использовали продукт, к которому не добавляли фукоидан. Органолептическое испытание проводили таким же образом, как в примере 6. Результаты приведены в таблице 14. Таблица 14. Органолептическая оценка Продукт 13 Продукт 14 Контроль Ощущение на язык Сладость 3,6 3,0 2,1 Гладкость 3,5 2,9 2,5 Баланс вкуса 4,0 3,6 3,0 Свежесть вкуса 4,2 2,8 2,4 Ощущение при про 3,9 3,3 2,1 глатывании Общая оценка 3,8 3,1 2,4 Из таблицы 14 видно, что по сравнению с контролем продукты 13 и 14 по настоящему 37 изобретению имели улучшенное ощущение на язык и баланс вкуса, показали большую свежесть вкуса (по сравнению с ощущением для контроля, где молоко как бы зависало на языке,т.е. плохая свежесть вкуса), благодаря чему полученным молочным продуктам можно оказать предпочтение. Пример 13. Соевое молоко готовили из соевых бобов обычным способом и коагулировали в коагуляторе для получения обычного соевого творога. В продукте 15 по настоящему изобретению использовали фукоидан IV примера 2 в соевом молоке и добавляли его в количестве 40 мг фукоидана на 100 г конечного продукта. В продукте 16 по настоящему изобретению использовали смесь(содержание фукоидана 60%) фукоиданаIV примера 2 и экстракта морской водоросли горячей водой и добавляли количество смеси,соответствовавшее 40 мг фукоидана на 100 мл конечного продукта. В качестве контроля использовали продукт, в который не вводили добавки. Органолептическое испытание проводили таким же образом, как в примере 6. Результаты приведены в таблице 15. Таблица 15. Органолептическая оценка Продукт 15 Продукт 16 Контроль Ощущение на язык Сладость 4,0 3,2 2,8 Гладкость 3,8 3,1 2,5 Текстура 3,6 3,2 2,8 Общая оценка 3,8 3,2 2,7 Из таблицы 15 видно, что по сравнению с контролем продукты 15 и 16 по настоящему изобретению имели улучшенное ощущение на язык и давали также приятное ощущение на языке, подобно соевому творогу, приготовленному отжимом через шелковую ткань, в результате чего общая органолептическая оценка была существенно улучшена. Шоколадный крем Леденцы Апельсиновое желе 38 Пример 14. Что касается кондитерских продуктов, то шоколадный крем, леденцы и апельсиновое желе готовили следующим образом. Шоколадный крем готовили смешением двух яичных желтков, 125 мл коровьего молока,10 г пшеничной муки и 30 г сахара при нагревании. Леденцы готовили следующим образом. Так, 1,2 кг сахара и 0,8 кг сиропа смешивали и растворяли в растворителе (110 С), кипятили при 120-130 С на плите, чтобы довести содержание воды до 2% или менее, и затем для приготовления леденцов добавляли 16,3 г молочной кислоты (50% раствор по весу), 10,1 г малоновой кислоты, 5,0 г карбоната кальция и соответствующее количество ароматизатора. Апельсиновое желе готовили следующим образом. Так, 9 г каррагена (ирландский мох) смешивали со 180 г гранулированного сахара и добавляли туда 800 мл воды, после чего перемешивали и растворяли при нагревании. К смеси добавляли 10 г концентрированного фруктового сока "уншу-микан" (цитрусы "уншу), 2 г лимонной кислоты, 1,5 г цитрата натрия, 2 г апельсинового аромата и 1 г ароматизатора для получения конечного продукта. Для каждого из продуктов 17 (шоколадный крем), 18 (леденцы) и 19 (апельсиновое желе) по настоящему изобретению использовали фукоидан-U примера 4 и добавляли 20 мг фукоидана на 100 г конечного продукта. Для каждого из продуктов 20 (шоколадный крем), 21(леденцы) и 22 (апельсиновое желе) по настоящему изобретению использовали смесь (содержание фукоидана 60%) фукоидана-U примера 4 и экстракта морской водоросли горячей водой, и добавляли ее в количестве, соответствующем 20 мг фукоидана на 100 г конечного продукта. Контролем были продукты, для которых добавки не применялись. Проводили органолептические испытания, и результаты приведены в таблице 16. Таблица 16. Органолептическая оценка Ощущение на язык Текстура Продукты Контроль Продукты Контроль 17 20 17 20 3,5 2,9 2,4 3,7 3,2 2,6 Продукты Контроль Продукты Контроль 18 21 18 21 3,8 3,1 2,3 3,6 3,2 2,4 Продукты Контроль Продукты Контроль 19 22 19 22 4,2 3,0 2,2 4,1 2,9 2,3 Из таблицы 16 видно, что продукты 17/18/19 и 20/21/22 показали улучшенную гладкость ощущения на язык, что дает мягкий вкус в целом, и также заслужили лучшую оценку по сравнению с контролем для каждого из них. Общая оценка Продукты Контроль 17 20 3,6 3,0 2,5 Продукты Контроль 18 21 3,7 3,1 2,3 Продукты 1 Контроль 19 22 4,1 2,9 2,2 Пример 15. Что касается мясных пастообразных продуктов, то готовили камабоко, используя рыбную пасту и колбасу, используя животное мясо. В случае камабоко 100 г воды и 20 г соли добавляли к 1 кг размолотого мяса (категория: 39 упаковывали в виниловый мешочек, хранили в течение ночи при 5 С и варили на пару под обычным давлением, получая вареное на пару камабоко (вареную рыбную пасту). В случае колбасы 2 кг свинины и 700 г сала измельчали на волчке с решеткой с отверстиями диаметром 5 мм, затем смешивали с 7 г перца, 3 г шалфея и 1 г муската, и смесь делили на части и упаковывали, используя свиную кишку диаметром 2 см. Затем ее готовили на пару в течение 15 мин для приготовления колбасы. Использовали фукоидан I примера 1, и 50 мг фукоидана на 100 г продукта добавляли к 40 камабоко (продукт 23) перед измельчением/смешиванием или к колбасе (продукт 24) перед расфасовкой. В случае камабоко в продукте 25 и колбасы в продукте 26 использовали смесь (содержание фукоидана 67%) фукоидана I примера 1 и экстракта морской водоросли горячей водой и добавляли ее в количестве, соответствующем 50 мг фукоидана на 100 г конечного продукта. Контролем были продукты, для которых добавки не применялись. Органолептические испытания проводили таким же образом, как в примере 6, и результаты приведены в таблице 17. Таблица 17. Органолептическая оценка Ощущение на язык Текстура Продукты Контроль Продукты Контроль 23 25 23 25 3,8 3,4 2,7 3,7 3,0 2,6 Продукты Контроль Продукты Контроль 24 26 24 26 3,8 3,1 2,8 3,6 3,1 2,5 Из таблицы 17 видно, что по сравнению с контролем продукты 23/25 (камабоко) и 24/26(колбаса) по настоящему изобретению дают более мягкое ощущение на язык и имеют улучшенную эластичность в текстуре. Пример 16. Готовили "рамен" (род китайской лапши). Так, 25,4 г лактата натрия (раствор 50% вес.),9,4 г малата натрия и 10 г карбоната кальция добавляли к 4 кг специальной мучной смеси для рамен (пшеничная мука, содержащая специфическую щелочную соль), затем туда добавляли 1,6 л воды и смесь хорошо перемешивали. Тесто превращали в лапшу, используя домашнюю машину для изготовления лапши (Sanyo Electric). В продукте 27 по настоящему изобретению использовали фукоидан II примера 1 и добавляли 40 мг фукоидана на 100 г конечного продукта. В продукте 28 по настоящему изобретению использовали смесь (содержание фукоидана 60%) фукоидана II примера 1 и экстракта морской водоросли горячей водой и перед добавлением воды добавляли количество смеси, соответствовавшее 40 мг фукоидана на 100 мл конечного продукта. В качестве контроля использовали продукт, в который не вводили добавки. Полученную лапшу "рамен" варили обычным образом, и органолептическое испытание проводили таким же образом, как в примере 6. Результаты приведены в таблице 18. Общая оценка Продукты Контроль 23 25 3,7 3,2 2,6 Продукты Контроль 24 26 3,7 3,1 2,6 на язык и имели эластичную структуру, дающее хорошее ощущение при откусывании, благодаря чему общая оценка была высокой. Пример 17. Хлеб и китайские "маньжу" ("dim sum" или булочки с начинкой) готовили обычным образом. Составы и условия приготовления хлеба и оболочек для китайских маньжу приведены,соответственно, в таблицах 19 и 20. Таблица 18. Органолептическая оценка Продукт 27 Продукт 28 Контроль Ощущение на язык 3,8 3,2 2,5 Текстура 3,5 3,0 2,8 Общая оценка 3,6 3,1 2,6 Таблица 19. Рецептура и условия приготовления хлеба Рецептура для приготовления кислого теста Пшеничная мука 70 частей по весу Дрожжи 2 Пища для дрожжей 0,1 Вода 40 Рецептура для конечной операции замешивания Пшеничная мука 30 частей по весу Сахар 5 Соль 2 Жир для рассыпчатости 5 Казеин 0,5 Вода 2,5 Условия приготовления Время ферментации 4 ч (при температуре 27 С и влажности 75%) Время дозревания 40 мин (при температуре 38 С и влажности 85%) Время печения 36 мин(при 210 С) Таблица 20. Рецептура и условия приготовления оболочек для китайских маньжу Рецептура для приготовления оболочек Пшеничная мука 100 частей по весу Сахар 15 Соль 0,8 Разрыхлитель 1 Лярд 5 Дрожжи 3,5 Вода 43,5 Условия приготовления Время дозревания 90 мин (при температуре 45 С и влажности 75%) Время готовки на пару 15 мин Из таблицы 18 видно, что по сравнению с контролем продукты 27 и 28 по настоящему изобретению показали улучшенное ощущение В продуктах 29 (хлеб) и 30 (оболочки для китайских маньжу) по настоящему изобретению использовали фукоидан IV примера 2, и добав 41 ляли 35 мг фукоидана на 100 г хлеба или оболочек. В продуктах 31 (хлеб) и 32 (оболочки для китайских маньжу) по настоящему изобретению использовали смесь (содержание фукоидана 80%) фукоидана IV примера 2 и экстракта морской водоросли горячей водой и количество смеси, соответствовавшее 35 мг фукоидана на 100 мл конечного продукта, добавляли на стадии смешения материалов. В качестве контроля 42 использовали продукт, в который не вводились добавки. Полученные хлеб и оболочки для китайских маньжу обертывали чистой пластиковой оберткой и оставляли их постоять при 5 С в течение 24 ч. Органолептические испытания проводили для хлеба и оболочки для китайских маньжу как таковых таким же образом, как в примере 6, и результаты приведены в таблице 21. Таблица 21. Органолептическая оценка Ощущение на язык Текстура Продукты Контроль Продукты Контроль 29 31 29 31 3,3 2,0 1,5 3,0 1,8 1,3 Продукты Контроль Продукты Контроль 30 32 30 32 2,8 2,1 1,6 3,4 1,7 1,1 Когда хлеб и оболочки для китайских маньжу хранили при низкой температуре, их влажность ухудшается, давая ощущение сухости при еде. Однако, как показано в таблице 21,продукты 29/31 и 30/32 по настоящему изобретению показали после хранения лучшее ощущение на язык и лучшую текстуру по сравнению с контролем для каждого из них в результате хорошего замедления ухудшения органолептики,каковым образом был подтвержден значительный эффект сохранения их хорошей органолептики. Пример 18. Для продукта 33 по настоящему изобретению использовали приготовленное обычным способом саке (японское рисовое вино) и фукоидан-U примера 4, и добавляли 26 мг фукоидана на 100 мл конечного продукта. В продукте 34 по настоящему изобретению использовали смесь (содержание фукоидана 70%) фукоиданаU примера 4 и экстракта морской водоросли горячей водой, и добавляли количество смеси,соответствовавшее 25 мг фукоидана на 100 мл конечного продукта. Органолептические испытания проводили таким же образом, как в примере 6. Вкусовые и ароматические добавки вводили в продукты для оценки, и результаты приведены в таблице 22. Таблица 22. Органолептическая оценка Продукт 33 Продукт 34 Контроль Вкус 3,1 3,0 3,0 Аромат 2,9 2,8 2,9 Ощущение на язык Сладость 3,9 3,2 2,5 Гладкость 4,2 3,5 2,8 Баланс вкуса 3,5 3,1 2,9 Свежесть вкуса 3,6 3,2 2,7 Ощущение при про 3,8 3,0 2,6 глатывании Из таблицы 22 видно, что по сравнению с контролем продукты 33 и 34 по настоящему изобретению показали лучшее ощущение на язык, в особенности в терминах гладкости, и Общая оценка Продукты Контроль 29 31 3,1 1,9 1,4 Продукты Контроль 30 32 3,1 1,9 1,3 проявили также улучшенные свежесть вкуса и ощущение при проглатывании, в результате чего был получен эффект улучшения ощущений при питье как у первосортного продукта. Пример 19. Обычным образом приготовленные "мирин" (сладкое саке) и ферментированная приправа были использованы в этом примере. Так,для продуктов 35 (мирин) и 37 (ферментированная приправа) по настоящему изобретению использовали фукоидан III примера 2 и добавляли 30 мг фукоидана на 100 мл конечного продукта. Для продуктов 36 (мирин) и 38 (ферментированная приправа) использовали смесь (содержание фукоидана 67%) фукоидана III примера 2 и экстракта морской водоросли горячей водой, и добавляли смесь в количестве, соответствовавшем 30 мг фукоидана на 100 мл конечного продукта. Контролем являлись те продукты, для которых не использовали добавки. Органолептические испытания проводили таким же образом, как в примере 6. К продуктам для оценки добавляли вкусовые добавки и ароматизаторы, и результаты приведены в таблице 23. Таблица 23. Органолептическая оценка Ферментированная Мирин приправа Продукт Контроль Продукт Контроль 35 37 36 38 Вкус 2,9 2,8 2,8 2,7 2,6 2,7 Аромат 2,7 2,4 2,7 2,4 2,1 2,4 Ощущениенаязык Сладость 3,9 3,0 2,5 3,7 2,8 2,6 Гладкость 4,1 3,2 2,7 3,8 2,9 2,4 Баланс вкуса 3,4 3,2 3,1 2,9 2,5 2,4 Свежесть вкуса 3,5 3,1 3,0 3,2 2,8 2,3 Общая оценка 3,4 3,0 2,8 3,1 2,6 2,5 Из таблицы 23 видно, что по сравнению с контролем каждого продукта, "мирин" (35/37) и ферментированные приправы (36/38) по настоящему изобретению показали улучшенные ощущение на язык (особенно по пунктам сладости и гладкости) и баланс вкуса, благодаря чему эти продукты 43 эффективны как приправы для улучшения вкусовых ощущений продуктов в кулинарии. Пример 20. Рыбный порошок (4,7 кг), 0,8 кг сушеного лавра, 2,5 кг кунжута, 1,0 кг соли и 0,5 кг глютамата натрия смешивали с последующим гранулированием обычным методом для приготовления фурикаке(рыбная мука для приправ). В продукте 39 по настоящему изобретению применяли фукоидан-U примера 4 и добавляли 1000 мг фукоидана на 100 г конечного продукта. В продукте 40 по настоящему изобретению применяли смесь (содержание фукоидана 60%) фукоиданаU примера 4 и экстракта морской водоросли горячей водой, и добавляли смесь в количестве, соответствовавшем 1000 мг фукоидана на 100 мл конечного продукта. Контролем являлись те продукты, для которых не использовали добавки. Продукт насыпали на вареный рис и проводили органолептическую оценку вкусовых ощущений таким же образом, как в примере 6. По сравнению с контролем, продукты 39 и 40 по изобретению хорошо сочетались на вкус с вареным рисом, давая хорошее ощущение на языке, и не создавали грубых ощущений, благодаря чему в целом было найдено, что они улучшают качество рыбной муки для приправ. Достоинства изобретения Пищевой продукт или напиток по настоящему изобретению содержит фукоидан, имеющий физиологическую активность и/или продукты его деградации и, благодаря индуцирующему апоптоз действию указанного фукоидана, продукт является оздоравливающим или функциональным пищевым продуктом или напитком, проявляющим при его приеме эффект предотвращения карциногенеза и подавления рака, и, в частности, этот продукт является пищевым продуктом или напитком, содержащим функциональную морскую ткань, которая полезна для поддержания в здоровом состоянии желудка и кишечника. Фукоидан по настоящему изобретению, в особенности, фукоидан из морских водорослей,является очень хорошим веществом, поскольку он может быть получен по низкой цене в больших количествах из съедобных морских водорослей, т.е. из съедобных продуктов, и в высшей степени безопасен. Кроме того, согласно настоящему изобретению может быть предложен фукоидан, в котором содержание альгиновой кислоты уменьшено или отсутствует. Указанный фукоидан способен улучшать вкусовые ощущения, такие как ощущение на язык, свежесть вкуса, баланс вкуса, текстуру, и т.п. без ухудшения характерной природы пищевого продукта или напитка и также способен поддерживать хорошее качество с точки зрения ощущений при еде, в результате чего он крайне полезен при производстве пищевых продуктов и напитков. 44 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фукоидансодержащий пищевой продукт, из которого частично или полностью извлечены альгины, полученный из фукоидансодержащего вещества посредством экстрагирования указанного фукоидансодержащего вещества в присутствии соли кальция. 2. Пищевой продукт по п.1, в котором солью кальция является хлорид кальция. 3. Фукоидансодержащий пищевой продукт, из которого частично или полностью извлечены альгины, полученный из фукоидансодержащего вещества посредством экстрагирования указанного фукоидансодержащего вещества щелочным раствором с последующим добавлением к экстракту соли кальция. 4. Пищевой продукт по п.3, в котором щелочным раствором является раствор карбоната натрия. 5. Пищевой продукт по п.3, в котором солью кальция является хлорид кальция. 6. Фукоидансодержащий пищевой продукт, из которого частично или полностью извлечены альгины, полученный из фукоидансодержащего вещества посредством экстрагирования указанного фукоидансодержащего вещества щелочным раствором с последующим подкислением экстракта. 7. Пищевой продукт по п.6, в котором щелочным раствором является раствор карбоната натрия. 8. Пищевой продукт по любому из пп.1-7, содержащий фукоидан, полученный из морских водорослей. 9. Пищевой продукт по п.8, в котором фукоидан является фукоиданом-U и/или фукоиданом F,имеющим следующие физические и химические свойства: физические и химические свойства фукоидана-U: 1) компонентный сахар содержит уроновую кислоту, и 2) молекулярный вес снижается под действием эндофукоиданлиазы, продуцированной Flavobacterium sp. SA-0082 (FERM BP-5402), обспечивая один или более продуктов, выбранных из соединений, представленных, по меньшей мере, следующими формулами (I), (II) и (III): физические и химические свойства фукоидана-F: 1) компонентный сахар по существу не содержит уроновой кислоты, и 46 2) молекулярный вес по существу не снижается под действием эндофукоиданлиазы, продуцированной Flavobacterium sp. SA-0082 (FERM BP5402). 10. Пищевой продукт по любому из пп.1-9,представляющий собой напиток. 11. Пищевой продукт по любому из пп.1-10, в котором фукоидан является расщепленным фукоиданом. 12. Пищевой продукт по любому из пп.1-11, в котором количество фукоидана, рассчитанного как фукоза, составляет 0,001 вес./вес.% или более. 13. Вызывающий апоптоз пищевой продукт,представляющий собой фукоидансодержащий продукт по любому из пп.1-12 и содержащий фукоидан в количестве, эффективном для вызывания апоптоза. 14. Вызывающий апоптоз пищевой продукт по п.13, представляющий собой напиток. 15. Вызывающий апоптоз пищевой продукт по п.13 или 14, в котором фукоидан является расщепленным фукоиданом. 16. Вызывающий апоптоз пищевой продукт по любому из пп.13-15, в котором количество фукоидана, рассчитанного как фукоза, составляет 0,001 вес./вес.% или более.
МПК / Метки
МПК: C07H 5/10, A61P 43/00, A23L 1/30, A61K 35/80
Метки: вызывающие, фукоидансодержащие, пищевые, продукты, апоптоз, частности
Код ссылки
<a href="https://eas.patents.su/25-2021-fukoidansoderzhashhie-pishhevye-produkty-v-chastnosti-vyzyvayushhie-apoptoz.html" rel="bookmark" title="База патентов Евразийского Союза">Фукоидансодержащие пищевые продукты, в частности, вызывающие апоптоз</a>
Предыдущий патент: Способ генерации противовирусного иммунного ответа у человека или животного
Следующий патент: Аморфные бензотиофены, способы получения и способы применения